AKTIVITAS ANTIMIKROBA KAPANG ENDOFIT BAR 1.5
DARI BAKAU MERAH (Rhizophora stylosa) DENGAN MEDIA
PERTUMBUHAN YANG BERBEDA
ADILA SABILIILAIKA
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
*Dengan ini saya menyatakan bahwa skripsi berjudul Aktivitas Antimikroba Kapang Endofit BAR 1.5 dari Bakau Merah (Rhizophora stylosa) dengan Media Pertumbuhan yang Berbeda adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, 30 Agustus 2015
Adila Sabiliilaika NIM C34110057
ABSTRAK
ADILA SABILIILAIKA. Aktivitas Antimikroba Kapang Endofit BAR 1.5 dari Bakau Merah (Rhizophora stylosa) dengan Media Pertumbuhan yang Berbeda Dibimbing oleh KUSTIARIYAH TARMAN dan SAFRINA DYAH HARDININGTYAS.
BAR 1.5 merupakan kode isolat kapang yang terdapat pada daun Rhizhophora stylosa yang berasal dari Perairan Barru, Sulawesi Selatan. Tujuan penelitian ini adalah membandingkan aktivitas antimikroba dari kapang BAR 1.5 dengan menggunakan media kultur yang berbeda. Biomassa miselia dari perlakuan media PDB lebih tinggi dibandingkan dengan perlakuan media hagem, nilai pH media kultur pada masing-masing perlakuan berada pada kisaran pH 4-5. Aktivitas antimikroba dari ekstrak media kultur PDB hari 15 kultivasi memberikan hasil terbaik terhadap E.coli, P. aeruginosa, C. maltosa, B. subtilis dan S.aureus dengan diameter zona hambatan sebesar 12,47±0,26 mm. Hasil uji bioautografi menunjukkan ekstrak kapang BAR 1.5 memiliki fraksi aktif yang dapat menghambat pertumbuhan bakteri B subtilis karena mengandung senyawa aktif yaitu terpenoid, polifenol dan flavonoid.
Kata kunci: Antimikroba, hagem, kapang BAR 1.5, PDB, Rhizhophora stylosa
ABSTRACT
ADILA SABILIILAIKA. Antimicroba Activity of BAR 1.5 Endophytic Fungi from Bakau Merah (Rhizophora stylosa) with Different Growth Medium Supervised by KUSTIARIYAH TARMAN and SAFRINA DYAH HARDININGTYAS.
Bar code 1.5 is code of isolates fungi contain in leaves Rhizhophora stylosa derived from Barru district waters, South of Sulawesi. The aimed of this research was to compare the activity of antimicrobial by culture medium extract from fungi BAR 1.5 with different of culture medium. Micellium biomass with PDB medium treatment was higher than Hagem medium treatment, pH value for each treatment were 4-5. Antimicroba activity from PDB culture medium extract in 15 days cultivation give the best result to E.coli, P. aeruginosa, C. maltosa, B. subtilis and S.aureus with diameter of inhibit zone are 12.47±0,26 mm. The bioautography test showed that extract of BAR 1.5 fungi have active fractions that can inhibit B. subtilis growth cause contains active compounds are terpenoid, polyfenol, and, flavonoid.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
ADILA SABILIILAIKA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada
Departemen Teknologi Hasil Perairan
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
2015
AKTIVITAS ANTIMIKROBA KAPANG ENDOFIT BAR 1.5
DARI BAKAU MERAH (Rhizophora stylosa) DENGAN MEDIA
Judul Skripsi : Aktivitas Antimikroba Kapang Endofit BAR 1.5 dari Bakau Merah (Rhizophora stylosa) dengan Media Pertumbuhan yang Berbeda
Nama : Adila Sabiliilaika NIM : C34110057
Program Studi : Teknologi Hasil Perairan
Disetujui oleh
Dr Kustiariyah Tarman SPi MSi Pembimbing I
Safrina Dyah Hardiningtyas SPi MSi Pembimbing II
Diketahui oleh
Prof Dr Ir Joko Santoso MSi Ketua Departemen
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT yang telah memberikan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan skripsi dengan judul Aktivitas Antimikroba Kapang Endofit BAR 1.5 dari Bakau Merah (Rhizophora stylosa) dengan Media Pertumbuhan yang Berbeda. Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu dalam proses penulisan karya ilmiah ini, terutama kepada:
1 Dr Kustiariyah SPi MSi dan Safrina Dyah Hardiningtyas SPi MSi selaku dosen pembimbing, atas segala bimbingan dan pengarahan yang diberikan kepada penulis.
2 Prof Dr Ir Joko Santoso MSi selaku Ketua Departemen Teknologi Hasil Perairan.
3 Dr Desniar SPi MSi selaku dosen penguji pada sidang akhir.
4 Dr Ir Agus M. Jacoeb Dipl-Biol selaku dosen perwakilan komisi pendidikan THP.
5 Ayah, Mama, Annisa Miladina dan M. Hafidz Al-Fikri yang senantiasa mendoakan dan memberikan motivasi.
6 Ibu Ema, Paqih, Ibu Nunung, Mbak Dila dan Bapak Eman, serta kakak-kakak pascasarjana (kak Alif, kak Nabila, kak Zia, kak Yulia, kak Abas, kak Diah), dan kakak-kakak THP angkatan 47 (Kak Nisa, Kak Zeta, kak Fajri) yang telah membantu dan membimbing penulis selama penelitian di laboratorium.
7 Teman-teman seperjuangan yang tergabung dalam “Paguyuban Laboratorium Mikrobiologi” (Konita, Mada, Ayumi, Atika, Titin, dan Sizu) atas kebersamaannya selama penulis melakukan penelitian, bantuan dan motivasinya.
8 “Keluarga Cemara” (Eki, Gesti, Annisa Ulfa, Rere, Fianita, Aulia, Aziza, Intan, Navisa, Aisyah, Bramantyo dan Bagja), serta keluarga besar THP 48 atas segala suka-duka selama penulis menempuh perkuliahan, segala bantuan dan motivasinya.
9 “Keluarga Jamets” serta kedua sahabatku Linda dan Wulan atas doa dan motivasinya.
Penulis menyadari bahwa karya ilmiah ini masih memiliki kekurangan. Penulis mengharapkan saran dan kritik yang bersifat membangun untuk perbaikan. Semoga karya ilmiah ini dapat bermanfaat bagi semua pihak yang memerlukannya.
Bogor, Agustus 2015
DAFTAR ISI
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vi
PENDAHULUAN ... 1
Latar Belakang ... 1
Perumusan Masalah ... 2
Tujuan Penelitian ... 3
Manfaat Penelitian... 3
Ruang Lingkup Penelitian ... 3
METODE PENELITIAN ... 3
Bahan ... 4
Alat ... 4
Prosedur Penelitian ... 4
Analisis Data ... 7
HASIL DAN PEMBAHASAN ... 7
Pertumbuhan Kapang BAR 1.5 dengan Media yang berbeda ... 7
Ekstrak Kapang BAR 1.5 ... 9
Aktivitas Antimikroba Ekstrak Kapang BAR 1.5 ... 11
Hasil Uji Bioautografi dan Kromatografi Lapis Tipis... 15
Fitokimia Ekstrak Etil Asetat Kapang BAR 1.5 ... 16
KESIMPULAN DAN SARAN ... 16
Kesimpulan ... 16
Saran ... 17
DAFTAR PUSTAKA ... 17
LAMPIRAN ... 21
DAFTAR TABEL
1 Rendemen ekstrak etil asetat kapang BAR 1.5 ... 10
2 Hasil uji bioautografi ekstrak BAR 1.5 pada bakteri Bacillus subtilis ... 15
3 Hasil skrinning fitokimia ekstrak etil asetat kapang BAR 1.5 ... 16
DAFTAR GAMBAR
1 Diagram alir prosedur penelitian ... 52 Morfologi kapang BAR 1.5 umur 7 hari pengamatan secara makroskopis dan mikroskopis perbesaran 400x ... 7
3 Kurva pertumbuhan dan perubahan pH kapang BAR 1.5 dengan perlakuan perbedaan media kultur ... 8
4 Media kultur kapang BAR 1.5 setelah fermentasi pada media PDB dan Hagem ... 10
5 Aktivitas antibakteri ekstrak media kultur kapang BAR 1.5 pada media PDB dan media Hagem pada bakteri E. coli (a), P. aeroginosa (b), S. aureus (c), B. subtilis (d) dan Candida maltosa (e) ... 12
6 Kromatogram ekstrak etil asetat kapangBAR 1.5 PDB dan Hagem di bawah Sinar UV 254 nm dan 366 nm ... 14
7 Hasil uji bioautografi ektrak etil asetat kapang BAR 1.5 media PDB dan Hagem pada bakteri Bacillus subtilis ... 15
DAFTAR LAMPIRAN
1 Komposisi media yang digunakan ... 232 Kultur kapang BAR 1.5 ... 23
3 Hasil uji antibakteri ekstrak kapang BAR 1.5 ... 24
1
PENDAHULUAN
Latar Belakang
Indonesia merupakan negara kepulauan yang memiliki wilayah pesisir dengan garis pantai mencapai 81.000 km. Kekayaan sumberdaya alam pesisir tersebut meliputi ekosistem hutan mangrove yang didukung dengan komponen abiotiknya. Luasan ekosistem mangrove di dunia mencapai 75% dari total keseluruhan garis pantai. Giri et al. (2011) menyebutkan ekosistem hutan mangrove terluas di dunia ditempati oleh Indonesia (22,6 %; 3,112,989 ha) dan diikuti oleh Australia (7,1%; 977,975 ha), dan Brazil (7%; 962,683 ha). Kekayaan mangrove tersebut seringkali dimanfaatkan sebagai sumber obat tradisional oleh masyarakat setempat, karena dipercaya memiliki aktivitas bioaktif tertentu diantaranya sebagai antimikroba, antijamur, antitumor, antivirus, insektisida dan antileukimia (Soetarno 2000). Salah satu jenis tumbuhan mangrove yang memiliki karakteristik sebagai obat tradisional adalah Rhizophora stylosa.
R. stylosa memiliki nama lokal bakau merah, bako-kurap, slindur, tongke besar, wako dan bako. Tumbuhan ini banyak tersebar di Taiwan, Malaysia, Filipina, sepanjang Indonesia, Papua Nugini dan Australia tropis (FAO 2000). Karakteristik tumbuhan ini diantaranya kulit kayu halus, akar tunjang, daun berkulit dengan bintik teratur di lapisan bawah, serta menghasilkan buah berwarna merah kecoklatan dengan lentisel banyak. Penelitian Akhyar (2010) melaporkan bahwa ekstrak akar dan buah R. stylosa dapat menghambat pertumbuhan bakteri Vibrio harveyi. Penelitian Wulandari (2014) melaporkan bahwa ekstrak buah R. stylosa dapat menghambat pertumbuhan bakteri Escherichia coli, Staphylococcus aureus, Pseudomonas aeruginosa, dan Salmonella typhimurium penyebab diare. Beberapa kajian tersebut menunjukkan R. stylosa sebagai salah satu sumber bahan baku yang potensial digunakan untuk keperluan farmasi.
Penggunaan tumbuhan induk secara berlebihan akan berdampak pada kelestarian tumbuhan tersebut. Cara efektif yang dapat digunakan untuk mengefisiensikan sumber senyawa bioaktif dari tumbuhan tanpa mengganggu kelestarian tumbuhan tersebut yaitu dengan menggunakan mikroba endofit yang berasosiasi dengan tumbuhan. Mikroba endofit adalah mikroorganisme yang hidup di dalam jaringan tanaman, tanpa merugikan tanaman inangnya. Mikroba endofit dapat berupa kapang atau bakteri yang diperoleh dari bagian dalam tumbuhan. Kapang endofit mampu menghasilkan sejumlah senyawa bioaktif yang sama dengan tumbuhan inangnya disebabkan oleh transfer genetik dari tanaman inang ke dalam kapang endofit (Radji 2005). Beberapa penelitian telah banyak mengkaji potensi dari komponen bioaktif yang dihasilkan oleh kapang endofit. Sahara (2014) melaporkan bahwa kapang RS3 yang diisolasi dari tanaman sarang semut (Hydnophytum formicarum) memiliki potensi sebagai antihiperglikemik. Penelitan Pavithra et al. (2012) menunjukkan kapang endofit dari tanaman tulsi (Ocimum sp.) memiliki aktivitas enzim diantaranya amilase, protease dan tirosinase serta potensial digunakan sebagai antibakteri.
2
demikian beberapa diantaranya belum dilakukan kajian terhadap aktivitas metabolit sekundernya, salah satunya yaitu kapang dengan kode BAR 1.5. Kapang BAR 1.5 diduga memiliki aktivitas dalam menghambat bakteri dan jamur. Penelitian Mouafi et al. (2014) menunjukkan bahwa ekstrak daun R. stylosa dapat menghambat pertumbuhan E. coli, S. aureus, B. subtilis, Penicillium digitatum, Fusarium oxysporium dan Candida albicans.
Infeksi menjadi salah satu penyebab utama penyakit di dunia termasuk di Indonesia. Temperatur yang tropis dengan kelembaban tinggi di Indonesia menyebabkan mikroba dapat tumbuh dengan subur. Infeksi dapat disebabkan oleh berbagai mikroorganisme antara lain virus, jamur, protozoa, dan bakteri. Secara umum penyakit infeksi dapat disembuhkan dengan menggunakan antibiotik. Antibiotik atau antimikroba merupakan suatu substansi kimia yang berasal dari mikroorganisme yang mempunyai kemampuan menghambat pertumbuhan bahkan membunuh mikroba lain. Antibiotik alami salah satunya dapat berasal dari kultur kapang. Metabolit sekunder yang dihasilkan oleh kapang diproduksi sebagai sistem pertahanan terhadap perubahan kondisi lingkungan pada media pertumbuhannya dan perlindungan terhadap serangan bakteri dan jamur patogen inangnya. Penelitian Tarman (2011) menemukan bahwa kapang KT19 yang diisolasi dari habitat pasir pantai di wilayah Malang, Jawa Timur dapat menghambat pertumbuhan jamur dan bakteri diantaranya S. aureus, B. subtilis, P. aeruginosa dan E. coli.
Semua organisme hidup termasuk kapang, memerlukan nutrien untuk mendukung pertumbuhannya. Nutrien berupa unsur atau senyawa kimia digunakan sel sebagai konstituen kimia penyusun sel. Nutrien tersebut diperoleh dari subtrat atau media pertumbuhannya. Kultivasi kapang skala laboratorium umumnya menggunakan media pertumbuhan diantaranya Potato Dextrose Broth (PDB), Potato Dextrose Yeast (PDY), dan Potato Dextrose Agar (PDA). Media lain yang dapat digunakan untuk pertumbuhan kapang salah satunya yaitu media hagem. Komposisi media hagem ini terdiri dari KH2PO4, MgSO4. 7H2O, FeCl3, glukosa, malt extract, dan aquades. Media hagem memiliki pH mendekati netral yaitu 7-7.5 (Helmholz et al. 1999). Menurut Gandjar et al. (2006) nutrien yang dibutuhkan kapang diantaranya karbon, nitrogen, sulfur, fosfor, kalium, magnesum, natrium, kalsium, nutrien makro dan vitamin. Media hagem mengandung sebagian besar nutrien yang dibutuhkan untuk pertumbuhan kapang. Nutrien yang lengkap tersebut diharapkan dapat menunjang pertumbuhan kapang, serta memberikan pengaruh dalam produksi metabolit yang dihasilkan kapang. Kajian terhadap potensi kapang BAR 1.5 perlu dilakukan untuk mengetahui pertumbuhan dan metabolit sekunder yang dihasilkan oleh kapang dari media kultur yang berbeda, khususnya akvitas antibakteri terhadap bakteri patogen pada manusia.
Rumusan Masalah
3
salah satu faktor penentu pertumbuhan kapang. Media hagem digunakan sebagai perbandingan dengan media PDB yang merupakan media umum untuk kultivasi kapang. Perbedaan komposisi media diduga berpengaruh terhadap pertumbuhan dan metabolit sekunder yang dihasilkan kapang BAR 1.5, khususnya terhadap aktivitas antimikroba.
Tujuan Penelitian
Tujuan penelitian ini adalah untuk menentukan potensi antimikroba kapang endofit tumbuhan bakau R. stylosa (BAR 1.5) dengan menggunakan media kultur berbeda.
Manfaat Penelitian
Penelitian ini dapat memberikan informasi mengenai perbedaan kemampuan kapang endofit tumbuhan bakau R. stylosa (BAR 1.5) sebagai antimikroba pada media kultur yang berbedaserta senyawa bioaktif yang berperan dalam aktivitas antibiotik.
Ruang Lingkup Penelitian
Ruang lingkup penelitian ini adalah kultivasi kapang endofit tumbuhan bakau R. stylosa (BAR 1.5) selama 18 hari dengan perlakuan perbedaan media kultur. Ekstraksi media kultur dari masing-masing perlakuan selanjutnya dilakukan pengujian aktivitas antimikroba terhadap lima mikroba uji. Ekstrak yang memberikan hasil terbaik dari uji aktivitas antimikroba kemudian dilakukan pengujian bioautografi dengan salah satu bakteri yang memberikan sensitifitas terbesar terhadap ekstrak. Fraksi aktif yang berperan dalam aktivitas antimikroba selanjutnya dilakukan pengujian fitokimia menggunakan pereaksi semprot.
METODE PENELITIAN
Waktu dan Tempat
4
Bahan
Bahan utama yang digunakan pada penelitian ini adalah isolat kapang koleksi Dr. Kustiariyah Tarman , SPi MSi yang diisolasi dari tumbuhan bakau R. stylosa dengan kode BAR 1.5. Media pertumbuhan yang digunakan yaitu Potato Dextrose Agar (PDA) (BD company), Potato Dextrose Broth (PDB) (BD company) dan media Hagem. Komposisi media yang digunakan dapat dilihat pada Lampiran 1. Bahan yang digunakan untuk analisis antimikroba meliputi media Nutrient Agar (NA) (oxoid), Nutrient Broth (NB) (oxoid), media Mueller Hinton Agar (MHA) (oxoid), akuades, bakteri Gram-positif (S. aureus dan B. subtilis), Gram-negatif (E. coli dan P. aeruginosa), dan khamir (Candida maltosa). Bahan-bahan kimia lain yaitu etil asetat p.a, n-heksana, diklorometana, anisaldehid asam sulfat, amonia, plat silika F254 60, dan kloromfenikol.
Alat
Alat yang digunakan yaitu clean bench (Thermo Scientific 1300 Series A2), oven, autoklaf (Yamato SM52), shaker, refrigerator, spektrofotometer (UV Vis UV-2500), inkubator (Yamato IS900), rotary vacuum evaporator (Heidolph VV2000), vortex mixer, pipet mikro (Eppendorf), pH meter, timbangan digital (Sartorius TE214S), incubator (Binder) dan penggaris (1 mm).
Prosedur Penelitian
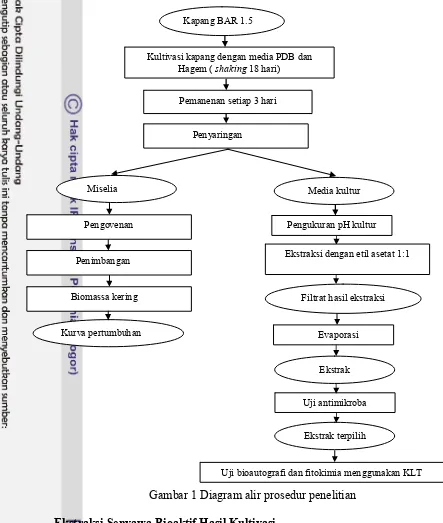
Metode penelitian terdiri dari kultivasi kapang BAR 1.5 yang disertai pengukuran pH kultur, ekstraksi media kultur, uji aktivitas antimikikroba, uji bioautografi dan fitokimia dengan metode Kromatografi Lapis Tipis (KLT). Diagram alir penelitian dapat dilihat pada Gambar 1.
Kultivasi Kapang (Artanti et al. 2011)
Kultivasi kapang melalui dua tahap, yaitu prekultur dan kultur massal. Prekultur bertujuan agar kapang dapat beradaptasi terlebih dahulu terhadap media pertumbuhannya. Prekultur dilakukan dengan cara memindahkan isolat kapang endofit ke dalam labu Erlenmeyer yang berisi 50 mL media PDB dan Hagem. Setelah itu media berisi kapang diinkubasi pada suhu ruang selama 1 minggu.
Kultur massal dilakukan dengan mengambil sebanyak 5% inokulum kapang endofit yang telah diprekultur kemudian dipindahkan ke dalam 200 mL media PDB dan Hagem untuk selanjutnya diinkubasi selama 18 hari dalam kondisi digoyang (shaking) dengan kecepatan 120 rpm. Kultur massal pada media PDB dan Hagem masing-masing dilakukan dua kali ulangan. Pemanenan biomasa kapang dilakukan setiap 3 hari. Proses tersebut disertai dengan pengukuran nilai pH media kultur.
5
dikurangi berat kertas saring awal kosong. Hasil perhitungan tersebut digunakan untuk penentuan kurva pertumbuhan kapang, sedangkan media kultur kapang yang diperoleh kemudian diekstraksi.
Gambar 1 Diagram alir prosedur penelitian
Ekstraksi Senyawa Bioaktif Hasil Kultivasi
Ekstraksi dilakukan pada media kultur kapang dengan waktu panen yang berbeda. Ekstraksi media kultur menggunakan metode maserasi. Metode maserasi digunakan untuk mengekstraksi sampel yang relatif mudah rusak oleh panas. Sebanyak 70 mL media kultur diekstraksi menggunakan pelarut etil asetat dengan perbandingan 1:1. Media yang telah dilarutkan dalam etil asetat selanjutnya dibiarkan dalam kondisi shaking selama 3x24 jam tanpa proses pemanasan.
Penyaringan
Miselia
Kapang BAR 1.5
Kultivasi kapang dengan media PDB dan Hagem ( shaking 18 hari)
Pemanenan setiap 3 hari
Pengovenan
Penimbangan
Biomassa kering
Kurva pertumbuhan
Media kultur
Pengukuran pH kultur
Evaporasi
Ekstraksi dengan etil asetat 1:1
Filtrat hasil ekstraksi
Ekstrak
Ekstrak terpilih Uji antimikroba
6
Pemisahan media kultur dengan hasil ekstrak etil asetat dilakukan dengan corong pisah. Ekstrak didiamkan beberapa saat sampai fase antar kedua media kultur dan ekstrak etil asetat memisah dengan jelas. Ekstrak yang diperoleh selanjutnya dipekatkan menggunakan rotary vacuum evaporator pada suhu 40 oC sehingga diperoleh ekstrak dalam bentuk pasta. Suhu ini digunakan agar ekstrak tidak kehilangan senyawa aktif yang tidak tahan panas.
Uji Aktivitas Antimikroba (Moorothy et al. 2007)
Mikroba yang digunakan pada uji aktivitas antimikroba adalah B. subtilis, P. aeruginosa, E. coli, S. aureus dan Candida maltosa. Peremajaan mikroba uji dilakukan dengan mengambil satu ose biakan mikroba untuk diinokulasikan ke dalam media NA, kemudian diinkubasi pada suhu 37 oC selama 24 jam. Mikroba tersebut selanjutnya diinokulasi kembali pada media NB dan diinkubasi pada suhu 37 oC selama 18-24 jam. Kultur mikroba diukur kekeruhannya secara turbidimetri menggunakan spektrometer UV-Vis pada panjang gelombang 600 nm hingga mencapai OD 0,5-0,8.
Sebanyak 20 μL mikroba uji ditambahkan ke dalam media MHA steril. Media MHA yang mengandung mikroba uji dihomogenisasi menggunakan vortex kemudian dituang pada cawan petri steril secara aseptis. Media MHA tersebut didiamkan hingga memadat. Selanjutnya dibuat lubang (sumur) secara aseptis dengan diameter 6 mm (seragam). Ekstrak kapang endofit dimasukkan ke dalam lubang dengan jumlah yang berbeda yaitu 0,5 mg; 1 mg; 2 mg beserta kontrol positif dan kontrol negatif. Kontrol positif menggunakan antibiotik jenis kloramfenikol sedangkan kontrol negatif menggunakan pelarut etil asetat. Cawan diinkubasi pada suhu 37 oC selama 24 jam dan dilakukan pengukuran zona hambat yang terbentuk menggunakan penggaris (mm). Masing-masing perlakuan ekstrak dilakukan sebanyak dua kali ulangan. Daya hambat zat antimikroba diukur dengan cara mengurangi diameter zona hambat yang terbentuk dengan diameter lubang (sumur). Hasil dinyatakan sebagai rata-rata ulangan yang disertai standar deviasi.
Uji Bioautografi dan Fitokimia dengan Metode Kromatografi Lapis Tipis (KLT)
Uji bioautografi dilakukan terhadap ekstrak media kultur dari media hagem dan PDB dengan waktu panen yang menghasilkan diameter zona hambat terbesar pada uji aktivitas antimikroba. Uji bioautografi menggunakan plat alumunium dengan silika gel G60 F254 Merck. Plat tersebut kemudian dikeringkan di dalam oven pada suhu 105 oC selama 10 menit. Penotolan ekstrak dilakukan menggunakan pipa kapiler hingga membentuk lingkaran kecil, kemudian plat dimasukkan ke dalam gelas yang telah berisi eluen. Eluen yang digunakan adalah campuran diklorometana, etil asetat, dan n-heksana dengan perbandingan 2:3:1 (Ukhty 2015). Plat disandarkan dan dibiarkan hingga eluennya naik mencapai garis batas, setelah itu plat diangkat dan dibiarkan kering.
7
media MHA yang telah dicampur dengan suspensi mikroba uji dan dibiarkan memadat. Mikroba uji yang digunakan merupakan mikroba yang memilki sensitivitas tertinggi terhadap ekstrak pada uji aktivitas antimikroba. Selanjutnya dilakukan inkubasi pada suhu 37 oC selama 24 jam dan pengamatan zona hambat yang terbentuk.
Uji fitokimia dilakukan dengan penyemprotan dengan suatu pereaksi pada plat KLT yang telah dikeringkan dengan eluen terpilih. Pereaksi yang digunakan diantaranya uap amonia, FeCl3, dan anisaldehid asam sulfat. Uap amonia digunakan untuk mendeteksi senyawa flavonoid, hasil positif dapat dilihat dari adanya bercak berwarna kuning atau kuning coklat. Pereaksi FeCl3 digunakan untuk mendeteksi senyawa polifenol, hasil positif dapat dilihat dari adanya bercak berwarna hitam. Pereaksi anisaldehid asam sulfat digunakan untuk pengujian senyawa terpenoid/steroid, hasil positif dapat dilihat dari adanya bercak berwarna ungu-merah atau ungu (Wagner 1996).
Analisis Data
Analisis data diperlukan untuk mendapatkan kesimpulan dari percobaan yang dilakukan. Analisis yang digunakan pada penelitian ini adalah analisis secara deskriptif menggunakan standar defiasi dari dua kali ulangan yang ditunujukan dalam hasil berupa tabel dan grafik.
HASIL DAN PEMBAHASAN
Pertumbuhan Kapang BAR 1.5 dengan Media yang Berbeda
Kapang BAR 1.5 merupakan kapang yang diisolasi dari daun R. stylosa yang berhabitat di perairan Barru, Sulawesi Selatan. Kapang ini memiliki karakteristik warna putih, hifa menyebar dengan tepian berserat menyerupai akar, permukaan hifa agak kasar, dan bagian bawah berwarna putih-kecoklatan. Morfologi kapang BAR 1.5 dapat dilihat pada Gambar 2.
A B
8
Pertumbuhan isolat kapang dihitung berdasarkan berat kering miselia kapang yang diambil pada selang waktu 3 hari selama 18 hari waktu inkubasi (Lampiran 2). Kurva pertumbuhan kapang BAR 1.5 dan perubahan pH yang dihasilkan dari masing-masing media yang digunakan dapat dilihat pada Gambar 3.
Gambar 3 Kurva pertumbuhan ( media Hagem, media PDB) dan perubahan pH media kultur ( media Hagem, media PDB) kapang BAR 1.5 selama 18 hari waktu kultivasi.
Fase logaritmik kapang BAR 1.5 pada perlakuan media PDB terdapat pada waktu kultivasi hari ke-0 sampai dengan hari ke-9, kemudian memasuki fase stasioner pada waktu kultivasi hari ke-9 sampai dengan hari ke-15, setelah itu memasuki penurunan masa sel dan memasuki fase kematian pada kultivasi hari ke-18. Sementara itu pada perlakuan media hagem, fase logaritmik kapang terdapat pada waktu kultivasi hari ke-0 sampai dengan hari ke-9, setelah itu memasuki fase stasioner pada waktu kultivasi hari ke-9 sampai dengan hari ke-12, dan memasuki fase kematian pada kultivasi hari ke-12 sampai dengan hari ke-18. Penurunan kecepatan tumbuh terjadi karena keterbatasan unsur-unsur pertumbuhan setelah digunakan pada fase sebelumnya. Menurut Gandjar et al. (2006) terdapat enam fase pertumbuhan kapang, antara lain: (1) fase lag, yaitu fase penyesuaian sel-sel dengan lingkungan, pembentukan enzim untuk mengurai substrat; (2) fase akselerasi, yaitu fase mulainya sel-sel membelah sehingga fase lag menjadi fase aktif; (3) fase eksponensial, merupakan fase perbanyakan jumlah sel dan peningkatan aktivitas sel; (4) fase deselerasi, yaitu ketika sel-sel kurang membelah; (5) fase stasioner, yaitu fase jumlah sel yang bertambah dan jumlah sel yang mati relatif seimbang; dan (6) fase kematian dipercepat, jumlah sel yang mati atau tidak aktif lebih banyak dibandingkan sel yang masih hidup.
9
Media PDB menghasilkan bobot biomassa kapang yang lebih tinggi dibandingkan media hagem. Bobot biomassa tertinggi pada media PDB sebesar 1,727±0,53 gram yang dihasilkan pada kultivasi hari ke-15, sedangkan pada media hagem sebesar 0,728±0,06 gram yang dihasilkan pada kultivasi hari ke-9. Komposisi nutrien pada media PDB diduga lebih cocok untuk pertumbuhan kapang BAR 1.5 karena mineral yang terdapat pada media hagem belum dapat digunakan secara optimal oleh kapang untuk menunjang pertumbuhannya. Sementara itu dilihat dari segi komposisi karbon dan nitrogen (C/N) pada media PDB terdapat dextrose dan pati kentang yang menjadi sumber karbon bagi kapang serta asam amino sebagai sumber nitrogen (Rahman et al. 2011), sedangkan pada media hagem hanya terdapat sumber karbon yang dipenuhi dari malt ekstrak dan glukosa. Hal tersebut menyebabkan
Faktor penentu pertumbuhan kapang salah satunya adalah pH substrat. Hal tersebut disebabkan enzim-enzim tertentu hanya akan mengurai substrat sesuai dengan aktivitasnya pada pH tertentu. Rentang pH optimum pertumbuhan kapang yaitu 4-7 (Gandjar et al. 2006). Selama kultivasi 18 hari pH media kultur tidak mengalami perubahan, kecuali hari ke-18 pada perlakuan media PDB terjadi penurunan dari nilai pH 5 menjadi 4. Penurunan pH disebabkan pembentukan asam organik hasil dari metabolisme glukosa (Trihardiningrum 2004).
Ekstrak Kapang BAR 1.5
Ekstraksi merupakan proses penarikan komponen zat aktif dari suatu bahan menggunakan pelarut dengan tujuan untuk mendapatkan komponen aktif tertentu. Ekstraksi dilakukan pada media kultur kapang BAR 1.5. Pemilihan media kultur karena senyawa yang ingin diperoleh pada proses ekstraksi ini adalah metabolit sekunder yang merupakan hasil ekstraselular dari metabolisme kapang (Gandjar et al. 2006). Penelitian Tarman et al. (2013) menunjukkan ekstrak media kultur memiliki persentase rendemen ekstrak yang lebih banyak serta aktivitas antimikroba yang lebih tinggi dibandingkan ekstrak biomassa kapang.
10
Gambar 4 Media kultur kapang BAR 1.5 setelah fermentasi pada media (A) PDB dan (B) Hagem.
Kenampakan media kultur BAR 1.5 pada Gambar 4 menujukkan adanya perubahan warna media kultur selama waktu kultivasi. Perlakuan media PDB mengalami perubahan warna dari kuning bening menjadi coklat kemerahan seiring lamanya waktu kultivasi, sedangkan media hagem yang berwarna putih kekuningan tidak mengalami perubahan warna yang begitu signifikan. Perubahan warna pada kedua media kultur berkaitan dengan rendemen ekstrak yang dihasilkan oleh kapang BAR 1.5 selama fase pertumbuhannya. Warna media kultur yang dihasilkan semakin pekat seiring bertambahnya rendemen ekstrak. Nilai rendemen ekstrak masing-masing media kultur disajikan dalam Tabel 1.
Tabel 1 Rendemen ekstrak etil asetat kapang BAR 1.5 Media Waktu panen (hari) Rendemen (%)
PDB 3 0,029
Rendemen ekstrak media kultur PDB memiliki persentase yang lebih besar dibandingkan media kultur Hagem. Persentase rendemen tertinggi pada media PDB sebesar 0,139% terdapat pada waktu kultivasi hari ke-15 yang menunjukkan akhir fase stasioner, sedangkan pada media Hagem rendemen tertinggi sebesar 0,1% terdapat pada waktu kultivasi hari ke-9 yang merupakan akhir fase logaritmik. Hal tersebut menunjukkan adanya hubungan antara bobot miselia dengan jumlah rendemen ekstrak yang dihasilkan, dimana rendemen ekstrak tertinggi pada masing-masing perlakuan terdapat pada waktu kultivasi yang menghasilkan bobot miselia terbesar (Gambar 3). Penelitian Melliawati dan Harni (2009) yang menunjukkan pada saat kapang mencapai jumlah tertinggi
H3 H6 H9 H12 H15 H18
( A)
H3 H6 H9 H12 H15 H18
11
diperkirakan senyawa metabolit sekunder yang terakumulasi juga mencapai maksimal sehingga rendemen ekstrak yang dihasilkan akan lebih besar. Selain bobot biomassa, faktor lain yang mempengaruhi jumlah rendemen ekstrak diantaranya jumlah pelarut, suhu ekstraksi, ukuran partikel, jenis pelarut, dan waktu ekstraksi (Bustan et al. 2008).
Aktivitas Antimikroba Ekstrak Kapang BAR 1.5
Aktivitas antimikroba diuji menggunakan metode difusi sumur agar. Metode difusi sumur agar merupakan metode yang banyak digunakan untuk pengujian antibakteri karena relatif lebih sederhana dalam pengerjaannya. Kontrol positif yang digunakan yaitu kloramfenikol. Kloramfenikol tergolong antibiotik dengan spektrum luas yang aktif terhadap banyak bakteri dari positif dan Gram-negatif (Pelczar dan Chan 2008). Kontrol Gram-negatif yang digunakan adalah etil asetat. Penggunaan etil asetat sebagai pembanding untuk melihat pengaruh pelarut untuk pengenceran ekstrak terhadap diameter zona hambat yang dihasilkan ekstrak. Pengujian dilakukan pada ekstrak media kultur terhadap 5 mikroba yang mewakili bakteri Gram-positif (S. aureus dan B. subtilis), Gram-negatif (E. coli dan P. aeruginosa), dan khamir (C. maltosa). Hasil uji aktivas antimikroba dari ekstrak kapang BAR 1.5 dapat dilihat pada Lampiran 3.
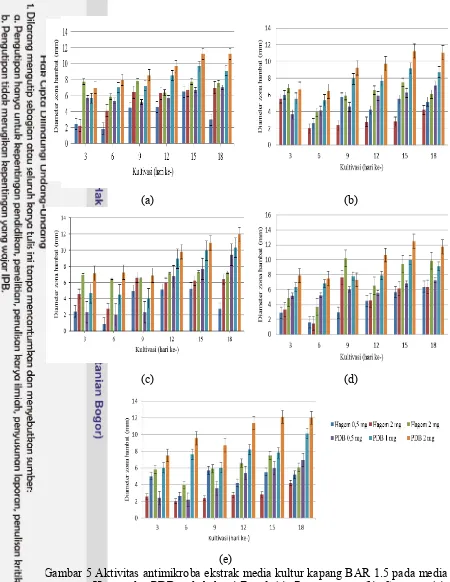
Aktivitas antimikroba berhubungan dengan metabolit sekunder yang diproduksi oleh kapang endofit pada fase pertumbuhannya. Metabolit sekunder diproduksi secara ekstraselular oleh kapang sebagai pertahanan terhadap kondisi lingungan yang tidak sesuai (Gandjar et al. 2006). Srikandace et al. (2007) menambahkan bahwa keterbatasan sumber nutrisi utama seperti karbon dan nitrogen menyebabkan terjadinya pelepasan zat-zat hasil proses katabolisme yang merupakan metabolit sekunder. Pengujian dilakukan selain untuk melihat daya hambat ekstrak terhadap bakteri uji, juga untuk melihat pengaruh waktu kultivasi terhadap aktivitas antimikroba dari ekstrak. Aktivitas antimikroba ekstrak media kultur kapang PDB dan Hagem dapat dilihat pada Gambar 5.
12
(a) (b)
(c) (d)
(e)
Gambar 5 Aktivitas antimikroba ekstrak media kultur kapang BAR 1.5 pada media Hagem dan PDB pada bakteri E. coli (a), P. aeroginosa (b), S. aureus (c), B. subtilis (d) dan Candida maltosa (e).
13
Pandet et al. (2014) terdapat empat kategori antimikroba berdasarkan diameter zona hambat yang dihasilkan dari ekstrak kasar suatu senyawa, yaitu kategori lemah (≤5 mm), sedang (5-10 mm), kuat (10-20 mm) dan sangat kuat (≥20 mm). Aktivitas antimikroba yang terbentuk oleh ekstrak kapang BAR 1.5 dikategorikan memiliki daya hambat yang kuat. Perbedaan masing-masing zona hambat dipengaruhi oleh sensitivitas bakteri. Tingkat sensitivitas terhadap senyawa antimikroba diduga disebabkan perbedaan komponen pada dinding sel kedua jenis bakteri, seperti jumlah peptidoglikon (adanya reseptor, pori-pori, dan lipid), sifat ikatan silang, dan aktivitas enzim autolitik. Komponen tersebut merupakan faktor yang menentukan penetrasi, pengikatan, dan aktivitas senyawa antimikroba (Jawetz 1998). B. subtilis termasuk dalam golongan bakteri Gram-positif. Bakteri Gram-Positif memiliki struktur dinding sel yang berlapis tunggal dan relatif lebih sederhana sehingga memudahkan senyawa antimikroba untuk masuk ke dalam sel (Pelczar dan Chan 2008).
Mekanisme kerja senyawa antimikroba menurut Jawetz et al. (2001) yaitu dengan cara mengubah permeabilitas membran sel, menghambat pengangkutan aktif melalui membran sel, menghambat sintesis dinding sel, sintesis protein, sintesis asam nukleat dan proses metabolisme. Mekanisme kerja antimikroba dipengaruhi oleh beberapa faktor antara lain komponen yang terkandung di dalam antimikroba, waktu penyimpanan, suhu lingkungan, dan sifat mikroba (Pelczar dan Chan 2008). Hasil terbaik pada pengujian aktivitas antimikroba ditunjukkan oleh ekstrak kapang BAR 1,5 dengan kultivasi hari ke-15 pada media PDB dan hari ke-9 pada media Hagem. Ekstrak tersebut selanjutnya digunakan untuk pengujian kromatografi lapis tipis, uji bioautografi serta skrining fitokimia.
Hasil Uji Bioautografi dan Kromatografi Lapis Tipis
Uji bioautografi merupakan pengujian untuk menemukan suatu senyawa antimikroba dengan cara melokalisasi aktivitas antimikroba tersebut dalam suatu kromatogram (Rahalison et al. 1994). Metode ini memanfaatkan pengerjaan Kromatografi Lapis Tipis (KLT). Kromatografi Lapis Tipis adalah metode pemisahan senyawa berdasarkan kecepatan migrasi atau rasio distrubusi dari komponen campuran fase diam dan fase gerak. Bioautografi dapat dipertimbangkan karena paling efisien untuk mendeteksi komponen antimikroba, sebab dapat melokalisir aktivitas meskipun senyawa aktif tersebut dalam bentuk senyawa kompleks dan dapat pula diisolasi langsung dari komponen yang aktif (Akhyar 2010).
14
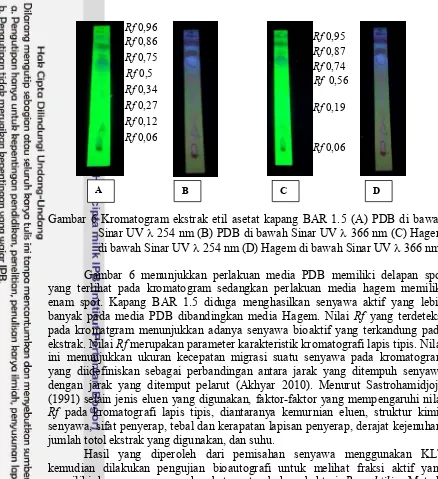
Gambar 6 Kromatogram ekstrak etil asetat kapang BAR 1.5 (A) PDB di bawah Sinar UV 254 nm (B) PDB di bawah Sinar UV 366 nm (C) Hagem di bawah Sinar UV 254 nm (D) Hagem di bawah Sinar UV 366 nm.
Gambar 6 menunjukkan perlakuan media PDB memiliki delapan spot yang terlihat pada kromatogram sedangkan perlakuan media hagem memiliki enam spot. Kapang BAR 1.5 diduga menghasilkan senyawa aktif yang lebih banyak pada media PDB dibandingkan media Hagem. Nilai Rf yang terdeteksi pada kromatgram menunjukkan adanya senyawa bioaktif yang terkandung pada ekstrak. Nilai Rf merupakan parameter karakteristik kromatografi lapis tipis. Nilai ini menunjukkan ukuran kecepatan migrasi suatu senyawa pada kromatogram yang diidefiniskan sebagai perbandingan antara jarak yang ditempuh senyawa dengan jarak yang ditemput pelarut (Akhyar 2010). Menurut Sastrohamidjojo (1991) selain jenis eluen yang digunakan, faktor-faktor yang mempengaruhi nilai Rf pada kromatografi lapis tipis, diantaranya kemurnian eluen, struktur kimia senyawa, sifat penyerap, tebal dan kerapatan lapisan penyerap, derajat kejenuhan, jumlah totol ekstrak yang digunakan, dan suhu.
Hasil yang diperoleh dari pemisahan senyawa menggunakan KLT kemudian dilakukan pengujian bioautografi untuk melihat fraksi aktif yang memiliki kemampuan menghambat pertumbuhan bakteri B. subtilis. Metode bioautografi yang digunakan adalah bioautografi agar overlay. Keuntungan menggunakan metode ini menurut Kusumaningtyas et al. (2008) karena hanya membutuhkan ekstrak dengan jumlah yang sedikit dan dapat digunakan untuk bioassay yang mengarah pada isolasi senyawa aktif. Selain itu, agar overlay yang berada di bawah kromatogram efektif mencegah lempeng kromatogram bergeser sehingga kromatogram dapat menempel dengan sempurna. Profil hasil uji bioautografi ekstrak kapang BAR 1.5 disajikan pada Tabel 2 dan Gambar 7.
15
Tabel 2 Hasil uji bioautografi ekstrak isolat BAR 1.5 pada bakteri B. Subtilis
B
(A) (B)
Gambar 7 Hasil uji bioautografi ektrak etil asetat kapang BAR 1.5 (A) media PDB dan (B) media Hagem pada bakteri Bacillus subtilis
Gambar 7 menunjukkan bahwa ekstrak etil asetat media kultur kapang BAR 1.5 memiliki aktivitas antimikroba terhadap bakteri B. subtilis yang ditunjukkan dengan adanya zona hambatan pada media agar yang telah diinokulasi dengan bakteri tersebut. Hasil tersebut menunjukkan adanya kaitan antara jumlah fraksi aktif dengan aktivitas antimikroba yang dihasilkan. Media PDB yang memiliki fraksi aktif lebih banyak dibandingkan media hagem menunjukkan diameter zona hambat bakteri yang lebih besar pada pengujian antibakteri. Kombinasi antara ketiga fraksi aktif yang terkandung dalam ekstrak media kultur PDB diduga memberikan kontribusi yang besar untuk menghambat pertumbuhan bakteri dibandingkan dengan ekstrak media kultur hagem yang hanya memiliki satu fraksi aktif saja. Fraksi aktif yang memiliki zona hambatan diduga mengandung senyawa aktif yang berperan dalam aktivitas antimikroba, oleh karena itu diperlukan pengujian fitokimia semprot untuk mengetahui jenis metabolit sekunder yang terkandung dalam ekstrak.
Fitokimia Ekstrak Etil Asetat Kapang BAR 1.5
Fraksi yang terlihat pada kromatogram selanjutnya dilakukan uji fitokimia dengan metode KLT untuk melihat komponen senyawa yang terkandung dalam masing-masing ekstrak menggunakan pereaksi semprot, diantaranya anisaldehid-asam sulfat, uap amonia dan FeCl3. Hasil skrining fitokimia ekstrak etil asetat kapang BAR 1.5 dapat dilihat pada Tabel 3, sedangkan kenampakan kromatogram hasil uji fitokimia dapat dilihat pada Lampiran 4.
Perlakuan Rf (Retardation factor) Diameter zona hambat (mm)
16
Tabel 3 Hasil skrining fitokimia ekstrak etil asetat kapang BAR 1.5 Pereaksi Senyawa Perlakuan Hasil Nilai Rf Anisaldehid
asam-sulfat
Terperoid/Steroid PDB + (kuning-coklat) + (biru-ungu) Uap amonia Flavonoid PDB + ( kuning-coklat) 0,74
Hagem + (kuning) 0,75 FeCl3 Polifenol PDB + ( ungu-hitam) 0,86
Hagem + (hitam) 0,75
Ekstrak kapang BAR 1.5 pada perlakuan media PDB memilki aktivitas antimikroba yang lebih tinggi dibandingkan perlakuan media Hagem. Hal ini diduga disebabkan adanya kombinasi senyawa yang berperan pada aktivitas antimikroba. Fraksi aktif dari ekstrak media PDB yang terdeteksi diantaranya steroid, poifenol dan flavonoid sedangkan, pada ekstrak media hagem hanya terdapat satu fraksi aktif yang terdeteksi yaitu steroid. Mekanisme senyawa antibakteri setiap senyawa bioaktif berbeda-berbeda. Menurut Cowan (1990) mekanisme penghambatan bakteri oleh senyawa steroid diduga dengan cara merusak membran sel bakteri. Flavonoid merupakan senyawa metabolit sekunder yang berperan sebagai faktor pertahanan alami, seperti mencegah serangan bakteri (Harborne 1987). Sifat antibakteri senyawa flavonoid adalah dapat menyebabkan terjadinya denaturasi protein di dalam sel. Hal tersebut disebabkan kemampuan gugus OH pada senyawa flavonoid untuk berikatan dengan protein internal membran sel (Scheuer 1995). Menurut Pelczar dan Chan (2008) senyawa fenol dan turunannya dapat merusak membran sel sehingga terjadi perubahan permeabilitas sel yang dapat mengakibatkan terhambatnya pertumbuhan sel atau matinya sel. Mekanisme penghambatan tersebut menurut Jawetz et al. (2001) terjadi karena senyawa fenol dapat berikatan dengan gugus sulfidrin dari protein. Hal tersebut menyebabkan perubahan konfirmasi protein membran sel target. Ketidakstabilan pada struktur protein tersebut akan menyebabkan terganggunya fungsi permeabilitas selektif, fungsi pengangkutan aktif, pengendalian susunan protein dan sel bakteri sehingga sel kehilangan bentuk dan lisis.
KESIMPULAN DAN SARAN
Kesimpulan
17
pertumbuhan bakteri B. subtilis yaitu terpenoid, polifenol dan flavonoid sedangkan ekstrak media Hagem memiliki satu fraksi yaitu steroid.
Saran
Perlu dilakukan uji Konsentrasi Hambat Minimum (KHM) untuk melihat konsentrasi terendah dari antimikroba yang menghambat pertumbuhan mikroba, selain itu perlu penambahan pereaksi semprot untuk uji fitokimia sehingga dapat mengidentifikasi senyawa yang terkandung dalam ekstrak kapang BAR 1.5.
DAFTAR PUSTAKA
[FAO] Food and Agriculture Organization. 2000. Mangrove Guide Book for Southeasst Asia, Part 2 Description-Trees & Shrubs. Rhizophoraceae: Ministry of Fisheries, Agricultural and Marine Resources. hlm: 710-711.
Akhyar. 2010. Uji daya hambat dan analisis KLT bioautografi ekstrak akar dan buah bakau (Rhizophora stylosa Griff.) terhadap Vibrio harveyi [skripsi]. Makassar(ID): Fakultas Farmasi,Universitas Hasanuddin.
Artanti N, Tachibana S, Kardono LBS, Sukiman H. 2011. Screening of endophytic fungi having ability for antioxidative and a-glucosidase inhibitor activities isolated from Taxus sumatrana. Pakistan Journal of Biological Science. 14(22): 1019-1023.
Bustan MD, Febriyani E, Halomoan P.2008. Pengaruh waktu ekstraksi dan ukuran partikel terhadap berat oleoresin jahe yang diperoleh dari berbagai jumlah pelarut organik (metanol). Jurnal Teknik Kimia .4(15): 16-26.
Cowan MM. 1999. Plant product as antimicrobial agents. Clinical Microbiology Review. 12(4): 564-582.
Fajri NF. 2015. Pengaruh media pertumbuhan terhadap potensi antibakteri dan anihiperglikemik kapang endofit tumbuhan pesisir sarang semut Hydnophytum formicarum [skripsi]. Bogor (ID): Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Gandjar I, Sjamsuridzal W, Oetari A. 2006. Mikologi Dasar dan Terapan. Jakarta (ID): Yayasan Obor Indonesia.
Ghozali I. 2011. Aplikasi Analisis Multivariate dengan Program IBM SPSS 19. Semarang (ID): Badan Penerbit Universitas Diponegoro.
Giri C, Ochieng E, Tieszen L, Zhu Z, Singh A, Loveland T, Masek J, and Duke N. 2011. Status and distribution of mangrove forests of the world using earth observation satellite data. Global Ecology and Biogeography. 20:154-159. Harborne. 1987. Metode Fitokimia, Penuntun Cara Modern Menganalisis
18
Helmholz H, Etoundi P, Lindequist U. 1999. Cultivation of the marine basidiomycete Nia vibrissa. Journal of Biotechonology. 70:203-206.
Jawetz E, Melnick JL, Adelberg EA. 2001. Mikrobiologi Kedokteran. Nani W, penerjemah. Jakarta (ID): Salemba Medika. Terjemahan dari: Medical Microbiology. 196-198.
Jawetz E. 1998. Obat-obat kemoteuratika. Di dalam: Katzung BG, editor. Hartanto H et al., penerjemah. Farmakologi Dasar dan Klinik. Jakarta (ID): EGC. Terjemahan dari: Basic and Clinical Pharmacology.
Kusumaningtyas E, Estie A, Darmono. 2008. Sensitivitas metode bioautografi kontak dan agar overlaydalam penentuan senyawa antikapang. Jurnal Ilmu Kefarmasia Indonesia. 6(2):75-79.
Melliawati R, Wulandari PS. 2008. Kapang endofit dari Taman Nasional Gunung Halimun sebagai penghambat pertumbuhan mikroba pathogen Salmonella thypimurium dan Candida albicans. Berkala Penelitian Hayati. 13(1): 101-107.
Moorthy K, Srinivasan K, Subramanian, Palaniswamy M, Mohanasundari C.2007. Phytochemical screening and antibacterial evaluation of stem bark of Mallotus philippinensis var. Tomentosus. African Journal of Biotechnology. 6(13), 1521-1523.
Mouafi F, Shadia m, Abdel A, Awatif AB, Amal AF. 2014. Phytochemical analysis and antimicrobial activity of mangrove leaves (Avicennia marina and Rhizophora stylosa) against some pathogens. World Applied Sciences Journal. 29(4):547-554.
Nursid M, Asri P, Ekowati C. 2010. Kutivasi kapang MFW-01-08 yang diisolasi dari Ascidia ( Aplidium longithorac) dan uji aktivitas sitotoksiknya terhadap sel kanker payudara TP7D. Jurnal Pascapanen dan Bioteknologi Kelautan dan Perikanan. 6(2):103:111.
Paudel B, Hari D ,Chan K, Hyoungseok L, Roman S, Lena I, Lena P. 2014. Estimation of antioxidant, antimicrobial activity and brine shrimp toxicity of plants collected from Oymyakon region of the Republic of Sakha (Yakutia), Russia. Biological Research. 47(10):1-6.
Pavithra N, Sathish L, Ananda K. 2012. Antimicrobial and enzyme activity of endophytic fungi isolated from Tulsi. Journal of Pharmaceutical and Biomedical Science. 16(12): 1-6.
Pelczar MJ, Chan ESC. 2008. Dasar-Dasar Mikrobiologi 2. Hadioetomo, Penerjemah. Jakarta (ID): UI-Press. Terjemahan dari: Elements of Microbiology. 99-156, 447-508.
Radji M. 2005. Peranan bioteknologi dan mikroba endofit dalam pengembangan obat herbal. Majalah Ilmu Kefarmasian. 2(3): 118-121.
19
Rahman MA, Hasan SN, Sampad KS, Das AK. 2011. Antinociceptive, antidiarrhoeal and cytotoxic activity of Rhizophora mucronata Lamk. Pharmacology online. 1: 921-929.
Rayner ADM, 1991. The challenge of the individualistic mycelium. Mycologia 83: 48–71.
Sahara R. 2013. Kapang endofit dari tumbuhan pesisir sarang semut (Hydnophylum formicarum) dan potensinya sebagai antihiperglikemik. [skripsi]. Bogor (ID): Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Sastrohamidjojo, H. 1991. Kromatografi. Yogyakarta (ID): Liberti.
Scheuer JS.1995. Produk Alami Lautan. Semarang (ID): IKIP Semarang Press. Schmidt K. 1994. Mikrobiologi Umum. Baskoro T, penerjemah; Wattimena JR,
editor. Yogyakarta (ID): Penerbit Gadjah Mada University Press. Terjemahan dari: Allgemeine Mikrobiologie
Soetarno S. 2000. Potential and benefits of mangrove plants as source of bioactive compounds. Acta Pharmaceutica Indonesia. 12(4): 84-103.
Srikandace Y, Hapsari Y dan Simanjuntak P. 2007. Seleksi mikroba endofit Curcuma zedoaria dalam memproduksi senyawa kimia antimikroba. Jurnal Ilmu Kefarmasian Indonesia.5(2): 77-84.
Steel RGD, Torrie JH. 1993. Prinsip dan Prosedur Statistika. Sumantri B, penerjemah. Jakarta (ID): Gramedia Pustaka Utama. Terjemahan dari Principles and Procedures of Statistics.
Tarman K, Safitri D, Setyaningsih I. 2013. Endophytic fungi isolated from Rhizophora mucronata and their antibacterial activity. Squalen Bulletin of Marine and Fisheries Postharvest and Biotechnology. 8(20): 69-76.
Tarman K. 2011. Biological and chemical investigations of Indonesian marinederived fungi and their secondary metabolites [disertasi]. Greifswald (DE): Mathematisch-Naturwissenschaftlichen Fakultät, Ernst-Moritz-Arndt-Universität.
Trihadiningrum Y. 2004. Potensi kapang pelapuk putih Phanerochaete chrysosporium dalam mengolah limbah hasil industri tekstil. Berkala Penelitian Hayati. 9(1): 125-129
Ukhty N. 2015. Isolasi kapang endofit tumbuhan pesisir terong pungo (Solanum sp.) dan aktivitas antibakterinya terhadap patogen mulut [tesis]. Bogor (ID): Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Wagner H, Bland S. 1996. Plant Drug Analysis; A Thin Layer Chromatography Atlas. Ed ke-2. Berlin (DE): Berlin Heidelberg-Springer. 28-60.
23
Lampiran 1 Komposisi media yang digunakan (dalam satuan Liter)
Potato Dextrose Agar (PDA) BD Company®
Potato starch 4.0 g
Dextrose 20.0 g
Agar 15.0 g
pH 5.6 ± 0.2
Potato Dextrose Broth BD Company®
Potato starch 4.0 g
Dextrose 20.0 g
pH 5.1 ± 0.2
Hagem media
KH2PO4 MERCK® 0.5 g
MgSO4.7H2O MERCK® 0.5 g
FeCl3 MERCK® 0.5 g
Glukosa MERCK® 5 g
Malt ekstrak MERCK® 5 g
Akuades 1 L
pH 7.5
Lampiran 2 Kultur kapang BAR 1.5
Periode Kultivasi Media PDB Media Hagem
Hari ke-3
Hari ke-6
24
Hari ke-12
Hari ke-15
Hari ke-18
Lampiran 3 Hasil uji antibakteri ekstrak kapang BAR 1.5
Media PDB terhadap bakteri B subtilis
H3 H6
25
H15 H18
Media Hagem terhadap bakteri B subtilis
H3 H6
H9 H12
26
Lampiran 4 Dokumentasi hasil uji fitokimia
No Pereaksi Semprot
Dokumentasi
1 Anisaldehid asam-sulfat
2 Uap Amonia
27
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 24 Desember 1993 dari ayah Teddy Pribaddy dan Herni Nurani. Penulis adalah putri kedua dari tiga bersaudara. Penulis memulai jenjang formal pendidikan Taman Kanak-kanak di TK Aisyah 32 Jagakarsa, lalu penulis melanjutkan Sekolah Dasar Negeri Mampang 2 dan lulus pada tahun 2005. Penulis melanjutkan Sekolah Menengah Pertama di SMP Negeri 13 Depok dan lulus pada tahun 2008, kemudian penulis melanjutkan Sekolah Menegah Atas di SMA Negeri 5 Depok dan lulus pada tahun 2011. Pada tahun 2011 penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur SNMPTN Undangan dan diterima di Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan.