PEMBERIAN MIKROKAPSUL PROBIOTIK
Bacillus
sp. NP5
DAN PREBIOTIK MANNANOLIGOSAKARIDA UNTUK
PENCEGAHAN INFEKSI
Aeromonas hydrophila
PADA IKAN PATIN (
Pangasianodon hypophthalmus
)
RIFQI TAMAMDUSTURI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul “Pemberian Mikrokapsul Probiotik Bacillus sp. NP5 dan Prebiotik Mannanoligosakarida untuk Pencegahan Infeksi Aeromonas hydrophila pada Ikan Patin (Pangasianodon hypophthalmus)” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
RIFQI TAMAMDUSTURI. Pemberian Mikrokapsul Probiotik Bacillus sp. NP5 dan Prebiotik Mannanoligosakarida untuk Pencegahan Infeksi Aeromonas hydrophila pada Ikan Patin (Pangasianodon hypophthalmus). Dibimbing oleh WIDANARNI dan MUNTI YUHANA.
Salah satu penyakit pada budidaya ikan patin adalah motile aeromonad septicaemia (MAS) yang diakibatkan oleh infeksi bakteri Aeromonas hydrophila. Penyakit bakterial ini paling umum menyerang ikan-ikan di perairan tawar baik pada ikan budidaya maupun liar di seluruh dunia. Penggunaan antibiotik dalam kegiatan budidaya sudah dibatasi, karena penggunaan jangka panjang dapat mengakibatkan resistensi bakteri patogen, menjadi residu dalam lingkungan dan organisme budidaya. Salah satu alternatif yang dapat dilakukan untuk pencegahan penyakit adalah dengan aplikasi probiotik, prebiotik dan sinbiotik untuk meningkatkan sistem imun inang. Aplikasi probiotik dan prebiotik secara tunggal dapat meningkatkan performa pertumbuhan dan sistem imun inang, akan tetapi, gabungan probiotik dan prebiotik (sinbiotik) memberikan hasil yang lebih baik dalam menstimulasi pertumbuhan organisme akuatik dan sistem imun dibandingkan secara terpisah. Efektivitas aplikasi probiotik sangat bergantung pada viabilitas sel probiotik selama penyimpanan hingga mencapai target dan bekerja pada saluran pencernaan inang. Salah satu pendekatan yang dapat digunakan dalam mempertahankan viabilitas bakteri probiotik yaitu dengan teknik mikroenkapsulasi. Penelitian ini bertujuan untuk mengevaluasi pemberian mikrokapsul probiotik Bacillus NP5, prebiotik (MOS) serta gabungan keduanya untuk pencegahan infeksi A. hydrophila pada ikan patin.
Probiotik yang digunakan pada penelitian ini adalah Bacillus sp. NP5 RfR yang
dienkapsulasi dengan metode spray drying. Prebiotik yang digunakan adalah MOS dan sinbiotik merupakan gabungan dari probiotik dan prebiotik. Pada uji in vivo ikan patin diberi mikrokapsul probiotik, prebiotik dan sinbiotik selama 30 hari dengan pakan komersial kadar protein 31% secara at satiation. Percobaan meliputi K-, K+ (probiotik 0%, Prebiotik 0% dan sinbiotik 0%), Pro (mikrokapsul probiotik 1%), Pre (prebiotik MOS 0,2%) dan Sin (mikrokapsul probiotik 1% + prebiotik MOS 0,2%). Pada hari ke 32, dilanjutkan dengan pengujian resistensi ikan patin terhadap infeksi A. hydrophila melalui injeksi intramuskular dan pengamatan dilakukan selama 9 hari. Parameter yang diamati meliputi total bakteri di usus (total bakteri dan Bacillus sp. NP5 RfR), performa
pertumbuhan (laju pertumbuhan spesifik dan rasio konversi pakan), kelangsungan hidup dan respons imun (kadar hemoglobin, hematokrit, total eritrosit, total leukosit, aktivitas fagosit dan ledakan respiratori) serta total A. hydrophila di organ target inang.
Berdasarkan hasil penghitungan total bakteri dan probiotik Bacillus sp. NP5 RfR
di usus, nilai tertinggi terdapat pada perlakuan sinbiotik (9,27±0,13 log CFU g-1;
7,26±0,04 log CFU g-1). Selain itu, perlakuan sinbiotik menunjukkan performa
SUMMARY
RIFQI TAMAMDUSTURI. Administration of Microencapsulated Probiotic Bacillus sp. NP5 and Prebiotic Mannan Oligosaccharide for the Prevention of Aeromonas hydrophila Infection on Pangasianodon hypophthalmus. Guided by WIDANARNI and MUNTI YUHANA.
One of important diseases found in pangasius farming is Motile Aeromonad Septicaemia (MAS) caused by the infection of Aeromonas hydrophila. This bacterial disease most commonly affects freshwater fishes, both farmed fish and wild fish worldwide. To overcome the MAS disease, antibiotics were commonly applied in the fish farming activities, however their use have been restricted since the long-term use of antibiotics may lead to resistance of pathogenic bacteria and becomes residues in the environment as well as in the fish products. One of alternatives which is environmentally friendly and can be used as disease prevention is application of probiotics (pro), prebiotics (pre) and synbiotic (syn) to enhance the host immune system. Applications singlely probiotics and prebiotics can improve the host growth performance and immune system. The effectiveness of probiotics depend on the viability of the probiotic cells during storage, one approach taken by the microencapsulation technique. This study aimed to evaluate the application of probiotic microcapsules Bacillus NP5, prebiotics (MOS) and their combination for the prevention of A. hydrophila infection on pangasius.
Probiotic cells used in this study was Bacillus sp. NP5 RfR encapsulated by spray
drying method, MOS prebiotic and synbiotic combination. For in vivo test, the fish were fed by pellet containing probiotic microcapsules, prebiotic and synbiotic for 30 days. Treatments included both of controls K-, K+ (without supplementation) and the main treatments of Pro (probiotic microcapsules 1%), Pre (prebiotic MOS 0,2%) and Syn (hemoglobin concentration, hematocrit, total erythrocytes, total leukocytes, phagocytic activity and respiratory burst) also the total A. hydrophila cells in the target organs of fish.
Based on the results of total bacterial cells count in the gut, the highest number of total bacteria and Bacillus sp. NP5 RfR were found in syn treatment (9,27 ± 0,13 log
CFU g-1; 7,26 ± 0,04 log CFU g-1). In addition, syn treatment showed the best growth
total erythrocytes were found in syn treatment. Moreover, on day 34 and 37 after the challenge test, levels of hematocrit, hemoglobin and total erythrocytes decreased and further increased on day 41. The results also showed that total leukocytes (TL), phagocytic activity (AF) and respiratory burst (RB) in all treatments, before the challenge test, were not significantly different. Increase of total leukocytes, phagocytic activity and respiratory burst occurred on day 34 and 37, but then they decreased on day
41. Based on the calculation after challenge test, the lowest number of total A. hydrophila cells in the fish’s kidney was found in syn treatment. Dietary Bacillus sp.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
PEMBERIAN MIKROKAPSUL PROBIOTIK
Bacillus
sp. NP5
DAN PREBIOTIK MANNANOLIGOSAKARIDA UNTUK
PENCEGAHAN INFEKSI
Aeromonas hydrophila
PADA IKAN PATIN (
Pangasianodon hypophthalmus
)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Pemberian Mikrokapsul Probiotik Bacillus sp. NP5 dan Prebiotik Mannanoligosakarida untuk Pencegahan Infeksi Aeromonas hydrophila pada Ikan Patin (Pangasianodon hypophthalmus) Nama : Rifqi Tamamdusturi
NIM : C151130371
Disetujui oleh Komisi Pembimbing
Dr Ir Widanarni, MSi
Ketua Dr Munti Yuhana, SPi, MSi Anggota
Diketahui oleh
Ketua Program Studi Ilmu Akuakultur
Dr Ir Widanarni, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala limpahan rahmat dan karunia-Nya sehingga tesis yang berjudul “Pemberian Mikrokapsul Probiotik Bacillus sp. NP5 dan Prebiotik Mannanoligosakarida untuk Pencegahan Infeksi Aeromonas hydrophila pada Ikan Patin (Pangasianodon hypophthalmus)” ini berhasil diselesaikan. Tesis ini ditulis berdasarkan hasil penelitian yang dilaksanakan pada bulan Agustus 2014-Mei 2015 bertempat di Institut Pertanian Bogor.
Penulis menyadari bahwa terselesaikannya tesis ini tidak lepas dari segala bantuan dan dukungan dari berbagai pihak, baik ide, tenaga, moril maupun
materiil. Penulis menyampaikan rasa terima kasih yang mendalam pada Dr Ir Widanarni, MSi dan Dr Munti Yuhana, SPi MSi sebagai komisi
pembimbing atas waktu dan bimbingannya mulai dari penyusunan proposal, pelaksanaan penelitian hingga penulisan tesis. Penulis juga menyampaikan rasa terima kasih pada Dr. Alimuddin, SPi, MSc sebagai penguji luar komisi dan Dr. Dinamella Wahjuningrum, SSi, MSi sebagai perwakilan dari Program Studi Ilmu Akuakultur yang memberikan saran dan semangat selama ujian tesis.
Terima kasih disampaikan pada Direktorat Jendral Pendidikan Tinggi (DIKTI), Kementerian Pendidikan dan Kebudayaan (KEMENDIKBUD) atas penyediaan Beasiswa Fresh Graduate Tahun 2013 sehingga penulis dapat melanjutkan studi di Sekolah Pascasarjana, Institut Pertanian Bogor.
Terima kasih dan penghargaan yang tinggi penulis persembahkan pada Ayah Anwar Sulaiman dan Ibu Rohana, Kakak Royhan Rozqie dan Kakak Rida Cameli atas doa, bantuan, dukungan dan semangatnya.
Terima kasih kepada rekan-rekan S2 Ilmu Akuakultur angkatan 2013 atas kebersamaannya dalam menempuh studi, rekan-rekan di Laboratorium Kesehatan Ikan (Mbak Diah, Dendi, Windu, Kak Dwi, Kak Haezy, Ike, Yanti), kelompok belajar Al-Hikmah (Maruli, Akmal, Kak Aty, Ayu, Kak Poernomo, Kang Hidayat, Bu Setyorini, Kak Fitria, Destianingrum, Lukman, Pak Tirta, Lukmini) dan rekan-rekan UNDIP yang melanjutkan studi di IPB. Mbak Yuli, Kang Asep, Bapak Ranta, Bapak Nurwanto, Bapak Aam atas bantuannya selama penelitian.
Semoga karya ilmiah ini bermanfaat untuk kemajuan ilmu pengetahuan, khususnya perikanan budidaya.
DAFTAR ISI
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
2 METODE PENELITIAN 2
Waktu dan Tempat Penelitian 2
Penyiapan Mikrokapsul Probiotik dan Mannanoligosakarida 2
Penyiapan Bakteri A. hydrophila 3
Uji In vivo 3
Parameter Penelitian 4
Kinerja Pertumbuhan 4
Total Bakteri dan Bacillus sp. NP5 RfR di Usus Ikan Uji 5
Parameter Gambaran Darah 5
Total A. hydrophila di Organ Target Ikan Uji 6
Analisis Data 6
3 HASIL DAN PEMBAHASAN 7
Kinerja Pertumbuhan 7
Respons Imun 8
4 SIMPULAN DAN SARAN 14
Simpulan 14
Saran 14
DAFTAR PUSTAKA 14
LAMPIRAN 18
DAFTAR GAMBAR
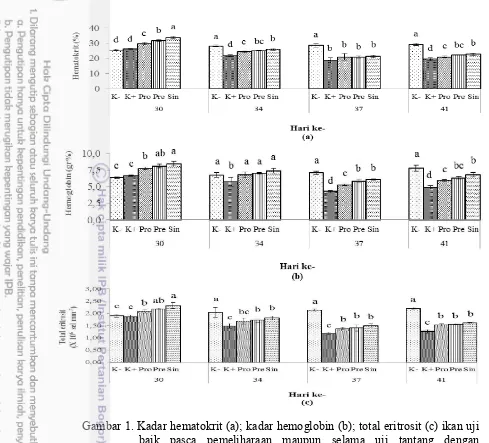
1. Kadar hematokrit (a); kadar hemoglobin (b); total eritrosit (c) ikan uji
baik pasca pemeliharaan maupun selama uji tantang dengan A. hydrophila. Huruf superscript yang berbeda ditiap bar pada hari yang
sama menunjukkan perbedaan secara statistik (Uji jarak berganda Duncan; p<0,05). Kontrol negatif (K-); kontrol positif (K+); mikrokapsul probiotik Bacillus sp. NP5 RfR dosis 1% (Pro); prebiotik
MOS dosis 0,2% (Pre); mikrokapsul probiotik Bacillus sp. NP5 RfR
dosis 1% + prebiotik MOS dosis 0,2% (Sin). 9
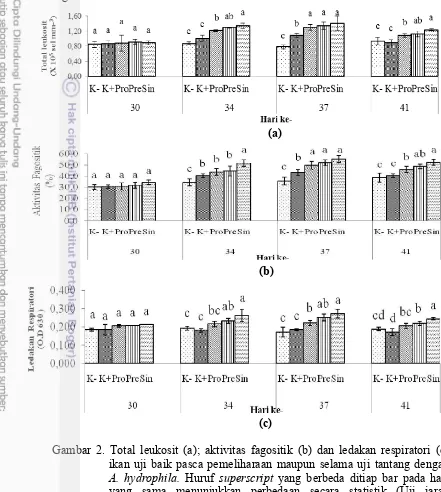
2. Total leukosit (a); aktivitas fagositik (b) dan ledakan respiratori (c) ikan
uji baik pasca pemeliharaan maupun selama uji tantang dengan A. hydrophila. Huruf superscript yang berbeda ditiap bar pada hari yang
sama menunjukkan perbedaan secara statistik (Uji jarak berganda Duncan; p<0,05). Kontrol negatif (K-); kontrol positif (K+); mikrokapsul probiotik Bacillus sp. NP5 RfR dosis 1% (Pro); prebiotik
MOS dosis 0,2% (Pre); mikrokapsul probiotik Bacillus sp. NP5 RfR
dosis 1% + prebiotik MOS dosis 0,2% (Sin). 11
3. Total A. hydrophila di hati (a) dan ginjal (b) ikan uji. Huruf superscript yang berbeda ditiap bar pada hari yang sama menunjukkan perbedaan secara statistik (Uji jarak berganda Duncan; p<0,05). Kontrol negatif (K-); kontrol positif (K+); mikrokapsul probiotik Bacillus sp. NP5 RfR dosis 1% (Pro); prebiotik MOS dosis 0,2% (Pre); mikrokapsul probiotik Bacillus sp. NP5 RfR dosis 1% + prebiotik MOS dosis 0,2% (Sin). 12
4. Kelangsungan hidup ikan uji setelah uji tantang dengan A. hydrophila. Huruf superscript yang berbeda di tiap bar menunjukkan perbedaan secara statistik (uji jarak berganda Duncan; p<0,05). Kontrol negatif (K-); kontrol positif (K+); mikrokapsul probiotik Bacillus sp. NP5 RfR
dosis 1% (Pro); prebiotik MOS dosis 0,2% (Pre); mikrokapsul probiotik Bacillus sp. NP5 RfR dosis 1% + prebiotik MOS dosis 0,2% (Sin). 13
DAFTAR LAMPIRAN
1. Hasil pengujian morfologi, fisiologi dan biokimia bakteri Bacillus sp.
NP5 dan A. hydrophila 19
2. Analisis statistik terhadap laju pertumbuhan spesifik (A) dan rasio konversi pakan (B) ikan patin pada akhir perlakuan probiotik, prebiotik
dan sinbiotik. 20
3. Hasil uji Duncan terhadap hematokrit, hemoglobin dan total eritrosit akhir pemberian pakan perlakuan dan setelah uji tantang dengan
A. hydrophila. 21
4. Hasil uji Duncan terhadap total leukosit, aktivitas fagosit dan ledakan respiratori akhir pemberian pakan perlakuan dan setelah uji tantang
1 PENDAHULUAN
Latar Belakang
Ikan patin merupakan ikan asli Asia Tenggara dan telah dibudidayakan secara luas di sistem budidaya air tawar serta menjadi spesies akuakultur yang bernilai ekonomis tinggi (Hedayati dan Tarkhani 2014). Intensifikasi produksi budidaya patin saat ini juga disertai dengan munculnya beberapa penyakit yang disebabkan oleh bakteri dan parasit (Phan et al. 2009). Salah satu penyakit pada budidaya ikan patin yakni motile aeromonad septicaemia (MAS) yang disebabkan oleh bakteri Aeromonas hydrophila.
Penyakit bakterial ini paling umum menyerang ikan-ikan di perairan tawar baik pada ikan budidaya maupun liar di seluruh dunia (Zhang et al. 2014a). Penggunaan antibiotik pada kegiatan budidaya sudah mulai dibatasi, karena penggunaan dalam jangka panjang dapat mengakibatkan resistensi bagi bakteri patogen, menjadi residu dalam lingkungan budidaya dan organisme budidaya. Eksplorasi metode yang ramah lingkungan diperlukan untuk pencegahan MAS. Salah satu alternatif yang dapat digunakan yaitu aplikasi probiotik, prebiotik dan sinbiotik secara oral (Talpur et al. 2014).
Probiotik merupakan mikroba tambahan yang dapat memberikan pengaruh menguntungkan bagi inang (Nayak 2010). Bakteri probiotik genus Bacillus memiliki daya tahan terhadap suhu dan tekanan tinggi serta telah digunakan secara luas dalam akuakultur (Lin et al. 2012). Suplementasi Bacillus sp. NP5 dalam pakan dilaporkan mampu meningkatkan efisiensi pakan dan pertumbuhan ikan nila dibandingkan dengan kontrol (Putra et al. 2015). Prebiotik adalah bahan makanan yang tidak dapat dicerna inang namun memberi pengaruh menguntungkan dengan merangsang pertumbuhan dan aktivitas dari sejumlah bakteri yang menguntungkan (Zhang et al. 2012). Mannanoligosakarida (MOS) merupakan glukomannoprotein kompleks yang diperoleh dari dinding sel ragi Saccharomyces cerevisiae (Sang et al. 2010). Hasil penelitian Zhang et al. (2012) menunjukkan bahwa pemberian MOS 2-4 g kg-1 dapat meningkatkan performa
pertumbuhan dibandingkan pakan kontrol pada udang vaname. Sinbiotik merupakan suplemen penggabungan probiotik dan prebiotik, sehingga mampu meningkatkan efek menguntungkan pada inang (Cerezuela et al. 2011). Menurut Daniels et al. (2010), penelitian tentang sinbiotik memberikan keuntungan dalam peningkatan laju pertumbuhan, konversi pakan dan kondisi kesehatan lobster.
Menurut Weinbreck et al. (2010) efektivitas probiotik bergantung kemampuan probiotik untuk bertahan hidup dalam masa penyimpanan untuk mencapai target dan bekerja pada saluran pencernaan inang. Mikroenkapsulasi merupakan suatu pendekatan sebagai cara untuk menyediakan sel probiotik dengan physical barrier guna melindungi probiotik selama proses pencernaan, pengolahan dan penyimpanan produk probiotik (Kailasapathy 2009).
2
Perumusan Masalah
A. hydrophila menjadi suatu masalah dalam budidaya ikan air tawar salah satunya budidaya ikan patin. Pemberian probiotik dan prebiotik terbukti mampu meningkatkan sistem imun dan kinerja pertumbuhan pada ikan maupun krustasea, namun pemberian probiotik dalam bentuk segar memiliki masa penyimpanan yang terbatas karena mudah rusaknya sel probiotik oleh pengaruh lingkungan seperti suhu maupun oksigen. Solusi untuk melindungi sel probiotik adalah dengan teknik mikroenkapsulasi. Penelitian pemberian mikrokapsul probiotik Bacillus sp. NP5 dan prebiotik MOS diharapkan mampu memberikan efek positif terhadap kinerja pertumbuhan dan sistem imun ikan patin yang diinfeksi A. hydrophila.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengevaluasi pemberian mikrokapsul probiotik Bacillus sp. NP5, prebiotik mannanoligosakarida dan gabungannya terhadap kinerja pertumbuhan, respons imun dan resistensi ikan patin terhadap infeksi A. hydrophila.
Manfaat Penelitian
Manfaat dari penelitian ini adalah diperoleh suatu informasi tentang pemberian mikrokapsul probiotik Bacillus sp. NP5 dan prebiotik MOS serta gabungan keduanya yang dapat diaplikasikan dengan baik dalam akuakultur untuk pencegahan penyakit bakterial, khususnya A. hydrophila pada ikan patin.
2 METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian dilaksanakan mulai bulan Agustus 2014 – Mei 2015 di Laboratorium Kesehatan Ikan untuk pengamatan gambaran darah, uji in vivo di Teaching Farm Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor dan kegiatan spray drying di Laboratorium SEAFAST (South East Asian Food and Agriculture Science and Technology) Center, Institut Pertanian Bogor.
Penyiapan Mikrokapsul Probiotik dan Mannanoligosakarida
3
mikrokapsul mengikuti metode Utami et al. (2015). Viabilitas probiotik setelah pengeringan diamati untuk mengetahui jumlah probiotik dalam produk. Uji viabilitas dilakukan dengan teknik spread plate menggunakan TSA (Tryptic Soy Agar) yang ditambahkan dengan 50 mg ml-1 rifampisin (TSA+Rif).
Kultur segar probiotik Bacillus sp. NP5 RfR dengan kepadatan 1010 CFU g-1
setelah dimikroenkapsulasi menunjukkan hasil uji viabilitas sebesar 108 CFU g-1.
Mannanoligosakarida yang digunakan pada penelitian ini berasal dari dinding sel ragi Saccharomyces cerevisiae (Bio-Mos Alltech).
Penyiapan Bakteri A. hydrophila
Bakteri patogen yang digunakan untuk uji tantang pada penelitian ini adalah A.hydrophila dengan hasil karakterisasiyang ada pada Lampiran 1. Bakteri ini diberi penanda resisten antibiotik chloramphenicol. Stok bakteri ditumbuhkan pada media TSA yang mengandung chloramphenicol. Sel bakteri A. hydrophila sebanyak satu ose diambil dan ditumbuhkan dalam medium TSB volume 25 ml, kemudian diinkubasi dalam waterbath shaker pada suhu 29oC dengan kecepatan
140 rpm selama 24 jam, sehingga diperoleh A. hydrophila dengan kepadatan 108 CFU ml-1 lalu dilakukan pengenceran serial satu kali untuk mendapatkan
kepadatan A. hydrophila sebesar 107 CFU ml-1 yang merupakan dosis LD50 dari
infeksi A. hydrophila pada ikan patin dan akan digunakan pada uji tantang.
Uji In vivo
Penelitian ini terdiri dari lima perlakuan dengan lima ulangan, yaitu kontrol negatif (K-), kontrol positif (K+) serta pakan dengan penambahan mikrokapsul probiotik 1% (Pro), prebiotik MOS 0,2% (Pre) dan gabungan mikrokapsul probiotik 1% + prebiotik MOS 0,2% (Sin). Pakan yang digunakan dalam penelitian ini adalah pakan komersil dengan kandungan protein 31%. Mikrokapsul probiotik maupun prebiotik MOS ditambahkan kedalam pakan sesuai masing-masing perlakuan dan dicampur dengan 2% putih telur sebagai perekat. Pakan yang telah dicampur, dikering udarakan lalu disimpan pada lemari pendingin bersuhu 4oC sebelum digunakan.
Ikan patin yang digunakan dalam penelitian ini berukuran 6,54±0,17g yang telah diaklimatisasi selama dua minggu dan selanjutnya dipelihara pada akuarium berukuran 50x30x25cm3 dengan kepadatan 10 ekor per akuarium. Ikan
diberi pakan sebanyak tiga kali sehari secara at satiation selama 30 hari. Pada hari ke-2 setelah 30 hari pemeliharaan dengan perlakuan probiotik, prebiotik dan sinbiotik, 10 ekor ikan uji dari masing-masing perlakuan kecuali kontrol negatif diuji tantang dengan injeksi bakteri A. hydrophila dengan kepadatan 107 CFU ml-1
sebanyak 0,1 ml per ekor menggunakan syringe steril secara intramuscular (IM), kemudian diamati selama 9 hari. Kualitas air media pemeliharaan dipertahankan dengan penyiponan tiap tiga hari dan penggantian air sebanyak 65% dari volume total media pemeliharaan. Kualitas air dipertahankan stabil pada kondisi normal untuk budidaya ikan patin menurut SNI (2002), yakni oksigen terlarut >4 mg L-1,
4
Parameter Penelitian
Parameter yang diukur pada masa pemeliharaan meliputi kinerja pertumbuhan (laju pertumbuhan spesifik dan rasio konversi pakan), tingkat kelangsungan hidup, total bakteri serta total Bacillus sp. NP5 RfR di usus ikan uji.
Parameter respons imun yang diukur pada akhir perlakuan dan selama uji tantang meliputi hematokrit, hemoglobin, total eritrosit, total leukosit, aktivitas fagosit, ledakan respiratori, total A. hydrophila di organ target ikan uji dan kelangsungan hidup setelah uji tantang.
Kinerja Pertumbuhan
Parameter kinerja pertumbuhan yang diukur pada uji in vivo yakni tingkat kelangsungan hidup (SR), laju pertumbuhan spesifik (SGR) dan rasio konversi pakan (FCR). Perhitungan SR menggunakan persamaan menurut Effendie (2002) sebagai berikut:
SR (%) = Keterangan:
SR = Tingkat kelangsungan hidup (%)
Nt = Jumlah ikan yang hidup pada akhir penelitian (ekor) No = Jumlah ikan pada awal penelitian (ekor)
Perhitungan laju pertumbuhan spesifik pada masa pemeliharaan sebelum uji tantang menggunakan persamaan sebagai berikut:
SGR = Keterangan:
SGR = Laju pertumbuhan spesifik (%)
5
Total Bakteri dan Bacillus sp. NP5 RfR di Usus Ikan Uji
Perhitungan ini dilakukan dengan metode hitungan cawan. Usus ikan uji diambil sebanyak 0,1 g dan dihomogenisasi dengan 0,9 ml larutan PBS steril, kemudian dilakukan pengenceran serial dan disebar sebanyak 0,05 ml pada media TSA untuk total bakteri dan TSA + rif untuk total Bacillus sp. NP5 RfR.
Perhitungan total bakteri dan total Bacillus sp. NP5 RfR dilakukan pada akhir
pemeliharaan sebelum uji tantang.
Parameter Gambaran Darah
Pengamatan gambaran darah dilakukan pada hari ke-30 akhir perlakuan serta hari ke-34, 37 dan 41 uji tantang. Saat pengambilan darah, ikan terlebih dahulu dibius menggunakan stabilizer guna menghindari faktor stres, kemudian darah diambil menggunakan syringe steril yang telah dibilas dengan antikoagulan (Na sitrat 3,8%). Sampel darah digunakan untuk mengukur hematokrit (Hc), hemoglobin (Hb), total eritrosit (TE), total leukosit (TL), aktivitas fagositik (AF) dan ledakan respiratori (RB).
Kadar hematokrit diketahui melalui perbandingan panjang sel darah yang mengendap dengan panjang total volume darah pada tabung mikrohematokrit (Anderson dan Siwicki 1995). Kadar Hb diukur menggunakan Sahlinometer dengan metode Sahli Wedemeyer dan Yasutake (1977), yakni sampel darah dihisap menggunakan pipet Sahli hingga skala 20 mm3 atau 0,2 ml, kemudian
dimasukkan ke dalam tabung Hbmeter yang telah diisi HCL 0,1 N sampai skala 10 (merah), lalu dilakukan pengadukan dan diamkan selama 3-5 menit, kemudian ditambahkan akuades hingga terjadi perubahan warna seperti warna larutan standar pada Hbmeter. Skala dibaca dengan melihat permukaan cairan kemudian dicocokkan dengan skala jalur g% (kuning) yang menandakan banyaknya Hb per 100 ml darah.
TE diukur menggunakan metode Blaxhall dan Daisley (1973). Sampel darah diambil menggunakan pipet yang berisi bulir berwarna merah hingga skala 1, lalu ditambahkan larutan Hayem sampai skala 101, kemudian dilakukan pengadukan dengan membentuk angka delapan selama 3-5 menit hingga darah dan larutan Hayem tercampur rata. Tetesan pertama dan kedua dibuang dan tetesan berikutnya diteteskan pada Haemocytometer, kemudian ditutup dengan gelas penutup dan diamati dibawah mikroskop dengan perbesaran 400x. Perhitungan TE dilakukan pada lima kotak kecil dalam Haemocytometer dengan persamaan sebagai berikut:
TE =
6
penutup dan diamati dibawah mikroskop dengan perbesaran 400x. Perhitungan TL dilakukan pada empat kotak besar dalam Haemocytometer dengan persamaan sebagai berikut:
TL =
Aktivitas fagositik diawali dengan membuat preparat ulas darah dari
sampel darah yang dicampur dengan suspensi Staphylococcus aureus (107 CFU ml-1) dan diinkubasi selama 20 menit. Preparat ulas dikeringkan lalu
difiksasi dengan metanol selama 5 menit dan dikeringkan kembali, kemudian diwarnai melalui perendaman dalam larutan Giemsa selama 20 menit. Preparat ulas kemudian diamati menggunakan mikroskop dengan perbesaran 400x guna mengetahui aktivitas fagositik yang didasarkan pada persentase dari 100 sel fagosit yang menunjukkan proses fagositosis (Anderson dan Siwicki 1995).
Ledakan respiratori diukur dengan mengisi lubang mikroplate dengan darah sebanyak 0,05 ml lalu diinkubasi didalam inkubator suhu 37oC selama satu
jam. Setelah satu jam darah kemudian dibuang dan dibilas menggunakan phospate buffer saline (PBS) sebanyak 0,1 ml sebanyak tiga kali hingga darah dalam lubang mikroplate hilang. Larutan nitroblue tetrazolium (NBT) dimasukkan kedalam lubang mikroplate sebanyak 0,05 ml lalu diinkubasi kembali selama satu jam pada suhu 37oC. Satu jam setelah inkubasi larutan NBT dibuang dan dibilas
dengan methanol 100% sebanyak 0,05 ml selama 2-3 menit, kemudian ditambahkan kembali methanol 30% sebanyak 0,05 ml dan dilakukan sebanyak tiga kali, mikroplate kemudian dikeringanginkan selama ± 15 menit. Larutan KOH 0,06 ml dan DMSO 0,07 ml dimasukkan ke dalam lubang mikroplate dan dibaca di mikroplate reader untuk mendapatkan hasil.
Total A. hydrophila di Organ Target Ikan Uji
Perhitungan ini dilakukan dengan metode hitungan cawan dimana organ target hati dan ginjal masing-masing diambil sebanyak 0,1 g dan dihomogenisasi dengan 0,9 ml larutan PBS steril. Pengenceran serial dilakukan dan disebar sebanyak 0,05 ml pada media TSA yang telah ditambah chloramphenicol (25 mg ml-1). Perhitungan total A. hydrophila di organ target dilakukan pada hari
ke-34, 37 dan 41 uji tantang.
Analisis Data
7
3 HASIL DAN PEMBAHASAN
Kinerja Pertumbuhan
Berdasarkan hasil penelitian setelah 30 hari pemeliharaan, pada perlakuan kontrol, probiotik, prebiotik dan sinbiotik menunjukkan tingkat kelangsungan hidup 100±0,00%. Laju pertumbuhan spesifik pada perlakuan sinbiotik sebesar 2,51±0,16% lebih tinggi dan berbeda nyata (p<0,05; Tabel 1) (Lampiran 2) dengan semua perlakuan. Rasio konversi pakan pada perlakuan sinbiotik menunjukkan nilai terendah yaitu 1,34±0,13 yang berbeda nyata (p<0,05; Tabel 1) (Lampiran 2) dengan semua perlakuan. Jumlah total bakteri setelah 30 hari masa pemeliharaan dengan perlakuan sinbiotik menunjukkan lebih tinggi (p<0,05; Tabel 1) dibanding prebiotik, probiotik maupun kontrol, sedangkan pada perlakuan prebiotik dan probiotik menunjukkan hasil yang lebih tinggi (p<0,05; Tabel 1) dibandingkan kontrol. Total bakteri NP5 (TBNP5) pada perlakuan sinbiotik di usus ikan uji menunjukkan nilai yang lebih tinggi (p<0,05; Tabel 1) dibandingkan perlakuan probiotik, sedangkan pada kontrol maupun prebiotik tidak ditemukan bakteri Bacillus sp. NP5 RfR.
Tabel 1. Survival rate (SR), specific growth rate (SGR), feed conversion ratio (FCR), total bacterial count (TBC) dan total bacterial NP5 (TBNP5) di ikan patin setelah 30 hari pemberian probiotik, prebiotik dan sinbiotik.
Parameter
Keterangan: huruf superscript yang berbeda pada baris yang sama menunjukkan pengaruh perlakuan yang berbeda nyata (uji Duncan; p<0,05). Nilai yang tertera merupakan nilai rata-rata dan simpangan baku.
Berdasarkan hasil yang diperoleh, penggunaan probiotik, prebiotik dan sinbiotik secara in vivo terbukti mampu meningkatkan kinerja pertumbuhan pada ikan patin. Peningkatan tersebut ditunjukkan dengan adanya perbedaan yang signifikan antara probiotik, prebiotik dan sinbiotik dibandingkan dengan perlakuan kontrol. Hasil penelitian yang dilakukan Daniels et al. (2010) menunjukkan pakan yang diberi gabungan Bacillus spp. + MOS meningkatkan laju pertumbuhan spesifik, rasio konversi pakan dan tingkat kelangsungan hidup lobster. Suplementasi penggunaan secara tunggal baik Bacillus atau MOS juga meningkatkan secara signifikan pada parameter pertumbuhan, kelangsungan hidup dan kondisi pasca larva pada lobster.
8
tubuh ikan melalui dinding usus dan disebarkan ke seluruh tubuh melalui sistem peredaran darah untuk dimanfaatkan sebagai sumber energi untuk pertumbuhan. Putra et al. (2015) menyatakan pemberian bakteri probiotik amilolitik Bacillus sp. NP5 yang berasal dari saluran pencernaan ikan nila dapat meningkatkan aktivitas enzim pencernaan, meningkatkan kecernaan nutrien dan meningkatkan performa pertumbuhan ikan nila. Dimitroglou et al. (2009), menyatakan penggunaan MOS pada ikan mampu meningkatkan panjang dan densitas mikrovili usus pada rainbow trout (Onchorhynchus mykiss) dengan demikian luas permukaan penyerapan usus meningkat sehingga menambah kemampuan menyerap nutrien dan juga memodulasi jenis mikroba usus.
Kinerja pertumbuhan yang baik pada ikan patin diduga dipengaruhi oleh keberadaan mikroba di dalam usus seperti terlihat pada peningkatan jumlah total bakteri dan total bakteri NP5 RfR. Peningkatan yang optimal pada sinbiotik diduga disebabkan oleh pengaruh MOS yang dimanfaatkan dengan baik oleh mikroflora normal usus di ikan patin. Hasil penelitian Daniels et al. (2010) menyarankan kombinasi penggunaan Bacillus dan MOS sebagai biaya yang efektif dalam meningkatkan kelulushidupan dan memberikan keuntungan tambahan dalam meningkatkan performa pertumbuhan bila dibandingkan pemberian tunggal.
Respons Imun
Hasil yang diperoleh pada pemberian probiotik, prebiotik dan sinbiotik memberikan pengaruh terhadap parameter gambaran darah, terutama pascauji tantang (Gambar 1a, b, c) dan (Gambar 2a, b, c) dimana terjadi fluktuasi pada parameter hematokrit (Hc), hemoglobin (Hb), total eritrosit (TE), total leukosit (TL), aktivitas fagosit (AF) dan ledakan respiratori (RB). Perubahan yang terjadi pada gambaran darah menggambarkan status kesehatan ikan.
Pemberian mikrokapsul Bacillus sp. NP5 maupun MOS diketahui memberikan pengaruh terhadap Hc, Hb dan TE (Gambar 1a, b, c) setelah masa pemeliharaan. Perlakuan sinbiotik menunjukkan Hc tertinggi (33,83±0,71%) yang berbeda nyata (p<0,05) (Lampiran 3) dengan semua perlakuan. Perlakuan sinbiotik juga menunjukkan nilai Hb tertinggi (8,46±0,35 g%) diikuti perlakuan prebiotik dan probiotik (8,10±0,3 g%; 7,73±0,21 g%) yang berbeda nyata
(p<0,05) (Lampiran 3) dengan perlakuan K- dan K+ (6,40±0,10 g%; 6,63±0,12 g%). Hal yang sama juga terjadi pada TE, perlakuan
sinbiotik menunjukkan nilai TE tertinggi yakni (2,31±0,12 x106 sel mm-3) yang
berbeda nyata (p<0,05) (Lampiran 3) dengan perlakuan K-, K+ dan probiotik, tetapi tidak berbeda nyata (p>0,05) (Lampiran 3) dengan perlakuan prebiotik.
Rata-rata eritrosit pada berbagai perlakuan bervariasi tetapi masih berada dalam kisaran normal pada ikan. Menurut Kumar et al. (2013) jumlah sel darah merah merupakan yang terbesar dan jumlahnya bervariasi mempunyai kisaran 1,05-3,0 x106/mm3. Tingginya nilai eritrosit pada perlakuan sinbiotik disebabkan
9
Gambar 1. Kadar hematokrit (a); kadar hemoglobin (b); total eritrosit (c) ikan uji
baik pasca pemeliharaan maupun selama uji tantang dengan A. hydrophila. Huruf superscript yang berbeda ditiap bar pada hari
yang sama menunjukkan perbedaan secara statistik (Uji jarak berganda Duncan; p<0,05). Kontrol negatif (K-); kontrol positif (K+); mikrokapsul probiotik Bacillus sp. NP5 RfR dosis 1% (Pro); prebiotik
MOS dosis 0,2% (Pre); mikrokapsul probiotik Bacillus sp. NP5 RfR
dosis 1% + prebiotik MOS dosis 0,2% (Sin).
10
kembali meningkat pada hari ke-41. Nilai TE tertinggi terdapat pada perlakuan sinbiotik yang ditunjukkan secara berturut-turut yakni (1,80±0,09 x106 sel mm-3;
1,49±0,08 x106 sel mm-3; 1,61±0,03 x106 sel mm-3).
Penurunan yang terjadi pada parameter Hc, Hb dan TE pascauji tantang A. hydrophila ini menandakan bahwa keberadaan bakteri A. hydrophila yang menghasilkan eksotoksin maupun endotoksin menyebabkan sel darah merah menjadi lisis (Hardi et al. 2014). Pada penelitian Harikrishnan et al. (2010) sel darah merah secara signifikan menurun setelah uji tantang A. hydrophila. Penurunan konsentrasi TE, Hb dan Hc yang terinfeksi patogen menunjukkan
bahwa sel darah merah hancur menyebabkan terjadinya anemia. Hilman et al. (2005) mengatakan hemoglobin berperan dalam tingkat ketahanan
tubuh ikan karena berfungsi mengikat oksigen dalam darah, kadar hemoglobin ini yang bersinergi positif terhadap jumlah eritrosit.
Pengamatan TL, AF dan RB (Gambar 2a, b dan c) pada semua perlakuan selama pemeliharaan tidak memberikan pengaruh yang berbeda nyata (p>0,05) (Lampiran 4). Hal ini menandakan ikan uji tidak berada pada kondisi stres. Perbedaan TL baru terjadi ketika pascauji tantang dimana terdapat kenaikan TL pada semua perlakuan kecuali perlakuan K- dan mulai menurun kembali di hari ke-41. Puncak kenaikan dari pengamatan TL ini terjadi pada hari ke-37 dimana perlakuan sinbiotik memiliki nilai (1,41±0,19 x105 sel mm-3 ) yang berbeda nyata
(p<0,05) terhadap perlakuan K+ dan K-, namun tidak berbeda nyata (p>0,05) (Lampiran 4) pada perlakuan prebiotik (1,34±0,11) dan probiotik (1,30±0,07). Perbedaan nilai AF terjadi ketika pascauji tantang, dimana perlakuan sinbiotik sebesar (51,66±3,06; 55,33±3,21; 52,33±2,52%). Perbedaan RB pun baru terjadi ketika pascauji tantang dimana perlakuan sinbiotik menunjukkan RB tertinggi secara berturut-turut (0,263±0,03); (0,272±0,02); (0,244±0,01).
Peningkatan yang terjadi pada TL, AF dan RB menandakan adanya upaya dari ikan uji untuk mempertahankan diri dari adanya infeksi bakteri A. hydrophila. Hasil penelitian menunjukkan bahwa pemberian probiotik, prebiotik dan sinbiotik dapat membantu memulihkan keadaan gambaran darah akibat adanya infeksi. Leukosit menurut Uribe et al. (2011) adalah salah satu bagian dari sistem pertahanan tubuh yang bersifat non-spesifik. Leukosit yang diproduksi dengan tinggi akan terjadi bila terdapat infeksi pada tubuh ikan terkait kinerja sistem imun dalam melawan infeksi tersebut. Ketika diujitantang ada upaya dari ikan uji untuk mempertahankan diri dari adanya infeksi melalui proses fagositik.
Fagositosis adalah pertahanan pertama dari respons selular yang dilakukan oleh monosit (makrofag) dan granulosit (netrofil). Proses ini terjadi ketika benda asing masuk ke dalam tubuh ikan akan difagosit oleh makrofag. Makrofag ini akan menghancurkan antigen dengan cara memfagosit. Makrofag kemudian akan mengirim sinyal pada jaringan limfosit guna membentuk antibodi yang spesifik. Antibodi ini akan melemahkan patogen agar tidak menyebar dan toksisitas racun menjadi turun sehingga akan lebih mudah diserang sel fagosit. Suplementasi kombinasi antara Enterococcus faecalis dan MOS menunjukkan aktivitas fagosit tertinggi dibandingkan perlakuan kontrol (Rodriguez-Eztrada et al. 2013).
11
(Rawling et al. 2012). Rieger dan Barreda (2011) mengatakan ledakan respiratori akan meningkatkan konsumsi oksigen sehingga terjadi pembentukan anion superoksida dan proses ini dipercepat oleh NADPH-oksidase, multi komponen enzim yang terdapat di bagian dalam membran plasma setelah terjadi aktivasi fagositik.
(a)
(b)
(c)
Gambar 2. Total leukosit (a); aktivitas fagositik (b) dan ledakan respiratori (c) ikan uji baik pasca pemeliharaan maupun selama uji tantang dengan A. hydrophila. Huruf superscript yang berbeda ditiap bar pada hari yang sama menunjukkan perbedaan secara statistik (Uji jarak berganda Duncan; p<0,05). Kontrol negatif (K-); kontrol positif (K+); mikrokapsul probiotik Bacillus sp. NP5 RfR dosis 1% (Pro); prebiotik
MOS dosis 0,2% (Pre); mikrokapsul probiotik Bacillus sp. NP5 RfR
12
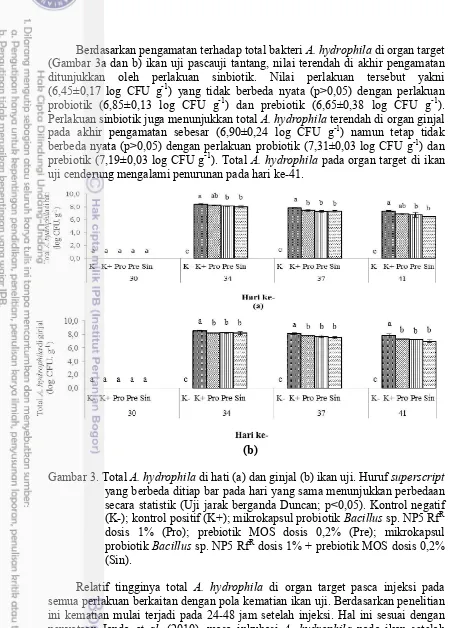
Berdasarkan pengamatan terhadap total bakteri A. hydrophila di organ target (Gambar 3a dan b) ikan uji pascauji tantang, nilai terendah di akhir pengamatan ditunjukkan oleh perlakuan sinbiotik. Nilai perlakuan tersebut yakni (6,45±0,17 log CFU g-1) yang tidak berbeda nyata (p>0,05) dengan perlakuan
probiotik (6,85±0,13 log CFU g-1) dan prebiotik (6,65±0,38 log CFU g-1).
Perlakuan sinbiotik juga menunjukkan total A. hydrophila terendah di organ ginjal pada akhir pengamatan sebesar (6,90±0,24 log CFU g-1) namun tetap tidak
berbeda nyata (p>0,05) dengan perlakuan probiotik (7,31±0,03 log CFU g-1) dan
prebiotik (7,19±0,03 log CFU g-1). Total A. hydrophila pada organ target di ikan
uji cenderung mengalami penurunan pada hari ke-41.
(b)
Gambar 3. Total A. hydrophila di hati (a) dan ginjal (b) ikan uji. Huruf superscript yang berbeda ditiap bar pada hari yang sama menunjukkan perbedaan secara statistik (Uji jarak berganda Duncan; p<0,05). Kontrol negatif (K-); kontrol positif (K+); mikrokapsul probiotik Bacillus sp. NP5 RfR
dosis 1% (Pro); prebiotik MOS dosis 0,2% (Pre); mikrokapsul probiotik Bacillus sp. NP5 RfR dosis 1% + prebiotik MOS dosis 0,2%
(Sin).
13
Perlakuan pemberian sinbiotik, probiotik dan prebiotik serta K+ pada total A. hydrophila di organ target mengalami penurunan pada hari ke-41 terkait dengan adanya aktivitas fagosit yang dilakukan sel darah putih. Peran ini dimainkan oleh monosit dan netrofil melalui nilai AF. Monosit dan netrofil adalah komponen sel darah yang selama fagositosis menghasilkan anion superoksida (O2-), hidrogen peroksida (H2O2), nitrit oksida (NO), peroksinitrit (ONOO-), asam
hipoklorid (HOCl) dan hidroksi radikal (OH-) yang mempunyai peran
microbiocidal yang sangat tinggi (Secombes 1996; Ellis 2001).
Gambar 4. Kelangsungan hidup ikan uji setelah uji tantang dengan A. hydrophila. Huruf superscript yang berbeda di tiap bar menunjukkan perbedaan secara statistik (uji jarak berganda Duncan; p<0,05). Kontrol negatif (K-); kontrol positif (K+); mikrokapsul probiotik Bacillus sp. NP5 RfR
dosis 1% (Pro); prebiotik MOS dosis 0,2% (Pre); mikrokapsul probiotik Bacillus sp. NP5 RfR dosis 1% + prebiotik MOS dosis 0,2%
(Sin).
Tingkat kelangsungan hidup ikan uji setelah uji tantang menunjukkan pada perlakuan sinbiotik lebih tinggi (p<0,05) dibandingkan kontrol positif dan probiotik, namun tidak berbeda (p>0,05) dengan prebiotik (Gambar 4).
Hasil yang diperoleh pada penggunaan probiotik, prebiotik dan sinbiotik secara in vivo mampu meningkatkan kelangsungan hidup ikan patin yang diinfeksi oleh A. hydrophila. Peningkatan tersebut ditunjukkan oleh adanya perbedaan nilai kelangsungan hidup antara probiotik, prebiotik dan sinbiotik dibandingkan kontrol positif. Berdasarkan hasil penelitian Widanarni dan Tanbiyaskur (2015) bahwa perlakuan probiotik Bacillus sp. NP5 dan prebiotik oligosakarida memiliki kelangsungan hidup yang lebih baik. Bakteri probiotik dalam usus mampu memanfaatkan prebiotik untuk merangsang pertumbuhan dalam usus ikan, prebiotik akan difermentasi oleh probiotik untuk menghasilkan asam lemak rantai pendek seperti asam laktat, asam asetat, asam propionat dan asam butirat (Merriefield et al. 2010). Jumlah produksi fermentasi yang dihasilkan dapat merusak keseimbangan pH seluler internal dari bakteri patogen, oleh karena itu, jumlah bakteri patogen akan menurun sedangkan bakteri menguntungkan dapat meningkatkan status kesehatan ikan (Tanbiyaskur et al. 2015).
14
Mikrokapsul probiotik Bacillus sp. NP5, prebiotik mannanoligosakarida dan gabungannya pada ikan patin secara signifikan dapat meningkatkan kinerja pertumbuhan, respons imun dan resistensi ikan patin yang diinfeksi A. hydrophila.
Saran
Berdasarkan kesimpulan tersebut, maka penambahan mikrokapsul probiotik 1% dan prebiotik MOS 0,2% melalui pakan dapat dijadikan sebagai acuan dalam kegiatan budidaya benih ikan patin guna meningkatkan kinerja pertumbuhan, respon imun dan resistensi dalam pencegahan MAS. Hal tersebut memberi peluang untuk penelitian lebih lanjut mengenai pemberian mikrokapsul probiotik dan prebiotik MOS dengan frekuensi pemberian yang berbeda sehingga mampu menggambarkan tingkat efisiensi waktu pemberian dan biaya yang dikeluarkan.
DAFTAR PUSTAKA
Anderson DP, Siwicki AK. 1995. Basic hematology and serology for fish health programs. Proceeding of the second symposium on disease in Asian Aquaculture, October 25-29. 1993, Phuket, Thailand, pp: 17-.
Andrews SR, Sahu NP, Pal AK, Kumar S. 2009. Haematological modulation and growth of Labeo rohita fingerlings: effect of dietary mannan oligosaccharide, yeast extract, protein hydrolysate and chlorella. Journal Aquaculture Research. 41: 61-69.
Blaxhall PC, Daisley KW. 1973. Routine haematological methods for use with fish blood. Journal of Fish Biology. 5: 771-781.
Boyd CE. 1990. Water Quality in Ponds for Aquaculture. 2nd Edn., Alabama Agricultural Experiment Station, Auburn University, Auburn, AL., USA, Pages: 482.
Cerezuela R, Meseguer J, Esteban MA. 2011. Current knowledge in synbiotic use for fish aquaculture: A review. Journal of Aquaculture Research Development.
15
Dimitroglou A, Merrifield DL, Moate R, Davies SJ, Spring P, Sweetman J, Bradley G. 2009. Dietary mannan oligosaccharide supplemetation modulates intestinal microbial ecology and improves guts morphology of rainbow trout, (Oncorhynchus mykiss) Wallbaum. Journal of Animal Science.87: 3226-3234.
Effendie MI. 2002. Biologi perikanan. Yogyakarta (ID): Yayasan Pustaka Nusantara. 163pp.
Ellis AE. 2001. Innate host defense mechanisms of fish against viruses and bacteria. Development & Comparative Immunology. 25:827-839.
Faisal M, Popp W, Refai M. 1989. Aeromonas hydrophila-related septicemia in the Nile tilapia (Oreochromis niloticus). Berl Munch Tierarztl Wochenschr. 102: 87-93.
Hardi EH, Catur AP, Triesna H, Rizki TH. 2014. Infeksi Aeromonas hydrophila
melalui jalur berbeda pada ikan nila (Oreochromis niloticus) di Loa Kulu Kutai Kartanegara Kalimantan Timur. Jurnal Kedokteran Hewan. 8: 130-133.
Harikrishnan R, Balasundaram C, Heo MS. 2010. Herbal supplementation diets on hematology and innate immune immunity in goldfish against Aeromonas hydrophila. Fish & Shellfish Immunology. 28: 354-361.
Hedayati A, Tarkhani R. 2014. Hematological and gill histopathological changes iridescent shark, (Pangasius hypophthalmus) (Sauvage, 1878) exposed to sublethal diazinon and deltamethrin concentrations. Fish Physiology Biochemistry. 40: 715-720.
Hilman RS, Rinder H, Ault KA. 2005. Hematology in Clinical Practice: A guide to Diagnosis and Management. 4th Edn., McGraw-Hill Profesional, New
York.
Janda JM, Abbott SL. 2010. The genus Aeromonas: Taxonomy, pathogenicity and infection. Clinical Microbiology Reviews. 23: 35-73.
Kailasapathy K. 2009. Encapsulation technologies for functional foods and nutraceutical product development. CAB Reviews: Perspectives in Agriculture, Veterinary Science, Nutrition & Natural Resources. 4: 1-19. Kumar S, Rahman RP, Pandey PK, Mohanty S, Kumar A, Kumar K. 2013. Effect
of orally administered azadirachtin on non-specific immune parameters of goldfish Carassius auratus (Linn. 1758) and resistence against Aeromonas hydrophila. Fish & shellfish immunology. 34:564-673.
Lin S, Mao S, Guan Y, Luo L, Pan Y. 2012. Effects of dietary chitosan oligosaccharides and Bacillus coagulans on the growth, innate immunity and resistance of koi (Cyprinus carpio koi). Aquaculture. 342-343:36-41. Merrifield DL, Dimitroglou A, Foey A, Davies SJ, Baker RTM, Bogwald J,
Castex M, Ringo E. 2010. The current status and future focus of probiotic and prebiotic applications for salmonids. Aquaculture. 302: 1-18.
Nayak SK. 2010. Probiotics and immunity: A fish perspective. Fish & Sellfish Immunology.29: 2-14.
16
Putra AN, Utomo NBP, Widanarni. 2015. Growth performance of tilapia (Oreochromis niloticus) fed with probiotic, prebiotic and synbiotic in diet. Pakistan Journal of Nutrition. 14: 263-268.
Putra AN, Widanarni. 2015. Screening of amylolytic bacteria as candidates of probiotics in tilapia (Oreochromis sp.). Research Journal of Microbiology. 10: 1-13.
Rawling MD, Merrifield DL, Snellgrove DL, Kuhlwein H, Adams A, Davies SJ, 2012. Haemato-immunological and growth response of mirror carp (Cyprinus carpio) fed a tropical earthworm meal in experimental diets. Fish & Shellfish Immunology. 32: 1002-1007.
Rieger AM, Barreda DR. 2011. Antimicrobial mechanisms of fish leukocytes. Developmental & Comparative Immunology. 35: 1238-1245.
Rodriguez-Eztrada U, Satoh S, Haga Y, Fushimi H, Sweetman J. 2013. Effects of inactivated Enterococcus faecalis and mannanoligosaccharide and their combination on growth, immunity and disease protection in rainbow trout. North American Journal of Aquaculture. 75: 416-428.
Sang HM, Fotedar R, Filer K. 2010. Effects of dietary mannanoligosakarida on the survival, growth, immunity and digestive enzyme activity of freshwater
crayfish, (Cherax destructor). Journal of Aquaculture Nutrition. 17: 629-635.
Secombes CJ. 1996. The non-specific immune system: cellular defenses. Dalam: Iwama G, Nakanishi T, editor. The Fish Immune System: Organism, Pathogens and Environment. San Diego (US): Academic Press.
SNI/Standar Nasional Indonesia. 2002. Ikan patin siam (Pangasius hypopthalmus) bagian 5: Produksi kelas pembesaran di kolam. Badan Standarisasi Nasional/BSN. 6483.5.2002.
Talpur AD, Munir MB, Mary A, Hashim R. 2014. Dietary probiotics and prebiotics improved food acceptability, growth performance, haematology and immunological parameters and disease resistance against Aeromonas hydrophila in snakehead (Channa striata) fingerlings. Aquaculture. 426-427: 14-20.
Tanbiyaskur, Widanarni, Angela ML. 2015. Administration of Bacillus NP5 and oligosaccharide to enhance the immune response in tilapia (Oreochromis niloticus) towards Streptococcosis. International Journal of Sciences: Basic & Applied Research (IJSBAR). 20: 304-315.
Uribe C, Folch H, Enriquez R, Moran G. 2011. Innate and adaptive immunity in teleost fish: A review. Veteterina Medecine. 56: 486-503.
Utami DAS, Widanarni, Suprayudi MA. 2015. Quality of dried Bacillus NP5 and its effect on growth performance of tilapia (Oreochromis niloticus). Pakistan Journal of Biological Sciences. 18: 88-93.
Wedemeyer GA, Yasutake WT. 1977. Clinical methods for the assesment of the effect environmental stress on fish health. Technical paper of the U.S. fish and wildlife service. Vol.89. U.S. Department of the Interior, Fish and Wildlife Service, Washington DC.
17
Widanarni, Tanbiyaskur. 2015. Application of probiotic, prebiotic and synbiotic for the control of Streptococcosis in tilapia (Oreochromis niloticus). Pakistan Journal of Biological Sciences. 18: 59-66.
Zhang J, Liu Y, Tian L, Yang H, Liang G, Xu, D. 2012. Effects of dietary mannan oligosakarida on growth performance, gut morphology and stress tolerance
of juvenile Pacific white shrimp (Litopenaeus vannamei). Fish & Shellfish Immunology. 33: 1027-1032.
Zhang X, Yang W, Wu H, Gong X, Li A. 2014a. Multilocus sequence typing revealed a clonal lineage of Aeromonas hydrophila caused motile Aeromonas septicaemia outbreaks in pond cultured cyprinid fish in an epidemic area in Central China. Aquaculture. 432: 1-6.
Zhang Q, Hairui Y, Tong T, Tong W, Dong L, Xu M, Wang Z. 2014b. Dietary supplementation of Bacillus subtilis and fructooligosaccharide enhance the growth, non-specific immunity of juvenile ovate pompano (Trachinotus
18
19
Lampiran 1. Hasil pengujian morfologi, fisiologi dan biokimia bakteri Bacillus sp. NP5 dan A. hydrophila.
Parameter Hasil Uji
Gram
Bentuk sel Batang panjang Positif Oksidatif/fermentatif Fermentatif
Bacillus sp. NP5 Katalase Positif
Motilitas Motil
Oksidase Positif
Parameter Hasil Uji
Gram Negatif
Bentuk sel Batang pendek
A. hydrophila Oksidatif/fermentatif Fermentatif
Katalase Positif
Motilitas Motil
20
Lampiran 2. Analisis statistik terhadap laju pertumbuhan spesifik (A) dan rasio konversi pakan (B) ikan patin pada akhir perlakuan probiotik,
Means for groups in homogeneous subsets are displayed.
ANOVA
21
Lampiran 3. Hasil uji Duncan terhadap hematokrit, hemoglobin dan total eritrosit akhir pemberian pakan perlakuan dan setelah uji tantang dengan A. hydrophila.
Parameter
Uji Hari ke- K- K+ Perlakuan Pro Pre Sin
30 25.6±0.62d 26,1±0,50d 29,8±0,62c 31,7±0,55b 33,8±0,71a
Hematokrit 34 28,2±0,45a 21,8±0,57d 24,3±0,46c 25,0±0,25bc 25,9±0,76b
(%) 37 28,6±1,01a 18,7±1,73b 20,9±2,18b 21,0±0,62b 21,3±0,90b
41 29,1±0,71a 19,5±1,11d 21,0±0,55c 22,3±0,15bc 22,7±0,90b
Parameter
Uji Hari ke- K- K+ Perlakuan Pro Pre Sin 30 6,4±0,10c 6,6±0,12c 7,7±0,21b 8,1±0,30ab 8,4±0,35a
Hemoglobin 34 6,9±0,35a 5,7±0,70b 6,7±0,42a 7,0±0,10a 7,4±0,35a
(gr%) 37 7,0±0,25a 4,3±0,14d 5,2±0,15c 5,8±0,31b 6,1±0,10b
41 7,8±0,46a 4,8±0,25d 5,9±0,15c 6,3±0,21bc 6,8±0,30b
Parameter
Uji Hari ke- K- K+ Perlakuan Pro Pre Sin 30 1,9±0,06c 1,8±0,08c 2,0±0,09b 2,1±0,03ab 2,3±0.12a
Total Eritrosit 34 2,0±0,20a 1,4±0,05c 1,6±0,07bc 1,7±0,14b 1,8±0.09b
(x 106 sel mm-3)
37 2,1±0,04a 1,1±0,06c 1,3±0,06b 1,4±0,13b 1,4±0.08b
22
Lampiran 4. Hasil uji Duncan terhadap total leukosit, aktivitas fagosit dan ledakan respiratori akhir pemberian pakan perlakuan dan setelah uji tantang dengan A. hydrophila.
Parameter
Uji Hari ke- K- K+ Perlakuan Pro Pre Sin 30 0,84±0,08a 0,87±0,07a 0,87±0,21a 0,91±0,07a 0,88±0,05a
Total Leukosit 34 0,86±0,04d 1,00±0,09c 1,21±0,03b 1,29±0,02ab 1,34±0,07a
(x 105 sel mm-3)
37 0,77±0,06c 1,07±0,06b 1,30±0,07a 1,34±0,11a 1,41±0,19a
41 0,93±0,10c 0,88±0,08c 1,07±0,05b 1,12±0,07ab 1,23±0,03a
Parameter
Uji Hari ke- K- K+ Perlakuan Pro Pre Sin 30 30,3±2,08a 30,6±1,53a 30,6±3,21a 31,6±2,52a 34,3±2,08a
Akt. Fagositik 34 34,3±3,06c 40,3±1,53b 43,6±3,06b 44,6±4,51b 51,6±3,06a
(%) 37 35,6±3,51c 43,3±4,04b 49,6±3,51a 52,0±2,65a 55,3±3,21a
41 38,6±4,04c 40,3±1,53c 46,0±2,65b 48,6±2,08ab 52,3±2,52a
Parameter
Uji Hari ke- K- K+ Perlakuan Pro Pre Sin 30 0,18±0,01a 0,18±0,03a 0,20±0,01a 0,20±0,001a 0,21±0,001a
Led.Repiratori 34 0,19±0,005c 0,18±0,01c 0,21±0,005bc 0,23±0,02ab 0,26±0,03a
(O.D 630) 37 0,17±0,03c 0,18±0,005c 0,22±0,01b 0,25±0,02ab 0,27±0,02a
23
RIWAYAT HIDUP
Penulis dilahirkan di Palembang pada tanggal 3 Juni 1990 dari Ibu Rohana dan Ayah Anwar Sulaiman. Penulis merupakan anak ketiga dari 3 bersaudara. Pendidikan formal yang pernah dilalui penulis adalah SDN 02 Setu (lulus tahun 2002), SMPN 259 Taman Mini (lulus tahun 2005) dan SMAN 64 Jakarta (lulus tahun 2008). Penulis menempuh pendidikan sarjana pada Program Studi Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Universitas Diponegoro melalui jalur Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN) tahun 2008 dan lulus tahun 2012. Pada tahun 2013 penulis melanjutkan studinya dengan menempuh Program Magister pada Program Studi Ilmu Akuakultur, Sekolah Pascasarjana, Institut Pertanian Bogor.
Program Magister ditempuh melalui Beasiswa Fresh Graduate yang diberikan oleh Direktorat Jendral Pendidikan Tinggi (DIKTI), Kementerian Pendidikan dan Kebudayaan (KEMENDIKBUD). Selama menjadi mahasiswa Sekolah Pascasarjana Institut Pertanian Bogor, penulis pernah menjadi asisten praktikum Mikrobiologi Akuakultur (S2).