OPTIMASI PRODUKSI BIOHIDROGEN OLEH
Rhodobium
marinum
TERAMOBIL MENGGUNAKAN
RESPONSE
SURFACE METHODOLOGY
(RSM)
VICARIA AMANDA FERLINKO
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa skripsi saya yang berjudul “Optimasi Produksi Biohidrogen oleh Rhodobium marinum Teramobil Menggunakan Response Surface Methodology (RSM)” benar karya saya dengan arahan dari
komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Maret 2016
Vicaria Amanda Ferlinko
ABSTRAK
VICARIA AMANDA FERLINKO. Optimasi Produksi Biohidrogen oleh
Rhodobium marinum Teramobil Menggunakan Response Surface Methodology
(RSM). Dibimbing oleh SYAMSUL FALAH dan DWI SUSILANINGSIH.
Hidrogen merupakan salah satu bahan bakar alternatif potensial yang ramah lingkungan karena hasil samping pembakaran hanya berupa air. Produksi biohidrogen memanfaatkan organisme bakteri melalui proses fermentasi atau fotoproduksi untuk merombak substrat menjadi energi hidrogen. Penelitian ini bertujuan untuk menentukan titik optimum produksi biohidrogen oleh Rhodobium marinum teramobil pada media produksi yang diberi perlakuan berupa %
konsentrasi glukosa (X1), kerapatan sel (X2), dan % konsentrasi agar (X3)
menggunakan response surface methodology (RSM). Terdapat 2 respon yang
dianalisis, yaitu kadar produksi gas hidrogen dan kadar glukosa total terkonversi. Penelitian ini menggunakan rancangan central composite design (CCD). Hasil
analisis statistik menunjukkan kerapatan sel (X2) dan interaksi antara konsentrasi
glukosa dengan konsentrasi agar (X1X3) memberikan pengaruh terhadap produksi
hidrogen. Kombinasi 1.0 % glukosa, kerapatan sel 1.5, dan konsentrasi agar 1.2 % menghasilkan gas hidrogen paling banyak, yaitu 638.185 mL H2/L. Hasil prediksi
dari kombinasi level tersebut menghasilkan kadar gas hidrogen sebesar 593.45 mL H2/L.
Kata kunci: Biohidrogen, Rhodobium marinum, response surface methodology, central composite design (CCD), sel amobil.
ABSTRACT
VICARIA AMANDA FERLINKO. Optimization of Biohydrogen Production by Immobilized Rhodobium marinum Using Response Surface Methodology.
Supervised by SYAMSUL FALAH and DWI SUSILANINGSIH.
Hydrogen is the one of potential alternative fuel, clean energy source because it is oxidized to water as a combustion byproduct. Biohydrogen production is obtained by fermentation or photoproduction processes that convert substrate to hydrogen energy using bacterial agent. The aim of this research was to determine optimum condition of hydrogen production by immobilized Rhodobium marinum using
response surface methodology (RSM), with parameters of optimization were % glucose concentration (X1), cell density (X2), and % agar gels concentration (X3) .
There were 2 responses that were analyzed by this method, amount of hydrogen production and total convertion of glucose. A central composite design was employed in planning the experiments. Statistic analysis showed that cells density (X2) and interaction between glucose and agar gels concentration (X1X3) have
effects to hydrogen production. Combination of 1.0 % glucose, 1.5 cells density, and 1.2 % agar gels produced highest hydrogen of 638.185 mL H2/L. Yield
prediction of hydrogen calculated by RSM method was produced 593.45 mL H2/L.
Keyword: Biohydrogen, Rhodobium marinum, response surface methodology,
OPTIMASI PRODUKSI BIOHIDROGEN OLEH
Rhodobium
marinum
TERMOBIL MENGGUNAKAN
RESPONSE
SURFACE METHODOLOGY
(RSM)
VICARIA AMANDA FERLINKO
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
PRAKATA
Alhamdulillaahirabbil‟aalamiin, segala puji bagi Allah SWT atas segala karunia dan rahmat-Nya sehingga penulis bisa menyelesaikan skripsi ini yang berjudul “Optimasi Produksi Biohidrogen oleh Rhodobium marinum Teramobil
Menggunakan Response Surface Methodology (RSM)”. Penelitian ini merupakan
bagian dari proyek penelitian Pusat Penelitian Bioteknologi Lembaga Ilmu Pengetahuan Indonesia (Puslit Bioteknologi LIPI), Laboratorium Bioenergi dan Bioproses (LBB).
Penulis menyampaikan terima kasih kepada Bapak Dr Syamsul Falah SHut MSi dan Ibu Dr Dwi Susilaningsih, MPharm selaku pembimbing atas bimbingan, bantuan materiil, arahan berikut kritik dan sarannya dalam kegiatan penelitian ini. Terima kasih juga penulis sampaikan kepada Bapak Khairul Anam, MSi Apt yang telah mempercayakan proyek penelitian ini sehingga penulis mendapat banyak pengalaman yang luar biasa dalam produksi biohidrogen, kepada Puslit Bioteknologi LIPI yang telah mendanai penelitian ini, kepada Mba Peza Batamarlia Reko SSi dan Mba Dian Noverita Widyaningrum, MSi yang telah memberikan pelatihan, saran, serta perhatiannya selama melakukan penelitian ini. Ucapan terima kasih kepada kedua orang tua dan keluarga tersayang atas dukungan dan kasih sayang yang selalu diberikan, juga tidak lupa terimakasih kepada para sahabat saya sesama penelitian di LBB, Rani Nur Fitriani dan Yustika Nur Azizah, serta teman-teman Biokimia 48 yang selalu memberikan inspirasi dan motivasi. Di samping itu, penghargaan penulis sampaikan kepada para peneliti, staf, serta sesama mahasiswa penelitian di Laboratorium Bioenergi dan Bioproses, Pusat Penelitian Biologi LIPI Cibinong. Akhir kata penulis berharap tulisan ini dapat berguna bagi penulis maupun semua pihak demi kemajuan ilmu pengetahuan.
Bogor, Maret 2016
DAFTAR ISI
DAFTAR ISI vii
DAFTAR TABEL viii
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN viii
PENDAHULUAN 1
METODE 2
Waktu dan Tempat Penelitian 2
Alat dan Bahan 2
Prosedur Penelitian 2
HASIL 5
Pertumbuhan Bakteri Rhodobium marinum 5
Produksi Hidrogen oleh Rhodobium marinum melalui Rancangan
Acak Lengkap (RAL) 6
Rancangan RSM menggunakan model permukaan respon
Central Composite Design (CCD) 7
Model Permukaan Respon Kadar Produksi Gas Hidrogen (H2) 8
Model Permukaan Respon Glukosa Total Terkonversi 10
PEMBAHASAN 12
Pertumbuhan Bakteri Rhodobium marinum 12
Produksi Hidrogen oleh Rhodobium marinum melalui Rancangan
Acak Lengkap (RAL) 12
Rancangan RSM menggunakan model permukaan respon
Central Composite Design (CCD) 14
Model Permukaan Respon Kadar Produksi Gas Hidrogen (H2) 15
Analisis Model Permukaan Respon Glukosa Total Terkonversi 16
SIMPULAN DAN SARAN 17
Simpulan 17
Saran 17
DAFTAR PUSTAKA 17
DAFTAR TABEL
1 Variabel dan level terhadap media produksi hidrogen R.marinum untuk
rancangan acak lengkap (RAL) 6 2 Variabel dan level yang diberikan terhadap media produksi hidrogen R.
marinum untuk rancangan CCD pada RSM 7
3 Rancangan percobaan CCD produksi biohidrogen oleh R. marinum pada
berbagai perlakuan media produksi 8 4 Analisis regresi ANOVA kadar produksi gas hidrogen (H2) 9
5 Analisis regresi ANOVA kadar glukosa total terkonversi 11
DAFTAR GAMBAR
1 Kultur R. marinum 5
2 Kurva pertumbuhan R. marinum 6
3 Kadar produksi H2 oleh R. marinum teramobil untuk setiap 7
perlakuan sampel pada rancangan acak lengkap (RAL) 7 4 Kontur permukaan respon kadar gas hidrogen (H2) dengan variasi 9
konsentrasi glukosa (X1) dan konsentrasi agar (X3) 9
5 Kontur kadar gas hidrogen (H2) dengan variasi konsentrasi gukosa (X1) 10
6 Kontur permukaan respon kadar glukosa total terkonversi dengan 11 variasi kerapatan sel (X2) dan konsentrasi agar (X3) 11
7 Kontur respon glukosa total terkonversi dengan variasi kerapatan sel (X2)
dan konsentrasi agar (X3) 11
8 Fotofermentasi bakteri fotosintetik 13
DAFTAR LAMPIRAN
1 Alur Penelitian 19
2 Hasil pengukuran absorbansi kultivasi R. marinum 19
3 Rancangan acak lengkap (RAL) produksi hidrogen oleh R. marinum 20
4 Absorbansi pengukuran standar glukosa pada panjang gelombang 490 nm 20 5 Kurva standar pengukuran kadar glukosa pada panjang gelombang 490 nm 21 6 Hasil produksi hidrogen dan kadar glukosa total terkonversi dari
rancangan acak lengkap (RAL) oleh R. marinum 21
7 Data hasil eksperimen produksi gas hidrogen (H2) rancangan RSM 21
9 Data hasil eksperimen glukosa total terkonversi rancangan RSM 22 10 Grafik permukaan respon dan kontur kadar gas hidrogen (H2) dengan
variasi konsentrasi glukosa (X1) dan kerapatan sel (X2) 23
11 Grafik permukaan respon dan kontur kadar gas hidrogen (H2) dengan
12 Grafik permukaan respon dan kontur kadar glukosa total terkonversi
dengan variasi konsentrasi glukosa (X1) dan kerapatan sel (X2) 24
PENDAHULUAN
Keamanan energi Indonesia saat ini menghadapi rintangan dan tantangan yang sangat besar. Mempertahankan kebutuhan pasokan energi nasional dalam jangka panjang merupakan tugas berat di tengah pasokan minyak bumi yang semakin terbatas. Penggunaan energi di segala sektor meningkatkan kebutuhan energi. Pada tahun 2009, sektor transportasi membutuhkan 226 juta setara barel minyak (SBM) yang sebelumnya pada tahun 2000 hanya membutuhkan 139 juta SBM. Penggunaan energi di sektor ini meningkat rata-rata 5.6 % per tahun (Sugiyono 2012). Jika dikonversi dalam barel per hari, konsumsi minyak Indonesia naik secara signifikan dari hanya 621 ribu barel per hari pada tahun 1990 menjadi 1.132 juta barel per hari di tahun 2003 (Triatmojo 2013). Ketersediaan energi fosil semakin terbatas ditengah kebutuhannya yang semakin meningkat. Selain itu, pencemaran lingkungan akibat penggunaan energi fosil tidak bisa dihindari.
Suatu periode transisi dari dominasi energi fosil khususnya bahan bakar minyak ke sumber-sumber energi alternatif harus dilalui agar dapat mengurangi penggunaan energi fosil yang pasokannya semakin terbatas serta mengurangi dampak negatif pencemaran terhadap lingkungan. Energi alternatif yang dapat diperbaharui (renewable energy) dan aman bagi lingkungan sangat dibutuhkan
untuk mengurangi penggunaan bahan bakar tersebut. Biohidrogen merupakan salah satu pilihan yang tepat untuk dijadikan energi alternatif. Biohidrogen adalah hidrogen yang diproduksi melalui proses biologis atau dari biomassa. Biohidrogen diproduksi dengan memanfaatkan organisme bakteri melalui proses fermentasi atau fotoproduksi untuk merombak substrat organik (limbah atau non limbah) menjadi energi hidrogen (Sirait 2007).
Rhodopseudomonas marina atau yang lebih dikenal dengan nama Rhodobium marinum (R. marinum) merupakan salah satu bakteri fotosintetik yang
mampu mengubah senyawa organik menjadi gas hidrogen dengan adanya energi cahaya (Habibi 2009). Penelitian sebelumnya oleh Habibi (2009) telah melakukan produksi biohidrogen melalui fermentasi R. marinum ini, akan tetapi belum ada
penelitian produksi biohidrogen melalui fermentasi R. marinum yang teramobil
dengan konsentrasi agar, glukosa, dan kerapatan sel yang berbeda. Amobilisasi sel ini dilakukan dengan maksud untuk meningkatkan stabilitas dan membuat sel, organel atau enzim dapat digunakan secara terus-menerus (Betha 2009).
Optimasi produksi biohidrogen menggunakan bakteri R. marinum dalam
penelitian ini terdiri atas 3 variabel berupa konsentrasi glukosa, kerapatan sel, serta konsentrasi agar. R. marinum dijebak dalam sel amobil selama proses
fermentasi. Amobilisasi dalam bidang bioteknologi didefinisikan sebagai suatu cara yang digunakan untuk menempatkan secara fisika atau kimia suatu sel, organel, enzim atau protein lainnya ke dalam suatu penyangga berupa bahan padat, matrik, atau membran. Efek dari variasi 3 variabel tersebut dipelajari secara sistematis menggunakan metode permukaan respon (Response Surface Methodology) dengan Central Composite Design (CCD). Ide dasar metode ini
2
antara serangkaian faktor eksperimental independen, metode yang menghemat waktu, serta membutuhkan sedikit jumlah percobaan (Ghosh et al. 2012).
Tujuan dari penelitian ini adalah menentukan titik optimum produksi biohidrogen oleh R. marinum teramobil pada media produksi yang diberi
perlakuan berupa konsentrasi glukosa, konsentrasi agar, dan kerapatan sel. Analisis response surface methodology (RSM) dapat menghasilkan nilai optimum
dari 3 variabel berupa konsentrasi glukosa, kerapatan sel, dan konsentrasi agar sehingga menghasilkan respon produksi hidrogen optimal. Produksi hidrogen ditandai dengan semakin tinggi konsumsi glukosa terpakai, semakin tinggi pula gas hidrogen yang dihasilkan.
METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan di Pusat Penelitian Bioteknologi Lembaga Ilmu Pengetahuan Indonesia (Puslit Bioteknologi LIPI), Laboratorium Bioenergi dan Bioproses (LBB), Jalan Raya Bogor Km 46 Cibinong. Penelitian ini berlangsung mulai bulan Maret hingga November 2015.
Alat dan Bahan
Alat-alat yang digunakan adalah botol Schott 1 L, botol serum 120 mL, sudip, neraca analitik, gelas ukur, gelas piala, botol falcon, pipet mikro, tip, pipet
pasteur, tissue, aluminium foil, plastik tahan panas, autoklaf, spektrofotometer
UV-Vis (UV-1700 PharmaSpec Shimadzu), batang magnetic stirrer, vortex, pH
meter (Jenway 3505), Sentrifuge (Hitachi), shaker (Certomat), lampu TL (tubular lamp, Philips), syringe, laminar cabinet, water bath (Thermolyne Type 16500
Dri-Bath), dan kromatografi gas (HP Hewlett Packard 5890 Series 2).
Bahan-bahan yang digunakan adalah K2HPO4 (Merck), KH2PO4 (Merck),
EDTA.2Na (Merck), H3BO3 (Merck), Na2MoO4.2H2O (Merck), ZnSO4.7H2O
(Merck), MnCl2 (Merck), CuCl2.2H2O (Merck), FeSO4.7H2O (Merck),
CaCl2.2H2O (Merck), MgSO4.7H2O (Merck), tiamin-HCl (Himedia), biotin
(Himedia), nicotin (Merck), p-aminobenzoat (Merck), disodium suksinat (Merck), amonium sulfat (Merck), yeast extract (Himedia), monosodium glutamat (MSG)
(Merck), NaOH (Merck), HCl (Merck), fenol (Merck), H2SO4 (Merck), glukosa
(Himedia), kultur R. marinum, dan agar powder bacteriological (Himedia).
Prosedur Penelitian
Pembuatan Media Pertumbuhan Bakteri R. marinum (Anam 2012)
3
0.75 mg CaCl2.2H2O, 200 mg MgSO4. 7H2O, 0.025 mg thiamin-HCl, 0.025 mg
biotin, 0.025 mg nikotinat, dan 0.025 mg asam p-aminobenzoat ke dalam 1 L aquades. Bahan-bahan berupa tiamin-HCl, biotin, nikotinat, dan asam p-Aminobenzoat dicampurkan setelah media tumbuh disteril karena akan merusak bahan jika terkena suhu tinggi. Media tumbuh tersebut diaduk hingga homogen dan disesuaikan pH-nya hingga 6.8-7. Setelah itu, media disteril menggunakan autoklaf dengan suhu 121 oC selama 15 menit.
Kultivasi Bakteri R. marinum (Anam 2012)
Stok kultur Rhodobium marinum dimasukkan ke dalam media tumbuh
kira-kira sepersepuluh bagian (v/v) agar OD awal media berkisar 0.1-0.2 dan dikultivasi menggunakan shaker dengan kecepatan 120 rpm disertai lampu TL
(tubular lamp, Philips). Kemudian, diukur optical density (OD) setiap harinya
selama ± 2 minggu pada panjang gelombang 680 nm menggunakan spektrofotometer UV-Vis sehingga didapatkan kurva pertumbuhan R. marinum.
Kultur yang digunakan untuk fermentasi produksi hidrogen adalah yang berada pada puncak fase log (eksponensial). Setelah didapatkan kurva pertumbuhan R. marinum, bakteri kembali dikultivasi dan siap dipanen saat puncak fase
eksponensial yang nantinya digunakan untuk produksi biohidrogen.
Pembuatan Media Produksi Hidrogen (Anam 2012; Kawaguchi 2001)
Eksperimen produksi hidrogen ini diawali dengan rancangan RAL. Sebanyak 28 botol serum 120 mL disiapkan yang akan digunakan sebagai wadah media produksi (MP) rancangan RAL. Dua puluh tujuh sampel merupakan kombinasi sampel rancangan RAL dan 1 sampel sebagai kontrol tanpa sel amobil dengan komposisi 1 % glukosa dan kerapatan sel 0.2. Media produksi dibuat 50 mL dalam botol serum 120 mL. Percobaan menggunakan rancangan acak lengkap (RAL) ini untuk menentukan level yang tepat untuk digunakan dalam percobaan rancangan RSM sehingga diharapkan akan menghasilkan model yang signifikan dan titik optimum yang tepat sehingga menghasilkan produksi hidrogen optimal. Percobaan RAL ini dilakukan sebanyak 2 kali ulangan. Setelah eksperimen RAL, dilanjutkan dengan rancangan RSM sebanyak 20 sampel. Percobaan RSM menggunakan model permukaan respon Central Composite Design (CCD).
Rancangan percobaannya didesain menggunakan software Design Expert.
Pembuatan media produksi rancangan RAL dan RSM sama saja, hanya berbeda di masing-masing level perlakuan. Berikut ini adalah pembuatan media produksi rancangan RAL.
Variabel konsentrasi glukosa. Level dari variabel konsentrasi glukosa (X1)
adalah 0.5 %, 1 %, dan 1.5 %. Masing-masing konsentrasi glukosa dibuat stok 1 L, ditambah dengan 1 g monosodium glutamat, dan 10 mL media basal (stok 100 kali) dicampurkan dalam Schott 1000 mL. Kemudian, dihomogenisasi menggunakan stirer. Media produksi dinetralisasi (pH 7) dengan menambahkan
4
Variabel kerapatan sel. Level dari variabel kerapatan sel (X2) adalah 0.2,
0.6, dan 1.0. Kultur R. marinum yang telah diremajakan dipanen pada puncak fase
eksponensial dan diukur optical density (OD) terlebih dahulu sehingga dapat
ditentukan jumlah bakteri yang diperlukan agar OD awal MP (OD0) menjadi 0.2,
0.6, dan 1.0. Kemudian, bakteri tersebut disentrifus dengan kecepatan 6000 rpm selama 15-20 menit dalam falcon 50 mL. Pelet R. marinum dicampur dengan 1
mL basal medium agar bakteri tetap mendapatkan asupan nutrisi. Campuran tersebut dihomogenkan dengan vortex. Jaga agar tetap homogen sebelum sel amobil dicampurkan dengannya.
Variabel konsentrasi agar (sel amobil). Level dari variabel konsentrasi
agar (gel) (X3) adalah 1 %, 1.5 %, dan 2 %. Masing-masing level konsentrasi agar
dibuat dengan volume 80 mL sebagai stok. Sebanyak 1 gram agar untuk konsentrasi 1 %, 1.5 gram agar untuk konsentrasi 1.5 %, dan 2 gram agar untuk konsentrasi 2 % dilarutkan masing-masing dalam 80 mL media basal. Larutan agar dihomogenkan menggunakan stirer, dan disterilisasi selama 15 menit dengan suhu 121 °C. Kemudian agar ditunggu sampai suhunya kira-kira 30-35 °C, tanpa membiarkannya memadat sebelum sel R. marinum yang telah disentrifus
sebelumnya dicampurkan. Setelah itu, 4 mL agar dicampurkan ke dalam pelet R. marinum. Kemudian, sel amobil tersebut ditunggu hingga padat. Agar yang padat
dicacah dan dimasukkan ke dalam MP yang telah disiapkan sebelumnya.
Fermentasi (Anam 2012)
Sebanyak 5 mL masing-masing MP yang telah berisi sel amobil R. marinum
diambil untuk diuji kadar glukosa total awal. Setelah itu, MP ditutup menggunakan penutup karet dan diklep dengan penutup aluminium agar gas yang nantinya dihasilkan selama fermentasi diharapkan tidak keluar. Masing-masing MP tersebut dishaker dengan kecepatan 120 rpm disertai perlakuan pencahayaan
dari lampu TL (Philips) pada suhu kamar. Dua hari kemudian, sampel dianalisis
berupa kadar produksi gas hidrogen dan kadar glukosa total akhir. Untuk pembuatan media produksi kontrol sama saja, akan tetapi tidak menggunakan sel amobil.
Analisis Kadar Glukosa (Gula Total) (Dubois et al. 1956)
Pengukuran ini dilakukan dengan metode asam fenol sulfat. Sampel disentrifugasi pada 6000 rpm selama 5 menit. Supernatan kemudian diencerkan 100 kali. Kemudian diambil 0.5 mL dari larutan hasil pengenceran tersebut ke dalam tabung reaksi kecil, setelah itu ditambahkan fenol 5 % sebanyak 0.5 mL dan 2.5 mL larutan H2SO4 lalu dikocok dengan vortex. Setelah itu didiamkan 10
menit dan diletakkan di dalam water bath dengan suhu 40 °C selama 20 menit.
Kadar glukosa (gula total) dalam sampel dianalisis dengan cara diukur absorbansinya menggunakan spektrofotometer UV-Vis dengan panjang gelombang 490 nm. Sebelumnya dibuat standar glukosa dengan konsentrasi 10, 20, 40, 60, 80, dan 100 ppm untuk mendapatkan persamaan matematis dan regresi linier agar nilai absorbansi sampel gula dapat diubah menjadi ppm.
Analisis Gas Hidrogen (Susilaningsih et al. 2008)
Gas yang terbentuk diambil menggunakan syringe khusus (terdapat
5
sampel gas hasil produksi dilakukan menggunakan kromatografi gas dengan metode detektor TCD (thermal conductivity detector). Kolom yang digunakan
adalah kolom poropak (packed column), dengan temperatur injektor, detektor, dan
kolom masing-masing adalah 150, 250, dan 80 °C. Gas pembawa yang digunakan adalah gas nitrogen ultra high purity (UHP) dengan kecepatan 8 mL/menit.
Sebanyak 1 ml sampel gas diinjeksikan ke dalam kolom kemudian hasilnya dapat dilihat pada layar monitor setelah tiga menit. Hidrogen murni digunakan sebagai standar perhitungan kadar hidrogen. Perhitungan kadar gas hidrogen hasil fermentasi dapat dilakukan dengan menggunakan rumus :
Kadar H2 (mL/L) = [Luas area standar hidrogen Luas area sampel × Volume gas produk ] × 1000
Volume MP
HASIL
Pertumbuhan Bakteri Rhodobium marinum
Rhodobium marinum merupakan salah satu bakteri fotosintetik yang mampu
menghasilkan biohidrogen. Bakteri ini ditumbuhkan dalam media cair aSy (ammonium sulfate, succinate, yeast extract) dengan pencahayaan yang cukup (±
2000 lux). Kultivasi R. marinum dalam media aSy dilakukan selama ± 14 hari.
Setiap hari optical density (OD) diukur hingga bakteri memasuki fase stasioner
(hari ke-14). Kultur R. marinum yang tumbuh dengan baik berwarna merah
(Gambar 1).
Gambar 1 Kultur R. marinum.
Kurva pertumbuhan R. marinum (Gambar 2) menunjukkan hari ke-10
merupakan puncak fase eksponensial. Fase eksponensial adalah fase membelahnya bakteri dengan laju yang konstan, massa menjadi dua kali lipat dan pertumbuhan seimbang yang ditandaidengan bertambahnya populasi secara teratur. Dengan demikian, hari ke-10 merupakan umur bakteri R. marinum yang
6
Gambar 2 Kurva pertumbuhan R. marinum.
Produksi Hidrogen oleh Rhodobium marinum melalui Rancangan Acak Lengkap (RAL)
Variabel berupa konsentrasi glukosa, konsentrasi agar, serta kerapatan sel R. marinum. Level-level dari 3 variabel diharapkan dapat mempengaruhi produksi
hidrogen sehingga dihasilkan hidrogen dengan jumlah maksimal. Model rancangan acak lengkap dengan 27 kombinasi dan 1 kontrol ditunjukkan pada Lampiran 3. Percobaan rancangan acak lengkap (RAL) ini dilakukan 2 kali ulangan. Berikut variabel dan level yang diberikan terhadap media produksi R. marinum untuk RAL yang disajikan pada Tabel 1.
Fermentasi R. marinum dalam media produksi yang diberi 3 perlakuan
(variabel) dengan rancangan acak lengkap dibandingkan dengan kontrol yang tidak menggunakan sel amobil (agar). Media produksi kontrol terdiri atas 1.0 % glukosa dengan kerapatan sel R. marinum 0.2. Hasil produksi gas hidrogen yang
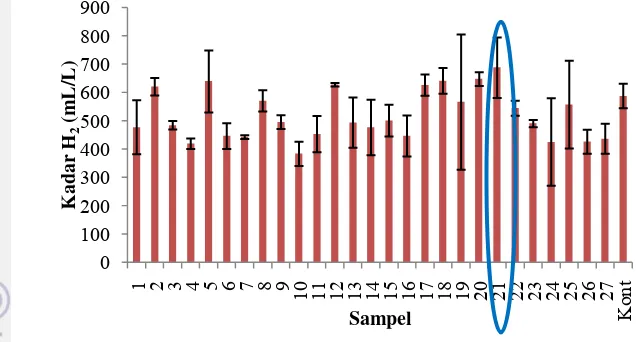
dilakukan menggunakan rancangan RAL (Gambar 3) berguna untuk mendapatkan kombinasi level perlakuan yang menghasilkan gas hidrogen tertinggi yang nantinya akan dilanjutkan dengan optimasi menggunakan rancangan RSM. Grafik kadar produksi H2 (Gambar 3) menunjukkan sampel 21 menghasilkan gas
hidrogen paling banyak. Kadar produksi gas hidrogen (H2) sampel 21 yaitu
687.710 mL/L (Lampiran 6). Kadar glukosa total yang terkonversi adalah 3971.429 ppm. Sampel 21 merupakan media produksi dengan perlakuan berupa 1.5 % glukosa, 1.0 % agar, dan kerapatan sel 1.0. Dengan demikian kombinasi level dan perlakuan yang diambil untuk optimasi menggunakan metode RSM adalah kombinasi 1.5 % glukosa, 1.0 % agar, dan kerapatan sel 1.0. Kombinasi ini akan menjadi nilai tengah (0) dari rancangan percobaan CCD pada RSM.
Tabel 1 Variabel dan level yang diberikan terhadap media produksi hidrogen R. marinum untuk rancangan acak lengkap (RAL)
Konsentrasi glukosa (%) Konsentrasi agar (%) Kerapatan sel
7
Gambar 3 Kadar produksi H2 oleh R. marinum teramobil untuk setiap
perlakuan sampel pada rancangan acak lengkap (RAL).
Rancangan RSM menggunakan model permukaan respon Central Composite
Design (CCD)
Kombinasi perlakuan (variabel) dan level yang tertinggi dalam menghasilkan gas hidrogen pada rancangan RAL sebelumnya akan menjadi nilai tengah atau titik pusat (0) dalam rancangan CCD. Central Composite Design
(CCD) adalah sebuah rancangan percobaan yang terdiri dari rancangan 2k faktorial
dengan ditambahkan beberapa center runs dan axial runs. Rancangan ini membutuhkan batas bawah (-1) dan batas atas (+1). Untuk memperoleh orde yang bagus dalam menghasilkan nilai respon, maka model harus memiliki perbedaan yang stabil antar batas bawah (-), titik pusat (0), dan batas atas (+1).
Hasil analisis produksi hidrogen pada rancangan RAL sebelumnya menunjukkan kombinasi 1.5 % glukosa, kerapatan sel 1.0, dan 1.0 % agar menghasilkan gas hidrogen paling tinggi. Kombinasi ini digunakan sebagai level-level pada titik pusat (0) untuk rancangan RSM. Melalui kombinasi tersebut juga ditentukan batas atas (+1) dan batas bawah (-1) untuk masing-masing perlakuan. Berikut variabel dan level yang diberikan untuk rancangan CCD pada RSM dan rancangan percobaan CCD produksi biohidrogen oleh R. marinum disajikan pada
Tabel 2 dan Tabel 3.
Respon yang dianalisis adalah kadar gas hidrogen (H2) dan glukosa total
yang terkonversi. Respon kadar gas H2 dinyatakan dalam mL/L media produksi
dan glukosa total terkonversi dinyatakan dalam ppm. Data yang telah didapatkan kemudian diolah menggunakan software Design Expert. Hasil yang diperoleh
akan diterjemahkan ke dalam model persamaan fungsi respon terhadap variabel bebas. Data yang diolah nantinya juga akan menghasilkan berpengaruh atau tidaknya variabel bebas yang dipilih terhadap respon dan hubungan antar respon.
Tabel 2 Variabel dan level yang diberikan terhadap media produksi hidrogen
R. marinum untuk rancangan CCD pada RSM
8
Tabel 3 Rancangan percobaan CCD produksi biohidrogen oleh R. marinum pada
berbagai perlakuan media produksi
Model Permukaan Respon Kadar Produksi Gas Hidrogen (H2)
Pengolahan data model permukaan respon menggunakan software Design Expert menghasilkan persamaan model, yaitu :
Y1 = 445.93 - 28.96 X1 + 46.14 X2 + 2.77 X3 - 22.18 X1X2 - 50.79 X1X3 - 3.33 X2X3 hidrogen (H2) disajikan pada Tabel 4. Hasil tersebut menunjukkan bahwa nilai p
yang diperoleh untuk parameter kerapatan sel (X2) dan kombinasi konsentrasi
glukosa dengan konsentrasi agar (X1X3) lebih kecil dari 0.05. Hal ini berarti
bahwa parameter kerapatan sel (X2) serta kombinasi antara konsentrasi glukosa
dengan konsentrasi agar (X1X3) memberikan pengaruh terhadap respon kadar gas
hidrogen (Y1) pada persamaan model permukaan respon di atas. Parameter
konsentrasi glukosa (X1), konsentrasi agar (X3), kombinasi antara konsentrasi
glukosa dengan kerapatan sel (X1X2), serta kombinasi kerapatan sel dengan
konsentrasi agar (X2X3) menunjukkan nilai p yang lebih besar dari 0.05. Hal ini
berarti bahwa mereka tidak memberikan pengaruh terhadap respon pada persamaan respon.
Nilai p pada lack of fit lebih besar dari 0.05 yaitu 0.7416. Hal ini
9
Sementara itu, nilai R2 (koefisien determinasi) menjelaskan bahwa 59.33 % data yang dihasilkan dari penelitian merupakan pengaruh faktor-faktor perlakuan, sedangkan sisanya berasal dari faktor-faktor di luar perlakuan yang diamati. Nilai R2 pada model ini terbilang kecil karena hampir setengahnya dipengaruhi oleh
faktor-faktor di luar perlakuan yang diamati. Akan tetapi, model ini masih dapat digunakan (sesuai) karena tidak adanya lack of fit. Selain itu, nilai F pada model
sebesar 3.16 menunjukkan bahwa model signifikan (sesuai). Nilai p pada model sebesar 0.0388, menunjukkan bahwa hanya 3.88 % kemungkinan nilai F model akan menyebabkan gangguan. Grafik permukaan respon dan kontur dari data kadar gas hidrogen (H2) dapat dilihat pada Gambar 4 dan 5.
Grafik permukaan respon kadar gas H2 (Gambar 4) memperlihatkan
bentuk pelana (saddle point), tidak berbentuk maksimum atau pun minimum. Hal
ini menunjukkan kombinasi konsentrasi glukosa dan konsentrasi agar (X1X3)
menghasilkan respon yang tidak teridentifikasi optimum pada satu titik, tetapi menyebar di wilayah saddle point. Tujuan penelitian ini adalah untuk
mendapatkan level dari variabel bebas yang dapat mengoptimalkan respon kadar gas hidrogen yang dihasilkan. Namun tidak terpenuhi karena titik stasioner yang didapat memiliki karakteristik titik pelana. Jika dilihat dari grafik kontur (Gambar 5), dapat disimpulkan nilai respon maksimum dihasilkan dari 1.0 % glukosa dan 1.2 % agar yang menghasilkan gas hidrogen sebesar 638.185 mL/L. Hasil analisis RSM memprediksi bahwa kombinasi 1.0 % glukosa, 1.2 % agar, serta kerapatan sel 1.5 menghasilkan gas hidrogen paling banyak, yaitu 593.45 mL/L.
Tabel 4 Regresi ANOVA kadar produksi gas hidrogen (H2)
Parameter Hasil analisis regresi (ANOVA)
Lack of fit 0.62 0.7416 Tidak signifikan
R2 59.33 %
Gambar 4 Kontur permukaan respon kadar gas hidrogen (H2) dengan variasi
10
Gambar 5 Kontur kadar gas hidrogen (H2) dengan variasi konsentrasi gukosa (X1)
dan konsentrasi agar (X3).
Model Permukaan Respon Glukosa Total Terkonversi
Persamaan model permukaan respon yang dihasilkan dari pengolahan data terhadap respon kadar glukosa yang terkonversi sebagai berikut.
Y2 = 2599.35+910.00 X1+834.29 X2-125.71 X3+948.05X12+569.48 X22+598.05X32 +
100.00 X1X2 -67.86 X1X3+882.14 X2X3
Keteragan :
Y2 = kadar glukosa total terkonversi (ppm)
Hasil analisis statistik untuk model permukaan respon kadar glukosa total terkonversi disajikan pada Tabel 5. Hasil tersebut menunjukkan bahwa nilai p yang diperoleh untuk parameter konsentrasi glukosa (X1), kerapatan sel (X2),
serta kombinasi antara kerapatan sel dan konsentrasi agar (X2X3) lebih kecil dari
0.05 (p < 0.05). Hal ini berarti bahwa hanya parameter konsentrasi glukosa (X1),
kerapatan sel (X2), serta kombinasi antar kerapatan sel dengan konsentrasi agar
(X2X3) memberikan pengaruh terhadap respon glukosa total terkonversi (Y2) pada
persamaan model permukaan respon di atas. Parameter lainnyamenunjukkan nilai p yang lebih besar dari 0.05, yang berarti bahwa mereka tidak memberikan pengaruh terhadap respon pada persamaan respon tersebut.
Nilai p pada lack of fit lebih besar dari 0.05 yaitu 0.2002. Hal ini
menunjukkan tidak adanya lack of fit sehingga model ini dapat digunakan.
Sementara itu, nilai R2 (koefisien determinasi) menjelaskan bahwa 86.52 % data
yang dihasilkan dari penelitian merupakan pengaruh faktor-faktor perlakuan, sedangkan sisanya berasal dari faktor-faktor di luar perlakuan yang diamati. Nilai R2 pada model ini cukup baik, karena hanya 13.48 % dipengaruhi oleh
11
Tabel 5 Regresi ANOVA kadar glukosa total terkonversi
Parameter Hasil analisis regresi (ANOVA)
Koefisien Nilai F Nilai p (Prob>F)
Model 7.13 0.0025 Signifikan
Konstanta 2599.35
X1 (Kons. glukosa) 910.00 13.87 0.0040
X2 (Kerapatan sel) 834.29 11.65 0.0066
X3 (Kons. agar) -125.71 0.26 0.6181
X12 948.05 4.14 0.0693
X22 569.48 1.49 0.2497
X32 598.05 1.65 0.2283
X1*X2 100.00 0.13 0.7220
X1*X3 -67.86 0.062 0.8089
X2*X3 882.14 10.42 0.0090
Lack of fit 2.23 0.2002 Tidak signifikan
R2 86.52 %
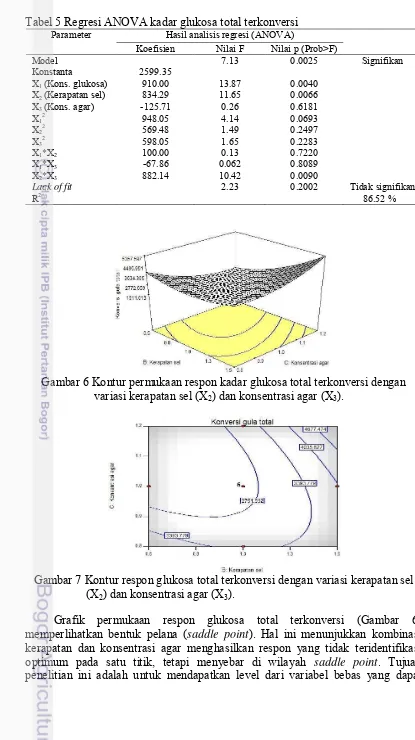
Gambar 6 Kontur permukaan respon kadar glukosa total terkonversi dengan variasi kerapatan sel (X2) dan konsentrasi agar (X3).
Gambar 7 Kontur respon glukosa total terkonversi dengan variasi kerapatan sel (X2) dan konsentrasi agar (X3).
Grafik permukaan respon glukosa total terkonversi (Gambar 6) memperlihatkan bentuk pelana (saddle point). Hal ini menunjukkan kombinasi
kerapatan dan konsentrasi agar menghasilkan respon yang tidak teridentifikasi optimum pada satu titik, tetapi menyebar di wilayah saddle point. Tujuan
12
mengoptimalkan respon glukosa total terkonversi. Namun tidak terpenuhi karena titik stasioner yang didapat memiliki karakteristik titik pelana. Jika dilihat dari grafik kontur (Gambar 7), dapat disimpulkan nilai respon maksimum dihasilkan dari kerapatan sel 1.5 dan 1.2 % agar. Hasil analisis RSM memprediksi bahwa kombinasi kerapatan sel 1.5, 1.2 % agar, dan 2.0 % glukosa menunjukkan kadar glukosa total terkonversi paling banyak, yaitu 7247.79 ppm.
PEMBAHASAN
Pertumbuhan Bakteri Rhodobium marinum
Kultivasi bakteri Rhodobium marinum dilakukan di dalam media cair aSy
(ammonium sulfate, succinate, yeast extract). Media pertumbuhan dinetralisasi
hingga pHnya menjadi 7. Menurut Habibi et al. (2010), R. marinum dapat hidup
secara optimal pada pH 7. R. marinum dapat tumbuh dengan baik pada suhu
maksimum berkisar 30 oC hingga 35 oC (Anam 2012). Selain itu, beberapa
vitamin berupa thiamin-HCl, biotin, nikotinat, dan asam p-aminobenzoat ditambahkan ke dalam media basal yang digunakan dalam media pertumbuhan aSy. Vitamin ini ditambahkan setelah media disteril karena akan rusak jika terkena suhu tinggi. Vitamin berguna untuk mempertahankan nutrisi yang penting bagi sel (Guo et al. 2009).
Hasil pengamatan pada kurva pertumbuhan bakteri R. marinum
menunjukkan puncak fase log (eksponensial) terjadi pada hari ke-10. Hal ini berarti bakteri siap dipanen pada umur 10 hari. Fase eksponensial merupakan fase membelahnya sel dengan laju yang cepat, massa menjadi dua kali lipat, dan pertumbuhan seimbang yang ditandai dengan bertambahnya populasi secara teratur (Sumarsih 2007). Puncak fase ini akan menghasilkan jumlah sel bakteri paling banyak. Oleh karena itu dipilih puncak fase log untuk memanen bakteri.
Produksi Hidrogen oleh Rhodobium marinum melalui Rancangan Acak Lengkap (RAL)
Bakteri fotosintetik membutuhkan senyawa organik untuk memproduksi hidrogen dan energi cahaya untuk membantu reaksi energi yang terlibat dalam produksi hidrogen. Glukosa merupakan salah satu sumber asam organik yang bisa digunakan bakteri fotosintetik untuk memproduksi gas hidrogen. Menurut Sirait (2007), senyawa organik yang dapat digunakan oleh bakteri ini sebagai substrat untuk produksi hidrogen adalah asam lemak, gula, tepung, selulosa, dan lainnya. Selain konsentrasi substrat, rasio inokulum, dan penggunaan sel amobil mempengaruhi produksi hidrogen. Penelitian oleh Sun et al. (2010) yang
mengoptimasi produksi biohidrogen menggunakan bakteri fotosintetik
Rhodobacter sphaeroides dan Clostridium acidisoli menunjukkan konsentrasi
substrat, pH, dan rasio inokulum memberikan pengaruh terhadap produksi hidrogen. Menurut Basak et al. (2014), penggunaan sel amobil berupa agar,
agarose, serta gel sodium alginat dengan jumlah sel optimum awal sebanyak 10 mg/mL gel menghasilkan produksi H2 yang lebih tinggi (60-88 %). Selain itu,
13
Bakteri R. marinum merupakan salah satu bakteri fotosintetik ungu non
sulfur (PNS). Bakteri PNS tidak menghasilkan oksigen pada proses fotosintesisnya, tetapi menghasilkan hidrogen sebagai produk samping dengan bantuan cahaya. Produksi hidrogen pada bakteri fotosintetik ini dikatalisis dengan adanya aktivitas enzim nitrogenase dan hidrogenase. Meskipun enzim hidrogenase juga aktif untuk memproduksi hidrogen, akan tetapi enzim ini juga berperan merombak kembali hidrogen yang telah diproduksi (Koku et al. 2002).
Enzim nitrogenase bertanggung jawab untuk produksi hidrogen. Nitrogenase dikenal sebagai katalis utama produksi hidrogen oleh bakteri fotosintetik (Barbosa
et al. 2001). Reaksi produksi hidrogen dari senyawa organik berupa glukosa oleh
bakteri fotosintetik adalah sebagai berikut (Habibi 2009):
Glukosa + 2H2O 6CO2 +12H2 G = -33.8 kJ
Proses produksi hidrogen pada bakteri fotosintetik hanya melibatkan satu fotosistem (PS1). Fotosistem terjadi dalam membran intraseluler. Fotosistem pada bakteri ini tidak cukup kuat untuk memecah air. Pada kondisi anaerob, bakteri fotosintetik dapat dengan baik menggunakan asam organik sederhana seperti asam asetat sebagai donor elektron (Sirait 2007). Elektron yang dilepaskan dari senyawa organik akan dipompakan oleh sejumlah besar pembawa elektron (kuinon dan plastosianin). Selama transpor elektron, proton dipompakan melewati membran (dalam kompleks protein sitokrom bc1) sehingga terjadi gradien proton. Gradien proton yang terjadi digunakan oleh enzin ATP sintase untuk menghasilkan ATP. Energi ATP yang terbentuk dapat digunakan untuk transpor lebih jauh elektron ke elektron akseptor feredoksin (Fd). Enzim nitrogenase akan mereduksi proton H+ menjadi gas hidrogen dengan bantuan energi dalam bentuk
ATP dan elektron yang diperoleh dari feredoksin yang teroksidasi (Akkerman et al. 2002) (Gambar 8).
Gambar 8 Fotofermentasi bakteri fotosintetik (Akkerman et al. 2002).
Keterangan : PS = fotosistem C = plastosianin,
14
Hasil eksperimen rancangan RAL menunjukkan produksi gas hidrogen pada kontrol yang tidak menggunakan sel amobil lebih besar dibanding menggunakan sel amobil dengan konsentrasi glukosa dan kerapatan sel yang sama. Hal ini disebabkan karena faktor-faktor yang mempengaruhi produksi biohidrogen tidak hanya pada media, tetapi juga dari lingkungan. Akan tetapi, jika dilihat dari keefisienan waktu dan energi, penggunaan sel amobil sudah menguntungkan karena ketika sel amobil R. marinum digunakan kembali untuk produksi hidrogen
selanjutnya, pemisahan sel amobil dengan media produksi tidak membutuhkan waktu yang lama karena mereka telah terpisah secara langsung sehingga tidak perlu disentrifugasi. Selanjutnya, diperlukan level yang tepat antara konsentrasi agar, konsentrasi glukosa, dan kerapatan sel sehingga produksi hidrogen menjadi optimal dengan penggunaan sel amobil tersebut.
Media produksi hidrogen terdiri atas substrat glukosa sebagai sumber C dan monosodium glutamat (MSG) sebagai sumber N bagi sel R. marinum. Kosentrasi
MSG yang diberikan terhadap media produksi hanya 0.1 %. Konsentrasi MSG sebagai sumber N juga berpengaruh terhadap produksi gas H2. Hal ini karena
enzim nitrogenase yang berperan penting dalam produksi gas H2 merupakan
kompleks enzim yang bertanggung jawab pada proses fiksasi nitrogen. Ketika molekul nitrogen tersedia, enzim nitrogenase bertanggung jawab untuk mengubah nitrogen menjadi amonia. Pada kondisi anaerob dan tidak adanya nitrogen, enzim nitrogenase cenderung mengkatalisis reaksi pembentukan hidrogen dengan persamaan reaksi seperti berikut (Koku et al. 2002).
2H+ + 2e- + 4ATP → H
2 + 4ADP + 4Pi
Selain itu, dalam proses pembentukan gas hidrogen, kerja enzim nitrogenase juga dapat dihambat dengan kadar amonia dan amonium berlebih serta rasio perbandingan nitrogen dan karbon (N/C) yang tinggi (Kapdan & Kargi 2006). Oleh karena itu, MSG yang diberikan untuk media produksi H2 hanya dengan
konsentrasi kecil. Produksi gas H2 melalui proses fotofermentasi bergantung pada
beberapa parameter penting, seperti aktivitas enzim nitrogenase dan hidrogenase secara simultan, rasio sumber karbon dan nitrogen (C/N) di dalam media produksi H2, peningkatan konsentrasi mikronutrien dalam media kultur, umur bakteri,
sumber dan intensitas cahaya yang diberikan, pH, suhu, dan sebagainya (Basak et al. 2014). Faktor-faktor tersebut saling berikatan satu sama lain. Oleh karena itu,
dibutuhkan optimasi produksi hidrogen berbagai faktor tersebut agar menghasilkan gas H2 optimal.
Rancangan RSM menggunakan model permukaan respon Central Composite
Design (CCD)
Metode permukaan respon (response surface methodology) merupakan
15
interaksi antar variabel yang divariasikan, membuat optimasi menggunakan RSM menjadi lebih baik dan cepat (Wibowo 2014). Desain eksperimen RSM yang digunakan adalah central composite design (CCD). Desain CCD tiga faktor terdiri
atas 20 rancangan percobaan, yaitu 8 rancangan faktorial 2 level, 6 rancangan titik aksial, dan 6 rancangan titik pusat (center points). Menurut Irmayanti (2012),
suatu desain harus memuat setidaknya dua atau tiga titik pusat agar terbuat beberapa replikasi untuk mengestimasi eksperimen eror pada model.
Hasil pengamatan RAL menunjukkan konsentrasi glukosa 1.5 %, konsentrasi agar 1.0 %, dan kerapatan sel 1.0 adalah level yang terpilih sebagai titik pusat untuk rancangan RSM karena menghasilkan gas hidrogen paling tinggi, yaitu 687.710 mL/L. Nilai batas bawah dan atas ditentukan berdasarkan nilai titik pusat yang didapatkan. Variansi nilai tersebut haruslah memiliki perbedaan yang stabil dan konsisten sehingga diperoleh model rancangan yang bagus dalam menghasilkan respon (Irmayanti 2012).
Model Permukaan Respon Kadar Produksi Gas Hidrogen (H2)
Analisis model permukaan respon ini dilakukan untuk melihat pengaruh parameter dengan berbagai level yang telah dipilih terhadap respon. Substrat, jumlah sel, serta pemberian sistem amobil merupakan faktor-faktor yang memberikan pengaruh terhadap produksi hidrogen. Hal ini telah dibuktikan oleh penelitian sebelumnya. Akan tetapi, penelitian optimasi produksi biohidrogen menggunakan bakteri R. marinum masih sangat minim. Menurut Basak et al.
(2014), bakteri fotosintetik PNS (purple non sulfur) dapat mengkonversi energi
cahaya menjadi gas H2 menggunakan senyawa organik sebagai substrat, dengan
kultur yang berkelanjutan atau sistem sel amobil. Selama proses tersebut, hasil gas H2 mungkin bisa ditingkatkan dengan mempertahankan aktivitas maksimal
nitrogenase dan meminimalkan aktivitas hidrogenase, perbandingan yang baik antara sumber C dan N, serta adanya distribusi cahaya yang seragam.
Hasil analisis statistik model permukaan respon terhadap kadar produksi gas hidrogen menunjukkan kerapatan sel (X2) dan interaksi antara konsentrasi glukosa
dengan konsentrasi agar (X1X3) memberikan pengaruh terhadap respon kadar gas
hidrogen. Hal ini dilihat dari nilai p dari masing-masing parameter yang lebih kecil 0.05. Nilai p yang lebih besar 0.05 menunjukkan bahwa parameter tidak berpengaruh terhadap respon. Nilai lack of fit sebesar 0.7416 menunjukkan bahwa
model ini dapat digunakan. Lack of fit artinya penyimpangan atau ketidaktepatan. Lack of fit berguna untuk mendeteksi model sudah tepat atau belum. Tidak adanya lack of fit jika nilainya lebih besar dari α (0.05), sehingga model dapat dinyatakan
sudah tepat. Selain itu, hasil analisa model dengan nilai Pvalue < 5% (0.05) juga
menunjukkan signifikan yang berarti model dapat digunakan untuk proses optimasi produksi gas hidrogen. Nilai p pada model sebesar 0.0388, menunjukkan bahwa hanya 3.88 % kemungkinan nilai F model akan menyebabkan gangguan.
Grafik permukaan respon kadar gas hidrogen memperlihatkan bentuk pelana (saddle point). Hal ini menunjukkan kombinasi kerapatan sel (X2) dan konsentrasi
agar (X3) menghasilkan respon yang tidak teridentifikasi optimum pada satu titik,
tetapi menyebar di wilayah saddle point. Penentuan titik optimum dari variabel
16
yang paling maksimum (Wibowo 2014). Titik optimum dilakukan dengan menganalisa bentuk kurva permukaan dan kontur respon terhadap faktor. Kurva yang berbentuk saddle point ini menyulitkan dalam menentukan titik optimum.
Kurva titik optimum yang berupa saddle point ini diduga karena penentuan batas
atas dan batas bawah dari faktor yang diujikan kurang tepat. Akan tetapi, titik ini dapat dilihat melalui kontur. Titik optimum berada di dalam daerah yang rentang produksi gas hidrogennya diprediksi maksimum.
Model Permukaan Respon Glukosa Total Terkonversi
Analisis gula total menggunakan metode asam fenol sulfat. Metode ini disebut juga dengan metode TS (total sugar) yang digunakan untuk mengukur
total gula. Metode ini dapat mengukur dua molekul gula pereduksi. Gula sederhana, oligosakarida, dan turunannya dapat dideteksi dengan fenol dalam asam sulfat pekat yang akan menghasilkan warna jingga kekuningan yang stabil.
Hasil analisis statistik model permukaan respon terhadap kadar glukosa total terkonversi menunjukkan parameter konsentrasi glukosa (X1), kerapatan sel (X2),
serta interaksi antar kerapatan sel dengan konsentrasi agar (X2X3) memberikan
pengaruh terhadap respon glukosa total terkonversi. Hal ini dilihat dari nilai p masing-masing parameter yang lebih kecil 0.05. Nilai lack of fit sebesar 0.2002
menunjukkan bahwa model ini dapat digunakan karena nilainya lebih besar dari α (0.05). Selain itu, hasil analisa model dengan nilai Pvalue < 5% (0.05) juga
menunjukkan signifikan yang berarti model dapat digunakan. Nilai p pada model sebesar 0.0025, menunjukkan bahwa hanya 0.25 % kemungkinan nilai F model akan menyebabkan gangguan.
Grafik permukaan respon kadar gula total terkonversi memperlihatkan bentuk pelana (saddle point). Hal ini menunjukkan interaksi antar kerapatan sel
dengan konsentrasi agar (X2X3) menghasilkan respon yang tidak teridentifikasi
optimum pada satu titik, tetapi menyebar di wilayah saddle point. Titik optimum
faktor yang dipilih adalah yang memiliki respon yang paling maksimum. Titik optimum dilakukan dengan menganalisa bentuk kurva permukaan dan kontur respon terhadap faktor. Kurva yang berbentuk saddle point ini menyulitkan dalam
menentukan titik optimum. Kontur titik optimum yang berupa saddle point ini
diduga karena penentuan batas atas dan batas bawah dari faktor yang diujikan kurang tepat. Akan tetapi, titik ini dapat dilihat melalui kontur. Titik optimum berada di dalam daerah yang rentang kadar gula terkonversinya diprediksi maksimum. Tujuan penelitian ini adalah untuk mendapatkan level dari variabel bebas yang dapat mengoptimalkan respon glukosa total terkonversi. Namun tidak terpenuhi karena titik stasioner yang didapat memiliki karakteristik titik pelana. Jika dilihat pada kontur, titik optimum pada model ini berada pada titik tertinggi dengan level kerapatan sel 1.5 dan konsentrasi agar 1.2 %, serta konsentrasi glukosa 2.0 % yang diprediksi kadar glukosa total terkonversi sebanyak 7247.79 ppm. Berdasarkan hasil dari 2 respon yang dianalisis, ternyata kombinasi variabel dan level yang menghasilkan produksi gas hidrogen paling banyak tidak mengkonsumsi glukosa paling banyak pula. Hal ini disebabkan karena aktivitas enzim hidrogenase yang juga berperan kembali hidrogen yang telah diproduksi (Koku et al. 2002). Pada mikroorganisme tertentu seperti pada bakteri fotosintetik,
17
hidrogen karena mengkonsumsi sebagian hidrogen yang telah diproduksi (Anam 2012). Keaktifan enzim nitrogenase dan hidrogenase mikroba yang berbeda-beda serta pengaruh lingkungan (pH, cahaya, suhu, dan lain-lain) juga mempengaruhi produksi hidrogen dan konsumsi glukosa (Basak et al. 2014).
SIMPULAN DAN SARAN
Simpulan
Optimasi produksi biohidrogen oleh R. marinum menggunakan metode
permukaan respon menunjukkan kerapatan sel (X2) dan interaksi antara
konsentrasi glukosa dengan konsentrasi agar (X1X3) memberikan pengaruh
terhadap produksi hidrogen. Kombinasi 1.0 % glukosa, kerapatan sel 1.5, dan konsentrasi agar 1.2 % menghasilkan gas hidrogen paling banyak, yaitu 638.185 mL H2/L. Hasil prediksi dari kombinasi level tersebut menunjukkan kadar gas
hidrogen sebesar 593.45 mL H2/L.
Saran
Perlu dilakukan kembali optimasi produksi biohidrogen menggunakan
metode RSM ini dengan level yang lebih tepat sehingga didapatkan titik maksimum melalui grafik (kontur) permukaan respon berbentuk maksimum sehingga menghasilkan gas hidrogen lebih optimal.
DAFTAR PUSTAKA
Akkerman I, Janssen M, Rocha J, Wij H. 2002. Photobiological hydrogen production photochemical efficiency and bioreactor design. Int J Hydrogen Energy. 27:1195-1208.
Anam K, Habibi MS, Harwati TU, Susilaningsih D. 2012. Photofermentative hydrogen production using Rhodobium marinum from bagasse and soy
sauce wastewater. Int J Hydrogen Energy. 37(20):15436-15442.
Barbosa MJ, Rocha JMS, Tramper J, Wijffels RH. 2001. Acetate as a carbon source for hydrogen production by photosynthetic bacteria. J Biotechnol.
85:25–33.
Basak N, Jana AK, Das D, Saikia D. 2014. Photofermentative molecular biohydrogen production by purple-non-sulfur (PNS) bacteria in various modes: The present progress and future perspective. Int J Hydrogen Energy.
39:1-19.
Betha OS. 2009. Lactobacillusacidophilus fncc116 dan Bacillus licheniformis
18
Ghosh D, Sobro IF, Hallenbeck PC. 2012. Optimization of the hydrogen yield from single-stage photofermentation of glucoseby Rhodobacter capsulatus
JP91 using response surface methodology. Bioresour Technol. 123:199–206.
Habibi MS, Anam K, Susilaningsih D. 2010. Environmental factors optimization in photo-fermentation to produce biohydrogen by Sanur consortia. Di dalam:
Yopi, editor. ASEAN-Korea Symposium and Workshop on Biorefinery Technology; Jakarta, 18-20 Feb 2010. Jakarta: LIPI Press. hlm 169-172.
Habibi MS. 2009. Fermentasi Bakteri Fotosintetik Rhodobium marinum dan Isolat
Sanur (Koleksi BTCC) dengan Substrat Glukosa 1 % dalam Menghasilkan Biohidrogen. [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Irmayanti R. 2012. Optimasi Pelilinan dan Suhu Penyimpanan Buah Alpukat (Persea americana, Mill) Menggunakan Response Surface Methodology
(RSM). [skripsi]. Bogor(ID): Institut Pertanian Bogor.
Kapdan IK, Kargi F. 2006. Biohydrogen production from waste materials. Enzyme Microb Technol. 38:569-582.
Kawaguchi H. 2001. Effect of algal extract on H2 production by a photosintetic bacterium Rhodobiummarinum A-501: analysis of stimulating effect using a
kinetic model. J Biosci Bioeng. 94:62-69.
Koku H, Eroglu I, Gunduz U, Yucel M,Turker L. 2002. Aspects of the metabolism of hydrogen production by Rhodobacter sphaeroides. Int J Hydrogen Energy. 27:1315-139.
Koku H, Inci E, Ufuk G, Meral Y, Lemi T. 2002. Aspect of the metabolism of hydrogen production by Rhodobacter sphaeroides. Int J Hydrogen Energy
27:1315-1329.
Sirait LR. 2007. Produksi Gas Hidrogen dari Limbah Cair Tahu dengan Bakteri Fotosintetik Rhodobium marinum. [tesis]. Depok (ID): Universitas
Indonesia.
Sugiyono A. 2012. Prakiraan Kebutuhan Energi untuk Kemdaraan Bermotor di Perkotaan: Aspek Permodelan. J Sains Teknol Ind. 14(2):104-109.
Sun Q, Xiao W, Xi D, Shi J, Yan X, Zhou Z. 2010. Statistical optimization of biohydrogen production from sucrose by a co-culture of Clostridium acidisoli andRhodobacter sphaeroides. Int J Hydrogen Energy.
35:4076-4084.
Susilaningsih D, Harwati TU, Anam K, Yopi . 2008. Preparasi substrat limbah biomassa kekayuan tropika untuk produksi biohidrogen. Makara Teknologi.
12(1):38-42.
Triatmojo F. 2013. Dinamika Kebijakan Diversifikasi Energi di Indonesia: Analisis Kebijakan Pengembangan Energi Terbarukan di Indonesia. JAP.
4(2):147-148.
Wibowo SG. 2014. Optimasi Produksi Xilanase dari Bacillus halodurans CM1
19
LAMPIRAN
Lampiran 1 Alur Penelitian
Lampiran 2 Hasil pengukuran absorbansi kultivasi R. marinum
Hari ke- 1 Ulangan 2 Absorbansi (A) Rata-rata
0 0.098 0.102 0.100± 0.003
1 0.346 0.348 0.347± 0.001
2 0.812 0.789 1.601± 0.016
3 1.268 1.258 1.263± 0.007
4 1.411 1.468 1.440± 0.040
5 1.798 1.791 1.795± 0.005
6 2.051 2.051 2.051± 0.000
7 2.225 2.211 2.218± 0.010
8 2.351 2.345 2.348± 0.004
9 2.508 2.508 2.508± 0.000
Kultivasi dan pembuatan kurva pertumbuhan R. marinum
Kultivasi dan pemanenan kultur R. marinum(puncak fase eksponensial)
Fermentasi media produksi rancangan RAL (27 Sampel + kontrol)
Pengambilan sampel untuk pengujian kadar gula dan produksi hidrogen
Fermentasi media produksi Rancangan RSM (20 sampel + 1 kontrol)
Pengambilan sampel untuk pengujian kadar gula dan produksi hidrogen
Analisis respon yang dihasilkan dari interaksi parameter menggunakan metode RSM serta pembuatan model
20
Lampiran 3 Rancangan acak lengkap (RAL) produksi hidrogen oleh R. marinum
Sampel Konsentrasi glukosa (%) Konsentrasi agar (%) Kerapatan sel
1 0.5 1.0 0.2
21
Lampiran 5 Kurva standar pengukuran kadar glukosa pada panjang gelombang 490 nm.
Lampiran 6 Hasil produksi hidrogen dan kadar glukosa total terkonversi dari rancangan acak lengkap (RAL) oleh R. marinum
Lampiran 7 Data hasil eksperimen produksi gas hidrogen (H2) rancangan RSM
22
Lampiran 9 Data hasil eksperimen glukosa total terkonversi rancangan RSM
23
Lampiran 10 Grafik permukaan respon dan kontur kadar gas hidrogen (H2)
dengan variasi konsentrasi glukosa (X1) dan kerapatan sel (X2).
Lampiran 11 Grafik permukaan respon dan kontur kadar gas hidrogen (H2)
24
25
26
RIWAYAT HIDUP
Penulis dilahirkan di Kabupaten Agam, Sumatera Barat, pada tanggal 22 Desember 1992. Penulis merupakan putri ketiga dari 3 bersaudara dari bapak Asry dan Ibu Warni (Almh.). Penulis merupakan lulusan dari SMAN 01 Kamang Magek, Sumatera Barat pada tahun 2011. Setelah itu, penulis diterima sebagai mahasiswa Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui jalur SNMPTN Undangan.
Selama masa perkuliahan, penulis aktif dalam organisasi himpunan profesi biokimia Community of Research and Education in Biochemistry (CREBs)
2012/2014 dan Persatuan Alumni Kamang Magek dan Tilatang Kamang (PRIMASISTA) 2011/2014. Selain itu, penulis juga ikut dalam kepanitiaan kegiatan kampus, seperti anggota Div. Medis „Masa Perkenalan Kampus Mahasiswa Baru „49 (MPKMB „49) 2012, sekretaris Div. PDD ‘Explo Science‟
2013, dan sekretaris Div. Danus and Sponsorship „Lomba Karya Ilmiah Populer (LKIP)‟ 2013. Selain itu, penulis juga aktif sebagai pengajar privat di Lembaga Adi Indonesia Manajemen, Dramaga, Bogor, 2013/2015.
Penulis juga mengikuti kegiatan praktik lapang di Laboratorium Bioenergi dan Bioproses, Pusat Penelitian Bioteknologi Lembaga Ilmu Pengetahuan Indonesia (Bioteknologi LIPI), Cibinong pada bulan Juli-Agustus 2014 dengan judul Studi Pertumbuhan Rhodobium marinum pada Media Tumbuh GL dan