MOTILITAS SPERMATOZOA KUCING DOMESTIK
DALAM PENGENCER TRIS KUNING TELUR YANG
DISUPLEMENTASI BEBERAPA KARBOHIDRAT
PADA SUHU 5 °C
ANGELINE BUDIAWAN
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Yolk Extender Supplemented with Several Carbohydrate at 5 °C. Supervised by R. IIS ARIFIANTINI and BUDHY JASA WIDYANANTA.
The quality of chilled semen depends on the diluents composition; including the energy source for the survival of sperm. Glucose, fructose and lactose are the most widely used energy source for mammalian semen preservation. This study aims to evaluate the effect of fructose and/or trehalose suplementation in Tris Egg Yolk Extender to maintain the motility of domestic cat’s sperm at 5 °C. Semen was collected from three sexually mature cats by electro-ejaculator (three repetition n = 9). Immediately after collection, semen was evaluated macroscopically and microscopically. The semen showed > 70% sperm motility divided into three tubes and each of them diluted with Tris fructose egg yolk (TFEY), Tris trehalose egg yolk (TTEY) or Tris fructose trehalose egg yolk (TFTEY). Semen was stored at 5 °C and observed for percentage of sperm motility and individual progressive movements (scoring) every 12 hours until 60 hours of storage. Descriptively the results showed that TFTEY was the best diluents in maintained the motility of cat’s sperm (29.63 ± 18.76%) after 60 hours storage, but no significantly difference (P>0.05) was found between three diluents in maintained the sperm motility at 5 °C statistically. For individual progressive movements descriptive as well as statistically indicated no significant between three diluents which were 2.06 ± 0.42, 2.06 ± 0.42 and 2.22 ± 0.94 in TFEY, TTEY and TFTEY respectively.
dalam Pengencer Tris Kuning Telur yang Disuplementasi Beberapa Karbohidrat pada Suhu 5 °C. Dibimbing oleh R. IIS ARIFIANTINI dan BUDHY JASA WIDYANANTA.
Kualitas semen cair bergantung dengan komposisi bahan pengencer yang digunakan, diantaranya adalah harus mengandung sumber energi untuk kelangsungan hidup spermatozoa. Sumber energi yang biasa digunakan untuk preservasi semen mamalia yaitu glukosa, fruktosa dan laktosa. Penelitian ini bertujuan menguji penambahan fruktosa dan/atau trehalosa ke dalam bahan pengencer Tris kuning telur dalam mempertahankan motilitas spermatozoa kucing domestik pada suhu 5 °C. Semen dikoleksi menggunakan elektroejakulator dari tiga ekor kucing domestik dewasa kelamin dengan tiga kali pengulangan (n=9). Semen dievaluasi secara makroskopis dan mikroskopis. Semen dengan persentase motilitas spermatozoa > 70% dibagi menjadi tiga bagian yang masing-masing diencerkan dengan Tris fruktosa kuning telur (TFKT), Tris trehalosa kuning telur (TTKT) atau Tris fruktosa trehalosa kuning telur (TFTKT). Semen cair ini kemudian disimpan pada suhu 5 °C dan diamati motilitas serta gerakan individunya setiap 12 jam. Pengamatan dilakukan selama 60 jam. Hasil penelitian menunjukkan bahwa secara deskriptif, pengencer TFTKT merupakan pengencer yang paling baik dalam mempertahankan motilitas spermatozoa (29.63 ± 18.76%) setelah 60 jam penyimpanan, sedangkan secara statistik tidak terdapat perbedaan antara ketiga bahan pengencer dalam mempertahankan motilitas spermatozoa pada suhu 5 °C. Selain itu, gerakan individu kucing domestik pada masing-masing pengencer setelah 60 jam penyimpanan juga tidak menunjukkan perbedaan yang nyata, baik secara deskriptif ataupun secara statistik. Nilai gerakan individu spermatozoa pada penelitian ini setelah 60 jam penyimpanan secara berturut-turut yaitu 2.06 ± 0.42, 2.06 ± 0.42 dan 2.22 ± 0.94.
DISUPLEMENTASI BEBERAPA KARBOHIDRAT
PADA SUHU 5 °C
ANGELINE BUDIAWAN
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa skripsi Motilitas Spermatozoa Kucing Domestik dalam Pengencer Tris Kuning Telur yang Disuplementasi Beberapa Karbohidrat pada Suhu 5 °C adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, September 2011
© Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebut sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
Judul penelitian : Motilitas Spermatozoa Kucing Domestik dalam Pengencer
lllTris Kuning Telur yang Disuplementasi Beberapa
lllKarbohidrat pada Suhu 5 °C Nama mahasiswa : Angeline Budiawan
NRP : B04070105
Disetujui,
Dr. R. Iis Arifiantini, M. Si Pembimbing I
drh. Budhy Jasa Widyananta, M. Si Pembimbing II
Diketahui,
Dr. Nastiti Kusumorini
Wakil Dekan Fakultas Kedokteran Hewan
Segala puji syukur penulis panjatkan kehadirat Tuhan yang Maha Esa,
Tuhan kami Yesus Kristus karena berkat, anugerah dan kasih karunia melimpah
yang telah diberikan, sehingga skripsi yang berjudul Motilitas Spermatozoa
Kucing Domestik dalam Pengencer Tris Kuning Telur yang Disuplementasi
Beberapa Karbohidrat pada Suhu 5 °C dapat diselesaikan dengan baik. Skripsi
ini disusun sebagai salah satu syarat untuk menyelesaikan Program Sarjana S1
di Fakultas Kedokteran Hewan Institut Pertanian Bogor. Penulis ingin
menyampaikan ucapan terimakasih yang sebesar-besarnya kepada:
1. Dr. R. Iis Arifiantini, M. Si selaku pembimbing pertama skripsi.
2.
drh. Budhy Jasa Widyananta, M. Si selaku pembimbing kedua skripsi.3. drh. Huda Shalahudin Darusman, M. Si selaku pembimbing akademik.
4. drh. Andriyanto, M. Si selaku pembimbing akademik.
5. Papa, Mama, Ci Nita, Ko Kevin, Ci Areth yang memberi dukungan
sepenuhnya.
6. Keluarga besar Departemen Klinik, Patologi dan Reproduksi.
7. Bondan Achmadi SE yang setia membantu kami selama penelitian.
8. Keluarga besar Unit Rehabilitasi Reproduksi (URR).
9. Keluarga besar Rumah Sakit Hewan (RSH) IPB.
10. Teman-teman seperjuangan penelitan: Raditya Nandiasa dan Fajriati
Rafelia Hapsari.
11. Teman-teman dekat: Tancop, kak Vin, Wisnu, Siska, Uwen.
12. Teman-teman Gianuzzi FKH IPB tercinta.
13. Keluarga besar HIMPRO Hewan Kesayangan dan Satwa Akuatik.
Tuhan pasti memberikan balasan atas semua bantuan dan dorongan yang
telah diberikan. Penulis skripsi ini masih jauh dari sempurna, sehingga
diharapkan adanya saran dan kritik yang dapat membangun di masa mendatang.
Semoga skripsi ini bermanfaat bagi perkembangan ilmu pengetahuan.
Bogor, September 2011
Penulis dilahirkan di Surakarta pada tanggal 10 Agustus 1989, merupakan
anak ke empat dari empat bersaudara, pasangan Theodore Ayib Budiawan dan
Mayawati Chandra.
Pendidikan taman kanak-kanak hingga sekolah dasar diselesaikan di
Bekasi, pada tahun 1992 penulis mengambil pendidikan taman kanak-kanak di
TK Ananda Bekasi dan pada tahun 1995 mengambil pendidikan sekolah dasar di
SD Strada Budi Luhur II. Pendidikan Sekolah Lanjutan Tingkat Pertama dan
Sekolah Lanjutan Tingkat Atas diselesaikan di Jakarta, pada tahun 2001 penulis
mengambil pendidikan Sekolah Lanjutan Tingkat Pertama di SMP Tarakanita 5
Jakarta dan lulus tahun 2004, kemudian dilanjutkan ke SMAN 82 Jakarta dan
lulus tahun 2007.
Penulis diterima di Institut Pertanian Bogor melalui jalur USMI (Undangan
Seleksi Masuk IPB) sebagai mahasiswa Fakultas Kedokteran Hewan (FKH) IPB.
Selama menjadi mahasiswa, penulis pernah menjadi Sekretaris UKM
KEMAKI periode 2008-2009 dan anggota dari Himpunan Minat Profesi Hewan
DAFTAR ISI
Parameter Kesehatan Kucing... 5
Struktur dan fungsi spermatozoa... 6
Koleksi semen kucing... 7
Pengolahan semen... 9
MATERI DAN METODE... 12
Waktu dan tempat penelitian... 12
Materi penelitian... 12
Metode penelitian... 13
HASIL DAN PEMBAHASAN... 15
Karakteristik semen segar kucing domestik... 15
Daya tahan hidup spermatozoa kucing domestik dalam berbagai bahan pengencer pada suhu 5 °C... 17
Penurunan persentase motilitas kucing domestik dalam berbagai bahan pengencer pada suhu 5 °C... 20
SIMPULANDAN SARAN………... 23
Simpulan... 23
Saran... 23
DAFTAR PUSTAKA... 24
DAFTAR TABEL
Halaman
1. Komposisi buffer yang digunakan untuk membuat bahan pengencer... 13
2. Komposisi bahan pengencer semen... 13
3. Karakteristik semen segar kucing domestik yang dikoleksi menggunakan elektroejakulator... 16
4. Motilitas spermatozoa kucing domestik pada penyimpanan suhu 5 °C... 18
5. Gerakan individu spermatozoa kucing domestik pada penyimpanan
DAFTAR GAMBAR
Halaman
1. Kucing domestik... 5
2. Morfologi spermatozoa normal... 6
Latar Belakang
Sekitar awal tahun 1900 terdapat 230 spesies kucing namun saat ini hanya
terdapat kurang dari 30 spesies (Edwards 2005). Penurunan jumlah spesies
kucing diakibatkan oleh perburuan yang dilakukan oleh manusia sehingga
banyak spesies yang mengalami kepunahan. Kucing memilki tiga genus yaitu
Phantera, Felis dan Acinonyx. Menurut Edwards (2005), ketiga genus ini memiliki
hubungan erat, namun yang dapat dipastikan adalah kucing domestik yang saat
ini banyak terdapat di lingkungan sekitar kita berasal dari genus Felis.
Perkembangbiakkan kucing dari genus Phantera dan Acinonyx tergolong
sulit. Keadaan ini menyebabkan terjadinya ketidakseimbangan jumlah kelahiran
dan kematian kucing dari genus Phantera dan Acinonyx. Karena itu, penelitian
mengenai aspek reproduksi pada kucing tersebut perlu dikembangkan.
Permasalahannya adalah sulit dilakukan penelitian pada kucing yang hampir
punah, selain karena jumlahnya yang terbatas juga sulit untuk memberi
perlakuan pada kucing di alam liar atau penangkaran. Karena alasan tersebut,
kucing domestik digunakan sebagai hewan model untuk melakukan penelitian
mengenai aspek reproduksi pada kucing non domestik (Ganán et al. 2009).
Salah satu teknik reproduksi yang perlu dikembangkan adalah teknik
Inseminasi Buatan (IB). Ketika perkawinan secara alamiah sulit dilakukan atau
ketika hewan jantan dan betina berada pada lokasi yang terpisah, teknik IB perlu
dilakukan. Teknik ini akan membantu dalam konservasi kucing-kucing non
domestik yang berada di ambang kepunahan.
Keberhasilan teknik IB tidak hanya bergantung pada kualitas dan kuantitas
semen yang diejakulasikan oleh seekor jantan tetapi juga bergantung pada
kemampuan dalam mempertahankan kualitasnya secara in vitro. Salah satu
faktor yang akan mempengaruhi kualitas semen in vitro adalah bahan pengencer
yang ditambahkan pada semen saat preservasi (Wicaksono & Arifiantini 2009).
Bahan pengencer yang baik harus dapat menyediakan nutrisi bagi spermatozoa
selama penyimpanan, melindungi spermatozoa dari cold shock, bersifat buffer
untuk mencegah perubahan pH, mempertahankan tekanan osmotik dengan cara
menyediakan lingkungan yang isotonik, mengandung antibiotik untuk mencegah
timbulnya bakteri, dan menyediakan lingkungan yang baik untuk berlangsungnya
Karbohidrat merupakan komponen penting yang harus ada di dalam bahan
pengencer. Sumber karbohidrat yang umum digunakan untuk semen cair kucing
diantaranya adalah glukosa (Axnér et al. 2004), fruktosa (Baran et al. 2004;
ganán et al. 2009) dan laktosa (Axnér & Linde-Forsberg 2002). Penelitian
mengenai preservasi semen kucing telah banyak dilaporkan. Bahan pengencer
yang digunakan diantaranya adalah buffer Tris dengan fruktosa (Baran et al.
2004; Ganán et al. 2009), Tris dengan glukosa (Axnér et al. 2004) dan Tris
dengan laktosa (Axnér & Linde-Forsberg 2002).
Trehalosa merupakan karbohidrat golongan disakarida bersifat membran
stabilisator (Isnaini et al. 2005) yang memiliki kemampuan lebih untuk melindungi
spermatozoa dalam proses pembekuan sehingga kualitas spermatozoa dapat
bertahan lebih lama (Yildiz et al. 2000). Selain itu, karbohidrat ini juga berfungsi
sebagai krioprotektan ekstraseluler (Arifiantini et al. 2009) dengan cara
memperbaiki fluiditas membran plasma spermatozoa (Aboagla & Terada 2003).
Mengingat fungsi trehalosa sebagai membran stabilisator dan saat preservasi
pada suhu 5 °C spermatozoa akan mengalami cold shock, maka perlu dilakukan
penelitian mengenai penggunaan trehalosa pada bahan pengencer Tris kuning
telur dalam upaya penyediaan semen cair untuk inseminasi pada kucing.
Tujuan Penelitian
Penelitian ini bertujuan menguji penambahan fruktosa dan/atau trehalosa
ke dalam bahan pengencer Tris kuning telur dalam mempertahankan motilitas
spermatozoa kucing domestik pada suhu 5 °C.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberi informasi mengenai pengencer
yang baik untuk melakukan preservasi semen kucing domestik dengan harapan
Hipotesis
Bahan pengencer Tris kuning telur yang disuplementasi kombinasi fruktosa
dengan trehalosa merupakan bahan pengencer terbaik dibandingkan dengan
bahan pengencer Tris kuning telur yang disuplementasi fruktosa atau trehalosa
dalam mempertahankan persentase motilitas spermatozoa kucing domestik pada
Klasifikasi Kucing
Kucing termasuk ke dalam Famili Felidae dan terdiri dari tiga genus yaitu
Phantera, Felis dan Acinonyx. Pembagian genus ini bukan berdasarkan
perbedaan ukuran tubuh namun berdasarkan perbedaan anatomi tubuh mereka.
Kucing yang termasuk ke dalam genus Phantera merupakan kucing yang dapat
mengaum diantaranya singa dan harimau. Genus Felis merupakan genus dari
kucing domestik. Kucing yang termasuk ke dalam genus Phantera dan Felis
dapat menarik atau menyimpan kukunya saat tidak digunakan namun hal ini tidak
dapat dilakukan oleh kucing dari genus Acinonyx (Edwards 2005).
Kucing dari Genus Acinonyx merupakan kucing yang tidak dapat
menyimpan kukunya walaupun tidak sedang digunakan (Edwards 2005). Contoh
kucing dari genus Acinonyx adalah cheetah sehingga kucing ini tidak
meninggalkan jejak kuku di atas tanah. Semua kucing memiliki empat jari pada
kaki belakang dan lima jari pada kaki depan dengan ibu jari yang kecil. Pada
umumnya, kaki depan berukuran lebih besar daripada kaki belakang (Ario 2010 ).
Genus Felis memiliki beberapa spesies diantaranya Felis manul, Felis
sylvestris libyca (African wild cat) dan Felis sylvestris sylvestris (European wild
cat). Felis manul merupakan kucing berambut panjang sedangkan Felissylvestris
libyca dan Felis sylvestris sylvestris merupakan kucing berambut pendek. Felis
sylvestris libyca merupakan nenek moyang kucing domestik yang kemudian di
Indonesia disebut kucing lokal (Edwards 2005).
Kucing yang bukan berasal dari Felissylvestris libyca dapat disebut kucing
non domestik. Semua kucing yang ada di dunia memiliki bentuk tubuh yang mirip
dengan kucing domestik. Mereka juga memiliki jumlah gigi yang sama yaitu
28-30 gigi. Ciri-ciri yang membedakan kucing ini yaitu ukuran tubuh, panjang ekor,
pola warna, dan penyebarannya. Kucing non domestik memiliki ukuran tubuh
yang bervariasi. Ukurannya mulai dari seukuran kucing domestik hingga besar
seperti harimau dan macan tutul. Panjang ekor pun bervariasi, mulai dari ekor
sangat pendek sampai yang panjang ekornya melebihi panjang tubuh kucing itu
sendiri (Ario 2010).
Secara umum, jenis kucing yang termasuk ke dalam genus Felis dapat
dikelompokkan berdasarkan rambutnya, yaitu: short hair, medium hair dan long
dalam kelompok kucing short hair. Hal ini didukung dengan pernyataan Edwards
(2005) bahwa nenek moyang kucing domestik yaitu Felis sylvestris libyca yang
merupakan kucing berambut pendek. Kucing domestik dapat dilihat pada
Gambar 1.
Kucing telah mengalami domestikasi yang begitu sempurna dan mampu
berhubungan erat dengan manusia. Contoh kucing yang telah didomestikasi
yaitu Felis catus. Klasifikasi kucing ini menurut LaBruna (2001) yaitu:
Kingdom : Animalia
Filum : Chordata
Kelas : Mammalia
Ordo : Carnivora
Famili : Felidae
Genus : Felis
Spesies : Felis catus
Gambar 1 Kucing domestik.
Parameter Kesehatan Kucing
Pemeriksaan kucing secara umum dilakukan dengan cara inspeksi dan
adspeksi yaitu memeriksa dengan cara melihat, membau dan mendengarkan
tanpa alat bantu. Parameter yang diperiksa diantaranya frekuensi nadi, frekuensi
napas, suhu tubuh, warna dan kelembaban membran mukosa, ukuran dan
Frekuensi nadi atau frekuensi denyut jantung kucing normal yaitu 120 kali
per menit dengan denyut jantung yang bersuara “lub dub” (Foss 2008). Kucing
nomal memiliki frekuensi napas 25-30 kali per menit (Eldredge 2008) dan
memiliki suhu tubuh 37.6-39.4 °C. Membran mukosa kucing normal berwarna
merah muda. Limfonodus yang terdapat pada kucing normal memiliki konsistensi
kenyal dan dapat digerak-gerakkan ketika dipalpasi (Boddie 1962).
Struktur dan Fungsi Spermatozoa
Spermatozoa dibagi menjadi tiga bagian yaitu kepala, midpiece dan ekor.
Morfologi spermatozoa dapat dilihat pada Gambar 2. Ujung kepala spermatozoa
merupakan bagian yang disebut akrosom. Di sana terdapat dua enzim yang
paling berperan pada proses reaksi akrosom yaitu hyaluronidase dan acrosin.
Enzim hyaluronidase akan mencerna asam hialuronat yang terdapat di antara
cumulus oophorus sehingga spermatozoa dapat menembus cumulus oophorus
dan kemudian berikatan dengan zonapellucida. Enzim acrosin merupakan enzim
yang melisiskan zona pellucida sehingga spermatozoa dapat masuk ke dalam
sitoplasma ovum(Noakes 2001).
Spermatozoa melakukan metabolisme terhadap molekul-molekul
sederhana terutama senyawa gula dan turunannya, misalnya: fruktosa, glukosa
dan piruvat mannosa. Metabolisme ini dilakukan untuk menyediakan energi yang
digunakan untuk bergerak (Noakes 2001).
Perpindahan spermatozoa dari suatu tempat ke tempat lain dikarenakan
adanya gelombang yang dihasilkan dari gerakan leher dan ekor dari
spermatozoa tersebut (Noakes 2001). Motilitas dari spermatozoa memiliki peran
kecil untuk bisa melalui cervix dan uterus. Kontraksi dari saluran reproduksi
betina itu sendiri yang memiliki peran penting bagi spermatozoa untuk masuk ke
dalam cervix dan uterus (Hunter 1980). Motilitas spermatozoa tidak diperlukan
dalam perjalanannya melalui oviduct. Motilitas spermatozoa akan sangat
berperan penting untuk melakukan penetrasi ke dalam cumulus oophorus dan
zona pellucida (Noakes 2001).
Koleksi Semen Kucing
Koleksi semen bertujuan memperoleh hasil ejakulasi dengan konsentrasi
dan motilitas spermatozoa yang memadai. Koleksi semen harus memiliki tingkat
stres yang minimal pada hewan yang dikoleksi semennya (Zambelli et al. 2007).
Metode yang umum dilakukan di lapangan untuk mengoleksi semen yaitu
dengan menggunakan vagina buatan dan elektroejakulator. Penggunaan vagina
buatan dapat menghasilkan semen yang berkualitas baik pada suatu peternakan,
namun koleksi semen dengan vagina buatan sulit dilakukan pada kucing terkait
dengan temperamen hewan tersebut.
Koleksi Semen Kucing Menggunakan Vagina Buatan
Penggunaan vagina buatan untuk koleksi semen memiliki beberapa
keuntungan diantaranya biaya untuk membuat vagina buatan tidak mahal, tidak
menggunakan pengendalian kimia dan hanya sedikit melakukan pengendalian
fisik. Koleksi semen kucing dengan vagina buatan membutuhkan pejantan yang
terlatih serta menggunakan teaser queen (betina estrus atau betina steril yang
diberi esterogen). Tiga dari lima pejantan yang dipilih secara acak dan dirawat
dengan baik selama 2 minggu berhasil dikoleksi semennya dengan vagina
buatan (Zambelli & Cunto 2006).
Vagina buatan dibuat dari bulb karet pipet 2 mL dan tabung eppendorf.
Kedua peralatan ini kemudian dimasukkan ke dalam botol polyethylene yang diisi
air hangat sampai temperatur vagina buatan mencapai 52 °C. Temperatur ini
disesuaikan dengan suhu vagina kucing yang sebenarnya.
Setelah vagina buatan telah siap, pengoleksi semen memasukkan penis
pejantan menaiki betina saat kawin. Koleksi semen akan selesai dalam waktu 1-4
menit. Koleksi semen yang dilakukan tiga kali dalam seminggu akan
menghasilkan semen dengan volume konstan (Zambelli & Cunto 2006).
Koleksi Semen Kucing Menggunakan Elektroejakulator
Koleksi semen kucing dengan menggunakan elektroejakulator tidak
membutuhkan teaser queen atau pelatihan pejantan terlebih dahulu. Metode ini
dapat dilakukan pada semua pejantan yang belum dikastrasi serta layak untuk
dianestesi.
Jumlah stimulasi yang diberikan saat melakukan elektroejakulasi dapat
mempengaruhi konsentrasi spermatozoa maupun volume semen yang
diejakulasi, sedangkan voltase yang digunakan untuk melakukan elektroejakulasi
hanya mempengaruhi konsentrasi spermatozoa. Konsentrasi spermatozoa yang
diperoleh dengan voltase 4 atau 8 volt lebih banyak jika dibandingkan dengan
konsentrasi spermatozoa yang diperoleh dengan voltase 1 atau 2 volt. Plasma
semen akan dikeluarkan pada saat stimulasi sebesar 0 atau 1 volt sedangkan
spermatozoa dikeluarkan pada stimulasi di atas 2 volt.
Persentase motilitas spermatozoa tidak dipengaruhi oleh voltase stimulasi,
pengulangan koleksi semen atau metode yang digunakan dalam koleksi semen.
Semen yang dikoleksi dengan menggunakan elektroejakulator memiliki pH yang
lebih tinggi daripada pH semen yang dikoleksi dengan menggunakan vagina
buatan (Zambelli & Cunto2006).
Koleksi semen dengan menggunakan elektroejakulator dilakukan dengan
terlebih dahulu melakukan anestesi terhadap kucing yang akan dikoleksi
semennya. Kucing yang telah dianestesi dibaringkan dengan posisi lateral
recumbency. Rektal probe dengan tebal 1 cm, panjang 12 cm dan memiliki 3
elektroda dimasukkan ke dalam rektum sejauh kurang lebih 9 cm. Tabung
eppendorf hangat diposisikan di dekat penis sebelum stimulasi mulai diberikan
(Baran et al. 2004).
Menurut Howard et al. (1990), koleksi semen dengan menggunakan
elektroejakulator dilakukan dalam 3 tahap. Tahap pertama dilakukan dengan
memberikan tegangan 2 volt, 3 volt dan 4 volt. Tahap kedua dilakukan dengan
memberikan tegangan 3 volt, 4 volt dan 5 volt. Tahap ketiga dilakukan dengan
memberikan tegangan 4 volt dan 5 volt. Masing-masing perlakuan terdiri dari 10
Pengulangan dalam mengoleksi semen kucing dengan menggunakan
elektroejakoulator dilakukan dengan jarak waktu minimal 4 hari dengan tujuan
menghilangkan efek anestesi pada hewan coba (Zambelli et al. 2007).
Sediaan Anestesi
Kombinasi ketamin dan diazepam dapat digunakan untuk anestesi kucing
sebelum koleksi semen menggunakan elektroejakulator. Ketamin merupakan
larutan yang tidak berwarna, stabil pada suhu kamar dan relatif aman. Senyawa
ini memilki sifat analgesik, anestetik dan kataleptik dengan kerja yang singkat.
Sifat analgesik yang dimiliki sangat kuat untuk sistem somatik namun lemah
untuk sistem visceral. Sifat anestetiknya akan bekerja lebih baik jika
dikombinasikan dengan diazepam.
Ketamin menyebabkan tekanan darah, frekuensi nadi dan curah jantung
mengalami peningkatan sampai 20%. Refleks faring dan laring juga mengalami
peningkatan walaupun hanya sedikit. Senyawa ini tidak menyebabkan terjadinya
relaksasi otot lurik bahkan terkadang sedikit meningkatkan tonus otot (Ganiswara
1995). Dosis penggunaan ketamin pada kucing jika diaplikasikan melalui
intravena yaitu 2-4 mg/kg berat badan (Plumb 2005).
Diazepam merupakan senyawa yang dapat menyebabkan turunnya
kesadaran namun tidak memiliki efek analgesik. Senyawa ini juga tidak
menimbulkan potensiasi terhadap efek dari penghambat neuromuskular serta
efek analgesik obat lain.
Pemberian diazepam secara intra vena untuk mendapatkan efek sedasi
tidak menyebabkan penurunan tekanan arteri dan curah jantung namun dapat
menyebabkan terjadinya takikardi dan depresi napas ringan. Biasanya, diazepam
digunakan untuk medikasi preanestetik dan untuk mengatasi konvulsi yang
disebabkan oleh ketamin (Ganiswara 1995). Dosis sediaan ini jika diaplikasikan
pada kucing yaitu 0.05-0.4 mg/kg berat badan (Plumb 2005).
Pengolahan Semen
Semen segar hasil ejakulasi biasanya diolah dengan tujuan memiliki daya
simpan yang lebih lama dengan kualitas yang dipertahankan. Biasanya semen
segar diolah menjadi semen cair dan semen beku bergantung dengan daya
simpan yang diinginkan. Semen yang telah diolah umumnya digunakan untuk
Pembuatan Semen Cair
Pengenceran semen adalah penambahan bahan pada spermatozoa yang
dapat mempertahankan daya hidup spermatozoa lebih lama daripada ketahanan
aslinya (Junaidi 2006). Bahan pengencer yang baik harus dapat menyediakan
nutrisi bagi spermatozoa sebagai sumber energi, melindungi spermatozoa dari
cold shock saat dilakukan preservasi pada suhu rendah, bersifat buffer untuk
mencegah perubahan pH terkait dengan sifat spermatozoa yang tidak tahan
asam, mempertahankan tekanan osmotik dengan menyediakan lingungan yang
isotonik bagi spermatozoa, serta mengandung antibiotik untuk mematikan bakteri
yang terbawa saat koleksi semen dan mencegah timbulnya bakteri selama
preservasi (Kostaman & Sutama2006).
Karbohidrat merupakan komponen penting yang harus ada di dalam bahan
pengencer, karena karbohidrat merupakan senyawa yang akan dimetabolisme
oleh spermatozoa untuk menghasilkan energi yang digunakan untuk melakukan
aktivitas. Bahan pengencer yang umum digunakan dalam membuat semen cair
kucing domestik diantaranya adalah buffer Tris dengan fruktosa (Baran et al.
2004, Ganan et al. 2009), Tris dengan glukosa (Axnér et al. 2004) dan Tris
dengan laktosa (Axnér & Linde-Forsberg 2002). Pada bahan pengencer ini, yang
berperan sebagai sumber energi yaitu fruktosa, glukosa dan laktosa.
Pembuatan Semen Beku
Pengolahan semen cair menjadi semen beku yang berkualitas
membutuhkan bahan pengencer semen yang mampu mempertahankan kualitas
spermatozoa selama proses pendinginan, pembekuan maupun pada saat
thawing (Aboagla & Terada 2004). Salah satu komponen penting yang harus
ditambahkan pada pengencer untuk membuat semen beku adalah krioprotektan.
Gliserol merupakan krioprotektan yang umum digunakan untuk membuat semen
beku (Arifiantini et al. 2007). Senyawa ini akan melindungi spermatozoa pada
saat pembekuan dari kristal es tajam yang dapat merusak membran
spermatozoa (Park & Graham 1992).
Pengolahan semen segar kucing menjadi semen beku telah dilakukan oleh
beberapa peneliti diantaranya Baran et al. (2004) yang telah membuat semen
dan Axnér dan Linde-Forsberg (2002) yang menambahkan gliserol pada bahan
pengencer Tris glukosa.
Sebagai antibakteri pada semen cair dan semen beku digunakan antibiotik.
Antibiotik yang sering ditambahkan ke dalam pengencer yaitu penisilin dan
streptomisin, baik digunakan secara bersamaan maupun terpisah (Laing 1979).
Penisilin merupakan antibiotik golongan betalaktam yang bekerja pada bakteri
gram positif, sedangkan streptomisin merupakan antibiotoik golongan
aminoglikosida yang bekerja pada bakteri gram negatif (Ganiswara 1995).
Menurut Martin (1989), kombinasi dari penisilin dan streptomisin dapat bekerja
Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan Juli 2010 sampai dengan Mei 2011 di
laboratorium Unit Rehabilitasi Reproduksi (URR) Bagian Reproduksi dan
Kebidanan, Fakultas Kedokteran Hewan IPB.
Materi Penelitian
Hewan Percobaan
Hewan percobaan yang digunakan adalah tiga ekor kucing domestik (Felis
catus) jantan yang telah dewasa kelamin, dengan bobot badan antara 3 sampai
dengan 4 kg dan dinyatakan sehat dengan pengujian fisik dan darah (hematologi
rutin) di laboratorium. Kucing tersebut diberi pakan kering (My Dear Cat®) dua
kali sehari masing-masing sebanyak 50 g, diberi tambahan Vitamin E dan kuning
telur yang dicampur dengan madu secara rutin satu kali sehari untuk menjaga
kesehatannya. Ketiga kucing ini dipelihara di dalam kandang secara individual di
Rumah Sakit Hewan (RSH), Institut Pertanian Bogor.
Peralatan Penelitian
Peralatan yang digunakan dalam penelitian yaitu tabung erlenmeyer,
tabung eppendorf, elektroejakulator yang diproduksi oleh Fujihira Industry, pipet,
pipet mikro, kontainer, pH meter (pH-indikatorpapier berskala 6.4-8.0), object
glass dan cover glass, mikroskop cahaya listrik (Olympus CH 20), kamar hitung
Neubauer, kertas tissue, dan spuit
Bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian ini adalah bahan
pengencer semen yaitu Tris fruktosa kuning telur, Tris trehalosa kuning telur dan
Tris fruktosa trehalosa kuning telur; ketamin HCL 100 mg/cc; diazepam 5 mg/cc;
gel; NaCl fisiologis; formolsalin; pewarna eosin-nigrosin; aquadest; dan
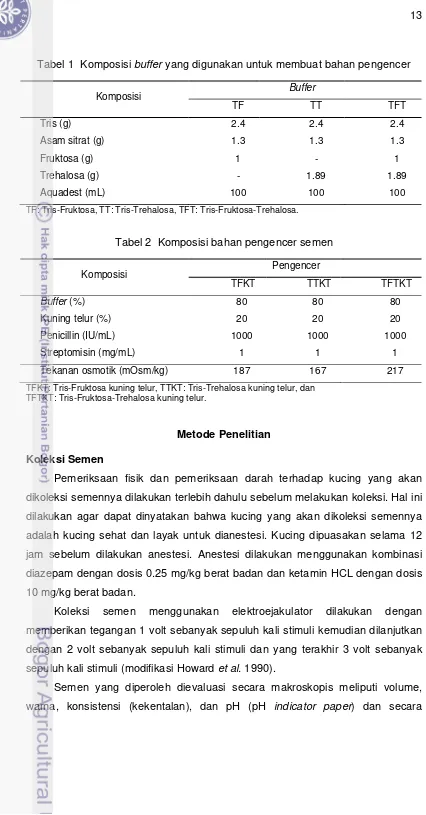
alumunium foil. Komposisi buffer dan bahan pengencer semen yang merupakan
Tabel 1 Komposisi buffer yang digunakan untuk membuat bahan pengencer
TF: Tris-Fruktosa, TT: Tris-Trehalosa, TFT: Tris-Fruktosa-Trehalosa.
Tabel 2 Komposisi bahan pengencer semen
Komposisi Pengencer TFTKT: Tris-Fruktosa-Trehalosa kuning telur.
Metode Penelitian
Koleksi Semen
Pemeriksaan fisik dan pemeriksaan darah terhadap kucing yang akan
dikoleksi semennya dilakukan terlebih dahulu sebelum melakukan koleksi. Hal ini
dilakukan agar dapat dinyatakan bahwa kucing yang akan dikoleksi semennya
adalah kucing sehat dan layak untuk dianestesi. Kucing dipuasakan selama 12
jam sebelum dilakukan anestesi. Anestesi dilakukan menggunakan kombinasi
diazepam dengan dosis 0.25 mg/kg berat badan dan ketamin HCL dengan dosis
10 mg/kg berat badan.
Koleksi semen menggunakan elektroejakulator dilakukan dengan
memberikan tegangan 1 volt sebanyak sepuluh kali stimuli kemudian dilanjutkan
dengan 2 volt sebanyak sepuluh kali stimuli dan yang terakhir 3 volt sebanyak
sepuluh kali stimuli (modifikasi Howard et al. 1990).
Semen yang diperoleh dievaluasi secara makroskopis meliputi volume,
mikroskopis meliputi gerakan individu (scoring 0-5), persentase motilitas
(0-100%), konsentrasi spermatozoa dengan Neubauer chamber (106/mL),
persentase spermatozoa hidup dan morfologi spermatozoa (normalitas dan
abnormalitas) menggunakan pewarnaan eosin-nigrosin (Barth & Oko 1989).
Pengenceran Semen
Semen dengan persentase motilitas spermatozoa > 70% digunakan dalam
penelitian ini. Semen segar dibagi menjadi tiga bagian dan diencerkan
masing-masing dengan salah satu bahan pengencer yaitu: Tris fruktosa kuning telur
(TFKT), Tris trehalosa kuning telur (TTKT) atau Tris fruktosa trehalosa kuning
telur (TFTKT) dengan dosis pengenceran 33 x 106/mL sampai dengan 35 x
106/mL. Semen yang sudah diencerkan disimpan pada suhu 5 °C untuk
dievaluasi lebih lanjut.
Pengamatan Semen Cair
Pengamatan semen cair dilakukan setiap 12 jam sampai jam ke 60
penyimpanan dengan menggunakan mikroskop (Olympus CH 20) dengan
pembesaran 400 X, terhadap persentase motilitas spermatozoa dan nilai
gerakan individu spermatozoa (SNI 01-4869.1-2005) dari lima lapang pandang
yang berbeda. Persentase motilitas adalah jumlah spermatozoa yang bergerak
maju ke depan dibandingkan dengan semua spermatozoa yang teramati dalam
satu lapang pandang. Pengamatan persentase motilitas tersebut dilakukan
dengan memberikan nilai 0 sampai dengan 100%.
Gerakan individu (scoring individu) merupakan kecepatan spermatozoa
bergerak maju ke depan yang dinilai secara individual pada suatu lapang
pandang. Penilaiannya dilakukan dengan memberikan nilai 0 (tidak bergerak)
sampai dengan 5 (bergerak sangat cepat).
Rancangan Percobaan
Penelitian ini dirancang dengan menggunakan rancangan acak lengkap
(RAL) menggunakan tiga ekor kucing dengan tiga kali ulangan. Data yang
didapatkan diolah menggunakan uji Anova dan jika terdapat perbedaan
Karakteristik Semen Segar Kucing Domestik
Koleksi semen kucing pada penelitian ini dilakukan menggunakan
elektroejakulator. Teknik ini dipilih karena koleksi semen kucing menggunakan
teknik vagina buatan memerlukan waktu lama untuk melatih kucing jantan,
sedangkan menggunakan elektroejakulator tidak memerlukan latihan terlebih
dahulu (Thuwanut 2010).
Karakteristik semen segar berbeda-beda bergantung pada jenis hewan,
teknik koleksi dan sediaan obat yang digunakan untuk menganestesi kucing
yang akan dikoleksi semennya. Beberapa sediaan anestesi yang pernah
digunakan adalah kombinasi ketamin HCL dengan xilazin (Baran et al. 2009) dan
kombinasi ketamin HCL dengan medetomidin (Zambelli & Cunto 2006; Axnér &
Linde-Forsberg 2002; Zambelli et al. 2007). Medetomidin merupakan sediaan
yang paling banyak digunakan untuk anestesi kucing dalam melakukan koleksi
semen menggunakan elektroejakulator, tetapi obat ini sulit didapatkan di
Indonesia. Dokter hewan di Indonesia biasa menggunakan kombinasi ketamin
HCL dan diazepam untuk melakukan anestesi pada kucing dan memberikan
hasil yang baik.
Semen kucing yang diperoleh pada penelitian ini berwarna putih keruh
dengan konsistensi encer sampai sedang. Menurut Malandain (2005), warna
putih yang ditunjukkan semen kucing merefleksikan konsentrasi spermatozoa
yang terkandung didalamnya. Hematospermia dapat muncul pada semen kucing
jika teknik koleksi dilakukan menggunakan kateter. Warna semen yang tampak
kekuningan menunjukkan adanya kontaminasi urin pada semen tersebut. Semen
kucing mempunyai konsistensi yang encer sampai sedang, hal ini berhubungan
dengan konsentrasi spermatozoanya yang rendah (Tabel 3).
Volume semen kucing hasil penelitian ini sangat beragam dengan nilai
rataan sebesar 42.78 ± 11.82 µL. Nilai ini termasuk normal menurut Axnér dan
Linde-Forsberg (2002) yang melaporkan bahwa volume semen kucing yang
dikoleksi menggunakan elektroejakulator berkisar antara 19 sampai dengan 740
µL. Derajat keasaman (pH) semen kucing yang diperoleh pada penelitian ini
adalah 7.04 ± 0.39. Nilai pH ini termasuk normal menurut (Thuwanut 2010), yang
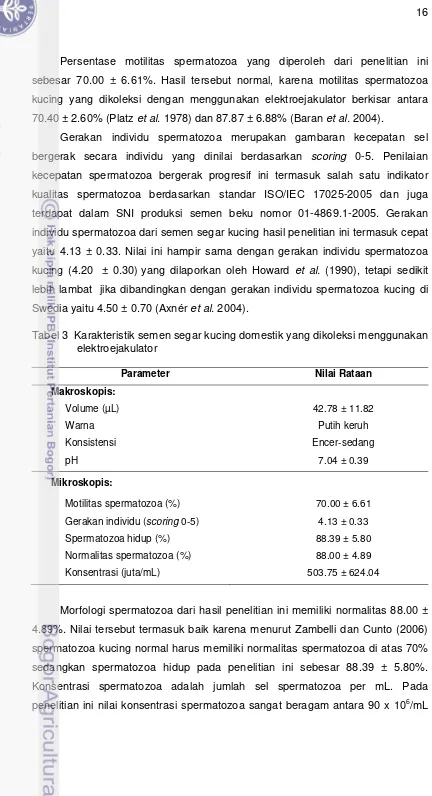
Persentase motilitas spermatozoa yang diperoleh dari penelitian ini
sebesar 70.00 ± 6.61%. Hasil tersebut normal, karena motilitas spermatozoa
kucing yang dikoleksi dengan menggunakan elektroejakulator berkisar antara
70.40 ± 2.60% (Platz et al. 1978) dan 87.87 ± 6.88% (Baran et al. 2004).
Gerakan individu spermatozoa merupakan gambaran kecepatan sel
bergerak secara individu yang dinilai berdasarkan scoring 0-5. Penilaian
kecepatan spermatozoa bergerak progresif ini termasuk salah satu indikator
kualitas spermatozoa berdasarkan standar ISO/IEC 17025-2005 dan juga
terdapat dalam SNI produksi semen beku nomor 01-4869.1-2005. Gerakan
individu spermatozoa dari semen segar kucing hasil penelitian ini termasuk cepat
yaitu 4.13 ± 0.33. Nilai ini hampir sama dengan gerakan individu spermatozoa
kucing (4.20 4± 0.30)yang dilaporkan oleh Howard et al. (1990), tetapi sedikit
lebih lambat* jika dibandingkan dengan gerakan individu spermatozoa kucing di
Swedia yaitu 4.50 ± 0.70 (Axnér et al. 2004).
Tabel 3 Karakteristik semen segar kucing domestik yang dikoleksi menggunakan
Llllelektroejakulator
Parameter Nilai Rataan
Makroskopis:
Morfologi spermatozoa dari hasil penelitian ini memiliki normalitas 88.00 ±
4.89%. Nilai tersebut termasuk baik karena menurut Zambelli dan Cunto (2006)
spermatozoa kucing normal harus memiliki normalitas spermatozoa di atas 70%
sedangkan spermatozoa hidup pada penelitian ini sebesar 88.39 ± 5.80%.
Konsentrasi spermatozoa adalah jumlah sel spermatozoa per mL. Pada
sampai dengan 851.25 x 106/mL, dengan rataan 503.75 ± 624.04 x 106/mL.
Keragaman konsentrasi spermatozoa juga dilaporkan terjadi pada kucing-kucing
domestik di Swedia yaitu antara 96 sampai dengan 5101 x 106/mL namun teknik
koleksinya menggunakan vagina buatan (Thuwanut 2010). Berdasarkan hasil
evaluasi semen segar yang didapat, kualitas semen tersebut termasuk normal
dan dapat diproses lebih lanjut menjadi semen cair.
Daya Tahan Hidup Spermatozoa Kucing Domestik dalam Berbagai Bahan Pengencer pada Suhu 5 °C
Daya tahan hidup spermatozoa ditunjukkan dengan nilai motilitas
spermatozoa yang masih bergerak dalam waktu tertentu yang dapat dinilai dari
perbandingan jumlah spermatozoa yang bergerak progresif yang disebut dengan
motilitas dan juga kecepatan spermatozoa secara individu bergerak maju ke
depan (scoring individu). Pada penelitian ini penilaian terhadap motilitas
spermatozoa dilakukan secara subjektif kuantitatif dari lima lapang pandang
dengan cara membandingkan jumlah spermatozoa yang bergerak progresif
dengan semua spermatozoa yang teramati dalam satu lapang pandang dan
dinyatakan dalam persen (0-100%). Kecepatan progresif spermatozoa yang
disebut dengan gerakan individu spermatozoa dinilai dengan memberikan nilai 0
sampai dengan 5 (Zambelli & Cunto 2006).
Hasil pengamatan sampai dengan jam ke 60 penyimpanan, secara
deskriptif menunjukkan motilitas spermatozoa kucing yang diencerkan
menggunakan TFTKT adalah 29.63 ± 18.76%. Nilai ini lebih tinggi daripada nilai
motilitas spermatozoa yang diencerkan menggunakan TFKT dan TTKT pada jam
yang sama yaitu hanya 21.67 ± 12.47% dan 18.15 ± 13.24%.
Pengujian secara statistik menunjukkan tidak ada perbedaan (p>0.05)
dalam mempertahankan motilitas spermatozoa kucing antara ketiga pengencer
yang digunakan untuk setiap waktu pengamatan ataupun sampai dengan jam ke
60 penyimpanan (Tabel 4). Tidak berbedanya hasil penelitian ini secara statistik,
kemungkinan karena sangat bervariasinya kemampuan spermatozoa dari setiap
individu kucing dalam mempertahankan kualitas semen, selain itu jumlah kucing
dan ulangan yang digunakan terlalu sedikit.
Sampai dengan jam ke 24, hasil penelitian ini sama dengan yang
dilaporkan oleh Filliers et al. (2008), dimana pada penelitiannya persentase
sitrat adalah 49.60 ± 15.90%. Pada penelitian ini persentase motilitas pada jam
ke 24 adalah antara 46.48 ± 16.04% (TTKT) sampai dengan 50.56 ± 18.87%
(TFTKT), tetapi pada penyimpanan selanjutnya ternyata penurunan kualitas
semen cair pada penelitian ini sangat cepat, sedangkan penelitian Filliers et al.
(2008) kualitasnya bertahan lebih lama karena sampai dengan hari ke 10 (240
jam) masih ada 19.30 ± 9.30% spermatozoa yang masih bergerak progresif. Nilai
ini sangat akurat mengingat penilaian dilakukan menggunakan Computer
Assisted Semen Analyzer (CASA).
Hasil penelitian ini juga termasuk rendah, karena Siemieniuch dan Dubiel
(2007) melaporkan pada hari ke 3 (72 jam) penyimpanan, persentase motilitas
spermatozoa kucing masih 52.50 ± 13.80%. Perbedaan kualitas tersebut
kemungkinan karena sumber semen, teknik koleksi dan bahan pengencer yang
digunakan berbeda. Pada penelitian ini, semen dikoleksi menggunakan
elektroejakulator sedangkan Siemieniuch dan Dubiel (2007) menggunakan
spermatozoa dari epididimis yang dipreservasi menggunakan bahan pengencer
Tris glukosa kuning telur. Baran et al. (2009), melaporkan nilai motilitas yang
sangat tinggi yaitu 75.50 ± 5.82% pada jam ke 24, dengan teknik koleksi yang
sama yaitu menggunakan elektroejakulator, tetapi menggunakan kombinasi
pengencer Tris glukosa kuning telur susu skim dan taurin. Pemberian taurin
tampaknya mampu mempertahankan kualitas semen kucing lebih baik, terbukti
dari laporan peneliti tersebut jika tanpa taurin dengan pengencer yang sama,
pada jam ke 24 hanya menunjukkan nilai motilitas sebesar 66.25 ± 12.86%.
Tabel 4 Motilitas spermatozoa kucing domestik pada penyimpanan suhu 5 °C
Pengamatan
Secara deskriptif pengencer yang mengandung fuktosa dan trehalosa
menunjukkan motilitas yang paling tinggi setelah 60 jam penyimpanan. Hal ini
dapat dipahami karena pada pengencer tersebut mengandung dua macam
karbohidrat yaitu fruktosa dan trehalosa, dimana fruktosa merupakan sumber
energi untuk spermatozoa sedangkan trehalosa melindungi membran plasma
dari cold shock. Hal ini juga didukung dengan tekanan osmotik dari pengencer
TFTKT sebesar 217 mOsm/kg yang mendekati tekanan osmotik spermatozoa
kucing. Menurut Luvoni (2006), tekanan osmotik pada semen segar kucing yaitu
antara 290 sampai 320 mOsm/kg. Pengencer TFKT dan TTKT menunjukkan
tekanan osmotik yang lebih rendah yaitu 187 dan 167 mOsm/kg. Tekanan
osmotik ini sangat penting dalam mempertahankan keutuhan membran, karena
itu spermatozoa memerlukan lingkungan yang bersifat isotonik. Spermatozoa
akan mengalami kebengkakan (swelling) jika dipaparkan pada larutan hipotonik,
akibat masuknya cairan dari bagian luar sel ke bagian dalam dan sebaliknya
akan mengalami penyusutan apabila berada pada lingkungan hipertonik (Luvoni
2006). Lingkungan isotonik untuk spermatozoa kucing yaitu memiliki tekanan
osmotik 290 sampai 320 mOsm/kg. Lingkungan dengan tekanan osmotik di
bawah 290 mOsm/kg menunjukkan lingkungan yag bersifat hipotonik sedangkan
lingkungan dengan tekanan osmotik di atas 320 mOsm/kg menunjukkan
lingkungan yang bersifat hipertonik bagi spermatozoa kucing.
Pada penelitian ini, pengencer TTKT memiliki nilai persentase motilitas
paling rendah karena didalamnya hanya mengandung trehalosa, akibatnya
spermatozoa menjadi kekurangan energi. Meskipun di dalam kuning telur juga
terdapat karbohidrat, namun pada penelitian ini tidak cukup menjadi sumber
energi bagi spermatozoa.
Gerakan individu spermatozoa pada SNI 01-4869.1-2005, dinyatakan
dengan nilai 0-4 sedangkan pada penelitian ini menggunakan nilai 0-5 (Howard
et al. 1990; Axnér et al. 2004; Zambelli & Cunto 2006 ). Gerakan individu
spermatozoa pada penelitian ini menunjukkan nilai yang sama secara deskriptif
ataupun secara statistik. Gerakan individu menurun sejalan dengan waktu
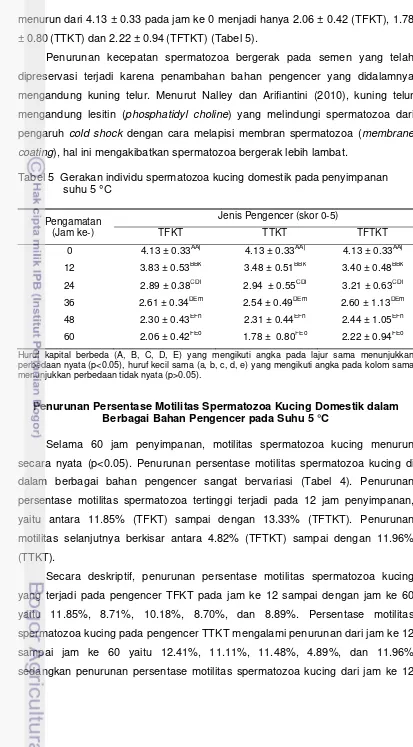
penyimpanan (p<0.05). Pada penyimpanan jam ke 0, nilai kecepatan
spermatozoa bergerak adalah 4.13 menurun menjadi antara 3.40 (TFTKT)
sampai dengan 3.83 (TFKT) pada jam ke 12. Penurunan selanjutnya juga terlihat
pada jam ke 24 penyimpanan dengan nilai 2.89 (TFKT) sampai dengan 3.21
menurun dari 4.13 ± 0.33 pada jam ke 0 menjadi hanya 2.06 ± 0.42 (TFKT), 1.78
± 0.80(TTKT) dan 2.22 ± 0.94(TFTKT) (Tabel 5).
Penurunan kecepatan spermatozoa bergerak pada semen yang telah
dipreservasi terjadi karena penambahan bahan pengencer yang didalamnya
mengandung kuning telur. Menurut Nalley dan Arifiantini (2010), kuning telur
mengandung lesitin (phosphatidyl choline) yang melindungi spermatozoa dari
pengaruh cold shock dengan cara melapisi membran spermatozoa (membrane
coating), hal ini mengakibatkan spermatozoa bergerak lebih lambat.
Tabel 5 Gerakan individu spermatozoa kucing domestik pada penyimpanan suhu 5 °C
Huruf kapital berbeda (A, B, C, D, E) yang mengikuti angka pada lajur sama menunjukkan perbedaan nyata (p<0.05), huruf kecil sama (a, b, c, d, e) yang mengikuti angka pada kolom sama menunjukkan perbedaan tidak nyata (p>0.05).
Penurunan Persentase Motilitas Spermatozoa Kucing Domestik dalam Berbagai Bahan Pengencer pada Suhu 5 °C
Selama 60 jam penyimpanan, motilitas spermatozoa kucing menurun
secara nyata (p<0.05). Penurunan persentase motilitas spermatozoa kucing di
dalam berbagai bahan pengencer sangat bervariasi (Tabel 4). Penurunan
persentase motilitas spermatozoa tertinggi terjadi pada 12 jam penyimpanan,
yaitu antara 11.85% (TFKT) sampai dengan 13.33% (TFTKT). Penurunan
motilitas selanjutnya berkisar antara 4.82% (TFTKT) sampai dengan 11.96%
(TTKT).
Secara deskriptif, penurunan persentase motilitas spermatozoa kucing
yang terjadi pada pengencer TFKT pada jam ke 12 sampai dengan jam ke 60
yaitu 11.85%, 8.71%, 10.18%, 8.70%, dan 8.89%. Persentase motilitas
spermatozoa kucing pada pengencer TTKT mengalami penurunan dari jam ke 12
sampai jam ke 60 yaitu 12.41%, 11.11%, 11.48%, 4.89%, dan 11.96%
sampai dengan jam ke 60 pada pengencer TFTKT yaitu 13.33%, 6.11%, 9.63%,
4.82%,dan 6.48% (Gambar 2).
Spermatozoa menggunakan energi yang didapatkan dari proses
metabolisme untuk bertahan hidup dan melakukan aktifitasnya selama
penyimpanan (Nazlie 2004). Selama proses penyimpanan, akan terjadi
penurunan persentase motilitas dari spermatozoa yang diakibatkan oleh
akumulasi sisa dari metabolisme spermatozoa itu sendiri. Bersamaan dengan
lamanya waktu penyimpanan, kebutuhan energi yang tersedia pada bahan
pengencer akan semakin berkurang sedangkan asam laktat sebagai sisa
metabolisme akan semakin bertambah. Asam laktat merupakan sisa
metabolisme dari spermatozoa. Senyawa ini juga menurunkan pH, rendahnya pH
pengencer dapat menjadi toksik bagi spermatozoa dan dapat merusak enzim
metabolisme spermatozoa tersebut (Eriani et al. 2008).
11.85
Gambar 3 Penurunan motilitas spermatozoa kucing domestik pada
... penyimpanansuhu 5 °C.
Selain diakibatkan oleh akumulasi sisa metabolisme, selama preservasi
akan terjadi peroksidasi lipid berupa reactive oxygen species (ROS) yang juga
merupakan penyebab turunnya motilitas spermatozoa (Soeradi 2004). Menurut
Fraser (2004), ROS dapat meningkatkan kerusakan DNA, akibat kerusakan DNA
yang tinggi menyebabkan turunnya motilitas dan fertilitas dari spermatozoa
(Eriani et al. 2008).
Penurunan motilitas spermatozoa selama penyimpanan terjadi akibat
banyaknya jumlah spermatozoa yang mati, spermatozoa yang mati
mengeluarkan suatu substansi yang toksik bagi spermatozoa yang masih hidup.
terkandung di dalam bahan pengencer yang telah mengalami oksidasi akibat
proses penyimpanan. Toksik yang terbentuk dapat merusak keutuhan membran
plasma spermatozoa. Spermatozoa yang telah mengalami kerusakan membran
plasma akan terganggu kemampuan metabolismenya sehingga motilitas
spermatozoa tersebut mengalami penurunan dan akhirnya mengalami kematian
(Yulnawati & Setiadi 2005).
Berdasarkan hasil penelitian ini, semen cair kucing dalam tiga macam
bahan pengencer (Tabel 2) dapat digunakan untuk tujuan inseminasi sampai
dengan jam ke 36 penyimpanan pada TFTKT dan jam ke 24 penyimpanan pada
TFKT dan TTKT. Hal ini didasari oleh ketentuan SNI 01-4869.1-2005 yang
menyatakan bahwa spermatozoa yang boleh digunakan untuk keperluan
inseminasi yaitu spermatozoa dengan nilai motilitas minimal 40%. Spermatozoa
yang memiliki nilai motilitas di bawah 40% masih dapat digunakan untuk
inseminasi dengan cara menggandakan volume IB. Selain itu, spermatozoa
dengan motilitas di bawah 40% dapat digunakan untuk In Vitro Fertilization (IVF)
Simpulan
Dari hasil penelitian ini dapat disimpulkan bahwa secara deskriptif,
pengencer TFTKT merupakan pengencer yang paling baik dalam
mempertahankan motilitas spermatozoa kucing domestik, sedangkan secara
statistik tidak terdapat perbedaan antara ketiga bahan pengencer dalam
mempertahankan motilitas spermatozoa kucing domestik pada suhu 5 °C.
Saran
Semen cair kucing domestik yang diencerkan menggunakan TFTKT dan
dipreservasi pada suhu 5 °C dapat digunakan untuk inseminasi sampai jam ke
36 penyimpanan. Penelitian lanjutan mengenai penggunaan TFTKT sebagai
Aboagla EME, Terada T. 2003. Trehalose-enhanced fluidity of the goat sperm
membrane and its protection during freezing. Biol Reprod 69:1245-1250.
Aboagla EME, Terada T. 2004. Effects of egg yolk during the freezing step of
cryopreservation on the viability of goat spermatozoa. Theriogenology
62:1160-1172.
Arifiantini RI, Supriatna I, Aminah. 2007. Kualitas semen beku kuda dalam pengencer susu skim dan dimitropoulos dengan dimetilformamida sebagai
krioprotektan. Media Peternakan 30:100-105.
Arifiantini RI, Puwantara B, Yusuf TL, Sajuthi D. 2009. Peranan fruktosa,
rafinosa, dan trehalosa pada kriopreservasi semen kuda. Media
Peternakan 32:171-178.
Ario A. 2010. Panduan Lapang Kucing-Kucing Liar Indonesia. Jakarta: Yayasan
Obor Indonesia.
Axnér E, Linde-Forsberg C. 2002. Semen collection and assessment and artificial insemination in the cat. Uppsala: Department of Obstetrics and Gynecology, Swedish University of Agricultural Sciences.
Axnér E, Hermansson U, Linde-Forsberg C. 2004. The effect of equex STM paste and sperm morphology on post thaw survival of cat epididymal
spermatozoa. Anim Reprod Sci. 84:179-191.
Baran A, Bacinoğlu S, Evecen M, Şahin BE, Alkan S, Demir K, Kemal AK, İleri
İK. 2004. Freezing of cat semen in straw with different glycerol levels
containing tris extender. Turk J Vet Anim Sci 28:545-552.
Baran A, Demir K, Sahin BE, Evecen M, Bacinoglu S, Alkan S, Ileri IK. 2009. Short-term chilled storage of cat semen extended with and without taurine
containing milk extenders. J Anim Vet Adv 8:1367-1371.
Barth AD, Oko RJ. 1989. Abnormal Morphology of Bovine Spermatozoa. Iowa:
Iowa State University Press.
Boddie GF. 1962. Diagnostic Methods in Veterinary Medicine. Philadelphia: J.B.
Lippincott Company.
Edwards A. 2005. Cat Breeds & Cat Care.London: Hermes House.
Eriani K, Boediono A, Djuwita I, Sumarsono SH, Al-azhar. 2008. Development of
domestic cat embryo produced by preserved sperms. J Biosciences
15:155-160.
Eldredge DM, Carlson DG, Carlson LD, Giffin JM. 2008. Cat Ownwer’s Home
Veterinary Handbook. Ed ke-3. Hoboken: Howell Book House.
Filliers M, Rijsselaere T, Bossaert P, De Causmaecker V, Dewulf J, Pope CE, Van Soom A. 2008. Computer-assisted sperm analysis of fresh epididymal cat spermatozoa and the impact of cool storage (4 °C) on sperm quality.
Theriogenology 70:1550-1559.
Foss MA, Stewart N, Swift J. 2008. Cat Anatomy and Physiology. Washington:
Fraser L. 2004. Structural damage to nuclear DNA in mammalian spermatozoa:
its evaluation techniques and relationship with male infertility. Polish J Vet
Sci 7:311-321.
Ganán N, Gomendio M, Roldan ERS. 2009. Effects of storage of domestic cat (Felis catus) epididymides at 5 °C on sperm quality and cryopreservation.
Theriogenology 72:1268-1277.
Ganiswara SG. 1995. Famakologi dan Terapi.Ed ke-4. Jakarta: Gaya Baru.
Howard JG, Brown JL, Bush M, Wildt DE. 1990. Teratospermic and normospermic domestic cats: ejaculate traits, pituitary-gonadal hormones, and improvement of spermatozoa motility and morphology after swim-up
processing. J Androl 11:204-215.
Hunter RFH. 1980. Physiology and Technology of Reproduction in Female
Domestic Animals. London: Academic Press.
Isnaini N, Suyadi S, Luqman H, Susilawati T. 2005. Trehalose reduces sperm membrane damage during cold strorage of boer goat semen. http://alumni-network.de/conference/viewabstract.php?id=174&cf=37 [23 Maret 2011].
Junaidi A. 2006. Reproduksi dan Obstetri pada Anjing.Yogyakarta: Gajah Mada
University Press.
Kostaman T, Sutama IK. 2006. Studi motilitas dan daya hidup spermatozoa
kambing boer pada pengencer tris-sitrat-fruktosa. J Sain Vet 24:58-63.
LaBruna D. 2001. Introduce spesies summary project domestic cat (Felis catus).
http://www.columbia.edu/itc/cerc/danoffburg/invasion_bio/inv_spp_summ/F elis_catus.html. [7 Juli 2011].
Laing JA. 1979. Fertility and Infertility in Domestic Animal.Ed ke-3. London: The
English Language Book Society and Bailliere Tindall.
Luvoni GC. 2006. Gamete cryopreservation in the domestic cat. Theriogenology
66:101-111.
Malandain E. 2005. Artificial insemination in cat. In: Reproduction in Companion,
Exotic and Laboratory Animal. Proceeding; Nantes, 12-17 September 2005. Nantes: Royal Canin, Aimargues, France. hlm 25.1-25.6.
Martin RJ. 1989. Small Animal Therapeutics. London: Wiley-Blackwell.
Nalley WMM, Arifiantini RI. 2010. Penggunaan berbagai jenis kuning telur ayam dalam pengencer tris terhadap kualitas semen cair domba lokal. Di dalam:
Peranan Teknologi Reproduksi dalam Rangka Swasembada Pangan Nasional. Prosiding Seminar Nasional; Bogor, 6-7 Oktober 2010. Bogor: Bagian Reproduksi dan Kebidanan, Departemen Klinik, Reproduksi dan Patologi, Fakultas Kedokteran Hewan, IPB. hlm 50-52.
Nazlie CS. 2004. Kajian kualitas spermatozoa kucing asal epididymis dan duktus deferens setelah proses preservasi pada suhu 4 °C [tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Noakes DE, Parkinson TJ, England GCW, editor. 2001. Arthur's Veterinary Rep-
roduction and Obstetrics. Ed. ke-8. Philadelphia: Elsivier Limited.
Park JE, Graham JK. 1992. Effect of cryopreservation procedur on sperm
Platz CC, Wildt DE, Seager SWJ. 1978. Pregnancy in the domestic cat after
artificial insemination with previously frozen spermatozoa. J Reprod Fert
52:279-282.
Plumb DC. 2005. Veterinary Drug Handbook.Ed ke-5. Ames: PharmaVet.
Siemieniuch M, Dubiel A. 2007. Preservation of tom cat (Felis catus) semen in
variable temperatures. Anim Reprod Sci 99:135-144.
Soeradi O. 2004. Radikal bebas pada pria infertil. Di dalam: Paradigma Terkini
Genetika dan Reproduksi. Jakarta: Departemen Biologi Kedokteran, Fakultas Kedokteran, UI. hlm 95-101.
Steel RGD, JH Torrie. 1995. Prinsip dan Prosedur Statistika. B Sumantri,
penerjemah. Jakarta: Gramedia.
Suwed MA, Budiana NS. 2009. Membiakkan Kucing Ras. Depok: Penebar
Swadaya.
Thuwanut P. 2010. Role of oxidative stress and antioxidants in domestic and non-domestic cat spermatozoa: with special reference to cryopreservation [thesis]. Uppsala: Doctoral Thesis, Swedish University of Agricultural Sciences.
Wicaksono A, Arifiantini RI. 2009. Uji banding empat bahan pengencer untuk
preservasi semen anjing retriver. Jurnal Ilmu Ternak Dan Veteriner
14:50-57.
Yildiz C, Kaya A, Aksoy M, Tekeli T. 2000. Influence of sugar supplementation of the extender on motility, viability and acrosomal integrity of dog
spermatozoa during freezing. Theriogenology 54:579-585.
Yulnawati, Setiadi MA. 2005. Motilitas dan keutuhan membrane plasma spermatozoa epididimis kucing selama penyimpanan pada suhu 4 °C.
Media Kedokteran Hewan 21:100-104.
Zambelli D, Cunto M. 2006. Semen collection in cats: techniques and analysis.
Theriogenology 66:159-165.
Zambelli D, Cunto M, Prati F, Merlo B. 2007. Effects of ketamine or medetomidine administration on quality of electroejaculated sperm and on
Yolk Extender Supplemented with Several Carbohydrate at 5 °C. Supervised by R. IIS ARIFIANTINI and BUDHY JASA WIDYANANTA.
The quality of chilled semen depends on the diluents composition; including the energy source for the survival of sperm. Glucose, fructose and lactose are the most widely used energy source for mammalian semen preservation. This study aims to evaluate the effect of fructose and/or trehalose suplementation in Tris Egg Yolk Extender to maintain the motility of domestic cat’s sperm at 5 °C. Semen was collected from three sexually mature cats by electro-ejaculator (three repetition n = 9). Immediately after collection, semen was evaluated macroscopically and microscopically. The semen showed > 70% sperm motility divided into three tubes and each of them diluted with Tris fructose egg yolk (TFEY), Tris trehalose egg yolk (TTEY) or Tris fructose trehalose egg yolk (TFTEY). Semen was stored at 5 °C and observed for percentage of sperm motility and individual progressive movements (scoring) every 12 hours until 60 hours of storage. Descriptively the results showed that TFTEY was the best diluents in maintained the motility of cat’s sperm (29.63 ± 18.76%) after 60 hours storage, but no significantly difference (P>0.05) was found between three diluents in maintained the sperm motility at 5 °C statistically. For individual progressive movements descriptive as well as statistically indicated no significant between three diluents which were 2.06 ± 0.42, 2.06 ± 0.42 and 2.22 ± 0.94 in TFEY, TTEY and TFTEY respectively.
dalam Pengencer Tris Kuning Telur yang Disuplementasi Beberapa Karbohidrat pada Suhu 5 °C. Dibimbing oleh R. IIS ARIFIANTINI dan BUDHY JASA WIDYANANTA.
Kualitas semen cair bergantung dengan komposisi bahan pengencer yang digunakan, diantaranya adalah harus mengandung sumber energi untuk kelangsungan hidup spermatozoa. Sumber energi yang biasa digunakan untuk preservasi semen mamalia yaitu glukosa, fruktosa dan laktosa. Penelitian ini bertujuan menguji penambahan fruktosa dan/atau trehalosa ke dalam bahan pengencer Tris kuning telur dalam mempertahankan motilitas spermatozoa kucing domestik pada suhu 5 °C. Semen dikoleksi menggunakan elektroejakulator dari tiga ekor kucing domestik dewasa kelamin dengan tiga kali pengulangan (n=9). Semen dievaluasi secara makroskopis dan mikroskopis. Semen dengan persentase motilitas spermatozoa > 70% dibagi menjadi tiga bagian yang masing-masing diencerkan dengan Tris fruktosa kuning telur (TFKT), Tris trehalosa kuning telur (TTKT) atau Tris fruktosa trehalosa kuning telur (TFTKT). Semen cair ini kemudian disimpan pada suhu 5 °C dan diamati motilitas serta gerakan individunya setiap 12 jam. Pengamatan dilakukan selama 60 jam. Hasil penelitian menunjukkan bahwa secara deskriptif, pengencer TFTKT merupakan pengencer yang paling baik dalam mempertahankan motilitas spermatozoa (29.63 ± 18.76%) setelah 60 jam penyimpanan, sedangkan secara statistik tidak terdapat perbedaan antara ketiga bahan pengencer dalam mempertahankan motilitas spermatozoa pada suhu 5 °C. Selain itu, gerakan individu kucing domestik pada masing-masing pengencer setelah 60 jam penyimpanan juga tidak menunjukkan perbedaan yang nyata, baik secara deskriptif ataupun secara statistik. Nilai gerakan individu spermatozoa pada penelitian ini setelah 60 jam penyimpanan secara berturut-turut yaitu 2.06 ± 0.42, 2.06 ± 0.42 dan 2.22 ± 0.94.
Latar Belakang
Sekitar awal tahun 1900 terdapat 230 spesies kucing namun saat ini hanya
terdapat kurang dari 30 spesies (Edwards 2005). Penurunan jumlah spesies
kucing diakibatkan oleh perburuan yang dilakukan oleh manusia sehingga
banyak spesies yang mengalami kepunahan. Kucing memilki tiga genus yaitu
Phantera, Felis dan Acinonyx. Menurut Edwards (2005), ketiga genus ini memiliki
hubungan erat, namun yang dapat dipastikan adalah kucing domestik yang saat
ini banyak terdapat di lingkungan sekitar kita berasal dari genus Felis.
Perkembangbiakkan kucing dari genus Phantera dan Acinonyx tergolong
sulit. Keadaan ini menyebabkan terjadinya ketidakseimbangan jumlah kelahiran
dan kematian kucing dari genus Phantera dan Acinonyx. Karena itu, penelitian
mengenai aspek reproduksi pada kucing tersebut perlu dikembangkan.
Permasalahannya adalah sulit dilakukan penelitian pada kucing yang hampir
punah, selain karena jumlahnya yang terbatas juga sulit untuk memberi
perlakuan pada kucing di alam liar atau penangkaran. Karena alasan tersebut,
kucing domestik digunakan sebagai hewan model untuk melakukan penelitian
mengenai aspek reproduksi pada kucing non domestik (Ganán et al. 2009).
Salah satu teknik reproduksi yang perlu dikembangkan adalah teknik
Inseminasi Buatan (IB). Ketika perkawinan secara alamiah sulit dilakukan atau
ketika hewan jantan dan betina berada pada lokasi yang terpisah, teknik IB perlu
dilakukan. Teknik ini akan membantu dalam konservasi kucing-kucing non
domestik yang berada di ambang kepunahan.
Keberhasilan teknik IB tidak hanya bergantung pada kualitas dan kuantitas
semen yang diejakulasikan oleh seekor jantan tetapi juga bergantung pada
kemampuan dalam mempertahankan kualitasnya secara in vitro. Salah satu
faktor yang akan mempengaruhi kualitas semen in vitro adalah bahan pengencer
yang ditambahkan pada semen saat preservasi (Wicaksono & Arifiantini 2009).
Bahan pengencer yang baik harus dapat menyediakan nutrisi bagi spermatozoa
selama penyimpanan, melindungi spermatozoa dari cold shock, bersifat buffer
untuk mencegah perubahan pH, mempertahankan tekanan osmotik dengan cara
menyediakan lingkungan yang isotonik, mengandung antibiotik untuk mencegah
timbulnya bakteri, dan menyediakan lingkungan yang baik untuk berlangsungnya
Karbohidrat merupakan komponen penting yang harus ada di dalam bahan
pengencer. Sumber karbohidrat yang umum digunakan untuk semen cair kucing
diantaranya adalah glukosa (Axnér et al. 2004), fruktosa (Baran et al. 2004;
ganán et al. 2009) dan laktosa (Axnér & Linde-Forsberg 2002). Penelitian
mengenai preservasi semen kucing telah banyak dilaporkan. Bahan pengencer
yang digunakan diantaranya adalah buffer Tris dengan fruktosa (Baran et al.
2004; Ganán et al. 2009), Tris dengan glukosa (Axnér et al. 2004) dan Tris
dengan laktosa (Axnér & Linde-Forsberg 2002).
Trehalosa merupakan karbohidrat golongan disakarida bersifat membran
stabilisator (Isnaini et al. 2005) yang memiliki kemampuan lebih untuk melindungi
spermatozoa dalam proses pembekuan sehingga kualitas spermatozoa dapat
bertahan lebih lama (Yildiz et al. 2000). Selain itu, karbohidrat ini juga berfungsi
sebagai krioprotektan ekstraseluler (Arifiantini et al. 2009) dengan cara
memperbaiki fluiditas membran plasma spermatozoa (Aboagla & Terada 2003).
Mengingat fungsi trehalosa sebagai membran stabilisator dan saat preservasi
pada suhu 5 °C spermatozoa akan mengalami cold shock, maka perlu dilakukan
penelitian mengenai penggunaan trehalosa pada bahan pengencer Tris kuning
telur dalam upaya penyediaan semen cair untuk inseminasi pada kucing.
Tujuan Penelitian
Penelitian ini bertujuan menguji penambahan fruktosa dan/atau trehalosa
ke dalam bahan pengencer Tris kuning telur dalam mempertahankan motilitas
spermatozoa kucing domestik pada suhu 5 °C.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberi informasi mengenai pengencer
yang baik untuk melakukan preservasi semen kucing domestik dengan harapan
Hipotesis
Bahan pengencer Tris kuning telur yang disuplementasi kombinasi fruktosa
dengan trehalosa merupakan bahan pengencer terbaik dibandingkan dengan
bahan pengencer Tris kuning telur yang disuplementasi fruktosa atau trehalosa
dalam mempertahankan persentase motilitas spermatozoa kucing domestik pada
Klasifikasi Kucing
Kucing termasuk ke dalam Famili Felidae dan terdiri dari tiga genus yaitu
Phantera, Felis dan Acinonyx. Pembagian genus ini bukan berdasarkan
perbedaan ukuran tubuh namun berdasarkan perbedaan anatomi tubuh mereka.
Kucing yang termasuk ke dalam genus Phantera merupakan kucing yang dapat
mengaum diantaranya singa dan harimau. Genus Felis merupakan genus dari
kucing domestik. Kucing yang termasuk ke dalam genus Phantera dan Felis
dapat menarik atau menyimpan kukunya saat tidak digunakan namun hal ini tidak
dapat dilakukan oleh kucing dari genus Acinonyx (Edwards 2005).
Kucing dari Genus Acinonyx merupakan kucing yang tidak dapat
menyimpan kukunya walaupun tidak sedang digunakan (Edwards 2005). Contoh
kucing dari genus Acinonyx adalah cheetah sehingga kucing ini tidak
meninggalkan jejak kuku di atas tanah. Semua kucing memiliki empat jari pada
kaki belakang dan lima jari pada kaki depan dengan ibu jari yang kecil. Pada
umumnya, kaki depan berukuran lebih besar daripada kaki belakang (Ario 2010 ).
Genus Felis memiliki beberapa spesies diantaranya Felis manul, Felis
sylvestris libyca (African wild cat) dan Felis sylvestris sylvestris (European wild
cat). Felis manul merupakan kucing berambut panjang sedangkan Felissylvestris
libyca dan Felis sylvestris sylvestris merupakan kucing berambut pendek. Felis
sylvestris libyca merupakan nenek moyang kucing domestik yang kemudian di
Indonesia disebut kucing lokal (Edwards 2005).
Kucing yang bukan berasal dari Felissylvestris libyca dapat disebut kucing
non domestik. Semua kucing yang ada di dunia memiliki bentuk tubuh yang mirip
dengan kucing domestik. Mereka juga memiliki jumlah gigi yang sama yaitu
28-30 gigi. Ciri-ciri yang membedakan kucing ini yaitu ukuran tubuh, panjang ekor,
pola warna, dan penyebarannya. Kucing non domestik memiliki ukuran tubuh
yang bervariasi. Ukurannya mulai dari seukuran kucing domestik hingga besar
seperti harimau dan macan tutul. Panjang ekor pun bervariasi, mulai dari ekor
sangat pendek sampai yang panjang ekornya melebihi panjang tubuh kucing itu
sendiri (Ario 2010).
Secara umum, jenis kucing yang termasuk ke dalam genus Felis dapat
dikelompokkan berdasarkan rambutnya, yaitu: short hair, medium hair dan long
dalam kelompok kucing short hair. Hal ini didukung dengan pernyataan Edwards
(2005) bahwa nenek moyang kucing domestik yaitu Felis sylvestris libyca yang
merupakan kucing berambut pendek. Kucing domestik dapat dilihat pada
Gambar 1.
Kucing telah mengalami domestikasi yang begitu sempurna dan mampu
berhubungan erat dengan manusia. Contoh kucing yang telah didomestikasi
yaitu Felis catus. Klasifikasi kucing ini menurut LaBruna (2001) yaitu:
Kingdom : Animalia
Filum : Chordata
Kelas : Mammalia
Ordo : Carnivora
Famili : Felidae
Genus : Felis
Spesies : Felis catus
Gambar 1 Kucing domestik.
Parameter Kesehatan Kucing
Pemeriksaan kucing secara umum dilakukan dengan cara inspeksi dan
adspeksi yaitu memeriksa dengan cara melihat, membau dan mendengarkan
tanpa alat bantu. Parameter yang diperiksa diantaranya frekuensi nadi, frekuensi
napas, suhu tubuh, warna dan kelembaban membran mukosa, ukuran dan