LUKMAN LA GIA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Aktivitas dan Stabilitas
Biosensor Glukosa Berbasis Escherichia coli yang Diimobilisasi pada
Zeolit-Glutaraldehida adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Desember 2012
ABSTRAK
LUKMAN LA GIA. Aktivitas dan Stabilitas Biosensor Glukosa Berbasis
Escherichia coli yang Diimobilisasi pada Zeolit-Glutaraldehida. Dibimbing oleh
DYAH ISWANTINI PRADONO, NOVIK NURHIDAYAT, dan TRIVADILA.
Biosensor glukosa berbasis Escherichia coli hingga saat ini telah
dikembangkan. Pengembangan ini memiliki beberapa kelemahan, yaitu aktivitas glukosa dehidrogenase (GDH) dan stabilitas elektrode rendah. Penggunaan zeolit pada biosensor dapat meningkatkan aktivitas enzim, sedangkan penggunaan glutaraldehida (GA) sebagai bahan taut-silang dapat meningkatkan stabilitas elektrode. Perancangan percobaan optimisasi dilakukan menggunakan metode permekaan respons (RSM). Kondisi optimum aktivitas biosensor ini ialah suhu 30
o
C, pH 6, konsentrasi glukosa 15 mM, konsentrasi pirolokuinolina kuinon (PQQ)
3.5 µM, zeolit 150 mg/mL, dan konsentrasi GA 14.05%. GDH sel E. coli
terimobilisasi dapat mendeteksi konsentrasi glukosa hingga 50 mM. Reaksi
kinetika GDH sel E. coli terimobilisasi mengikuti persamaan Lineweaver-Burk.
Nilai KM appdan Imaks app biosensor ini secara berturut-turut adalah 2.69 mM dan
3.73 µA. Aktivitas GDH sel bakteri relatif stabil sebesar 70–80% selama 4 hari.
Oleh karena itu, penggunaan zeolit-GA sebagai matriks imobilisasi dapat
meningkatkan aktivitas GDH sel bakteri E. coli yang relatif stabil.
Kata kunci: biosensor glukosa, Escherichia coli, glutaraldehida, zeolit.
ABSTRACT
LUKMAN LA GIA. Activity and Stability of Glucose Biosensor Based on
Escherichia coli Immobilized on Zeolite-Glutaraldehyde. Supervised by DYAH
ISWANTINI PRADONO, NOVIK NURHIDAYAT and TRIVADILA.
Glucose biosensor based on Escherichia coli have been developed recently.
Despite of some drawbacks, such as the activity of glucose dehydrogenase (GDH) and the lower electrode stability. The use of zeolite in biosensors can increase the enzyme activity, while the use of glutaraldehyde (GA) as a cross-link can improve the electrode stability. The design optimization employed response surface
methods (RSM). The optimum conditions activity of GDH cells with E. coli
immobilized was at temperature 30 °C, pH 6, glucose 15 mM, pyrroloquinoline
quinone (PQQ) 3.5 μM, zeolite 150 mg/mL, and GA 14.05%. This biosensor was
able to detect up to 50 mM glucose concentration. The reaction kinetics followed
Lineweaver-Burk equation. KM app value and Imaks app GDH cells E. coli
immobilized in a row is 2.69 mM and 3.73 µA. The biosensor was relatively
stable at 70–80% for 4 days. Therefore, the use of zeolite-GA as an
immobilization matrix can enhance the activity of the stable bacterial cell of
GDH-E. coli.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Kimia
AKTIVITAS DAN STABILITAS BIOSENSOR GLUKOSA
BERBASIS
Escherichia coli
YANG DIIMOBILISASI PADA
ZEOLIT
-
GLUTARALDEHIDA
LUKMAN LA GIA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Aktivitas dan Stabilitas Biosensor Glukosa Berbasis Escherichia
coli yang Diimobilisasi pada Zeolit-Glutaraldehida
Nama : Lukman La Gia
NIM : G44080119
Disetujui oleh Pembimbing I
Prof Dr Dyah Iswantini Pradono, MScAgr NIP 19670730 1999103 2 001
Pembimbing II Pembimbing III
Dr Novik Nurhidayat Trivadila, SSi, MSi
NIP 19771029 200502 2 001
Diketahui oleh Ketua Departemen Kimia
Prof Dr Ir Tun Tedja Irawadi, MS NIP 19501227 197603 2 002
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala
karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Mei 2012 ini ialah biosensor, dengan
judul Aktivitas dan Stabilitas Biosensor Glukosa Berbasis Escherichia coli yang
Diimobilisasi pada Zeolit-Glutaraldehida.
Terima kasih penulis ucapkan kepada Ibu Prof Dr Dyah Iswantini Pradono, MScAgr, Bapak Dr Novik Nurhidayat dan Ibu Trivadila, SSi, MSi selaku pembimbing, serta Bapak La Eddy, Dirwan, Bapak Ammar, Raudhatul Fadhilah, Dian, Okik, Yuanita, Liyonawati, dan Dinie yang telah banyak memberi saran. Di samping itu, penghargaan penulis sampaikan kepada Ibu Ai dan Bapak Mail, staf Laboratorium Kimia Fisik, Ibu Dr Henny Purwaningsih selaku Kepala Laboratorium Bersama Kimia, Bapak Wawan dan Bapak Eko, staf Laboratoriun Bersama Kimia. Apresiasi juga penulis sampaikan kepada Ibu Neri, Ibu Erna, Ibu Ratih, dan Bapak Acun di Laboratorium Genetika Mikrobiologi, Puslit Biologi LIPI yang telah membantu selama pengumpulan data. Ungkapan terima kasih juga disampaikan kepada Pemda Halmahera Selatan atas beasiswa BUD IPB yang telah diberikan. Tak lupa pula, ungkapan terima kasih disampaikan kepada Ayah, Ibu, seluruh keluarga, dan Nurfajriana atas segala doa dan kasih sayangnya, serta teman-teman seperjuangan di mayor Kimia angkatan 2008.
Semoga karya ilmiah ini bermanfaat.
Bogor, Desember 2012
DAFTAR ISI
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN viii
PENDAHULUAN 1
TINJAUAN PUSTAKA 2
Biosensor 2
Glukosa Dehidrogenase 3
Escherichia coli 3
Zeolit 4
Glutaraldehida 5
Imobilisasi Enzim 5
Metode Voltammetri 6
METODE 7
Alat dan Bahan 7
Metode Penelitian 7
HASIL DAN PEMBAHASAN 9
Optimasi Aktivitas GDH Sel Bakteri E. coli Terimobilisasi 9
Kinetika GDH Sel Bakteri E. coli Terimobilisasi 10
Aktivitas dan Stabilitas GDH Sel E. coli Terimobilisasi 14
SIMPULAN DAN SARAN 16
Simpulan 16
Saran 16
DAFTAR PUSTAKA 16
LAMPIRAN 19
RIWAYAT HIDUP 27
DAFTAR GAMBAR
1 Ilustrasi tiga generasi perkembangan biosensor 2
2 Escherichia coli 4
3 Plot kontur hubungan antara faktor peubah bebas terhadap arus anode 12
4 Hubungan konsentrasi substrat glukosa dan aktivitas GDH 13
5 Alur Lineweaver-Burk GDH sel E. coli terimobilisasi 13
6 Voltammogram siklis GDH sel E. coli terimobilisasi 154
7 Stabilitas biosensor glukosa berbasis E. coli 145
DAFTAR LAMPIRAN
1 Bagan alir umum penelitian 19
2 Bagan alir pembutan media 20
3 Bagan alir kerja 21
4 Bagan alir elektrode pasta karbon dan imobilisasi 22
5 Hasil kombinasi faktor-faktor peubah bebas. 23
6 Hasil optimasi Aktivitas GDH Sel Bakteri E. coli Terimobilisasi 24
7 Kinetika enzim GDH sel bakteri E. coli terimobilisasi 25
PENDAHULUAN
Penyakit diabetes melitus (DM) disebabkan oleh timbulnya masalah dalam produksi dan suplai hormon insulin dalam tubuh (IDF 2009). Dewasa ini, penderita DM menggunakan biosensor sebagai alat pengukur gula darah. Umumnya digunakan enzim sebagai biosensor yang bekerja berdasarkan reaksi enzimatik. Biosensor adalah sensor yang mengombinasikan komponen hayati dengan komponen elektronik (transduser) yang mengubah sinyal dari komponen
hayati menjadi luaran yang terukur (Castillo et al. 2004; Witarto 2007).
Enzim memiliki peran yang penting dalam biosensor, tetapi harganya, serta
stabilitas dan aktivitas enzimnya rendah. Menurut Ohfuji et al. (2004),
mikroorganisme dapat digunakan sebagai biosensor glukosa. Mikrob penghasil enzim sebagai sensor untuk mengukur kadar glukosa ini merupakan alternatif baru (Trivadila 2006). Keuntungan sensor mikrob dibandingkan dengan sensor enzim adalah lebih tahan lama, lebih murah karena tidak diperlukan isolasi dan
pemurnian enzim aktif, serta lebih stabil (Iswantini et al. 2011).
Biosensor pertama kali dikembangkan oleh Leland Clark (1956). Enzim glukosa oksidase (GOD) yang digunakan Clark mekanisme kerjanya bergantung pada keberadaan oksigen. Akibatnya, alat pengukur ini dapat memberikan hasil yang berbeda dari individu yang sama. Hal tersebut mendorong penggantian enzim GOD dengan enzim glukosa dehidrogenase (GDH). Enzim GDH spesifik terhadap substrat glukosa dan aktivitasnya tidak dipengaruhi oleh kadar oksigen. Enzim pirolokuinolina kuinon glukosa dehidarogenase (PQQGDH) merupakan alternatif baru yang digunakan sebagai komponen pengenal analit pada biosensor glukosa. Struktur kristal PQQ diketahui merupakan gugus prostetik enzim GDH. Menurut Witarto (2007), enzim PQQGDH yang berasal dari bakteri Gram negatif
seperti Escherichia coli dapat mengatalisis reaksi redoks glukosa dan dianggap
memenuhi syarat biosensor.
Penggunaan mikrob sebagai penghasilan enzim, yaitu E. coli KRGL dan
Bacillus subtilis KRGS. E. coli telah diketahui menghasilkan GDH-A. Enzim
PQQGDH-A telah dimanfaatkan dan diaplikasikan sebagai biosensor glukosa
(Iswantini et al. 2011). Aktivitas GDH yang dihasilkan oleh sel bakteri E. coli
KRGS terbesar dibandingkan dengan B. subtilis KRGL baik dengan metode
spektrofotometri maupun metode elektrokimia (Trivadila 2006).
Penelitian tentang penggunaan zeolit untuk sensor telah dilakukan. Balal et
al. (2009) melaporkan bahwa elektrode pasta karbon yang termodifikasi zeolit Y
dengan mediator Fe3+ dapat menghasilkan arus yang lebih tinggi serta sensitivitas,
selektivitas, dan kestabilan yang tinggi. Penggunaan glutaraldehida (GA) sebagai bahan taut-silang dengan enzim juga sangat populer pada biosensor. Teknik imobilisasi dengan taut-silang GA dapat meningkatkan stabilitas dan sensitivitas
biosensor (Othman et al. 2006; Goriushkina et al. 2010). Keuntungan
menggunakan GA ialah harganya relatif murah dan lazim digunakan secara
komersial (Mateo et al. 2004). Penelitian yang telah dilakukan, penggunaan GA
sebagai bahan taut-silang sel E. coli diimobilisasi pada permukaan elektrode pasta
karbon dapat meningkatkan aktivitas dan stabilitas GDH pada biosensor glukosa
sebesar 68% (Hapsari 2011). Hingga saat ini, penelitian biosensor berbasis E. coli
elektrode kerja yang rendah. Oleh karena itu, penelitian ini menggunakan zeolit untuk meningkatkan aktivitas enzim dan GA sebagai bahan biofungsional yang dapat meningkatkan kestabilan biosensor glukosa.
Penelitian ini bertujuan menentukan aktivitas dan stabilitas enzim GDH
yang dihasilkan oleh isolat bakteri E. coli ATCC25922 yang diimobilisasi pada
zeolit-GA.
TINJAUAN PUSTAKA
Biosensor
Biosensor didefinisikan sebagai suatu kesatuan turunan dari sensor kimia yang menggabungkan unsur hayati dengan transduser atau kombinasi reseptor senyawa biologi dan transduser fisik atau fisiokimia. Komponen pengenal hayati sebuah biosensor berinteraksi secara interaktif dan selektif terhadap analat, sedangkan transduser mengubah respon hayati menjadi sinyal yang dapat diukur
sebagai sinyal dari biosensor (Castilo et al. 2004; Rana et al. 2010).
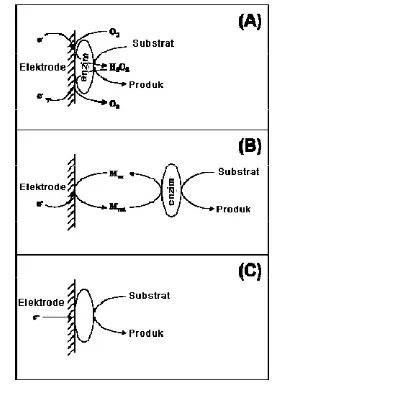
Perkembangan biosensor dibagi menjadi tiga generasi, yaitu: biosensor generasi pertama, kedua dan ketiga (Gambar 1). Biosensor generasi pertama melibatkan oksigen dalam pengukuran. Elektrode yang digunakan adalah elektrode oksigen. Reaksi redoks yang terjadi, melibatkan oksigen dan enzim diantaranya ialah oksigenase dan oksidase. Kelemahan dari biosensor generasi pertama ialah data yang dihasilkan tidak akurat karena pengaruh oksigen bebas dari lingkungan. Biosensor generasi kedua merupakan generasi biosensor yang menggunakan mediator untuk menghubungkan reaksi oksidasi substrat dengan elektrode. Sedangkan biosensor generasi ketiga mulai meningkatkan integrasi mediator dengan elektrode (Liu dan Wang 2000).
Perancangan biosensor yang lebih inovatif terus dilakukan karena memiliki
kelemahan, yaitu tidak dapat digunakan secara berulang, daya variasi kurang tinggi, waktu respon yang relatif rendah, rentang linear sempit, sensitivitas rendah
dan kurang stabil serta presisi dan deteksi yang masih rendah (Wang et al. 2008).
Biosensor glukosa merupakan salah satu dari aplikasi biosensor yang berkembang dengan cepat bahkan telah dimanfaatkan secara komersial (Fiorito dan Torresi
2001; Castillo et al. 2004). Biosensor glukosa pertama kali dikembangkan pada
tahun 1956 oleh Leland Clark, seorang ahli fisiologi dan biokimia dari Amerika Serikat. Saat itu Clark menggunakan enzim GOD yang spesifik terhadap glukosa
dan dapat dihasilkan secara alamiah dari jamur Aspergillus niger.
Perkembangan biosensor glukosa hingga sekarang telah diarahkan pada
penggunaan pengenal hayati menggunakan mikrob. Iswantini et al. (2011)
melakukan penelitian mengenai pemilihan bakteri asal Indonesia sebagai biosensor glukosa. Berdasarkan uji enzim GDH menggunakan metode
spektrofotometer dan elektrokimia, bakteri E. coli asal Indonesia dapat
dikembangkan sebagai biosensor glukosa.
Glukosa Dehidrogenase
Glukosa dehidrogenase (GDH) merupakan enzim yang aktif dalam pengambilan atom hidrogen dari substrat dan berperan dalam reaksi oksidasi langsung glukosa membentuk asam glukonat (Winarno 2010). Enzim GDH spesifik terhadap substrat glukosa dan aktivitasnya tidak dipengaruhi oleh kadar oksigen (Turner 2002). Kristal PQQ diketahui merupakan gugus prostetik enzim GDH. Pengikatan PQQ terhadap enzim GDH terjadi melalui interaksi polar. PQQGDH merupakan alternatif baru yang digunakan sebagai biosensor glukosa. PQQGDH sendiri ditemukan pada berbagai bakteri gram negatif. PQQGDH tidak dipengaruhi kadar oksigen, juga memiliki aktivitas yang tinggi. Menurut Witarto (2007), penggunaan enzim GDH dalam biosensor glukosa untuk merekayasa protein enzim PQQGDH sebagai alat ukur gula darah dapat mengunakan enzim PQQGDH-A dan PQQGDH-B sebagai komponen biosensor glukosa.
Escherichia coli
Escherichia coli (Gambar 2) termasuk dalam superdomain Phylogenetica,
filum Proteobacteria, kelas Gamma Proteobacteria, ordo Enterobacteriales,
genus Escherichia, dan spesies E. coli. Bakteri ini merupakan suatu organisme
yang tidak berbahaya, biasanya hidup didalam saluran usus manusia dan hewan
tingkat tinggi lainnya. Sel E. coli berukuran panjang 2 µm dan berdiameter
sedikitnya <1 µm.
Bakteri ini telah diketahui menghasilkan GDH-A. Enzim PQQGDH-A merupakan enzim yang dimanfaatkan dan diaplikasikan sebagai biosensor glukosa (Witarto 2007). Bakteri ini menghasilkan apo-GDH (enzim yang belum aktif) dan tidak memiliki kemampuan menghasilkan PQQ. Oleh karena itu, diperlukan penambahan PQQ dari luar untuk mengubah apo-GDH menjadi holo-GDH atau
Bakteri E. coli dapat dikembangkan sebagai biosensor glukosa karena menghasilkan serapan cahaya dan stabilitas arus yang baik dengan menggunakan metode spektrofotometer dan elektrokimia. Hasil ini, menunjukan bahwa penggunakan sel mikrob sebagai biosensor glukosa memiliki kemampuan yang sama dibandingkan dengan enzim murni. Metode ini dapat dikatakan lebih murah karena enzim aktif tidak perlu diisolasi dan dimurnikan. Penelitian terbaru, GDH
yang berasal dari E. coli dapat digunakan sebagai sel biodisel enzimatik dan
berpotensi sebagai biosensor glukosa (Iswantini et al. 2011). Bakteri E. coli telah
dikembangkan sebagai biosensor glukosa (Iswantini et al. 1998; Iswantini et al.
2000; Wang 2005; Iswantini et al. 2011), dan biosensor asam amino (Chalova
2009).
Zeolit
Zeolit merupakan kristal aluminasilika yang mendefinisikan struktur mikropori yang terbentuk pada permukaan luar partikel, mempunyai kapasitas pertukaran ion dan sifat-sifat selektivitas. Zeolit dapat dimanfaatkan dalam elektrokimia dengan merancang berbagai modifikasi elektrode zeolit. Modifikasi elektrode zeolit ini, dapat diaplikasikan dalam bidang sensor molekul, elektrokatalisis dan elektroanalisis. Sebagian besar penggunaan zeolit dalam elektroanalisis kimia lainnya diarahkan sebagai analisis voltametrik, aplikasi
biosensor dan lain-lain (Hawlaoui et al. 2008).
Zeolit yang digunakan pada penelitian ini berasal dari Bayah, Indonesia. Berdasarkan hasil karakterisasi, zeolit ini merupakan jenis klinoptilolit
[(Na,K,Ca)2-3Al3(Al,Si)2Si13O36.12(H2O)] dan merupakan salah satu jenis zeolit
dengan kandungan silikon tertinggi (Arif 2011). Nilai kapasitas tukar kation (KTK) dari zeolit ini adalah 48 cmol/kg, nilai ini lebih rendah dibandingkan
dengan nilai KTK pada zeolit sintetik yang berkisar antara 250–450 cmol/kg
(Ginting et al. 2007). Zeolit yang telah dikalsinasi digunakan sebagai matriks
pengimobilisasi peroksidase dan metilen hijau (Lui et al. 1999). Zeolit jenis NaY
digunakan sebagai matriks imobilisasi sitokrom c (Dai et al. 2004). Penggunaan
zeolit alam asli Indonesia sebagai matriks imobilisasi komponen pengenal hayati
biosensor antioksidan berbasis superoksida dismutase (SOD) Deinoccus
radiodurans dapat meningkatkan respons arus yang dihasilkan (Weniarti 2011).
Glutaraldehida
Glutaraldehida (GA) merupakan reagen biofungsional yang membentuk ikatan kovalen antara partikel biokatalitik atau protein. Oleh karena itu, imobilisasi enzim dengan GA sering digunakan untuk pengembangan biosensor berbasis enzim. Metode ini menghasilkan imobilisasi matriks tiga dimensi, dimana enzim terjebak dengan bahan elektrode, sehingga dapat meningkatkan
aktivitas enzim (Goriushkina et al.2010). GA dalam biosensor pada umumnya
digunakan sebagai agen taut-silang dengan enzim yang digunakan. Taut-silang enzim dengan GA menurut reaksi berikut:
Dalam kondisi taut-silang, molekul enzim teradsorpsi pada permukaan elektrode, polimer kehilangan kelarutan dan enzim tetap memiliki aktivitas biologisnya (Lapėnaitėet al. 2003).
Penggunaan teknik taut-silang dengan GA dikombinasikan dengan teknik imobilisasi lainnya, sehingga dapat meningkatkan stabilitas dan sensitivitas
biosensor (Goriushkina et al. 2010). Teknik ini dipengaruhi oleh konsentrasi GA
secara optimum. Agen taut-silang yang paling umum digunakan adalah GA kelompok aldehida yang bereaksi dengan gugus amina dari rantai samping protein. Keuntungan menggunakan GA sebagai reagen biofungsional, yaitu
harganya relatif murah dan sering digunakan secara komersial (Mateo et al. 2004).
Imobilisasi Enzim
Enzim terimobilisasi merupakan suatu enzim yang secara fisik maupun kimia tidak bebas bergerak sehingga dapat dikendalikan atau kapan enzim harus kontak dengan substrat. Proses ini dapat dilakukan secara fisik maupun kimia. Cara fisik merupakan cara yang tidak melibatkan pembentukan ikatan kovalen. Cara ini umumnya reversibel, yaitu enzim dapat kembali ke keadaan aslinya. Sedangkan cara kimia merupakan cara imobilisasi enzim yang melibatkan paling sedikit satu ikatan kovalen antara dua atau lebih residu enzim yang sejenis. Cara kimia menjadikan molekul ireversibel, yaitu enzim tidak dapat kembali ke keadaan aslinya (Winarno 2010).
Keuntungan enzim yang diimobilisasi dibandingkan dengan enzim bebas adalah dapat digunakan kembali, sesuai untuk aplikasi dalam operasi yang berkesinambungan, menghasilkan produk yang bebas enzim sehingga tidak perlu dilakukan proses lebih lanjut seperti penghilangan atau penginaktifan enzim, dan
peningkatkan stabilitas dari aktivitas enzim. Laurinavicius et al. (2004)
melakukan studi terhadap aktivitas enzim mGDH yang dimobilisasi dan tidak
diimobilisasi (native enzyme). Studinya menunjukkan bahwa imobilisasi m-GDH
menghasilkan sifat yang sangat berbeda dari sifat native enzyme. Imobilisasi
enzim meningkatkan selektivitas substrat, meningkatkan laju regenerasi pusat
2E-NH2 + HC-(CH2)3-CH E-NH-C-(CH2)3-C-NH-E
O
PQQ-GQH Glutaraldehida (GA) Kopolimer PQQ-GDH/GA
aktif dan laju pengikatan substrat mulai memberikan peran yang signifikan
terhadap keseluruhan proses (Laurinavicius et al. 2004).
Enzim kelompok redoks banyak digunakan dalam biosensor elektrokimia karena enzim ini dapat menghasilkan atau menggunakan elektron dalam mengkatalis suatu substrat menjadi produk, transfer elektron yang terjadi akan dideteksi (Grieshaber 2008). Ada beberapa pemasalahan yang muncul dalam penggunaan enzim pada biosensor, yaitu pemurnian, stabilisasi, dan selektivitas enzim serta inhibisi reduksi oleh medium atau produk. Salah satu metode desain dan optimalisasi biosensor yang dapat digunakan untuk menjaga kestabilan enzim adalah dengan melakukan imobilisasi enzim pada material yang berpori dan untuk
meningkatkan stabilitas dapat digunakan material nano (Mateo et al 2004).
Metode Voltammetri
Metode voltammetri merupakan metode elektroanalisis yang didasarkan pada pengukuran arus listrik sebagai fungsi perubahan potensial listrik dan diterapkan pada sel elektrolisis. Sel elektrolisis terdiri dari elektrode kerja, elektrode pembantu, dan elektrode pembanding (Wang 2001). Elektrode kerja merupakan tempat terjadinya reaksi oksidasi reduksi. Elektrode kerja yang umum digunakan adalah elektrode merkuri, karbon, dan logam mulia (Apriliani 2009). Elektrode pembanding merupakan suatu elektrode yang potensialnya diketahui dan selalu konstan selama pengukuran, serta tidak sensitif terhadap komposisi larutan yang dianalisis. Elektrode pembanding yang biasa digunakan adalah elektrode kalomel jenuh (SCE) dan elektrode perak/perak klorida (Ag/AgCl). Elektrode pembantu merupakan elektrode yang membantu mengalirkan arus sehingga laju potensial tetap dipertahankan. Elektrode pembantu yang digunakan harus bersifat inert, seperti kawat platina atau batang karbon yang berfungsi sebagai pembawa arus (Wang 2001). Penerapan metode ini tidak hanya sebatas pada penggunaan kepentingan analitik, akan tetapi diperlukan juga untuk kepentingan non-anlitik seperti penentuan proses dan mekanisme oksidasi reduksi pada berbagai media, proses adsorpsi pada suatu permukaan dan mekanisme transfer elektron pada permukaan elektrode yang dimodifikasi (Hattu 2009).
Metode voltammetri yang digunakan pada penelitian ini ialah voltametri siklis. Voltammetri siklis merupakan metode analisis elektrokimia yang didasarkan pada pengukuran nilai arus listrik sebagai fungsi aluran potensial, dengan potensial awal sama dengan potensial akhir. Penggunaan metode ini dalam biosensor glukosa berbasis bakteri lebih baik dari metode spektrofotometer (Trivadila 2006). Kelemahan dari metode ini ialah tidak dapat menggambarkan secara pasti laju yang terjadi secara akurat karena hanya dapat mengukur laju pada waktu tertentu saja. Kelebihan metode ini ialah lebih sensitif, jumlah contoh yang sedikit dapat terdeteksi dengan baik. Selain itu, jumlah enzim yang dihasilkan
oleh suatu isolat bakteri E. coli dapat ditentukan (Iswantini et al. 1998; Ikeda et
al. 2001).
METODE
Alat dan Bahan
Alat-alat yang digunakan adalah potensiostat-galvanostat eDAQ yang
dilengkapi perangkat lunak Echem v2.1.0, laminar air flow, inkubator, high speed
refrigated centrifuge KUBOTA 6500, autoklaf, pipet mikro, sel elektrokimia,
serta alat-alat kaca yang lazim di laboratorium. Bahan-bahan yang digunakan
ialah mikrob sel E. coli ATCC25922 yang diperoleh dari koleksi LIPI
Mikrobiologi, tripton, yeast extract, agar, akuades, alkohol 70%, natrium klorida
(NaCl), MgSO4, glukosa, pirolokuinolina kuinon (PQQ),
2,3-dimetoksi-5-metil-1,4 benzokuinon (Qo), bufer fosfat (PBS), gas N2, glutaraldehida (GA), larutan
albumin serum sapi (BSA) 5% dan zeolit alam dari bayah, Indonesia.
Metode Penelitian
Penelitian terdiri atas enam tahap. Tahap pertama aktivasi zeolit alam. Tahap kedua, yaitu penanaman dan pemanenan isolat bakteri. Tahap ketiga, yaitu
pembuatan elektrode pasta karbon. Tahap keempat, yaitu imobilisasi sel E. coli
pada matriks zeolit-GA dan permukaan elektrode pasta karbon. Tahap kelima, yaitu optimasi aktivitas GDH dengan parameter: suhu, pH, konsentrasi PQQ, zeolit, konsentrasi GA dan konsentrasi glukosa. Dan tahap keeman, yaitu penentuan kinetika enzim dan stabilitas elektrode.
Aktivasi Zeolit
Aktivasi zeolit mengacu pada metode Arif (2011). Sebanyak 50 gram zeolit Bayah dicuci dengan akuades sampai pH 7, disaring, dan dikeringkan
menggunakan oven pada suhu 105 oC. Zeolit yang telah dikeringkan diaktivasi
dengan menambah 250 mL HCl 3 M dalam gelas piala dan diaduk selama 1 jam. Zeolit yang telah diaktivasi disaring, kemudian dicuci dengan akuades sampai pH
7. Larutan hasil saringan diuji kandungan klorin dengan AgNO3 dan dicuci
kembali dengan akuades sampai tidak mengandung klorin. Setelah pH netral dan
bebas klorin, zeolit dikeringkan pada suhu 300 oC selama 3 jam. Zeolit yang telah
diaktivasi kemudian dihaluskan dan diayak dengan ayakan 100 mesh.
Kultur Bakteri E. coli
Kultur bakteri E. coli membutuhkan media Luria Broth (LB) agar miring
dan cair. Media LB agar miring dibuat dari tripton, yeast extract, NaCl, dan agar.
Sebanyak 1 L media dibuat dengan 10 g tripton, 5 g yeast extract, 5 g NaCl, dan
Bakteri E. coli ditumbuhkan pada media LB agar miring, diinkubasi selama
1 hari pada suhu 37 oC. Bakteri yang tumbuh selanjutnya ditanam ke 10 mL
media LB cair sebagai starter, diinkubasi hingga mencapai nilai OD610 = 0.7.
Sebanyak 5 mL starter diinokulasi ke dalam 50 mL media LB cair dan diikunbasi.
E. coli dipanen dengan disentrifugasi pada kecepatan 10.000 rpm selama 15
menit. Pelet dipisahkan dari supernatan, dicuci 2 kali dengan air destilasi, dan diresuspensikan dengan NaCl 0.85%.
Pembuatan Elektrode Pasta Karbon
Elektrode pasta karbon dibuat dari campuran grafit dan parafin cair 2:1. Grafit dicampur dengan parafin cair hingga membentuk pasta. Kemudian pasta karbon dimasukkan ke dalam badan elektrode hingga memadat sampai ke permukaan kaca. Permukaan kaca elektrode dihaluskan dan dibersihkan dengan ampelas dan kertas minyak.
Imobilisasi Sel Bakteri pada Permukaan Elektrode
Metode Imobilisasi sel bakteri dengan memodifikasi metode Saiapina et
al.(2011). Imobilisasi sel E. coli dilakukan dengan menyiapkan larutan berbasis
sel E. coli dengan komposisi sel bakteri (7.5%), BSA (7.5%), gliserol (20%), dan
50 mM PBS, pH 6.5. Setelah itu, 5 µL zeolit (mg/mL), 5 µL larutan berbasis sel
E. coli, dan 5 µL GA dicampurkan dan dihomogenkan. Campuran selanjunya
didiamkan selama 10 menit. Kemudian larutan diteteskan pada permukaan elektrode pasta karbon dan didiamkan hingga pelarutnya menguap/mengering. Selanjutnya permukaan elektrode dilapisi dengan membran dialisis, ditutup dengan jaring nilon, dan diikat dengan parafilm. Elektrode kemudian direndam
dalam larutan NaCl fisiologis pada suhu 4 oC ketika tidak digunakan, untuk
memberikan keadaan yang sama dengan lingkungan sebenarnya. Elektrode dapat langsung digunakan untuk pengukuran aktivitas GDH secara elektrokimia.
Pengukuran Aktivitas GDH dengan Metode Elektrokimia
Pengukuran aktivitas GDH dengan metode elektrokimia dilakukan dengan menggunakan seperangkat alat potensiostat-galvanostat eDAQ yang dilengkapi perangkat lunak Echem v2.1.0. Elektrode yang digunakan ialah elektrode Ag/AgCl sebagai elekrode rujukan, elektrode Pt/Ti sebagai elektrode pembantu, dan elektrode pasta karbon sebagai elektrode kerja. Parameter pengukuran dibuat
sebagai berikut: Mode : Cyclic, Initial : -400 mV, Final : -400 mV, Rate : 250
mV/s, Step W : 20 ms, Upper E : 800 mV, Lower E : -500 mV, Range : 5 V.
Sebanyak 1 mL PBS ditambahkan ke dalam sel elektrokimia dan puncak arus anode yang terbentuk diamati sebagai blangko. Selanjutnya, ditambahkan
100 μL Qo 5 mM, glukosa, PQQ, dan MgSO4 10 mM. Sebelum dilakukan
pengukuran, larutan dideaerasi dengan mengalirkan gas nitrogen selama ±1 menit. Setelah penambahan setiap zat ke dalam larutan, perubahan arus yang terjadi diamati hingga mencapai arus keadaan tunak secara runut.
Optimasi Aktivitas GDH Sel E. coli Terimobilisasi
Optimasi dilakukan pada suhu (25–35 oC), pH (5–7), konsentrasi glukosa (5–
25 mM), konsentrasi PQQ (1–6 μM), zeolit (50–250 mg) dan glutaraldehida (5–
GDH. Metode ini dilakukan dengan cara memasukkan kombinasi faktor-faktor peubah bebas pada perangkat lunak statistika Minitab.v.15 English. Selanjutnya percobaan dilakukan sesuai dengan kombinasi yang dihasilkan untuk mendapatkan nilai aktivitas optimumnya.
Penentuan Stabilitas Elektrode
Stabilitas elektrode ditentukan dari pengukuran aktivitas sel E. coli
terimobilisasi setelah didapat kondisi optimum. Nilai aktivitas yang diperoleh pada pengukuran awal dianggap 100%. Aktivitas diukur ulang pada setiap waktu tertentu dan aktivitas yang tersisa.
Aktivitas E. coli (%)= Isaat ke-t (µA)
Isaat awal (µA)×100%
HASIL DAN PEMBAHASAN
Optimasi Aktivitas GDH Sel Bakteri E. coli Terimobilisasi
Bakteri E. coli menghasilkan enzim GDH pada periplasma selnya(Trivadila
2006). Pada umumnya kinerja reaksi enzim dipengaruhi oleh suhu, pH, dan
konsentrasi substrat. Oleh karena itu dalam penggunaan enzim ini, diperlukan optimasi pada setiap pengembangan aplikasinya.
Rancangan percobaan optimasi aktivitas GDH sel E. coli terimobilisasi
zeolit-GA dilakukan menggunakan RSM yang terdapat pada perangkat lunak statistik Minitab.v.14 English. RSM merupakan kumpulan teknik matematika dan statistik untuk membangun model empiris, pemodelan, dan analisis terhadap suatu masalah dengan mengoptimumkan sebuah respons yang dipengaruhi oleh beberapa peubah (Bradley 2007). Segi penting dari RSM adalah rancangan percobaan (DOE) untuk memilih titik tempat respons harus dievaluasi (Khuri dan Mukhopandhyay 2010).
Parameter (faktor-faktor peubah bebas) yang dioptimumkan untuk aktivitas
GDH sel E. coli terimobilisasi adalah suhu (25–35 oC), pH (5–7), konsentrasi
glukosa (5–25 mM), konsentrasi PQQ (1–6 μM), zeolit (50–250 mg/mL), dan
konsentrasi GA (5–20%). Faktor-faktor peubah bebas ini kemudian diolah dengan
RSM dan menghasilkan luaran kombinasi faktor-faktor peubah bebas (Lampiran 5). Imobilisasi bakteri dan pengukuran elektrokimia untuk memperoleh respons arus puncak oksidasi (puncak anode) dilakukan sesuai dengan kombinasi tersebut. Hasil optimasi aktivitas GDH diberikan pada Lampiran 6 dan alur kontur hubungan antara berbagai faktor dan puncak arus oksidasi yang dihasilkan ditunjukan pada Gambar 3. Alur kontur menunjukkan puncak arus oksidasi yang
tertinggi pada daerah dengan warna hijau gelap (2.5–5.0 µA dan >5.0 µA) dan
menghasilkan kondisi optimum di sekitar suhu 30 oC, pH 6, konsentrasi glukosa
15 mM, konsentrasi PQQ 3.5 μM, zeolit 150 mg/mL, dan konsentrasi GA 12.5%.
Hasil optimum yang dihasilkan pada alur kontur digunakan sebagai nilai
Kondisi optimum aktivitas GDH sel E. coli terimobilisasi adalah suhu 30 oC, pH
6, konsentrasi glukosa 15 mM, konsentrasi PQQ 3.5 μM, zeolit 150 mg/mL, dan
konsentrasi GA 14.05%. Hapsari (2011) melaporkan kondisi suhu dan pH
optimum yang sama, yaitu 30 oC dan pH 6, sedangkan kondisi optimum
konsentrasi PQQ, glukosa, dan GA berturut-turut adalah 3.05 µM, 10.25 mM, dan 12.5 µL (GA 25%). Hasil ini membuktikan kondisi bahwa optimum arus puncak
anode sangat dipengaruhi oleh proses imobilisasi. Saiapina et al. (2011)
menggunakan zeolit klinoptilolit pada biosensor enzim untuk menentukan urea dan menghasilkan kondisi optimum pada PBS pH 7.
Parameter kondisi optimum puncak arus oksidasi dipengaruhi oleh nilai pH. Enzim terimobilisasi menunjukkan kebergantungan pada perubahan nilai pH dan kekuatan ionik, terutama jika parameter ini diubah oleh reaksi enzim (Bisswanger 2008). Pergeseran nilai pH terjadi karena enzim terimobilisasi pada matriks yang memiliki perbedaan muatan (Trivadila 2011).
Alur kontur hasil optimasi aktivitas GDH sel E. coli terimobilisasi (Gambar
3) sulit diduga kondisi optimumnya. Hal ini disebabkan penggunaan faktor peubah bebas yang lebih besar dari 5 (6 faktor). Menurut Tiera (2003),
berdasarkan aturan statistik, jika jumlah faktor ≥5 perlu dilakukan penapisan
menggunakan metode faktorial fraksional atau metode Plackett-Burman.
Kinetika GDH Sel Bakteri E. coli Terimobilisasi
Kinetika imobilisasi enzim pada sistem biosensor umumnya melihat
parameter tetapan Michaelis-Menten (KMapp) dan laju reaksi maksimum (Vmaks app)
yang diasumsikan sebagai arus maksimum (Imaks app). Tetapan Michaelis-Menten
(KM) merupakan konsentrasi yang menghasilkan setengah aktivitas maksimum,
sedangkan Imaks merupakan aktivitas maksimum. Parameter kinetika ditentukan
dengan mengukur aktivitas GDH sel bakteri E. coli terimobilisasi dengan variasi
konsentrasi substrat (glukosa) 0.5–70 mM pada kondisi optimum. Data aktivitas
enzim GDH sel bakteri E.coli terimobilisasi ditunjukkan pada Lampiran 7.
Gambar 4a menunjukkan bahwa hubungan konsentrasi substrat dengan
aktivitas GDH sel E. coli terimobilisasi sesuai dengan persamaan
Michaelis-Menten: v = Vmaks[S]/(KM + [S]). Bentuk kurva menunjukan aktivitas GDH terjadi
dalam 2 tahap, yaitu (1) ketika konsentrasi substrat di bawah 50 mM, belum semua tapak aktif enzim mengikat substrat dan aktivitas GDH semakin meningkat; (2) ketika konsentrasi substrat mencapai 50 mM kondisi aktivitas maksimum dan semua tapak aktif enzim telah mengikat substrat. Menurut Murray
et al. (2003), aktivitas enzim akan meningkat dengan bertambahnya konsentrasi
Gl ukosa 15 PQQ 3.5 Hold Values >
Gambar 3 Alur kontur hubungan antara suhu dan pH (a), suhu dan [glukosa] (b), suhu dan [PQQ] (c), suhu dan zeolit (d), suhu dan [glutaraldehida] (e), pH dan [glukosa] (f), pH dan [PQQ] (g), pH dan zeolit (h), pH dan [GA] (i), [glukosa] dan [PQQ] (j), [glukosa] dan zeolit (k), [glukosa] dan [GA] (l), [PQQ] dan zeolit (m), [PQQ] dan [GA] (n), zeolit dan [GA] terhadap puncak arus oksidasi (o).
Hold Values >
Gl ukosa 15 [ GA] 12.5 Hold Values
Hubungan linear antara konsentrasi substrat glukosa dan aktivitas GDH sel
E. coli terimobilisasi (Gambar 4b) yang terjadi hingga konsentrasi glukosa
mencapai 50 mM, mengikuti persamaan regresi y = 0.1301x + 0.8299 dengan R2 =
99.10%. Penentuan linearitas pengukuran bertujuan menentukan daerah kerja maksimum dari elektrode. Jika dibandingkan dengan hasil yang diperoleh Hapsari
(2011), aktivitas maksimum enzim GDH sel E. coli yang ditaut-silang dengan GA
diperoleh pada konsentrasi substrat 20 mM. Konsentrasi substrat yang lebih tinggi dari 20 mM menghasilkan aktivitas yang cenderung konstan (Hapsari 2011). Hasil penelitian ini menunjukan dearah kerja maksimum dari elektrode lebih baik yaitu 50 mM.
Penentuan parameter kinetika menggunakan persamaan Lineweaver-Burk.
Gambar 5 menunjukan kurva alur Lineweaver-Burk dengan persamaan garis y =
0.7211x + 0.278 dan R2= 93.28%. Dari persamaan garis yang diperoleh, dapat
ditentukan nilai KM app dan Imaks app secara berturut-turut adalah 2.6927 mM dan
3.7341 µA. Hapsari (2011) melaporkan nilai KM app GDH sel E. coli tanpa dan
taut-silang GA berturut-turut sebesar 1.9007 mM dan 1.1162 mM, Nilai KM app
lebih kecil dibandingkan dengan hasil penelitian ini. Akan tetapi, nilai KM
penelitian ini masih lebih kecil dari hasil yang dilaporkan oleh Gaikwad et
al.(2007) dalam imobilisasi enzim GOD pada film PANNI tertaut-silang GA
untuk menentukan glukosa secara potensiometri, yaitu sebesar 7.14 mM.
Gambar 4 Alur Lineweaver-Burk GDH sel E. coli terimobilisasi.
y = 0.7211x + 0.2678
0.00 0.50 1.00 1.50 2.00 2.50
Ip
Gambar 5 Hubungan konsentrasi substrat glukosa dengan aktivitas (a), rentang
antara linear substrat glukosa dan aktivitas GDH E. coli
terimobilisasi (b).
0
Aktivitas GDH
Nilai KM merupakan ukuran kuat atau lemahnya enzim mengikat substrat.
Semakin besar nilai KM, semakin lemah enzim mengikat substrat dan semakin
kecil nilai KM, semakin kuat pula enzim mengikat substrat atau semakin tinggi
afinitasnya. Nilai KM app yang tinggi pada penelitian ini dapat bekerja dalam
kisaran konsentrasi glukosa jauh lebih lebar, yaitu 0.5–50 mM. Selain itu, nilai
Imaks app yang dilaporkan Hapsari (2011) untuk GDH sel E. coli tanpa dan
taut-silang GA, yaitu berturut-turut 1.7931µA dan 2.1404 µA, lebih kecil jika
dibandingkan dengan hasil penelitian ini. Nilai Imaks app merupakan indikator
aktivitas enzim. Semakin besar nilai Imaks app, semakin tinggi aktivitas enzim dan
sebaliknya. Hasil ini menunjukan penggunaan zeolit-GA sebagai matriks
imobilisasi sel E. coli pada biosensor glukosa dapat meningkatkan aktivitas GDH,
walaupun masih memiliki afinitas yang rendah.
Aktivitas dan Stabilitas GDH Sel E. coli Terimobilisasi
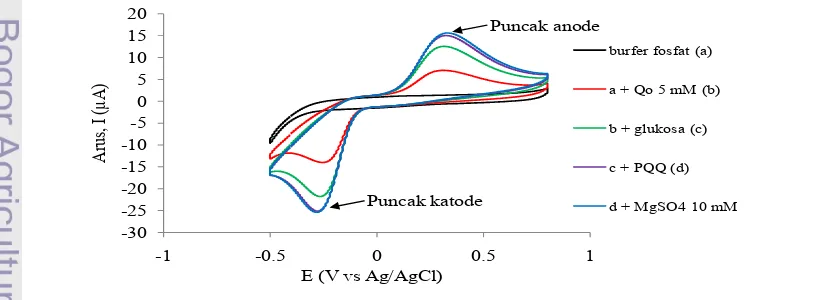
Metode voltammetri siklis digunakan untuk mengukur aktivitas GDH. Elektron dihasilkan dari reaksi oksidasi substrat glukosa dengan katalis GDH (Trivadila 2006). Oleh karena itu, aktivitas GDH dapat diamati dari perubahan arus yang terukur akibat reaksi oksidasi ini (puncak anode). Gambar 6 menunjukkan perbedaan puncak anode dan katode pada voltammogram siklis
pasta karbon sel E. coli terimobilisasi.
Larutan bufer fosfat pH 6 (-) tidak menghasilkan puncak anode dan katode. Hal ini, menunjukkan tidak ada aktivitas GDH sel bakteri. Penambahan Qo 5 mM
sebagai mediator (-) dan glukosa 15 mM sebagai substrat (-) menghasilkan
puncak anode dan katode. Penggunaan Qo sebagai mediator, karena bersifat cepat bereaksi dengan enzim maupun elektrode, stabil, potensial redoks yang baik, dan tidak bergantung pada nilai pH (Trivadila 2006). Perubahan puncak anode dan
katode secara signifikan terjadi setelah penambahan PQQ 3.5 µM (-) dan MgSO4
10 mM sebagai aktivator (-). Hasil ini, menunjukan sel E. coli menghasilkan
enzim apo-GDH (GDH inaktif) dan setelah panambahan PQQ dan MgSO4, GDH
berubah menjadi holo-GDH (GDH aktif) sehingga menghasilkan puncak arus
yang signifikan. penambahan PQQ dan MgSO4 merupakan koenzim dan kofaktor
dari gugus prostetik enzim GDH.
Gambar 6 Voltammogram siklis larutan bufer fosfat pH 6.5 (-), + Qo 5 mM (-), +
burfer fosfat (a)
a + Qo 5 mM (b)
b + glukosa (c)
c + PQQ (d)
d + MgSO4 10 mM
Puncak anode
Aktivitas GDH dipengaruhi oleh stabilitas, yang merupakan faktor penting dalam biosensor. Stabilitas elektrode kerja ditentukan dengan mengukur puncak anode selama 7 hari. Gambar 7 menunjukan stabilitas elektrode yang di simpan
pada suhu 4 oC dan suhu kamar. Stabilitas elektrode yang di simpan pada suhu 4
o
C cenderung turun hingga hari ke-2 dan stabil hingga dihari ke-5 kemudian
aktivitas GDH turun pada 63.34% setelah 7 hari. Sedangkan stabilitas elektrode yang di simpan pada suhu ruang turun secara drastis 23.40% pada hari pertama
dan cenderung stabil hingga hari ke-5. Aktivitas GDH sel E. coli terimobilisasi
turun setelah 7 hari. Menurut Trivadila (2006), aktivitas GDH sel E. coli turun
setelah 6 jam dan menurut Hapsari (2011), aktivitas GDH sel E. coli taut-silang
GA turun setah 10 jam. Hasil penelitian ini, aktivitas GDH sel E. coli
terimobilisasi relatif stabil 70–80% selama 4 hari. Hasil ini menunjukkan
penggunaan zeolit-GA sebagai matriks imobilisasi dapat meningkatkan aktivitas
GDH sel E. coli sebagai biosensor glukosa.
Menurut Sudjadi et al. (2004), penggunaan gliserol dan BSA dapat
mengurangi denaturasi protein karena kekentalannya menyerupai cairan sel. Gliserol dapat membentuk ikatan hidrogen dengan molekul air. Pembentukan ikatan hidrogen ini menghilangkan pergerakan air bebas yang mudah mendenaturasi protein. Penggunan gliserol dan BSA pada penelitian ini,
menambah umur hidup E. coli pada permukaan elektrode, yang menghasilkan
aktivitas GDH yang lebih stabil selama 4 hari. Hapsari (2011) melaporkan dengan
penambahan BSA dapat menghasilkan aktivitas relatif GDH sel E. coli stabil
selama 10 jam. Dari uji stabilitas, dapat disimpulkan penggunaan zeolit-GA
sebagai matriks imobilisasi dapat meningkatkan aktivitas GDH sel E. coli relatif
stabil sebesar 70-80% selama 4 hari.
Gambar 7 Stabilitas biosensor glukosa berbasis E. coli disimpan pada
suhu 4 oC ( ) dan suhu ruang ( ).
100 86.35
78.32 77.70 76.09 75.83 69.49
63.34
73.98 71.43 71.12 70.28 69.69
41.84 31.22
0 20 40 60 80 100 120
0 1 2 3 4 5 6 7 8
Aktivitas
GDH
(%)
SIMPULAN DAN SARAN
Simpulan
Penggunaan zeolit-GA sebagai matriks imobilisasi sel E. coli ATC25922
dapat meningkatkan aktivitas GDH pada biosensor glukosa berdasarkan nilai Imaks.
Penggunaan zeolit-GA menghasilkan aktivitas GDH relatif stabil sebesar 70–80%
selama 4 hari, elektrode yang disimpan pada suhu 4 oC maupun suhu ruang. Nilai
KM yang tinggi menunjukan afinitas yang rendah. Akan tetapi, nilai KM yang
tinggi dapat bekerja dalam kisaran konsentrasi glukosa yang lebih tinggi.
Saran
Penelitian lebih lanjut perlu dilakukan uji keterulangan, ketepatan, limit
deteksi, dan pembuatan alat biosensor glukosa berbasis E. coli untuk
pengembangan ke arah aplikatif.
DAFTAR PUSTAKA
Apriliani R. 2009. Studi peggunaan kurkumin sebagai modifier elektroda pasta
karbon untuk analisis timbal(II) secara stripping voltammetry [skripsi].
Surakarta: Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sebelas Maret Surakarta.
Arif Z. 2011. Karakterisasi dan modifikasi zeolit alam sebagai bahan media pendeteksi studi kasus: kromium heksavalen. [tesis]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Balal K, Mohammad H, Bahareh, Ali BMH, Mozhgam Z. 2009. Zeolite nonoparticle modified carbon paste electrode as a biosensor for simultaneous
determination of dopamine and tryptophan. J Chim Chem 56: 789-796.
Bradley N. 2007. The response surface methodology. [thesis]. Indiana: Department of Mathematical Sciences, Indiana University of South Bend
Castillo J et al. 2004. Biosensors for life quality design, development
andapplications. Sensors and Actuators B 102:179-194.
Chalova VI, Sirsat SA, O’Bryan CA, Crandall PG, Ricke SC. 2009. Escherichia
coli, an intestinal microorganism, as a biosensor for quantification of amino
acid bioavailability. Sensors 9: 7038-7057.
Dai Z, Liu S, Ju H. 2004. Direct electron transfer of cytocchrome c immobilizated
on a NaY zeolite matrix and its application in biosensing. Electro Acta 49:
2139-2144
Fiorito P, Torresi S. 2001. Glucose amperometric biosensor based on the
co-immobilization of glucose oxidase (GOx) and ferrocene in poly(pyrrole)
generated from ethonol/water mixtures. J Brazilian Chem Soc12(6):729-733.
Ginting AB, Anggraini D, Indaryati S, Kriswarini R. 2007. Karakterisasi
komposisi kimia, luas permukaan pori dan sifat termal dari zeolit bayah,
Goriushkina TB, Kurç BA, Jr. AS, Dzyadevych AV. 2010. Application of zeolites
for immobilization of glucose oxidase in amperometric biosensors. Sensor
Electronics and Microsystem Technologies 1: 36-42.
Grieshalber D, MacKenziel R, Vorosl J, Reimhult E. 2008. Review paper guanine
and adenine biosensor. J Biosen Bioelect 24: 591-599.
Hapsari RP. 2011. Stabilitas dan efektifitas biosensor glukosa berbasis
Escherichia coli menggunakan imobilisasi glutaraldehida. [skripsi]. Bogor:
Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Hattu N. 2009. Studi voltametri dan analisis antihistamin setirizin dihidroklorida
dan deksklorfeniramin maleat dalam medium surfaktan menggunakan electrode pasta karbon. [disertasi]. Bandung. Program Pascasarjana, Institut Teknologi Bandung.
Hawlaoui ML, Bouyahi N, Jafferzic-Renault N. 2008. Development of a urea
biosensor based on a polymeric membrane including zeolite. Sciences &
TechnologieB: 51-55.
[IDF] International Diabetes Federation. 2009. What is Diabetes?. [terhubung berkala]. http://www.idf.org/diabetesatlas/what-is-diabetes [5 Jul 2012].
Ikeda T, Iswantini D, Yosuke I, Kono K. 2001. Electrochemical analysis of
glucose dehydrogenase activity exhibted by escherichia coli cell. Anal Sci 17:
i285-i286.
Iswantini D, Kato K, Ikeda T, 1998. Electrochemical measurements of glucose
dehydrogenase activity exhibited by Escherichia coli cells; effectsof the
addition of pyrroloquinoline quinone, magnesium or calcium ions and
ethylenediaminetetraacetic acid. Bioelectrochem and Bioenerg 46: 249- 254.
Iswantini D, Kano K, IkedaT. 2000. Kinetics and thermodynamic of activation of
quinoprotein apoenzyme in vivo and catalytic activity of the activated enzyme
in Escherichia coli cells. Biochem J 350: 917-923.
Iswantini D, Nurhidayat N, Trivadila. 2011. Glucose biosensor selected Indonesia
bacteria. Microbiology Indonesia 5(1): 9-14.
Khuri AI, Mukhopadhyay S. 2010. Response surface methodology. WIREs
Computational Statistics 2: 128-149.
Lapėnaitė I et al. 2003. Application of PQQ-GDH based polymeric layer in design
of biosensor far detection of heavy metals. Material Sci 9(4): 431-435.
Laurinavicius V, Razumiene J, RamanaviciusA, Ryabov AD. 2004. Wiring of
PQQ dehydrogenase. Biosensors and Bioelectronics20:1217-1222.
Lui B, Yan F, Kong J, Deng J. 1999. Reagentless amperometric biosensor based on the coimmobilization of horseradish peroxidase and methylene green in a
modified zeolite matrix. Anal Chem Acta 386: 31-39.
Liu J, Wang J. 2000. A novel improved design for the first-generation glucose
biosensor. Food Technology Biotechnology 39(1): 55-58.
Mateo C, Palomo JM, van Langen LM, van Rantwijk F, dan Sheldon RA. 2004. A new, mild crosslinking methodology to prepare crosslinked enzyme aggregates.
Biotech Bioeng 86 (3): 273-276.
Murray RK, Granner DK, Mayes PA, Rodwell VW. 2003. Biokimia Harper. Ed
ke-25. Hartono A, penerjemah; Bani AP, Sikumbang TMN, editor. Jakarta:
Ohfuji K et al. 2004. Construction of a glucose sensor based on a screen-printed
electrode and a novel mediator pyocyanin from Pseudomonas aeruginosa.
Biosens Bioelec 19(10):1237-1244.
Othman N, Abu BF, Salleh AB, Heng LY, Wagiran R. 2006. Preliminary investigation on a histamine biosensor constructed from diamine oxidase
immobilised onto an oxygen probe. Malaysia J Anal Scienc 10: 137-142.
Rana JS, Jindal J, Beniwal V, Chokar V. 2010. utility biosensors for applications
in agriculture-A Review. Journal of American Science 6(9): 353-375.
Saiapina OY et al. 2011. Conductometric enzyme biosensors based on natural
zeolite clinoptilolite for urea determination. Materials Science and Engineering
C 31: 1490-1497.
Sudjadi, Ikawati Z, Sismindari, Rahayu PRS. 2004. Pengaruh pH, suhu dan
penyimpanan pada stabilitas protein MJ-30 dari daun Mirabilis jalapa L.
Majalah Farmasi INA 15 (1): 1-6.
Tiera B. 2003. Engineering statistics hanbook. [terhubung berkala].
http://fs1.bib.tiera.ru/content//DVD_032/_Engineering_Statistics_Handbook_ %282003%29%28en%29%281522s%29.pdf. [30 Okt 2012].
Trivadila. 2006. Aktivitas glukosa dehidrogenase pada tiga isolat bakteri Indonesia terpilih yang diimobilisasi untuk pengembangan biosensor glukosa. [skripsi]. Bogor: Fakultas Matematikadan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Trivadila. 2011. Biosensor antioksidan menggunakan superoksida dismutase
Deinococus radiodurans diimobilisasi pada permukaan elektrode pasta karbon
dan parameter kinetikanya. [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Turner APF. 2002. Biosensor: paste, present, and future. [terhubung berkala].
http://www.cranfield.ac.uk/health/researchareas/biosensorsdiagnostics/page187 9 5.html. [15 Januari 2012].
Wang J. 2001. Analytical Electrochemistry. Ed ke-2. New York: J Willey.
Wang J, Carmon KS, Luck LA, Suni II. 2005. Electrochemical impedance
biosensor for glucose detection utilizing a periplasmic E. coli receptor protein.
Electrochemical and Solid-State Letters 8 (8): H61-H64.
Wang H et al. 2008. High sensitivity glucose biosensor based an Pt electrode
position onto low-density aligned carbon nanotubes. Int J Electrochen Sci
3(11): 1258-1267.
Weniarti. 2011. Biosensor antioksidan berbasis superoksida dismutase Deinoccos
radiodurans diimobilisasi pada nanokomposit zeolit alam Indonesia.[tesis].
Bogor: Program Pacasarjana, Institut Pertanian Bogor.
Winarno FG. 2010. Enzim Pangan. Bogor: M-Brio Press.
Witarto AB. 2007. Rekayasa protein enzim PQQ Glucose Dehydrogenase untuk
alat pengukur gula darah. Inovasi 9: 61-68.
LAMPIRAN
Lampiran 1 Bagan alir umum penelitian
Penanaman dan peremajaan
Pemanenan mikrob
Uji aktivitas enzim GDH sel bakteri E. coli
Metode voltammetri siklis
Media Luria Broth (LB) agar miring dan cair
Optimasi aktivitas enzim GDH terimobilisasi: pH, suhu, [PQQ], [glukosa], zeolit, dan [GA]
Nilai aktivitas enzim GDH sel
bakteri E. coli
Perubahan arus Profil voltammogram
Lampiran 2 Bagan alir pembutan media
A. Media LB agar miring
B. Media LB cair
10 g tripton + 5 g yeast extract + 5 g NaCl + 15 g agar + akuades hingga
volume 1 L
Dipanaskan hingga homogen dan mencair
Larutan media dipindahkan ke dalam tabung reaksi masing-masing 5 mL
Tabung ditutup dengan sumbat
Sterilisasi dengan outoklaf selama ± 2 jam
Media ditempatkan pada rak miring hingga dingin dan padat
10 g tripton + 5 g yeast extract + 5 g NaCl + akuades hingga volume 1 L
Dipanaskan hingga homogen dan mencair
Larutan media dipindahkan ke dalam tabung reaksi masing-masing 5 mL
Tabung ditutup dengan sumbat
Sterilisasi dengan outoklaf selama ± 2 jam
Lampiran 3 Bagan alir kerja
Mikrob
ditanam pada media LB agar miring
Inkubasi 1 hari (37oC)
ditanam pada 5 mL media LB cair (starter)
diinokulasi pada 50 mL media LB cair
Inkubasi s.d OD (610) min 0.7
diinkubasi
Sentrifugasi (dipanen), 10.000 rpm
supernatan Pelet (sel)
Resuspensi dengan NaCl 0.85%
Suspensi sel
Uji aktivitas enzim GDH sel bakteri E.coli
Lampiran 4 Bagan alir elektrode pasta karbon dan imobilisasi
Parafin cair : grafit (1:2)
Campuran di gerus
Pasta karbon
15 µL suspensi sel bakteri diimobilisasi pada permuakaan elektrode Dimasukkan ke dalam badan elektrode hingga padat sampai permuakaan
Permukaan karbon dihaluskan dengan amplas dan kertas
Permukaan elektrode dilapisi dengan membran dialisis Pelarut diuapkan
Tutup dengan jaringan nilon dan ikat dengan parafilm
Elektrode disimpan dalam larutan garam fisiologis (NaCl 0.85%) 5 oC
Lampiran 5 Hasil kombinasi faktor-faktor peubah bebas.
Lampiran 7 Kinetika enzim GDH sel bakteri E. coli terimobilisasi
Kinetika enzim GDH sel bakteri E. coli terimobilisasi mengikuti plot
Lineweaver-Bruk:
0.00 2.00 4.00
1/I
p
(µA
-1)
1/[glukosa] (mM-1)
Plot Lineweaver-Burk
y = 0.1161x + 2.1123
Ip/[glukosa] (µA/mM)
Lampiran 8 Stabilitas elektrode biosensor glukosa berbasis E. coli terimobilisasi
Waktu (hari) Aktivitas GDH (%)
suhu 4 °C Suhu ruang
![Gambar 3 Alur kontur hubungan antara suhu dan pH (a), suhu dan [glukosa] (b), (o)](https://thumb-ap.123doks.com/thumbv2/123dok/899183.387432/20.595.109.513.86.748/gambar-alur-kontur-hubungan-antara-suhu-suhu-glukosa.webp)