UNTUK BIOSENSOR ASAM URAT
OKIK WIDIYATMOKO
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2012
UNTUK BIOSENSOR ASAM URAT
OKIK WIDIYATMOKO
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2012
UNTUK BIOSENSOR ASAM URAT
OKIK WIDIYATMOKO
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Aktivitas dan Stabilitas Urikase Lactobacillus platarum yang Diimobilisasi pada Zeolit Alam untuk Biosensor Asam Urat adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Desember 2012
Okik Widiyatmoko
ABSTRAK
OKIK WIDIYATMOKO. Aktivitas dan Stabilitas Urikase Lactobacillus plantarum yang Diimobilisasi pada Zeolit Alam untuk Biosensor Asam Urat. Di Bawah Bimbingan DYAH ISWANTINI PRADONO, NOVIK NURHIDAYAT, TRIVADILA.
Bakteri Lactobacillus plantarum telah diketahui menghasilkan enzim urikase, namun aktivitas dan stabilitasnya masih rendah. Metode pengukuran yang lebih sensitif dan selektif diperlukan untuk mengukur aktivitas dan stabilitas urikasenya.Voltametri siklik digunakan untuk menentukan perilaku katalitik pada biosensor. Penelitian ini dilakukan dengan mengimobilisasi urikase L. plantarum
pada zeolit menggunakan mediator terbaik dan kondisi optimum. Penelitian bertujuan mengukur aktivitas dan stabilitas urikase yang diimobilisasi pada zeolit alam. Imobilisasi urikase L. plantarum pada zeolit dapat meningkatkan aktivitas dan stabilitasnya. Mediator terbaik untuk aktivitas urikase ini adalah Q0 (2,3-dimetoksi-5-metil-1,4-benzokuinon). Kondisi optimum imobilisasi urikase pada zeolit adalah pH 8.5, suhu 40 oC, konsentrasi asam urat 0.05 mM, dan massa zeolit 220 mg. Nilai konstanta Michaelis-Menten dan laju maksimum (KM dan
Vmaks) urikase L. plantarum yang diperoleh dari persamaan Lineweaver-Burk
adalah 6.0292×10-3mM dan 6.3331 A. Stabilitas urikase ini dapat dijaga selama 18 hari jika disimpan pada suhu 10oC.
Kata Kunci :Lactobacillus plantarum, mediator, urikase, voltametri siklik, zeolit
ABSTRACT
OKIK WIDIYATMOKO. Uricase Activity and Stability from Lactobacillus plantarum Immobilized on Natural Zeolite for Uric Acid Biosensor. Supervised by DYAH ISWANTINI PRADONO, NOVIK NURHIDAYAT, TRIVADILA.
Lactobacillus plantarum had been known for its ability in producing uricase, however, its activity and stability still low. Method was needed to measure its uricase activity and stability. Cyclic voltametry was used to investigate the catalytic behavior of the biosensor. This research was done with immobilized L. plantarum uricase on natural zeolite using the best mediator and the optimum condition. The research aimed to measure uricase activity and stability that was immobilized on natural zeolite. Uricase immobilized on natural zeolite increasing uricase its activity and stability. The best mediator for this uricase was Q0 (2,3-dimethoxy-5-methyl-1,4-benzoquinone). The optimum condition for the immobilized uricase was pH 8.5, temperature 40 oC, uric acid concentration 0.05 mM, and zeolite mass of 220 mg. Michaelis-Menten constant and maximum velocity (KM and Vmaks) ofL. plantarum uricase obtained from Lineweaver-Burk
equation were 6.0292×10-3mM and 6.3331 A, respectively. The uricase stability could be kept for 18 days if stored at 10oC .
AKTIVITAS DAN STABILITAS URIKASE
Lactobacillus
plantarum
YANG DIIMOBILISASIKAN PADA ZEOLIT ALAM
UNTUK BIOSENSOR ASAM URAT
OKIK WIDIYATMOKO
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
stabilitas urikase Lactobacillus plantarum yang Diimobilisasikan pada Zeoam untuk Biosensor Asam Urat
Judul Skripsi: Aktivitas dan Stabilitas UrikaseLactobacillus plantarumyang Diimobilisasi pada Zeolit Alam untuk Biosensor Asam Urat Nama : Okik Widiyatmoko
NIM : G44080066
Disetujui oleh
Prof Dr Dyah Iswantini Pradono, MScAgr Pembimbing I
Dr Novik Nurhidayat Pembimbing II
Trivadila, SSi, MSi Pembimbing III
Diketahui oleh
Prof Dr Ir Tun Tedja Irawadi, MS Ketua Departemen
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas segala karunia dan rahmat-Nya sehingga skripsi ini berhasil diselesaikan. Judul skripsi ini adalah Aktivitas dan Stabilitas Urikase Lactobacillus plantarumyang Diimobilisasi pada Zeolit Alam untuk Biosensor Asam Urat.
Terima kasih penulis ucapkan kepada Prof Dr Dyah Iswantini Pradono, MSc.Agr, Dr Novik Nurhidayat, dan Trivadilla, SSi, MSi selaku pembimbing penelitian ini atas semua saran dan arahannya mengenai penelitian yang telah penulis lakukan. Selain itu, saya ucapkan terima kasih pula kepada Bu Ai, Pak Ismail, Pak Sobur, dan Mas Eko di Laboratorium Kimia Fisik dan Lingkungan, Kimia Organik, dan Laboratorium Bersama, Departemen Kimia IPB. Mbak Ratih, Bu Erna, dan Pak Acun di Laboratorium Genetika, Puslit Biologi LIPI.
Ungkapan terima kasih juga dihaturkan kepada Ayah dan Ibu tercinta, semua saudaraku atas dukungan dan doanya. Penghargaan disampaikan pula kepada Pak Budi Arifin, Lukman, Liyonawati, Dini, Pak Muamar, Kak Yuanita serta seluruh teman-teman kimia angkatan 45 atas doa serta kerja samanya.
Bogor, Desember 2012
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 23 Oktober 1990 dari ayah Jiyat dan ibu Sudarti. Penulis merupakan anak kedua dari dua bersaudara. Tahun 2008 penulis lulus dari SMA Negeri 9 Bekasi dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB (USMI). Penulis memilih mayor Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis pernah mengikuti anggota Badan Kerohanian Islam Mahasiswa (BKIM) pada tahun 2008/2009 dan panitia beberapa kegiatan di Ikatan Mahasiswa Kimia (IMASIKA) IPB. Selain itu, penulis pernah aktif menjadi asisten mata kuliah Kimia Tingkat Persiapan Bersama pada tahun 2009/2010 dan asisten Kimia Fisik pada tahun 2011/2012. Penulis juga berkesempatan melakukan praktik kerja lapangan di Laboratorium
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN 1 TINJAUAN PUSTAKA Biosensor...2
Urikase...3
Bakteri L. plantarum...4
Imobilisasi Enzim...4
METODE Bahan dan alat...5
Prosedur Penelitian...6
Media GYP ...6
Penumbuhan dan panenL. plantarum ...6
Pembuatan elektrode pasta karbon ...6
Aktivasi zeolit...6
ImobilisasiL. plantarum ...6
Pengukuran elektrokimia ...7
Penentuan mediator terbaik ...7
Optimasi aktivitas urikaseL. plantarum...7
Parameter kinetika ...7
Penentuan kestabilan elektrode...8
HASIL DAN PEMBAHASAN Penumbuhan dan panenL. plantarum ...8
Aktivasi zeolit...9
Penentuan mediator terbaik ...9
Perbandingan imobilisasiL. plantarum...11
Optimalisasi aktivitas urikaseL. plantarum ...12
Optimalisasi aktivitas urikaseL. plantarum dengan zeolit...13
Parameter kinetika urikaseL. plantarum ...14
Penentuan kestabilan elektrode... 18
SIMPULAN DAN SARAN ...19
DAFTAR TABEL
1 Arus oksidasi beberapa jenis mediator...9
2 Arus oksidasi beberapa sampel ...11
DAFTAR GAMBAR 1 Mekanisme kerja biosensor ...3
2 Reaksi urikase dan asam urat...3
3 Kultur dan peletL. plantarum ...8
4 Pola difraktogram zeolit Bayah terhadap asam ...9
5 Voltamogram Mediator ...10
6 Voltamogram perbedaan arus beberapa sampel ...11
7 Plot kontur pengaruh pH, suhu, dan konsentrasi asam urat...12
8 Plot kontur pengaruh pH, suhu, konsentrasi asam urat dan zeolit ...13
9 Kurva linearitas hubungan [substrat] urikaseL. plantarumdan murni...14
10 Kurva Lineweaver-Burk urikaseL. plantarumdan murni...15
11 Kurva hubungan arus dengan konsentrasi substrat ...16
12 Kurva stabilitas urikase pada 10oC dan suhu kamar ...17
DAFTAR LAMPIRAN 1 Diagram alir penumbuhan selLactobacillus plantarum ...21
2 Diagram alir penelitian secara umum ...22
3 Penentuan mediator terbaik ...23
4 Hasil pengukuran arus oksidasi imobilisasi tanpa zeolit ...23
5 Perbandingan tanpa imobilisasi pada pH 7.6, 28oC dan 40oC ...24
6 Hasil pengukuran arus oksidasi imobilisasi dengan zeolit ...25
7 Penentuan imobilisasi zeolit pada suhu kamar...26
8 Imobilisasi zeolit pada pH 7.6, 28oC dan pH 10, 40oC ...26
9 Aktivitas urikase Lactobacillus plantarumterhadap [substrat]...27
10 Perhitungan persamaan Lineweaver-BurkLactobacillus plantarum...27
11 Perhitungan persamaan Lineweaver-Burk enzim murni ...29
PENDAHULUAN
Asam urat adalah sisa metabolisme zat purin yang berasal dari makanan yang kita konsumsi dan hasil samping dari pemecahan sel dalam darah. Penyakit asam urat (gout) terjadi jika kadar di dalam serum darah tinggi (hiperurisemia) yang menyebabkan kristal padat mengumpul di persendiaan sehingga menimbulkan rasa sakit. Kadar normal asam urat dalam darah sebesar 3.5 7 mg/dL untuk pria dan 2.6 6 mg/dL untuk wanita (Mulyasuryani dan Hardiastutie 2011).
Kandungan asam urat dalam tubuh perlu diukur secara akurat dan cepat, agar penyakit asam urat dapat diobati sejak dini dan tidak timbul komplikasi penyakit tersebut seperti kardiovaskular, gagal ginjal, dan Lesch-Nyhan. Salah satu metode yang umum dan banyak digunakan untuk menentukan kadar asam urat adalah spektrofotometri, yang didasarkan atas serapan maksimum aktivitas enzim terhadap suatu substrat (Mateo et al. 2007). Metode spektrofotometri saat ini mulai ditinggalkan, karena kurang spesifik, mahal, dan sangat peka terhadap cahaya, dan mulai beralih ke biosensor, yaitu suatu perangkat analisis untuk mendeteksi analit tertentu yang menggabungkan komponen biologis dengan komponen detektor fisikokimia (Arslan 2008). Keunggulan biosensor tersebut adalah aplikatif, selektif, praktis, cepat, dan akurat (Mulyasuryani dan Hardiastutie 2011).
Komponen terpenting dalam penerapan biosensor asam urat adalah enzim. Salah satu enzim yang berperan mengatalisis reaksi oksidasi asam urat adalah urikase. Enzim urikase yang pada umumnya diperoleh dari hewan vertebrata, namun isolasi yang rumit, ketersediaan bahan atau sumber enzim yang minim, dan biaya yang besar mendorong penggunaan sumber alternatif lain seperti kapang, khamir, dan bakteri (Attalaet al.2009). Salah satu bakteri yang penghasil enzim urikase adalah Lactobacillus plantarum yang telah diketahui memiliki aktivitas yang baik terhadap asam urat. Bakteri ini dipilih karena mudah diperoleh, ketahanan hidupnya relatif tinggi, dan tidak sulit penanganannya (Rostini 2007).
Penelitian aktivitas urikase L. plantarum pada berbagai pH, suhu, konsentrasi enzim, dan konsentrasi substrat, serta kestabilannya telah dilakukan oleh Mardiah (2010) dengan metode spektrofotometri. Aktivitas enzim urikase L. plantarum yang dihasilkan pada suhu, pH, dan konsentrasi optimum dengan substrat asam urat masih sangat rendah bila dibandingkan dengan menggunakan enzim urikase murni. Selain itu, kestabilannya pun rendah, yaitu hanya stabil sampai hari ke-2. Rendahnya aktivitas dan kestabilan enzim urikase L. plantarum
diduga karena kurang selektifnya kinerja spektrofotometer dalam menentukan aktivitas urikase terhadap substrat. Oleh sebab itu, dilakukan penelitian ini untuk mengimobilisasi enzim urikase L. plantarum pada suatu nanomaterial untuk mendapatkan selektivitas dan kestabilan yang lebih baik.
enzim urikase bakteriL. plantarum. Oleh karena itu, penelitian penggunaan zeolit sebagai pengimobilisasi untuk enzim urikase yang berasal dari bakteri L. plantarum perlu untuk dilakukan. Penelitian ini bertujuan mengukur aktivitas dan kestabilan enzim urikaseL. plantarum yang diimobilisasi pada zeolit alam dengan metode elektrokimia.
TINJAUAN PUSTAKA
Biosensor
Metode yang umumnya banyak digunakan di bidang kedokteran untuk menentukan kadar asam urat adalah metode sinar-X, metode test strip dengan alat UA Sureblood uric meter, metode spektrofotometri, dan mikroskop polarisasi (Kertia dan Widodo 2009). Metode tersebut memiliki banyak kekurangan, seperti alat yang kurang stabil, biayanya yang mahal, sensitifitas, dan selektifitas yang rendah merupakan beberapa faktor mulai dikembangkan metode baru yang memiliki sensitifitas dan selektifitas yang lebih tinggi dari metode sebelumnya yaitu biosensor, suatu alat yang mengubah respon biologi menjadi sinyal listrik agar mudah diperoleh informasi di dalamnya. Biosensor yang menggunakan enzim sebagai elemen biologi dikenal sebagai biosensor berbasis enzim (Chaplin 2004). Biosensor berbasis enzim mulai diperkenalkan pertama kali oleh Prof Leland C Clark pada tahun 1961. Biosensor ini banyak dikembangkan untuk mengukur kandungan asam urat (Shankar et al. 2011, Yao et al. 2007, Mulyasuryani dan Hardiastutie 2011, Ardakaniet al. 2010), kapasitas antioksidan (Pisoschi et al. 2009, Coban 2008), kadar gula (Nien et al. 2006, Iswantini et al.
2011, Kotzian et al. 2006), kolestrol (Yang et al. 2011, Li dan Gu 2006, Nien et al.2006), dan lain-lain.
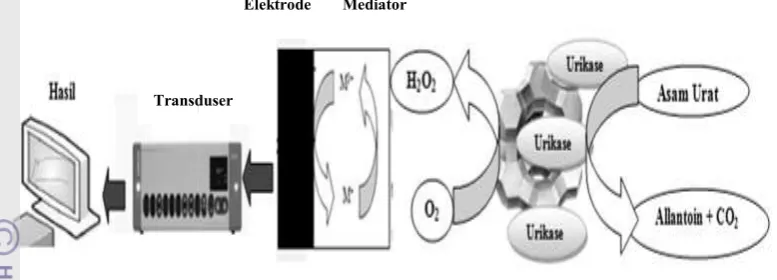
Gambar 1 Mekanisme kerja biosensor asam urat (Martin 2011)
Penelitian penentuan asam urat secara elektrokimia sudah banyak diteliti dan akan terus berkembang guna menghasilkan biosensor dengan tingkat selektifitas dan sensitifitasnya yang tinggi. Penelitian yang telah dilakukan di antaranya, Wang et al. (2006) yang memodifikasi elektrode karbon gelas dengan poly(p-toluena asam sulfonat) menghasilkan reprodusibilitas yang baik, selektifitasnya tinggi, dan sensitivitasnya sangat baik dalam menentukan asam urat dan asam askorbat. Yao et al. (2007) memodifikasi elektrode karbon gelas dengan poly(eriocrom black-T) menghasilkan sensitivitas yang bagus dan limit deteksi yang sangat baik dalam menentukan asam urat, dopamin, dan asam askorbat pada sampel biologi. Shishehbore dan Nasirizadeh (2009) memodifikasi elektrode pasta karbon dengan turunan koumestan yang menghasilkan aktivitas elektrokatalis yang baik pada penentuan asam urat. Zhang et al. (2010) memodifikasi elektrode gelas dengan lapisan komposit CTAB/kitosan yang dapat menghasilkan arus yang stabil dalam penentuan asam urat dan asam askorbat. Shankar et al. (2011) memodifikasi elektrode pasta karbon dengan polykristal violet menghasilkan stabilitas, sensitivitas, dan sensitivitas yang tinggi serta reprodusibel.
Urikase
Urikase (asam urat oksidase) merupakan enzim yang memiliki peran penting dalam metabolisme nitrogen dan katalis spesifik untuk oksidasi asam urat dengan bantuan air dan oksigen (Gambar 2). Enzim ini memiliki berat molekul sebesar 125000 g/mol dengan nilai Km dan pH optimum beragam sesuai sumber enzimnya. Katalisis enzim ini dilakukan dengan cara membuka cincin purin pada asam urat dengan keberadaan oksigen sebagai oksidator (Arslan 2008).
Gambar 2 Reaksi urikase dengan asam urat (Arslan 2008)
Asam Urat Allantoin
+ CO2+ H2O2
Mediator Elektrode
Transduser
Gambar 1 Mekanisme kerja biosensor asam urat (Martin 2011)
Penelitian penentuan asam urat secara elektrokimia sudah banyak diteliti dan akan terus berkembang guna menghasilkan biosensor dengan tingkat selektifitas dan sensitifitasnya yang tinggi. Penelitian yang telah dilakukan di antaranya, Wang et al. (2006) yang memodifikasi elektrode karbon gelas dengan poly(p-toluena asam sulfonat) menghasilkan reprodusibilitas yang baik, selektifitasnya tinggi, dan sensitivitasnya sangat baik dalam menentukan asam urat dan asam askorbat. Yao et al. (2007) memodifikasi elektrode karbon gelas dengan poly(eriocrom black-T) menghasilkan sensitivitas yang bagus dan limit deteksi yang sangat baik dalam menentukan asam urat, dopamin, dan asam askorbat pada sampel biologi. Shishehbore dan Nasirizadeh (2009) memodifikasi elektrode pasta karbon dengan turunan koumestan yang menghasilkan aktivitas elektrokatalis yang baik pada penentuan asam urat. Zhang et al. (2010) memodifikasi elektrode gelas dengan lapisan komposit CTAB/kitosan yang dapat menghasilkan arus yang stabil dalam penentuan asam urat dan asam askorbat. Shankar et al. (2011) memodifikasi elektrode pasta karbon dengan polykristal violet menghasilkan stabilitas, sensitivitas, dan sensitivitas yang tinggi serta reprodusibel.
Urikase
Urikase (asam urat oksidase) merupakan enzim yang memiliki peran penting dalam metabolisme nitrogen dan katalis spesifik untuk oksidasi asam urat dengan bantuan air dan oksigen (Gambar 2). Enzim ini memiliki berat molekul sebesar 125000 g/mol dengan nilai Km dan pH optimum beragam sesuai sumber enzimnya. Katalisis enzim ini dilakukan dengan cara membuka cincin purin pada asam urat dengan keberadaan oksigen sebagai oksidator (Arslan 2008).
Gambar 2 Reaksi urikase dengan asam urat (Arslan 2008)
Asam Urat Allantoin
+ CO2+ H2O2
Mediator Elektrode
Transduser
Gambar 1 Mekanisme kerja biosensor asam urat (Martin 2011)
Penelitian penentuan asam urat secara elektrokimia sudah banyak diteliti dan akan terus berkembang guna menghasilkan biosensor dengan tingkat selektifitas dan sensitifitasnya yang tinggi. Penelitian yang telah dilakukan di antaranya, Wang et al. (2006) yang memodifikasi elektrode karbon gelas dengan poly(p-toluena asam sulfonat) menghasilkan reprodusibilitas yang baik, selektifitasnya tinggi, dan sensitivitasnya sangat baik dalam menentukan asam urat dan asam askorbat. Yao et al. (2007) memodifikasi elektrode karbon gelas dengan poly(eriocrom black-T) menghasilkan sensitivitas yang bagus dan limit deteksi yang sangat baik dalam menentukan asam urat, dopamin, dan asam askorbat pada sampel biologi. Shishehbore dan Nasirizadeh (2009) memodifikasi elektrode pasta karbon dengan turunan koumestan yang menghasilkan aktivitas elektrokatalis yang baik pada penentuan asam urat. Zhang et al. (2010) memodifikasi elektrode gelas dengan lapisan komposit CTAB/kitosan yang dapat menghasilkan arus yang stabil dalam penentuan asam urat dan asam askorbat. Shankar et al. (2011) memodifikasi elektrode pasta karbon dengan polykristal violet menghasilkan stabilitas, sensitivitas, dan sensitivitas yang tinggi serta reprodusibel.
Urikase
Urikase (asam urat oksidase) merupakan enzim yang memiliki peran penting dalam metabolisme nitrogen dan katalis spesifik untuk oksidasi asam urat dengan bantuan air dan oksigen (Gambar 2). Enzim ini memiliki berat molekul sebesar 125000 g/mol dengan nilai Km dan pH optimum beragam sesuai sumber enzimnya. Katalisis enzim ini dilakukan dengan cara membuka cincin purin pada asam urat dengan keberadaan oksigen sebagai oksidator (Arslan 2008).
Gambar 2 Reaksi urikase dengan asam urat (Arslan 2008)
Asam Urat Allantoin
+ CO2+ H2O2
Mediator Elektrode
Urikase murni umumnya diperoleh dari hati sapi dan babi yang telah mengalami proses pemurnian. Penggunaan enzim murni memiliki beberapa kendala terutama harga enzim yang mahal. Oleh sebab itu, pemanfaatan mikroorganisme penghasil urikase adalah solusi untuk menekan biaya. Urikase saat ini telah banyak diisolasi dari beberapa mikroorganisme, misalnya berasal dari kapang adalah Saccaropolyspora sp. PNR 11 (Dmytruk et al. 2011) dan
Hanasunula polmorpha (Dmytruk et al. 2011); berasal dari khamir adalah
Candida utilis (Dmytruk et al. 2011) dan Gliomastix gueg (Atalla et al. 2009); sedangkan yang berasal dari bakteri adalah Pseudomonas aerugenosa (Atalla et al. 2009), Microbacterium sp. (Atalla et al. 2009), Bacillus thermochatelunatus
(Atallaet al. 2009), danL. plantarum(Mardiah 2010). BakteriL. plantarum
Bakteri L. plantarum termasuk ke dalam kingdom Bacteria, filum Firmicutes, kelas Bacili, ordo Lactobacillus, familia Lactobacillaceae, dan genus
Lactobacillus. Bakteri ini merupakan salah satu jenis bakteri asam laktat (BAL) homofermentatif dengan suhu optimum kurang dari 30oC dan memiliki pH optimum untuk pertumbuhan sebesar 6.5. Bakteri L. plantarum memiliki ciri, yaitu berbentuk batang, tidak bergerak (nonmotil), bersifat katalase negatif, aerob atau fakultatif anaerobik, mampu mencairkan gelatin, dan toleran terhadap asam. Selain itu, bakteri ini termasuk ke dalam bakteri gram positif. Ciri bakteri gram positif adalah dinding selnya terdiri atas 60 100 persen peptidoglikan dan semua bakteri gram-positif memiliki polimer lurus asam N-asetil muramat dan N-asetil glukosamin. Jika dinding sel beberapa bakteri gram positif diberi pewarna gram akan menghasilkan warna ungu (Rostini 2007).
Bakteri L. plantarum telah diketahui dapat menghasilkan beberapa enzim yang dapat dimanfaatkan sebagai komponen pengenal hayati biosensor. Enzim yang dihasilkan oleh bakteri tersebut adalah piruvat oksidase (POX) yang digunakan pada biosensor fosfat (Gavalas dan Chaniotakis 2001), laktat oksidase (LOX) yang digunakan pada biosensor asam laktat (Gamella 2010), dan urikase oksidase yang dapat digunakan untuk biosensor asam urat (Mardiah 2010).
Imobilisasi Enzim Urikase
Zeolit memiliki kerangka terbuka sehingga memungkinkan untuk melakukan adsorpsi ion yang bermuatan positif bertukar dengan Na, Ca, dan K maupun Al dengan Si (Mutngimaturrahma et al. 2003). Medan elektrostatik yang kuat di dalam rongga-rongga zeolit menghasilkan interaksi yang sangat kuat dengan molekul polar seperti air. Molekul nonpolar juga dapat diserap dengan kuat berkaitan dengan tenaga polarisasi dari medan listrik yang ada, sehingga separasi dapat dilakukan oleh zeolit (Widianti 2006). Oleh karena sifatnya tersebut, zeolit banyak dimanfaatkan sebagai katalis, penukar ion, adsorben, dan filter.
Nanopartikel zeolit yang digunakan dalam penelitian ini berasal dari alam, yaitu tepatnya berasal dari Bayah, Banten, Jawa Barat. Mineral zeolit alam umumnya terdapat dalam bentuk batuan modernit, klinoptilotit, barerit, kabalsit, stilbit, analkim, dan laumonlit. Zeolit yang berasal dari Bayah dominannya berjenis klinoptilotit yang merupakan zeolit dengan kandungan Si sedang dan terbentuk karena sedimentasi vulkanik. Zeolit klinoptilotit memiliki rumus molekul (Na4K4)(Al8Si40O96). 24H2O dengan kerangka Al dari zeolit tersebut tidak stabil terhadap panas dan asam (Gintinget al. 2007).
METODE
Penelitian aktivitas dan stabilitas urikase L. plantarum diawali dengan pembuatan media GYP, penumbuhan dan pemanenan L. plantarum, pembuatan elektrode pasta karbon, aktivasi zeolit, imobilisasi L. plantarum, pengukuran elektrokimia, penentuan mediator terbaik, optimalisasi aktivitas urikase L. plantarum, penentuan kinetika, dan penentuan kestabilan elektrode. Bagan alir penelitian secara umum ditampilkan pada Lampiran 1 dan 2.
Bahan dan Alat
Prosedur Penelitian
Media GYP (Glucose Yeast Peptone)(Mardiah 2010)
Media GYP padat dibuat dengan menimbang sebanyak 3.75 gram kalsium karbonat, 20 gram agar, 10 gram glukosa, 5 gram pepton, 1,4 gram natrium asetat, 5 ml larutan garam, 10 ml tween 80, 2 gram beef extract, dan 10 gram yeast extract dilarutkan dalam 1000 ml akuades dan diaduk hingga larut. Setelah itu, larutan kemudian diautoklaf. Media GYP cair padat dibuat sama seperti di atas tetapi tanpa penambahan agar dan kalsium karbonat.
Penumbuhan dan PemanenanL. plantarum(Mardiah 2010)
Sebanyak 5 ml media GYP cair dipipet ke dalam tabung reaksi. Sebanyak 1 ose bakteri L. plantarum murni ditanam ke media GYP cair tersebut dan diinkubasi pada suhu 37oC selama 24 jam. Setelah 24 jam, larutan tersebut diukur nilai OD600 hingga mencapai 0.5. Setelah itu, larutan tersebut dipindahkan ke-50 ml media GYP cair dan dan diinkubasi pada suhu 37oC selama 24 jam.
Sebanyak 5 ml larutan larutan GYP cair yang sudah ditumbuhiL. plantarum
dipipet ke tabung sentrifus dan disentrifus pada kecepatan 10.000 rpm selama 10 menit. Setelah itu, pelet dicuci 2 kali dengan akuades steril dan disentrifus pada kecepatan 10000 rpm selama 5 menit. PeletL. plantarumyang sudah bersih diberi larutan fisiologis (NaCl 0.85%) sebanyak 1 ml, kemudian diukur nilai OD600= 1. Pembuatan Elektrode Pasta Karbon (Weniarti 2011)
Elektrode pasta karbon dibuat dengan cara grafit dicampur dengan parafin cair (2:1), lalu digerus dengan mortar hingga terbentuk pasta. Setelah itu, pasta karbon dimasukkan ke dalam badan elektrode. Permukaan elektrode dihaluskan dan dibersihkan dengan amplas dan kertas minyak. Elektrode didiamkan selama 2 hari sebelum digunakan.
Aktivasi Zeolit (Arif 2011)
Sebanyak 50 gram zeolit halus dicuci dengan akuades sampai pH netral, disaring, dan dikeringkan dalam oven pada suhu 105 oC. Zeolit yang telah dikeringkan diaktivasi dengan menambah 250 ml HCl 3 M dalam gelas piala plastik dan diaduk selama 1 jam. Zeolit yang telah diaktivasi disaring, kemudian dicuci dengan akuades sampai pHnya netral. Larutan hasil saringan diuji kandungan klorin dengan AgNO3 dan dicuci kembali dengan akuades sampai tidak mengandung klorin. Setelah pHnya netral dan bebas klorin zeolit dikeringkan pada suhu 300 oC selama 3 jam. Zeolit yang telah diaktivasi kemudian dihaluskan dan diayak dengan ayakan 100 mesh.
ImobilisasiL. plantarum
Pengukuran Elektrokimia
Pengukuran elektrokimia dilakukan dengan metode voltametri siklik menggunakan eDAQ potensiostat (Ecorder 410) yang dilengkapi perangkat lunak Echem v 2.1.0. Elektrode yang digunakan adalah elektrode Ag/AgCl, platina, dan pasta karbon yang berturut-turut sebagai elektrode pembanding, elektrode pembantu (counter), dan elektrode kerja. Parameter pengukuran dibuat dengan
mode cyclic, initial -500 mV, final -500 mV, rate 250 mV/s, step W 20 ms, upper E 800mV, lower E -500 mV, range 5 V,danarus 100 A.
Sebanyak 2 ml larutan bufer boraks ditambahkan ke dalam sel pengukuran, lalu puncak arus yang terbentuk diamati sebagai puncak blanko. Selanjutnya, ditambahkan mediator sebanyak 100 L dan diukur kembali perubahan atau kenaikan puncak arus yang terjadi. Setelah itu, ditambahkan 100 L asam urat dan diukur kembali perubahan atau kenaikan puncak arus yang terjadi.
Penentuan Mediator Terbaik (Trivadila 2011)
Sebanyak 10 mM masing-masing mediator dibuat dengan cara dilarutkan dalam DMSO untuk Ferosena dan 2,3-dimetoksi-5-metil-1,4-benzokuinon (Q0). Sedangkan untuk K3[Fe(CN)6] dilarutkan dengan akuabides steril. Setelah itu, larutan mediator diukur secara elektrokimia dengan menggunakan elektrode kerja pasta karbon yang telah diimobilisasi dengan pelet L. plantarum tanpa zeolit. Mediator yang menghasilkan arus paling tinggi adalah mediator terbaik.
Optimalisasi Aktivitas UrikaseL. plantarum
Optimalisasi yang akan dilakukan adalah suhu (25 45 oC), pH (7 10), konsentrasi asam urat (0.001 0.05 mM), dan berat zeolit (30 240 mg). Metode yang digunakan untuk pengoptimuman aktivitas urikase adalah Respon Surface Method. Metode ini dilakukan dengan cara memasukan kombinasi faktor-faktor peubah bebas pada perangkat lunak statistik minitab. Setelah itu, percobaan dilakukan sesuai dengan kombinasi yang dihasilkan untuk mendapatkan nilai aktivitas optimumnya.
Parameter Kinetik (Weniarti 2011)
Penentuan parameter kinetik dilakukan setelah diperoleh kondisi optimum aktivitas urikase. Parameter kinetik ekstrak enzim urikase Lactobacillus plantarum yang diimobilisasikan ditentukan dengan menggunakan persamaan Michealis-Menten :
I= [ ]
[ ]
dengan adalah respon arus maksimal yang terukur (apperent), adalah konstanta Michaelis-Menten dan [Asam urat] adalah konsentrasi asam urat.
Penentuan Kestabilan Elektrode (Taufan 2012)
Stabilitas elektrode ditentukan dari pengukuran aktivitas enzim urikase setelah didapatkan kondisi optimumnya. Pengukuran aktivitas secara langsung dilakukan pada elektrode yang telah dibuat dengan imobilisasi enzim urikase pada permukaan elektrode. Elektrode diukur ulang tiap kurun waktu 0, 1, 2, 3, 4, 5, 6, 7 hari dan seterusnya hingga terjadi penurunan % stabilitas aktivitas urikase. Presentasi kestabilan elektrode dapat dihitung dengan menggunakan rumus :
% Stabilitas = (100% ([( )] 100 %)
HASIL DAN PEMBAHASAN
Penumbuhan dan PemanenanL. plantarum
Bakteri L. plantarum ditumbuhkan pada media GYP cair dan diinkubasi pada suhu 37oC, yaitu suhu optimum pertumbuhan L. plantarum. Salah satu ciri bahwa L. plantarum tumbuh pada media GYP cair adalah terbentuknya warna putih pada dinding kaca tabung reaksi (Gambar 3a). Pemanenan L. plantarum
dilakukan dengan mengempar media GYP cair yang telah ditumbuhi bakteri. Pelet
L. plantarumyang mengendap di dasar (Gambar 3b).
(a) (b)
Gambar 3 KulturL. plantarummenempel pada dinding kaca tabung reaksi (a) dan peletL. plantarumyang terpisah dari media (b)
Berdasarkan Gambar 3a, L. plantarum dapat menempel dengan baik pada dinding kaca. Oleh karena itu, L. plantarum sangat sesuai sebagai pengimobilisasi. Penelitian ini mengimobilisasi sel bakteri L. plantarum secara langsung ke permukaan elektrode dan zeolit karena berdasarkan penelitian Mardiah (2010) bakteri L. plantarum sudah dapat mengeksresikan urikase di dinding selnya sehingga tidak diperlukan pemecah dinding sel bakteri tersebut.
Aktivasi Zeolit
(Ginting et al. 2007). Oleh karena itu, pada penelitian ini zeolit terlebih dahulu dihaluskan dan diaktivasi. Penghalusan zeolit akan memperluas permukaannya sehingga dapat meningkatkan efisiensi proses dan meningkatkan kemungkinan dihasilkannya permukaan yang lebih seragam (Arif 2011).
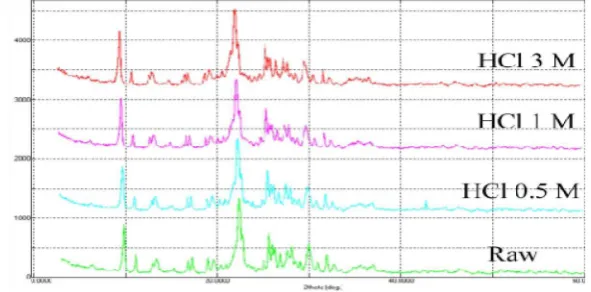
Aktivasi zeolit pada penelitian ini dilakukan secara fisik dan kimia. Aktivasi secara fisis dilakukan dengan cara pemanasan pada suhu 300 400 oC, agar zeolit mengalami dehidrasi, yang membuka pori-pori atau rongga-rongga utama pada zeolit (Widianti 2006). Aktivasi kimia dilakukan pada suasana asam, untuk membuang pengotor, mengatur kembali letak atom yang dapat dipertukarkan, dan diharapkan dapat menaikkan daya tukar kationnya (Widianti 2006). Digunakan konsentrasi HCl yang tinggi, yaitu HCl 3 M untuk mempersingkat waktu aktivasi. Penggunaan konsentrasi tinggi ini tidak merusak struktur zeolit. Pola difraktogram pada Gambar 4 tidak memperlihatkan perubahan signifikan setelah aktivasi zeolit dengan berbagai konsentrasi HCl hingga 3 molar.
Gambar 4 Pola difraktogram zeolit Bayah dengan perlakuan asam (Arif 2011) Penentuan Mediator Terbaik
Mediator merupakan agen pentransfer elektron yang mudah berpartisipasi dalam reaksi redoks dengan komponen biologis tertentu sehingga dapat mempercepat proses transfer elektron pada reaksi enzimatis. Mediator terbaik adalah yang memberikan arus paling tinggi pada proses oksidasi senyawa tertentu (Jiang dan Zhao 2010).
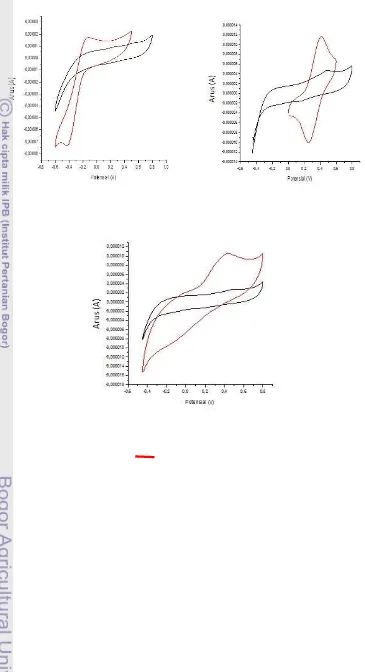
Dari ketiga jenis mediator, yaitu K3[Fe(CN)6], 2,3-dimetoksi-5-metil-1,4-benzokuinon (Q0), dan ferosena (Fe(C5H5)2), mediator terbaik untuk proses oksidasi asam urat oleh urikaseL. plantarum adalah Q0. Berdasarkan Tabel 1, Q0 memberikan arus oksidasi paling tinggi dibandingkan dengan mediator yang lain. Nilai arus oksidasi ditentukan dengan mengukur puncak oksidasi pada kurva voltamogram (Gambar 5) menggunakan program Echem v2.1.0. Data hasil pengukuran dapat dilihat pada Lampiran 3.
Tabel 1 Arus oksidasi rata-rata beberapa jenis mediator
Mediator Arus Oksidasi ( A)
Q0 28.2800
Ferosena 5.4400
(a) (b)
(c)
Gambar 5 Voltamogram (a) QO, (b) Ferosena, dan (c) K3Fe(CN)6; Bufer ( ) dan mediator ( )
Perbandingan ImobilisasiL. plantarum
Dua jenis metode imobilisasi urikase L. plantarum dibandingkan dalam penelitian ini, yaitu imobilisasi langsung ke permukaan elektrode pasta karbon dan imobilisasi pada zeolit baru kemudian ke permukaan elektrode. Jumlah selL. plantarumyang digunakan untuk setiap imobilisasi adalah 7.5 × 105cfu/ml.
tanpa zeolit. Ardacani et al. (2009) menggunakan nanokomposit zeolit dan elektrode pasta karbon dapat meningkatkan sensitivitas dan arus pada penentuan logam Cu2+. Kemampuan zeolit meningkatkan respon arus dikarenakan zeolit memiliki rangka dan pori yang seragam sehingga enzim yang terjerap menghasilkan selektivitas dan keterulangan yang lebih tinggi (Weniarti 2011). Voltamogram perbedaan metode imobilisasi dapat dilihat pada Gambar 6.
Tabel 2 Arus oksidasi beberapa sampel
Sampel Arus Oksidasi ( A)
Bufer 1.3300
Q0 3.3000
Asam urat 5.5700
Asam urat , Zeolit 14.4200
Gambar 6 Voltamogram perbedaan arus oksidasi beberapa sampel; bufer ( ), QO ( ), asam urat ( ), dan asam urat dengan zeolit ( )
Optimalisasi Aktivitas UrikaseL. plantarum
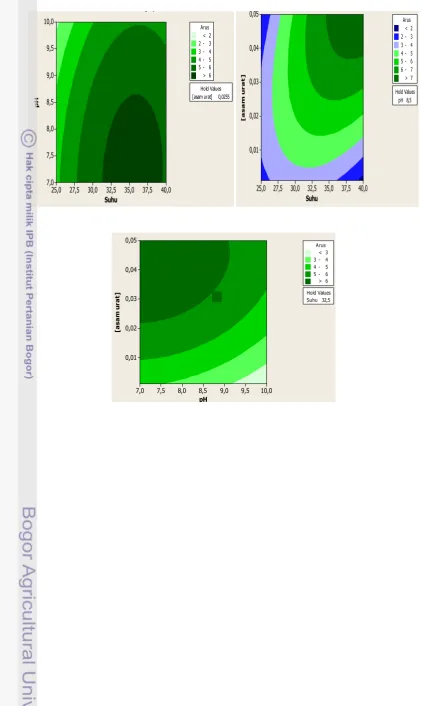
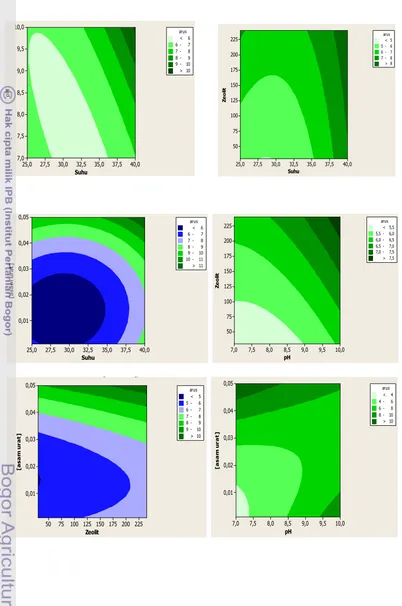
Optimalisasi untuk aktivitas urikase L. plantarum dilakukan dengan menggunakan rancangan percobaan metode respons permukaan (RSM) meliputi parameter suhu (25 45 oC), pH (7 10), dan konsentrasi asam urat (0.001 0.05 mM), (Lampiran 4). Gambar 7 memperlihatkan alur kontur hubungan suhu dengan pH (a), suhu dengan konsentrasi asam urat (b), dan konsentrasi asam urat dengan pH (c). Kondisi optimum aktivitas urikase L. plantarum diperoleh pada pH 7.6, suhu 40oC, dan konsentrasi asam urat 0.05 mM. Daerah optimum tersebut ditunjukkan dengan warna alur kontur yang semakin gelap dan arus oksidasi yang tinggi. Hasil optimalisasi yang diperoleh digunakan untuk pengukuran selanjutnya.
A
rus (
A
(a) (b)
(c)
Gambar 7 Alur kontur hubungan suhu dengan pH (a), suhu dengan konsentrasi asam urat (b), dan konsentrasi asam urat dengan pH (c)
Sensor tidaklah praktis bila digunakan pada suhu 40 oC. Oleh karena itu, dilakukan pengukuran pada suhu kamar. Arus yang diperoleh dari hasil pengukuran tersebut tidaklah berbeda jauh dengan suhu 40 oC (Lampiran 5) sehingga sensor dapat digunakan pada suhu kamar. Hasil yang diperoleh dengan kondisi optimum penelitian Mardiah (2010) menggunakan metode spektrofotometri, yaitu aktivitas urikase L. plantarum adalah pada pH 8.5 dan suhu 35 oC. Ini dikarenakan perbedaan sensitivitas dan selektivitas kinerja alat yang digunakan.
Optimalisasi Aktivitas UrikaseL. plantarumdengan Zeolit
Optimalisasi aktivitas urikase L. plantarum yang diimobilisasi pada nanokomposit zeolit dilakukan untuk melihat pengaruh penambahan zeolit terhadap aktivitas dan stabilitas urikase. Parameter yang dioptimalkan adalah suhu (25 45oC), pH (7 10), konsentrasi asam urat (0.001 0.05 mM), dan massa zeolit (30 240 mg), (Lampiran 6). Alur kontur pada Gambar 8 menunjukkan kondisi
Contour Plot of Arus vs pH; Suhu
optimum L. plantarumyang diimobilisasi pada nanokomposit zeolit, pH 10, suhu 40oC, konsentrasi asam urat 0.05 mM, dan massa zeolit 225 mg.
(a) (b)
(c) (d)
(e) (f)
Gambar 8 Alur kontur hubungan suhu dengan pH (a), suhu dengan zeolit (b), suhu dengan asam urat (c), pH dengan zeolit (d), zeolit dengan asam urat (e), dan pH dengan asam urat
Perbedaan pH imobilisasi dan tanpa imobilisasi pada zeolit kemungkinan dikarenakan adanya interaksi yang terjadi antara enzim dengan zeolit sehingga
Suhu
Contour Plot of arus vs pH; Suhu
Suhu
Contour Plot of arus vs [asam urat]; Suhu
pH
Contour Plot of arus vs Zeolit; pH
Zeolit
Contour Plot of arus vs [asam urat]; Zeolit
pH
mempengaruhi aktivitas enzim urikase. Nilai pH yang diperoleh masuk ke dalam selang imobilisasi maksimum enzim urikase yaitu 7.5-10 (Mulyasuryani dan Hardiastutie 2011). Sensor menjadi kurang praktis bila digunakan pada suhu 40 o
C. Oleh dikarena itu, pengoptimalan pada suhu kamar dilakukan dengan faktor pH dan suhu (Lampiran 7) sehingga diperoleh kondisi pH 7.6, suhu 28 oC, konsentrasi asam urat 0.05 mM, dan massa zeolit 225 mg (Lampiran 8).
Kinetika UrikaseL. plantarum
Spesifitas enzim terhadap substrat dapat ditentukan dari parameter kinetika enzim, yaitu tetapan Michaelis-Menten (KM) dan laju maksimum (Vmaks) yang
dianalogikan dengan arus maksimum. Parameter kinetika enzim ditentukan dengan mengukur aktivitas urikase L. plantarum pada konsentrasi substrat 0.001 0.05 mM. Data hasil pengukuran aktivitas ditampilkan pada Lampiran 6 dan dialirkan pada Gambar 9.
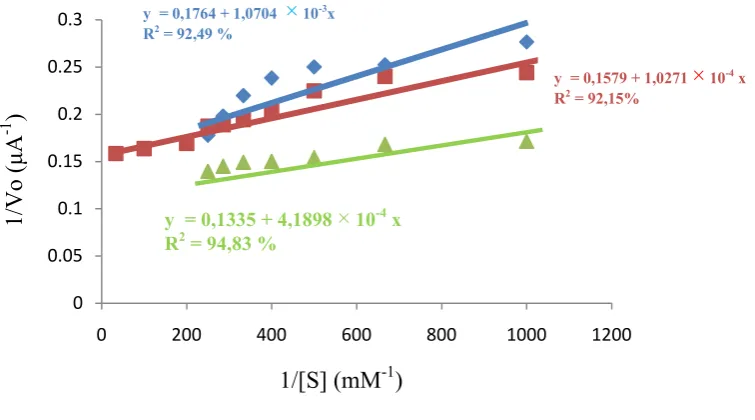
Gambar 9 Persamaan regresi dan linearitas hubungan konsentrasi substrat dengan aktivitas urikase; urikase murni ( ), tanpa zeolit ( ) dan dengan zeolit ( )
Alur pada Gambar 9 menunjukan hubungan konsentrasi substrat dan aktivitas urikase L. plantarum yang identik dengan kurva Michaelis-Menten. Kurva tersebut menunjukkan 2 tahap reaksi. Tahap pertama terjadi pada kisaran konsentrasi 0.001 0.005 mM dan belum semua tapak aktif urikase L. plantarum
Untuk memperoleh nilai KM dan Vmaks, digunakan persamaan
Michaelis-Menten ke transformasi aljabar persamaan Lineweaver-Burk. Kurva dan persamaan regresi yang diperoleh (Gambar 10) menghasilkan nilai KM dan Vmaks
seperti dijelaskan pada Lampiran 7 dan 8.
Gambar 10 Kurva Lineweaver-Burk urikaseL. plantarum; urikase murni ( ), tanpa zeolit ( ), dan dengan zeolit ( )
NilaiKM danVmakstanpa imobilisasi dan dengan imobilisasi adalah 6.068 ×
10-3mM dan 5.6689 A serta 6.0292 × 10-3mM dan 6.3331 A. NilaiKMdengan
imobilisasi lebih kecil daripada tanpa imobilisasi menunjukkan afinitas enzim dengan imobilisasi lebih besar sehingga rendahnya konsentrasi substrat sudah dapat menjenuhkan enzim. Jika hasil tersebut dibandingkan dengan nilai KM
urikase murni Bacillus fastidious dan Candida sp. maka hasilnya berbeda yaitu 3.1384 × 10-3 mM dan 5.2 × 10-3 mM (Yang et al. 2011). Perbedaan ini dikarenakan jenis bakteri yang digunakan berbeda namun demikian nilai Km yang diperoleh masuk ke dalam selang Km untuk urikase yaitu 1.3 × 10-3 60 × 10-3 mM (Yanget al.2011).
Nilai KM dan Vmaks yang diperoleh berbeda dengan penelitian Mardiah
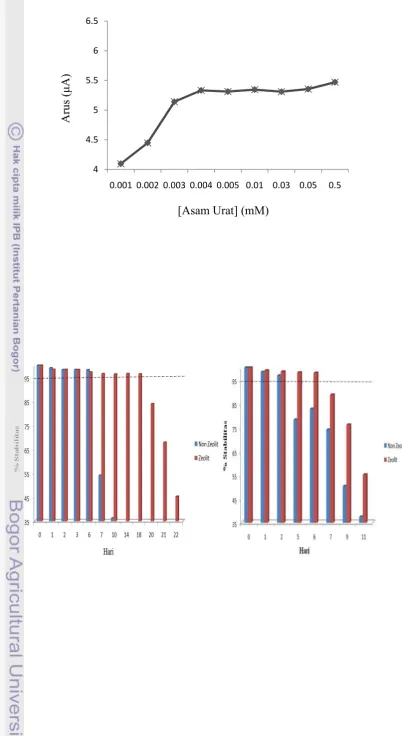
(2010) yaitu 0.1541 mM dan 1.3635. Ini kemungkinan dikarenakan perbedaan sensitivitas dan selektivitas kinerja alat. Spektrofotometer hanya mengukur berdasarkan seberapa banyak sinar yang diserap atau dihamburkan oleh sampel sedangkan metode elektrokimia hanya mendeteksi elektron yang dihasilkan dari proses oksidasi maupun reduksi. Selain itu, konsentrasi asam urat yang dapat dideteksi dengan menggunakan metode spektrofotometer secara in vivo sampai 0.0045 mM (Mardiah 2010) dan bila menggunakan metode elektrokimia dapat mendeteksi asam urat hingga konsentrasi 0.5 mM (Gambar 13).
0
0 200 400 600 800 1000 1200
Gambar 11 Kurva hubungan arus dengan konsentrasi asam urat Kestabilan Elektrode
Stabilitas elektrode ditentukan dari pengukuran aktivitas urikase setelah didapatkan kondisi optimal urikase secara langsung melalui pengukuran arus yang didapat. Stabilitas elektrode digambarkan sebagai hubungan persen kestabilan dengan waktu dimana persen kestabilan pada hari ke-0 dianggap 100% yang ditunjukan pada Gambar 14.
a b
Gambar 12 Kurva stabilitas urikase pada 10oC (a) dan 28oC (b)
Berdasarkan hasil pengujian yang telah dilakukan bahwa kestabilan elektrode yang disimpan pada suhu 10oC lebih lama yaitu stabil sampai hari ke-6, sedangkan bila disimpan pada suhu kamar (28oC) elektrode tersebut stabil sampai hari ke-2. Ini karena terjadi denaturasi enzim oleh panas. Semakin tinggi suhu semakin mudah rusak enzim tersebut dan aktivitasnya menurun (Lehninger 1998).
4 4.5 5 5.5 6 6.5
0.001 0.002 0.003 0.004 0.005 0.01 0.03 0.05 0.5
[Asam Urat] (mM)
A
rus
(
A
Hasil kestabilan pada suhu kamar yang diperoleh sama dengan hasil penelitian oleh Mardiah (2010) dengan menggunakan metode spektrofotometri.
Imobilisasi L. plantarum pada zeolit dapat meningkatkan kestabilan. Ini dapat dilihat pada Gambar 12, yaitu kestabilan elektrode pada suhu kamar (28oC) stabil sampai hari ke-6, sedangkan bila disimpan pada suhu 10oC elektrode stabil sampai hari ke-18. Kenaikan kestabilan elektrode dengan mengimobilisasi L. plantarum pada zeolit kemungkinan karena sebagian sisi aktif enzim terlindungi oleh zeolit sehingga memperlambat proses denaturasi. Data hasil pengukuran kestabilan dapat dilihat pada Lampiran 9.
SIMPULAN DAN SARAN
Simpulan
UrikaseL. plantarum yang diimobilisasi pada zeolit memiliki aktivitas yang lebih tinggi dibandingkan tanpa diimobilisasi dengan zeolit. Aktivitas enzim dihubungkan dengan perubahan arus listrik. Nilai KM urikaseL. plantarum tanpa imobilisasi pada zeolit lebih kecil dibandingkan KM dengan imobilisasi pada zeolit. Ini menunjukkan afinitas urikase L. plantarum dengan imobilisasi pada zeolit lebih besar dibandingkan tanpa imobilisasi pada zeolit. Imobilisasi urikase
L. plantarum pada zeolit dapat meningkatkan kestabilan dan kestabilan elektrode akan meningkat bila disimpan pada suhu 10oC.
Saran
1. Perlu dilakukan pemberian nutrisi pada saat imobilisasi untuk meningkatkan stabilitas elektrode.
2. Perlu dilakukan imobilisasi pada jenis zeolit alam yang lain untuk menentukan jenis zeolit terbaik.
3. Hasil penelitian yang telah dilakukan perlu diaplikasikan secara langsung pada seperangkat alat biosensor asam urat.
DAFTAR PUSTAKA
Arif Z. 2011. Karakterisasi dan modifikasi zeolit alam sebagai bahan media pendeteksi studi kasus : kromium heksavalen [tesis]. Bogor (ID) : Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Arslan F. 2008. An amperometric biosensor for uric acid determination prepared from uricase immobilized in polyaniline-polypyrrole film. Sensors Articels
8:492-500. doi : 10.3390/s8095492.
Attala MM et al. 2009. Optimum conditions uricase enzyme production by
Ardacani MM, Akrami Z, Kazeiman H, Zare RH. 2009. Preconcentration and electroanalysis of copper at zeolite nanocomposite modified carbon paste electrode. Int J Electrochem 4:308-319. Tersedia dari : www.electrochemsci.org/papers/vol4/4020308.pdf.
Azab EA, Ali MM, Fareed MF. 2005. Studies on uricase in certain bacteria.Egyp J Biol7:44-54. Tersedia dari : web.usm.my/mjm/issus/vol5no1/research8.pdf.
Chaplin M. 2004. Biosensor. http ://www.isbuk.ac.uk/biology/enztech/biosensor. Html [26 Januari 2012].
Coban S. 2008. Development of biosensor determination of the total antioxidant capacity [thesis]. Izmir (TR) : The Graduate School of Engineering and Science, Izmir Institut of Technology.
Dmytruk K et al. 2011. Construction of uricase-overproducing strains of
Hansenula polymorpha and its application as biological recognition element in microbial urate biosensor. Bmc Biotech 11: 50-58. doi : 10.3923 /pjbs.2011.226.231.
Gamella M. 2010. Intregated multienzyme electrochemical biosensors for monitoring malolactic fermetation in wines [abstract]. In the : Quimica Analitica, Madrid, 17-25 Januari 2010. http://dx.doi.org/10.1016/j. talanta.2010.01.038 [21 April 2012].
Gavalas VG, Chaniotakis NA. 2001. Phosphate biosensor based on electrolyte-stabilized pyruvate oxsidase. Analy Chem Acta 427:271-277. Tersedia dari : 144.206.159.178/ft/38/30149/521370.pdf.
Ginting A, Anggraini D, Indrayati S, Kriswarini R. 2007. Karakteristik komposisi kimia, luas pori, dan sifat termal zeolit dari daerah Bayah, Tasikmalaya, dan Lampung. Serpong (ID) : LIPI-BATAN.
Grieshaber D, Mackenzeil A, Voros IJ, Reimhult E. 2008. Riview paper guanin and adenin biosensor. J Biosen Bioelect 24:591-599. Tersedia dari : www.mdpi.com/1424-8220/9/4/3122/pdf.
Iswantini D, Nurhidayat N, Trivadila. 2011. Glucose biosensor using selected Indonesia bacteria. J Microbiol Indones 5:9-14. Tersedia dari : jurnal.permi.or.id/index.php/mionline/article/viewFile/128/pdf.
Jiang H, Zhao Z. 2010.Enzyme Based Electrochemical Biosensor. Vukavar (HR) : Intench.
Kertia N, Widodo S. 2009. Artritis gout dengan nefropati urat : suatu studi kasus.
Berkala Kesehatan Klinik14:56-67.
Khalilzadeh Bet al. 2009. Zeolite nanoparticle modified carbon paste electrode as abiosensor for simultaneous determination of dopamine and tryptophan. J Chin Chem Soc 56:789-796. Tersedia dari : www.ibb.ut.ac.ir/rsb/program /Poster%20Session%202.pdf.
Kotzian P et al. 2006. Amperometric glucose biosensor based on radium
dioxide-modified carbon ink. J Electroanaly 18:1499-1504. Tersedia dari : www.nccr.iitm.ac.in/Frontiers%20in%20Chemistry.pdf.
Lehninger AL. 1998. Dasar-Dasar Biokimia. Thenawijaya M, penerjemah. Jakarta (ID) : Erlangga. Terjemahan dari :Principles of Biochemistry.
Li PJ, Gu HN. 2006. Aselective cholestrol biosensor based on composite film
modified electrode from amperometric detection. J Chin Chem Soc
53:575-582. Tersedia dari : proj3.sinica.edu.tw/~chem/servxx6/files/paper_7391_1
Mardiah DE. 2010. Aktivitas urikase yang dihasilkan dari berbagai sel Lactobaciilus plantarum dan parameter kinetiknya [skripsi]. Bogor (ID) : Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Martin C. 2011. Prinsip Biosensor.
http://www.newsmedical.net/health/Biosensor-Principle-(indonesia).aspx [20 Januari 2012].
Mateo et al. 2007. Improvement of enzyme activity, stability, and selectivity via immobilization technique. J Enzymitech 40:1451-1463. Tersedia dari : www.sciencedirect.com/science/article/pii/S0141022907000506.
Mulyasuryani A, Hardiastutie A. 2011. Conductimetric biosensor for the detection of uric acid by immobilization uricase on nata de coco membrane. J Anal Chem Insights 6:47-51. Tersedia dari : www.ncbi.nlm.nih.gov/pmc/ articles/PMC3140265.
Mutngimaturrahma, Gunawan, Khabibi. 2003. Aplikasi zeolit alam terdealuminasi dan termodifikasi HDTMA sebagai adsorben fenol. Semarang (ID) : Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Diponogoro.
Nien PC, Chen PY, Ho CK. 2009. Fabrication on amperometric cholestrol biosensor by covalent linkage between poly(3-thiopheniatic acid) and cholestrol oxidation. Sensors 9:1794:1806. Tersedia dari : www.mdpi.com/1424-8220/9/3/1794/pdf.
Pisoschi AM, Cheregi MC, Danet AF. 2009. Total antioxidant capacity of some commercial fruit juices : Electrochemical and spectrofotometrical approach.
Molecules 14:480-493. Tersedia dari : www.mdpi.com/1420-3049/ 14/1/480/pdf.
Rostini I. 2007. Peranan Bakteri asam laktat (Lactobacillus plantarum) terhadap masa simpan filet nila merah pada suhu rendah [tesis]. Jatinangor (ID) : Fakultas Perikanan dan Ilmu Kelautan, Universitas Padjajaran.
Shankar SS, Kumara BE, Chandra U, Sherigara BS. 2011. Simultaneous determination of dopamine, ascorbic acid and uric acid at poly(crystal violet) modified carbon paste electrode.J Bioelectrochem 5:462-477. Tersedia dari : www.abechem.com/No.%205-2011/2011,3,5,462-477.pdf.
Shishehbore MR, Nasirizadeh N. 2009. Simultaneous determination of ascorbic acid and uric acid at coumestan derivative modified carbon paste electrode.J. Iran Chem 2: 47-56. Tersedia dari : www.sid.ir/en/ VEWSSID/J_pdf/1018020090105.pdf.
Taufan B. 2012. Validasi metode biosensor elektrokimia berbasis superoksida dismutase untuk mengukur kapasitas anti oksidan [skripsi]. Bogor (ID) : Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Trivadila. 2011. Biosensor antioksidan menggunakan superoksida dimutase
Deinococcus radioduransyang diimobilisasi pada permukaan elektroda pasta karbon dan parameter kinetiknya [tesis]. Bogor (ID) : Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Varoyd C, Gligor D, Muresan ML. 2007. Carbon paste electrodes incorporating synthetic zeolites and methylene blue for amperometric detection of ascorbic acid. J Babesbolia 1:1-10. Tersedia dari : chem.ubbcluj.ro/~studiachemia/docs/pdf20071/12.pdf.
Weniarti. 2011. Biosensor antioksidan berbasis superoksida dismutase
Deinoccocus radiodurans diimobilisasi pada nanokomposit zeolit alam Indonesia [tesis]. Bogor (ID) : Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Widianti T. 2006. Pengujian kapasitas tukar kation zeolit sebagai penukar kation alami untuk pengolahan limbah industri. Tangerang (ID) : Pusat Penelitian Sistem Mutu dan Pengujian-LIPI.
Yang JY, Li Y, Chen MS, Lin KC. 2011. Fabrication of a cholestrol biosensor based on cholestrol oxidase and multiwall carbon nanotube hybrid composite.
Int J Electrochem 6:2223-2234. Tersedia dari : www.electrochemsci.org/papers/vol6/6062223.pdf.
Yao Het al. 2007. Electrochemical characterization of poly(eriochrome black T) modified glassy carbon electrode and its application to simultaneous determination of dopamine, ascorbic acid, and uric acid.J Elec Acta 52:6165-6171. Tersedia dari : www.sciencedirect.com/science/article/pii/S001346860 7004744.
Lampiran 1 Diagram alir penumbuhan dan pemanenan selL. plantarum
MikrobLactobacillus plantarum
Pemisahan pelet (sel) dari media
Sel bakteri dipanen
(sentrifugasi 10000 rpm,t= 15 menit)
Inkubasi sampaiOD600=0.5
Media GYP padat
Starter
Ditanam
0.5 ml starter diambil
Inkubasi pada 30oC selama 1 hari
Media GYP cair Inkubasi pada 37oC
DiukurOD600kerapatan
sel = 1
Lampiran 2 Diagram alir penelitian secara umum
Pembuatan Elektrode Pasta Karbon
Imobilisasi Enzim Urikase
Penentuan Mediator Terbaik
Penentuan Kinetika Enzim Optimalisasi Aktivitas Urikase dan
Bakteri Terimobilisasi Aktivasi Zeolit
Penentuan Kestabilan Elektrode Penumbuhan dan Pemanenan
Lampiran 3 Penentuan mediator terbaik
Ulangan Arus oksidasi ( A) Mediator QO Ferosena K3[Fe(CN)6]
1 28.39 5.43 4.18
2 28.11 5.44 4.23
3 28.34 5.45 4.22
Rataan 28.28 5.44 4.21
SD 0.1493 0.0100 0.0270
Lampiran 4 Hasil pengukuran arus oksidasi imobilisasi tanpa zeolit
No Suhu (oC) pH [asam urat] (mM) Arus Oksidasi ( A)
1 28.04 7.61 0.0109 4.9710
2 36.96 7.61 0.0109 5.0225
3 28.04 9.39 0.0109 2.5300
4 36.96 9.39 0.0109 3.7733
5 28,04 7.61 0.0400 5.2530
6 36.96 7.61 0.0400 8.6862
7 28.04 9.39 0.0400 4.0233
8 36.96 9.39 0.0400 6.7500
9 25.00 8.50 0.0255 3.2818
10 40.00 8.50 0.0255 4.7989
11 32.50 7.00 0.0255 4.9215
12 32.50 10.00 0.0255 5.0925
13 32.50 8.50 0.0010 3.6683
14 32.50 8.50 0.0500 5.3893
15 32.50 8.50 0.0255 6.3060
16 32.50 8.50 0.0255 6.1038
17 32,50 8.50 0.0255 5.0900
18 32.50 8.50 0.0255 5.4192
19 32.50 8.50 0.0255 5.8800
Lampiran 5 Perbandingan tanpa imobilisasi pada pH 7.6, suhu 28oC dan 40oC
Arus ( A)
Ulangan 28oC 40oC
1 7.5000 7.1700
2 7.2400 7.1100
3 7.1500 7.1300
Rata-rata 7.2967 7.1367
7.2400 7.1300
SD 0.1818 0.0305
S2 0.0330 0.0009
H0 = 7.13 H1 7.13 Z =
S2/
Z = 30.90
Selang kepercayaan 95% Z0.05> 2.9200
Lampiran 6 Hasil pengukuran arus oksidasi imobilisasi dengan zeolit
No Suhu (oC) pH Zeolit (mg) [asam urat] (mM) Arus Oksidasi ( A)
1 28.75 7.60 82.50 0.0378 7.2370
2 36.25 7.60 82.50 0.0133 5.7240
3 28.75 9.25 82.50 0.0133 4.8900
4 36.25 9.25 82.50 0.0378 6.9340
5 28.75 7.60 187.50 0.0133 5.8933
6 36.25 7.60 187.50 0.0378 9.2633
7 28.75 9.25 187.50 0.0378 6.5363
8 36.25 9.25 187.50 0.0133 7.9953
9 2875 7.60 82.50 0.0133 4.1833
10 36.25 7.60 82.50 0.0378 8.5153
11 28.75 9.25 82.50 0.0378 6.7558
12 36.25 9.25 82.50 0.0133 5.6030
13 28.75 7.60 187.50 0.0378 9.2046
14 36.25 7.60 187.50 0.0133 4.2906
15 28.75 9.25 187.50 0.0133 5.2413
16 36.25 9.25 187.50 0.0378 8.1055
17 25.00 8.50 135.00 0.0255 5.8789
18 40.00 8.50 135.00 0.0255 9.2636
19 32.50 7.00 135.00 0.0255 4.1127
20 32.50 10.00 135.00 0.0255 8.9690
21 35.50 8.50 30.00 0.0255 5.8800
22 32.50 8.50 240.00 0.0255 6.6853
23 32.50 8.50 135.00 0.0255 5.7130
24 32.50 8.50 135.00 0.0255 6.1530
25 32.50 8.50 135.00 0.0010 7.3646
26 32.50 8.50 135.00 0.0500 8.9875
27 32.50 8.50 135.00 0.0255 6.1350
28 32.50 8.50 135.00 0.0255 5.6600
29 32.50 8.50 135.00 0.0255 6.3660
30 32.50 8.50 135.00 0.0255 4.9695
Lampiran 7 Penentuan imobilisasi zeolit pada suhu kamar
No pH Suhu (oC) Arus ( A)
1 7.60 28.00 8.2170
2 10.0 28.00 5.8490
3 7.60 40.00 6.7890
4 10.00 40.00 4.3205
5 6.50 32.50 6.7423
6 10.00 32.50 5.1043
7 8.500 20.00 4.3240
8 8.500 40.00 6.7890
9 8.500 32.50 5.4132
10 8.500 32.50 6.5432
11 8.500 32.50 6.8907
12 8.500 32.50 6.1023
13 8.500 32.50 6.2345
Lampiran 8 Perbandingan imobilisasi zeolit pada pH 7.6, 28oC dan pH 10, 40oC
Ulangan pH 7.6, 28oC pH 10, 40oC
1 8.63 8.36
2 8.49 8.57
3 8.58 8.34
Rata-rata 8.5667 8.4233
8.5800 8.3600
SD 0.0709 0.1274
S2 0.0050 0.0162
H0 = 8.36 H1 8.36 Z = 2/ Z= 20.06
Selang kepercayaan 95% Z0.05> 2.9200
Lampiran 9 Aktivitas urikaseL. plantarumterhadap konsentrasi substrat
Konsentrasi (mM)
Tanpa Zeolit ( A)
Zeolit ( A)
Urikase murni ( A)
0.0010 4.0970 3.6151 5.8315
0.0015 4.2626 3.8640 5.9410
0.0020 4.4480 3.9965 6.4760
0.0025 4.9056 4.1950 6.6565
0.0030 5.1410 4.5503 6.7020
0.0035 5.2850 5.0540 6.8880
0.0040 5.3330 5.6278 7.1528
0.0050 5.3130 5.9070 7.1510
0.0100 5.2460 5.9060 6.8570
0.0300 5.2110 6.0060 6.8220
0.0500 5.1710 6.1026 6.8770
Lampiran 10 Perhitungan persamaan Lineweaver-Burk untukL. plantarum
[Substrat] Non Zeolit Zeolit
(mM) V0 ( A)
1/[S]
(1/mM) 1/V0 (1/ A) V0 ( A)
1/[S] (1/mM)
1/V0 (1/ A)
0.0010 3.6151 1000.0000 0.2766 4.0970 1000.0000 0.2441
0.0015 3.9640 666.6667 0.2523 4.1626 666.6667 0.2402
0.0020 3.9965 500.0000 0.2502 4.4480 500.0000 0.2248
0.0025 4.1950 400.0000 0.2383 4.9056 400.0000 0.2038
0.0030 4.5503 333.3333 0.2198 5.1410 333.3333 0.1945
0.0035 5.0540 285.7143 0.1979 5.2850 285.7143 0.1892
0.0040 5.3333 250.0000 0.1875 5.6278 250.0000 0.1777
0.0050 5.9070 200.0000 0.1693
0.0100 6.1069 100.0000 0.1637
Non Zeolit
1/V0 = 1/Vmaks+KM/Vmaks. 1/[S]
y = 0.1764 + 1.0704 × 10-3x, R2= 92.49% Intersep-Y :
1/Vmaks = 0.1764 A-1
Vmaks = 5.6689 A Kemiringan :
KM/Vmaks = 1.0704 × 10-3 mM-1
KM = 6.0680 × 10-3 mM
Imobilisasi pada Zeolit
1/V0 = 1/Vmaks+KM/Vmaks. 1/[S]
y = 0.1579 + 1.0271 × 10-4x, R2= 92.15% Intersep-Y :
1/Vmaks = 0.1613 A-1
Vmaks = 6.3331 A Kemiringan :
KM/Vmaks = 9.7251 × 10-4mM-1
Lampiran 11 Perhitungan persamaan Lineweaver-Burk untuk enzim urikase
S (mM) V0 ( A) 1/S (1/mM) 1/V0 (1/ A)
0.0010 5.8315 1000.0000 0.1715
0.0015 5.9410 666.6667 0.1683
0.0020 6.4760 500.0000 0.1544
0.0025 6.6565 400.0000 0.1502
0.0030 6.7020 333.3333 0.1493
0.0035 6.8880 285.7143 0.1452
0.0040 7.1528 250.0000 0.1398
Perhitungan :
1/V0 = 1/Vmaks+KM/Vmaks. 1/[S]
y = 0.1335 + 4.1898 × 10-4x, R2= 94.83% Intersep-Y :
1/Vmaks = 0.1335 A-1
Vmaks = 7.4936 A Kemiringan :
KM/Vmaks = 4.1898 ×10-4 mM-1
KM = 3.1397 × 10-3 mM
Lampiran 12 Data hasil pengukuran kestabilan elektrode Bila disimpan pada suhu 10oC
Hari Tanpa Zeolit Dengan Zeolit
Arus ( A) %Stabilitas Arus ( A) %Stabilitas
0 4.1876 100.00 4.1500 100.00
1 4.2330 9.892 4.0786 98.28
2 4.1130 9.822 4.1367 98.26
3 4.1126 9.821 4.0753 98.20
6 4.0912 9.812 4.2680 97.16
7 6.1090 5.412 4.0047 96.50
10 6.8565 3.627 3.9991 96.36
14 4.0064 96.54
18 4.0006 96.40
20 3.5033 84.00
21 2.8167 67.87
Bila disimpan pada suhu kamar
Hari Tanpa Zeolit Dengan Zeolit
Arus ( A) %Stabilitas Arus ( A) %Stabilitas
0 5.2413 100.00 5.4090 100.00
1 5.3380 98.16 5.4765 98.75
2 5.0120 96.63 5.3165 98.28
5 6.3647 78.16 5.2992 97.97
6 6.1480 82.70 5.2890 97.78
7 6.6060 74.00 4.7923 88.60
9 7.8500 50.28 4.1123 76.03
11 8.5205 37.44 8.3904 55.12
Hari 1 tanpa zeolit pada suhu 10oC
% Stabilitas = (100%-([( )]×100 %)) = (100%-([( , , )
, ]×100 %))