IMOBILISASI SEL Saccharomyces cerevisiae MENGGUNAKAN
ALGINAT- KITOSAN DAN UJI STABILITASNYA UNTUK
PRODUKSI ETANOL DARI MOLASE SECARA
FERMENTASI BATCH
SKRIPSI
ADRI HUDA
100802040
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
IMOBILISASI SEL
Saccharomyces cerevisiae
MENGGUNAKAN
ALGINAT-KITOSAN DAN UJI STABILITASNYA UNTUK
PRODUKSI ETANOL DARI MOLASE SECARA
FERMENTASI BATCH
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
ADRI HUDA 100802040
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : IMOBILISASI SEL Saccharomyces cerevisiae
MENGGUNAKAN ALGINAT-KITOSAN DAN UJI STABILITASNYA UNTUK PRODUKSI ETANOL DARI MOLASE SECARA FERMENTASI BATCH
Kategori : SKRIPSI
Nama : ADRI HUDA
Nomor Induk Mahasiswa : 100802040
Program Studi : SARJANA (S1) KIMIA
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUANALAM UNIVERSITAS SUMATERA UTARA
Disetujui di
Medan, Agustus 2014 Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
PERNYATAAN
IMOBILISASI SEL Saccharomyces cerevisiae MENGGUNAKAN ALGINAT-KITOSAN DAN UJI STABILITASNYA UNTUK
PRODUKSI ETANOL DARI MOLASE SECARA FERMENTASI BATCH
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dari ringkasan yang masing-masing disebutkan sumbernya.
Medan, Agustus 2014
PENGHARGAAN
Puji dan Syukur serta Penghargaan yang Paling tinggi saya ucapkan kepada Allah SWT atas segala berkah kepada saya baik keberkahan Ilmu, Waktu dan Kesempatan sehingga saya dapat menyelesaikan skrips iini. Shalawat beriring kan salam saya ucapkan untuk Nabi Besar Muhammad SAW yang telah menjadi Tokoh dan Motivator yang ada dalam diri saya, sehingga dalam Penyusunan skripsi ini saya selalu diberi kemudahan oleh Nya.
Dengan segenap jiwa dan raga saya, saya mengucapkan terimakasih kepada Orang tua saya Risda, dan kepada Andung dan Atuk saya, H. Abdullah Sani dan Hj. Rahil yang dengan penuh kasih sayang serta tak bosan-bosannya selalu membimbing dan mendukung apa yang saya lakukan selama jenjang studi Strata 1 ini. Terimakasih juga telah menjadi Orang tua yang sempurna yang selalu memberikan kasih dan sayang yang tulus kepada saya. Penghargaan juga saya berikan kepada Om saya Yasirwan Sani, SE dan Nizhamul, SE yang selal umemberi motivasi dan sumbangan materi kepada saya.Terimakasih juga saya ucapkan kepada adik-adik saya Dara Amanda Tasya dan Alvino Gunawan yang telah menjadi motivasi saya selama kuliah untuk menjadi yang terbaik. Untuk Sahabat saya, Alfi Fadhli, Muhammad Syarif Hidayat, Yudi Umara dan (Alm) Faizin S. Hasibuan yang selalu menemani saya selama ini. Saya persembahkan skripsi ini untuk kalian semua yang sangat berpengaruh terhadap hidup saya.
Saya juga mengucapkan Terimakasih setulus hati kepada :
1. Dr. Rumondang Bulan, M.S sebagai Dosen Pembimbing I dan Drs. Firman Sebayang, M.S sebagai dosen Pembimbing II yang selalu menjadi tempat Diskusi dan member masukan kepada saya dalam menyelesaikan Penelitian dan Skripsisaya.
2. Ketua dan Sekretaris Departemen Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam , Universitas Sumatera Utara
3. Dr. Marpongahtun sebagai Dosen Wali saya, Dr. Yuniarti Yusak serta seluruh dosen Kimia FMIPA USU, Prof. Harlem Marpaung sebagai Pembina IMK yang selalu membimbing saya untuk memimpin IMK selama periode 2014-2015.
4. Rekan-rekan asisten Laboratorium Biokimia/KBM FMIPA USU, Muhammad Sadani, Maimunah, Sumariah, FahrurezaArifni, Bang Saipul, Bang Ari, Kak Tika dan Kak Echa, serta Adik-adik 2011 Firdha, Alex, Habibi, Isti, Novi dan Putri.
ABSTRAK
IMMOBILIZATION CELL OF Saccharomyces cerevisiae USING ALGINATE-CHITOSAN AND ITS STABILITY FOR ETHANOL PRODUCTION FROM
MOLASSES WITH BATCH FERMENTATION
ABSTRACT
DAFTAR ISI
2.3 Sel Saccharomyces cerevisiae 11
2.3.1. Sumber energi 13
2.3.2. Pertumbuhan sel Saccharomyces cerevisiae 14
2.4 Alginat 16
2.5 Kitosan 18
2.6 Imobilisasi sel 19
2.6.1 Metode imobilisasi 20
2.7 Fermentasi 22
2.7.1 Pengertian fermentasi 22
2.7.2 Pembagian fermentasi 23
2.7.3 Mekanisme fermentasi 24
2.8 Kromatografi gas 25
2.9 Mikroskop cahaya 25
BAB 3 METODOLOGI PENELITIAN 27
3.1 Alat dan Bahan 27
3.1.1 Alat-alat 27
3.2 Prosedur penelitian 29
3.2.1 Pembuatan larutan pereaksi 29
3.2.1.1 Pembuatan larutan asam asetat 2 % 29 3.2.1.2 Pembuatan larutan alginat 3 % 29 3.2.1.3 Pembuatan larutan CaCl2 2% 29 3.2.1.4 Pembuatan larutan kitosan 1 % - CaCl2 2% 30 3.2.1.5 Pembuatan larutan buffer sitrat pH 4 30
3.2.2 Pembuatan larutan media 30
3.2.2.1 Pembuatan media Potato Dextrose Agar (PDA) 30 3.2.2.2 Pembuatan media Yeast Pepton Glukosa (YPG) 31
3.2.2.3 Pembuatan media starter 31
3.2.2.4 Pembuatan media fermentasi 31 3.2.3. Isolasi sel Saccharomyces cerevisiae 31
3.2.3.1 Pengembangbiakan sel Saccharomyces cerevisiae dengan metode cawan sebar 31 3.2.3.2 Pengembangbiakan sel Saccharomyces cerevisiae
pada medium cair YGP 32
3.2.3.3 Pembuatan starter sel Saccharomyces cerevisiae 32 3.2.4 Imobilisasi sel Saccharomyces cerevisiae 32 3.2.5 Fermentasi molase menggunakan
sel Saccharomyces cerevisiae terimobil 32 3.2.6 Analisis kadar gula reduksi sebelum dan setelah fermentasi 33 3.2.7 Analisis kadar etanol yang dihasilkan dari
proses fermentasi 33
3.2.6.1 Pemisahan etanol dari hasil fermentasi 33 3.2.6.2 Analisis kadar etanol menggunakan
kromatografi gas 33
3.2.8 Pengujian stabilitasi dari
sel Saccharomyces cerevisiae terimobil 34 3.2.8.1 Pengujian stabilitas bead menggunakan
uji tekanan osmosis 34
3.2.8.2 Pengujian stabilitas bead berdasarkan
kerusakan setelah fermentasi 34 3.2.8.3 Pengujian stabilitas bead berdasarkan
jumlah pemakaian bead pada fermentasi 34 3.2.9 Pengujian interaksi antara sel S.cerevisiae,
Ca-alginat dan kitosan 34
3.3 Bagan Penelitian 35
3.3.1 Isolasi sel Saccharomyces cerevisiae 35 3.3.2 Imobilisasi sel Saccharomyces cerevisiae 36 3.3.3 Fermentasi molase menggunakan
3.3.4 Regenerasi bead 38
3.3.5 Analisis kadar etanol 38
3.3.6 Pengujian stabilitas dari bead
sel Saccharomyces cerevisiae terimobil 39 3.3.7 Pengujian interaksi antara sel S.cerevisiae,
Ca-alginat dan kitosan 39
BAB 4 HASIL DAN PEMBAHASAN 40
4.1 Hasil penelitian 40
4.1.1 Isolasi sel Saccharomyces cerevisiae 40 4.1.1.1 Pengembangbiakan sel Saccharomyces cerevisiae
dengan metode cawan sebar 40
4.1.1.2 Uji positif sel Saccharomyces cerevisiae 41 4.1.1.3 Pengembangbiakan sel Saccharomyces cerevisiae
pada media YGP 41
4.1.2 Imobilisasi sel Saccharomyces cerevisiae 42 4.1.2.1 Menghitung jumlah sel total 42
4.1.2.1.1 Menghitung jumlah sel Saccharomyces cerevisiae yang tidak terimobilisasi 43
4.1.3 Analisis kadar gula reduksi
sebelum dan sesudah fermentasi 45
4.1.4 Analisis kadar etanol dari hasil fermentasi 45 4.1.3.1 Analisis kualitatif dan kuantitatif etanol 45 4.1.5 Pengujian stabilitas dari sel Saccharomyces cerevisiae 46
4.1.4.1 Pengujian stabilitas bead menggunakan
uji tekanan osmosis 46
4.1.4.2 Pengujian stabilitas bead berdasarkan kerusakan
setelah fermentasi 47
4.1.5 Pengujian interaksi antara sel Saccharomyces cerevisiae
Ca-alginat-kitosan 48
4.1.5.1 Uji menggunakan mikroskop cahaya 48
4.1.5.2 Uji menggunakan FT-IR 49
4.2 Pembahasan 50
4.2.1 Isolasi sel Saccharomyces cerevisiae 50 4.2.1.1Pengembangbiakan sel Saccharomyces cerevisiae
dengan metode cawan sebar 50
4.2.1.2 Uji positif sel Saccharomyces cerevisiae 50 4.2.1.3 Pengembangbiakan sel Saccharomyces cerevisiae
pada media YGP 51
Saccharomyces cerevisiae terimobil 53 4.2.4 Analisis kadar etanol dari proses fermentasi 53 4.1.3.1 Analisis kualitatif dan kuantitatif etanol 54 4.2.5 Pengujian stabilitas dari sel Saccharomyces cerevisiae 56
4.2.5.1 Pengujian stabilitas bead menggunakan
uji tekanan osmosis 56
4.2.5.2 Pengujian stabilitas bead berdasarkan kerusakan
setelah fermentasi 56
4.2.5.3 Pengujian stabilitas bead berdasarkan
jumlah pemakaian pada proses fermentasi 58 4.2.6 Pengujian interaksi antara
sel Saccharomyces cerevisiae-Ca-alginat-kitosan 59 4.2.6.1 Uji menggunakan mikroskop cahaya 59
4.2.6.2 Uji menggunakan FT-IR 59
BAB 5 KESIMPULAN DAN SARAN 60
5.1 Kesimpulan 60
5.2 Saran 60
DAFTAR TABEL
Nomor Judul Halaman
tabel
Tabel 2.1 Komposisi kimia molase black strap 10
Tabel 2.2 Kandungan kimia S. Cerevisiae 12
Tabel 2.3 Komposisi sel Saccharomyces cerevisiae 12 Tabel 2.4 Kandungan asam amino dalam Saccharomyces cerevisiae 13 Tabel 4.1 Jumlah sel Saccharomyces cerevisiae pada media starter 42 Tabel 4.2 Jumlah sel yang dihitung dari masing-masing hasil
pencucian bead 43
Tabel 4.3 Hubungan antara konsentrasi gula reduksi, laju konsumsi
glukosa dan etanol 45
Tebel 4.4 Uji Kualitatif dan kuantitatif Etanol 46
DAFTAR GAMBAR
Nomor Judul Halaman
Gambar
Gambar 2.3 Sel Saccharomyces cerevisiae dengan perbesaran 10 x 40 12 Gambar 2.4 Kurva pertumbuhan sel Saccharomyces cerevisiae 15 Gambar 2.5 Struktur dasar penyusun alginat 16 Gambar 2.6 Proses terbentuknya egg box dari alginat 18 Gambar 2.7 Struktur dasar penyusun dari kitosan 19 Gambar 2.8 Proses pembentukan etanol dari glukosa 24 Gambar 4.1 Sel Saccharomyces cerevisiae tumbuh dalam media PDA
setelah 48 jam 40
Gambar 5.a Sel Saccharomyces cerevisiae dengan pembesaran 10 x 40 41 Gambar 5.b Sel Saccharomyces cerevisiae dengan pembesaran 10 x10 41 Gambar 6.a Media YPG sebelum ditumbuhkan dengan
sel Saccharomyces cerevisiae 42 Gambar 6.b Media YPG setelah ditumbuhkan oleh
sel Saccharomyces cerevisiae 42 Gambar 7.1 Sel Saccharomyces cerevisiae terimobil 44 Gambar 7.2 Gambar permukaan bead dengan pengujian osmosa
menggunakan NaCl 0,2 %. Analisa menggunakan
DAFTAR LAMPIRAN
Hasil kromatografi gas etanol hasil fermentasi - Fermentasi ke 1
Spektrum FT-IR sel Saccharomyces cerevisiae terimobilisasi alginat-kitosan
ABSTRAK
IMMOBILIZATION CELL OF Saccharomyces cerevisiae USING ALGINATE-CHITOSAN AND ITS STABILITY FOR ETHANOL PRODUCTION FROM
MOLASSES WITH BATCH FERMENTATION
ABSTRACT
BAB 1
PENDAHULUAN
1.1Latar Belakang
Etanol merupakan salah satu sumber energi alternatif yang dapat dijadikan sebagai energi alternatif dari bahan bakar nabati (BBN). Etanol mempunyai beberapa kelebihan dari pada bahan bakar lain seperti premium antara lain sifat etanol yang dapat diperbaharui, menghasilkan gas buangan yang ramah lingkungan karena gas CO2 yang dihasilkan rendah (Jeon, 2007).
Molase adalah sirup yang mengandung glukosa dan fruktosa yang sangat sulit untuk dikristalkan. Molase merupakan produk limbah dari industri gula dimana produk ini masih banyak mengandung gula dan asam – asam organik, sehingga merupakan bahan baku yang sangat baik untuk dijadikan sebagai bahan baku pembuatan etanol ataupun industri etanol. Bahan ini merupakan produk samping dari industri gula pasir dengan kandungan gula dari molase terutama sukrosa berkisar 40-55% 2008).
isolasi produk hasil fermentasi dan juga sel yang digunakan tidak dapat diperoleh kembali sehingga ragi yang digunakan hanya dapat digunakan sekali saja. Teknik ini juga memiliki kekurangan antara lain sel yang digunakan dapat rusak dan mati diakibatkan oleh faktor inhibisi dari produk hasil fermentasi yaitu etanol. Etanol merupakan senyawa yang dapat memecah dinding sel dari sel Saccharomyces cerevisiae sehingga ketersediaan etanol dengan kapasitas tertentu dapat menyebabkan kematian sel Saccharomyces cerevisiae semakin cepat. Kadar etanol yang dapat ditoleransi oleh sel sebesar 14%. Sel Saccharomyces cerevisiae bebas juga tidak dapat mentoleransi dari perubahan lingkungan seperti pH dan suhu dari lingkungan media fermentasinya.
Untuk dapat mengatasi masalah diatas maka dilakukan suatu teknik imobilisasi sel dengan metode penjebakan dalam mikrokapsul, dimana sel Saccharomyces cerevisiae yang digunakan dibatasi pergerakannya dalam suatu matrix dengan tidak mengurangi daya aktifitas dari sel tersebut, namun dapat meningkatkan daya aktivitasnya dan melindungi sel tersebut dari perubahan lingkungan. Keunggulan dari teknik imobilisasi yaitu dapat meningkatkan produktivitas volumetrik , meningkatkan konsentrasi produk dalam proses fermentasi, mampu menurunkan konsentrasi substrat (Goksungur et al, 2001) dan membuat proses pemisahan produk lebih mudah dikarenakan sel yang digunakan tidak larut dalam media fermentasi.
Firman Sebayang (2006) telah melakukan penelitian tentang Pembuatan etanol dari molase secara fermentasi menggunakan sel Saccharomyces cerevisiae yang terimobilisasi pada kalsium alginat. Sel yang terimobil hanya terjebak pada satu lapisan (single layer) dari matrix, cara ini memiliki kelemahan yaitu ketidakmampuan sel dalam menahan pergerakan pertumbuhan sel yang terjadi di dalam bead. Hal ini disebabkan sel yang dijebak dapat memperbanyak diri didalam bead. Akibatnya sel yang dijebak dengan lapisan single kalsium alginat cenderung akan bocor dan sel akan terlepas dari dalam mikrokapsul.
Untuk dapat mengatasi hal diatas, bead dari kalsium alginat harus dilapisi kembali dengan suatu lapisan luar yang tidak mengandung sel sehingga bead yang dihasilkan dapat terlapisi oleh dua lapisan (Yokotsuka et al, 1997). Penambahan lapisan dari bead dapat meningkatkan kestabilan dari bead sehingga dapat efisiensi penggunaan bead dapat meningkat. Salah satu lapisan yang dapat digunakan untuk melapisi bead Ca-Alginat-sel adalah kitosan. Hal ini didasarkan pada kemampuan dari kitosan yang memiliki gugus positif amino untuk mengisi kenegatifan dari gugus asam karboksil dari alginat secara ikatan ionik sehingga membentuk suatu kompleks polielektrolit (Takahashi et al, 1990). Atas dasar diatas, maka kitosan dapat digunakan sebagai lapisan kedua dari bead kalsium alginat yang menjebak sel Saccharomyces cerevisiae.
bead dalam proses fermentasi serta pengaruh kerusakan permukaan bead terhadap kadar etanol yang dihasilkan.
Pengujian kadar etanol dilakukan dengan menggunakan kromatografi gas. Hal ini didasarkan pada sifat fisik dari etanol yang mudah menguap. Kromatografi gas merupakan teknik kromatografi yang digunakan untuk memisahkan senyawa organik yang mudah menguap (Mardoni et al, 2007). Pengujian stabilitas bead dilakukan dengan melihat permukaan dari bead pada awal dan setiap akhir fermentasi menggunakan mikroskop cahaya dan juga diuji menggunakan uji tekanan osmosis. Pengujian ini didasarkan untuk mengetahui bagaimana pengaruh fermentasi dan lapisan kitosan dalam melapisi dan meningkatkan sifat fisik dari bead terhadap laju difusi substrat dan produk dari dan ke dalam bead, pengaruh ion perusak kestabilan bead dan faktor inhibisi dari etanol. Pengujian interaksi antara sel S. cerevisiae, Ca-alginat dan kitosan dilakukan dengan mikroskop cahaya dan fourier transform infra red (FT-IR). Penggunaan mikroskop dapat digunakan untuk melihat secara langsung lapisan dari kitosan dan alginat yang menyusun dari bead. Penggunaan FT-IR bertujuan untuk melihat apakah terdapat spektrum senyawa kitosan dan alginat yang menyusun dari sel imobil, terdapatnya spektrum tersebut menjadi landasan bahwa telah terlapisi ca-alginat-sel dengan kitosan.
1.2Permasalahan
1. Bagaimana stabilitas sel Saccharomyces cerevisiae terimobil jika digunakan pada produksi etanol dari molase secara fermentasi batch?
1.3 Pembatasan masalah
Dalam penelitian ini permasalahan dibatasi pada:
1. Sel Saccharomyces cerevisiae yang digunakan adalah sel yang telah diisolasi dari ragi roti saf-instan yang dijual di pasar sore Padang bulan
2. Molase yang digunakan adalah molase Black Strap
3. Molase yang digunakan memiliki kadar % gula reduksi sebesar 35.585% kemudian diencerkan hingga 14.295% dimana kadar gula reduksinya diuji menggunakan penentuan gula reduksi metode lane-eynon
4. Natrium alginat yang digunakan memiliki konsentrasi 3 % 5. Kitosan yang digunakan memiliki konsentrasi 1 %
6. Buffer yang digunakan adalah buffer sitrat 0,1 M dengan pH 4.0 7. Suhu fermentasi dilakukan pada suhu 30oC
8. Waktu fermentasi yang digunakan adalah 48 jam
9. Jumlah (g) beadyang dipergunakan dalam fermentasi adalah 150 g 10.Jumlah (ml) media fermentasi yang digunakan adalah 150 ml
11.Etanol yang dianalisis kadarnya adalah etanol yang dipisahkan dengan media fermentasi menggunakan alat rotarievaporator.
1.4Tujuan Penelitian
1. Untuk mengetahui stabilitas sel Saccharomyces cerevisiae terimobil jika digunakan pada produksi etanol dari molase secara fermentasi batch
1.5Manfaat Penelitian
Dari hasil penelitian diharapkan sel Saccharomyces cerevisiae terimobil dapat dimanfaatkan pada industri etanol maupun dalam pengolahan limbah molase (tetes tebu) dari pabrik gula tebu sehingga dapat menghasilkan etanol yang maksimal dangan penggunaan biomassa yang lebih efektif
1.6Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Biokimia FMIPA-USU, Laboratorium Kultur Jaringan FMIPA USU dan Laboratorium Terpadu USU.
1.7Metodologi Penelitian
selanjutnya bead dicuci kembali menggunakan akuades sebanyak 3 kali dan digunakan dalam fermentasi berikutnya hingga diperoleh jumlah etanol yang menurun secara signifikan atau memiliki konsentrasi yang sama dengan fermentasi menggunakan sel bebas. Setiap selesai fermentasi dilakukan uji kerusakan permukaan bead menggunakan mikroskop cahaya. Bead yang dihasilkan juga dianalisa interaksi antara penyusunnya menggunakan mikroskop cahaya. Pengujian stabilitas bead dilakukan dengan melihat permukaan dari bead pada awal dan setiap akhir fermentasi menggunakan mikroskop cahaya dan juga diuji menggunakan uji tekanan osmosis.
Adapun variabel – variabel dalam penelitian adalah:
1. Variabel bebas adalah variabel yang mempunyai pengaruh terhadap jumlah etanol yang terbentuk yaitu :
- Stabilitas dan bentuk permukaan dari mikrokapsul yang terbentuk
- Konsentrasi glukosa dari molase
2. Variabel terikat adalah variabel yang terukur terhadap perubahan perlakuan. Dalam penelitian ini yang menjadi variabel terikat yaitu :
- Jumlah etanol yang terbentuk
- Efisiensi penggunaan sel Saccharomyces cerevisiae yang terimobilisasi (bead) dalam fermentasi
- Konsentrasi glukosa dari molase tiap akhir fermentasi
3. Variabel tetap adalah variabel yang dibuat tetap sehingga tidak menyebabkan terjadinya perubahan variabel terikat. Dalam penelitian ini variabel tetap adalah :
- Konsentrasi alginat
- Konsentrasi kitosan
- Konsentrasi CaCl2
- Waktu fermentasi
- pH dan suhu fermentasi
BAB 2
TINJAUAN PUSTAKA
2.1 Etanol
Etanol atau sering juga disebut dengan alkohol adalah suatu cairan transparan, mudah terbakar, tidak berwarna, mudah menguap, dengan rumus kimia C2H5OH, dapat bercampur dengan air, eter, dan kloroform, yang diperoleh melalui fermentasi karbohidrat dari ragi yang disebut juga dengan etil alkohol (Bender, 1982).
Etanol atau etil alkohol (C2H5OH) termasuk kelompok hidroksilyang memberikan polaritas pada molekul dan mengakibatkan meningkatnya ikatan hidrogen intermolekuler. Etanol memiliki massa jenis 0.7893 g/mL. Titik didih etanol pada tekanan atmosfer adalah 78.32 °C. Indeks bias dan viskositas pada temperatur 20°C adalah 1.36143 dan 1.17 cP (Kirk and Othmer, 1965). Etanol digunakan pada berbagai produk meliputi campuran bahan bakar, produk minuman, penambah rasa, industri farmasi, dan bahan-bahan kimia.
Etanol merupakan salah satu sumber energi alternatif yang dapat dijadikan sebagai energi alternatif dari bahan bakar nabati (BBN). Etanol mempunyai beberapa kelebihan dari pada bahan bakar lain seperti premium antara lain sifat etanol yang dapat diperbaharui, menghasilkan gas buangan yang ramah lingkungan karena gas CO2 yang dihasilkan rendah (Jeon, 2007).
1. Etanol untuk konsumsi umumnya dihasilkan dengan proses fermentasi atau peragian bahan makanan yang mengandung pati atau karbohidrat, seperti beras dan umbi. Etanol yang dihasilkan dari proses fermentasi biasanya berkadar rendah. Untuk mendapatkan etanol dengan kadar yang lebih tinggi diperlukan proses pemurnian melalui penyulingan ataupun destilasi. Etanol untuk keperluan industri dalam skala lebih besar dihasilkan dari fermentasi tetes tebu, yaitu hasil samping dalam industri gula tebu atau gula bit.
2. Melalui sintesis kimia melalui reaksi antara gas etilen dan uap air dengan asam sebagai katalis. Katalis yang dipakai biasanya asam fosfat. Asam sulfat juga dapat digunakan sebagai katalis, namun sangat jarang digunakan. 2008).
Etanol dapat dijadikan sebagai bahan bakar, namun harus etanol dengan kadar kemurnian yang tinggi atau terbebas oleh air. Adapun cara pemurnian etanol dapat dilakukan dengan destilasi tetapi kemurniannya hanya sampai 96% karena adanya peristiwa azeotrop antara campuran etanol dan air. Untuk dapat memperoleh etanol dengan kadar yang tinggi maka dilakukan suatu cara yaitu absorbsi fisik atau molecular sieve. Dalam penggunaan etanol sebagai bahan bakar, tidak dapat langsung digunakan pada kendaraan bermotor, namun etanol harus ditambahkan dengan bensin. Sebagai contoh sebanyak 10% etanol dari 1 liter bensin dapat digunakan sebagai bahan bakar (disebut E10). Namun haruslah berhati-hati dalam penggunaan bahan bakar ini, karena etanol yang digunakan harus benar-benar bebas dari air, dikarenakan ketersediaan air dapat menyebabkan kerusakan dan korosi pada mesin.
2.2 Molase
Dalam industri gula dari tebu diperoleh suatu limbah dari sisa pengkristalan gula pasir berbentuk cairan berwarna coklat kehitaman yang disebut dengan molase. Molase adalah sirup yang mengandung glukosa dan fruktosa yang sangat sulit untuk dikristalkan. Molase merupakan produk limbah dari industri gula dimana produk ini masih banyak mengandung gula dan asam – asam organik, sehingga merupakan bahan baku yang sangat baik untuk dijadikan sebagai bahan baku pembuatan ataupun industri etanol. Bahan ini merupakan produk samping dari industri gula pasir dengan kandungan gula dari molase terutama sukrosa berkisar 40-55%
Molase dapat dikonversi menjadi etanol melalui proses fermentasi, biasanya pH molase berkisar antara 5,5-6,5. Molase yang telah diencerkan hingga 10-18% telah memberikan hasil yang memuaskan dalam menghasilkan etanol dari proses fermentasi
Molase dari tebu dapat dibedakan menjadi 3 jenis. Molase kelas 1, kelas 2 dan “black strap”. Molase kelas 1 didapatkan saat pertama kali jus tebu dikristalisasi. Saat dikristalisasi terdapat sisa jus yang tidak mengkristal dan berwarna bening. Maka sisa jus ini langsung diambil sebagai molase kelas 1. Kemudian molase kelas 2 atau biasa disebut dengan “Dark” diperoleh saat proses kristalisasi kedua. Warnanya agak kecoklatan sehingga sering disebut dengan istilah “Dark”. Dan molase kelas terakhir yaitu “Black Strap” diperoleh dari kristalisasi terakhir. Warna “Black Strap” ini memang mendekati hitam (coklat tua)
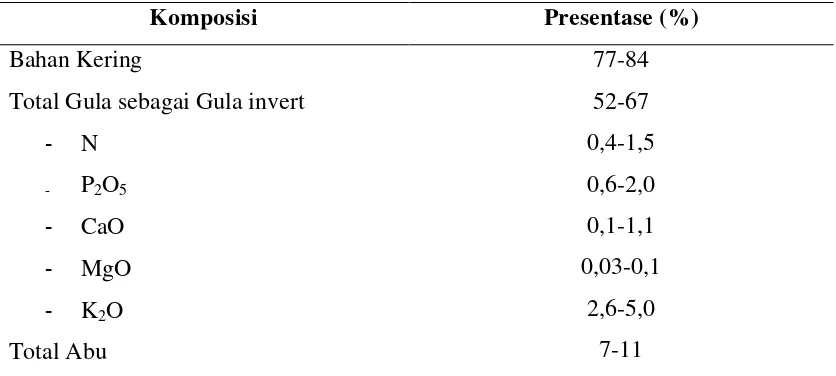
Tabel 2.1. Komposisi kimia molase black strap
Komposisi Presentase (%)
Bahan Kering
Total Gula sebagai Gula invert
- N
2.3 Sel Saccharomyces cerevisiae
Saccharomyces cerevisiae merupakan khamir sejati tergolong eukariot yang secara morfologi hanya membentuk blastospora berbentuk bulat lonjong, silindris, oval atau bulat telur yang dipengaruhi oleh strainnya. Dapat berkembangbiak dengan membelah diri melalui "budding cell" . Reproduksinya dapat dipengaruhi oleh keadaan lingkungan serta jumlah nutrisi yang tersedia bagi pertumbuhan sel . Penampilan makroskopik mempunyai koloni berbentuk bulat, warna kuning muda, permukaan berkilau, licin, tekstur lunak dan memiliki sel bulat dengan askospora 1-8 buah (Nikon et al, 2004) .
Taksonomi Saccharomyces cerevisiae menurut Sanger (2004), sebagai berikut:
Super kingdom : Eukaryota
Phylum : Fungi
Genus : Saccharomyces
Species : Saccharomyces cerevisiae
Khamir dapat berkembang biak dalam gula sederhana seperti glukosa, maupun gula kompleks disakarida yaitu sukrosa (Marx, 1991). Selain itu untuk menunjang kebutuhan hidup diperlukan oksigen, karbohidrat, dan nitrogen. Pada uji fermentasi gula – gula mempunyai reaksi positif pada gula dekstrosa, galaktosa, sukrosa, maltosa, raffinosa, trehalosa, dan negatif pada gula laktosa (Lodder, 1970). Gambar 2.3 menunjukkan bentuk sel Saccharomyces cerevisiae dengan bentuk blastospora bulat lonjong yang dilihat menggunakan mikroskop cahaya.
Gambar 2.3 Sel Saccharomyces cerevisiae dengan perbesaran 10 x 40
Komposisi kimia S. cerevisiae dapat di lihat dalam tabel 2.2
Tabel 2.2 Kandungan kimia S. cerevisiae
Komposisi senyawa Presentasi (%)
Protein Karbohidrat Lemak Mineral lain
50-52 30-37 4-5 7-8
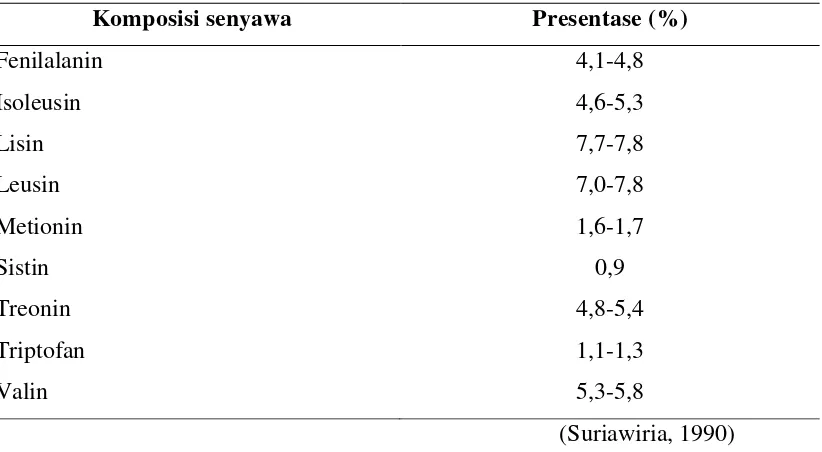
Suriawiria (1990) melaporkan komposisi kimia sel khamir yang hampir sama pada Tabel 2.3 dan kandungan asam aminonya Tabel 2.4.
Tabel 2.3 Komposisi sel Saccharomyces cerevisiae
Komposisi senyawa Presentase (%)
Abu
Tabel 2.4 Kandungan asam amino dalam Saccharomyces cerevisiae
Komposisi senyawa Presentase (%)
Fenilalanin
memproduksi etanol dari molase yang sebagian besar merupakan sukrosa maka sel Saccharomyces cerevisiae adalah sel yang tepat. Hal ini dikarenakan sel ini mampu tumbuh dan berkembang dengan cepat dan mempunyai toleransi terhadap konsentrasi gula (sukrosa) yang tinggi, selain itu etanol yang dihasilkan dapat ditoleransi oleh sel ini (Sa’id, 1987).
Menurut Fraenkel (1982), temperatur pertumbuhan yang optimum untuk sel Saccharomyces cerevisiae adalah 28 – 36o C dan pH optimum untuk pertumbuhan adalah 4,5 – 5,5 ( Moat and Foster, 1998)
2.3.1 Sumber Energi
Sel Saccharomyces cerevisiae dapat hidupnya memperoleh energi dari bahan – bahan organik dan anorganik. Sel ini mendapatkan energi dari ikatan karbon, hal ini digunakannya untuk pertumbuhan dan perkembangbiakannya yang seluruhnya diperoleh dari molekul glukosa, sukrosa, asam organik ataupun alkohol yang telah diubah menjadi senyawa kompleks seperti protein, polisakarida, lemak dan lignin (Gattaway and evans, 1984).
Menurut Buckle (1987) karbon dan energi yang diperlukan oleh sel Saccharomyces cerevisiae diperoleh dari gula dan karbohidrat lain seperti glukosa. Karbohidrat merupakan sumber karbon paling banyak yang digunakan dalam fermentasi oleh sel ini.
Kemampuan untuk menkonversi gula menjadi etanol ini disebabkan oleh adanya peran dari enzim zimase dan invertase. Enzim zimase adalah enzim yang berperan sebagai pemecah sukrosa dari gula menjadi monosakarida-monosakaridanya (glukosa dan fruktosa), selanjutnya terdapat enzim invertase yang mengubah glukosa menjadi etanol. Konsentrasi gula yang umumnya dibuat untuk pembuatan etanol berkisar 14-20 persen. Jika konsentrasi lebih tinggi akan menghambat aktivitas dari khamir dikarenakan menurunnya oksigen terlarut yang diperlukan khamir. Lama dari fermentasi sekitar 30 – 70 jam dengan kondisi anaerob (Judoamidjojo et al. 1992)
Jika pemberian O2 berlebihan (kondisi aerob), sel S.cerevisiae akan melakukan respirasi secara aerobik, dalam keadaan ini enzim khamir dapat memecah senyawa gula lebih sempurna, dan akan dihasilkan karbondioksida dan air.
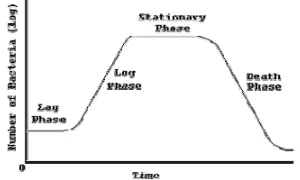
2.3.2 Pertumbuhan sel Saccharomyces cerevisiae
Pertumbuhan sel merupakan puncak aktivitas fisiologi yang saling mempengaruhi secara berurutan. Proses pertumbuhan ini sangat kompleks meliputi pemasukan nutrien dasar dari lingkungan ke dalam sel, konversi bahan-bahan nutrien menjadi energi dan berbagai constituen vital cell serta perkembangbiakan. Pertumbuhan mikrobial ditandai dengan peningkatan jumlah dan massa sel serta kecepatan pertumbuhan tergantung pada lingkungan fisik dan kimia (Anonymous, 2008).
Adapun kurva pertumbuhan mikroba secara umum dapat dilihat pada Gambar 2.4. .
Pada dasarnya pertumbuhan sel Saccharomyces cerevisiae dapat berlangsung tanpa batas, akan tetapi karena pertumbuhan sel Saccharomyces cerevisiae berlangsung dengan mengkonsumsi nutrien sekaligus mengeluarkankan produk-produk metabolisme yang terbentuk maka setelah waktu tertentu laju pertumbuhan akan menurun dan akhirnya pertumbuhan berhenti sama sekali. Berhentinya pertumbuhan dapat disebabkan karena berkurangnya beberapa nutrien esensial dalam medium atau karena terjadinya akumulasi aututuksin dalam medium atau kombinasi dari keduanya (Ansori, 1989).
Pertumbuhan Saccharomyces cerevisiae pada umumnya berada dalam kultur murni. Ragi yang beredar dipasaran biasanya mengandung mikroba jenis yeast. Didalam ragi Saccharomyces cerevisiae dicampur dengan tepung beras dan dikeringkan, biasanya berbentuk agak bulat dengan diameter 3 cm serta berwarna putih.
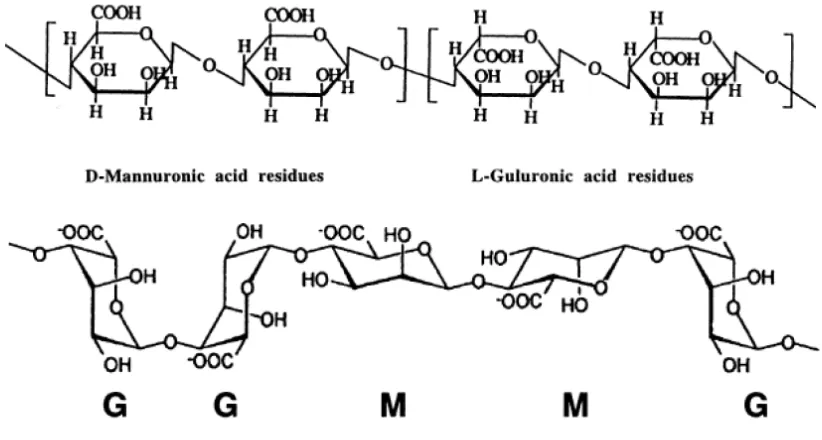
2.4 Alginat
Gambar 2.5 Struktur dasar penyusun alginat
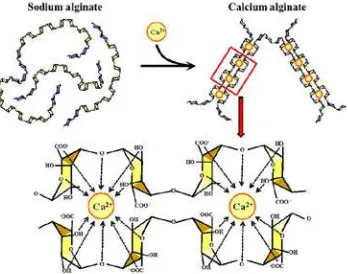
Sifat-sifat alginat sebagian besar tergantung pada tingkat polimerisasi dan perbandingan komposisi guluronat dan mannuronat dalam molekul. Asam alginat tidak larut dalam air dan mengendap pada pH < 3,5 sedangkan garam alginat dapat larut dalam air dingin atau air panas dan mampu membentuk larutan yang stabil. Natrium alginat tidak dapat larut dalam pelarut organik tetapi dapat mengendap dengan alkohol. Alginat sangat stabil pada pH 5 – 10, sedangkan pada pH yang lebih tinggi viskositasnya sangat kecil akibat adanya degradasi ß- eliminatif. Ikatan glikosidik antara asam mannuronat dan guluronat kurang stabil terhadap hidrolisis asam dibandingkan ikatan dua asam mannuronat atau dua asam guluronat. Kemampuan alginat membentuk gel terutama berkaitan dengan proporsi L-guluronat (An Ullman’s, 1998).
Asam alginat diproduksi dengan cara ekstraksi alga coklat (Phaeophyceae) dan banyak digunakan sebagai bahan pembentuk gel dan pengental yang bersifat thermoreversibel dalam berbagai bidang industri, juga dipakai sebagai suspending emulsifying, dan stabilizing agent.
dimanfaatkan dalam industri kosmetik karena dengan adanya alginat, kosmetik dapat menempel dengan erat di jaringan kulit dengan kelembapan yang tetap terjaga.
Alginat memiliki sifat koloid, dapat membentuk gel dan hidrofilik, selain digunakan di berbagai industri diatas, kemampuan alginat tersebut dapat digunakan dalam proses imobilisasi. Dari penelitian yang telah banyak dilakukan, alginat merupakan matrix imobilisasi yang paling baik, karena efisien, mudah digunakan, dapat dimodifikasi, dan tidak bersifat toksik. Sifat-sifat alginat sebagian besar tergantung pada tingkat polimerisasi dan perbandingan komposisi guluronat dan mannuronat dalam molekul.
Alginat tidak stabil terhadap panas, oksigen, ion logam, dan sebagainya. Dalam keadaan demikian, alginat akan mengalami degradasi. Selama penyimpanan, alginat cepat mengalami degradasi dengan adanya oksigen, terutama dengan naiknya kelembaban udara. Alginat dengan visositas tinggi lebih cepat terdegradasi dibandingkan alginat dengan viskositas sedang atau rendah. Urutan stabilitas alginat selama penyimpanan adalah natrium alginat > ammonium alginat > asam alginat (Sembiring, 2010)
Kemampuan alginat membentuk gel juga ditentukan oleh kadar asam guluronat yang menyusun struktur alginat. Kekuatan gel ditentukan oleh ukuran molekul dan komposisi struktur yang menyusun alginat. Tinggi kandungan asam guluronat di dalam alginat akan menyebabkan alginat dapat mengikat ion divalent lebih baik dibandingkan dengan alginat yang memiliki sedikit asam guluronat.
Kekakuan strukutur alginat dalam aplikasi imobilisasi ditentukan oleh adanya ion divalent. Kekakuan strukutur alginat akan bertambah secara umum seiring dengan bertambahnya afinitas terhadap ion – ion divalent. Berikut urutan ion yang dapat membuat
Seperti yang telah dijelaskan sebelumnya, rantai asam guluronat melengkung sedangkan rantai asam mannuronat merata. Hal ini menyebabkan keduanya mempunyai perbedaan dalam berikatan dengan ion Ca2+. Penambahan Ca2+ pada asam guluronat menjadikannya bentuk gel, seperti Ca2+ masuk kedalam egg box antar unit monomer (Sembiring, 2010), seperti yang di tunjukkan dalam gambar 2.6.
Gambar 2.6 Proses terbentuknya egg box dari alginat
2.5 Kitosan
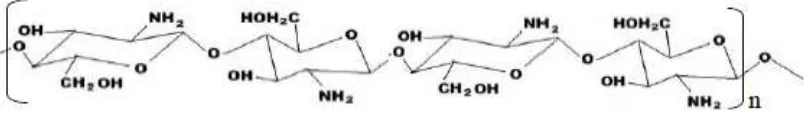
Kitosan adalah poli – (2,6– amino – 2 – deoksi - β -(1 – 4) – D – glukopiranosa dengan rumus molekul (C6H11NO4)n yang dapat diperoleh dari deasetilasi kitin. Kitosan juga dijumpai secara alamiah dibeberapa organisme. Proses kimiawi menggunakan basa, misalnya NaOH, dan dapat menghasilkan kitosan dengan derajat deasetilasi yang tinggi, yaitu mencapai 85 – 93% (Sugita et al, 2009).
Gambar 2.7 Struktur dasar Penyusun dari Kitosan
Karena adanya gugus amino, kitosan merupakan polielektrolit kationik (pKa = 6,5) hal yang sangat jarang terjadi secara alamiah. Sifat yang basa ini menjadikan kitosan:
a. Dapat larut dalam media asam encer membentuk larutan yang kental sehingga dapat digunakan dalam pembuata gel. Dalam beberapa variasi konfigurasi seperti butiran, membran, pelapis kapsul, serat dan spons.
b. Membentuk kompleks yang tidak larut dengan air dengan polianion yang dapat juga digunakan untuk pembuatan butiran gel, kapsul, dan membran.
c. Dapat digunakan sebagai pengkhelat ion logam berat dimana gelnya menyediakan sistem produksi terhadap efek dekstruksi dari ion (Meriaty, 2002)
2.6 Imobilisasi Sel
Untuk dapat mengeliminasi kelemahan-kelemahan tersebut maka dilakukan imobilisasi sel Sacchaomyces cerevisiae tersebut. Dengan demikian sel yang diperoleh lebih tahan terhadap inhibisi dari etanol yang dihasilkan. Sel terimobil ini juga dapat menahan perubahan lingkungan yang terjadi di sekelilingnya seperti perubahan pH dan suhu, dan tentunya dapat digunakan lagi berulang-ulang setelah mengkatalisis suatu reaksi sintesis tertentu (Chibata, 1978).
Sel terimobilisasi dapat didefenisikan sebagai sel yang secara fisik ditempatkan dalam suatu ruang tertentu yang sudah di atur dengan kondisi tertentu dan tetap memiliki aktifitas katalitiknya dan dapat digunakan secara berulang-ulang ataupun secara berlanjut (Chibata, 1978).
Imobilisasi sel juga merupakan salah satu usaha untuk mempermudah proses pemisahan produk hasil fermentasi molase yaitu etanol dengan sel Saccharomyces cerevisiae selama reaksi berlangsung dengan menggunakan sistem dua fase, yaitu satu fase mengandung sel dan fase lainnya mengandung produk, sehingga tidak terjadi proses kontaminasi dari produk terhadap sel yang digunakan (Chaplin, 1990).
Imobilisasi juga diartikan sebagai suatu modifikasi tempat sel untuk hidup dengan meniru keadaan dari tempat berkembangnya sel sehingga sel tetap dapat berkembang dan bekerja dalam proses katalisis suatu reaksi yang berkesinambungan (Zaborsky, 1973).
2.6.1 Metode Imobilisasi
Metode untuk imobilisasi enzim dapat dibagi atas 3 kategori dasar, yaitu: 1. Metode Carrier-binding
Metode ini dibagi menjadi tiga berdasarkan cara pengikatan enzimnya, yaitu adsorpsi fisika, pengikatan ionik, dan pengikatan kovalen.
Metode ini berdasarkan pada adsorpsi fisika dari protein enzim pada permukaan pembawa yang tidak larut dalam air. Kelemahan dari metode ini dimana enzim yang diserap dapat bocor selama pemakaian karena gaya ikat antara protein enzim dan pembawa lemah.
b. Metode pengikatan ionik
Metode pengikatan ionik berdasarkan pengikatan ionik dari protein enzim pada pembawa yang tidak larut dalam air yang mengandung residu penukar ion. Kelemahan metode ini dimana kebocoran dapat terjadi dimana dalam larutan substrat dengan kekuatan ionik yang tinggi atau pada variasi pH.
c. Metode pengikatan kovalen
Pada metode ini diperlukan kondisi reaksi yang sulit dan biasanya dilakukan tidak dalam keadaan kamar. Dalam beberapa kasus, ditemukan bahwa ikatan kovalen mengubah bentuk konformasi dan pusat aktif enzim yang mengakibatkan kehilangan aktivitas atau perubahan spesifitas aktivitas.
2.Metode Ikat Silang
Metode ini berdasarkan pembentukan ikatan kimia seperti dalam metode ikat kovalen,namun pembawa yang digunakan tidak larut dalam air. Imobilisasi enzim dilakukan dengan pembentukan ikat silang intermolekuler diantara molekul enzim dengan penambahan reagent bi-atau multifungsional.
3. Metode Penjebakan
Metode penjebakan berdasarkan pengikatan enzim dalam kisi matriks polimer atau melingkupi enzim dalam membran semipermiabel dan dibagi menjadi tipe kisi dan mikrokapsul.
a. Tipe kisi (lattice type)
b. Mikrokapsul
Penjebakan dengan cara mikrokapsul melibatkan pelingkupan enzim dengan membran polimer semipermiabel.Prosedur untuk mikroenkapsulasi enzim dapat dibagi kedalam tiga kategori (Chibata,1978) yaitu :
1. Polimerisasi interfasial
2. Pengeringan cair (liquid drying) 3. Pemisahan fase (phase separation)
Teknik penjebakan yang umum untuk mikroorganisme dalam butiran adalah pembentukan gel ionotropik dari makromolekul dengan kation multivalensi. Penjebakan dapat terjadi dengan mencampurkan mikroorganisme dengan polimer anionik dan kemudian diikatsilang larutan tersebut dengan kation multivalensi sehingga membentuk struktur yang menjebak mikroorganisme tersebut. (Liouni,2007).
Dalam penelitian kali ini dilakukan teknik mikrokapsul. Dasar dari penggunaan teknik mikrokapsul didasarkan pada kestabilan yang lebih tinggi pada proses fermentasi, sederhana dalam pembuatan dan penggunaan, terjadi interaksi yang kuat, mudah dalam pemisahan produk dan juga mudah dalam modifikasi (Mosbach, 1976).
2.7 Fermentasi
2.7.1 Pengertian Fermentasi
Fermentasi berasal dari bahasa latin ferfere yang artinya mendidihkan, yaitu berdasarkan ilmu kimia terbentuknya gas-gas dari suatu cairan kimia yang pengertiannya berbeda dengan air mendidih. Gas yang terbentuk tersebut di antaranya karbondioksida (CO2) (Afrianti,2004).
tetapi definisi yang lebih jelas mengatakan bahwa fermentasi diartikan sebagai respirasi dalam lingkungan anaerobik dengan tanpa akseptor electron eksternal (Darmanto, 2006). Fermentasi juga dapat diartikan sebagai perubahan gradual oleh enzim, bakteri, khamir dan jamur. Contoh fermentasi yang ada di kehidupan sehari – hari antara lain pengasaman susu, perubahan gula menjadi alkohol serta oksidasi senyawa nitrogen organik (Hidayat et al, 2006).
2.7.2 Pembagian Fermentasi
Menurut Afrianti (2004) fermentasi berdasarkan kebutuhan O2, dapat dibedakan menjadi dua, yaitu:
1. Ferementasi aerob (proses respirasi)
Fermentasi aerob yaitu disimilasi bahan-bahan yang disertai dengan pengambilan oksigen. Semua organisme untuk hidupnya memerlukan sumber energi yang diperoleh dari hasil metabolisme bahan pangan, dimana organisme itu berada. Bahan energi yang paling banyak digunakan mikroorganisme untuk tumbuh adalah glukosa. Dengan adanya oksigen maka mikroorganisme dapat mencerna glukosa menghasilkan air, karbondioksida dan sejumlah besar energi. Contoh : fermentasi asam asetat, asam nitrat, dan sebagainya.
2. Fermentasi anaerob
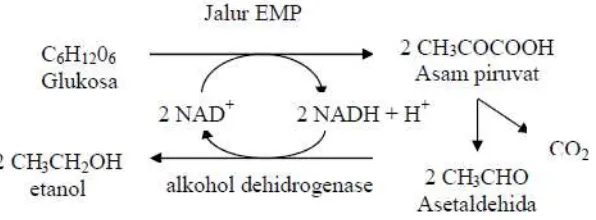
proses fermentasi anaerob mula-mula glukosa dipecah menjadi asam piruvat yang melalui lintasan Embden Meyerhoff Pamas (EMP). Setelah itu terjadi dekarboksilasidehida asam piruvat menjadi asetaldehida. asetaldehida tereduksi menjadi etanol yaitu menerima elektron hasil oksidasi asam gliseraldehida 3- phosphat. Melalui proses fermentasi anaerob ini 90% glukosa akan dirubah menjadi etanol dan CO2 (Ansori, 1989).
Reaksi pada Gambar 2.8 asetaldehida bertindak sebagai penerima hidrogen dalam fermentasi, dimana hasil reduksinya oleh NADH2 menghasilkan etanol, dan NAD yang teoksidasi kemudian dapat digunakan lagi untuk menangkap hidrogen (Fardiaz,1992)
Gambar 2.6 Proses fermentasi glukosa
Gambar 2.8 Proses pembentukan etanol dari glukosa
2.7.3 Mekanisme fermentasi
Didalam fermentasi , kapasitas mikroba untuk mengoksidasi tergantung dari jumlah akseptor elektron terakhir yang dapat dipakai. Sel – sel melakukan fermentasi menggunakan enzim-enzim yang akan mengubah hasil dari reaksi oksidasi , dalam hal ini yaitu asam menjadi senyawa yang memiliki muatan positif, sehingga dapat menangkap elektron terakhir dan menghasilkan energi (Fardiaz, 1990)
- pH dari Reaksi yang berlangsung
- Konsentrasi substrat yang digunakan
- Temperatur selama fermentasi dan
- Kemurnian dari Sel yang digunakan.
Jika tumbuh dalam keadaaan anaerobik, sel Saccharomyces cerevisiae lebih cenderung memfermentasi substrat karbohdirat untuk menghasilkan etanol bersama sedikit produk akhir, sesuai dengan jalur glikolisis menurut Buckle, (1987).
2.8Kromatografi Gas
Kromatografi gas merupakan teknik kromatografi yang digunakan untuk memisahkan senyawa organik yang mudah menguap. Senyawa yang dapat dipisahkan dengan kromatografi gas sangat banyak, namun ada batasan-batasannya. Senyawa tersebut harus mudah menguap dan stabil pada temperatur pengujian. Temperatur ini berkisar 50-300oC. Jika senyawa yang diuji tidak dapat menguap dan stabil pada temperatur pengujian, maka senyawa tersebut bisa diderivatisasi agar dapat dianalisis dengan kromatografi gas (Mardoni et al, 2007).
Penentuan kadar etanol yang terdapat dalam sampel dapat dilakukan dengan menggunakan kromatografi gas (GC). Metode ini dapat digunakan karena metode ini mampu memisahkan zat-zat organik (berupa cairan komplek), waktu analisis relatif singkat, jumlah sampel yang dibutuhkan untuk analisis relatif kecil, dan kepekaan tinggi (Munson, 1981).
2.9Mikroskop cahaya
Mikroskop cahaya merupakan jenis mikroskop yang menggunakan cahaya matahari atau lampu sebagai sumber cahaya. Pada dasarnya mikroskop cahaya bekerja sebagai suatu alat pembesar tingkat dua. Suatu lensa objektif melakukan pembesaran awal, dan suatu lensa okuler ditempatkan sedemikian rupa sehingga memperbesar bayangan pertama untuk kedua kalinya. Pembesaran seluruhnya diperoleh dengan mengalikan kekuatan pembesaran lensa objektif dan lensa okuler.
Untuk dapat melihat bagaimana interaksi dari penyusun bead, dapat dilakukan menggunakan mikroskop cahaya, hal ini berlandaskan bahwa pada setiap penyusun dari bead memiliki bentuk permukaan yang berbeda. Melalui mikroskop cahaya masing-masing penyusun dapat dilihat dari bentuk permukaan yang berbeda-beda sehingga dapat ditentukan komponen penyusun dari bead.
BAB 3
7. Neraca analitis Mettler Toledo
8. Sentrifugasi 7000 rpm Gemmy Corp KCE
9. Vortex BIORAD-2000
19.Pipet volumetri Pyrex
20.Spatula
22.Labu takar Pyrex
23.Labu alas Pyrex
24.Rotarievaporator Buchi
25.Piknometer Pyrex
26.Buret Pyrex
27.Labu rotarievaporator Pyrex
28.Aluminium foil
29.Termometer Fisher
30.Luminar airflow ESCO Class II Biosafety
31.Corong
39.Mikroskop cahaya Zeiss Axiocam ERC-5S
40.Haemocytometer Marienfield
3.1.2 Bahan – Bahan
1. Ragi roti saf-instan
2. Alginat p.a.(E.Merck)
3. CaCl2.2H2O p.a(E.Merck)
4. Molase 5. Kertas saring
6. Media potato dextrose agar p.a(E.Merck)
8. D-glukosa p.a(E.Merck)
9. Yeast extract p.a(E.Merck)
10.Akuades p.a(E.Merck)
11.MgSO4.7H2O p.a(E.Merck)
12.ZnSO4.2H2O p.a(E.Merck)
13.(NH4)2SO4 p.a(E.Merck)
14.K2HPO4 p.a(E.Merck)
15.KH2PO4 p.a(E.Merck)
16.Asam sitrat p.a(E.Merck)
17.Natrium sitrat p.a(E.Merck)
18.Kitosan
19.Asam asetat glasial p.a(E.Merck)
20.NaCl p.a(E.Merck)
3.2 Prosedur Penelitian
3.2.1 Pembuatan larutan pereaksi
3.2.1.1 Pembuatan larutan asam asetat 2 %
Sebanyak 2 ml asam asetat 100% p.a dimasukkan dalam labu takar 100 ml kemudian diencerkan dengan akuades hingga garis tanda sehingga konsentrasi asam asetat 2%
3.2.1.2 Pembuatan larutan alginat 3 %
3.2.1.3 Pembuatan larutan CaCl2 2%
Sebanyak 20 gram kristal CaCl2.2H2O dilarutkan dalam 1000 ml akuades hingga larut sehingga konsentrasi CaCl2 menjadi 2%
3.2.1.4 Pembuatan larutan kitosan 1 % - CaCl2 2%
Sebanyak 1 gram kitosan dilarutkan dalam 100 ml asam asetat 2% hingga larut sehingga konsentrasi kitosan 1 %. Larutan kitosan kemudian dicampurkan dengan larutan CaCl2 2%. Kemudian disterilisasi dengan autoklaf pada suhu 121oC selama 15 Menit.
3.2.1.5 Pembuatan larutan buffer sitrat pH 4
Sebanyak 2,10 gram asam sitrat p.a dimasukkan kedalam labu takar 100 ml kemudian ditambahkan akuades hingga larut sehingga konsentrasi larutan asam sitrat 0,1 M. Kemudian sebanyak 2,94 gram natrium sitrat dimasukkan kedalam labu takar 100 ml kemudian ditambahkan akuades hingga larut sehingga konsentrasi larutan garam natrium sitrat 0,1 M. Kemudian untuk membuat larutan buffer sitrat dengan pH 4 maka sebanyak 33 ml larutan asam sitrat 0,1M dicampurkan dengan 17 ml larutan natrium sitrat 0.1 M, keduanya dimasukkan kedalam labu takar 100 ml dan diencerkan hingga garis tanda.
3.2.2 Pembuatan larutan media
3.2.2.1.Pembuatan media potato dextrose agar (PDA)
didinginkan hingga suhu kamar. Media PDA kemudian dituang kedalam cawan petri dan dibiarkan hingga mengeras.
3.2.2.2.Pembuatan media yeast pepton glukosa (YPG)
Sebanyak 2,00 gram yeast extract, 4,00 gram pepton dan 4,00 glukosa dilarutkan dalam 200 ml akuades sambil dipanaskan hingga mendidih, kemudian diautoklaf pada suhu 121oC selama 30 menit kemudian didinginkan hingga suhu kamar.
3.2.2.3. Pembuatan media starter
Sebanyak 100 ml media YPG ditambahkan dengan 0,1 gram (NH4)2SO4, 0,04 gram MgSO4.7H2O, 0,2 gram KH2PO4 dan 10 ml buffer sitrat 0,1 M dengan pH 4, Kemudian larutan disterilkan dengan autoklaf pada suhu 121oC selama 15 menit dan didinginkan hingga suhu kamar.
3.2.2.4. Pembuatan media fermentasi
3.2.3.Isolasi sel Saccharomyces cerevisiae
3.2.3.1 Pengembangbiakan sel Saccharomyces cerevisiae dengan metode cawan
sebar
Sebanyak 1 gram ragi roti saf-instan disuspensikan dalam 10 ml akuades hingga larut kemudian diambil 1 ose suspensi tersebut dan disebarkan menggunakan ose stick pada permukaan media PDA. Kemudian media disimpan dalam inkubator pada suhu 30oC selama 48 Jam.
3.2.3.2 Pengembangbiakan sel Saccharomyces cerevisiae pada media cair YGP
Sebanyak 3 ose dari koloni terpisah hasil biakan sel Saccharomyces cerevisiae dari media sebelumnya kemudian dibiakkan kembali dalam media cair YGP pada suhu 30oC selama 48 jam.
3.2.3.3 Pembuatan starter sel Saccharomyces cerevisiae
Diinokulasikan 10 ml subkultur sel Saccharomyces cerevisiae murni kedalam media starter dan diinkubasi pada suhu 30oC selama 48 Jam.
3.2.4 Imobilisasi sel Saccharomyces cerevisiae
Saccharomyces cerevisiae. Bead dibiarkan selama 30 menit didalam larutan CaCl2 2% lalu disaring. Bead yang diperoleh kemudian dimasukkan kedalam larutan kitosan 1% - CaCl2 2% dan dibiarkan selama 12 jam lalu disaring dan dicuci dengan NaCl 0,9. Bead disimpan pada suhu 4oC dalam larutan yeast extract 0,2% sampai bead tersebut digunakan.
3.2.5 Fermentasi molase menggunakan sel Saccharomyces cerevisiae terimobil
Sebanyak 300 gr bead diinkubasi dalam yeast extract 2% selama 15 menit pada suhu 30oC kemudian disaring. Bead selanjutnya dimasukkan kedalam media fermentasi yang telah disterilisasi. Fermentasi dilakukan pada suhu 30oC selama 48 jam.
3.2.6 Analisis kadar Gula reduksi sebelum dan setelah Fermentasi
Analisis kadar gula reduksi dari molase dilakukan menggunakan metode Lane-eynon dimana sampel diuji kadar glukosanya sebelum dan sesudah fermentasi. Pada tiap akhir fermentasi, media fermentasi dipisahkan dengan produk fermentasi berupa etanol , kemudian media fermentasi yang merupakan molase tersebut diuji kadar gula reduksinya kembali. Jumlah penurunan dari gula reduksi pada tiap akhir fermentasi diasumsikan sebagai laju konsumsi glukosa dari sel.
3.2.7 Analisis kadar etanol yang dihasilkan dari proses fermentasi
3.2.7.1 Pemisahan etanol dari hasil fermentasi
Setelah proses fermentasi berakhir, di saring bead dengan menggunakan kertas saring kemudian filtrat dirotarievaporator pada suhu 78oC hingga tidak terdapat destilat menetes. Kemudian destilat diuji kadarnya dan diukur volumenya.
3.2.7.2 Analisis kadar etanol menggunakan kromatografi gas
Analisis kuantitatif etanol merujuk pada sholikhah (2010) dengan menggunakan kromatografi gas dimana dilakukan dengan cara menginjeksikan 1 µl larutan etanol kedalam inlet. Luas dari puncak kromatogram dihitung dalam persamaan regresi linier dengan ketentuan y adalah luas area atau peak dama cm2 dan x adalah kadar % etanol.
3.2.8 Pengujian stabilitasi dari sel Saccharomyces cerevisiae terimobil
3.2.8.1 Pengujian stabilitas beadmenggunakan uji tekanan osmosis
Uji tekanan osmosis dapat dilakukan dengan cara menggunakan larutan NaCl 0,02 % selama 15 menit kemudian direndam ke dalam akuades selama 60 menit dan dilihat secara fisik apakah terjadi kerusakan dari bead yang dihasilkan menggunakan mikroskop cahaya (Gaserød et al, 1999).
3.2.8.2 Pengujian stabilitas bead berdasarkan kerusakan setelah fermentasi
3.2.8.3 Pengujian stabilitas bead berdasarkan jumlah pemakaian bead pada
fermentasi
Analisis ini didasarkan pada penggunaan bead pada proses fementasi dengan jumlah alkohol yang hampir sama hingga alkohol yang dihasilkan menurun jumlahnya secara signifikan ataupun mendekati hasil tanpa menggunakan bead (sel bebas).
3.2.9 Pengujian interaksi antara sel S.cerevisiae, Ca-alginat dan kitosan
3.3 Bagan Penelitian
3.3.1 Isolasi sel Saccharomyces cerevisiae
1 g ragi saf-instan disuspensikan dalam 10 ml akuades
0,1 ml larutan ragi diinokulasikan pada media PDA dengan teknik cawan sebar
Diinkubasi pada suhu 30oC selama 48 jam selama 48 Jam
3 Ose koloni yang tumbuh di media PDA diinokulasi pada media YGP
Diinkubasi kembali pada suhu 30oC selama 48 jam selama 48 Jam
Diinokulasikan 10 ml subkultur Saccharomyces cerevisiae murni kedalam media starter
Diinkubasi kembali pada suhu 30oC 48 jam selama 48 Jam
3.3.2 Imobilisasi sel Saccharomyces cerevisiae
50 ml starter sel Saccharomyces cerevisiae dicampurkan dengan 50 ml larutan alginat 3%
Diteteskan kedalam larutan CaCl2 2% menggunakan jarum suntik (Syringe)
Bead mikrokapsul
sel Saccharomyces cerevisiae - Ca-alginat
Dibiarkan mengeras selama 30 menit sambil distirrer dengan kecepatan 80 rpm
Dimasukkan bead yang telah mengeras kedalam larutan kitosan 1% - CaCl2 2% selama 12 Jam
Mikrokapsul
sel Saccharomyces cerevisiae - Ca-alginat -
Disaring bead yang terbentuk kemudian dicuci menggunakan NaCl fisiologis sebanyak 3 kali
3.3.3 Fermentasi molase menggunakan sel Saccharomyces cerevisiae terimobil
Fermentasi dilakukan selama 48 jam dengan kondisi yang telah
Dipisahkan Etanol dengan media fermentasi
Etanol Media fermentasi
Diuji kadar glukosa 150 gr bead mikrokapsul sel
Saccharomyces cerevisiae terimobil
Bead diinkubasi dalamyeast extract 2% selama 15 menitpada suhu
Bead disaring
3.3.4 Regenerasi bead
3.3.5 Analisis kadar etanol
Disaring bead dari larutan hasil fermentasi untuk
memperoleh bead kembali
Bead yang dihasilkan kemudian dicuci kembali dengan menggunakan akuades dan disimpan dalam
yeast extrack 0,2% dan disimpan pada suhu 4oC sebelum digunakan kembali
Proses pemisahan etanol dari hasil fermentasi dilakukan dengan menggunakan rotarievaporator
pada suhu 78oC
etanol
3.3.6 Pengujian stabilitas dari bead sel Saccharomyces cerevisiae terimobil
3.3.7 Pengujian interaksi antara sel S.cerevisiae, Ca-alginat dan kitosan
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian
4.1.1 Isolasi sel Saccharomyces cerevisiae
4.1.1.1 Pengembangbiakan sel Saccharomyces cerevisiae dengan metode cawan
sebar
Sel Saccharomyces cerevisiae dikembangibiakkan pada media PDA menggunakan teknik cawan sebar dengan menyebar suspensi sel Saccharomyces cerevisiae komersial diatas media PDA kemudian diratakan menggunakan hockey stick sehingga merata keseluruh permukaan media PDA. Selanjutnya diinkubasi selama 48 jam pada suhu 30oC. Gambar 4.1 menunjukkan sel Saccharomyces cerevisiae yang tumbuh didalam media PDA.
Gambar 4.1 Sel Saccharomyces cerevisiae tumbuh dalam media PDA setelah
4.1.1.2 Uji positif sel Saccharomyces cerevisiae
Pengujian sel yang tumbuh dilakukan menggunakan mikroskop cahaya dengan melihat sifat morfologis dari sel Saccharomyces cerevisiae yang tumbuh. Gambar 5.a dan 5.b menunjukkan bentuk sel dengan perbesaran 10 x 10 dan 10 x 40.
Gambar 5.a Gambar 5.b
Gambar 5.a Sel Saccharomyces cerevisiae dengan pembesaran 10 x 40; 5.b Sel
Saccharomyces cerevisiae dengan pembesaran 10 x10
4.1.1.3 Pengembangbiakan Saccharomyces cerevisiae pada Media YGP
Gambar 6.a Gambar 6.b
Gambar 6.a Media YPG sebelum pengembangibiakan sel Saccharomyces
cerevisiae; 6.b Media YPG setelah sel Saccharomyces cerevisiae
berkembangbiak
4.1.2 Imobilisasi sel Saccharomyces cerevisiae
4.1.2.1 Menghitung jumlah sel total
Sel / ml = n x 4 x 104 x d
Keterangan : n = jumlah sel yang dihitung menggunakan Haemocytometer
d = Faktor Pengeceran (Fardiaz, 1992)
Tabel 4.1 Jumlah sel Saccharomyces cerevisiae pada media starter
Dalam penelitian ini digunakan 50 ml sel sehingga jumlah total sel yang digunakan adalah :
Total Sel = Total Volume (ml) x Jumlah Sel/ml Total Sel = 50 ml x 15,8 x 107 Sel/ml
Total Sel yang digunakan = 79 x 108 Sel (a)
4.1.2.1.1 Menghitung jumlah sel Saccharomyces cerevisiae yang tidak terimobilisasi
Tabel 4.2 menunjukkan hasil perhitungan sel menggunakan Haemocytometer dari masing-masing sampel hasil pencucian bead.
Tabel 4.2 Jumlah Sel yang dihitung dari masing-masing hasil pencucian bead
No Sampel n1 n2 n3 nrata-rata Jumlah Sel / ml
Jumlah Sel yang terlepas adalah sebagai berikut :
Jumlah Sel terlepas pada Pencucian Bead ke I
Jumlah Sel terlepas = Jumlah total cucian (ml) x Jumlah Sel/ml Jumlah Sel terlepas = 134 ml x 0,704 x107 sel/ml
Jumlah Sel terlepas = 9,4 x 108 Sel (b)
Jumlah Sel terlepas pada Pencucian Bead ke II
Jumlah Sel terlepas = Jumlah total cucian (ml) x Jumlah Sel/ml Jumlah Sel terlepas = 151 ml x 0,544 x107 sel/ml
Jumlah Sel terlepas = 8,2 x 108 Sel (c)
Jumlah Sel yang terimobilisasi = Jumlah Sel Total – Jumlah Sel terlepas
Jumlah Sel yang terimobilisasi = Jumlah Sel Total – (Pencucian I + Pencucian II) Jumlah Sel yang terimobilisasi = 79 x 108 Sel – (9,4 x 108 Sel + 8,2 x 108 Sel)
Jumlah Sel yang terimobilisasi = 61,4 x x 108 Sel
Efisiensi penjebakan sel Saccharomyces cerevisiae (EP)
Gambar 7.1 menunjukkan bead yang merupakan sel Saccharomyces cerevisiae terimobil
Gambar 7.1 Sel Saccharomyces cerevisiae terimobil
4.1.3 Analisis kadar gula reduksi sebelum dan sesudah Fermentasi
Tabel 4.3 menunjukkan konsentrasi gula reduksi dari masing-masing molase dan laju konsumsi glukosa dari sel terimobil pada tiap fermentasi dan etanol yang dihasilkan.
Tabel 4.3 Hubungan antara konsentrasi gula reduksi,laju konsumsi glukosa dan
4.1.4 Analisis kadar etanol dari hasil fermentasi
4.1.3.1 Analisis kualitatif dan kuantitatif etanol
Untuk menentukan bahwa sampel yang diperoleh dari hasil fermentasi adalah etanol, maka dilakukan uji kualitatif etanol yang dilakukan dengan cara menambahkan Pereaksi H2SO4(p) + K2CrO4 pada sampel. Setelah positif etanol selanjutnya dilakukan uji kuantitatif untuk mengetahui kadar etanol yang dihasilkan Penentuan konsentrasi etanol secara kuantitatif menggunakan kromatografi gas dilakukan dengan melihat waktu retensi dari etanol. Semakin tinggi konsentrasi etanol maka waktu retensi akan semakin cepat dan juga sebaliknya. Berikut adalah hasil pengukuran konsentrasi etanol dari hasil fermentasi berdasarkan waktu retensinya. Tabel 4.4 menunjukkan hasil uji kualitatif dan kuantitatif dari etanol hasil fermentasi.
Tabel 4.4 Hasil Uji kualitatif dan kuantitatif etanol hasil fermentasi
No Sampel Penambahan
H2SO4(p) + K2CrO4
Waktu
retensi
Konsentrasi
etanol (%)
4.1.5 Pengujian stabilitas dari sel Saccharomyces cerevisiae
4.1.5.1 Pengujian stabilitas bead menggunakan uji tekanan osmosis
Hasil dari Pengujian stabilitas bead menggunakan uji tekanan osmosis dapat dilihat pada gambar 7.2
s
Gambar 7.2 Gambar Permukaan bead dengan pengujian osmosa menggunakan
NaCl 0,2 %. Analisa menggunakan mikroskop cahaya dengan
perbesaran 10 x 10
4.1.4.2 Pengujian stabilitas bead berdasarkan kerusakan setelah fermentasi
dilakukan pengujian permukaan bead untuk mengetahui pengaruh fermentasi terhadap kerusakan dari permukaan bead pasca fermentasi. Berikut hasil analisis permukaan bead sebelum dan setelah fermentasi menggunakan analisis permukaan menggunakan mikroskop cahaya.
Gambar 8.a Gambar 8.b
Gambar 8.c Gambar 8.d
Gambar 8.a Permukaan bead sebelum fermentasi; 8.b Permukaan bead setelah
fermentasi ke 1; 8.c Permukaan bead setelah fermentasi ke 2; 8.d
4.1.5 Pengujian interaksi antara sel Saccharomyces cerevisiae-Ca-alginat-kitosan
4.1.5.1 Uji interaksi menggunakan mikroskop Cahaya
Pengujian ini didasarkan pada analisis permukaan menggunakan mikroskop cahaya dengan perbesaran 10 x 10. Adapun hasilnya sebagai berikut :
Gambar 9.a Gambar 9.b
Gambar 9.a Permukaan bead yang dibelah dan dilihat dari samping;
4.1.5.2 Uji menggunakan Fourier Transform Infra Red (FT-IR)
Hasil FT-IR Bead Sel Saccharomyces cerevisiae terimobil sebagai berikut :
4500 4000 3500 3000 2500 2000 1500 1000 500
1071,76-1032,27
Gambar 10.1 Hasil FT-IR Sel Saccharomyces cerevisiae terimobil
Tabel 4.5 Gugus fungsi FT-IR
Gugus Fungsi Frekuensi (cm-1) hasil Frekuensi (cm-1) teori
C-O
4.2. Pembahasan
4.2.1 Isolasi sel Saccharomyces cerevisiae
Sel Saccharomyces cerevisiae diisolasi untuk meregenerasi sel yang akan di imobilisasi dan digunakan dalam proses fermentasi. Sel komersil yang dijual dipasaran sudah disimpan begitu lama didalam media sehingga harus diregerasi dan dipisahkan dari media awal pada saat dijual. Isolasi bertujuan untuk menumbuhkan secara spesifik sel yang akan diimobilisasi, dikarenakan sel komersil yang dijual terdapat beberapa sel ataupun mikroba lain yang akan terjebak juga jika tidak diisolasi dan ditumbuhkan kembali sebelum imobilisasi.
4.2.1.1Pengembangbiakan Saccharomyces cerevisiae dengan metode cawan sebar
4.2.1.2 Uji positif sel Saccharomyces cerevisiae
Sifat fisik dari Biomassa yang tumbuh di media PDA sangat mirip dengan yang dijelaskan Nikon (2004). Untuk melihat bentuk Blastospora, maka dilakukan analisa menggunakan mikroskop cahaya dengan perbesaran 10 x 10 dan 10 x 40. Hasil dari pengamatan diperoleh Gambar 5.a dan 5.b yang menunjukkan bentuk blastospora dari sel Saccharomyces cerevisiae. Bentuk ini sesuai dengan teori dari Nikon, 2004 dan menjadi bukti bahwa sel yang tumbuh di media PDA merupakan sel Saccharomyces cerevisiae.
4.2.1.3 Pengembangbiakan Saccharomyces cerevisiae pada media YGP
Setelah positif bahwa sel yang tumbuh merupakan sel Saccharomyces cerevisiae , selanjutnya dilakukan pengembangbiakan kembali ke media cair. Hal ini bertujuan untuk memudahkan proses penjebakan (imobilisasi) dari sel tersebut, bentuk lunak dan berada pada media padat (PDA) membuat proses pencampuran antara sel dengan matrix penjebak sulit dilakukan. Untuk itu dilakukan penumbuhan kembali sel dalam media cair. Media tumbuh cair yang digunakan adalah yeast glucose peptone (YGP). Diambil 3 ose sel Saccharomyces cerevisiae dari media PDA kemudian di inokulasikan kedalam media YPG dan diinkubasi sambil diguncang (shake) pada kecepatan 150 rpm pada suku 30oC selama 48 jam. Setelah 48 jam, Media dikeluarkan dan akan terlihat kekeruhan dari media YPG yang mengindikasikan bahwa sel Saccharomyces cerevisiae telah tumbuh. Kemudian sel yang telah tumbuh dimasukkan ke media starter yang berisi nutrien yang dibutuhkan sel sehingga pertumbuhan sel akan maksimal sebelum diimobilisasi.
4.2.2 Imobilisasi sel Saccharomyces cerevisiae
Saccharomyces cerevisiae yang terjebak didalam bead. Dengan menggunakan Haemocytometer diperoleh jumlah sel awal yang akan dijebak (a). Selanjutnya Imobilisasi dilakukan dalam 2 tahap.
Pertama starter sel Saccharomyces cerevisiae dicampurkan dengan larutan natrium alginat dan dihomogenkan. Setelah homogen campuran keduanya diteteskan menggunakan jarum suntik ke dalam larutan CaCl2 2% dan dibiarkan selama 30 menit untuk memantapkan proses pengerasan dari Ca-alginat yang terbentuk. Setelah 30 menit, bead dicuci menggunakan akuades sebanyak 3 kali. Air cucian dan CaCl2 yang digunakan selanjutnya dihitung kembali jumlah sel yang tidak terjebak. Karena dalam proses penjebakan tidak semua sel akan terjebak dalam matrix (b).
Tahap kedua, setelah bead Ca-alginat sudah mengeras, maka bead tersebut kemudian direndam dalam larutan kitosan 1%-CaCl2 2% selama 12 jam. Hal ini bertujuan untuk memberi lapisan pada bead pertama sehingga stabilitas dari bead akan meningkat. Dalam penambahan lapisan kitosan ini kita juga menambahkan CaCl2 2%, hal ini dikarenakan penambahan ion kalsium dalam larutan kitosan meningkatkan presentase ikatan yang terjadi antara kitosan dan alginat (Gaserod et al, 1998). Setelah 12 Jam maka bead disaring dan dicuci dengan menggunakan NaCl fisiologis (NaCl 0,9%) untuk menghilangkan sisa-sisa ion natrium yang ada pada permukaan bead. Ion natrium ini dapat menganggu kestabilan dari bead yang terbentuk. Prinsip pencucian bead ini berdasarkan pencucian menggunakan ion senama. Artinya dalam hal ini kita ingin menghilangkan ion natrium sehingga kita mencucinya menggunakan NaCl yang mengandung natrium, kemudian dicuci kembali menggunakan akuades untuk menghilangkan sisa NaCl yang tertinggal. Setelah pencucian bead siap untuk digunakan. Sama seperti tahap pencucian pertama, di tahap ini air cucian bead beserta larutan kitosan dan CaCl2 selanjutnya dihitung jumlah sel yang terlepas (c).
yang terlepas pada tiap fermentasi tidak dapat dihitung secara pasti, hal ini dikarenakan beberapa faktor antara lain, media fermentasi yang digunakan berwarna gelap dan sel yang terdapat didalamnya tidak dapat dihitung menggunakan haemocytometer. Kedua sel yang terlepas cenderung akan berkembangbiak ketika kontak langsung dengan media fermentasi yang memiliki glukosa. Hal ini dikarenakan sifat dari sel yang berkembang biak jika terdapat media tumbuhnya sehingga jumlah sel yang terlepas pada proses fermentasi tidak dapat dihitung secara pasti. Adapun Efisiensi penjebakan sel sebesar 77.72 %.
4.2.3 Fermentasi Molase menggunakan sel Saccharmoyces cerevisiae terimobil
Fermentasi dilakukan dengan menggunakan molase yang sudah diuji kadar gula reduksinya menggunakan metode Lane-eynon. Sebelum dipergunakan dalam fermentasi perlu dipastikan bahwa didalam molase tidak terdapat alkohol yang terkandung didalamnya. Pengujian kadar alkohol didalam molase dapat dilakukan dengan cara memisahkan alkohol yang terkandung didalam molase menggunakan alat rotarievaporator kemudian di uji secara kualitatif dan kuantitatif. Setelah dipisahkan dan diuji kadar alkoholnya , molase kemudian dipergunakan sebagai substrat dalam fermentasi. Dari penelitian ini dipergunakan molase yang bebas alkohol, artinya didalam molase tersebut tidak terdapat alkohol sehingga kontaminasi alkohol di dalam molase tidak ada. Molase yang digunakan juga disterilisasi agar menghilangkan kontaminasi dari mikroba yang terkandung didalam Molase. Sterilisasi dilakukan menggunakan autoklaf dengan pemanasan pada suhu 212oC selama 15 menit.