Lampiran 2. Bagan kerjapenelitian
Serbuk simplisia Bunga pisang klutuk
Simplisia
Dicuci, ditiriskan, dipotong-potong
melintang dan ditimbang sebagai
berat basah
Ditimbang berat kering
Dihaluskan
Pemeriksaan makroskopik Pemeriksaan mikroskopik Penetapan kadar air
Penetapan kadar sari yang larut
dalam air Penetapan kadar
sari yang larut dalam etanol Penetapan kadar
abu total Penetapan kadar
abu yang tidak larut dalam asam
Pemeriksaan alkaloida Pemeriksaan glikosida Pemeriksaan flavonoida Pemeriksaan tanin Pemeriksaan saponin Pemeriksaan Steroida/ triterpenoida
Karakterisasi simplisia Skrining Fitokimia Ekstraksi
Dimaserasi dengan etanol 96 % setelah 5 hari disaring,
Ekstrak kental
Hasil
Diuapkan dengan
t t
UV-Lampiran 3. Tumbuhan pisang klutuk dan bunga pisang klutuk
Tumbuhan pisang klutuk
Bunga pisang klutuk Bunga pisang klutuk serbuk simplisia setelah dipotong bunga pisang klutuk
Lampiran 4. Hasil pemeriksaan mikroskopik serbuk simplisia bunga pisangklutuk. Perbesaran 10 x 40
Keterangan:
1. Sel batu
2. Kristal kalsium oksalat 3. Sklerenkim
4. Amylum
1
2
3
Lampiran 6. Perhitungan pemeriksaan karakteristik serbuk simplisia bunga pisang klutuk
1. Perhitungan kadar air serbuk simplisia bunga pisang klutuk
% Kadar air simplisia =
x
100%
(g)
sampel
berat
(mL)
air
volume
No. Berat sampel (g) Volume awal (mL) Volume akhir (mL)
1. 5,012 2,1 2,3
2. 5,015 2,3 2,5
3. 5,019 2,5 2,7
1. Kadar air = 2,3 – 2,1
5,012 x 100 % = 3,99%
2. Kadar air
=
2,5 – 2,35,015 x 100 % = 3,98%
3. Kadar air = 2,7 – 2,5
5,019 x 100 % = 3,98%
% Rata-rata kadar air = 3,99% + 3,98% + 3,98%
3 = 3,98%
2. Perhitungan kadar sari larut dalam air
% Kadar sari larut air = Berat cawan sari – berat cawan kosong
Berat sampel x
100
20 x 100 %
No. Berat sampel (g) Berat cawan kosong (g) Berat cawan sari (g)
1. 5,001 50,95 51,15
2. 5,002 51,20 51,40
3. 5,001 50,95 51,16
1. Kadar sari larut dalam air = 51,15 – 50,95
5,001
×
100
20
×
100 % = 20, 00 %2. Kadar sari larut dalam air = 51,40 – 51,20
5,002
×
100
20
×
100 % = 20,00 %3. Kadar sari larut dalam air = 51,16 – 50,95
5,001
×
100
Lampiran 6. (lanjutan) Perhitungan pemeriksaan karakteristik serbuk simplisia
bunga pisang klutuk
% Rata-rata kadar sari larut air
=
20,00 % + 20,00% + 21,00 %3 = 20,33 %
4. Perhitungan kadar sari simplisia larut dalam etanol
% kadar etanol =
Berat cawan sari – berat cawan kosongBerat sampel
×
100
20
×
100 %No. Berat sampel (g) Berat cawan kosong (g) Berat cawan sari (g)
1. 5,001 50,95 51,10
2. 5,003 50,93 51,08
3. 5,002 50,95 51,11
1. Kadar sari larut etanol
=
51,10 – 50,955,001
×
100
20
×
100 % = 15,00%2. Kadar sari larut etanol = 51,08 – 50,93
5,003
×
100
20
×
100 % = 15,00%3. Kadar sari larut etanol
=
51,11 – 50,955,002
×
100
20
×
100 % = 15,99%% Rata-rata kadar sari larut etanol = 15,00 % + 15,00 % + 15,99 %
3 = 15,33%
5. Perhitungan kadar abu total simplisia
% Kadar abu = Berat krus porselen Abu – Berat krus porselen kosong
Berat sampel × 100%
No. Berat sampel (g) Berat krus porselin kosong
Berat kurs porselin abu
1. 2,0001 41,24 41,35
2. 2,0001 42,80 42,92
3. 2,0002 41,20 41,33
1. Kadar abu total
=
41,35 – 41,242,0001
×
100 % = 5,5 %2. Kadar abu total = 42,92 – 42,80
Lampiran 6. (lanjutan) Perhitungan pemeriksaan karakteristik serbuk simplisia
bunga pisang klutuk
3. Kadar abu total
=
41,33 – 41,202,0002
×
100 % = 6,5 %% Rata-rata kadar abu total = 5,5 % + 6,00 % + 6,5 %
3 = 6,00 %
5. Perhitungan kadar abu simplisia tidak larut dalam asam
% Kadar abu tidak larut dalam asam =
x
100%
(g)
simplisia
Berat
(g)
abu
Berat
No. Berat sampel (g) Berat abu (g)
1. 2,0001 0,0072
2. 2,0001 0,0065
3. 2,0002 0,0079
1. Kadar abu tidak larut dalam asam
=
0,00722,0001
×
100 % = 0,35%2. Kadar abu tidak larut dalam asam = 0,0065
2,0001
×
100 % = 0,32%3. Kadar abu tidak larut dalam asam = 0,0079
2,0002
×
100 % = 0,39%% Rata-rata kadar abu tidak larut asam
=
0,35% + 0,32% + 0,39%Lampiran 7. (lanjutan) Grafik Data penentuan waktu kerja (operating time).
0,57 0,58 0,59 0,6 0,61 0,62 0,63
0 5 10 15 20 25 30 35 40 45 50 55 60 65 70 75 80
A
bs
or
ba
ns
i
Waktu (menit)
Lampiran 8. Data orientasi penentuan konsentrasi sampel uji
Data orientasi I
No Konsentrasi Absorbansi
1 0 0,9642
2 50 0,5538
3 65 0,4056
4 80 0,4006
5 95 0,3204
Data orientasi II
No Konsentrasi Absorbansi
1 0 1,0675
2 50 0,4204
3 100 0,3061
4 150 0,2259
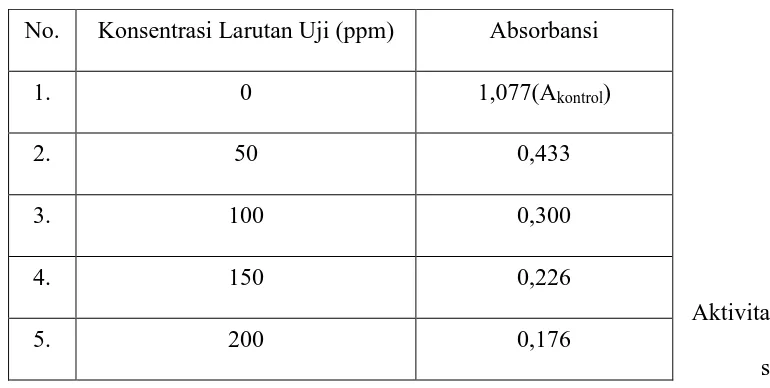
Lampiran 9.Hasil uji aktivitas antioksidan
1.Tabel hasil uji aktivitas antioksidan ekstrak etanol bunga pisang klutuk
Larutan uji
Konse ntrasi (ppm)
Absorbansi % Pemerangkapan
I II III I II III Rata-rata
Ekstrak Etanol Bunga Pisang Klutuk
0 1,077 1,059 1,065 0,00 0,00 0,00 0,00 50 0,433 0,411 0,416 59,76 61,21 60,87 60,61
100
0,300 0,309 0,309 72,14 70,81 70,99 71,31 150 0,226 0,226 0,224 78,98 78,60 78,90 78,82
200 0,176 0,174 0,175 83,58 83,53 83,52 83,54
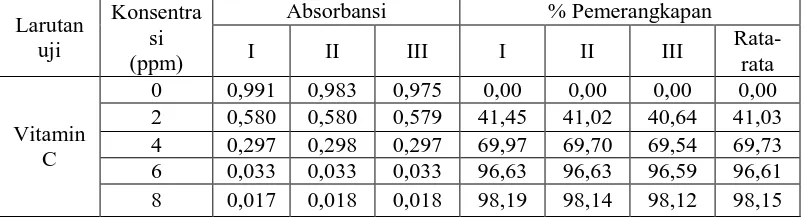
2. Tabel hasil uji aktivitas antioksidan vitamin C
Larutan uji
Konse ntrasi (ppm)
Absorbansi % Pemerangkapan
I II III I II III Rata-rata
Vitamin C
0
0,991 0,983 0,975 0,00 0,00 0,00 0,00 2
0,580 0,580 0,579 41,45 41,02 40,64 41,03
4 0,297 0,298 0,297 69,97 69,70 69,54 69,73
6 0,033 0,033 0,033 96,63 96,63 96,59 96,61
Lampiran 10.Perhitungan Persen Pemerangkapan dan Nilai IC50
• Contoh perhitungan persen pemerangkapan Ekstrak etanol bunga pisang klutuk
Tabel data absorbansi DPPH pengukuran I
Aktivita
s
pemerangkapan (%) = x 100%
kontrol A sampel A -kontrol A
Keterangan : Akontrol = Absorbansi tidak mengandung sampel
Asampel = Absorbansi sampel
Perhitungan % pemerangkapan ekstrak etanol bunga pisang klutuk Pengukuran I
- Konsentrasi 50 ppm
% Pemerangkapan = x 100%
kontrol A sampel A -kontrol A
% Pemerangkapan = x 100%
077 , 1 433 , 0 077 , 1 − = 59,76%
- Konsentrasi 100 ppm
% Pemerangkapan = x 100%
kontrol A sampel A -kontrol A
No. Konsentrasi Larutan Uji (ppm) Absorbansi
1. 0 1,077(Akontrol)
2. 50 0,433
3. 100 0,300
4. 150 0,226
Lampiran 10.(lanjutan)
% Pemerangkapan = x 100%
077 , 1 300 , 0 077 , 1 − = 72,14%.
Konsentrasi 150 ppm
% Pemerangkapan = x 100%
kontrol A sampel A -kontrol A
% Pemerangkapan = x 100%
077 , 1 226 , 0 077 , 1 −
= 78,98 %
- Konsentrasi 200 ppm
% Pemerangkapan = x 100%
kontrol A sampel A -kontrol A
% Pemerangkapan = x 100%
077 , 1 176 , 0 077 ,
1 − = 83,58%
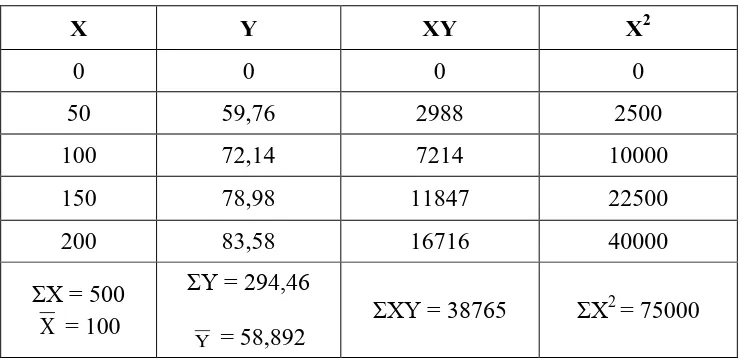
• Contoh Perhitungan nilai IC50
Tabel IC50 dari Ekstrak Etanol Bunga Pisang Klutuk
X Y XY X2
0 0 0 0
50 59,76 2988 2500
100 72,14 7214 10000
150 78,98 11847 22500
200 83,58 16716 40000
ΣX = 500 X = 100
ΣY = 294,46
Y = 58,892
ΣXY = 38765 ΣX2
Lampiran 10.(lanjutan)
Keterangan: X = Konsentrasi (ppm)
Y = % Pemerangkapan
a =
n / X) ( ) X ( n / Y) X)( ( -XY) ( 2
2 − ∑
∑ ∑ ∑
∑
= 0,37276
25000 9319 5 / ) 500 ( ) 75000 ( 5 / ) 294,46 )( 500 ( ) 38765 (
2 = =
− −
b = Y−aX
= 58,892 – (0,37276)(100) = 21,616
Jadi, persamaan garis regresi Y = 0,37276X + 21,616
Nilai IC50 = Y = 0,37276X + 21,616
50 = 0,37276X + 21,616
X = 76,14
IC50 = 76,14 ppm
Tabel data absorbansi pemerangkapan aktivitas antioksidan vitamin C pengukuran I
Aktivitas pemerangkapan (%) = x 100% kontrol A sampel A -kontrol A
Keterangan : Akontrol = Absorbansi tidak mengandung sampel
Asampel = Absorbansi sampel
No. Konsentrasi Larutan Uji (ppm) Absorbansi
1. 0 0,99142(Akontrol)
2. 2 0,58046
3. 4 0,29767
4. 6 0,03337
Lampiran 10. (lanjutan)
Perhitungan % pemerangkapan aktivitas antioksidan vitamin C Pengukuran I
- Konsentrasi 2 ppm
% Pemerangkapan = x 100%
kontrol A sampel A -kontrol A
% Pemerangkapan = x 100%
991 , 0 580 , 0 991 , 0 − = 41,45%
- Konsentrasi 4 ppm
% Pemerangkapan = x 100%
kontrol A sampel A -kontrol A
% Pemerangkapan = x 100%
991 , 0 297 , 0 991 , 0 − = 69,97%.
Konsentrasi 6 ppm
% Pemerangkapan = x 100%
kontrol A sampel A -kontrol A
% Pemerangkapan = x 100% 991 , 0 033 , 0 991 , 0 − = 96,63%
- Konsentrasi 8 ppm
% Pemerangkapan = x 100%
kontrol A sampel A -kontrol A
% Pemerangkapan = x 100%
991 , 0 017 , 0 991 , 0 − = 98,19%
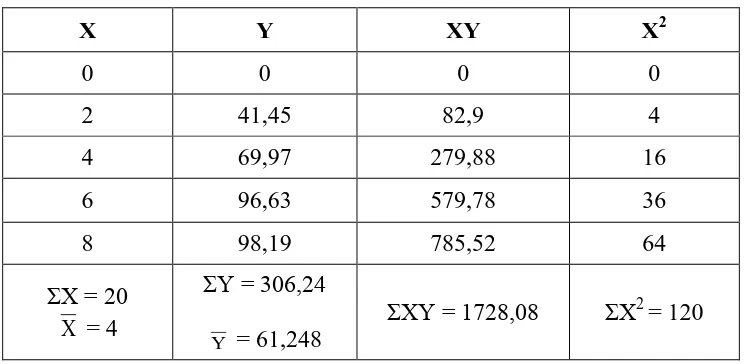
Tabel IC50 dari Vitamin C
X Y XY X2
0 0 0 0
2 41,45 82,9 4
4 69,97 279,88 16
6 96,63 579,78 36
8 98,19 785,52 64
ΣX = 20 X = 4
ΣY = 306,24
Y = 61,248
ΣXY = 1728,08 ΣX2
= 120
Keterangan: X = Konsentrasi (ppm)
Y = % Pemerangkapan
a =
n / X) ( ) X ( n / Y) X)( ( -XY) ( 2
2 − ∑
∑ ∑ ∑
∑
= 12,578
40 503,12 5 / ) 20 ( ) 120 ( 5 / ) 306,24 )( 20 ( ) 1728,08 (
2 = =
− −
b = Y−aX
= 61,248 – (12,578)(4) = 10,936
Jadi, persamaan garis regresi Y = 12,578 X + 10,936
Nilai IC50 = Y = 12,578X + 10,936
50 = 12,578X + 10,936
X = 3,10
DAFTAR PUSTAKA
Anonim. (2015). Pisang Klutuk. (http://www. Plantamor.Com/ Index. Php Plant Diakses tanggal 8 Nopember 2015.
Dachriyanus. (2004). Analisis Struktur Senyawa Organik secara Spektrofotometri. Padang: Andalas University Press. Halaman 1.
Depkes, RI.,(1979).Farmakope Indonesia.Edisi III. Jakarta : DepartemenKesehatan Republik Indonesia. Halaman 33.
Depkes, RI., (1995).MateriMedika Indonesia, Jilid VI. Jakarta : DepartemenKesehatanRepublik Indonesia. Halaman 297- 307, 321- 325, 333 - 337.
Depkes, RI., (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat,Departemen Kesehatan Republik Indonesia. Halaman 1.
Farnsworth, N.R. (1966). Biological and Phytochemical Screeningof Plants.Journalof Pharmaceutical Sciences. (55 (3): 263-264.
Fidrianny,I.,Darmawati, A., dan Sukrasno. (2014). Antioxidant capacities from different polarities Extracts of Cucurbitaceae Leaves Using Frap, DPPH Assays and Correlation with phenolic, Flavonoid, Caretonoid Content. International Journal of Pamacy and Pharmaceutical Sciences. 6(2):861.
Ionita, P. (2005). Is DPPH Stable Free Radikal A Good Scavenger for Oxygen Active Species. Cem. Pap. 59 (1):11.
Harborne, J.B. (1987).Metode Fitokimia Penuntuncara Modern MenganalisaTumbuhan.Penerjemah : Kosasih Padmawinata dan Iwang Soediro. Terbitan kedua.Bandung : ITB. Halaman21, 147.
Kumalaningsih, S. (2006). Antioksidan Alami. Surabaya: Trubus Agrisarana. Halaman 3, 39,53.
Lestario, NL. (2009). Kandungan Antosianin Dan Antosianidin Dari JantungPisang Klutuk (Musa brachycarpa Back) Dan Pisang Ambon (Musa acuminata Colla), Jurnal Teknol.dan Industri Pangan, Vol. 20. Halaman 2.
Marinova, G., dan Batchvarov, V. (2011). Evaluation of the Methods for Determination of the Free Radikal Scavenging Activity by DPPH. Bulg. J.Agric. Sci. 17 (1):13-14.
Miller , AL. (1996).Antioxidant flavonoids : Structure, Function, and Clinical Usage.AlternativeMedicineReview 1, 103.
(DPPH) for Estimating Antioxidant Activity.Songklanakarin Journal. Sci. Technol.26(2) : 211-219.
Muchtadi, D. (2013). Antioksidan danKiat Sehat di Usia Produktif. Bandung: Alfabeta. Halaman 15.
Packer, L. (2002). The Antioxidant Vitamins C and E. United States of America: AOCS Press. Halaman 9.
Pazmino. (2001). Anthocyanins from Banana Bracts (Musa X paradisiaca) as Potential Food Colorant, Food Chemistry. Halaman 73 : 321-332.
Prahasta, A. (2009). Budidaya Usaha Pengolahan Agribisnis pisang. Bandung. Pustaka Grafika. Halaman 2-5. 26-32.
Prakash, A. (2001). Antioxidant activity. Medallion Laboratories-Analithycal progress. vol 19 (2) :2.
Rohman, A. (2007). Kimia Farmasi Analisis. Yogyakarta: pustaka pelajar. Halaman 222.
Rosidah.,Yam, M.F., Sadikun, A., dan Asmawi, M.Z. (2008). Antioxidant Potential of Gynura Procumbens. Pharmaceutical Biology. 46(9):616-625.
Robinson, T. (1995). Kandungan Organik Tumbuhan Tinggi. Edisi VI. Bandung: Penerbit ITB. Halaman 191-193.
Sen, S., Chakraborty, R., Sridhar, C., Reddy, Y. S. R., dan Pe, B. (2010). Free Radikal Antioxidants, Disease and Phytomedicines: Current Status and Future Prospect. International Journal of Pharmaceutical Sciences Review and Research. 21 (3) : 91-100.
Shirwaikar, A., Kirti, S., dan Punitha. (2006). Invitro Antioxidant Studies of Sphaeranthus indicus. Indian journal of Experimental Biology. 4(1): 995.
Silalahi, J. (2006). Makanan Fungsional. Yogyakarta: Penerbit Kanisius. Halaman 40, 47-48.
Takashi, M., dan Takayumi, S. (1997). Antioxidant Activities of Natural Compound Found in Plants. Journal of Agriculture and Food Chemistry. Halaman 45(1):1819-1822.
Wardhany, H.K. (2014). Khasiat Ajaib Pisang. Yogyakarta: Penerbit Rapha Publishing. Halaman 48, 68-70.
BAB III
METODE PENELITIAN
Penelitianini menggunakan metode eksperimental dengan tahapan
penelitian meliputi pengumpulan dan pengolahan bahan tumbuhan, identifikasi
bahan tumbuhan, karakterisasi simplisia, skrining fitokimia,pembuatan dan
pengujian aktivitas antioksidan dari ekstrak etanol bunga pisang klutuk dengan
metode aktivitas pemerangkapan radikal bebas DPPH
(1,1-diphenyl-2-picrylhidrazyl) yang diukur secara spektrofotometri UV-Visibel. Penelitian ini
dilakukan di laboratorium fitokimia dan laboratorium penelitian, Fakultas
Farmasi, Universitas Sumatera Utara.
3.1 Alat
Alat-alat yang digunakanpada penelitian ini meliputi alat-alat gelas
laboratorium, aluminium foil, blender, desikator, krus porselin, kurs tang, lemari
pengering, mikroskop (olympus), seperangkat alat destilasi penetapan kadar air,
neraca analitik (Boeco Germany), objek gelas, gelas penutup, oven, penangas air,
rotary evaporator (stuart), spektofotometer UV/Visible (Shimadzu UV-1800),
stopwatch, tanur (Nabertherm).
3.2Bahan
Bahan yang digunakan adalah bunga pisang klutuk. Bahan bahan kimia
berkualitas pro analisis produksi Sigma: 1,1-diphenyl-2-picrylhydrazyl (DPPH)
(Aldrich); vitamin C (CSPC Welsheng Pharmaceutical CO., Ltd.); produksi E-
asam nitrat pekat, besi (III) klorida, asam klorida pekat, asam sulfat pekat, timbal
(II) asetat, kloralhidrat, kloroform, isopropanol, benzen, asam asetat anhidrit,
natrium hidroksida, amil alkohol, serbuk magnesium (Mg), α-naftol, Bahan kimia
berkualitas teknis: Etanol 96% dan air suling.
3.3Penyiapan Bahan Tumbuhan 3.3.1 Pengumpulan bahan tumbuhan
Tumbuhan yang digunakan adalah bunga pisang klutuk (Musa balbisiana
BB) yang masih segar. Pengambilan sampeldilakukan secara purposif tanpa
membandingkan dengan bahan sampel yang sama dari daerah lain. Sampel
diambil dari kebun pisang di Desa Nogio, Kecamatan Delitua, Kabupaten Deli
Serdang,Provinsi Sumatera utara.
3.3.2 Identifikasi tumbuhan
Identifikasi tumbuhan dilakukan di Herbarium Bogoriense, Bidang
Lembaga Ilmu Penelitian Indonesia (LIPI), Bogor.
3.3.3 Pengolahan bahan tumbuhan
Bahan tumbuhan yang digunakan adalah bunga pisang klutuk. Bunga
dibersihkan, dicuci,ditiriskan, kemudian dipotong-potong secara melintang dan
ditimbang sebagai berat basah. selanjutnya bungapisang dikeringkan di lemari
pengering pada temperatur± 40ºC, sampai kering dan rapuh,kemudian ditimbang
sebagai berat kering. Simplisia yang telah kering diblender menjadi serbuk lalu
disimpan pada suhu kamar dalam kantong plastik untuk mencegah pengaruh
lembab dan pengotoran lain. Bagan kerja penelitian dapat dilihat pada lampiran 2
3.4 Pembuatan pereaksi
3.4.1 Pereaksi besi (III) klorida 1%
Sebanyak 1 g besi (III) klorida ditimbang, kemudian dilarutkan dalam air
secukupnya hingga diperoleh larutan 100 mL (Depkes, RI.,1995).
3.4.2 Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat ditimbang, kemudian dilarutkan dalam
air suling bebas karbon dioksida sebanyak 100 mL (Depkes, RI., 1995).
3.4.3 Pereaksi natrium hidroksida 2 N
Sebanyak 8 g kristal natrium hidroksida dilarutkan dengan air suling
sebanyak 100 mL (Depkes, RI., 1995).
3.4.4 Pereaksi asam klorida 2 N
Sebanyak 17 mL larutan asam klorida pekat ditambahkan air suling hingga
diperoleh larutan 100 mL (Depkes, RI., 1995).
3.4.5 Pereaksi asam sulfat 2 N
Sebanyak 5,5 mL larutan asam sulfat pekat ditambahkan air suling sampai
100 mL (Depkes, RI., 1995).
3.4.6 Pereaksi kloralhidrat
Sebanyak 50 g kristal kloralhidrat ditimbang lalu dilarutkan dalam 20 mL
air suling (Depkes, RI., 1995).
3.4.7 Pereaksi Mayer
Sebanyak 1,4 g raksa (II) klorida dilarutkan dalam air suling hingga 60 mL
pada wadah lain ditimbang sebanyak 5 g kalium iodida lalu dilarutkan dalam 10
mL air suling, kedua larutan dicampurkan dan ditambahkan air suling hingga
3.4.8 Pereaksi Mollish
Sebanyak 3 g α-naftol ditimbang, dilarutkan dalam asam nitrat 0,5 N
hingga diperoleh larutan 100 mL (Depkes, RI., 1995).
3.4.9 Pereaksi Dragendorff
Sebanyak 0,8 g bismut (III) nitrat ditimbang, dilarutkan dalam 20 mL
asam nitrat pekat, pada wadah lain ditimbang sebanyak 27,2 g kalium iodida,
dilarutkan dalam 50 mL air suling, kemudian kedua larutan dicampurkan dan
didiamkan sampai memisah sempurna. Larutan yang jernih diambil dan
diencerkan dengan air suling hingga volume larutan 100 mL (Depkes, RI., 1995).
3.4.10 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida ditimbang, dilarutkan dalam air suling
secukupnya, lalu ditambahkan 2 g iodium kemudian ditambahkan air suling
hingga diperoleh larutan 100 mL (Depkes, RI., 1995).
3.4.11 Pereaksi Liebermann-Burchard
Sebanyak 5 bagian volume asam sulfat pekat dicampurkan dengan 50
bagian volume etanol 95%. Kemudian ditambahkan dengan hati-hati 5 bagian
volume asam asetat anhidrida ke dalam campuran tersebut dan dinginkan
(Depkes, RI., 1995.)
3.5 Pemeriksaan Karakteristik Simplisia 3.5.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan dengan mengamati bentuk, tekstur
dan ukuran serta pemeriksaan organoleptik dengan mengamati warna, rasa dan
bungapisang klutuk segar dan serbuk simplisia pisang klutuk dapat dilihat pada
Lampiran 3, halaman 45.
3.5.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia bunga
pisang klutuk.Serbuk simplisia ditaburkan diatas kaca objek yang telah ditetesi
dengan larutan kloralhidrat dan tutup dengan kaca penutup, kemudian diamati di
bawah mikroskop. Gambar mikroskopik serbuk simplisia bunga pisang klutuk
dapat dilihat pada Lampiran 4, halaman 46.
3.5.3 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi
toluen). Alat terdiri dari alas bulat 500 mL, alat penampung, pendingin, pemanas
listrik, tabung penyambung, tabung penerima 5 mL berskala 0,05 mL.
a. Penjenuhan toluen
Sebanyak 200 mL toluena dan 2 mL air suling dimasukkan ke dalam labu
alas bulat, dipasang alat penampung dan pendingin, kemudian didestilasi selama 2
jam. Destilasi dihentikan dan dibiarkan dingin selama 30 menit, kemudian volume
air dalam tabung penerima dibaca dengan ketelitian 0,05 mL.
b. Penetapan kadar air simplisia
Sebanyak 5 gram serbuk simplisia yang telah ditimbangseksama
dimasukkan kedalam labu berisi toluene yang telah dijenuhkan, kemudian labu
dipanaskan hati-hati selama 15 menit.Setelah toluen mendidih, kecepatan tetesan
diatur 2 tetes untuk tiap detik sampai sebagian besar air terdestilasi, kemudian
kecepatan destilasi dinaikkan sampai 4 tetes tiap detik.Setelah semua air
terdestilasi, bagian dalam pendingin dibilas dengan toluen.Destilasi dilanjutkan
kamar. Setelah air dan toluen memisah sempurna, volume air dibaca dengan
ketelitian 0,05 mL. Selisih kedua volume air yang dibaca sesuai dengan
kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung
dalam persen (WHO, 1998).
3.5.4 Penetapan kadar sari yang larut dalam air
Sebanyak 5 gram serbuk simplisia dimaserasi selama 24 jam dalam 100
mL air-kloroform (2,5 mL kloroform dalam air suling sampai 1 liter) dalam labu
bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan
selama 18 jam, kemudian disaring. Sejumlah 20 mL filtrat pertama diuapkan
sampai kering dalam cawan penguap yang berdasar rata yang telah dipanaskan
dan ditara. Sisa dipanaskan pada suhu 105oC sampai bobot tetap. Kadar dalam
persen sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan di
udara (Depkes, RI., 1995).
3.5.5 Penetapan kadar sari yang larut dalam etanol
Sebanyak 5 gram serbuk simplisia dimaserasi selama 24 jam dalam 100
mL etanol 96% dalam labu bersumbat sambil dikocok sesekali selama 6 jam
pertama, kemudian dibiarkan selama 18 jam. Kemudian disaring cepat untuk
menghindari penguapan etanol. Sejumlah 20 mL filtrat diuapkan sampai kering
dalam cawan penguap yang berdasar rata yang telah dipanaskan dan ditara. Sisa
dipanaskan pada suhu 105oC sampai bobot tetap.Kadar dalam persen sari yang
larut dalam etanol 96% dihitung terhadap bahan yang telah dikeringkan di udara
(Depkes, RI., 1995).
3.5.6 Penetapan kadar abu total
Krus porselin ditara, dimasukkan dalam tanur, kemudian dipijar. Sebanyak
porselin yang telah dipijar dan ditara, kemudian diratakan.Krus porselin dipijar
perlahan-lahan sampai arang habis, didinginkan, ditimbang sampai diperoleh
bobot tetap. Kadar abu dihitung terhadap bahan yang telah dikeringkan di udara
(Depkes, RI., 1995).
3.5.7 Penetapan kadar abu yang tidak larut dalam asam
Abu yang diperoleh dalam penetapan kadar abu dididihkan dalam 25 mL
asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam
dikumpulkan, disaring melalui kertas saring dipijarkan sampai bobot tetap,
kemudian didinginkan dan ditimbang. Kadar abu yang tidak larut dalam asam
dihitung terhadap bahan yang telah dikeringkan di udara (Depkes, RI., 1995).
3.6 Skrining Fitokimia 3.6.1 Pemeriksaan alkaloida
Serbuk simplisia ditimbang sebanyak 0,5 g, ditambahkan 1 mL asam
klorida 2 N dan 9 mL air suling, dipanaskan diatas penangas air selama 2 menit,
didinginkan dan disaring, filtrat dipakai untuk uji alkaloida. Diambil 3 tabung
reaksi, lalu ke dalam masing-masing tabung reaksi dimasukkan 0,5 mL filtrat.
Pada tabung I : ditambahkanl 2 tetes pereaksi Mayer, akan terbentuk endapan
menggumpal berwarna putih atau kuning.
Pada tabung II : ditambahkan 2 tetes pereaksi Dragendorff, akan terbentuk
endapan berwarna coklat atau jingga kecoklatan.
Pada tabung III : ditambahkan 2 tetes pereaksi Bourchardat, akan terbentuk
endapan berwarna coklat sampai kehitaman.
Alkaloid disebut positif jika terjadi endapan atau kekeruhan pada dua atau
3.6.2 Pemeriksaan glikosida
Sebanyak 3 g serbuk simplisia ditimbang, lalu disari dengan 30 mL
campuran dari 7 bagian etanol 96% dan 3 bagian air suling.Kemudiaan direfluks
selama 10 menit, didinginkan, lalu disaring. Diambil 20 mL filtrat, ditambahkan
25 mL air suling dan 25 mL timbal (II) asetat 0,4 M dikocok, didiamkan 5 menit
lalu disaring. Filtrat disari dengan 20 mL campuran 2 bagian isopropanol dan 3
bagian kloroform, perlakuan ini diulangi sebanyak 3 kali. Sari air dikumpulkan
dan ditambahkan Natrium sulfat anhidrat, disaring, kemudian diuapkan pada
temperatur tidak lebih dari 500C, sisanya dilarutkan dalam 2 mL metanol. Larutan
sisa digunakan untuk percobaan berikut: 0,1 mL larutan percobaan dimasukkan
dalam tabung reaksi, kemudian diuapkan di atas penangas air. Pada sisa
ditambahkan 2 mL air dan 5 tetes larutan perekasi Molish, lalu ditambahkan
dengan hati-hati 2 mL asam sulfat pekat, terbentuk cincin ungu pada batas kedua
cairan, menunjukkan adanya ikatan gula (glikon) atau glikosida (Depkes, RI.,
1995).
3.6.3 Pemeriksaan steroid/triterpenoid
Sebanyak 1 g serbuk simplisia dimaserasi dengan eter 20 mL selama 2
jam, disaring, lalu filtrat diuapkan dalam cawan penguap. Pada sisa ditambahkan
20 tetes asam asetat anhidrat dan 1 tetes asam sulfat pekat (pereaksi Lieberman-
Burchard), diteteskan pada saat akan mereaksikan sampel uji. Apabila terbentuk
warna biru atau biru hijau menunjukkan adanya steroida sedangkan warna merah,
merah muda atau ungu menunjukkan adanya triterpenoid (Harborne, 1987).
3.6.4 Pemeriksaan flavonoida
Sebanyak 10 g serbuk simplisia ditambah 100 mL air panas, dididihkan
ditambahkan 0,1 g serbuk Mg, 1 mL asam klorida pekat dan 2 mL amil alkohol,
dikocok dan dibiarkan memisah. Flavonoid positif jika pada lapisan amil alkohol
terjadi warna merah kekuningan atau jingga (Farnsworth, 1966).
3.6.5 Pemeriksaaan tannin
Sebanyak 0,5 g serbuk simplisia disari dengan 10 mL air suling lalu
disaring, filtratnya diencerkan dengan air sampai tidak berwarna. Larutan diambil
sebanyak 2 mL dan ditambahkan 1-2 tetes pereaksi besi (III) klorida 1%. Jika
terjadi warna biru atau kehitaman menunjukkan adanya tannin (Farnsworth,
1966).
3.6.6 Pemeriksaan saponin
Sebanyak 0,5 g serbuk simplisia dimasukkan ke dalam tabung reaksi,
ditambahkan 10 mL air suling panas, didinginkan, kemudian dikocok kuat-kuat
selama 10 detik. Saponin positif jika terbentuk busa yang stabil tidak kurang dari
10 menit setinggi 1 sampai 10 cm dan dengan penambahan 1 tetes asam klorida 2
N buih tidak hilang (Depkes, RI., 1995).
3.7 Pembuatan Ekstrak Etanol Bunga Pisang Klutuk (EEBPK)
Pembuatan ekstrak bunga pisang klutuk dilakukan secara maserasi.
Prosedur pembuatan ekstrak : Sebanyak 200 g serbuk simplisia dimasukkan
kedalam wadah kaca, dituangi dengan 1500 mL(75 bagian) etanol, ditutup dan
dibiarkan selama 5 hari terlindung dari cahaya dan sesekali diaduk, setelah 5 hari
campuran tersebut diserkai (saring). Ampas dicuci dengan etanol secukupnya
hingga diperoleh 2000 mL (100 bagian), lalu dipindahkan dalam bejana tertutup,
dan dibiarkan ditempat sejuk, terlindung dari cahaya selama 2 hari, kemudian di
evaporatorsuhu 40ºC kemudian dikeringkan menggunakan freeze dryer hingga
diperoleh ekstrak kental bunga pisang klutuk (Depkes, RI., 1979).
3.8Pengujian Aktivitas Antioksidan
3.8.1 Prinsip metode pemerangkapan radikal bebas DPPH
Kemampuan sampel uji dalam menghambat proses oksidasi radikal bebas
DPPH (1,1-diphenyl-2-picryl-hidrazyl) dalam larutan metanol (ditandai dengan
perubahan warna DPPH dari warna ungu menjadi warna kuning) dengan nilai IC50
(konsentrasi sampel uji yang mampu menghambatradikal bebas sebesar 50%)
digunakan sebagai parameter untuk menentukan aktivitas antioksidan sampel uji
tersebut.(Molyneux, 2004).
3.8.2 Pembuatan larutan blanko a. Larutan DPPH
Sebanyak 10 mg DPPH ditimbang kemudian dimasukkan kedalam labu
tentukur 50 mL, dicukupkan volumenya dengan metanol sampai garis tanda,
diperoleh larutan DPPH 0,5 mM (konsentrasi 200 ppm).
Larutan DPPH 0,5 mM dipipet sebanyak 5 mL, kemudian dimasukkan ke dalam
labu tentukur 25 mL, dicukupkan volumenya dengan metanol sampai garis tanda,
diperoleh larutan blanko DPPH (konsentrasi 40 ppm).
b. Larutan sampel uji ekstrak etanol bunga pisang klutuk (EEBPK)
Sebanyak 25 mg sampel uji ditimbang kemudian dilarutkan dalam labu
tentukur 25 mL dengan metanol lalu volumenya dicukupkan dengan metanol
sampai garis tanda (konsentrasi 1000 ppm).
Konsentrasi ditetapkan setelah dilakukan beberapa orientasi. Larutan
masing-masinglabu labu tentukur 25 mLuntuk mendapatkan konsentrasi 50 ppm, 100
ppm, 150 ppm, 200 ppm, kemudian ditambahkan 5 mL larutan DPPH 0,5 mM
(konsentrasi 200 ppm) lalu volume dicukupkan dengan metanol sampai garis
tanda. Diamkan ditempat gelap selama 65 menit, lalu diukur serapannya
menggunakan spektrofotometer UV-visibel pada panjang gelombang 516 nm.
c. Larutan vitamin C
Sebanyak 25 mg serbuk vitamin C ditimbang, dimasukkan ke dalam labu
tentukur 25 mL dilarutkan dengan metanol lalu volumenya dicukupkan dengan
metanol sampai garis tanda (konsentrasi 1000 ppm)
Larutan induk dipipet sebanyak 0,05 mL; 0,1 mL; 0,15 mL; 0,2 mL ke
dalam labu tentukur 25 mL untuk mendapatkan konsentrasi larutan uji 2 ppm, 4
ppm, 6 ppm, 8 ppm, kedalam masing-masing labu ukur ditambahkan 5 mL larutan
DPPH 0,5 mM (konsentrasi 200 ppm) lalu volumenya dicukupkan dengan
metanol sampai garis tanda. Diamkan ditempat gelap selama 65 menit, lalu diukur
serapannya menggunakan spektrofotometer UV-Visibel pada panjang gelombang
516 nm.
3.8.3 Penentuan panjang gelombang serapan maksimum
Larutan DPPH konsentrasi 40 ppm dihomogenkan dan diukur serapannya
pada panjang gelombang 400-800 nm. Gambar seperangkat alat spektrofotometer
UV-Visibel dapat dilihat pada lampiran 5, halaman 48.
3.8.4Waktu pengukuran
Lama pengukuran metode DPPH menurut beberapa literatur yang
direkomendasikan adalah selama 65 menit. Larutan sampel uji ekstrak etanol
bunga pisang klutuk 50 ppm diukur pada panjang gelombang yang diperoleh
dipipet ke dalam labu tentukur 25 mL, ditambahkan 5 mL larutan DPPH 0,5 mM
lalu dicukupkan dengan metanol hingga garis tanda, dihomogenkan lalu diukur.
3.8.5 Analisis persen pemerangkapan radikal bebas
Penentuan persen pemerangkapan radikal bebas dihitung dengan rumus
sebagai berikut:
Aktivitas pemerangkapan radikal bebas(%) = x 100% kontrol
A
sampel A -kontrol A
Keterangan :
A Kontrol = Absorbansi tidak mengandung sampel A sampel = Absorbansi sampel
3.8.6 Analisis nilai IC50
Nilai IC50 merupakan bilangan yang menunjukkan konsentrasi sampel uji
yang memberikan peredaman DPPH sebesar 50% (mampu menghambat proses
oksidasi sebesar 50%). Nilai 0% berarti tidak mempunyai aktivitas antioksidan,
sedangkan nilai 100% berarti peredaman total dan pengujian perlu dilanjutkan
dengan pengenceran larutan uji untuk melihat batas konsentrasi aktivitasnya.
Hasil perhitungan dimasukkan kedalam persamaan regresi dengan konsentrasi
ekstrak (ppm) sebagai absis (sumbu X) dan nilai % peredaman (antioksidan)
sebagai ordinatnya (sumbu Y) (Shirwaikar, dkk., 2006).
Suatu senyawa secara spesifik dikatakan sebagai antioksidan sangat kuat
jika nilai IC50 kurang dari 50 ppm, kuat untuk nilai IC50 bernilai 50-100 ppm,
sedang jika IC50 bernilai 101-150 ppm dan lemah jika IC50 bernilai lebih dari 150
BAB IV
HASIL DAN PEMBAHASAN
4.1Hasil Identifikasi Tumbuhan
Hasil identifikasi tumbuhan yang dilakukan diHerbarium Bogoriense,
Bidang Botani Pusat Penelitian Biologi, Lembaga ilmu Pengetahuan Indonesia
(LIPI) Bogor adalah bunga pisang klutuk (Musa balbisiana BB), suku Musaceae
dapat dilihat pada Lampiran 1, halaman 43.
4.2Hasil Karakterisasi Simplisia 4.2.1 Hasil pemeriksaan makroskopik
Hasil pemeriksaan makroskopik bunga pisang klutuk segar yaitu memiliki
bentuk lonjong, dengan ujung meruncing, panjang 40-55 cm, lebar 10-15 cm,
warna merah keunguan, memiliki bau yang khas. Gambar bunga pisang klutuk
segar dapat dilihat pada Lampiran 3, halaman 45.
Hasil pemeriksaan makroskopik serbuk simplisia yang diperoleh yaitu
serbuk kasar, warna coklat, terdapatbanyak serat dan memiliki bau yang khas.
Gambar serbuk simplisia bunga pisang klutuk dapat dilihat pada Lampiran 3,
halaman 45.
4.2.2Hasil pemeriksaan mikroskopik
Hasil pemeriksaan mikroskopik pada serbuk simplisia diperoleh adanya
Sel batu, sklerenkim, Kristal kalsium oksalat, amylum. Gambar hasil mikroskopik
serbuk simplisia dapat dilihat pada Lampiran 4, halaman 46.
4.2.3 Hasil pemeriksaan karakteristik
perhitungan dapat dilihat pada Lampiran 6, halaman 48. Monografi dari simplisia
bunga pisang klutuk tidak terdapat dalam buku Materia Medika Indonesia (MMI),
[image:33.595.114.512.191.289.2]sehingga tidak ada acuan untuk menentukan parameter simplisia tersebut.
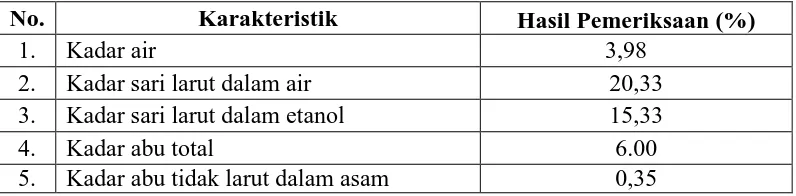
Tabel 4.1 Hasil pemeriksaan karakteristik simplisia bunga pisang klutuk
No. Karakteristik Hasil Pemeriksaan (%)
1. Kadar air 3,98
2. Kadar sari larut dalam air 20,33
3. Kadar sari larut dalam etanol 15,33
4. Kadar abu total 6.00
5. Kadar abu tidak larut dalam asam 0,35
Monografi simplisia bunga pisang klutuk belum tercantum dalam Materia
Medica Indonesia (MMI), sehingga tidak ada acuan dalam menentukan
parameternya.Tabel 4.1 menunjukkan kadar air pada simplisia bunga pisang
klutuk sebesar 3,98% kadar tersebut memenuhi persyaratan umum yaitu lebih
kecil dari 10%. Kadar air yang lebih besar dari 10% dapat menjadi media
pertumbuhan kapang dan jasad renik lainnya (Depkes, RI., 1995).
Penetapan kadar sari yang larut dalam air menyatakan jumlah zat yang
tersari dalam pelarut air seperti glikosida, gula, gom, protein, enzim, zat warna
dan asam-asam organik, sedangkan penetapan kadar sari yang larut dalam etanol
menyatakan jumlah zat yang tersari dalam pelarut etanol seperti glikosida, steroid
flavonoid, klorofil, saponin, tannin dan yang larut dalam jumlah sedikit yaitu
lemak (Depkes, RI., 1995).
Penetapan kadar abu total dan kadar abu tidak larut asam bertujuan untuk
memberikan jaminan bahwa simplisia tidak mengandung logam berat tertentu
melebihi nilai yang ditetapkan karena dapat berbahaya (toksik) bagi kesehatan.
Penetapan kadar abu total menyatakan jumlah kandungan senyawa anorganik
kadar abu tidak larut dalam asam dilakukan untuk mengetahui kadar senyawa abu
yang tidak larut dalam asam, misalnyasilika. Abu total terbagi dua yaitu abu
fisiologis dan abu non fisiologis. Abu fisiologis adalah abu yang berasal dari
jaringan tumbuhan itu sendiri sedangkan abu non fisiologis adalah sisa setelah
pembakaran yang berasal dari bahan-bahan luar yang terdapat pada permukaan
simplisia (WHO, 1998). Perhitungan pemeriksaan karakteristik serbuk simplisia
bunga pisang klutuk dapat dilihat pada Lampiran 6, halaman 48-50.
4.3. Hasil Skrining Fitokimia
Hasil skrining fitokimia terhadap serbuk simplisia diperoleh simplisia
tidak mengandung alkaloid, penambahan pereaksi Mayer, Bourchardat maupun
Dragendroff tidak terbentuk endapan, tidak mengandung saponin, busa tidak
terbentuk dengan pengocokan dan penambahan HCL 2N, Mengandung glikosida,
penambahan pereaksi Molish dan asam sulfat pekat membentuk cincin ungu;
mengandung flavonoid, terbentuknya warna merah intensif pada lapisan amil
alkohol; mengandung tanin dengan penambahan FeCl³memberi warna biru atau
kehitaman; mengandung steroid, penambahan pereaksi
Liebermann-Burchadmembentuk warna biru hijau. Hasil skrinning fitokimia simplisia EEBPK
[image:34.595.115.472.633.749.2]dapat dilihat pada Tabel 4.2 berikut:
Tabel 4.2 Hasil skrinning fitokimia simplisia ekstrak etanol bunga pisang klutuk
No Pemeriksaan Hasil
Serbuk Simplisia Ekstrak Etanol
1 Alkaloida - -
2 Flavonoida + +
3 Glikosida + +
4 Tanin + +
5 Saponin - -
Keterangan: (+) Positif : mengandung golongan senyawa (−) Negatif : tidak mengandung golongan senyawa
Hasil Skrining yang dilakukan terhadap serbuk simplisia dan ekstrak
bunga pisang klutukmenunjukkan bahwa bunga pisang klutukmengandung
senyawa metabolit sekunder yaitu glikosida, flavonoid, steroid dan tanin.
Senyawa antioksidan kuat dalam menetralkan radikal bebas adalah senyawa fenol.
Flavonoida dan tannin termasuk dalam golongan senyawa fenol, sehingga dapat
dikatakan bahwa bunga pisang klutuk memiliki potensi antioksidan yang baik.
4.4Hasil Pengujian Aktivitas Antioksidan
Hasil uji aktivitas antioksidan dari ekstrak etanolbunga pisang klutuk
dengan metode pemerangkapan 1,1-diphenyl-2-picrylhidrazyl (DPPH) secara
spektrofotometri visibel.
4.4.1 Hasil penentuan panjang gelombang serapan maksimum
Pengukuran serapan maksimum larutan DPPH 40 ppm dalam metanol
dengan menggunakan spektrofotometer UV-Visibel. Data hasil pengukuran dan
[image:35.595.170.448.548.714.2]panjang gelombang maksimum dapat dilihat pada Gambar 4.1 berikut:
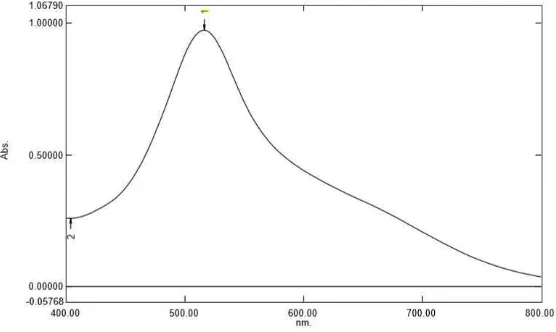
Gambar 4.1 Kurva serapan maksimum larutan DPPH 40 ppm dalam metanol
Hasil pengukuran menunjukkan bahwa larutan DPPH dalam metanol
menghasilkan serapan maksimum pada panjang gelombang 516 nm.
Panjanggelombang 516 nm, termasuk dalam kisaran panjang gelombang sinar
tampak (400-750 nm) (Rohman, 2007).
4.4.2. Hasil penentuan operating time larutan DPPH dalam metanol
Penentuan operating time bertujuan untuk mengetahui waktu pengukuran
yang stabil. Waktu operasional ditentukan dengan mengukur hubungan antara
waktu pengukuran dengan absorbansi larutan. Hasil penentuan operating time
diperoleh waktu kerja terbaik pada menit ke 65 setelah penambahan pelarut
etanol. Kurva absorbansi untuk operating time larutan DPPH dalam metanol dapat
dilihat pada Lampiran 7, halaman 51.
4.4.3 Hasil analisis aktivitas antioksidan sampel uji
Aktivitas antioksidan ekstrak etanol bunga pisang klutuk (EEBPK)
diperoleh dari hasil pengukuran absorbansi DPPH pada menit ke-65 dengan
adanya penambahan larutan uji dengan konsentrasi 50 ppm, 100 ppm, 150 ppm
dan 200 ppm yang dibandingkan dengan kontrol DPPH (tanpa penambahan
larutan uji). Pada hasil analisis aktivitas antioksidan dapat dilihat adanya
penurunan nilai absorbansi DPPH yang diberi larutan uji ekstrak etanol bunga
pisang klutuk (EEBPK) dan vitamin C terhadap kontrol pada setiap kenaikan
konsentrasi. Penurunan absorbansi DPPH dan persen pemerangkapan dengan
penambahan ekstrak etanol bunga pisang klutuk dan vitamin C dapat dilihat
Tabel 4.3 Penurunan absorbansi dan persen pemerangkapan DPPH oleh ekstrak
etanol bunga pisang klutuk (EEBPK)
Larutan uji
Konsentra si (ppm)
Absorbansi % Pemerangkapan
I II III I II III
Rata-rata Ekstrak Etanol Bunga Pisang Klutuk
0 1,077 1,059 1,065 0,00 0,00 0,00 0,00 50 0,433 0,411 0,416 59,76 61,21 60,87 60,61 100 0,300 0,309 0,309 72,14 70,81 70,99 71,31 150 0,226 0,226 0,224 78,98 78,60 78,90 78,82 200 0,176 0,174 0,175 83,58 83,53 83,52 83,54
Tabel 4.4 Penurunan absorbansi dan persen pemerangkapan DPPH oleh vitamin
C Larutan uji Konsentra si (ppm)
Absorbansi % Pemerangkapan
I II III I II III
Rata-rata
Vitamin C
0 0,991 0,983 0,975 0,00 0,00 0,00 0,00 2 0,580 0,580 0,579 41,45 41,02 40,64 41,03 4 0,297 0,298 0,297 69,97 69,70 69,54 69,73 6 0,033 0,033 0,033 96,63 96,63 96,59 96,61 8 0,017 0,018 0,018 98,19 98,14 98,12 98,15
Ekstrak etanol bunga pisang klutuk (EEBPK) menunjukkan nilai
penurunan absorbansi DPPH yang lebih kecil dibandingkan vitamin C. Penurunan
nilai absorbansi menunjukkan aktivitas antioksidan yang semakin besar.
Penurunan nilai ini terjadi karena larutan uji memerangkap DPPH dan
pemerangkapan terjadi karena adanya transfer elektron atom hidrogen antioksidan
kepada DPPH. Interaksi ini akan menetralkan radikal bebas DPPH. Semua
elektron pada radikal bebas DPPH menjadi berpasangan ditandai dengan warna
larutan yang berubah dari ungu tua menjadi kuning terang (Molyneux, 2004).
Contoh perhitungan persen pemerangkapan dan nilai IC50 dapat dilihat pada
Lampiran 10, halaman 55-59.Hubungan antara konsentrasi dengan persen
pemerangkapan radikal bebas DPPH oleh Ekstrak etanol bunga pisang klutuk dan
[image:37.595.112.515.302.411.2]Gambar 4.2 Grafik hasil uji aktivitas antioksidan ekstrak etanol
bunga pisang klutuk (EEBPK)
Gambar 4.3Grafik hasil uji aktivitas antioksidan vitamin C 4.4.4 Hasil analisis nilai IC50
Nilai IC50 diperoleh berdasarkan perhitungan persamaan regresi linier yang
diperoleh dengan cara memplot konsentrasi larutan uji dan persen pemerangkapan
DPPH sebagai parameter aktivitas antioksidan, dimana konsentrasi sampel (ppm) 0 10 20 30 40 50 60 70 80 90
0 50 100 150 200 250
% P em er an gk ap an D PPH Konsentrasi (ppm) 0 20 40 60 80 100 120
0 2 4 6 8 10
sebagai absis (sumbu X) dan nilai % pemerangkapan sebagai ordinat (sumbu Y).
Nilai IC50 (konsentrasi sampel uji yang mampu memerangkap radikal bebas
sebesar 50%) digunakan sebagai parameter untuk menentukan aktivitas
antioksidan sampel uji (Shirwaikar, dkk., 2006).
Hasil persamaan regresi linier dan hasil analisis IC50 yang diperoleh dari
ekstrak etanol bunga pisang klutuk dan vitamin C dapat dilihat pada Tabel 4.5
berikut ini:
Tabel 4.5 Hasil persamaan regresi linier dan hasil analisis IC50 yang diperoleh dari ekstrak etanol bunga pisang klutuk dan vitamin C.
Larutan Uji Persamaan regresi IC50 (ppm)
Ekstrak etanol bunga pisang klutuk Y = 0,37276X + 21,616 76,14
Vitamin C Y = 12,578X + 10,936 3,10
Menurut Fidrianny, dkk.,(2014), kategori kekuatan aktivitas antioksidan
[image:39.595.115.510.315.377.2]berdasarkan nilai IC50 dapat dilihat pada Tabel 4.6 berikut:
Tabel 4.6 Kategori nilai IC50 sebagai antioksidan
No. Kategori Konsentrasi (ppm)
1. Sangat kuat < 50
2. Kuat 50 – 100
3. Sedang 101 – 150
4. Lemah 151 – 200
Hasil analisis nilai IC50 pada tablel 4.6 menunjukkan bahwa ekstrak etanol
bunga pisang klutuk memiliki aktivitas antioksidan yang baik yakni dalam
kategori kuat dengan nilai IC50 76,14 ppm, sedangkan vitamin C dalam kategori
sangat kuat dengan nilai IC50 3,10 ppm. Nilai ekstrak etanol bunga pisang klutuk
(EEBPK) tidak termasuk dalam rentang kategori yang sama dengan vitamin C. hal
ini karena vitamin C merupakan senyawa murni sedangkan ekstrak etanol bunga
[image:39.595.116.511.472.545.2]BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil penelitian yang telah dilakukan dapat disimpulkan:
a. Hasil karakterisasi simplisia bunga pisang klutuk diperoleh kadar air 3,98 %,
kadar sari larut air 20,33%, kadar sari larut etanol 15,33 %, kadar abu total
6,00%, dan kadar abu tidak larut asam 0,35%.
b. Hasil skrining fitokimia simplisia bunga pisang klutuk menunjukkan adanya
senyawa kimia golongan flavonoid, glikosida, steroid, dan tanin.
c. Hasil analisis nilai IC50 diperoleh nilai IC50 Ekstrak etanol bunga pisang klutuk
menunjukkan aktivitas antioksidan kategori kuat dan vitamin C kategori sangat
kuat..
5.2 Saran
Disarankan kepada peneliti selanjutnya untuk melakukan uji aktivitas
antioksidan dengan metode dan pelarut yang lain maupun uji aktivitas biologi
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan 2.1.1 Habitat
Tumbuhan pisang klutuk merupakan tumbuhan yang mudah diperoleh
dapat tumbuh dimana saja, biasanya sebagai tanaman liar atau dibudidayakan.
Pisang yang umum dibudidayakan sekarang yaituMusa balbisiana BB dan Musa
acuminatacolla yang banyak memiliki keanekaragaman di Indonesia, Malaysia
dan Papua Nugini (Anonim, 2015). Tumbuhan pisang klutuksebaiknya ditanam di
dataran rendah, ketinggian 1000 meter di atas permukaan laut (Prahasta, 2009).
2.1.2 Morfologi tumbuhan
Tumbuhan pisang klutuk memiliki ciri-ciri yaitu tumbuhan semak,
berumpun, tinggi tanaman kurang lebih 3 meter dengan lingkar batang 60-70 cm,
memiliki batang semu, berpelepah, berwarna hijau, memiliki daun tunggal yang
panjangnya 60-200 cm, bentuk lansetmemanjang, Tandan buah mencapai panjang
80-100 cm. Bunga pisang klutuk berbentuk lonjong dengan ujung meruncing,
panjang bunga pisang klutuk 40-55 cm, lebar 10-15 cm.memiliki daun pelindung
berwarna ungu kemerahan, mahkota bunga berwarna putih kekuningan (Anonim,
2015). Menurut I Wayan Mudita (2012), akhir pertumbuhan vegetatif, batang
pisang akan menghasilkan pertumbuhan memanjang untuk membentuk rangkaian
bunga yang terdiri atas beberapa baris bunga, masing-masing ditutupi dengan
pisang juga termasuk dalam golongan bunga majemuk dengan karangan bunga
berbentuk bulir (Spica) yang diselubungi.Bagian sphata adalah bagian dari bunga
yang paling sering dimanfaatkan sebagai obat (Wardhany, 2014).
2.1.3 Sistematika tumbuhan
Menurut Prahasta (2009), sistematika dari tumbuhan pisang klutuk adalah
sebagai berikut:
Kingdom : Plantae
Divisi : Spermatopyta
Subdivisi : Angiospermae
Kelas : Monocotyledonae
Bangsa : Zingiberales
Suku : Musaceae
Marga : Musa
Species : Musa balbisiana BB
2.1.4 Nama daerah
Gedang (Jawa), Cau (Sunda), Biu (Bali), Puti (Lampung), Wusak lambi, Lutu
(Gorontalo), Kulo (Ambon), Uki (Timor).
2.1.5 Nama asing
Banana (Inggris, Jepang) Tsiu, Cha (Cina), Pisyanga, Kila (India), Klue
(Thailand), Pyaw, Nget (Burma).
2.1.6 Kandungan kimia dan kegunaan
Bagian tumbuhan yang digunakan sebagai obat adalah bunga. Bunga yang
diambil yaitu bunga setelah pisang terbentuk. Bunga mengandung senyawa kimia
seperti Flavonoida dan tannin yang dapat berpotensi sebagai antioksidan.
stroke, hipertensi, diare, diabetes, dan mencegah kanker (Wardhany, 2014).
2.2 Ekstraksi
Ekstraksi adalah suatu proses pemisahan kandungan senyawa kimia dari
jaringan tumbuhan maupun hewan dengan pelarut yang sesuai. Sebelum
ekstraksidilakukan biasanya bahan dikeringkan terlebih dahulu kemudian
dihaluskan pada derajat kehalusan tertentu (Harborne, 1996).
Tujuan utama dari ekstraksi adalah untuk mendapatkan atau memisahkan
sebanyak mungkin zat-zat yang memiliki khasiat pengobatan yang terdapat dalam
simplisia tersebut (Depkes, RI., 2000).
Hasil ekstraksi disebut ekstrak, yaitu sediaan kental atau cair yang
diperoleh dengan cara mengekstraksi zat aktif dengan pelarut yang sesuai
kemudian menguapkan semua atau hampir semua pelarut yang digunakan pada
ekstraksi (Depkes, RI., 1995).
Menurut Depkes, RI (2000), ada beberapa metode ekstraksi yang sering
digunakan yaitu:
2.2.1 Cara dingin
a. Maserasi
Maserasi adalah penyarian simplisia dengan cara perendaman
menggunakan pelarut disertai sesekali pengadukan pada temperatur kamar.
Maserasi yang dilakukan pengadukan secara terus menerus disebut maserasi
kinetik sedangkan yang dilakukan penambahan ulang pelarut setelah dilakukan
penyaringan terhadap maserat pertama dan seterusnya disebut remaserasi. Metode
maserasi digunakan untuk menyari simplisia yang mengandung komponen kimia
yang mudah larut dalam cairan penyari.
Perkolasi adalah proses penyarian simplisia menggunakan alat perkolator
dengan pelarut yang selalu baru sampai terjadi penyarian sempurna yang
umumnya dilakukan pada temperatur kamar.Proses perkolasi terdiri dari tahap
pengembangan bahan, tahap maserasi antara, tahap perkolasi sebenarnya
(penetesan/penampungan perkolat) terus menerus sampai diperoleh ekstrak.
Keuntungan proses perkolasi adalah proses penyarian sempurna.
2.2.2 Cara panas
a. Refluks
Refluks adalah proses penyarian simplisia pada temperatur titik didihnya
menggunakan alat dengan pendingin balik dalam waktu tertentu dimana pelarut
akan terkondensasi menuju pendingin dan kembali ke labu.
b. Sokletasi
Sokletasi adalah proses penyarian menggunakan pelarut yang selalu baru,
dilakukan dengan menggunakan alat khusus (soklet) dimana pelarut akan
terkondensasi dari labu menuju pendingin, kemudian jatuh membasahi sampel.
c. Digestiasi
Digestiasi adalah proses penyarian dengan pengadukan kontinu pada
temperatur lebih tinggi dari temperatur kamar, yaitu secara umum dilakukan pada
temperatur 40-500C.
d. Infundasi
Infundasi adalah proses penyarian dengan menggunakan pelarut air pada
temperatur 900C selama 15 menit.
e. Dekoktasi
Dekoktasi adalah proses penyarian dengan menggunakan pelarut air pada
2.3 Radikal bebas
Radikal bebas adalah setiap molekul yang mengandung satu atau lebih
elektron yang tidak berpasangan. Radikal bebas sangat reaktif dan dengan mudah
menjurus ke reaksi yang tidak terkontrol menghasilkan ikatan silang pada DNA,
protein, lipida atau kerusakan oksidatif pada gugus fungsional yang penting pada
biomolekul. Perubahan ini akan menyebabkan proses penuaan. Radikal bebas juga
terlibat dan berperan dalam patologi penyakit degeneratif, yakni kanker,
aterosklerosis, rematik, jantung koroner, katarak(Silalahi, 2006).
Radikal bebas ini antara lain radikal superoksida, hidroksil, peroksil,
alkoksil, hidroperoksil, nitrit oksida, nitrogen dioksida, lipid peroksil dan
kelompok non-radikal yang kurang reaktif namun masih tergolong radikal bebas
seperti hidrogen peroksida, asam hipoklorit, oksigen singlet, peroksinitrat, asam
nitrit, dinitrogen trioksida dan lipid peroksida (Sen, dkk., 2010). Berdasarkan
sumbernya jenis radikal bebas dalam tubuh ada dua macam yaitu:
1. Radikal Bebas Endogen
Merupakan bentuk radikal bebas yang berasal dari dalam tubuh yaitu:
a. Oksidasi Enzimatik
Radikal bebas ini dihasilkan oleh enzim, misalnya pada proses sintesis
prostaglandin, oksidasi aldehida, oksidasi xantin, oksidasi asam amino.
b. Autoksidasi
Radikal bebas yang berasal dari proses metabolisme aerobik, misalnya pada
hemoglobin, katekolamin.
c. Respiratory Burst
2. Radikal Bebas Eksogen
Merupakan bentuk radikal bebas yang berasal dari luar tubuh yaitu:
a. Asap Rokok
Asap rokok mengandung epoksida, aldehida, peroksida, dan radikal bebas
lainnya yang dapat menyebabkan kerusakan pada alveoli di paru- paru.
b. Polusi Udara.
Polusi udara yang berasal dari asap pabrik, asap kenderaan bermotor dan debu
merupakan bentuk radikal bebas yang dapat mengganggu metabolisme tubuh.
c. Radiasi Ultraviolet
Pancaran sinar matahari yang mengandung ultraviolet merupakan sumber
radikal bebas yang masuk melalui kulit (Irmawati, 2014).
Menurut Kumalaningsih (2006), radikal bebas terbentuk dari 3 tahapan reaksi
berantai berikut:
a. Tahap Inisiasi yaitu tahap awal terbentuknya radikal bebas.
b. Tahap Propagasi, yaitu tahap perpanjangan radikal berantai, terjadi reaksi
antara radikal bebas dengan senyawa lain dan menghasilkan radikal baru.
c. Tahap Terminasi, yaitu tahap akhir, terjadi pengikatan suatu radikal bebas
dengan radikal bebas yang lain sehingga membentuk senyawa non-radikal
yang biasanya kurang reaktif dari radikal induknya.
Reaktivitas radikal bebas merupakan upaya untuk mencari pasangan
elektron. Sebagai dampak kerja radikal bebas tersebut, akan terbentuk radikal
bebas baru yang berasal dari atom atau molekul yang elektronnya diambil untuk
Meningkatnya jumlah radikal bebas dalam tubuh yang dikenal sebagai
kondisi stress oksidatif, akan memulai oksidasi asam lemak tidak jenuh, protein,
DNA, dan sterol didalam tubuh. Meningkatnya jumlah protein teroksidasi, DNA
teroksidasi, sterol teroksidasi dan lipid teroksidasi, seiring dengan bertambahnya
umur, mendukung hipotesis bahwa ROS dan radikal bebas tersangkut dalam
proses penuaan. Konsumsi sayuran dan buah-buahan yang kaya akan nutraceutical
antioksidatif berhubungan dengan status keseimbangan antara radikal bebas dan
antioksidan, yang membantu meminimumkan stress oksidatif dalam tubuh
(Muchtadi, 2013).
Radikal bebas dapat merusak membran sel, kemudian merusak komponen
sel termasuk inti sel dan berakibat mati nya sel. Proses ini akan berlangsung terus
menerus dalam tubuhsehingga menimbulkan penyakit, Reaktivitas radikal bebas
ini dapat diredam oleh antioksidan (Winarsi, 2007).
2.4 Antioksidan
Antioksidan adalah molekul yang dapat menetralkan radikal bebas dengan
cara menerima atau mendonorkan satu elektron sehingga radikal bebas menjadi
tidak reaktif dan stabil (Muchtadi, 2013). Antioksidan atau reduktor berfungsi
untuk mencegah terjadinya oksidasi atau menetralkan senyawa yang telah
teroksidasi, dengan cara menyumbangkan hidrogen atau elektron. Antioksidan
pangan adalah suatu zat dalam makanan yang menghambat akibat buruk dari efek
senyawa oksigen reaktif, senyawa nitrogen reaktif dalam fungsi fisiologis normal
pada manusia. Antioksidan dalam makanan dapat berperan dalam pencegahan
berbagai penyakit meliputi penyakit kardiovaskular, kanker dan penyakit yang
Menurut Kumalaningsih (2006) dan Winarsi (2007), antioksidan dapat
dikelompokkan menjadi 3 kelompok berdasarkan fungsinya, yaitu:
a. Antioksidan primer
Antioksidan primer adalah antioksidan yang berfungsi untuk mencegah
terbentuknya radikal bebas baru atau mengubah radikal bebas yang telah
terbentuk menjadi molekul yang kurang reaktif. Antioksidan ini berupa enzim
yang diproduksi oleh tubuh, meliputi: SOD (superoksida dismutase), CAT
(katalase) dan GSH-Px (glutation peroksidase). Enzim SOD berperan dalam
mengubah radikal superoksida (O2•‾) menjadi hidrogen peroksida (H2O2), enzim
CAT dan GSH-Px akan mengubah hidrogen peroksida (H2O2) menjadi air (H2O).
b. Antioksidan sekunder
Antioksidan ini adalah senyawa fenol yang berfungsi untuk menangkap radikal
bebas dan menghentikan reaksi berantai.Antioksidan sekunder disebut juga
sebagai antioksidan preventif, dimana pembentukan senyawa oksigen reaktif
dihambat dengan cara pengkelatan metal. antioksidan ini meliputi:
- Antioksidan golongan vitamin, contoh: vitamin A, C, E.
- Antioksidan alamiah, contoh: flavonoid, katekin, karotenoid, β-karoten.
- Antioksidan sintetik, contoh: BHA (butylated hydroxyl anisole), BHT
(butylated hydroxyrotoluene), PG (propyl gallate).
c. Antioksidan tersier.
Antioksidan tersier merupakan senyawa yang dapat memperbaiki sel-sel
jaringan yang rusak akibat radikal bebas. Senyawa yang termasuk dalam jenis ini
adalah jenis enzim misalnya metionin sulfoksidan reduktase yang mampu
memperbaiki DNA dalam inti sel. Enzim ini sangat bermanfaat untuk perbaikan
2.4.1 Vitamin C
Vitamin C atau asam askorbat mempunyai berat molekul 176,13 dengan
rumus molekul C6H8O6. Pemerian vitamin C adalah hablur atau serbuk berwarna
putih atau agak kekuningan. Pengaruh cahaya lambat laun menyebabkan berwarna
gelap, dalam keadaan kering stabil di udara namun dalam larutan cepat teroksidasi
Vitamin C mudah larut dalam air, agak sukar larut dalam etanol, praktis tidak
larut dalam kloroform, dalam eter dan dalam benzen (Depkes, RI., 1979).
Rumus bangun vitamin C dapat dilihat pada Gambar 2.1 berikut:
Gambar 2.1 Rumus vitamin C
Vitamin C (asam ascorbat) merupakan suatu antioksidan penting yang
larut dalam air. Vitamin C secara efektif menangkap radikal-radikal seperti
peroksil dan oksigen singlet, dan juga berperan dalam regenerasi vitamin E.
Vitamin C dapat melindungi membran biologis dan LDL dari kerusakan oksidatif
(Silalahi, 2006).Vitamin C mampu bereaksi dengan radikal bebas dan
mengubahnya menjadi radikal ascorbil yang kurang reaktif, kemudian membentuk
asam monodehidroaskorbat atau asam dehidroaskorbat. Bentuk tereduksi ini dapat
diubah kembali menjadi asam askorbat oleh enzim monodehidroaskorbat
reduktase dan dehidroaskorbat reduktase (Packer, 2002).Vitamin C dapat
mencegah timbulnya penyakit kanker, penyakit jantung, dan influenza. Pemberian
2.4.2 Flavonoid
Flavonoid adalah suatu senyawa polifenol. Polifenol sangat tersebar di
alam, dan dilaporkan lebih dari 8000 struktur polifenol tanaman telah
diidentifikasi (Muchtadi, 2013). Senyawa flavonoid mengandung 15 atom karbon
dalam inti dasarnya, terdiri dari dua cincin benzene yang dihubungkan menjadi
satu oleh rantai linier yang terdiri dari 3 atom karbon, tersusun dalam konfigurasi.
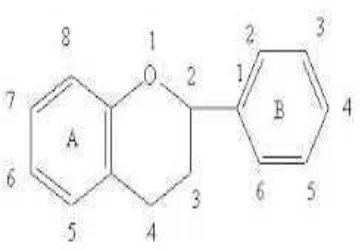
[image:50.595.240.420.322.447.2]Menurut Robinson (1995) Rumus bangun turunan flavonoid dapat dilihat pada
Gambar 2.2 berikut:
Gambar 2.2 Rumus flavonoid
Umumnya senyawa flavonoid dalam tumbuhan terikat dengan gula yang
disebut dengan glikosida sehingga untuk menganalisis flavonoid, lebih baik
ekstrak tumbuhan dihidrolisis terlebih dahulu untuk memecah ikatan gula dengan
aglikon. Flavonoida berkhasiat sebagai antioksidan, antibakteri dan antiinflamasi
(Harborne, 1996).
Senyawa flavonoid berperan sebagai penangkap radikal bebas karena
mengandung gugus hidroksil dan bersifat reduktor, dan dapat bertindak sebagai
donor hidrogen terhadap radikal bebas. senyawa flavonoid seperti quarsetin,
morin, mirisetin, kaemferol, asam tanat, dan asam elegat merupakan antioksidan
2.4.3 Vitamin E
Vitamin E atau tokoferol berupa minyak kental jernih, warna kuning atau
kuning kehijauan, dengan rumus kimia C29H50O2 dan bobot molekul 430,71.
Vitamin E tidak larut dalam air, larut dalam etanol, dalam minyak nabati, sangat
mudah larut dalam kloroform (Depkes, RI., 1995).Rumus bangun vitamin E dapat
dilihat pada Gambar 2.3 berikut:
Gambar 2.3 Rumus vitamin E
Fungsi terpenting vitamin E adalah sebagai antioksidan, adapun fungsi lain yaitu
menstimulasi respon imunologi. Vitamin E bekerja sebagai antioksidan karena
vitamin E mudah teroksidasi, dengan demikian dapat melindungi senyawa lain
dari oksidasi (Silalahi, 2006). Vitamin E berfungsi sebagai donor hidrogen yang
mampu mengubah radikal peroksil menjadi radikal tokoferol yang kurang reaktif
sehingga tidak mampu merusak rantai asam lemak (Winarsi, 2007).
Vitamin E dapat mencegah serangan jantung, penyumbatan pembuluh
darah perifer, dan stroke. Selain menghambat oksidasi kolesterol LDL vitamin E
juga memperlambat agregasi alamiah. Sebagai antikanker vitamin E akan
meningkatkan sistem kekebalan tubuh dan menghambat pertumbuhan sel kanker.
Khasiat lain adalah menunda terjadinya katarak, memperlambat kemunduran
fungsi otak, dan berkhasiat pada kesuburan. Vitamin E juga berperan mengatasi
2.5 Spektrofotometer UV-Visibel
Prinsip kerja Spektrofotometer UV-Visibel adalah sinar/cahaya dilewatkan
melalui sebuah wadah (kuvet) yang berisi larutan. Dimana akan menghasilkan
spektrum. Alat ini menggunakan hukum Lamber Beer sebagai acuan.
Spektrofotometer UV-Visibel terdiri dari sumber sinar monokromator, tempat sel
untuk zat yang diperiksa, detektor, penguat arus dan alat ukur atau pencatat.
Panjang gelombang untuk sinar ultraviolet antara 200-400 nm sedangkan panjang
gelombang untuk sinar tampak antara 400-800 nm (Rohman, 2007)
Spektrofotometer UV-Visibel pada umumnya digunakan untuk:
1. Menentukan jenis kromofor, ikatan rangkap yang terkonjugasi dan auksokrom
dari suatu senyawa organik
2. Menjelaskan informasi dari struktur berdasarkan panjang gelombang
maksimum suatu senyawa
3. Menganalisis senyawa organik secara kuantitatif.
Berdasarkan aspek kuantitatif, suatu berkas radiasi dikenakan pada
cuplikan (larutan sampel) dan intensitas sinar radiasi yang diteruskan diukur
besarnya. Radiasi yang diserap oleh cuplikan kemudian ditentukan dengan
membandingkan intensitas sinar yang diteruskan dengan intensitas sinar yang
diserap (Rohman, 2007).
2.6 Metode Pemerangkapan Radikal Bebas DPPH
DPPH pertama kali ditemukan pada tahun 1922 oleh Goldschmidt dan
Renn. DPPH bersifat tidak larut dalam air, memberikan serapan maksimum pada
panjang gelombang 516 nm, berwarna ungu pekat seperti KMnO4, warna ini akan
1,1-diphenyl-2-picrylhydrazine (DPPH-H) (Ionita, 2005). Metode pemerangkapan
radikal bebas DPPH (1,1-diphenyl-2-picrylhydrazil) merupakan metode yang
sederhana untuk mengukur kemampuan berbagai senyawa dalam memerangkap
radikal bebas serta untuk mengevaluasi aktivitas antioksidan pada bahan makanan
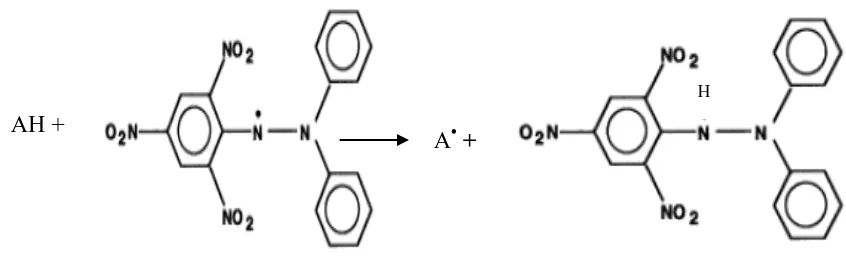
[image:53.595.213.382.222.322.2](Marinova dan Batchvarov, 2011).Rumus bangun DPPH dapat dilihat pada
Gambar 2.4 berikut:
Gambar 2.4 Rumus DPPH
DPPH merupakan radikal bebas yang stabil pada suhu kamar. Prinsip
metode pemerangkapan radikal bebas DPPH, yaitu elektron ganjil pada molekul
DPPH memberikan serapan maksimum pada panjang gelombang 516 nm.
Interaksi antioksidan dengan DPPH akan menetralkan karakter radikal bebas dari
DPPH (Molyneux, 2004). Warna ungu larutan DPPH akan berubah menjadi
kuning lemah apabila elektron ganjil tersebut berpasangan dengan atom hidrogen
yang dari senyawa antioksidan (Prakash, 2001).
[image:53.595.108.531.597.730.2]Mekanisme reaksi antioksidan dengan radikal bebas DPPH dapat dilihat pada
Gambar 2.5 berikut:
Gambar 2.5 Mekanisme reaksi antioksidan dengan radikal bebas DPPH
AH +
A• +
Parameter yang dipakai untuk menunjukkan aktivitas antioksidan adalah
harga konsentrasi efisien atau Efficient Concentration (EC50) atau Inhibitory
Concentration (IC50) yaitu konsentrasi suatu zat antioksidan yang dapat
menyebabkan 50% DPPH kehilangan karakter radikal atau konsentrasi suatu zat
antioksidan yang memberikan persen peredaman sebesar 50% (Molyneux, 2004).
2.6.1 Pelarut DPPH
Metode DPPH akan memberikan hasil yang baik dengan menggunakan pelarut
metanol atau etanol karena kedua pelarut ini tidak mempengaruhi dalam reaksi
antarasampel uji antioksidan dengan radikal bebas DPPH (Molyneux, 2004).
2.6.2 Pengukuran panjang gelombang
Panjang gelombang yang digunakan untuk analisis kuantitatif adalah
panjang gelombang yang mempunyai absorbansi maksimal (Gandjar dan Abdul,
2007). Panjang gelombang maksimum (ʎmaks) yang digunakan dalam pengukuran
sampel uji pada metode pemerangkapan radikal bebas DPPH sangat
bervariasi.Menurut beberapa literatur, panjang gelombang maksimum untuk
DPPH antara lain 515-520 nm (Molyneux, 2004)
2.6.3 Waktu pengukuran
Waktu pengukuran atau waktu kerja (operating time) bertujuan untuk
mengetahui waktu yang tepat dalam melakukan pengukuran, yakni saat sampel
telah mencapai kesetimbangan sehingga dalam kondisi stabil. Waktu pengukuran
yang digunakan dalam beberapa penelitian sangatlah bervariasi, yaitu 1-240
menit. Waktu pengukuran yang paling banyak direkomendasikan adalah 60 menit.
Kecepatan reaksi dipengaruhi oleh sifat dari aktivitas antioksidan yang terdapat di
BAB I PENDAHULUAN
1.1 Latar Belakang
Dewasa ini, dunia kesehatan banyak membahas tentang radikal bebas dan
antioksidan. Hal ini terjadi karena sebagian besar penyakit terjadi karena adanya
reaksi oksidasi yang berlebihan di dalam tubuh. Reaksi ini mencetuskan
terbentuknya radikal bebas yang sangat aktif (Winarsi, 2007).Radikal bebas
adalah molekul atau atom yang memiliki satu atau lebih elektron yang tidak
berpasangan pada orbital terluarnya, bersifat sangat reaktif dan tidak stabil
(Muchtadi, 2013). Radikal bebas akan bereaksi dengan molekul disekitarnya
untuk memperoleh pasangan elektron dalam mencapai kestabilan dan dapat
mengubah suatu molekul menjadi radikal. Reaktivitas radikal bebas ini dikenal
sebagai oksidasi (Youngson, 2005).Radikal bebas terbentuk karena proses
oksidasi yang dapat merusak struktur dan fungsi sel serta diyakini sebagai pemicu
berbagai penyakit degeneratif seperti kanker, penyakit kardiovaskular, gangguan
penglihatan, penyakit saluran pernapasan dan lain-lain (Silalahi, 2006).Sumber
radikal bebas, banyak ditemukan dalam kehidupan sehari-hari, beberapa
diantaranya yaitu asap (dari rokok, pabrik dan kendaraan bermotor), air yang
tercemar logam berat, makanan berpengawet serta paparan sinar matahari berlebih
(Kumalaningsih, 2006). Radikal bebas ini tidak dapat dihindari namun dapat
dihambat dengan adanya antioksidan (Youngson, 2005).
Antioksidanmerupakan senyawa yang mampu meredam atau menghambat
aktivitas senyawa oksidan dalam tubuh dengan cara mendonorkan elektronnya.
dari dalam tubuh seperti enzim-enzim peroksidase, katalase dan glutation
seringkali kurang akibat pengaruh lingkungan dan diet yang buruk. Kondisi ini
menjadikan senyawa antioksidan yang diperoleh dari luar tubuh sangat
dibutuhkan (Winarsi, 2007).Sumber antioksidan dari luar tubuh dapat berupa
antioksidan alami maupun antioksidan sintetik. Penggunanan antioksidan sintetik
mulai dibatasi karena dari hasil penelitian dilaporkan bahwa antioksidan sintetik
seperti BHT (butyl hydroxytoluena) ternyata dapat meracuni hewan percobaan dan
bersifat karsinogenik sehingga industri makanan dan obat-obatan mulai
mengembangkan dan mencari sumber-sumber antioksidan alami yang baru
(Takashi dan Takayumi, 1997).Antioksidan alami banyak ditemukan dalam
tumbuh-tumbuhan. Senyawa antioksidan alami pada tumbuhan umumnya adalah
senyawa fenolik atau polifenolik, dapat berupa golongan flavonoid, tokoferol,
kumarin dan asam-asam organik polifenol (Kumalaningsih,2006).
Salah satu tumbuhan yang mengandung antioksidan adalah bunga pisang
klutuk (Musa balbisiana BB) dari suku Musaceae, tumbuhan ini mudah tumbuh
dan mudah diperoleh, akan tetapi belum digunakan secara optimal oleh
masyarakat.Bunga pisang klutuk berwarna merah keunguan, variasi warna pada
bunga pisang klutuk berhubungan dengan keberadaan senyawa flavonoida