PENENTUAN RASIO C/N DAN PENGEMBANGAN PRODUKSI
BIOINSEKTISIDA OLEH
Bacillus thuringiensis
MENGGUNAKAN
MEDIA KULTIVASI LIMBAH INDUSTRI TAHU
AI NELLY
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis yang berjudul “ Penentuan Rasio C/N dan Pengembangan Produksi Bioinsektisida oleh Bacillus thuringiensis Menggunakan Media Kultivasi Limbah Industri Tahu” adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Pebruari 2012
Ai Nelly
ABSTRACT
AI NELLY. Determination of C/N Ratio and development of Bioinsecticide Production by Bacillus thuringiensis Using Tofu waste Cultivation Media. Supervised by MULYORINI RAHAYUNINGSIH and KHASWAR SYAMSU.
Development and application of local product biopesticide, especially based on B. thuringiensis (Bt) still has been considerable potential. This is supported by the local availability of Bt local strains and agro-based raw materials are abundant and not expensive. Research toward utilization of industrial waste of tofu as a medium of cultivation of Bt has been done. In the early stages the Bt strains are isolated and selected. Bt B2 bacteria from the culture collection, protein crystals form bipiramid and cubes, are strains with the highest toxicity against C. binotalis. The optimization of media formulation is performed on a scale of 500 ml with a variation of C/N ratio 3:1, 5:1, 7:1, 9:1 and 11:1. B2 strains provides optimum toxicity value at C/N ratio 7:1 with LC50 value of 0.90 mg/L or 8356 IU/mg. The results of cultivation on the bioreactor 3 L shows substrate utilization efficiency of 67.77 % with LC50 value of 3.56 g/ml or 2112 IU/mg. Characterization of δ-endotoxin with SDS-PAGE indicates protein pattern at all media formulations contain genes Cry 1 (144 kD) and Cry 2 (66.80 kD and 55.51 kD) and Cyt1Aa (25.27). Amino acid δ-endotoxin in 500 ml scale cultivation and 3 L bioreactor show the same composition as many as 15 kinds of amino acids but the quantity of amino acids on the 3 L bioreactor scale smaller than which on 500 ml. Determination of physical factors for the increasing scale on the 40 L bioreactor using a base power per unit volume (Pg/V) still provide power value per unit volume (Pg/V) of 0.037 HP/m3 (weak level of agitation impellers), aeration requirement is 0.7 VVM with agitation speed 111.57 rpm. Cultivation at 40 L bioreactor run at a pH range from 6.5 to 7.0 where the total number of maximum cells is 10.35± 0.03 x 10 8 cfu/ml with a maximum cell growth rate of 0.48 ± 0.01 hours-1, while the number of the highest spore of 3.90±0.06 x 108 cfu/ml with a maximum rate of spore growth is 0.25 ± 0.01 hours-1. Substrate utilization efficiency at 68.21 % with LC50 values is 3.19 g/ml or 2357 IU/mg.
AI NELLY. Penentuan Rasio C/N dan Pengembangan Produksi Bioinsektisida oleh Bacillus thuringiensis Menggunakan Media Kultivasi Limbah Industri Tahu. Dibimbing oleh MULYORINI RAHAYUNINGSIH dan KHASWAR SYAMSU.
Pengembangan dan penggunaan biopestisida produk lokal khususnya berbasis B. thuringiensis (Bt) masih memiliki potensi yang cukup besar. Hal ini didukung oleh ketersediaan galur Bt lokal dan bahan baku berbasis agroindustri yang melimpah dan murah. Penelitian ke arah pemanfaatan limbah industri tahu sebagai media kultivasi Bt telah dilakukan. Pada tahap awal dilakukan isolasi dan seleksi galur Bt. Bakteri Bt B2 dari culture collection memiliki bentuk kristal protein bipiramid, kubus dan bulat. Galur ini menghasilkan daya toksisitas paling tinggi terhadap C. binotalis. Penentuan rasio C/N terbaik dilakukan pada skala 500 mL dengan variasi rasio C/N 3:1, 5:1, 7:1, 9:1 dan 11:1. Galur B2 memberikan nilai toksisitas paling tinggi pada rasio C/N 7:1 dengan nilai LC50
sebesar 0,90 mg/L atau 8356 IU/mg. Hasil kinetika kelima rasio C/N menunjukan rentang pH cairan kultivasi antara 7,13 dan 8,20. Jumlah koloni dan spora tertinggi dicapai oleh rasio C/N 9:1 masing-masing sebesar 10,75 x 108 cfu/ml dan 4,10 ± 0,02 x 108 cfu/ml. Laju pertumbuhan sel maksimum sebesar 0,55 ± 0,01 jam-1 pada rasio C/N 9:1 sedang laju pertumbuhan spora maksimum pada C/N 7:1 sebesar 0,29 ± 0,01 jam-1. Efisiensi pemanfaatan substrat tertinggi sebesar 88,05 ± 0,00 % pada Rasio 9:1.
Hasil kultivasi pada bioreaktor 3 L menunjukkan jumlah total sel maksimum sebesar 11,40 ± 0,05 x 108 cfu/ml dengan laju pertumbuhan sel maksimum sebesar 0,57 ± 0,01 jam-1, sedangkan jumlah spora tertinggi sebesar 3,30 ± 0,05 x 108 cfu/ml dengan laju pertumbuhan spora maksimum adalah 0,17 ± 0,05 jam-1. Efisiensi pemanfaatan substrat sebesar 67,77 ± 0,00 % dengan nilai LC50 sebesar 3,56 g/L atau 2112 IU/mg.
Karakterisasi δ-endotoksin dengan SDS-PAGE mengindikasikan pola protein pada semua rasio C/N mengandung gen cry 1 (144 kD), cry 2 (66,80 kD dan 55,51 kD) dan Cyt1 (25,27 kD). Asam amino δ-endotoksin pada kultivasi skala 250 ml dan bioreaktor 3 L menunjukan komposisi yang sama sebanyak 15 jenis asam amino tetapi kuantitas asam amino pada bioreaktor 3 L lebih kecil dibanding skala 500 ml.
Penentuan faktor-faktor fisik untuk penggandaan skala pada bioreaktor 40 L menggunakan basis tenaga per unit volume (Pg/V) tetap memberikan nilai tenaga per unit volume (Pg/V) sebesar 0,037 HP/m3 (tingkat agitasi impeler lemah). Kebutuhan aerasi sebesar 0,7 vvm dengan kecepatan agitasi 111,57 rpm. Pengembangan produksi bioinsektisida pada bioreaktor 40 L memberikan hasil optimum pada jam ke-36 dengan jumlah sel total 10,35 ± 0,02 x 108 cfu/mL, jumlah spora 3,90 ± 0,03 x 108 cfu/mL dengan efisiensi pemanfaatan substrat sebesar 68,21 ± 0,00 % dan nilai LC50 sebesar 3,19 mg/L atau 2357 IU/mg.
© Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
PRODUKSI BIOINSEKTISIDA OLEH
Bacillus
thuringiensis
MENGGUNAKAN MEDIA KULTIVASI
LIMBAH INDUSTRI TAHU
AI NELLY
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Teknologi Industri Pertanian
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Penentuan Rasio C/N dan Pengembangan Produksi Bioinsektisida oleh Bacillus thuringiensis Menggunakan Media Kultivasi Limbah Industri Tahu
Nama Mahasiswa : Ai Nelly
NRP : F351080151
Disetujui, Komisi Pembimbing
Dr. Ir. Mulyorini Rahayuningsih, M.Si Prof. Dr. Ir. Khaswar Syamsu, M.Sc
Ketua Anggota
Diketahui,
Ketua Program Studi Dekan Sekolah Pascasarjana Teknologi Industri Pertanian
Dr. Ir. Machfud, MS. Dr. Ir. Dahrul Syah, M.Sc. Agr
PRAKATA
Alhamdulillahirrabbil’alamiin. Puji syukur penulis sampaikan ke hadirat Allah SWT yang telah memberikan karunia sehingga penyusunan Tesis dengan judul “Penentuan Rasio C/N dan Pengembangan Produksi Bioinsektisida oleh Bacillus thuringiensis Menggunakan Media Kultivasi Limbah Industri Tahu” telah dapat diselesaikan.
Penyusunan tesis ini merupakan bagian dari salah satu syarat untuk memperoleh gelar Magister Sains pada Program Studi Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Dalam masa penelitian dan penyusunan tesis ini, penulis mendapat dukungan bimbingan berbagai pihak. Penghargaan setinggi-tingginya dan ucapan terima sebanyak-banyaknya penulis sampaikan kepada
1. Dr. Ir. Machfud, MS., selaku Ketua Program Studi
2. Dr. Ir. Mulyorini Rahayuningsih, M.Si., selaku Ketua Komisi Pembimbing 3. Prof. Dr. Ir. Khaswar Syamsu, M.Sc., selaku Anggota Komisi
Pembimbing
4. Dr. Ir. Mohamad Yani, M.Eng selaku Dosen Penguji Luar Komisi
5. Teknisi laboratorium dan staf TIP : Ibu Rini, Ibu Ega, Ibu Sri, Pak Edi, Pak Sugiardi, dan Ibu Nur. Terima kasih bantuannya.
6. Teman-teman lab LDit Indra, Erlin, Sarfat, Bagus, Devi, dan Zora.
7. Teman-teman TIP ’08 Donna, Renny, Mappe, Dessy, Fatma, Deli, Saud, Andrew, Niken, Citra, Siti, Susi dan Angga yang banyak membantu selama penelitian.
8. Suami, Sujarwo Mawardi dan putri tercinta Fisilmi Kaffah serta Addieni Hanifa atas keleluasaan menuntut ilmu, dukungan dan doa.
9. Abbi dan Ummi atas motivasi, kesabaran dan doa, serta Adik-adik yang selalu memberikan kekuatan.
10. Dr. Bambang S. Pujantiyo, Dr. Iwan Sudrajat, M.SEE dan I-tech BPPT all crew atas dukungan dan kesempatan.
11. Departemen Teknologi Industri Pertanian Fakultas Teknologi Pertanian IPB, yang telah memberikan sebagian bantuan dana penelitian.
12. Teman-teman TIP IPB angkatan 2008.
13. Dan semua pihak yang telah membantu penulisan hasil penelitian.
Penulis menyadari bahwa dalam penyusunannya masih banyak terdapat kekurangan sehingga perlu adanya perbaikan pada penelitian sejenis dimasa yang akan datang. Semoga karya kecil ini dapat berperan pada kemajuan khazanah ilmu pengetahuan.
Penulis lahir di Majalengka pada tanggal 28 Agustus 1978, anak pertama dari tiga bersaudara dari pasangan Bapak H.M. Habuddin S. dan Ibu Hj. Anah Rohanah. Pendidikan Sekolah Dasar selesai tahun tahun1989 di SDN I Ligung, dan melanjutkan ke tingkat Sekolah Menengah Pertama di SMPN 1 Ligung hingga lulus tahun 1992. Selepas SMP, penulis menyelesaikan sekolah di SMAN 1 Majalengka pada 1995. Satu tahun kemudian penulis melanjutkan kuliah di Institut Teknologi Bandung mengambil jurusan Kimia Fakultas MIPA dan lulus tahun 2001.
Karir penulis dimulai tahun 2001 dengan bekerja di Badan Pengkajian dan Penerapan Teknologi (BPPT) -Lembaga Pemerintahan non Departemen dibawah Menristek- sebagai staf Balai Inkubator Teknologi Kedeputian Pengkajian dan Kebijakan Teknologi dengan jabatan terakhir sebagai Kepala Seksi Fasilitasi dan Advokasi.
Pada tahun 2008 Penulis melanjutkan pendidikan program master di jurusan Teknologi Industri Pertanian IPB dengan sponsor pembiayaan dari BPPT dan bantuan penelitian yang berasal dari Departemen Teknologi Industri Pertanian Institut Pertanian Bogor melalui program IMHERE.
DAFTAR ISI
Halaman
DAFTAR TABEL ... v
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... ix
1PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Identifikasi Masalah ... 3
1.3 Tujuan Penelitian ... 4
1.4 Ruang Lingkup... 4
1.5 Hipotesis ... 5
2 TINJAUAN PUSTAKA ... 7
2.1 Bacillus thuringiensis ... 7
2.2 Kristal Protein (δ-endotoksin)... 9
2.3 Mekanisme Patogenesis ... 10
2.4 Limbah Industri Tahu ... 11
2.5 Crocidolomia binotalis Zell ... 13
2.6 Kondisi Kultivasi B. Thuringiensis ... 15
2.7 Penentuan Aktivitas Insektisida Mikroba ... 16
2.8 Penggandaan Skala... 17
3 METODE PENELITIAN ... 21
3.1 Kerangka Pemikiran ... 21
3.2 Tempat dan Waktu Penelitian ... 23
3.3 Alat dan Bahan ... 23
3.4 Metode Penelitian ... 23
3.4.1 Analisis komposisi media dan isolasi bakteri ... 23
3.4.1.1 Analisis bahan baku ... 23
3.4.1.2 Isolasi B. thuringiensis... 24
3.4.2 Penentuan rasio C/N terbaik ... 25
3.4.4 Karakterisasi dan uji daya toksisitas bioinsektisida ... 29
4 HASIL DAN PEMBAHASAN ... 31
4.1 Analisis Komposisi Media Kultivasi ... 31
4.2 Seleksi B. thuringiensis ... 33
4.3 Pengaruh Media Kultivasi ... 36
4.3.1 Jumlah sel hidup... 36
4.3.2 Jumlah spora ... 38
4.3.3 Uji toksisitas bioinsektisida ... 39
4.4 Penentuan Rasio C/N Terbaik ... 41
4.4.1 Pengaruh rasio C/N pada pH cairan kultivasi ... 41
4.4.2 Pertumbuhan Bacillus thuringiensis ... 42
4.4.3 Total gula sisa ... 46
4.4.4 Pembentukan spora selama kultivasi... 48
4.4.5 Kinetika kultivasi ... 49
4.4.6 Penentuan aktivitas bioinsektisida ... 51
4.5 Kultivasi Btk pada bioreaktor 3 L ... 52
4.6 Karakterisasi bioinsektisida ... 55
4.6.1 Profil protein kristal ... 55
4.6.2 Komposisi asam amino ... 58
4.7 Pengandaan skala (Scale-up) ... 60
4.7.1 pH cairan media kultivasi pada bioreaktor 40 L ... ... 61
4.7.2 Pertumbuhan sel B. Thuringiensis pada bioreaktor 40 L ... .. 63
4.7.3 Pembentukan spora dan uji daya toksisitas ... ... 63
4.7.4 Kinetika kultivasi pada bioreaktor 40 L ... .. 64
5 KESIMPULAN DAN SARAN ... 67
5.1 Kesimpulan ... 67
5.2 Saran ... 68
DAFTAR PUSTAKA ... 69
DAFTAR TABEL
Halaman
1 Subspesies Bt yang digunakan sebagai insektisida ... 9
2 Komposisi kimia ampas tahu ... 11
3 Komposisi komponen limbah cair tahu... 13
4 Jenis dan potensi standar bioassay B. thuringiensis... 17
5 Komposisi rasio C/N pada media kultivasi ... 26
6 Hasil analisis komposisi media kultivasi ... 31
7 Hasil analisis kadar karbon dan nitrogen pada media kultivasi ... 32
8 Kandungan mikro elemen pada ampas tahu dan limbah cair tahu ... 33
9 Komposisi bahan penyusun nutrient broth ... 37
10 Pengaruh jenis galur bakteri dan jenis media terhadap daya toksisitas ... 40
11 Pengaruh komposisi media pada kinetika kultivasi... 49
12 Pengaruh komposisi media pada daya toksisitasnya terhadap ulat terhadap kubis... 51
13 Daya toksisitas Bt pada ulat kubis dalam berbagai media fermentasi ... 52
14 Uji daya toksisitas Bt B2 terhadap ulat kubis pada kultivasi 3 L ... 54
15 Kinetika kultivasi Bt pada bioreaktor 3 L ... 55
16 Analisis asam amino kristal protein ... 59
17 Kultivasi Bt pada bioreaktor skala 3 L ... 61
18 Uji daya toksisitas Bt B2 terhadap ulat kubis pada kultivasi 40L ... 64
19 Kinetika kultivasi B. thuringinesis pada bioreaktor 40L ... 65
Halaman 1 Mikrogram transmisi elektron dari isolat B. thuringiensis dengan
spora dan kristal protein ... 8
2 Profil kristal protein murni dari isolat HD1 B. thuringiensis subsp. kurstaki dan badan paraspora B.thuringiensis subsp. israelensis... . 10
3 Diagram alir proses pembuatan tahu ... 12
4 Limbah cair tahu dan ampas tahu ... 13
5 Kumpulan telur ulat krop kubis ... 14
6 Diagram alir tahapan penelitian ... 22
7 Kultur Bt hasil seleksi dari culture collection dan ulat sutera ... 33
8 Sel vegetatif B. thuringiensis dengan perbesaran 400x ... 34
9 Hasil pengamatan spora pada masing-masing kolonoi dibawah mikroskop dengan perbesaran 1000x ... 35
10 B. thuringiensis masing-masing diamati di bawah SEM (5000x)... 36
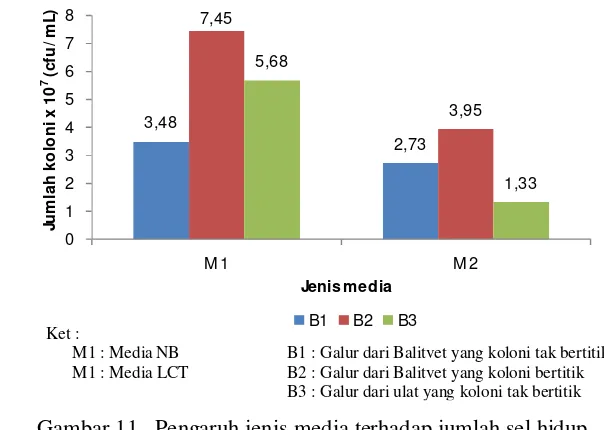
11 Pengaruh jenis media terhadap jumlah sel hidup ... 38
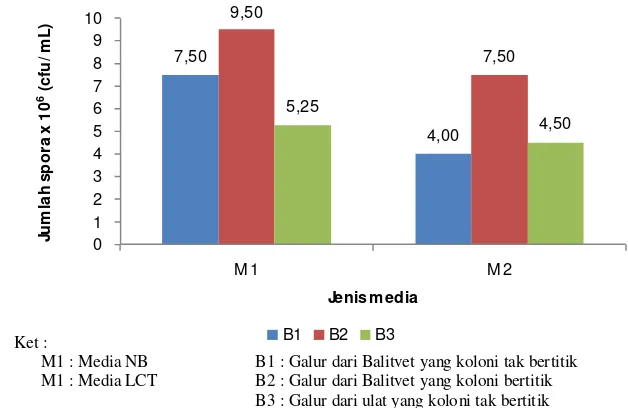
12 Pengaruh jenis media dan jenis isolat B. thuringinesis terhadap Jumlah spora... ... 39
13 Pengaruh rasio C/N terhadap pH cairan kultivasi ... 41
14 Pertumbuhan sel hidup B. thuringiensis ... 43
15 Pengaruh koposisi media pada bobot biomassa kering ... 45
16 Hubungan total sel kultur B. thuringiensis pada masing-masing komposisi media ... 47
17 Pertumbuhan spora bt selama kultivasi ... 48
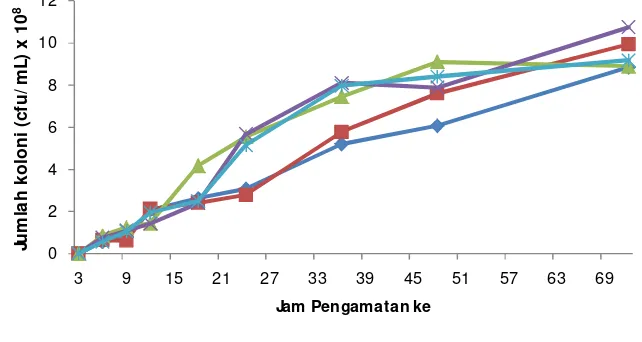
18 Parameter kinetika kultivasi pada pada bioreaktor 3 L ... 53
19 Profil pita protein δ-endotoksin... ... 57
21 Kultivasi Bt pada bioreaktor 40 L ... 61
22 Parameter kinetika kultivasi pada bioreaktor 3 L ... 62
23 Profil bioreaktor 40 L ... 65
24 Kurva standar glukosa ... 80
25 Hubungan bilangan tenaga terhadap bilangan Reynold ... 109
Halaman 1 Analisis Bahan Baku Media Kultivasi ... 77
2 Metode Analisis Sebelum dan Setelah Kultivasi ... 82
3 Perhitungan Susunan Media Kultivasi ... 85
4 Rekapitulasi Data, Hasil Analisa Uji Anova dan Uji Lanjut Seleksi
Bakteri ... 86
5 Rekapitulasi Data , Hasil Analisa Data, Uji Anova dan Uji Lanjut
Penentuan C/N Rasio ... 91
6 Rekapitulasi Data Kultivasi pada Bioreaktor 3 L ... 105
7 Penentuan Reologi Cairan kultivasi ... 107
8 Perhitungan Laju Aerasi dan Kecepatan Agitasi untuk
Penggandaan Skala Bioreaktor 40 L... 108
I P E N D A H U L U A N
1.1 Latar Belakang
Pengendalian hama secara biologis senantiasa dikaitkan dengan keberhasilan bakteri Bacillus thuringiensis sebagai bioinsektisida. Bakteri ini adalah bakteri gram positif, berbentuk batang, dan memiliki kemampuan menghasilkan kristal protein (endotoksin) selama masa sporulasinya. Sebagai pengendali hayati, spora dan kristal protein ini dapat bersifat racun pada sistem pencernaan serangga (Hofte dan Whiteley 1989; Dulmage 1993).
Di alam, B. thuringiensis memiliki habitat berbeda-beda seperti tanah, serangga mati, dan lingkungan akuatik. Hidupnya bersifat saprofit, yaitu dengan memanfaatkan bahan sisa-sisa organik, dan juga bersifat parasit karena dapat hidup serta menyebabkan kematian pada serangga tertentu (Glazer & Nikaido, 1994).
Kondisi geografis yang berbeda menunjukkan perbedaan genetik dan daya toksisitas B. thuringiensis. Masing-masing habitat memungkinkan terkandung isolat-isolat yang baru dengan potensi daya toksisitas yang lebih efektif. Oleh karena itu banyak penelitian dilakukan untuk mendapatkan galur B. thuringiensis dari lingkungan yang berbeda-beda dengan potensi daya toksisitas tinggi dan serangga sasaran yang lebih luas (Apaydin 2004).
secara lokal. Negara-negara di kawasan Asia seperti India dan Thailand juga telah menjadi produsen besar produk B. thuringiensis. Pengembangan dan penggunaan biopestisida mikroba di Asia memiliki potensi besar. Sejumlah hambatan penting dalam pengembangan industri bioinsektisida di negara-negara tersebut adalah kemampuan untuk membeli, ketersediaan bahan kimia murah, kebijakan pemerintah untuk dukungan produksi lokal seringkali sulit dalam jangka panjang. Meskipun perkembangan pasar biopestisida akan sulit dan mungkin lambat, potensinya tetap tinggi dan kesempatan yang ada dapat meningkatkan pasar total $225.000.000 pada tahun 2015.
Ketersedian sumberdaya untuk pengembangan industri bioinsektisida lokal sangat melimpah. Rusmana et al. (1994) telah mengisolasi 2813 isolat Bacillus dari daerah Sulawesi Selatan, Jawa Tengah dan Jawa Timur. Dari jumlah tersebut, 32 isolat diantaranya menghasilkan protein kristal. Berbagai jenis media pertumbuhan seperti molases (Cahyati 1998), air kelapa (Yulianti 2001; Syamsu et al. 2003) dan onggok (Wicaksono 2002) telah diteliti kemampuannya sebagai
media pertumbuhan. Limbah industri tahu dapat menjadi alternatif untuk media kultivasi B. thuringiensis. Selain harganya yang murah, menurut Jenie (1994) kandungan nutrisinya seperti protein (19,69%) dan karbohidrat (58,21%) termasuk diantaranya fermentable sugar (38,74%) dapat dikonversi menjadi biomassa dan produk oleh B. thuringiensis. Menurut Shurtleff dan Aoyagi (1979), dalam produksi tahu banyak industri menggunakan batu tahu (CaSO4) sebagai
bahan untuk mengendapkan protein pada susu kedelai sehingga menjadi tahu. Kalsium yang terbuang bersama limbah cair tahu dapat membantu dalam pertumbuhan spora B. thuringiensis. Menurut Dulmage & Rhodes (1971), Ca selain berperan dalam pertumbuhan dan produksi endotoksin juga berfungsi untuk menjaga kestabilan spora terhadap panas.
patokan penggandaan skala kriteria dasar tenaga per unit volume dan koefisien transfer oksigen konstan merupakan prosedur umum yang sering dipakai (Banks 1979). Kriteria ini menggunakan asumsi bahwa kecepatan agitasi yang optimum dalam pembentukan produk akhir diperoleh dari percobaan skala kecil dan data ini digunakan untuk mendapatkan kecepatan agitasi pada skala besar yang membutuhkan tenaga per unit volume (Pg/V) yang sama (Wiseman 1977).
1.2 Identifikasi Masalah
Keberhasilan produksi bioinsektisida selain dipengaruhi oleh galur bakterinya, juga dipengaruhi oleh medium dan kondisi fermentasi yang digunakan (Dulmage dan Rhodes 1971). Berbagai limbah indutri pertanian seperti ampas tahu dan limbah cair tahu dapat dipakai sebagai media untuk pertumbuhan B. thuringiensis. Menurut Jenie (1994), ditinjau dari komposisi kimianya ampas tahu
dapat digunakan sebagai sumber karbon dimana limbah tahu ini mengandung pati 38,74% dan protein 19,69% (berat kering). Ampas tahu juga mengandung unsur-unsur mineral makro dan mikro seperti Ca, Fe, Mn, Mg, Cu, Co,dan Zn (Sumardi dan Patuan 1983). Kalsium, Fe, Mn dan Cu merupakan komponen yang sangat penting dalam produksi protein kristal. Kultivasi B. thuringiensis pada media yang mengandung garam kalsium menghasilkan peningkatan produksi protein kristal (Foda et al. 1985; Sikdar et al. 1991).
Dalam pertumbuhannya, B. thuringiensis membutuhkan formulasi rasio karbon dan nitrogen yang sesuai sebagai unsur utama dalam media kultivasi. Unsur-unsur tersebut digunakan untuk memperoleh energi, pembentukan sel dan membantu proses sporulasi (Vandekar dan Dulmage 1982). Menurut Scherrer et al. (1972), konsentrasi glukosa pada media kultivasi berpengaruh secara langsung
pada ukuran kristal protein dan kandungan endotoksin. Dengan demikian untuk media dan kultur yang berbeda, kebutuhan rasio C/N dalam produksi endotoksin juga akan berbeda. Sehingga dalam penelitian ini diperlukan pemilihan komposisi rasio C/N terbaik agar diperoleh kristal protein dengan daya toksisitas paling tinggi.
diperlukan penentuan kecepatan aerasi dan agitasi sesuai kapasitas bioreaktor yang akan dipakai. Analisa produk akhir juga perlu dilakukan untuk mengetahui konsistensi produk setelah dilakukan penggandaan skala, meliputi analisa asam amino dan profil protein endotoksin.
1.3 Tujuan Penelitian
Berdasarkan perumusan masalah di atas, tujuan dari penelitian ini adalah: 1. Memperoleh galur B. thuringiensis yang bersifat insektisidal pada ulat
Crocidolomia binotalis (ulat kubis).
2. Memperoleh rasio C/N terbaik dalam kultivasi B. thuringiensis, yaitu formulasi media yang menghasilkan kristal protein dengan toksisitas paling tinggi.
3. Mengetahui pengaruh pengandaan skala dari erlenmeyer ke bioreaktor 3 L terhadap parameter kinetika kultivasi, toksisitas dan pola pita protein. 4. Mengetahui pengaruh penggandaan skala menggunakan kriteria Pg/V dari
3 L ke 40 L terhadap parameter kinetika kultivasi dan toksisitas
1.4 Ruang Lingkup
Ruang lingkup penelitian mencakup :
1. Karakterisasi media kultivasi dari limbah industri tahu meliputi kadar C, kadar N, kadar air, abu, protein, lemak, serat, kandungan kalsium dan trace element.
2. Seleksi B. thuringiensis yang menghasilkan daya toksisitas paling tinggi dengan sumber mikroba berasal dari culture collection dan ulat sutra. 3. Penentuan C/N rasio terbaik pada skala laboratorium (500 ml)
menggunakan B. thuringiensis yang terpilih dan kondisi kultivasi yang sesuai untuk pertumbuhannya.
4. Penerapan kondisi terbaik pada bioreaktor 3 L dan menentukan faktor-faktor lingkungan fisik untuk penggandaan skala pada reaktor 40 L. 5. Karakterisasi bioinsektisida yang dihasilkan meliputi pola protein dan
kandungan asam amino.
1.5 Hipotesis
Hipotesis dari penelitian ini adalah:
1. Daya toksisitas kristal protein dipengaruhi oleh galur dan subspesies B. thuringiensis.
2. Kombinasi rasio C/N berpengaruh terhadap pola pita protein dan daya toksisitas kristal protein yang dihasilkan.
3. Penggandaan skala produksi bioinsektisida dari skala erlenmeyer ke skala bioreaktor akan memberikan hasil yang sama dalam hal karakteristik bioinsektisida yang dihasilkan.
2.1 Bacillus thuringiensis
B. thuringiensis (Bt) adalah bakteri gram positif berbentuk batang, aerobik
dan membentuk spora. Bakteri ini merupakan bakteri yang ada di tanah, air, permukaan tumbuhan, serangga mati dan biji-bijian (Kawalek et al. 1995). Menurut Ellis (2004) bakteri ini diisolasi pertama kali pada tahun 1902 dari larva ulat sutra. Berbagai galur Bt telah digunakan secara komersial di Amerika Serikat sejak tahun 1958 sebagai insektisida pada hasil hutan dan lahan pertanian. Banyak galur dari bakteri ini menghasilkan protein yang beracun bagi serangga. Penggunaan Bt sebagai insektisida dianggap menguntungkan karena lebih efektif, efisien dan lebih aman bagi lingkungan.
Menurut Krieg and Langenbroich (1981) Bt dapat tumbuh dalam media yang mengandung karbon, nitrogen dan trace element, juga dapat hidup dalam jaringan serangga yang terinfeksi. Dalam tanah, Bt hanya terdapat dalam bentuk spora (Akiba 1986). Galur dari Bt telah banyak ditemukan di berbagai tempat di dunia. Sebagai contoh di Jepang (ulat sutra); Jerman (tepung moths), Perancis (original B. thuringiensis, Israel (B. thuringiensis israelensis), Kenya (B. thuringiensis kenyae); Amerika Serikat (B. thuringiensis HD-1) dan Kanada (B.
thuringiensis canadensis). Ini mengindikasikan bahwa bakteri ini mudah
beradaptasi diberbagai tempat.
Pada kondisi media pertumbuhan bakteri tidak lagi optimal, Bt akan membentuk spora. Spora adalah fase dorman (tidur) pada rantai kehidupan bakteri. Saat membentuk spora Bt juga membentuk protein kristal yang merupakan komponen toksik bagi serangga. Sel vegetatif Bt lebarnya mendekati 1
µm dan panjang 5 µm. Selama masa sporulasi bakteri ini dapat menghasilkan
Gambar 1 Microgram transmisi elektron dari isolat B. thuringiensis dengan spora dan kristal protein (Maheswaran et al. (2010)).
B. thuringiensis dapat tumbuh dalam medium yang sederhana. Sumber karbon, asam amino dan garam mineral dibutuhkan untuk pertumbuhan sel dan pembentukan kristal protein. Faktor lain yang sangat berpengaruh antara lain pH, kelarutan oksigen dan temperatur (Vandekar dan Dulmage 1982).
B. thuringiensis mengkatabolisme glukosa selama pertumbuhan vegetatif
melalui jalur Embden-Meyerhof-Parnas (EMP) dan jalur pentosa-posfat (PP) (Nickerson et
al.
1974; Bulla et al. 1969 di dalam Rivera 1998). Jalur EMPmerupakan tahapan primer dalam degradasi glukosa menjadi piruvat dan asetat. Akumulasi asam organik tersebut menyebabkan turunnya pH media selama pertumbuhan vegetatif. Selanjutnya selama transisi dari fase pertumbuhan ke fase sporulasi, enzim-enzim siklus tricarboxylic acid (TCA) disintesis. Selain itu,
asam piruvat dan asetat yang terakumulasi selama fase pertumbuhan teroksidasi dalam tahap awal sporulasi. Bt menggunakan siklus TCA untuk mengkatabolisme
glutamat dan α-ketoglutarat melalui jalur asam ϒ-aminobutirat (GABA). Jalur GABA mentransformasi glutamat menjadi suksinat yang dibantu oleh enzim glutamat dehidrogenase, aminobutirat aminotransferase, dan suksinat semialdehid dehidrogenase. Suksinat ditransformasi oleh dua enzim dari siklus TCA, fumarat hidratase dan malat dehidrogenase.
Bt menggunakan siklus TCA dengan bantuan dua enzim, isositrat liase dan malat sintase, dimana transformasi isositrat menjadi malat melalui jalur asam glyoxylic.
Polimer asam β-hidroksibutirat adalah komponen utama granul lemak bakteri. Keberadaan polimer ini dibentuk dengan adanya glukosa. Polimer ini dibentuk selama tahap pertumbuhan dan mencapai jumlah maksimum pada saat sel-sel memasuki fase stasioner, dan menurun dengan pembentukan spora. Ada indikasi bahwa polimer ini dimanfaatkan oleh sel selama pembentukan spora.
2.2 Kristal Protein (δ-endotoksin)
Kriteria yang membedakan Bt dengan spesies Bacillus yang lain adalah adanya kristal protein yang dapat dilihat dengan mudah di bawah mikroskop elektron. Sinonim dari kristal protein adalah badan paraspora, inklusi paraspora
dan δ-endotoksin. Menurut Tokcaer (2003), bentuk struktur protein kristalnya menyebabkan kristal ini dsebut sebagai protein kristal (Cry) atau δ-endotoksin. Gen yang mengkode kristal ini adalah cry gen, dimana gen ini diekspresikan selama fase stasionernya. Protein kristal terakumulasi di dalam sel induk dan dilepaskan setelah masa sporulasi selesai. Selain cry gen, protein sitolitik yaitu sitolsin (cyt) juga ditemukan pada galur ini. Kebanyakan galur B. thuringiensis memproduksi lebih dari satu protein kristal dan mempunyai sifat toksisitas dalam kombinasinya. Tabel 1 menunjukkan empat subspesies utama dan jenis serangga target (Federici et al. 2010).
Delta-endotoksin merupakan senyawa yang mengandung unit-unit glikoprotein yang berbentuk batang atau halter. Kristal protein tidak mengandung asam nukleat, tidak larut di dalam air tetapi dapat larut dalam larutan alkalin. (Bulla et al. 1979 di dalam Rivera 1998). Untuk mengetahui berat molekul dan komposisi asam aminonya, kristal protein dapat diuraikan melalui elektroforesis gel poliakrilamid.
Tabel 1 Subspesies Bt yang digunakan sebagai insektisida
Subspesies Subunit protein Insektisidal pada
kurstaki Cry1Aa (133), Cry1Ab (131), Cry1Ac (133), Cry2Aa (72) Lepidoptera aizawai Cry1Aa (133), Cry1Ab (131), Cry1Ca (135), Cry1Da (133) Lepidoptera
morrisoni Cry3Aa , Cry3Bb (73) Coleoptera
Morfologi, ukuran dan jumlah kristal protein sangat bervariasi dalam setiap galur Bt. Ada empat jenis morfologi kristal protein yang berbeda : kristal bipiramid berhubungan dengan protein Cry1; kristal kubus berhubungan dengan protein Cry2 ; bentuk kristal protein yang amorfus berhubungan dengan protein Cry4 dan Cyt; kristal segiempat merupakan tipe protein Cry3 sedangkan bentuk bar berhubungan dengan protein Cry4D (Lopez-Meza dan Ibarra 1996; Schnepf 1998 di dalam Apaydin 2004). Ada hubungan nyata antara bentuk kristal dengan kisaran daya bunuhnya. Misal pada Bt HD1 (Gambar 2) menunjukan dua bentuk kristal, dalam kristal bipiramid terdapat protein Cry1Aa, Cry1Ab, dan Cry1Ac, sedangkan Cry2Aa terdapat pada kristal protein berbentuk kubus. Galur ini memiliki daya bunuh terhadap serangga ordo Lepidoptera. B. thuringiensis subsp. israelensi memiliki kristal protein berbentuk bulat bersifat toksik pada golongan
Diptera. Kristal protein dari subspesies ini mengandung empat protein utama, Cry4Aa, Cry4Ba, Cry11Aa dan Cyt1Aa (Frederici et al. 2010).
(a) (b)
Gambar 2 Profil kristal protein murni dari isolat HD1 B. thuringiensis subsp. Kurstaki (a) dan badan paraspora B.thuringiensis subsp. israelensis (b) (Frederici et al. (2010))
2.3 Mekanisme Patogenesis
menempel pada protein receptor yang berada pada langit-langit sel epitel usus serangga. Masuknya toksin kedalam membran sel usus terjadi dalam dua tahap ikatan, yaitu ikatan yang bersifat reversible dan irreversibel. Ikatan reversible sangat penting pada aktivitas racun selanjutnya, karena hilangnya ikatan akan menurunkan toksisitas racun, sebaliknya jika afinitas meningkat maka daya toksisitas racun pun meningkat (Schnepf et al. 1998 di dalam Apaydin 2004).
Setelah insersi ke dalam membran dan terbentuk pori terjadi influk air yang mengandung ion yang menyebabkan sel menjadi swelling dan akhirnya menjadi lisis (Knowles and Ellar 1987). Pada akhirnya serangga akan mengalami gangguan pencernaan dengan berhentinya makan yang menyebabkan kematian larva.
Tiga faktor yang mempengaruhi potensi delta-endotoksin adalah (Jaquet et al. 1987):
Galur B. thuringiensis yang digunakan (berhubungan dengan asal toksin). Derajat kelarutan toksin dalam usus serangga sasaran, dan
Faktor intrinsik dari serangga sasaran yang berpengaruh terhadap toksin
2.4 Limbah Industri Tahu
Proses pengolahan tahu memberikan hasil samping ampas tahu dan limbah cair tahu. Prinsip pembuatan tahu pada dasarnya adalah mengekstrak protein dan mengendapkan protein tersebut menjadi tahu. Tahapan pembuatan tahu meliputi pembuatan susu kedelai dan penggumpalan protein susu kedelai menjadi tahu. Adapun diagram alir proses pembuatan tahu dapat dilihat pada Gambar 3. Menurut Jenie et al. (1994), ampas tahu masih mengandung nitrogen total dan pati yang masih cukup untuk pertumbuhan mikroba (Tabel 2).
Tabel 2 Komposisi kimia ampas tahu
Komponen % (berat kering) Komponen Berat (mg/g)
Keberadaan mineral dalam bahan alam seperti ampas tahu juga sangat penting untuk organisme. Ion logam yang sangat diperlukan dalam pertumbuhan dan sporulasi Bt adalah Mg2+, Mn2+, Fe2+, Zn2+, dan Ca2+ (Dulmage 1990).
Gambar 3 Diagram alir proses pembuatan tahu (Nuraida 1985).
Pada proses pembuatan tahu, industri menggunakan bahan penggumpal protein seperti batu tahu (CaSO4) dan asam cuka (CH3COOH). Menurut Shinta
(2010), zat penggumpal batu tahu menghasilkan pH dan kadar air yang lebih tinggi serta aroma dan tekstur tahu yang lebih baik daripada jenis zat penggumpal asam cuka. Sedangkan analisis yang dilakukan Ferdian (2006) terhadap limbah yang dihasilkan juga menunjukan limbah cair tahu dengan penggumpal batu tahu mengandung unsur hara yang lebih tinggi pula (Tabel 3). Kandungan Ca yang cukup tinggi dapat dimanfaatkan untuk pertumbuhan spora B. thuringiensis.
Perendaman Air bersih
Air matang
Penggilingan
Air bersih 1:9 Pemasakan T= 100 o
C (t = 7-14 menit)
Penggilingan
Penggumpalan
Pencetakan
Pemotongan
Lar. CaSO4 2-4% Limbah cair tahu
Air kotor
Penyaringan Ampas tahu Kedelai
Tahu
Menurut Yanus (1998), adanya mineral pada limbah cair tahu akibat penambahan batu tahu pada pembuatan tahu dapat berperan pada sintesis protease pada mikroba.
Tabel 3 Komposisi komponen limbah cair tahu
Mineral Limbah cair tahu dengan penggumpalan (mg/L)
Batu tahu (CaSO4) Asam Cuka (CH3COOH)
N-total 434,780 226,090
Glukosa 92,000 37,000
Ca 34,030 0,036
Fe 0,197 0,107
Cu 0,118 0,067
Na 0,591 0,573
Ferdian (2006)
Dengan demikian, kandungan nutrisi dalam ampas tahu dan limbah cair tahu memiliki potensi yang besar apabila dimanfaatkan sebagai media kultivasi B. thuringiensis.
(a) (b)
Gambar 4 Limbah cair tahu (a) dan ampas tahu (b).
2.5 Crocidolomia binotalis Zell.
Dalam fase telur biasanya telur berwarna hijau terang dan terletak di bagian bawah daun kubis. Sebelum menetas, warna telur berubah menjadi jingga, kuning kecoklatan dan coklat tua (Gambar 5). Telur terletak saling menumpuk 9-140 telur dengan rata-rata 48 telur. Ukuran kelompok telur dari 1 x 2 mm hingga 3,5 x 6 mm dengan rata-rata 2,6 x 4,3 mm. Masa inkubasi telur sekitar 4 hari (kisaran 3-6 hari) pada 26,0-33,2 °C, presentasi menetas 92,4 % (kisaran 69,2-100 %). Larva yang baru menetas berukuran panjang 2-3 mm, berbulu dan terlihat basah dengan kepala berwarna hitam dan badan berwarna hijau yang bertitik gelap. Larva dicirikan dengan strip garis-garis berwarna putih membujur tiga dibagian kepala dan masing-masing satu di bagian sisi samping. Pertumbuhan maksimum larva sampai mencapai panjang 15-21 mm dan terdapat 5 instar larva. Periode pertumbuhan suksesi masing-masing instar berturut-turut 2,6 hari (kisaran 2-4 hari), 2,4 hari (kisaran 1-3 hari), 2 hari (kisaran 1-3 hari), 2,3 hari (kisaran 1-5 hari) dan 4,7 hari (kisaran 3-7 hari). Total periode waktu yang dibutuhkan hingga 14 hari (kisaran 11-17 hari) pada 26,0-33,2 °C and 54,1-87,8 % RH (Othman 1982 di dalam Sastrosiswojo et al. 2003).
Larva yang lebih dewasa berwarna hijau muda, berbulu dan memiliki garis-garis hijau pucat atau muda sepanjang punggungnya. Larva ini menutupi permukaan tanaman dengan anyaman sutera tebal dan makan di bawah daun. Larva yang telah tumbuh sempurna (panjang 20 mm) menggali tanah dan membentuk kepompong cokelat mengkilap. Ngengat dewasa muncul sekitar dua minggu kemudian.
Gambar 5 Kumpulan telur ulat krop kubis: berumur satu hari berwarna Kuning (a), lebih dewasa saat bentuk seperti irisan jeruk terlihat (b); dan telur berwarna coklat tua siap untuk menetas (c)
(www.indopetani.com)
seringkali kerusakannya total. Kecenderungan ini terjadi pada saat larva masuk dalam fase instar tiga. Jika ulat menyerang pohon kubis selama pembentukan kepala, ulat masuk ke dalam kepala dan membuat terowongan yang menyebabkan kebusukan. Secara umum, studi mengindikasikan bahwa dalam 90 hari periode pertumbuhan kubis, populasi larva cenderung meningkat mulai minggu ke-2 setelah penanaman dan mencapai puncaknya pada minggu ke 6-8 sesudah itu dan menurun pada saat mendekati masa panen.
2.6 Kondisi Kultivasi B. thuringiensis
Menurut Dulmage (1990), proses fermentasi B. thuringiensis dapat dilakukan dengan dua cara yaitu fermentasi terendam (submerged/deep-tank fermentation) dan fermentasi semi padat (semi solid fermentation). Pada
fermentasi terendam, biakan murni B. thuringiensis ditumbuhkan dalam medium cair dengan fermentasi yang merata (Dulmage dan Rhodes 1971). Fermentasi terhadap B. thuringiensis dapat dilakukan di dalam labu kocok pada suhu 28-30OC dengan pH awal medium berkisar antara 6,8 dan 7,2. Sedangkan agitasi yang digunakan berkisar antara 142 dan 340 rpm. Labu yang digunakan berukuran 300 ml yang diisi 50-100 ml medium fermentasi atau dengan menggunakan labu erlenmeyer ukuran 500 ml yang diisi 100-125 ml medium (Vandekar dan Dulmage 1982; Mummigatti dan Raghunathan 1990).
Untuk kultivasi yang dilakukan dalam bioreaktor 1,5-3 liter, maka kondisi kondisi kultivasi dilakukan pada suhu 28-32 oC, pH 6,8 – 7,2, agitasi 200 rpm, aerasi 1 v/v/m dan dipanen setelah sporulasi penuh ± 40-72 jam (Dulmage et al. 1990 ; Yulianti 2001 ; Syamsu et al. 2003; Aprifianto 2006). Dalam bioreaktor lebih besar dari 14 liter, dilakukan pada suhu 28-32 oC, pH 6,8 – 7,2, agitasi 400-700 rpm, aerasi 0,5-1,5 v/v/m dan dipanen setelah sporulasi penuh ± 40-72 jam (Vandekar dan Dulmage 1982 ; Sikdar et al. 1993)
daya toksisitas yang tinggi pula (Dulmage et al. 1990). Sebelumnya, diyakini bahwa tingginya jumlah spora selalu berbanding lurus dengan besarnya daya toksisitas, namun tidak selalu demikian.
Dalam kultivasi B. thuringiensis, karbon mempunyai peran yang sangat penting. Dalam konsentrasi yang tinggi, karbohidrat menyebabkan efek yang berlawanan karena B. thuringiensis menghasilkan asam dan dapat menurunkan pH di bawah 5,5 – 5,7 dimana kebanyakan galur B. thuringiensis tidak dapat tumbuh sehingga fermentasi terhenti (Dulmage et al. 1990). Untuk menjaga kondisi ini diperlukan keseimbangan perbandingan karbon – nitrogen dan pH dikontrol dengan cara menambahkan basa selama proses. Farrera et al. (1998) menjelaskan bahwa keseimbangan rasio C/N secara langsung berpengaruh pada produksi kristal protein. Hasil investigasinya menunjukan bahwa pada kisaran perbandingan C/N dari 3:1 sampai 11:1 untuk fermentasi B. thuringiensis kurstaki HD-73, walaupun jumlah spora tertinggi diperoleh pada perbandingan rasio 4:1 tetapi konsentrasi protein kristal tertinggi diperoleh pada rasio C/N 7:1.
Pengaruh glukosa pada fermentasi tidak selalu demikian, penelitian yang dilakukan Scherrer et al. (1973) memperlihatkan bahwa ketika konsentrasi glukosa medium dinaikan, ukuran dan potensi protein kristal juga meningkat. Komponen lain yang sangat penting dalam produksi protein kristal adalah kalsium. Kultivasi B. thuringiensis pada media yang mengandung garam kalsium dan dihasilkan peningkatan produksi protein kristal. Namun ketika garam kalsium digantikan oleh garam natrium, efek yang sama tidak terlihat. Foda et al. (1985) melaporkan, komponen lain yang penting adalah trace element. Sikdar et al. (1993) menemukan bahwa Fe, Mn, dan Cu dibutuhkan untuk memproduksi protein kristal.
2.7 Penentuan Aktivitas Insektisida Mikroba
jumlah yang kecil dan tingkat kemurnian dari kultivasi satu ke kultivasi lainnya juga berbeda.
Cara standar untuk mengevaluasi daya toksisitas bioinsektisida yang dihasilkan adalah melalui biological assay atau bioassay. Bioassay insektisida mikrobial didesain untuk menentukan berapa banyak bahan yang diperlukan untuk menyebabkan kematian populasi serangga sasaran. Secara statistik, pengukuran kematian populasi serangga adalah konsentrasi toksin yang dapat membunuh 50 % populasi serangga sasaran atau LC50. Konsentrasi ini ditentukan
melalui mengekspos sejumlah larva dengan konsentrasi yang berbeda dari sampel pada makanan serangga target, menginkubasinya pada standar waktu tertentu, kemudian merekam persen kematian pada masing-masing konsentrasi. Nilai LC50
ditentukan menggunakan analisis regresi dari masing-masing sampel menggunakan program probit count.
Nilai LC50 untuk sampel yang telah ditentukan akan bervariasi dari hari ke
hari. Variasi ini diminimalisir oleh analisa formula standar sepanjang pengujian sampel melalui bioassay menggunakan populasi serangga yang sama, kemudian dihitung rasio potensi sampel terhadap potensi standar dengan cara membandingkan LC50 standard dengan LC50 sampel yang diuji (Dulmage et al.
1981). Standar yang digunakan dapat dilihat pada Tabel 4 dinyatakan dalam Satuan Internasional (SI). Standar HD-1 digunakan dalam pengujian serangga golongan lepidoptera dan standar IPS digunakan untuk pengujian bioassay pada nyamuk dan lalat.
Tabel 4 Jenis dan potensi standar bioassay B. thuringiensis
Nama Standar Lembaga Potensi
HD-1-S-1981 USDA 16.000 IU/mg*
IPS-82 WHO 15.000 ITU/mg**
2.8 Penggandaan Skala
pH, suhu dan waktu kultivasi yang memberikan hasil yang optimal. (2) Skala pilot plan, merupakan tahapan penerapan kondisi optimum kontrol proses yang tepat.
(3) Skala industri, yaitu pelaksanaan proses-proses dengan melibatkan studi kelayakan untuk produksi komersial.
Penggandaan skala merupakan hal yang menyangkut masalah desain proses operasi dan atau desain bangunan peralatan skala besar berdasarkan data optimal percobaan skala kecil. Menurut Wang et al. (1978), jika kesamaaan geometrik peralatan skala kecil ke skala besar dipertahankan dan kondisi media fermentasi seperti komposisi media, suhu, pH, dan konsentrasi oksigen terlarut diasumsikan sama, maka bagian yang memperlihatkan perilaku cairan dalam tangki fermentor adalah tenaga yang digunakan untuk agitasi (P) atau tenaga untuk agitasi dalam sistem berairasi (Pg), kecepatan agitasi (N) dan kecepatan aerasi atau kecepatan pemompaan oleh impeler (F).
Tenaga yang digunakan dalam proses kultivasi berfungsi untuk mengaduk dan memutar suspensi kultur, jika tenaga per unit volume pada berbagai skala fermentasi dijaga konstan maka hubungan antara kecepatan impeler (N) dan diameter impeler (D) dapat dinyatakan dengan persamaan :
N13D12 = N13D12 (1)
Hubungan tenaga yang digunakan (P) untuk agitasi dan variabel lain menggunakan teknik analisa dimensi dapat dijelaskan melalui persamaan (Aiba 1973):
Np =
(2)
Dimana : Np = Bilangan tenaga (bilangan tak berdimensi) P = Tenaga eksternal dari agitator (kg m/det)
ρ = Densitas cairan dalam tangki (kg/m3) D = diameter impeler (m)
Bilangan tak berdimensi lain yang dapat menggambarkan pergerakan
Bilangan Reynolds dan bilangan tenaga merupakan bilangan tak berdimensi yang digunakan untuk menghitung tenaga yang dibutuhkan dalam proses pengadukan suspensi kultur. Hubungan dua bilangan tersebut dapat ditunjukan oleh kurva tenaga yaitu dengan cara memplotkan nilai-nilai bilangan tenaga dan bilangan Reynolds berdasarkan hasil percobaan yang dilakukan. Dari kurva tenaga (Gambar 25) dapat dilihat tiga bagian daerah berdasarkan nilai bilangan Reynolds yaitu (Rushtons 1971 di dalam Aiba 1973):
a. Aliran laminar (viscous flow), jika NRe < 10
b. Aliran transisi (transient), jika NRe antara 10 - 104
c. Aliran turbulen (turbulenss flow), jika NRe > 104
Menurut Wang et al. (1978), metode konvensional penggandaan skala fermentasi sistem agitasi dan aerasi adalah dengan mempertahankan kesamaan geometrik peralatan skala kecil ke skala besar pada tingkat kriteria tertentu yang dikotrol tetap. Kriteria dasar penggandaan skala dapat dipilih antara lain adalah:
a. Tenaga per unit volume (Pg/V) b. Koefisien Transfer Oksigen (Kla) c. Kecepatan Ujung impeller (πND) d. Waktu Pengadukan (Mixing Time) e. Momentum Faktor
3 METODE PENELITIAN
3.1 Kerangka Pemikiran
Keberhasilan produksi bioinsektisida selain dipengaruhi oleh galur bakterinya, juga dipengaruhi oleh media dan kondisi fermentasi yang digunakan. Untuk memperoleh komplek spora - kristal yang optimum diperlukan kesesuaian nutrisi dan galur Bt yang digunakan. Nilai parameter terbaik untuk suatu galur tidak sama dengan galur yang lain, tetapi secara umum kondisi kultivasi harus dioptimalkan untuk memperoleh jumlah spora yang banyak, konsentrasi protein kristal yang tinggi dan daya toksisitas yang tinggi pula (Dulmage et. al. 1990). Dalam kultivasi B. thuringiensis, karbon mempunyai peran yang sangat penting. Konsentrasi karbon yang tinggi menyebabkan B. thuringiensis menghasilkan asam sehingga terjadi penurunan pH di bawah 5,5 – 5,7 dimana pada kondisi ini kebanyakan galur B. thuringiensis tidak dapat tumbuh sehingga fermentasi terhenti (Dulmage et al. 1990). Sebaliknya, efek kenaikan pH akan terjadi apabila konsentrasi nitrogen dalam media cukup tinggu. Untuk menjaga kondisi ini diperlukan keseimbangan perbandingan karbon – nitrogen dan pH dikontrol dengan cara menambahkan buffer selama proses. Farrera et al. (1998) menjelaskan bahwa keseimbangan rasio C/N secara langsung berpengaruh pada produksi kristal protein. Komponen lain yang sangat penting dalam produksi protein kristal adalah kalsium. Kultivasi B. thuringiensis pada media yang mengandung garam kalsium akan menghasilkan peningkatan produksi protein kristal. Untuk menguji aktivitas bioinsektisida (komplek spora-kristal protein) dari Bt dapat diukur melalui bioassay yaitu metode pengujian insektisida mikrobial yang didesain untuk menentukan berapa banyak bahan yang diperlukan untuk menyebabkan kematian populasi serangga sasaran.
Dalam penggandaan skala diperlukan penerapan kondisi terbaik berdasarkan suatu acuan tertentu. Acuan yang umum digunakan adalah berbasis tenaga per volume (Pg/V) tetap atau berdasarkan koefisien transfer oksigen (Kla)
konstan. Kultivasi dengan media limbah cair tahu yang memiliki partikel kasar cukup menyulitkan pengontrolan Kla, sehingga basis Pg/V menjadi pilihan yang
Gambar6Diagram alir tahapan penelitian
Gambar 6 Diagram alir penelitian Analisa Komposisi Media
Kadar air,abu, protein, lemak, serat kasar, karbohidrat, C total, N total
Seleksi B. thuringiensis
Sumber Bakteri dari culture collection dan ulat sutra
Parameter yang dianalisa : jumlah sel hidup (N), jumlah spora hidup (P), penampakan mikroskopik, daya toksisitas terhadap C.binotalis
Daya toksisitas terhadap C.binotalis
Persiapan Inokulum
Penyegaran di agar miring, pembiakan dalam Nutrient Broth, pembiakan dalam limbah cair tahu
Penentuan C/N Rasio pada Kultivasi Skala Laboratorium (500 ml) Parameter yang dianalisa pada jam pengamatan ke 0,3,6,9,12,24,36,48, 72: pH, jumlah sel hidup (N), jumlah spora hidup (P), jumlah substrat sisa
(S), pertumbuhan spesifik maksimum (µx-maks.), efisiensi penggunaan substrat, konversi substrat menjadi biomassa (YN/S), konversi substrat menjadi produk (YP/S) ), dan konversi substrat menjadi biomassa (YX/S)
Kultivasi Skala Laboratorium (3 liter)
Parameter yang dianalisa pada jam pengamatan ke 0,3,6,9,12,24,36,48, 72 : pH, jumlah sel hidup (N), jumlah spora hidup (P), jumlah substrat sisa (S), laju pertumbuhan spesifik (µ), YN/S, YP/S, YX/S, Penentuan Tenaga per
unit Volume (Pg/V) dan daya toksisitas terhadap C.binotalis
Karakterisasi Bioinsektisida
Pola Protein dengan SDS-PAGE, Kadar asam amino
Kultivasi Skala Laboratorium (40 liter)
Parameter yang dianalisa pada jam pengamatan ke 0,3,6,9,12,24,36,48,: pH, jumlah sel hidup (N), jumlah spora hidup (P), jumlah substrat sisa (S),
3.2 Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Dasar Ilmu Terapan, Laboratorium Bioindustri, Teknologi Kimia dan Lab Instrumentasi Jurusan Teknologi Industri Pertanian FATETA IPB dan dan Lab Hama dan Penyakit Tanaman, Fakultas Pertanian IPB. Penelitian dimulai pada bulan April 2010 sampai dengan Desember 2010 dan bulan September 2011.
3.3 Alat dan Bahan
Kultur B. thuringiensis diperoleh dengan membiakkan campuran spora-kristal protein bakteri dari cultur collection pada media agar miring. Isolat diperoleh dari Balitvet, Bogor, yang berasal dari tanah dan kandang domba, Ds. Jatiraga, Kec. Kadipaten Majalengka tahun 2003. Sumber isolat lainnya adalah ulat sutera mati yang diperoleh dari dari Rumah Sutra Ciapus Bogor, Mei 2010).
Bahan-bahan lain yang digunakan dalam penelitian ini terdiri dari nutrient agar (NA), nutrient broth (NB), MgSO4.7H2O, MnSO4.7H2O, FeSO4.7H2O,
ZnSO4.7H2O, CaCO3, limbah cair tahu dari industri tahu di desa Cibadak
Ciampea dan Kayu Manis Salabenda Bogor, garam fisiologis, laktosa, bahan perekat dan perata (Agristick), larutan buffer, air suling, etanol 94%, spiritus, tisu, kapas, alumunium foil, CuSO4, Na2SO4, H2SO4 pekat, NaOH, HCl, indikator
mensel, heksana, Pb-asetat, Na-oksalat, fenol, HNO3, HF. Untuk bioassay
diperlukan ulat kubis (C. binotalis) dan daun kubis organik.
Peralatan yang diperlukan diantaranya adalah rotary shaker, autoclave, inkubator, labu erlenmeyer, pemanas listrik, tabung ulir, tabung reaksi, tabung eppendorf, jarum ose, pipet, lemari pendingin, oven, mortar, teflon bom digester,
labu Kjedhal, soxhlet, desikator, tanur, spektrofotometer, Spektrofotometri Serapan Atom (SSA), Scanning Electron Microscophy (SEM), neraca analitik, pH meter, kertas saring, cawan petri, cawan alumunium, gelas piala, pinset, bunsen, papan miring serta alat gelas lainnya.
3.4 Metode Penelitian
3.4.1 Analisis komposisi media dan isolasi bakteri 3.4.1.1 Analisis bahan baku
kadar lemak, kadar serat kasar dan fermentable sugars serta kandungan makro dan mikro elemen. Masing-masing langkah analisis bahan baku dapat dilihat pada Lampiran 1.
3.4.1.2 Isolasi B. thuringiensis
Metode isolasi yang digunakan adalah metode cawan tuang. Campuran spora kristal dari cultur collection dan cairan usus ulat sutra digoreskan ke dalam agar miring secara aseptis. Kemudian kultur diinkubasi selama 24 jam pada suhu 30-32 oC. Masing-masing kultur diambil satu lup ke dalam larutan 9 ml garam fisiologis dan dilakukan renjatan panas pada suhu 80 oC selama 10-15 menit. Larutan selanjutnya diencerkan berseri sampai pada pengenceran 10-7 dan sebanyak 1 ml dari masing-masing pengenceran disebarkan dalam medium agar (pH 7,4). Biakan dalam cawan diinkubasi selama 24 jam pada suhu 30-32 oC. Koloni-koloni yang terpisah dan bentuk yang berbeda selanjutnya dibiakkan dalam agar miring. Masing-masing kultur dalam agar miring ini selanjutnya dilakukan pengamatan mikroskopik menggunakan mikroskop dan Scanning Electron Microscopy (SEM).
Sebanyak satu lup isolat kemudian diinokulasikan ke dalam Nutrient Broth dan dikocok dalam rotary shaker selama 24 jam dengan kecepatan 180 rpm. Untuk mempelajari pengaruh jenis media pada isolat bakteri yang dihasilkan maka disiapkan media kultivasi yang berbeda terdiri dari dua macam media yaitu: 1. Media M1 : Nutrient Broth (NB). binotalis. Prosedur penentuan jumlah sel hidup, jumlah spora dan daya toksisitas
bioinsektisida dapat dilihat pada Lampiran 2.
media terdiri dari media NB (M1) dan media LCT (M2). Faktor isolat bakteri meliputi isolat dari Balitvet yang koloni tak bertitik (B1), isolat dari Balitvet yang koloninya bertitik (B2) serta isolat dari ulat (B3). Model matematis yang digunakan untuk percobaan ini sebagai berikut (Hanafiah 2005):
Yijk= µ + αi + βj + (αβ)ij + εijk
Keterangan :
Yijk = nilai variabel respon unit percobaan yang dikenai taraf ke-i faktor jenis
media dan isolat bakteri ke-j.
µ = nilai rata-rata pengamatan yang sesungguhnya. αi = pengaruh aditif dari jenis media ke-i.
βj = pengaruh aditif dari isolat bakteri ke-j.
(αβ)ij = pengaruh interaksi antara jenis media ke-i faktor dan isolat bakteri ke-j.
Σk(ij) = pengaruh galat dari satuan percobaan ke-k yang memperoleh kombinasi perlakuan.
Parameter yang diamati meliputi total sel hidup dan jumlah spora. Apabila hasilnya menunjukkan perbedaan yang nyata, maka analisis dilanjutkan dengan uji Duncan menggunakan program SPSS.
3.4.2 Penentuan rasio karbon/nitrogen media 3.4.2.1 Persiapan inokulum
3.4.2.2 Penentuan komposisi rasio karbon/nitrogen terbaik
Penentuan komposisi C/N terbaik dilakukan dengan terlebih dahulu menyiapkan media kultivasi dimana sumber karbon berasal dari ampas tahu (AT) dan limbah cair tahu (LCT) dengan perbandingan AT : LCT = 1 : 9 dan sumber N dari urea.
Percobaan dilakukan pada labu erlenmeyer 500 ml yang masing-masing berisi 50 ml media kultivasi dengan komposisi berbandingan karbon/nitrogen yang digunakan seperti terlihat pada Tabel 5.
Tabel 5 Komposisi rasio C/N pada media kultivasi
Kode C3N C5N C7N C9N C11N
Rasio C/N 3:1 5:1 7:1 9:1 11:1
Tujuan dari tahap ini adalah untuk mengetahui pengaruh perbandingan dari sumber karbon dan sumber nitrogen pada media terhadap produksi bioinsektisida. Jenis dan konsentrasi mineral yang digunakan dalam penelitian ini sesuai dengan yang digunakan oleh Dulmage dan Rhodes (1971), yaitu 0,3 g/L MgSO4.7H2O, 0,02 g/L MnSO4. H2O, 0,02 g/L ZnSO4.7 H2O, 0,02 g/L FeSO4.7
H2O, dan 1,0 g/L CaCO3. Hasil perhitungan pembuatan media kultivasi secara
terperinci dapat dilihat pada Lampiran 3.
Sterilisasi ampas tahu, CaCO3, dan limbah cair tahu dilakukan secara
terpisah dari urea, trace elementdan, larutan buffer. Semua bahan didinginkan sampai ± 30 0C, dicampurkan dan pH diatur hingga 7,2. Masing-masing labu diinokulasi dengan kultur inokulum dari labu pembibitan II sebanyak 2 % dari media kultivasi secara aseptis. Kemudian diinkubasi dalam rotary shaking incubator pada kondisi suhu 28-32 oC, pH 6,8 – 7,2, agitasi 181 rpm dan waktu pengamatan dilakukan pada jam ke 0, 3, 6, 9, 12, 18, 24, 36, 48 dan 72 jam (Mummigati dan Raghunatan 1990).
Cairan fermentasi tersebut kemudian dianalisis. Metode analisis dapat dilihat pada Lampiran 2 meliputi:
pH cairan fermentasi
Pengukuran pembentukan koloni total (Total Plate Count/TPC) Pengukuran total gula sisa dengan menggunakan Metode Fenol
Pengukuran biomassa kering dengan metode yang sama seperti penentuan kadar air.
Penentukan parameter kinetika fermentasi. Parameter kinetika fermentasi yang ditentukan meliputi laju pertumbuhan spesifik maksimum (µx-maks.), efisiensi penggunaan substrat menjadi sel (YN/S), konversi substrat menjadi
biomassa (YX/S) dan konversi substrat menjadi produk (YP/S).
Penentuan daya toksisitas bioinsektisida yang dihasilkan dari ke lima perbandingan C/N.
Rancangan percobaan yang digunakan untuk menganalisa pengaruh rasio karbon/nitrogen media terhadap pH, bobot kering biomassa, jumlah sel dan jumlah spora hidup adalah rancangan acak kelompok, dengan dua kali ulangan, mengikuti persamaan berikut ((Hanafiah 2005):
Yij= µ + Ai + Bj + εij
Dengan i = 1,2,3,4,5 ; j = 1,2,3,4,5,6,7,8,9 Keterangan :
Yij = nilai variabel respon unit percobaan yang dikenai taraf ke-i faktor
rasio C/N pada jam pengamatan ke-j.
µ = nilai rata-rata pengamatan yang sesungguhnya.
Ai = keragaman akibat taraf kelompok ke-i faktor rasio C/N βj = keragaman akibat perlakuan taraf ke-j jam pengamatan
εij = pengaruh galat dari satuan percobaan ke-ij yang memperoleh kombinasi
perlakuan.
Data yang diperoleh dari pengukuran parameter, masing-masing dianalisis menggunakan analisis ragam uji F. Apabila hasilnya menunjukkan perbedaan yang nyata, analisis dilanjutkan dengan uji Duncan menggunakan program SPSS.
3.4.3 Penerapan kondisi terbaik pada bioreaktor 3 L dan 40 L
Dulmage 1982; Dulmage et al.1990 ; Yulianti 2001 ; Syamsu et al. 2003; Aprifianto 2006). Biakan selanjutnya diamati pada jam ke 0, 3, 6, 9, 12, 18, 24, 36, 48 dan 72 jam dengan parameter analisa :
Pengukuran pH cairan fermentasi
Pengukuran pembentukan spora dengan menentukan jumlah spora hidup (viable spore count /VSC)
Pengukuran pembentukan sel total (Total Plate Count/TPC) Pengukuran total gula sisa dengan menggunakan Metode Fenol
Pengukuran biomassa kering dengan metode yang sama seperti penentuan kadar air.
Penentuan daya toksisitas bioinsektisida yang dihasilkan dari ke lima perbandingan C/N.
Perhitungan rancang bangun bioreaktor untuk skala pilot 40 L dilakukan dengan menggunakan metode tenaga per volum tetap (Pg/V). Nilai tenaga per volum pada skala produksi dihitung dengan asumsi bahwa pada efisiensi aerasi yang sama akan diperoleh rendemen produk yang sama baik pada skala kecil maupun skala besar (Banks dalam Wiseman, 1979). Konsumsi tenaga per satuan volum cairan kultivasi di dalam tangki biorekator (P/V) adalah:
P/V = N3D3
Keterangan : P: Konsumsi tenaga V: Volume cairan kultivasi N: Laju sirkulasi cairan kultivasi D: Diameter pengaduk
Penggandaan skala kultivasi dilakukan pada bioreaktor tangki berpengaduk dengan volume kerja 25 liter. Kondisi kultivasi yang harus dipenuhi antara lain pH awal 6,8 - 7,2 dan suhu 30-32 oC , dengan nilai aerasi dan agitasi diperoleh dari perhitungan berbasis Pg/V. Hasil kultivasi selanjutnya diamati pada jam ke 0, 6, 12, 18, 24, 36, dan 48 jam dengan parameter analisa :
Pengukuran pH cairan fermentasi
Pengukuran biomassa kering dengan metode yang sama seperti penentuan
kadar air.
Pengukuran pembentukan spora dengan menentukan jumlah spora hidup (viable spore count /VSC).
Penentuan daya toksisitas bioinsektisida yang dihasilkan
3.4.4 Karakterisasi dan uji daya toksisitas bioinsektisida
4 HASIL DAN PEMBAHASAN
4.1 Analisis Komposisi Media Kultivasi
Ampas tahu merupakan limbah padat yang dihasilkan dari tahap pembuatan susu kedelai pada proses pembuatan tahu. Protein dalam susu kedelai kemudian diendapkan menggunakan bahan-bahan penggumpal seperti batu tahu (CaSO4),
asam cuka (CH3COOH). Bagian yang tidak terendapkan (whey) merupakan
limbah cair tahu yang dapat dimanfaatkan sebagai media kultivasi.
Limbah industri tahu dipilih sebagai media pertumbuhan karena ditinjau dari komposisi kimianya (Tabel 6) mengandung bahan yang diperlukan untuk pertumbuhan sel seperti air, karbon dan nitrogen. Karbon merupakan bahan utama untuk mensistesis sel baru atau produk sel (Dulmage dan Rhodes 1971).
Tabel 6 Hasil analisis komposisi media kultivasi
Dalam penentuan sumber karbon, komposisi karbon dalam media menjadi pertimbangan penting. Menurut Yang dan Wang (1998), penggunaan glukosa dalam konsentrasi tinggi (> 40 g/L) menyebabkan pH medium turun dan keasaman yang terlalu tinggi akan menghambat pertumbuhan B. thuringiensis. Sebaliknya, konsumsi glukosa kurang dari 1 g/L penyebabkan pertumbuhan yang lambat dan jumlah spora yang sedikit (Kang et al. 1993). Kadar glukosa secara signifikan berpengaruh pada ukuran kristal protein yang terbentuk. Seperti dilaporkan Scherrer et al. (1972), konsentrasi glukosa 1 g/L menghasilkan rata-rata panjang δ-endotoksin 0,5 µm, sedangkan penambahan glukosa sampai 8 g/L memberikan ukuran maksimum yaitu rata-rata 2 µm.
Berdasarkan penelitian Sarfat (2010), penggunaan substrat oleh B thuringiensis masih dapat tumbuh pada total karbon sebesar 56,3 g/L, oleh karena
itu dalam penelitian ini digunakan perbandingan ampas tahu dan limbah cair tahu sebesar 1: 9 atau sebanding dengan total karbon sebesar 80,7 g/L medium. Dari Tabel 7, total fermentable sugars dari limbah tahu apabila menggunakan perbandingan yang sama diperoleh 7,1 g/L.
Tabel 7 Hasil analisis kadar karbon dan nitrogen pada media kultivasi
Sumber nutrisi lain yang diperlukan mikroba dalam media kultivasi adalah nitrogen. Kandungan nitrogen dalam limbah indutri tahu relatif rendah sehingga diperlukan sumber lain seperti urea. Urea di dalam air akan membentuk ion amonium yang sangat dibutuhkan dalam pertumbuhan mikroba. Selain itu ion amonium bersifat buffer sehingga mampu mempertahankan pH. Namun demikian, urea bersifat tidak stabil sehingga penggunaannya harus dibatasi (Stanbury dan Withaker 1984).
Kandungan unsur-unsur mikro dalam ampas tahu dan limbah cair tahu juga menunjang pertumbuhan, sporulasi dan produksi endotoksin oleh B. thuringiensis. Menurut Dulmage dan Rhodes (1971), Ca selain berperan dalam pertumbuhan dan produksi endotoksin juga berfungsi untuk menjaga kestabilan spora terhadap panas, sedangkan Fe, Mn, dan Cu diperlukan untuk produksi toksin.
Hasil analisis kandungan mineral pada ampas tahu dan limbah cair tahu diberikan Tabel 8. Kadar kalsium yang sangat tinggi berasal dari penggunaan garam CaSO4 pada saat penggumpalan protein dalam susu kedelai. Menurut
kofaktor untuk menstabilkan dan mengaktivasi enzim amilase dan eksoprotease B thuringiensis selama pertumbuhan sel vegetatif dan mempunyai peran penting
dalam pembentukan protein dinding sel serta bahan penyusun polimer kapsul bakteri.
Tabel 8 Kandungan mikro elemen pada ampas tahu dan limbah cair tahu
4.2 Seleksi B. thuringiensis
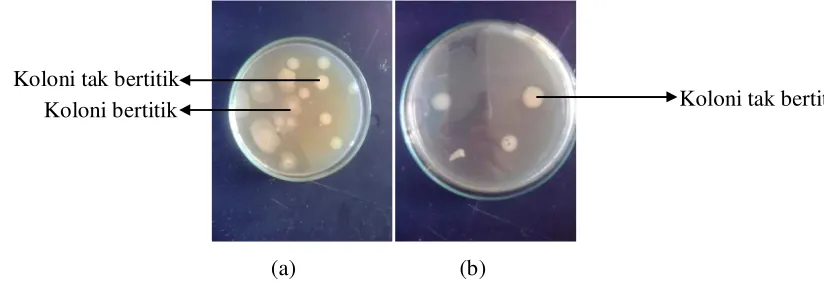
Hasil seleksi dari culture collection memberikan dua koloni yang berbeda yaitu koloni bertitik (B1) dan koloni tak bertitik (B2), sedangkan hasil isolasi dari ulat menunjukan satu jenis koloni (B3). Galur yang di tumbuhkan pada media agar menunjukkan morfologi koloni B. thuringiensis (Gambar 7).
(a) (b)
Gambar 7 Kultur Bt Hasil Seleksi dari culture collection (a) dan ulat sutera (b)
Menurut Bucher (1981), jika B. thuringiensis ditumbuhkan pada media padat, koloninya berbentuk bulat dengan tepian berkerut, memiliki diameter 5-10
Komponen
Hasil Analisa Ampas Tahu
(mg/Kg)
Limbah cair tahu (LCT) (mg/L)
Calsium (Ca) 1708,66 249,25
Mangan (Mn) 0,17 < 0,02 Magnesium (Mg) 104,61 33,51 Besi (Fe) 9,33 5,32 Seng (Zn) 8,98 2,42
Koloni tak bertitik
mm dan berwarna putih. Di bawah pengamatan mikroskop sel vegetatifnya berbentuk batang (Gambar 8).
B1 B2
B3
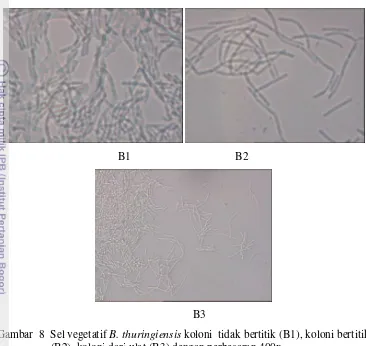
Gambar 8 Sel vegetatif B. thuringiensis koloni tidak bertitik (B1), koloni bertitik (B2), koloni dari ulat (B3) dengan perbesaran 400x
Pada Gambar 9 ditunjukan bahwa B. thuringiensis dapat membentuk spora (S) selama fase stasioner dalam daur hidupnya (Schnepf et al. 1998). Ciri yang membedakan B. thuringiensis dengan spesies bacillus yang lain adalah kemampuan menghasilkan badan inklusi parasporal berupa kristal protein yang dapat diamati dibawah mikroskop fase kontras. Morfologi, ukuran, dan jumlah protein kristal sangat bervariasi pada setiap galur B. thuringiensis (Apaydin 2004; Xavier et al. 2010).
Masing-masing morfologi protein kristal dikode oleh gen Cry gen dan gen Cyt. Ada lima jenis morfologi kristal protein yang masing-masing dikode oleh
berhubungan dengan protein Cry4 dan protein Cyt; kristal persegi berhubungan dengan protein Cry3; Kristal berbentuk batang berhubungan dengan protein Cry4D (Lopez-Meza dan Ibra, 1996; Schnepf et al. 1998).
B1 B2
B3
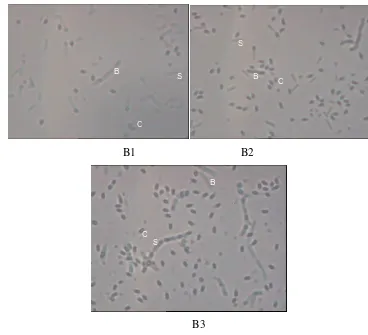
Gambar 9 Hasil pengamatan koloni tidak bertitik (B1), koloni bertitik (B2), koloni dari ulat (B3) dibawah mikroskop dengan perbesaran 1000x. bakteri (B), spora (S), kristal protein (C)
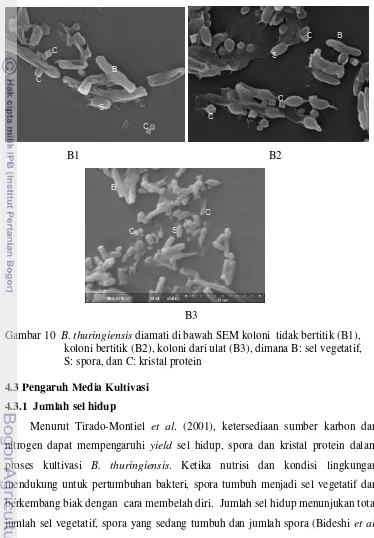
Pengamatan dibawah Scanning Electron Microscopy (SEM) menunjukkan koloni B1 dan koloni B2 (dari culture collection) serta koloni B3 (dari ulat) mengandung kristal protein berbentuk kubus, bipiramid dan bulat (Gambar 10). Menurut Bideshi et al. (2010), gen Cry1Aa, Cry1Ab, Cry1Ac merupakan penyusun kristal protein berbentuk bipiramida, sedangkan Cry2Aa penyusun kristal protein berbentuk kubus. Masing-masing kristal protein memiliki daya toksisitas terhadap Lepidoptera. Sedangkan menurut Frederici et al. (2010) kristal
C
S B
C S
B
C S
protein berbentuk bulat dikode oleh gen Cyt1Aa dan mempunyai daya toksisitas terhadap Diptera.
B1 B2
B3
Gambar 10 B. thuringiensis diamati di bawah SEM koloni tidak bertitik (B1), koloni bertitik (B2), koloni dari ulat (B3), dimana B: sel vegetatif, S: spora, dan C: kristal protein
4.3 Pengaruh Media Kultivasi 4.3.1 Jumlah sel hidup
Menurut Tirado-Montiel et al. (2001), ketersediaan sumber karbon dan nitrogen dapat mempengaruhi yield sel hidup, spora dan kristal protein dalam proses kultivasi B. thuringiensis. Ketika nutrisi dan kondisi lingkungan mendukung untuk pertumbuhan bakteri, spora tumbuh menjadi sel vegetatif dan berkembang biak dengan cara membelah diri. Jumlah sel hidup menunjukan total jumlah sel vegetatif, spora yang sedang tumbuh dan jumlah spora (Bideshi et al. 2010).
C
C
C
S
S
S
B
B
C
C
C B
C