TAUFIQURRAHMAN SIDQI. Pembuatan dan Karakterisasi Nanopartikel
Ekstrak Temulawak dengan Metode Ultrasonikasi. Dibimbing oleh LAKSMI
AMBARSARI, DIMAS ANDRIANTO, dan MERSI KURNIATI.
ABSTRACT
TAUFIQURRAHMAN SIDQI. Production and Characterization of
Curcuma
xanthorrhiza
Roxb. Extract Nanoparticles using Ultrasonication Method.
Supervised by LAKSMI AMBARSARI, DIMAS ANDRIANTO, and MERSI
KURNIATI.
Curcuma xanthorrhiza
Roxb. extract is known to have antioxidant,
anti-inflammatory, antibacterial, and antifungal activities. However, it cause a taste of
bitterness and also has a low bioavailability. One of the efforts that can be
developed to solve this problem is encapsulation using nanochitosan.
Ultrasonication is one of the methods that can be used to produce
Curcuma
xanthorrhiza
Roxb. extract nanoparticles. This research has focused on gaining
Curcuma xanthorrhiza
Roxb. extract nanoparticles using ultrasonication, physical
characterization of morphology, functional groups, and crystanility degree. This
research has used the treatment of sonication time (30 and 60 minutes), usage of
TPP, and the additon process of
Curcuma xanthorrhiza
Roxb. extract. The data
has shown that the choosen treatment to produce
Curcuma xanthorrhiza
Roxb.
extract nanoparticles by the addition of TPP and twice 60 minutes ultrasonication
which drying by spray dryer. The yield of nanoparticles that resulting from the
choosen treatment is 5,47%. Nanoparticles size of the choosen treatment ranges
from 470 – 3000 nm by SEM.
Curcuma xanthorrhiza
Roxb. extract nanoparticles
surface more smooth and convex than nanochitosan. The characterization of FTIR
has shown no presence of curcumin functional groups at
Curcuma xanthorrhiza
ilmu Fisika, Kimia, Biologi, dan Rekayasa yang penting dan menarik beberapa tahun terakhir ini. Jepang dan Amerika Serikat merupakan dua negara terdepan dalam riset nanoteknologi (Poole & Owens 2003). Berdasarkan data tahun 2004, pemerintah Jepang mengeluarkan dana riset sebesar 875 juta dolar (Kallender 2004) sedangkan Amerika Serikat sebesar 1,3 milyar dolar pada tahun 2006 (USGAO 2008). Penelitian nanobiosistem dan biomedis bahkan telah menjadi prioritas di beberapa negara maju termasuk Amerika Serikat, Inggris, Jepang, Australia, dan Cina (Malsch 2005).
Penggunaan nanopartikel sebagai pembawa obat dan sistem pengantar obat telah berkembang beberapa tahun terakhir. Ukuran nanopartikel yang kecil menyebabkan ekstrak mudah larut dan memiliki efisiensi penyerapan yang tinggi di usus (Poulain & Nakache 1998).
Indonesia merupakan salah satu negara yang memiliki ragam sumber daya alam terbesar di dunia (Matthews 2002). Ragam tanaman herbal yang cukup melimpah di Indonesia merupakan sumber yang tidak akan pernah habis dikembangkan menjadi obat (Nurkhasanah 2006). Salah satu tanaman herbal yang dapat dimanfaatkan dalam teknologi nanobiomedis adalah temulawak.
Ekstrak temulawak diketahui memiliki khasiat sebagai antibakteri (Rukayadi & Hwang 2006), antijamur (Rukayadi & Hwang 2007), antioksidan, dan antiinflamasi (Lim et al. 2005). Akan tetapi, konsumsi ekstrak temulawak secara oral menimbulkan rasa getir pada lidah serta memiliki bioavailabilitas rendah. Hal ini disebabkan ekstrak temulawak memiliki kelarutan rendah dalam saluran pencernaan sehingga sulit masuk ke plasma darah (Marczylo et al.2007). Salah satu upaya yang telah dikembangkan untuk mengatasi permasalahan tersebut adalah penyalutan dengan partikel nano. Enkapsulasi dengan menggunakan nanopartikel menyebabkan ekstrak mudah menyebar dalam darah dan lebih akurat dalam mencapai target (Poulain & Nakache 1998). Salah satu penyalut yang aman digunakan dalam teknologi nanoenkapsulasi adalah kitosan. Kitosan merupakan hasil ekstraksi limbah kulit hewan golongan Crustacea (Hu et al.2007).
Limbah kulit hewan golongan Crustacea yang cukup melimpah di Indonesia berpotensi untuk dijadikan sebagai bahan baku kitosan.
(Prasetyo 2006).
Kitosan telah dibuktikan mampu menghambat penyerapan lemak oleh tubuh (Kaats et al. 2006). Kitosan juga banyak digunakan sebagai penyalut obat dengan tujuan mengoptimalisasi penyerapan obat pada sel target. Desai & Park (2005) membuktikan bahwa mikrosfer kitosan yang berikatan silang dengan tripolifosfat dapat digunakan sebagai peyalut obat dengan metode pengeringan semprot (spray drying). Selain itu, kitosan bersifat biodegradabel, biokompatibel, nonimunogenik, serta nonkarsinogenik sehingga cocok digunakan dalam teknologi farmasi (Hejazi & Amiji 2003).
Salah satu metode yang dapat digunakan untuk pembuatan nanopartikel adalah ultrasonikasi. Nanopartikel kitosan larut air yang diperoleh dari hasil ultrasonikasi dapat digunakan sebagai penyalut retinol. Nanopartikel retinol tersalut kitosan memiliki ukuran 50 – 200 nm sesuai dengan jumlah retinol yang mengisi kitosan (Kim et al.
2006). Akan tetapi belum ada penelitian mengenai nanopartikel ekstrak temulawak tersalut kitosan.
Penelitian ini bertujuan memperoleh nanopartikel ekstrak temulawak dengan metode ultrasonikasi serta karakterisasi morfologi, gugus fungsi, dan derajat kristalinitas nanopartikel yang diperoleh. Hipotesis yang diajukan adalah metode ultrasonikasi dengan variasi waktu sonikasi, penambahan TPP, dan seleksi metode pengeringan dapat menghasilkan nanopartikel ekstrak temulawak tersalut kitosan. Penelitian ini diharapkan dapat memberikan inovasi teknologi pembuatan nanopartikel ekstrak temulawak dengan penyalut kitosan untuk pengobatan. Selain itu, penggunaan kitosan dalam penelitian ini diharapkan dapat meningkatkan nilai guna kitosan dalam bidang kesehatan.
TINJAUAN PUSTAKA
Nanopartikel
PENDAHULUAN
Nanoteknologi menjadi salah satu bidang ilmu Fisika, Kimia, Biologi, dan Rekayasa yang penting dan menarik beberapa tahun terakhir ini. Jepang dan Amerika Serikat merupakan dua negara terdepan dalam riset nanoteknologi (Poole & Owens 2003). Berdasarkan data tahun 2004, pemerintah Jepang mengeluarkan dana riset sebesar 875 juta dolar (Kallender 2004) sedangkan Amerika Serikat sebesar 1,3 milyar dolar pada tahun 2006 (USGAO 2008). Penelitian nanobiosistem dan biomedis bahkan telah menjadi prioritas di beberapa negara maju termasuk Amerika Serikat, Inggris, Jepang, Australia, dan Cina (Malsch 2005).
Penggunaan nanopartikel sebagai pembawa obat dan sistem pengantar obat telah berkembang beberapa tahun terakhir. Ukuran nanopartikel yang kecil menyebabkan ekstrak mudah larut dan memiliki efisiensi penyerapan yang tinggi di usus (Poulain & Nakache 1998).
Indonesia merupakan salah satu negara yang memiliki ragam sumber daya alam terbesar di dunia (Matthews 2002). Ragam tanaman herbal yang cukup melimpah di Indonesia merupakan sumber yang tidak akan pernah habis dikembangkan menjadi obat (Nurkhasanah 2006). Salah satu tanaman herbal yang dapat dimanfaatkan dalam teknologi nanobiomedis adalah temulawak.
Ekstrak temulawak diketahui memiliki khasiat sebagai antibakteri (Rukayadi & Hwang 2006), antijamur (Rukayadi & Hwang 2007), antioksidan, dan antiinflamasi (Lim et al. 2005). Akan tetapi, konsumsi ekstrak temulawak secara oral menimbulkan rasa getir pada lidah serta memiliki bioavailabilitas rendah. Hal ini disebabkan ekstrak temulawak memiliki kelarutan rendah dalam saluran pencernaan sehingga sulit masuk ke plasma darah (Marczylo et al.2007). Salah satu upaya yang telah dikembangkan untuk mengatasi permasalahan tersebut adalah penyalutan dengan partikel nano. Enkapsulasi dengan menggunakan nanopartikel menyebabkan ekstrak mudah menyebar dalam darah dan lebih akurat dalam mencapai target (Poulain & Nakache 1998). Salah satu penyalut yang aman digunakan dalam teknologi nanoenkapsulasi adalah kitosan. Kitosan merupakan hasil ekstraksi limbah kulit hewan golongan Crustacea (Hu et al.2007).
Limbah kulit hewan golongan Crustacea yang cukup melimpah di Indonesia berpotensi untuk dijadikan sebagai bahan baku kitosan.
Salah satu hewan golongan tersebut adalah udang. Produk limbah kulit udang di Indonesia mencapai 325.000 ton per tahun (Prasetyo 2006).
Kitosan telah dibuktikan mampu menghambat penyerapan lemak oleh tubuh (Kaats et al. 2006). Kitosan juga banyak digunakan sebagai penyalut obat dengan tujuan mengoptimalisasi penyerapan obat pada sel target. Desai & Park (2005) membuktikan bahwa mikrosfer kitosan yang berikatan silang dengan tripolifosfat dapat digunakan sebagai peyalut obat dengan metode pengeringan semprot (spray drying). Selain itu, kitosan bersifat biodegradabel, biokompatibel, nonimunogenik, serta nonkarsinogenik sehingga cocok digunakan dalam teknologi farmasi (Hejazi & Amiji 2003).
Salah satu metode yang dapat digunakan untuk pembuatan nanopartikel adalah ultrasonikasi. Nanopartikel kitosan larut air yang diperoleh dari hasil ultrasonikasi dapat digunakan sebagai penyalut retinol. Nanopartikel retinol tersalut kitosan memiliki ukuran 50 – 200 nm sesuai dengan jumlah retinol yang mengisi kitosan (Kim et al.
2006). Akan tetapi belum ada penelitian mengenai nanopartikel ekstrak temulawak tersalut kitosan.
Penelitian ini bertujuan memperoleh nanopartikel ekstrak temulawak dengan metode ultrasonikasi serta karakterisasi morfologi, gugus fungsi, dan derajat kristalinitas nanopartikel yang diperoleh. Hipotesis yang diajukan adalah metode ultrasonikasi dengan variasi waktu sonikasi, penambahan TPP, dan seleksi metode pengeringan dapat menghasilkan nanopartikel ekstrak temulawak tersalut kitosan. Penelitian ini diharapkan dapat memberikan inovasi teknologi pembuatan nanopartikel ekstrak temulawak dengan penyalut kitosan untuk pengobatan. Selain itu, penggunaan kitosan dalam penelitian ini diharapkan dapat meningkatkan nilai guna kitosan dalam bidang kesehatan.
TINJAUAN PUSTAKA
Nanopartikel
Jain (2008) mengklasifikasikan nanopartikel menjadi lima macam berdasarkan jenis materi partikel yaitu kuantum dot, nanokristal, lipopartikel, nanopartikel magnetik, dan nanopartikel polimer. Kuantum dot merupakan kristal berukuran nano dari suatu bahan semikonduktor yang bersinar atau berfluoresens apabila dikenai dengan cahaya seperti laser. Kuantum dot memiliki sifat tidak stabil dan sulit larut sehingga penggunaan kuantum dot harus ditanamkan dalam bahan penjerap karet. Beberapa kristal yang sering digunakan sebagai kuantum dot adalah kadmium selenida (CdSe) dan seng selenida (ZnSe). Pembuatan nanopartikel kuantum dot menggunakan gas mikroemulsi pada suhu kamar. Teknik ini memanfaatkan fase terdispersi dari berbagai mikroemulsi untuk beberapa nanoreaktor yang identik. Kuantum dot banyak digunakan sebagai penanda dalam pelacakan protein pada sel hidup, biosensor, ekspresi gen, pengambilan gambar sel hidup secara in vitro, dan melacak keberadaan sel kanker dengan bantuan Magnetic Resonance Imaging(MRI) secara in vivo.
Partikel yang termasuk dalam kuantum dot selain CsSe dan ZnSe adalah nanopartikel emas dan nanopartikel silika (SiO2).
Nanopartikel emas digunakan untuk mengetahui keberadaan timbal dalam DNA. Molekul DNA yang melekat pada nanopartikel emas menghasilkan warna biru pada spektroskopi. Keberadaan senyawa timbal mengakibatkan putusnya ikatan molekul DNA dengan nanopartikel emas sehingga menyebabkan perubahan warna menjadi merah. Nanopartikel emas juga dapat digunakan sebagai biosensor dalam mendeteksi adanya penyakit. Metode biosensor menggunakan nanopertikel emas ini lebih akurat dibanding penggunaan molekul fluoresens lainnya karena lebih banyak salinan antibodi dan DNA yang dapat melekat pada nanopartikel emas. Nanopartikel silika diperoleh dari ekstrak cangkang silika hasil sedimentasi alga. Nanopartikel ini telah digunakan dalam sistem pengantaran obat dan terapi gen (Jain 2008).
Lipopartikel adalah matriks berukuran nano yang dikelilingi oleh lipid bilayer dan ditanamkan dalam protein membran integral. Jenis nanopartikel ini digunakan dalam biosensor, pengembangan antibodi, penelitian mengenai struktur reseptor kompleks, dan mikrofluida (Jain 2008).
Nanopartikel magnetik merupakan bahan penting untuk sortasi sel, pemisahan protein,
dan pengukuran molekul tunggal. Partikel yang digunakan pada aplikasi tersebut harus memenuhi persyaratan seperti keseragaman ukuran, paramagnetik kuat, dan stabil dalam lingkungan larutan penyangga garam (Jain 2008).
Beberapa penelitian mengenai nanopartikel telah diaplikasikan secara luas dalam bidang industri. Pembuatan pipa nano karbon (carbon nanotubes) telah digunakan dalam pembuatan elektroda baterai dan peralatan listrik lainnya (Poole & Owens 2003). Pengembangan nanoteknologi dalam industri tekstil terbukti mampu melindungi kain dari paparan bakteri. Penggunaan nanopartikel perak oksida (AgO2) tersalut
kitosan dapat digunakan sebagai pelindung kain agar warna kain tidak mudah luntur dan lebih tahan terhadap paparan bakteri. Nanopartikel perak oksida tersalut kitosan yang diperoleh dengan metode emulsifikasi ini berdiameter kurang lebih 300 nm. Pengujian antibakteri dilakukan dengan kapas dan menunjukkan aktivitas antibakteri yang tahan lama hingga 20 kali pencucian kapas (Hu et al. 2007). Penggunaan nanopartikel dalam bidang pertanian dapat menghindari fitotoksisitas pada tanaman dengan menggunakan herbisida terhadap gulma yg bersifat parasit. Nanopartikel herbisida dapat meningkatkan penetrasi melewati kutikula dan jaringan tanaman dan mengatur pelepasan herbisida dalam gulma (Luque & Rubiales 2009). Di bidang makan dan minuman, penggunaan nanopartikel dengan penyalut seng oksida (ZnO) dapat melindungi senyawa asam linoleat terkonjugasi dan asam linoleat gamma terhadap suhu tinggi diatas 50 ºC. Penyalut seng oksida juga dapat mencegah terjadinya autooksidasi pada kedua asam lemak tersebut (Won et al. 2008).
Nanopartikel dapat digunakan sebagai pengantar obat melalui berbagai jalur pengiriman. Nanopartikel sangat penting dalam pengantaran obat secara intravena sehingga dapat melewati pembuluh darah terkecil secara aman. Penggunaan nanopartikel juga dapat memperluas permukaan obat sehingga meningkatkan kelarutan obat dalam sistem pengantaran obat melalui saluran pernapasan (Jain 2008). Beberapa jenis nanopartikel yg dapat digunakan sebagai pengantar obat antara lain nanopartikel emas (Radt et al. 2004), nanopartikel kalsium fosfat (Morcol et al.
3
Nanopartikel emas digunakan sebagai pengatur pelepasan obat dalam tubuh. Proses pelepasan obat pada sel target dapat dikendalikan dengan pelapisan nanopartikel emas pada dinding partikel polimer pengantar obat. Dinding polimer pengantar obat akan terbuka apabila nanopartikel emas terkena sinar laser dari luar tubuh. Kelebihan nanopartikel emas sebagai sistem pengantar obat adalah pengendaliannya dapat dilakukan secara eksternal. Pada umumnya pelepasan obat dikendalikan oleh perubahan lingkungan pada sel target (Radt et al.2004).
Nanopartikel kalsium fosfat digunakan dalam sistem pengantaran insulin secara oral. Nanopartikel kalsium fosfat yg terisi insulin direaksikan dengan polietilen glikol (PEG) dan diendapkan dengan kasein sehingga dapat dikonsumsi secara oral. Dosis tunggal dari campuran tersebut diujikan terhadap mencit yang mengalami diabetes non obesitas sebelum dan sesudah makan untuk mengamati aktivitas glikemik. Hasil pengujian menunjukkan kadar hipoglikemik yang berkepanjangan setelah pemberian secara oral nanopartikel kalsium fosfat-insulin pada mencit yang mengalami diabetes. Nanopartikel kalsium fosfat melindungi insulin dari degradasi ketika melewati lingkungan asam lambung (Morcol et al.
2004).
Siklodekstrin merupakan kelompok oligosakarida siklik dengan permukaan luar yang bersifat hidrofilik dan pusat rongga yang bersifat lipofilik. Nanopartikel siklodekstrin digunakan untuk meningkatkan kelarutan dan stabilitas senyawa dalam air (Memisoglu-Bilensoy & Hincal 2006).
Nanopartikel kitosan dibentuk dengan ikatan ionik dengan tripolifosfat (TPP). Penggunaan nanopartikel kitosan dapat meningkatkan efisiensi protein Bovine Serum Albumin (BSA) tersalut kitosan hingga 90%. Ukuran nanopartikel kitosan-BSA yang dihasilkan mencapai 110-180 nm. Efisiensi nanoenkapsulasi meningkat seiring bertambahnya konsentrasi BSA (Xu et al. 2003).
Beberapa penelitian menunjukkan bahwa penggunaan obat-obatan dalam ukuran nanometer mampu meningkatkan kelarutan dan penyerapan oleh tubuh. Selain itu, penggunaan obat-obatan dalam skala nano dapat mengurangi dosis obat yang dapat mengakibatkan efek samping pada beberapa pasien (Malsch 2005). Penggunaan nanopartikel dalam mendeteksi dan mengobati sel target yang terkena kanker lebih efektif
dibanding obat kanker biasa (Sunderland et al.
2006). Senyawa-senyawa yang bersifat antioksidan umumnya memerlukan penyalut agar aktivitas antioksidan tetap optimal. Mozafari et al. (2006) menunjukkan bahwa penggunaan nanopartikel senyawa antioksidan seperti vitamin E, vitamin C, karotenoid, dan fenol dengan penyalut asal lemak seperti nanoliposom, arkaeosom, dan nanokokleat mampu memberikan perlindungan yang signifikan terhadap senyawa antioksidan. Penggunaan penyalut berbahan dasar lemak dapat meningkatkan potensi pengiriman intraseluler.
Nanoenkapsulasi memiliki banyak keuntungan antara lain melindungi senyawa dari penguraian, meningkatkan akurasi obat pada target, dan mengendalikan pelepasan senyawa aktif seperti obat (Mozafari et al.
2006). Pengendalian pelepasan obat dilakukan agar penggunaan obat lebih efisien, untuk memperkecil efek samping, serta untuk mengurangi frekuensi penggunaan obat (Babtsov et al.2005).
Senyawa aktif yang dienkapsulasi umumnya yang mudah bereaksi dengan senyawa lain, cenderung tidak stabil, atau memiliki waktu paruh eliminasi yang singkat (Birnbaum & Peppas 2003). Senyawa aktif dapat terletak tepat di tengah-tengah kapsul dan bertindak sebagai intinya, atau tersebar di seluruh kapsul atau tidak terpusat pada satu titik saja (Mozafari et al.2006).
Polimer yang bisa digunakan pada proses enkapsulasi suatu senyawa aktif adalah yang bersifat biokompatibel dan biodegradabel. Hal ini disebabkan produk yang dihasilkan akan dimasukkan ke dalam tubuh baik secara oral maupun intravena. Selain itu, polimer sebagai penyalut tidak boleh bereaksi secara kimia dengan senyawa aktif yang dibawa. Polimer yang dapat digunakan untuk proses enkapsulasi antara lain alginat, kitosan (Ain et al.2003) dan etilselulosa (Warsiti 2008).
Kitosan
Kitosan merupakan senyawa berbobot molekul besar yang memiliki rantai polisakarida β(1 -4)-2-amino-2-deoksi-D-glukosa dengan rumus kimia (C6H11NO4)n.
Gambar 1 Struktur kimia kitosan (Muzarelli & Peter 1997).
Bahan baku yang digunakan untuk pembuatan kitosan adalah kulit, kepala, atau cangkang dari hewan golongan Crustacea yang mengandung kitin (Alasalvar & Taylor 2002). Kitosan diperoleh dari deasetilasi kitin yang merupakan biopolimer alami. Kitosan dapat diproduksi dari limbah udang hasil industri pangan asal laut. Pemanfaatan limbah tersebut sekaligus meningkatkan produktifitas industri pangan asal laut (Suyatma et al. 2004).
Indonesia merupakan salah satu negara pengekspor udang terbesar di dunia dengan nilai ekspor antara 850 juta hingga 1 miliar dolar per tahun. Data Direktorat Jenderal Budidaya Departemen Kelautan dan Perikanan menunjukkan bahwa areal tambak udang nasional pada tahun 2003 seluas 478.847 hektar dengan volume produksi 191.723 ton atau 400 kg per hektar. Jumlah tempat pengolahan udang di Indonesia mencapai sekitar 170 tempat dengan kapasitas produksi sebesar 500.000 ton per tahun. Proses pembekuan udang dilakukan dalam bentuk tanpa kepala dan tanpa kulit. Bagian kepala dan kulit sebesar 60 hingga 70 persen dari berat udang menjadi limbah (Prasetyo 2009). Pengolahan produk kitosan dalam negeri diharapkan dapat menciptakan nilai tambah dari limbah kulit udang dan menanggulangi masalah pencemaran limbah kulit udang.
Kitosan telah digunakan dalam bidang pertanian, pengolahan air, industri pangan, industri kosmetika, farmasi, kedokteran, industri aneka (seperti industri cat dan tekstil), bioteknologi, dan sektor industri lainnya. Dalam bidang makanan, kitosan dapat berfungsi sebagai bahan pembentuk gel, pembentuk tekstur, dan pelembut (Hirano 1996). Dalam bidang kesehatan dan farmasi, kitosan dapat digunakan sebagai diet serat dan obat penurun kandungan kolesterol di dalam darah (Hennen 1996). Glukosamin dari kitosan juga telah dipdroduksi secara luas. Produk glukosamin dapat dikonsumsi langsung atau dalam bentuk suplemen (Alasalvar dan Taylor 2002).
Kitosan bersifat biokompatibel, biodegradabel dan non toksik. Beberapa
penelitian menunjukkan penggunaan kitosan dapat diterima oleh tubuh dan tidak menimbulkan gejala klinis. Menurut laporan Wedmore et al. (2006), kitosan digunakan untuk mencegah pendarahan tentara Amerika Serikat pada saat perang di Irak. Data penelitian menunjukkan 97% kasus pendarahan dapat dihentikan dengan penggunaan kitosan sebagai pengganti obat anti pendarahan. Sebanyak 62 dari 64 pasien berhasil dihentikan pendarahan dengan menggunakan kitosan sedangkan 2 pasien lainnya tidak bisa dihentikan pendarahan karena terkena luka yg cukup dalam.
Kitosan juga mulai banyak digunakan dalam teknologi pengantar obat. Beberapa penelitian menunjukkan bahwa penggunaan kitosan sebagai pengantar obat meningkatkan efisiensi obat tanpa menimbulkan efek samping pada tubuh. Nanopartikel kitosan yang ditambahkan gugus tiol mampu meningkatkan penyerapan teofilin dalam pengobatan penyakit asma. Teofilin merupakan obat antiinflamasi yang sering digunakan dalam pengobatan asma melalui intranasal. Efek antiinflamasi teofilin ditunjukkan dengan adanya penurunan eosinofil dalam cairan Bronchoalveolar lavage (BAL) hingga 20%. Penggunaan nanopartikel kitosan sebagai pembawa tiofilin menunjukkan penurunan eosinofil hingga 35% pada tikus (Lee et al.2006).
Nanopartikel kitosan sebagai pengantar obat mata juga menunjukkan adanya peningkatan efisiensi penyerapan. Selama ini pengobatan penyakit mata terhambat oleh sistem pertahanan kompleks sel epitel konjugtiva pada kornea mata sehingga penyerapan obat kurang efisien. Penggunaan nanopartikel kitosan sebagai pengantar obat
fluorescein isothiocyanate-bovine serum albumin (FITC-BSA) pada kelinci yg mengalami inflamasi pada kornea mata menunjukkan penurunan secara signifikan ketika diamati dengan mikroskop konvokal. Pengamatan efek samping pemberian nanopartikel kitosan dilakukan setiap 30 menit selama 6 jam. Hasil pengamatan menunjukkan tidak adanya efek samping dan kelinci tetap nyaman sehingga kitosan aman dikonsumsi dan dapat diterima oleh sel kornea (Enriquez de Salamanca et al.2006)
Ekstrak Temulawak (Curcuma
xanthorrhizaRoxb)
5
coklat gelap. Akar rimpang terbentuk dengan sempurna, bercabang kuat, dan berwarna hijau gelap. Temulawak di Indonesia dikenal dengan berbagai nama daerah seperti temulawak di Sumatra; koneng gede, temu raya, temu besar, aci koneng, koneng tegel, dan temulawak di Jawa; temulobak di Madura; tommo di Bali; tommon di Sulawesi Selatan; atau karbaga di Ternate (Dalimartha 2000). Secara lengkap taksonomi temulawak adalah sebagai berikut: Dunia Plantae, Divisi Spermatophyta, Sub divisi Angiospermae, Kelas Monocotyledoneae, Keluarga Zingiberaceae, Genus Curcuma, dan Spesies
Curcuma xanthorrhiza Roxb. Bagian yang paling banyak dimanfaatkan dari tanaman ini adalah rimpang temulawak.
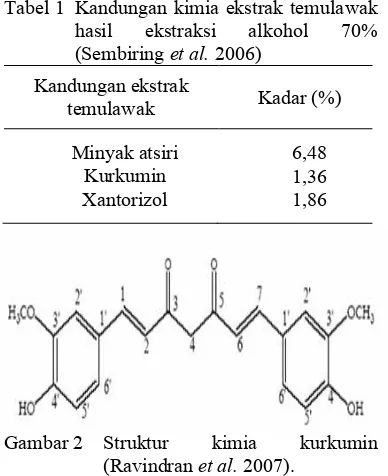
Kandungan kimia rimpang temulawak sebagai sumber bahan pangan, bahan baku industri atau bahan baku obat dapat dibedakan menjadi beberapa fraksi yaitu fraksi pati, kurkuminoid, dan fraksi minyak atsiri (Sidik
et al. 1995). Selain ketiga fraksi tersebut, masih terdapat kandungan lain dalam rimpang temulawak yaitu lemak, serat kasar, dan protein (Suwiah 1991). Senyawa aktif yang banyak dimanfaatkan dari ekstrak tanaman temulawak adalah kurkuminoid dan xantorizol. Presentase komposisi ekstrak temulawak dapat dilihat pada Tabel 1.
Fraksi kurkuminoid merupakan komponen yang memberi warna kuning berbentuk serbuk dengan rasa pahit, larut dalam aseton, alkohol, asam glasial, alkohol hidroksida, tidak larut dalam air, memiliki aroma yang khas, dan tidak bersifat toksik. Kurkuminoid rimpang temulawak terdiri atas desmetoksikurkumin dan kurkumin yang memiliki rumus struktur C21H20O6(Gambar 2) dan bobot molekul 368
g/mol (Sidik et al. 1995). Hal ini berbeda dengan kandungan kurkuminoid pada rimpang kunyit (Curcuma domestica Vahl.) yang memiliki komponen lain yaitu bisdemetoksikurkumin di samping memiliki kedua komponen di atas. Sifat menarik dari bisdemetoksikurkumin ini adalah aktivitas kerjanya terhadap sekresi empedu yang antagonis dengan kurkumin dan desmetoksikurkumin. Berdasarkan hal tersebut, penggunaan rimpang temulawak sebagai sumber kurkuminoid lebih menguntungkan dibandingkan dengan rimpang kunyit walaupun kandungan rimpang temulawak lebih rendah dari rimpang kunyit Kandungan kurkuminoid rimpang temulawak kering berkisar 3.16 % sedangkan kurkuminoid rimpang kunyit sebesar 6.9 % (Afifah et al.2003).
Tabel 1 Kandungan kimia ekstrak temulawak hasil ekstraksi alkohol 70% (Sembiring et al.2006)
Kandungan ekstrak
temulawak Kadar (%)
Minyak atsiri Kurkumin Xantorizol 6,48 1,36 1,86
Gambar 2 Struktur kimia kurkumin (Ravindran et al.2007).
Xantorizol merupakan komponen khas minyak atsiri hasil ekstraksi menggunakan metanol dari famili Zingiberaceae dan Astericeae seperti rimpang temulawak. Komponen ini termasuk dalam kelompok seskuiterpen tipe bisabolen (Aguilar et al.
2001). Xantorizol memiliki rumus molekul C12H22O7 dengan bobot molekul 218.335
g/mol (Gambar 3) (Sidik et al. 1995). Xantorizol merupakan antibakteri yang memiliki spektrum luas terhadap aktivitas antibakteri, stabil terhadap panas, dan aman terhadap kulit manusia. Xantorizol secara efisien dapat menghambat infeksi pada gigi dan penyakit kulit, dapat dimanfaatkan pada berbagai produk, misalnya digunakan sebagai agen antibakteri, pasta gigi, sabun, pembersih mulut, permen karet, dan kosmetik yang memerlukan aktivitas antibakteri. Aktivitas antibakteri dari xantorizol mempunyai stabilitas yang baik terhadap panas yaitu masih terdapat aktivitas antibakteri pada temperatur tinggi antara 60-120 °C (Hwang 2004).
Xantorizol diketahui dapat menghambat pertumbuhan berbagai macam bakteri seperti
Streptococcus mutans, S. sobrinus, S. salivarius, Bifidobacterium bifidum,
Gambar 3 Struktur kimia xanthorrizol (Ravindran et al.2007).
Pembuatan Nanopartikel
Sediaan nanopartikel dapat dibuat dengan berbagai metode. Hingga saat ini, ada enam metode pembuatan nanopartikel yang sering digunakan yaitu metode emulsifikasi spontan atau difusi pelarut, salting out, fluida superkritis, polimerisasi monomer, polimer hidrofilik, dan dispersi pembentukan polimer (Soppimath et al. 2001).
Metode emulsifikasi spontan menggunakan prinsip difusi antara pelarut larut air seperti aseton atau metanol dengan pelarut organik tidak larut air seperti kloroform dengan penambahan polimer. Difusi yang terjadi antara dua pelarut tersebut mengakibatkan emulsifikasi pada daerah di antara dua fase pelarut. Partikel yang berada di antara dua fase pelarut tersebut berukuran lebih kecil dari pada kedua fase pelarut itu sendiri (Soppimath et al. 2001).
Metode salting outmerupakan modifikasi dari metode emulsifikasi spontan. Penggunaan pelarut organik pada metode emulsifikasi spontan dapat membahayakan lingkungan serta sistem fisiologis sehingga diperlukan pemisahan pelarut organik (Soppimath et al. 2001).
Metode fluida superkritis menggunakan senyawa yang memiliki suhu dan tekanan di atas titik kritis. Senyawa yang termasuk dalam golongan ini antara lain karbon dioksida, air, dan gas metan. Senyawa ini digunakan sebagai pengganti pelarut organik yang berbahaya bagi lingkungan (Soppimath et al. 2001).
Metode polimerisasi monomer menggunakan senyawa polialkilsianoakrilat (PACA). Metil atau etil sianoakrilat dimasukkan dalam media asam dengan penambahan surfaktan. Monomer sianoakrilat ditambahkan dalam campuran yang sedang diaduk dengan magnetic stirrer. Senyawa obat ditambahkan baik sebelum penambahan monomer maupun setelah reaksi polimerisasi. Suspensi nanopartikel yang terbentuk dimurnikan dengan ultrasentrifugasi (Soppimath et al. 2001).
Metode polimer hidrofilik tidak memerlukan surfaktan seperti metode polimerisasi monomer. Polimer yang digunakan dalam metode ini merupakan polimer larut air seperti kitosan larut air, natrium alginat dan gelatin. Nanopartikel umumnya terbentuk secara spontan ataupun dengan penambahan pengemulsi (Soppimath
et al. 2001)
Metode evaporasi pelarut menggunakan pelarut organik seperti diklorometan, kloroform atau etil asetat untuk melarutkan polimer. Senyawa obat atau pengisi ditambahkan dalam campuran kemudian diemulsifikasi dengan penambahan surfaktan. Homogenasi atau sonikasi dilakukan agar emulsi menjadi stabil. Nanopartikel kemudian dikeringkan untuk memperoleh produk dalam bentuk serbuk nanopartikel. Metode ini sangat cocok dilakukan untuk skala laboratorium (Soppimath et al. 2001).
Ultrasonikasi
Ultasonik merupakan vibrasi suara dengan frekuensi melebihi batas pendengaran manusia yaitu di atas 20 KHz (Tipler 1998). Ultrasonikasi merupakan salah satu teknik paling efektif dalam pencampuran, proses reaksi, dan pemecahan bahan dengan bantuan energi tinggi (Pirrung 2007). Batas atas rentang ultrasonik mencapai 5 MHz untuk gas dan 500 MHz untuk cairan dan padatan (Mason & Lorimer 2002).
Penggunaan ultasonik berdasarkan rentangnya yang luas ini dibagi menjadi dua bagian. Bagian pertama adalah suara beramplitudo rendah (frekuensi kebih tinggi). Gelombang beramplitudo rendah ini secara umum digunakan untuk analisis pengukuran kecepatan dan koefisien penyerapan gelombang pada rentang 2 hingga 10 MHz. Bagian kedua adalah gelombang berenergi tinggi dan terletak pada frekuensi 20 hingga 100 KHz. Gelombang ini dapat digunakan untuk pembersihan, pembentukan plastik, dan modifikasi bahan-bahan organik maupun anorganik (Mason & Lorimer 2002).
Ultrasonikasi dengan intensitas tinggi dapat menginduksi secara fisik dan kimia. Efek fisik dari ultrasonikasi intensitas tinggi salah satunya adalah emulsifikasi. Beberapa aplikasi ultrasonikasi ini adalah dispersi bahan pengisi dalam polimer dasar, emulsifikasi partikel anorganik pada polimer dasar, serta pembentukan dan pemotongan plastik (Suslick & Price 1999).
7
sehingga terjadi perubahan kimia. Interaksi tersebut disebabkan panjang gelombang ultrasonik lebih tinggi dibandingkan panjang gelombang molekul-molekul. Interaksi gelombang ultrasonik dengan molekul-molekul terjadi melalui media cairan. Gelombang yang dihasilkan oleh tenaga listrik diteruskan oleh media cair ke medan yang dituju melalui fenomena kavitasi akustik yang menyebabkan kenaikan suhu dan tekanan lokal dalam cairan (Wardiyati et al. 2004). Ultrasonikasi pada cairan memiliki berbagai parameter seperti frekuensi, tekanan, suhu, viskositas, dan konsentrasi suatu sampel. Aplikasi ultrasonikasi pada polimer berpengaruh terhadap degradasi polimer tersebut (Wardiyati et al. 2004).
Karakterisasi Nanopartikel
Ukuran nanopartikel yang sangat kecil memerlukan karakterisasi yang berbeda dengan mikromolekul pada umumnya. Karakterisasi nanopartikel kitosan dapat dilakukan secara fisiologi dan struktur fisik. Beberapa karakterisasi fisiologis yang telah dilakukan antara lain stabilitas nanopartikel dalam larutan garam, nilai pH, serta fenomena agregrasi akibat pengaruh suhu dan waktu (Kauper et al.2007).
Poole & Owens (2003) membagi metode karakterisasi fisik nanopartikel menjadi tiga macam yaitu metode kristalografi, mikroskopi, dan spektroskopi. Kristalografi dengan menggunakan sinar X sangat berguna untuk mengidentifikasi kristal isomorfik yaitu kristal yang memiliki kesamaan struktur tetapi berbeda dalam pola-pola geometrisnya. Metode mikroskopi dapat digolongkan menjadi mikroskop elektron transmisi, mikroskop elektron payar, dan mikroskop medan ion. Karakterisasi dengan spektroskopi dapat menggunakan fotoemisi, spektroskopi resonansi magnetik, spektroskopi infra merah (Fourier Transform Infra Red/ FTIR), dan spektroskopi sinar X (X ray diffractometry/ XRD).
Mikroskop elektron payaran (SEM) digunakan dalam pengamatan morfologi dan penentuan ukuran nanopartikel. Metode ini merupakan cara yang efisien dalam memperolah gambar permukaan spesimen. Cara kerja mikroskop ini adalah dengan memancarkan elektron ke permukaan spesimen. Informasi tentang permukaan partikel dapat diperoleh dengan pengenalan
probe dalam lintasan pancaran elektron yang mengenai permukaan partikel. Informasi juga dapat dibawa oleh probe yang menangkap
elektron pada terowongan antara permukaan partikel spesimen dengan tip probe atau sebuah probe yang menangkap gaya dorong antara permukaan dengan tip probe(Poole & Owens 2003).
Analisis difraksi sinar X (XRD) menggunakan prinsip emisi sinar X yang dihasilkan oleh tumbukan elektron dan atom Cr, Fe, Co, Cu, Mo, atau W. Analisis XRD dapat memberikan informasi mengenai struktur sampel seperti parameter kisi, orientasi, dan sistem kristal. Analisis XRD juga berguna untuk mengindentifikasi fase sampel semi kuantitatif, dengan menghitung fraksi volume suatu sampel dan perbandingan fraksi area kristalin terhadap fraksi total area (Poole & Owens 2003).
Spektroskopi infra merah (FTIR) digunakan untuk mengidentifikasi gugus kompleks dalam senyawa tetapi tidak dapat menentukan unsur-unsur penyusunnya. Pada FTIR, radiasi infra merah dilewatkan pada sampel. Sebagian radiasi sinar infra merah diserap oleh sampel dan sebagian lainnya diteruskan. Jika frekuensi dari suatu vibrasi spesifik sama dengan frekuensi radiasi infra merah yang langsung menuju molekul, molekul akan menyerap radiasi tersebut. Spektrum yang dihasilkan menggambarkan penyerapan dan transmisi molekuler. Transmisi ini akan membentuk suatu sidik jari molekuler suatu sampel. Karena bersifat sidik jari, tidak ada dua struktur molekuler unik yang menghasilkan spektrum infra merah yang sama (Kencana 2009).
BAHAN DAN METODE
Alat dan Bahan
Alat yang digunakan untuk pembuatan nanopartikel ekstrak temulawak adalah labu Erlenmeyer 600 mL, 250 mL, gelas piala, neraca analitik, magnetic stirrer, gelas ukur 100 mL, pipet Mohr 5 mL, 25 mL, ultrasonikator, pengering beku, pengering semprot Buchi 190. Alat yang digunakan untuk karakterisasi nanopartikel ekstrak temulawak adalah penyalut JFC 1600, mikroskop elektron payaran (scanning electron microscopy/SEM) JSM 6510, defraktometer sinar X (X ray diffractometry/ XRD), dan spektrofotometer Fourier Transform Infra Red(FTIR).
sehingga terjadi perubahan kimia. Interaksi tersebut disebabkan panjang gelombang ultrasonik lebih tinggi dibandingkan panjang gelombang molekul-molekul. Interaksi gelombang ultrasonik dengan molekul-molekul terjadi melalui media cairan. Gelombang yang dihasilkan oleh tenaga listrik diteruskan oleh media cair ke medan yang dituju melalui fenomena kavitasi akustik yang menyebabkan kenaikan suhu dan tekanan lokal dalam cairan (Wardiyati et al. 2004). Ultrasonikasi pada cairan memiliki berbagai parameter seperti frekuensi, tekanan, suhu, viskositas, dan konsentrasi suatu sampel. Aplikasi ultrasonikasi pada polimer berpengaruh terhadap degradasi polimer tersebut (Wardiyati et al. 2004).
Karakterisasi Nanopartikel
Ukuran nanopartikel yang sangat kecil memerlukan karakterisasi yang berbeda dengan mikromolekul pada umumnya. Karakterisasi nanopartikel kitosan dapat dilakukan secara fisiologi dan struktur fisik. Beberapa karakterisasi fisiologis yang telah dilakukan antara lain stabilitas nanopartikel dalam larutan garam, nilai pH, serta fenomena agregrasi akibat pengaruh suhu dan waktu (Kauper et al.2007).
Poole & Owens (2003) membagi metode karakterisasi fisik nanopartikel menjadi tiga macam yaitu metode kristalografi, mikroskopi, dan spektroskopi. Kristalografi dengan menggunakan sinar X sangat berguna untuk mengidentifikasi kristal isomorfik yaitu kristal yang memiliki kesamaan struktur tetapi berbeda dalam pola-pola geometrisnya. Metode mikroskopi dapat digolongkan menjadi mikroskop elektron transmisi, mikroskop elektron payar, dan mikroskop medan ion. Karakterisasi dengan spektroskopi dapat menggunakan fotoemisi, spektroskopi resonansi magnetik, spektroskopi infra merah (Fourier Transform Infra Red/ FTIR), dan spektroskopi sinar X (X ray diffractometry/ XRD).
Mikroskop elektron payaran (SEM) digunakan dalam pengamatan morfologi dan penentuan ukuran nanopartikel. Metode ini merupakan cara yang efisien dalam memperolah gambar permukaan spesimen. Cara kerja mikroskop ini adalah dengan memancarkan elektron ke permukaan spesimen. Informasi tentang permukaan partikel dapat diperoleh dengan pengenalan
probe dalam lintasan pancaran elektron yang mengenai permukaan partikel. Informasi juga dapat dibawa oleh probe yang menangkap
elektron pada terowongan antara permukaan partikel spesimen dengan tip probe atau sebuah probe yang menangkap gaya dorong antara permukaan dengan tip probe(Poole & Owens 2003).
Analisis difraksi sinar X (XRD) menggunakan prinsip emisi sinar X yang dihasilkan oleh tumbukan elektron dan atom Cr, Fe, Co, Cu, Mo, atau W. Analisis XRD dapat memberikan informasi mengenai struktur sampel seperti parameter kisi, orientasi, dan sistem kristal. Analisis XRD juga berguna untuk mengindentifikasi fase sampel semi kuantitatif, dengan menghitung fraksi volume suatu sampel dan perbandingan fraksi area kristalin terhadap fraksi total area (Poole & Owens 2003).
Spektroskopi infra merah (FTIR) digunakan untuk mengidentifikasi gugus kompleks dalam senyawa tetapi tidak dapat menentukan unsur-unsur penyusunnya. Pada FTIR, radiasi infra merah dilewatkan pada sampel. Sebagian radiasi sinar infra merah diserap oleh sampel dan sebagian lainnya diteruskan. Jika frekuensi dari suatu vibrasi spesifik sama dengan frekuensi radiasi infra merah yang langsung menuju molekul, molekul akan menyerap radiasi tersebut. Spektrum yang dihasilkan menggambarkan penyerapan dan transmisi molekuler. Transmisi ini akan membentuk suatu sidik jari molekuler suatu sampel. Karena bersifat sidik jari, tidak ada dua struktur molekuler unik yang menghasilkan spektrum infra merah yang sama (Kencana 2009).
BAHAN DAN METODE
Alat dan Bahan
Alat yang digunakan untuk pembuatan nanopartikel ekstrak temulawak adalah labu Erlenmeyer 600 mL, 250 mL, gelas piala, neraca analitik, magnetic stirrer, gelas ukur 100 mL, pipet Mohr 5 mL, 25 mL, ultrasonikator, pengering beku, pengering semprot Buchi 190. Alat yang digunakan untuk karakterisasi nanopartikel ekstrak temulawak adalah penyalut JFC 1600, mikroskop elektron payaran (scanning electron microscopy/SEM) JSM 6510, defraktometer sinar X (X ray diffractometry/ XRD), dan spektrofotometer Fourier Transform Infra Red(FTIR).
8
Metode Penelitian
Pembuatan Nanopartikel Kitosan (Ambarsari et al.2009)
Kitosan dilarutkan dalam asam asetat 2% sehingga diperoleh konsentrasi kitosan 2%. Campuran diaduk dengan magnetic stirrer
untuk mempercepat pelarutan. Larutan kitosan kemudian dibagi dalam 4 Erlenmeyer dengan volume masing-masing 100 mL. Erlenmeyer 1 dan 2 ditambahkan dengan masing-masing 50 mL TPP 0,5% sedangkan Erlenmeyer 3 dan 4 tidak ditambahkan dengan TPP. Larutan kemudian disonikasi dengan ultrasonikator. Erlenmeyer 1 dan 3 disonikasi selama 30 menit dengan pulsa hidup 5 detik dan pulsa mati 1 detik. Erlenmeyer 2 dan 4 disonikasi selama 60 menit dengan pulsa hidup 5 detik dan pulsa mati 1 detik. Keempat larutan kitosan yang telah disonikasi dikeringkan. Pengeringan dilakukan dengan dua metode yaitu pengeringan beku dan pengeringan semprot untuk mengetahui bentuk kitosan kering yang dapat dikarakterisasi.
Pembuatan Nanopartikel Ekstrak Temulawak Tersalut Kitosan (Modifikasi
Kim et al.2006)
Kitosan dilarutkan dalam asam asetat 2% sehingga diperoleh konsentrasi kitosan 2%. Campuran diaduk dengan magnetic stirrer
untuk mempercepat pelarutan. Disiapkan 2 labu Erlenmeyer yang diisi dengan 100 mL larutan kitosan 2%. Tiap Erlenmeyer ditambahkan 50 mL TPP 0.5%. Erlenmeyer 1 ditambahkan dengan 1 mL ekstrak temulawak 5% larut dalam etanol 70% sedangkan Erlenmeyer 2 tidak ditambahkan dengan ekstrak temulawak. Kedua sampel kemudian disonikasi selama 30 menit. Kedua larutan kitosan yang telah disonikasi dikeringkan dengan pengering semprot sehingga diperoleh sampel dalam bentuk serbuk.
Serbuk kitosan-TPP dilarutkan kembali dalam 100 mL asam asetat 2% dan 50 mL akuades. Untuk mempercepat pelarutan, digunakan magnetic stirrer dengan pemanasan. Sebanyak 1 mL ekstrak temulawak 5% ditambahkan dalam larutan kitosan-TPP. Campuran disonikasi kembali selama 30 menit kemudian dikeringkan dengan pengering semprot. Sampel kering dikarakterisasi dengan SEM untuk memperoleh ukuran partikel.
Setelah diperoleh tahapan pembuatan nanopartikel terpilih, dilakukan variasi waktu sonikasi selama 30 dan 60 menit untuk mengetahui apakah masih terdapat perbedaan
ukuran nanopartikel yang terbentuk akibat penambahan waktu sonikasi.
Penentuan Ukuran dan Morfologi Nanopartikel dengan Mikroskop Elektron Payaran (SEM) (Modifikasi Desai & Park 2005)
Serbuk nanopartikel kitosan diletakkan pada potongan kuningan (stub) berdiameter 1 cm dengan menggunakan selotip dua sisi. Selanjutnya serbuk tersebut dibuat menjadi konduktif secara elektrik dengan seberkas sinar platina lapis tipis dari coaterselama 30 detik pada tekanan dibawah 2 Pa dan kuat arus 30 mA. Foto diambil pada tegangan elektron 10 kV dengan perbesaran yang diinginkan.
Karakterisasi Gugus Fungsi Nanopartikel dengan Fourier Transform Infra Red
(FTIR) (Kencana 2009)
Sebanyak 2 mg sampel nanopartikel dicampur dengan 100 mg KBr untuk dibuat pelet dengan pencetak vakum. Pelet yang terbentuk dikenai sinar infra merah pada jangkauan bilangan gelombang 4000 – 400 cm-1. Latar belakang penyerapan dihilangkan dengan cara pelet KBr dijadikan satu pada setiap pengukuran.
Karakterisasi Derajat Kristalinitas Nanopartikel dengan Difraksi Sinar X (XRD) (Kencana 2009)
Sebanyak 200 mg sampel dicetak langsung pada cetakan aluminium berukuran 2 x 2,5 cm dengan bantuan perekat. Derajat kristalinitas ditentukan menggunakan XRD dengan sumber sinar dari tembaga pada panjang gelombang 1,5406 Ǻ.
HASIL DAN PEMBAHASAN
Nanopartikel Kitosan
Optimalisasi pembuatan nanopartikel kitosan menggunakan tiga variasi yaitu penambahan TPP, waktu ultrasonikasi, dan seleksi metode pengeringan. Penambahan TPP bertujuan untuk membentuk ikatan silang ionik antar melekul kitosan sehingga dapat digunakan sebagai bahan penjerap (Mi et al.
Metode Penelitian
Pembuatan Nanopartikel Kitosan (Ambarsari et al.2009)
Kitosan dilarutkan dalam asam asetat 2% sehingga diperoleh konsentrasi kitosan 2%. Campuran diaduk dengan magnetic stirrer
untuk mempercepat pelarutan. Larutan kitosan kemudian dibagi dalam 4 Erlenmeyer dengan volume masing-masing 100 mL. Erlenmeyer 1 dan 2 ditambahkan dengan masing-masing 50 mL TPP 0,5% sedangkan Erlenmeyer 3 dan 4 tidak ditambahkan dengan TPP. Larutan kemudian disonikasi dengan ultrasonikator. Erlenmeyer 1 dan 3 disonikasi selama 30 menit dengan pulsa hidup 5 detik dan pulsa mati 1 detik. Erlenmeyer 2 dan 4 disonikasi selama 60 menit dengan pulsa hidup 5 detik dan pulsa mati 1 detik. Keempat larutan kitosan yang telah disonikasi dikeringkan. Pengeringan dilakukan dengan dua metode yaitu pengeringan beku dan pengeringan semprot untuk mengetahui bentuk kitosan kering yang dapat dikarakterisasi.
Pembuatan Nanopartikel Ekstrak Temulawak Tersalut Kitosan (Modifikasi
Kim et al.2006)
Kitosan dilarutkan dalam asam asetat 2% sehingga diperoleh konsentrasi kitosan 2%. Campuran diaduk dengan magnetic stirrer
untuk mempercepat pelarutan. Disiapkan 2 labu Erlenmeyer yang diisi dengan 100 mL larutan kitosan 2%. Tiap Erlenmeyer ditambahkan 50 mL TPP 0.5%. Erlenmeyer 1 ditambahkan dengan 1 mL ekstrak temulawak 5% larut dalam etanol 70% sedangkan Erlenmeyer 2 tidak ditambahkan dengan ekstrak temulawak. Kedua sampel kemudian disonikasi selama 30 menit. Kedua larutan kitosan yang telah disonikasi dikeringkan dengan pengering semprot sehingga diperoleh sampel dalam bentuk serbuk.
Serbuk kitosan-TPP dilarutkan kembali dalam 100 mL asam asetat 2% dan 50 mL akuades. Untuk mempercepat pelarutan, digunakan magnetic stirrer dengan pemanasan. Sebanyak 1 mL ekstrak temulawak 5% ditambahkan dalam larutan kitosan-TPP. Campuran disonikasi kembali selama 30 menit kemudian dikeringkan dengan pengering semprot. Sampel kering dikarakterisasi dengan SEM untuk memperoleh ukuran partikel.
Setelah diperoleh tahapan pembuatan nanopartikel terpilih, dilakukan variasi waktu sonikasi selama 30 dan 60 menit untuk mengetahui apakah masih terdapat perbedaan
ukuran nanopartikel yang terbentuk akibat penambahan waktu sonikasi.
Penentuan Ukuran dan Morfologi Nanopartikel dengan Mikroskop Elektron Payaran (SEM) (Modifikasi Desai & Park 2005)
Serbuk nanopartikel kitosan diletakkan pada potongan kuningan (stub) berdiameter 1 cm dengan menggunakan selotip dua sisi. Selanjutnya serbuk tersebut dibuat menjadi konduktif secara elektrik dengan seberkas sinar platina lapis tipis dari coaterselama 30 detik pada tekanan dibawah 2 Pa dan kuat arus 30 mA. Foto diambil pada tegangan elektron 10 kV dengan perbesaran yang diinginkan.
Karakterisasi Gugus Fungsi Nanopartikel dengan Fourier Transform Infra Red
(FTIR) (Kencana 2009)
Sebanyak 2 mg sampel nanopartikel dicampur dengan 100 mg KBr untuk dibuat pelet dengan pencetak vakum. Pelet yang terbentuk dikenai sinar infra merah pada jangkauan bilangan gelombang 4000 – 400 cm-1. Latar belakang penyerapan dihilangkan dengan cara pelet KBr dijadikan satu pada setiap pengukuran.
Karakterisasi Derajat Kristalinitas Nanopartikel dengan Difraksi Sinar X (XRD) (Kencana 2009)
Sebanyak 200 mg sampel dicetak langsung pada cetakan aluminium berukuran 2 x 2,5 cm dengan bantuan perekat. Derajat kristalinitas ditentukan menggunakan XRD dengan sumber sinar dari tembaga pada panjang gelombang 1,5406 Ǻ.
HASIL DAN PEMBAHASAN
Nanopartikel Kitosan
Optimalisasi pembuatan nanopartikel kitosan menggunakan tiga variasi yaitu penambahan TPP, waktu ultrasonikasi, dan seleksi metode pengeringan. Penambahan TPP bertujuan untuk membentuk ikatan silang ionik antar melekul kitosan sehingga dapat digunakan sebagai bahan penjerap (Mi et al.
9
menit. Penurunan bobot molekul ini menunjukkan polimer kitosan mengalami pemecahan molekul selama proses ultrasonikasi. Variasi waktu ultrasonikasi yang digunakan adalah 30 dan 60 menit untuk melihat pengaruh waktu ultrasonikasi terhadap ukuran partikel. Seleksi metode pengeringan dilakukan untuk memperoleh bentuk kering sampel nanopartikel sehingga dapat dikarakterisasi. Metode pengeringan yang diseleksi adalah pengeringan beku dan pengeringan semprot. Karakterisasi ukuran dan morfologi partikel dilakukan dengan SEM. Karakterisasi gugus fungsi dengan FTIR dan karakterisasi derajat kristalinitas dengan XRD dilakukan apabila telah diperoleh sediaan nanopartikel ekstrak temulawak.
Kitosan yang digunakan dalam penelitian ini adalah kitosan larut asam. Larutan kitosan 2% tersebut diberi dua perlakuan yaitu penambahan TPP 0,5% dan tanpa penambahan TPP. Selain itu, dilakukan variasi waktu sonikasi 30 dan 60 menit untuk masing-masing sampel. Perlakuan ini bertujuan membandingkan ukuran dan kestabilan partikel setelah proses sonikasi dan pengeringan. Hasil sonikasi menunjukkan sampel dengan penambahan TPP berbusa sedangkan sampel tanpa penambahan TPP tidak berbusa (Gambar 4). Tripolifosfat merupakan senyawa pengkelat yang dijadikan bahan baku pembuatan deterjen. Fosfat memiliki fungsi antara lain meningkatkan emulsifikasi serta mengurangi penggunaan surfaktan (Madsen et al.2001).
Sampel hasil ultrasonikasi dikeringkan dengan dua cara yaitu pengeringan beku dan pengeringan semprot. Kedua cara pengeringan tersebut menghasilkan bentuk sampel kering yang berbeda. Pengeringan beku menghasilkan sampel kering berbentuk lembaran kuning seperti plastik sedangkan hasil pengeringan semprot berbentuk serbuk putih. Pengeringan beku menggunakan prinsip sublimasi air dalam bentuk beku. Sampel amorf cenderung membentuk gel apabila dikeringkan dengan pengering beku sehingga kitosan kering yang diperoleh berbentuk lembaran seperti plastik (Jennings 1999). Kitosan hasil pengeringan semprot berbentuk serbuk putih. Pengeringan semprot menggunakan panas untuk menghilangkan air pada kitosan. Penguapan dilakukan pada saat larutan sampel disemprotkan (Patel et al.
2009). Pada tahap selanjutnya, pengeringan sampel beku tidak digunakan karena tidak diperoleh gambaran partikel oleh SEM.
Gambar 4 Hasil ultrasonikasi dengan penambahan TPP selama 30 menit (a), 60 menit (b) serta tanpa penambahan TPP selama 30 menit (c) dan selama 60 menit (d).
Sampel yang telah dikeringkan dengan pengering semprot kemudian dihitung rendemennya. Rendemen dari 150 mL sampel larutan nanopartikel kitosan ditunjukkan pada Tabel 2. Secara umum, rendemen yang diperoleh setelah pengeringan baik untuk sampel nanopartikel kitosan maupun nanopartikel kitosan-TPP di bawah 50%. Rendahnya rendemen yang diperoleh disebabkan beberapa sampel menempel pada tabung pengering semprot. Hal ini disebabkan alat tidak mampu mempertahankan suhu pengeringan semprot secara stabil. Suhu pada awal penyemprotan sebesar 140 ºC (inlet) dan suhu saat sampel keluar dari tabung penguap sebesar 80 ºC (outlet). Suhu inlet di bawah 140 ºC menyebabkan sampel tidak bisa kering secara sempurna sehingga menempel pada dinding tabung pengering semprot (Zuidam & Nedovic 2010).
Pengeringan semprot banyak digunakan untuk sampel yang mengandung partikel yang larut dalam air, memiliki sifat kristalinitas dan mudah berdifusi. Selain itu, sampel yang dikeringkan dengan pengering semprot harus tahan terhadap panas (Patel et al.2009).
Tabel 2 Rendemen nanopartikel kitosan hasil pengeringan semprot pada tiap waktu sonikasi
Sampel
Rendemen 30 menit 60 menit gram % gram %
Setelah diperoleh nanopartikel kering, sampel dikarakterisasi secara fisik. Karakterisasi fisik partikel dilakukan dengan mikroskop elektron payaran (scanning electron microscopy/ SEM). Mikroskop elektron payaran digunakan untuk mengamati morfologi dan menentukan ukuran nanopartikel. Metode ini merupakan cara yang efisien dalam memperolah gambar permukaan spesimen. Cara kerja mikroskop ini adalah dengan memancarkan elektron ke permukaan spesimen. Informasi tentang permukaan partikel dapat diperoleh dengan pengenalan probe dalam lintasan pancaran elektron yang mengenai permukaan partikel. Informasi juga dapat dibawa oleh probe yang menangkap elektron pada terowongan antara permukaan partikel spesimen dengan tip
probe atau sebuah probe yang menangkap gaya dorong antara permukaan dengan tip
probe (Poole & Owens 2003). Data yang diperoleh dari SEM berupa foto dua dimensi yang menampilkan permukaan spesimen.
Menurut Kencana (2009), penentuan ukuran partikel ditentukan oleh bentuk partikel kitosan. Foto SEM pada sampel pengeringan semprot menunjukkan bahwa nanopartikel memiliki bentuk menyerupai bola. Oleh karena itu, ukuran partikel ditentukan dengan mengukur diameter nanopartikel kitosan.
Sampel pengeringan beku dan pengeringan semprot menghasilkan foto SEM yang berbeda. Nanopartikel kitosan hasil pengeringan beku tidak dapat diambil gambar partikelnya oleh SEM. Bentuk kering nanopartikel berupa membran pada sampel pengeringan beku menyebabkan sampel kurang konduktif walaupun telah diberi pelapis platina. Menurut Poole & Owens (2003), kondisi ini menyebabkan elektron yang dipancarkan pada permukaan partikel tidak dapat terdeteksi. Karena sampel pengeringan beku tidak dapat diambil foto SEM, maka metode pengeringan ini tidak digunakan pada tahap selanjutnya.
Sampel nanopartikel kitosan hasil pengeringan semprot terlihat oleh SEM berupa partikel aglomerat putih (Gambar 5). Penggumpalan ini disebabkan larutan kitosan tidak diberi surfaktan (Kencana 2009). Selain itu, jarak waktu antara sonikasi dengan pengeringan semprot yang terlalu lama dapat mengakibatkan terjadinya penggumpalan. Penggumpalan lebih banyak terjadi pada larutan kitosan yang diberi TPP dibanding tanpa penambahan TPP. Penambahan TPP mengakibatkan molekul-molekul kitosan
berikatan silang sehingga peluang terjadi penggumpalan semakin besar (Desai & Park 2005). Penggumpalan dapat dikurangi dengan mempersingkat jarak waktu antara sonikasi dengan pengeringan semprot.
Morfologi partikel kitosan berdasarkan foto SEM memiliki bentuk bulat dengan permukaan kasar dan berkerut. Nanopartikel kitosan dan nanopartikel kitosan-TPP memiliki bentuk permukaan partikel yang sama. Menurut Desai & Park (2005), penambahan TPP pada kitosan tidak akan mempengaruhi morfologi permukaan nanopartikel yang dihasilkan karena TPP hanya membentuk ikatan ionik antar molekul kitosan. Perubahan morfologi nanopartikel kitosan akan berubah apabila ada bahan pengisi dalam kitosan.
Rentang ukuran partikel dari keempat perlakuan sulit ditentukan karena banyaknya partikel yang menggumpal dan beragamnya ukuran partikel yang diperoleh (Gambar 5). Berdasarkan data foto SEM, ukuran partikel sampel kitosan dengan perlakuan penambahan TPP dan ultrasonikasi 60 menit tidak bisa ditentukan karena terjadi penggumpalan yang sangat banyak. Rentang ukuran nanopartikel yang dapat diamati disajikan dalam Tabel 3. Beragamnya ukuran partikel disebabkan tidak semua molekul kitosan terpecah pada saat ultrasonikasi. Pada bagian terluar larutan kitosan dalam Erlenmeyer tidak memperoleh energi yang cukup dari ultrasonikator untuk memecah molekul kitosan. Derajat deasetilasi kitosan juga berpengaruh terhadap pemecahan molekul. Semakin rendah derajat deasetilasi maka gugus asetil pada molekul kitosan semakin banyak sehingga bobot molekulnya semakin besar. Besarnya molekul kitosan memerlukan energi ultrasonikasi yang lebih tinggi untuk memecah molekul (Kencana 2009).
Berdasarkan hasil yang diperoleh, nanopartikel kitosan dengan ukuran terkecil dihasilkan melalui perlakuan penambahan TPP dengan ultrasonikasi selama 30 menit dan pengeringan sampel dengan pengering semprot. Perlakuan ini digunakan untuk tahap pembuatan nanopartikel ekstrak temulawak tersalut kitosan.
Tabel 3 Rentang diameter nanopartikel kitosan hasil pengeringan semprot
Perlakuan
Perlakuan waktu sonikasi 30 menit
(nm)
60 menit (nm) Kitosan
Kitosan + TPP
384 – 6900 267 - 3000
-11
Gambar 5 Foto SEM kitosan tanpa TPP sonikasi 30 menit (a), 60 menit (b) serta dengan TPP sonikasi 30 menit (c), dan 60 menit (d) pada perbesaran 3000 kali dengan skala 2,7 cm : 5000 nm. Partikel terbesar dalam lingkaran kuning dan terkecil lingkaran merah (inset).
Nanopartikel Ekstrak Temulawak Tersalut Kitosan
Nanopartikel ekstrak temulawak dibuat dengan menggunakan perlakuan terpilih pada tahap pembuatan nanopartikel kitosan yaitu penambahan TPP dan ultrasonikasi 30 menit dengan pengeringan semprot. Pembuatan sediaan nanopartikel ekstrak temulawak tersalut kitosan dilakukan dengan membandingkan dua perlakuan penambahan ekstrak temulawak sebelum ultrasonikasi 30 menit dan setelah pengeringan (dua kali ultrasonikasi). Perlakuan ini bertujuan mengamati pengaruh tahap penambahan ekstrak temulawak terhadap bentuk dan ukuran optimal nanopartikel. Perlakuan pertama adalah penyediaan nanopartikel kitosan sekaligus penambahan ekstrak temulawak dengan sekali ultrasonikasi kemudian dikeringkan. Perlakuan kedua adalah penyediaan nanopartikel kitosan terlebih dahulu dalam bentuk serbuk kemudian dilarutkan kembali dengan penambahan ekstrak temulawak diikuti oleh ultrasonikasi kedua dan dikeringkan.
Kitosan yang digunakan dalam penelitian ini memiliki bobot molekul 800 kDa sedangkan ekstrak temulawak yang digunakan merupakan ekstrak kasar dengan bobot molekul cukup besar. Akan tetapi, komponen senyawa aktif ekstrak temulawak seperti
kurkumin dan xantorizol memiliki bobot molekul lebih kecil. Kurkumin memiliki bobot molekul 368 Da sedangkan xantorizol memiliki bobot molekul 218 Da (Sidik et al.
1995). Senyawa-senyawa aktif tersebut diharapkan dapat terjerap dalam kitosan.
Kedua sampel yang telah dikeringkan dengan pengering semprot kemudian dihitung rendemennya. Sebanyak 151 mL larutan nanopartikel kitosan-ekstrak temulawak sekali ultrasonikasi diperoleh 0,862 gram nanopartikel kering sedangkan larutan nanopartikel kitosan-ekstrak temulawak dua kali ultrasonikasi dengan volume yang sama diperoleh 0,126 gram nanopartikel kering. Persentase rendemen yang diperoleh dari kedua perlakuan masih di bawah 50% (Tabel 4).
Tabel 4 Rendemen nanopartikel ekstrak temulawak hasil sekali dan dua kali ultrasonikasi
Sampel Rendemen gram % Kitosan+TPP+ekstrak
temulawak (sekali ultrasonikasi) Nanokitosan+ekstrak temulawak (dua kali ultrasonikasi)
0,862
0,126
37,48
5,47
a b
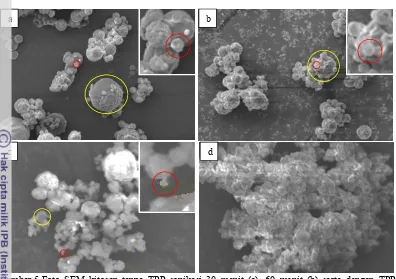
Kedua sampel perlakuan yang telah dikeringkan kemudian dikarakterisasi dengan SEM. Hasil foto SEM menunjukkan perlakuan penambahan ekstrak temulawak setelah pengeringan (dua kali ultrasonikasi) terlihat lebih seragam daripada perlakuan penambahan ekstrak temulawak sebelum ultrasonikasi. Selain itu, rentang ukuran partikel pada perlakuan kedua lebih kecil dengan diameter partikel 400 – 3600 nm sedangkan rentang ukuran partikel pada perlakuan pertama berkisar 400 – 5000 nm (Gambar 6). Hasil ini menunjukkan bahwa ultrasonikasi kedua masih dapat memecah partikel kitosan-ekstrak temulawak. Perbedaan keseragaman nanopartikel antara kedua sampel disebabkan proses pemberian energi ultrasonikasi untuk pemecahan partikel pada sampel dua kali ultrasonikasi lebih banyak dibandingkan dengan satu kali ultrasonikasi. Akan tetapi, ukuran partikel terkecil yang diperoleh dari kedua perlakuan relatif sama yaitu sebesar 400 nm.
Indikasi penyalutan ekstrak temulawak oleh kitosan dapat dilihat dari morfologi nanopartikel yang dihasilkan dari foto SEM. Menurut Desai & Park (2005), nanokitosan yang telah terisi dengan senyawa obat memiliki bentuk seperti bola dan morfologi permukaan partikel yang lebih halus. Nanokitosan yang tidak terisi dengan senyawa obat cenderung memiliki bentuk tidak beraturan dan memiliki morfologi permukaan partikel yang cekung. Selain itu, konsentrasi TPP yang ditambahkan akan mempengaruhi porositas kitosan. Semakin tinggi konsentrasi TPP menyebabkan ikatan silang dengan kitosan semakin banyak sehingga pori-pori kitosan-TPP semakin kecil. Ukuran pori kitosan-TPP yang terlalu kecil dapat menyebabkan ekstrak temulawak sulit masuk ke dalam kitosan.
Berdasarkan hasil yang diperoleh pada kedua tahap penelitian, ukuran nanopartikel kitosan kosong lebih kecil dibandingkan nanopartikel kitosan yang terisi oleh ekstrak temulawak dengan waktu sonikasi yang sama. Nanopartikel kitosan kosong dengan penambahan TPP pada awal penelitian memiliki rentang ukuran 267 - 3000 nm sedangkan ukuran nanopartikel kitosan-ekstrak temulawak antara 400 - 5000 nm. Data tersebut memperlihatkan bahwa pengisian ekstrak temulawak ke dalam nanopartikel kitosan mengakibatkan ukuran partikel menjadi lebih besar.
Mekanisme penjerapan ekstrak temulawak diduga merupakan penjerapan fisik dengan bantuan energi ultrasonikasi. Hal ini disebabkan senyawa aktif dalam ekstrak temulawak dan kitosan tidak memiliki muatan sehingga tidak ada ikatan ionik yang terjadi. Menurut Mi et al. (1999), kitosan akan berikatan silang dengan TPP membentuk butiran manik-manik yang memiliki pori-pori. Pori-pori tersebut dapat digunakan untuk menjerap bahan seperti logam atau obat-obatan. Berdasarkan penelitian Kencana (2009), energi ultrasonikasi dapat memberikan tekanan terhadap partikel ekstrak temulawak sehingga masuk dalam kitosan melalui pori-pori hasil ikatan silang partikel kitosan dengan TPP. Akan tetapi, diperlukan penelitian lanjutan mengenai mekanisme penjerapan ekstrak temulawak oleh nanopartikel kitosan.
Hasil perbandingan kedua perlakuan tersebut menunjukkan teknik penambahan ekstrak temulawak setelah diperoleh nanopartikel kitosan kering dengan ultrasonikasi 30 menit menghasilkan rentang ukuran lebih kecil. Selanjutnya, teknik ini akan digunakan untuk menentukan pengaruh waktu ultrasonikasi 60 menit terhadap ukuran nanopartikel ekstrak temulawak.
Gambar 6 Foto SEM nanopartikel temulawak dengan sekali ultrasonikasi (a) dan dua kali ultrasonikasi 30 menit (b) pada perbesaran 4000 kali dengan skala 3,1 cm : 5000 nm. Partikel terbesar dalam lingkaran kuning sedangkan partikel terkecil dalam lingkaran merah (inset).
13
Pengaruh Ultrasonikasi 30 menit dan 60 menit
Nanopartikel ekstrak temulawak tersalut kitosan yang memiliki keseragaman tinggi dan ukuran terkecil diperoleh dengan perlakuan dua kali ultrasonikasi selama 30 menit. Akan tetapi belum diketahui apakah penambahan waktu ultrasonikasi masih berpengaruh terhadap ukuran nanopartikel ekstrak temulawak dengan teknik penambahan ekstak temulawak setelah terbentuk nanopartikel kitosan kering. Variasi waktu sonikasi selama 30 menit dan 60 menit dilakukan untuk mengetahui apakah ukuran nanopartikel ekstrak temulawak masih bisa dioptimalkan dengan penambahan waktu ultrasonikasi.
Kedua sampel nanopartikel kitosan-ekstrak temulawak kering yang diperoleh diamati ukuran dan morfologi partikel dengan SEM. Hasil foto SEM yang diperoleh menunjukkan nanopartikel ekstrak temulawak dengan dua kali ultrasonikasi selama 30 menit memiliki rentang ukuran 647 - 3529 nm sedangkan sampel yang sama dengan waktu ultrasonikasi 60 menit berukuran 470 – 3000 nm (Gambar 7). Perbedaan ukuran ini memperlihatkan bahwa masih ada efek pemecahan molekul kitosan yang dihasilkan dari penambahan waktu ultrasonikasi. Menurut Kencana (2009), semakin lama waktu ultrasonikasi menyebabkan energi yang dikeluarkan oleh ultrasonikator dapat diterima
oleh semua partikel dalam larutan kitosan. Pemecahan molekul kitosan ini terjadi apabila frekuensi gelombang yang dikeluarkan ultrasonikator mengalami resonansi dengan frekuensi molekul kitosan. Resonansi merupakan peristiwa ikut bergetarnya suatu benda akibat gelombang dari sumber (Tipler 1998).
Keragaman ukuran nanopartikel ekstrak temulawak tersalut kitosan yang diperoleh pada penelitian ini cukup besar. Menurut Poulain & Nakache (1997), keragaman ini dapat dikurangi dengan ultrafiltrasi atau ultrasentrifugasi. Ultrafiltrasi dengan alat mikrokonsentrator yang dilengkapi membran ultrafiltrasi dapat memisahkan nanopartikel dengan mikropartikel. Mikrokonsentrator ini bahkan dapat digunakan untuk seleksi nanopartikel yang telah terisi atau belum terisi. Ultrasentifugasi dengan pendingin pada kecepatan 20.000 rpm selama 45 menit dapat memisahkan nanopartikel yang telah terisi pada bagian pelet dan nanopartikel yang tidak terisi pada bagian supernatan.
Letak ekstrak temulawak tidak dapat diketahui dari foto SEM. Salah satu metode yang dapat digunakan untuk menentukan gugus fungsi senyawa adalah FTIR. Menurut Bisht et al. (2007) dan Poulain & Nakache (1997), FTIR dapat digunakan untuk menentukan keberadaan polimer yang dijadikan sebagai bahan pengisi.
Gambar 7 Foto SEM nanopartikel temulawak sonikasi 30 menit (a) dan sonikasi 60 menit (b) pada perbesaran 2000 kali serta sonikasi 30 menit (c) dan sonikasi 60 menit (d) pada perbesaran 10000 kali dengan skala 1,7 cm : 1000 nm. Partikel terkecil ditunjukkan dengan lingkaran merah sedangkan partikel terbesar ditunjukkan dengan lingkaran kuning.
c d
Gugus Fungsi Spesifik Nanopartikel Ekstrak Temulawak
Penentuan keberadaan ekstrak temulawak dalam kitosan sangat diperlukan untuk mengetahui kemampuan penyalutan. Salah satu metode yang dapat digunakan untuk menentukan keberadaan ekstrak temulawak adalah FTIR. Spektrum infra merah dapat mendeteksi keberadaan gugus fungsi yang digunakan untuk identifikasi senyawa dalam suatu sampel polimer (Zhang et al. 2007). FTIR yang digunakan pada penelitian ini menggunakan bilangan gelombang tingkat menengah yaitu antara 4000–200 cm-1. Pembanding yang digunakan pada penelitian ini adalah standar kurkumin. Hal ini disebabkan belum adanya data FTIR standar ekstrak temulawak. Kurkumin digunakan sebagai pembanding karena merupakan salah satu senyawa aktif yang terdapat dalam ekstrak temulawak (Wahyudi 2006).
Prinsip kerja FTIR berdasarkan pada serapan atau transmitan sinar infra merah oleh molekul penyusun suatu senyawa pada sampel. Apabila frekuensi dari suatu vibrasi gugus fungsi sama dengan frekuensi radiasi sinar infra merah maka molekul akan menyerap sinar tersebut. Hal ini menyebabkan tidak semua sinar infra merah diserap oleh molekul, sebagian lainnya diteruskan (Kencana 2009). Data yang diperoleh dari alat ini berupa grafik serapan dan transmitan dari sampel.
Menurut Wahyudi (2006), kurkumin memiliki gugus fungsi spesifik yaitu C-H ulur, C-H tekuk, C-C, C=C, -OH, C-O, dan C=O sedangkan gugus fungsi khas yang terdapat pada kitosan murni adalah gugus amida (-NH2) dan hidroksil (-OH) (Bumkhar &
Pokharkar 2006, Firdaus et al. 2008). Bilangan gelombang tiap gugus fungsi
spesifik dari kurkumin dan kitosan ditunjukkan pada Tabel 5.
Grafik transmitan hasil FTIR nanokitosan murni pada penelitian ini menunjukkan adanya gugus amida pada bilangan gelombang 1575 cm-1. Gugus yang sama terlihat juga pada sampel nanopartikel ekstrak temulawak dengan sonikasi 30 dan 60 menit yaitu pada bilangan gelombang 1576 cm-1dan 1572 cm-1 (Gambar 8). Gugus fungsi hidroksil pada sampel nanokitosan murni muncul pada bilangan gelombang 3415 cm-1 (Tabel 5). Menurut Bumkhar & Pokharkar (2006) dan Firdaus et al. (2008), gugus hidroksil pada kitosan akan muncul pada bilangan gelombang sekitar 3450 cm-1 karena adanya interaksi regangan vibrasi antara gugus hidroksil dengan gugus amida pada kitosan.
Berdasarkan grafik FTIR yang diperoleh, gugus fungsi khas yang terdapat pada kurkumin seperti gugus fungsi C=O, C=C, dan C-H tekuk tidak terdeteksi pada sampel nanopartikel ekstrak temulawak dengan ultrasonikasi 30 menit maupun 60 menit. Akan tetapi terjadi pergeseran gugus fungsi – OH, -NH2, C-O, dan C-H ulur pada sampel
nanopartikel ekstrak temulawak dibandingkan dengan standar kitosan. Pergeseran panjang gelombang tersebut disebabkan adanya interaksi antara gugus fungsi lain selain gugus fungsi kitosan (Colthup et al. 1975). Gugus fungsi spesifik kurkumin yang tidak terdeteksi pada sampel nanopartikel ekstrak temulawak disebabkan konsentrasi ekstrak temulawak yang digunakan dalam metode ini sangat sedikit yaitu 5%. Keberadaan kurkumin dapat terlihat dari warna kuning sediaan nanopartikel ekstrak temulawak kering. Analisis lanjutan menggunakan XRD diperlukan untuk membuktikan adanya senyawa pengisi dalam kitosan.
Tabel 5 Bilangan gelombang gugus fungsi spesifik standar kurkumin, standar kitosan, sampel nanopartikel kitosan-ekstrak temulawak dengan ultrasonikasi 30 dan 60 menit
Gugus fungsi
Bilangan gelombang (cm-1)
Kurkumin Kitosan Sampel ultrasonikasi 30 menit Sampel ultrasonikasi 60 menit Literatur -OH C-H ulur C=O C=C N-H C-C C-O C-H tekuk 3509 2922 1628 1602 1429 1281 812 3415 2926 -1575 1413 1257 -3398 2925 -1576 1413 1256 -3372 2924 -1572 1411 1259 -3700-3100 3000-2700 1900-1550 1700-1550 1660-1500 1500-1430 1300-1000 880-750
15
Bilangan gelombang
T
ra
n
sm
it
an
Gambar 8 Grafik transmitan hasil FTIR untuk standar kurkumin (ungu), standar kitosan (biru), sampel nanopartikel ekstrak temulawak sonikasi 30 menit (hijau), dan nanopartikel eksrak temulawak sonikasi 60 menit (jingga).
Derajat Kristalinitas Nanopartikel Ekstrak Temulawak
Analisis XRD digunakan untuk menentukan struktur fisik bahan. Data yang diperoleh dari analisis XRD berupa grafik hubungan sudut difraksi sinar X pada bahan dengan intensitas sinar yang dipantulkan oleh bahan. Nilai derajat kristalinitas dapat diketahui dari grafik kristalinitas yang memotong bagian lembah dari grafik.
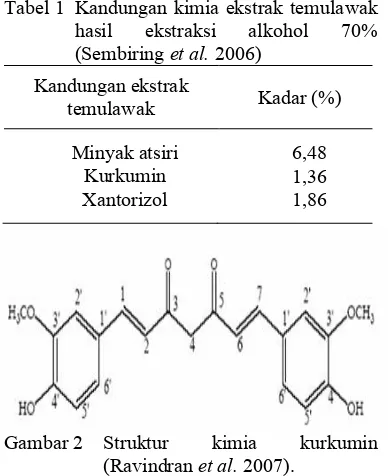
Hasil karakterisasi sampel nanopartikel dengan XRD menunjukkan sifat amorf. Sifat amorf ini menunjukkan bahwa partikel penyusun suatu molekul tersusun secara tidak beraturan dan kurang kompak. Ketidakteraturan susun