HARAP DIPERBAIKI SESUAN!!
PREVALENSI DAN KARAKTERISASI MOLEKULER
INFECTIOUS MYONECROSIS VIRUS
(IMNV) DI SENTRA
BUDIDAYA UDANG VANAME (
Litopenaeus vannamei
) DI
PROPINSI BANTEN
RONA CHOIRUZ ZAUJAT
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Prevalensi dan Karakterisasi Molekuler Infectious Myonecrosis Virus (IMNV) di Sentra Budidaya Udang Vaname (Litopenaeus vannamei) di Propinsi Banten adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
RONA CHOIRUZ ZAUJAT. Prevalensi dan Karakterisasi Molekuler Infectious Myonecrosis Virus (IMNV) di Sentra Budidaya Udang Vaname (Litopenaeus vannamei) di Propinsi Banten. Dibimbing oleh SURACHMI SETIYANINGSIH dan ANGELA MARIANA LUSIASTUTI.
Udang vaname Pasifik (Litopenaeus vannamei) merupakan udang hasil introduksi yang berkembang baik dan memasyarakat di Indonesia sebagai spesies udang budidaya alternatif selain spesies udang lokal, udang windu (Penaeus monodon) dan udang jerbung (P. merguensis). Saat ini udang vaname telah dibudidayakan secara komersil hampir di seluruh propinsi di Indonesia.
Penyakit myonecrosis menjadi satu di antara empat penyakit virus signifikan yang menyerang industri budidaya udang vaname di Indonesia: taura syndrome virus (TSV), white spot syndrome virus (WSSV), infectious myonecrosis virus (IMNV), dan infectious hypodermal and hematopoietic necrosis virus (IHHNV). Wabah myonecrosis pada udang vaname berkontribusi pada turunnya produksi udang di Indonesia dan dunia. Myonecrosis disebabkan oleh infectious myonecrosis virus yang termasuk ke dalam famili Totiviridae, berbentuk icosahedral, diameter 40 nm, merupakan virus dsRNA dengan panjang 8223 – 8230 bp. Pola infeksi IMNV bersifat persisten, kronis dan progresif. Deteksi IMNV dini secara molekuler diperlukan untuk penanganan lebih lanjut untuk mencegah kerugian dan penyebaran penyakit yang lebih luas.
Penelitian ini bertujuan untuk mendeteksi secara dini menggunakan metode real time PCR (qRT-PCR) dan menduga prevalensi IMNV di Banten serta karakterisasi molekuler isolat IMNV lapang Banten. Penelitian dilakukan pada bulan Maret – Juni 2015. Pengambilan sampel dilakukan di 24 tambak aktif di empat sentra budidaya udang vaname di Propinsi Banten.
Deteksi IMNV pada sampel subklinis menunjukkan metode qRT-PCR mampu mendeteksi secara dini infeksi myonecrosis pada udang vaname. Delapan sampel menunjukkan hasil positif IMNV dengan jumlah salinan 3.44 – 24.72 salinan IMNV/µl. Limit deteksi qRT-PCR hingga <101salinan/µl sedangkan metode RT-PCR memiliki limit deteksi 102– 103 salinan/µl.
Prevalensi IMNV secara keseluruhan di Propinsi Banten adalah 33.3% sedangkan prevalensi di masing-masing sentra budidaya udang vaname yaitu Kota Serang 0%, Kabupaten Serang 0%, Kabupaten Tangerang 14.3% dan Kabupaten Pandeglang 100%. Hasil pairwise comparison sekuens nukleotida parsial ORF1 (fragmen 740 – 1118) isolat Brazil dan isolat lapang Banten memiliki persentase kemiripan 97.9 – 99.2% dan sekuens asam amino menunjukkan persentase kemiripan 99.2 –100%. Hasil pairwise comparison isolat Indonesia dan isolat lapang Banten memiliki persentase kemiripan 98.9 – 99.7% dan sekuens asam amino menunjukkan persentase kemiripan 98.4 –100%. Percabangan pohon filogenetik menunjukkan bahwa telah terjadi diversifikasi genetik antara IMNV Indonesia dan Brazil. Analisis filogenetik juga menunjukkan terjadi variasi pada isolat Indonesia yang masing-masing berkembang membentuk cabang tersendiri terpisah dari kelompok isolat Brazil.
SUMMARY
RONA CHOIRUZ ZAUJAT. Prevalence and Molecular Characterization of Infectious Myonecrosis Virus (IMNV) in White Shrimp (Litopenaeus vannamei) Farm Sites in Banten Province. Supervised by SURACHMI SETIYANINGSIH and ANGELA MARIANA LUSIASTUTI.
Pacific white shrimp (Litopenaeus vannamei) was initially introduced in Indonesia as an alternative species for aquaculture besides local shrimp species tiger shrimp (Penaeus monodon) and udang jerbung (P. merguensis). At present, white shrimp has been cultured commercially in almost provinces in Indonesia.
Myonecrosis has become one of four significant virus diseases attacked white shrimp industry in Indonesia, i.e.: taura syndrome virus (TSV), white spot syndrome virus (WSSV), infectious myonecrosis virus (IMNV), and infectious hypodermal and hematopoietic necrosis virus (IHHNV). Myonecrosis outbreak in white shrimp contributes in declining production yield in Indonesia and worldwide. The causative agent of myonecrosis disease is infectious myonecrosis virus (IMNV), was classified in the member of family Totiviridae, icosahedral viral particles with a 40 nm diameter, double-stranded RNA molecule of 8223 – 8230 bp. The infection pattern of IMNV is persistent, chronic and progressive. Early detection is necessary for further handling to prevent loss and wider disease transmission.
The aim of this study is early detection of IMNV using real time PCR (qRT-PCR) method, to investigate the prevalence and to characterize local IMNV isolate molecularly. The research was accomplished from March to June 2015. Samples was collected from 24 active shrimp farms in four districts in Banten province.
IMNV detection in subclinical samples showed that qRT-PCR method is useful for early detection of IMNV in the samples. Eight samples showed positive results with 3.44 – 24.72 IMNV copies/µl. Detection limit of qRT-PCR is <101copies/µl whereas RT-PCR method has detection limit 102– 103copies/µl.
Overall prevalence of IMNV in Banten province was 33.3%; Serang city 0%; Serang district 0%; Tangerang district 14.3%; and Pandeglang district 100%. Pairwise comparison of partial ORF1 (fragment 740 – 1118) of Banten isolate shared 97.9 – 99.2% nucleotide or 99.2 – 100% amino acid sequence identities with Brazil isolates. Pairwise comparison of partial ORF1 (fragment 740 – 1118) of Banten isolate shared 98.9 – 99.7% nucleotide or 98.4 – 100% amino acid sequence identities with other Indonesia isolates. Phylogenetic analysis of nucleotide sequences demonstrate a clear genetic diversification of IMNV between Indonesia and Brazil, as well as within Indonesia isolates.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi Medik
PREVALENSI DAN KARAKTERISASI MOLEKULER
INFECTIOUS MYONECROSIS VIRUS
(IMNV) DI SENTRA
BUDIDAYA UDANG VANAME (
Litopenaeus vannamei
) DI
PROPINSI BANTEN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Judul Tesis :Prevalensi dan Karakterisasi Molekuler Infectious Myonecrosis Virus (IMNV) di Sentra Budidaya Udang Vaname (Litopenaeus vannamei) di Propinsi Banten
Nama : Rona Choiruz Zaujat NIM : B253130171
Disetujui oleh Komisi Pembimbing
Drh.Surachmi Setiyaningsih, Ph. D Ketua
Dr. Drh.Angela M Lusiastuti, M. Si Anggota
Diketahui oleh
Ketua Program Studi Mikrobiologi Medik
Prof. Dr.Drh. Fachriyan H Pasaribu
Dekan Sekolah Pascasarjana IPB
Dr. Ir. Dahrul Syah, M. Sc Agr
PRAKATA
Segala puji dan syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga studi dan tesis ini dapat diselesaikan dengan baik. Shalawat dan salam senantiasa tercurahkan kepada Rasulullah Muhammad SAW.
Penulis mengucapkan terima kasih kepada Ibu Drh. Surachmi Setiyaningsih, Ph. D selaku ketua komisi pembimbing dan Ibu Dr. Drh. Angela Mariana Lusiastuti M. Si selaku anggota komisi pembimbing yang telah bersabar meluangkan waktu dalam memberikan masukan dan saran dalam proses pembimbingan dan penyelesaian tesis. Terima kasih penulis ucapkan kepada Bapak Prof. Dr. Drh. Fachriyan Hasmi Pasaribu selaku ketua program studi Mikrobiologi Medik serta seluruh dosen program studi Mikrobiologi Medik beserta tenaga kependidikan yang turut membantu dan mendukung secara penuh dan konsisten sehingga masa studi dan penelitian dapat diselesaikan dengan baik oleh penulis.
Terima kasih kepada Lembaga Pengelola Dana Pendidikan (LPDP), Kementerian Keuangan, yang telah mempercayakan dan memberikan Beasiswa Pendidikan Indonesia dan kesempatan bagi penulis untuk dapat menjalani proses pendidikan magister di Sekolah Pascasarjana IPB.Terima kasih kepada Loka Pemeriksaan Penyakit Ikan dan Lingkungan (LP2IL) Serang dan Instalasi Penelitian dan Pengembangan Pengendalian Penyakit Ikan, Badan Penelitian dan Pengembangan Budidaya Air Tawar Kementerian Kelautan dan Perikanan (IP4I BPPBAT KKP) Depok yang telah memfasilitasi dan mendukung penuh terhadap kegiatan penelitian yang penulis lakukan.
Terima kasih kepada Bapak dan Ibu, dan suami tercinta yang telah memberikan dorongan, semangat, dan doaselama penulis menempuh masa studi dan penelitian. Terima kasih kepada keluarga besar yang telah turut memotivasi dan menginspirasi penulis selama menjalani perkuliahan.Terima kasih kepada teman-teman kelas MKM Reguler tahun 2013 yang selalu kompak, semangat, dan sukacita dalam menempuh pendidikan magister bersama. Terima kasih kepada seluruh teman-teman MKM semua angkatan yang telah banyak membantu dan memberi saran serta masukan saat masa pendidikan di Program Studi Mikrobiologi Medik, Sekolah Pascasarjana Institut Pertanian Bogor.
Semoga segala bantuan, dukungan, motivasi dan perhatian dari semua pihak yang telah diberikan dengan tulus kepada penulis mendapat imbalan yang setimpal dari Allah SWT. Penulisan tesis ini masih jauh dari sempurna sehingga diharapkan adanya saran dan kritik membangun di masa mendatang. Semoga tesis ini dapat bermanfaat bagi semua pihak dan bagi perkembangan ilmu pengetahuan.
DAFTAR ISI
Deteksi IMNV menggunakan Metode Real Time-PCR (qRT-PCR) 11
Amplifikasi gen ORF1 IMNV 12
Visualisasi Produk PCR dengan Gel Elektroforesis 13
Sekuensing DNA 13
Karakterisasi Molekuler IMNV Isolat Lapang Banten 19
5 KESIMPULAN DAN SARAN 23
Kesimpulan 23
DAFTAR PUSTAKA 25 Lampiran 1 Multiple sequence alignment nukleotida fragmen gen ORF1 29 Lampiran 2 Persentase kemiripan (similarity) sekuens IMNV 30
Lampiran 3 BLAST NCBI IMNV isolat lapang Banten 31
Lampiran 4 Kromatogram sekuens forward dan reverse isolat lapang Banten 31 Lampiran 5 Sekuens nukleotida dan asam amino parsial isolat lapang Banten 31
DAFTAR TABEL
1 Daftar inang IMNV 6
2 Jumlah sampel tambak udang di Propinsi Banten 11
3 Sekuens primer IMNV metode RT-PCR 12
4 Konsentrasi salinan dan nilai CT sampel Kabupaten Serang 15 5 Konsentrasi salinan dan nilai CT sampel Kabupaten Tangerang
Kecamatan Kronjo 16
6 Konsentrasi salinan dan nilai CT sampel Kabupaten Tangerang Kecamatan Kemiri, Kota Serang, dan Kabupaten Pandeglang 17
7 Prevalensi IMNV di Propinsi Banten 18
DAFTAR GAMBAR
1 Virion IMNV 5
2 Sketsa genom dan ORF IMNV 5
3 Udang dengan gejala klinis IMNV 6
4 Cara kerja Real Time PCR (qRT-PCR) 8
5 Peta lokasi sentra budidaya Propinsi Banten 9
6 Layout pertambakan di Kabupaten Pandeglang 10
7 Uji qRT-PCR sampel Kabupaten Serang 15
8 Uji qRT-PCR sampel Kabupaten Tangerang Kecamatan Kronjo 16 9 Uji qRT-PCR sampel Kabupaten Tangerang Kecamatan Kemiri, Kota
Serang, dan Kabupaten Pandeglang 17
10 Gel elektoroforesis IMNV isolat lapang 19
11 Sampel udang 20
12 Uji qRT-PCR sampel koleksi tambak Kabupaten Pandeglang
Kecamatan Tegalpapak 20
13 Gel elektroforesis sampel udang koleksi tambak Kabupaten
Pandeglang Kecamatan Tegalpapak 21
1
PENDAHULUAN
Latar Belakang
Budidaya udang menjadi mata pencaharian utama lebih dari enam juta penduduk di wilayah pesisir Indonesia dan berkontribusi besar terhadap total ekspor produk perikanan Indonesia. Kementerian Kelautan dan Perikanan masih menempatkan udang sebagai komoditas ekspor perikanan budidaya terbesardengan nilai lebih dari US$ 1 juta pada tahun 2010. Produksi udang yang terdiri dari udang vaname (Litopenaeus vannamei) dan udang windu (Penaeus monodon) diproyeksikan naik sebesar 74.75% dari 400 ribu ton pada tahun 2010 menjadi 699 ribu ton pada tahun 2014. Namun perkembangan produksi udang vaname secara nasional selama 4 tahun terakhir kurang baik dan cenderung fluktuatif, salah satunya disebabkan oleh serangan penyakit yang menurunkan produksi udang per tahun rata-rata sebesar 32.83%.
Masalah yang dihadapi budidaya intensif udang vaname adalah populasi udang rentan terkena penyakit. Salah satunya adalah myonecrosisyang mampu membunuh hingga 70% populasi udang dan saat ini menjadi salah satu penyakit penting yang telah mempengaruhi industri budidaya udang vaname di Indonesia dan di dunia.
Myonecrosis pertama kali menyerang udang vaname di Brazil pada tahun 2002 dan telah mengakibatkan kerugian ekonomi hingga US$ 120 juta pada industri udang di Brazil.Di Indonesia, myonecrosis pertama kali dilaporkan terjadi di Situbondo pada tahun 2006 dengan gejala klinis berupa jaringan otot berwarna putih akibat nekrosis ekstensif, khususnya bagian punggung dan ekor, serupa dengan kejadian wabah myonecrosis di Brazil (Senapin et al. 2007). Berdasarkan data paparan publik PT Central Proteinaprima (CPP) tahun 2010, dalam waktu 9 bulan perusahaan merugi hingga 42% akibat serangan IMNV dengan kerugian material lebih dari 300 milyar rupiah yang disebabkan oleh menurunnya volume penjualan udang di dalam dan di luar negeri (CPP 2010). Produksi udang di Indonesia sejak tahun 1980 mencapai puncaknya di tahun 2008 hingga ± 450 ribu ton kemudian menurun drastis menjadi ± 350 ribu ton akibat serangan IMNV pada tahun 2009 (Naim et al. 2014).
Penyakit myonecrosis biasanya terjadi secara akut di tambak, dengan kematian tinggi dan gejala klinis pada udang muda, kemudian menjadi kronis dengan kematian mencapai 40 – 70% (Lightner 2012). Gejala klinis meliputi memutihnya segmen abdominal bagian terakhir dan kipas ekor yang kaya akan otot skeletal yang menjadi organ target IMNV. Transmisi horizontal IMNV terjadi karena kanibalisme dan melalui air, sedangkan transmisi vertikal diduga terjadi dari induk ke benurnya (Naim et al. 2014).
2
Keberadaan IMNV di Indonesia diduga berasal dari Brazil melalui impor induk atau benur untuk kepentingan budidaya udang. Sumber asli infeksi belum diketahui tetapi penyebaran trans-benua hampir dapat dipastikan menjadi penyebab kejadian myonecrosis di Indonesia karena tingginya frekuensi perdagangan induk udang vaname (Senapin et al. 2007; Walker dan Winton 2010; Lightner 2012; Naim et al. 2014). Hasil sekuensing sampel IMNV isolat lapang yang berasal dari Situbondo dan Lampung, keduanya memiliki kemiripan dengan isolat Brazil dan Indonesia hingga 99% dengan gejala klinis yang ditimbulkan akibat infeksi IMNV pada kedua isolat tersebut mirip dengan gejala klinis IMNV Brazil (Widowati 2013).
Perumusan Masalah
Infectious myonecrosis virus (IMNV) adalah salah satu agen penyakit penting pada industri budidaya udang vaname di Indonesia dan berdampak ekonomi serta sosial yang besar karena menyebabkan kematian tinggi pada udang budidaya dan memerlukan biaya penanggulangan yang tinggi jika area tambak sudah terinfeksi myonecrosis.
Penyakit myonecrosis merupakan salah satu ancaman bagi usaha budidaya udang vaname sehingga menjadikan dasar pentingnya dilakukan penelitian mengenai prevalensi IMNVdi Propinsi Banten sebagai upaya pemantauan dini untuk pencegahan serta pengendaliannya.
Tujuan Penelitian
Tujuan penelitian ini untuk menduga prevalensi IMNV dan karakterisasi molekuler isolat IMNV di sentra budidaya udang vaname di Propinsi Banten.
Hipotesis Penelitian
Penyakit myonecrosis pada udang putih sudah menyebar di sentra budidaya udang vaname di Propinsi Banten dan virus penyebabnya mempunyai kekerabatan yang lebih dekat dengan isolat Indonesia lainnya daripada dengan isolat Brazil.
Manfaat Penelitian
3 Ruang Lingkup Penelitian
Pada penelitian ini dilakukan serangkaian kegiatan mencakup koleksi sampel dari pertambakan di sentra budidaya udang vaname Propinsi Banten, pooling sampel, ekstraksi RNA, uji Real Time Reverse Transcriptase Polymerase Chain Reaction (qRT-PCR), amplifikasi IMNV dan karakterisasi molekuler IMNV isolat lapang menggunakan metode sekuensing DNA.
2
TINJAUAN PUSTAKA
Infectious Myonecrosis
Sejarah Infeksi Myonecrosis
Pada bulan Agustus tahun 2002, penyakit infeksius baru teridentifikasi dari udang putih Pasifik, Litopenaeus vannamei (disebut juga Penaeus vannamei) (Farfante dan Kensley 1997; Holthuis 1980) di Piauí, daerah pesisir pantai Timur Laut Brazil. Diagnosa awal dari penyakit ini adalah sindrom otot kram yang disebabkan oleh defisiensi nutrisi, keracunan pakan, atau ketidakseimbangan ion air.Penyakit ini awalnya disebut sebagai camarăo zumbi (udang zumbi) atau camarăo morto-vivo (udang hampir mati) karena udang dengan infeksi lanjut menunjukkan gejala klinis otot ekor memutih dan sebagian udang menunjukkan gejala klinis kemerahan di segmen abdominal ke-5 dan/atau ke-6, di telson dan uropod sebagai manifestasi penyakit ini kemudian berkembang teori baru dan penyakitnya diberi nama idiopathic muscle necrosisatau necrose idiopatica muscular (NIM) (Andrade 2009).
Evaluasi performa produksi enam tambak terbesar di Brazil yang terinfeksi IMNV bulan Januari – Juni 2002 dan 2003 menunjukkan penurunan survival udang rata-rata tiap tambak 34.1% dan dari enam tambak tersebut rata-rata penurunan survival udang hingga 45.1%. Pada semester pertama tahun 2003, kerugian di Piauí mencapai 35%. Periode ini merupakan serangan wabah yang intens dengan total kerugian mencapai 0.8% dari produksi nasional. Faktor lingkungan yang sering dikaitkan dengan serangan penyakit baru ini antara lain menurunnya level oksigen terlarut, fluktuasi suhu dan salinitas yang ekstrim saat musim hujan dan meningkatnya bahan organik. Serangan IMNV lebih parah terjadi saat fase bulan purnama dan bulan baru saat aktivitas molting sedang pada puncaknya. Penyakit ini juga terdeteksi di hatchery udang dengan kepadatan 35 – 120 benur/liter air dan di tambak dengan padat tebar >15 ekor udang/m2. Prevalensi infeksi IMNV pada wilayah enzootik di area budidaya udang vaname dapat mencapai 100% (Andrade 2009).
4
Association-ABCC. Strategi ini utamanya adalah pengurangan padat tebar dan aplikasi pedoman budidaya udang yang baik. Penerapan strategi yang baik menunjukkan hasil dengan meningkatnya laju survival udang vaname hingga 70% di beberapa pertambakan pada daerah yang terjangkit IMNV.Kejadian IMNV telah menyebabkan kerugian besar pada industri budidaya udang di Brazil sejak awal wabahnya sehingga IMNV dimasukkan ke dalam daftar penyakit virus udang oleh World Animal Health Organization (OIE) pada tahun 2005 (Loy 2014).
Tahun 2006 bulan Mei diketahui IMNV telah menyebar ke Asia Tenggara saat penyakit ini dilaporkan terjadi di Indonesia. Di Indonesia, IMNV dilaporkan terjadi di pulau Jawa dan Sumatera (Senapin et al. 2007; Andrade 2009). Situbondo merupakan daerah pertama kali dilaporkan kejadian IMNV di pulau Jawa, kemudian menyebar ke timur yaitu Bali dan Nusa Tenggara Barat (NTB). Pertengahan tahun 2008, IMNV menyebar ke barat yaitu di Bangka Belitung dan di Lampung.
Hasil surveilans aktif di Situbondo tahun 2006 prevalensi IMNV sebesar 11.1% (Nuraini et al. 2007) dan berdasarkan hasil penelitian Nuraini (2008) prevalensi IMNV di Jawa Timur yaitu Banyuwangi 23.07%, Situbondo 20.51%, Jember 0%, Probolinggo 23.53%, dan di kabupatan Tuban, Gresik, Lamongan sebesar 3.7%. Prevalensi IMNV tahun 2014 di Lampung Selatan sebesar 10.6% dan Banten sebesar 19.5% (Taslihan 2014).
Etiologi
Agen kausatif IMNV yang menyerang budidaya udang vaname (Litopenaeus vannamei) di Brazil adalah virus double-stranded (ds) RNA dari famili Totiviridae, tidak beramplop, berbentuk icosahedral dan memiliki panjang genom 8226 – 8230 bp (Loy 2014; Naim et al. 2015). Jika anggota lain dari family Totiviridae dikaitkan dengan infeksi laten avirulen pada inang, namun sebaliknya IMNV dikaitkan dengan infeksi yang mematikan pada udang penaeid (Lightner et al. 2004; Poulos et al.2006).
5
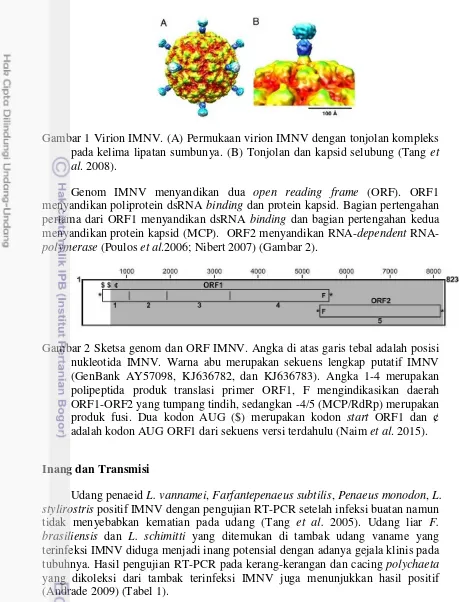
Gambar 1 Virion IMNV. (A) Permukaan virion IMNV dengan tonjolan kompleks pada kelima lipatan sumbunya. (B) Tonjolan dan kapsid selubung (Tang et al. 2008).
Genom IMNV menyandikan dua open reading frame (ORF). ORF1 menyandikan poliprotein dsRNA binding dan protein kapsid. Bagian pertengahan pertama dari ORF1 menyandikan dsRNA binding dan bagian pertengahan kedua menyandikan protein kapsid (MCP). ORF2 menyandikan RNA-dependent RNA-polymerase (Poulos et al.2006; Nibert 2007) (Gambar 2).
Gambar 2 Sketsa genom dan ORF IMNV. Angka di atas garis tebal adalah posisi nukleotida IMNV. Warna abu merupakan sekuens lengkap putatif IMNV (GenBank AY57098, KJ636782, dan KJ636783). Angka 1-4 merupakan polipeptida produk translasi primer ORF1, F mengindikasikan daerah ORF1-ORF2 yang tumpang tindih, sedangkan -4/5 (MCP/RdRp) merupakan produk fusi. Dua kodon AUG ($) merupakan kodon start ORF1 dan ¢ adalah kodon AUG ORF1 dari sekuens versi terdahulu (Naim et al. 2015).
Inang dan Transmisi
6
Tabel 1 Daftar inang IMNV. Sampel dikoleksi dari tambak udang dan infeksi buatan
Transmisi horizontal IMNV antar udang terjadi melalui kanibalisme dan transmisi melalui air. Transmisi vertikal diduga terjadi melalui induk ke larvanya walaupun belum diketahui moda transmisinya melalui transovarium atau kontaminasi telur (Lightner et al. 2004; Poulos et al. 2006; Naim et al. 2014).
Pola infeksi IMNV bersifat persisten, kronis dan progresif. Wabah IMNV biasanya muncul secara akut di tambak dengan peningkatan kematian dan gejala klinis pada benur, kemudian berkembang menjadi kronis, dengan kematian persisten 40% - 70% (Lightner et al. 2004; OIE 2015).
Gejala klinis IMNV pada udang vaname
Gejala klinis IMNV pada udang vaname adalah nekrosis ekstensif berwarna putih pada jaringan otot, khususnya pada bagian punggung dan ekor (Gambar 3), timbulnya warna putih pada jaringan otot menyerupai warna udang rebus/udang yang dimasak (Puthawibool et al. 2009).
7 Pada pemeriksaan histopatologi, lesi ditandai dengan nekrosis koagulatif di otot dengan edema pada fase akut. Pada fase pemulihan atau fase kronis, myonecrosis berkembang menjadi liquefaktif nekrosis dengan infiltrasi hemositik dan fibrosis (Lightner et al. 2004). Infeksi myonecrosis dimulai dari stadia awal juvenil atau udang dewasa di area enzootik IMNV. Wabah kematian udang dalam jumlah besar akibat infeksi myonecrosis berhubungan dengan keadaan yang beresiko menyebabkan stres seperti penangkapan dengan jaring lempar, pemberian pakan, dan perubahan salinitas secara mendadak (OIE 2015).
Diagnosis IMNV dengan Teknik Molekuler Real Time PCR (qRT-PCR)
Diagnosis patogen berbasis molekuler dimulai dari dikembangkannya metode Polymerase Chain Reaction (PCR) tahun 1983 oleh Kary Mullis . Metode PCR dapat memperbanyak sejumlah kecil salinan RNA/DNA dalam waktu beberapa jam. Metode PCR merupakan pengujian berbasis biomolekuler berupa reaksi enzimatis untuk melipatgandakan secara eksponensial suatu sekuens nukleotida tertentu secara in vitro (Sambrook dan Russel 2001). Suatu fragmen DNA (110 bp, 5×10-19 mol) dapat dilipatgandakan sebesar 200.000 kali setelah dilakukan 20 siklus reaksi selama 220 menit (Yuwono 2006).
Persyaratan dalam penggunaan metode PCR salah satunya adalah harus mengetahui bagian tertentu sekuens DNA yang akan dilipatgandakan terlebih dahulu. Sekuens yang diketahui tersebut penting untuk menyediakan primer, yaitu sekuens oligonukleotida pendek yang berfungsi mengawali sintesis rantai DNA. Empat komponen utama yang dibutuhkan untuk menjalankan suatu reaksi PCR yaitu: DNA cetakan (fragmen DNA yang akan dilipatgandakan), oligonukleotida primer yaitu suatu sekuens oligonukleotida pendek (15–25 basa nukleotida) yang digunakan untuk mengawali sintesis rantai DNA, deoksiribonukleotida trifosfat (dNTP) yang terdiri atas dATP, dCTP, dGTP, dTTP dan yang terakhir adalah enzim DNA polimerase yaitu enzim yang melakukan katalisis reaksi sintesis rantai DNA (Yuwono 2006). Deteksi produk akhir PCR dengan gel elektroforesis sehingga lebih dikenal sebagai PCR end point atau hasil pengujian baru terlihat setelah selesai keseluruhan tahapan tersebut (Sambrook dan Russell 2001).
8
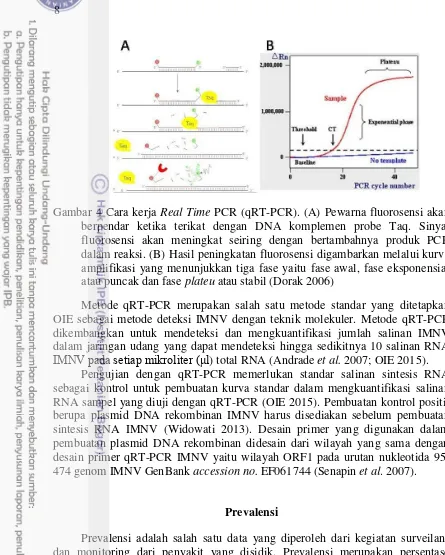
Gambar 4 Cara kerja Real Time PCR (qRT-PCR). (A) Pewarna fluorosensi akan berpendar ketika terikat dengan DNA komplemen probe Taq. Sinyal fluorosensi akan meningkat seiring dengan bertambahnya produk PCR dalam reaksi. (B) Hasil peningkatan fluorosensi digambarkan melalui kurva amplifikasi yang menunjukkan tiga fase yaitu fase awal, fase eksponensial atau puncak dan fase plateu atau stabil (Dorak 2006)
Metode qRT-PCR merupakan salah satu metode standar yang ditetapkan OIE sebagai metode deteksi IMNV dengan teknik molekuler. Metode qRT-PCR dikembangkan untuk mendeteksi dan mengkuantifikasi jumlah salinan IMNV dalam jaringan udang yang dapat mendeteksi hingga sedikitnya 10 salinan RNA
IMNV pada setiap mikroliter (μl) total RNA (Andrade et al. 2007; OIE 2015). Pengujian dengan qRT-PCR memerlukan standar salinan sintesis RNA sebagai kontrol untuk pembuatan kurva standar dalam mengkuantifikasi salinan RNA sampel yang diuji dengan qRT-PCR (OIE 2015). Pembuatan kontrol positif berupa plasmid DNA rekombinan IMNV harus disediakan sebelum pembuatan sintesis RNA IMNV (Widowati 2013). Desain primer yang digunakan dalam pembuatan plasmid DNA rekombinan didesain dari wilayah yang sama dengan desain primer qRT-PCR IMNV yaitu wilayah ORF1 pada urutan nukleotida 95-474 genom IMNV GenBank accession no. EF061744 (Senapin et al. 2007).
Prevalensi
Prevalensi adalah salah satu data yang diperoleh dari kegiatan surveilans dan monitoring dari penyakit yang disidik. Prevalensi merupakan persentase hewan yang terserang penyakit pada saat titik waktu tertentu dibandingkan dengan jumlah hewan dalam populasi (Cameron 2002; Budiharta 2002; Nuraini 2008).
9 Cameron (2002), monitoring adalah koleksi yang sistematis, analisa dan diseminasi informasi pada aras penyakit, misalnya timbulnya penyakit, insidensi dan prevalensi penyakit yang sudah diketahui ada pada populasi yang spesifik. Perbedaan mendasar antara surveilans dan monitoring menurut Cameron (2002) adalah jika surveilans mencari keberadaan penyakit baru atau eksotik yang belum terdeteksi pada populasi yang spesifik sedangkan monitoring adalah memantau perkembangan penyakit yang sudah ada dalam suatu populasi.
3
METODE
Kerangka Konsep Penelitian
Penelitian akan dilaksanakan dalam enam tahapan, yaitu pengambilan dan pooling sampel udang, ekstraksi RNA, uji Real Time Reverse Transcriptase Polymerase Chain Reaction (qRT-PCR), amplifikasi IMNV dengan Reverse Transcriptase Polymerase Chain Reaction (RT-PCR), sekuensing DNA dan analisis data secara deskriptif.
Waktu dan Tempat
Penelitian ini dilaksanakan selama empat bulan dari bulanMaret hingga Juni 2015. Pengambilan sampel udang dilakukan di sentra budidaya udang vaname di Propinsi Banten (Gambar 5). Pemeriksaan sampel dilakukan di Loka Pemeriksaan Penyakit Ikan dan Lingkungan (LP2IL) Serang dan Instalasi Penelitian dan Pengembangan Pengendalian Penyakit Ikan, Badan Penelitian dan Pengembangan Budidaya Air Tawar Kementerian Kelautan dan Perikanan (IP4I BPPBATKKP) Depok.
10
Metode Pengambilan Sampel
Penentuan jumlah sampel menggunakan rumus menduga prevalensi menurut Nuraini (2008):
Dengan,
n = jumlah sampel
P = prevalensi dugaan
Q = (1-P)
L2 = galat yang diinginkan
Nilai prevalensi dugaan 10%, tingkat kepercayaan 90% dan galat 10% sehingga diperoleh sebanyak 36 sampel. Berdasarkan data survei di lapangan, sebagian besar tambak udang vaname sedang tidak aktif akibat terkena penyakit pada siklus produksi sebelumnya atau sedang dalam masa persiapan produksi.Sampel kemudian diperoleh dari area pertambakan aktif yang berada di empat sentra budidaya udang vaname di Propinsi Banten yaitu di Kota Serang 1 tambak, Kabupaten Serang 9 tambak, Kabupaten Tangerang 7 tambak, dan Kabupaten Pandeglang 7 tambak. Total jumlah tambak udang vaname aktif di Propinsi Banten pada saat penelitian sebanyak 24 tambak dan dari masing-masing tambak dipilih 1 petak sebagai sampel sehingga total terkumpul 24 sampel. Sampel udang diambil dari satu petak per tambak berdasarkan satu blok tambak aktif memiliki perairan (saluran inlet dan outlet) yang sama (Gambar 6).
Gambar 6 Layout pertambakan di Kabupaten Pandeglang. (--) Jalur inlet. (--) Jalur outlet.
11 menggunakan metode real time PCR (qRT-PCR) (OIE 2015). Jumlah sampel udang yang diperoleh dari Banten disajikan dalam Tabel 3.
Tabel 2 Jumlah sampel tambak udang di Propinsi Banten
Lokasi Kecamatan ∑ (DNA ladder) 100 bp, loading dye, 1% ethidium bromide, etanol absolut, etanol 95%, etanol 70%, nuclease free water, dan Big Dye Terminator v3.1 Cycle Sequencing Kit.
Alat
Alat yang digunakan dalam penelitian ini adalah sectio set, pestel, cool box, refrigerated microcentrifuge (Sanyo Hawk 15/05), vortex, mini-spin, mesin AB 7500 Fast Real-Time PCR, dan mesin sequencer ABI Prism® 3130 Genetic Analyzer (Applied Biosystems®).
Deteksi IMNV menggunakan Metode Real Time-PCR (qRT-PCR)
12
RB column kemudian dipindahkan RB column ke microtube 1.5 ml baru, ditambahkan 50 µl RNAse-free water, didiamkan 2 menit, disentrifugasi 13000 × g selama 1 menit. Ekstrak RNA disimpan di dalam freezer -20 °C hingga siap digunakan.
Uji qRT-PCR terdiri dari tiga tahap. Tahap pertama menyiapkan standar IMNVdengan melakukan 5 pengenceran berseri (105– 101) standar IMNV. Tahap kedua membuat master mix PCR untuk IMNVdengan komponen yaitu 2× Template Control (NTC), 8 µl untuk setiap konsentrasi Standar, 8 µl ekstrak RNA sebagai sampel target.Total volume per reaksi sebanyak 25 µl. Tahap ketiga, amplifikasi IMNV menggunakan Applied Biosystems (AB) One Step Real-Time PCR IMNV Kit sesuai petunjuk kit. Profil amplifikasi yang digunakan yaitu suhu 48 °C selama 10 menit,suhu 95 °C selama 10 menit, 95 °C selama 15 detik 40 siklus dan suhu 60 °C selama 1 menit. Hasil uji qRT-PCR positif bila ada kurva amplifikasi yang memotong threshold dan negatif bila tidak terlihat kurva amplifikasi atau bila ada kurva amplifikasi di akhir siklus PCR namun tidak memotong threshold.
Amplifikasi gen ORF1 IMNV
Tahap pertama karakterisasi molekuler adalah amplifikasi IMNV dengan metode RT-PCR. Amplifikasi IMNV dilakukan menggunakan Qiagen® One Step RT-PCR Kit sesuai petunjuk standar kit. Campuran reaksi amplifikasi pada tabung mikro adalah Qiagen One Step RT-PCR Master Mix 2.5 µl, Qiagen One (Senapin et al. 2007). Profil amplifikasi yang digunakan sesuai metode Loy et al. 2012 yaitu suhu 95 °C selama 10 menit, 35 siklus PCR pada suhu 95 °C selama 15 detik, dan suhu 60 °C selama 1 menit.
13 Visualisasi Produk PCR dengan Gel Elektroforesis
Produk PCR (amplikon) dielektroforesis menggunakan 1.5% gel agarose. Gel diletakkan dalam electrophoresis chamber dan direndam buffer TAE 1x hingga tertutup seluruh permukaannya. Sumur pada gel diisi secara berurutan dengan marker (DNA ladder) 100 bp (Promega), kontrol negatif danpositif IMNV, dan amplikon sebanyak 10 µl per sumuran gel dari masing-masing sampel yang telah ditambahkan sebelumnya dengan 3 µl mass loading dye. Mesin elektroforesis diatur pada 220V selama 30 menit. Pita DNA kemudian tervisualisasi dalam gel agarose. Gel kemudian direndam pada ethidium bromide (EtBr) selama 10 menit. Sampel positif IMNV ditandai dengan munculnya pita pada 400 bp.Pita produk PCR didokumentasikan menggunakan Gel Doc UV Transilluminator.
Sekuensing DNA
Amplikon positif dengan primer IMNV 95F dan 474R dikirim untuk proses sekuensing DNA ke First Base Laboratories, Selangor, Malaysia. Sekuensing DNA dilakukan menggunakan BigDye® Terminator v3.1 cycle sequencing kit.Tahap pertama purifikasi amplikonmenggunakan etanol absolut di dalam Centricon®-100 columns.Sebanyak 2 ml ddH2O dimasukkan ke dalam column,
ditambahkan amplikon, kemudian disentrifugasi 3000×g selama 10 menit.Wadah penampung ampas dibuang dan tabung baru diletakkan di dalam column.Column selanjutnya dibalik dan disentrifugasi 270×g selama 2 menit. Tahap kedua adalah PCR sequencing dengan campuran reaksi 4 µl 2× Ready Reaction Premix, 2 µl 5× BigDye sequencing buffer, primer dengan konsentrasi 3.2 pmol/µl, 3-10 ng templat 1 µl, dan ddH2O sampai volume 20 µl. Profil amplifikasiyaitu pada suhu
96 ºC selama 1 menit, 25 siklus 96 ºC 10 detik, 50 ºC 5 detik, dan 60 ºC selama 4 menit.Tahap ketiga adalah purifikasi amplikon dan cycle sequencing menggunakan mesin sequencer ABI3130 Genetic Analyzer (Applied Biosystems®). Amplikon dimasukkan ke dalam Centri-Sep™ spin column kemudian ditambahkan 2 µl sodium dodecyl sulfate 2.2% dan dipanaskan pada suhu 95 ºC selama 5 menit. Campuran produk ekstensi kemudian dimasukkan ke dalam spin column dan disentrifugasi 750× g selama 2 menit untuk mengkoleksi sampel kemudian dibaca susunan oligonukleotidanya.
Analisis Data
Hasil analisis qRT-PCR diolah untuk mengetahui prevalensi IMNV di sentra budidaya udang vaname di Propinsi Banten dengan rumus berdasarkan Cameron (2002) sebagai berikut:
14
Hasil sekuensing DNA dianalisis menggunakan perangkat lunak Bioedit 7.2.5. Isolat IMNV pembanding didapatkan dari pusat data GenBank menggunakan Basic Local Alignment Search Tool (BLAST). Analisis perbandingan filogenetik neighbor-joining (distance) dilakukan menggunakan MEGA6 dengan metode maximum composite likelihood dan branch support ditentukan dengan bootstrapping (1000 ulangan). Analisis filogenetik maximum-likelihood dilakukan menggunakan program MEGA6 dengan metode nearest neighbor interchange (NNI) dan initial tree for ML dengan NJ/BioNJ (Naim et al. 2014). Hubungan kekerabatan isolat IMNV Banten dan isolat pembanding dianalisis secara deskriptif.
4
HASIL DAN PEMBAHASAN
Pertambakan udang di Propinsi Banten
Propinsi Banten memiliki empat kawasan minapolitan sebagai sentra budidaya perikanan dengan udang vaname sebagai satu di antara komoditas perikanan lainnya. Penetapan sebagai kawasan minapolitan perikanan budidaya pada tahun 2010 berdasarkan Surat Keputusan Menteri Kelautan dan Perikanan RI Nomor: KEP.32/MEN/2010 Tentang Penetapan Kawasan Minapolitan. Daerah pertambakan udang di Propinsi Banten terdapat di empat kawasan yaitu Kota Serang, Kabupaten Serang, Kabupaten Tangerang, dan Kabupaten Pandeglang. Pertambakan di Banten pada umumnya terbagi menjadi dua yaitu kelompok pembudidaya ikan (POKDAKAN) dan swasta skala besar serta satu tambak Unit Pembantu Teknis KKP. Teknologi sistem produksi di Banten adalah budidaya intensif dengan padat tebar tinggi akan tetapi pada saat penelitian dilakukan hanya tambak di Kota Serang dan di Kabupaten Pandeglang yang menerapkan budidaya intensif dengan padat tebar hingga di atas 100 ekor/m2. Tambak di Kabupaten Serang dan Kabupaten Tangerang menerapkan budidaya semi intensif dengan padat tebar <100 ekor/m2.
Tahun 2012, Kabupaten Serang dan Tangerang dijadikan proyek percontohan budidaya udang vaname (demonstrasi farming/demfarm) oleh Kementerian Kelautan dan Perikanan (KKP) yang terdiri dari 11 POKDAKAN dalam upaya peningkatan produksi perikanan budidaya di wilayah Jawa. Tahun 2013 dilaporkan terjadi kematian udang akibat serangan virus dengan gejala klinis myonecrosis yang memaksa petambak melakukan panen mendadak untuk menekan kerugian. Penyakit virus lain yang juga menyerang tambak udang di Banten adalah white spot syndrome virus (WSSV) (Taslihan 2014). Saat ini banyak tambak demfarm maupun tambak swasta di Banten yang tidak aktif akibat kerugian dari serangan wabah virus tersebut.
Deteksi IMNV menggunakan metode qRT-PCR
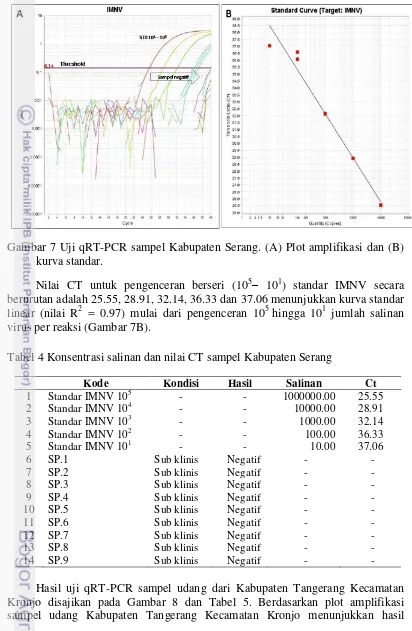
15 Kabupaten Serang menunjukkan hasil negatif. Pada gambar 7A, kurva yang memotong threshold adalah kurva pengenceran berseri (105– 101) standar IMNV.
Gambar 7 Uji qRT-PCR sampel Kabupaten Serang. (A) Plot amplifikasi dan (B) kurva standar.
Nilai CT untuk pengenceran berseri (105– 101) standar IMNV secara berurutan adalah 25.55, 28.91, 32.14, 36.33 dan 37.06 menunjukkan kurva standar linear (nilai R2 = 0.97) mulai dari pengenceran 105 hingga 101 jumlah salinan virus per reaksi (Gambar 7B).
Tabel 4 Konsentrasi salinan dan nilai CT sampel Kabupaten Serang
Kode Kondisi Hasil Salinan Ct
1 Standar IMNV 105 - - 1000000.00 25.55
2 Standar IMNV 104 - - 10000.00 28.91
3 Standar IMNV 103 - - 1000.00 32.14
4 Standar IMNV 102 - - 100.00 36.33
5 Standar IMNV 101 - - 10.00 37.06
6 SP.1 Sub klinis Negatif -
-7 SP.2 Sub klinis Negatif -
-8 SP.3 Sub klinis Negatif -
-9 SP.4 Sub klinis Negatif -
-10 SP.5 Sub klinis Negatif -
-11 SP.6 Sub klinis Negatif -
-12 SP.7 Sub klinis Negatif -
-13 SP.8 Sub klinis Negatif -
-14 SP.9 Sub klinis Negatif -
16
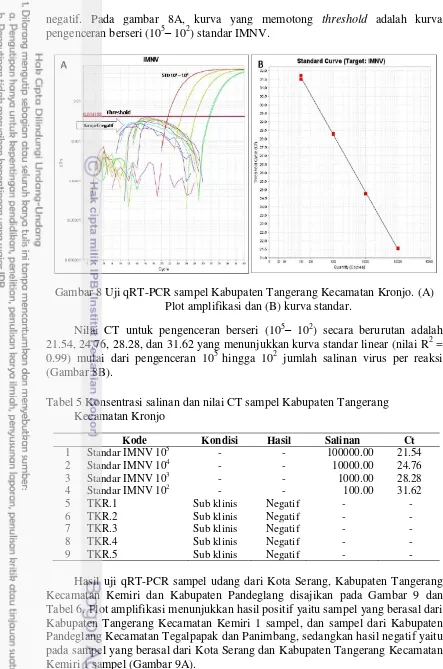
negatif. Pada gambar 8A, kurva yang memotong threshold adalah kurva pengenceran berseri (105– 102) standar IMNV.
Gambar 8 Uji qRT-PCR sampel Kabupaten Tangerang Kecamatan Kronjo. (A) Plot amplifikasi dan (B) kurva standar.
Nilai CT untuk pengenceran berseri (105– 102) secara berurutan adalah 21.54, 24.76, 28.28, dan 31.62 yang menunjukkan kurva standar linear (nilai R2 = 0.99) mulai dari pengenceran 105 hingga 102 jumlah salinan virus per reaksi (Gambar 8B).
Tabel 5 Konsentrasi salinan dan nilai CT sampel Kabupaten Tangerang Kecamatan Kronjo
Kode Kondisi Hasil Salinan Ct
1 Standar IMNV 105 - - 100000.00 21.54
2 Standar IMNV 104 - - 10000.00 24.76
3 Standar IMNV 103 - - 1000.00 28.28
4 Standar IMNV 102 - - 100.00 31.62
5 TKR.1 Sub klinis Negatif -
-6 TKR.2 Sub klinis Negatif -
-7 TKR.3 Sub klinis Negatif -
-8 TKR.4 Sub klinis Negatif -
-9 TKR.5 Sub klinis Negatif -
17
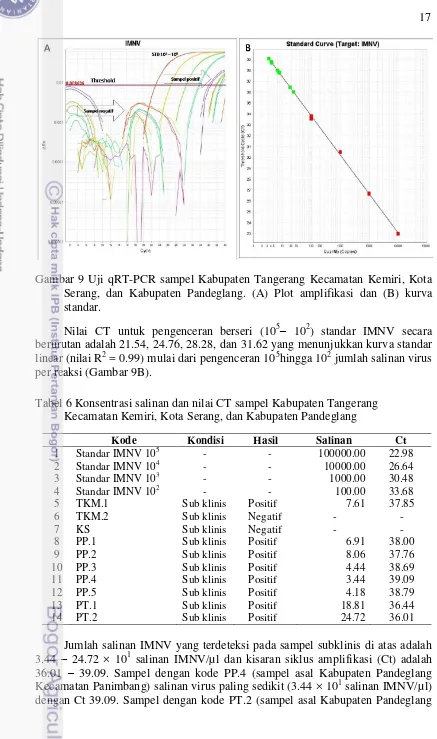
Gambar 9 Uji qRT-PCR sampel Kabupaten Tangerang Kecamatan Kemiri, Kota Serang, dan Kabupaten Pandeglang. (A) Plot amplifikasi dan (B) kurva standar.
Nilai CT untuk pengenceran berseri (105– 102) standar IMNV secara berurutan adalah 21.54, 24.76, 28.28, dan 31.62 yang menunjukkan kurva standar linear (nilai R2 = 0.99) mulai dari pengenceran 105hingga 102 jumlah salinan virus per reaksi (Gambar 9B).
Tabel 6 Konsentrasi salinan dan nilai CT sampel Kabupaten Tangerang Kecamatan Kemiri, Kota Serang, dan Kabupaten Pandeglang
Kode Kondisi Hasil Salinan Ct
1 Standar IMNV 105 - - 100000.00 22.98
2 Standar IMNV 104 - - 10000.00 26.64
3 Standar IMNV 103 - - 1000.00 30.48
4 Standar IMNV 102 - - 100.00 33.68
5 TKM.1 Sub klinis Positif 7.61 37.85
6 TKM.2 Sub klinis Negatif - -
7 KS Sub klinis Negatif - -
8 PP.1 Sub klinis Positif 6.91 38.00
9 PP.2 Sub klinis Positif 8.06 37.76
10 PP.3 Sub klinis Positif 4.44 38.69
11 PP.4 Sub klinis Positif 3.44 39.09
12 PP.5 Sub klinis Positif 4.18 38.79
13 PT.1 Sub klinis Positif 18.81 36.44
14 PT.2 Sub klinis Positif 24.72 36.01
18
Kecamatan Tegalpapak) memiliki salinan virus paling banyak (24.72 × 101 salinan IMNV/µl) dengan Ct 36. Salinan virus yang lebih banyak akan menaikkan kurva lebih cepat pada siklus amplifikasi atau dengan kata lain konsentrasi salinan virus berbanding terbalik dengan nilai Ct (Widowati 2013).
Jumlah salinan virus yang terdeteksi dengan uji qRT-PCR masih sangat sedikit karena infeksi masih terjadi di fase awal dan tidak ditemukan gejala klinis myonecrosis pada saat dilakukan pengambilan sampel akan tetapi kemudian diketahui ada kematian akibat infeksi myonecrosis di tambak dalam periode 1 hingga 2 bulan setelah waktu pengambilan sampel. Umur udang dari enam lokasi di sentra budidaya Propinsi Banten berumur kurang dari 40 hari sedangkan umur udang dari dua lokasi di Kecamatan Tegalpapak berumur di atas 40 hingga 80 hari sehingga jumlah salinan IMNV terdeteksi lebih banyak. Penyakit IMNV berkembang secara perlahan dalam tubuh udang dengan kemunculan gejala klinis myonecrosis 40 hari pasca infeksi dengan mortalitas kumulatif mencapai 40-70% (Andrade 2009). Menurut Loy (2014), jika udang terinfeksi IMNV di tambak sejak umur 20 hari dan berat tubuh 1 gram, memerlukan waktu hingga 2 bulan hingga muncul gejala klinis dan terjadi kematian akibat infeksi IMNV. Pada fase akut, jumlah salinan IMNV yang terdeteksi pada udang vaname sebanyak 105 salinan/µl (Silva et al. 2014), sedangkan pada fase kronis jumlahnya sebanyak 105
– 108 salinan/µl (Silva et al. 2011).
Prevalensi IMNV Propinsi Banten
Prevalensi IMNV di masing-masing sentra budidaya udang vaname di Propinsi Banten adalah Kota Serang 0%, Kabupaten Serang 0%, Kabupaten Tangerang 14.3% dan Kabupaten Pandeglang 100%. Prevalensi IMNV secara keseluruhan sebesar 33.3%.
Tabel 7 Prevalensi IMNV di Propinsi Banten
Lokasi Tambak aktif/total Tambak +/n Prevalensi (%)
1 Kota Serang 1/1 0/1 0.0
2 Kab. Serang 9/9 0/9 0.0
3 Kab. Tangerang 7/7 1/7 14.3
4 Kab. Pandeglang 7/7 7/7 100.0
Total 24/24 8/24 33.3 (8/24)
19 banyak tambak yang tidak operasional akibat terkena penyakit myonecrosis dan WSSV seperti halnya yang terjadi di Kab. Serang. Saat ini tambak udang vaname yang aktif di Kab. Tangerang juga menerapkan sistem budidaya semi intensif dengan padat tebar rendah. Kabupaten Pandeglang saat ini merupakan sentra budidaya udang vaname yang menerapkan sistem budidaya intensif dengan padat tebar tinggi dan jarak tambak relatif berdekatan sehingga potensi transmisi horizontal IMNV lebih tinggi dibandingkan daerah lain. Transmisi horizontal IMNV di pertambakan diduga juga terjadi akibat perairan lepas yang sudah terkontaminasi IMNV. Tambak yang terinfeksi IMNV biasanya membuang air dan udang mati langsung ke laut tanpa perlakuan sterilisasi terlebih dahulu sehingga dapat mengkontaminasi pertambakan lain yang berada di kawasan tersebut yang juga mengambil air laut yang sudah terkontaminasi sehingga infeksi virus semakin meluas.
Karakterisasi Molekuler IMNV Isolat Lapang Banten
Delapan sampel positif dari empat sentra udang vaname di Propinsi Banten tersebut kemudian diamplifikasi menggunakan RT-PCR untuk keperluan sekuensing. Visualisasi amplikon fragmen ORF1 IMNV dengan gel elektroforesis dari 8 sampel tersebut tidak memperlihatkan adanya pita 400 bp (Gambar 10). Hal tersebut bisa terjadi karena tingkat sensitifitas RT-PCR lebih rendah dibandingkan dengan qRT-PCR. Metode RT-PCR hanya dapat mendeteksi 100 salinan virus/µl, sementara qRT-PCR limit deteksinya hingga 1 salinan virus/µl (Widowati 2013).
Gambar 10 Gel elektoroforesis IMNV isolat lapang. Jalur 1-8 sampel udang, jalur 9 kontrol (-), jalur 10 kontrol (+), dan jalur M marker 100 bp.
20
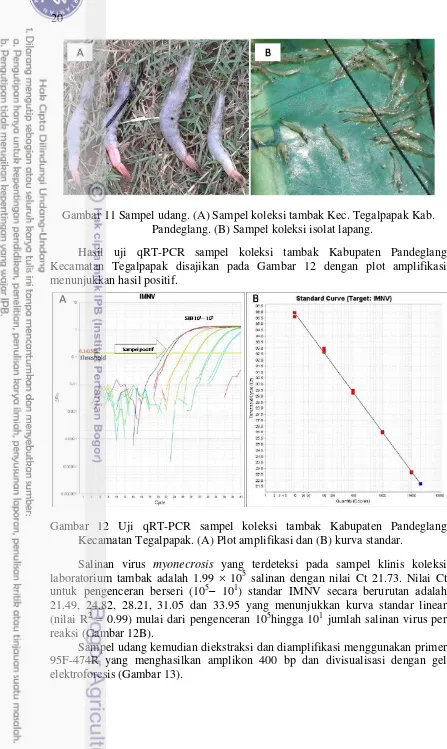
Gambar 11 Sampel udang. (A) Sampel koleksi tambak Kec. Tegalpapak Kab. Pandeglang. (B) Sampel koleksi isolat lapang.
Hasil uji qRT-PCR sampel koleksi tambak Kabupaten Pandeglang Kecamatan Tegalpapak disajikan pada Gambar 12 dengan plot amplifikasi menunjukkan hasil positif.
Gambar 12 Uji qRT-PCR sampel koleksi tambak Kabupaten Pandeglang Kecamatan Tegalpapak. (A) Plot amplifikasi dan (B) kurva standar.
Salinan virus myonecrosis yang terdeteksi pada sampel klinis koleksi laboratorium tambak adalah 1.99 × 105 salinan dengan nilai Ct 21.73. Nilai Ct untuk pengenceran berseri (105– 101) standar IMNV secara berurutan adalah 21.49, 24.82, 28.21, 31.05 dan 33.95 yang menunjukkan kurva standar linear (nilai R2 = 0.99) mulai dari pengenceran 105hingga 101 jumlah salinan virus per reaksi (Gambar 12B).
21
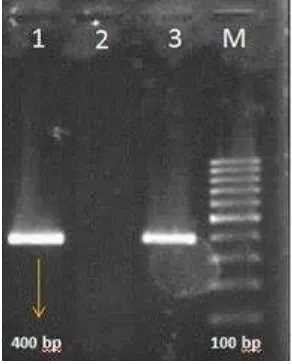
Gambar 13 Gel elektroforesis sampel udang koleksi tambak Kabupaten Pandeglang Kecamatan Tegalpapak. Jalur 1 sampel, jalur 2 kontrol (-), jalur 3 kontrol (+), dan jalur M marker 100 bp.
Pada sampel di atas terlihat pita fragmen IMNV 400 bp karena jumlah salinan IMNV yang tinggi hingga 105 sehingga IMNV dapat diamplifikasi dan tervisualisasi dengan gel elektroforesis. Amplikon 400 bp yang diamplifikasi menggunakan primer 95F-474R membentuk sekuens nukleotida dengan panjang 379 bp berada pada daerah 740 – 1118 fragmen ORF 1 IMNV. Deteksi fragmen ORF1 sangat penting karena daerah tersebut merupakan daerah genom lestari yang stabil (conserved region) dari IMNV yang mengkode protein pengikat (binding protein) RNA sehingga daerah ini yang sering digunakan untuk mendeteksi keberadaan IMNV (Nibert 2007).
22
terdapat perubahan 0-5 per pasangan sekuens nukleotida (<1 substitusi/genom/tahun).
Pola kekerabatan isolat Brazil dan Indonesia serta isolat lapang Banten juga diamati dengan pohon filogenetik menggunakan sekuens nukleotida karena keragaman yang terbatas pada sekuens asam amino (Townsend et al. 2008). Konstruksi pohon filogenetik menggunakan dua pendekatan yang berbeda yaitu neigbor joining (distance) dan maximum likelihood dengan hasil serupa yang menunjukkan konsistensi percabangan filogenetik. Kedua pohon filogenetik menunjukkan bahwa isolat Indonesia dan Brazil tersusun dari dua clusteryang terpisah dan masing-masing clustersaling membentuk percabangan tersendiri (Gambar 14).
Gambar 14 Perbandingan filogenetik isolat IMNV. Gambar dalam bentuk radial phylogram. (A) Neighbor joining (distance) (B) Maximum likelihood Keberadaan IMNV di Indonesia diduga berasal dari Brazil (Senapin et al. 2007; OIE 2015). Udang vaname telah dibudidayakan sejak tahun 1983 di Brazil sedangkan di Indonesia baru pada tahun 2001 (Briggs et al. 2004) dan IMNV muncul lebih awal di Brazil tahun 2002 (Andrade, 2009) sedangkan IMNV terdeteksi di Indonesia pada tahun 2006 (Nuraini et al., 2007; Senapin et al., 2007) walaupun dari percabangan yang terpisah antara Indonesia dan Brazil menunjukkan bahwa telah terjadi diversifikasi genetik antara IMNV Indonesia dan Brazil tetapi masih dalam spesies virus yang sama karena tingkat keragaman yang rendah sampai saat ini (Lampiran 2).
23 Penyakit myonecrosis di Indonesia pertama kali dilaporkan di Situbondo Jawa Timur pada tahun 2006 (Nuraini et al. 2007; Senapin et al. 2007). Karena tidak adanya laporan wabah IMNV di daerahlain pada tahun itu, Naim et al. (2014) menyimpulkan bahwa Jawa Timur merupakan sumber wabah myonecrosis di Indonesia dan kemudian menyebar ke daerah lainnya di Indonesia. Analisis filogenetik menggunakan fragmen genom IMNV dengan panjang sekuens 379 bp pada penelitian ini menunjukkan variasi isolat Indonesia yang masing-masing berkembang membentuk cabang tersendiri. Dua isolat Indonesia, ID-EJ-06-2ID-LP-11 dan, berada pada subclade yang terpisah dengan isolat Indonesia lainnya sesuai dengan nilai persentase kemiripan yang rendah pada hasil pairwise sequence alignment (Tabel 8). Penyimpangan isolat ID-LP-11 pada pohon filogenetik sesuai dengan hasil penelitian Naim et al. (2014) yang menyatakan bahwa isolat tersebut memang secara konsisten berada pada subclade yang berbeda pada isolat IMNV Indonesia.Konsistensi filogenetik isolat Indonesia perlu diuji lebih lanjut menggunakan sekuens nukleotida yang lebih panjang ~ 600 bp (Min dan Hickey 2007) untuk meningkatkan akurasi pohon filogenetik.
Faktor lingkungan atau praktek budidaya udang vaname yang berbeda di tiap daerah dapat berpengaruh kuat terhadap keragaman genetik IMNV secara regional di Indonesia. Pertukaran IMNV secara alamiah antar regional juga dapat terjadi melalui hewan carrier, bangkai udang mati, sumber air maupun udara yang terkontaminasi. Pembawa patogen (carrier) dalam suatu sistem budidaya meliputi inang terinfeksi (benih, induk, vektor, dan inang perantara), karier inang biologis lainnya (burung, anjing, serangga dan manusia) serta perantara lain (air, mobil, ember, sepatu, jaring, pakaian) yang masuk ke dalam sistem budidaya melalui air, udara maupun sarana transportasi (jalan). Penularan melalui air meliputi air yang terkontaminasi dari saluran inlet dan outletserta inang alami di perairan sedangkan penularan darat melalui aktivitas manusia, hewan, mobil dan peralatan lapangan (Nuraini 2008).
5
KESIMPULAN DAN SARAN
Kesimpulan
24
isolat Indonesia yang masing-masing berkembang membentuk cabang tersendiri terpisah dari kelompok isolat Brazil.
Saran
25
DAFTAR PUSTAKA
Andrade TPD. 2009. Development and application of novel quantitative and qualitative molecular techniques for detection of infectious myonecrosis virus (IMNV) in Pacific white shrimp (Litopenaeus vannamei) [dissertation]. Department of Veterinary Science and Microbiology. University of Arizona. Andrade TPD, Srisuvan T, Tang KFJ, Lightner DV. 2007. Real-time reverse
transcription polymerase chain reaction assay using TaqMan probe for detection and quantification of infectious myonecrosis virus (IMNV). Aquaculture 264, 9–15.
Briggs M, Smith SF, Subasinghe R, Phillips M. 2004.Introduction and movement of Penaeus vannamei and Penaeus stylirostris in Asia and The Pacific. RAP Publication 2004/10.
Budiharta S. 2002. Kapita selekta epidemiologi veteriner. Kesmavet. Fakultas Kedokteran Hewan. Yogyakarta (ID) .Universitas Gajah Mada Pr.
Cameron A. 2002. Survey toolbox for aquatic animal diseases. ACIAR. Canberra. p 373.
[CPP] PT. Central Proteinaprima Tbk. 2010. Paparan Publik. [Internet]. [Diunduh
2014 Desember 8]. Tersedia pada:
www.cpp.co.id/uploaded/content/File/Company Presentation/CP PRIMA PUBLIC EXPOSE 2010.pdf.
[DKP] Dinas Perikanan dan Kelautan Propinsi Banten. [Internet]. [Diunduh 2015 Januari 4]. Tersedia pada: http://www.dkp.bantenprov.go.id/read/peta-minopolitan.html.
Dorak T. 2006. Real Time PCR. Taylor and Francis Group. p 239.
Farfante P dan Kensley BF. 1997.Penaeid and sergestoid shrimp and prawns of the world: keys and diagnoses for the families and genera. Muséum national d'Histoire naturelle 175, 1–233.
Holthuis LB. 1980. FAO species catalog, Vol. 1. Shrimp and prawn of the world. FAO Fish Synopsis 125. Rome.
Lightner DV. 2012. Infectious myonecrosis. In: Manual of Diagnostic Tests for Aquatic Animal, 6th ed. World Organization for Animal Health (OIE), pp. 138–147 (on-line update).
Lightner DV, Pantoja CR, Poulos BT, Tang KFJ, Redman RM, Andrade TP dan Bonami JR. 2004. Infectious myonecrosis: new disease in Pacific white shrimp. Global Aquaculture Advocate 7, 85.
Loy DS. 2014. Host-virus interactions in the Pacific white shrimp, Litopenaeus vannamei [dissertation]. Iowa State University. USA.
Loy JD, Mogler MA, Loy DS, Junke B, Kamrud K, Scura ED, Harris DLH dan Bartholomay LC. 2012. dsRNA provides sequence-dependent protection against infectious myonecrosis virus in Litopenaeus vannamei. J Gen Virol 93: 880-888.
Min XJ dan Hickey DA. 2007. Assessing the effect of varying sequence length on DNA barcoding of fungi. Mol Ecol Notes 7, 365-373.
26
Naim S, Brown JK, Nibert ML. 2014. Genetic diversification of penaeid shrimp infectious myonecrosis virus between Indonesia and Brazil. Virus Res 189, 97-105.
Nibert ML. 2007. ‘2A-like’ and ‘shifty heptamer’ motifs in penaeid shrimp infectious myonecrosis virus, a monosegmented double-stranded RNA virus. J Gen Virol 88:1315–1318.
Nuraini YN. 2008. Prevalensi dan perubahan histopatologik infectious myonecrosis (IMN) pada udang putih (Litopenaeus vannamei) di Jawa Timur [tesis]. Universitas Gajah Mada. Yogyakarta.
Nuraini YN, Hanggono B, Subyakto S, Triastutik G. 2007. Survailen aktif infectious myonecrosis virus (IMNV) pada udang vanamei (Litopenaeus vannamei) yang dibudidayakan di Jawa Timur dan Bali. J Fish Sci XI (1): 25-31.
[OIE] Office International des Epizooties/World Animal Health Organization. 2015. Infectious myonecrosis (IMNV). Manual of Diagnostic Tests for Aquatic Animals: chapter 2.2.3.
Poulos BT, Tang KFJ, Pantoja CR, Bonami JR, Lightner DV. 2006. Purification and characterization of infectious myonecrosis virus of penaeid shrimp. J Gen Virol 87, 987-996.
Puthawibool T, Senapin S, Kiatpathomchaia W,Flegel TW. 2009. Detection of shrimp infectious myonecrosis virus by reverse transcription loop-mediated isothermal amplification combined with a lateral flow dipstick. J Virol Methods 156 : 27–31.
Sambrook J dan Russel D. 2001. Molecular cloning: a laboratory manual. Cold Spring Harbor Laboratory Press, Cold Spring Harbor.New York USA.
Senapin S, Phewsaiya K, Gangnongiw W dan Flegel TW. 2011. False rumours of disease outbreaks caused by infectious myonecrosis virus (IMNV) in the whiteleg shrimp in Asia. J Negative Results in Biomedicine. Thailand.
Senapin S, Phewsaiya K, Briggs M, Flegel TW. 2007. Outbreaks of infectious myonecrosis virus (IMNV) in Indonesia confirmed by genome sekuensing and use of an alternative RT-PCR detection method. J Aquaculture 266: 32–38. Silva SMBC, Rocha J, Martins P, Galvez A, dos Santos F, Andrade H, Coimbra
M. 2014. Experimental infection of infectious myonecrosis virus (IMNV) in the Pacific white shrimp Litopenaeus vannamei (Boone, 1931). Aquaculture International 23, 563-576.
Silva S, Pinheiro A, Coimbra M. 2011. Quantitation of infectious myonecrosis virus in different tissues of naturally infected Pacific white shrimp, Litopenaeus vannamei, using real-time PCR with SYBR Green chemistry. J Virol Methods 177 (2): 197-201.
Tang J, Ochoa WF, Sinkovitsa RS, Poulos BT, Ghabrial SA, Lightner DV, Bakera TS, Nibert ML. 2008. Infectious myonecrosis virus has a totivirus-like, 120-subunit capsid but with fiber complexes at the fivefold axes. National Academy of Sciences 105, 17526–17531.
27 Taslihan A. 2014. Penyakit udang terkini, permasalahan dan pemecahannya. Balai Besar Perikanan Budidaya Air Payau (BBBAP) Jepara. Kementerian Kelautan dan Perikanan (KKP).
Townsend JP, López-Giráldez F, Friedman R. 2008. The phylogenetic informative-ness of nucleotide and amino acid sequences for reconstructing the vertebrate tree. J Mol Evol 67, 437–447.
Walker PJ dan Winton JR. 2010. Emerging viral diseases of fish and shrimp. Vet Res 41, 51-75.
Widowati Z. 2013. Pengembangan real time RT-PCR dan karakterisasi molekuler untuk deteksi infectious myonecrosis virus (IMNV) pada udang vaname (Litopenaeus vannamei) [tesis]. Program Studi Mikrobiologi Medik. Institut Pertanian Bogor.
28
30
31 Lampiran 3 BLAST NCBI IMNV isolat lapang Banten
Lampiran 4 Kromatogram sekuens forward dan reverse isolat lapang Banten
32
RIWAYAT HIDUP
Penulis dilahirkan di Bangkalan, 4 Januari 1984 dari ayah M. Nadjib dan ibu Lely Rosiati. Penulis adalah anak kedua dari tiga bersaudara. Tahun 2001 penulis lulus dari Gontor Putri Mantingan Ngawi dan pada tahun 2003 penulis lulus seleksi masuk Universitas Brawijaya Malang melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB) Nasional dan diterima di Program Studi Manajemen Sumberdaya Perairan, Fakultas Perikanan dan Kelautan.