RESISTENSI
Salmonella
spp. YANG DIISOLASI DARI FESES
SAPI IMPOR ASAL AUSTRALIA TERHADAP ANTIBIOTIK
ANINDYA KURNIAWATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Resistensi Salmonella spp. yang Diisolasi dari Feses Sapi Impor Asal Australia Terhadap Antibiotik adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
ANINDYA KURNIAWATI. Resistensi Salmonella spp. yang Diisolasi dari Feses Sapi Impor Asal Australia Terhadap Antibiotik. Dibimbing oleh DENNY WIDAYA LUKMAN dan I WAYAN T WIBAWAN.
Importasi sapi bakalan asal Australia berasal dari peternakan asal yang menggunakan antibiotik secara berlebihan sebagai pemacu pertumbuhan, dalam pakan membawa potensi terhadap terjadinya resistensi bakteri terhadap antibiotik. Alasan ini yang mendasari bahwa untuk mengetahui tingkat resistensi pada bakteri komensal Salmonella spp. dipandang perlu dilakukan sebagai indikator untuk melihat tingkat penggunaan antibiotik dan resistensinya.
Tujuan dari penelitian ini adalah untuk melihat resistensi antibiotik pada sapi potong dari Australia yang diimpor melalui pelabuhan Tanjung Priok Jakarta. Isolat Salmonella spp. (n=50) yang dapat diisolasi dari total 100 sampel feses sapi impor bakalan diuji tingkat resistensinya terhadap 10 agen antibiotik (ampisilin, sefalotin, eritromisin, tetrasiklin, streptomisin, asam nalidiksid, trimetoprim, trimetoprim-sulfametoksasol, enrofloksasin dan kloramfenikol) menggunakan metode cakram difusi pada media Muller Hinton dan interpretasi hasil mengacu pada Clinical and Laboratory Standards Institute(CLSI). Hasil pengujian resistensi antibiotik menunjukkan isolat resisten terhadap eritromisin 98%, ampisillin 34%, streptomisin 22%, asam nalikdiksat 8%, sefalotin 6%, tetrasiklin 4%, and kloramfenikol 2%. Tidak ditemukan resistensi terhadap enrofloksasin, trimetoprim dan trimetoprim-sulfametoksasol. Salmonella spp. yang berasal dari sapi impor bakalan asal Australia dan telah resisten terhadap antibiotik berpeluang menyebarkan resistensi tersebut. Kemampuan Salmonella spp. memindahkan gen resisten tersebut harus diwaspadai terhadap penyebarannya di Indonesia.
Konsumsi daging yang berasal dari sapi impor dari peternakan yang menggunakan antibiotik baik pada pakan maupun minumannya dapat berakibat terjadinya resistensi antibiotik. Penggunaan antibiotik yang berlebihan baik sebagai imbuhan pakan maupun pengobatan dan tanpa pengawasan akan sangat membahayakan konsumen.
SUMMARY
ANINDYA KURNIAWATI. Antibiotic Resistant of Salmonella spp. Isolated from Imported Australian Feeder cattles faeces. Supervised by DENNY WIDAYA LUKMAN AND I WAYAN T WIBAWAN.
Importation of Australian feeder cattle from farms were constantly using antibiotics in feed would the result in the occurrence of antibiotic resistance. The aim of the study was to determine Salmonella spp. resistant against antibiotic isolated from feeder cattle in Australia imported through Tanjung Priok port, Jakarta. Salmonella spp. (n=50) isolates were collected from 100 samples of feeder cattles faeces. The study was designed using cross sectional study. Total of 50 Salmonella spp. isolates were subjected to Salmonella spp. examination and the isolated Salmonella spp. was tested for the antibiotic resistance using 10 antibiotics (ampicillin, cephalotin, erythromycin, tetracycline, streptomycin, chloramphenicol, trimethoprim, trimethoprim-sulfamethoxazole, nalidixic acid, and enrofloxacin) using disk diffusion method on Muller-Hinton agar following Clinical and Laboratory Standards Institute (CLSI) guidelines for interpretation. The isolated Salmonella showed resistance towards erythromycin 98%, ampicillin 34%, streptomycin 22%, nalidixic acid 8%, cephalotin 6%, tetracycline 4%, and chloramphenicol 2%. There was no resistance against antibiotic of enrofloxacin, trimethoprim, and trimethoprim-sulfamethoxazole.
Salmonella spp. derived from imported Australian feeder cattle and resistant to antibiotics have potential spread of antibiotic resistance. The ability of Salmonella spp. to transfer resistance gene should be aware of the spread in Indonesia and the antibiotic resistant of Salmonella spp. could be a potential threat for public health and animal health.
Consumption of beef from farms that were constanly using antibiotics in feed and drink would the result in the occurrence of antibiotic resistance, addicted on the use of antibiotics in excess and without supervision were very dangerous to the consumers.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Kesehatan Masyarakat Veteriner
RESISTENSI
Salmonella
spp. YANG DIISOLASI DARI FESES
SAPI IMPOR ASAL AUSTRALIA TERHADAP ANTIBIOTIK
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Resistensi Salmonella spp yang Diisolasi dari Feses Sapi Impor Asal Australia Terhadap Antibiotik
Nama : Anindya Kurniawati
NIM : B251130074
Disetujui oleh Komisi Pembimbing
Dr med vet Drh Denny Widaya Lukman, MSi
Ketua Prof Dr Drh I Wayan T Wibawan, MS Anggota
Diketahui oleh
Ketua Program Studi
Kesehatan Masyarakat Veteriner
Dr med vet Drh Denny Widaya Lukman, MSi
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juli 2014 ini ialah resistensi antibiotik, dengan judul Resistensi Salmonella spp yang Diisolasi dari Feses Sapi Impor Asal Australia Terhadap Antibiotik.
Terima kasih penulis ucapkan kepada Bapak Dr med vet Drh Denny Widaya Lukman, MSi dan Prof Dr Drh I Wayan T Wibawan, MS selaku pembimbing, yang telah banyak memberi saran. Di samping itu, penghargaan penulis sampaikan pada Kantor Balai Besar Karantina Pertanian Tanjung Priok (BBKP Tanjung Priok) dan Drh RR Endang Ekowati sebagai Kepala Balai Pengujian Mutu dan Sertifikasi Produk Hewan (BPMSPH), dan kepada staf Laboraturium Kesehatan Mayarakat Veteriner (KESMAVET) Fakultas Kedokteran Hewan IPB yang telah membantu selama penelitian dan pengumpulan data. Ungkapan terima kasih juga disampaikan kepada bapak Yohanes Sukamto, ibu Tri Widiastuti, serta seluruh keluarga (Sukma,Dhanti, Mas Budi, Mas Ucok, Eckel dan Galen), dan seluruh teman-teman KMV 13 atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2015
DAFTAR ISI
DAFTAR TABEL ix
DAFTAR GAMBAR x
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penulisan Makalah 2
Manfaat Penelitian 2
Perumusan Masalah 2
2 TINJAUAN PUSTAKA 3 Resistensi Antibiotik 3
Penggunaan Antibiotik pada Peternakan 4
Resistensi Antibiotik pada Salmonella spp. 5
3 METODE 6
Bahan 6
Alat 6
Tempat Peneelitian 6
Waktu Penelitian 7
MetodePengambilan Sampel 7
Isolasi dan Identifikasi Bakteri 7
Uji Kepekaan Isolat Salmonella terhadap Antibiotik 9
Analisa Data 9
4 HASIL DAN PEMBAHASAN 10 Pengambilan dan Pengujian Feses 10 Uji Resistensi Antibiotik pada Mueller Hinton Agar 13
5 SIMPULAN 19 Simpulan 19 Saran 20
Ucapan Terima Kasih 20
DAFTAR PUSTAKA 20 RIWAYAT HIDUP 25
DAFTAR GAMBAR
1 Koloni Salmonella spp. berwarna kehitaman pada media XLD 11 2 Hasil positif Salmonella pada TSIA dan LIA 11 3 Salmonella spp. yang resisten terhadap antibiotik pada media agar
Muller Hilton; A. Blank disc, B. Cakram antibiotik, C. Diameter zona
hambat 15
1
1 PENDAHULUAN
Latar Belakang
Peningkatan kesejahteraan dan kesadaran masyarakat tentang pentingnya protein hewani ikut mendorong meningkatnya permintaan terhadap pangan hewani. Alokasi impor nasional daging sapi tahun 2013 sebesar 80000 ton, terdiri dari 60% impor dalam bentuk sapi bakalan (267000 ekor sapi atau setara 48000 ton daging) dan 40% impor dalam bentuk daging sapi (32000 ton) (Ditjen PKH 2013). Minimnya pasokan sapi di dalam negeri ditambah meningkatnya permintaan akan konsumsi daging menjadi pemicu tingginya permintaan daging sapi saat ini. Populasi ternak penghasil daging untuk konsumsi kemungkinan tidak mampu memenuhi kebutuhan daging di Indonesia. Rendahnya produktivitas dan kesehatan ternak merupakan penyebab rendahnya populasi ternak penghasil daging, disamping tingginya pemotongan ternak produktif dan belum berkembangnya pemanfaatan ternak penghasil daging lainnya seperti kerbau, kambing, domba dan lain-lain. Cara untuk memenuhi kekurangan pasokan daging tersebut melaui impor sapi potong dan bakalan dari Australia (Ditjen PKH 2012). Frekuensi dan jumlah sapi potong impor asal Australia yang melalui pelabuhan Tanjung Priok dapat dilihat pada Tabel 1.
Tabel 1 Jumlah dan frekuensi sapi potong bakalan, sapi potong dan kerbau bakalan yang diimpor melalui Pelabuhan Tanjung Priok berdasarkan Laporan Tahunan Balai Besar Karantina Pertanian Tanjung Priok (2013)
Jenis Jumlah (ekor) Frekuensi Sapi bakalan (Feeder) 172 799 128 Sapi potong (Slaughter) 78 052 62 Kerbau bakalan 201 1
Tingginya frekuensi dan jumlah sapi potong impor dari Australia yang masuk ke dalam wilayah Indonesia membawa konsekuensi mengkhawatirkan di bidang kesehatan masyarakat veteriner. Impor sapi tersebut berpotensi membawa agen-agen penyakit yang penting untuk diwaspadai antara lain adalah adanya foodborne bakteri yang resisten terhadap beberapa jenis antibiotik.
Pemakaian antibiotik dalam pakan ternak baik untuk pencegahan penyakit maupun pemacu pertumbuhan (growth promotor) dilaporkan mempunyai peranan untuk terjadinya resistensi foodborne patogen. Pemakaian antibiotik sebagai AGP walaupun dalam konsentrasi kecil, yaitu berkisar antara 2.5 – 12.5 mg/kg (ppm), namun dapat mengakibatkan terjadinya resistensi bakteri patogen terhadap antibiotik (Bradbury dan Munroe 1985; Noor et al. 2006).
2
Berdasarkan laporan dari JETACAR (1999), bakteri patogen asal hewan yang telah resisten terhadap antibiotik dapat mentransfer gen yang resisten tersebut ke manusia. Salmonella, Campylobacter, Enterococci dan Escherichia coli merupakan contoh bakteri yang resisten terhadap antibiotik dan dapat mentransfer gen yang resisten tersebut ke bakteri lain pada hewan dan dapat menginfeksi manusia melalui rantai makanan atau kontak langsung (Butaye et al. 2003; WHO 1997; Noor et al. 2006).
Importasi sapi potong dapat berpotensi membawa bakteri Salmonella spp. yang resisten terhadap antibiotik tertentu. Keberadaan Salmonella spp. yang resisten terhadap antibiotik tertentu dapat mentransferkan gen resisten tersebut ke bakteri lain terutama yang tergolong dalam foodborne bakteri dan apabila menginfeksi manusia dapat menyebabkan kerugian bagi kesehatan manusia, diantaranya adalah kegagalan pengobatan dengan menggunakan antibiotik terhadap agen penyakit yang telah resisten.
Penelitian ini dilakukan untuk mengetahui sejauh mana dampak pemberian antibiotik di negara asal terhadap kemungkinan terjadinya resistensi terhadap antibiotik dan mendeterminasi kepekaan beberapa antibiotik terhadap isolat Salmonella spp. yang diisolasi dari sampel feses sapi impor bakalan (feeder cattle) yang dilalulintaskan melalui pelabuhan Tanjung Priok.
Tujuan Penelitian
Penelitian ini bertujuan untuk menguji kepekaan isolat Salmonella spp. yang diisolasi dari sampel feses sapi impor bakalan asal Australia yang dilalulintaskan melalui pelabuhan Tanjung Priok terhadap beberapa antibiotik, berdasarkan pada pemeriksaan kultur dan uji sensitivitas secara in vitro dengan metode difusi kertas cakram (beurr kirby).
Manfaat Penelitian
Manfaat dari penelitian ini adalah untuk memberikan informasi ilmiah mengenai bakteri Salmonella spp. yang diisolasi dari feses sapi impor bakalan (feeder cattle) asal Australia yang dilalulintaskan melalui pelabuhan Tanjung Priok. Memberikan informasi ilmiah mengenai resistensi dan kepekaannya terhadap beberapa antibiotik sehingga dapat mencegah peluang penyebaran bakteri yang mengalami resistensi.
Perumusan Masalah Penelitian
3 bagi kesehatan manusia, diantaranya adalah kegagalan pengobatan dengan antibiotik tertentu terhadap agen penyakit yang telah resisten.
2
TINJAUAN PUSTAKA
Resistensi Antibiotik
Antibiotik adalah senyawa kimia yang dihasilkan oleh mikroorganisme (khususnya dihasilkan oleh fungi) atau dihasilkan secara sintetik yang dapat membunuh atau menghambat perkembangan bakteri dan organisme lain (Munaf dan Chaidir 1994). Secara garis besar antimikroba dibagi menjadi dua jenis yaitu yang membunuh kuman (bakterisid) dan yang hanya menghambat pertumbuhan kuman (bakteriostatik). Antibiotik yang termasuk golongan bakterisid antara lain penisilin, sefalosporin, aminoglikosida (dosis besar), kotrimoksazol, rifampisin, isoniazid dan lain-lain. Sedangkan antibiotik yang memiliki sifat bakteriostatik, dimana penggunaanya tergantung status imunologi pasien, antara lain sulfonamida, tetrasiklin, kloramfenikol, eritromisin, trimetropim, linkomisin, klindamisin, asam paraaminosalisilat, dan lain-lain (Laurence dan Bennet 1987).
Prinsip daya kerja antibiotik dapat dikategorikan menjadi 4 cara yaitu (1) hambatan sintesis dinding sel, obat-obat antibiotik yang mempunyai daya kerja menghambat sintesis dinding sel mikroba, adalah basitrasin, sefalosporin, penisillin, ristoferin, vankomisin. (2) hambatan fungsi dari selaput sel, diantaranya amfoterin B, kolistin, nistatin, polimiksin. (3) hambatan sintesis protein, diantaranya khloramfenikol, eritromisin, linkomisin, tetrasiklin, aminoglikosida, amikasin, neomisin, netilmisin, streptomisin, tobramisi, serta (4) hambatan sintesis asam nukleat, termasuk di dalamnya asam nalidiksat, novobiosin, primetamin, sulfonamid, trimetoprin, rifampin (Munaf dan Chaidir 1994).
Resistensi didefinisikan sebagai tidak terhambatnya pertumbuhan bakteri dengan pemberian antibiotik secara sistemik dengan dosis normal yang seharusnya atau kadar hambat minimalnya. Sedangkan multiple drugs resistance didefinisikan sebagai resistensi terhadap dua atau lebih obat maupun klasifikasi obat. Sedangkan cross resistance adalah resistensi suatu obat yang diikuti dengan obat lain yang belum pernah dipaparkan (Tripathi 2003).
Resistensi terjadi ketika bakteri berubah dalam satu atau lain hal yang menyebabkan turun atau hilangnya efektivitas obat, senyawa kimia atau bahan lainnya yang digunakan untuk mencegah atau mengobati infeksi. Bakteri yang mampu bertahan hidup dan berkembang biak, menimbulkan lebih banyak bahaya. Kepekaan bakteri terhadap kuman ditentukan oleh kadar hambat minimal yang dapat menghentikan perkembangan bakteri (Bari et al. 2009). Timbulnya resistensi terhadap suatu antibiotik terjadi berdasarkan salah satu atau lebih mekanisme berikut:
4
G karena bakteri tersebut dapat menghasilkan beta-laktamase, yang dapat merusak obat tersebut. Beta-laktamase lain dihasilkan oleh bakteri Gram-negatif.
2. Bakteri mengubah permeabilitasnya terhadap obat, misalnya tetrasiklin, tertimbun dalam bakteri yang rentan tetapi tidak pada bakteri yang resisten. 3. Bakteri mengembangkan suatu perubahan struktur sasaran bagi obat,
misalnya resistensi kromosom terhadap aminoglikosida berhubungan dengan hilangnya (atau perubahan) protein spesifik pada subunit 30s ribosom bakteri yang bertindak sebagai reseptor pada organisme yang rentan.
4. Bakteri mengembangkan perubahan jalur metabolik yang langsung dihambat oleh obat, misalnya beberapa bakteri yang resisten terhadap sulfonamid tidak membutuhkan para 4-amino bensoic acid (PABA) ekstraseluler, tetapi seperti sel mamalia dapat menggunakan asam folat yang telah dibentuk.
5. Bakteri mengembangkan perubahan enzim yang tetap dapat melakukan fungsi metabolismenya tetapi lebih sedikit dipengaruhi oleh obat dari pada enzim pada kuman yang rentan, misalnya beberapa bakteri yang rentan terhadap sulfonamid, dihidropteroat sintetase, mempunyai afinitas yang jauh lebih tinggi terhadap sulfonamid dari pada PABA (Jawetz 1997; Utami 2012).
Penggunaan Antibiotik pada Peternakan
Menurut Murdiati (1997) penggunaan obat-obatan dalam usaha peternakan hampir tidak dapat dihindarkan, karena ternak diharapkan selalu berproduksi secara optimal yang berarti kesehatan ternak harus selalu terjaga. Upaya memenuhi tuntutan produksi ternak yang tinggi, maka ketersediaan obat hewan sangat diperlukan, disamping penggunaan bibit unggul dan pemuliaan yang memakan waktu yang relatif lama. Dalam bidang peternakan, pemakaian antibiotik selain untuk pengobatan penyakit, juga digunakan untuk memacu pertumbuhan ternak (growth promotor), yang umumnya ditambahkan dalam pakan sebagai imbuhan. Pada pemakaian antibiotik dalam bidang peternakan, faktor keamanan harus dipertimbangkan, diantaranya adalah keamanan produk peternakan dari residu antibiotik yang digunakan.
5 Penggunaan antibiotik di Indonesia yang cukup dominan adalah turunan tetrasiklin, penisillin, kloramfenikol, eritromisin dan streptomisin. Seperti juga di negara lain, pola penggunaan antibiotik tersebut telah mencapai tingkat yang berlebihan dan banyak diantaranya digunakan secara tidak tepat. Perkembangan resistensi kuman terhadap antibiotik sangat dipengaruhi oleh intensitas pemaparan antibiotik di suatu wilayah, tidak terkendalinya penggunaan antibiotik cenderung akan meningkatkan resistensi kuman yang semula sensitif (Refdanita et al. 2001).
Resistensi Antibiotik pada Salmonella spp.
Berdasarkan data yang dikumpulkan oleh Pan-American Health Organization (PAHO) menunjukkan bahwa wabah foodborne illness pada negara-negara berkembang dilaporkan sebanyak 9180 kasus dari tahun 1993-2010 dari 22 negara di wilayah ini, dari wabah ini 69% disebabkan oleh bakteri, 9.7% oleh virus, 9.5% oleh marine toxins, 2.5% oleh kontaminan bahan kimia, 1.8% oleh parasit dan 0.5% oleh racun tumbuhan dan di antara beberapa penyebab foodborne bakteri Salmonella spp. adalah paling sering sebagai penyebab foodborne (Pires et al. 2012), yang bertanggung jawab untuk 58.1% dari wabah dan 66.2% dari kasus yang pernah dilaporkan (Franco et al. 2003).
Salmonelosis merupakan salah satu penyakit enterik yang disebabkan oleh bakteri terpenting yang menyebabkan jutaan kasus penyakit pada manusia dan hewan, serta menimbulkan kerugian ekonomi yang signifikan di seluruh dunia (Nógrády et al. 2008). Salmonelosis pada manusia umumnya dikategorikan foodborne disease
yang disebabkan oleh konsumsi makanan asal hewan yang tercemar (daging, susu, unggas, telur). Produk susu, termasuk keju dan es krim, juga pernah berkaitan dengan wabah salmonelosis (Bhunia 2008; Hugas et al. 2009).
Salmonella dapat diisolasi dari berbagai spesies hewan dan dikenal sebagai bakteri penyebab zoonosis utama yang menyebabkan gejala seperti diare, demam, dan septikemia. Gejala-gejala ini dapat mematikan hewan, sehingga pengobatan yang cepat dengan agen antimikroba yang sesuai tetap dianggap penting secara ekonomis. Salmonella juga merupakan bakteri patogen penyebab utama foodborne diseases. Di Jepang, Salmonella adalah penyebab utama foodborne bakteri, dan pada tahun 2001 terjadi kasus Salmonellosis sebanyak 24.6% kasus yang dilaporkan pada National Institute of Infectious Diseases. Salmonelosis non-tipoid pada manusia biasanya merupakan penyakit self-limiting dan terbatas pada saluran gastrointestinal, tetapi ketika infesksi ini menyebar keluar usus atau ketika orang sedang mengalami gangguan sistem imun, maka obat-obatan antimikroba yang sesuai tetap diperlukan (Esaki et al. 2003).
Genus Salmonella merupakan anggota famili Enterobacteriaceae, Gram
negatif, berbentuk batang, tidak berspora, motil (kecuali Salmonella Pullorum dan S.
Gallinarum), memiliki flagela peritrikus, bersifat anaerob fakultatif, tumbuh pada suhu antara 5-45 °C, dengan suhu optimum 35-37 °C. Salmonella mampu tumbuh
pada pH rendah dan umumnya sensitif pada kadar garam yang meningkat. Salmonella
membentuk rantai filamen yang panjang jika dibiakkan/ditumbuhkan pada suhu ekstrim 4-8 °C atau 44 °C, serta pada pH 4.4 atau 9.4. Semua Salmonella merupakan
6
Salmonella dikelompokkan berdasarkan antigen somatik (O), flagela (H), dan
kapsular (Vi) (Molbak et al. 2006; Bhunia 2008). Saat ini, terdapat 2500 serovar Salmonella yang ditempatkan di bawah dua spesies, yaitu Salmonella enterica dan Salmonella bongori menurut The Center for Food Security and Public Health atau
CFSPH (2005). Sekarang Salmonella enterica terdiri atas enam subspesies yang
ditulis dengan angka romawi, yaitu I (enterica), II (salamae), IIIa (arizonae), IIIb (diarizonae), IV (houtenae), dan VI (indica). Informasi mengenai subspecies dalam system nomenklatur modern mulai diabaikan, sebagai contoh penulisan nama isolat
Salmonella ditulis sebagai Salmonella enterica subspesies I serovar Enteritidis.
Resistensi terhadap antibiotik juga digunakan sebagai pengklasifikasian Salmonella.
Sebagai contoh, DT104 resisten terhadap berbagai antibiotik seperti ampisillin, kloramfenikol, streptomisin, spektinomisin, sulfonamid, florfenikol, tetrasiklin, asam nalidiksad dan siprofloksasin. Sekarang dilaporkan bahwa DT204 menjadi emerging strain yang resisten terhadap 8-9 antibiotik dan menjadi masalah penting bagi
kesehatan manusia (Bhunia 2008).
Infeksi Salmonella merupakan penyebab penting mortalitas dan morbiditas pada sapi, dan kasus subklinis pada hewan sering ditemukan. Sapi mungkin merupakan reservoir penting untuk infeksi pada manusia (Wray dan Davies 2000). Banyak dari bakteri galur patogen yang dilaporkan telah menjadi resisten terhadap beberapa jenis antibiotik seperti ampisiin, amoksisilin, kloramfenikol, streptomisin, sulfonamid, dan tetrasiklin. Selain itu dilaporkan pula empat galur bakteri yang telah resisten terhadap beberapa antibiotik yaitu bakteri Salmonella sp., Campylobacter, Enterococci, dan Escherichia coli. Department of Health and Human Service's (HHS), Food and Drug Administration (FDA), dan Centers for Disease Control (CDC) melaporkan bahwa resistensi strain Salmonella, Campylobacter, dan E. coli pada manusia terhadap antibiotik yang menyebabkan terjadinya penyakit berhubungan dengan penggunaan antibiotik pada manusia (GAO REPORT 1999).
3 METODE
Bahan
Bahan yang digunakan dalam penelitian adalah feses sapi impor bakalan (feeder cattle), Buffer Peptone Water (BPW) 0.1%, Rappaport Vassiliadis, Xylose lysine Deoxycholate Agar (XLD) Agar (Oxoid), Triple Sugar Iron Agar (Oxoid), Lysin Iron Agar (Oxoid), brain heart infusion (Oxoid), McFarland Broth 0.5, Muller Hinton Agar (MHA), disk antibiotik, dan alkohol.
Alat
7 autoklaf, label, spidol, tabung Durham, waterbath, inkubator 35-37 °C dan inkubator 42 °C.
Tempat Penelitian
Pengambilan sampel feses dari sapi impor bakalan (feeder cattle) untuk penelitian ini dilakukan di Pelabuhan Tanjung Priok. Pengujian sampel ini dilakukan di Laboraturium Balai Besar Karantina Pertanian Tanjung Priok, Laboratorium Kesehatan Masyarakat Veteriner (Kesemavet) Fakultas Kedokteran Hewan, Institut Pertanian Bogor (FKH IPB), dan Balai Pengujian Mutu dan Sertifikasi Produk Hewan (BPMSPH), Bogor.
Waktu Penelitian
Penelitian ini dilaksanakan pada bulan Juli 2014 sampai dengan bulan November 2014.
Metode Pengambilan Sampel
Jumlah sampel untuk menduga prevalensi penyakit pada tingkat kepercayaan 95% dihitung menggunakan kajian lintas seksional dengan asumsi semua kedatangan sapi pada bulan yang ditetapkan dianggap sebagai satu populasi ternak. Penentuan sampel di kapal dilakukan secara acak (random) hingga jumlah sampel terpenuhi. Setiap anggota populasi di dalam kerangka penarikan contoh diberi nomor 1, 2, 3, …, N, kemudian contoh dipilih secara acak dari N anggota populasi tersebut. Pengambilan sampel dilakukan secara acak sederhana berdasarkan shipment.
Menurut Budiharta (2002) berdasarkan perhitungan/rumus kajian lintas seksional dengan memperhatikan asumsi prevalensi sebesar 50%, tingkat kepercayaan 95 % dan galat yang diinginkan 10 % maka didapat besaran sampel sebanyak:
n = 4 PQ ; n = 4 x 0.5 x 0.5 = 100 sampel L2 (0.1)2
Keterangan: n = besaran sampel P = asumsi prevalensi Q = 1 – P
L = galat yang diinginkan
8
Isolasi dan Identifikasi Bakteri
Metode Isolasi Salmonella spp.
Pengujian yang dilakukan mengacu pada Standar Nasional Indonesia (SNI) 2897:2008 tentang Metode Pengujian Cemaran Mikroba dalam Daging, Telur, dan Susu serta Hasil Olahannya (BSN 2008), dengan modifikasi metode berdasarkan Lukman dan Purnawarman (2008). Secara garis besar tahapan atau langkah pengujian adalah:
Uji Pra-Pengayaan (Pre-enrichment)
Salmonella diisolasi dari sampel feses sapi potong impor (feeder cattle) dari Australia sebanyak 25 gram secara aseptik dan dimasukkan dalam erlenmeyer steril yang berisi 225 buffered peptone water (BPW 0.1%). Sampel dihomogenkan dengan stomacher selama 1-2 menit di dalam plastik steril, kemudian sampel diinkubasi pada suhu 35-37 °C selama 16-20 jam.
Uji Pengayaan (Enrichment)
Biakan pra-pengayaan kemudian diambil 0.1 ml inokulan dari BPW yang telah diinkubasi dan dimasukkan ke dalam 10 ml Rappaport-Vasiliadis Medium (RV Medium) dalam tabung reaksi. Media RV diinkubasi pada suhu 42 °C ± 2 °C selama 24 ± 2 jam.
Uji Inokulasi (Isolasi) pada Media Selektif
Dua atau lebih inokulum diambil dengan ose dari media RV dan dimasukkan di atas media selektif agar XLD, selanjutnya dengan metode strik digoreskan dengan batang ose baru. Cawan petri yang telah digores tersebut diinkubasi pada suhu 35-37 °C selama 24 ± 2 jam. Pada media XLD koloni terlihat merah muda dengan atau tanpa titik mengkilat atau terlihat hampir seluruh koloni hitam.
Uji Biokimiawi
Koloni yang diduga sebagai Salmonella diambil, kemudian diinokulasikan pada media triple sugar iron agar (TSIA) dan lysine indol agar (LIA) dengan cara koloni yang diduga Salmonella ditusukkan ke dasar media agar, selanjutnya digores pada media agar miring. Media diinkubasikan pada suhu 35-37 °C selama 24 ± 2 jam. Amati koloni spesifik Salmonella dengan hasil reaksi seperti tercantum pada Tabel 2. Biakan yang menunjukkan positif pada uji TSIA dan LIA ditanam pada agar miring (nutrient agar) dan dikirim ke BPMSPH Bogor untuk konfirmasi Salmonella.
Tabel 2 Interpretasi hasil uji Salmonella spp. pada TSIA dan LIA Media Agar miring/slant Dasar agar/bottom H2S Gas
TSIA alkalin/K
9
Pembuatan Inokulum Bakteri
Bakteri Salmonella spp. yang resisten diinokulasikan pada media padat dipindahkan 1 ose ke dalam brain heart infusion atau BHI (Oxoid), kemudian diinkubasi pada suhu 35 °C selama 24 jam hingga menjadi keruh. Sebanyak 0.1 ml bakteri yang telah dimurnikan disuspensikan dalam buffered peptone water atau BPW (Oxoid) 0.1% 9 ml hingga kekeruhannya menyamai dengan 0.5 Mc Farland (1.5 x 108 sel/ml) dengan menggunakan vortex mixer dan dituang pada permukaan agar Muller Hinton sebanyak 0.1 ml, diratakan menggunakan hockey stick dan dibiarkan selama 15 menit kemudian sisa kultur dibuang.
Uji Kepekaan Isolat Salmonella terhadap Antibiotik
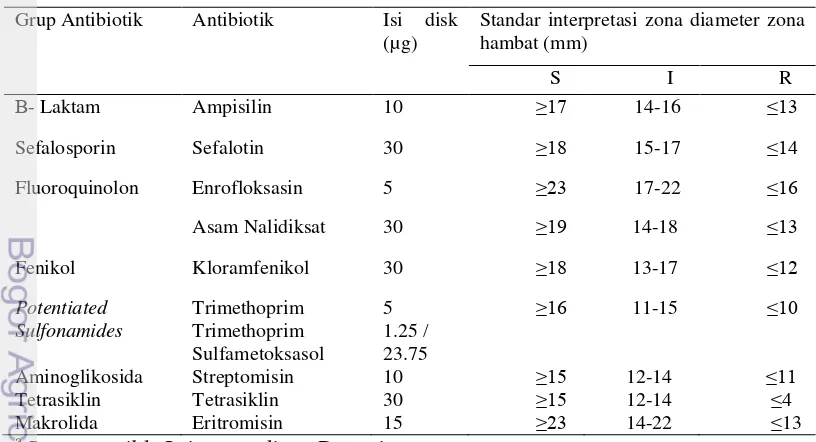
Pengujian kepekaan bakteri Salmonella spp. terhadap antibiotik dilakukan menggunakan metode difusi cakram (disc diffusion method). Cakram antibiotik diletakkan secara individual memakai forsep steril pada permukaan cawan petri berisi agar Muller Hinton yang telah diinokulasi bakteri Salmonella. Tekan pelan-pelan cakram antibiotik dan cakram tanpa antibiotik (blank disk) sampai kontak dengan permukaan agar dan kemudian cawan petri diinkubasikan pada suhu 37 °C selama 24 jam. Setelah diinkubasikan semalam, diameter daerah hambat (DDH) pertumbuhan bakteri yang terbentuk di sekitar cakram antibiotik diukur dengan penggaris dalam millimeter. Isolat bakteri ditentukan kepekaannya terhadap antimikrobial dengan mengukur zona hambat yang terbentuk. Penentuan susceptible (S), intermediate (I), dan resistant ditentukan melalui ukuran zona hambat yang terbentuk berdasarkan standar CLSI yang disajikan pada Tabel 3.
Tabel 3 Standar interpretasi diameter zona hambat antibiotik (CLSI 2012)
Grup Antibiotik Antibiotik Isi disk
(µg) Standar interpretasi zona diameter zona hambat (mm)
10
Analisis Data
Data yang diperoleh dianalisis secara deskriptif dengan menyajikan hasil uji adanya keberadaan Salmonella spp. pada feses sapi potong bakalan (feeder cattle) impor asal Australia dan isolat Salmonella spp. baik yang peka, intermediet maupun yang resisten terhadap berbagai antibiotik dalam bentuk tabel dan gambar.
4 HASIL DAN PEMBAHASAN
Pengambilan dan Pengujian Sampel Feses
Penelitian ini didisain menggunakan kajian lintas seksional dan dilakukan melalui pengumpulan data dan pengujian laboratorium terhadap bakteri Salmonella spp. yang resisten dan peka terhadap beberapa antibiotik. Sebanyak 100 sampel feses sapi impor bakalan (feeder cattle) diperoleh dengan cara pengambilan sampel secara acak di atas kapal dengan asumsi semua kedatangan sapi pada pertengahan bulan Agustus sampai dengan pertengahan September dianggap sebagai satu populasi ternak. Penentuan sampel dikapal dilakukan secara acak (random) hingga diperoleh jumlah sampel 100. Sampel feses yang diperoleh kemudian dilakukan pengujian isolasi dan identifikasi Salmonella spp.
Hasil pengujian dari 100 sampel menunjukkan bahwa 25 sampel feses yng diuji menunjukkan bahwa positif terhadap Salmonella spp. Hal tersebut diperkuat dengan adanya penelitian yang dilakukan oleh Fegan et al. (2004) terhadap sapi potong di Australia dari mulai bulan September 2002 sampai dengan Januari 2003 ditemukan adanya positif Salmonella spp. sebanyak 21 sampel (6.8%) dari 310 sampel feses sapi potong. Penelitian yang dilakukan oleh Wray et al. (2000) selama tiga tahun menunjukkan bahwa pada peternakan sapi potong terdeteksi adanya infeksi S. Dublin pada ternak dan lingkungan sekitar, walaupun tidak menunjukkan adanya gejala klinis. Hal serupa juga ditemukan pada peternakan sapi potong yang terdeteksi Salmonella spp. pada 38 feedlot dari total 100 feedlot dan pada 21 ekor dari 187 ekor sapi potong dan anak sapi yang diteliti (Fedorka et al. 1998; Dargatz et al. 2000).
11
Gambar 1 Koloni Salmonella spp. berwarna kehitaman pada media XLD Koloni yang diduga sebagai Salmonella diambil, kemudian diinokulasikan pada media triple sugar iron agar (TSIA) dan lysine indol agar (LIA). Menurut Food and Drug Administration (FDA) (2011), konfirmasi Salmonella dengan uji serologi dapat menggunakan media triple sugar iron agar (TSIA) dan lysine iron agar (LIA). Berdasarkan reaksi biokimiawi Salmonella spp. bersifat tidak mem-fermentasikan laktosa tetapi menghasilkan gas H2S yang berwarna hitam. Pada media TSIA biakan Salmonella dicirikan dengan terlihatnya reaksi basa pada slant (merah) dan asam pada butt (kuning), dengan atau tanpa diproduksinya H2S (hitam). Pada media LIA, Salmonella ditandai dengan timbulnya reaksi basa pada butt (ungu) yang menunjukkan hasil positif, sedangkan reaksi asam (kuning terang) menunjukkan hasil negatif. Salmonella pada media LIA memproduksi H2S. Yildirim et al. (2011) menambahkan bahwa pengujian konfirmasi Salmonella berhubungan dengan faktor virulensi Salmonella, yaitu aglutinasi antisera O dan H.
Seluruh uji biokimiawi yang dilakukan menunjukkan hasil sesuai dengan literatur yang ada, yaitu TSI menghasilkan H2S, media agar miring berwarna merah muda dan bagian tegak berwarna kuning. Dua koloni tunggal diambil dari setiap sampel sehingga diperoleh sebanyak 50 isolat Salmonella spp. untuk pengujian resistensi terhadap antibiotik. Hasil identifikasi dari uji biokimiawi pada media TSI dan LIA ditunjukkan pada Gambar 2.
Gambar 2Hasil positif Salmonella pada media; (1). TSIA; (2).LIA
A
12
Bakteri Salmonella spp. berhasil diisolasi dari beberapa sampel yang diuji. Habitat bakteri Salmonella adalah di dalam alat pencernaan manusia, hewan, dan bangsa burung. Banyak dari serotipe Salmonella yang menginfeksi berbagai jenis mamalia, unggas dan reptil serta sering terekskresikan melalui feses. Saluran pencernaan diketahui sebagai jalur utama infeksi Salmonella spp. meskipun bakteri ini juga dapat ditemukan pada mukosa saluran pernafasan atas dan konjungtiva. Bakteri ini juga dapat ditemukan pada air, tanah, pakan ternak, serta pada bahan pangan antara lain daging dan sayuran (Quin et al. 2001).
Salmonella spp. adalah bakteri yang bersifat patogen baik bagi manusia maupun hewan. Infeksi Salmonella merupakan penyebab penting mortalitas dan morbiditas pada sapi, dan hewan yang terinfeksi secara subklinis sering ditemukan. Sapi adalah hewan yang diduga merupakan reservoir penting untuk infeksi manusia (Wray dan Davies 2000). Beberapa spesies Salmonella merupakan penyebab gastroenteritis akut di beberapa negara dan salmonellosis tetap menjadi masalah pada sebagian masyarakat di seluruh dunia khususnya negara-negara berkembang, meskipun tingkat insidensi bervariasi dari tiap negara. Kotoran dari hewan dan manusia yang terinfeksi adalah sumber kontaminasi bakteri dari lingkungan dan rantai makanan (Estoepangesti et al. 2014).
Salmonella dapat bertahan hidup pada periode waktu yang lama pada feses hewan yang terinfeksi dan pada feses basah dengan tergantung pada beberapa faktor yang mempengaruhi, terutama oleh pengaruh kondisi iklim. Pada kondisi lembab dan feses yang belum diolah menjadi kompos, Salmonella dapat bertahan hidup selama tiga sampai empat bulan pada kondisi iklim sedang dan dapat bertahan lebih lama pada kondisi iklim yang panas (Poppe 2000).
Manusia yang terinfeksi oleh Salmonella spp. dapat bertindak sebagai karier setelah terinfeksi dan dapat menularkan pada manusia lainnya melalui feses dalam waktu yang lama. Salmonella spp. dapat diisolasi pada tanah, air, dan sampah yang terkontaminasi oleh feses (Ray 2001). Dosis infektif dari Salmonella spp. bervariasi tergantung pada serovar Salmonella spp. yang teridentifikasi, tingkat dari imunitas individu yang mengkonsumsi makanan, dan jenis makanan yang dikonsumsi. Jumlah Salmonella ( 10-100 sel bakteri) dapat menyebabkan penyakit jika dikonsumsi terutama oleh anak-anak, orang tua, dan orang yang memiliki system imun rendah (Lawley et al. 2008).
Bakteri Salmonella spp. merupakan golongan bakteri Enterobacteriacceae, kelompok bakteri gram negatif dengan karakteristik motil dengan flagella peritricus, kecuali S. Pullorum dan S. Gallinarum serta tidak mampu untuk memfermentasikan laktosa (Quin et al. 2001, Songer dan Post 2005). Bakteri tersebut juga merupakan bakteri anaerobik fakultatif, non spora dan pertumbuhan optimal pada suhu 37 °C (Songer dan Post 2005). Untuk dapat bertahan hidup pada lingkungan Salmonella dapat mengembangkan suatu mekanisme pertahanan yang memungkinkan terbentuknya koloni permanen dan dapat membentuk biofilm pada saat berada pada lingkungan yang keras. Selain itu, hewan dapat menjadi pembawa penyakit (carrier) yang persisten, sehingga prevalensi kejadian Salmonella tidak mudah dideteksi, kecuali melalui pengambilan dan pemeriksaan sampel yang rutin (Namata et al.2009).
13 telah resisten terhadap beberapa antibiotik yaitu salah satunya adalah bakteri Salmonella spp. Resistensi galur Salmonella, Campylobacter, dan E. coli pada manusia terhadap antibiotik yang menyebabkan terjadinya penyakit berhubungan dengan penggunaan antibiotik pada manusia (GAO REPORT 1999).
Adanya kekhawatiran saat ini terhadap aspek kesehatan manusia adalah munculnya serovar dari bakteri Salmonella spp. yang mempunyai kemampuan resistensi terhadap beberapa antibiotik. Hal tersebut dapat terjadi karena pola penggunaan antibiotik di industri peternakan secara terus-menerus baik dalam proses pengobatan maupun penggunaannya sebagai bahan imbuhan pakan dan growth promotor. Penggunaan antibiotik yang berlebihan dan di luar batas pengawasan dapat berpotensi untuk dapat menyebabkan terjadinya resistensi antibiotik dan kemungkinan dapat menyebarkan gen resisten tersebut kepada mikroba lainnya. Sehingga dikhawatirkan dapat mempengaruhi kegagalan pengobatan pada manusia. Dalam beberapa tahun terakhir isolat Salmonella spp. yang berhasil diisolasi baik pada produk hewan maupun dari hewan hidup telah mengalami adanya peningkatan pola resistensi terhadap beberapa antibiotik.
Uji Resistensi Antibiotik pada Mueller-Hinton Agar
Sepuluh antibiotik yang digunakan pada penelitian ini diberikan dengan dosis standar antibiotik atau dapat dikatakan dosis efektifitas antibiotik secara umum, meliputi ampisillin 10 µg, sefalotin 30 µg, enrofloksasin 5 µg, asam nalidiksat 30 µg, kloramfenikol 30 µg, trimetoprim dosis tunggal 5 µg, trimethoprim 1.25 µg/ sulfametoksasol 23.75 µg, streptomisin 10 µg, tetrasiklin 30 µg, eritromisin 15 µg. Hal ini didasarkan pada teori yang disampaikan Chambers (2006) bahwa dosis yang diberikan pada penggunaan antibiotik sangat mempengaruhi kemampuan antibiotik dalam menghambat pertumbuhan mikroorganisme, selain itu dapat mempengaruhi resistensi antibiotik tersebut. Hasil sensitif mengindikasikan bahwa antibiotik mampu menghambat mikroba pada konsentrasi antibiotik yang direkomendasikan sehingga dapat digunakan untuk penanganan infeksi mikroorganisme. Hasil resisten mengindikasikan bahwa isolat mikroorganisme tidak mampu terhambat oleh antibiotik pada dosis yang normal dan tidak lagi digunakan dalam pengobatan (CLSI 2012).
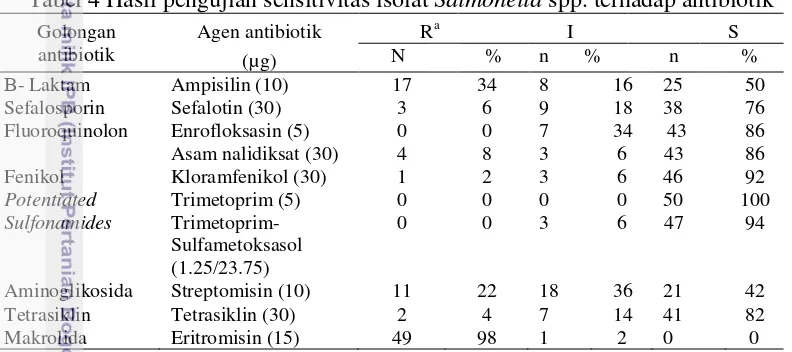
Hasil pengujian resistensi isolat Salmonella spp. terhadap 10 jenis antibiotik menunjukkan adanya pola resistensi yang berbeda pada setiap isolat yang diuji. Pengujian resistensi antibiotik pada 50 isolat Salmonella spp. menunjukkan bahwa seluruh isolat mengalami resistensi terhadap setidaknya satu jenis antibiotik. Tingkat resistensi Salmonella spp. berturut-turut dari yang paling tinggi tingkat resistensinya terhadap antibiotik yaitu diketahui dari 50 isolat Salmonella spp. yang didapatkan, resisten terhadap eritromisin 98%, 34% resisten terhadap ampisilin, 22% resisten terhadap streptomisin, 6% resisten terhadap sefalotin dan 4% terhadap antibiotik tetrasiklin. Antibiotik yang paling baik adalah trimetoprim dosis tunggal yaitu dapat menghambat 100% isolat bakteri Salmonella spp. Hasil pola resistensi isolat Salmonella spp. disajikan pada Tabel 4, 5, dan Gambar 3.
14
resisten terhadap dua jenis antibiotik, lima isolat resisten terhadap tiga jenis antibiotik dan tiga isolat resisten terhadap empat jenis antibiotik. Hasil pola resistensi isolat Salmonella spp. disajikan pada Tabel 5 dan Gambar 3.
Hasil pengujian menunjukkan bahwa isolat Salmonella spp. juga mengalami resistensi intermediet dan masih terdapat yang peka terhadap beberapa antibiotik. Tingkat resistensi intermediet tertinggi terjadi pada antibiotik streptomisin dengan jumlah sebanyak 18 isolat. Hasil uji yang menunjukkan hasil intermediet menunjukkan bahwa aktivitas dari antibiotik kurang optimal sehingga perlu dilakukan penambahan dosis antibiotik untuk hasil yang optimal. Interpretasi intermediet dapat menjadi penyebab berkembangnya sifat resistensi bakteri terhadap antibiotik (Kristaningsih et al. 2005).
Tabel 4 Hasil pengujian sensitivitas isolat Salmonella spp. terhadap antibiotik
Golongan
Tabel 5 Pola resistensi isolat Salmonella spp. terhadap golongan antibiotik
Pola resistensi terhadap
a AMP: ampisilin; KF: sefalotin; S: streptomisin; ENR: enrofloksasin; NA: asam nalidiksat; E: eritromisin; C: kloramfenikol; SXT: trimetoprim-sulfametoksasol; TE : tetrasiklin
15 bakterial dalam suatu populasi. Uji sensitivitas bakteri terhadap antibiotik merupakan cara penentuan antibiotik yang tepat untuk pengobatan. Uji resistensi antibiotik mempunyai fungsi, terutama dalam pemilihan pengobatan antimikrobial. Bakteri bisa mendapatkan resistensi antibiotik dari bakteri lainnya (Plumb 2005).
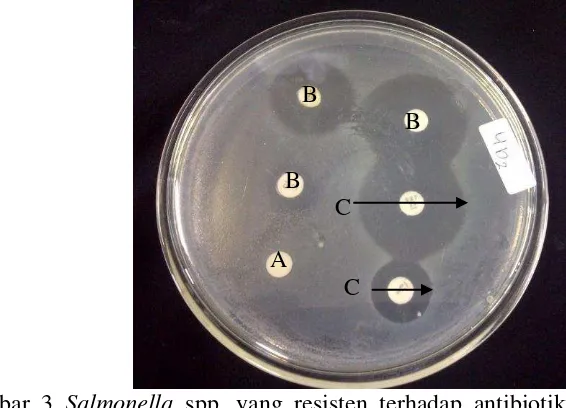
Gambar 3 Salmonella spp. yang resisten terhadap antibiotik pada media agar Muller Hilton; A. Blank disc, B. Cakram antibiotik, C. Diameter zona hambat
Antibiotik ampisilin memiliki daya resisten 34% terhadap 17 isolat Salmonella spp. danintermedietsebanyak 16 % terhadap 8 isolat Salmonella spp. Kondisi resistensi Salmonella spp. pada sapi di Negara Brazil juga ditemukan dalam penelitian Zhao et al. (2007) dari 129 isolat Salmonella asal sapi 66% isolat resisten terhadap ampisilin. Kejadian resistensi terhadap ampisilin juga terjadi pada isolat Salmonella spp. pada sapi perah di Texaz, Amerika Serikat yaitu resisten sebesar 88% dari 50 isolat yang diuji (Bischoff et al. 2004). Davis et al. (2007) melaporkan selama tahun 2001-2004 di Negara Brazil dilaporkan bahwa 79.6% Salmonella Dublin yang diisolasi dari sapi mengalami resistensi terhadap ampisilin. Organisme patogen melalui proses enzimatik berperan mengurangi atau mengeliminasi antibiotik. Pada mikroorganisme yang telah mengalami mutasi, terjadi peningkatan aktifitas enzim atau terjadi mekanisme baru sehingga obat menjadi tidak aktif sehingga penggunaan ampisilin sudah tidak efektif lagi bagi Salmonella spp. (Estoepangestie et al. 2014).
Ampisilin merupakan prototip golongan aminopenisilin dan antibiotik golongan laktam yang paling banyak beredar dan digunakan di Indonesia. Antibiotik beta laktam bekerja dengan menghambat sintesa dinding sel bakteri karena proses transpeptidase antar rantai peptidoglikan terganggu, yang kemudian akan mengaktivasi enzim proteolitik pada dinding sel bakteri. Ampisilin mempunyai aktivasi paling baik terhadap bakteri gram positif dibandingkan dengan bakteri gram negatif walaupun mempunyai spektrum antibiotik yang luas (Istiantoro dan Gan 2008).
Resistensi bakteri terhadap ampisilin dan antibiotik β-laktam lainnya terjadi karena kemampuan bakteri menghasilkan enzim β-laktamase yang dapat merusak ampisillin (Brander et al. 1991). Ampisilin merupakan jenis antibiotik yang
A
B B
C B
16
diperbolehkan digunakan sebagai bahan campuran pakan di Australia sampai pada tahun 2012 (Schipp 2012). Resistensi terhadap ampisilin dapat menyebar pada populasi bakteri baik secara klonal dan dapat dilanjutkan dengan perubahan genetik secara horizontal sehingga dapat dihasilkan lebih banyak strain bakteri yang resisten daripada pada jenis antibiotik asam nalidiksat yang hanya dapat menyebarkan secara klonal dan tidak mampu memindahkan sifat resistensi (Bortolaia et al. 2010).
Streptomisin merupakan yang efektif digunakan untuk melawan bakteri Pasteurella, Brucella, Hemophilus, Salmonella, Klebsiella, Shigella dan organisme Mycobacterium (Hubber 1977). Streptomisin termasuk golongan antibiotik aminoglikosida yang aktif terutama terhadap bakteri gram negatif dan resistensi silang parsial antar sesamanya (neomisin, gentamisin, dan spektinomisin). Jenis kerja streptomisin adalah bakterisid. Mekanisme kerja streptomisin adalah antibiotik ini berikatan dengan komponen ribosom 30S dan menyebabkan kode pada mRNA salah dibaca oleh tRNA pada waktu sintesis protein. Akibatnya akan terbentuk protein yang abnormal, nonfungsional bagi sel bakteri (Setiabudy dan Gan 2003).
Resistensi terhadap streptomisin mungkin disebabkan oleh adanya mutasi yang terjadi secara kebetulan. Secara umum dikatakan bahwa makin lama terapi dengan streptomisin berlangsung, maka resistensinya juga akan semakin meningkat. Mutasi ini terjadi pada rRNA, sebagai target obat yang mekanisme kerjanya menghambat sintesis protein bakteri. Mutasi pada rRNA telah terbukti dapat menimbulkan resistensi obat yang berhubungan dengan mekanisme sebab akibat, dan mempunyai hubungan dengan resistensi perolehan yang didapatkan secara in vivo dari organisme patogen lain yang resisten terhadap streptomisin. Resistensi terhadap streptomisin pada Salmonella disebabkan oleh adanya modifikasi enzim aminoglikosida adenil transferase yang dikode oleh suatu protein aada dan aadb yang berhubungan dengan resistensi streptomisin (Hur et al. 2012). Selain inaktivasi dari obat, mekanisme resistensi lain terkait adanya modifikasi target obat untuk mengikat dalam sel (Folley dan Lynne 2008).
Antibiotik kloramfenikol memiliki daya sensitivitas 92% terhadap 46 sampel untuk Salmonella spp. Khloramfenikol bekerja dengan cara menghambat pengikatan asam amino baru pada rantai peptida yang mulai timbul, sebagian besar karena kloramfenikol menghambat peptidil transferase. Khloramfenikol terutama bersifat bakteriostatik dan pertumbuhan mikroorganisme dimulai lagi bila pemberian obat dihentikan (Jawetz 1997). Kloramfenikol memiliki daya intermediet 6% terhadap 3 sampel untuk Salmonella spp., memiliki daya resisten 2% terhadap 1 sampel untuk Salmonella spp., itu artinya Salmonella spp. termasuk masih sensitif terhadap antibiotik kloramfenikol tetapi 1 isolat sudah menunjukkan adanya resistensi. Resistensi terhadap kloramfenikol terjadi karena adanya asetilasi yang membuat kloramfenikol tidak aktif (Brander et al. 1991).
17 positif, gram negatif, riketsia, spiroseta, klamidia, mikoplasma dan beberapa jenis protozoa (Ahrens dan Martin 2008). Bakteri yang resisten terhadap tetrasiklin biasanya juga resisten terhadap antibiotik dari grup yang sama (Brander et al. 1991).
Antibiotik tetrasiklin tidak dapat mencapai lokasi target yang dikehendaki disebabkan karena penurunan permeabilitas dinding mikroorganisme terhadap antibiotik. Perubahan permeabilitas berhubungan dengan perubahan reseptor permukaan sel sehingga antibiotik kehilangan kemampuan untuk melakukan transportasi aktif guna melewati membran sel karena terjadinya perubahan struktur dinding sel yang tidak spesifik yang dapat disimpulkan bahwa Salmonella spp. masih sensitif terhadap antibiotik tetrasiklin tetapi beberapa mulai menunjukkan resistensi(Estoepangesti et al. 2014).
Resistensi Salmonella spp. terhadap antibiotik eritromisin adalah hasil yang paling tinggi yaitu sebanyak 98% terhadap 49 isolat Salmonella spp. dan intermediet 2% dari 1 isolat. Organisme patogen melalui proses enzimatik berperan mengurangi atau mengeliminasi antibiotik. Pada mikroorganisme yang telah mengalami mutasi, terjadi peningkatan aktifitas enzim atau terjadi mekanisme baru sehingga obat menjadi tidak aktif dan penggunaannya sudah tidak efektif lagi (Estoepangesti et al. 2014).
Eritromisin adalah antibiotik yang termasuk golongan makrolid, bersifat bakteriostatik terhadap bakteri gram positif dan beberapa bakteri gram negatif (Brander et al. 1991). Antibiotik ini tidak menghambat pertumbuhan E. coli, Salmonella spp. dan Shigella tetapi merupakan antibiotik yang dianjurkan untuk pengobatan Campylobacteriosis (Fraser 1986). Eritromisin bekerja dengan cara berikatan dengan ribosom 50S sehingga asam amino tidak bisa terikat oleh ribosom akibatnya sintesa protein terganggu. Resistensi bakteri terjadi karena adanya perubahan struktur ribosom 50S (Lay dan Hastowo 1992). Resistensi Salmonella terhadap eritromisin dapat terjadi melalui beberapa mekanisme yang diperantarai oleh plasmid, yaitu modifikasi reseptor atau target dari obat yang melibatkan gen erythromycin resistance methylase dan hidrolisis obat oleh enzim esterase yang dihasilkan oleh golongan bakteri Enterobacteriaceae termasuk dari bakteri Salmonella spp. (Istiana 1998).
Menurut Schipp (2012) di negara Australia antibiotik golongan makrolida termasuk didalamnya eritromisin merupakan antibiotik yang diperbolehkan digunakan sebagai bahan imbuhan pakan dan growth promotor. Resistensi yang cukup tinggi terhadap antibiotik eritromisin dan streptomisin di peternakan sapi diduga karena kedua antibiotik tersebut banyak digunakan dan mempunyai daya kerja spektrum yang luas.
Resistensi Salmonella spp. terhadap antibiotik asam nalidiksat yaitu sebanyak 8%. Asam nalidiksat merupakan preparat quinolon yang dapat bekerja dengan cara menghambat sintesis DNA sehingga tidak terjadi replikasi sel. Aktivitas asam nalidiksat hanya terbatas pada bakteri gram negatif (Brander et al. 1991). Asam nalidiksat mempunyai frekuensi resistensi mutasi kromosom yang rendah karena tidak adanya pembawa plasmid resisten.
18
resistensi yang dapat dipindahkan), resistensi non-genetik (inaktivasi dari metabolik), dan resistensi silang.
Faktor yang menentukan sifat resistensi mikroba terhadap antimikroba terdapat pada elemen yang bersifat genetik. Menurut Yenny dan Herwana (2007) kebanyakan resistensi antibiotik terjadi akibat mutasi atau transfer horisontal gen yang membawa sifat resisten. Mutasi terjadi secara acak, spontan dan tidak tergantung dari adanya antimikroba. Mutasi terjadi bila terdapat kekeliruan dalam proses replikasi DNA yang luput untuk diperbaiki oleh DNA repair system, contoh pada bakteri Salmonella spp. pada saat multi step mutation terjadi peningkatan resistensi secara bertahap seperti adanya mutasi DNA gyrase (gyr A atau par C) sehingga dapat menimbulkan resistensi klinis terhadap fluorokuinolon. Elemen genetik ekstrakromosom ini dapat ditransmisikan secara vertikal yaitu dari bakteri ke keturunannya melalui pembelahan biner dan yang lebih penting lagi transmisi secara horisontal yang dapat melintasi spesies dan genus. Faktor resistensi yang dipindahkan dapat berlangsung dari kromosom ke plasmid atau viceversa pada transposon dan integron. Tidak setiap plasmid dapat dipindahkan. Yang dapat dipindahkan adalah plasmid faktor R, disebut juga plasmid penular (infectious plasmids) (Kariuki dan Hart 2001).
Bentuk resistensi yang ditunjukkan oleh beberapa isolat Salmonella spp. terhadap beberapa preparat antibiotik seperti eritromisin, ampisilin, tetrasiklin, streptomisin, asam nalidiksat, sefalotin dan kloramfenikol dapat disebabkan karena adanya multiple-drug resistance seperti yang dikemukakan oleh Pratt (1973) yang merupakan suatu kondisi keadaan resistensi dari bakteri terhadap beberapa jenis antibiotik sekaligus karena diperantarai oleh plasmid faktor R yang merupakan suatu DNA ekstrakromosomal. Faktor R ini dapat berperan sebagai suatu faktor resistensi yang dapat ditransfer dan dipindahkan dengan cara konjugasi antara sesama bakteri enterobakter, seperti bakteri E. coli, Salmonella spp. dan Shigella spp. (Krisnaningsih et al. 2005).
Menurut National Research Counsil Institute of Medicine (1998) multiple drug resistance yang meliputi ampisilin (derivat dari penisilin), streptomisin dan derivat tetrasiklin hampir selalu dapat ditemukan pada setiap kasus resistensi bakteri terhadap antibiotik, khususnya untuk bakteri Escherichia coli dan Salmonella spp.. Penelitian Estoepangestie et al. (2014) juga menemukan dalam 7 isolat Salmonella (33%) yang dapat diisolasi dalam daging sapi yang dibeli baik pada pasar tradisional dan swalayan di Kota Surabaya mengalami resistensi terhadap asam nalidiksat sebanyak 57.2%; resisten terhadap oksitetrasiklin dan tetrasiklin sebanayak 85.7% dan resisten 100% terhadap ampisilin, kloksasilin, eritromisin, dan penisilin. Pernyataan ini mendukung hasil uji terhadap isolat yang menunjukkan sifat resistensi Salmonella spp. terhadap beberapa preparat antibiotik sekaligus yaitu eritromisin, ampisilin, tetrasiklin, dan streptomisin.
Menurut Schipp (2012) tingkat sensitivitas Salmonella spp. terhadap beberapa antibiotik seperti jenis enrofloksasin, trimetoprim-sulfametoksasol dan tetrasiklin termasuk cukup tinggi dikarenakan adanya kebijakan dari Negara Australia yang cukup ketat untuk melarang penggunaan antibiotik dari jenis gentamisin, kloramfenikol, dan golongan fluoroquinolon dipergunakan sebagai bahan imbuhan dalam pakan.
19 untuk terjadinya resistensi foodborne patogen. Pemakaian antibiotik sebagai AGP walaupun dalam konsentrasi kecil, yaitu berkisar antara 2.5 – 12.5 mg/kg (ppm), namun dapat mengakibatkan terjadinya resistensi bakteri patogen terhadap antibiotik (Noor et al. 2006).
Penggunaan antibiotik harus berhati-hati karena sifatnya yang mudah mengalami resistensi terhadap penggunaan penyakit mikrobial tertentu. Menurut Chambers (2006) faktor yang mempengaruhi kepekaan dan resistensi antibiotik adalah konsentrasi. Konsentrasi yang digunakan dalam pengobatan dan dapat menghambat pertumbuhan mikroorganisme namun harus di bawah ambang toksisitas obat.
Menurut Refdanita et al. (2004) penggunaan antibiotik di Indonesia yang cukup dominan adalah turunan tetrasiklin, penisilin, kloramfenikol, eritromisin dan streptomisin. Seperti juga di negara lain, pola penggunaan antibiotik tersebut telah mencapai tingkat yang berlebihan dan banyak diantaranya digunakan secara tidak tepat. Perkembangan resistensi kuman terhadap antibiotik sangat dipengaruhi oleh intensitas pemaparan antibiotik di suatu wilayah, tidak terkendalinya penggunaan antibiotik cenderung akan meningkatkan resistensi bakteri yang semula sensitif.
Menurut Murdiati (1997) dalam bidang peternakan perlu diperhatikan waktu henti atau withdrawal time dari antibiotik yang bersangkutan. Yang dimaksud dengan waktu henti adalah kurun waktu dari saat pemberian obat yang terakhir hingga ternak boleh dipotong atau produknya seperti susu dan telur boleh dikonsumsi. Waktu henti satu antibiotik tidak sama dengan antibiotik yang lainnya, tergantung juga dari jenis ternak dan cara pemakaian antibiotik, Waktu henti dari suatu obat termasuk antibiotika sangat dipengaruhi oleh proses absorbsi, distribusi dan eliminasi dari obat yang bersangkutan (Baggot 1977). Proses tersebut dipengaruhi oleh beberapa hal antara lain umur dan jenis hewan, status kesehatan dan nutrisi hewan, serta sifat kimia dan fisika dari obat seperti berat molekul, kelarutan dalam air maupun dalam lemak dan ikatannya dengan protein tubuh.
5 SIMPULAN DAN SARAN
Simpulan
20
untuk penggemukan memiliki potensi untuk dapat menyebarkan resistensi antibiotik di Indonesia.
Saran
Perlu dilakukan kajian yang lebih lanjut terhadap Salmonella spp. yang resisten terhadap antibiotik dengan menggunakan sampel yang berasal dari sapi siap potong (slaughter) maupun sapi yang diperuntukkan untuk sapi bibit, kemudian dapat dilihat perkembangan resistensinya selama sapi tersebut dikembangbiakkan dan dipelihara di Indonesia. Diperlukan adanya penelitian lanjutan untuk melihat keberadaan dan pola resistensi Salmonella spp. pada lingkungan (perairan, tanah, dan peralatan) di sekitar peternakan penggemukan sapi dan diperlukan adanya kerjasama antara Kementerian Pertanian dan Kementerian Kesehatan dengan melakukan surveilans dan penyuluhan yang berkelanjutan kepada peternak terkait pentingnya bahaya resistensi antibiotik dan pengawasan penggunaan antibiotik di peternakan dengan meningkatkan penggunaan probiotik dan vaksinasi sebagai upaya mengurangi penggunaan antibiotik yang berlebihan.
Ucapan Terima Kasih
Peneliti mengucapkan terima kasih atas bantuan dari Bagian Kesehatan Masyarakat Veteriner, Fakultas Kedokteran Hewan IPB, Balai Besar Karantina Pertanian Tanjung Priok, dan Balai Pengujian Mutu dan Sertifikasi Produk Hewan (BPMSPH).
DAFTAR PUSTAKA
Ahrens FA, Martin RJ. 2008. Antimicrobial Drugs. Di dalam: Hsu WA, editor. Handbook of Veterinary Pharmacology. Iowa (US): Wiley Blackwell.
Baggot JD. 1977. Principles of Drug Disposition in Domestic Animals. Philadelphia (US): Saunders Co.
Bari SB, Mahajan BM, Surana SJ. 2009. Resistance to antibiotic: a global issue of concern. Asian J Pharm Educ Clin Res. 2(2):189-195.
Bhunia AK. 2008. Foodborne Microbial Pathogens: Mechanisms and Pathogenesis.
New York (US): Springer.
Bischoff KM, Edrington TS, Callaway KJ, Genovese KJ, Nisbet DJ. 2004. Characterization of antimicrobial resistant Salmonella Kinshasa from dairy calves in Texaz. App Microbiol. 38(2):140-145. DOI:10.1111/K,1472-765x.2003.01476.x
21 Brander GC, Pugh DM, Bywater RJ, Jenkins WL. 1991. Veterinary Applied
Pharmacology and Therapeutics. London (UK): Bailliere Tindal.
Budiharta S. 2002. Kapita Selecta Epidemiologi Veteriner. Yogyakarta (ID): Bagian Kesehatan Masyarakat Veteriner FKH UGM.
Butaye P, Deviase LA, Hasebrouck F. 2003. Antimicrobial growth promoters used in animal feed: effects of less well known antibiotics on Gram-positive bacteria. ClinMicrobiol Rev. 16 (2): 175 – 188.
[BSN] Badan Standardisasi Nasional. 2008. SNI 2897: 2008 Tentang Metode Pengujian Cemaran Mikroba dalam Daging, Telur dan Susu Serta Hasil Olahannya. Jakarta (ID): Badan Standardisasi Nasional.
Chambers HF. 2006. Chemotherapy of Microbial Disease. Di dalam: Bruton LL, Lozo JS dan Parker KL, editor. Godman and Gilman’s The Pharmacological Basis of Therapeutics. Edisi ke -11. New York (US): McGraw-Hill.
[BBKP TANJUNG PRIOK] Balai Besar Karantina Pertanian Tanjung Priok. 2013. Laporan Tahunan BBKP Tanjung Priok 2013. Jakarta (ID): BBKP Tanjung Priok.
[CFSPH] The Center for Food Security and Public Health. 2005. Salmonellosis: Paratyphoid, Non-typhoidal Salmonellosis. Iowa (US): Institute for International Cooperation in Animal Biologics.
[CLSI] Clinical and Laboratory Standards Institute. 2012. Performance Standarts for Antimicrobial Susceptibility Testing; Twenty SecondInformational Supplemant. West Valley (US): Clinical and Laboratory Standards Institute. Dargatz DA, Fedorka CPJ, Ladely SR, Feris KE. 2000. Survey of Salmonella
serotypes shed and feces of beef cows and their antimicrobial susceptibility patterns. J Food Prot. 63:1648-1653.
Davis MA, Hancock DD, Besser TE, Daniels JB, Baker KNK, Call DR. 2007. Antimicrobial resistance in Salmonella enterica serovar Dublin isolates from beef and dairy sources. Vet Microbiol. 119: 221-230.
[Ditjen PKH] Direktorat Jenderal Peternakan dan Kesehatan Hewan Kementerian Pertanian. 2012 Press Release Konfrensi Pers Direktorat Jenderal Peternakan dan Kesehatan Hewan Tentang Supply Demand Daging Sapi/Kerbau sampai dengan Desember 2012. Jakarta (ID): Direktorat Jenderal Peternakan.
[Ditjen PKH] Direktorat Jenderal Peternakan dan Kesehatan Hewan Kementerian Pertanian. 2013 Press Release Konfrensi Pers Direktorat Jenderal Peternakan dan Kesehatan Hewan tentang Supply Demand Daging Sapi/Kerbau Sampai Dengan Desember 2013. Jakarta (ID): Direktorat Jenderal Peternakan.
Dzidic S, Suskovic J, Kos B. 2008. Antibiotic resistance mechanism in bacteria: Biochemical and genetic aspect. Food Technol Biotechnol. 46(1):11-21. Esaki H, Morioka A, Ishihara K, Kojima A, Shiroki S, Tamura Y, Takahashi T.
2004. Antimicrobial susceptibility of Salmonella isolated from Cattle, swine and poultry (2001-2002); report from the Japanese veterinary antimicrobial resistance monitoring program. JAC. 53:266-270.DOI: 10.1093/jac/dkb081. Estoepangestie ATS, Anggita FA, Setiawan B. 2014. Gambaran Resistensi
Kuman Salmonella spp. yang diisolasi dari daging sapi. Vet Medika. 7: 67-72. [FDA] Food and Drug Administration. 2011. Bacteriological Analytical Manual
Chapter 5 Salmonella. [internet].[diacu 2011 Mei 28]. Tersedia dari:
22
Fedorka CPJ, Dargatz DA, Thomas LA, Gray JT. 1998. Survey of Salmonella serotypes in feedlot cattles. J Food Prot. 61:525-530.
Fegan N, Vabderlinde P, Higgs G, Desmarchelier P. 2004. Quantification and prevalence of Salmonella in beef cattle presenting at slaughter. J App Microbiol. 97:892-898.
Foley SL, Lynne AM. 2008. Food animals-assosiated Salmonella challenges: Pathogenecity and antimicrobial resistance. J Anim Sci. 86: 173-187.
Fraser CM. 1986. The Merck Veterinary Manual, a Handbook of Diagnosis, Therapy, and Diseases Prevention and Control for the Veterinarian. Edisi ke-6. Rahway (US): Merck.
Franco BD, Landgraf M, Destro MT, Gelli D. 2003. Foodborne Diseases in Southern South America. Di dalam: Miliotis MD, Bier JW, editor. International Handbook of Foodborne Pathogens. New York (US): Marcel Dekker, Inc.
GAO REPORT. 1999. Food Safety: The Agricultural Use of Antibiotics and Its Implications for Human Health [internet]. [diacu 1999 April 28]. Washington (US): GAO. hlm 1-23; [diunduh 2014 Juni 24]. Tersedia dari: http:// www.gao.gov.
Hubber WG. 1977. Veterinary Pharmacology and Therapeutics. Iowa (US): The Iowa State University Pr.
Hugas M, Tsigarida E, Robinson T, Colistri P. 2009. The EFSA Scientific Panel on Biological Hazard first mandate: May 2003 – May 2006. Insight into foodborne zoonosis. Trends Food Sci Technol. 20: 188-193.
Hur J, Jawale C, Lee JH. 2012. Antimicrobial resistance of Salmonella isolated from food animals: A review. Food Res Int. 45: 819-830.
Istiana. 1998. Resistensi Salmonella spp. isolat itik alabio terhadap beberapa antibiotik. JITV. 3(2):106-110.
Istiantoro YH, Gan HS. 2008. Antimikroba Penisilin, Sefalosporin dan Antibiotik Betalaktam lainnya. Farmakologi dan Terapi. Edisi 5. Jakarta (ID): Balai Penerbit FKUI.
Jawetz E. 1997. Principle of Antimicrobial Drug Action. Basic and Clinical Pharmacology. Edisi ke-3. Norwalk (US): Appleton and Lange.
[JETACAR] Joint Expert Advisory Committee On Antibiotic Resistance Australia. 1999. The use Antibiotic in Food Producing Animals: Antibiotic resistance Bacteria in Animals and humans. Darwin (AU): Commonwealth of Australia.
Kan CA. 1993. Residues of veterinary drugs in eggs. Poultry Sci. 49: 291-292. Kariuki S, Hart A. 2001. Global aspects of antimicrobial resistant enteric bacteria.
Curr Opin Infect Dis. 14: 579-86.
Krisnaningsih MMF, Asmara W, Wibowo MH. 2005. Uji sensitivitas isolat Eschericia coli patogen pada ayam terhadap beberapa jenis antibiotik. J Sain Vet. 1:13-18.
Lay BW, Hastowo S. 1992. Mikrobiologi. Bogor (ID): Institut Pertanian Bogor Rajawali Pres.
Lawley R, Cyrtis L, Davis J. 2008. The Food Safety Hazard Guidebook. Cambridge (GB): RSC Pub.
23 Lukman DW, Purnawarman T. 2008. Pemeriksaan Presumtif Salmonella. Di dalam: Lukman DW, Purnawarman T, editor. Penuntun Praktikum Higiene Pangan. Bogor (ID): Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Molbak K, Olsen JE, Wegener HC. 2006. Salmonella Infection, Di dalam: Riemann
HP, Cliver DO, editor. Foodborne Infections and Intoxications. California (US):
Elsevier.
Munaf S, Chaidir J. 1994. Obat Antimikroba. Jakarta (ID): Farmakologi UNSRI EGC.
Murdiati TB. 1997. Pemakaian antibiotika dalam usaha peternakan. Wartazoa. 6(1): 18-22.
Namata H, Welby S, Aerts M, Faes C, Abrahantes JC, Imberechts H, Vermeersch K, Hooyberghs J, Méroc E, Mintiens K. 2009. Identification of risk factors for the prevalence and persistence of Salmonella in Belgian broiler chicken flocks. Prev Vet Med. 90:211-222.
National Research Council Institute of Medicine. 1998. Issues Spesific of Antibiotic. Di dalam: National Research Council Institute of Medicine. The Use of Drugs in Food Animals: Benefits and Risks. Washington DC (US): National Academy Pr.
Nógrády N, Kardos G, Bistyák A, Turcsányi I, Mészáros J, Galántai Zs, Juhász Á, Samu P, Kaszanyitzky JÉ, Pászti J, Kiss I. 2008. Prevalence and characterization of Salmonella infantis isolates originating from different points of the broiler
chicken–human food chain in Hungary. Int J FoodMicrobiol. 127:162–167.
Noor SM, Poeloengan M, Andriani. 2006. Kepekaan isolat Salmonella Enteritidis dan Salmonella Hadar yang diisolasi dari daging ayam terhadap antibiotika. Seminar Nasional Teknologi Peternakan dan Veteriner 2006. Bogor (ID): Balitvet.
Pires SM, Vieira AR, Perez E, Lo Fo Wong D, Hald T. 2012. Attributing human foodborne illness to food sources and water in latin America and the Caribbean using data from outbreak investigations. Int J Food Microbiol. 152:129–138. Plumb DC. 2005. Plumb’s Veterinary Drug Handbook. Edisi ke-5. New Jersey
(US): Wiley Blackwell.
Poppe C. 2000. Salmonella infection in the domestic fowl. Di dalam: Wray C, Wray A, editor. Salmonella in Domestic Animals. Oxon (UK): CABI.
Pratt WB. 1973. Fundamentals of Chemotherapy. New York (US): University Pr. Quinn PJ, Markey BK, Carter ME, Donnely WJ, Leonard FC. 2001. Veterinary
Microbial Disease. Iowa (US): Blackwell Sci.
Ray B. 2001. Fundamental Food Microbiology. Edisi Kedua. Boca Raton (US): CRC Pr.
Refdanita, Maksum, Nurgani A, Endang P. 2004. Pola kepekaan bakteri terhadap antibiotika di ruang rawat intensif rumah Sakit Fatmawati Jakarta Timur tahun 2001-2002. Makara Kesehatan. 8: 41-48.
Schip M. 2012. Country Report: Australia. Proceedings of The International Workshop on the Use of Antimicrobials in Livestock Production and Antimicrobial Resistance in The Asia-Pacific Region. Bangkok (TH): Animal Production and Health Commision for Asia and the Pacific (APHCA).