SCANNING ELECTRON MICROSCOPY
SRI RAHAYU SULISTIYANI
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
SRI RAHAYU SULISTIYANI. Optimasi Penumbuhan Apatit pada Mucoza Ampela Ayam :
Hamburan Difraksi Sinar-X dan Scanning Electron Microscopy. Dibimbing oleh MERSI
KURNIATI DAN YESSIE WIDYA SARI.
Senyawa kalsium fosfat karbonat sebagai mineral tulang sintesis yang ditumbuhkan diatas permukaan mucoza ampela ayam sebagai matriks, dibuat dari campuran (NH4)2HPO4 dan
(NH4)2CO3 dengan rasio molar CO3
: PO4
yang bervariasi (0.15:0.3, 0.5:1.02, 0.9:1.8) dan larutan Ca(NO3)2 dengan rasio molar Ca/P sebesar 1.67. Hamburan Difraksi Sinar-X dilakukan
untuk mengidentifikasi fase serta ukuran kristal sedangkan SEM (Scanning Electron Microscopy)
untuk melihat morfologi apatit karbonat yang ditumbuhkan diatas mucoza ampela ayam. Hasil presipitasi menunjukkan larutan dengan rasio molar CO3
dan PO4
= 0.15: 0.3 merupakan konsentrasi optimal untuk pertumbuhan apatit pada mucoza, dibuktikan dengan hadirnya puncak mucoza pada sampel ini. Penambahan mucoza pada konsentrasi ini juga mengakibatkan penurunan ukuran kristal. Foto SEM memperlihatkan apatit karbonat yang ditumbuhkan di mucoza ampela ayam secara umum memiliki morfologi yang menyerupai kelompok partikel tidak teratur dan gumpalan bulat-bulat kecil.
OPTIMASI PENUMBUHAN APATIT PADA MUCOZA
AMPELA AYAM: HAMBURAN DIFRAKSI SINAR-X DAN
SCANNING ELECTRON MICROSCOPY
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Fisika
SRI RAHAYU SULISTIYANI
G74103051
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi
: Optimasi Penumbuhan Apatit pada Mucoza Ampela
Ayam : Hamburan Difraksi Sinar-X dan
Scanning
Electron Microscopy
Nama
: Sri Rahayu Sulistiyani
NIM :
G74103051
Menyetujui :
Pembimbing I
Pembimbing II
Mersi Kurniati, M.Si
Yessie Widya Sari, M.Si
NIP. 132 206 237
Mengetahui
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Prof. Dr. Ir. Yonny Koesmaryono, MS
NIP. 131 473 999
RIWAYAT HIDUP
Penulis dilahirkan di Depok pada tanggal 16 April 1984 sebagai anak keempat dari empat bersaudara, putri pasangan Suparno, BA dan Ny. Siti Amsiah.
Tahun 2002, penulis lulus dari SMUN 4 Depok dan tahun 2003 masuk IPB melalui jalur SPMB (Seleksi Penerimaan Mahasiswa Baru). Penulis memilih Program Studi Fisika, Departemen Fisika, Fakultas Matematika dan Ilmu Pengetahuan Alam.
PRAKATA
Subhanallah, Alhamdulillahirobbilaalamin, Puji Syukur kepada Allah SWT atas segala nikmat yang selalu diberikan-Nya sehingga skripsi ini berhasil diselesaikan. Sholawat dan salam semoga tercurah kepada uswatun hasanah Nabi Muhammad SAW beserta keluarga,sahabat dan para pengikutnya. Skripsi ini berjudul Optimasi Penumbuhan Apatit pada Mucoza Ampela Ayam : Hamburan Difraksi Sinar-X dan Scanning Electron Microscopy.
Penulis menyadari bahwa karya ini masih terdapat banyak kekurangan, sehingga penulis sangat mengharapkan krtik dan saran yang membangun, sehingga karya ini dapat bermanfaat di masa mendatang.
Terimakasih sedalam-dalamnya penulis ucapkan kepada pihak-pihak yang telah membantu penyelesaian karya ilmiah ini, antara lain :
Ibu Mersi Kurniati, M.Si selaku pembimbing I dan Ibu Yessie Widya Sari, M.Si selaku pembimbing II yang telah membimbing penulis dengan keluasan ilmu, kesabaran, motivasi dan semangatnya. Semoga setiap kata dan ilmu yang telah diberikan menjadi sebuah amal kebaikan yang harum dan kekal dimata Allah SWT.
Bapak Dr.Ir. Irzaman, M.Si dan Bapak Jajang Juansah, M.Si, selaku dosen penguji untuk masukan yang berarti bagi penulis.
Bapak Drs. Nur Indro selaku Komisi Pendidikan Departemen Fisika
Bapak Setyanto, seluruh dosen dan staf Departemen Fisika FMIPA IPB atas ilmu,
perhatian dan bantuan yang diberikan.
Program Hibah Penelitian A2 Departemen Fisika, FMIPA IPB tahun 2007
Pak Bambang Sugiono dari Ilmu Material UI atas bantuan ilmu XRD-nya.
Matur nuwun sanget untuk Ibu Ari dari Puspiptek-BATAN, Serpong atas SEM-nya.
Mas Adhi-Teknik Metalurgi UI atas SOP XRD-nya.
Bapak dan Mama tersayang, yang selalu mendoakan penulis di setiap waktu, perhatian dan kasih sayangnya yang tidak terbatas. Hanya Allah SWT yang bisa membalas semuanya.
Mas Benk, Mba Esti dan dr.Setiyo, kaka terbaik yang ulis punya. Terimakasih atas perhatian, keceriaan dan kasih sayang, dukungan baik materi atau yang lain. Maaf ademu sering merepotkan.
Mba Wiet, Mba Zami dan Mas Aan, Mas Dony, thanks for everything. Keponakan yang bandel-bandel tapi lucu , Dian Nafi, Tiara Nafi, Rizki Muhammad Raydi, mudah-mudahan menjadi anak yang pintar, sholeh dan sholehah.
Mba Esti Riyani, S.Si, Te-O-Pe Be-Ge-Te, makasih mba ilmu&wejangannya.
Ukhuwah sejati di PEMANIS ( Ka Ucup, Konde, Ria, Elpi, Nungki, Nopit), TPA Nuris (Lina, Mba Im, Mba Atun,Nuri, Uni, Mba Em, Lia, Elin, rita), syukron jiddan tuk perhatian setiap harinya. My Brothers n My Sisters di SERRUM-G... Dont Give Up!!
Tim HAP : Adi-Irma-Setia-Atiq-Mba Melly-Opik-Priyo-Mba Arsy
My lovely friends ( Sarma, Yudha, Rina, Vita, Jowie, Yuli, Susu, Bodor, Mba Arum, Ica, , Sriti, Naniq ). Mba Vera, Mba Ima, Mba Risna, Mba Ina dan Mba Helvy Tiana Rosa atas “cuti” yang diberikan.
Thank’s to my partners : Irma Nurmala ‘n Adi Purwa atas perjuangan penelitian kita, rekan-rekan fisika 40 (Rika, Ai, Ziah, Asih, Set, Atik, Lira, Mami Euis, Euis Tasik, Ica, Gita, Mba yul, Ita, Nenden, Adiyanto, Opik, Priyo, Awit, Marwan, Tahyudi, Izal, Hudar, Dicky, Azis, Alwi, Subhi, Kusnadi, Mardani, Mada, Eki, Ucup, Bambang) atas kenangan yang telah terukir bersama. Fisika 39-41-42 atas semangatnya.
Bogor, September 2007
Ya Rahman…..Ya Rahim…. Ya Latif…
Jadikanlah segala apa yang hamba lihat, segala apa yang hamba sentuh,
segala apa yang hamba dengar menjadi sesuatu yang bisa
mendekatkan hamba kepada-Mu…
“Bersungguh-sungguhlah dengan kehinaanmu, niscaya Ia menolongmu dengan
kemuliaan-Nya,
Bersungguh-sungguhlah dengan ketidakberdayaanmu, niscaya Ia menolongmu
dengan kekuasaan-Nya. Bersungguh-sungguhlah dengan kelemahanmu, niscaya
Ia menolongmu dengan kekuatan-Nya
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1
Latar Belakang ... 1
Perumusan Masalah ... 1
Tujuan Penelitian ... 1
Tempat dan Waktu Penelitian ... 1
TINJAUAN PUSTAKA ... 2
Tulang ... 2
Mineral Tulang ... 2
Mineral Apatit ... 3
Struktur Apatit ... 3
Pengaruh Ion CO32- dalam kristal Apatit ... 4
Matriks Kolagen ... 4
Sintesis Hidroksiapatit ... 5
Hamburan Difraksi Sinar-X ... 5
Scanning Electron Microscopy (SEM) ... 6
BAHAN DAN METODA ... 6
Bahan dan Alat ... .6
Persiapan Sampel ... 6
Persiapan Presipitasi ... 6
Penyaringan dan Pengeringan Endapan ... 6
Karakterisasi sampel dengan XRD ... 6
Karakterisasi sampel dengan SEM... 7
HASIL DAN PEMBAHASAN ... 8
Analisis Hasil Difraksi Sinar-X... 8
Analisis Mikrograf SEM ... 10
SIMPULAN DAN SARAN ... 12
Simpulan ... 12
Saran ... 12
DAFTAR PUSTAKA ... 12
DAFTAR TABEL
Halaman
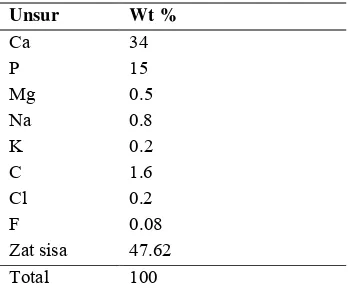
1 Kandungan unsur inorganik dalam Tulang ... 2
2 Variasi Ca/P kalsium fosfat ... 3
3 Ukuran kristal tanpa penambahan mucoza variasi konsentrasi CO3:PO4 bidang 002 ... 9
4 Ukuran kristal pada sampel dengan dan tanpa penambahan mucoza variasi konsentrasi CO3 : PO4 ... 9
DAFTAR GAMBAR
Halaman 1 Tulang belakang manusia ... 2
2 Struktur kristal hidroksiapatit yang di proyeksikan sepanjang sumbu-c dan sepanjang sumbu-a ... 3
3 Struktur hidroksiapatit (a) Unit sel hidroksiapatit (b) Tampak atas unit sel hidroksiapatit ... 4
4 Struktur kolagen ... 5
5 Difraksi Sinar-X oleh kristal ... 5
6 Skema Difraktometer Sinar-X ... 6
7 Skema Scanning Electron Microscope (SEM) ... 6
8 Diagram alir penelitian ... 7
9 Pola difraksi sinar-X sampel 1a, 2a dan 3a ... 8
10 Pola difraksi sinar-X sampel 1b, 2b dan 3b ... 8
11 Mikrograf SEM mucoza ampela ayam perbesaran 10000x ... 10
12 Mikrograf SEM perbesaran 10000x. (a) Sampel 1a. (b) Sampel 2a. (c) Sampel 3a. (d) Sampel 1b. (e) Sampel 2b. (f) Sampel 3b ... 11
DAFTAR LAMPIRAN
Halaman 1 Skematik proses presipitasi ... 15
2 Bahan dan alat penelitian ... 16
3 Lokasi maksima profil difraksi sinar-X kalsium fosfat karbonat sampel 1,2 dan 3 untuk tanpa dan dengan penambahan mucoza ampela ayam ... 18
4 Presentase fase AKB, AKA, HAP,OKF dan mucoza terhadap lokasi maksima ... 19
5 Data JCPDS (Joint Committee on Powder Diffraction Standards) ... 20
6 Pola XRD mucoza ampela ayam ... 21
7 Pola XRD sampel 1a (tanpa mucoza) dengan konsentrasi CO32- : PO43- = 0.15 : 0.3 ... 22
8 Pola XRD sampel 2a (tanpa mucoza) dengan konsentrasi CO3 : PO4 = 0.5 : 1.02 ... 23
9 Pola XRD sampel 3a (tanpa mucoza) dengan konsentrasi CO32- : PO43- = 0.9 : 1.8 ... 24
10 Pola XRD sampel 1b (penambahan mucoza) dengan konsentrasi CO3 : PO4 3- = 0.15 : 0.3 ... 25
11 XRD sampel 2b (penambahan mucoza) dengan konsentrasi CO32- : PO43- = 0.5 : 1.02 ... 26
PENDAHULUAN
Latar BelakangKejadian patah tulang atau kelainan metabolik pada tulang dapat menimpa setiap orang kapan saja. Kelainan metabolik tulang biasanya ditandai dengan menurunnya massa tulang (osteoporosis) dan menurunnya mineralisasi tulang (osteomalasia)1. Jika kelainan metabolik tulang ini terjadi pada usia anak-anak sampai remaja, dapat segera pulih karena hormon-hormon tubuhnya masih sangat mencukupi untuk proses perbaikan tulang. Pada usia lanjut, hal ini relatif sulit, karena ketidakseimbangan sistem hormon tubuh. Untuk itu di perlukan adanya suatu material subsitusi tulang yang diharapkan menjadi alternatif untuk mengatasi kelainan metabolik tulang pada usia lanjut. Material subsitusi tulang yang digunakan juga harus bersifat dapat diterima oleh tubuh (biokompatibel) dan dapat berintegrasi dengan cepat.
Fungsi tulang selain sebagai pembentuk rangka badan, juga sebagai tempat deposit kalsium, fosfor, magnesium dan garam2. Adapun fungsi kalsium dalam tubuh sangat penting dan berhubungan erat dengan fosfor. Kedua unsur itu sebagian besar terdapat bersamaan dalam bentuk senyawa kalsium fosfat. Senyawa kalsium fosfat dalam tulang hadir dalam dua fase, yaitu, fase amorf dan fase kristal. Fase stabil kristal kalsium fosfat mempunyai rumus kimia Ca10 (PO4)6(OH)2
atau yang lebih dikenal dengan nama hidroksiapatit (HAP). Kristal kalsium fosfat dalam jaringan keras dikenal dengan kristal apatit, yang mempunyai formula kimia berbeda dengan hidroksiapatit, namun memiliki struktur kristal yang sama2.
Tulang terdiri dari substansi organik yaitu matriks kolagen dan substansi inorganik yaitu kalsium dan fosfor sedangkan sisanya adalah magnesium, sodium, hidroksil, karbonat dan
fluorida1. Kehadiran ion karbonat dapat
menghambat pertumbuhan kristal kalsium fosfat. Selain itu ion karbonat juga mudah masuk dalam struktur kristal HAP3. Partikel berbentuk sperules sesuai dengan foto SEM fase amorf kalsium fosfat2. Campuran amorf dan kristal tampak dalam foto SEM sebagai gumpalan dengan tepi tidak teratur4.
Matriks berfungsi sebagai media pertumbuhan bagi mineral tulang. Pembuatan kalsium fosfat sintesis yang ditumbuhkan pada matriks organik diharapkan mampu menghasilkan biokompatibel biomaterial subsitusi tulang yang bersifat ekonomis,
sekaligus dapat mempercepat proses penyembuhan kelainan metabolik tulang.
Perumusan Masalah
Keberadaan ion asing seperti CO3 2-
dalam kalsium fosfat sintesis dapat mempengaruhi fase yang terbentuk dan ukuran kristal dari apatit. Fase amorf dan ukuran kristal yang kecil memungkinkan bagi biomaterial sintesis masuk dan tumbuh dalam tulang. Penambahan matriks organik sintesis berfungsi sebagai wadah tumbuh bagi apatit.
Variasi konsentrasi CO32- : PO43- serta
penambahan matriks organik sintesis merupakan optimasi yang dilakukan untuk mendapatkan hasil yang sesuai dengan kondisi fisiologis tulang.
Tujuan Penelitian
1. Membuat senyawa kalsium fosfat karbonat sintesis variasi konsentrasi hasil presipitasi dari larutan jenuh ion kalsium dan fosfat yang ditumbuhkan pada permukaan mucoza ampela ayam sebagai matriks. 2. Melakukan identifikasi fase dan ukuran
kristal serta morfologi kristal apatit
karbonat dengan alat XRD (X-Ray
Diffraction) dan SEM (Scanning Electron Microscope).
Tempat dan Waktu penelitian
TINJAUAN PUSTAKA
TulangKomposisi tulang terdiri atas substansi organik 35 %, substansi inorganik 45% dan air 20%. Substansi organik terdiri atas sel-sel tulang dan substansi organik intraseluler atau matriks kolagen1. Matriks tulang diperlukan sebagai substrat bagi deposisi mineral tulang. Dalam keadaan normal, tulang kita senantiasa berada dalam keadaan seimbang antara proses pembentukan dan penghancuran. Ada tiga jenis sel tulang yang berperan dalam pembentukan dan penghancuran tulang, yaitu, osteoblast, osteosit dan osteoklas. Sebagai sel, osteoblas dapat memproduksi substansi organik intraseluler atau matriks dengan cara mengeluarkan enzim tulang atau alkali fosfatase, dimana akan terjadi kalsifikasi di kemudian hari. Sesaat setelah osteoblas dikelilingi oleh matriks, disebut osteosit. Osteosit merupakan osteoblas yang sudah dewasa dan tetap bertahan dalam matriks.
Kalsium hanya dapat dikeluarkan dari tulang melalui proses aktivitas osteoklasis, dimana yang berperan adalah osteoklas. Osteoklas akan melepaskan enzim protease yang nantinya akan merusak matriks. Fase yang satu akan merangsang terjadinya fase yang lain. Dengan demikian tulang senantiasa beregenerasi1.
Substansi inorganik berisi mineral tulang diantaranya kalsium, fosfor, magnesium, natrium dan yang lainnya. Komponen mineral yang sangat dominan dalam tulang yaitu kalsium dan fosfor dalam bentuk senyawa yaitu hidroksiapatit (HAP).
Komponen kalsium dan fosfor membuat tulang keras dan kaku. Kisi tulang terdiri dari 2 lapis, yaitu tulang kompak (75% dalam tubuh) dan tulang spon (25%). Tulang kompak adalah tulang dengan struktur halus, keras dan rapat. Tulang kompak juga tersusun atas pilar-pilar sel tulang, yang masing-masing dengan rongga ditengah. Rongga-rongga diisi dengan sumsum tulang penghasil sel darah merah. Tulang spon diisi dengan kolagen, garam kalsium dan mineral-mineral lain. Ruang-ruang berstruktur mirip sarang lebah mengandung pembuluh darah dan sumsung tulang1.
Proses pembentukan dan penimbunan sel-sel tulang sampai tercapai kepadatan maksimal berjalan paling efisien sampai umur mencapai 30 tahun. Semakin bertambah usia, semakin sedikit jaringan tulang yang dibuat.
Gambar 1 Tulang belakang manusia5.
Mineral Tulang
Mineralisasi dalam organisme hidup didefinisikan sebagai deposisi material inorganik pada jaringan keras dalam kondisi fisiologi2. Mineral dalam jaringan keras
banyak didominasi oleh kalsium dan fosfor dalam bentuk senyawa. Senyawa kalsium fosfat dalam tulang hadir dalam dua fase, yaitu fase amorf dan fase kristal yang bervariasi dengan tiga faktor utama, yaitu jenis spesies, jenis jaringan dan umur jaringan2. Hadirnya kedua fase ini mendukung dua fungsi tulang dalam tubuh yaitu penompang pertumbuhan tubuh dan kekuatan. Bentuk kristal yang stabil dari senyawa kalsium fosfat biasanya disebut hidroksiapatit (HAP). Stoikiometri HAP memiliki formula Ca10(PO4)2(OH)2, struktur kristal hexagonal
dengan dimensi sel satuan 9,42 Å dalam sumbu a dan b, dan 6,88 Å sepanjang sumbu-c6.
Tabel 1 Kandungan unsur inorganik dalam
tulang6
Unsur Wt %
Ca 34 P 15 Mg 0.5 Na 0.8 K 0.2 C 1.6 Cl 0.2 F 0.08
Zat sisa 47.62
Mineral Apatit
Apatit adalah istilah umum untuk kristal mineral dengan komposisi M10(ZO4)6X2.
Banyak elemen yang menempati keadaan M,Z dan X yaitu, M dapat terdiri dari unsur Ca, Sr, Ba, Cd, Pb, dst, dan Z terdiri dari
unsur P,V, As, S, Si, Ge, CO3, dst,
sedangkan X terdiri dari unsur CO3, F, Cl, OH,
O, Br, dst5. Mineral apatit memiliki beberapa jenis, diantaranya fluoroapatit (Ca10(PO4)6F2),
kloroapatit (Ca10(PO4)6Cl2), hidroksiapatit
(Ca10(PO4)6(OH)2), podolit (Ca10(PO4)6CO3),
dahlit (Ca10)(PO4,CO3)6(OH)2, frankolit
(Ca10(PO4,CO3)6(F,OH)2). Apatit biologi
selain ditemukan pada tulang dan gigi dari vertebrata, juga ditemukan pada urinari, otak, salivari , ureter, tonsil, OPPL (Ossification of the Posterior Longitudinal Ligamen of the Cervical Spine)6.
Apatit yang hadir dalam tulang mempunyai karakteristik kristanilitas rendah dan nonstoikiometri, disebabkan oleh kehadiran ion asing, sebagian ion asing masuk kedalam kisi kristal apatit, dan sebagian lain hanya diadsorpsi pada permukaan kristal. Pengaruh ion asing seperti ion karbonat dan Mg diketahui akan memperlambat proses awal presipitasi dan proses hidrolisis3.
Hidroksiapatit adalah kalsium fosfat yang mengandung hidroksida dan memiliki rasio Ca/P sebesar 1.67. Secara umum tipe dari kalsium fosfat memiliki rasio Ca/P yang bervariasi dari 2.0 sampai 0.5 (Tabel 2). Diketahui bahwa variasi harga Ca/P yang lebar dalam jaringan keras berkaitan dengan kandungan karbonat.
Tabel 2 Variasi Ca/P kalsium fosfat7
Formula Nama Ca/P
Ca10(PO4)6(OH)2 Hidroksiapatit 1.67
Ca3(PO4)2
Trikalsium
Fosfat 1.50
Ca3(PO4)2
Trikalsium
Fosfat (amorf) 1.50
Ca4(PO4)2O
Tetrakalsium
Fosfat 2.0
Ca3(PO4)2
Trikalsium
Fosfat 1.50
Ca2P2O7
Kalsium
Pirofosfat 1.0
CaO Kalsium
Oksida NA
Ca10(PO4)6F2 Fluorapatit 1.67
Senyawa kalsium fosfat bersifat kompleks, diantaranya dapat berada dalam berbagai fase. Secara eksplisit dapat dibedakan dalam lima fase dasar, satu fase amorf dan empat fase kristal yaitu kalsium fosfat amorf (KFA), dikalsium fosfat dihidrat (DKDF, CaHPO4.2H2O), oktakalsium fosfat (OKF,
Ca8H2(PO4)6. 5H2O), trikalsium fosfat (TKF,
Ca3(PO4)2) dan hidroksiapatit (HAP,
Ca10(PO4)6(OH)2). Keempat fase kristal
kalsium fosfat selain mempunyai formula yang berbeda juga memiliki struktur maupun parameter kisi kristal yang berlainan2.
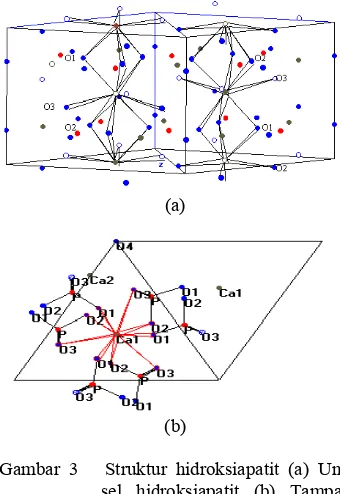
Struktur Apatit
Hidroksiapatit memiliki struktur kristal hexagonal (closed packed) dengan parameter kisi a = 9.423 Å dan c = 6.875 Å. Gambar 2 menunjukkan struktur kristal hidroksiapatit yang diproyeksikan sepanjang sumbu c. Terdapat 2 atom kalsium yang independen di dalam satu unit sel. Atom Ca(II) di kelilingi oleh 6 atom O. Atom Ca(II) membentuk segitiga normal di sumbu c. Segitiga Ca(II)
menumpuk pada sumbu-c, berotasi 60o
terhadap yang lainnya. Hidroksiapatit memiliki struktur dengan gugus OH tidak berada di pusat, tetapi bergeser ke bagian atas dari segitiga. Atom P dikelilingi oleh 4 atom O sehingga membentuk tetrahedron.
Tetrahedron PO4 hampir teratur dengan
sedikit distorsi6.
Gambar 2 Struktur kristal hidroksiapatit yang diproyeksikan sepanjang sumbu-c (a) dan sepanjang sumbu-a (b)6.
(a)
(a)
(b)
Gambar 3 Struktur hidroksiapatit (a) Unit sel hidroksiapatit (b) Tampak atas unit sel hidroksiapatit8.
Pengaruh Ion CO32- dalam kristal Apatit
Fraksi mineral dalam jaringan keras selalu mengandung CO2 (dalam bentuk ion karbonat
atau bikarbonat) meskipun jumlahnya yang sedikit8. Apatit karbonat merupakan bagian penting dalam sistem biologi sebagai komponen inorganik dalam tulang dan gigi8. Komponen mineral dalam tulang biasanya disebut “apatit biologi”dan ion karbonat (3-5 %wt) mensubsitusi ion fosfat10. CO
32- dapat
menempati posisi PO43- dan OH- yang
berturut-turut menghasilkan apatit karbonat tipe B dan tipe A6. Apatit biologi biasanya didominasi oleh apatit karbonat tipe B dan tipe A dalam jumlah yang sedikit11.
Subsitusi ion CO32- terhadap ion PO4
3-dapat menurunkan parameter kisi dalam sumbu-a, sedangkan subsitusi CO3
2-
terhadap
ion OH- dapat menaikkan parameter kisi
dalam sumbu-a4,9. Kontraksi parameter kisi a pada kristal apatit karbonat tipe B terjadi karena ion karbonat berbentuk planar yang menggantikan ion fosfat yang berbentuk tetrahedral yang relatif lebih besar2 . Pada sintesis apatit karbonat tipe B, selain menggantikan ion PO4
, CO3
juga dapat diserap atau terikat pada permukaan kristal12.
Kehadiran ion CO32- dalam larutan akan
memperlambat proses nukleasi dan
pertumbuhan kristal3. Preparasi apatit
karbonat sintetis dengan proses pemanasan sampai 1000 oC biasanya banyak ion OH yang
tergantikan9. Melalui apatit karbonat,
pembentukan tulang oleh sel-sel pembentuk tulang dapat berlangsung baik sehingga benar-benar menyerupai dan bisa menyatu dengan tulang asli.
Matriks Kolagen
Kolagen merupakan suatu protein struktur yang terdapat didalam matriks luar sel fibril dan serat tisu perantara. Sekitar 25-33% protein dalam tubuh ialah kolagen. Kolagen merupakan komponen utama lapisan kulit dermis (bagian bawah epidermis) yang dibuat oleh sel fibroblast. Kolagen adalah protein yang paling berlimpah jumlahnya pada jaringan tubuh mamalia13. Pada dasarnya
kolagen adalah senyawa protein rantai panjang yang tersusun atas asam amino alanin, arginin, lisin, glisin, prolin, serta hiroksiprolin. Glisin dalam kolagen menempati sepertiga bagian. Prolin dan hidroksiprolin membantu dalam proses pertumbuhan.
Kolagen biologis banyak ditemukan dalam tulang (Tipe I), kartilago (Tipe II) dan dalam pembuluh darah (Tipe III). Tipe I kolagen selain di tulang juga terdapat di kulit, tendon, ligamen den kornea. Kolagen merupakan jaringan konektif dan dapat diekstraksi dari jaringan hewan, seperti kulit babi, tulang paha kelinci atau tikus dan tendon sapi atau domba serta jaringan manusia seperti plasenta. Kolagen yang ditemukan pada tiap spesies tidak menunjukkan perbedaan ukuran rongga dan diameter fibril14.
Sifat biokompatibel, biodegradabel dan absorpsi yang baik dalam tubuh menjadikan kolagen dapat digunakan untuk biomaterial teknik jaringan. Walaupun demikian, kolagen mempunyai sifat mekanik yang relatif rendah dibandingkan tulang, oleh karena itu kolagen biasanya ditemukan dalam bentuk komposit, seperti kolagen-hidroksiapatit sebagai
remodeling tulang14.
Sifat ductile dari kolagen membantu
menaikkan kekerasan dan stabilitas dari hidroksiapatit. Kombinasi dari kolagen-hidroksiapatit juga membantu untuk menghambat bakteri pathogen yang mungkin hadir saat proses implantasi14. Penggunaan kolagen sebagai matriks tulang beserta hidroksiapatit sebagai mineralnya juga dapat mempercepat proses penyembuhan kelainan pada tulang, contohnya ketika terjadi retak atau fraktur.
Gambar 4 Strukturkolagen15.
elastisitas yang tinggi pada kondisi lembab tetapi getas (brittle) pada kondisi kering. Kehadiran mucoza adalah sebagai tempat/ wadah untuk nukleasi apatit16.
Sintesis Hidroksiapatit
Pembentukan HAP yang dilakukan berlangsung dalam larutan dengan konsentrasi ion kalsium dan fosfat super jenuh yang melebihi tingkat kritis yang dibutuhkan untuk terjadinya nukleasi kristal HAP. Proses pembentukan kristal HAP dipengaruhi oleh konsentrasi ion kalsium dan fosfat dalam larutan. Larutan dengan konsentrasi ion Ca2+ dan PO43- kurang dari 2mM disebut dalam
kondisi superjenuh rendah, dan larutan dengan konsentrasi kedua ion lebih dari 10 mM disebut dalam kondisi superjenuh tinggi. Larutan superjenuh rendah kristal HAP stokiometri terbentuk secara langsung tanpa melalui pembentukan fase senyawa kalsium fosfat metastabil. Larutan superjenuh tinggi, pembentukan HAP mempunyai proses yang berbeda. Presipitasi pertama dihasilkan dalam bentuk kalsium fosfat amorf (KFA). Selanjutnya, transformasi KFA menjadi fase kristal stabil HAP didahului oleh pembentukan fase kristal metastabil nonapatit seperti oktakalsium fosfat (OKF) dengan rumus kimia Ca8H2(PO4)6.5H2O, dan
dikalsium fosfat dihidrat (DFD) dengan rumus kimia CaHPO4.2H2O. Gugus hidroksil dalam
kristal HAP diperoleh dari molekul air, sehingga proses konversi KFA menjadi kristal HAP harus berlangsung dalam lingkungan air3. Proses kristalisasi dapat ditingkatkan dengan meningkatkan aktivitas ion yang bersangkutan, misalnya dengan meningkatkan laju pengadukan, menaikkan pH, menaikkan suhu, atau menghilangkan penghambat. Kehadiran ion lain dalam larutan dapat berpengaruh pada proses kristalisasi. Sebagai contoh kehadiran ion CO3
2-
dalam larutan akan memperlambat proses nukleasi dan
pertumbuhan kristal. Selain itu, kehadiran ion CO3
2-
juga mudah masuk dalam struktur kristal HAP, menggantikan ion OH- ataupun PO43- yang berturut-turut membentuk kristal
apatit karbonat tipe A dan tipe B. Umumnya apatit biologis maupun hasil sintesis yang diperoleh dengan cara presipitasi pada temperatur rendah adalah apatit karbonat tipe B, sedangkan apatit yang di produksi dari reaksi padat dan temperatur tinggi adalah apatit karbonat tipe A. Dalam penelitian yang sudah dilakukan menunjukkan bahwa kehadiran karbonat pada sintetik apatit akan menurunkan proses kristalisasi dengan meningkatnya konsentrasi karbonat. Dapat disimpulkan bahwa karbonat merupakan penghambat dalam pembentukan kristal3.
Hamburan Difraksi Sinar-X
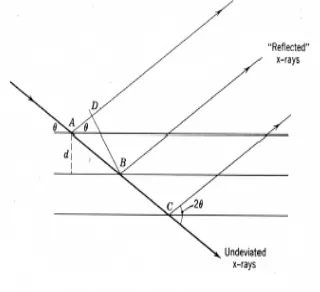
Karakterisasi dengan X-Ray Diffraction
(XRD) dilakukan untuk mengidentifikasi kristal kalsium fosfat karbonat yang ditumbuhkan pada permukaan mucoza ampela ayam. Metode difraksi sinar-X yakni seberkas sinar X jatuh pada kristal dengan sudut tertentu dan berkas-berkas itu akan berinterferensi konstruktif jika jarak ekstra yang ditempuh berkas 1 lebih besar dari berkas 2 sebesar kelipatan bilangan bulat λ. Jarak ekstra ini = 2d sin θ (Gambar 5). Dengan demikian interferensi konstruktif akan terjadi, mengikuti persamaan Bragg yaitu
2d sin θ = n λ (1)
Sinar-X dapat didifraksikan dari bidang-bidang yang berbeda dengan sudut berbeda di dalam kristal17.
θ
β
λ
cos
.
.
K
D
=
Gambar 6 Skema difraktometer Sinar-X19.
Informasi hasil pola difraksi sinar-X meliputi posisi puncak dan intensitas. Posisi puncak mengindikasikan struktur kristal dan identifikasi fase yang ada di bahan tersebut, sedangkan intensitas menunjukkan total hamburan balik dari masing-masing bidang dalam struktur kristal18.
Pola difraksi dari berbagai macam bahan
dikumpulkan dalam data JCPDS (Joint
Commitee for Powder Diffraction Standard), untuk kristal apatit karbonat tipe B dengan rumus Ca10(PO4)3(CO3)3(OH)2 pola difraksi
sinar-X mempunyai maksimum pada sudut difraksi 2θ = 29.965o, 37.538o, 38.995o, 39.893o, dan 42.035o20.
Perhitungan ukuran kristal dengan persamaan Scherrer yaitu :
(2)
λ adalah panjang gelombang sinar-X, β adalah harga lebar setengah maksimum atau FWHM (full width at half maximum), θ adalah sudut difraksi dan K adalah konstanta variasi kristal12.
Scanning Electron Microscope (SEM)
Karakterisasi dengan Scanning Electron Microscope (SEM) dilakukan untuk mengetahui morfologi sampel dalam berbagai bidang. Prinsipnya adalah sifat gelombang dari elektron yakni difraksi pada sudut yang sangat kecil. Elektron dapat didifraksikan oleh sampel yang bermuatan, untuk sampel nonkonduktor dilakukan pelapisan dengan karbon, emas atau paduan emas, yang berfungsi untuk mengalirkan muatan elekton berlebih pada sampel ke ground21. Pola yang terbentuk menggambarkan struktur dari sampel. Kelebihan mikroskop elektron ini mempunyai daya pisah (resolusi) yang sangat tinggi dan penggunaan berkas elektron dengan panjang gelombang yang pendek.
Sumber Elektron
Lensa Pemfokus
Lensa Pemfokus
Gambar 7 Skema Scanning Electron Microscope (SEM)22.
BAHAN DAN METODA
Bahan dan AlatBahan-bahan yang digunakan dalam penelitian ini adalah (NH4)2HPO4 pro analisis,
(NH4)2CO3 pro analisis, Ca(NO3)2 pro analisis,
gas nitrogen, mucoza ampela ayam, NH3 pro
analisis, aquades, Buffer pH.
Alat-alat yang digunakan adalah neraca analitik, hot plate, buret, magnetic stirrer, pH meter, kertas saring, pipet, sudip, crucibel, corong panjang, statif, thermometer, furnace, labu takar, alumunium, foil, beaker glass
pyrex, botol polyethylene, styrofoam.
Metoda Penelitian
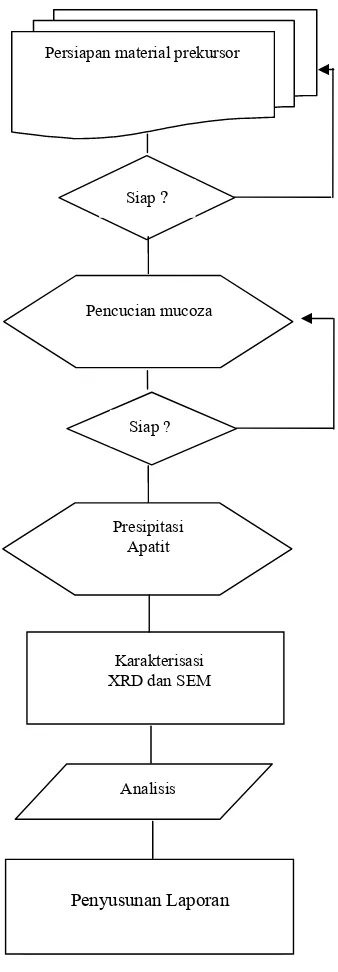
Metode penelitian ditunjukkan dalam diagram alir penelitian (Gambar 8).
Persiapan sampel
Larutan prekursor dibuat dari campuran (NH4)2HPO4, (NH4)2CO3 dan aquades
masing-masing sebanyak 50 ml dengan konsentrasi CO32-:PO43- yang bervariasi, yaitu 0.15:0.3,
0.51:1.02 dan 0.9:1.8. Larutan Ca(NO3)2
dibuat sedemikian rupa sehingga diperoleh rasio molar Ca2- dan PO4
sebesar 1.67. Mucoza ampela ayam diperoleh secara langsung kemudian dilakukan pencucian dengan melarutkannya dalam 100 ml aquades
Persiapan material prekursor
Siap ?
Pencucian mucoza
Siap ?
Karakterisasi XRD dan SEM
Analisis Presipitasi
Apatit
yang telah ditetesi amoniak, setelah itu dilakukan pemanasan didalam furnace pada temperatur 110 oC selama 2 jam. Bila mucoza masih berwarna kuning, proses pencucian diulangi, sehingga didapatkan mucoza berwarna putih.
Persiapan Presipitasi
Larutan prekursor yang telah dibuat untuk tiap sampel ditempatkan dalam beaker glass
dan gas nitrogen disemprotkan kedalam
beaker glass selama 5 menit dengan kondisi
beaker glass tertutup rapat. Pemanasan
dilakukan pada temperatur 37 0C dan
dilakukan pengadukan terus menerus, kemudian ditambahkan tetes demi tetes
larutan Ca(NO3)2 sebanyak 50 ml
menggunakan buret. Lampiran 1 memperlihatkan skema pemanasan dan pengadukan larutan diatas pemanas (hot plate) dan magneticstirrer. Pengontrolan pH sebesar 7.4 dilakukan dengan menambahkan amoniak dengan bantuan pH meter. Presipitasi dilakukan selama 5 jam, kemudian sampel diendapkan selama 24 jam.
Penyaringan dan pengeringan endapan
Hasil presipitasi disaring dengan kertas saring, lalu dibersihkan/dibilas dengan aquades panas triplo. Endapan yang terbungkus kertas saring diletakkan dalam
crucible. Hasil endapan dipanaskan 110 oC dalam furnace untuk menguapkan air yang tersisa dalam sampel. Hasil presipitasi merupakan senyawa kalsium fosfat karbonat.
Karakterisasi sampel dengan XRD
Karakterisasi dilakukan dengan Difraktometer Philips tipe PW3710 BASED, dengan sumber CoKα dengan tegangan 40 kV, arus generator 30 mA, dimulai dari sudut 2θ= 20o-50o. Sampel dalam bentuk serbuk
ditempatkan dalam plat alumunium ukuran 2x2 cm dengan bantuan perekat.
Karakterisasi sampel dengan SEM
Karakterisasi dengan Scanning Electron Microscope (SEM) merk Philips 515, dengan perbesaran 10000x. Sampel dalam bentuk serbuk ditempatkan di kaca preparat berukuran 2x2 cm dengan bentuan perekat, kemudian di letakkan diatas logam tembaga
berbentuk bulat (sampel holder) yang
berdiameter ± 5 cm, dan dilakukan proses pelapisan atau coating sampel dengan emas, setelah itu proses karakterisasi SEM baru dilakukan.
20 22 24 26 28 30 32 34 36 38 40 42 44 46 48 50
2 theta (derajat)
In te n s it a s 1A 2A 3A OKF OKF AKA OKF AKB OKF HAP AKB HAP OKF AKB AKA AKA OKF AKA OKF OKF AKA AKA AKA OKF HAP
20 22 24 26 28 30 32 34 36 38 40 42 44 46 48 50
2 theta (derajat)
In te n s ita s 1B 2B 3B AKB OKF AKA HAP OKF AKA AKB OKF Hidroksiprolin AKA AKA HAP AKB OKF OKF AKA AKB OKF HAP HAP OKF OKF
HASIL DAN PEMBAHASAN
Analisa Hasil Difraksi Sinar-X
Hamburan difraksi sinar-X dilakukan untuk mengidentifikasi fase dan ukuran kristal kalsium fosfat karbonat yang ditumbuhkan pada mucoza ampela ayam. Lokasi maksima untuk profil tiap sampel dapat dilihat pada lampiran 3.
Profil difraksi sinar-X untuk semua sampel menunjukkan grafik campuran fase amorf dan mikrokristal. Hasil analisa kemudian akan dibandingkan dengan data JCPDS. Persentase ketelitian hasil analisa dengan JCPDS dapat dilihat pada lampiran 4.
Variasi konsentrasi CO32- : PO4
3-merupakan optimasi yang dilakukan, meliputi konsentrasi 0.15:0.3 , 0.5:1.02 dan 0.9:1.8. Penambahan 0.75 gr mucoza di lakukan pada tiap sampel dikonsentrasi yang sama, sehingga sampel berjumlah 6 buah (1a-1b, 2a-2b, 3a-3b), indeks a menunjukkan sampel tanpa mucoza sedangkan indeks b menunjukkan sampel dengan mucoza.
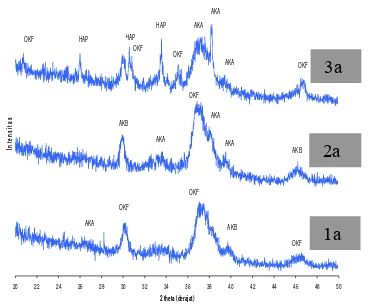
Perbandingan sampel 1a, 2a dan 3a dapat dilihat pada Gambar 9. Hasil identifikasi fase didapatkan bahwa pada sampel 1a didominasi oleh fase OKF terutama pada 2θ= 20.605°, 30.210, 36.96° dan 46.685°. Fase apatit
karbonat tipe A (AKA) muncul pada 2θ=
26.29° sedangkan apatit karbonat tipe B (AKB) terjadi pada 2θ= 39.84°.
Jika dibandingkan dengan sampel 1a, hilangnya sebagian fase OKF pada sampel 2a diiringi oleh bertambahnya fase apatit karbonat. Lokasi maksima AKA dalam
konsentrasi ini menempati 2θ= 33.485°,
38.17° dan 39.445° sedangkan AKB pada 2θ= 29.89o, 46.1o. Tampak ada sedikit perubahan bentuk pada profil XRD sampel 3a, pada konsentrasi ini hadir fase HAP di posisi maksima 2θ= 25.985°, 30.02°, 33.575° yang masing-masing mewakili bidang (200), (002) dan (210), tetapi posisi puncak dominan ditempati oleh fase OKF. Kehadiran AKA pada 2θ= 38.2° memiliki intensitas 100%, hal ini berarti pada sudut tersebut, total hamburan balik dari bidang yang dimiliki AKA relatif cukup besar.
Kehadiran ion karbonat dalam larutan akan memperlambat proses nukleasi dan pertumbuhan kristal3. Munculnya fase AKA
dan AKB menandakan bahwa ion CO3
sudah mulai masuk kedalam struktur kristal apatit untuk menggantikan posisi OH- dan PO43-.
Kenaikan konsentrasi CO3
yang terjadi pada sampel 1a-2a-3a diiringi juga dengan kenaikan konsentrasi PO43-. Sampel 1a
Gambar 9 Pola difraksi sinar-X sampel 1a, 2a dan 3a.
Gambar 10 Pola difraksi sinar-X sampel 1b, 2b dan 3b.
memiliki konsentrasi karbonat paling kecil, sehingga ion karbonat pada sampel 1a belum banyak masuk dalam struktur kristal, ditunjukkan dengan sedikitnya fase apatit karbonat yang hadir pada sampel ini dibandingkan dengan sampel 2a dan 3a.
Analisa fase yang diperoleh untuk sampel 2b dan 3b berbeda dengan sampel 1b, dikedua sampel tersebut tidak tampak lagi puncak hidroksiprolin dari mucoza, hal ini terjadi kemungkinan karena konsentrasi kedua sampel yang lebih tinggi daripada sampel 1b dan massa mucoza yang tetap. Denaturasi protein oleh reagensia seperti urea, ion H+
ringan atau OH- akan memutuskan ikatan
hidrogen, hidrofobik dan elektrostatik pada protein, sehingga membuat protein terganggu kestabilannya. Aktivitas kebanyakan protein dirusak oleh asam atau basa kuat, panas, detergen ionik, urea dan logam-logam berat12. Ada kemungkinan konsentrasi karbonat yang terus meningkat secara tidak langsung akan mengganggu kestabilan protein yang terdapat pada mucoza. Puncak AKA dan AKB sampel 2b masing-masing pada 2θ= 38.285o dan 37.49o, sedangkan di sampel 3b terdeteksi pada 2θ= 36.955o, 38.235o dan 29.985o. Fase OKF dan HAP muncul juga dikedua sampel ini. Ini berarti sampel masih terdapat fase kristal.
Hasil pola XRD secara umum memperlihatkan bahwa perubahan konsentrasi karbonat dan penambahan mucoza juga dapat menyebabkan perubahan fase dominan. Sampel 1a dengan perbandingan rasio molar terkecil (CO32-:PO43-= 0.15:0.30) memiliki
fase apatit karbonat yang lebih sedikit dibandingkan sampel 2a dan 3a. Penambahan mucoza membuat sampel 1b memiliki fase apatit karbonat yang dominan, yang sebelumnya banyak ditempati oleh fase OKF pada sampel 1a. Jika dibandingkan dengan sampel 1b, sampel 2b juga mengalami perubahan fase dominan dari sampel 2a, dari fase dominan apatit karbonat menjadi fase dominan OKF, sedangkan untuk sampel 3a menuju sampel 3b, dari fase dominan OKF menuju fase dominan apatit karbonat. Jika dilihat perubahan yang terjadi, sampel 1b dan 3b memiliki fase dominan apatit karbonat (AKA dan AKB), tetapi dalam hal ini sampel 1b memiliki fase AKB lebih banyak dari sampel 3b, seperti yang telah diketahui apatit biologi biasanya didominasi oleh apatit karbonat tipe B (AKB) dan tipe A (AKA) dalam jumlah yang sedikit11.
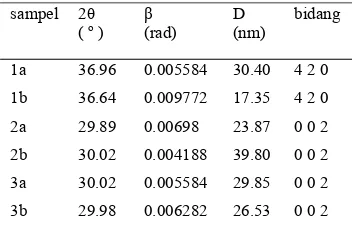
Hasil identifikasi ukuran kristal (Dhkl)
setiap sampel ditunjukkan oleh Tabel 3 dan 4, dengan perhitungan menggunakan persamaan Scherrer. Diketahui bahwa harga FWHM (β) berbanding terbalik dengan ukuran kristal. Nilai lebar setengah maksimum (FWHM) yang bertambah menjelaskan ukuran kristal menurun24.
Tabel 3 Ukuran kristal pada sampel tanpa penambahan mucoza variasi konsentrasi CO32- : PO43- bidang 002
sampel 2θ ( o ) β (rad) D (nm)
1a 30.21 0.00698 23.88
2a 29.89 0.00698 23.87
3a 30.02 0.00558 29.85
Tabel 4 Ukuran kristal pada sampel dengan dan tanpa penambahan mucoza variasi konsentrasi CO32- : PO43-
sampel 2θ
( o ) β(rad) D (nm) bidang
1a 36.96 0.005584 30.40 4 2 0
1b 36.64 0.009772 17.35 4 2 0
2a 29.89 0.00698 23.87 0 0 2
2b 30.02 0.004188 39.80 0 0 2
3a 30.02 0.005584 29.85 0 0 2
3b 29.98 0.006282 26.53 0 0 2
Tabel 3 memperlihatkan pada sampel 1a dan 2a memiliki FWHM (β) yang sama dan sedikit menurun pada sampel 3a. Ini berarti pada sampel 3a ukuran kristal cenderung naik. Kenaikan karbonat yang diiringi kenaikan fosfat pada sampel tanpa mucoza dapat mempengaruhi ukuran kristal yang terbentuk walaupun tidak signifikan.
Tabel 4 memperlihatkan perbandingan ukuran kristal antara sampel tanpa mucoza dan sampel dengan mucoza. Kenaikan
FWHM (β) yang mengindikasikan
penurunan ukuran kristal (Dhkl) signifikan
Analisis mikrograf SEM
Gambar 11 memperlihatkan hasil foto SEM mucoza ampela ayam. Mucoza yang terdiri dari protein, memiliki bentuk kelompok partikel yang menyerupai lempeng dengan permukaan cukup halus dan mempunyai ukuran yang cukup besar, diameternya ± 3-4
μm. Hasil foto mikrograf SEM untuk
presipitat kalsium fosfat karbonat dengan variasi konsentrasi CO3
: PO4
dapat dilihat pada Gambar 12. Foto SEM kalsium fosfat karbonat menunjukkan tanpa atau dengan penambahan mucoza pada umumnya terdiri dari kelompok partikel membentuk gumpalan bulat kecil-kecil.
Morfologi sampel 1a (Gambar 12a) memperlihatkan kelompok partikel pada umumnya berbentuk bulat kecil yang menyebar tidak jelas, tapi tetap dalam satu koloni besar serta jarak antar kelompok partikel yang masih sangat dekat. Hadirnya karbonat dapat mereduksi efek stabilitas
beberapa ion dalam struktur apatit12.
Kemungkinan konsentrasi karbonat yang masih rendah yang dimiliki oleh sampel 1a tampak membuat kecenderungan kelompok partikel apatit untuk menyatu lebih besar daripada sampel 2a dan 3a.
Partikel-partikel kecil pada sampel 2a (Gambar 12b) terlihat memisahkan diri walaupun masih belum jelas, dan semakin memisahkan diri pada sampel 3a (Gambar 12c). Konsentrasi kabonat dan fosfat yang cukup tinggi pada sampel 3a membuat kelompok partikel tidak lagi menunjukkan penyatuan yang baik serta memperlihatkan kelompok partikel yang semakin menjauh. Kelompok partikel pada sampel 3a juga menunjukkan tepi yang tidak rata akibat partikel-partikel kecil yang membentuk satu koloni terpisah. Bentuk kelompok partikel dengan tepi tidak rata menyerupai campuran dari fase amorf dan mikrokristal2.
Perubahan morfologi foto SEM terjadi untuk sampel dengan penambahan mucoza. Sampel 1b (Gambar 12d) yang memiliki konsentrasi karbonat terendah, memperlihatkan kelompok partikel-partikel kecil yang menyatu dengan baik serta nampak lebih rapat karena seperti terlihat ada partikel penghubung antar kelompok partikel apatit yang kemungkinan itu berasal dari partikel mucoza, sehingga penumbuhan apatit optimum pada sampel ini. Seiring dengan penambahan konsentrasi karbonat, pada sampel 2b (Gambar 12e) tampak kelompok partikel kecil-kecil yang masih bersatu mulai
Gambar 11 Mikrograf SEM mucoza ampela ayam perbesaran 10000x
memisahkan diri menjadi partikel-partikel kecil individu tetapi relatif masih kurang jelas terlihat. Kelompok partikel yang sudah memisahkan diri membentuk gumpalan-gumpalan bulat dengan ukuran tidak seragam serta memperlihatkan koloni partikel individu terlihat dengan jelas pada sampel 3b (Gambar 12f) dan berada dalam orde nanometer sampai mikrometer.
Jika dibandingkan sampel tanpa mucoza terhadap sampel dengan mucoza, tampak perbedaan kelompok partikel relatif jelas terlihat pada sampel 1a menuju 1b, sedangkan partikel pembentuk sampel 2a menyerupai partikel pembentuk sampel 2b, juga pada 3a menuju 3b dengan masing-masing memiliki bentuk yang hampir serupa. Ini berarti bahwa penambahan mucoza pada sampel 2b dan 3b tidak berpengaruh banyak pada morfologi sampel.
Hasil foto mikrograf SEM untuk sampel 1b memperlihatkan secara makro gambaran kelompok partikel kecil-kecil dalam orde mikrometer yang pada dasarnya terbentuk dari gabungan beberapa kristal yang berukuran nanometer, dan dari foto SEM juga memperlihatkan adanya interaksi dan penyatuan yang baik diantara kelompok partikel di sampel 1b. Secara keseluruhan analisa foto mikrograf SEM mendukung hasil analisa difraksi sinar-X yang menyatakan bahwa penumbuhan apatit optimum terjadi di sampel 1b.
( a )
( b )
( d )
( e )
( c ) ( f )
Gambar 12 Mikrograf SEM perbesaran 10000x. (a) Sampel 1a. (b) Sampel 2a. (c) Sampel 3a. (d) Sampel 1b. (e) Sampel 2b. (f) Sampel 3b.
Sampel 1a Sampel 1b
Sampel 2a Sampel 2b
SIMPULAN DAN SARAN
SimpulanPenumbuhan apatit pada mucoza ayam optimum terjadi di sampel 1b dengan perbandingan rasio molar terkecil (CO3
2-:PO4
3-= 0.15:0.30). Hasil identifikasi fase pola XRD menunjukkan pada sampel 1b didominasi oleh puncak apatit karbonat, pada sampel ini juga terdeteksi puncak hidroksiprolin yang merupakan penyusun kolagen pada mucoza. Ukuran kristal yang kecil juga diperoleh pada sampel ini. Hasil keseluruhan analisis XRD memperlihatkan fase apatit karbonat (AKA dan AKB) terbentuk disemua sampel disamping itu terbentuk juga fase OKF dan HAP. Sampel 1a dengan perbandingan rasio molar terkecil (CO32-:PO43-= 0.15:0.30) memiliki fase
apatit karbonat yang lebih sedikit dibandingkan sampel 2a dan 3a.
Hasil foto SEM sampel 1b memperlihatkan kelompok partikel dengan penyatuan yang baik dan lebih rapat dibanding dengan sampel 2b dan 3b yang cenderung meperlihatkan kelompok partikel dengan gumpalan-gumpalan bulat yang mulai memisahkan diri. Kenaikan karbonat dapat mengurangi stabilitas dari kolagen yang terdapat mucoza.
Saran
Untuk penelitian lebih lanjut dengan menggunakan metode presipitasi, diperlukan ketelitian terutama dalam hal pengaturan suhu, pH, pengadukan. Jika menggunakan material organik seperti mucoza, perlu juga divariasikan massa dari mucoza untuk mengetahui seberapa banyak apatit yang tumbuh.
DAFTAR PUSTAKA
[1] Rasjad C. 2003. Pengantar Ilmu
Bedah Ortopedi. Makassar : Bintang Lamumpatue.
[2] Soejoko DS. 1999. Kajian komposisi
dan struktur senyawa mineral
dalam kutikula Macrobrachium
Rosenbergii dan Penaeus Monodon serta evolusinya selama perioda molting. [disertasi]. Bandung: Institut Teknologi Bandung
[3] Soejoko DS, Wahyuni S. 2002. Spektroskopi Inframerah Senyawa
Kalsium Fosfat Hasil Presipitasi. Makara Seri Sains 6 (No 6) : 117-120 [4] Riyani E. 2005. Karakterisasi
Senyawa Kalsium Fosfat Karbonat Hasil Pengaruh Penambahan Ion F
dan Mg 2- [skripsi] Bogor : Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor
[5] Pusat Maklumat Rakyat. Jabatan
Penerangan Malaysia. Khasiat
pemakanan penting bagi tulang. 2006. http://www.yahoo.com/pmr.penerang an .gov.my/article.cfm
[6] Aoki Hideki. 1991. Science and
Medical Application of Hydroxyapatit. Tokyo, Japan : JAAS
[7] U.S Food and Drug Administrator.
Memorandum of Understanding (MOU), number : 225-94-6001. 2005.
http://www.google.co.id/FDA MOU
225-94- 6001.html
[8] Hanson, Bob. 2005. 150000000:1
Model of Hydroxyapatite. www.stolaf.edu/people/hanson [9] Elliott JC. 1973. The Problem of The
Composition and Structure of The Mineral Component of The Hard Tissues. Clin Orthop Rel Res 93 :
1973, 313-345.
[10] Tadic D, Epple M. 2002. Mechanical stable implants of synthetic bone mineral by cold isostaticpressing.
www.elsevier.com/locate/biomaterial
[11] Mathew M, Shozo T. 2001.
Structures of Biological Minerals in Dental
Research. Journal of Research of The National of Standard and Technology. 106 : 1035-1044.
[12] Bigi A, E. Foresti, R. Gregorini, A. Ripamonti, N. Roveri, and J. S. Shah. 1992. TheRole of Magnesium on The Structure of Biological Apatites. Calc. Tiss. Int. 50 : 439-444.
[13] Murray RK et al. Biokimia Harper. 1995. Hartanto, penerjemah; Ronardy
DH, editor. Jakarta: Penerbit Buku Kedokteran EGC.
Terjemahan dari: Harper’s
Review of Biochemistry
[14] Wahl DA, Czernuszka JT. 2000.
Collagen-Hydroxyapatite Composites For Hard Tissue Repair. European Cells and Materials Vol II : 43-56 [15] Mengenal kulit dan penuaan dini.
[16] Notonegoro HA. 2003. Analisis Hasil Spektroskopi Inframerah dan Difraksi Sinar-X. Pertumbuhan Kristal Apatit pada Mukoza Ampela Ayam [skripsi] Depok : Fakultas Matematika dan
Ilmu Pengetahuan Alam,
Universitas Indonesia
[17] Giancoli. 1998. Pysics fifth Edition, penerjemah. Jakarta : Erlangga. Terjemahan dari : Prentice Hall
[18] Asmuni. 2006. Karakterisasi Pasir Kuarsa dengan metode XRD.FMIPA USU. http://www.yahoo.com
[19] Connoly J. 2003. Introduction to
X-Ray Powder Diffraction. EPS 002
[20] International Center for Diffraction Data. 1997. Joint Commitee on Powdered Diffraction Standard.
[21] Verhoeven, JD. 1986. ASM
Handbook Material Characterization,
Vol 1, Scanning Electron
Microscopy. USA
[22] [Anonim]. 2007. Scanning Electron Microscope.
http://www.unl.edu/CMRacfem/semo
pt ic.htm
[23] Byung HY et al. 2004. Stability and cellular responses to fluorapatite–
collagen composites
.
www.sciencedirect.com
[24] Culliti BD. 2001. Element of X-Ray Diffraction, Third Edition. New Jersey : Prentice Hall
[25] Muslich A. 2007. Apatite Growth
Optimation on Chicken Mucouse by Fourier Transform Infrared (FTIR) Characterization [skripsi] Bogor :
Fakultas Matematika dan Ilmu
Pengetahuan Alam, Institut
HOT PLATE
-Pengatur pengaduk
Magnetic stirrer
pH meter
termometer
buret
statif
Pengatur Panas
Lampiran 2 Bahan dan alat penelitian
(NH4)2HPO4 dan Ca(NO3)2 (NH4)2CO3
mucoza ampela ayam Furnace
X-Ray Diffractometer (XRD)
Lampiran 3 Lokasi maksima profil difraksi sinar-X kalsium fosfat karbonat sampel 1,2 dan 3 untuk tanpa dan dengan penambahan mucoza ampela ayam
sampel Hasil Pengukuran d (Ǻ) Keterangan
2θ (o) I/Io(%) FWHM
1a (CO3:PO4 =
0.15:0.3) tanpa mucoza
20.605 18.9 0.12 4.9871 OKF
26.29 8.2 0.4 3.9332 AKA
30.210 50.8 0.4 3.3425 OKF 36.96 100 0.32 2.8219 OKF 39.84 20.6 0.64 2.654 AKB 46.685 15.1 0.48 2.2575 OKF
1b (CO3:PO4 =
0.15:0.3 dengan mucoza)
20.34 2.0 0.64 5.0659 Hidroksiprolin
29.68 59.3 0.28 3.4924 OKF 32.52 13.9 0.32 3.1946 AKB
33.07 17 0.32 3.1429 AKA
36.64 100 0.56 2.8457 OKF 37.195 92.2 0.24 2.8047 HAP
38.06 46.6 0.32 2.7433 AKA 39.29 25.8 0.48 2.6606 OKF 46.005 16.4 0.48 2.289 AKB
2a (CO3:PO4=
0.51:1.02 tanpa mucoza)
29.89 47.1 0.4 3.4684 AKB
33.485 8.9 0.64 3.1051 AKA 36.73 100 0.4 2.839 OKF 38.17 60.4 0.28 2.7357 AKA 39.455 22.2 0.48 2.6499 AKA
46.1 18.5 0.96 2.2846 AKB
2b (CO3:PO4 =
0.51:1.02 dengan mucoza)
26.46 10.1 0.48 3.9084 OKF
30.02 70.1 0.24 3.4538 HAP
33.5 11.7 0.64 3.1037 HAP
36.925 100 0.56 2.8245 OKF
37.49 81.4 0.32 2.7834 AKB
38.285 44.4 0.32 2.7277 AKA 39.59 25.4 0.28 2.6413 OKF
3a (CO3:PO4=
0.9:1.8 tanpa mucoza)
20.74 20.7 0.2 4.9692 OKF
25.985 55.4 0.16 3.9786 HAP
30.02 40.5 0.32 3.4538 HAP 30.575 64.3 0.06 3.3925 OKF
33.575 72.5 0.06 3.097 HAP
35.065 28.0 0.32 2.9693 OKF 36.78 71.1 0.48 2.8353 AKA
38.2 100 0.12 2.7336 AKA
39.57 13.8 0.48 2.6425 AKA 46.63 22.2 0.4 2.26 OKF 3b
(CO3:PO4=
0.9:1.8 dengan mucoza)
26.455 12.0 0.48 3.9091 OKF 29.985 59.5 0.36 3.4577 AKB
33.6 14.3 0.32 3.0947 HAP
Lampiran 4 Presentase fase AKB, AKA, HAP,OKF dan mucoza terhadap lokasi maksima
Sampel 2θ Hasil Identifikasi Fase dengan JCPDS (%) Keterangan
AKB AKA HAP OKF
1a (CO3:PO4
= 0.15:0.3) tanpa mucoza
20.605 98.41 OKF
26.29 99.62 98.62 99.39 AKA
30.210 99.64 99.77 99.92 OKF
36.96 99.43 99.70 OKF 39.84 99.86 99.30 99.77 99.42 AKB
46.685 98.71 99.75 99.78 99.88 OKF
1b (CO3:PO4
= 0.15:0.3 dengan mucoza)
20.34 Hidroksiprolin
29.68 99.05 98.55 99.48 99.63 OKF
32.52 99.20 99.16 99.19 AKB
33.07 99.51 97.93 AKA
36.64 99.69 99.79 OKF
37.195 99.08 99.04 99.65 98.71 HAP
38.06 97.60 99.86 99.11 97.98 AKA 39.29 98.48 99.30 98.84 99.63 OKF
46.005 99.81 98.89 98.75 98.65 AKB
2a (CO3:PO4=
0.51:1.02 tanpa mucoza)
29.89 99.75 97.83 98.77 99.66 AKB
33.485 99.23 99.16 AKA
36.73 99.94 99.96 OKF 38.17 97.88 99.57 99.40 99.30 AKA
39.455 98.90 99.72 99.25 99.21 AKA
46.1 99.98 99.10 98.95 98.86 AKB 2b
(CO3:PO4
= 0.51:1.02
dengan mucoza)
26.46 99.73 99.26 99.95 OKF
30.02 99.31 99.59 99.29 HAP
33.5 99.19 99.21 HAP
36.925 99.53 99.79 OKF 37.49 99.87 99.82 99.79 99.49 AKB
38.285 98.18 99.99 99.70 98.56 AKA
39.59 99.24 99.93 99.59 99.94 OKF 3a
(CO3:PO4=
0.9:1.8 tanpa mucoza)
20.74 97.74 OKF
25.985 96.19 97.99 HAP
30.02 99.31 99.59 99.29 HAP
30.575 98.85 98.56 99.86 OKF
33.575 98.96 99.43 HAP
35.065 98.63 99.22 OKF
36.78 99,92 99.46 AKA
38.2 97.96 99.77 99.48 AKA
39.57 99.19 99.98 99.54 98.92 AKA
46.63 98.83 99.75 99.9 99.99 OKF 3b
(CO3:PO4=
0.9:1.8 dengan mucoza)
26.455 99.75 99.24 99.97 OKF
29.985 99.93 97.51 98.45 99.34 AKB
33.6 98.89 99.50 HAP
36.955 99.44 99.35 AKA
38.235 98.05 99.86 99.57 98.43 AKA
0
200
400
600
800
1
000
1
200
20
2
5
30
35
40
45
50
55
60
6
5
70
7
5
80
85
90
95
1
0
0
105
2 t
het
a
In tensit as
SCANNING ELECTRON MICROSCOPY
SRI RAHAYU SULISTIYANI
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
SRI RAHAYU SULISTIYANI. Optimasi Penumbuhan Apatit pada Mucoza Ampela Ayam :
Hamburan Difraksi Sinar-X dan Scanning Electron Microscopy. Dibimbing oleh MERSI
KURNIATI DAN YESSIE WIDYA SARI.
Senyawa kalsium fosfat karbonat sebagai mineral tulang sintesis yang ditumbuhkan diatas permukaan mucoza ampela ayam sebagai matriks, dibuat dari campuran (NH4)2HPO4 dan
(NH4)2CO3 dengan rasio molar CO3
: PO4
yang bervariasi (0.15:0.3, 0.5:1.02, 0.9:1.8) dan larutan Ca(NO3)2 dengan rasio molar Ca/P sebesar 1.67. Hamburan Difraksi Sinar-X dilakukan
untuk mengidentifikasi fase serta ukuran kristal sedangkan SEM (Scanning Electron Microscopy)
untuk melihat morfologi apatit karbonat yang ditumbuhkan diatas mucoza ampela ayam. Hasil presipitasi menunjukkan larutan dengan rasio molar CO3
dan PO4
= 0.15: 0.3 merupakan konsentrasi optimal untuk pertumbuhan apatit pada mucoza, dibuktikan dengan hadirnya puncak mucoza pada sampel ini. Penambahan mucoza pada konsentrasi ini juga mengakibatkan penurunan ukuran kristal. Foto SEM memperlihatkan apatit karbonat yang ditumbuhkan di mucoza ampela ayam secara umum memiliki morfologi yang menyerupai kelompok partikel tidak teratur dan gumpalan bulat-bulat kecil.
OPTIMASI PENUMBUHAN APATIT PADA MUCOZA
AMPELA AYAM: HAMBURAN DIFRAKSI SINAR-X DAN
SCANNING ELECTRON MICROSCOPY
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Fisika
SRI RAHAYU SULISTIYANI
G74103051
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi
: Optimasi Penumbuhan Apatit pada Mucoza Ampela
Ayam : Hamburan Difraksi Sinar-X dan
Scanning
Electron Microscopy
Nama
: Sri Rahayu Sulistiyani
NIM :
G74103051
Menyetujui :
Pembimbing I
Pembimbing II
Mersi Kurniati, M.Si
Yessie Widya Sari, M.Si
NIP. 132 206 237
Mengetahui
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Prof. Dr. Ir. Yonny Koesmaryono, MS
NIP. 131 473 999
RIWAYAT HIDUP
Penulis dilahirkan di Depok pada tanggal 16 April 1984 sebagai anak keempat dari empat bersaudara, putri pasangan Suparno, BA dan Ny. Siti Amsiah.
Tahun 2002, penulis lulus dari SMUN 4 Depok dan tahun 2003 masuk IPB melalui jalur SPMB (Seleksi Penerimaan Mahasiswa Baru). Penulis memilih Program Studi Fisika, Departemen Fisika, Fakultas Matematika dan Ilmu Pengetahuan Alam.
PRAKATA
Subhanallah, Alhamdulillahirobbilaalamin, Puji Syukur kepada Allah SWT atas segala nikmat yang selalu diberikan-Nya sehingga skripsi ini berhasil diselesaikan. Sholawat dan salam semoga tercurah kepada uswatun hasanah Nabi Muhammad SAW beserta keluarga,sahabat dan para pengikutnya. Skripsi ini berjudul Optimasi Penumbuhan Apatit pada Mucoza Ampela Ayam : Hamburan Difraksi Sinar-X dan Scanning Electron Microscopy.
Penulis menyadari bahwa karya ini masih terdapat banyak kekurangan, sehingga penulis sangat mengharapkan krtik dan saran yang membangun, sehingga karya ini dapat bermanfaat di masa mendatang.
Terimakasih sedalam-dalamnya penulis ucapkan kepada pihak-pihak yang telah membantu penyelesaian karya ilmiah ini, antara lain :
Ibu Mersi Kurniati, M.Si selaku pembimbing I dan Ibu Yessie Widya Sari, M.Si selaku pembimbing II yang telah membimbing penulis dengan keluasan ilmu, kesabaran, motivasi dan semangatnya. Semoga setiap kata dan ilmu yang telah diberikan menjadi sebuah amal kebaikan yang harum dan kekal dimata Allah SWT.
Bapak Dr.Ir. Irzaman, M.Si dan Bapak Jajang Juansah, M.Si, selaku dosen penguji untuk masukan yang berarti bagi penulis.
Bapak Drs. Nur Indro selaku Komisi Pendidikan Departemen Fisika
Bapak Setyanto, seluruh dosen dan staf Departemen Fisika FMIPA IPB atas ilmu,
perhatian dan bantuan yang diberikan.
Program Hibah Penelitian A2 Departemen Fisika, FMIPA IPB tahun 2007
Pak Bambang Sugiono dari Ilmu Material UI atas bantuan ilmu XRD-nya.
Matur nuwun sanget untuk Ibu Ari dari Puspiptek-BATAN, Serpong atas SEM-nya.
Mas Adhi-Teknik Metalurgi UI atas SOP XRD-nya.
Bapak dan Mama tersayang, yang selalu mendoakan penulis di setiap waktu, perhatian dan kasih sayangnya yang tidak terbatas. Hanya Allah SWT yang bisa membalas semuanya.
Mas Benk, Mba Esti dan dr.Setiyo, kaka terbaik yang ulis punya. Terimakasih atas perhatian, keceriaan dan kasih sayang, dukungan baik materi atau yang lain. Maaf ademu sering merepotkan.
Mba Wiet, Mba Zami dan Mas Aan, Mas Dony, thanks for everything. Keponakan yang bandel-bandel tapi lucu , Dian Nafi, Tiara Nafi, Rizki Muhammad Raydi, mudah-mudahan menjadi anak yang pintar, sholeh dan sholehah.
Mba Esti Riyani, S.Si, Te-O-Pe Be-Ge-Te, makasih mba ilmu&wejangannya.
Ukhuwah sejati di PEMANIS ( Ka Ucup, Konde, Ria, Elpi, Nungki, Nopit), TPA Nuris (Lina, Mba Im, Mba Atun,Nuri, Uni, Mba Em, Lia, Elin, rita), syukron jiddan tuk perhatian setiap harinya. My Brothers n My Sisters di SERRUM-G... Dont Give Up!!
Tim HAP : Adi-Irma-Setia-Atiq-Mba Melly-Opik-Priyo-Mba Arsy
My lovely friends ( Sarma, Yudha, Rina, Vita, Jowie, Yuli, Susu, Bodor, Mba Arum, Ica, , Sriti, Naniq ). Mba Vera, Mba Ima, Mba Risna, Mba Ina dan Mba Helvy Tiana Rosa atas “cuti” yang diberikan.
Thank’s to my partners : Irma Nurmala ‘n Adi Purwa atas perjuangan penelitian kita, rekan-rekan fisika 40 (Rika, Ai, Ziah, Asih, Set, Atik, Lira, Mami Euis, Euis Tasik, Ica, Gita, Mba yul, Ita, Nenden, Adiyanto, Opik, Priyo, Awit, Marwan, Tahyudi, Izal, Hudar, Dicky, Azis, Alwi, Subhi, Kusnadi, Mardani, Mada, Eki, Ucup, Bambang) atas kenangan yang telah terukir bersama. Fisika 39-41-42 atas semangatnya.
Bogor, September 2007
Ya Rahman…..Ya Rahim…. Ya Latif…
Jadikanlah segala apa yang hamba lihat, segala apa yang hamba sentuh,
segala apa yang hamba dengar menjadi sesuatu yang bisa
mendekatkan hamba kepada-Mu…
“Bersungguh-sungguhlah dengan kehinaanmu, niscaya Ia menolongmu dengan
kemuliaan-Nya,
Bersungguh-sungguhlah dengan ketidakberdayaanmu, niscaya Ia menolongmu
dengan kekuasaan-Nya. Bersungguh-sungguhlah dengan kelemahanmu, niscaya
Ia menolongmu dengan kekuatan-Nya
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1
Latar Belakang ... 1
Perumusan Masalah ... 1
Tujuan Penelitian ... 1
Tempat dan Waktu Penelitian ... 1
TINJAUAN PUSTAKA ... 2
Tulang ... 2
Mineral Tulang ... 2
Mineral Apatit ... 3
Struktur Apatit ... 3
Pengaruh Ion CO32- dalam kristal Apatit ... 4
Matriks Kolagen ... 4
Sintesis Hidroksiapatit ... 5
Hamburan Difraksi Sinar-X ... 5
Scanning Electron Microscopy (SEM) ... 6
BAHAN DAN METODA ... 6
Bahan dan Alat ... .6
Persiapan Sampel ... 6
Persiapan Presipitasi ... 6
Penyaringan dan Pengeringan Endapan ... 6
Karakterisasi sampel dengan XRD ... 6
Karakterisasi sampel dengan SEM... 7
HASIL DAN PEMBAHASAN ... 8
Analisis Hasil Difraksi Sinar-X... 8
Analisis Mikrograf SEM ... 10
SIMPULAN DAN SARAN ... 12
Simpulan ... 12
Saran ... 12
DAFTAR PUSTAKA ... 12
DAFTAR TABEL
Halaman
1 Kandungan unsur inorganik dalam Tulang ... 2
2 Variasi Ca/P kalsium fosfat ... 3
3 Ukuran kristal tanpa penambahan mucoza variasi konsentrasi CO3:PO4 bidang 002 ... 9
4 Ukuran kristal pada sampel dengan dan tanpa penambahan mucoza variasi konsentrasi CO3 : PO4 ... 9
DAFTAR GAMBAR
Halaman 1 Tulang belakang manusia ... 2
2 Struktur kristal hidroksiapatit yang di proyeksikan sepanjang sumbu-c dan sepanjang sumbu-a ... 3
3 Struktur hidroksiapatit (a) Unit sel hidroksiapatit (b) Tampak atas unit sel hidroksiapatit ... 4
4 Struktur kolagen ... 5
5 Difraksi Sinar-X oleh kristal ... 5
6 Skema Difraktometer Sinar-X ... 6
7 Skema Scanning Electron Microscope (SEM) ... 6
8 Diagram alir penelitian ... 7
9 Pola difraksi sinar-X sampel 1a, 2a dan 3a ... 8
10 Pola difraksi sinar-X sampel 1b, 2b dan 3b ... 8
11 Mikrograf SEM mucoza ampela ayam perbesaran 10000x ... 10
12 Mikrograf SEM perbesaran 10000x. (a) Sampel 1a. (b) Sampel 2a. (c) Sampel 3a. (d) Sampel 1b. (e) Sampel 2b. (f) Sampel 3b ... 11
DAFTAR LAMPIRAN
Halaman 1 Skematik proses presipitasi ... 15
2 Bahan dan alat penelitian ... 16
3 Lokasi maksima profil difraksi sinar-X kalsium fosfat karbonat sampel 1,2 dan 3 untuk tanpa dan dengan penambahan mucoza ampela ayam ... 18
4 Presentase fase AKB, AKA, HAP,OKF dan mucoza terhadap lokasi maksima ... 19
5 Data JCPDS (Joint Committee on Powder Diffraction Standards) ... 20
6 Pola XRD mucoza ampela ayam ... 21
7 Pola XRD sampel 1a (tanpa mucoza) dengan konsentrasi CO32- : PO43- = 0.15 : 0.3 ... 22
8 Pola XRD sampel 2a (tanpa mucoza) dengan konsentrasi CO3 : PO4 = 0.5 : 1.02 ... 23
9 Pola XRD sampel 3a (tanpa mucoza) dengan konsentrasi CO32- : PO43- = 0.9 : 1.8 ... 24
10 Pola XRD sampel 1b (penambahan mucoza) dengan konsentrasi CO3 : PO4 3- = 0.15 : 0.3 ... 25
11 XRD sampel 2b (penambahan mucoza) dengan konsentrasi CO32- : PO43- = 0.5 : 1.02 ... 26
PENDAHULUAN
Latar BelakangKejadian patah tulang atau kelainan metabolik pada tulang dapat menimpa setiap orang kapan saja. Kelainan metabolik tulang biasanya ditandai dengan menurunnya massa tulang (osteoporosis) dan menurunnya mineralisasi tulang (osteomalasia)1. Jika kelainan metabolik tulang ini terjadi pada usia anak-anak sampai remaja, dapat segera pulih karena hormon-hormon tubuhnya masih sangat mencukupi untuk proses perbaikan tulang. Pada usia lanjut, hal ini relatif sulit, karena ketidakseimbangan sistem hormon tubuh. Untuk itu di perlukan adanya suatu material subsitusi tulang yang diharapkan menjadi alternatif untuk mengatasi kelainan metabolik tulang pada usia lanjut. Material subsitusi tulang yang digunakan juga harus bersifat dapat diterima oleh tubuh (biokompatibel) dan dapat berintegrasi dengan cepat.
Fungsi tulang selain sebagai pembentuk rangka badan, juga sebagai tempat deposit kalsium, fosfor, magnesium dan garam2. Adapun fungsi kalsium dalam tubuh sangat penting dan berhubungan erat dengan fosfor. Kedua unsur itu sebagian besar terdapat bersamaan dalam bentuk senyawa kalsium fosfat. Senyawa kalsium fosfat dalam tulang hadir dalam dua fase, yaitu, fase amorf dan fase kristal. Fase stabil kristal kalsium fosfat mempunyai rumus kimia Ca10 (PO4)6(OH)2
atau yang lebih dikenal dengan nama hidroksiapatit (HAP). Kristal kalsium fosfat dalam jaringan keras dikenal dengan kristal apatit, yang mempunyai formula kimia berbeda dengan hidroksiapatit, namun memiliki struktur kristal yang sama2.
Tulang terdiri dari substansi organik yaitu matriks kolagen dan substansi inorganik yaitu kalsium dan fosfor sedangkan sisanya adalah magnesium, sodium, hidroksil, karbonat dan
fluorida1. Kehadiran ion karbonat dapat
menghambat pertumbuhan kristal kalsium fosfat. Selain itu ion karbonat juga mudah masuk dalam struktur kristal HAP3. Partikel berbentuk sperules sesuai dengan foto SEM fase amorf kalsium fosfat2. Campuran amorf dan kristal tampak dalam foto SEM sebagai gumpalan dengan tepi tidak teratur4.
Matriks berfungsi sebagai media pertumbuhan bagi mineral tulang. Pembuatan kalsium fosfat sintesis yang ditumbuhkan pada matriks organik diharapkan mampu menghasilkan biokompatibel biomaterial subsitusi tulang yang bersifat ekonomis,
sekaligus dapat mempercepat proses penyembuhan kelainan metabolik tulang.
Perumusan Masalah
Keberadaan ion asing seperti CO3 2-
dalam kalsium fosfat sintesis dapat mempengaruhi fase yang terbentuk dan ukuran kristal dari apatit. Fase amorf dan ukuran kristal yang kecil memungkinkan bagi biomaterial sintesis masuk dan tumbuh dalam tulang. Penambahan matriks organik sintesis berfungsi sebagai wadah tumbuh bagi apatit.
Variasi konsentrasi CO32- : PO43- serta
penambahan matriks organik sintesis merupakan optimasi yang dilakukan untuk mendapatkan hasil yang sesuai dengan kondisi fisiologis tulang.
Tujuan Penelitian
1. Membuat senyawa kalsium fosfat karbonat sintesis variasi konsentrasi hasil presipitasi dari larutan jenuh ion kalsium dan fosfat yang ditumbuhkan pada permukaan mucoza ampela ayam sebagai matriks. 2. Melakukan identifikasi fase dan ukuran
kristal serta morfologi kristal apatit
karbonat dengan alat XRD (X-Ray
Diffraction) dan SEM (Scanning Electron Microscope).