ISOLASI DAN KLONING GEN
P5CS
(PIROLIN-5-KARBOKSILAT SINTETASE)
DARI TANAMAN KARET
YOSHITA KHURUN AIN
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
YOSHITA KHURUN AIN. Isolasi dan Kloning Gen
P5CS
(pirolin-5-karboksilat
sintetase) dari Tanaman Karet. Dibimbing oleh LAKSMI AMBARSARI dan
TETTY CHAIDAMSARI.
Karet (
Hevea brasiliensis
)
merupakan salah satu tanaman perkebunan yang
memegang peranan penting bagi Indonesia. Teknik molekuler dengan
memanfaatkan gen
P5CS
sebagai penanda molekuler merupakan metode seleksi
yang tepat dan akurat untuk menghasilkan klon karet yang sesuai dibudidayakan
di lahan marjinal. Penelitian ini bertujuan mengisolasi dan mengklon gen
P5CS
,
yang merupakan salah satu gen penanda sifat resisten kekeringan. Tahapan
penelitian yang dilaksanakan yaitu isolasi DNA genom tanaman karet, isolasi gen
P5CS
dari tanaman karet dengan primer
P5CS CS forward-P5CS CS reverse
dan
P5CS start-P5CS stop
, kloning ke dalam plasmid pGEM-T
easy
, isolasi DNA
plasmid, sekuensing, dan analisis hasil sekuensing. Isolasi DNA genom dari daun
tanaman karet berhasil dilakukan. Isolasi gen
P5CS
tanaman karet dengan primer
P5CS CS forward-P5CS CS reverse
belum berhasil dilakukan, sedangkan isolasi
gen dengan primer
P5CS start-P5CS stop
berhasil dilakukan dengan
menghasilkan amplikon berukuran 2250 pb. Konfirmasi hasil kloning gen
P5CS
ABSTRACT
YOSHITA KHURUN AIN. Isolation and Cloning of
P5CS
(pyrrolin-5-carboxylate synthetase) Gene from Rubber Plant. Under direction of LAKSMI
AMBARSARI and TETTY CHAIDAMSARI.
Rubber plant (
Hevea brasiliensis
) is one of the plantations that has
important role in Indonesia. Molecular technique by using
P5CS
gene as
molecular marker is selection method that faster and more accurate for producing
rubber plant that compatible for marginal land. The aim of this research is to
isolate and clone
P5CS
gene as a marker gene of drought resistant. Steps of this
research are isolation of rubber plant DNA genome, isolation of
P5CS
gene from
rubber plant by
P5CS CS forward-P5CS CS reverse
and
P5CS start-P5CS stop
primers, cloning into pGEM-T easy plasmid, isolation of plasmid DNA,
sequencing, and analyzing DNA sequence. Isolation of rubber plant DNA genome
is successfully proceed. Isolation of
P5CS
gene by using
P5CS CS forward-P5CS
CS reverse
primer
is not been successfully proceed, while isolation gene by using
ISOLASI DAN KLONING GEN
P5CS
(PIROLIN-5-KARBOKSILAT SINTETASE)
DARI TANAMAN KARET
YOSHITA KHURUN AIN
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Isolasi dan Kloning Gen
P5CS
(pirolin-5-karboksilat sintetase)
dari Tanaman Karet
Nama
: Yoshita Khurun Ain
NRP
: G84070080
Disetujui
Komisi Pembimbing
Diketahui
Dr. Ir. I Made Artika, M.App.Sc
Ketua Departemen Biokimia
Tanggal lulus:
Dr. Laksmi Ambarsari, M.S
Ketua
PRAKATA
Puji syukur penulis panjatkan ke hadirat Allah SWT karena atas limpahan
hidayah-Nya penulis dapat menyelesaikan karya tulis
yang berjudul “
Isolasi dan
Kloning Gen
P5CS
dari Tanaman Karet
”. Shalawat serta salam semoga senantiasa
tercurah kepada Rasulullah SAW. Karya tulis ini disusun berdasarkan kegiatan
penelitian yang dilaksanakan dari bulan Januari sampai Mei 2011, di
Laboratorium Rekayasa Genetika dan Biologi Molekuler, Balai Penelitian
Bioteknologi Perkebunan Indonesia (BPBPI), Jalan Taman Kencana No.1 Bogor.
Penulis mengucapkan terima kasih kepada Dr. Laksmi Ambarsari, M.S dan
Dr. Tetty Chaidamsari, M.Si atas bimbingan dan motivasi yang diberikan selama
penyusunan karya tulis ini. Ucapan terima kasih juga penulis sampaikan kepada
teknisi yang sudah menularkan pengalaman berharganya, Nina Yuniar, Herti
Sugiarti, Aan Sriyani, dan Dini Nopayanti. Penulis menyampaikan terima kasih
kepada kedua orang tua, ketiga kakak: Hendy, Robby, dan Oki, serta keluarga
yang tak pernah lelah mendukung, menasehati, memberikan semangat dan
motivasi, serta mendoakan penulis sehingga dapat menyelesaikan karya tulis ini
dengan baik. Penulis juga mengucapkan terima kasih kepada A. Heriyanto,
Rezky, Agnes, dan Sylvania atas semangat yang ditularkan; Endah, Dewi, Riska,
Ekky, Ismi, Dhaniar, Tiara, teman-teman Biokimia Angkatan 44, teman kosan:
Maulina, Syifa, Dina, Rizqi, Astry, Ashna, Wika, dan Fitri yang rela berbagi suka
dan duka, serta semua pihak yang mendukung penyusunan karya tulis ini.
Penulis berharap semoga karya tulis ini bermanfaat untuk kemajuan
pendidikan, pengetahuan, dan penelitian.
Bogor, Juli 2011
RIWAYAT HIDUP
Penulis dilahirkan di Nganjuk, Jawa Timur, 02 Juni 1988 dari pasangan
Syamsudin dan Srikanah. Bungsu dari empat bersaudara ini menempuh
pendidikan formal di SMAN 1 Kertosono (2004-2007), Nganjuk, Jawa Timur.
Penulis mengikuti program Seleksi Penerimaan Mahasiswa Baru (SPMB) pada
tahun 2007 untuk melanjutkan pendidikannya di Departemen Biokimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Organisasi mahasiswa yang pernah diikuti oleh penulis yaitu Himpunan
Profesi Departemen Biokimia,
Community Research and Education of
Biochemistry Student
(CREBs) pada tahun 2008-2009 sebagai staf divisi Biologi
Molekuler. Penulis juga aktif dalam organisasi mahasiswa daerah, Ikatan
Mahasiswa Jawa Timur (IMAJATIM) pada tahun 2008-2009. Selain aktif
berorganisasi, penulis juga tergabung pada beberapa kepanitian di Institut
Pertanian Bogor, di antaranya Seminar Keselamatan dan Kesehatan Kerja (2009),
Seminar Kanker (2009), IPB Art Contest 2009, dan Lomba Karya Ilmiah Populer
Nasional (2009).
Penulis menjadi staf pengajar Kimia di bimbingan belajar
Student
Improvement Programme
(STIMP) pada tahun 2009-2011. Penulis juga menjadi
pengajar privat pelajaran matematika SMA (2008-2010). Penulis menjadi asisten
praktikum mata kuliah Pengantar Penelitian Biokimia pada tahun 2011.
Ketertarikan penulis terhadap karya tulis mengantarkan penulis untuk
menorehkan prestasi selama menempuh pendidikan di Institut Pertanian Bogor.
Prestasi-prestasi yang diperoleh penulis di antaranya Peraih Hibah Dikti Program
Kreativitas Mahasiswa Bidang Gagasan Tertulis, Juara II Kompetisi Karya Tulis
Mahasiswa Nasional INDEX 2010, dan Juara II Lomba Karya Tulis Ilmiah Al
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... ix
DAFTAR TABEL ... ix
DAFTAR LAMPIRAN ... x
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Karet (
Hevea brasiliensis
) ... 1
Respon Tanaman terhadap Cekaman Kekeringan ... 2
Plasmid sebagai Vektor Kloning ... 3
Polymerase Chain Reaction
(PCR) ... 5
BAHAN DAN METODE
Bahan ... 5
Metode ... 6
HASIL DAN PEMBAHASAN
Hasil Isolasi DNA Genom dari Daun Tanaman Karet ... 8
Amplikon Gen
P5CS
Tanaman Karet ... 9
Hasil Ekstraksi dan Purifikasi Gen
P5CS
... 10
Koloni Rekombinan Hasil Kloning ... 10
Hasil PCR Koloni ... 11
DNA plasmid Rekombinan ... 11
Hasil Urutan Basa Gen Hasil Kloning ... 12
SIMPULAN DAN SARAN
Simpulan ... 13
Saran ... 13
DAFTAR PUSTAKA ... 13
DAFTAR GAMBAR
Halaman
1 Tanaman Karet ... 2
2 Tahapan kloning ... 4
3 Elektroforegram DNA hasil isolasi (Castillo 1994) ... 9
4 Elektroforegram hasil PCR optimasi suhu
annealing
... 9
5 Elektroforegram hasil PCR suhu
annealing
40ºC ... 10
6 Konfirmasi ekstraksi dan purifikasi fragmen gen
P5CS
... 10
7 Koloni biru putih hasil kloning fragmen gen
P5CS
... 11
8 Elektroforegram PCR koloni ... 11
9 Elektroforegram isolasi DNA plasmid ... 12
10 Urutan basa DNA yang disekuen dengan primer
M13 forward
... 12
11 Urutan basa DNA yang disekuen dengan primer
M13 reverse
... 12
DAFTAR TABEL
Halaman
1 Kuantitas dan Kemurnian DNA Hasil Isolasi ... 8
2 Primer spesifik fragmen gen P5CS ... 10
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian... 17
2 Komposisi larutan yang digunakan dalam penelitian ... 18
3 Pembuatan gel agarosa 0.8 % dan 1.0 % ... 19
4 Pembuatan media ... 20
5 Peta restriksi plasmid pGEM-T
easy
... 21
6 Elektroferogram fragmen gen
P5CS
... 22
7 Hasil sekuen DNA hasil kloning ... 24
PENDAHULUAN
Karet merupakan salah satu komoditi perkebunan penting bagi Indonesia, baik sebagai sumber pendapatan, kesempatan kerja dan devisa, pendorong pertumbuhan ekonomi, serta pelestarian lingkungan dan sumberdaya hayati. Hasil devisa yang diperoleh dari karet cukup besar, mencapai US$ 4,868.75 juta pada tahun 2007 (BPS 2009).
Produktivitas karet alam Indonesia mengalami peningkatan sebesar 5.9% dari tahun 1998-2007 (BPS 2009). Peningkatan produktivitas karet harus terus dilakukan karena permintaan produk karet sebagai bahan baku industri juga mengalami peningkatan. Salah satu upaya untuk meningkatkan produksi karet alam yaitu memperluas areal perkebunan karet. Namun, usaha perluasan areal perkebunan karet dihadapkan pada satu permasalahan, yaitu terbatasnya lahan yang sesuai untuk budidaya karet. Permasalahan ini dapat diatasi dengan cara memberdayakan lahan-lahan marjinal yang ada di Indonesia. Lahan marjinal dapat diartikan sebagai lahan yang memiliki mutu rendah karena memiliki beberapa faktor pembatas jika digunakan untuk suatu keperluan tertentu (Yuwono 2009). Salah satu lahan marjinal yang dapat dimanfaatkan yaitu lahan kering. Luas lahan kering yang ada di Indonesia mencapai 140 juta ha (Hidayat & Mulyani 2002), yang berpotensi digunakan untuk perluasan wilayah perkebunan karet.
Faktor pembatas pengusahaan lahan kering berkaitan dengan sifat fisik dan kimia tanah yang kurang baik, solum dangkal, curah hujan rendah, dan distribusi hujan yang tidak merata. Lahan kering mempunyai struktur tanah padat dan lapisan tanah atas (top soil) serta lapisan bawah (sub soil) memiliki kelembaban yang rendah. Sirkulasi udara pada lahan kering agak terhambat dan kemampuan menyimpan air relatif rendah (Rukmana 1995).
Adanya faktor pembatas di lahan kering mengharuskan pembudidaya karet melakukan seleksi terhadap klon-klon karet yang tahan kekeringan. Waktu yang dibutuhkan untuk melakukan seleksi relatif lama, antara 15-25 tahun, oleh karena itu diperlukan suatu metode seleksi yang lebih cepat dan akurat. Proses seleksi terhadap cekaman kekeringan dapat dilakukan dengan teknik molekuler dan dipadukan dengan data morfologi. Penggabungan teknik ini biasa dikenal dengan marker assisted selection (MAS). Keuntungan penggunaan marka molekuler yaitu stabil,
tidak dipengaruhi oleh lingkungan, dan relatif mudah (Meksem & Kahl 2005).
Toleransi tanaman terhadap cekaman kekeringan secara fisiologis berkaitan dengan perubahan aktivitas metabolisme yang antara lain ditunjukkan oleh perubahan akumulasi prolina pada daun (Bates et al. 1973). Prolina diduga terlibat dalam osmoregulasi, menjaga kelarutan protein, kestabilan membran fosfolipid dan juga sebagai sumber cadangan karbon, nitrogen dan energi (Walton et al. 1998).
Marka molekuler yang diperlukan untuk seleksi tanaman karet resisten kekeringan dapat diperoleh dengan cara mengisolasi gen P5CS (pirolin-5-karboksilat sintetase). Gen P5CS adalah gen yang menyandi enzim Δ1 -pirolin-5-karboksilat sintetase. Enzim ini berperan pada proses konversi glutamat
menjadi Δ1
-pirolin-5-karboksilat yang kemudian direduksi menjadi prolina. Hasil penelitian menunjukkan bahwa gen P5CS merupakan penyandi enzim yang menjadi faktor pembatas dalam biosintesis prolina pada tanaman tingkat tinggi (Hu et al. 1992).
Penelitian ini bertujuan mengisolasi gen P5CS, yang merupakan kandidat gen penanda sifat resisten kekeringan sehingga dapat digunakan sebagai dasar untuk mendapatkan marka molekuler. Hipotesis penelitian ini yaitu gen P5CS dapat diisolasi dari tanaman karet dengan menggunakan primer spesifik. Gen yang dihasilkan dapat digunakan sebagai kandidat marka molekuler yang dapat dimanfaatkan untuk melakukan seleksi klon karet yang tahan kekeringan dengan waktu yang relatif singkat.
TINJAUAN PUSTAKA
Karet (Hevea brasiliensis)
Divisi : Spermatophyta Subdivisi : Angiospermae Kelas : Dicotyledonae Ordo : Euphorbiales Famili : Euphorbiaceae Genus : Hevea
Spesies : Hevea brasiliensis
Gambar 1 Tanaman karet.
Daun karet berwarna hijau dan terdiri atas tangkai daun utama dan tangkai anak daun. Tangkai daun utama mempunyai panjang 3-20 cm, sedangkan tangkai anak daun mempunyai panjang 3-10 cm. Daun karet mempunyai tiga anak daun pada setiap helainya. Bunga karet terdiri atas bunga jantan dan bunga betina yang terdapat dalam malai payung tambahan. Pangkal tenda bunga berbentuk lonceng dengan panjang tenda antara 4 dan 8 mm (Webster & Baulkwill 1989).
Pertumbuhan karet dipengaruhi oleh lingkungan yang digunakan untuk membudidayakan tanaman ini. Karet sangat baik diusahakan di zona antara 15° LS dan 15° LU. Curah hujan optimum agar karet mempunyai produktivitas yang tinggi yaitu 2500-4000 mm per tahun dengan 100-150 hari hujan. Dataran rendah yang mempuyai ketinggian sampai 200 m di atas permukaan laut dengan suhu 25-35°C merupakan daerah yang cocok untuk budi daya karet (Setyamidjaja 1993).
Tanaman karet mempunyai struktur anatomi seperti tanaman dikotil yang lain. Secara umum jaringan kulit karet tersusun oleh sel-sel parenkimatis yang di antaranya terdapat jaringan pengangkut xilem dan floem yang dipisahkan oleh kambium. Batang dan kulit merupakan wadah dari produksi tanaman karet, tempat segala proses asimilasi yang terjadi di daun ditransfer ke dalam tubuh pohon untuk memproduksi lateks. Terbentuknya lateks di dalam batang berhubungan dengan besarnya pertumbuhan pohon (Indraty 1987). Penampang melintang batang pohon karet memperlihatkan bagian tengah sampai lapisan terluar terdiri atas
bagian kayu, kambium, kulit lunak, kulit keras, dan akhirnya lapisan gabus. Kulit lunak mempunyai suatu deretan pembuluh tapis yang vertikal yang mengandung karbohidrat hasil fotosintesis (Ginting 1983).
Jumlah pembuluh lateks akan semakin banyak pada daerah yang mendekati kambium. Sistem pembuluh lateks merupakan suatu bejana berbentuk pipa-pipa kapiler (anastomisis), yang saling berhubungan di dalam keseluruhan pohon atau tubuh tanaman (Setyamidjaja 1983). Jumlah dan susunan pembuluh lateks bervariasi di antara klon, bahkan dari pohon ke pohon. Hal ini dipengaruhi oleh umur tanaman, posisi kulit, tebal kulit, jenis pohon dan pertumbuhan batang tanaman (Lukman 1984).
Karet sebagai tanaman penghasil getah karet terus dikembangkan untuk menghasilkan klon-klon unggul. Klon adalah tanaman yang diperoleh dari hasil perbanyakan secara vegetatif atau aseksual (Tim Penulis PS 2008). Kelebihan tanaman klon yaitu lebih seragam, umur produksi lebih cepat, dan jumlah lateks yang dihasilkan lebih banyak. Tanaman klon juga memiliki kekurangan, di antaranya daya tahan klon terhadap suatu penyakit berbeda-beda, bergantung pada jenis klon. Pertumbuhan tanaman klon sangat dipengaruhi oleh lingkungan, sehingga klon tertentu hanya dapat ditanam pada tempat yang tertentu juga (Tim Penulis PS 2008).
Respon Tanaman terhadap Cekaman Kekeringan
Cekaman kekeringan merupakan keadaan lingkungan yang menyebabkan kekurangan air bagi tanaman. Peristiwa ini dapat terjadi akibat kekurangan air di daerah perakaran atau akibat laju evaporasi lebih tinggi dibandingkan dengan laju absorbsi air (Sinaga 2007). Cekaman kekeringan dapat mengakibatkan penurunan yang nyata pada pertumbuhan dan karakter vegetatif tanaman yang berada dalam masa pertumbuhan aktif. Selain itu, cekaman kekeringan juga dapat berakibat pada penurunan daya serap tanaman terhadap unsur hara, yaitu nitrogen, fosfor, kalium, kalsium, dan magnesium (Widyatmoko 2005), penurunan protein pada daun (Mathius et al. 2004) dan bobot kering total tanaman (Hamim et al. 1996). Secara fisiologis, tanaman yang tumbuh pada kondisi cekaman kekeringan akan mengurangi jumlah stomata sehingga laju fotosintesis mengalami penurunan (Sasli 2004).
yang mampu menginisiasi siklus-siklus transduksi dalam tanaman yang menyebabkan berbagai perubahan fisiologi. Pada saat kekeringan, akan terjadi perubahan metabolisme dalam akar tanaman yang menghasilkan signal-signal biokimia pada tunas. Salah satu mekanisme alami yang melindungi sel-sel tanaman dari ancaman kekeringan, salinitas, suhu rendah dan faktor stres lainnya adalah akumulasi asam amino dan amida, serta gula yang berperan dalam meningkatkan tekanan osmotik sel (Bohnert et al. 1995). Beberapa penelitian menunjukkan ketahanan terhadap cekaman kekeringan berhubungan dengan peningkatan kandungan prolina yang berperan penting dalam menjaga pertumbuhan akar pada potensial osmotik air yang rendah.
Prolina merupakan salah satu senyawa osmotik yang disintesis dan diakumulasi pada berbagai jaringan tanaman yang dicekam kekeringan, terutama pada bagian daun (Yang & Kao 1999). Prolina diduga terlibat dalam osmoregulasi, menjaga kelarutan protein, kestabilan membran fosfolipid, dan juga sebagai sumber cadangan karbon, nitrogen dan energi (Walton et al. 1998). Prolina juga berperan menetralisir pengaruh toksik NH, yang merupakan hasil hidrolisis protein sebagai sumber energi dan sumber N bagi pemulihan proses tanaman pasca cekaman kekeringan (Levitt 1980). Delauney dan Verna (1993) menyatakan bahwa ditemukan indikasi korelasi positif antara akumulasi prolina dan adaptasi tanaman terhadap cekaman kekeringan dan garam positif. Sejumlah peneliti menyatakan bahwa prolina dapat dipertimbangkan sebagai indikator seleksi menyangkut adaptasi tanaman terhadap cekaman lingkungan, terutama cekaman kekeringan dan salinitas (Kuznetsov & Shevyakova 1997; Yoshiba et al. 1997).
Salah satu gen yang berperan dalam stres kekeringan yaitu pirolin-5-karboksilat sintetase (P5CS). Ekspresi berlebihan gen Δ1 -pirolin-5-karboksilat sintetase (P5CS) dari Vigna aconitifolia meningkatkan ketahanan terhadap stres osmotik pada tembakau (Kavi et al. 1995; Hong et al. 2000 dalam Jaiwal & Singh 2003). Zhu et al. (1998) memasukkan cDNA Δ1-pirolin-5-karboksilat sintetase (P5CS) dari mothbean ke dalam sel padi dengan menggunakan metode biolistik. Padi yang dihasilkan menunjukkan adanya peningkatan produk gen P5CS, yaitu enzim P5CS dan akumulasi prolina.
Prolina dianggap sebagai senyawa yang menyebabkan tanaman tahan terhadap
kekeringan. Prolina akan terakumulasi di dalam jaringan tanaman apabila tanaman tersebut mengalami cekaman kekeringan atau pada keadaan cekaman salinitas tinggi. Menurut Widyasari & Sugiyarta (1997), dalam keadaan normal prolina yang dihasilkan bersifat umpan balik dan karena kehadiran air, prolina akan dioksidasi kembali menjadi asam glutamat. Konsentrasi prolina akan selalu rendah dalam kondisi normal. Pada kondisi kekeringan oksidasi prolina akan dihambat sehingga produksi prolina akan bertambah dan dengan adanya gen P5CS produksi prolina semakin meningkat karena enzim P5CS memicu katalisis glutamat menjadi prolina. Akumulasi prolina dapat menjadi indikator tanaman yang toleran terhadap kekeringan dan salinitas tinggi.
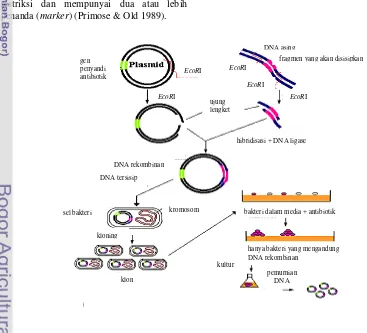
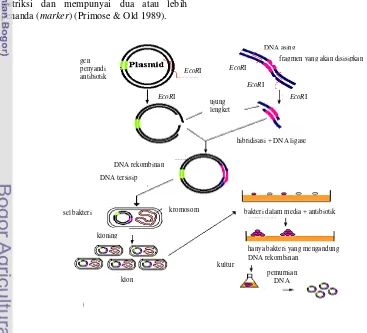
Plasmid sebagai Vektor Kloning Kloning bertujuan memperbanyak dan mengisolasi DNA yang disisipkan pada DNA vektor. DNA disambungkan pada DNA plasmid dan molekul kimeriknya ditransformasikan ke dalam inang, seperti E.coli. Plasmid melakukan replikasi dalam inang sewaktu inang tumbuh dan membelah, dan potongan DNA yang diinginkan terklonkan (Russel 1980, diacu dalam Sardjoko 1991). Kloning gen untuk mendapatkan klon tertentu dalam jumlah banyak pada prinsipnya berguna untuk mempermudah pengujian, modifikasi dan pemanfaatan gen tersebut.
Tahapan kloning (Gambar 2) diawali dengan cara mempersiapkan DNA target melalui proses pemotongan dengan enzim endonuklease restriksi. Fragmen untai tunggal yang pendek pada ujung yang dihasilkan dari pemotongan enzim restriksi diligasi ke dalam vektor yang mengandung situs ORI (origin of replication). DNA rekombinan kemudian ditransfer ke dalam sel inang (bakteri atau khamir). DNA ini mampu bereplikasi tanpa bergantung pada DNA genom bakteri atau khamir. Sel inang yang berhasil ditransformasi kemudian ditumbuhkan ke dalam media selektif (Passarge 2007).
gen yang menyandikan metabolit sekunder yang tidak biasa (plasmid degradatif) (Glick & Pasternak 2003).
Plasmid yang berupa DNA berutas ganda dan berbentuk sirkular merupakan DNA ekstrakromosom yang dikenal pada bakteri. Plasmid memiliki dua sifat istimewa yang bermanfaat dalam manipulasi genetik. Plasmid pada umumnya tidak diperlukan dalam pertumbuhan sel sehingga pada keadaan tertentu dapat keluar masuk tanpa membahayakan sel tersebut. Gen asing dapat bersatu dengan plasmid secara mudah dan diangkut ke dalam E.coli dan menjadi bagian genom sel inang (Lehninger 1994).
Semua plasmid memiliki paling sedikit satu urutan (rangkaian) DNA yang dapat bertindak sebagai asal replikasi sehingga plasmid itu dapat memperbanyak diri di dalam sel tanpa bergantung pada kromosom bakteri (Brown 1991). Secara umum plasmid yang baik untuk digunakan dalam teknologi DNA rekombinan yaitu mempunyai berat molekul rendah, mempunyai kemampuan mengekspresikan gen yang dibawanya dari inang, hanya mempunyai sisi pemotong tunggal untuk kebanyakan endonuklease restriksi dan mempunyai dua atau lebih penanda (marker) (Primose & Old 1989).
Marka seleki yang umum digunakan adalah gen resistensi terhadap ampisilin dan tetrasiklin. Gen resistensi ampisilin menyandi enzim beta laktamase yang dapat memecah molekul ampisilin sehingga sel inang yang membawa plasmid dapat tumbuh dalam media yang mengandung ampisilin. Gen resistensi tetrasiklin menyandi protein yang memompa molekul tetrasiklin sehingga meniadakan efek toksik tetrasiklin (Brown 1991).
Plasmid pGEM-T easy merupakan vektor yang biasa dimanfaatkan untuk kloning produk PCR. Plasmid pGEM-T easy mengandung gen resistensi terhadap antibiotika ampisilin. Vektor pGEM-T easy
mengandung gen lacZ yang menyandi β -galaktosidase yang akan mengubah X-Gal (5-bromo-4- kloro-3- indolil-β- D-galaktosidase) dari tidak berwarna menjadi biru. Gen lacZ yang diinduksi oleh molekul DNA lain maka lacZ ini tidak dapat mengubah X-Gal menjadi berwarna biru. Plasmid pGEM-T easy berukuran 3015 pb dan mengandung MCS (multiple cloning sites). Daerah restriksi ini memungkinkan lepasnya insert/sisipan DNA melalui digesti dengan enzim restriksi tunggal, misalnya EcoRI, BstZI, dan NotI.
Gambar 2 Tahapan kloning.
DNA asing
klon
hibridisasi + DNA ligase ujung
lengket
DNA rekombinan
DNA tersisip
kromosom
sel bakteri bakteri dalam media + antibiotik
hanya bakteri yang mengandung DNA rekombinan
kultur
pemurnian DNA kloning
gen penyandi antibiotik
fragmen yang akan disisipkan
EcoRI
EcoRI EcoRI
Polymerase Chain Reaction (PCR) Reaksi rantai polimerase merupakan metode untuk memperbanyak fragmen DNA yang menjadi sasaran secara in vitro menggunakan instrumen PCR. Teknik PCR merupakan sarana yang sensitif, selektif, dan sangat cepat untuk memperbanyak fragmen DNA yang diinginkan. Spesifisitas reaksi ini berdasarkan pada penggunaan dua primer oligonukleotida yang berhibridisasi menjadi rangkaian komplementer pada untai DNA yang berlawanan dan mengapit rangkaian sasaran (Murray et al. 2003).
Komponen yang diperlukan dalam proses PCR yaitu DNA cetakan (template), primer, enzim Taq polimerase, dan deoksinukleotida trifosfat (dNTPs). Sampel target yang digunakan adalah DNA cetakan dari suatu organisme yang akan diamplifikasi melalui teknik PCR. Molekul DNA cetakan yang akan diamplifikasi tidak harus mempunyai konsentrasi tinggi karena jumlah yang dibutuhkan dalam proses PCR sangat sedikit, antara 10-100 ng untuk setiap reaksinya (Innis & Gelfand 1990). DNA cetakan tersebut harus mengandung daerah dan fragmen DNA yang akan diamplifikasi.
Primer adalah untai DNA pendek yang terdiri atas beberapa nukleotida, umumnya 10-25 nukleotida (oligonukleotida). Primer berperan sebagai pemula pada proses sintesis menggunakan PCR. Primer akan menempel pada DNA target dan membentuk rangkaian komplementer pada untai DNA yang berlawanan serta mengapit rangkaian sasaran (DNA cetakan). Konsentrasi primer untuk proses PCR menurut William et al. (1990) berkisar antara 0.1-0.5 μM.
Deoksinukleotida trifosfat (dNTPs) merupakan suatu nukleotida yang diperlukan dalam proses PCR agar enzim Taq polimerase dapat membentuk kompleks rantai baru (Innis & Gellfand 1990). Kandungan dNTPs adalah deoksiadenosin trifosfat (dATP), deoksisistidin trifosfat (dCTP), deoksiguanin trifosfat (dGTP), dan deoksitimidin trifosfat (dTTP). Deoksinukleotida trifosfat (dNTPs) akan dihubungkan terhadap primer melalui ikatan kovalen, yaitu gugus hidroksil bebas (OH) dari primer berikatan dengan gugus fosfat dari dNTPs.
Enzim Taq polimerase berperan dalam proses polimerisasi atau pemanjangan utas DNA baru. Enzim ini bersifat termostabil dan diisolasi dari bakteri Thermus aquaticus. Aktivitas polimerisasi DNAnya dimulai dari
ujung 5’ hingga ujung 3’ dan aktivitas
enzimatiknya memiliki waktu paruh sekitar 40
menit pada suhu 95ºC. Konsentrasi Taq DNA polimerase yang digunakan biasanya berkisar antara 0.5-2.5 unit untuk setiap reaksinya (Innis & Gelfand 1990).
Aktivitas enzim Taq polimerase dipengaruhi oleh nilai pH. Nilai pH optimum dari enzim ini adalah 8.3. Kondisi optimum Taq polimerase dapat dicapai dengan menggunakan bufer yang sesuai. Aktivitas enzim Taq polimerase juga ditentukan oleh konsentrasi ion Mg2+ karena ion ini merupakan kofaktor bagi Taq polimerase dan biasanya terdapat dalam larutan bufer pada beberapa jenis kit. Ion Mg2+ yang optimum untuk PCR adalah 1.5 mM. Konsentrasi Mg2+ yang lebih tinggi dari 2.0 mM akan menjadi inhibitor dan menyebabkan penempelan primer terganggu serta akan menghasilkan pita-pita yang kompleks dalam elektroforesis (William et al. 2003).
Reaksi pelipatgandaan suatu fragmen DNA dimulai dengan melakukan denaturasi DNA template (cetakan) sehingga DNA yang beruntai ganda akan terpisah menjadi rantai tunggal. Denaturasi DNA dilakukan dengan menggunakan panas (95ºC) selama 1-2 menit, kemudian suhu diturunkan menjadi 55ºC sehingga primer akan menempel (annealing) pada cetakan yang telah terpisah menjadi rantai tunggal. Primer akan membentuk ikatan hidrogen dengan cetakan pada daerah sekuen yang komplementer dengan sekuen primer. Setelah dilakukan annealing oligonukleotida primer dengan DNA cetakan, suhu inkubasi dinaikkan menjadi 72ºC selama 1.5 menit. Pada suhu ini DNA polimerase akan melakukan proses polimerasi rantai DNA yang baru berdasarkan informasi yang ada pada DNA cetakan. Setelah terjadi polimerasi, rantai DNA yang baru akan membentuk jembatan hidrogen dengan DNA cetakan. DNA yang terbentuk akan didenaturasi lagi dengan menaikkan suhu inkubasi menjadi 95ºC. Rantai DNA yang baru tersebut selanjutnya akan berfungsi sebagai cetakan bagi reaksi polimerasi berikutnya (Yuwono 2006).
BAHAN DAN METODE
Bahan dan AlatpH 5.2, NaCl 5 M, etanol 70%, isopropanol, etanol absolut, kloroform: isoamilalkohol (24:1), natrium asetat 3 M pH 5.2, dan ddH2O.
Amplifikasi gen membutuhkan primer P5CS CS forward, primer P5CS CS reverse, primer P5CS start, primer P5CS stop, bufer PCR, deoksinukleotida (dNTPs), Taq polimerase, dan air molekuler (MW). Ekstraksi dan pemurnian DNA menggunakan Extraction and Purification Kit (Invitrogen). Bahan-bahan yang diperlukan untuk ligasi dan transformasi yaitu vektor pGEM-T Easy (Promega), T4 DNA ligase, bufer ligasi, sel kompeten E.coli XL-1 Blue, media LB (Lurian Bertani) (Lampiran 4), ampisilin 50,000 ppm, IPTG 0.1 M, dan X-Gal 40,000 ppm. Elektroforesis memerlukan bahan-bahan sebagai berikut: agarosa, bufer TBE 0.5×, etidium bromida, dan marker 1 kb plus DNA ladder (Invitrogen). Isolasi DNA plasmid menggunakan High Pure Plamid Isolation Kit (Fermentas).
Alat-alat yang digunakan pada penelitian ini adalah mortar, lemari asam, sentrifus Beckman Allegra 64R, PCR ESCO, tabung Eppendorf, penangas air, tabung sentrifus, tabung mikro, pipet Mohr, pipet mikro, spektrofotometer UV-VIS Beckman Coulter-DU 530, sisir dan cetakan agar, bak elektroforsis, adaptor, gel doc, DNA speed vacuum 110 savant, inkubator bergoyang, laminar, autoklaf, pH meter, cawan Petri, gelas piala, labu Erlenmeyer, dan gelas ukur.
Metode
Isolasi DNA Genom dari Daun Karet (Castillo 1994)
Isolasi DNA dari daun tanaman karet dilakukan dengan menggunakan metode Castillo (1994). DNA diisolasi dari tiga belas klon karet, yaitu IRR104, IRR105, IRR107, IRR109, IRR110, IRR111, IRR112, IRR118, IRR119, IRR131, IRR132, IRR134, dan IRR136. Sebanyak 1 gram daun tanaman karet yang sudah dicuci bersih dimasukkan ke dalam mortar dingin kemudian ditambahkan sekitar 0.1 gram PVP dan nitrogen cair. Setelah itu, daun karet digerus hingga halus. Serbuk halus yang dihasilkan selanjutnya dimasukkan ke dalam tabung sentrifus yang berisi 5 mL bufer ekstraksi (CTAB 10%, EDTA 0.5 M pH 8.0, Tris HCl 1 M pH 8.0, NaCl 5 M, dan akuades steril) yang telah
dipanaskan dan ditambahkan β
-merkaptoetanol. Campuran ekstraksi lalu diinkubasi pada suhu 65ºC selama 30 menit selanjutnya diinkubasi pada suhu ruang
selama 5 menit. Campuran kemudian ditambah 5 mL larutan kloroform: isoamilalkohol (24:1) lalu disentrifugasi dengan kecepatan 11,000 rpm selama 10 menit. Supernatan yang dihasilkan diambil kemudian diekstraksi kembali dengan 5 mL larutan kloroform: isoamilalkohol (24:1) lalu disentrifugasi dengan kecepatan 11,000 rpm selama 10 menit. Supernatan diambil dan ditambah isopropanol dingin sebanyak 1 volume kemudian diinkubasi pada suhu 4ºC selama 30 menit. Campuran supernatan dan isopropanol selanjutnya disentrifugasi pada kondisi yang sama dengan sebelumnya.
Pelet yang dihasilkan dikeringanginkan lalu dilarutkan dalam CH3COONa 3 M pH 5.2
sebanyak 1/10 volume dan etanol absolut 2.5 mL kemudian diinkubasi pada suhu -20ºC selama 30 menit atau semalam. Setelah diinkubasi campuran disentrifugasi pada suhu 4ºC dengan kecepatan 12,000 rpm selama 10 menit. Pelet dicuci dengan larutan etanol 70% lalu dikeringkan. Pelet DNA selanjutnya dilarutkan dalam 30 µL bufer TE (Tris HCl 1 M pH 8.0, EDTA 0.5 M pH 8.0, dan ddH2O)
kemudian disimpan di dalam freezer.
Uji Kualitatif dan Kuantitatif DNA DNA yang telah diisolasi kemudian dianalisis secara kualitatif dan kuantitatif. Uji kualitatif DNA dilakukan melalui metode elektroforesis. DNA dielektroforesis dalam gel agarosa 0.8% (Lampiran 3) pada tegangan listrik 75 volt selama 1.5 jam. Analisis kuantitatif DNA memanfaatkan teknik spektrofotometri. DNA dilarutkan ke dalam air molekuler kemudian diukur nilai serapannya pada panjang gelombang 260 nm untuk mengetahui konsentrasi DNA sampel. Kemurnian DNA ditentukan dengan melakukan pengukuran pada panjang gelombang 230 nm dan 280 nm kemudian dibandingkan dengan nilai serapan pada panjang gelombang 260 nm.
forward-P5CS CS reverse dan P5CS start-P5CS stop. Program termal untuk setiap PCR diatur sebagai berikut: predenaturasi pada 94ºC selama 45 detik, annealing pada 40ºC selama 45 detik, dan ekstensi pada 72ºC selama 2 menit. Amplifikasi gen P5CS dilakukan sebanyak 35 siklus. Hasil PCR kemudian dielektroforesis dalam gel agarosa 1% (Lampiran 3) dengan tegangan listrik 75 volt selama 1.5 jam.
Ekstraksi dan Purifikasi DNA Ekstraksi dan purifikasi DNA hasil PCR dilakukan dengan menggunakan kit Invitrogen. Pita yang terang pada gel agarosa dipotong di bawah transluminator UV. Gel ditambah dengan bufer pelarut sebanyak 3 kali volume gel. Potongan gel diinkubasi pada suhu 50oC sampai gel tersebut larut. Setelah potongan gel larut, larutan dimasukkan ke dalam kolom ekstraksi dan disentrifugasi selama 1 menit dengan kecepatan 12,000 rpm. Sebanyak 500 - 700 µL wash buffer yang mengandung etanol ditambahkan ke dalam kolom kemudian disentrifugasi 1 menit dengan kecepatan 12,000 rpm. Setelah cairan dibuang, kolom disentrifugasi dalam keadaan kosong dengan kecepatan 12,000 rpm, 25oC selama 1 menit. Kolom kemudian dipindahkan ke dalam tabung recovery, setelah itu ditambahkan bufer elusi sebanyak 30 µL dan diinkubasi selama 1 menit pada suhu ruang. Larutan tersebut disentrifugasi kembali pada 12,000 rpm, 25oC selama 2 menit. Hasil ekstraksi dan purifikasi gel dianalisis dengan teknik elektroforesis gel agarosa.
Kloning Gen P5CS
Gen yang sudah dipurifikasi diligasi ke dalam vektor pGEM-T Easy (Promega). Campuran ligasi 10 µL dibuat dengan komposisi 5 µL bufer ligasi, 3.5 µL gen hasil purifikasi, 0.5 µL vektor pGEM-T easy, dan 1 µL T4 ligase. Ligasi dilakukan dengan menginkubasi campuran ligasi pada suhu 4°C selama satu malam atau pada suhu 25ºC selama 1 jam. Sebanyak 10 µL hasil ligasi ditransformasikan ke dalam 200 µL sel kompeten E.coli XL-1 Blue dan dikocok perlahan hingga tercampur rata kemudian diinkubasi di dalam es selama 30 menit. Larutan hasil ligasi dan sel kompeten diberi kejut panas (heat shock) pada suhu 42oC selama 50 detik yang selanjutnya segera dimasukkan ke dalam es selama 10 menit. Ke dalam larutan hasil rekombinasi dan sel kompeten ditambahkan 800 µL Luria Bertani
(LB) + glukosa 20 mM kemudian diinkubasi ke dalam shaker incubator selama 1.5 jam pada suhu 37oC dengan kecepatan 150 rpm. Setelah proses inkubasi, suspensi sel transforman ditransfer pada media seleksi (media LA + Ampisilin 100 ppm + IPTG 0.1 mM + X-Gal 40 ppm) lalu diinkubasi pada suhu 37ºC selama semalam. Seleksi transforman dilakukan dengan pengamatan terhadap koloni yang terbentuk. Koloni berwarna putih yang tumbuh selanjutnya diambil untuk duplikasi dan PCR koloni.
Konfirmasi Koloni Transforman dengan Teknik PCR Koloni
Konfirmasi koloni transforman dilakukan dengan teknik PCR koloni. PCR koloni dilakukan dengan membuat komponen mix yang terdiri atas, MW, buffer complete, dNTPs, primer M13-F, primer M13-R, dan Taq polymerase. Tahap pertama PCR adalah program lisis 96oC selama 5 menit, 50oC selama 1 menit 30 detik, 96oC selama 1 menit 30 detik, 45oC selama 1 menit 30 detik, 96oC selama 1 menit, 40oC selama 1 menit. Program dihentikan sejenak untuk penambahan sebanyak 5 µL komponen mix ke dalam masing-masing tabung. Kemudian program PCR dilanjutkan kembali dengan program PCR berikut: predenaturasi 94oC selama 30 detik, annealing 55oC selama 1 menit, ekstensi 72oC selama 2 menit. Hasil PCR koloni diverifikasi dengan gel agarosa 1 %. Koloni terpilih dikultur ke dalam media LB cair yang telah ditambah ampisilin 100 ppm kemudian diinkubasi di inkubator bergoyang pada suhu 37ºC dengan kecepatan 150 rpm.
Bufer pencuci (W10) yang mengandung etanol ditambahkan sebanyak 500 µL ke dalam kolom kemudian diinkubasi pada suhu ruang selama 1 menit dan disentrifugasi dengan kecepatan 12,000 rpm selama 1 menit. Cairan di dalam tabung dibuang. Ke dalam tabung ditambahkan bufer pencuci (W9) yang mengandung etanol kemudian disentrifugasi dengan kondisi yang sama. Setelah itu, kolom kembali disentrifugasi dengan keadaan kosong. Sebanyak 30 µL bufer elusi ditambahkan ke dalam kolom kemudian diinkubasi pada suhu ruang selama 2 menit. Setelah diinkubasi, tabung disentrifugasi dengan kecepatan 12,000 rpm selama 2 menit. Larutan tersebut kemudian diverifikasi dengan elektroforesis gel agarosa 1%.
Sekuensing dan Analisis Hasil Sekuensing Gen P5CS
DNA plamid yang sudah dimurnikan ditentukan urutan basanya melalui metode sekuensing dengan primer M13 forward dan M13 reverse. Pengurutan basa (sekuensing) gen terklon dilakukan di Lembaga Ilmu Pengetahuan Indonesia (LIPI), Cibinong, Bogor. Hasil sekuen gen terklon selanjutnya dianalisis lebih lanjut dengan program bioinformatika.
Sebelum dilakukan analisis terhadap hasil sekuen gen P5CS, perlu dilakukan penghilangan sekuen vektor. Setelah sekuen vektor dihilangkan, dicari sekuen primer forward dan reverse. Hasil sekuen selanjutnya dianalisis dengan program Bioedit untuk menentukan reverse complement sekuen gen yang dihasilkan dari primer M13 reverse. Setelah diperoleh reverse complement, ditentukan daerah yang overlap antara sekuen M13 forward dan reverse complement M13 reverse.
Urutan basa hasil sekuensing dianalisis dengan program BLASTX (www.ncbi.
nlm.nih.gov). Program BLASTX mentranslasi
sekuen nukleotida menjadi protein, kemudian membandingkannya dengan protein yang terdapat pada pangkalan data (database). Homologi yang tinggi ditunjukkan dengan nilai skor bits yang semakin besar (>150) dan E value yang kecil (<10-4).
HASIL DAN PEMBAHASAN
Hasil Isolasi DNA Genom dari DaunTanaman Karet
Isolasi DNA adalah langkah pertama manipulasi DNA secara in vitro. Isolasi DNA genom dari daun tanaman karet dilakukan
berdasarkan metode Castillo (1994). DNA diisolasi dari tiga belas klon karet yang berbeda, yaitu IRR104, IRR105, IRR107, IRR109, IRR110, IRR111, IRR112, IRR118, IRR119, IRR131, IRR132, IRR134, dan IRR136. DNA hasil isolasi dianalisis secara kuantitatif untuk mengetahui konsentrasi dan kemurnian DNA.
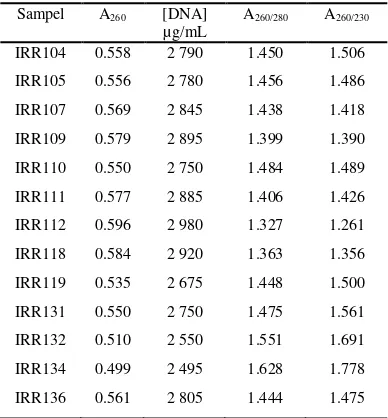
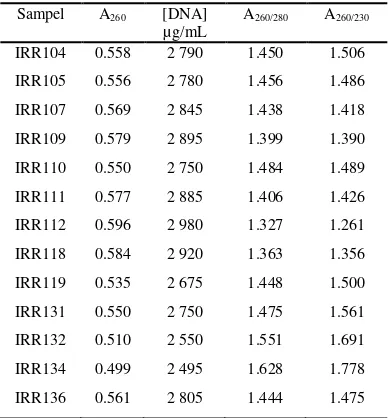
Penentuan konsentrasi DNA didasarkan prinsip bahwa nilai serapan sebesar 1.000 dari hasil pembacaan dengan spektrofotometer DNA setara dengan 50 µg/mL (Brown 2003; Walker & Wilson 2000). Berdasarkan Tabel 1, konsentrasi DNA berkisar antara 2495 dan 2920 µg/mL. Kemurnian DNA dilihat dari nilai A260/A230 dan A260/A280. Nilai A260/A230
merupakan indikator kontaminasi DNA oleh polifenol dan polisakarida, sedangkan nilai A260/A280 merupakan parameter kontaminasi
DNA oleh protein. Nilai perbandingan yang menunjukkan tidak adanya pengotor berada pada kisaran 1.8-2.0 (Asif et al. 2000). Nilai A260/A230 DNA yang telah diisolasi berkisar
antara 1.261 dan 1.778, sedangkan nilai A260/A280 yaitu 1.327-1.628. Nilai tersebut
menunjukkan bahwa DNA hasil isolasi masih memiliki pengotor polifenol, polisakarida, dan protein. DNA dapat digunakan untuk analisis lebih lanjut, karena DNA yang dipakai sebagai cetakan PCR tidak memerlukan kemurnian yang tinggi (Yuwono 2006). DNA dipekatkan dengan larutan etanol.
Uji kualitas DNA dilakukan melalui elektroforesis gel agarosa 0.8%. Berdasarkan Gambar 3, pita DNA menunjukkan intensitas yang cukup tinggi, sehingga DNA dapat digunakan untuk tahapan selanjutnya.
Tabel 1 Kuantitas dan kemurnian DNA hasil isolasi
Sampel A260 [DNA]
µg/mL
A260/280 A260/230
IRR104 0.558 2 790 1.450 1.506
IRR105 0.556 2 780 1.456 1.486
IRR107 0.569 2 845 1.438 1.418
IRR109 0.579 2 895 1.399 1.390
IRR110 0.550 2 750 1.484 1.489
IRR111 0.577 2 885 1.406 1.426
IRR112 0.596 2 980 1.327 1.261
IRR118 0.584 2 920 1.363 1.356
IRR119 0.535 2 675 1.448 1.500
IRR131 0.550 2 750 1.475 1.561
IRR132 0.510 2 550 1.551 1.691
IRR134 0.499 2 495 1.628 1.778
Gambar 3 Elektroforegram DNA hasil isolasi (Castillo 1994); (a) IRR104, (b) IRR105, (c) IRR107, (d) IRR109, (e) IRR110, (f) IRR111, (g) IRR112, (h) IRR118, (i) IRR119, (j) IRR131, (k) IRR132, (l) IRR134, dan (m) IRR136.
Amplikon Gen P5CS Tanaman Karet Gen P5CS tanaman karet diisolasi dengan dua pasang primer, yaitu P5CS CS forward-P5CS CS reverse dan P5CS start-P5CS stop. Primer yang digunakan harus memenuhi beberapa syarat, di antaranya tidak komplemen satu sama lain sehingga memungkinkan terjadinya hibridisasi dan primer dimer, yang akan mengurangi produk PCR. Pasangan primer yang didesain seharusnya mempunyai suhu annealing (melting temperature) berdekatan dan mengandung basa G-C sekitar 50% (Maier et al. 2009).
Primer gen P5CS yang digunakan dalam penelitian ini dirancang berdasarkan sekuen gen P5CS tanaman Vigna aconitifolia. Primer diharapkan dapat mengamplifikasi gen P5CS tanaman karet pada daerah terkonservasi dan daerah sekuen penuh gen (full-length gene). Pasangan primer P5CS CS forward-P5CSCS reverse dirancang untuk mengamplifikasi gen P5CS pada daerah terkonservasi (500-1750 pb), sedangkan P5CS start-P5CS stop disusun untuk mengamplifikasi sekuen penuh gen P5CS (1-2250 pb) (Minarsih et al.2001). Primer P5CS yang digunakan untuk mengisolasi gen P5CS dapat dilihat pada Tabel 2.
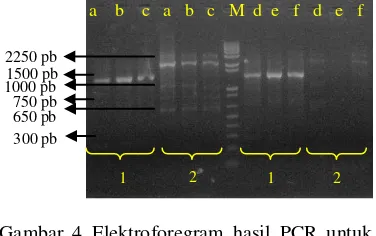
Primer perlu dioptimasi sebelum digunakan untuk mengamplifikasi gen P5CS. Parameter yang perlu dicoba adalah suhu annealing. Optimasi dilakukan dengan PCR gradien dengan suhu annealing sebesar 35, 40, 45, 50, 55, dan 60ºC. DNA yang dipakai sebagai cetakan PCR tidak memerlukan kemurnian yang tinggi (Yuwono 2006). Hal ini juga didukung oleh visualisasi hasil pemurnian DNA ketiga belas klon karet (Gambar 3), yang menunjukkan intensitas tinggi sehingga dapat digunakan sebagai cetakan. DNA yang dipilih sebagai cetakan yaitu klon IRR105. Produk PCR kemudian dielektroforesis gel agarosa 1 % (Gambar 4).
Hasil visualisasi elektroforesis DNA memperlihatkan bahwa PCR dengan primer P5CS CS forward dan P5CS CS reverse pada keenam suhu annealing menghasilkan tiga pita DNA, yaitu 300, 750, dan 1500 pb. Primer tersebut disusun untuk mengamplifikasi daerah terkonservasi (500-1750 pb), sehingga ukuran DNA yang dihasilkan yaitu 1250 pb. Berdasarkan elektroforegram (Gambar 4), amplikon tidak menghasilkan DNA dengan ukuran yang diinginkan. Hal ini menunjukkan primer P5CS CS forward-P5CS CS reverse yang dirancang berdasarkan sekuen gen P5CS Vigna aconitifolia tidak dapat mengamplifikasi gen P5CS pada tanaman karet.
Amplikon yang dihasilkan dari teknik PCR dengan primer P5CS start dan P5CS stop menunjukkan terbentuknya tiga pita DNA, yaitu 650, 1000, dan 2250 pb (Gambar 4). Intensitas pita DNA paling tinggi berukuran sekitar 2250 pb. DNA berukuran 2250 pb yang diperoleh merupakan amplikon yang diduga sebagai gen P5CS tanaman karet. Pasangan primer P5CS start dan P5CS stop didesain untuk menghasilkan sekuen penuh gen P5CS (1-2250 pb), sehingga menghasilkan DNA sebesar 2250 pb.
Pada tahapan optimasi suhu annealing, diharapkan terbentuknya satu pita spesifik pada gel agarosa, namun berdasarkan hasil uji kualitatif diperoleh pita lebih dari satu. Spesifisitas amplifikasi dipengaruhi oleh beberapa faktor. Suhu annealing yang rendah menyebabkan primer menempel kurang spesifik pada DNA cetakan (Yuwono 2006). Selain itu, perancangan primer berdasarkan sekuen gen dari tanaman yang berbeda juga dapat menyebabkan primer tidak spesifik mengamplifikasi gen yang diinginkan.
Gambar 4 Elektroforegram hasil PCR untuk optimasi suhu annealing; (1) primer P5CS CS forward-P5CS CS reverse, (2) primer P5CS start-stop, (a) 35ºC, (b) 40ºC, (c) 45ºC, (d) 50ºC, (e) 55ºC, (f) 60ºC, (M)marker.
a b c d e f g h i j k l m
1500 pb 750 pb 300 pb 2250 pb 1000 pb 650 pb
1 2
a b c a b c M d e f d e f
Tabel 2 Primer untuk isolasi gen P5CS
Primer Sekuen Tm (ºC) % GC Jumlah basa
P5CS CS forward 5’-TACTGAGACTGTGAAGTCGC-3’ 60 50.0 20
P5CS CS reverse 5’-ATGGCATTGCAGGCTGCCG-3’ 62 63.2 19
P5CS start 5’-CGGGGGTTCATGAAGGACG-3’ 62 63.2 19
P5CS stop 5’-GAATCGTTAAACATTGTGGACC-3’ 62 40.9 22
Suhu annealing optimum dipilih berdasarkan kualitas DNA hasil optimasi. Pita DNA hasil amplifikasi dengan suhu 40ºC pada proses optimasi suhu annealing (Gambar 4) menunjukkan intensitas paling tinggi dibandingkan dengan suhu 35, 45, 50, 55, dan 60ºC. Amplikon non-target yang dihasilkan dari amplifikasi pada suhu 40ºC mempunyai konsentrasi yang rendah, ditunjukkan oleh tipisnya pita DNA pada elektroforegram. Berdasarkan hasil pengamatan, suhu annealing optimum yang dipilih yaitu 40ºC. Suhu annealing optimum yang dipilih lebih rendah dibandingkan dengan Tm teoretis primer P5CS start-P5CS stop, yaitu 62ºC. Berdasarkan Rybicki (2001), penentuan suhu annealing dapat diperkirakan berdasarkan nilai Tm, yaitu 5ºC di bawah nilai Tm teoretis, namun menurut Darmawan (2004), nilai Tm yang tepat biasanya diperoleh secara empiris.
Primer P5CS CS forward-P5CS CS reverse tidak menghasilkan gen P5CS yang diinginkan, sehingga pasangan primer tersebut tidak digunakan untuk tahapan selanjutnya. Primer P5CS start dan P5CS stop menghasilkan pita DNA yang diduga sebagai gen P5CS, sehingga primer digunakan untuk amplifikasi gen. Elektroforegram hasil amplifikasi gen P5CS dengan primer P5CS start dan P5CS stop pada suhu optimum (40ºC) dapat dilihat pada Gambar 5. Ukuran pita DNA yang dihasilkan yaitu 650, 1000, dan 2250 pb.
Gambar 5 Elektroforegram hasil PCR suhu annealing 40ºC.
Hasil Ekstraksi dan Purifikasi Gen P5CS
Pasangan primer P5CS start-P5CS stop dirancang untuk mengamplifikasi daerah penuh gen (1-2250 pb). Berdasarkan pengamatan visualisasi hasil amplifikasi pada Gambar 5, dihasilkan pita berukuran sekitar 2250 dengan intensitas yang sangat tinggi. DNA tersebut diduga sebagai gen P5CS yang diinginkan. Amplikon berukuran 2250 pb diekstraksi dan dipurifikasi menggunakan Extraction and Purification Kit (Invitrogen). Gel diletakkan di atas transluminator ultraviolet (UV) T2201 untuk melihat pita yang akan dipotong. Pita DNA yang terlihat setelah penyinaran sinar UV dipotong dengan pisau potong (scalpel) kemudian diekstraksi dan dimurnikan. Ekstrasi dan pemurnian bertujuan untuk memurnikan DNA dari berbagai pengotor yang tidak diinginkan seperti protein dan RNA. Visualisasi hasil ekstraksi dan purifikasi dapat diamati pada Gambar 6 berikut. Keberhasilan proses ekstraksi dan purifikasi DNA dapat dilihat dari terbentuknya pita tunggal.
Gambar 6 Konfirmasi ekstraksi dan purifikasi gen P5CS.
Koloni Rekombinan Hasil Kloning Teknologi DNA rekombinan merupakan teknik untuk mentransfer DNA dari satu organisme ke organisme yang lain. Tahapan kloning dibagi menjadi tiga, yaitu ligasi, transformasi, dan seleksi transforman. Gen P5CS yang sudah dimurnikan diklon ke vektor pGEM-T easy. Kloning gen dengan 2250 pb
1000 pb
650 pb
memanfaatkan pGEM-T easy sebagai vektor mempunyai keuntungan, yaitu tidak memerlukan proses restriksi. Hal ini disebabkan oleh adanya basa timin (T) overhang pada ujung 3’ vektor, sehingga produk PCR yang menggunakan Taq polimerase, yang mempunyai kemampuan menambahkan satu basa adenin (A) pada
ujung 3’ produk PCR, akan mudah bergabung
dengan vektor. Hasil ligasi yang sudah diinkubasi selama semalam kemudian ditransformasi ke dalam sel bakteri Escherichia coli XL-1 Blue. Seleksi transforman dilakukan dengan cara menumbuhkan sel E.coli di dalam media seleksi yang mengandung ampisilin, IPTG (isopropiltiogalaktosida), dan X-Gal (5-bromo-4- kloro-3- indolil-β -D-galaktopirano-sida).
Koloni berwarna putih dan biru yang tumbuh merupakan sel yang mengandung plasmid pGEM-T easy (Gambar 7). Plasmid pGEM-T easy mengandung sekuen gen LacZ.
Gen ini mengkode bagian peptida alfa dari β
-galaktosidase. β-galaktosidase merupakan satu di antara rangkaian enzim untuk memecah laktosa menjadi glukosa dan galaktosa. Pengujian enzim beta galaktosidase dilakukan dengan penggunaan analog laktosa, yaitu X-Gal. X-Gal diuraikan oleh enzim membentuk produk berwarna biru (Brown 1991). Adanya gen P5CS yang terinsersi ke dalam vektor menyebabkan sel tidak dapat memproduksi
enzim β-galaktosidase, sehingga koloni berwarna putih.
Gambar 7 Koloni biru putih hasil kloning gen P5CS.
Hasil PCR Koloni
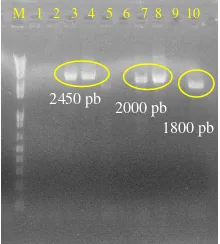
Koloni berwarna putih kemudian diduplikasi dan dilakukan PCR koloni untuk menentukan koloni terbaik di antara koloni positif. Koloni terbaik merupakan koloni yang berhasil tersisipi oleh vektor rekombinan, yaitu vektor yang mengandung gen P5CS hasil amplifikasi. Hasil PCR koloni kemudian
dikonfirmasi dengan elektroforesis gel agarosa 1%. Berdasarkan elektroforegram yang diperoleh (Gambar 8), dihasilkan 5 koloni positif, yaitu koloni 3, 4, 7, 8, dan 10.
Koloni yang berhasil diamplifikasi dengan primer M13 forward dan M13 reverse merupakan koloni yang mengandung vektor rekombinan. Koloni positif yang mengandung gen P5CS dapat ditentukan dengan cara mengamati ukuran pita DNA yang terbentuk dari hasil elektroforesis PCR koloni. Gen P5CS mempunyai ukuran 2250 pb. Amplifikasi dengan primer M13 forward-M13 reverse menyebabkan penambahan ukuran sebesar 200 pb akibat teramplifikasinya sebagian sekuen DNA vektor pGEM-T easy, yaitu sebesar 100 pb pada masing-masing ujungnya. Berdasarkan alasan tersebut, koloni yang berhasil disisipi oleh gen P5CS tanaman karet mempunyai ukuran 2450 pb.
Koloni berukuran 2450 dihasilkan oleh koloni 3 dan 4. Koloni 7 dan 8 menunjukkan ukuran yang berbeda, yaitu 2000 pb, sedangkan koloni 10 mempunyai ukuran 1800 pb. Koloni positif yang menghasilkan pita DNA berukuran 2000 dan 1800 pb menunjukkan bahwa koloni berhasil disisipi oleh gen, namun bukan gen P5CS tanaman karet.
Gambar 8 Elektroforegram PCR koloni.
DNA Plasmid Rekombinan
Koloni 3 dan 4 yang merupakan koloni pembawa gen P5CS tanaman karet kemudian dikultur ke dalam media LB cair yang mengandung antibiotik ampisilin 100 ppm dan diinkubasi selama semalam pada suhu 37ºC. Kultur bakteri yang berubah menjadi keruh menunjukkan adanya pertumbuhan bakteri. Kultur bakteri kemudian diisolasi DNA plasmidnya. Isolasi DNA plasmid dilakukan dengan mengunakan kit dari Invitrogen. DNA plasmid yang diperoleh dikonfirmasi dengan elektroforesis gel agarosa 1% (Gambar 9).
M 1 2 3 4 5 6 7 8 9 10
2450 pb 2000 pb
Plasmid yang digunakan yaitu pGEM-T easy dengan ukuran 3015 pb, sedangkan gen P5CS yang disisipkan ke dalam plasmid mempunyai ukuran sekitar 2250 pb, sehingga plasmid rekombinan mempunyai ukuran sekitar 5250 pb. Berdasarkan pengamatan pada gel agarosa, ukuran DNA plasmid yang diisolasi yaitu sekitar 5250 pb. Hal ini menunjukkan bahwa isolasi DNA plasmid berhasil dilakukan.
Gambar 9 Elektroforegram isolasi DNA plasmid.
Hasil Urutan Basa Gen Hasil Kloning DNA plasmid hasil isolasi ditentukan urutan basanya dengan menggunakan primer universal M13 forward dan M13 reverse. Pengurutan basa DNA dilakukan terhadap gen P5CS yang diamplifikasi dengan pasangan primer P5CS start-P5CS stop. Sekuen gen yang diamplifikasi dengan primer M13 forward dapat dilihat pada Gambar 10, sedangkan M13 reverse menghasilkan sekuen gen seperti Gambar 11.
Analisis hasil sekuen gen P5CS dengan primer P5CS start-P5CS stop menunjukkan primer menempel secara tepat pada kedua hasil sekuen. Urutan primer P5CS start yaitu CGGGGGTTCATGAAGGACG (Gambar 10), sedangkan urutan primer P5CS stop yaitu GAATCGTTAAACATTGTGGACC
(Gambar 11). Berdasarkan analisis hasil sekuen dengan primer M13 forward dan reverse complement M13 reverse, dapat dinyatakan bahwa tidak ada daerah yang overlap. Hal ini berarti terdapat gaps antara awal dan akhir hasil sekuensing. Adanya gaps ini dapat disebabkan oleh alat sekuensing yang digunakan adalah seri yang mampu membaca nukleotida dengan ukuran 450-600 pb, sehingga untuk membaca seluruh hasil sekuen perlu dirancang primer antara.
Hasil sekuen dianalisis lebih lanjut dengan menggunakan program BLASTX. Urutan basa yang digunakan sebagai query yaitu basa ketujuh puluh sampai kelima ratus, berdasarkan kualitas elektroferogram
(Lampiran 6). Hasil BLASTX dari urutan basa gen P5CS disajikan pada Tabel 3. Berdasarkan hasil tersebut diketahui bahwa urutan basa yang diperoleh bukan gen P5CS. Hal itu terlihat dari homologi yang tinggi (68%) terhadap protein yang bersesuaian dengan protein hipotetik dari Vitis vinifera. Selain itu, sekuen gen yang dihasilkan mempunyai homologi yang cukup tinggi dengan reverse transcriptase Asparagus officinalis. Basyuni et al. (2010) mengemukakan bahwa kedua protein ini merupakan jenis protein yang terekspresi pada tanaman yang mengalami cekaman kekeringan. Berdasarkan analisis tersebut, meskipun hasil amplifikasi menghasilkan gen bukan P5CS, namun ini juga merupakan salah satu gen penanda kekeringan.
*hanya ditampilkan sebagian, secara lebih lengkap dapat dilihat pada Lampiran 7
Gambar 10 Urutan basa DNA yang disekuen dengan primer M13 forward.
*hanya ditampilkan sebagian, secara lebih lengkap dapat dilihat pada Lampiran 7
Gambar 10 Urutan basa DNA yang disekuen dengan primer M13 reverse.
Tabel 3 Hasil analisis BLASTX gen P5CS primer P5CS start-P5CS stop
Protein yang bersesuaian Score (bits) E value
Gag/pol polyprotein… 364 5e-99 RNA-directed DNA
polymerase… 357 1e-96
Hypothetical protein [Vitis….
355 4e-96
*hanya ditampilkan sebagian, secara lebih lengkap dapat dilihat pada Lampiran 8
SIMPULAN DAN SARAN
Simpulan
Isolasi gen P5CS tanaman karet dengan primer P5CS CS forward-P5CS CS reverse belum berhasil dilakukan, sedangkan isolasi gen dengan primer P5CS start-P5CS stop menghasilkan amplikon berukuran 2250 pb. Konfirmasi hasil kloning gen P5CS melalui teknik PCR dengan primer M13 forward-M13 reverse menghasilkan DNA berukuran 2450 pb. Isolasi DNA plasmid menghasilkan DNA berukuran 5450 pb. Analisis hasil sekuensing dengan BLASTX menunjukkan bahwa amplikon yang telah diisolasi dan dikloning bukan gen P5CS, namun masih mempunyai homologi yang tinggi (68%) dengan gen penanda kekeringan.
Saran
Karakterisasi gen perlu dilakukan untuk mengetahui bahwa fragmen DNA yang disisipkan ke dalam vektor kloning merupakan gen yang diinginkan. Primer yang digunakan untuk mengamplifikasi gen P5CS tanaman karet perlu dirancang ulang. Optimasi kondisi PCR juga perlu dilakukan untuk mendapatkan gen P5CS tanaman karet. Isolasi gen P5CS dari tanaman karet yang sudah mengalami perlakuan stres kekeringan perlu dilakukan.
DAFTAR PUSTAKA
Asif MH, Dhawan P, Nath P. 2000. A simple procedure for the isolation of high quality RNA from ripening banana fruit. Plant Mol Biol 18: 105-115.
Azizah A. 2009. Perbandingan pola pita amplifikasi DNA daun, bunga, dan buah kelapa sawit normal dan abnormal [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Basyuni M, Kinjo Y, Baba S, Shinzato N, Iwasaki H, Siregar EBM, Oku H. 2010. Isolation of salt stress tolerance genes from roots of mangrove plant, Rhizospora stylosa Griff., using PCR-based suppression subtractive hybridization. Plant Mol Biol Rep.
Bates LS. 1973. Rapid determination of free proline for water stress studies. Plant and Soil 39: 205-207.
Bohnert HJ, DE Nelson, RG Yensen. 1995.
Adaptation to environmental stress. Plant Cell 7: 1099-1111.
[BPS] Badan Pusat Statistik. 2010. Produktivitas karet alam Indonesia. [terhubung berkala]. www.bps.go.id [23 Des 2010].
Bray EA. 1993. Molecular responses to water deficit. Plant Physiol 103: 1035-1040.
Brown TA. 1991. Pengantar Kloning Gen. Muhammad SA, penerjemah. Yogyakarta: Yayasan Essentia Medika. Terjemahan dari: Gene Cloning an Introduction. Brown TA. 2003. Pengantar Kloning Gen.
Muhammad SA, penerjemah. Yogyakarta: Yayasan Essentia Medika. Terjemahan dari: Gene Cloning an Introduction.
Campbell MK, Farrel SO. 2009. Biochemistry 6th Ed. USA: Thomson Brooks/ Cole. Darmawan N. 2004. Isolasi, kloning, dan
sekuensing gen putative enzim PQQ glukosa dehidrogenase dari Agrobacterium tumefaciens [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam.
Delauney AJ, Verma DPS. 1993. Prolina biosynthesis and osmoregulation in plants. The plant journal 4: 215-223.
Ginting S. 1985. Hubungan antara ciri tanaman muda dengan kemampuan produksi beberapa klon karet [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Hamim, Sopandie D, Jusuf M. 1996. Beberapa karakteristik morfologi dan fisiologi kedelai toleran dan peka terhadap cekaman kekeringan. Hayati 3(1): 30-34.
Hidayat A, A. Mulyani. 2002. Lahan kering untuk pertanian dalam teknologi pengelolaan lahan kering menuju pertanian produktif dan ramah lingkungan. Pusat Penelitian dan Pengembangan Tanah dan Agroklimat, Badan Litbang Pertanian.
Hong Z, Lakkineni K, Zhang Z, Verma DPS. 2000. Removal of feedback inhibition of pyrroline-5-carboxylate synthetase results in increased proline accumulation and protection of plants from osmotic stress. Plant physiol 122: 1129–1136.
Indraty IS. 1987. Mekanisme pembentukan lateks pada tubuh pohon karet. Bulletin Rubber Research Centre Getas 53: 1-8.
Innis MA, Gelfand DH. 1990. Optimization of PCR: PCR Protocols a Guide to Methods and Application. London: Academic.
Isselbacher KJ et al. 1995. Prinsip-prinsip Ilmu Penyakit Dalam. Asdie AH, penerjemah. Jakarta: Buku Kedokteran EGC. Terjemahan dari: Harrison’s Principles oh Internal Medicine.
Jaiwal PK, Singh RP. 2003. Improvement Strategies of Leguminosae Biotechnology. Britania: MPG Books Limited.
Kavi Kishor P B, Hong Z, Miao G, Hu C,Verma DPS. 1995. Over expression of D1-pyrroline-5-carboxylate synthetase increases proline overproduction and confers osmtolerance in transgenic plants. Plant physiol 108: 1387–1394.
Kenneth EP, JA Sanchez, John ER, Lawrence JW. 2005. Linear-After-The-Exponential (LATE)-PCR: Primer design criteria for high yields of specific single stranded DNA and improved real-time detection. PNAS 102: 8609–8614.
Kuznetsov VV, Shevyakova NI. 1997. Stress responses of tobacco cells to hight temperature and salinity. Proline accumulation and phosphorylation of polypeptides. Physiol Plant. 100:320-326.
Lehninger A.L. 1994. Dasar-Dasar Biokimia jilid 1. Maggy Thenawidjadja, penerjemah. Jakarta: Erlangga. Terjemahan dari: Principal of Biochemistry.
Lukman. 1984. Pembentukan lateks dan hubungannya dengan penyadapan. Kumpulan Makalah Kursus Eksploitasi Balai Penelitian Perkebunan Sungei Putih: 1-7.
Mathius NT, et al. 2004. Respon biokimia beberapa progeni kelapa sawit (Elaeis guineensis Jacq.) terhadap cekaman kekeringan pada kondisi lapang. Menara perkebunan 72(2): 38-56.
Maier RM, Pepper IL, Gerba CP. 2009. Environmental Microbiology. London: Elsevier, Inc.
Meksem K, Kahl G. 2005. The Handbook of Plant Genome Mapping. Jerman: Wiley-VCH Verlag GmbH & KGaA Weinheim.
Minarsih H, Santoso D, Fitranty N. 2001. Identification of P5CS gene on sugarcane by PCR using heterologous primer. Menara Perkebunan 69: 1-9.
Murray RK, Granner DK, Rodwell VW. 2003. Biokimia Harper. Pendit BU, penerjemah. Jakarta: EGC. Terjemahan dari: Harper’s Illustrated Biochemistry.
Nurhayati, Rizwan, Hanifah. 2006. Ekspresi gen selama defisit air. Jurnal Penelitian Bidang Ilmu Pertanian 4: 18-23.
Parhusip AB. 2008. Potret karet alam Indonesia. Economic review No.213.
Passarge Eberhard. 2007. Color Atlas of Genetics. Jerman: Georg Thieme Verlag KG.
Primose DJ, Old RW. 1989. Principles of Genes Manipulation, Ed. ke-4. London: Blackwell Scientific Publications.
Rukmana Rahmat. 1995. Teknik Pengelolaan Lahan Berbukit dan Kritis. Yogyakarta: Kanisius.
Rybicki E. 2001. PCR primer design and reaction optimization. Coyne VE et al., editor. Molecular Techniques Manual 3rd Ed. Cape Town: University of Cape Town.
Sardjoko. 1991. Bioteknologi: Latar Belakang dan Beberapa Penerapannya. Jakarta: Gramedia.
Sasli I. 2004. Peranan Mikoriza Vesikula Arbuskula (MVA) dalam peningkatan resistensi tanaman terhadap cekaman kekeringan [makalah]. Program Pascasarjana, Institut Pertanian Bogor.
Setyamidjaja D. 1993. Seri Budi Daya Karet. Yogyakarta: Kanisius.
Sinaga R. 2007. Analisis model ketahanan rumput gajah dan rumput raja akibat cekaman kekeringan berdasarkan respon dan anatomi akar dan daun. Jurnal Biologi Sumatera 2(1): 17-20.
Suharsono, Widyastuti U. 2006. Penuntun Praktikum Pelatihan Teknik Pengklonan Gen. Pusat Penelitian Sumber Daya Hayati dan Bioteknologi, Institut Pertanian Bogor.
[Tim Penulis PS] Tim Penulis Penebar Swadaya. 2008. Panduan Lengkap Karet. Jakarta: Penebar Swadaya.
Cambridge University Press.
Walton EF, Podivinsky E, Wu RM, Reynolds PHS, Young LW. 1998. Regulation of proline biosynthesis on kiwifruit buds with and without hydrogen cyanamide treatment. Physiol Plant 102:171-178.
Webster CC, Baulkwill WJ. 1989. Rubber. New York: John Wiley & Sons.
Widyasari WB, E. Sugiyarta. 1997. Akumulasi prolina dalam jaringan daun tebu sebagai indikator sifat varietas tebu tahan kering. Majalah Penelitian Gula, XXXIII (1), 1-10.
Widyatmoko K. 2005. Analisis tanggapan tanaman tebu terhadap cekaman kekeringan [tesis]. Program Pascasarjana, Universitas Lampung.
Williams JGK, Kubelik AR, Livak KJ, Rafalski JA, Tingey SV. 1990. DNA polymoprhisms amplified by arbitrary primers are useful genetic markers. Nucleic Acids Res 18: 6531-6535.
Yang CW, Kao CH. 1999. Importance of orni-
thine-δ-transferase to prolina accumulation coused by water stress in detached rice leaves. Plant Growth Reg. 27: l89-192.
Yoshiba Y, Kiyoue T, Nakashima K, Yamaguchi-Shinozaki K, Shinozaki K. 1997. Regulation of levels of proline as an osmolyte in plants under water stress. Plant Cell Physiol 38: 1095-1102.
Yuwono NW. 2009. Membangun kesuburan tanah di lahan marginal. Jurnal ilmu tanah dan lingkungan 9: 137-141.
Yuwono T. 2006. Biologi Molekular. Amalia S, editor. Jakarta: Erlangga.
Yuwono T. 2006. Teori dan Aplikasi Polimerase Chain Reaction. Yogyakarta: Andi.
Lampiran 1 Diagram alir penelitian
Isolasi DNA genom tanaman karet
Isolasi gen
P5CS
dengan PCR
Elusi
Ligasi ke vektor pGEM-T
easy
Transformasi ke
E.coli
XL-1
PCR koloni
Isolasi DNA plasmid
Lampiran 2 Komposisi larutan yang digunakan dalam penelitian
Bufer ekstraksi
Stok Diperlukan Dipipet
Tris HCl 1 M pH 8.0 100 mM 5 mL
EDTA 0.5 M pH 8.0 20 mM 2 mL
NaCl 5 M 1.26 M 12.6 mL
CTAB 10% 2% 10 mL
Aquades Steril − 20.4 mL
25 mL
Bufer Tris-EDTA
Stok Dipipet
Tris HCl 10 mM 1 mL
EDTA 1 mM 0.2 mL
Aquades Steril 98.8 mL
100 mL
Larutan TBE 10× 1 Liter
Bahan Jumlah
Tris base 108 g
Boric acid 55 g
EDTA 0.5 M Akuades
Lampiran 3 Pembuatan gel agarose 0.8% dan 1%
Gel agarose 0.8%
Gel agarose 1%
Gel agarose ditimbang sebanyak 0.48 g
Ditambah larutan TBE 0.5×
Dipanaskan sampai larut
Ditambah 3 µL EtBr
Larutan dituang ke dalam cetakan
Gel agarose ditimbang sebanyak 0.6 g
Ditambah larutan TBE 0.5×
Dipanaskan sampai larut
Ditambah 3 µL EtBr
Lampiran 4 Pembuatan media
Media Luria Bertani (LB) cair 1 L
Media agar 1 L
Tripton,
yeast extract
, dan NaCl
ditimbang sebanyak 10, 5, dan 5 g
Bahan dilarutkan dengan akuades
Campuran diukur pH = 7.2
Campuran ditera hingga 1 L
Diautoklaf 1 atm, 121ºC, 15 menit
Media agar ditimbang sebanyak 32 g
Bahan dilarutkan dengan akuades
Larutan diukur pH = 7.2
Larutan ditera hingga 1 L
Diautoklaf 1 atm, 121ºC, 15 menit
Media ditambah ampisilin 100 ppm,
IPTG 0.1 mM, X-Gal 40 ppm
Lampiran 7 Hasil sekuen DNA hasil kloning
Urutan basa DNA yang disekuen dengan primer
M13 forward
CGGGGGTTCATGAAGGACGGGAGAGTCAGGGTGTGCATTGACTACCGGGATCTTAAT
AAAGTTAGCTTGAAAGATGATTTCCCTCTCCCCCACATTGATGTGCTAGTTGACAATG CTGCGGGATTGGGTAGGTGTTCGTGTATTGATGGGGCATCAGGGTATAATCAGATCCC AATGGACGAGGAAGACAAGGATAAAACTGCTTTCATCACCCAATGGGGGGTATTTTG CTATCGGGTCATGCCCTTCGGGTTGAAGAATGCCGGGGCTACTTATCAGCGTGCGATG GTCACATTATTCCATGATATGATGCATAAAGAAGTGGAGGTATACGTGGATGATATGA TCATCAAATCCAGGGGAGAAGAGAGCCACGTTCAGGTGATGAGGAGGGTATTCGAAA GGCTCAGGAAATACCAGTTGAAGCTGAACCCTGCTAAATGCATATTCGGAGCTAGAT CGGGGAAATTGTTGGGATTCATAGTAAGCGAGAAAGGGATAGAAGTAGATCCAGACA AAGTTCGAGCTATTCAAGAAATGCCATCCCCAAAGACAGAAAGGGAGGTGCGCAGTT TTCTAGGAAAGCTGAACTACATTTCGAGGTTTATTTCTAATCTCACTGCCAAAGCTGA GCCTATTTTTAGATTACTCCGGAAGAACAACTCTACCCAATGGGATTCAGTTTGTCAA AAGGCCTTTGAGAAAATCAAGCAGTATCTGTCAAATCCACCCGTGTTGGTT
Urutan basa DNA yang disekuen dengan primer
M13 reverse