SINTESIS MAGNETIT DARI FILTRAT HASIL DESTRUKSI
TAILING
PASIR TIMAH PULAU BANGKA
SECARA HIDROTERMAL
DWI WAHYUDI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Sintesis Magnetit dari Filtrat Hasil Destruksi Tailing Pasir Timah Pulau Bangka secara Hidrotermal adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2013
Dwi Wahyudi
ABSTRAK
DWI WAHYUDI. Sintesis Magnetit dari Filtrat Hasil Destruksi Tailing Pasir Timah Pulau Bangka secara Hidrotermal. Dibimbing oleh DEDEN SAPRUDIN dan RUDI HERYANTO.
Kandungan besi dalam filtrat hasil destruksi tailing pasir timah (FDTPT) Pulau Bangka berpotensi sebagai bahan baku sintesis magnetit. Keasaman yang sangat rendah dan keberadaan unsur Ti dalam FDTPT kemungkinan dapat mengganggu proses sintesis. Penelitian diawali dengan mengamati pengaruh Ti pada sintesis magnetit dan penentuan kandungan Fe dan Ti dalam FDTPT. Selanjutnya terhadap FDTPT dilakukan penambahan NaOH dan urea untuk meningkatkan pH FDTPT. Hasil penelitian menunjukkan bahwa nisbah mol Ti/Fe di bawah 0.125 tidak mengganggu sintesis magnetit, sehingga FDTPT yang memiliki nisbah mol Ti/Fe 0.121 dapat digunakan sebagai bahan baku sintesis magnetit. Penambahan NaOH pada FDTPT tidak menghasilkan magnetit. Penggantian NaOH dengan urea menghasilkan magnetit dengan ukuran kristal rerata 64.5 nm berdasarkan persamaan Scherrer.
Kata kunci: hidrotermal,magnetit, pasir timah, tailing
ABSTRACT
DWI WAHYUDI. Synthesis of Magnetite from Destructed Filtrate of Tin Sand Tailings of Bangka Island by Hydrothermal Method. Supervised by DEDEN SAPRUDIN and RUDI HERYANTO.
The iron content in the filtrate of tin tailings sand destruction (FTTSD) of Bangka Island is potential as raw material for synthesis of magnetite. Very low acidity and the presence of Ti in FTTSD may interfere the synthesis process. The study began by examine the effect of Ti in the magnetite synthesis and determined the Fe and Ti contents in the FTTSD. NaOH and urea were added to FTTSD to raise the pH for syntesis. The results showed that the mole ratio of Ti/Fe of less than 0.125 did not interfere the magnetite synthesis, therefore the mole ratio of Ti/Fe 0.121 could be used as raw material for the synthesis. The addition of NaOH in FTTSD did not produce magnetite. Replacement of NaOH with urea produced magnetite crystals with an average size of 64.5 nm according to Scherrer equation.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Kimia
SINTESIS MAGNETIT DARI FILTRAT HASIL DESTRUKSI
TAILING
PASIR TIMAH PULAU BANGKA
SECARA HIDROTERMAL
DWI WAHYUDI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Sintesis Magnetit dari Filtrat Hasil Destruksi Tailing Pasir Timah Pulau Bangka secara Hidrotermal
Nama : Dwi Wahyudi NIM : G44080114
Disetujui oleh
Dr Deden Saprudin, MSi Pembimbing I
Rudi Heryanto, SSi MSi Pembimbing II
Diketahui oleh
Prof Dr Ir Tun Tedja Irawadi, MS Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas segala limpahan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi
yang berjudul “Sintesis Magnetit dari Filtrat Hasil Destruksi Tailing Pasir Timah Pulau Bangka secara Hidrotermal”. Skripsi ini disusun berdasarkan penelitian yang dilaksanakan pada bulan Mei 2012 hingga Januari 2013 di Laboratorium Kimia Analitik, Departemen Kimia, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih atas semua bimbingan, dukungan, dan kerjasama yang telah diberikan oleh Bapak Dr Deden Saprudin, MSi selaku pembimbing I dan Bapak Rudi Heryanto, SSi MSi selaku pembimbing II. Di samping itu, penghargaan penulis sampaikan kepada Bapak Suherman, Ibu Nunung beserta staf laboratorium analitik. Ungkapan terima kasih juga penulis sampaikan kepada ayah, ibu, Heru Purwadi, serta Ragil Pratiwi atas segala doa, dukungan dan kasih sayangnya.
Semoga skripsi ini dapat bermanfaat. Terima kasih.
Bogor, Juni 2013
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
METODE 2
Alat dan Bahan 2
Prosedur Penelitian 2
HASIL DAN PEMBAHASAN 4
Kadar Fe dan Ti dalam Filtrat Hasil Destruksi Tailing Pasir Timah Pulau
Bangka 4
Pengaruh Perbandingan Mol Fe dan Ti pada Sintesis Magnetit 4 Sintesis Magnetit dari Filtrat Hasil Destruksi Tanpa Penambahan NaOH 6 Sintesis Magnetit dari Filtrat Hasil Destruksi dengan Penambahan NaOH
dan Urea 7
Karakterisasi Hasil 9
Kadar Amonium Filtrat Hasil Sintesis Hidrotermal 11
SIMPULAN DAN SARAN 12
Simpulan 12
Saran 12
DAFTAR PUSTAKA 12
LAMPIRAN 14
DAFTAR TABEL
1 Variasi penambahan TiCl4 3
2 Massa magnetit yang terbentuk pada berbagai variasi perbandingan mol
Ti/Fe 5
3 Massa magnetit larutan A dan F 6
4 Nilai pH larutan A dan F sebelum dan setelah sintesis hidrotermal 7 5 Nilai pH larutan G dan H sebelum dan setelah sintesis hidrotermal 8 6 Massa endapan dari larutan G dan H setelah hidrotermal 8 7 Puncak 2θ magnetit standar, endapan G2 dan endapan H2 10
8 Massa amonium larutan G2 dan H2 11
DAFTAR GAMBAR
1 Reaksi pembentukan kompleks antara TiCl4 dengan sitrat 5
2 Larutan sebelum sintesis (A1) dan (F1) dan setelah sintesis (A2) dan
(F2) 6
3 Larutan sebelum sintesis (G1) dan (H1), dan setelah sintesis (G2) dan
(H2) 8
4 Endapan G2 dan H2 tanpa ada magnet dan endapan G2 dan H2
dengan adanya magnet 9
5 Spektrum FTIR endapan G2 dan H2 9
6 Difraktogram magnetit standar, endapan G2, dan endapan H2 10
DAFTAR LAMPIRAN
1 Hasil analisis pasir timah Pulau Bangka oleh Pusat Survey Geologi 14
2 Diagram alir penelitian 15
3 Pembuatan larutan standar dan pereaksi pada penentuan amonium 16 4 Pengukuran kadar Fe dalam filtrat hasil destruksi 16 5 Sertifikat analisis pengukuran kadar Ti dalam filtrat hasil destruksi 17 6 Perhitungan jumlah mmol urea yang harus ditambahkan ke dalam
Larutan H 17
7 Perhitungan bobot magnetit teoritis 18
8 Pengukuran kadar Fe setelah sintesis hidrotermal 18 9 Basis data puncak 2θ nomor arsip 19-0629 pada JCPDS 20
10 Penentuan ukuran kristal 20
PENDAHULUAN
Tailing adalah salah satu jenis limbah yang dihasilkan oleh kegiatan pertambangan. Limbah tailing merupakan sisa pengolahan bijih batuan yang mengandung mineral, setelah diambil mineralnya. Tailing dapat berupa padatan semacam pasir yang sangat halus atau slurry,yaitu tailing padat yang bercampur dengan air membentuk lapisan tipis. Tailing umumnya masih mengandung mineral-mineral berharga karena proses pengolahan bijih tidak pernah mencapai perolehan (recovery) 100% (Purwantari 2007). Oleh karena itu, tailing harus dimanfaatkan dengan baik agar limbah tailing dapat dikurangi.
Berdasarkan analisis oleh Pusat Survey Geologi 2011, tailing pasir timah mengandung logam Fe dan Ti sebagai komponen mayor, sedangkan komponen minornya adalah unsur tanah jarang (Lampiran 1). Pengolahan tailing perlu diawali dengan proses destruksi, yaitu suatu perlakuan untuk melarutkan atau mengubah sampel menjadi bentuk materi yang dapat diukur sehingga kandungan yang terdapat di dalamnya dapat dianalisis. Pratiwi (2012) telah melakukan destruksi tailing dengan menggunakan basa dan dilanjutkan dengan ekstraksi hidrometalurgi menggunakan HCl yang dapat melarutkan tailing dengan cukup baik karena hampir semua tailing dapat terlarutkan sehingga kandungan unsur di dalamnya tidak terlalu banyak berkurang. Kandungan Fe dalam filtrat hasil destruksi berpotensi untuk dijadikan bahan dasar sintesis magnetit.
Magnetit(Fe3O4) adalah suatu mineral magnetik yang memiliki respon kuat
terhadap medan magnet luar. Magnetit sangat berguna untuk kepentingan riset dan dalam dunia industri yang berbasis kemagnetan, misalnya dalam hal rekayasa elektronika, pembuatan magnet permanen, industri baja, sampai untuk pembuatan film tipis(Sunaryo dan Sugihartono 2010). Selain itu, nanomagnetit telah banyak digunakan dalam dunia kedokteran dan media penyimpanan magnetik. Magnetit juga memiliki aplikasi pada bidang industri seperti keramik, katalis, dan diagnosis medis (Wang et al. 2000).
Sintesis magnetit telah dilakukan oleh Cheng et. al. (2010) dengan bahan dasar FeCl3·6H2O, urea, natrium sitrat, dan poliakrilamida secara hidrotermal.
Magnetit yang dihasilkan berbentuk bulat dan terdispersi dalam air. Fauziah (2012) telah melakukan sintesis magnetit dengan modifikasi metode Cheng et. al. (2010), yaitu melakukan sintesis magnetit dengan bahan dasar FeCl3·6H2O, urea,
dan natrium sitrat tanpa menggunakan poliakrilamida secara hidrotermal. Sintesis tersebut menghasilkan magnetit berbentuk bulat dengan ukuran nanometer dan tidak terdispersi dalam air karena terjadi aglomerasi. Metode hidrotermal memiliki kelebihan dibandingkan dengan metode lainnya, yaitu kemurnian dan homogenitas kristal yang dihasilkan tinggi, derajat kristalinitas tinggi, energi yang dibutuhkan rendah, serta ramah lingkungan (Kristiyanti 2011).
Filtrat hasil destruksi tailing pasir timah akan digunakan sebagai sumber FeCl3 untuk sintesis magnetit dengan metode Fauziah (2012). Adanya Ti dalam
hasil penelitian ini diharapkan dapat meningkatkan nilai tambah dari tailing pasir timah Pulau Bangka karena dapat diperoleh magnetit berukuran nanometer yang memiliki banyak kegunaan.
METODE
Metode penelitian mengikuti diagram alir pada Lampiran 2 yang meliputi pengukuran kadar Fe dan Ti dalam filtrat hasil destruksi tailing, pengaruh perbandingan mol Fe dan Ti pada sintesis magnetit, sintesis magnetit dari filtrat hasil destruksi tailing, karakterisasi padatan yang diperoleh menggunakan XRD dan FTIR, serta pengukuran kadar amonium filtrat hasil sintesis.
Alat dan Bahan
Alat-alat yang digunakan adalah oven (Memmert), desikator, neraca analitik (BSA224-Sartorius), alat-alat gelas, alat hidrotermal, pH meter (TOA HM-20S), spektrofotometer (Genesys 10W), spektrofotometri serapan atom (Shimadzu AA-7000), FTIR (Bruker), difraktometer sinar-X (Shimadzu XRD 7000). Bahan-bahan yang digunakan adalah filtrat hasil destruksi tailing, FeCl3·6H2O (Nacalai
Tesque), akuades, NaOH (Merck), natrium sitrat (Merck), urea (Merck), TiCl4
(Merck), kalium-natrium tartrat (Merck), NaOCl 12 %, dan fenol (Merck).
Prosedur Penelitian
Penentuan Kadar Fe dan Ti dalam Filtrat Destruksi Tailing
Analisis kadar Fe dilakukan di Laboratorium Bersama Departemen Kimia IPB. Larutan standar dibuat dengan konsentrasi 0.5, 1.0, 2.0, 4.0, dan 8.0 ppm untuk pembuatan kurva standar. Sampel diencerkan hingga 1250 kali kemudian diukur serapannya menggunakan spektrofotometri serapan atom pada panjang gelombang 248.33 nm dengan gas pembakar udara-asetilena. Sedangkan analisis Ti dilakukan di Laboratorium Pengujian Tekmira menggunakan spektrofotometri serapan atom pada panjang gelombang 364.27 nm dengan gas pembakar dinitrogen oksida-asetilena.
Pengaruh Perbandingan Mol Fe dan Ti pada Sintesis Magnetit
FeCl3·6H2O sebanyak 2 mmol, natrium sitrat sebanyak 4 mmol, dan urea
sebanyak 6 mmol dilarutkan dalam 30 ml akuades. Kemudian ke dalam larutan tersebut ditambahkan TiCl4 dengan variasi seperti pada Tabel 1. Setelah itu
Tabel 1 Variasi penambahan TiCl4
Larutan mmol Ti Perbandingan mol Ti/Fe
A 0.00 0.000
B 0.05 0.025
C 0.25 0.125
D 0.50 0.250
E 1.00 0.500
Sintesis Magnetit dari Filtrat Hasil Destruksi Asam Tanpa Penambahan NaOH
Sebanyak 40 ml filtrat hasil destruksi asam dengan kadar Fe yang telah diketahui ditambahkan natrium sitrat dan urea dengan perbandingan Fe: natrium sitrat: urea sebesar 1:2:3 mmol (larutan F). Larutan tersebut dimasukkan ke dalam wadah hidrotermal. Wadah tersebut dimasukkan ke dalam oven pada suhu
200˚C selama 12 jam. Setelah itu, wadah didinginkan pada suhu ruang, endapan
hitam yang terbentuk dipisahkan dengan cara sentrifugasi kemudian dicuci dengan air dan etanol. Endapan dikeringkan dengan oven pada suhu 70˚C selama satu malam. Diagram alir sintesis magnetit dari filtrat hasil destruksi asam tanpa penambahan basa diperlihatkan pada Lampiran 2.
Sintesis Magnetit dari Filtrat Hasil Destruksi Asam dengan Penambahan NaOH
Sebanyak 40 ml filtrat hasil destruksi asam dengan kadar Fe yang telah diketahui ditambahkan natrium sitrat dan urea dengan perbandingan Fe: natrium sitrat: urea sebesar 1:2:3 mmol, ditambahkan NaOH 30% hingga pH 3 (larutan G). Larutan tersebut dimasukkan ke dalam wadah hidrotermal. Wadah tersebut dimasukkan ke dalam oven pada suhu 200˚C selama 12 jam. Setelah itu, wadah didinginkan pada suhu ruang, endapan hitam yang terbentuk dipisahkan dengan cara sentrifugasi kemudian dicuci dengan air dan etanol. Kemudian dikeringkan
dengan oven pada suhu 70˚C selama satu malam. Diagram alir sintesis magnetit dari filtrat hasil destruksi asam dengan penambahan basa NaOH diperlihatkan pada Lampiran 2.
Sintesis Magnetit dari Filtrat Hasil Destruksi Asam dengan Penambahan Urea
Sebanyak 40 ml filtrat hasil destruksi asam dengan kadar Fe yang telah diketahui ditambahkan natrium sitrat dan urea dengan perbandingan Fe: natrium sitrat: urea sebesar 1:2:3 mmol, ditambahkan urea sebanyak jumlah mmol NaOH yang digunakan pada larutan G lalu diaduk hingga urea larut (larutan H). Larutan tersebut dimasukkan ke dalam wadah hidrotermal. Wadah tersebut dimasukkan ke
suhu 70˚C selama satu malam. Diagram alir sintesis magnetit dari filtrat hasil destruksi asam dengan penambahan basa urea diperlihatkan pada Lampiran 2.
Penentuan Amonium pada Larutan Hasil Sintesis Magnetit
Sebanyak 1 ml larutan hasil sintesis dimasukkan ke dalam tabung reaksi kemudian ditambahkan berturut-turut larutan sangga tartrat dan Na-fenat masing-masing sebanyak 2 ml, dikocok dan dibiarkan 10 menit. Larutan ditambahkan 2 ml NaOCl 5 %, dikocok dan diukur dengan spektrofotometer pada panjang gelombang 630 nm setelah 10 menit sejak pemberian pereaksi ini. Pembuatan pereaksi diperlihatkan pada Lampiran 3.
Karakterisasi Hasil Sintesis Magnetit
Kristal magnetit hasil sintesis dari filtrat destruksi dikarakterisasi menggunakan XRD dan FTIR.
HASIL DAN PEMBAHASAN
Kadar Fe dan Ti dalam Filtrat Hasil Destruksi Tailing Pasir Timah Pulau Bangka
Pratiwi (2012) melakukan destruksi tailing pasir timah Pulau Bangka menggunakan NaOH dan dilanjutkan dengan ekstraksi hidrometalurgi menggunakan HCl. Ekstraksi menggunakan HCl tersebut menghasilkan filtrat dan padatan. Filtrat hasil destruksi inilah yang akan digunakan untuk sintesis magnetit.
Pengukuran kadar Fe dan Ti sebagai komponen mayor dalam filtrat hasil destruksi perlu dilakukan untuk mengetahui konsentratsi Fe awal yang terkandung dalam filtrat destruksi. Hasil pengukuran kadar Fe dan Ti dalam filtrat destruksi berturut-turut 1850 ppm (Lampiran 4) dan 206 ppm (Lampiran 5). Konsentrasi Fe dalam filtrat setara dengan 0.033 M, sedangkan konsentrasi Ti setara dengan 0.004 M. Perbandingan mol Ti/Fe dalam filtrat destruksi sebesar 0.121.
Pengaruh Perbandingan Mol Fe dan Ti pada Sintesis Magnetit
Tabel 2 Massa magnetit yang terbentuk pada berbagai variasi perbandingan mol Ti/Fe
Kandungan Ti (mmol) Perbandingan mol Ti/Fe Massa magnetit (g)
0.00 0.000 0.1092
0.05 0.025 0.1073
0.25 0.125 0.1018
0.50 0.250 t.da
1.00 0.500 t.d
a
t.d: tidak dapat ditentukan.
Campuran Fe3+, natrium sitrat, dan urea tanpa penambahan TiCl4 berwarna
kuning, sedangkan campuran yang ditambahkan TiCl4 berwarna jingga. Semakin
banyak Ti yang ditambahkan ke dalam campuran warna jingga yang dihasilkan semakin pekat. Penambahan TiCl4 ke dalam campuran yang mengandung Fe3+,
natrium sitrat, dan urea menurut Panagiotidis (2005), Ti4+ dapat membentuk senyawa kompleks dengan sitrat (Gambar 1). Kompleks antara Ti4+ dengan sitrat tersebut memberikan warna jingga kemerahan pada larutan (Kakihana 2010).
Gambar 1 Reaksi pembentukan kompleks antara TiCl4 dengan sitrat
Pada pembentuk magnetit dengan sumber besi dari Fe3+ diperlukan pereduksi untuk mengubah sebagian biloks Fe3+ menjadi Fe2+ sehingga diperoleh perbandingan Fe3+ dengan Fe2+ sebesar 2:1. Pereduksi yang digunakan dalam penelitian ini adalah sitrat. Terbentuknya senyawa kompleks antara Ti4+ dengan sitrat dapat mempengaruhi sintesis magnetit. Potensial reduksi (Eº) Fe3+ | Fe2+ = 0.771 V sedangkan Eº Ti4+ | Ti3+ = -0.055 V. Nilai Eº Fe3+ | Fe2+ lebih besar dari nilai Eº Ti4+ | Ti3+ artinya Fe3+ lebih mudah direduksi dibandingkan dengan Ti4+ sehingga kehadiran Ti4+ dalam campuran tidak dapat mengoksidasi kembali Fe2+. Jika kandungan Ti dalam campuran cukup banyak dapat menyebabkan adanya persaingan pembentukan kompleks Fe-sitrat dan Ti-sitrat. Terbentuknya kompleks antara Ti dengan sitrat tersebut mengakibatkan sitrat yang tersedia untuk mengkelat Fe3+ menjadi berkurang sehingga proses reduksi Fe3+ menjadi Fe2+ lebih sedikit. Selain itu, Ti4+ yang bersifat oksidator dapat menghambat proses reduksi dari Fe3+ menjadi Fe2+. Hal tersebut mengakibatkan Fe2+ yang dibutuhkan untuk pembentukan Fe3O4 menjadi lebih sedikit sehingga endapan Fe3O4 tidak
6
Sintesis Magnetit dari Filtrat Hasil Destruksi Tanpa Penambahan NaOH
Sintesis magnetit dilakukan dengan cara menambahkan 2.6 mmol natrium sitrat dan 3.9 mmol urea ke dalam 40 ml filtrat hasil destruksi asam yang mengandung 1.3 mmol Fe. Di samping itu larutan standar (larutan A) dibuat untuk perbandingan. Larutan standar dibuat dengan metode Fauziah (2012). Gambar 2 memperlihatkan hasil sintesis dari kedua larutan.
Gambar 2 menunjukkan bahwa baik larutan standar maupun larutan dari filtrat hasil destruksi sebelum dilakukan sintesis dengan hidrotermal memiliki warna kuning. Warna tersebut dihasilkan dari adanya Fe3+ dalam larutan. Setelah dilakukan sintesis hidrotermal terjadi perbedaan terhadap hasil yang diperoleh. Hasil sintesis dari larutan standar diperoleh larutan yang tidak berwarna dan terdapat endapan berwarna hitam yang tertarik magnet. Endapan tersebut merupakan magnetit Fe3O4. Tabel 3 memperlihatkan massa magnetit yang
terbentuk. Reaksi pembentukan magnetit menurut Cheng et al. (2009) diperlihatkan pada persamaan reaksi 1 sampai 6.
CO(NH2)2 + H2O→ 2NH3 + CO2 (1)
Gambar 2 Larutan sintesis (A1) dan (F1) dan setelah sintesis (A2) dan (F2) Tabel 3 Massa magnetit larutan A dan F
Larutan Massa magnetit (g)
Aa 0.1092
F 0.0000
a
A: 2mmol FeCl3·6H2O + 4 mmol Na-sitrat + 6 mmol urea dalam 40 ml akuades, F: 40 ml filtrat hasil destruksi + 2.6 mmol Na-sitrat + 3.9 mmol urea.
FeCl3 dalam filtrat hasil destruksi dan FeCl3·6H2O menyediakan besi dalam
bentuk Fe3+, sedangkan magnetit tersusun atas Fe3+ dan Fe2+. Oleh karena itu ditambahkan sitrat sebagai pereduksi untuk membentuk Fe2+. Sitrat berperan penting dalam pembentukkan kristal Fe3O4. Tanpa adanya sitrat, hanya akan dihasilkan α-Fe2O3 (Cheng et al. 2010). Sitrat mereduksi Fe3+ menjadi Fe2+
diawali dengan mengionnya natrium sitrat menjadi ion sitrat. Kemudian, ion sitrat dan Fe3+ membentuk kompleks Fe(III)-sitrat. Adanya ion H+ dalam larutan mengakibatkan terjadinya reduksi Fe3+ menjadi Fe2+, sedangkan sitrat teroksidasi (Gutteridge 1991). Pada saat pemanasan, urea terdekomposisi menjadi NH3
A2 F2
(reaksi 1) yang membuat suasana basa dalam sistem reaksi. Suasana basa ini memicu pembentukkan Fe(OH)3 dan Fe(OH)2 yang akan berubah menjadi Fe3O4
setelah proses dehidrasi (Cheng et al. 2010) (reaksi 6).
Hasil sintesis larutan F diperoleh larutan yang berwarna jingga dan tidak diperoleh endapan. Warna tersebut dihasilkan dari warna hematit (α-Fe2O3) yang
masih dalam bentuk koloid. Nilai pH larutan yang asam karena mengandung HCl berpengaruh terhadap sintesis (Tabel 4). Mohapatra dan Anand (2010) melaporkan bahwa pada sintesis oksida besi secara hidrotermal yang berlangsung pada pH 0.8-2.6 hanya menghasilkan α-Fe2O3 yang berwarna jingga kemerahan
dalam larutan. Jumlah urea yang ditambahkan ke dalam larutan F terlalu sedikit untuk menetralkan keasaman dari HCl, sehingga kondisi basa yang dibutuhkan untuk proses pembentukan magnetit tidak tercapai.
Tabel 4 Nilai pH larutan A dan F sebelum dan setelah sintesis hidrotermal larutan pH sebelum hidrotermal pH setelah hidrotermal
A 3.48 10.54
F -2.89 2.07
Sintesis Magnetit dari Filtrat Hasil Destruksi dengan Penambahan NaOH dan Urea
Sintesis magnetit dilakukan dari filtrat hasil destruksi asam dengan penambahan basa dilakukan dengan dua variasi. Sintesis pertama dilakukan dengan menambahkan NaOH ke dalam larutan F. Sintesis lainnya dilakukan dengan menambahkan urea ke dalam larutan F. Nilai pH filtrat diatur hingga nilai pH larutan mendekati nilai pH larutan standar (larutan A). Basa NaOH (basa kuat) digunakan untuk menetralkan keasaman HCl yang termasuk asam kuat sebelum sintesis hidrotermal. Basa urea digunakan untuk menciptakan suasana basa saat sintesis. Saat proses sintesis berlangsung urea akan terdekomposisi menjadi amonia dan CO2. Amonia tersebut akan menaikkan nilai pH menjadi lebih tinggi.
8
Tabel 5 Nilai pH larutan G dan H sebelum dan setelah sintesis hidrotermal larutan pH sebelum hidrotermal pH setelah hidrotermal
Ga 3.44 9.79
H -2.32 9.16
a
G: 40 ml filtrat hasil destruksi + 2.6 mmol Na-sitrat + 3.9 mmol urea + 61.5 mmol NaOH; H: 40 ml filtrat hasil destruksi + 2.6 mmol Na-sitrat + 65.4 mmol urea.
Larutan G dan H sebelum dan setelah sintesis hidrotermal diperlihatkan pada Gambar 3. Sebelum sintesis hidrotermal, warna G1 dan H1 berbeda. G1 berwarna jingga. Warna jingga ini merupakan warna dari koloid hasil hidrolisis Fe dari reaksi Fe3+ dalam larutan dengan OH- dari NaOH yang ditambahkan.
Gambar 3 Larutan sebelum sintesis (G1) dan (H1), dan setelah sintesis (G2) dan (H2)
Larutan G dan H menghasilkan endapan setelah proses hidrotermal. Bobot endapan yang diperoleh diperlihatkan pada Tabel 6. Bobot endapan yang diperoleh dari larutan G sebanyak 0.1297 g sedangkan dari larutan H sebanyak 0.2352 g. Endapan dari Larutan G dan H lebih banyak dibandingkan dengan jumlah magnetit yang seharusnya diperoleh secara teoritis, yaitu 0.1021 g (Lampiran 7) jika semua Fe yang ada dalam filtrat berubah menjadi magnetit. Endapan yang melebihi bobot teori ini dikarenakan di dalam filtrat terdapat berbagai macam logam yang membentuk oksida dan mengendap ataupun teradsorpsi oleh magnetit. Selain itu, pada larutan H penambahan urea yang lebih banyak mengakibatkan penambahan jumlah karbon yang dapat teradsorpsi sehingga hasil endapan yang diperoleh lebih banyak. Amonium yang teradsorpsi juga dapat menambah massa endapan yang diperoleh.
Tabel 6 Massa endapan dari larutan G dan H setelah hidrotermal Larutan Massa magnetit (g)
G 0.1297
H 0.2352
Persentase jumlah Fe yang mengendap diukur dengan cara mengukur kadar Fe dalam larutan G dan H setelah sintesis hidrotermal (Lampiran 8). Persentase Fe yang mengendap dari larutan G, yaitu 99.98 % sedangkan untuk larutan H sebesar 99.99 %. Hampir seluruh Fe dari larutan G dan H mengendap atau membentuk oksida, namun fase oksida Fe yang terbentuk belum dapat dipastikan membentuk magnetit.
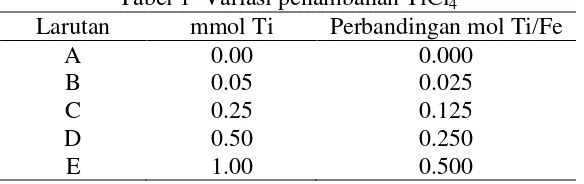
Magnetit merupakan suatu mineral ferimagnetik. Sifat ferimagnetik tersebut dihasilkan dari adanya ion Fe2+ dan Fe3+ (Paul 2010). Oleh karena itu, magnetit memberikan respon terhadap magnet sehingga akan tertarik oleh magnet jika ada
magnet di dekatnya. Endapan G2 tidak tertarik magnet saat ada magnet didekatnya, sedangkan endapan H2 tertarik magnet saat ada magnet di dekatnya (Gambar 4). Endapan G2 bukan magnetit, kemungkinan oksida besi lainnya. Liang et.al. (2006) telah melakukan sintesis berbagai oksida besi. Adanya NaOH dapat membentuk oksida besi selain magnetit, yaitu Fe2O3. Endapan H2 tertarik
oleh magnet di dekatnya sehingga kemungkinan endapan tersebut merupakan magnetit.
Gambar 4 Endapan G2 dan H2 tanpa ada magnet dan endapan G2 dan H2 dengan adanya magnet
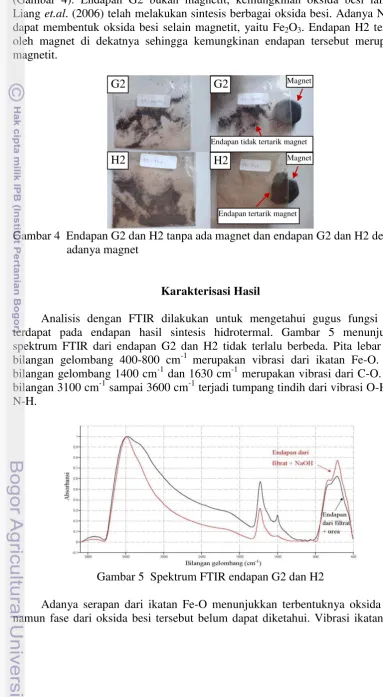
Karakterisasi Hasil
Analisis dengan FTIR dilakukan untuk mengetahui gugus fungsi yang terdapat pada endapan hasil sintesis hidrotermal. Gambar 5 menunjukkan spektrum FTIR dari endapan G2 dan H2 tidak terlalu berbeda. Pita lebar pada bilangan gelombang 400-800 cm-1 merupakan vibrasi dari ikatan Fe-O. Pada bilangan gelombang 1400 cm-1 dan 1630 cm-1 merupakan vibrasi dari C-O. Pada bilangan 3100 cm-1 sampai 3600 cm-1 terjadi tumpang tindih dari vibrasi O-H dan N-H.
Gambar 5 Spektrum FTIR endapan G2 dan H2
Adanya serapan dari ikatan Fe-O menunjukkan terbentuknya oksida besi, namun fase dari oksida besi tersebut belum dapat diketahui. Vibrasi ikatan C-O
G2
H2
G2
H2
Endapan tertarik magnet Magnet Magnet
10
yang terdeteksi dapat berasal dari karbonat yang teradsorpsi. Menurut Roonasi (2007), karbonat dapat teradsorpsi pada magnetit. Vibrasi O-H dapat berasal dari Fe(OH)3.Vibrasi N-H dapat berasal dari amonium yang teradsorpsi pada magnetit.
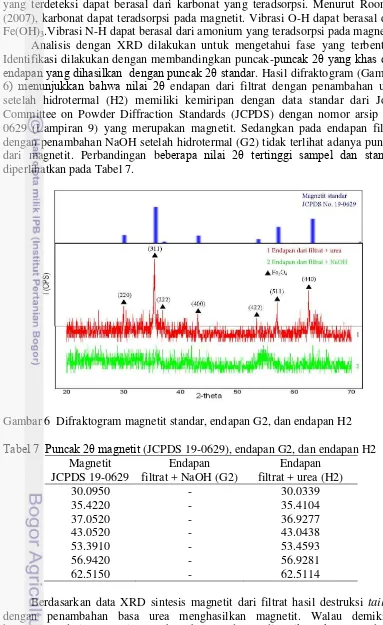
Analisis dengan XRD dilakukan untuk mengetahui fase yang terbentuk. Identifikasi dilakukan dengan membandingkan puncak-puncak 2θ yang khas dari
endapan yang dihasilkan dengan puncak 2θ standar. Hasil difraktogram (Gambar 6) menunjukkan bahwa nilai 2θ endapan dari filtrat dengan penambahan urea setelah hidrotermal (H2) memiliki kemiripan dengan data standar dari Joint Committee on Powder Diffraction Standards (JCPDS) dengan nomor arsip 19-0629 (Lampiran 9) yang merupakan magnetit. Sedangkan pada endapan filtrat dengan penambahan NaOH setelah hidrotermal (G2) tidak terlihat adanya puncak dari magnetit. Perbandingan beberapa nilai 2θ tertinggi sampel dan standar diperlihatkan pada Tabel 7.
Gambar 6 Difraktogram magnetit standar, endapan G2, dan endapan H2
Tabel 7 Puncak 2θ magnetit (JCPDS 19-0629), endapan G2, dan endapan H2 Magnetit
JCPDS 19-0629
Endapan filtrat + NaOH (G2)
Endapan filtrat + urea (H2)
30.0950 - 30.0339
35.4220 - 35.4104
37.0520 - 36.9277
43.0520 - 43.0438
53.3910 - 53.4593
56.9420 - 56.9281
62.5150 - 62.5114
Berdasarkan data XRD sintesis magnetit dari filtrat hasil destruksi tailing
dari filtrat hasil destruksi tailing dengan penambahan basa NaOH tidak menghasilkan magnetit. NaOH yang ditambahkan ke dalam filtrat sebelum sintesis menyebabkan Fe3+ dalam filtrat berubah menjadi Fe(OH)3 sehingga
menghambat proses reduksi Fe3+ menjadi Fe2+ sehingga magnetit sukar terbentuk. Ukuran kristal dapat diukur dari hasil data XRD dengan menggunakan persamaan Scherrer (Zakaria et.al. 2009). Ukuran kristal magnetit endapan H, yaitu 64.4624 nm (Lampiran 10). Sintesis magnetit dalam larutan berair dapat menghasilkan kristal dengan ukuran kurang dari 1 µm (Cornell & Schwertmann 2003). Ukuran kristal yang kecil ini sangat baik sehingga magnetit yang terbentuk dapat dimanfaatkan dalam berbagai bidang. Nanomagnetit ini banyak dimanfaatkan karena karakterisitk magnetiknya, stabilitas kimianya, biokompatibilitas, dan tidak terlalu beracun (Cheng et al. 2010).
Kadar Amonium Filtrat Hasil Sintesis Hidrotermal
Pengukuran kadar amonium dalam filtrat hasil sintesis hidrotermal dilakukan untuk mengetahui jumlah urea yang terdekomposisi menjadi amonia. Amonia dalam air akan berbentuk amonium. Penentuan kadar amonium pada larutan dilakukan dengan metode kolorimetri melalui penambahan larutan natrium fenat, K-Na tartrat, dan NaClO (Pradana 2013). Pengukuran dilakukan menggunakan spektrofotometer UV-Vis pada panjang gelombang 630 nm (Lampiran 11).
Massa amonium yang dihasilkan dari dekomposisi urea pada filtrat G2 dan H2 diperlihatkan pada Tabel 8. Filtrat G2 menghasilkan amonium sebesar 0.1074 g sedangkan filtrat H2 menghasilkan amonium sebesar 0.9139 g. Massa amonium pada filtrat H2 lebih besar karena jumlah urea yang ditambahkan sebelum sintesis lebih banyak dari filtrat G2. Sedangkan persentase amonium yang terbentuk dari hasil dekomposisi urea dari filtrat G2 dan H2, yaitu 75.32 % untuk filtrat G2 dan 38.78 % untuk filtrat H2 (Lampiran 11). Persentase yang tidak terlalu tinggi ini disebabkan karena ada kemungkinan amonium dalam larutan menguap sehingga saat pengukuran tidak semua amonium terukur. Selain itu, struktur magnetit yang berpori dapat mengadsorpsi amonium yang terbentuk sehingga mengurangi persentase amonium yang terukur pada filtrat H2.
Tabel 8 Massa amonium larutan G2 dan H2 Filtrat Massa amonium (g)
G2 0.1074
SIMPULAN DAN SARAN
Simpulan
Magnetit berhasil disintesis dari filtrat destruksi tailing pasir timah Pulau Bangka dengan metode hidrotermal dengan penambahan urea dan natrium sitrat. Sintesis magnetit dengan adanya Ti4+ dalam larutan masih dapat dilakukan jika perbandingan mol Ti/Fe kurang dari 0.125. Keasaman yang tinggi berpengaruh terhadap sintesis magnetit sehingga perlu dilakukan penurunan keasaman. Penambahan NaOH untuk mengurangi keasaman filtrat tidak dapat digunakan karena mengganggu sintesis magnetit. Penambahan urea dapat menggantikan peran NaOH dalam upaya mengurangi keasaman filtrat tanpa mengganggu proses sintesis magnetit.
Saran
Analisis morfologi dan kandungan unsur dalam kristal magnetit menggunakan SEM-EDX perlu dilakukan. Selain itu, kandungan unsur dalam larutan setelah sintesis hidrotermal perlu dianalisis untuk mengetahui apakah unsur lain terendapkan bersama dengan magnetit atau masih dalam larutan. Karakteristik magnetik dari magnetit yang terbentuk perlu dianalisis untuk mengetahui sifat magnetik dari magnetit yang terbentuk. Sintesis dengan variasi penambahan natrium sitrat perlu dilakukan lebih lanjut untuk menetralisir pengaruh oksidasi Ti4+ dalam filtrat hasil destruksi.
DAFTAR PUSTAKA
Cheng C, Wen Y, Xu X, Gu H. 2009. Tunable synthesis of carboxyl-functionalized magnetite nanocrystal clusters with uniform size. J Mater Chem. 19: 8782-8788.doi:10.1039/b910832g.
Cheng W, Tang K, Qi Y, Sheng J, Liu Z. 2010. One-step synthesis of superparamagnetic monodisperse porous Fe3O4 hollow and core-shell
spheres. J Mater Chem. 20:1799-1805.doi:10.1039/b919164j.
Cornell RM, Schwertmann U. 2003. The Iron Oxides. Weinheim (DE): Wiley-Vch.
Fauziah H. 2012. Nanomagnetit sebagai peningkat sensitivitas elektrode pasta karbon untuk analisis iodida secara voltammetri siklik [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Gutteridge JMC. 1991. Hydroxyl radical formation from the auto-reduction of a ferric citrate complex. Free Radical Biology and Medicine. 11 (4):401-406. Kakihana M, Kobayashi M, Tomita K, Petrykin V. 2010. Application of
titanium-containing oxides via aqueous solution processes. Bull. Chem. Soc. Jpn. 83(11):1285–1308.doi:10.1246/bcsj.20100103.
Kristiyanti PLP. 2011. Pengaruh pH pada sintesis titanium dioksida (TiO2) dengan
metode hidrotermal [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Liang X, Wang X, Zhuang J, Chen Y, Wang D, Li Y. 2006. Synthesis of nearly monodisperse iron oxide and oxyhydroxide nanocrystals. Adv. Funct. Mater.16:1805-1813.doi:10.1002/adfm.200500884.
Mohaptara M, Anand S. 2010. Synthesis and applications of nano-structured iron oxides/hydroxides a review. International Journal of Engineering, Science and Technology. 2(8): 127-146.
Panagiotidis P, Kefalas E, Salifoglou A. 2005. Structural speciation attempts in the binary Ti(IV)-citrate system in aqueous media. Agroalimentary Processes and Technologies. 11(1):65-68.
Paul MC. 2010. Molecular beam epitaxy and properties of magnetite thin films on semiconducting substrates [disertasi]. Wurzburg (DE): Universitas Julius Maximilians.
Pradana VM. 2013. Keragaan nitrogen-amonium dalam magnetit sintetik (Fe3O4)
[skripsi]. Bogor (ID): Institut Pertanian Bogor.
Pratiwi F. 2012. Pengembangan metode destruksi unsur tanah jarang dari tailing
pasir timah Pulau Bangka [skripsi]. Bogor (ID): Institut Pertanian Bogor. Purwantari ND. 2007. Reklamasi area tailing di pertambangan dengan tanaman
pakan ternak; mungkinkah? Wartazoa. 17(3):101-108.
Roonasi P. 2007. Adsorption and surface reaction properties of synthesized magnetite nano-particles [tesis]. Luleå (SE): Luleå University of Technology.
Sunaryo, Sugihartono I. 2010. Pemisahan senyawa titanomagnetite Fe 3-xTixO4(o<x<1) dari pasir alam Indramayu, Jawa Barat. Makara, Teknologi. 14
(2):106-110.
Wang CY et al. 2000. Synthesis of Fe3O4 powder by a novel arc discharge
method. Material Research Bulletin. 35:755-759.
14
Lampiran 2 Diagram alir penelitian
Sintesis hidrotermal 200 ºC selama 12 jam
Pemisahan
2 mmol FeCl3·6H2O + 4 mmol natrium sitrat + 6 mmol urea dalam 40 ml akuades
16
Lampiran 3 Pembuatan larutan standar dan pereaksi pada penentuan amonium
♦Standar pokok 1.000 ppm N
Serbuk(NH4)2SO4 p.a ditimbang 4,7143 g ke dalam labu takar 1 l.
Kemudian ditambahkan air bebas ion hingga tepat 1 l dan dikocok hingga larutan homogen.
♦ Standar 20 ppm N
Sebanyak 2 ml standar pokok 1000 ppm N dipipet ke dalam labu takar 100 ml dan diencerkan dengan akuades hingga tepat 100 ml.
♦ Deret standar 0-20 ppm N
Standar N 20 ppm, dipipet 0; 1; 2; 4; 6; 8; dan 10 ml, masing-masing dimasukkan ke dalam tabung reaksi. Kemudian ditambahkan akuades hingga semuanya menjadi 10 ml. Deretstandar ini memiliki kepekatan 0; 2; 4; 8; 12; 16; dan 20 ppm N, tiap-tiap tabung reaksi kemudian dikocok.
♦ Larutan Na-fenat
Sebanyak 100 g serbuk NaOH p.a ditimbang dan dilarutkan secara perlahan sambildiaduk dengan sekitar 500 ml air bebas ion di dalam labu ukur 1 l. Setelah dingin, ditambahkan 125 gram serbuk fenol dan aduk hingga larut. Kemudian diencerkandengan air bebas ion sampai 1 l.
♦ Larutan sangga Tartrat
Sebanyak 50 gram serbuk NaOH p.a. ditimbang dan dilarutkan secara perlahan sambildiaduk dengan sekitar 500 ml air bebas ion di dalam labu ukur 1 l. Setelah dingin ditambahkan 50 g serbuk K, Na-tartrat dan diaduk hingga larut. Kemudian diencerkandengan air bebas ion sampai 1 l.
Lampiran 4 Pengukuran kadar Fe dalam filtrat hasil destruksi
Konsentrasi standar (ppm) Absorbansi
0.0000 0.0008
0.5000 0.0363
1.0000 0.0707
2.0000 0.1396
4.0000 0.2639
Absorbansi sampel filtrat = 0.1024 Konsentrasi Fe dalam sampel filtrat :
y = 0.0609x + 0.0123 0.1024= 0.0609x + 0.0123 x = 1.4795 ppm
Faktor pengenceran = 1250
Konsentrasi Fe dalam filtrat sebenarnya :
1250 × 1.4795 ppm = 1849.9742 ppm ≈ 1850 ppm
Lampiran 5 Sertifikat analisis pengukuran kadar Ti dalam filtrat hasil destruksi
Lampiran 6 Perhitungan jumlah mmol urea yang harus ditambahkan ke dalam Larutan H
Konsentrasi NaOH yang digunakan adalah 30% (b/v) pH awal larutan F: -3.36
18
Jumlah mmol NaOH yang ditambahkan:
mmol
Oleh karena itu urea yang ditambahkan sebanyak 61.5 mmol Lampiran 7 Perhitungan bobot magnetit teoritis
Reaksi pembentukan magnetit
Lampiran 8 Pengukuran kadar Fe setelah sintesis hidrotermal
Konsentrasi standar (ppm) Absorbansi Konsentrasi Fe dalam sampel Larutan G :
y = 0.1058x + 0.0028 0.0335 = 0.1058x + 0.0028 x = 0.2896 ppm
Faktor pengenceran = 1
Konsentrasi Fe dalam Larutan G sebenarnya : 1 × 0.2896 = 0.2896 ppm
Konsentrasi Fe dalam sampel Larutan H : y = 0.1058x + 0.0028
0.0295 = 0.1058x + 0.0028 x = 0.2517 ppm
Faktor pengenceran = 1
Konsentrasi Fe dalam Larutan H sebenarnya : 1 × 0.2517 = 0.2517 ppm
Penentuan Fe yang berubah menjadi magnetit Konsentrasi Fe awal
Berdasarkan pengukuran dengan AAS, dalam filtrat hasil leburan asam mengandung Fe sebanyak 1850 ppm
volume Larutan G tersisa = 36 ml
mmol Fe yang tersisa pada Larutan G = -1 volume Larutan H tersisa = 27 ml
20
Lampiran 9 Basis data puncak 2θ nomor arsip 19-0629 pada JCPDS
Lampiran 10 Penentuan ukuran kristal Ukuran kristal magnetit larutan H
2θ θ Cosθ FWHM W Ukuran (nm)
30.0339 15.0170 0.7706 0.1300 0.0023 79.3017
35.4104 17.7052 0.4136 0.2467 0.0043 77.8522
36.9277 18.4639 0.9265 0.1100 0.0019 77.9474
43.0438 21.5219 0.8919 0.1500 0.0026 59.3805
56.9281 28.4641 0.9821 0.1700 0.0030 47.5849
62.5114 31.2557 0.9872 0.1800 0.0031 44.7076
Rerata 64.4624
Contoh perhitungan
Ukuran kristal pada ulangan 1 berdasarkan persamaan Scherrer: D =
θ
cos W
λ
K
D : ukuran kristal (nm) K : konstanta (0.9)
λ : panjang gelombang sinar-X (0.15406 nm)
W : Lebar puncak pada setengah intensitas puncak maksimum (rad) D =
0.7706 0.0023
0.15406 0.9
Lampiran 11 Penentuan bobot amonium dalam filtrat Penentuan panjang gelombang maksimum
λ (nm) Absorbansi λ (nm) Absorbansi
550 0.211 602 0.359
552 0.217 604 0.362
554 0.223 606 0.364
556 0.227 608 0.367
558 0.233 610 0.371
560 0.238 612 0.374
562 0.244 614 0.377
564 0.250 616 0.381
566 0.257 618 0.385
568 0.264 620 0.386
570 0.271 622 0.388
572 0.278 624 0.389
574 0.283 626 0.390
576 0.289 628 0.389
578 0.294 630 0.390
580 0.298 632 0.389
582 0.303 634 0.389
584 0.308 636 0.388
586 0.314 638 0.386
588 0.319 640 0.374
590 0.326 642 0.374
592 0.333 644 0.373
594 0.339 646 0.364
596 0.345 648 0.364
598 0.350 650 0.358
600 0.354
22
Rerata =
Konversi urea menjadi amonium secara teoritis pada Larutan G: Jumlah mmol urea = 3.96 mmol
Jumlah mmol amonium = 2 × 3.96 mmol = 7.92 mmol
Bobot amonium yang terbentuk secara teoritis = 7.92 mmol × Mr amonium = 7.92 mmol × 18 g mol-1 = 0.1426 g
Bobot amonium yang terbentuk dalam Larutan G = 0.1074 g
Persentase urea yang terdekomposisi menjadi amonium:
Konversi urea menjadi amonium secara teoritis pada Larutan H: Jumlah mmol urea = 65.46 mmol
Jumlah mmol amonium = 2 × 65.46 mmol = 130.92 mmol
Bobot amonium yang terbentuk secara teoritis = 130.92 mmol × Mr amonium = 130.92 mmol × 18 g mol-1 = 2.3566 g
RIWAYAT HIDUP
Penulis dilahirkan di Bandung pada tanggal 30 Juni 1990 dari pasangan Sunarmo dan Rasinem. Penulis merupakan anak kedua dari dua bersaudara. Penulis lulus dari SMP Negeri 8 Bandung pada tahun 2005, kemudian melanjutkan pendidikan di SMA Negeri 24 Bandung dan lulus tahun 2008. Setelah itu, penulis lulus seleksi masuk Jurusan Kimia di Institut Pertanian Bogor melalui jalur Seleksi Nasional Masuk Perguruan Tinggi (SNMPTN).