POTENSI BAKAU Rhizophora apiculata SEBAGAI
INHIBITOR TIROSINASE DAN ANTIOKSIDAN
ABDULLAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Potensi Bakau Rhizophora apiculata
BL sebagai inhibitor tirosinase dan antioksidan adalah karya saya dengan
arahan komisi pembimbing dan belum diajukan dalam bentuk apapun kepada
perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya
yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam
teks dan dicantumkan dalam daftar pustaka di bagian akhir tesis ini.
Bogor, Agustus 2011
ABDULLAH NRP G451090021
ABSTRACT
ABDULLAH. Potency of Rhizophora apiculata as Tyrosinase Inhibitors and Antioxidants. Under direction of IRMA HERAWATI SUPARTO, and IRMANIDA BATUBARA
The purpose of this study was to screen the potency of crude extract, fractions from silica gel column chromatography, and fraction from preparative thin layer chromatography (TLC) of Rhizophora apiculata which has the best activity as tyrosinase inhibitors, and antioxidant. Stem, bark and roots of R. apiculata were extracted with n-hexane, ethylacetate and methanol. Each extracts were tested for tyrosinase inhibitors and antioxidant activities. Based on the tyrosinase inhibitors, methanol extracts of R. apiculata bark had the best potency as tyrosinase inhibitors (monophenolase: 78.79 μgmL-1; diphenolase: 1116.5 μgmL-1) and the best radical scavenging activity 1,1-diphenyl-picrylhidrazil (DPPH) and 2,2’-Azinobis(3-etilbenzatiazolin)-6-sulfonat acid(ABTS) withIC50: 3.81 μgmL-1 and 18.47 μgmL-1, respectively. Fractionation was performed on methanol extracts of R. apiculata bark using silica gel column chromatography and yielded 10 fractions (A to J). Fraction B from column chromatography had the best tyrosinase inhibitors with monophenolase (IC50: 1045.6 μgmL-1), diphenolase (IC50: 846.71 μgmL-1), and the best antioxidants activities with DPPH (IC50: 9.19 μgmL-1), ABTS (IC50: 7.73 μgmL-1). Fraction B was fractionated with preparative TLC resulted 9 fractions (B1 to B9). Fraction B1 had the best tyrosinase inhibitors with monophenolase (IC50: 1278 μgmL-1) and diphenolase (IC50: 1678.2 μgmL-1), dan the best antioxidants activity with DPPH (IC50: 5.75 μgmL-1), ABTS (IC50: 24.78 μgm/L). Fraction B1 further fractionated with preparative TLC resulted 2 fractions (B1.1 and B1.2). Fraction B1.1 had the best tyrosinase inhibitors with monophenolase (IC50: 1037.32 μgmL-1) and diphenolase (IC50: 1257.24 μgmL-1), and antioxidants activity with DPPH (IC50: 14.40 μgmL-1), ABTS (IC50: 40.67 μgmL-1). The result of phytochemical test and infrared spectroscopy on fraction B1.1 showed that the active compounds as tyrosinase inhibitors and antioxidant was an isoflavon compound.
Keyword: Rhizophora apiculata, tyrosinase inhibitors, 1,1-diphenyl-picrylhidrazil
RINGKASAN
ABDULLAH. Potensi Bakau Rhizophora apiculata sebagai Inhibitor Tirosinase dan Antioksidan. Dibimbing oleh IRMA HERAWATI SUPARTO, dan IRMANIDA BATUBARA.
Proses pembentukan melanin atau pigmen pada kulit manusia terjadi dengan bantuan biokatalis (enzim) dan sinar ultraviolet (UV) yang terdapat dalam matahari, biokatalis yang berperan dalam reaksi pencoklatan ini adalah tirosinase yang ditemukan pada hewan, tumbuhan, dan manusia (Chang 2009). Proses pembentukan melanin dapat dicegah dengan suatu senyawa inhibitor (senyawa penghambat) yang dapat diperoleh dari senyawa sintetik ataupun dari bahan alam.
Senyawa yang berasal dari bahan alam telah dilaporkan dapat menghambat enzim tirosinase, seperti senyawa yang berasal dari golongan flavonol (kuersetin, mirisetin, kaempferol), golongan isoflavon, flavanol, kalkon, dan stilbenoid (Chang 2009). Senyawa ini sebagian besar diperoleh dari bahan alam seperti dari ekstrak tumbuhan andalas (Morus macroura) dan beberapa spesies Dipterocarpaceae, seperti Shorea assamica, S. seminis, Vatica umbonata, dan Dryobalanops oblongifolia (Hakim et al. 2008). Dari ekstrak kayu Artocarpus incisus dan Artocarpus heterophyllus diperoleh senyawa isoartocarpesin dan kloroforin yang memiliki aktivitas inhibisi yang sama dengan asam kojat (Arung et al. 2005; Supriyanti 2009), sedangkan dari tumbuhan mulberri (Broussonetia papyrifera) berhasil diisolasi sejumlah senyawa diantaranya adalah golongan senyawa flavon, kuersetin, flavonol, dan luteolin (Zheng et al. 2008).
Tujuan dari penelitian ini adalah untuk mengetahui potensi tanaman bakau Rhizophora apiculata (batang, kulit batang, dan akar) asal Makassar Sulawesi Selatan sebagai inhibitor tirosinase dan membandingkan potensi antioksidan dari tiap bagian tanaman bakau dengan menggunakan metode penangkapan radikal bebas 1,1-difenil-pikrilhidrazil (DPPH), dan 2,2’-Azinobis(3-etilbenzatiazolin)-6-sulfonatacid (ABTS).
untuk analisis kualitatif keberadaan gugus fungsi senyawa yang berperan dalam menghambat enzim tirosinase dan antioksidan.
Hasil penelitian menunjukkan bahwa ekstrak kasar metanol kulit batang R. apiculata (IC50 monofenolase: 78.79 µg/mL dan difenolase: 1116.65 µg/mL) memiliki potensi terbaik dalam menghambat enzim tirosinase. Nilai IC50 untuk jalur monofenolase lebih baik dibandingkan dengan asam kojat sebagai kontrol positif (IC50 monofenolase: 156.75 µg/mL dan difenolase: 245.19 µg/mL), sedangkan untuk jalur difenolase asam kojat memiliki nilai IC50 yang lebih baik dari ekstrak kasar metanol kulit batang.
Ekstrak metanol kulit batang juga memiliki aktivitas antioksidan yang paling baik dalam menghambat pembentukan radikal bebas DPPH (IC50: 3.31 µg/mL) dan ABTS (IC50: 18.47 µg/mL). Nilai IC50 ekstrak metanol kulit batang R.
apiculata untuk metode DPPH lebih tinggi dibanding kontrol positif asam askorbat (IC50: 9.79 µg/mL), sedangkan untuk metode ABTS, ekstrak ini memiliki nilai IC50 yang tidak berbeda jauh dengan asam askorbat (IC50: 10.93 µg/mL).
Fraksinasi dilakukan terhadap ekstrak kasar metanol kulit batang R. apiculata menggunakan kromatografi kolom silika gel dengan eluen n-heksana:etilasetat:metanol (1:3:6). Hasil fraksinasi diperoleh 10 fraksi (A-J) dan fraksi teraktif sebagai inhibitor tirosinase adalah fraksi B (IC50 monofenolase: 1045.6 µg/mL dan difenolase: 846.71 µg/mL). Fraksi yang aktif sebagai antioksidan juga didapat pada fraksi B dengan metode penangkapan radikal bebas DPPH (IC50: 9.19 µg/mL) dan ABTS (IC50: 7.73 µg/mL).
Proses pemurnian terhadap fraksi B hasil kolom dilakukan dengan menggunakan kromatografi lapis tipis preparatif (KLTP) dengan eluen kloroform:metanol (9:1), dan diperoleh 9 fraksi (fraksi B1-B9). fraksi teraktif sebagai inhibitor tirosinase adalah fraksi B1 (IC50 monofenolase: 1278 µg/mL dan difenolase: 1678.2 µg/mL). Fraksi B1 merupakan fraksi yang aktif sebagai antioksidan dengan metode penangkapan radikal bebas DPPH (IC50: 5.75 µg/mL) dan ABTS (IC50: 24.78 µg/mL).
Identifikasi komponen senyawa dalam fraksi B1.1 dilakukan dengan uji kualitatif fitokimia untuk mengetahui golongan senyawanya, serta analisis FTIR diperoleh bahwa golongan senyawa yang aktif sebagai inhibitor tirosinase dan antioksidan adalah isoflavon.
© Hak Cipta Milik IPB, Tahun 2011 Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencamtumkan atau menyebutkan sumbernya.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan masalah b. pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apa pun tanpa izin IPB
POTENSI BAKAU Rhizophora apiculata SEBAGAI
INHIBITOR TIROSINASE DAN ANTIOKSIDAN
ABDULLAH
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Kimia
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2011
Penguji Luar Komisi Pada ujian Tesis: Prof. Dr. Ir. Latifah K Darusman, M.S
HALAMAN PENGESAHAN
Judul Tesis : Potensi Bakau Rhizophora apiculata sebagai Inhibitor Tirosinase dan Antioksidan
Nama : Abdullah
NRP : G451090021
Program studi : Kimia
Disetujui: Komisi Pembimbing
Dr.dr. Irma Herawati Suparto, M.S Dr. Irmanida Batubara, M.Si Ketua Anggota
Diketahui:
Ketua Program Studi Dekan Sekolah Pascasarjana Pascasarjana Kimia
Prof. Dr. Purwantiningsih Sugita, M.S Dr. Ir. Dahrul Syah. M.Sc. Agr.
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Desember 2010 ini adalah Potensi bakau Rhizophora apiculata sebagai inhibitor tirosinase dan antioksidan.
Terima kasih penulis ucapkan kepada Dr. dr. Irma Herawati Suparto, M.S sebagai ketua komisi pembimbing, dan Dr. Irmanida Batubara, M.Si sebagai anggota komisi pembimbing yang telah banyak memberi saran, bimbingan, dan pengarahan sehingga penulisan tesis ini dapat diselesaikan dengan baik. Pada kesempatan ini penulis ucapkan terima kasih kepada Prof. Dr. Ir. Latifah K Darusman M.S sebagai penguji luar komisi, Prof. Dr. Purwantiningsih Sugita M.S selaku wakil mayor Kimia yang telah banyak memberikan masukan dan arahan dalam kesempurnaan tesis ini. Ungkapan terima kasih yang sebesar-besarnya saya haturkan kepada keluarga saya (ayah, ibu, adik-adikku dan seluruh keluarga besarku) serta seluruh staf guru MTS/MA Muhammadiyah Bontorita yang telah memberikan doa dan semangat selama penulis menjalani perkuliahan. Untuk semua teman-teman seperjuangan “S2 kimia angkatan 2009 IPB”, terima kasih telah memberikan semangat dan motivasi serta kenangan berharga. Disamping itu, penghargaan dan terima kasih penulis sampaikan kepada seluruh staf dosen dan pegawai Departemen Kimia IPB, staf Pusat Studi Biofarmaka IPB, dan staf laboratorium kimia analitik Departemen Kimia IPB serta semua pihak yang tidak bisa saya sebutkan satu persatu yang telah membantu kelancaran penelitian saya.
Semoga Allah SWT membalas segala kebaikan yang telah diberikan. Karya ilmiah ini diharapkan dapat bermanfaat bagi semua pihak. Penulis menyadari sepenuhnya atas keterbatasan kemampuan yang dimiliki. Segala kritik dan saran yang membangun, diharapkan demi kesempurnaan tesis ini.
RIWAYAT HIDUP
Penulis dilahirkan di Bontomanai desa Kalebarembeng Kecamatan Bontonompo Kabupaten Gowa Sulawesi Selatan pada tanggal 9 Oktober 1982 dari ayah Awaluddin dan ibu Subaedah. Penulis merupakan putra pertama dari empat bersaudara.
Tahun 2000 penulis lulus dari SMA Negeri I bontonompo dan pada tahun yang sama lulus seleksi masuk Universitas negeri Makassar (UNM) melalui Penerimaan mahasiswa jalur khusus (PMJK). Penulis memilih jurusan pendidikan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, lulus pada tahun 2005. Pada tahun 2009, penulis mendapatkan beasiswa utusan daerah (BUD) dari Departemen Agama Republik Indonesia untuk melanjutkan studi Magister Sains pada Program Studi Kimia, Sekolah Pascasarjana Institut Pertanian Bogor (IPB).
Penulis bekerja sebagai staf guru di MTS/MA Muhammadiyah Bontorita mulai tahun 2004 sampai sekarang. Kegiatan ilmiah yang pernah diikuti selama menjadi mahasiswa pascasarjana kimia adalah peserta semiloka ‘Jamu sebagai warisan budaya untuk meningkatkan citra Indonesia” (tahun 2010), peserta seminar nasional sains III (tahun 2010), peserta seminar nasional teknologi kimia aplikatif (tahun 2010), peserta “IPB dedication for education” (tahun 2010), serta peserta dan presenter poster pada “The 2nd international symposium on temulawak” dengan judul ‘Potency of Rhizophora apiculata extracts as tyrosinase inhibitors and antioxidants” (tahun 2011).
DAFTAR ISI
Metode Penangkapan Radikal Bebas 2,2’-difenil pikrilhidrazil ... 9
Metode Penangkapan Radikal Bebas Asam 2,2’-Azinobis (3-etilbenzatiazolin-6-sulfonat) ABTS ... 10
Penelitian Tentang Senyawa Inhibitor Tirosinase dan Antioksidan ... 11
METODE PENELITIAN
Aktivitas Inhibitor Tirosinase dan Antioksidan Ekstrak Kasar ... 24
Fraksinasi Ekstrak Kasar Metanol Kulit Batang dengan kromatografi Kolom ... 26
Aktivitas Inhibitor Tirosinase dan Antioksidan Fraksi Hasil kromatografi Kolom ... 29
Aktivitas Inhibitor Tirosinase dan Antioksidan Fraksi Hasil
Kromatografi Lapis Tipis Preparatif (KLTP) ... 33
Uji Kualitatif Fitokimia ... 35
Analisis Spektrofotometer Infra Merah (IR) ... 36
SIMPULAN DAN SARAN ... 38
DAFTAR PUSTAKA ... 40
LAMPIRAN ... 43
DAFTAR TABEL
Halaman
1 Rendemen ekstrak kasar batang, kulit batang, dan akar Rhizophora
apiculata ... 22
2 Uji fitokimia ekstrak kasar batang, kulit batang, dan akar
R. apiculata ... 23
3 Nilai IC50 inhibitor tirosinase (monofenolase dan difenolase)
dan antioksidan pada ekstrak kasar bakau R. apiculata BL ... 24
4 Rendemen fraksi hasil kromatografi kolom ... 28
5 Nilai IC50 inhibitor tirosinase (monofenolase dan difenolase) dan
antioksidan pada fraksi hasil kromatografi kolom ... 29
6 Rendemen fraksi hasil kromatografi lapis tipis preparatif (KLTP) ... 32
7 Nilai IC50 inhibitor tirosinase (monofenolase dan difenolase) dan
antioksidan pada fraksi hasil KLTP ... 33
8 Nilai IC50 inhibitor tirosinase (monofenolase dan difenolase) dan
antioksidan pada fraksi hasil KLTP lanjutan ... 35
9 Hasil absorpsi inframerah gugus fungsi fraksi KLTP teraktif inhibitor tirosinase dan antioksidan (fraksi B1.1) ekstrak metanol
kulit batang R. apiculata ... 36
3 Reaksi antara DPPH radikal dan antioksidan menjadi DPPH ... 9
4 Reaksi pembentukan ABTS radikal dari ABTS dengan
kalium persulfat ... 10
5 Senyawa dari bahan alam yang dapat menghambat enzim tirosinase ..
6 Contoh senyawa antioksidan golongan flavonoid ... 11
7 Kromatogram lapis tipis eluen terbaik untuk kromatografi kolom ... 27
8 Kromatogram lapis tipis dari 10 fraksi hasil kolom ... 28
preparatif (KLTP) ... 31
10 kromatogram lapis tipis dari 9 fraksi
hasil KLT preparatif ... 32
11 Struktur isoflavon ... 37
DAFTAR LAMPIRAN
Halaman
1 Prosedur penelitian ... 45
2 Hasil identifikasi/determinasi sampel tanaman ... 48
3 Kadar air serbuk batang, kulit batang, dan akar R. apiculata ... 49
4 Kadar abu serbuk batang, kulit batang, dan akar R. apiculata ... 50
5 Rendemen ekstrak kasar R. apiculata ... 51
6 Contoh perhitungan IC50 Inhibitor Tirosinase baik monofenolase dan difenolase ekstrak teraktif (ekstrak metanol kulit batang Rhizophora
apiculata) ... 52
7 Contoh perhitungan IC50 antioksidan dengan metode penangkapan radikal bebas DPPH untuk ekstrak teraktif
(ekstrak metanol kulit batang R. apiculata) ... 54
8 Contoh perhitungan IC50 antioksidan dengan metode penangkapan radikal bebas ABTS untuk ekstrak teraktif
(ekstrak metanol kulit batang R. apiculata) ... 56
9 Hasil pencarian eluen terbaik ekstrak metanol kulit batang ... 58
10 Pengelompokan fraksi hasil kromatografi kolom
dari ekstrak metanol kulit batang R. apiculata ... 60
11 Pengelompokan fraksi hasil KLT preparatif dari fraksi B hasil kromatografi kolom ekstrak metanol kulit batang
R. apiculata ... 60
12 Spektum inframerah (IR) dari fraksi B1.1
KLT preparatif lanjutan ... 61
Melanin merupakan pigmen warna pada kulit, rambut, lapisan koroid
mata, dan sel-sel tumor tertentu. Pigmen melanin yang diproduksi pada sel
melanosit terdiri dari dua jenis, yaitu eumelanin (pigmen-cokelat hitam), dan
feomelanin (pigmen kuning-merah). Pada keadaan normal produksi pigmen
melanin stabil, akan tetapi pada keadaan tertentu produksi melanin berubah,
misalnya karena terkena sinar matahari, perubahan hormonal, pengaruh rokok dan
alkohol.
Proses pembentukan melanin pada tubuh manusia dapat direduksi dengan
beberapa mekanisme, seperti antioksidan, inhibitor enzim tirosinase, dan aktivitas
hormonal (Prota & Thompson 1976). Proses pembentukan melanin atau pigmen
pada kulit manusia terjadi dengan bantuan biokatalis (enzim) dan sinar ultraviolet
(UV) yang terdapat dalam matahari, biokatalis yang berperan dalam reaksi
pencoklatan ini adalah tirosinase yang ditemukan pada hewan, tumbuhan dan
manusia (Chang 2009).
Antioksidan dan inhibitor enzim tirosinase dapat diperoleh dari senyawa
sintetik ataupun dari bahan alam, senyawa antioksidan dan inhibitor tirosinase
yang telah ditemukan dalam bahan kosmetik sebagai pencegah terbentuknya
melanin diantaranya adalah asam askorbat (Vitamin C), arbutin, asam kojat,
merkuri dan hidrokuinon. Dari beberapa senyawa tersebut, asam kojat memiliki
efek inhibisi dan kestabilan paling besar dalam menghambat pembentukan
melanin dan banyak digunakan pada produk kosmetik. Namun menurut Miyazawa
(2007), asam kojat ternyata bersifat karsinogenik dan penggunaannya dalam
konsentrasi tinggi dapat mengakibatkan kerusakan pada kulit.
Senyawa yang berasal dari bahan alam telah dilaporkan dapat menghambat
enzim tirosinase, seperti senyawa yang berasal dari golongan flavonol (kuersetin,
mirisetin, kaempferol), golongan isoflavon, flavanol, kalkon, dan stilbenoid
(Chang 2009). Senyawa ini sebagian besar diperoleh dari bahan alam seperti dari
ekstrak tumbuhan andalas (Morus macroura) dan beberapa spesies
Dipterocarpaceae, seperti Shorea assamica, S. seminis, Vatica umbonata, dan
incisus dan A. heterophyllus diperoleh senyawa isoartokarpesin dan kloroforin
yang memiliki aktivitas inhibisi yang sama dengan asam kojat (Arung et al. 2005;
Supriyanti 2009), sedangkan dari tumbuhan mulberri (Broussonetia papyrifera)
berhasil diisolasi sejumlah senyawa diantaranya adalah golongan senyawa flavon,
kuersetin, flavonol, dan luteolin (Zheng et al. 2008).
Hasil penapisan yang telah dilakukan oleh Batubara et al. (2010) terhadap
tanaman obat Indonesia dari 35 spesies, ternyata diperoleh bahwa ekstrak metanol
dari kayu Rhizophora sp memiliki kemampuan inhibisi yang cukup baik terhadap
tirosinase dengan IC50: 108.2 μg/ml untuk monofenolase dan 124 μg/ml untuk
difenolase, serta aktivitas antioksidan dengan metode DPPH diperoleh IC50: 5,90 μg/ml yang tidak berbeda jauh dengan (+)-katekin sebagai kontrol positif dengan IC50: 2,94 μg/ml.
Rahim et al. (2008) meneliti aktivitas antioksidan senyawa tanin yang
diisolasi dari kulit batang R. apiculata dan diperoleh data bahwa aktivitas
antioksidan dengan metode penangkapan radikal bebas 2,2-difenil-1-pikrihidrasil
(DPPH) dan 2,2’-azinobis (3-etilbenzotiazoline-6 sulfonic acid (ABTS) memiliki
persentase aktivitas antioksidan > 90% pada konsentrasi 30 μg/ml dan 50 μg/ml
yang tidak berbeda jauh dengan butil hidroksi toluena (BHT) dan L-(+)- asam
askorbat sebagai kontrol positif.
Penelitian yang dilakukan oleh Nurrefiyanti et al. (2010) menemukan
bahwa ekstrak metanol tanaman bakau dari pulau Jawa tidak memiliki potensi
sebagai inhibitor tirosinase, tetapi ekstrak tanaman bakau dari Samboja
Kalimantan Timur memiliki daya penginhibisi yang lebih baik yaitu dari segi
monofenolase untuk akar R. mucronata dan batang R. stylosa memiliki nilaiIC50 :
15,34 μg/ml dan 38,02 μg/ml.
Potensi yang dimiliki oleh pohon bakau sangat menarik untuk diteliti lebih
lanjut, terutama potensinya dalam menghambat enzim tirosinase dan sebagai
antioksidan alami. Maka dalam penelitian ini diteliti potensi bakau asal Makassar
Sulawesi Selatan dari jenis R. apiculata BL dan diharapkan dapat diperoleh
senyawa yang terkandung dalam kayu bakau yang dapat menghambat enzim
Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mengetahui potensi tanaman bakau
R. apiculata (batang, kulit batang, dan akar) asal Makassar Sulawesi Selatan
sebagai inhibitor tirosinase dan antioksidan.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi tentang potensi
dari batang, kulit batang, dan akar R. apiculata sebagai inhibitor tirosinase dan
antioksidan yang diharapkan dapat memberikan alternatif yang baik dalam
Bakau (Rhizophora apiculata BL)
Bakau (R. apiculata) merupakan salah satu pohon yang hidup di hutan
mangrove. Tanaman ini termasuk dalam famili Rhizophoraceae, Genus
Rhizophora dan spesies R. apiculata ( Duke 2006). Menurut Purnobasuki (2005),
R. apiculata dikenal dengan nama bakau minyak, memiliki beberapa nama daerah,
yaitu bako-bako, bangkita baruang, dan parai. Bagian tanaman bakau jenis ini
dapat dilihat pada Gambar 1.
a b c
d e f
Gambar 1 Bagian pohon bakau jenis Rhizophora apiculata : pohon (a), akar (b), batang (c), daun (d), bunga (e), buah dan hipokotil (f) (Duke 2006).
Tinggi pohon bakau bisa mencapai 30 m dengan diameter batang mencapai
50 cm dan memiliki perakaran yang khas hingga mencapai ketinggian 5 m, kulit
pada bagian tengah dan kemerahan di bagian bawah. Bentuk buah membulat telur
atau berbentuk seperti buah pir terbalik, warna coklat, panjang 2,0-3,5 cm.
Hipokotil silindris, berbintil berwarna hijau jingga, leher kotilodon berwarna
merah jika sudah matang dan memiliki panjang 18-38 cm dan diameter 1-2 cm
(Purnobasuki 2005).
Bakau jenis R. apiculata banyak dimanfaatkan dalam bidang kesehatan,
seperti di India dan Cina sebagai anti diare, obat mual, dan muntah (Gao et al.
2008); antiviral (Premanathan et al. 1999), dan hypoglikemik (Sur et al. 2004).
Batangnya menghasilkan asam piroligneus yang memiliki sifat antioksidan yang
tinggi (Loo et al. 2008), dan kulit kayu menghasilkan tanin yang digunakan
sebagai sumber antioksidan alami (Rahim et al. 2008). Satu lagi kegunaan kayu
bakau dalam bidang industri adalah untuk bahan baku kertas, kayu bakau biasa
dicincang dengan mesin potong menghasilkan serpihan kayu yang dinamakan
wood chips (Duke 2006).
Enzim Tirosinase
Enzim tirosinase banyak ditemukan pada mamalia, buah-buahan dan juga di
dalam proses pencoklatan fungi secara enzimatik (Chang 2009). Tirosinase yang
juga dikenal sebagai polifenol pengoksidase merupakan suatu enzim yang
mengandung tembaga dan memiliki campuran fungsi oksidase yang dapat
didistribusikan secara luas dalam mikroorganisme, hewan dan tanaman.
Tirosinase atau fenol oksidase adalah enzim utama yang terlibat dalam sintesis
melanin (Likhitwitayawuid 2008).
Inhibitor terhadap enzim tirosinase untuk mengatur metabolisme
pigmentasi telah menarik banyak perhatian, diantaranya adalah inhibitor tirosinase
yang diperoleh dari senyawa metabolit sekunder pada tumbuh-tumbuhan. Enzim
tirosinase mengkatalisis dua reaksi berbeda yang menggunakan oksigen: o
-hidrosilasi tirosin menjadi 3,4-dihidroksifenilalanin atau DOPA (o-difenol) yang
dikenal dengan nama monofenolase dan oksidasi dari DOPA menjadi dopakuinon
(o-kuinon) yang disebut difenolase, sebelum menjadi eumelanin atau feomelanin
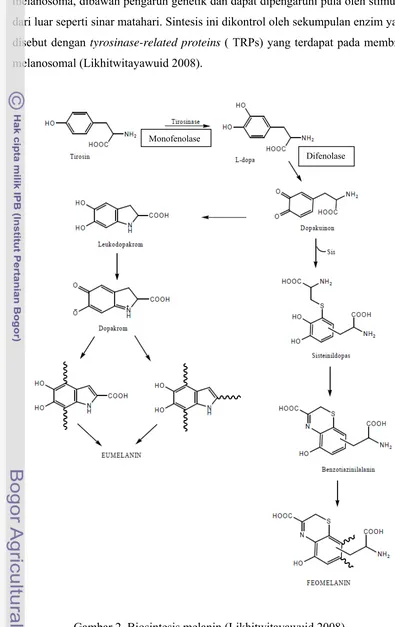
Menurut Kariosentono (2008), biosintesis melanin terjadi di dalam
melanosoma, dibawah pengaruh genetik dan dapat dipengaruhi pula oleh stimulus
dari luar seperti sinar matahari. Sintesis ini dikontrol oleh sekumpulan enzim yang
disebut dengan tyrosinase-related proteins ( TRPs) yang terdapat pada membran
melanosomal (Likhitwitayawuid 2008).
Gambar 2 Biosintesis melanin (Likhitwitayawuid 2008).
Monofenolase
Antioksidan
Antioksidan merupakan inhibitor penting dalam tubuh yang bermanfaat
untuk mencegah reaksi oksidasi yang ditimbulkan oleh radikal bebas baik berasal
dari metabolisme tubuh maupun faktor eksternal lainnya. Radikal bebas adalah
atom atau molekul yang tidak stabil dan sangat reaktif karena mengandung satu
atau lebih elektron tidak berpasangan pada orbital terluarnya. Radikal bebas akan
bereaksi dengan molekul di sekitarnya untuk memperoleh pasangan elektron
dalam mencapai kestabilan atom atau molekul.
Mekanisme kerja antioksidan secara umum menghambat oksidasi substrat
yang terjadi dalam tiga tahap utama, yaitu inisiasi, propagasi, dan terminasi.
Tahap inisiasi terjadi pembentukan radikal substrat, yaitu turunan substrat yang
bersifat tidak stabil dan sangat reaktif akibat hilangnya satu atom H. Radikal
substrat akan bereaksi dengan oksigen membentuk radikal peroksi pada tahap
propagasi. Radikal peroksi lebih lanjut akan menyerang substrat menghasilkan
hidroperoksida dan radikal substrat baru (Pinnel 2003).
Reaksi Inisiasi:
Aktivitas antioksidan tidak dapat diukur secara langsung, melainkan melalui
efek antioksidan dalam mengontrol proses oksidasi. Banyak metode yang bisa
digunakan untuk mengukur aktivitas antioksidan dan setiap metode memiliki
mekanisme yang berbeda, sesuai dengan kandungan senyawa antioksidannya.
Untuk mengamati aktivitas antioksidan digunakan beberapa metode pengukuran
aktivitas antioksidan, yaitu seperti metode 2,2-difenil-1-pikrihidrasil (DPPH),
antioxidant power (FRAP), Cuprac reducing antioxidant capacity (CUPRAC)
(Krishnaiah et al. 2010). Dalam penelitian ini akan dilakukan pengujian aktivitas
antioksidan dengan metode penangkapan radikal bebas DPPH dan ABTS.
Metode Penangkapan Radikal Bebas 2,2’-Difenil-1-pikrilhidrasil (DPPH)
Senyawa 1,1-difenil-1-pikrilhidrazil (DPPH) merupakan senyawa radikal
nitrogen. DPPH akan mengambil atom hidrogen yang terdapat pada suatu
senyawa, misalnya senyawa fenol. Mekanisme terjadinya reaksi DPPH ini
berlangsung melalui transfer elektron. Larutan DPPH yang berwarna ungu
memberikan serapan maksimum pada 517 nm. Larutan DPPH ini akan
mengoksidasi senyawa dalam ekstrak tanaman. Proses ini ditandai dengan
memudarnya warna larutan dari ungu menjadi kuning.
Senyawa DPPH merupakan radikal bebas yang stabil dalam larutan berair
atau metanol dan memiliki warna ungu yang ditunjukkan oleh pita absorpsi dalam
pelarut metanol pada panjang gelombang 515-520 nm. DPPH bersifat peka
terhadap cahaya, oksigen, dan pH. Namun, bersifat stabil dalam bentuk radikal
sehingga mungkin dilakukan pengukuran aktivitas antioksidan yang cukup akurat.
Radikal bebas DPPH dapat menangkap atom hidrogen dari komponen ekstrak
yang dicampurkan, kemudian bereaksi menjadi bentuk tereduksinya dan ditandai
dengan berkurangnya intensitas warna ungu larutan DPPH. Senyawa antioksidan
melepas atom hidrogen menjadi radikal senyawa antioksidan. DPPH yang
merupakan radikal bebas direaksikan dengan senyawa antioksidan dan
membentuk DPPH yang nonradikal, proses reaksi dapat dilihat pada Gambar 3.
Metode Penangkapan Radikal Bebas Asam
2,2-Azinobis(3-etilbenzatiazolin)-6-sulfonat (ABTS)
Senyawa radikal bebas ABTS merupakan senyawa yang diperoleh dari hasil
oksidasi kalium persulfat dengan garam diammonium ABTS. Prinsip pengujian
ini adalah senyawa antioksidan akan menangkap radikal bebas ABTS yang
ditandai dengan peristiwa hilangnya warna biru (dekolorisasi) pada pereaksi
ABTS. Hal ini ditandai dengan menurunnya nilai absorbansi dari serapan sampel
yang diukur.
ABTS merupakan senyawa larut air dan stabil secara kimia, akumulasi dari
ABTS dapat dihambat oleh antioksidan pada medium reaksi dengan aktivitas yang
bergantung waktu reaksi dan jumlah antioksidan. Kemampuan relatif antioksidan
untuk mereduksi ABTS dapat diukur dengan spektrofotometri pada panjang
gelombang maksimum 414 nm atau 734 nm (Roberta et al. 1999).
Penelitian tentang senyawa Inhibitor Enzim Tirosinase dan Antioksidan
Beberapa senyawa bahan alam seperti kelompok senyawa flavonoid,
benzaldehida, turunan benzoat, lemak dan steroid rantai panjang, stilben, dan
koumarin dilaporkan dapat menghambat enzim tirosinase (Chang 2009).
Mekanisme tipe hambatan yang terjadi umumnya mengarah kepada inhibitor
kompetitif, dan non-kompetitif, beberapa senyawa dari bahan alam yang dapat
menghambat enzim tirosinase, diantaranya kuersetin (golongan flavonol),
streppogenin (golongan flavanon), dihidromorin (golongan flavanol), calycosin
(golongan isoflavon), 2,4,2’,4’-tetrahidrokalkon dan likokalkon (golongan
kalkon), kloroporin (golongan stilben) (Gambar 5).
kuersetin (flavonol) streptogenin (flavanon) dihidromorin (flavanol)
calycosin (isoflavon) 2,4,2’,4’-tetrahidrokalkon
Gambar 5 Senyawa dari bahan alam yang dapat menghambat enzim tirosinase (Chang 2009)
Flavonoid mampu menghambat enzim tirosinase karena memiliki kemiripan
struktur dengan substrat L-tirosin dan L-DOPA, besarnya kekuatan inhibisi
flavonoid dipengaruhi oleh besarnya kekuatan mereduksi/derajat oksidasi dari
gugus fungsi hidroksil (OH) dan karbonil (C=O).
Penelitian tentang senyawa bahan alam yang dilaporkan memiliki aktivitas
antioksidan dengan metode penangkapan radikal bebas DPPH, dan ABTS sudah
banyak dilaporkan, terutama dari senyawa golongan flavonoid, alkaloid,
flavonoid seperti asam dihidroksi sinamik flavanol, flavon, flavonols, dan pigmen
antosianin memiliki aktivitas antioksidan dalam menghambat radikal bebas DPPH
dan ABTS (Dimitrios 2006). Beberapa contoh senyawa antioksidan golongan
fenolik yang diisolasi dari bahan alam dapat dilihat pada Gambar 6.
Apigenin luteolin
Gambar 6 Contoh senyawa antioksidan golongan flavonoid
Waktu dan Tempat Penelitian.
Penelitian dilaksanakan mulai bulan Desember 2010 sampai Juni 2011,
bertempat di Laboratorium Kimia Analitik Departemen Kimia Fakultas
Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor dan Pusat Studi
Biofarmaka Lembaga Penelitian dan Pengabdian Masyarakat Institut Pertanian
Bogor.
Bahan dan Alat
Bahan yang digunakan adalah kayu bakau jenis R. apiculata yang diperoleh
dari Makassar Sulawesi Selatan terdiri dari batang, kulit batang, dan akar. Bahan
kimia, yaitu metanol, etil asetat, kloroform, dietil eter, aseton, n-heksana,
diklorometana (Merck), DMSO (dimetil sulfoksida), buffer fosfat pH 6,5, larutan
L-tirosin, L-DOPA, enzim tirosinase dari jamur (Sigma 333 unit/ml dalam buffer
fosfat), larutan 2,2-difenil-1-pikrihidrasil (DPPH), larutan 2,2’-azinobis
(3-etilbenzotiazoline-6 sulfonic acid) (ABTS), Troloks, dan asam askorbat (Sigma).
Alat-alat yang digunakan adalah spektrofotometer FTIR (Brucker), multiple
well plate reader, multiwell plates, oven, tanur, eksikator, neraca analitik
(Sartosius), penguap putar, kolom kromatografi, Pelat kromatografi lapis tipis
(KLT), pelat kromatografi lapis tipis preparatif (KLTP), vortex, glass wool,
tabung reaksi, gelas piala, pipet mohr (1 ml, 5 ml dan 10 ml), pipet volumetrik,
pipet mikro, cawan petri, cawan porselin, labu takar (5 ml dan 250 ml), dan pelat
silika gel.
Prosedur Penelitian
Prosedur penelitian dimulai dari pengambilan sampel R. apiculata di
Makassar Sulawesi Selatan, sampel kemudian diidentifikasi di Herbarium
Bogoriensis bidang Botani Pusat Penelitian Biologi Lembaga Ilmu Pengetahuan
Indonesia (LIPI) Cibinong Jawa Barat. Bagian tanaman lalu dipisahkan antara
bagian batang, kulit batang, dan akar. Setelah itu, tiap bagian dikeringkan dan
Serbuk diekstraksi secara bertingkat dengan cara maserasi dimulai dengan pelarut
non polar (n-heksana) kemudian diekstraksi kembali dengan pelarut semi polar
(etil asetat), dan terakhir diekstraksi dengan pelarut polar (metanol). Semua
ekstrak yang dihasilkan diuji fitokimia, kemudian dilakukan uji aktivitas inhibitor
tirosinase dan aktivitas antioksidan dengan metode DPPH dan ABTS. Penentuan
eluen terbaik dilakukan dengan menggunakan kromatografi lapis tipis, ekstrak
teraktif dipisahkan dengan kromatografi kolom silika gel, fraksi yang diperoleh
diuji aktivitas inhibitor tirosinase dan aktivitas antioksidan sehingga diperoleh
fraksi teraktif. Lalu, dilakukan pemisahan lebih lanjut dengan kromatografi lapis
tipis preparatif untuk mendapatkan fraksi teraktif. Hal ini bertujuan untuk
mendapatkan senyawa inhibitor tirosinase lalu karakterisasi dan identifikasi
senyawa dengan menggunakan spektrofotometer infra merah (FTIR), serta uji
kualitatif fitokimia untuk menentukan golongan senyawanya. Prosedur penelitian
dapat dilihat pada Lampiran 1.
Preparasi dan ekstraksi sampel
Preparasi sampel ekstrak R. apiculata dilakukan dengan cara mengeringkan
sampel batang, kulit batang, dan akar R. apiculata, kemudian dibuat serbuk.
Sampel kering berupa serbuk kemudian ditentukan kadar air dan kadar abu, lalu
dilakukan ekstraksi secara bertingkat dengan cara maserasi dimulai dengan pelarut
non polar (n- heksana) dan ampas yang diperoleh kemudian di maserasi kembali
dengan pelarut semi polar (etil asetat) dan terakhir ampas diekstraksi dengan
pelarut polar (metanol). Semua ekstrak yang diperoleh disaring dengan
menggunakan kertas saring dan dipekatkan dengan penguap putar pada suhu 300C
kemudian rendemen tiap ekstrak dihitung (Batubara et al. 2010).
Penentuan kadar air
Cawan dikeringkan terlebih dahulu selama 1 jam dalam oven pada suhu
1050C, lalu didinginkan dalam eksikator kemudian beratnya ditimbang. Sampel
ditimbang seberat 1 g dan dimasukkan ke dalam cawan, kemudian sampel
dalam eksikator kemudian ditimbang kembali sampai diperoleh bobot yang
konstan. Proses ini dilakukan secara triplo.
Kadar air (%) : A-B x 100 % B
dengan
A adalah bobot sampel basah (g)
B adalah bobot sampel kering (g)
Penentuan kadar abu
Cawan porselin dikeringkan pada temperatur 6000C selama 30 menit dan
didinginkan dalam eksikator kemudian ditimbang. Sebanyak 2 g sampel
ditimbang dan dimasukkan ke dalam cawan porselin. Cawan dan isinya
dipanaskan dengan nyala Bunsen sampai tidak berasap lagi. Kemudian cawan
dimasukkan ke dalam tanur listrik dengan temperatur 6000C sampai contoh
menjadi abu sama sekali (kira-kira 30 menit). Setelah didinginkan dalam eksikator
kemudian cawan ditimbang. pekerjaan dilakukan dengan cara triplo.
Kadar abu (%) : Z - X x 100 % Y
X adalah bobot kosong cawan porselen (g)
Y adalah bobot sampel (g)
Z adalah bobot cawan dan bahan setelah diabukan (g)
Uji fitokimia
Uji fitokimia merupakan uji pendahuluan untuk mengetahui kandungan
senyawa spesifik seperti alkaloid, triterpenoid, steroid, saponin, flavonoid, kuinon,
tannin dan fenol secara kualitatif. (Harborne 1987).
Uji Alkaloid. Ekstrak R. apiculata dengan bobot tertentu dilarutkan dengan 10
ml kloroform dan beberapa tetes NH4OH kemudian disaring ke dalam tabung
reaksi bertutup. Ekstrak kloroform dalam tabung reaksi dikocok dengan 10 tetes
H2SO4 2 M dan lapisan asamnya dipisahkan ke dalam tabung reaksi lain. Lapisan
dan dragendorf yang akan menimbulkan endapan dengan warna berturut-turut
putih, coklat,dan merah jingga.
Uji saponin dan flavonoid. Ekstrak R. apiculata dengan bobot tertentu,
dimasukkan ke dalam gelas kimia besar kemudian ditambahkan 100 ml air panas
dan dididihkan selama 5 menit, setelah itu disaring dan filtratnya digunakan untuk
pengujian. Uji saponin dilakukan dengan pengocokan 10 ml filtrat dalam tabung
reaksi tertutup selama 10 detik kemudian dibiarkan selama 10 menit, adanya
saponin ditunjukkan dengan terbentuknya buih stabil.
Sebanyak 10 ml filtrat yang lain ditambahkan 0,5 g serbuk magnesium, 2 ml
alkohol klorhidrat (campuran HCl 37 % dan etanol 95 % dengan volume yang
sama) dan 20 ml amil alkohol kemudian dikocok kuat-kuat, terbentuknya warna
merah, kuning dan jingga pada lapisan amil akohol menunjukkan adanya
flavonoid.
Uji terpenoid dan steroid. Ekstrak R. apiculata dilarutkan dengan 25 ml etanol
panas (500C) kemudian disaring dalam cawan porselin dan diuapkan sampai
kering. Residu ditambahkan eter dan ekstrak eter dipindahkan ke dalam lempeng,
lalu ditambahkan 3 tetes anhidrida asam asetat dan 1 tetes H2SO4 pekat (uji
Lieberman-Burchard). Warna merah atau ungu menunjukkan adanya triterpenoid
dan warna hijau atau biru menunjukkan adanya steroid.
Uji Tanin. Ekstrak R. apiculata ditambah 100 ml air panas dididihkan selama 5
menit dan disaring. Lalu ke dalam sebagian filtrat ditambahkan larutan FeCl3, bila
terjadi warna hitam kehijauan menunjukkan adanya tanin.
Penentuan eluen terbaik pada KLT
Ekstrak pekat dari sampel ditotolkan pada pelat KLT. Setelah kering
langsung dielusi dalam ruang elusi yang telah dijenuhkan oleh uap eluen
pengembang. Eluen yang digunakan adalah metanol, etil asetat, kloroform,
dietil-eter, diklorometana, dan n-heksana, lalu dilakukan perbandingan pada eluen yang
menghasilkan spot yang banyak dan terpisah. Eluen akan diperbaiki lebih lanjut
apabila pemisahan belum baik. Noda hasil elusi diamati di bawah lampu UV pada
Fraksinasi dengan kromatografi kolom
Fraksinasi dilakukan dengan pengemasan kolom untuk pemisahan ekstrak
R. apiculata teraktif dengan diameter 2 cm dan tinggi kolom 30 cm. Ekstrak
dilarutkan dalam eluen terbaik yang telah diperoleh, kemudian dipisahkan dengan
kolom kromatografi dengan elusi step gradient. Eluat ditampung setiap 5 ml
dalam tabung reaksi dan eluat yang memiliki warna yang sama kemudian
dikumpulkan dalam satu fraksi. Dan setiap fraksi yang diperoleh kemudian
dilakukan pengujian KLT. Selanjutnya fraksi teraktif diuji dengan KLT preparatif,
noda yang diperoleh kemudian dideteksi di bawah lampu UV 254 nm dan 366 nm
(Rouessac & Rouessac 2007).
Uji aktivitas inhibitor tirosinase
Pengujian yang dilakukan pada tahap ini berdasarkan penelitian yang
dilakukan oleh Batubara et al. (2010), ekstrak R. apiculata dari masing-masing
bagian tanaman dilarutkan dalam larutan DMSO hingga konsentrasi 20 mg/ml,
larutan stok ekstrak kemudian disiapkan dengan cara melarutkan ekstrak pekat ke
dalam buffer fosfat 50 mM (pH 6,5) sehingga diperoleh konsentrasi 600 μg/ml.
Setelah itu, ekstrak diuji mulai konsentrasi 7,8-2000 μg/ml dan asam kojat
sebagai kontrol positif yang juga diuji pada konsentrasi 7,8-2000 μg/ml dalam
pelat tetes 96 sumur. Sebanyak 70 μl dari masing-masing ekstrak pengenceran ini
ditambahkan dengan 30 μl enzim tirosinase (Sigma 333 unit/ml dalam buffer
fosfat), setelah itu dilakukan inkubasi pada suhu kamar selama 5 menit. Kemudian
ditambahkan 110 μl substrat(2 mM L-tirosin atau 12 mM L-dopa) ke dalam tiap
lubang multi-well plate, campuran diinkubasi selama 30 menit pada suhu kamar.
Campuran diukur dengan menggunakan multi-well plate reader pada panjang
gelombang 492 nm, hal ini bertujuan untuk menentukan persen inhibisi dan nilai
konsentrasi hambat 50% (IC50). Persentase inhibisi dihitung dengan cara
membandingkan serapan sampel tanpa penambahan ekstrak dan sampel dengan
penambahan ekstrak. Nilai IC50 diperoleh dari persamaan kurva regresi linier
antara % inhibisi (sebagai sumbu y) dan konsentrasi ekstrak (sebagai sumbu x).
A adalah absorbansi pada 492 nm tanpa ekstrak dan B adalah absorbansi pada 492
nm dengan penambahan ekstrak.
Uji aktivitas antioksidan
Metode penangkapan radikal bebas DPPH
Metode DPPH yang digunakan pada tahap ini berdasarkan dari metode yang
telah dilakukan oleh Batubara et al. (2009), sampel dilarutkan dalam etanol
sehingga diperoleh konsentrasi akhir 1.67, 3.33, 6.67, 10.00, 13.33, 16.67, 33.33,
66.67, 100.00, 133.33, dan 166.67 µg/ml. Pada 100 µl sampel, kemudian
ditambahkan 100 µl larutan DPPH (1.18 mg DPPH dalam 10 ml etanol) pada
masing-masing lubang well plate. Setelah 30 menit absorbansi diukur pada 517
nm. Kontrol positif yang digunakan adalah asam askorbat, dan etanol sebagai
blangko. Setiap konsentrasi sampel dan kontrol positif diuji dua kali pengulangan.
Persentase inhibisi di hitung berdasarkan persamaan:
% Inhibisi = [1-(Asampel – A kontrol)/A blangko – A kontrol)] x 100%
Asampel adalah absorbansi sampel, Akontrol adalah absorbansi asam askorbat dan
Ablangko adalah absorbansi etanol.
Nilai konsentrasi hambat 50% (IC50) ditentukan dengan menggunakan
persamaan regresi linier yang menyatakan hubungan antara konsentrasi sampel uji
(sebagai sumbu x) dan persentase inhibisi (sebagai sumbu y).
Metode penangkapan radikal bebas ABTS
Metode ABTS yang digunakan pada tahap ini adalah berdasarkan metode
dari Rahim et al. (2008) dengan beberapa modifikasi, garam diammonium ABTS
(75 mM) dan Kalium persulfat (1,225 mM) dicampur dan didiamkan selama 12
jam, campuran dilarutkan 10 kali lipat dengan etanol 99,5% sebelum digunakan,
sampel diuji dengan konsentrasi 3.33, 6.67, 10.00, 13.33, 16.67, 33.33, 66.67,
100.00, 133.33, dan 166.67 µg/ml. Pada 50 µl sampel, kemudian ditambahkan
150 µl larutan ABTS pada masing-masing well plate. Setelah 60 menit,
askorbat, setiap konsentrasi sampel dan kontrol positif diuji dua kali pengulangan,
persentase inhibisi di hitung berdasarkan persamaan:
% Inhibisi = [(A0 – A)/A0] x 100%
A0 adalah absorbansi tanpa penambahan sampel, A adalah absorbansi dengan
penambahan sampel.
Nilai konsentrasi hambat 50% (IC50) ditentukan dengan menggunakan
persamaan regresi linier yang menyatakan hubungan antara konsentrasi sampel uji
(sebagai sumbu x) dan persentase inhibisi (sebagai sumbu y).
Identifikasi senyawa inhibitor tirosinase.
Identifikasi menggunakan spektrofotometer IR dilakukan dengan
menimbang sebanyak ± 0,8000 mg sampel dihaluskan bersamaan dengan 0,2004
gram KBr dalam mortar agat. Setelah dihaluskan dan bercampur, serbuk ini
dimasukkan ke dalam alat pencetak pelat KBr, sehingga diperoleh serbuk lempeng
yang transparan. Lempeng yang diperoleh dimasukkan ke dalam spektofotometer
Hasil Identifikasi Sampel
Sampel diambil dari daerah Lakkang Makassar Sulawesi Selatan. Bagian
batang, kulit batang, dan akar diidentifikasi di Herbarium Bogoriensis bidang
Botani Pusat Penelitian Biologi Lembaga Ilmu Pengetahuan Indonesia (LIPI)
Cibinong Jawa Barat. Berdasarkan hasil identifikasi, diperoleh bahwa tanaman
bakau yang akan digunakan sebagai sampel adalah jenis Rhizophora apiculata BL
dengan nomor spesimen 1276/IPH. 1. 02/If. 8/X/2010. Hasil identifikasi sampel
dapat dilihat pada Lampiran 2.
Analisis kadar Air dan Abu
Penetapan kadar air berguna untuk mengetahui ketahanan suatu bahan agar
dapat diperkirakan cara penyimpanan terbaik bagi sampel untuk menghindari
pengaruh aktivitas jamur (mikroba). Analisis kadar air yang dilakukan terhadap
batang, kulit batang, dan akar R. apiculata BL diperoleh masing- masing 9.50 %,
9.33% dan 8.40%. Nilai ini menunjukkan bahwa sampel batang, kulit batang, dan
akar yang berupa serbuk tahan lama untuk disimpan dalam jangka panjang, hal ini
sesuai dengan pernyataan Winarno (1997), yaitu bila kadar air yang terkandung
dalam suatu bahan kurang dari 10% maka kestabilan optimum bahan akan
tercapai dan pertumbuhan mikroba dapat dikurangi.
Penentuan kadar abu merupakan salah satu cara untuk menentukan adanya
mineral/ senyawa anorganik dalam suatu bahan. Mineral sebagai senyawa organik
akan tertinggal dalam bentuk abu yang dapat digunakan untuk analisis kualitatif
dan kuantitatif. Adapun kadar abu yang diperoleh untuk serbuk batang, kulit
batang dan akar R. apiculata BL berturut turut adalah 13.17%, 10.82%, dan
9.98%. Data hasil perhitungan kadar air dan abu dapat dilihat pada Lampiran 3
dan 4.
Ekstraksi Sampel
Ekstraksi merupakan proses yang secara selektif mengambil zat terlarut dari
suatu campuran dengan bantuan pelarut (Harborne 1987). Metode ekstraksi
dissolve like, yaitu pelarut polar akan melarutkan senyawa polar dan pelarut non
polar akan melarutkan senyawa non polar. Pemilihan pelarut yang digunakan juga
bergantung kepada sifat kelarutan zat tersebut. Suatu senyawa akan menunjukkan
kelarutan yang berbeda-beda dalam pelarut yang berbeda pula (Khopkar 2007).
Serbuk batang, kulit batang, dan akar diekstraksi dengan metode maserasi.
Metode ini digunakan karena memiliki kelebihan, yaitu praktis, efektif, aman, dan
ekonomis dalam penggunaannya juga bertujuan untuk menghindari rusaknya
senyawa aktif pada sampel yang tidak tahan panas. Maserasi dilakukan dengan
cara merendam sampel dalam pelarut organik, kemudian ekstrak cair dibebaskan
dari pelarutnya dengan menggunakan rotavapor. Rendemen yang diperoleh dari
hasil ekstraksi dapat dilihat pada Tabel 1.
Tabel 1 Rendemen ekstrak kasar batang, kulit batang, dan akar R. apiculata
Sampel Pelarut Rendemen (%)
batang n-heksana 3.05
etil asetat 2.98
metanol 8.53
kulit batang n-heksana 2.50
etil asetat 2.75
tertinggi diperoleh dari ekstrak metanol kulit batang, akar, dan batang, yaitu
sebesar 22.95%, 8.85%, dan 8.53%. Hal ini disebabkan karena metanol
merupakan pelarut yang memiliki sifat polar yang mampu mengekstraksi
komponen senyawa aktif yang larut dalam cairan ekstraseluler dan intraseluler
(Harborne 1987). Rendemen terendah diperoleh pada ekstrak n- heksana akar
sebesar 1.96%. Perhitungan rendemen dapat dilihat pada Lampiran 5.
Analisis Fitokimia
Analisis fitokimia merupakan salah satu cara untuk mengetahui kandungan
berguna untuk menentukan golongan utama senyawa aktif dari ekstrak batang,
kulit batang, dan akar bakau R. apiculata yang memiliki aktivitas sebagai
inhibitor enzim tirosinase dan antioksidan. Uji yang dilakukan meliputi uji
alkaloid, saponin, flavonoid, triterpenoid, steroid, dan tanin. Hasil pengujian
fitokimia ekstrak kasar batang, kulit batang, dan akar R. apiculata dapat dilihat
pada Tabel 2.
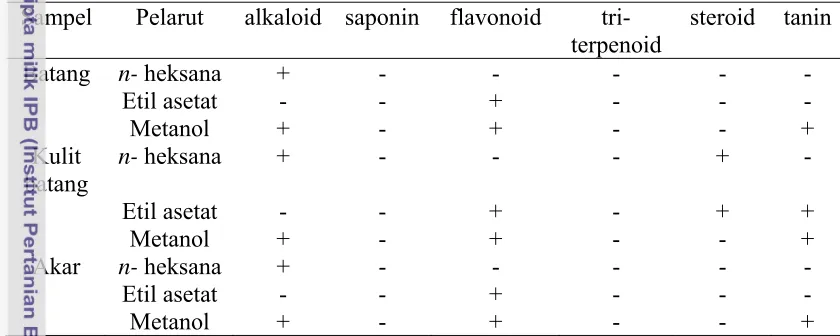
Tabel 2 Uji fitokimia ekstrak kasar batang, kulit batang, dan akar R. apiculata
Sampel Pelarut alkaloid saponin flavonoid tri- terpenoid
Keterangan: (-): tidak terdeteksi; (+): terdeteksi.
Hasil uji fitokimia pada Tabel 2 menunjukkan bahwa komponen alkaloid
terdapat pada ekstrak metanol dan n-heksana batang, kulit batang, dan akar R.
apiculata BL. Komponen flavonoid terdapat pada ekstrak etil asetat dan metanol
batang, kulit batang, dan akar. Kelompok senyawa steroid hanya terdapat pada
ekstrak metanol batang, dan kulit batang, serta ekstrak etil asetat kulit batang.
Kelompok senyawa saponin, dan triterpenoid tidak terdapat pada ketiga bagian
tanaman yang telah diuji. Komponen senyawa tanin hanya terdapat pada ekstrak
metanol batang, kulit batang, dan akar. Adanya kandungan flavonoid dan steroid
dalam ekstrak kasar R.apiculata, diduga akan memberikan efek inhibisi yang
cukup besar, hal ini berdasarkan penelitian sebelumnya bahwa kelompok senyawa
yang aktif sebagai inhibitor tirosinase adalah kelompok senyawa golongan
flavonoid dan steroid (Chang 2009).
Hasil uji fitokimia pada Tabel 2 jika dibandingkan dengan data fitokimia
yang telah dilakukan oleh Nurrefiyanti et al. (2010) menunjukkan perbedaan pada
jenis R. mucronata dan R.stylosa asal pulau Jawa dan Kalimantan positif
mengandung saponin, Sedangkan sampel batang bakau R. apiculata asal India
yang telah diuji fitokimia oleh Sur et al. (2004), positif mengandung senyawa
triterpenoid. Hal ini disebabkan karena perbedaan lokasi pengambilan sampel
yang memiliki kondisi geografis yang berbeda, serta perbedaan spesies dari bakau
yang diteliti, sehingga komponen metabolit sekunder yang terkandung dalam
masing-masing sampel juga berbeda.
Aktivitas Inhibitor Tirosinase dan Antioksidan Ekstrak Kasar
Uji aktivitas inhibitor tirosinase dan antioksidan dilakukan untuk
mengetahui ada tidaknya daya inhibisi senyawa bioaktif yang terdapat pada
ekstrak kasar metanol, etil asetat, dan n-heksana bakau dari spesies R. apiculata.
Data hasil pengujian aktivitas inhibitor tirosinase dan antioksidan pada ekstrak
kasar dapat dilihat pada Tabel 3.
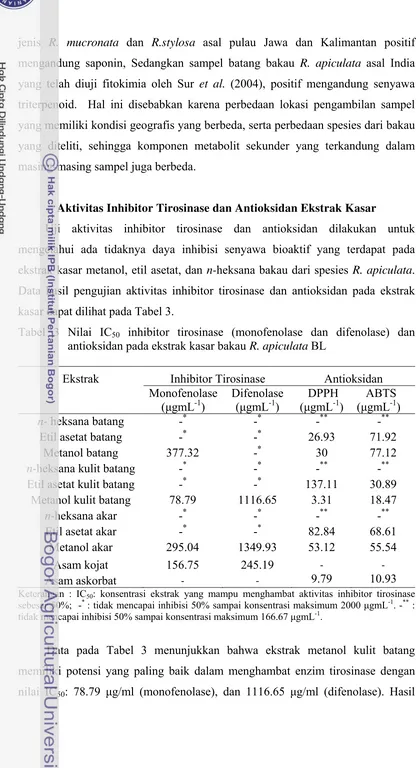
Tabel 3 Nilai IC50 inhibitor tirosinase (monofenolase dan difenolase) dan antioksidan pada ekstrak kasar bakau R. apiculata BL
Ekstrak Inhibitor Tirosinase Antioksidan
Monofenolase
Keterangan : IC50: konsentrasi ekstrak yang mampu menghambat aktivitas inhibitor tirosinase sebesar 50%; -* : tidak mencapai inhibisi 50% sampai konsentrasi maksimum 2000 μgmL-1. -** : tidak mencapai inhibisi 50% sampai konsentrasi maksimum 166.67 μgmL-1.
Data pada Tabel 3 menunjukkan bahwa ekstrak metanol kulit batang
memiliki potensi yang paling baik dalam menghambat enzim tirosinase dengan
yang diperoleh cukup bagus jika dibandingkan dengan penelitian yang telah
dilakukan oleh Lopolisa (2010) yang meneliti aktivitas inhibitor tirosinase dari
ekstrak metanol kulit batang tumbuhan mangrove dari jenis Xylocarpus granatum,
ternyata tidak menunjukkan aktivitas penghambatan 50% sampai konsentrasi 500 μg/ml baik pada jalur monofenolase dan difenolase.
Hasil yang diperoleh pada ekstrak metanol kulit batang menunjukkan bahwa
IC50 monofenolase lebih tinggi dari kontrol positif asam kojat (IC50: 156.75 μg/ml), sedangkan nilai IC50 difenolase lebih rendah dari kontrol positif asam kojat ( IC50:245.19 μg/ml). Hasil ini berbeda dengan penelitian yang dilakukan
oleh Batubara et al. (2010) dan Nurrefiyanti (2010), bahwa IC50 untuk ekstrak
metanol batang dan akar memiliki nilai IC50 yang tidak berbeda jauh dengan
kontrol positif asam kojat, sedangkan menurut Macrini et al. (2009) asam kojat
merupakan substansi yang efektif digunakan sebagai kontrol positif dalam uji
inhibitor tirosinase secara in vitro, adanya perbedaan hasil ini disebabkan karena
asam kojat yang digunakan memiliki penurunan aktivitas akibat penyimpanan
yang terlalu lama.
Ekstrak kasar lainnya yang juga memiliki potensi pada jalur monofenolase
dan difenolase adalah ekstrak metanol akar, sedangkan ekstrak metanol batang
hanya memiliki aktivitas inhibitor tirosinase pada jalur monofenolase. Ekstrak
n-heksana baik batang, kulit batang, dan akar tidak memiliki potensi dalam
menghambat kerja enzim tirosinase, jadi dapat disimpulkan bahwa komponen
senyawa yang berpotensi untuk menghambat kerja enzim tirosinase adalah
senyawa yang larut dalam pelarut polar. Hal ini sesuai dengan hasil uji aktivitas
inhibitor tirosinase yang telah dilakukan oleh Nurrefiyanti et al (2010) dan
Supriyanti (2009) bahwa komponen yang larut dalam pelarut metanol (polar) atau
yang diekstraksi dengan pelarut polar memiliki kemampuan yang cukup bagus
dalam menghambat enzim tirosinase. Contoh perhitungan IC50 inhibitor tirosinase
dapat dilihat pada Lampiran 6.
Data aktivitas antioksidan pada Tabel 3 menunjukkan bahwa ekstrak kasar
yang memiliki aktivitas antioksidan tertinggi dengan metode DPPH adalah
ekstrak metanol kulit batang dengan nilai IC50 sebesar 3.31 μg/ml. Nilai ini berarti
DPPH 50% pada konsentrasi 3.31 μg/ml, nilai yang diperoleh lebih tinggi dari
kontrol positif asam askorbat yang memiliki nilai IC50: 9.79 μg/ml. Nilai IC50
terendah adalah ekstrak etil asetat kulit batang dengan nilai IC50 sebesar 137.11 μg/ml. Ekstrak n-heksana pada batang, kulit batang, dan akar tidak ada yang memiliki inhibisi 50% hingga konsentrasi 166.67 μg/ml. Hasil penelitian ini
sesuai dengan penelitian yang telah dilakukan oleh Rahim et al (2008) bahwa
aktivitas antioksidan dari ekstrak kulit batang R. apiculata memiliki kemampuan
yang tinggi dalam menghambat pembentukan radikal bebas DPPH, hal ini
disebabkan adanya kandungan tanin, dan senyawa fenolik seperti flavonoid dalam
kulit batang tersebut (Loo et al. 2007). Contoh perhitungan IC50 antioksidan dari
ekstrak kasar dengan metode penangkapan radikal bebas DPPH dapat dilihat pada
Lampiran 7.
Aktivitas antioksidan tertinggi dengan metode ABTS adalah ekstrak
metanol kulit batang dengan nilai IC50 sebesar 18.47 μg/ml. Nilai ini berarti
ekstrak metanol kulit batang R. apiculata BL dapat menangkap radikal bebas
ABTS 50% pada konsentrasi 18.47 μg/ml, nilai yang diperoleh lebih rendah dari
kontrol positif asam askorbat yang memiliki nilai IC50: 10.93 μg/ml. Nilai IC50
terendah adalah ekstrak metanol batang dengan nilai IC50 sebesar 77.12 μg/ml.
Ekstrak n-heksana pada batang, kulit batang, dan akar tidak ada yang memiliki
inhibisi 50% hingga konsentrasi 166.67 μg/ml. Hasil penelitian yang telah
diperoleh ini tidak berbeda jauh dengan penelitian yang dilakukan oleh Rahim et
al. (2008) bahwa aktivitas antioksidan dengan metode ABTS dari ekstrak pekat
kulit batang R. apiculata memiliki aktivitas antioksidan yang cukup tinggi.
Contoh perhitungan IC50 antioksidan dari ekstrak kasar dengan metode
penangkapan radikal bebas ABTS dapat dilihat pada Lampiran 8.
Fraksinasi Ekstrak metanol Kulit Batang R. apiculata BL
Fraksinasi dilakukan untuk memurnikan ekstrak kasar metanol kulit
batang R. apiculata BL yang memiliki potensi inhibitor tirosinase. Fraksinasi
dilakukan menggunakan silika gel dengan metode step gradient (peningkatan
polaritas eluen yaitu agar semua komponen yang terlarut dalam ekstrak kasar akan
terbawa lebih cepat dan pemisahan dapat berlangsung dengan baik (Harvey 2000).
Sebelum dilakukan fraksinasi ekstrak kasar metanol kulit batang, maka
terlebih dahulu dilakukan pencarian eluen terbaik dengan menggunakan KLT
(kromatografi lapis tipis). Eluen ini berfungsi sebagai fase gerak saat fraksinasi.
Eluen yang digunakan adalah dimulai dengan eluen tunggal, yaitu n-heksana,
kloroform, aseton, etil asetat, diklorometan, metanol. Eluen dengan pemisahan
terbaik kemudian dikombinasikan satu dengan yang lainnya dengan berbagai
perbandingan. Berdasarkan hasil analisis dengan KLT diperoleh perbandingan
terbaik adalah n-heksana:etilasetat:metanol=1:3:6 (Gambar 7) dengan spot yang
diperoleh sebanyak 10 spot. Hasil pencarian eluen terbaik dengan menggunakan
eluen tunggal dan campuran dapat dilihat pada Lampiran 9.
Gambar 7 Kromatogram lapis tipis eluen terbaik ekstrak metanol kulit batang Rhizophora apiculata dengan eluen :n-heksana:etilasetat:metanol (1:3:6). (Kondisi KLT: plat KLT Silica gel G60F254, Visualisasi noda: 254 dan 366 nm).
Elusi dimulai dengan pelarut n-heksana, kemudian campuran dengan etil
asetat dan metanol serta diakhiri dengan pelarut air. Hasil pemisahan ekstrak
ditampung sebanyak 5 ml dalam tiap tabung reaksi. Hasil kolom dimonitor
dengan kromatografi lapis tipis (KLT) dengan menggunakan eluen terbaik yang
telah diperoleh yaitu n-heksana:etilasetat:metanol=1:3:6. Pengelompokan fraksi
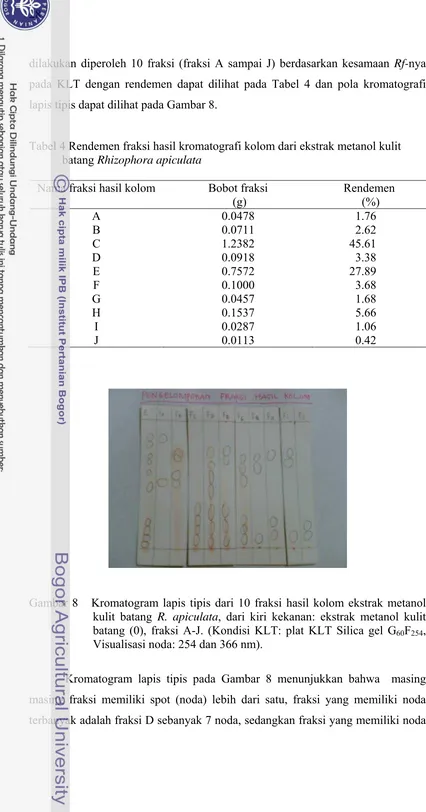
dilakukan diperoleh 10 fraksi (fraksi A sampai J) berdasarkan kesamaan Rf-nya
pada KLT dengan rendemen dapat dilihat pada Tabel 4 dan pola kromatografi
lapis tipis dapat dilihat pada Gambar 8.
Tabel 4 Rendemen fraksi hasil kromatografi kolom dari ekstrak metanol kulit batang Rhizophora apiculata
Nama fraksi hasil kolom Bobot fraksi (g)
Rendemen (%)
A 0.0478 1.76
B 0.0711 2.62
C 1.2382 45.61
D 0.0918 3.38
E 0.7572 27.89
F 0.1000 3.68
G 0.0457 1.68
H 0.1537 5.66
I 0.0287 1.06
J 0.0113 0.42
Gambar 8 Kromatogram lapis tipis dari 10 fraksi hasil kolom ekstrak metanol kulit batang R. apiculata, dari kiri kekanan: ekstrak metanol kulit batang (0), fraksi A-J. (Kondisi KLT: plat KLT Silica gel G60F254, Visualisasi noda: 254 dan 366 nm).
Kromatogram lapis tipis pada Gambar 8 menunjukkan bahwa masing
masing fraksi memiliki spot (noda) lebih dari satu, fraksi yang memiliki noda
sebanyak 2 adalah fraksi A dan J. fraksi lainnya juga rata-rata memiliki spot yang
lebih dari satu, maka dapat disimpulkan bahwa komponen fraksi hasil kolom
belum murni, sehingga diperlukan langkah pemisahan selanjutnya dengan
menggunakan kromatografi lapis tipis preparatif.
Aktivitas Inhibitor Tirosinase dan Antioksidan Fraksi Hasil
Kromatografi Kolom
Fraksi yang telah diperoleh dari hasil kromatografi kolom kemudian diuji
aktivitasnya sebagai inhibitor tirosinase dan antioksidan. Hal ini bertujuan untuk
melihat apakah potensi fraksi hasil kolom memiliki aktivitas yang sama dengan
ekstrak kasarnya dalam menghambat kerja enzim tirosinase, serta aktivitas
antioksidannya. Adapun hasil pengujian aktivitas inhibitor tirosinase dan
antioksidan terhadap 10 fraksi kolom yang diperoleh, dapat dilihat pada Tabel 5.
Tabel 5 Nilai IC50 inhibitor tirosinase (monofenolase dan difenolase) dan antioksidan pada fraksi hasil kromatografi kolom
Nama fraksi Inhibitor tirosinase (μgmL-1) Antioksidan (μgmL-1) Monofenolase difenolase Metode DPPH metode ABTS
A -* -* -** -**
Keterangan : IC50: konsentrasi ekstrak yang mampu menghambat aktivitas inhibitor tirosinase sebesar 50%; -* : tidak mencapai inhibisi 50% sampai konsentrasi maksimum 2000 μgmL-1. -**: : tidak mencapai inhibisi 50% sampai konsentrasi maksimum 166.67 μgmL-1.
Data pada Tabel 5 menunjukkan bahwa fraksi hasil kromatografi kolom
yang memiliki potensi yang paling baik dalam menghambat enzim tirosinase
μg/ml pada reaksi difenolase, hasil ini lebih rendah dibandingkan dengan kontrol positif asam kojat (IC50 monofenolase: 156.75 μg/ml, dan IC50 difenolase: 245.19 μg/ml). Bila dibandingkan dengan hasil penelitian yang dilakukan oleh Lopolisa (2010) yang juga menguji inhibitor tirosinase pada hasil fraksi kolom, ternyata
mengalami peningkatan aktivitas inhibitor tirosinase, hal ini mungkin disebabkan
karena komponen yang terkandung dalam ekstrak pekat metanol kulit batang lebih
banyak sehingga efek inhibisi yang dihasilkan juga lebih besar, sedangkan dalam
hasil fraksi kemungkinan komponen senyawanya telah terpisahkan sehingga efek
inhibisinya menurun.
Pada jalur difenolase, sebaliknya terjadi kenaikan nilai IC50, hal ini
disebabkan karena komponen senyawa yang telah terpisahkan memiliki efek
inhibisi yang lebih besar dibanding dengan ekstrak pekatnya. Fraksi lainnya yang
juga memiliki potensi pada jalur monofenolase dan difenolase adalah fraksi C, D,
dan F, tetapi nilai IC50 dari ketiga fraksi tersebut lebih kecil daripada fraksi B,
sedangkan fraksi E hanya memiliki aktivitas inhibitor tirosinase pada jalur
difenolase. Fraksi G, H, I, dan J tidak memiliki potensi dalam menghambat kerja
enzim tirosinase, jadi dapat disimpulkan bahwa kemampuan fraksi hasil kolom
sebagai inhibitor tirosinase sebesar 50% pada jalur monofenolase lebih rendah
dari ekstrak kasarnya, sedangkan pada jalur difenolase lebih tinggi dari ekstrak
kasarnya.
Data aktivitas antioksidan pada Tabel 5 menunjukkan bahwa fraksi hasil
kolom yang memiliki aktivitas antioksidan tertinggi dengan metode DPPH adalah
fraksi B dengan nilai IC50 sebesar 9.19 μg/ml. Nilai ini lebih rendah dibandingkan
ekstrak kasar metanol kulit batang yang memiliki IC50 sebesar 3.31 μg/ml. Hal ini
disebabkan karena komponen yang ada pada ekstrak kasar telah dipisahkan
sehingga efek inhibisi yang diperoleh juga lebih rendah. Fraksi lain yang juga
memiliki potensi yang baik adalah fraksi C, D dan E, tetapi memiliki nilai IC50
lebih rendah dari kontrol positif asam askorbat. Fraksi A, dan F-J tidak ada yang
memiliki inhibisi 50% hingga konsentrasi 166.67 μg/ml. Hal ini mengindikasikan
bahwa komponen senyawa yang ada dalam enam fraksi tersebut tidak memiliki
potensi sebagai antioksidan dalam menghambat pembentukan radikal bebas
Aktivitas antioksidan tertinggi dengan metode ABTS adalah fraksi B
dengan nilai IC50 sebesar 7.73 μg/ml. Nilai ini berarti lebih tinggi dari ekstrak
metanol kulit batang R. apiculata BL yang hanya dapat menangkap radikal bebas
ABTS 50% pada konsentrasi 18.47 μg/ml, dapat disimpulkan bahwa fraksi hasil
pemisahan dapat meningkatkan kemampuan fraksi dalam menghambat radikal
bebas ABTS. Fraksi lain yang juga memiliki nilai IC50 yang cukup bagus adalah
fraksi C dan E, fraksi D yang memiliki kemampuan dalam menghambat radikal
bebas DPPH ternyata tidak memiliki kemampuan dalam menghambat radikal
bebas ABTS sebesar 50% sampai konsentrasi 166.67 μg/ml, hal ini disebabkan
karena komponen dalam fraksi D hanya memiliki efek inhibisi yang kuat terhadap
radikal bebas ABTS.
Fraksinasi dengan Kromatografi Lapis Tipis Preparatif (KLTP)
Fraksi B sebagai fraksi teraktif berdasarkan aktivitas inhibitor tirosinase
dan antioksidan kemudian dimurnikan lebih lanjut dengan KLTP menggunakan
eluen kloroform:metanol (9:1), eluen ini berbeda dengan eluen yang digunakan
pada proses kromatografi kolom, karena pada profil KLT fraksi hasil kolom
diperoleh 4 spot untuk fraksi B, maka dilakukan pencarian eluen terbaik untuk
KLTP dengan menggunakan kombinasi beberapa eluen tunggal, agar diperoleh
proses pemisahan yang lebih bagus, maka diperoleh eluen terbaik seperti pada
Gambar 9.
Pada gambar tersebut nampak bahwa eluen kloroform:metanol (9:1)
memberikan pemisahan yang lebih bagus (spot yang lebih banyak) dibanding
eluen pada kromatografi kolom yaitu sebanyak 8 spot. Pengelompokan fraksi
hasil KLTP dapat dilihat pada Lampiran 11. Berdasarkan pemisahan yang
dilakukan diperoleh 9 fraksi (fraksi 1 sampai 9) berdasarkan kesamaan Rf-nya
pada KLT dengan rendemen dapat dilihat pada Tabel 6.
Tabel 6 Rendemen hasil fraksinasi dari fraksi B dengan menggunakan KLTP
Nama fraksi KLTP Bobot fraksi (g)
Berdasarkan pemisahan yang dilakukan diperoleh 9 fraksi (fraksi B1-B9).
Noda yang terbentuk dapat dilihat pada pola KLT fraksi hasil KLTP pada Gambar
10. Noda yang terbentuk dapat dideteksi dengan sinar UV pada panjang
gelombang 254 nm dan 366 nm.
Gambar 10 Kromatogram lapis tipis dari 9 fraksi hasil KLT preparatif, dari kiri
Aktivitas Inhibitor Tirosinase dan Antioksidan Fraksi Hasil Kromatografi
Lapis Tipis Preparatif (KLTP)
Fraksi yang telah diperoleh dari hasil pemisahan dengan menggunakan
KLTP kemudian masing-masing diuji aktivitas inhibitor tirosinase (monofenolase
dan difenolase) serta aktivitas antioksidannya. Hal ini bertujuan untuk melihat
potensi dari fraksi hasil KLTP dalam menghambat kerja enzim tirosinase serta
antioksidan. Adapun hasil pengujian aktivitas inhibitor tirosinase dan antioksidan
terhadap 9 fraksi KLTP yang diperoleh, dapat dilihat pada Tabel 7.
Tabel 7 Nilai IC50 inhibitor tirosinase (monofenolase dan difenolase) dan antioksidan pada fraksi hasil KLTP
Nama fraksi
KLTP Inhibitor tirosinase (μgmL-1) Antioksidan (μgmL-1)
monofenolase difenolase Metode DPPH
metode
Keterangan : IC50: konsentrasi ekstrak yang mampu menghambat aktivitas inhibitor tirosinase sebesar 50%; -* : tidak mencapai inhibisi 50% sampai konsentrasi maksimum 2000 μgmL-1. -**: : tidak mencapai inhibisi 50% sampai konsentrasi maksimum 166.67 μgmL-1.
Data pada Tabel 7 menunjukkan bahwa fraksi hasil kromatografi lapis
tipis preparatif (KLTP) yang memiliki potensi yang paling baik dalam
menghambat enzim tirosinase adalah fraksi B1 dengan nilai IC50: 1278.00 μg/ml
pada monofenolase dan IC50: 1678.20 μg/ml pada reaksi difenolase. Nilai IC50
fraksi B1 yang diperoleh pada jalur monofenolase dan difenolase lebih rendah