1 1.1. Latar Belakang
Ekosistem pesisir termasuk estuari merupakan wilayah yang kompleks dan rentan mengalami penurunan kualitas lingkungannya karena banyaknya masukan materi dari wilayah daratan dengan berbagai aktifitasnya. Balikpapan, Kalimantan Timur, merupakan salah satu kota pesisir di Indonesia yang memiliki beberapa muara sungai dengan berbagai ragam ciri dan kegiatan wilayah seperti komunitas mangrove, dan aktifitas pelabuhan yang mendapat perhatian Pemerintah Daerah dalam upaya pengembangan sumberdaya khususnya di sekitar Sungai Somber. Materi sisa kegiatan yang masuk ke sungai akan terakumulasi dan terendapkan di sedimen estuari dalam kurun waktu yang cukup lama. Bahan organik di sedimen akan mengalami degradasi yang dapat mempengaruhi kualitas perairan dan mengakibatkan pencemaran apabila penambahan bahan organik yang
terakumulasi melebihi dari kapasitas asimilasi perairan muara. Sumber bahan organik dapat berasal dari dalam perairan (autochthonous) dan dari luar perairan (allochthonous). Secara umum karakter kedua sumber dapat dibedakan dengan mempelajari komponen lipid yang ada dalam sedimen estuari.
Lipid yang dihasilkan oleh organisme hidup plankton adalah C28 dan C27, dan sterol cholest-5-en-3βol, bakteri memproduksi nC18:1ω7 (cis-asam vasenat), sedangkan hewan, tanaman tinggi dan algae menghasilkan nC18:1ω9 (asam oleat). Oleh sebab itu, lipid biomarker dapat digunakan untuk menduga sumber bahan organik dan sebagai indikator sumber pencemaran pada suatu perairan. Lipid biomarker juga dapat digunakan untuk menduga tingkat masukan dari akuatik, terestrial dan antropogenik (Parrish et al., 2000).
Lipid yang memiliki persistensi tinggi akan terendap dalam waktu yang lama pada sedimen. Semua materi yang berada di kolom air juga akan mengendap pada sedimen baik dalam jangka waktu yang singkat maupun dalam jangka waktu yang lama. Oleh sebab itu, sedimen baik digunakan dalam studi karakteristik lipid biomarker. Memperhatikan potensi endapan bahan organik termasuk lipid yang dapat mengganggu lingkungan perairan dari kemungkinan pengembangan aktifitas sungai Somber, penelitian tentang karakteristik asam lemak dan fraksi polar perlu dilakukan.
1.2. Tujuan
3 2.1. Kondisi Umum Lokasi Penelitian
Teluk Balikpapan memiliki luas daerah aliran sungai (DAS) 211.456 hektar dan perairan seluas 16.000 hektar. DAS Teluk Balikpapan memiliki peranan yang cukup penting dan strategis, di antaranya sebagai penyangga kesinambungan fungsi teluk tersebut sebagai pelabuhan laut Balikpapan dan sumber penghasilan masyarakat di sekitarnya serta kehidupan ekosistem perairan kawasan teluk. Sebanyak 54 sub-DAS menginduk di wilayah teluk ini, termasuk salah satunya adalah DAS Sei Wain yang sudah menjadi hutan lindung yang dikenal dengan Hutan Lindung Sungai Wain. Sungai Somber merupakan pertemuan antara bagian hulu dan hilir Sungai Wain yang digunakan sebagai sarana transportasi laut yaitu jalan kapal ferry menuju Teluk Balikpapan ke arah Penajam (Sarminah, 2003).
Sepanjang kiri dan kanan Sungai Somber merupakan dataran rendah dan pada bagian hulu sungai merupakan bukit. Sisi barat laut (kanan menuju hulu) dan sisi tenggara Sungai Somber umumnya masih berupa hutan bakau. Bagian
2.2. n-Alkanol
Alkanol atau alkil atau aril (sikloalkil) alkohol merupakan senyawa monohidroksi turunan dari alkana, dimana salah satu atom H diganti dengan gugus hidroksi (OH). Alkohol memiliki suatu gugus hidroksil yang terikat pada suatu atom karbon jenuh (struktur molekuler alkanol dapat dilihat pada Gambar 1). Atom karbon dapat berupa gugus alkenil atau gugus alkunil, atau dapat pula berupa suatu atom karbon jenuh dari suatu cincin benzena. Biomarker n-alkanol dapat digunakan untuk melihat sumber bahan organik yang berasal dari akuatik dan terestrial. Rantai karbon pendek (≤20) dan panjang (>20) n-alkanol umumnya didominasi oleh rantai karbon genap. Hal tersebut dapat dilihat dari nilai CPI pada n-alkanol > 1 (Gogou et al., 1998).
Gambar 1. Contoh struktur molekuler n-Alkanol
Rantai karbon pendek (≤ 20) umumnya berasal dari organisme akuatik
(Duan, 2000). Rantai karbon panjang (>20) umumnya mengindikasikan adanya masukan bahan organik dari komponen lilin (waxes)tumbuhan tingkat tinggi dari terestrial, namun ada juga yang berasal dari akuatik (Madureira & Piccinini, 1999; Duan, 2000; Yunker et al., 2005; Bechtel & Schubert, 2009).
Nilai TAROH n-alkanol <1 menunjukkan sumber yang berasal dari akuatik (autotonus) memiliki kontribusi relatif lebih besar daripada sumber yang berasal dari terestrial (alotonus). Sebaliknya, nilai TAROH >1 mengindikasikan sumber yang berasal dari terestrial memiliki kontribusi relatif lebih besar (Meyers, 1997).
n- tetradekanol (nC14)
2.3. Sterol
Sterol atau biasa disebut steroid alkohol (struktur molekuler steroid dapat dilihat pada Gambar 2) (Millero & Sohn, 1992; Killops & Killops, 1993) adalah senyawa biomarker yang potensial karena stabilitas dan keanekaragaman
strukturnya (Parrish et al., 2000). Sterol adalah bagian yang penting dari senyawa organik dan seringkali berfungsi sebagai nukleus. Salah satu jenis sterol, yakni kolesterol mempunyai peranan yang vital bagi fungsi-fungsi selular dan menjadi substrat awal bagi vitamin yang larut dalam lemak dan hormon steroid. Sterol dapat dibagi menjadi dua kelompok yaitu stanol (alkohol saturasi) dan stenol (alkohol unsaturasi) (Killops & Killops, 1993).
Gambar 2. Struktur molekuler steroid (Killops & Killops, 1993) Sterol dapat berasosiasi dengan bahan partikulat tersuspensi dan
hewan), β-sitosterol C29 (tumbuhan tingkat tinggi), brassicasterol (diatom), dinosterol C30 (dinoflagellata) dan fucosterol (alga cokelat) (Killops & Killops, 1993).
Mikroalga memiliki keanekaragaman sterol yang besar (Killops & Killops, 1993). Diatom berfungsi sebagai sumber bahan organik pada sistem laut yang terlihat pada distribusi sterol yang komplek dan bervariasi dalam sedimen (Killops & Killops, 1993). 24-Methylenecholesterol dapat digunakan sebagai marker pada diatom (Parrish et al., 2000).
Tingginya rasio coprostanol/ cholesterol dapat mengidentifikasikan tingginya limbah domestik air tawar (Parrish et al., 2000). Faecal sterol seperti coprostanol dan epicoprostanol dapat digunakan sebagai marker limbah manusia karena dapat hadir pada feses manusia (Martins et al., 2007). Perairan yang telah terkontaminasi oleh limbah domestik dapat dilihat dari nilai konsentrasi
coprostanol, yaitu lebih dari 1 ng.g-1 (Martins et al., 2007). 2.4. Asam Lemak
Asam lemak merupakan sekelompok senyawa hidrokarbon yang memiliki rantai panjang dengan gugus karboksilat pada ujungnya (Rusdiana, 2004). Asam lemak merupakan asam lemah, yang di dalam air akan terdisosiasi sebagian. Umumnya asam lemak berfase cair atau padat pada suhu ruang (27 °C). Semakin panjang rantai karbon penyusunnya, semakin mudah membeku dan juga semakin sukar larut. Asam lemak dapat bereaksi dengan senyawa lain membentuk
penyusun fosfolipid dan glikolipid, asam lemak memodifikasi protein melalui ikatan kovalen asam lemak dan menempatkan protein-protein tersebut ke lokasi-lokasinya pada membran, asam lemak sebagai molekul bahan bakar, asam lemak sebagai hormon dan cakra intrasel (Rusdiana, 2004).
Asam lemak dapat digunakan sebagai biomarker karena variasinya dalam organisme berbeda dan kestabilan kimianya yang diikuti ketahanannya (persisten) dalam periode waktu geologi (Millero & Sohn, 1992). Asam lemak didominasi oleh nomor atom genap dengan rantai lurus jenuh (struktur molekuler asam lemak jenuh dapat dilihat pada Gambar 3), mempunyai ciri panjang rantai C12 hingga C36 (Killops & Killops, 1993).. Sumber asam lemak berasal dari bakteri, mikroalga, tanaman tingkat tinggi dan hewan laut (misal : zooplankton) (Killops & Killops, 1993). Rantai panjang (>C20) asam lemak saturasi sering melimpah dalam wax
epikutikula pada tanaman tingkat tinggi dan tidak melimpah pada seagrass
(Volkman et al., 2008).
Gambar 3. Struktur molekuler asam lemak jenuh (saturasi) Asam lemak tak jenuh (unsaturasi) dengan karbon 16 dan 18 sebagian besar ditemukan pada organisme akuatik (Millero & Sohn, 1992; Killops & Killops, 1993). Asam lemak dengan nomor karbon ganjil nC15:1ω6dan nC17:1ω8 berasal dari bakteri yang diproduksi secara biosintesis anaerob (Killops & Killops,
Asam Pentadekanoat (nC15)
OH
C
1993). Beberapa contoh struktur molekuler asam lemak unsaturasi dapat dilihat pada Gambar 4.
Gambar 4. Struktur molekuler asam lemak polyunsaturasi (Berge & Barnathan, 2005 in Nugraha, 2011)
Asam lemak dengan berat molekul rendah (volatil) (<C5) juga hadir dalam perairan alami dan sedimen dan dihasilkan dari degradasi bahan organik oleh mikroba (Millero & Sohn, 1992). Posisi ikatan ganda dari asam lemak
polyunsaturasi/ PUFAs (Polyunsaturated Fatty Acids) dapat digunakan untuk mengidentifikasi sumber organisme (Killops & Killops, 1993). Asam lemak polyunsaturasi umumnya ditemukan pada alga dan tanaman tinggi (Killops & Killops, 1993). Asam lemak bercabang ditemukan pada organisme spesifik, sehingga baik digunakan sebagai biomarker (Millero & Sohn, 1992). Kehadiran asam lemak bercabang mengindikasikan biomassa dari bakteri. Beberapa contoh struktur molekuler asam lemak bercabang dapat dilihat pada Gambar 5.
Gambar 5. Struktur molekuler asam lemak bercabang (Killops & Killops, 1993)
iso-C15
anteiso-C15
O OH
2.5. Sedimen
Menurut Friedman dan Sanders (1978 in Apriadi, 2005) sedimen berasal dari kerak bumi yang diangkut melalui proses hidrologi dari suatu tempat ke tempat lain, baik secara vertikal ataupun horizontal.Sedimen laut dangkal pada
wilayah pesisir (khususnya estuari) merupakan “storage system” berbagai unsur
dan senyawa kimia. Proses fisik, kimia dan biologi yang terjadi di dalam kolom air akan mempengaruhi komposisi dan kualitas sedimen.
Sedimen terdiri dari bahan organik dan bahan anorganik. Bahan organik berasal dari biota atau tumbuhan yang membusuk lalu tenggelam ke dasar dan bercampur dengan lumpur. Bahan anorganik umumnya berasal dari pelapukan batuan. Butiran kasar banyak dijumpai dekat pantai, sedangkan butiran halus banyak di perairan dalam dan relatif tenang (Apriadi, 2005). Sedimen di dasar laut berasal dari berbagai sumber materi (Wibisono, 2005; Sanusi, 2006), yaitu:
1. Sedimen Lithogenous
Sedimen lithogenous berasal dari pelapukan (weathering) batuan dari daratan yang terbawa oleh aliran sungai (fluvial transport) dan angin (aeolian
transport) yang masuk ke lingkungan laut. 2. Sedimen Hydrogenous
Sedimen hydrogenous adalah sedimen yang terbentuk akibat proses
pengendapan atau mineralisasi elemen-elemen kimia yang terlarut dalam air laut.
3. Sedimen Biogenous
Ca, Mg (calcareous) dan Si (siliceous), selain mineral celesite (SrSO4) dan
barite (BaSO4).
4. Sedimen Cosmogenous
Sedimen cosmogenous adalah sedimen yang berasal dari luar angkasa yang ditemukan di dasar laut. Partikel-partikel sedimen ini banyak mengandung unsur besi sehingga mempunyai respon magnetik.
Sedimen mengalami proses diagenesis, yaitu proses fisika, kimia dan biologi yang secara umum mengubah sedimen menjadi batuan sedimen. Setelah sedimen menjadi batuan, proses diagenesis dapat terus berlangsung, mengubah tekstur dan mineraloginya. Menurut Peters dan Moldowan (1993 in Pohan, 2012) diagenesis merupakan perubahan yang terjadi secara biologi, fisika, dan kimia pada bahan organik dalam sedimen khususnya perubahan signifikan akibat bahang (heat). Diagenesis sedimen dipengaruhi oleh beberapa faktor, yaitu perubahan fisik lingkungan (peningkatan penimbunan, suhu, dan tekanan), kimiawi
(kandungan oksigen, mineral, dan potensi redoks), dan biologi (aktifitas bakteri, jenis bakteri) (Pohan, 2012).
Sedimen muara (estuari) merupakan tempat mengendap dan
2.6. Kromatografi Gas – Spektrometri Massa (GC-MS)
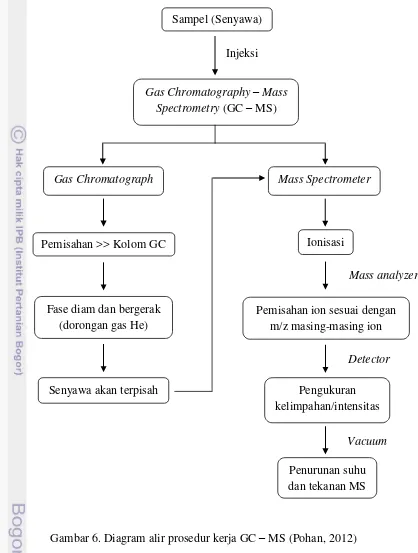
GC-MS adalah singkatan dari Gas Chromatography – Mass Spectrometry. GC-MS (diagram alir prosedur kerja GC – MS dapat dilihat pada Gambar 6) merupakan suatu metode yang mengkombinasikan kromatografi gas dan
spektrometri massa untuk mengidentifikasi senyawa yang berbeda dalam analisis sampel. Kromatografi gas merupakan metode pemisahan dan pengukuran yang berdasarkan pada perbedaan distribusi komponen-komponen dalam sampel. Spektrometri massa merupakan metode analisis berdasarkan pengukuran terhadap massa ion-ion gas yang dikonversi dari sampel.
Kromatografi gas menggunakan kolom yang tergantung pada sifat fase dan dimensi kolom itu (panjang, diameter, ketebalan film). Perbedaan sifat kimia antara molekul-molekul yang berbeda dalam suatu campuran dipisahkan dari molekul dengan melewatkan sampel sepanjang kolom. Molekul-molekul
memerlukan jumlah waktu yang berbeda (disebut waktu retensi) untuk keluar dari kromatografi gas. Spektrometer massa melakukan hal ini dengan memecah masing-masing molekul menjadi terionisasi mendeteksi fragmen menggunakan massa untuk mengisi rasio. Komponen dalam kromatografi akan terdistribusi dalam dua fase, yaitu menggunakan zat padat atau zat cair sebagai fase diam dan gas sebagai fase bergerak (Khopkar, 2003).
Gambar 6. Diagram alir prosedur kerja GC – MS (Pohan, 2012) Sampel (Senyawa)
Penurunan suhu dan tekanan MS
Gas Chromatography – Mass Spectrometry (GC – MS)
Pengukuran kelimpahan/intensitas Senyawa akan terpisah
Gas Chromatograph
Pemisahan >> Kolom GC
Pemisahan ion sesuai dengan m/z masing-masing ion Fase diam dan bergerak
(dorongan gas He)
Ionisasi
Mass Spectrometer
Injeksi
Mass analyzer
Detector
13
3.1. Waktu dan Tempat Pengambilan Contoh Sedimen
Lokasi pengambilan contoh sedimen secara geografi berada pada 1º12’30’’LS-1º13’30’’LS dan 116º49’30’’BT-116º51’00’’BT. Contoh sedimen diambil di Muara Sungai Somber, Balikpapan, Kalimantan Timur pada tanggal 27 Januari 2011 sebagai bagian dari kajian Studi Dinamika dan Daya Dukung
Ekosistem Sungai Somber Teluk Balikpapan, Kalimantan Timur. Pengambilan contoh sedimen dilakukan pada dua titik di Sungai Somber bagian hulu dan muara yang berjarak kurang lebih 2,14 kilometer seperti ditampilkan pada Gambar 7. Contoh sedimen yang telah tersedia dianalisis di Pusat Laboratorium Terpadu Universitas Islam Negeri (UIN) Syarif Hidayatullah, Tangerang.
Gambar 7. Peta lokasi pengambilan contoh sedimen di Muara Sungai Somber, Balikpapan, Kalimantan Timur
Kutai
T
eluk
B
a
lik
pa
pa
n
Sungai Sei Wein
1 2 LS
3.2. Bahan dan Alat Penelitian 3.2.1. Contoh sedimen
Contoh sedimen yang berasal dari muara Sungai Somber dikeringkan menggunakan alat freeze-dryer (24 jam) dan dihomogenkan dengan cara disaring menggunakan saringan dengan mesh size 250 µm.
3.2.2. Peralatan laboratorium
Peralatan penelitian yang terdiri atas gelas erlenmeyer, gelas ukur, soxhlet, gelas beaker, corong pemisah, labu bulat, kolom kromatografi, pipet tetes, dan gelas vialdicuci dengan sabun teepol dan dibilas dengan air. Peralatan
dikeringkan dengan cara diletakkan di rak selama beberapa menit agar air yang tersisa di dalam peralatan menguap. Selanjutnya, peralatan dimasukan ke dalam oven (80 °C) selama 24 jam. Setelah kering, peralatan dibilas dengan methanol (MeOH), diklorometana (DCM) dan n-Heksana secara berurutan (Prartono, 1995). Selanjutnya, peralatan dibungkus dengan aluminium foil, disimpan dan siap
digunakan. Di samping itu, juga digunakan peralatan lain seperti stirrer untuk hidrolisis, Rotary Evaporator untuk penguapan, dan Gas Chromatography – Mass Spectrometry (GC – MS) untuk identifikasi.
3.2.3. Pelarut organik
3.2.4. Pereaksi
a. Anhydrous sodium sulfat
Anhydrous sodium sulfat dibilas dengan DCM. Selanjutnya, diaktivasi (500 °C; 4 jam) menggunakan oven. Kemudian didinginkan pada desikator dan disimpan hingga akan digunakan (Prartono, 1995).
b. Bubuk tembaga aktif
Tembaga aktif disiapkan menurut prosedur dari Blumer (1957) dalam
Prartono (1995). Tembaga (II) sulfat seberat 45 g dilarutkan dalam 500 ml akuades dan ditambahkan Hydrochloric Acid (2 M; 20 ml). Bubuk seng seberat 15 g dilarutkan dalam 25 ml akuades. Selanjutnya, larutan seng dimasukkan dalam larutan tembaga (II) sulfat secara perlahan kemudian diaduk hingga terbentuk endapan tembaga dari warna merah hingga merah kecokelatan.
Kemudian cairan di permukaan dibuang. Endapan tembaga dibilas dengan DCM dan n-Heksana.
3.2.5. Silika gel 60 (ukuran partikel 0,040 – 0,063 mm)
Silika gel (8 g) dimurnikan melalui proses ekstraksi menggunakan alat soxhlet (6 jam) dengan campuran n-Heksana - MeOH (1:1) sebanyak 120 ml. Kemudian dikeringkan dan dibungkus dengan aluminium foil. Aluminium foil yang berisi silika dipanaskan dalam oven (500 °C; 1 jam). Berikutnya, suhu diturunkan secara bertahap menjadi 150 °C hingga 120 °C, kemudian disimpan dalam desikator selama 30 menit. Silika gel yang digunakan pada kolom
Jumlah akuades (5%) yang ditambahkan berdasarkan persamaan (1) dan (2) berikut :
Wt = Ws
0,95
Wh = Wt - Ws
dimana :
Wt = total (berat SiO2 + H2O)
Ws = berat SiO2
Wh = berat H2O yang ditambahkan 3.3. Prosedur Analisis
a. Ekstraksi sedimen, pemisahan fraksi netral dan asam
Contoh sedimen yang telah kering ditimbang sebanyak 10 g kemudian diekstraksi dengan 120 ml pelarut campuran (1:1) DCM dan MeOH menggunakan soxhlet selama 24 jam. Hasil ekstraksi diuapkan menggunakan rotary evaporator
hingga tersisa ekstrak kurang lebih 2 ml kemudian dihidrolisis dengan 6% KOH dalam MeOH (30 ml; 12 jam) (Prartono, 1995).
Fraksi netral didapat melalui ekstraksi dengan n-heksana (3x30 ml). Residu diuapkan dan dicampur dengan akuades (25 ml) yang sebelumnya telah disterilisasi dengan DCM (25 ml). Campuran diasamkan dengan 6 N HCl hingga pH menjadi 2 kemudian diekstraksi dengan DCM (3x30 ml) untuk mendapatkan fraksi asam. Selanjutnya, fraksi asam diuapkan menggunakan rotary evaporator
hingga diperoleh kurang lebih 2 ml dan dimasukkan dalam gelas vial. Sampel diderivatisasi melalui sililasi dengan bis-(trimetilsilil)-trifluoroacetamida (BSTFA
... (1)
(Sigma- Aldrich); 50 µl; 80 °C; 10 menit) sebelum dianalisis dengan GC-MS (Prartono, 1995).
b. Fraksinasi senyawa polar
Fraksi netral dimasukkan ke kolom kromatografi yang telah terisi silika gel (5% dideaktivasi silika; 8 g) untuk mendapatkan fraksi polar. Fraksi yang diperoleh adalah : (I) fraksi alifatik diperoleh dengan mengelut kolom dengan 50 ml n-Heksana, (II) fraksi aromatik diperoleh dengan mengelut campuran 20 ml dari n-Heksana : DCM (9 : 1) diikuti oleh 60 ml campuran n-Heksana : DCM (1 : 1) dan (III) fraksi polar diperoleh dengan mengelut campuran 25 ml dari 25% etil asetat dalam n-Heksana. Hasil tiap fraksi diuapkan menggunakan rotary
evaporator hingga diperoleh kurang lebih 2 ml dan dimasukkan ke dalam gelas vial. Selanjutnya, sampel diuapkan dengan nitrogen hingga kering. Pelarut
n-heksana (0,5 ml) ditambahkan ke dalam gelas vial bila akan dianalisis dengan GC-MS. Penelitian ini hanya menganalisis fraksi polar, sedangkan fraksi alifatik dan aromatik dilakukan oleh peneliti lain. Fraksi polar diderivatisasi melalui sililasi (BSTFA; 50 µl; 80°C; 10 menit) sebelum dianalisis dengan GC-MS (Prartono, 1995; Martins et al., 2007).
c. Analisis kromatografi gas – spektrometri massa (GC-MS)
pada 300 °C selama 20 menit. Kondisi GC-MS adalah ionisasi potensial/ electron energy 70eV, ion source temperature 230 °C dan interface temperature 250°C.
Full mass data dicatat antara 45–600 Dalton setiap detik. Data dicatat dan dianalisis menggunakan perangkat lunak GCMS Real Time Analysis dan GCMS
Postrun Analysis.
d. Identifikasi asam lemak dan fraksi polar
Asam lemak dan fraksi polar diidentifikasi dan dihitung menggunakan kromatografi gas dan kromatografi gas–spektrometri massa. Identifikasi dilakukan dengan membandingkan indeks relative retention dan mass spectra
dengan data literatur.
Asam lemak pada sampel sedimen dideteksi berdasarkan intensitas dari spektra utama (base peak) m/z 117, n-alkanol dengan m/z 75, Isoprenoid phytol dengan m/z 143, dihidrophytol dengan m/z 57 dan 355, dan asam phytanoat dengan m/z 73 dan 159, selanjutnya diidentifikasi spektra massanya (spektra massa dapat dilihat pada Lampiran 2, Lampiran 5, dan Lampiran 8). Sterol dideteksi berdasarkan intensitas dari beberapa spektra utama seperti coprostanol, epicoprostanol, cholestanol dengan m/z 215 dan 460, stigmastanol dengan m/z 215 dan 488, sitosterol dengan m/z 396 dan 486, stigmasterol dengan m/z 129 dan 394, campesterol dengan m/z 129 dan 472, brassicasterol dengan m/z 129, dan cholesterol dengan m/z 129 dan 458, selanjutnya diidentifikasi spektra massanya. e. Penentuan nomor karbon
bernilai 14 (CH2) satuan massa. Secara sederhana dituliskan dengan persamaan (3) dan (4) sebagai berikut:
n-alkanol :
dimana: x = nomor karbon
[M+ - 15] = molekuler based peak - 15
75 = ion target n-alkanol / ion based peak
14 = berat molekul CH2
n-asam alkanoat/fatty acid :
dimana:
x = nomor karbon
[M+ - 15] = molekuler based peak - 15
117 = ion target n-asam alkanoat/fatty acid - ionic based peak
14 = berat molekul CH2 f. Perhitungan parameter molekuler
Nilai Carbon Preference Index (CPI) untuk n-asam alkanoat/ FA dan
n-alkanol/ OH dihitung dengan persamaan (5) dan (6) berikut (Prartono, 1995; Silva
et al., 2008).
……….…… (3)
………..……….….... (4)
[M
+- 15] - 75
14
Cx =[M
+- 15] - 117
14
n-asam alkanoat dan n-alkanol :
[∑ ∑
∑
∑ ]
[∑ ∑
∑
∑ ]
Untuk menginterpretasikan dominasi terestrial versus akuatik digunakan
terestrial to aquatic ratio (TAR) (Meyers, 1997; Lu & Meyers, 2009) dengan persamaan (7) sebagai berikut :
TARFA / OH=
C24 + C26 + C28 C12 + C14 + C16
Untuk melihat adanya dominasi masukan dari autotonus/ akuatik atau alotonus/ terestrial secara relatif pada sterol digunakan rasio cholesterol (C27Δ5)/ sitosterol (C29Δ5) (Mater et al., 2004).
.. (5)
.. (6)
21 4.1. Asam Lemak
a. Asam lemak saturasi
Identifikasi asam lemak dilakukan berdasarkan hasil kromatogram senyawa asam lemak yang telah direkam selama 50 menit. Karakteristik asam lemak yang muncul pada spektra massa dicirikan dengan nilai spektra utama (base peak) m/z 117. Selain itu juga dilihat nilai bobot molekul senyawa asam lemak untuk menentukan nomor karbon senyawa asam lemak.
menunjukkan bahwa sebaran asam lemak saturasi didominasi oleh rantai karbon genap.
Gambar 8. Karakteristik sebaran asam lemak saturasi (n-asam alkanoat) pada sedimen bagian hilir/muara (Stasiun 1) Sungai Somber, Balikpapan, Kalimantan Timur
Rantai karbon panjang (>20) yang terdeteksi pada sedimen di bagian hulu dan muara Sungai Somber berkisar antara nC21 sampai nC34 mengindikasikan adanya masukan bahan organik dari tumbuhan tingkat tinggi (Madureira & Piccinini, 1999). Pada kasus di Muara Sungai Somber diduga tanaman tingkat tinggi yang dominan berasal dari mangrove, karena di sekitar Sungai Somber banyak ditemukan daerah yang ditumbuhi vegetasi mangrove. Rantai karbon pendek nC10-nC20 yang terdeteksi mengidentifikasikan adanya masukan bahan organik dari plankton dan bakteri (Duan, 2000). Buangan limbah rumah tangga akibat aktivitas permukimam masyarakat di sekitar Sungai Somber diduga sebagai salah satu penyebab masukan bakteri ke dalam Sungai Somber.
Rasio rantai karbon panjang terhadap rantai karbon pendek digunakan untuk menduga kontribusi dari komponen autotonus (akuatik) dan allotonus (terestrial) dengan menghitung nilai TARFA (Muri et al., 2004). Nilai TARFA yang diperoleh pada sedimen Muara Sungai Somber adalah <1, yaitu pada bagian muara dan hulu berturut-turut adalah 0,164 dan 0,948 (Lampiran 4). Hal ini menunjukkan bahwa masukan bahan organik dari akuatik pada sedimen Muara Sungai Somber lebih besar jika dibandingkan dengan masukan yang berasal dari terestrial (Meyers, 1997).
Asam lemak saturasi pada bagian muara dan hulu Sungai Somber
dibandingkan dengan daerah muara estuari. Sedimen Sungai Somber bagian muara dan hulu lebih didominasi masukan dari akuatik daripada terestrial. Tingginya aktivitas pertanian dan permukimam masyarakat di sekitar Sungai Somber menyebabkan tingginya masukan nutrient. Hal ini dapat dilihat dari terdeteksinya rantai karbon pendek yang dominan pada bagian muara dan hilir Sungai Somber yang merupakan sumber dari akuatik. Namun, rantai karbon panjang juga terdeteksi pada sedimen Sungai Somber yang mengindikasikan adanya masukan bahan organik dari tumbuhan tingkat tinggi. Pada kasus Sungai Somber diduga berasal dari pohon bakau karena sisi tenggara dan barat laut Sungai Somber masih berupa hutan bakau (BPMPPT, 2011).
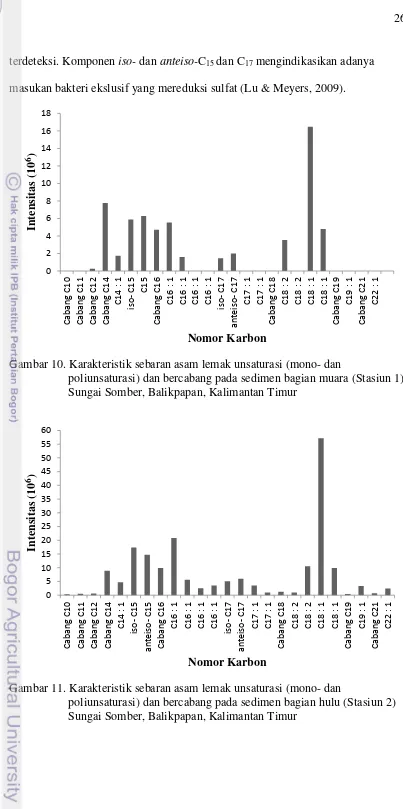
b. Asam lemak unsaturasi dan bercabang (iso- dan anteiso-)
Karakteristik sebaran asam lemak tidak jenuh (unsaturasi) telah terdeteksi pada sedimen di bagian muara dan hulu Sungai Somber. Asam lemak unsaturasi memiliki rantai yang lebih panjang daripada asam lemak jenuh dan memiliki ikatan rangkap. Asam lemak unsaturasi dengan nomor karbon nC16 dan nC18 sebagian besar ditemukan pada organisme akuatik (Millero & Sohn, 1992; Killops & Killops, 1993).
Asam lemak monounsaturasi (memiliki satu ikatan rangkap) yang terdeteksi pada sedimen bagian muara dan hulu Sungai Somber berkisar antara
nC14:1 sampai nC22:1 (Gambar 10 dan 11) dengan kisaran nilai intensitas pada bagian muara dan hulu berturut-turut (1,592-16,477)x106 dan (0,942-57,129)x106 yang didominasi oleh nC18:1. Komponen asam lemak monounsaturasi nC16:1 dan
memiliki konsentrasi tertinggi kedua setelah nC18:1 yang mengindikasikan adanya masukan dari diatom (Azevedo 2003). Menurut Azevedo (2003), asam lemak unsaturasi nC18:1 yang dominan dengan beberapa nC16:1 dan nC20:1 merupakan indikator biogenesis muda. Oleh karena itu, kehadiran asam lemak unsaturasi pada sedimen Sungai Somber bagian muara dan hulu diduga relatif masih baru. Selain itu, asam lemak rantai karbon panjang dan asam lemak saturasi pada sedimen lebih stabil dibandingkan dengan asam lemak rantai karbon pendek dan asam lemak unsaturasi (Duan, 2000). Gogou et al. (1998) dan Muri et al. (2004) juga menyatakan bahwa asam lemak unsaturasi relatif lebih mudah didegradasi oleh bakteri daripada asam lemak saturasi.
Asam lemak poliunsaturasi (memiliki dua atau lebih ikatan rangkap) yang terdeteksi yaitu nC18:2 dengan nilai intensitas pada bagian muara 3,543x106 dan pada bagian hulu (1,019 dan 10,536)x106. Komponen nC18:2 yang terdeteksi pada sedimen Sungai Somber mengindikasikan adanya masukan dari alga
(fitoplankton), zooplankton, dan cyanobakteri (Yunker et al. 2005; Bechtel & Schubert 2009).
terdeteksi. Komponen iso- dan anteiso-C15 dan C17 mengindikasikan adanya masukan bakteri ekslusif yang mereduksi sulfat (Lu & Meyers, 2009).
Gambar 10. Karakteristik sebaran asam lemak unsaturasi (mono- dan
poliunsaturasi) dan bercabang pada sedimen bagian muara (Stasiun 1) Sungai Somber, Balikpapan, Kalimantan Timur
Gambar 11. Karakteristik sebaran asam lemak unsaturasi (mono- dan
poliunsaturasi) dan bercabang pada sedimen bagian hulu (Stasiun 2) Sungai Somber, Balikpapan, Kalimantan Timur
Asam lemak unsaturasi (mono- dan poliunsaturasi) dan bercabang (iso- dan anteiso-) pada bagian muara dan hulu Sungai Somber tidak memiliki perbedaan yang signifikan. Hal ini diduga karena aktivitas daratan dan sekitar estuari hampir sama sehingga kontribusi masukan bahan organik ke dalam Sungai Somber juga hampir sama. Secara umum, masukan asam lemak unsaturasi dan bercabang di Sungai Somber bagian muara dan hilir berasal dari akuatik.
Tingginya aktivitas permukiman masyarakat sekitar Sungai Somber menyebabkan tingginya masukan antropogenik berupa limbah buangan manusia. Kondisi ini menyebabkan tingginya aktivitas bakteri di Sungai Somber yang diperkuat dengan terdeteksinya asam lemak bercabang yang merupakan sumber dari bakteri. Selain itu, tingginya aktivitas pertanian dan permukiman di sekitar Sungai Somber juga menyebabkan meningkatnya kandungan nutrient yang dapat mempengaruhi pertumbuhan fitoplankton. Hal ini dapat dilihat dari komponen nC16:1, nC18:2,
nC18:1 yang terdeteksi pada sedimen Sungai Somber bagian muara dan hulu. 4.2. n-Alkanol
Identifikasi n-alkanol dilakukan berdasarkan hasil kromatogram senyawa
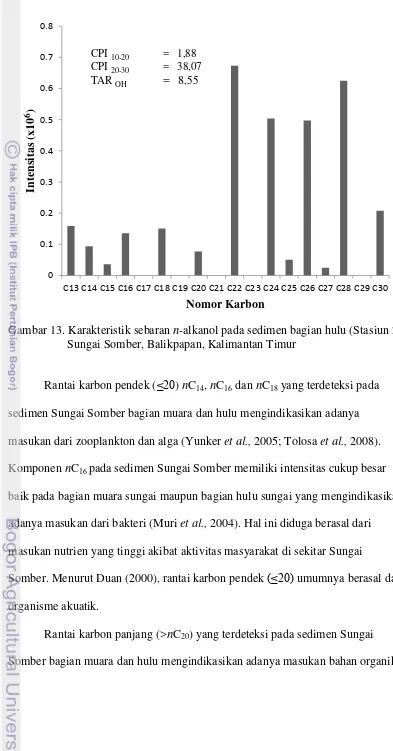
n-alkanol yang telah direkam selama 50 menit. Karakteristik n-alkanol yang muncul pada spektra massa dicirikan dengan nilai spektra utama m/z 75. Selain itu juga dilihat nilai bobot molekul senyawa n-alkanol untuk menentukan nomor karbon senyawa n-alkanol.
pada bagian hulu sungai adalah 1,882 dan 38,067, sedangkan pada bagian muara sungai rantai karbon ganjil tidak terdeteksi sehingga nilai CPI10-20 dan CPI20-30 juga tidak terdeteksi. Bagian hulu Sungai Somber menunjukkan rantai karbon genap lebih dominan daripada rantai karbon ganjil baik pada rantai karbon pendek (≤20) dan panjang (>20). Hal tersebut berdasarkan nilai CPI10-20 dan CPI20-30 bagian hulu, dimana nilai CPI > 1 menunjukkan adanya dominasi nomor karbon genap (Gogou et al., 1998). Bagian muara sungai juga didominasi oleh rantai karbon genap karena rantai karbon ganjil tidak terdeteksi.
Gambar 12. Karakteristik sebaran n-alkanol pada sedimen bagian muara (Stasiun 1) Sungai Somber, Balikpapan, Kalimantan Timur
0
C13 C14 C15 C16 C17 C18 C19 C20 C21 C22 C23 C24 C25 C26 C27 C28 C29 C30
Gambar 13. Karakteristik sebaran n-alkanol pada sedimen bagian hulu (Stasiun 2) Sungai Somber, Balikpapan, Kalimantan Timur
Rantai karbon pendek (≤20) nC14, nC16 dan nC18 yang terdeteksi pada sedimen Sungai Somber bagian muara dan hulu mengindikasikan adanya masukan dari zooplankton dan alga (Yunker et al., 2005; Tolosa et al., 2008). Komponen nC16 pada sedimen Sungai Somber memiliki intensitas cukup besar baik pada bagian muara sungai maupun bagian hulu sungai yang mengindikasikan adanya masukan dari bakteri (Muri et al., 2004). Hal ini diduga berasal dari masukan nutrien yang tinggi akibat aktivitas masyarakat di sekitar Sungai
Somber. Menurut Duan (2000), rantai karbon pendek (≤20) umumnya berasal dari organisme akuatik.
Rantai karbon panjang (>nC20) yang terdeteksi pada sedimen Sungai Somber bagian muara dan hulu mengindikasikan adanya masukan bahan organik
0
C13 C14 C15 C16 C17 C18 C19 C20 C21 C22 C23 C24 C25 C26 C27 C28 C29 C30
dari tumbuhan tingkat tinggi (Madureira & Piccinini, 1999; Duan, 2000; Yunker
et al., 2005; Bechtel & Schubert, 2009). Rantai karbon nC22, nC24, nC26, dan nC28 yang terdeteksi pada sedimen Sungai Somber memiliki intensitas cukup besar. Komponen nC22 atau nC24 yang terdeteksi dapat berasal dari biota akuatik makrophyta (Lu & Zhai, 2006; Bechtel & Schubert, 2009). Komponen nC22 juga dapat berasal dari tumbuhan terestrial ataupun bakteri (Ho & Meyers 1994). Komponen nC26 dan nC28 utamanya berasal dari tumbuhan terestrial (Muri et al. 2004; Lu & Zhai 2006).
Kontribusi komponen akuatik dan terestrial dapat diduga dengan
menghitung rasio nilai rantai karbon panjang terhadap rantai karbon pendek. Nilai TAROH yang diperoleh pada sedimen Muara Sungai Somber adalah >1, yaitu pada bagian muara dan hulu berturut-turut adalah 8,751 dan 8,548 (Lampiran 7). Hal ini menunjukkan bahwa masukan bahan organik dari terestrial pada sedimen Muara Sungai Somber lebih besar jika dibandingkan dengan masukan yang berasal dari akuatik (Meyers, 1997).
Alkanol pada bagian muara dan hulu Sungai Somber memiliki sedikit perbedaan, dimana intensitas atau kelimpahan alkanol lebih tinggi pada bagian hulu sungai daripada pada bagian muara sungai. Hal ini diduga karena adanya perbedaan tingkat akumulasi materi, dimana pada daerah hulu estuari
4.3. Isoprenoid
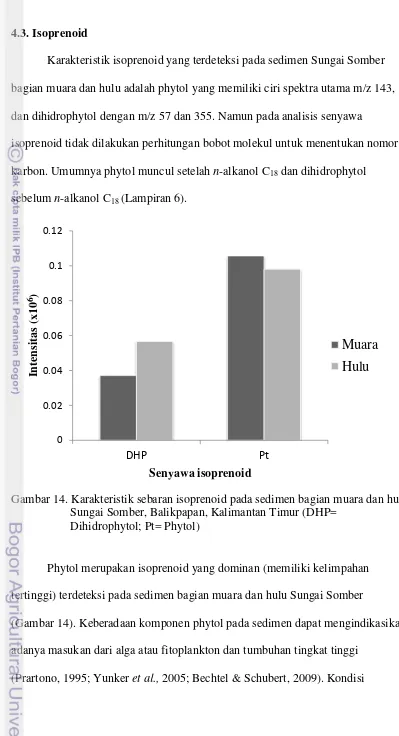
Karakteristik isoprenoid yang terdeteksi pada sedimen Sungai Somber bagian muara dan hulu adalah phytol yang memiliki ciri spektra utama m/z 143, dan dihidrophytol dengan m/z 57 dan 355. Namun pada analisis senyawa
isoprenoid tidak dilakukan perhitungan bobot molekul untuk menentukan nomor karbon. Umumnya phytol muncul setelah n-alkanol C18 dan dihidrophytol sebelum n-alkanol C18 (Lampiran 6).
Gambar 14. Karakteristik sebaran isoprenoid pada sedimen bagian muara dan hulu Sungai Somber, Balikpapan, Kalimantan Timur (DHP=
Dihidrophytol; Pt= Phytol)
Phytol merupakan isoprenoid yang dominan (memiliki kelimpahan tertinggi) terdeteksi pada sedimen bagian muara dan hulu Sungai Somber
(Gambar 14). Keberadaan komponen phytol pada sedimen dapat mengindikasikan adanya masukan dari alga atau fitoplankton dan tumbuhan tingkat tinggi
(Prartono, 1995; Yunker et al., 2005; Bechtel & Schubert, 2009). Kondisi
lingkungan sekitar Sungai Somber dan iklim akan mempengaruhi kelimpahan plankton di perairan, sehingga akan mempengaruhi keberadaan senyawa isoprenoid phytol. Dihidrophytol merupakan produk diagenetik dari phytol melalui proses biologi atau mikroba. Senyawa dihidrophytol dapat digunakan sebagai tanda kondisi anoksik pada tahap diagenesis awal karena terjadi pada suasana reduksi (Prartono, 1995). Kelimpahan dihidrophytol yang cukup tinggi diduga pada sedimen Sungai Somber pernah mengalami kondisi anoksik. 4.4. Sterol
Senyawa sterol pada sedimen di bagian muara dan hulu sungai somber tidak terdeteksi. Hal ini diduga karena konsentrasi senyawa sterol pada sedimen yang dianalisis sangat kecil sehingga tidak dapat dideteksi.
Sterol dapat digunakan sebagai indikator adanya masukan antropogenik pada suatu ekosistem perairan. Salah satu senyawa sterol yang biasa digunakan untuk menduga tercemar atau tidaknya suatu perairan adalah coprostanol. Tingginya limbah domestik air tawar dapat diidentifikasi berdasarkan tingginya rasio coprostanol/ cholesterol (Parrish et al., 2000). Coprostanol dan
33 5.1. Kesimpulan
Hasil penelitian dapat disimpulkan bahwa karakteristik asam lemak dan alkanol di sedimen Sungai Somber bagian muara dan hulu memiliki sedikit perbedaan, dimana intensitas atau kelimpahan asam lemak dan alkanol lebih tinggi pada bagian hulu sungai. Hal ini diduga karena adanya perbedaan tingkat akumulasi materi, dimana pada daerah hulu menunjukkan kondisi yang relatif tenang dibandingkan dengan daerah muara. Karakteristik asam lemak memiliki kisaran rantai karbon nC10-nC34 dengan pola bimodal pada bagian hulu dan pola monomodal pada bagian muara dan Cmax pada nomor karbon nC16 yang
mengindikasikan adanya masukan dari alga, bakteri, fungi dan tumbuhan tingkat tinggi. Asam lemak unsaturasi dan bercabang juga terdeteksi pada sedimen yang mengindikasikan adanya masukan dari bakteri. Sedimen Sungai Somber
BALIKPAPAN, KALIMANTAN TIMUR
VERLIN AYU IBRANI
SKRIPSI
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
Dengan ini menyatakan bahwa skripsi yang berjudul
KARAKTERISTIK ASAM LEMAK DAN FRAKSI POLAR
PADA SEDIMEN DI MUARA SUNGAI SOMBER, TELUK
BALIKPAPAN, KALIMATAN TIMUR
adalah benar merupakan hasil karya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir Skripsi ini.
Bogor, Januari 2013
VERLIN AYU IBRANI. Karakteristik Asam Lemak dan Fraksi Polar pada Sedimen di Muara Sungai Somber, Teluk Balikpapan, Kalimantan Timur. Dibimbing oleh TRI PRARTONO.
Lipid merupakan salah satu komponen utama bahan organik yang terdiri atas beberapa kelas, diantaranya hidrokarbon, asam lemak(fatty acid), alkanol, steroid dan terpenoid. Lipid biological marker (biomarker) dapat digunakan untuk menduga tingkat masukan dari akuatik, terestrial dan antropogenik. Buangan limbah mengandung asam lemak, sterol, dan alkanol dapat terjadi di wilayah Sungai Somber karena adanya aktivitas permukiman, pertanian, pelayaran, dan pelabuhan di sekitar perairan. Lipid yang memiliki persistensi tinggi akan terendap dalam waktu yang lama pada sedimen. Oleh sebab itu, sedimen baik digunakan dalam studi karakteristik lipid biomarker.
Contoh sedimen yang telah tersedia dianalisis di Pusat Laboratorium Terpadu Universitas Islam Negeri (UIN) Syarif Hidayatullah, Tangerang. Contoh sedimen diambil di Muara Sungai Somber, Balikpapan, Kalimantan Timur pada tanggal 27 Januari 2011. Pengambilan contoh sedimen dilakukan pada dua titik di Sungai Somber bagian hulu dan muara yang berjarak ± 2,14 kilometer. Contoh sedimen yang telah dikeringkan dengan freeze dryer dan dihomogenkan
selanjutnya diekstraksi (24 jam) dengan 120 ml pelarut campuran DCM : MeOH (1:1). Hasil ekstraksi diuapkan dengan Rotary Evaporator hingga tersisa ± 2 ml. Selanjutnya sampel dihidrolisis dengan 6% KOH dalam MeOH sebanyak 30 ml (12 jam). Fraksi netral didapat melalui ekstraksi dengan n-Heksana (3x30 ml). Residu diuapkan dan dicampur akuades (25 ml). Campuran diasamkan hingga pH menjadi 2 dengan 6 N HCl kemudian diekstraksi dengan DCM (3x30 ml) untuk mendapatkan fraksi asam. Fraksi polar diperoleh dari fraksi netral yang
difraksinasi pada kolom kromatografi berisi silika gel (5% dideaktivasi silika; 8 gr) yang dielut campuran 25% etil asetat dalam n-Heksana (25 ml). Masing-masing fraksi diuapkan hingga tersisa ± 2 ml dan dimasukkan ke dalam gelas vial. Sampel diderivatisasi melalui siliasi dengan bis-(trimetilsilil)-trifluoroacetamida (BSTFA (Sigma- Aldrich); 50 µl; 80 °C; 10 menit) sebelum dianalisis dengan GC-MS.
© Hak cipta milik Verlin Ayu Ibrani, tahun 2013
Hak cipta dilindungi
BALIKPAPAN, KALIMANTAN TIMUR
VERLIN AYU IBRANI
SKRIPSI
sebagai salah satu syarat untuk memperoleh gelar Sarjana Ilmu Kelautan pada
Departemen Ilmu dan Teknologi Kelautan
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
Judul Skripsi : KARAKTERISTIK ASAM LEMAK DAN FRAKSI POLAR PADA SEDIMEN DI MUARA SUNGAI SOMBER, TELUK BALIKPAPAN, KALIMANTAN TIMUR
Nama Mahasiswa : Verlin Ayu Ibrani Nomor Pokok : C54080061
Departemen : Ilmu dan Teknologi Kelautan
Menyetujui, Dosen Pembimbing
Dr. Ir. Tri Prartono, M. Sc NIP. 19600727 198603 1 006
Mengetahui,
Ketua Departemen Ilmu dan Teknologi Kelautan
Dr. Ir. I Wayan Nurjaya, M.Sc NIP. 19640801 198903 1 001
Puji syukur penulis panjatkan kepada Allah Swt. atas limpahan rahmat dan karunia yang telah diberikan sehingga skripsi ini dapat diselesaikan. Skripsi yang berjudul “Karakteristik Asam Lemak dan Fraksi Polar pada Sedimen Muara Sungai Somber, Balikpapan, Kalimantan Timur” diajukan sebagai salah satu syarat untuk mendapatkan gelar Sarjana Ilmu Kelautan pada Departemen Ilmu dan Teknologi Kelautan (ITK), Fakultas Perikanan dan Ilmu Kelautan (FPIK), Institut Pertanian Bogor (IPB).
Asam lemak dan fraksi polar merupakan hal yang menarik untuk diteliti karena dapat digunakan untuk menduga masukan dari akuatik, terestrial, dan antropogenik pada suatu perairan. Analisis terhadap karakteristik asam lemak dan fraksi polar pada sedimen diharapkan dapat menambah wawasan kita mengenai asam lemak dan fraksi polar serta peranannya di lingkungan perairan laut. Skripsi ini memberikan informasi tentang karakteristik asam lemak dan fraksi polar, khususnya sterol dan alkohol di sedimen Sungai Somber.
Penulis menyadari bahwa skripsi ini tidaklah sempurna, oleh karena itu kritik dan saran yang bersifat membangun dari semua pihak sangat penulis harapkan. Penulis berharap agar skripsi ini dapat bermanfaat dan menambah ilmu pengetahuan yang sudah ada.
Bogor, Januari 2013
Atas terselesaikannya skripsi ini penulis ingin mengucapkan terimakasih kepada : 1. Allah Swt. atas limpahan rahmat dan karunia yang diberikan kepada penulis. 2. Papi, Mami, Yuk Teten, Kesil, Ebon, Om Tony, Kenga beserta seluruh
keluarga besar penulis atas dukungan, kasih sayang, semangat, dan doanya. 3. Dr. Ir. Tri Prartono, M.Sc. selaku dosen pembimbing yang telah memberikan
ilmu, bimbingan, kritik, dan saran sehingga skripsi ini dapat diselesaikan. 4. Mohammad Agung Nugraha,S.Pi, M.Si. atas ilmu dan waktu yang selalu
diberikan kepada penulis selama melakukan penelitian.
5. Pusat Laboratorium Terpadu UIN Syarif Hidayatullah, Tangerang, khususnya Mbak Pipit atas bantuannya selama penulis melakukan penelitian.
6. Dr. Ir. Sigid Hariyadi, M.Sc. selaku dosen penguji yang telah memberikan kritik dan saran yang bermanfaat.
7. Dr. Ir. Nyoman M. N. Natih, M.Si. yang telah memberikan kritik dan saran. 8. Tedi Paturahman, S.E. atas kebersamaan, keceriaan, semangat, doa, dan
dukungan yang selalu diberikan kepada penulis.
9. Keluarga besar Paduan Suara Mahasiswa IPB Agria Swara khususnya Fauzan Akbar, Morina Maryam Z., Adithia Sanjaya H., Miladi M., Fakih K., atas persahabatan dan pengalaman luar biasa yang telah diberikan kepada penulis. 10.Teman-teman ITK angkatan 45 khususnya Ahmad Ridho, Jihan Jemika A.,
Winda Deviana M., Bahrun Rohadi., Ririn Prameswari, Nurlaela H., Hary Aditia P., dan Siti Khaerunissa atas persahabatan, dan dukungannya.
x 4. Struktur molekuler asam lemak polyunsaturasi (Berge & Barnathan,
2005 in Nugraha, 2011) ... 8 5. Struktur molekuler asam lemak bercabang (Killops & Killops,
1993) ... 8 6. Diagram alir prosedur kerja GC – MS (Pohan, 2012) ... 12 7. Peta lokasi pengambilan contoh sedimen di Muara Sungai Somber,
Balikpapan, Kalimantan Timur ... 13 8. Karakteristik sebaran asam lemak saturasi (n-asam alkanoat) pada
sedimen bagian hilir/muara (Stasiun 1) Sungai Somber, Balikpapan,
Kalimantan Timur ... 22
poliunsaturasi) dan bercabang pada sedimen bagian hulu (Stasiun 2)
Sungai Somber, Balikpapan, Kalimantan Timur ... 26 12.Karakteristik sebaran n-alkanol pada sedimen bagian muara
(Stasiun 1) Sungai Somber, Balikpapan, Kalimantan Timur ... 28 13.Karakteristik sebaran n-alkanol pada sedimen bagian hulu (Stasiun 2)
Sungai Somber, Balikpapan, Kalimantan Timur ... 29 14.Karakteristik sebaran isoprenoid pada sedimen bagian muara dan
hulu Sungai Somber, Balikpapan, Kalimantan Timur (DHP=
xi
DAFTAR LAMPIRAN
Halaman 1. Alat yang digunakan pada analisis asam lemak dan fraksi polar ... 38 2. Beberapa spektra massa biomarker asam lemak pada sedimen Muara
Sungai Somber, Balikpapan, Kalimantan Timur ... 39 3. Kromatogram biomarker asam lemak pada sedimen Muara Sungai
Somber, Balikpapan, Kalimantan Timur ... 41 4. Karakteristik asam lemak pada sedimen Muara Sungai Somber,
Balikpapan, Kalimantan Timur ... 42 5. Beberapa spektra massa n-alkanol pada sedimen Muara Sungai
Somber, Balikpapan, Kalimantan Timur ... 44 6. Kromatogram biomarker n-alkanol pada sedimen Muara Sungai
Somber, Balikpapan, Kalimantan Timur ... 45 7. Karakteristik biomarker n-alkanol pada sedimen Muara Sungai
Somber, Balikpapan, Kalimantan Timur ... 46 8. Beberapa spektra massa isoprenoid pada sedimen Muara Sungai
Somber, Balikpapan, Kalimantan Timur ... 47 9. Karakteristik biomarker isoprenoid pada sedimen Muara Sungai
1 1.1. Latar Belakang
Ekosistem pesisir termasuk estuari merupakan wilayah yang kompleks dan rentan mengalami penurunan kualitas lingkungannya karena banyaknya masukan materi dari wilayah daratan dengan berbagai aktifitasnya. Balikpapan, Kalimantan Timur, merupakan salah satu kota pesisir di Indonesia yang memiliki beberapa muara sungai dengan berbagai ragam ciri dan kegiatan wilayah seperti komunitas mangrove, dan aktifitas pelabuhan yang mendapat perhatian Pemerintah Daerah dalam upaya pengembangan sumberdaya khususnya di sekitar Sungai Somber. Materi sisa kegiatan yang masuk ke sungai akan terakumulasi dan terendapkan di sedimen estuari dalam kurun waktu yang cukup lama. Bahan organik di sedimen akan mengalami degradasi yang dapat mempengaruhi kualitas perairan dan mengakibatkan pencemaran apabila penambahan bahan organik yang
terakumulasi melebihi dari kapasitas asimilasi perairan muara. Sumber bahan organik dapat berasal dari dalam perairan (autochthonous) dan dari luar perairan (allochthonous). Secara umum karakter kedua sumber dapat dibedakan dengan mempelajari komponen lipid yang ada dalam sedimen estuari.
Lipid yang dihasilkan oleh organisme hidup plankton adalah C28 dan C27, dan sterol cholest-5-en-3βol, bakteri memproduksi nC18:1ω7 (cis-asam vasenat), sedangkan hewan, tanaman tinggi dan algae menghasilkan nC18:1ω9 (asam oleat). Oleh sebab itu, lipid biomarker dapat digunakan untuk menduga sumber bahan organik dan sebagai indikator sumber pencemaran pada suatu perairan. Lipid biomarker juga dapat digunakan untuk menduga tingkat masukan dari akuatik, terestrial dan antropogenik (Parrish et al., 2000).
Lipid yang memiliki persistensi tinggi akan terendap dalam waktu yang lama pada sedimen. Semua materi yang berada di kolom air juga akan mengendap pada sedimen baik dalam jangka waktu yang singkat maupun dalam jangka waktu yang lama. Oleh sebab itu, sedimen baik digunakan dalam studi karakteristik lipid biomarker. Memperhatikan potensi endapan bahan organik termasuk lipid yang dapat mengganggu lingkungan perairan dari kemungkinan pengembangan aktifitas sungai Somber, penelitian tentang karakteristik asam lemak dan fraksi polar perlu dilakukan.
1.2. Tujuan
3 2.1. Kondisi Umum Lokasi Penelitian
Teluk Balikpapan memiliki luas daerah aliran sungai (DAS) 211.456 hektar dan perairan seluas 16.000 hektar. DAS Teluk Balikpapan memiliki peranan yang cukup penting dan strategis, di antaranya sebagai penyangga kesinambungan fungsi teluk tersebut sebagai pelabuhan laut Balikpapan dan sumber penghasilan masyarakat di sekitarnya serta kehidupan ekosistem perairan kawasan teluk. Sebanyak 54 sub-DAS menginduk di wilayah teluk ini, termasuk salah satunya adalah DAS Sei Wain yang sudah menjadi hutan lindung yang dikenal dengan Hutan Lindung Sungai Wain. Sungai Somber merupakan pertemuan antara bagian hulu dan hilir Sungai Wain yang digunakan sebagai sarana transportasi laut yaitu jalan kapal ferry menuju Teluk Balikpapan ke arah Penajam (Sarminah, 2003).
Sepanjang kiri dan kanan Sungai Somber merupakan dataran rendah dan pada bagian hulu sungai merupakan bukit. Sisi barat laut (kanan menuju hulu) dan sisi tenggara Sungai Somber umumnya masih berupa hutan bakau. Bagian
2.2. n-Alkanol
Alkanol atau alkil atau aril (sikloalkil) alkohol merupakan senyawa monohidroksi turunan dari alkana, dimana salah satu atom H diganti dengan gugus hidroksi (OH). Alkohol memiliki suatu gugus hidroksil yang terikat pada suatu atom karbon jenuh (struktur molekuler alkanol dapat dilihat pada Gambar 1). Atom karbon dapat berupa gugus alkenil atau gugus alkunil, atau dapat pula berupa suatu atom karbon jenuh dari suatu cincin benzena. Biomarker n-alkanol dapat digunakan untuk melihat sumber bahan organik yang berasal dari akuatik dan terestrial. Rantai karbon pendek (≤20) dan panjang (>20) n-alkanol umumnya didominasi oleh rantai karbon genap. Hal tersebut dapat dilihat dari nilai CPI pada n-alkanol > 1 (Gogou et al., 1998).
Gambar 1. Contoh struktur molekuler n-Alkanol
Rantai karbon pendek (≤ 20) umumnya berasal dari organisme akuatik
(Duan, 2000). Rantai karbon panjang (>20) umumnya mengindikasikan adanya masukan bahan organik dari komponen lilin (waxes)tumbuhan tingkat tinggi dari terestrial, namun ada juga yang berasal dari akuatik (Madureira & Piccinini, 1999; Duan, 2000; Yunker et al., 2005; Bechtel & Schubert, 2009).
Nilai TAROH n-alkanol <1 menunjukkan sumber yang berasal dari akuatik (autotonus) memiliki kontribusi relatif lebih besar daripada sumber yang berasal dari terestrial (alotonus). Sebaliknya, nilai TAROH >1 mengindikasikan sumber yang berasal dari terestrial memiliki kontribusi relatif lebih besar (Meyers, 1997).
n- tetradekanol (nC14)
2.3. Sterol
Sterol atau biasa disebut steroid alkohol (struktur molekuler steroid dapat dilihat pada Gambar 2) (Millero & Sohn, 1992; Killops & Killops, 1993) adalah senyawa biomarker yang potensial karena stabilitas dan keanekaragaman
strukturnya (Parrish et al., 2000). Sterol adalah bagian yang penting dari senyawa organik dan seringkali berfungsi sebagai nukleus. Salah satu jenis sterol, yakni kolesterol mempunyai peranan yang vital bagi fungsi-fungsi selular dan menjadi substrat awal bagi vitamin yang larut dalam lemak dan hormon steroid. Sterol dapat dibagi menjadi dua kelompok yaitu stanol (alkohol saturasi) dan stenol (alkohol unsaturasi) (Killops & Killops, 1993).
Gambar 2. Struktur molekuler steroid (Killops & Killops, 1993) Sterol dapat berasosiasi dengan bahan partikulat tersuspensi dan
hewan), β-sitosterol C29 (tumbuhan tingkat tinggi), brassicasterol (diatom), dinosterol C30 (dinoflagellata) dan fucosterol (alga cokelat) (Killops & Killops, 1993).
Mikroalga memiliki keanekaragaman sterol yang besar (Killops & Killops, 1993). Diatom berfungsi sebagai sumber bahan organik pada sistem laut yang terlihat pada distribusi sterol yang komplek dan bervariasi dalam sedimen (Killops & Killops, 1993). 24-Methylenecholesterol dapat digunakan sebagai marker pada diatom (Parrish et al., 2000).
Tingginya rasio coprostanol/ cholesterol dapat mengidentifikasikan tingginya limbah domestik air tawar (Parrish et al., 2000). Faecal sterol seperti coprostanol dan epicoprostanol dapat digunakan sebagai marker limbah manusia karena dapat hadir pada feses manusia (Martins et al., 2007). Perairan yang telah terkontaminasi oleh limbah domestik dapat dilihat dari nilai konsentrasi
coprostanol, yaitu lebih dari 1 ng.g-1 (Martins et al., 2007). 2.4. Asam Lemak
Asam lemak merupakan sekelompok senyawa hidrokarbon yang memiliki rantai panjang dengan gugus karboksilat pada ujungnya (Rusdiana, 2004). Asam lemak merupakan asam lemah, yang di dalam air akan terdisosiasi sebagian. Umumnya asam lemak berfase cair atau padat pada suhu ruang (27 °C). Semakin panjang rantai karbon penyusunnya, semakin mudah membeku dan juga semakin sukar larut. Asam lemak dapat bereaksi dengan senyawa lain membentuk
penyusun fosfolipid dan glikolipid, asam lemak memodifikasi protein melalui ikatan kovalen asam lemak dan menempatkan protein-protein tersebut ke lokasi-lokasinya pada membran, asam lemak sebagai molekul bahan bakar, asam lemak sebagai hormon dan cakra intrasel (Rusdiana, 2004).
Asam lemak dapat digunakan sebagai biomarker karena variasinya dalam organisme berbeda dan kestabilan kimianya yang diikuti ketahanannya (persisten) dalam periode waktu geologi (Millero & Sohn, 1992). Asam lemak didominasi oleh nomor atom genap dengan rantai lurus jenuh (struktur molekuler asam lemak jenuh dapat dilihat pada Gambar 3), mempunyai ciri panjang rantai C12 hingga C36 (Killops & Killops, 1993).. Sumber asam lemak berasal dari bakteri, mikroalga, tanaman tingkat tinggi dan hewan laut (misal : zooplankton) (Killops & Killops, 1993). Rantai panjang (>C20) asam lemak saturasi sering melimpah dalam wax
epikutikula pada tanaman tingkat tinggi dan tidak melimpah pada seagrass
(Volkman et al., 2008).
Gambar 3. Struktur molekuler asam lemak jenuh (saturasi) Asam lemak tak jenuh (unsaturasi) dengan karbon 16 dan 18 sebagian besar ditemukan pada organisme akuatik (Millero & Sohn, 1992; Killops & Killops, 1993). Asam lemak dengan nomor karbon ganjil nC15:1ω6dan nC17:1ω8 berasal dari bakteri yang diproduksi secara biosintesis anaerob (Killops & Killops,
Asam Pentadekanoat (nC15)
OH
C
1993). Beberapa contoh struktur molekuler asam lemak unsaturasi dapat dilihat pada Gambar 4.
Gambar 4. Struktur molekuler asam lemak polyunsaturasi (Berge & Barnathan, 2005 in Nugraha, 2011)
Asam lemak dengan berat molekul rendah (volatil) (<C5) juga hadir dalam perairan alami dan sedimen dan dihasilkan dari degradasi bahan organik oleh mikroba (Millero & Sohn, 1992). Posisi ikatan ganda dari asam lemak
polyunsaturasi/ PUFAs (Polyunsaturated Fatty Acids) dapat digunakan untuk mengidentifikasi sumber organisme (Killops & Killops, 1993). Asam lemak polyunsaturasi umumnya ditemukan pada alga dan tanaman tinggi (Killops & Killops, 1993). Asam lemak bercabang ditemukan pada organisme spesifik, sehingga baik digunakan sebagai biomarker (Millero & Sohn, 1992). Kehadiran asam lemak bercabang mengindikasikan biomassa dari bakteri. Beberapa contoh struktur molekuler asam lemak bercabang dapat dilihat pada Gambar 5.
Gambar 5. Struktur molekuler asam lemak bercabang (Killops & Killops, 1993)
iso-C15
anteiso-C15
O OH
2.5. Sedimen
Menurut Friedman dan Sanders (1978 in Apriadi, 2005) sedimen berasal dari kerak bumi yang diangkut melalui proses hidrologi dari suatu tempat ke tempat lain, baik secara vertikal ataupun horizontal.Sedimen laut dangkal pada wilayah pesisir (khususnya estuari) merupakan “storage system” berbagai unsur
dan senyawa kimia. Proses fisik, kimia dan biologi yang terjadi di dalam kolom air akan mempengaruhi komposisi dan kualitas sedimen.
Sedimen terdiri dari bahan organik dan bahan anorganik. Bahan organik berasal dari biota atau tumbuhan yang membusuk lalu tenggelam ke dasar dan bercampur dengan lumpur. Bahan anorganik umumnya berasal dari pelapukan batuan. Butiran kasar banyak dijumpai dekat pantai, sedangkan butiran halus banyak di perairan dalam dan relatif tenang (Apriadi, 2005). Sedimen di dasar laut berasal dari berbagai sumber materi (Wibisono, 2005; Sanusi, 2006), yaitu:
1. Sedimen Lithogenous
Sedimen lithogenous berasal dari pelapukan (weathering) batuan dari daratan yang terbawa oleh aliran sungai (fluvial transport) dan angin (aeolian
transport) yang masuk ke lingkungan laut. 2. Sedimen Hydrogenous
Sedimen hydrogenous adalah sedimen yang terbentuk akibat proses
pengendapan atau mineralisasi elemen-elemen kimia yang terlarut dalam air laut.
3. Sedimen Biogenous
Ca, Mg (calcareous) dan Si (siliceous), selain mineral celesite (SrSO4) dan
barite (BaSO4).
4. Sedimen Cosmogenous
Sedimen cosmogenous adalah sedimen yang berasal dari luar angkasa yang ditemukan di dasar laut. Partikel-partikel sedimen ini banyak mengandung unsur besi sehingga mempunyai respon magnetik.
Sedimen mengalami proses diagenesis, yaitu proses fisika, kimia dan biologi yang secara umum mengubah sedimen menjadi batuan sedimen. Setelah sedimen menjadi batuan, proses diagenesis dapat terus berlangsung, mengubah tekstur dan mineraloginya. Menurut Peters dan Moldowan (1993 in Pohan, 2012) diagenesis merupakan perubahan yang terjadi secara biologi, fisika, dan kimia pada bahan organik dalam sedimen khususnya perubahan signifikan akibat bahang (heat). Diagenesis sedimen dipengaruhi oleh beberapa faktor, yaitu perubahan fisik lingkungan (peningkatan penimbunan, suhu, dan tekanan), kimiawi
(kandungan oksigen, mineral, dan potensi redoks), dan biologi (aktifitas bakteri, jenis bakteri) (Pohan, 2012).
Sedimen muara (estuari) merupakan tempat mengendap dan
2.6. Kromatografi Gas – Spektrometri Massa (GC-MS)
GC-MS adalah singkatan dari Gas Chromatography – Mass Spectrometry. GC-MS (diagram alir prosedur kerja GC – MS dapat dilihat pada Gambar 6) merupakan suatu metode yang mengkombinasikan kromatografi gas dan
spektrometri massa untuk mengidentifikasi senyawa yang berbeda dalam analisis sampel. Kromatografi gas merupakan metode pemisahan dan pengukuran yang berdasarkan pada perbedaan distribusi komponen-komponen dalam sampel. Spektrometri massa merupakan metode analisis berdasarkan pengukuran terhadap massa ion-ion gas yang dikonversi dari sampel.
Kromatografi gas menggunakan kolom yang tergantung pada sifat fase dan dimensi kolom itu (panjang, diameter, ketebalan film). Perbedaan sifat kimia antara molekul-molekul yang berbeda dalam suatu campuran dipisahkan dari molekul dengan melewatkan sampel sepanjang kolom. Molekul-molekul
memerlukan jumlah waktu yang berbeda (disebut waktu retensi) untuk keluar dari kromatografi gas. Spektrometer massa melakukan hal ini dengan memecah masing-masing molekul menjadi terionisasi mendeteksi fragmen menggunakan massa untuk mengisi rasio. Komponen dalam kromatografi akan terdistribusi dalam dua fase, yaitu menggunakan zat padat atau zat cair sebagai fase diam dan gas sebagai fase bergerak (Khopkar, 2003).
Gambar 6. Diagram alir prosedur kerja GC – MS (Pohan, 2012) Sampel (Senyawa)
Penurunan suhu dan tekanan MS
Gas Chromatography – Mass Spectrometry (GC – MS)
Pengukuran kelimpahan/intensitas Senyawa akan terpisah
Gas Chromatograph
Pemisahan >> Kolom GC
Pemisahan ion sesuai dengan m/z masing-masing ion Fase diam dan bergerak
(dorongan gas He)
Ionisasi
Mass Spectrometer
Injeksi
Mass analyzer
Detector
13
3.1. Waktu dan Tempat Pengambilan Contoh Sedimen
Lokasi pengambilan contoh sedimen secara geografi berada pada 1º12’30’’LS-1º13’30’’LS dan 116º49’30’’BT-116º51’00’’BT. Contoh sedimen diambil di Muara Sungai Somber, Balikpapan, Kalimantan Timur pada tanggal 27 Januari 2011 sebagai bagian dari kajian Studi Dinamika dan Daya Dukung
Ekosistem Sungai Somber Teluk Balikpapan, Kalimantan Timur. Pengambilan contoh sedimen dilakukan pada dua titik di Sungai Somber bagian hulu dan muara yang berjarak kurang lebih 2,14 kilometer seperti ditampilkan pada Gambar 7. Contoh sedimen yang telah tersedia dianalisis di Pusat Laboratorium Terpadu Universitas Islam Negeri (UIN) Syarif Hidayatullah, Tangerang.
Gambar 7. Peta lokasi pengambilan contoh sedimen di Muara Sungai Somber, Balikpapan, Kalimantan Timur
Kutai
T
eluk
B
a
lik
pa
pa
n
Sungai Sei Wein
1 2 LS
3.2. Bahan dan Alat Penelitian 3.2.1. Contoh sedimen
Contoh sedimen yang berasal dari muara Sungai Somber dikeringkan menggunakan alat freeze-dryer (24 jam) dan dihomogenkan dengan cara disaring menggunakan saringan dengan mesh size 250 µm.
3.2.2. Peralatan laboratorium
Peralatan penelitian yang terdiri atas gelas erlenmeyer, gelas ukur, soxhlet, gelas beaker, corong pemisah, labu bulat, kolom kromatografi, pipet tetes, dan gelas vialdicuci dengan sabun teepol dan dibilas dengan air. Peralatan
dikeringkan dengan cara diletakkan di rak selama beberapa menit agar air yang tersisa di dalam peralatan menguap. Selanjutnya, peralatan dimasukan ke dalam oven (80 °C) selama 24 jam. Setelah kering, peralatan dibilas dengan methanol (MeOH), diklorometana (DCM) dan n-Heksana secara berurutan (Prartono, 1995). Selanjutnya, peralatan dibungkus dengan aluminium foil, disimpan dan siap
digunakan. Di samping itu, juga digunakan peralatan lain seperti stirrer untuk hidrolisis, Rotary Evaporator untuk penguapan, dan Gas Chromatography – Mass Spectrometry (GC – MS) untuk identifikasi.
3.2.3. Pelarut organik
3.2.4. Pereaksi
a. Anhydrous sodium sulfat
Anhydrous sodium sulfat dibilas dengan DCM. Selanjutnya, diaktivasi (500 °C; 4 jam) menggunakan oven. Kemudian didinginkan pada desikator dan disimpan hingga akan digunakan (Prartono, 1995).
b. Bubuk tembaga aktif
Tembaga aktif disiapkan menurut prosedur dari Blumer (1957) dalam
Prartono (1995). Tembaga (II) sulfat seberat 45 g dilarutkan dalam 500 ml akuades dan ditambahkan Hydrochloric Acid (2 M; 20 ml). Bubuk seng seberat 15 g dilarutkan dalam 25 ml akuades. Selanjutnya, larutan seng dimasukkan dalam larutan tembaga (II) sulfat secara perlahan kemudian diaduk hingga terbentuk endapan tembaga dari warna merah hingga merah kecokelatan.
Kemudian cairan di permukaan dibuang. Endapan tembaga dibilas dengan DCM dan n-Heksana.
3.2.5. Silika gel 60 (ukuran partikel 0,040 – 0,063 mm)
Silika gel (8 g) dimurnikan melalui proses ekstraksi menggunakan alat soxhlet (6 jam) dengan campuran n-Heksana - MeOH (1:1) sebanyak 120 ml. Kemudian dikeringkan dan dibungkus dengan aluminium foil. Aluminium foil yang berisi silika dipanaskan dalam oven (500 °C; 1 jam). Berikutnya, suhu diturunkan secara bertahap menjadi 150 °C hingga 120 °C, kemudian disimpan dalam desikator selama 30 menit. Silika gel yang digunakan pada kolom
Jumlah akuades (5%) yang ditambahkan berdasarkan persamaan (1) dan (2) berikut :
Wt = Ws
0,95
Wh = Wt - Ws
dimana :
Wt = total (berat SiO2 + H2O)
Ws = berat SiO2
Wh = berat H2O yang ditambahkan 3.3. Prosedur Analisis
a. Ekstraksi sedimen, pemisahan fraksi netral dan asam
Contoh sedimen yang telah kering ditimbang sebanyak 10 g kemudian diekstraksi dengan 120 ml pelarut campuran (1:1) DCM dan MeOH menggunakan soxhlet selama 24 jam. Hasil ekstraksi diuapkan menggunakan rotary evaporator
hingga tersisa ekstrak kurang lebih 2 ml kemudian dihidrolisis dengan 6% KOH dalam MeOH (30 ml; 12 jam) (Prartono, 1995).
Fraksi netral didapat melalui ekstraksi dengan n-heksana (3x30 ml). Residu diuapkan dan dicampur dengan akuades (25 ml) yang sebelumnya telah disterilisasi dengan DCM (25 ml). Campuran diasamkan dengan 6 N HCl hingga pH menjadi 2 kemudian diekstraksi dengan DCM (3x30 ml) untuk mendapatkan fraksi asam. Selanjutnya, fraksi asam diuapkan menggunakan rotary evaporator
hingga diperoleh kurang lebih 2 ml dan dimasukkan dalam gelas vial. Sampel diderivatisasi melalui sililasi dengan bis-(trimetilsilil)-trifluoroacetamida (BSTFA
... (1)
(Sigma- Aldrich); 50 µl; 80 °C; 10 menit) sebelum dianalisis dengan GC-MS (Prartono, 1995).
b. Fraksinasi senyawa polar
Fraksi netral dimasukkan ke kolom kromatografi yang telah terisi silika gel (5% dideaktivasi silika; 8 g) untuk mendapatkan fraksi polar. Fraksi yang diperoleh adalah : (I) fraksi alifatik diperoleh dengan mengelut kolom dengan 50 ml n-Heksana, (II) fraksi aromatik diperoleh dengan mengelut campuran 20 ml dari n-Heksana : DCM (9 : 1) diikuti oleh 60 ml campuran n-Heksana : DCM (1 : 1) dan (III) fraksi polar diperoleh dengan mengelut campuran 25 ml dari 25% etil asetat dalam n-Heksana. Hasil tiap fraksi diuapkan menggunakan rotary
evaporator hingga diperoleh kurang lebih 2 ml dan dimasukkan ke dalam gelas vial. Selanjutnya, sampel diuapkan dengan nitrogen hingga kering. Pelarut
n-heksana (0,5 ml) ditambahkan ke dalam gelas vial bila akan dianalisis dengan GC-MS. Penelitian ini hanya menganalisis fraksi polar, sedangkan fraksi alifatik dan aromatik dilakukan oleh peneliti lain. Fraksi polar diderivatisasi melalui sililasi (BSTFA; 50 µl; 80°C; 10 menit) sebelum dianalisis dengan GC-MS (Prartono, 1995; Martins et al., 2007).
c. Analisis kromatografi gas – spektrometri massa (GC-MS)
pada 300 °C selama 20 menit. Kondisi GC-MS adalah ionisasi potensial/ electron energy 70eV, ion source temperature 230 °C dan interface temperature 250°C.
Full mass data dicatat antara 45–600 Dalton setiap detik. Data dicatat dan dianalisis menggunakan perangkat lunak GCMS Real Time Analysis dan GCMS
Postrun Analysis.
d. Identifikasi asam lemak dan fraksi polar
Asam lemak dan fraksi polar diidentifikasi dan dihitung menggunakan kromatografi gas dan kromatografi gas–spektrometri massa. Identifikasi dilakukan dengan membandingkan indeks relative retention dan mass spectra
dengan data literatur.
Asam lemak pada sampel sedimen dideteksi berdasarkan intensitas dari spektra utama (base peak) m/z 117, n-alkanol dengan m/z 75, Isoprenoid phytol dengan m/z 143, dihidrophytol dengan m/z 57 dan 355, dan asam phytanoat dengan m/z 73 dan 159, selanjutnya diidentifikasi spektra massanya (spektra massa dapat dilihat pada Lampiran 2, Lampiran 5, dan Lampiran 8). Sterol dideteksi berdasarkan intensitas dari beberapa spektra utama seperti coprostanol, epicoprostanol, cholestanol dengan m/z 215 dan 460, stigmastanol dengan m/z 215 dan 488, sitosterol dengan m/z 396 dan 486, stigmasterol dengan m/z 129 dan 394, campesterol dengan m/z 129 dan 472, brassicasterol dengan m/z 129, dan cholesterol dengan m/z 129 dan 458, selanjutnya diidentifikasi spektra massanya. e. Penentuan nomor karbon
bernilai 14 (CH2) satuan massa. Secara sederhana dituliskan dengan persamaan (3) dan (4) sebagai berikut:
n-alkanol :
dimana: x = nomor karbon
[M+ - 15] = molekuler based peak - 15
75 = ion target n-alkanol / ion based peak
14 = berat molekul CH2
n-asam alkanoat/fatty acid :
dimana:
x = nomor karbon
[M+ - 15] = molekuler based peak - 15
117 = ion target n-asam alkanoat/fatty acid - ionic based peak
14 = berat molekul CH2 f. Perhitungan parameter molekuler
Nilai Carbon Preference Index (CPI) untuk n-asam alkanoat/ FA dan
n-alkanol/ OH dihitung dengan persamaan (5) dan (6) berikut (Prartono, 1995; Silva
et al., 2008).
……….…… (3)
………..……….….... (4)
[M
+- 15] - 75
14
Cx =[M
+- 15] - 117
14
n-asam alkanoat dan n-alkanol :
[∑ ∑
∑
∑ ]
[∑ ∑
∑
∑ ]
Untuk menginterpretasikan dominasi terestrial versus akuatik digunakan
terestrial to aquatic ratio (TAR) (Meyers, 1997; Lu & Meyers, 2009) dengan persamaan (7) sebagai berikut :
TARFA / OH=
C24 + C26 + C28 C12 + C14 + C16
Untuk melihat adanya dominasi masukan dari autotonus/ akuatik atau alotonus/ terestrial secara relatif pada sterol digunakan rasio cholesterol (C27Δ5)/ sitosterol (C29Δ5) (Mater et al., 2004).
.. (5)
.. (6)
21 4.1. Asam Lemak
a. Asam lemak saturasi
Identifikasi asam lemak dilakukan berdasarkan hasil kromatogram senyawa asam lemak yang telah direkam selama 50 menit. Karakteristik asam lemak yang muncul pada spektra massa dicirikan dengan nilai spektra utama (base peak) m/z 117. Selain itu juga dilihat nilai bobot molekul senyawa asam lemak untuk menentukan nomor karbon senyawa asam lemak.