UJI AKTIVITAS ANTIBIOFILM SARI BUAH
BELIMBING WULUH
(Averrhoa bilimbi
L
)
TERHADAP
BIOFILM
Pseudomonas aeruginosa
SECARA
IN VITRO
SKRIPSI
Oleh
RESKY YULIANDARI
1111102000001
PROGRAM STUDI FARMASI
UJI AKTIVITAS ANTIBIOFILM SARI BUAH
BELIMBING WULUH
(Averrhoa bilimbi
L
)
TERHADAP
BIOFILM
Pseudomonas aeruginosa
SECARA
IN VITRO
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar sarjana farmasi
Oleh
RESKY YULIANDARI
1111102000001
PROGRAM STUDI FARMASI
Skripsi ini adalah benar karya saya sendiri, dan semua sumber baik yang dikutip maupun dirujuk,
telah saya nyatakan dengan benar.
Nama : Resky Yuliandari
NIM : 1111102000001
Tanda tangan :
Program Studi : Farmasi
Judul Skripsi :UJI AKTIVITAS ANTIBIOFILM SARI BUAH BELIMBING WULUH (Averrhoa bilimbi L) TERHADAP BIOFILM Pseudomonas aeruginosa SECARA IN VITRO
P.aeruginosa merupakan bakteri oportunistik penyebab resistensi obat. Pembentukan
biofilm P.aeruginosa dapat menyebabkan masalah yang serius dalam bidang
kesehatan, khususnya terkait masalah infeksi. Penelitian sebelumnya menyatakan
bahwa belimbing wuluh (Averrhoa bilimbi L) mengandung senyawa flavonoid yang
diketahui memiliki aktivitas antibiofilm. Tujuan dari penelitian ini adalah untuk
mengetahui aktivitas antibiofilm sari buah belimbing wuluh terhadap pembentukan
biofilm P.aeruginosa secara in vitro yaitu pencegahan, penghambatan dan degradasi
biofilm dan mengetahui kondisi optimum dari aktivitas terseleksi. Penelitian ini
mengunakan metode Microtitter Plate Biofilm Assay. Sampel yang digunakan yaitu
P.aeruginosa pembentuk biofilm yang merupakan koleksi LIPI yang diisolasi dari
alat dispenser. Perlakuan berupa penambahan sari buah belimbing wuluh dengan seri
konsentrasi 0,5 %, 1%, 2%, 4%, 8%, kontrol negatif dan kontrol positif. Pengukuran
pembentukan biofilm dilakukan dengan menggunakan microplate reader dan
diperoleh data kuantitatif berupa nilai absorbansi atau Optical Density pada panjang
gelombang 595nm (OD595nm). Hasil penelitian ini menunjukkan bahwa sari buah
belimbing wuluh memiliki aktivitas antibiofilm yaitu pencegahan, penghambatan dan
degradasi biofilm P.aeruginosa secara in vitro mulai dari konsentrasi 0,5% (p<0,05).
Penghambatan pertumbuhan biofilm merupakan aktivitas terbaik yang kemudian
dioptimasi dengan menggunakan metode Response Surface Analysis (RSA). Terdapat
tiga faktor yang dioptimasi yaitu suhu, konsentrasi dan waktu inkubasi. Hasil
optimasi menunjukkan bahwa suhu yang optimal adalah 300C, konsentrasi 4,3% dan
Program Studi : Farmasi
Judul Skripsi :UJI AKTIVITAS ANTIBIOFILM SARI BUAH BELIMBING WULUH (Averrhoa bilimbi L) TERHADAP BIOFILM Pseudomonas aeruginosa SECARA IN VITRO P.aeruginosa is a drug resistance opportunistic bacterium. Biofilm formation of
P.aeruginosa is able to cause serious health problems, especially infection diseases.
The previous study proved that a Averrhoa bilimbi L fruit juice is containing
flavonoid agent which is known to be antibiofilm effect. This study is conducted to
determine the in vitro antibiofilm activity of a Averrhoa bilimbi L fruit juice to
P.aeruginosa biofilm growth including three acivities preventive, inhibitory and
degradative of biofilm, and to determine the optimum condition of best selected
acivity. This study using Plate Biofilm Assay method. Sample of this study is
P.aeruginosa, the framer of biofilm an isolated LIPI collection of toll dispenser. The
treatments is addition of Averrhoa bilimbi L fruit juice with concentration of 0,5%,
1%, 2%, 4%, 8%, the negative control and the positive control. Quantification of
biofilm formation is measured by using microplate reader at 596 nm and its result is
absorbance value or Optical Density (OD595nm) as quantitative data. This study
showed that Averrhoa bilimbi L fruit juice has significant in vitro anibiofilm effect in
preventing, inhibitory and degradating of biofilm growth with starting concentration
0,5% (p<0,05). The biofilm inhibitory is the best activities which is optimized using
the Response Surface Analysis (RSA) method. This method optimized three factors
including temperature, concentration and the incubation period. The optimization
process result in optimal temperature 300C, concentration 4,3% and incubation period
2,25 days.
Alhamdulillahirabbil’aalamiin, segala puji dan syukur penulis ucapkan kehadirat ALLAH SWT yang telah melimpahkan rahmat dan ridho-Nya sehingga
penulis dapat menyelesaikan penyusunan skripsi ini hingga selesai. Penulisan skripsi yang berjudul “ UJI AKTIVITAS ANTIBIOFILM SARI BUAH BELIMBING WULUH (Averrhoa bilimbi L) TERHADAP BIOFILM Pseudomonas aeruginosa SECARA IN VITRO” bertujuan untuk memenuhi persyaratan guna memperoleh gelar Sarjana Farmasi pada Fakultas Kedokteran dan Ilmu Kesehatan Universitas
Islam Negri Syarif Hidayatullah Jakarta.
Pada kesempatan ini penulis menyadari bahwa, tanpa bantuan dan bimbingan
dari berbagai pihak, dari masa perkuliahan sampai pada penyusunan skripsi ini,
sangatlah sulit bagi saya untuk menyelesaikan skripsi ini. Oleh karena itu, saya
mengucapkan terima kasih dan penghargaan sebesar-besarnya kepada :
1. Prof.Dr. Atiek Soemiati,M.si.,Apt dan Novik Nurhidayat.P.hD selaku dosen
pembimbing yang telah banyak memberikan bimbingan, waktu, tenaga, saran
dan dukungan dalam penelitian ini.
2. Dr.H. Arif Sumantri,SKM.,M.Kes Selaku dekan Fakultas Kedokteran dan
Ilmu Kesehatan Universitas Islam Negri Syarif Hidayatullah Jakarta.
3. Yardi,P.hD.,Apt selaku ketua Program Studi Farmasi Fakultas Kedokteran
dan Ilmu Kesehatan Universitas Islam Negri Syarif Hidayatullah Jakarta dan
pembimbing akademik kelas A farmasi 2011 yang telah banyak memberikan
perhatian dan bimbingan selama masa perkuliahan.
4. Drs. Umar Mansur,M.Sc.,Apt selaku mantan ketua Program Studi Farmasi
Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negri Syarif
Hidayatullah Jakarta yang telah memberikan banyak motivasi dan bantuan
mendidik saya selama masa perkuliahan.
6. Kedua orang tua, papa tercinta Drs.Rizal Efendi (Alm) dan mama tersayang
Surhana yang telah membesarkan dan mendidik anaknya dan selalu
memberikan kasih sayang dan doa yang tidak pernah putus serta dukungan
baik moril maupun materil. Tidak ada apapun dunia ini yang dapat membalas
semua kebaikan, cinta dan kasih saying yang telah kalian berikan kepada
anakmu, semoga ALLAH SWT selalu memberikan keberkahan, kesehatan,
keselamatan, perlindungan, cinta dan kasih sayang kepada orang tua hamba
tercinta. Terkhusus untuk papa tercinta, semoga ALLAH SWT selalu
melindungimu dan menempatkanmu di antara orang-orang beriman.
7. Adikku tersayang Muhammad Destian Arif, serta semua keluarga besar yang
berada di Lampung yang telah memberikan doa, semangat dan dukungan
sehingga penelitian ini berjalan dengan lancar.
8. Faritz Azhar.S.Far.,Apt atas segala pengertian, semangat, perhatian dan
bantuannya.
9. Teman seperjuangan Biofilmers dan Biosensores (Firda, Rika, Fattah, ka via,
ka Eka, ka Anom dan ka Afif) yang telah berjuang bersama dan memberikan
dukungan dan bantuan selama di LIPI.
10. Laboran di LIPI Cibinong Pak Acun, ka Lusi, ka Ana dan keluarga besar LIPI
Cibinong yang telah banyak sekali membantu penulis selama masa penelitian.
11. Laboran FKIK ka Lisna, ka Tiwi, ka Eris, ka Liken, mba Rani dan mas
Rahmadi yang telah membantu penulis selama masa penelitian dan perkulian.
12. Sahabat terbaik (Rida, Tiara, Cahya, Jeje, Devid, Inul, Aripin, Dini, Raihana,
Nikmah, Wafa, Tari, Mazay, Fitri serta teman kosan RDC (inten, ka Devi, ka
Isti, ka Santi, Nina, Vani, Pire, mba Elsa, mba Anis, Cumi, Nita, Noni, mba
Evi dan lain-lain) yang telah mendoakan dan memberikan dukungan kepada
penulis.
Penulis menyadari bahwa skripsi ini masih jauh dri sempurna, namun penulis
berharap semoga hasil penelitian ini dapat bermanfaat bagi perkembangan ilmu
pengetahuan pada umumnya dan ilmu farmasi padakhususnya. Akhir kata, penulis
berharap ALLAH SWT berkenan membalas segala kebaikan semua pihak yang telah
membantu saya dalam penelitian ini.
Ciputat, Mei 2015
Sebagai civitas akademik Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta, saya yang bertanda tangan dibawah ini :
Nama : Resky Yuliandari
NIM : 1111102000001
Program Studi : Farmasi
Fakultas : Kedokteran dan Ilmu Kesehatan (FKIK)
Jenis Karya : Skripsi
Demi pengembangan ilmu pengetahuan, saya menyetujui skripsi/karya ilmiah saya dengan judul :
UJI AKTIVITAS ANTIBIOFILM SARI BUAH BELIMBING WULUH (Averrhoa bilimbi L) TERHADAP BIOFILM Pseudomonas aeruginosa SECARA IN VITRO.
Untuk dipublikasikan atau ditampilkan di internet atau media lain yaitu Digital Library Perpustakaan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta untuk kepentingan akademik sebatas sesuai dengan Undang-undang Hak Cipta. Demikian persetujuan publikasi karya ilmiah ini saya buat dengan sebenarnya.
Dibuat di : Ciputat
Pada Tanggal : 24 Juni 2015
Yang menyatakan,
HALAMAN PERNYATAAN OSRISINILITAS ... i
HALAMAN LEMBAR PERSETUJUAN ... ii
HALAMAN PENGESAHAN ... iii
ABSTRAK ... iv
ABSTRACT ... v
KATA PENGANTAR ... vi
HALAMAN PERSETUJUAN PUBLIKASI ... ix
DAFTAR ISI ... x
DAFTAR GAMBAR ... xiii
DAFTAR TABEL ... xiv
DAFTAR LAMPIRAN ... xv
BAB I PENDAHULUAN 1.1 Latar Belakang ... 1
1.2 Rumusan Masalah ... 3
1.3 Tujuan Penelitian ... 3
1.4 Hipotesis ... 3
1.5 Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAKA 2.1 Infeksi ... 5
2.2 Konsep Biofilm ... 5
2.2.1 Definisi Biofilm ... 5
2.2.2 Mekanisme Pembentukan Biofilm ... 6
2.2.3 Komposisi dan Struktur Biofilm ... 7
2.1.4 Faktor-faktor yang Mempengaruhi Perlekatan Sel-Sel Bakteri dalam Pembentukan Biofilm ... 8
2.2.8 Pemeriksaan Biofilm ... 11
2.2.9 Resistensi Biofilm Terhadap Antibiotik ... 11
2.2.10 Kontrol Biofilm ... 12
2.3 Bakteri Uji ... 13
2.3.1 Klasifikasi ... 13
2.3.2 Karakteristik ... 14
2.3.3 Resistensi Terhadap Antibiotik ... 16
2.3.4 Gambaran Klinik ... 17
2.3.5 Epidemiologi ... 17
2.3.6 Pencegahan dan Pengobatan ... 18
2.4 Belimbing Wuluh (Averrhoa bilimbi L) ... 19
2.4.1 Taksonomi... 19
2.4.2 Morfologi ... 19
2.4.3 Kandungan Kimia ... 20
2.4.5 Khasiat dan Kegunaan ... 21
BAB III METODELOGI PENELITIAN 3.1 Tempat dan Waktu ... 22
3.2 Alat dan Bahan ... 22
3.2.1 Alat ... 22
3.2.1 Bahan ... 22
3.3 Prosedur Penelitian ... 23
3.3.1 Identifikasi Belimbing Wuluh... 23
3.3.2 Karakterisasi Sampel dan Penyiapan Ekstrak Air Belimbing Wuluh (Averrhoa bilimbi L) ... 23
3.3.3 Uji Penapisan Fitokimia ... 24
3.3.6 Karakterisasi Bakteri Pseudomonas aeruginosa ... 26
3.3.6 Pembuatan Suspensi Bakteri ... 26
3.3.7 Uji Pembentukan dan Pertumbuhan Biofilm Bakteri Pseduomonas aeruginosa ... 27
3.3.7 Uji Aktivitas Antibiofilm Secara In Vitro ... 27
3.3.8 Analisa Data ... 30
3.3.9 Optimasi Aktivitas Penghambatan Pertumbuhan Biofilm ... 30
BAB IV HASIL DAN PEMBAHASAN 4.1 Hasil Penelitian ... 31
4.1.1 Determinasi ... 31
4.1.2 Karakterisasi Sampel dan Proses Penyiapan Sampel ... 31
4.1.3 Uji Penapisan Fitokimia ... 31
4.1.4 Hasil Karakterisasi Bakteri Pseudomoas aeruginosa ... 32
4.1.5 Uji Pembentukan dan Pertumbuhan Biofilm Pseudomonas aeruginosa ... 32
4.1.6 Uji Aktivitas Antibiofilm Ekstrak Air Belimbing Wuluh terhadap Biofilm Pseudomonas aeruginosa ... 33
4.1.7 Optimasi Aktivitas Penghambatan Pertumbuhan Biofilm Pseudomonas aeruginosa ... 35
4.2 Pembahasan ... 37
BAB V KESIMPULAN DAN SARAN 5.1 Kesimpulan ... 46
5.2 Saran ... 46
Gambar 2.1 Pembentukan Biofilm ... 6
Gambar 2.2 Matriks Ekstraseluler Pada P.aeruginosa Dilihat dengan Mikroskop Elektron ... 8
Gambar 2.3 Pseudomonas aeruginosa Pada Pewarnaan Gram-negatif ... 14
Gambar 2.4 Koloni Pseudomonas aeruginosa Pada Agar ... 15
Gambar 2.5 Hasil Uji Resistensi Antibiotik ... 16
Gambar 2.6 Pohon Belimbing Wuluh ... 19
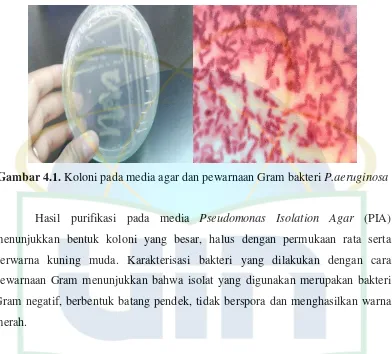
Gambar 4.1 Koloni Pada Media Agar dan Pewarnaan Gram Bakteri Pseudomonas aeruginosa ... 32
Gambar 4.2 Grafik Pembentukan dan Pertumbuhan Biofilm Pseudomonas aeruginosa ... 33
Gambar 4.3 Grafik Aktivitas Antibiofilm Ekstrak Air Belimbing Wuluh Terhadap Biofilm Pseudomonas aeruginosa ... 33
Gambar 4.4 Grafik Contour Plot antara Fase Reduksi vs Suhu, Waktu ... 36
Gambar 4.5 Grafik Contour Plot antara Fase Reduksi vs Suhu, Konsentrasi .... ... 36
Tabel 4.1 Hasil Uji Penapisan Fitokimia Serbuk Buah Belimbing Wuluh Secara Kualitatif ... 31
DAFTAR LAMPIRAN
Lampiran 1 Alur Kerja Penelitian ... 54
Lampiran 2 Hasil Determinasi Tanaman Belimbing Wuluh... 55
Lampiran 3 Alat dan Bahan Penelitian ... 56
Lampiran 4 Proses Penyiapan Sampel Belimbing Wuluh ... 58
Lampiran 5 Hasil Uji Penapisan Fitokimia ... 59
Lampiran 6 Proses Pembuatan Media Pseudomonas Isolation Agar (PIA) Padat dan Media Heterotrof (HTR) Cair... 60
Lampiran 7 Proses Inokulasi dan Pewarnaan Gram ... 61
Lampiran 8 Hasil Uji Pembentukan dan Pertumbuhan Biofilm Pseudomonas aeruginosa ... 62
Lampiran 9 Desain Pengujian Aktivitas Antibiofilm pada Mikroplate ... 63
Lampiran 10 Lampiran 11 Analisis Data Aktivitas Antibioilm Ekstrak Air Belimbing Wuluh terhadap Biofilm ... 64
BAB I PENDAHULUAN
1.1 Latar Belakang
Infeksi merupakan salah satu masalah serius dalam bidang
kesehatan yang terus berkembang di Indonesia. Bakteri merupakan salah
satu penyebab penyakit infeksi (Gibson, 1996). Sebagai pertahanan diri,
bakteri membentuk suatu lapisan lendir yang disebut dengan biofilm.
Biofilm merupakan bentuk struktural dari sekumpulan mikroorganisme
yang dilindungi oleh matrik ekstraseluler yang disebut Extracelluler
Polymeric Substance (EPS), dimana EPS merupakan produk yang
dihasilkan sendiri oleh mikroorganisme tersebut dan dapat melindungi dari
pengaruh buruk lingkungan (Prakash et al., 2003).
Biofilm saat ini dianggap sebagai mediator utama infeksi, dengan
perkiraan 80 % kejadian infeksi berkaitan dengan pembentukan biofilm
(Archer et al, 2011). Hal ini disebabkan pembentukan biofilm pada
mikroorganisme dapat meningkatkan toleransi terhadap antimikroba dan
disinfektan, sehingga biofilm berperan besar dalam terjadinya resistensi
dan penyakit kronis. Terapi antibiotik pada umumnya hanya akan
membunuh sel-sel yang bersifat planktonik, sedangkan bentuk bakteri
yang tersusun rapat dalam biofilm akan tetap hidup. Hal ini dikarenakan
antibiotik tidak dapat menembus lapisan biofilm (Mah dan Toole, 2001).
Berkembangnya resistensi oleh mikroorganisme target menjadi
masalah yang terus meningkat . Resistensi mikroba adalah keadaan dimana
mikroorganisme berubah sedemikian rupa sehingga menyebabkan
obat-obat yang dahulu digunakan untuk pengobat-obatan infeksi menjadi tidak
efektif. Beberapa mikroba yang mendapat perhatian saat ini akibat sifat
resistensinya antara lain methicillin-resistant Staphylococcus aureus
(MRSA), vancomycin-resistant Enterococcus (VRE), penicillin-resistant
Streptococcus pneumoniae, multidrug-resistant Pseudomonas aeruginosa
Pada penelitian sebelumnya telah dibuktikan bahwa P.aeroginosa
telah resisten terhadap beberapa antibiotik. Dari 25 jenis antibiotik yang
digunakan, lebih dari 50% telah resisten (Rukmono, 2013). P.aeroginosa
merupakan bakteri oportunistik, yaitu memanfaatkan kerusakan pada
mekanisme pertahanan inang untuk memulai suatu infeksi. Bakteri ini
dapat menyebabkan infeksi saluran kemih, infeksi saluran pernafasan,
dermatitis, infeksi jaringan lunak, infeksi tulang dan sendi, infeksi saluran
pencernaan dan bermacam-macam infeksi sistemik, terutama pada
penderita luka bakar berat, kanker, dan penderita AIDS yang mengalami
penurunan system imun (Todar, 2004).
Kontrol biofilm sejauh ini dilakukan dengan tiga cara, yaitu secara
fisika, kimia dan biologi. Kontrol biofilm secara fisika dapat dilakukan
dengan cara peningkatan suhu. Sedangkan secara kimia dapat dilakukan
dengan penambahan zat kimia contohnya enzim berbasis deterjen.
Selanjutnya kontrol biofilm secara biologi dapat menggunakan
bakteriofage dan interaksi mikrobiologis ( Simoes et al., 2010). Masih
sangat dibutuhkan alternatif lain untuk mengatasi masalah biofilm,
terutama biofilm penyebab infeksi. Penggunaan bahan alam masih
menjadi prioritas utama, karena toksisitas rendah, mudah didapat dan
biaya murah.
Salah satu tanaman yang dapat dimanfaatkan untuk penelitian
biofilm yaitu belimbing wuluh (Averrhoa bilimbi L). Adapun kandungan
dari buah belimbing wuluh diketahui memiliki aktivitas antibakteri adalah
senyawa flavonoid (Hembing, 2008). Tidak menutup kemungkinan
belimbing wuluh juga memiliki aktivitas antibiofilm, karena ekstrak
tanaman yang mengandung flavonoid berpotensi dapat menghambat
intercellular adhesion genes icaA dan icaD yang menjadi salah satu faktor
pembentukan biofilm (Lee et al., 2013). Selain mengandung senyawa
flavonoid, buah belimbing wuluh juga diketahui mengandung senyawa
saponin triterpen (Fahrunnida dan Pratiwi, 2012). Menurut Katzung dalam
Hartini (2012) saponin merupakan senyawa yang memiliki tegangan
mengganggu kestabilan membran sel bakteri yang menyebabkan lisis sel.
Hal ini disebabkan karena saponin yang merupakan senyawa semipolar
dapat larut dalam lipid dan air, sehingga senyawa ini akan terkonsentrasi
dalam membrane sel mikroba.
Penelitian sebelumnya membuktikan bahwa buah belimbing wuluh
(Averrhoa bilimbi L) dapat menghambat pembentukan biofilm
Staphylococcus aureus (Loresta, 2012). Oleh karena itu, penulis tertarik
melakukan penelitian tentang uji antibiofilm sari buah belimbing wuluh
(Averrhoa bilimbi L) terhadap biofilm P.aeroginosa secara in vitro.
1.2 Rumusan Masalah
Apakah ekstrak air belimbing wuluh (Averrhoa bilimbi L) dapat mencegah pertumbuhan biofilm P.aeroginosa secara in vitro ?
Apakah ekstrak air belimbing wuluh (Averrhoa bilimbi L) dapat menghambat pertumbuhan biofilm P.aeroginosa secara in vitro ?
Apakah ekstrak air belimbing wuluh (Averrhoa bilimbi L) dapat mendegradasi biofilm P.aeroginosa secara in vitro ?
Berapakah kondisi yang optimal (suhu, konsentrasi, waktu inkubasi) pada aktivitas terseleksi ?
1.3Tujuan Penelitian
Menguji aktivitas antibiofilm ekstrak air belimbing wuluh (Averrhoa bilimbi L) dalam mencegah pertumbuhan biofilm P.aeroginosa secara
in vitro.
Menguji aktivitas antibiofilm ekstrak air belimbing wuluh (Averrhoa bilimbi L) dalam menghambat pertumbuhan biofilm P.aeroginosa
secara in vitro.
Menguji aktivitas antibiofilm ekstrak air belimbing wuluh (Averrhoa bilimbi L) dalam mendegradasi biofilm P.aeroginosa secara in vitro.
1.4 Hipotesis
Ekstrak air belimbing wuluh (Averrhoa bilimbi L) dapat mencegah pertumbuhan biofilm P.aeroginosa secara in vitro.
Ekstrak air belimbing wuluh (Averrhoa bilimbi L) dapat menghambat pertumbuhan biofilm P.aeroginosa secara in vitro.
Ekstrak air belimbing wuluh (Averrhoa bilimbi L) dapat menghancurkan biofilm P.aeroginosa secara in vitro.
Kondisi optimal pada aktivitas terseleksi terletak pada level maksimal dari ketiga faktor (suhu, konsentrasi, waktu inkubasi).
1.5 Manfaat Penelitian
Menjadi alernatif sebagai bahan alam yang memiliki aktivitas sebagai antibiofilm terhadap pertumbuhan biofilm bakteri P.aeruginosa.
Menambah wawasan dan pengetahuan penulis dalam bidang eksperimen tentang pemanfaatan sari buah belimbing wuluh (Averrhoa
bilimbi L) sebagai antibiofilm bakteri P.aeroginosa secara in vitro.
Menjadi referensi untuk mahasiswa farmasi di UIN Syarif Hidayatullah khususnya yang ingin melakukan penelitian tentang aktivitas
BAB II TINJAUAN PUSTAKA
2.1 Infeksi
Infeksi merupakan salah satu masalah serius dalam bidang
kesehatan yang terus berkembang di Indonesia. Infeksi dapat disebabkan
oleh berbagai mikroorganisme seperti bakteri, virus, jamur dan protozoa
(Gibson, 1996). Penyakit yang disebabkan infeksi merupakan hasil
interaksi antara mikroorganisme dan sistem imun tubuh. Hasil interaksi ini
sangat bervariasi mulai dari tidak menimbulkan efek sama sekali sampai
dengan kematian. Hal tersebut tergantung jumlah dan virulensi
mikroorganisme, efek fisiologi dan anatomi yang terpengaruh, dan
efektivitas sistem imun tubuh (Todd et al., 2007).
Infeksi mikroba dapat dikontrol oleh antimikroba. Antimikroba
adalah obat yang digunakan untuk memberantas infeksi mikroba pada
manusia (Munaf, 1994). Namun, efektivitas antimikroba saat ini menurun
akibat resisten banyak obat (Donlan, 2003). Resistensi mikroba adalah keadaan dimana mikroorganisme berubah sedemikian rupa sehingga
menyebabkan obat-obat yang dahulu digunakan untuk pengobatan infeksi
menjadi tidak efektif. Resistensi antibiotik terhadap mikroba menimbulkan
beberapa konsekuensi yang fatal. Penyakit infeksi yang disebabkan oleh
bakteri yang gagal berespon terhadap pengobatan mengakibatkan
perpanjangan penyakit, meningkatnya resiko kematian dan semakin
lamanya masa rawat inap di rumah sakit (Deshpande et al., 2011).
2.2 Biofilm
2.2.1 Definisi Biofilm
Biofilm merupakan bentuk struktural dari sekumpulan
mikroorganisme yang dilindungi oleh matrik ekstraseluler yang disebut
Extracelluler Polymeric Substance (EPS), dimana EPS merupakan produk
yang dihasilkan sendiri oleh mikroorganisme tersebut dan dapat
di dalam biofilm mampu bertahan terhadap antibiotik, desinfektan, bahkan
mampu tahan terhadap sistem immunitas hospesnya. Di dalam lapisan
biofilm, mikroba cenderung tumbuh dan berkembang dengan pesat hingga
membentuk koloni terutama pada permukaan bahan yang lembab dan kaya
akan nutrisi (Tarver, 2009).
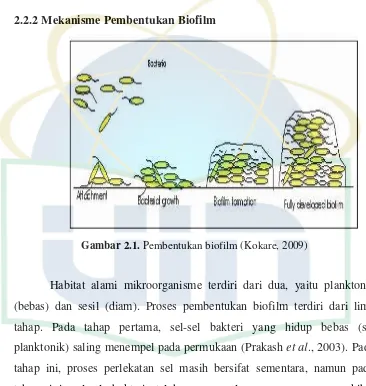
2.2.2 Mekanisme Pembentukan Biofilm
Gambar 2.1. Pembentukan biofilm (Kokare, 2009)
Habitat alami mikroorganisme terdiri dari dua, yaitu planktonic
(bebas) dan sesil (diam). Proses pembentukan biofilm terdiri dari lima
tahap. Pada tahap pertama, sel-sel bakteri yang hidup bebas (sel
planktonik) saling menempel pada permukaan (Prakash et al., 2003). Pada
tahap ini, proses perlekatan sel masih bersifat sementara, namun pada
tahap ini sel-sel bakteri telah menempel secara permanen akibat
terbentuknya material eksopolimer yang merupakan suatu senyawa perekat
yang lebih kuat.
Pada tahap ketiga yang disebut maturasi I ditandai dengan
terbentuknya mikrokoloni dan biofilm mulai terbentuk. Sementara pada
tahap keempat atau maturasi II, biofilm yang terbentuk semakin banyak
dan membentuk struktur tiga dimensi yang mengandung sel-sel
lainnya. Pada tahap terakhir, perkembangan struktur biofilm
mengakibatkan terjadinya dispersi sel sehingga sel-sel tersebut berpindah
dan membentuk biofilm yang baru. Sel-sel biofilm menggunakan sebagian
besar energi untuk membentuk eksopolisakarida yang dibutuhkan sel
sebagai nutrisi (Watnick and Kolter, 2000).
Pembentukan biofilm juga tergantung dari konsentrasi nutrisi yang
tersedia dan diatur oleh suatu zat kimia komplek yang dikeluarkan oleh sel
sebagai komunikasi antar sel. Sebagai contoh, ketika hidup bebas,
P.aeruginosa menghasilkan molekul signal dalam kadar yang rendah.
Tetapi ketika P.aeruginosa membentuk biofilm, maka konsentrasi molekul
signal akan meningkat dan menimbulkan perubahan aktifitas dari gen-gen,
salah satunya adalah gen yang mengatur sintesis dari alginat untuk
pembentukan matriks ekstraseluler (Donlan, 2002).
2.2.3 Komposisi dan Struktur Biofilm
Komponen utama biofilm terdiri dari sel-sel mikroorganisme
(15%) dan bahan matriks yang terdiri dari campuran komponen seperti
protein, asam nukleat, karbohidrat dan zat lainnya(85%). Eksopolisakarida
yang dihasilkan berbeda-beda komposisi dan sifat kimiawinya. Beberapa
merupakan makromolekul yang bersifat netral. Mayoritas bermuatan
karena adanya asam uronat, asam D-galakturonat, dan asam D-manuroniat
(Davey, 2000).
Ikatan eksopolisakarida pada biofilm bersifat kaku. Jumlah
eksopolisakarida yang dihasilkan oleh organisme berbeda-beda. Jumlah
eksopolisakarida akan meningkat seiring dengan bertambahnya usia
biofilm tersebut. Eksopolisakarida yang dihasilkan tergantung dari
kandungan nutrisi dan media pertumbuhan. Kekurangan nitrogen,
potassium dan fosfat juga dapat meningkatkan sintesis eksopolisakarida
(Donlan, 2002).
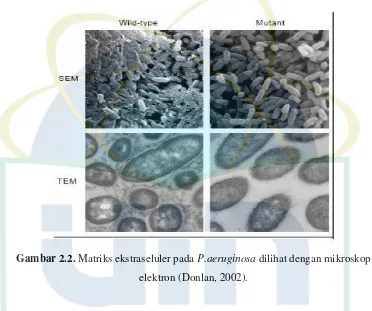
Biofilm adalah polimorfik dan dapat menyesuaikan struktur
terhadap perubahan jumlah nutrisi, yang telah ditunjukkan oleh percobaan
tinggi, mikrokoloni tumbuh dengan cepat dan akibatnya ketebalan biofilm
meningkat secara signifikan. Penelitian sebelumnya telah menunjukkan
bahwa perubahan struktur biofilm tergantung pada aliran.Pada aliran
laminar mikrokoloni bakteri menjadi bulat, dan dalam aliran turbulen
mereka berbentuk panjang ke arah hilir (Stoodley et al., 1998).
Gambar 2.2. Matriks ekstraseluler pada P.aeruginosa dilihat dengan mikroskop elektron (Donlan, 2002).
2.2.4Faktor-faktor yang Mempengaruhi Perlekatan Sel-Sel Bakteri dalam Pembentukan Biofilm (Costerton dan Stewart, 2001)
Efek substratum (permukaan)
Perlekatan terjadi lebih baik pada permukaan yang kasar, karena
akan menurunkan kekuatan aliran yang dapat melepaskan biofilm, dan
permukaan yang kasar mempunyai luas permukaan yang lebih besar. Hal
lain adalah mikroorganisme lebih baik melekat pada permukaan yang
hidrofobik seperti teflon dan plastik dibandingkan gelas atu logam.
Kondisi film
Permukaan yang terpapar oleh media cair akan segera ditutupi oleh
polimer-polimer dari medium dan menimbulkan modifikasi kimiawi yang
mikroorganisme pada permukaan tersebut. Contohnya yang terjadi pada
enamel gigi yang dilapisi oleh proteinaceous film yang disebut “acquired pellicle” dimana sel-sel bakteri akan melekat pada enamel dalam beberapa jam paparan.
Hidrodinamik
Semakin cepat aliran cairan yang terjadi maka semakin
mempercepat perlekatan sel pada permukaan karena sel-sel akan
bertubulensi dan berputar. Hal ini terbatas sampai kecepatan tidak
melepaskan perlekatan sel-sel dari permukaan.
Karakteristik media cairan
Seperti pH, suhu, jumlah zat gizi, kation dan adanya antimikroba
akan mempengaruhi perlekatan.
Keadaan permukaan sel bakteri
Permukaan sel yang hidrofobik, adanya fimbriae, flagel dan
polisakarida atau protein pada permukaan sel bakteri akan mempermudah
perlekatan, terutama bila terjadi kompetisi dalam suatu kumpulan
mikroorganisme.
2.2.5 Transfer Gen
Biofilm ternyata merupakan tempat yang ideal bagi pertukaran
DNA ekstrakromosal (plasmid). Tingkat konyugasi dalam biofilm lebih
tinggi dibandingkan pada sel-sel yang bebas. Konyugasi ini diperlukan
dalam pembentukan biofilm, Pilus konyugatif F (dikode oleh operontra
pada plasmid) berperan sebagai faktor adesi pada permukaan antar sel,
sehingga membentuk biofilm tiga dimensi pada E.coli. Karena plasmid
juga dapat membawa gen yang mengatur resistensi terhadap antibiotika
maka biofilm juga berperan dalam penyebaran resistensi bakteri terhadap
antibiotika.
2.2.6 Quorum Sensing
Quorum sensing merupakan suatu proses yang memungkinkan
disebut autoinduser atau molekul sinyal seperti bahasa. Proses ini
memungkinkan suatu populasi bakteri dapat mengatur ekspresi gen
tertentu. Konsentrasi autoinduser di lingkungan sebanding dengan jumlah
bakteri yang ada. Dengan mendeteksi autoinduser, suatu bakteri mampu
mengetahui keberadaan bakteri lain di lingkungannya.
Molekul sinyal juga memperlihatkan peranannya dalam
pembentukan biofilm. Sebagai contoh adalah homoserin lakton yang
merupakan sinyal utama yang terdapat pada P. aeruginosa (Donlan, 2001).
2.2.7 Peran Biofilm terhadap Mikroba
Peran biofilm terhadap mikroba adalah sebagai berikut :
Perlindungan
Bakteri mengeluarkan zat ekstra-polimer yang sangat penting yang
dikenal sebagai eksopolisakarida. Matriks ini melindungi bakteri dari
lingkungan eksternal seperti radiasi UV, pergeseran pH, suhu, gerakan
osmotik, dan pengeringan tanpa mempengaruhi pasokan nutrisinya
(Nichols et al.,1988).
Nutrisi
Kegiatan metabolisme bakteri dalam biofilm berbeda dengan
sel-sel planktonik. Didalam biofilm, bakteri memiliki akses terbatas terhadap
nutrisi dan memiliki pasokan oksigen yang rendah. Mereka berkomunikasi
satu sama lain dengan saluran selular dan sinyal lingkungan (Decho ,1990;
Flemming ,1993).
Variasi genetik
Munculnya bakteri resisten menjadi perhatian besar karena
penggunaan yang luas antibiotik rekayasa genetika mikroorganisme dan
sebagainya. Bakteri yang berada di dalam biofilm akan berkonjugasi dan
2.2.8 Pemeriksaan Biofilm
Pemeriksaan biofilm :
Mikroskop elektron dapat memeriksa biofilm pada alat-alat medik dan
pada infeksi manusia. Pada awalnya, mikroskop elektron ini merupakan
alat yang penting dalam mempelajari biofilm.
Concofocal Laser Scanning Microscope (CLSM) dengan fluoresen antisera dan fluoresen in situ hibridisasi, sehingga organisme yang
spesifik dan untuk mengidentifikasi dalam komunitas campuran kuman.
2.2.9 Resistensi Biofilm terhadap Antibiotik (Lewis, 2001; Stewart dan
Costeron, 2001; Mah dan Toole, 2001)
Struktur dan fisiologik dasar dari biofilm membuat biofilm secara
alami resisten terhadap agen antimikroba seperti antibiotik, desinfektan,
dan germisida. Hal ini dapat dilihat dari adanya perbedaan yang besar
dalam hal kepekaan terhadap antibiotik pada sel biofilm dan
planktoniknya. Faktor-faktor yang diperkirakan bertanggung jawab
terhadap resistensi biofilm adalah :
Penurunan penetrasi dari antimikroba
Biofilm terbungkus dalam matriks eksopolimer yang dapat
menghambat difusi dari substansi dan mengikat antibiotik.
Penurunan tingkat pertumbuhan organisme dalam biofilm
Antimikroba lebih efektif dalam membunuh sel-sel yang tumbuh
dengan cepat. Beberapa antibiotik memerlukan secara mutlak sel-sel yang
tumbuh dalam mekanisme penghambatannya.
Ekspresi dari gen resistensi yang spesifik dari biofilm
Hal ini dapat terlihat pada resistensi biofilm bakteri P.aeruginosa,
dimana MDR (Multi Drug Resistan) memainkan peranan penting pada
konsentrasi antibiotik yang rendah. Beta-galaktosidase berperan dalam
respon P.aeruginosa terhadap imipenem dan pipeacilin.
Faktor-faktor resistensi diatas dapat berdiri sendiri atau dapat
merupakan gabungan dari semua faktor yang ada. Beberapa eksperimen
daripada populasi sel planktonik. Persister ini biasanya dihancurkan oleh
sistem imun, dan menjadi masalah saat sistem imun tidak berfungsi.
Infeksi biofilm lebih kurang sama dengan infeksi sel planktonik tanpa
kehadiran sistem imun, eksopolimer dari biofilm melindungi sel dari
komponen sistem imun.
Pada awal aplikasi antibiotik yang bersifat bakterisidal akan terjadi
eradikasi hampir semua populasi, meninggalkan sedikit fraksi persister
yang bertahan. Jika konsentrasi antibiotik turun atau terapi dihentikan saat
gejala penyakit sudah hilang, maka persister akan membentuk biofilm
kembali. Dinamika ini menjelaskan adanya relaps pada infeksi biofilm dan
perlunya terapi yang lebih lama.
2.2.10 Kontrol biofilm
Kontrol biofilm dapat dilakukan dengan cara sebagai berikut :
Fisika
Yaitu memanfaatkan suhu yang tinggi atau pemanasan. Sanitasi
dengan menggunakan air panas lebih menguntungkan karena air panas
mudah tersedia dan tidak beracun. Peralatan kecil seperti pisau, serta
bagian-bagian alat pengolahan pangan dapat direndam dalam air yang
dipanaskan suhu 80-1000C (Silitonga et al., 2012).
Kimia
Biologi
Yaitu dengan menggunakan bakteriofaga. Pada dasarnya bakteriofaga merupakan virus yang menginfeksi bakteri melalui jalur yang
spesifik serta bersifat non-toksik terhadap manusia, sehingga memiliki
potensi yang baik untuk dikembangkan sebagai bahan pengendali biofilm
mikroba pada produk pangan (Kudva et al., 1999).
Selain itu, kontrol biofilm juga dapat dilakukan dengan adanya
interaksi mikrobiologis. Banyak bakteri yang mampu mensintesis dan
mensekresikan biosurfaktan dengan sifat anti lekat yang kuat (Desai and
Banat, 1997; Rodriguez et al., 2004; Nitschke and Costa, 2007). Surfaktan
yang dihasilkan oleh Bacillus subtilis mampu meluruhkan biofilm tanpa
mengganggu pertumbuhan sel serta mampu mencegah pembentukan
biofilm baru oleh Salmonella enterica, E. coli dan Proteus mirabilis
(Mireles et al., 2001)
2.3 Bakteri Uji (P.aeruginosa) 2.3.1 Klasifikasi
P.aeruginosa termasuk famili Pseudomonadaceae. P.aeruginosa
adalah patogen oportunistik, yaitu memanfaatkan kerusakan pada
mekanisme pertahanan inang untuk memulai suatu infeksi. Bakteri ini
dapat menyebabkan infeksi saluran kemih, infeksi saluran pernafasan,
dermatitis, infeksi jaringan lunak, bakteremia, infeksi tulang dan sendi,
infeksi saluran pencernaan dan bermacam-macam infeksi sistemik,
terutama pada penderita luka bakar berat, kanker, dan penderita AIDS
yang mengalami penurunan sistem imun (Todar, 2004). P.aeruginosa
menyebabkan kontaminasi pada perlengkapan anestesi dan terapi
pernafasan, cairan intravena, bahkan air hasil proses penyulingan.
Endoskopi, termasuk bronkoskopi adalah alat-alat medik yang paling
sering dihubungkan dengan berjangkitnya infeksi nosokomial. (Todar,
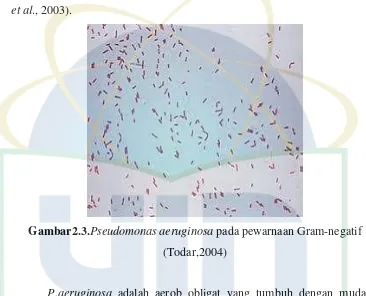
2.3.2 Karakteristik
P.aeruginosa adalah bakteri Gram-negatif berbentuk batang lurus
atau lengkung,berukuran sekitar 0,6 x 2 µm. Dapat ditemukan satu-satu,
berpasangan, dan kadang-kadang membentuk rantai pendek, tidak
mempunyai selubung (sheath), serta mempunyai flagel monotrika (flagel
tunggal pada kutub) sehingga selalu bergerak (Jawetzet al., 2001; Madigan
et al., 2003).
Gambar2.3.Pseudomonas aeruginosa pada pewarnaan Gram-negatif (Todar,2004)
P.aeruginosa adalah aerob obligat yang tumbuh dengan mudah
pada banyak jenis pembiakan, karena memiliki kebutuhan nutrisi yang
sangat sederhana. Di laboratorium, medium paling sederhana untuk
pertumbuhannya terdiri dari asetat (untuk karbon) dan ammonium sulfat
(untuk nitrogen). Metabolisme bersifat respiratorik tetapi dapat tumbuh
tanpa O2 bila tersedia NO3 sebagai akseptor elektron. Kadang-kadang
berbau manis atau menyerupai anggur yang dihasilkan aminoasetofenon
(Todar, 2004; Jawetzet al., 2001).
P.aeruginosa tumbuh dengan baik pada suhu 37-420C.
Pertumbuhannya pada suhu 420C membantu membedakannya dari spesies
pseudomonas lain (Balows et al.,1991). P.aeruginosa dalam biakan dapat
menghasilkan berbagai jenis koloni sehingga memberi kesan biakan dari
aktivitas biokimia dan enzimatik berbeda serta pola kepekaan antimikroba
yang berbeda pula. Isolat dari tanah atau air mempunyai ciri koloni yang
kecil dan tidak rata. Pembiakan dari spesimen klinik biasanya
menghasilkan satu atau dua tipe koloni yang halus :
Koloni besar dan halus dengan permukaan rata dan meninggi
Koloni halus dan mukoid sebagai hasil produksi berlebihan dari alginat.
Gambar 2.4. Koloni P.aeruginosa pada agar (Todar, 2004)
Alginat adalah suatu eksopolisakarida yang merupakan polimer
dari glucuronic acid dan mannuronic acid, berbentuk gel kental
disekeliling bakteri. Alginat memungkinkan bakteri-bakteri untuk
membentuk biofilm, yaitu kumpulan koloni sel-sel mikroba yang
menempel pada suatu permukaan misalnya kateter intravena, atau jaringan
paru. Alginat dapat melindungi bakteri dari pertahanan tubuh inang seperti
limfosit, fagosit, silia di saluran pernafasan, antibodi, dan komplemen.
P.aeruginosa membentuk biofilm untuk mambantu kelangsungan
hidupnya saat membentuk koloni pada paru-paru manusia (Todar, 2004;
2.3.3 Resistensi terhadap Antibiotik
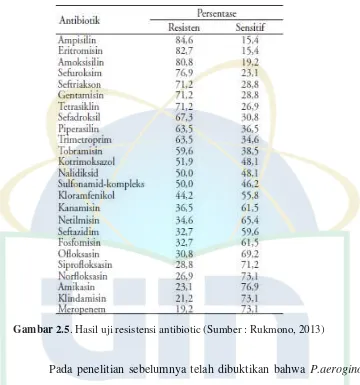
Gambar 2.5. Hasil uji resistensi antibiotic (Sumber : Rukmono, 2013)
Pada penelitian sebelumnya telah dibuktikan bahwa P.aeroginosa
telah resisten terhadap beberapa antibiotik. Jumlah antibiotik yang
digunakan 25 jenis. Gambar 2.5 memperlihatkan 14 jenis antibiotik (nomor urut 1−14) didapatkan >50% spesimen telah resisten. Antibiotik yang paling resisten adalah ampisilin, eritromisin, amoksisilin, sefurosim,
seftriason, gentamicin,tetrasiklin, sefadroksil, piperasilin, trimetroprim,
tobramisin, kotrimoksazol, nalidisid, sulfonamide kompleks.
Sementara 11 jenis antibiotik sebagian besar (<50%) masih sensitif yaitu dari urutan kloramfenikol sampai meropenem. Adapun untuk
golongan sefalosforin, sebagian besar spesimen masih sensitif mulai dari
antibiotik yang paling sensitif, berturut-turut adalah meropenem,
klindamisin, amikasin, norfloksasin, siprofloksasin, ofloksasin, fosfomisin,
2.3.4 Gambaran Klinik
P.aeruginosa menimbulkan infeksi pada luka dan luka bakar
tingkat II dan III dengan nanah hijau kebiruan disebabkan pigmen
piosianin, meningitis bila masuk lewat punksi lumbal, dan infeksi saluran
kemih bila masuk bersama kateter dan instrument lain atau dalam larutan
untuk irigasi. Keterlibatan saluran pernafasan, terutama dari respirator
yang terkontaminasi, menyebabkan pneumonia yang disertai nekrosis.
Bakteri ini sering ditemukan pada perenang dengan otitis eksterna ringan,
serta dapat menyebabkan otitis eksterna invasif (maligna) pada penderita
diabetes. Infeksi mata yang dengan cepat mengakibatkan kerusakan mata,
sering terjadi setelah cedera atau pembedahan. Pada bayi atau orang yang
lemah dapat menyerang aliran darah dan mengakibatkan sepsis yang fatal,
biasanya terjadi pada penderita leukemia atau limfoma yang mendapat
obat antineoplastik atau terapi radiasi, dan pada penderita dengan luka
bakar berat (Jawetz et al.,2001; Tortora et al.,2004).
Pada sebagian besar infeksi, gejala dan tanda-tandanya tidak
spesifik dan berkaitan dengan organ yang terlibat. Terkadang, verdoglobin
(suatu produk pemecah hemoglobin) atau pigmen yang berfluorosen dapat
dideteksi pada luka, luka bakar, atau urin dengan penyinaran fluorosen
ultraviolet. Nekrosis hemoragik pada kulit sering terjadi pada sepsis akibat
P.aeruginosa. Lesi yang disebut ektima gangrenosum ini dikelilingi oleh
eritema dan sering tidak berisi nanah. P.aeruginosa dapat dilihat pada
spesimen dari lesi ektima yang diberi pewarnaan Gram, dan biakannya
positif. Ektima gangrenosum tidak lazim pada bakteremia akibat
organisme lain (Jawetz et al.,2001).
2.3.5 Epidemiologi
P.aeruinosa terdapat di tanah dan air, dan pada 10% orang
merupakan flora normal di kolon. Dapat dijumpai pada daerah lembab
dikulit dan dapat membentuk koloni pada saluran pernafasan bagian atas
banyak tempat di rumah sakit. Disinfektan, alat bantu pernafasan,
makanan, saluran pembuangan air, dan kain pel merupakan beberapa
contoh reservoir.
Suatu penelitian di unit perawatan intensif neonates menyatakan
bahawa P.aeruginosa paling sering membentuk koloni disaluran
pernafasan dan saluran pencernaan. Hal ini terutama dijumpai pada bayi
prematur oleh karena pH lambung sering tinggi sehingga mendukung
pertumbuhan bakteri. Penyebaran terjadi dari pasien ke pasien lewat
tangan karyawan rumah sakit, melalui kontak langsung dengan reservoir,
atau lewat pencernaan makanan dan minuman yang telah terkontaminasi
(Todar, 2004; Foca et al.,2000).
P.aeruginosa menyebabkan kontaminasi pada perlengkapan
anastesi dan terapi pernafasan, cairan intravena, bahkan air hasil proses
penyulingan. Karena merupakan patogen nosokomial, maka metode untuk
mengendalikan infeksi ini mirip dengan metode untuk nosokomial lainnya
(Jawetz et al.,2001; Fiorillo et al.,2001).
2.3.6 Pencegahan dan Pengobatan
Pencegahan meliputi eliminasi sumber-sumber potensial bakteri
dan perawatan segera terhadap luka. Pembuangan secara hati-hati jaringan
mati pada penderita luka bakar, diikuti dengan penggunaan krim
antibakteri. Infeksi yang telah terbentuk sulit untuk diobati karena
P.aeruginosa sering resisten terhadap banyak antibiotik. Karena angka
keberhasilan suatu pengobatan cukup rendah, dan bakteri cepat
membentuk resistensi bila digunakan hanya satu jenis antimikroba, maka
pengobatan sebaiknya secara kombinasi (Jawetz et al.,2001; Balows et
2.4 Belimbing wuluh (Avverhoa bilimbi L)
Gambar 2.6. Pohon belimbing wuluh (Averrhoa bilimbi L) (Sumber : koleksi pribadi)
2.4.1 Taksonomi
Klasifikasi ilmiah tanaman belimbing wuluh adalah:
Kingdom : Plantae,
Subkingdom : Tracheobionta,
Superdivisio : Spermatophyta,
Divisio : Magnoliophyta,
Kelas : Magnoliopsida,
Sub-kelas : Rosidae,
Ordo : Geraniales,
Familia : Oxalidaceae,
Genus : Averrhoa,
Spesies : Averrhoa bilimbi L
2.4.2Morfologi
Belimbing wuluh disebut juga sebagai belimbing sayur yang
merupakan tumbuhan yang hidup pada ketinggian 5 hingga 500 meter
diatas permukaan laut. Ditanam sebagai pohon buah, kadang tumbuh liar.
Pohon belimbing bisa tumbuh dengan ketinggian mencapai 5-10 meter.
(tidak rata). Daunnya majemuk, berselang-seling, panjang 30-60 cm dan
berkelompok di ujung cabang. Pada setiap daun terdapat 11 sampai 37
anak daun yang berselang-seling atau setengan berpasangan. Anak daun
berbentuk oval (Nugrahawati et al., 2009).
Buahnya memiliki rasa asam sering digunakan sebagai bumbu
masakan dan campuran ramuan jamu. Bunganya kecil, muncul langsung
dari batang dengan tangkai bunga berambut. Buah belimbing wuluh
(Averrhoa bilimbi L) berbentuk elips hingga seperti torpedo, dengan
panjang 4-10 cm. warna buah ketika muda hijau, dengan sisa kelopak
bunga menempel diujungnya. Jika masak buahnya berwarna kuning atau
kuning pucat. Daging buahnya berair dan sangat asam. Kulit buah berkilap
dan tipis. Bijinya kecil (6 mm), berbentuk pipih, dan berwarna coklat, serta
tertutup lendir (Nugrahawati et al., 2009).
2.4.3 Kandungan Kimia
Buah belimbing wuluh (Averrhoa bilimbi L) mengandung banyak
vitamin C alami yang berguna sebagai penambah daya tahan tubuh dan
perlindungan terhadap sebagai penyakit. Belimbing wuluh mempunyai
kandungan unsur kimia yang disebut asam oksalat dan kalium.Hasil
pemeriksaan kandungan kimia buah belimbing wuluh (Averrhoa bilimbi L)
mengandung golongan senyawa oksalat, minyak menguap, fenol,
flavonoid, dan pektin (Parkesit dan Mario, 2009).
Ekstrak etanol dari buah belimbing menunjukkan uji positif pada
pengujian flavanoid dan terpenoid. Dari penelitian senyawa flavonoid
bersifat aktif sebagai antimikroba. Senyawa flavonoid merupakan salah
satu antimikroba yang bekerja dengan menganggu fungsi membran
sitoplasma (Samad, 2008; Parikesit, 2011). Ekstrak tanaman yang
mengandung flavonoid berpotensi dapat menghambat intercellular
adhesion genes icaA dan icaD yang menjadi salah satu faktor
pembentukan biofilm (Lee et al., 2013). Selain mengandung senyawa yang
telah disebutkan, buah belimbing wuluh juga diketahui mengandung
Katzung dalam Hartini (2012) saponin merupakan senyawa yang memiliki
tegangan permukaan yang kuat yang berperan sebagai antimikroba dengan
mengganggu kestabilan membran sel bakteri yang menyebabkan lisis sel.
Hal ini disebabkan karena saponin yang merupakan senyawa semipolar
dapat larut dalam lipid dan air, sehingga senyawa ini akan terkonsentrasi
dalam membrane sel mikroba.
Kandungan gizi buah belimbing wuluh (Averrhoa bilimbi L) per
100 gram adalah energi (23 kcal), protein (0.7 g), lemak (0.2 g),
karbohidrat (4.5 g), serat kasar (1.5 g), abu (0.3 g), kalsium (8 mg), fosfor
(11 mg), besi (0.4 mg), beta karoten (100ug), vitamin A (17ug), Thiamin
(0.01 mg), riboflavin (0.03 mg), niacin (0.3mg), vitamin C (18mg), kadar
air (94.3g) (Parkesit dan Mario, 2009).
2.4.4 Khasiat dan Kegunaan
Di kalangan masyarakat belimbing wuluh ternyata sangat popular, bahkan melebihi belimbing manis. Perasan air buah belimbing wuluh
(Averrhoa bilimbi L) sangat baik untuk asupan kekurangan vitamin C.
banyak hasil penelitian yang menyebutkan potensi suatu tanaman dalam
mengobati penyakit tertentu ataupun sebagai antibakteri. Akan tetapi,
penggunaan bahan antimikroba kimia, di lingkungan masyarakat dalam
produk pangan lebih popular. Hal ini dikarenakan kegunannya sebagai
pengawet lebih efektif dan biayanya relatif murah (Parkesit, Mario 2009).
Ada yang memanfaatkan buah belimbing wuluh sebagai obat untuk
sariawan, sakit perut, gondongan, rematik, batuk rejan, gusi berdarah, sakit
gigi berlubang, memperbaiki fungsi pencernaan, untuk membersihkan
noda pada kain, menghilangkan bau amis, sebagai bahan kosmetik serta
mengkilapkan barang-barang yang terbuat dari kuningan (Parkesit, Mario
BAB III
METODE PENELITIAN
3.1 Tempat dan Waktu
Penelitian dilaksanakan di Laboraturium Genetika dan Mikrobiologi
Lembaga Ilmu Pengetahuan Indonesia (LIPI) Cibinong dan Laboratorium
PDR (Phamacy Drugs and Research Development) Fakultas Kedokteran
dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
Waktu pelaksanaan penelitian 1-2 bulan dan dimulai pada bulan Maret
sampai dengan April 2015.
3.2 Alat dan Bahan 3.2.1 Alat Penelitian
Alat-alat yang digunakan dalam penelitian ini adalah blender
(Miyako), pisau , kain lap, kertas saring, cawan penguap, erlenmeyer
(Pyrex) , spatula, corong, cawan petri, jarum ose, bunsen, gelas ukur
(Pyrex), tabung reaksi (Pyrex), pipet tetes, rak, pipet mikro (Pipette Gilson)
, incubator (Sanyo MR 162), timbangan analitik (AND GF-02), autoklaf
(Hirayama), microwave (Sanyo), freezedryer, Laminar Air Flow (LAF),
vortex (Barnstead), microtitterplate flat-buttom polystyrene 96 well,
iMark-Biorad Microplate Reader.
3.2.2 Bahan Penelitian
Bahan uji : buah belimbing wuluh (Averrhoa bilimbi L) yang diperoleh dari kelurahan Cirendeu, Ciputat timur
RT 04 RW 09 Ciputat, Kota Tangerang Selatan,
Banten pada tanggal 8 Maret 2015.
Bakteri uji : kultur P.aeruginosa yang merupakan koleksi dari Laboratorium Mikrobiologi Lembaga Ilmu
Pengetahuan Indonesia (LIPI) Cibinong yang
Bahan kimia : Amoniak 1%, larutan HCl, kloroform, pereaksi Dragendroff, pereaksi Mayer, serbuk Mg, larutan
NaOH, FeCl3, eter, asam asetat, etanol 96%,
butanol, formaldehid 30%, natrium asetat,
petroleum eter, kristal violet 1 %, safranin, lugol,
NaCl fisiologis, aquades.
Bahan lainnya :Media Heterotrof (pepton, tripton, NaCl, K2HPO4, glukosa), dan media Pseudomonas Isolation agar
(PIA) (komposisi : pepton, irgasan, cloruro di
magnesio, solfato di pottasio, agar), Biorem 1
(alkaline detergent) dan Biorem 10 (enzyme
cocktail).
3.3 Prosedur Penelitian
3.3.1 Identifikasi Belimbing wuluh (Averrhoa bilimbi L)
Dilakukan determinasi terhadap belimbing wuluh (Averrhoa bilimbi
L) di Herbarium Bogoriense Lembaga Ilmu Pengethauan Indonesia-Kebun
Raya Bogor. Tujuannya adalah untuk memastikan klasifikasi dari tanaman
yang kita gunakan dalam penelitian.
3.3.2 Karakterisasi Sampel dan Penyiapan Ekstrak air Belimbing wuluh (Averrhoa bilimbi L) (Prayogo et al., 2011)
1 kg buah belimbing wuluh (Averrhoa bilimbi L) segar dicuci
terlebih dahulu sampai bersih kemudian diukur rerata panjang dan diameter
buahnya dan kemudian dipotong kecil-kecil, selanjutnya, potongan
belimbing wuluh (Averrhoa bilimbi L) diblender sampai benar-benar
hancur. Hasil jus kemudian disaring dengan menggunakan kain lap bersih
dan kertas saring Whatman no.1. Hasil saringan sebanyak 50 ml ditampung
ke dalam erlenmeyer, kemudian diuapkan dengan alat freezedryer selama 27
Tahap selanjutnya dilakukan menyiapkan larutan sari buah
belimbing wuluh (Averrhoa bilimbi L) dengan berbagai seri konsentrasi.
Konsentrasi larutan ekstrak air belimbing wuluh (Averrhoa bilimbi L) yang
digunakan pada penelitian ini adalah 0,5%, 1%, 2%, 4% dan 8%.
3.3.3 Uji Penapisan Fitokimia (Fransworth, 1966)
Penapisan fitokimia dilakukan pada serbuk buah belimbing wuluh
(Averrhoa bilimbi L). Tujuan dilakukan uji penapisan fitokimia adalah
untuk mengetahui kandungan apa saja yang terkandung di dalam buah
belimbing wuluh (Averrhoa bilimbi L).
Identifikasi Golongan Alkaloid
Metode yang pertama adalah dengan menggunakan plat KLT dan
reagen Dragendorff. Teteskan reagen Dragendorff pada sampel diatas plat
KLT. Bila terdapat noda naik dan berwarna merah atau oranye maka positif
mengandung alkaloid.
Identifikasi Golongan Flavonoid
1 gram sampel yang telah ditambahkan air sebanyak 5 ml dalam
tabung reaksi ditambahkan serbuk atau lempeng magnesium secukupnya
dan 1 mL HCl pekat, serta 5 mL anilin alkohol, dikocok dengan kuat lalu
dibiarkan hingga memisah. Jika terbentuk warna pada lapisan anilin alkohol
(lapisan atas) maka hal itu menunjukkan adanya senyawa golongan
flavonoid.
Identifikasi Golongan Saponin
Sebanyak 1 gram serbuk dan tambahkan aquades 5 ml dalam
tabung reaksi dan dikocok secara vertikal selama 10 detik, kemudian
dibiarkan selama 10 menit. Jika dalam tabung reaksi terbentuk busa yang
stabil dan jika ditambahkan 1 tetes HCl 1% busa tetap stabil maka hal itu
menunjukkan adanya senyawa golongan saponin.
Serbuk secukupnya dimasukan dalam tabung reaksi dan dikocok
dengan sedikit eter. Lapisan eter diambil lalu diteteskan pada 2 lubang plat
tetes dan dibiarkan sampai mengering. Setelah mengering, ditambahkan 2
tetes asam asetat anhidrat dan satu tetes asam sulfat pekat.Apabila terbentuk
warna orange, merah atau kuning berarti positif triterpenoid.Tetapi apabila
terbentuk warna hijau berarti positif steroid.
Identifikasi Golongan Fenolik
Serbuk secukupnya dikocok dengan sedikit eter dalam tabung reaksi,
lalu lapisan eter diteteskan pada plat tetes.Lapisan eter kemudian
dikeringkan.Setelah mengering, diteteskan larutan FeCl3.Apabila terbentuk
warna ungu atau biru berarti positif fenolik.
Identifikasi Golongan Kuinon
Serbuk secukupnya dimasukkan ke dalam tabung reaksi,
ditambahkan beberapa tetes larutan NaOH 1 N. Apabila terbentuk warna
merah maka hal itu menunjukkan adanya senyawa golongan kuinon.
3.3.4 Pembuatan Media Pseudomonas Isolation Agar (PIA) padat dan Heterotrof (HTR) cair
Tujuannya adalah untuk menyediakan nutrisi yang dibutuhkan oleh bakteri. Pertama yaitu pembuatan media Pseudomonas Isolation Agar (PIA)
padat. Sebanyak 4,5 gram Pseudomonas Isolation Agar (PIA) lalu
ditambahkan 100 ml aquades dan dipanaskan di microwave sampai
homogen, kemudian disterilisasi menggunakan autoklaf pada suhu 1210 C
selama 30 menit dan didinginkan. Media Pseudomonas Isolation Agar (PIA)
yang telah dingin, dituangkan ke dalam cawan petri sebanyak 20 ml dan
didiamkan selama 24 jam di dalam Laminar Air Flow (LAF) sambil
disterilisasi dengan sinar UV. Media selanjutnya yang dibuat adalah media
Heterotrof (HTR) cair. Sebanyak pepton 15 gram, K2HPO4 2,5 gram,
glukosa 2,5 gram, NaCl 5 gram dan tripton 3 gram dan dilarutkan dalam
selanjutnya disterilisasi menggunakan autoklaf pada suhu 1210 C selama 30
menit.
3.3.5 Inokulasi Bakteri pada Media Pseudomonas Isolation Agar (PIA) padat (Deby et al., 2012)
Inokulasi dilakukan untuk memindahkan dan meremajakan
bakteri.Teknik yang digunakan adalah Streak Plate. Jarum ose dipanaskan
terlebih dahulu sampai berpijar, lalu didinginkan, kemudian buka mulut
cawan yang berisi kultur bakteri P.aeruginosa dan bakteri diambil dengan
cara menggoreskan ose ke inokulum, lalu tutup mulut cawan dan panaskan
kembali. Ose digoreskan pada media Pseudomonas Isolation Agar (PIA)
padat dengan metode gores kontinyu, kemudian tutup mulut cawan dan
panaskan kembali di api, selanjutnya diinkubasi pada suhu 370C selama 24
jam.
3.3.6 Karakterisasi bakteri Pseudomonas aeruginosa
Karakterisasi bakteri P.aeruginosa dilakukan dengan cara pewarnaan Gram. Pewarnaan Gram dilakukan dengan tujuan untuk
mengidentifikasi isolat bakteri yang akan digunakan dalam penelitian.
Bahan yang digunakan pada pewarnaan Gram adalah safranin, lugol, kristal
violet, etanol 70%, NaCl fisiologis. Goreskan sedikit isolat bakteri dengan
menggunakan ose dan diusapkan sedikit ke kaca objek, lalu tambahkan
sedikit NaCl fisiologis pada isolat untuk membuat suspensi bakteri.
Keringkan suspensi bakteri dan lakukan fiksasi di atas api bunsen, kemudian
tambahkan satu tetes kristal violet dan diamkan selama satu menit, bilas
dengan air keran lalu tambahkan satu tetes lugol dan diamkan selamat satu
menit dan kembali bilas dengan etanol 70%. Tambahkan satu tetes safranin
lalu bilas dengan air keran dan keringkan menggunakan mikroskop.
Bakteri P.aeruginosa yang telah diremajakan di media Pseudomonas Isolation Agar (PIA) padat diambil dengan jarum ose dan
dimasukkan ke dalam tabung reaksi berisi media heterotrof (HTR) cair 10
lalu dikocok-kocok sampai lepas. Tabung reaksi divortex selama 1 menit,
kemudian diinkubasi selama 24 jam pada suhu 37oC. Setelah diinkubasi
selama 24 jam, diukur nilai absorbansi pada panjang 600 nm menggunakan
spektrofotometri untuk mengetahui konsentrasi suspensi bakteri tersebut.
3.3.8 Uji Pembentukan dan Pertumbuhan Biofilm Bakteri P. aeruginosa (Prasasti and Hertiani, 2010)
Uji pembentukan dan pertumbuhan biofilm bakteri P.aeruginosa dilakukan untuk mengetahui berapakah waktu yang dibutuhkan
P.aeruginosa untuk membentuk biofilm yang paling baik. Uji pertumbuhan
biofilm P.aeruginosa dilakukan dengan metode Microtitter Plat Biofilm
Assay. Sebanyak 100 µL suspensi bakteri P.aeruginosa (OD 0,5) dan 100
µL media Heterotrof (HTR) cair dimasukkan ke dalam sumur microplate,
kemudian diinkubasi pada suhu 370C selama 1 hari, 2 hari, 3 hari dan 4 hari.
Setelah diinkubasi, cuci microplate dengan menggunakan air yang mengalir
sebanyak 3 kali dan keringkan, kemudian masukkan larutan kristal violet
1% sebanyak 200 µL dan didiamkan selama 15 menit. Setelah itu cuci
kembali microplate dengan air mengalir sebanyak 3 kali dan keringkan, lalu
masukkan etanol 96% sebanyak 200µL dan diamkan selama 15 menit,
kemudian dilakukan pembaca Optical Density (OD) biofilm P.aeruginosa
menggunakan alat iMark-Biorad Microplate Reader pada panjang
gelombang 595nm.
3.3.9 Uji Aktivitas Antibiofilm Secara In Vitro (Sandasi et al., 2010; Prasasti dan Hertiani, 2010)
Pencegahan Pertumbuhan Biofilm
Pengujian dilakukan terhadap sari buah belimbing wuluh dengan variasi
konsentrasi 0,5%, 1%, 2%, 4% dan 8% b/v. Pada pengujian ini, kontrol
negatif yang digunakan adalah sumur microplate yang berisi suspensi
bakteri dan media Heterotrof (HTR) tanpa penambahan sari buah belimbing
wuluh, tetapi tidak digunakan kontrol positif sebagai pembanding. Sebanyak
200 µL sari buah belimbing wuluh terlebih dahulu dimasukkan pada tiap
sumur, kecuali pada sumur kontrol negatif dan didiamkan selama 60 menit,
kemudian buang sari buah belimbing wuluh yang ada didalam sumur
microplate. Tambahkan sebanyak 100 µL suspensi bakteri dan 100 µL
media Heterotrof (HTR) cair pada sumur microplate sampel dan kontrol
negatif, kemudian diinkubasi selama 3 hari pada suhu 37oC.
Setelah masa inkubasi, microplate dicuci dengan menggunakan air
mengalir sebanyak tiga kali, kemudian ditambahkan 200 µL kristal violet
1% ke tiap sumur dan diinkubasi pada suhu ruang selama 15 menit.
Microplate dicuci kembali dengan menggunakan air mengalir sebanyak tiga
kali. Larutan etanol 96% sebanyak 200 µL ditambahkan ke tiap sumur dan
dilakukan inkubasi kembali pada suhu ruang selama 15 menit. Selanjutnya
dilakukan pembacaan Optical Density (OD) dengan menggunakan alat
iMark-Biorad Microplate Reader pada panjang gelombang 595nm.
Pengujian dilakukan secara triplo. Uji ini dilakukan untuk mengetahui
apakah sari buah belimbing wuluh dapat mencegah pertumbuhan biofilm
P.aeruginosa.
x 100%
Penghambatan Pertumbuhan Biofilm
Pembentukan biofilm pada penelitian ini diuji secara in vitro
menggunakan metode Microtitterplate flat-buttom polystyrene 96 wells.
Pengujian dilakukan terhadap sari buah belimbing wuluh dengan variasi
konsentrasi 0,5%, 1%, 2%, 4% dan 8% b/v. Pada pengujian ini, tidak
dilakukan penambahan sari buah belimbing wuluh terlebih dahulu seperti
pada pengujian pencegahan pertumbuhan biofilm, tetapi sari buah belimbing
Heterotrof (HTR) cair. Sebagaimana pada uji sebelumnya, kontrol negatif
yang digunakan adalah sumur microplate yang berisi suspensi bakteri dan
media Heterotrof (HTR) tanpa penambahan sari buah belimbing wuluh,
tetapi tidak digunakan kontrol positif sebagai pembanding. Tambahkan
media Heterotrof (HTR) cair sebanyak 60 µL,suspensi bakteri sebanyak 70
µL dan sari buah belimbing wuluh 70 µL pada masing-masing sumur,
kecuali sumur kontrol negatif, kemudian diinkubasi selama 3 hari pada suhu
37oC. Setelah masa inkubasi, microplate dicuci dan dilakukan prosedur
seperti pada uji sebelumnya. Pengujian ini dilakukan secara triplo. Uji ini
dilakukan untuk mengetahui apakah sari buah belimbing wuluh dapat
menghambat pertumbuhan biofilm P.aeruginosa.
x 100%
Degradasi Biofilm
Pengujian ini dilakukan sebagaimana pada uji pencegahan pertumbuhan dan penghambatan pertumbuhan biofilm. Perbedaan dengan
uji sebelumnya adalah sari buah buah belimbing wuluh ditambahkan pada
saat biofilm telah terbentuk, dan pada uji ini digunakan kontrol negatif dan
kontrol positif sebagai pembanding. Pada pengujian ini, kontrol negatif yang
digunakan adalah sumur microplate yang berisi suspensi bakteri dan media
Heterotrof (HTR) tanpa penambahan sari buah belimbing wuluh kontrol
positif yang digunakan yaitu biorem 1 dan biorem 10. Sebanyak 100 µL
suspensi bakteri dan 100 µL media Heterotrof (HTR) cair dimasukkan
kedalam sumur microplate sampel, kontrol negatif dan kontrol posotif.
Microplate kemudian diinkubasi selama 3 hari pada suhu 37oC. Setelah
diinkubasi, suspensi di dalam microplate dibuang kemudian dicuci dengan
menggunakan air sebanyak tiga kali, kemudian tambahkan sebanyak 200
µL sari buah belimbing wuluh dengan variasi konsentrasi 0,5%, 1%, 2%,
4% dan 8% b/v kecuali kontrol negatif, kemudian sebanyak 200 µL biorem
1 dan biorem 10 ditambahkan pada sumur microplate kontrol posotif.
dilakukan prosedur seperti pada uji sebelumnya. Pengujian dilakukan secara
triplo. Uji ini dilakukan untuk mengetahui apakah sari buah belimbing
wuluh dapat mendegradasi biofilm P.aeruginosa.
x100%
3.3.10 Analisis data
Data hasil pengujian aktivitas antibiofilm sari buah belimbing wuluh (Averrhoa bilimbi L) terhadap pencegahan pertumbuhan,
penghambatan pertumbuhan dan degradasi biofilm P.aeruginosa dianalisis
secara statistik dengan menggunakan metode One Way Anova (analisa
varians satu arah) dengan program Statistical Product Service Solution
(SPSS 16). Tujuan dilakukan analisa statistik adalah untuk melihat apakah
sari buah belimbing wuluh (Averrhoa bilimbi L) memperlihatkan perbedaan
yang signifikan sebagai antibiofilm P.aeruginosa. Setelah dianalisis, dipilih
salah satu aktivitas antibiofilm yang paling baik.
3.3.11 Optimasi Aktivitas Terseleksi (Bazeera et al., 2008)
Pada penelitian ini, optimasi aktivitas terseleksi dilakukan dengan
menggunakan metode Response Surface Analysis (RSA). Tujuannya adalah
untuk mengetahui konsentrasi ekstrak air belimbing wuluh, waktu inkubasi
dan suhu yang optimal. Optimasi dilakukan pada aktivitas yang telah
terseleksi pada uji sebelumnya menggunakan metode Response Surface
Analysis (RSA). Hal pertama yang harus dilakukan adalah membuat desain
rancangan pengujian, kemudian dilakukan uji aktivitas antibiofilm ekstrak
air belimbing wuluh (Averrhoa bilimbi L). Pengujian ini dilakukan
sebagaimana pada uji aktivitas antibiofilm yang telah dilakukan
sebelumnya, hanya saja konsentrasi ekstrak air belimbing wuluh, waktu
inkubasi dan suhu yang digunakan berbeda, yaitu sesuai hasil optimasi
sebelumnya. Data yang diperoleh kemudian dioptimasi dengan