PENG ARUH pH TANAH TERHADAP ANTAGONISME
Gliocladium
JimbriaturnGilm.
&
Abbott
PADA
T y t h i u m
SP.
PENYEBAB REBAH- KECAMBAH KETIMUN
( @ u c u m i s b a t i u u aL.)
Oleh
WANWAN HERAWAN
A24.0756
J U R U S A N HAMA D A N PENYAKIT TUMBUHAN F A K U L T A S P E R T A N l A N
RINGKASAN
WANWAN HERAWAN. Pengaruh pH Tanah terhadap Antagonisme Gliocladium fimbriatum Gilm. & Abbott Pada Pythium sp. Penyebab Rebah-Kecambah Ketimun (Cucumis sativus
L)
(Di bawah bimbingan MEITY SURADJI SINAGA dan BONNY POERNOMO WAHYU SOEKARNO).
Penelitian ini bertujuan untuk mengetahui pengaruh
kemasaman (pH) media PDA dan PDB terhadap pertumbuhan cendawan Gliocladium fimbriatum dan Pythium sp., pengaruh
berbagai pH media PDA terhadap antagonisme G. fimbriatum pada Pythium sp., pengaruh filtrat G. fimbriatum yang ditumbuhkan pada berbagai pH media PDB terhadap pertumbuhan Pythium sp. dan pengaruh pH tanah terhadap efektifitas G. fimbriatum dalam menghambat perkembangan dan patogenisitas Pythium sp. pada tanaman ketimun.
Pertumbuhan Pythium sp. dan G. fimbriatum secara tunggal pada media PDA dan PDB dengan pH 4, 5, 6, 7, dan 8, pengujian interaksi G. fimbriatum dan Pythium sp. pada media PDA dengan pH 4, 5, 6, 7, dan 8, dan pengujian kemampuan filtrat G. fimbriatum terhadap penghambatan pertumbuhan Pythium sp dilakukan secara in vitro. Peubah yang diamati pada pengujian interaksi kedua cendawan ialah persentase
penghambatan koloni Pythium sp. Sedangkan untuk pengujian
9
dan berat kering cendawan. Data dianalisa secara statistik berdasarkan rancangan acak lengkap.
Pengujian in vivo di rumah kaca dilakukan dengan ranncangan faktorial dalam acak lengkap, dengan tiga faktor
perlakuan yaitu perlakuan dengan atau tanpa Pythium sp. (faktor A), perlakuan kemasaman tanah pH 4, 5, 6, 7, dan 8 (faktor B), dan perlakuan dengan atau tanpa G. fimbriatum.
Pengujian dilakukan pada baki semai dengan 25 benih ketimun setiap baki semai. Peubah yang diamati dalam uji ini ialah persentase gejala rebah-kecambah yang mungkin terjadi hingga
14 hari setelah tanam.
Hasil pengujian in vitro menunjukkan bahwa pada media PDA dan PDB pertumbuhan Pythium sp. yang terbaik terjadi pada pH 6, kemudian menurun pada pH 5, 7, 4, dan 8. Sedangkan G. fimbriatum memiliki tingkat pertumbuhan yang paling baik pada pH 5, kemudian menurun pada pH 6, 4, 7, dan
8. dari hasil uji filtrat dan uji interaksi diketahui bahwa G. fimbriatum mengeluarkan senyawa toksik yang dapat menghambat pertumbuhan dan mematikan Pythium sp. Pada media PDA persentase penghambatan tertinggi terjadi pada pH 4
dari PDB dengan pH 6, 4, 7, dan 8 yaitu 18.64 %, 8.68 %,
6.39 %, dan 5.87 %.
Pengujian in vivo menunjukkan bahwa ketiga faktor perlakuan yaitu Pythium sp. pH tanah, dan G. fimbriatum berpengaruh nyata terhadap persentase gejala yang timbul.
G. fimbriatum mampu menekan timbulnya gejala rebah-kecambah pada semua tingkat kernasaman tanah yang diujikan. Persentase penekanan G. fimbriatum pada pH 4 , 5, 6, 7, dan 8 berturut-turut ialah 100.00%, 80.00 %, 88.90 %, 87.82 %, dan
PENGARUH pH TANAH TERHADAP ANTAGONISME
Gliocladium fimbriatum Gilm. & Abbott PADA Pythium sp.
PENYEBAB REBAH-KECAMBAH KETIMUN (Cu-s sativus L.)
Skripsi
sebagai Salah satu syarat Untuk Memperoleh Gelar
Sarjana Pertanian Pada Fakultas Pertanian
Institut Pertanian Bogor
oleh :
WANWAN HERAWAN
A24.0756
JURUSAN HAMA DAN PENYAKIT TUMBUHAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
Judul laporan : PENGARUH pH TANAH TERHADAP ANTAGONISME
Gliocladium.fimbriatum Gilm. & Abbott PADA
Pythium sp. PENYEBAB REBAH-KECAMBAH KETIMUN (cucumis sativus L.)
Nama Mahasiswa : WANWAN HERAWAN Nomor P0k0k : A24.0756
Menyetujui
Dosen ~embimbinq I Dosen Pembimbing I1
Dr. Ir. Meity S. kinaqa) (Ir. ~ o h n y Poernomo W-Soekarno) NIP. 130536665
1
NIP. 13180365Menqetahui
-
RIWAYAT HIDUP
Penulis dilahirkan di Bandung (Jawa Barat) pada tanggal
19 Nopember 1968, sebagai anak kedua dari empat bersaudara, dari Ayah Aan sugandi dan Ibu Yati Kusmiati
Pada Tahun 1987 penulis menyelesaikan pendidikan Sekolah Menengah Atas di SMA Negeri 10 Bandung. Terdaftar sebagai mahasiswa Institut Pertanian Bogor pada Tahun 1987 melalui jalur Penelusuran Minat Bakat dan Kemampuan (PMDK). Pada Tahun 1988 tercatat sebagai mahasiswa Jurusan Hama dan Penyakit Tumbuhan, Fakultas Pertanian,
KATA PENGANTAR
Puji dan syukur penulis panjatkan k e hadirat Allah SWT,
yang telah memberikan rahmat dan hidayahNya sehingga penulis
dapat menyelesaikan penelitian dan menyusun laporan masalah
khusus ini sebagai salah satu syarat untuk menyelesaikan
pendidikan di Institut Pertanian Bogor.
Pada kesempatan ini penulis ingin menyampaikan rasa
terimakasih kepada Dr. Ir. Meity Suradji Sinaga dan
Ir.
Bonny Poernomo Wahyu Soekarno selaku dosen pembimbing atas
segala saran dan bimbingannya selama penelitian dan penyu-
sunan laporan ini, serta kepada seluruh staf dan karyawan
Jurusan Hama dan Penyakit Tumbuhan dan semua rekan mahasiswa
yang telah memberikan dorongan, saran, kritik dan
bimbingannya.
Rasa hormat dan terima kasih yang sedalam-dalamnya
penulis haturkan kepada Ayahanda dan Ibunda tercinta atas
segala bantuan dan dorongan baik moril maupun materil selama
ini.
Penulis harapkan semoga hasil laporan ini dapat
bermanfaat bagi mereka yang memerlukannya.
Bogor, Mei 1992
DAFTAR IS1
Halaman
PENDAHULUAN
...
1Latar Belakang
...
1Tujuan
...
3TINJAUAN PUSTAKA
...
4Penyakit Mati Benih-Kecambah
...
4Pythium sp
...
5Taksonomi dan Morfologi
...
5Biologi dan Ekologi
...
6Pengendalian Hayati
...
7...
Gliocladium sp 8 Taksonomi dan Morfologi...
8Biologi dan Ekologi
...
9BAHAN DAN METODE
...
12Tempat dan Waktu Penelitian
...
12Bahan dan Alat Penelitian
...
12Metode Penelitian
...
13Persiapan Media. Tanah dan Inokulum
...
13a
.
Persiapan Media PDA. PDB dan Tanah pada Beberapa Nilai pH...
13b
.
persiapan Inokula dan Pembiakan Massal...
13Pengujian In vitro
...
15b. Pengaruh pH Media t e r h a d a p
i n t e r a k s i Gliocladium s p . dengan
...
Pythium s p .
c. Pengaruh F i l t r a t Gliocladium s p . yang B e r a s a l d a r i Beberapa pH Media PDB t e r h a d a p Pertum-
...
buhan Pythium s p .
P e n g u j i a n I n v i v o
...
Pengaruh Antagonisme Gliocladium s p . t e r h a d a p Pythium s p . pada Tanah
dengan Kemasaman yang Berbeda
...
...
HASIL DAN PEMBAHASAN
...
KESIMPULAN
...
DAFTAR PUSTAKADAFTAR TABEL
Nomor Halaman
1. Diameter Koloni Pythium sp. pada Media PDA
dengan Berbagai pH
...
2 12. Berat Kering Pythium sp. yang Ditumbuhkan
...
pada PDB dengan Berbagai pH 22
3. Diameter Koloni G. fimbriatum pada Media PDA
dengan Berbagai pH
...
224. Berat Kering G. fimbriatum yang Ditumbuhkan pada Media PDB dengan Berbagai pH selama 7
Hari
...
235. Persentase Penghambatan G. fimbriatumk terha-
dap Pythium sp pada PDA dengan Berbagai pH.. 25 6. Diameter Koloni Pythium sp. pada Media PDA
dengan 20% Filtrat G. fimbriatum yang Berasal
dari Beberapa pH Media PDB
...
2 87. Berat Kering Pythium sp. yang Ditumbuhkan pada Media PDB dengan 20% Filtrat G. fimbriatum
...
yang Berasal dari Beberapa pH Media PDB 29
8. Persentase Kecambah yang Menunjukkan Gejala Rebah-kecambah karena Pengaruh Interaksi Per-
lakuan Pythium sp. (Faktor A), Perlakuan Per- bedaan Kemasaman (pH) Tanah (Faktor B) dan
...
Perlakuan G. fimbriatum (Faktor C) 3 2
9. Persentase Kecambah yang Menunjukkan Gejala Rebah-kecambah Karena Pengaruh Pythium sp.
(Faktor A) Secara Tunggal
...
3410. Persentase Kecambah yang Menunjukkan Gejala Rebah-kecambah karena Pengaruh Perbedaan Kema-
saman (pH) Tanah (Faktor B) Secara Tunggal
...
3411. Persentase Kecambah yang Menunjukkan Gejala Karena Pengaruh G. fimbriatum (Faktor C)
12. Persentase Kecambah yang Menunjukkan Geja- la Rebah-kecambah karena Pengaruh Interaksi Perlakuan Pythium sp. (Faktor A) dengan Perlakuan Perbedaan Kemasaman (pH) Tanah
(faktor B)
...
3513. Persentase Kecambah yang Menunjukkan Gejala Rebah-kecambah karena Pengaruh Interaksi Per-
lakuan Pythium sp. (Faktor A) dengan Perla-
...
kuan G. fimbriatum (Faktor C) 35
14. Persentase Kecambah yang Menunjukkan Gejala Rebah-kecambah karena Pengaruh Interaksi Per- lakuan Perbedaan Kemasaman (pH) Tanah
(Faktor B) dengan Perlakuan G. fimbriatum
...
(Faktor C) 3 6
15. Tinggi Tanaman Ketimun Pada umur 8 Hari kare- na Pengaruh Interaksi Perlakuan Perbedaan Ke- masaman (pH) Tanah (Faktor B) dengan Perlaku-
an G. fimbriatum (Faktor C)
...
3716. Tinggi Tanaman Ketimun pada Umur 8 Hari Karena Pengaruh Kemasaman (pH) Tanah
(Faktor B)
...
3817. Tinggi Tanaman Ketimun pada Umur 8 Hari karena Pengaruh Perlakuan G. fimbriatum
(Faktor C)
...
3 9Nomor Halaman
1. Diameter Koloni Pythium sp. pada Beberapa pH
Media PDA
...
4 62. Analisa Sidik Ragam Diameter Koloni Pythium
pada Beberapa pH Media PDA
...
4 63. Berat Kering Pythium sp. yang Ditumbuhkan pada
Beberapa pH Media PDB
...
474. Analisa Sidik Ragam Berat KeringPythi- urn sp. yang Ditumbuhkan pada Beberapa
Diameter Koloni Gliocladium fimbriatum pada Beberapa pH Media PDA
...
Analisa Sidik Ragam Ukuran Diameter Koloni G. fimbriatum pada Beberapa pH Media PDA...
Berat Kering G. fimbriatum yang Ditumbuhkan pada Beberapa pH Media PDB...
Analisa Sidik Ragam Berat Kering G. fimbria- tum yang Ditumbuhkan pada Beberapa pH Media
PDB
...
Hasil Pengamatan Uji Antagonis antara G. fim- briatum dengan Pythium sp. pada Beberapa pH
...
Media PDA
Persentase Penghambatan G. fimbriatum terha- dap Pythium sp. pada Beberapa pH Media PDA...
Analisa Sidik Ragam Persentase Penghambatan
G. fimbriatum terhadap Pythium sp. pada
...
Beberapa pH Media PDA
Diameter Koloni Cendawan Pythium sp. pada Me- dia PDA dengan 2 0 % Filtrat G. fimbriatum
....
yang Berasal dari Beberapa pH Media PDB
Analisa Sidik Ragam Diameter Koloni Pythium sp. yang Ditumbuhkan pada Media PDA dengan
2 0 % Filtrat G. fimbriatum yang Berasal da-
ri .Beberapa pH Media PDB
...
Berat Kering Pythium sp. yang Ditumbuhkan pa- da Media PDB dengan 2 0 % Filtrat G. fimbriatum...
yang Berasal dari Beberapa pH Media PDB
Analisa Sidik Ragam Berat Kering Pythium sp. yang Ditumbuhkan pada Media PDB dengan 20% Filtrat G. fimbriatum yang Berasal dari Be-
...
berapa pH Media PDB
Persentase Kecambah Ketimun yang Menunjukkan
...
Gejala Rebah kecambah
19. Analisa Sidik Ragam Tinggi Tanaman Ketimun
pada Umur 8 Hari Setelah Tanam
...
5 820. Banyaknya HC1 (0.1 N) dan KOH (0.1 N) yang Ditambahkan pada 200 ml Media PDA untuk
...
Mendapatkan pH yang Diinginkan 5 8
21. Banyaknya HC1 (0.1 N) dan KOH (0.1 N) yang Ditambahkan pada 200 ml Media PDB untuk
Mendapatkan pH yang Diinginkan
...
5 8DAFTAR GAMBAR
[image:15.547.94.503.60.631.2]Nomor Ha laman
...
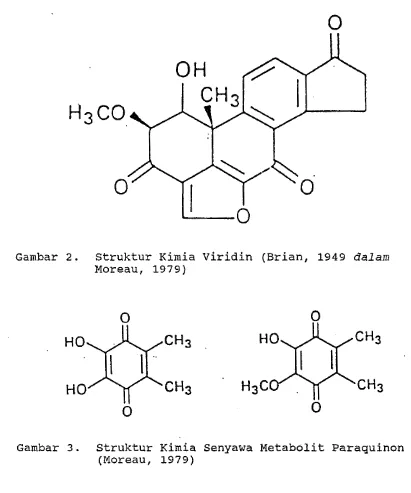
1. Struktur Kimia Gliotoxin 10
...
2. Struktur Kimia Viridin 11
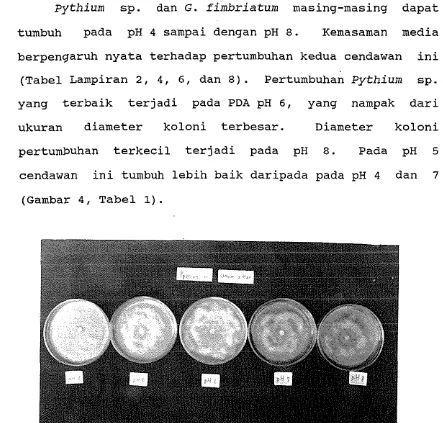
3. Struktur Kimia senyawa metabolit Paraquinon. 11 4. Perturnbuhan Pythium sp. pada PDA dengan Ber-
bagai pH Pada Hari Kedua
.;...
2 05. Pertumbuhan G. fimbriatum pada PDA dengan
...
Berbagai pH Pada Hari Ketiga 2 3
6. Antagonisme G. fimbriatum terhadap Pythium sp. Pada Media PDA dengan berbagai pH Pada Hari keempat. Efek antibiosis dan lisis tampak berupa mengempisnya koloni aerial Pythium
sp...
...
2 67. Perbandingan antara Tanaman Sehat dengan Ta-
...
naman sakit Pada 6 Hari Setelah Tanam 3 1
1. Grafik Hubungan Jumlah Belerang yang Ditam-
...
bahkan dengan Penurunan pH Tanah 60
2. Grafik Hubungan Jumlah Kapur (CaC03) yang Di-
tambahkan dengan Kenaikan pH Tanah
...
61PENDAHULUAN
Latar Belakanq
Pythium sp. merupakan patogen tular-tanah (soil-
borne) dan juga bersifat sebagai mikroorganisme penghuni
tanah (soil-inhabitant) yang banyak menimbulkan kerusakan
pada berbagai macam tanaman budidaya. Patogen ini dapat
menyebabkan penyakit busuk benih, busuk kecambah, rebah
kecambah, busuk akar, busuk batang, dan busuk lunak
(Walker, 1957; Agrios, 1978; dan Takahashi, 1981).
Pengendalian terhadap penyakit tersebut dapat dilaku-
kan dengan perlakuan benih, kultur teknik, biologi, atau
aplikasi fungisida (Agrios, 1978). Di lapang aplikasi
fungisida merupakan cara yang sering digunakan untuk
mengendalikan Pythium spp. Namun penggunaan fungisida
tidak selalu efektif, bahkan dapat menyebabkan peningkatan
resistensi patogen terhadap fungisida, meracuni tanaman
(fitotoksik), pencemaran lingkungan, dan dapat meracuni
organisme lain yang bukan sasaran. Oleh karena itu perlu
dicari alternatif pengendalian lain yang tidak banyak
berakibat negatif terhadap lingkungan biotik dan abiotik.
Pengendalian hayati dengan menggunakan antagonis merupakan
salahsatu alternatif pengendalian yang baik disamping
2
Penelitian mengenai pengendalian hayati, khususnya
mikroorganisme yang bersifat antagonis terhadap Pythium spp. memperlihatkan hasil yang dapat diharapkan. Sejumlah isolat bakteri dan actinomycetes yang belum diidentifi- kasi, telah dicoba dalam media agar dan memperlihatkan sifat antagonis terhadap Pythium spp. (Takahashi, 1981). Perlakuan benih kapas (seed-coating) dengan menggunakan
bakteri Pseudomonas flourescens Migula telah dapat
mengendalikan penyakit rebah-kecambah yang disebabkan oleh Pythium ultimum Trow (Howell dan Stipanovic, 1980 dalam Lifshitz, 1984). Pseudomonas putida Migula, bakteri yang masih termasuk dalam kelompok bakteri fluorescens, juqa telah diketahui dapat mengendalikan penyakit rebah- kecambah yang disebabkan oleh P. ultimum (Dupler dan
Baker, 1984 dalam Paulitz, 1991). Sivan, Elad, dan Chet (1984) mengemukakan bahwa Pythium aphanidermatum (Edson) Fitzpatrick dapat dikendalikan oleh Trichoderma sp. Selain pada P. aphanidermatum, Trichoderma sp. memberikan pengaruh antagonistik terhadap Pythium myriotilum
3
kapas yang disebabkan oleh P. ultimum dan Rhizoctonia solani Kuhn (Howell, 1982 dalam Papavizas, 1985).
Seringkali penggunaan antagonis di lapang dalam skala komersial tidak selalu memberikan hasil yang memuaskan. Hal ini mungkin disebabkan oleh beberapa faktor lingkungan biotik dan abiotik, seperti mikroflora tanah, ketersediaan
makanan, suhu, kelembaban, dan cahaya (Bell et dl., 1982). Selain itu Soepardi (1983), mengemukakan bahwa kegiatan
mikroorganisme tanah sangat dipengaruhi oleh reaksi kemasaman tanah (pH). Banyak faktor yang mempengaruhi berhasil atau tidaknya penggunaan antagonis, oleh karena itu perlu dilakukan penelitian terutama mengenai pengaruh pH tanah terhadap aktifitas antagonis yang diintroduksikan ke dalam tanah.
Tuiuan
Penelitian ini bertujuan untuk mengetahui pengaruh kemasaman (pH) media PDA dan PDB terhadap pertumbuhan cendawan Gliocladium fimbriatum dan Pythium sp., pengaruh
TINJAUAN PUSTAKA
Penvakit Mati Benih-Kecambah
Penyakit mati benih atau kecambah (damping-off) yang
disebabkan oleh Pythium sp. tersebar luas di seluruh
dunia. Gejala yang disebabkan oleh penyebab penyakit ini
tergantung pada umur dan tingkat perkembangan tanaman.
Benih-benih yang terinfeksi patogen akan gaga1 berkecam-
bah, menjadi busuk kemudian berubah warna menjadi kecok-
latan dan mengerut.
Jaringan kecambah yang dapat terserang meliputi
seluruh bagian kecambah. Infeksi awal ditandai dengan
perubahan warna menjadi gelap kecoklatan, kemudian bercak
kebasah-basahan (water-soaked spot). Bercak meluas dengan
cepat, jaringan menjadi rusak dan tertutup oleh cendawan,
akhirnya seluruh jaringan mati. Fase demikian disebut
mati benih atau kecambah sebelum timbul di atas permukaan
tanah (preemergence damping-off). Kecambah yang telah
muncul ke permukaan tanah umumnya terserang pada akarnya
dan kadang-kadang pada batang di bawah permukaan tanah.
Jaringan kecambah yang sukulen mudah dipenetrasi oleh
patogen. Bagian yang terserang menjadi kebasahan dan
berubah warna menjadi agak kecoklatan, kemudian pangkal
batang dekat permukaan tanah menggenting sehingga rebah
5
mati kecambah setelah muncul di atas permukaan tanah
(postemergence damping-off) (Agrios, 1978).
Pvthium su.
Taksonomi dan Morfoloqi
Pythium sp. termasuk ke dalam Divisi Mastigomycota,
Subdivisi Diplomastigomycotina, Kelas Oomycetes, Ordo
Peronosporales, Famili Pythiaceae (Alexopoulus dan Mims,
1979).
Di antara 14 genera yang termasuk Famili Pythiaceae, diketahui bahwa Pythium dan Phytophthora memiliki jumlah
spesies yang paling banyak. Umumnya spesies Pythium
merupakan mikroorganisme penghuni tanah (soil-inhabitant)
namun ada juga yang hidup di air. Middleton (1943 dalam
Bessey, 1952) mengemukakan bahwa Pythium mempunyai 66
spesies. Dari ke-66 spesies tersebut, 3 spesies adalah
saprofit dan 1 spesies parasitik pada hewan, 9 spesies
parasitik pada alga air tawar, dan 1 spesies saprofitik
pada rumput laut. Sekitar 9 spesies berhabitat dalam
tanah dan sisa tanaman serta tidak dikenal sebagai para-
sit, dan 40 spesies yang lainnya dikenal sebagai parasit
tanaman tingkat tinggi.
Miselium Pythium sp. berwarna putih, berbentuk ram-
ping, bercabang banyak, dan tumbuh cepat (Agrios, 1978).
Miselium biasanya tidak bersepta, dan akan bersepta jika
(Takahashi, 1981). Septa dibentuk untuk melepaskan an-
theridia, oogonia, zoosporangia, dan untuk memisahkan
bagian miselium yang telah tua (Bessey, 1952).
pythium sp. melakukan reproduksi secara seksual dan
aseksual. Reproduksi aseksual dilakukan melalui pemben-
tukan sporangium (zoosporangium) dan zoospora. Bentuk
sporangium bergantung pada spesiesnya, ada yang berbentuk
filamen, pipih dan sferikel sampai silindris. Zoospora
dibentuk dalam vesikel yang terletak di ujung
zoosporangium. Selain itu zoosporangium dapat langsung
berkecambah dengan membentuk tabung kecambah (Taka-
hashi, 1981)
.
Oogonium, antheridium, dan oospora adalah organ
seksual Pythium. oospora dibentuk dari hasil fertilisasi
antara oogonium dengan antheridium. Bentuk oogonium
umumnya sferikel, licin atau kadang-kadang berduri kasar.
Jumlah antheridia yang sampai ke oogonium bervariasi dari
1 sampai 25 atau lebih (Takahashi, 1981). Rongga oogonium
dapat terisi penuh (plerotic) atau terisi sebagian
(aplerotic) oleh oospora (Bessey, 1952).
Biolosi dan Ekolosi
Pertumbuhan Pythium sp. dipengaruhi oleh beberapa
faktor baik fisik maupun kimia dalam tanah, seperti suhu,
kelembaban, pH, tipe tanah, nutrisi, dan kedalaman tanah.
pH 4
-
9. Pythium graminicolum Braman. masih dapat hidup pada pH 3. Di dalam tanah, Pythium sp. tumbuh optimum pada pH 6-
7, dan berkembang lebih cepat pada tanah gembur dibanding tanah liat. Suhu yang optimum untuk terjadinya infeksi tidak sama untuk setiap spesies.Inf eksi P. aphanidermatum pada tanaman Famili Cucurbitaceae umumnya terjadi pada suhu di bawah 23O C. Patogenesitas Pythium sp. umumnya terjadi pada kedalaman
2.5
-
10 cm (Takahashi, 1981).
Penqendalian Havati
Menurut Baker dan Cook (1982), pengendalian hayati adalah pengurangan jumlah inokulum dalam keadaan aktif maupun dorman atau penurunan aktifitas patogen sebagai parasit oleh satu atau lebih organisme yang berlangsung secara alami atau melalui manipulasi lingkungan, inang atau antagonis, atau dengan introduksi secara massal satu atau lebih organisme antagonis.
Tujuan pengendalian hayati adalah menekan penyakit dengan cara sebagai berikut: (1) mengurangi inokulum pa-
togen dengan meningkatkan ketahanan tanaman; (2) mengu- rangi terjadinya infeksi patogen pada tanaman inang; (3) menurunkan daya serang patogen (Baker dan Cook, 1982).
antibiosis atau lisis, kompetisi, parasitisme, dan preda- si. Antibiosis adalah penghambatan suatu organisme mela- lui senyawa metabolik yang dihasilkan oleh organisme yang lainnya dan biasanya selain menghambat juga dapat memati- kan (Baker dan Cook, 1982). Lamanna dan Maletta (1965)
dalam Baker dan Cook (1982), mengemukakan bahwa lisis adalah istilah umum untuk penghancuran, disintegrasi, disolusi, atau dekomposisi materi biologi. Sedangkan kompetisi adalah persaingan dua organisme atau lebih untuk mendapatkan suplai substrat yang sama dalam bentuk dan keadaan tertentu, ketika suplai tersebut tidak mencukupi untuk kedua organisme (Clark, 1965 dalam Baker dan Snyder,
1965).
Gliocladium so.
Taksonomi dan Morfoloai
Gliocladium sp. termasuk ke dalam Divisi Amastigomy- cota, Subdivisi Deuteromycotina, Kelas Deuteromycetes, subkelas Hypomycetidae, Ordo Moniliales, Famili Moniliace- ae, Subfamili Gliosporae (Alexopoulus dan Mims, 1979).
hialin. Genus Gliocladium mirip Penicillium, akan tetapi percabangan yang menyangga massa spora berbeda, massa spora terikat oleh lendir dalam satu kepala konidia
(Domsch et al, 1980).
Biolosi dan Ekoloai
Suhu yang optimum untuk perkembangan cendawan ini berkisar antara 25
-
28O C, dapat tumbuh pada suhu 20-
35O C dengan suhu minimum 4-
6O C. Suhu yang dibutuhkan untuk perkembangan cendawan berbeda-beda' bergantung padaspesiesnya. Gliocladium catenulatum Gilm. & Abbott membutuhkan suhu optimum antara 26
-
28' C, G. virens antara 25-
32O C, dan G. roseum tumbuh optimum pada suhu 25-
28O C, sedangkan Gliocladium viride Matr dapat tumbuh pada suhu 6-
37O C dengan suhu optimum 25-
35O C.Sedangkan G. fimbriatum dan Gliocladium deliquescens Sopp,
pertumbuhannya terhambat pada suhu kurang dari 15O C dan lebih dari 35O C, denqan suhu optimum 25
-
30' C (Sinaga, 1986).Pertumbuhan cendawan ini juga banyak dipengaruhi oleh kemasaman media tumbuhnya, dan setiap spesies mempunyai kisaran pH tersendiri. G. catenulatum mempunyai pH
optimum 5.6 untuk pertumbuhannya, sedangkan kisaran pH
kisaran pH 2
-
9 serta tumbuh optimum pada pH 5.7-
6(Domsch et al., 1980). G. fimpriatum dan G. deliquescens dapat tumbuh dan bersporulasi dengan baik pada kisaran pH 5-6 sedangkan pada pH 4 dan pH 8 pertumbuhannya terhambat
(Sinaga, 1986). Kelembaban tanah optimum untuk perkem- bangan cendawan ini berkisar antara 97
-
100%.Gliocladium spp. telah banyak dilaporkan dapat
mengeluarkan senyawa yang bersifat toksik bagi mikroorga- nisme lain (Moreau, 1979). Weindling dan Emerson (1936 dalam Wolf dan Wolf, 1949) telah mengisolasi protein yang
bersifat toksik dari G. fimbriatum, dengan rumus empiris-
C14H16N2S204 Dutcher (1941) dalam Wolf dan Wolf (1949) menentukan kemudian bahwa rumus senyawa toksik tersebut
adalah C13H1404N2S2. Sedangkan Webster dan Lomas (1964) mengemukakan bahwa Gliocladium sp. dapat memproduksi gliotoxin (Gambar 1) dan viridin (Gambar 2) yang merupa- kan senyawa yang bersifat fungistatik. Menurut Moreau
(1979) selain kedua senyawa tersebut G. roseum seringkali mengeluarkan senyawa metabolit paraquinon (Gambar 3).
Gambar 2. Struktur Kimia Viridin (Brian, 1949 d a l a m
Moreau, 1979)
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Cendawan Patogen dan Rumah kaca Jurusan Hama dan Penyakit Tumbuhan, Fakultas Pertanian, Institut Pertanian Bogor, mulai bulan April 1991 sampai dengan Februari 1992.
Bahan dan Alat Penelitian
Bahan-bahan yang dipergunakan dalam penelitian ini adalah benih ketimun varitas lokal, isolat Pythium sp. Gliocladium fimbriatum, media Potato Dextrose Agar (PDA) dan Potato Dextrose Broth (PDB), KOH O.lN, HC1 0.1 N,
kapur (CaC03), belerang (S), serbuk gergaji, dedak, tanah
Latosol Baranangsiang, alkohol, aquades, kertas saring Whatman no 42, Seitz Filter, kantong plastik tahan panas, dan kapas.
Peralatan penelitian yang dipergunakan antara lain kotak isolasi, pipet volumetrik, cawan petri, labu erlenmeyer, autoklaf, baki semai plastik, jarum ose,
Metode Peneltian
Persiawan Media. Tanah dan Inokulum
a. Persiawan Media PDA. PDB. dan Tanah wada Beberawa Nilai
PE
Kemasaman media PDA dan PDB yang digunakan dalam pengujian adalah pH 4, 5, 6, 7, dan 8. Penurunan pH media dilakukan dengan menambahkan HC1 0.1 N dan untuk meningkatkan pH media digunakan KOH 0.1 N, banyaknya HCl
0.1 N atau KOH 0.1 N yang ditambahkan untuk mencapai kemasaman tertentu tertera pada Tabel Lampiran 20 dan 21. Pengukuran pH media dilakukan dengan pH meter dalam keadaan cair pada suhu 50° Celcius.
Tanah steril yang telah diayak ditambah kapur untuk meningkatkan kemasaman tanah dan ditambahkan belerang
untuk menurunkan kemasaman tanah, sehingga akan diperoleh
tanah dengan kisaran pH 4, 5, 6, 7 dan 8. Nilai pH tanah ditetapkan dengan pH H20 serta nisbah air dengan tanah
1 : 1. Jumlah kapur atau belerang yang perlu ditambahkan, diperoleh dari hasil uji pendahuluan (Gambar Lampiran 1
dan 2).
b. Persiawan Inokula dan Pembiakan Massal G. fimbriatum dan Pythium SD.
Institut Pertanian Bogor. Kedua cendawan dibiakkan dan diperbanyak pada medium PDA.
Pembiakan massal G. fimbriatum untuk introduksi pada
tanah dilakukan pada substrat campuran dedak-serbuk gergaji. Dedak dan serbuk gergaji direndam dalam air selama satu malam secara terpisah, kemudian diperas sampai kelembaban sekitar 45 %, dan dicampurkan dengan
perbandingan 1 : 1 dalam volume. Campuran tersebut sebanyak 0.25 kg dimasukkan ke dalam plastik tahan panas, ditutup dengan kapas dan disterilisasi. Sterilisasi dilakukan dengan autoklaf selama satu jam pada suhu 121° Celcius. Media dedak-serbuk gergaji steril diinokulasi dengan dua potong biakan G. fimbriatum yang berumur satu minggu berukuran diameter 1 cm, dan diinkubasikan selama
dua minggu pada suhu ruang.
Pembiakan massal Pythium sp. dilakukan pada corn-meal sand yang terdiri dari 98% pasir, 2% corn-meal (b/b) dan
20% ( v / b ) air (Quimio, 1978). Media tersebut
disterilisasi dengan autoklaf selama satu jam pada suhu 121° Celcius. Pada setiap 0.25 kg media diinokulasi
Penquiian In vitro.
a. Penqaruh DH Media PDA dan PDB terhada~ Pertumbuhan
G. fimbriatum dan Pvthium sp.
Pengujian dilakukan dengan membiakkan masing-masing cendawan pada media PDA dalam cawan petri dan pada 100 ml media PDB dalam erlenmeyer dengan dengan nilai pH 4, 5,
6, 7, dan 8. Potongan biakan murni yang digunakan berdiameter 0.5 cm, dan berasal dari biakan murni berumur satu minggu. Pengujian ini dilakukan sebanyak lima ulangan. Peubah yang diamati adalah diameter koloni tiap biakan untuk cendawan yang dibiakkan pada PDA, sedangkan
untuk cendawan yang dibiakkan pada media PDB yang diukur adalah berat kering cendawan berumur satu minggu setelah
.-,
dikeringkan di dalam oven selama tiga hari pada suhu 60° Celcius.b. Penqaruh DH Media PDA terhadar, Interaksi G. fimbriatum denqan Pvthium sr,.
Pengujian dilakukan dengan metode uji berganda dalam media PDA dengan pH yang berbeda yaitu pH 4, 5, 6, 7, dan
8. Isolat G. fimbriatum ditempatkan pada sisi cawan petri yang berlawanan dengan isolat Pythium sp. dengan jarak kurang lebih tiga sentimeter. Isolat cendawan masing-masing berdiameter 0.5 cm, yang berasal dari biakan murni pada PDA berumur satu minggu. Pengamatan dilakukan
16
parasitisme). Persentase penghambatan Pythium sp. oleh G. fimbriatum ditentukan dengan rumus (Yeh, 1980):
rl : jarak terjauh dari pusat koloni Pythium sp. r2 : jarak terdekat dari pusat koloni Pythium sp.
Rancangan percobaan yang digunakan pada kedua pengujian in vitro di atas adalah rancangan acak lengkap dengan lima perlakuan dengan masing-masing lima ulangan. Model linier dari rancangan percobaan tersebut adalah :
Yij = nilai pengamatan satuan percobaan yang mendapat perlakuan ke-i dan ulangan ke-j i = 1, 2, 3, 4, 5 j = 1, 2, 3, 3, 4, 5
p = nilai tengah umum
Ai = pengaruh perlakuan pH 4, 5, 6, 7, dan 8
eij = pengaruh galat dari satuan percobaan yang mendapat perlakuan ke-i dan ulangan ke-j
c.
Penqaruh Filtrat G. fimbriatum SP. vans Berasal dari Beberapa aH media PDB terhadap Pertumbuhan Pvthium SP.Filtrat Gliocladium didapatkan dengan menumbuhkan G. fimbriatum pada media PDB dengan pH 4, 5, 6, 7, dan 8, selama dua minggu. Media PDB tersebut kemudian disaring dengan menggunakan corong Buchner dengan memakai kertas saring Whatman no. 42, kemudian disaring kembali dengan
vakum. Masing-masing filtrat yang berasal dari media PDB dengan pH yang berbeda dipisahkan, kemudian dicampurkan dengan media PDA atau PDB dengan konsentrasi filtrat
sebesar 20 %. Sebagai kontrol ditambahkan aquades steril k e dalam media dengan konsentrasi yang sama.
Pengujian filtrat dilakukan dengan menumbuhkan Pythi- um sp. berumur satu minggu dengan diameter inokulum 0.9 cm pada campuran media PDA-filtrat G. fimbriatum di dalam cawan petri dan pada 50 ml campuran media PDB-filtrat G. fimbriatum di dalam erlenmeyer. Peubah yang diamati untuk pengujian filtrat pada media PDA ialah diameter koloni Pythium sp. yang dilakukan dengan selang waktu 12 jam. Untuk pengujian Eiltrat pada media PDB peubah yang diamati adalah berat kering koloni Pythium sp. setelah berumur satu minggu. Berat kering diukur setelah pengeringan di
dalam oven selama tiga hari pada suhu 60° Celcius.
Pendekatan secara statistik dilakukan dengan ranca-
ngan acak lengkap yang terdiri dari enam perlakuan dengan tiga ulangan. Model linier dari rancangan tersebut adalah :
Yij = p
+
Ai+
EijYi j = nilai pengamatan satuan percobaan yang mendapat perlakuan ke-i dan ulangan ke- j
Ai = pengaruh perlakuan filtrat Gliocladium yang berasal dari media PDB dengam pH 4,- 5, 6,
7, 8 dan kontrol
' i
j = pengaruh galat dari satuan percobaan yang mendapat perlakuan ke-i dan ulangan ke-j
Pensui ian In vivo
Penqaruh Antaaonisme G. fimbriatum terhadap Pythium sp. pada Tanah denqan Kemasaman vans Berbeda
Percobaan dilakukan dengan menggunakan baki semai plastik yang berisi tanah sebanyak 1.5 kg, yang terlebih dahulu diinfestasi biakan massal Pythium sp. dengan perbandingan antara biakan dengan tanah sebesar 1 : 40.
Tiga hari kemudian tanah yang telah terinfestasi tersebut diberi perlakuan penambahan kapur dan belerang untuk
memperoleh tanah dengan pH 4, 5, 6, 7, dan 8. Seminggu setelah perlakuan penambahan kapur dan belerang, diintroduksikan ke dalam tanah biakan G. fimbriatum
.
dengan perbandingan 1 : 6 antara biakan dengan tanah(Sinaga, 1986).
Benih ketimun ditanam tiga hari setelah introduksi G.
fimbriatum, dengan kedalaman kurang lebih dua sentimeter sebanyak 25 benih setiap baki semai dengan perlakuan pH tanah yang berbeda.
Perlakuan kontrol ialah perlakuan Pythium sp. tanpa
p~ tanah yang berbeda. Pengamatan dilakukan sampai tanaman berumur dua minggu, dengan mengamati gejala rebah- kecambah (damping-off) yang timbul pada setiap baki semai. Percobaan ini disusun dengan rancangan faktorial
dalam acak lengkap berukuran 2
x
5x
2 dengan tiga ulangan. Model linier dari rancangan tersebut adalah :'ijkl = p+Ai+B.+C 7 k +A.B.+AiCk+B.C 1 3 ]k +A i j k B C +"ijkl Yijkl = nilai pengamatan percobaan yang mendapat
perlakuan faktor A taraf ke-i, faktor B taraf ke-j, faktor C taraf ke-k dan
ulangan ke-1
p = nilai tengah umum
A1 = pengaruh perlakuan tanpa Pythium sp A2 = pengaruh perlakuan dengan Pythium sp. B1 = pengaruh perlakuan pH 4, 5, 6, 7, dan 8 C1 = pengaruh perlakuan tanpa G. fimbriatum C2 = pengaruh perlakuan dengan G. fimbriatum
AiBj = pengaruh interaksi faktor A pada taraf ke-i dengan faktor B pada taraf ke-j
AiCk = pengaruh interaksi faktor A pada taraf ke-i dengan faktor C pada taraf ke-k
BjCk = pengaruh interaksi faktor B taraf ke-j dengan faktor C taraf ke-k
AiBjCk = pengaruh interaksi antara faktor A taraf ke-i, faktor B taraf ke-j, dan faktor C taraf ke-k
HASIL DAN PEMBAHASAN
Pythium sp. dan G. fimbriatum masing-masing dapat tumbuh pada pH 4 sampai dengan pH 8. Kemasaman media berpengaruh nyata terhadap pertumbuhan kedua cendawan ini
(Tabel Lampiran 2, 4, 6, dan 8)
.
~ertumbuhan Pythium sp. yang terbaik terjadi pada PDA pH 6, yang nampak dariukuran diameter koloni terbesar. Diameter koloni pertumbuhan terkecil terjadi pada pH 8. Pada pH 5
cendawan ini tumbuh lebih baik daripada pada pH 4 dan 7
(Gambar 4, Tabel 1)
.
Gambar 4. Pertumbuhan Pythium sp. pada PDA dengan berbagai pH Pada Hari Kedua
[image:35.527.39.482.126.549.2]Tabel 1. Diameter Koloni Pythium sp. pada Media PDA dengan Berbagai pH
Diameter Koloni (mm) PH
Hari ke
.
.
.
1 2
Keterangan : Angka-angka yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada taraf 5% Uji Jarak Berganda Duncan
paling tinggi yaitu 0.1751 g, kemudian diikuti dengan berat kering cendawan yang lebih ringan pada pH 5, 4, 7,
beyturut-turut dengan berat kering 0.1614 g, 0.1535 g,
0.1492 g dan pada pH 8 dengan berat paling ringan yaitu
0.1465 g. Pada perlakuan pH 6
,
Pythium sp. memiliki be- rat kering yang tidak berbeda nyata dengan pH 5, tetapi berbeda nyata dengan berat kering pada perlakuan pH 4, 7,dan pH 8
.
Secara statistik antara perlakuan pH 4, 5, 7,dan 8 berat kering Pythium sp tidak memiliki perbedaan yang nyata (Tabel 2). Diameter koloni pertumbuhan G. fimbriatum terlihat berbeda pada media dengan pH yang
berlainan, perlakuan pH berpengaruh nyata terhadap diameter pertumbuhan (Tabel Lampiran 6). Pertumbuhan terbaik G. fimbriatum pada media PDA terjadi pada pH 5
dengan ukuran diameter koloni paling besar, kemudian pada pH 6, 7, 4 dan pertumbuhan yang paling rendah terjadi
[image:36.527.58.489.84.519.2]Tabel 2. Berat Kering Pythium sp. yang Ditumbuhkan pada PDB dengan Berbagai pH selama 7 Hari
PH Berat kering (gram)
Keterangan : Angka-angka yang diikuti oleh huruf yang sama tidak berbeda nTata pada taraf 5 % Uji Jarak Berganda Duncan
Tabel 3. Diameter Koloni G. fimbriatum pada Media PDA dengan berbagai pH
Diameter Koloni (mm) PH
hari ke..
.
1 2 3
Keterangan : Angka-angka yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada taraf 5% Uji Jarak Berganda Duncan
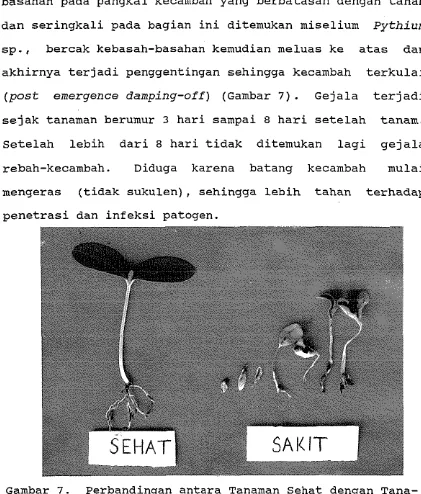
Pada media PDB berat kering G. fimbriatum tertinggi dicapai pada pH 5 kemudian diikuti oleh pH 6, 4, 7 dan 8. Pada perlakuan pH 4, 6 dan 7 tidak terdapat perbedaan berat yang nyata (Tabel 4).
[image:37.530.45.483.80.529.2]Gambar 5. Pertumbuhan G. f i m b r i a t u m pada Media PDA d e n g a n B e r b a g a i pH Pada H a r i K e t i g a
T a b e l 4 . B e r a t K e r i n g G . f i m b r i a t u m yang Ditumbuhkan pada Media PDB dengan B e r b a g a i pH Selama 7 H a r i
PH B e r a t k e r i n g (gram)
Keterangan : Angka-angka yang d i i k u t i o l e h h u r u f yang sama t i d a k berbeda n y a t a pada t a r a f 5% U j i
J a r a k Berganda Duncan
bahwa G . f i m b r i a t u m d a p a t mencapai pertumbuhan d a n
s p o r u l a s i t e r b a i k pada pH 5.
H a s i l pengamatan u j i i n t e r a k s i a n t a r a G . f i m b r i a t u m
dengan Pythium sp. s e c a r a i n v i t r o menunjukkan bahwa
pada h a r i p e r t a m a cendawan Pythium s p . tumbuh l e b i h c e p a t
d a r i p a d a G. f i m b r i a t u m s e h i n g g a tampak G . f i m b r i a t u m
[image:38.527.87.448.94.291.2]hari kedua ketika miselium Pythium sp. dan G. fimbriatum telah bertemu, terjadi penghambatan pertumbuhan miselium
aerial Pythium sp. Miselium Pythium yang berhadapan dengan G. fimbriatum tampak mengempis dan selanjutnya bagian yang mengempis ini mulai ditumbuhi oleh miselium G. fimbriatum. Hasil reisolasi dari bagian miselium yang mengempis menunjukkan miselium Pythium telah mati.
Pengamatan mikroskopis pada bagian yang mengempis
tersebut menunjukkan telah terjadi disintegrasi miselium
Pythium, sehingga menyebabkan kematian cendawan. Miselium Pythium yang mengalami disintegrasi diduga akibat senyawa toksik yang dikeluarkan oleh G. fimbriatum. Dugaan ini diperkuat dengan adanya senyawa berwarna kekuningan pada media PDA di sekitar biakan G. fimbriatum yang berdifusi k e arah Pythium sp., kemudian diikuti dengan mengempisnya koloni Pythium sp. Selain itu Pythium sp. tidak dapat tumbuh atau pertumbuhannya tertekan pada PDA dan PDB yang mengandung filtrat G. fimbriatum.
Perlakuan pH media PDA berpengaruh nyata terhadap antagonisme G. fimbriatum pada Pythium sp. (Tabel
Lampiran 11). Pada hari pertama persentase penghambatan terbesar terjadi pada pH 5, kemudian diikuti dengan pH 6,
4, 7 dan pH 8. Persentase penghambatan pada pH 5 dan 4
tidak berbeda nyata, demikian juga antara perlakuan pH 4,
kemungkinan karena kedua cendawan belum bertemu atau
difusi senyawa toksik G. fimbriatum belum mencapai miselium Pythium. Pada hari kedua dan ketiga persentase
penghambatan tertinggi terjadi pada pH 4, kemudian
diikuti dengan pH 5, 6, 7 dan pH 8 dengan persentase
penghambatan yang paling kecil. Penghambatan yang terjadi
pada pH 5 dan pH 6 secara statistik tidak berbeda nyata
(Gambar 6, Tabel 5).
Tabel 5. Persentase Penghambatan G. fimbriatum terhadap Pythium sp pada PDA dengan Berbagai pH
Besarnya penghambatan ( % ) PH
hari ke
. .
.
1 2 3
-- -
4 7.05 ab 61.34 a 95.32 a
5 11.87 a 51.33 ab 76.63 b
6 7.91 ab 42.00 bc 71.33 b
7 3.99 b 37.33 c 63.33 c 8 2.97 b 36.66 C 48.67 d
Keterangan : Angka-angka yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf 5% Uji
Jarak Berganda Duncan
Dari hasil uji antagonis di atas menunjukkan pada
umumnya tingkat penghambatan terhadap Pythium sp
berhubungan dengan kesesuaian pH untuk pertumbuhan G.
fimbriatum, namun dari hasil di atas terjadi penyimpangan
pada pH 4. Dari Tabel 3 dan 4 diketahui pada pH 4 G. fimbriatum menunjukkan pertumbuhan yang kurang baik,
tetapi pada uji antagonis mempunyai persentase
Gambar 6. Antagonisme G. fimbriatum terhadap Pythium sp. Pada Media PDA dengan berbagai pH Pada Hari keempat. Efek antibiosis dan lisis tampak berupa mengempisnya koloni aerial Pythium sp.
(lihat tanda panah)
tidak dapat membeku pada pH 4, menyebabkan senyawa toksik yang dihasilkan oleh G. fimbriatum lebih mudah untuk berdifusi pada media dan lebih cepat menghambat Pythium
sp., sedangkan pada pH t 5 media PDA berada dalam keadaan padat. Pendapat ini didukung oleh Barnett dan Lilly
(1962) yang ' melaporkan bahwa senyawa toksik yang
dihasilkan oleh G. roseum tidak aktif pada jarak yang jauh karena antibiotik yang dihasilkan tidak memiliki daya
difusi yang tinggi di dalam media padat.
Berdasarkan pengamatan pembiakan G. fimbriatum pada
media PDB, setelah beberapa hari inokulasi terjadi per-
ubahan warna media PDB. Pada awal pembiakan kultur, media
berubah menjadi kuning tua agak kecoklatan. Perubahan warna ini dimulai di sekitar biakan G. fimbriatum. Cairan yang berwarna kuning kecoklatan ini diduga merupakan senyawa toksik yang dikeluarkan oleh G. fimbriatum. Moreau (1979) mengemukakan bahwa G. virens mengeluarkan senyawa berpigmen kuning yang merupakan senyawa viridin dengan daya fungistatik yang sangat kuat.
Hasil uji filtrasi, selain membuktikan adanya
senyawa toksik yang dihasilkan G. fimbriatum, juga mem-
perlihatkan adanya pengaruh perbedaan pH media yang nyata terhadap banyaknya senyawa toksik yang dihasilkan (Tabel Lampiran 13 dan 14). Hal ini nampak dengan adanya perbedaan ukuran diameter koloni dan berat kering Pythium sp. pada media dengan perlakuan filtrat dibandingkan
dengan kontrol (tanpa filtrat). Pada perlakuan yang diberi filtrat G. fimbriatum, ukuran diameter koloni dan berat kering Pythium sp. lebih kecil daripada kontrol.
Pada Tabel 6. terlihat perlakuan filtrat berbeda nyata dengan kontrol. Ukuran diameter Pythium yang
terkecil terjadi pada biakan PDA dengan filtrat yang berasal dari media PDB dengan pH 5 dan 6, ha1 ini berarti persentase penghambatan yang terbesar, terjadi oleh filtrat yang berasal dari media dengan kedua pH ini yaitu
berturut-turut yaitu 8.68 %, 6.39 % dan 5.87 %. Diduga senyawa toksik yang dihasilkan pada filtrat dengan pH 4,
7 , dan 8 sangat rendah, karena ketiga pH tersebut merupakan kondisi kurang baik untuk pertumbuhan G.
fimbriatum (Tabel 3 dan 4).
Tabel 6. Diameter Koloni Pythium sp. pada Media PDA de- ngan 20% Filtrat G. fimbriatum yang Berasal dari Beberapa pH Media PDB
Diameter koloni (mm) pH media asal filtrat
pengamatan 12 jam ke
....
1 2 3 4
- --
4 20.8 a 43.2 b 71.5 b 90.0 a 5 11.5 d 35.3 d 60.0 d 76.0 c
6 10.7 c 37.7 c 63.7 c 81.2 b 7 18.7 b 43.5 b 73.3 b 90.0 a 8 18.3 b 43.8 b 73.7 b 90.0 a kontrol 22.0 a 47.3 a 78.3 a 90.0 a Keterangan : Angka-angka yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada taraf 5% Uji Jarak Berganda Duncan
Hasil pengujian filtrat Gliocladium sp. pada Pythium sp. yang dibiakkan pada media PDB dengan filtrat, menunjukkan perbedaan yang nyata antara perlakuan filtrat yang berasal dari berbagai pH media dengan berat kering
[image:43.530.55.480.87.509.2]yang berasal dari media PDB dengan pH 8 menyebabkan per- sentase penghambatan Pythium yang paling rendah. Filtrat yang berasal dari PDB dengan pH 5 menyebabkan berat kering
Pythium sp. yang paling kecil, tetapi ha1 ini tidak
berbeda nyata dengan perlakuan filtrat yang berasal dari media dengan pH 6, 4 dan pH 7. Pada pengujian ini persen- tase penghambatan oleh filtrat G. fimbriatum yang berasal dari pH 5, 6, 4, 7, dan 8 secara berurutan adalah 78.37
%, 73.57 %, 69.10 %, 62.13 % dan 55.60 %.
Pada pengujian antagonisme G. fimbriatum terhadap
infeksi Pythium sp. pada tananaman ketimun, kecambah ketimun yang terserang sebelum muncul (pre mergence dam- ping-off) menunjukkan gejala busuknya benih dan kotiledon yang belum muncul di permukaan tanah dengan warna
kecoklat-coklatan. Hal ini terjadi pada tanaman yang berumur kurang dari 4 hari. Setelah kecambah muncul, gejala serangan mula-mula ditandai dengan bercak kebasah-
Tabel 7. Berat Kering Pythium sp. yang Ditumbuhkan pada Media PDB dengan 20% Filtrat G. fimbriatum yang Berasal dari Beberapa pH Media PDB
pH media asal filtrat Berat kering cendawan (gram)
4
5 6 7 8 kontrol
basahan pada pangkal kecambah yang berbatasan dengan tanah
dan seringkali pada bagian ini ditemukan miselium Pythium sp., bercak kebasah-basahan kemudian meluas ke atas dan akhirnya terjadi penggentingan sehingga kecambah terkulai (post emergence damping-off) (Gambar 7). Gejala terjadi
[image:45.530.61.482.90.584.2]sejak tanaman berumur 3 hari sampai 8 hari setelah tanam. Setelah lebih dari 8 hari tidak ditemukan lagi gejala rebah-kecambah. Diduga karena batang kecambah mulai mengeras (tidak sukulen), sehingga lebih tahan terhadap penetrasi dan infeksi patogen.
Gambar 7. Perbandingan antara Tanaman Sehat dengan Tana- man Sakit Pada 6 Hari Setelah Tanam
~nalisa keragaman dari percobaan in vivo memper-
setiap faktor perlakuan mengakibatkan interaksi yang nyata
diantara faktor-faktor tersebut (Tabel Lampiran 17).
Hasil pengujian in vivo memperlihatkan pengaruh nyata
faktor Pythium sp. terhadap gejala rebah-kecambah yang
timbul, baik pengaruh secara tunggal maupun pengaruh
interaksi dengan faktor yang lain (Tabel 8, 9, 12, dan
13). Dari data Tabel 8 dan 9 menunjukkan bahwa benih
ketimun yang digunakan adalah benih sehat. Hal ini tampak
pada perlakuan tanpa Pythium sp., tidak menimbulkan gejala
rebah-kecambah.
Perlakuan perbedaan kemasaman tanah secara tunggal
memberikan pengaruh nyata terhadap perbedaan persentase
gejala yang timbul (Tabel 10). Demikian juga dengan
perlakuan penambahan G. fimbriatum memperlihatkan pengaruh
penekanan yang nyata terhadap timbulnya gejala rebah-
kecambah (Tabel 11).
Data pada Tabel 8 dan 12 memperlihatkan adanya inter-
aksi antara perlakuan perbedaan kemasaman tanah dengan
perlakuan Pythium sp. terhadap perbedaan persentase gejala
yang timbul. Pada perlakuan pH 6 yang diberi perlakuan
Pythium sp. mempunyai persentase rebah kecambah yang
paling tinggi kemudian diikuti dengan perlakuan pH 7, 5, 4
dan pH 8. Interaksi perlakuan Pythium dengan perlakuan pH
4 dan pH 8 memiliki persentase gejala terkecil dan kedua
Tabel 8. Persentase Kecambah yang Menunjukkan Gejala rebah-kecambah karena Pengaruh Interaksi Per-
lakuan Pythium sp. (Faktor A), Perlakuan Perbe daan Kemasaman (pH) Tanah (Faktor B) dan Perla- kuan G. fimbriatum (Faktor C)
perlakuan Persentase rebah kecambah ( % )
Keterangan : Angka-angka yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf 5% Uji Jarak Berganda Duncan
[image:47.527.53.483.75.557.2]terganggunya sistem kerja enzim dan berkurangnya kemampuan untuk menyerap glukosa karena kekurangan unsur hara penunjang. Sedangkan pada kemasaman tanah yang tinggi cendawan akan mengalami kekurangan unsur-unsur logam yang diperlukan. Persentase gejala yang besar pada pH 6 dan 7 disebabkan kisaran pH ini merupakan kondisi yang optimum bagi pertumbuhan Pythium sp. (Takahashi, 1981). Menurut
Lumsden dan Ayers (1975), pada pH 6
-
7 oospora yang mengalami dorman menjadi lebih mudah berkecambah seperti halnya pada sporangia vegetatif, dengan demikian akanmeningkatkan gejala rebah-kecambah yang timbul.
G. fimbriatum mempunyai pengaruh penekanan yang baik terhadap timbulnya gejala serangan Pythium sp. Hal ini
. .
terlihat dari data Tabel 8, 11 dan 13 yang memperlihatkan Tabel 9. Persentase Kecambah yang Monunjukkan Gejala
Rebah-kecambah Karena Pengaruh Pythium sp. (Faktor A) Secara Tunggal
Perlakuan Persentase Rebah-kecambah ( % ) Tanpa Pythium (A1) 0.00 b
Dengan Pythium (A2) 18.80 a
Keterangan : Angka-angka yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf 5% Uji Jarak Berganda Duncan
perbedaan hasil yang cukup besar antara perlakuan Pythium tanpa G. fimbriatum, dengan perlakuan Pythium yang mendapat perlakuan G. fimbriatum. Berdasarkan selisih
fimbriatum dengan diberi G. fimbriatum, ternyata G. fimbriatum dapat nenekan timbulnya gejala rebah-kecambah
sebesar 89.83 % (Tabel 13).
Tabel 10. Persentase Kecambah yang Menunjukkan Gejala Rebah-kecambah Karena Pengaruh Perbedaan Kema
-
saman (pH) Tanah (Faktor B) Secara TunggalPerlakuan Persentase Rebah-kecambah ( % )
Keterangan : Angka-angka yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf 5% Uji Jarak Berganda Duncan
Tabel 11. Persentase Kecambah yang Menunjukkan Gejala Rebah-kecambah Karena Pengaruh G. fimbria-
tum (Faktor C) Secara Tunggal
Perlakuan persentase Rebah-kecambah ( % ) Tanpa G. fimbriatum (C1)
Dengan G. fimbriatum ( C 7 )
-- -- -
Keterangan : Angka-angka yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf 5% Uji Jarak Berganda Duncan
Interaksi antara faktor kemasaman tanah dengan faktor perlakuan G. fimbriatum memberikan penekanan yang lebih besar terhadap timbulnya gejala penyakit, dibandingkan
[image:49.527.43.501.48.661.2]Tabel 12. Persentase Kecambah yang Menunjukkan Gejala Rebah-Kecambah karena Pengaruh Interaksi Perla kuan Pythium sp. (Faktor A) dengan Perlakuan Perbedaan Kemasaman (pH) Tanah (faktor B)
Perlakuan Persentase Rebah-kecambah ( % )
Tanpa Pythium) (A1)
x
pH 4 (B1) Tanpa Pythium (A1)x
pH 5 (B2) Tanpa Pythium (A1)x
pH 6 (B3) Tanpa Pythium (A1)x
pH 7 (B4) Tanpa Pythium (A )x
pH 8 (B5) Dengan Pythium) (A2)x
pH 4 (B1) Dengan Pythium (A2)x
pH 5 (B2) Dengan Pythium (A2)x
pH 6 (B3) Dengan Pythium (A2)x
pH 7 (B4) Dengan Pythium (A2)x
pH 8 (B5)Keterangan : Angka-angka yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf 5% Uji Jarak Berganda Duncan
Tabel 13. Persentase Kecambah yang Menunjukkan Gejala Re- bah-kecambah Karena Pengaruh Interaksi Perlaku- an Pythium sp. (Faktor A) dengan Perlakuan G. fimbriatum (Faktor C)
Perlakuan Persentase Rebah-kecambah ( % ) Tanpa Pythium (A1)
x
Tanpa G. fimbriatum (C ) 0 . 0 0 cTanpa Pythium (A )
x
Dengan G. fimbriatum (h2) 0 . 0 0 cDengan Pythium (A2)
x
Tanpa G. fimbriatum (C ) 34.13 a Dengan Pythium (A2) x Dengan G. fimbriatum ($2) 3.47 - bKeterangan : Angka-angka yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf 5% Uji Jarak Berganda Duncan
[image:50.523.52.478.68.539.2]secara stastistik nilai ini tidak berbeda nyata dengan nilai tanpa gejala (0 % ) . Berdasarkan selisih persentase
gejala yang timbul antara perlakuan tanpa G. fimbriatum dengan perlakuan pemberian G. fimbriatum, maka penekanan terhadap Pythium sp. yang terbesar terjadi pada pH 4 dan 8 yaitu sebesar 100 %. Hal ini dapat terjadi karena didukung oleh pH 4 dan 8 yang kurang cocok bagi penetrasi dan infeksi Pythium sp., sehingga gejala awal pada perlakuan tanpa G. fimbriatum dengan kedua pH tersebut jauh lebih rendah daripada pada pH yang lain (Tabel 12).
Tabel 14. Persentase Kecambah yang Menunjukkan gejala Rebah-kecambah karena Pengaruh Interaksi Perla kuan Perbedaan Kemasaman (pH) Tanah (Faktor B) dengan Perlakuan G. fimbriatum (Faktor C)
Perlakuan Persentase Rebah-kecambah(%)
pH 4 (B1)
x
Tanpa G. fimbriatum (Cl) 8 . 6 7 b pH 5 (B2)x
Tanpa G. fimbriatum (C1) 10.00 b pH 6 (B3)x
Tanpa G. fimbriatum (C1) 30.00 a pH 7 (B4)x
Tanpa G. fimbriatum (C1) 27.33 a pH 8 (B5)x
Tanpa G. fimbriatum (C ) 9.33 b pH 4 (B1)x
Dengan G. fimbriatum(e2)
0.00 c pH 5 (B2)x
Dengan G. fimbriatum (C2) 2.00 c pH 6 (B3)x
Dengan G. fimbriatum (C2j 3.33 c pH 7 (B4)x
Dengan G. fimbriatum (C2) 3.33 c pH 8 (B5)x
Dengan G. fimbriatum (C2) 0.00 c Keterangan : Angka-angka yang diikuti oleh huruf yangsama tidak berbeda nyata pada taraf 5% Uji Jarak Berganda Duncan
Hasil pengujian in vivo ini menunjukkan bahwa Pythi- um dan G. fimbriatum memiliki kisaran pH optimum yang sama
[image:51.527.55.481.336.613.2]tum masih mampu menekan dengan persentase penekanan yang
tinggi sebesar 88.90 dan 87.82 % (Tabel 14).
Faktor perlakuan pH tanah yang berbeda dan faktor G.
fimbriatum memberikan pengaruh yang nyata terhadap tinggi tanaman (Tabel Lampiran 19). Tanaman terlihat kerdil pada pH 4 dan 5, dan pada pH 8 tinggi tanaman
relatif lebih pendek daripada perlakuan pH 6 dan 7 (Tabel
Tabel 1 5 . Tinggi Tanaman Ketimun Pada umur 8 Hari karena Pengaruh Interaksi Perlakuan Perbedaan Kemasa man (pH) Tanah (Faktor B) dengan Perlakuan G. fimbriatum (Faktor C)
Perlakuan Tinggi Tanaman (nun)
--
pH 4 (B1)
x
Tanpa G. fimbriatum (C1) pH 5 (B2)x
Tanpa G. fimbriatum (C1) pH 6 (Bj)x
Tanpa G. fimbriatum (C1) pH 7 (B4)x
Tanpa G. fimbriatum (C1) pH 8 (B5)x
Tanpa G. fimbriatum (C ) pH 4 (B1)x
Dengan G. fimbriatum(EZ)
pH 5 (B2)x
Dengan G. fimbriatum (C2) pH 6 (B3)x
Dengan G. fimbriatum (C2) pH 7 (B4)x
Dengan G. fimbriatum (C2) pH 8 (B5)x
Dengan G. fimbriatum (C2)Keterangan : Angka-angka yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf 5% Uji Jarak Berganda Duncan
15 dan 16). Selain itu pada pH 4 dan 5, ukuran kotiledon menjadi kecil dan berwarna kekuning-kuningan disertai dengan bercak-bercak kecoklatan. Hal ini dapat terjadi karena pada keadaan tanah yang masam terjadi perubahan komposisi kimia tanah seperti kandungan Fe, Zn, Al, dan
Mn yang tinggi sehingga dapat meracuni tanaman (Soepardi,
[image:52.533.60.488.267.658.2]syarat tumbuh optimum ketimun, yaitu pada pH 5.7
-
7.0 (Shoemaker, 1956), maka pada pH 4, 5 dan 8 tidak dapat digunakan untuk membantu menekan gejala rebah-kecambahpada ketimun yang disebabkan oleh Pythium sp.
Berdasarkan hasil pada Tabel 17 dan Tabel Lampiran 19 menunjukkan bahwa penambahan G. fimbriatum dengan media
dedak-serbuk gergaj i ke dalam tanah tidak menyebabkan
keracunan pada tanaman (Fitotoksik), bahkan berpengaruh
Tabel 16. Tinggi Tanaman Ketimun pada Umur 8 Hari Karena Pengaruh Kemasaman (pH) Tanah (Faktor B)
Perlakuan Tinggi Tanaman (mm)
Keterangan : Angka-angka yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf 5% Uji Jarak Berganda Duncan
positif terhadap tinggi tanaman. Hal ini disebabkan oleh kemampuan Gliocladium menguraikan bahan organik dan
Tabel 17. Tinggi Tanaman Ketimun pada Umur 8 Hari karena Pengaruh Perlakuan G. fimbriatum (Faktor C)
Per lakuan Tinggi Tanaman (mm) Tanpa G. fimbriatum (C1)
Dengan G. fimbriatum (C2)
[image:54.530.60.484.78.228.2]KESIMPULAN
Secara i'n vitro kedua cendawan yaitu Pythium sp. dan G. fimbriatum dapat tumbuh pada semua pH media yang diujikan. Pertumbuhan Pythium paling baik terjadi pada pH 6, dan pertumbuhannya menurun pada pH 5, 4, 7, dan 8. Pertumbuhan G. fimbriatum yang paling baik terjadi pada pH
5, kemudian menurun pada pH 6, 7, 4 dan 8.
G. fimbriatum bersifat antagonistik terhadap Pythium sp. dengan mekanisme antagonis yang dilakukan ialah
antibiosis dan lisis. Berdasarkan persentase penghambatan koloni Pythium diketahui persentase penghambatan tertinggi terjadi pada pH 4, kemudian menurun pada pH 5, 6, 7 dan 8. Dari percobaan in vitro juga diketahui bahwa G. fimbriatum mengeluarkan senyawa yang bersifat toksik yang dapat
menghambat pertumbuhan Pythium sp. dan jumlah senyawa toksik yang dihasilkan berbeda dengan pH yang berbeda. Filtrat G. fimbriatum yang berasal dari media PDB dengan pH 5
41
Persentase penekanan gejala penyakit pada pH 4, 5, 6, 7
dan 8 secara berurutan adalah loo%, 80 %, 88.90 %, 87.82
%, dan 100 %. Introduksi G. fimbriatum tidak menimbulkan
DAFTAR PUSTAKA
Agrios, G. N. 1978. Plant Pathology. Academic Press. New York. 703p.
Alexopoulus, C. J. and C. W. Mims. 1979. Introductory Mycology. Third edition. John wiley and sons. New York. 631p.
Baker, K. F. and J. Cook. 1982. Biological control of Plant Pathogen. The American Phytopathological Society. St. Paul, Minnesota. 443p.
Baker, K. F. and W. C. Snyder. 1965. Soils-borne Plant Pathogens. Prelude to Biological control. Univ. Calif. Press. Berkeley. 571p.
Barnett, H. L. and V. G. Lillv. 1962. A destructive my&oparasite ~liocladium^ roseum. Mycologia
54 : 72-76.
Bell, D. K., H. D. Well and C. R. Markham. 1982. In vitro antagonism of Trichoderma spesies againts six fungal plant pathogens. Phytopathology 72: 379-482. Bessey, E. A. 1952. Morphology and Taxonomy of Fungi.
The Blakiston Company. Philadelphia
-
Toronto. 731p.Bruehl, G. W. 1975. Biology and Control of Soil-borne Plant Pathogen. The American Phytopathological society. St Paul, Minnesota. 216p.
Cochrane, V. W. 1958. Physiology of Fungi. John wiley and sons. New York. 524p.
Domsch, K. W., W. Gams, and T. H. Anderson. 1980. Compendium of Soil Fungi Vol. 1. Academic Press. London-New York-Toronto-Sydney-San Fransisco. 859p. Hardjowigeno, S. 1987. Ilmu Tanah. PT MESAPER.
Jakarta. 220p.
Lumsden, R. D. and W. A. Ayers. 1975. Influnce of soil environtment on the germinability of constitutively dormant oospore of Pythium ultimum. Phytopathology 65 : 1105-1107.
papavizas, G. C. 1985. Trichoderma and Gliocladium: biology, ekology and potential for control. Annu. Rev. Phytopathology 23: 23-54.
Paulitz, T. C. 1991. Effect of Pseudomonas putida on strain off Pythium ultimum by seed volatiles of pea and soybean. Phytopatology 81 : 1282-1287.'
Pugh, G. J. I?. and C. H. Dickinson. 1965. Studies on fungi in costal soils. Trans. Br..Mycol. soc. 48(2): 279-285.
Quimio, T. H. 1978. Workbook in Tropical Mycology: Departement of Plant Pathology, University of The Phillippines at Los Banos. Los Banos. 87p.
Shoemaker, J. S. 1956. General Horticulture. J. B. Lippincott Co. Philadelphia. 464p.
Sinaga, Meity S. 1986. Biological Control of Some Soil- borne Fungal Pathogens of Soybean with Gliocladium spp. Ph.D desertation (unpublished). 162p.
Sivan, A. Y., Elad and
I.
Chet. 1984. Biological effect new isolat of Trichoderma harzianum on Pythium aphanidermatum. Phytopathology 74: 498-501.Soepardi, Goeswono. 1983. Sifat dan Ciri Tanah. Jurusan Tanah, Fakultas Pertanian, Institut Pertanian Bogor.
591p.
Steel, G. D. dan J. H. Torrie. 1989. Prinsip dan Prosedur Statistika. Gramedia. Jakarta. 748p.
Takahashi, M. 1981. Taxonomy and ecology on Pythium as pathogenic soil fungi. Symposium on Pest Ecology and Pest Management, Nop.30-Dec.2. BIOTROP. Bogor- Indonesia. 79p.
Walker J. C. 1957. Palnt Pathology. Second Ed. Mc raw-Hill Book company. New York-Toronto-London. 707p.
Webster, J. and Lomas N. 1964. Does Trichoderma viride produce Gliotoxin and Viridin? Trans. Br. Mycol.
Soc. 47:535-540.
Wolf, F. A. and Frederick T. Wolf. 1949. The Fungi vol
Tabel Lampiran 1. Diameter Koloni Pythium sp. pada Beberapa pH Media PDA
Diameter Koloni (mm) P H
ulangan ke
...
1 2 3 4 5 rata-rata Hari pertama
4 2 9 . 0 2 8 . 5 2 9 . 0 27.5 29.0 2 8 . 6
5 3 2 . 5 3 5 . 0 3 3 . 0 3 2 . 5 3 2 . 0 3 3 . 0 6 3 5 . 5 3 6 . 0 35.5 3 6 . 0 3 5 . 0 3 5 . 6
7 2 9 . 0 3 0 . 0 29.5 3 0 . 0 28.5 2 9 . 4
8 2 5 . 0 26.0 2 4 . 0 2 6 . 0 25.5 25.4
Hari kedua
4 7 8 . 0 7 6 . 5 7 9 . 0 7 8 . 5 79.0 7 8 . 2
5 8 3 . 5 8 4 . 0 83.5 83.0 83.0 8 2 . 8
6 8 9 . 0 90.0 90.0 89.0 8 8 . 0 89.2
7 8 0 . 0 7 5 . 0 75.5 7 6 . 0 7 4 . 5 7 6 . 2 8 7 3 . 5 7 5 . 0 7 4 . 0 7 3 . 0 72.5 7 3 . 6
Tabel Lampiran 2. Sidik Ragam Diameter Koloni Pythium sp. pada Beberapa pH Media PDA
Hari Sumber db JK KT F Ftab
1 Perlakuan 4 3 1 5 . 1 9 9 7 8 . 8 0 0 1 3 9 . 4 5 9 * 2 . 8 7
Galat 2 0 1 1 . 3 0 1 0 . 5 6 5
Total 24 3 2 6 . 5 0 0 1 3 . 6 0 4
2 Perlakuan 4 7 7 3 . 8 4 4 1 9 3 . 4 6 1 1 2 5 . 6 3 7 * 2..87
Galat 2 0 30.797 1 . 5 4 0
Tabel Lampiran 3. Berat Kering P y t h i u m sp. yang Ditumbuh- kan pada Beberapa pH Media PDB
Berat kering cendawan (gram) PH
ulangan ke
...
1 2 3 4 5 rata-rata
Tabel Lampiran 4. Sidik Ragam Berat Kering P y t h i u m
sp. yang Ditumbuhkan pada Beberapa pH Media PDB
Sumber db JK KT F Ftab
Perlakuan 4 0.003 0.001 4.383* 2.87
Galat 2 0 0.003 0.000
Total 2 4 0.006 .O.OOO
*
= berbeda nyata pada taraf 5%Tabel Lampiran 5. Diameter Koloni G l i o c l a d i u m f i m b r i a t u m
pada Beberapa pH Media PDA
Diameter Koloni (mm) PH
ulangan ke
...
1 2 3 4 5 rata-rata
Hari pertama
12.5 12.5 12.0 12.0 13.0 12.4 17.0 17.0 19.0 17.5 16.5 17.4 15.0 16.0 15.5 16.0 15.5 15.6 14.0 13.5 14.0 13.0 14.0 13.7 10.5 11.0 12.0 12.0 11.5 11.4
Hari kedua
T a b e l Lampiran 5 . L a n j u t a n
Diameter K o l o n i (mm)
PH
u l a n g a n k e
...
1 2 3 4 5 r a t a - r a t a
H a r i k e t i g a
4 68.5 7 0 . 5 7 0 . 0 7 0 . 0 7 1 . 0 7 0 . 0
5 87.5 8 7 . 0 8 6 . 5 85.0 8 7 . 0 8 3 . 0
6 8 3 . 0 8 4 . 0 8 2 . 5 81.5 8 4 . 0 8 3 . 0
7 7 5 . 0 7 9 . 0 7 5 . 0 73.5 7 4 . 0 7 5 . 3
8 59.5 6 4 . 0 6 1 . 5 6 3 . 0 6 1 . 0 61.8
T a b e l Lampiran 6. S i d i k Ragam Diameter k o l o n i G . fim- briatum pada Beberapa pH Media PDA
H a r i Sumber d b J K KT F F t a b
1 P e r l a k u a n 4 1 1 7 . 4 0 0 2 9 . 3 5 0 7 7 . 2 3 6 * 2 . 8 7 G a l a t 2 0 7.600 0 . 3 8 0
T o t a l 2 4 125.000 5 . 2 0 8
2 ' P e r l a k u a n 4 667.840 1 6 6 . 9 6 0 2 4 0 . 2 5 7 * 2 . 8 7
G a l a t 2 0 1 3 . 8 9 8 0 . 6 9 5 T o t a l 2 4 681.738 2 8 . 4 0 6
3 P e r l a k u a n 4 1 9 8 6 . 5 6 3 4 9 6 . 6 4 1 2 3 2 . 0 9 2 * 2 . 8 7 G a l a t 2 0 42 - 7 9 7 2 . 1 4 0
T o t a l 2 4 2029.359 8 4 . 5 5 7
*
= b e r b e d a n y a t a pada t a r a f 5%T a b e l Lampiran 7. B e r a t Kering G. fimbriatum yang Ditum- buhkan pada Beberapa pH Media PDB
- - - -
B e r a t k e r i n g cendawan (gram) PH
u l a n g a n k e
...
[image:63.533.64.488.62.690.2]Tabel Lampiran 8. Sidik Ragam Berat Kering G. fimbriatum yang Ditumbuhkan Pada Beberapa,pH Media PDB
Sumber db JK KT F Ftab
Perlakuan 4 0.015 0.004 7.194* 2.87
Galat 2 0 0.010 0.001
Total 24 0.025 0.001
*
= berbeda nyata pada taraf 5%Tabel Lampiran 9. Hasil Pengamatan Uji Antagonis antara G. fimbriatum dengan Pythium sp. pada Beberapa pH Media PDA
Ukuran jari-jari (mm)
ulangan ke.
..
1 2 3 4
Hari pertama
13 15
13 14
15 18
14 15
17 18
15 17
15 14
14 14
13 13