PENGARUH PEMBERIAN BEBERAPA JAMUR ANTAGONIS DENGAN BERBAGAI TINGKAT KONSENTRASI UNTUK MENEKAN PERKEMBANGAN JAMUR Pythium sp. PENYEBAB REBAH KECAMBAH PADA TANAMAN TEMBAKAU (Nicotiana tabaccum L.)
SKRIPSI
OLEH
JONTAR M GULTOM 020302037
HPT
DEPARTEMEN ILMU HAMA DAN PENYAKIT TUMBUHAN FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA MEDAN
PENGARUH PEMBERIAN BEBERAPA JAMUR ANTAGONIS DENGAN BERBAGAI TINGKAT KONSENTRASI UNTUK MENEKAN PERKEMBANGAN JAMUR Pythium sp. PENYEBAB REBAH KECAMBAH PADA TANAMAN TEMBAKAU (Nicotiana tabaccum L.)
SKRIPSI
OLEH
JONTAR M GULTOM 020302037
HPT
Skripsi Sebagai Salah Satu Syarat Untuk Dapat Memperoleh Gelar Sarjana di Fakultas Pertanian
Universitas Sumatera Utara
Disetujui Oleh Komisi Pembimbing
Dr. Ir. Hasanuddin, MS Ir. Zulnayati
Ketua Anggota
DEPARTEMEN ILMU HAMA DAN PENYAKIT TUMBUHAN FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA MEDAN
ABSTRACT
Jontar M Gultom “ THE EFFECTS OF ANTAGONIST FUNGI
WITH VARIOUS LEVEL OF CONCENTRATIONS FOR DEPRESSING THE GROWTH OF Pythium sp. THAT CAUSE DAMPING OFF AT
TOBACCO PLANT (Nicotiana tabaccum L.)", with the conseling Dr. Ir. Hasanuddin, MS as a leader and Ir. Zulnayati as co-author. The experiment
was done at laboratory Plant Disease and Green House of Agriculture Faculty, North Sumatera University, during September - Desember 2007. The experiment was aimed to know the type of antagonist fungi and the level of conidia concentration for depressing the growth of Pythium sp. that cause of damping off tobacco plant. The experiment used Non Factorial Completely Randomized Design, with 3 treatment and 3 replication. The treatment are : J1 (Trichoderma koningii 104), J2 (Trichoderma koningii 106), J3 (Trichoderma koningii 108), J4
(Trichoderma harzianum 104), J5 (Trichoderma harzianum 106), J6 (Trichoderma
harzianum 108), J7 (Trichoderma viridae 104), J8 (Trichoderma viridae 106), J9 (Trichoderma viridae 108), J10 (Gliocladium virens 104), J11 (Gliocladium virens 106), J12 (Gliocladium virens 108). Observable variable is
Germination Percentage (%) and intensity of damping off (%). The result showed that the highest germination percentage are at J5, J6, J9 J12 (99,67%) and and the
lowest is J0 (controlled) (72,57 %). The highest intensity at J0 (controlled) (55,44%) and the lowest is J6 ( Trichoderma harzianum 108)
ABSTRAK
Jontar M Gultom “PENGARUH PEMBERIAN BEBERAPA JAMUR
ANTAGONIS DENGAN BERBAGAI TINGKAT KONSENTRASI UNTUK MENEKAN PERKEMBANGAN JAMUR Pythium sp. PENYEBAB REBAH KECAMBAH PADA TANAMAN TEMBAKAU (Nicotiana tabaccum L.)”,
dengan komisi pembiming Dr. Ir. Hasanuddin, MS sebagai ketua dan Ir. Zulnayati sebagai anggota. Penelitian ini dilaksanakan di Laboratorium
Penyakit Tumbuhan dan di Rumah Kaca Fakultas Pertanian Universitas Sumatera Utara, dari mulai bulan September-Desember 2007. Penelitian ini bertujuan untuk mengetahui jenis jamur antagonis dan tingkat kerapatan konidia yang efektif untuk menekan perkembangan jamur Pythium sp. penyebab rebah kecambah pada tembakau. Penelitian ini menggunakan metode Rancangan Acak Lengkap (RAL)
non faktorial dengan 13 perlakuan dan 3 ulangan. Perlakuan yang diuji adalah : J0 (kontrol/tanpa jamur antagonis, J1 (Trichoderma koningii 104), J2 (Trichoderma
koningii 106), J3 (Trichoderma koningii 108), J4 (Trichoderma harzianum 104), J5 (Trichoderma harzianum 106), J6 (Trichoderma harzianum 108), J7 (Trichoderma viridae 104), J8 (Trichoderma viridae 106), J9 (Trichoderma viridae 108), J10 (Gliocladium virens 104), J11 (Gliocladium virens 106), J12 (Gliocladium virens 108). Peubah yang diamati
adalah Persentase Perkecambahan (%) dan Intensitas Serangan (%). Hasil
penelitian menunjukkan bahwa persentase perkecambahan tertinggi terdapat pada J5, J6, J9, J12 yaitu sebesar 99,67 % dan terendah adalah J0 (kontrol) yaitu 72,57 %.
Intesitas serangan tertinggi terdapat pada J0 (kontrol) yaitu sebesar 55,44% dan
terendah pada J6 (Trichoderma harzianum 108) yaitu sebesar 38,33%.
RIWAYAT HIDUP
Jontar M Gultom, dilahirkan pada tanggal 18 November 1983 di
Sidikalang, Sumatera Utara. Merupakan anak keempat dari enam bersaudara dari
bapak M. Gultom (+) dan Ibu P. Sinambela.
Adapun pendidikan yang pernah ditempuh adalah :
Tahun 1990-1996 : Sekolah Dasar negeri 030279 di Sidikalang.
Tahun 1996-1999 : Sekolah Lanjutan Tingkat Pertama Negeri 1 di Sidikalang.
Tahun 1999-2002 : Sekolah Menengah Umum Negeri 1 di Sidikalang.
Tahun 2002 : Diterima di Fakultas Pertanian Universitas Sumatera Utara
Jurusan Ilmu Hama Dan Penyakit Tumbuhan melalui
Jalur Seleksi Penerimaan Mahasiswa Baru (SPMB).
Kegiatan Selama Perkuliahan
- Menjadi anggota Ikatan Mahasiswa Perlindungan Tanamaan (IMAPTAN)
Fakultas Pertanian Universitas Sumatera Utara periode 2002/2007.
- Menjadi asisten Laboratorium Pengendalian Hama Terpadu Fakultas
Pertanian Universitas Sumatera T.A 2005/2006
- Menjadi asisten Laboratorim Hama Penting Tanaman Perkebunan
T.A 2005/2006 dan 2006/2007
- Melaksanakan Praktek Kerja Lapangan (PKL) di Kebun percobaan
Tanaman Buah /Balai Penelitian Tanaman Buah (KPTB/BPTB) Tongkoh
kabupaten Karo, Sumatera Utara tahun 2006.
- Melaksanakan praktek skripsi di Laboratorium Penyakit Tumbuhan dan
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Tuhan Yang maha Esa karena
atas berkat dan anugerahNya penulis dapat menyelesaikan skripsi ini. Adapun
judul dari skripsi adalah PENGARUH PEMBERIAN BEBERAPA JAMUR
ANTAGONIS DENGAN BERBAGAI TINGKAT KONSENTRASI UNTUK MENEKAN PERKEMBANGAN JAMUR Pythium sp. PENYEBAB REBAH KECAMBAH PADA TANAMAN TEMBAKAU (Nicotiana tabaccum L.).
Adapun tujuan dan kegunaan skripsi ini adalah sebagai salah satu syarat
untuk dapat memperoleh gelar sarjana di Fakultas Pertanian
Universitas Sumatera Utara dan sebagai bahan informasi bagi pihak yang
membutuhkan.
Penulis mengucapkan terima kasih kepada Bapak Dr. Ir. Hasanuddin, MS
selaku ketua komisi pembimbing dan Ibu Ir. Zulnayati sebagai anggota komisi
pembimbing yang telah banyak memberikan arahan dan bimbingan kepada
penulis, dan tidak lupa juga kepada para rekan yang telah banyak membantu
penulis dalam menyelesaikan skripsi ini.
Penulis menyadari skripsi ini masih jauh dari sempurna, oleh sebab itu
penulis mengharapkan kritik dan saran yang bersifat membangun demi
kesempurnaan skripsi ini.
Akhir kata penulis mengucapkan terima kasih, semoga skripsi ini
bermanfaat.
Medan, Januari 2008
DAFTAR ISI
Hipotesa Penelitian ... 3
Kegunaan Penelitian ... 3
TINJAUAN PUSTAKA Penyakit Rebah Kecambah Tembakau ... 4
Biologi Penyebab Penyakit (Pythium sp.) ... 4
Gejala Penyakit ... 6
Daur Hidup Penyakit ... 7
Faktor Yang Mempengaruhi ... 8
Jamur Antagonis... 8
Trichoderma koningii... 8
Trichoderma harzianum ... 10
Trichoderma viridae ... 11
Gliocladium virens... 13
Mekanisme Antagonis ... 15
BAHAN DAN METODA Tempat Dan Waktu Penelitian ... 18
Bahan dan Alat ... 18
Metode Penelitian ... 18
Pelaksanan Penelitian ... 20
Pembuatan Potato Dextrose Agar (PDA)... 20
Penyediaan Inokulum Pythium sp ... .21
Pembuatan Suspensi Jamur Pythium sp ... 21
Pembiakan Jamur Antagonis ... 22
Pembuatan Suspensi Jamur Antagonis ... 22
Persiapan Media Semai ... 23
Inokulasi Jamur Pythium sp. ... 24
Aplikasi Jamur Antagonis ... 24
Peubah Pengamatan ... 24 Persentase Perkecambahan ... 24 Intensitas Serangan Damping off (Rebah Kecambah) ... 25
HASIL DAN PEMBAHASAN
Persentase Perkecambahan ... 27
Intensitas Serangan ... 29
KESIMPULAN DAN SARAN
Kesimpulan ... 34
Saran ... 34
DAFTAR TABEL
No Judul Hlm
1. Rata-rata Persentase Perkecambahan (%)
Benih Tembakau Pada 7 dan 14 Hari Setelah Semai. ... 27
2. Rata-rata Intensitas Serangan Rebah Kecambah (%) ... 30
3. Pengaruh Kerapatan Konidia Dari Jamur Antagonis
DAFTAR GAMBAR
No Judul Hlm
1. Pythium sp... 5
2. Ilustrasi Pythium sp. ... 6
3. Trichoderma koningii ... 9
4. Ilustrasi Trichoderma koningii ... 10
5. Trichoderma harzianum ... 11
6. Ilustrasi Trichoderma harzianum ... 11
7. Trichoderma viridae ... 12
8. Ilustrasi Trichoderma viridae ... 12
9. Gliocladium virens ... 14
10. Ilustrasi Gliocladium virens ... 14
11. Histogram Pengaruh Pengaruh Pemberian Jamur Antagonis Terhadap Persentase Perkecambahan Benih Tembakau ... 28
DAFTAR LAMPIRAN
No Judul Hlm
1. Bagan Percobaan ... 39
2. Data Persentase Perkecambahan I (7 HSS) (%)... 40
3. Analisa Sidik Ragam Persentase Perkecambahan I (7 HSS) ... 40
4. Uji Jarak Duncan Persentase Perkecambahan I (7 HSS) ... 41
5. Data Persentase Perkecambahan II (14 HSS) (%) ... 41
6. Analisa Sidik Ragam Persentase Perkecambahan II (14 HSS)... 42
7. Uji Jarak Duncan Persentase Perkecambahan II (14 HSS) ... 42
8. Data Intensitas Serangan Rebah Kecambah(%) ... 43
9. Analisa Sidik Ragam Intensitas Serangan Rebah Kecambah ... 43
10. Uji Jarak Duncan Intensitas Serangan Rebah Kecambah... 44
11. Foto-Foto Penelitian ... 45
12. Perhitungan Kerapatan Sporangium... 49
PENDAHULUAN
Latar Belakang
Tembakau (Nicotiana spp. L.) adalah genus tanaman yang berdaun lebar
yang berasal dari daerah Amerika Utara dan Amerika Selatan. Daun dari pohon
ini sering digunakan sebagai bahan baku rokok. Daun tembakau dapat pula
dikunyah atau dikulum, dan ada pula yang menghisap bubuk tembakau melalui
hidung. Tembakau mengandung zat alkaloid nikotin, sejenis neurotoxin yang
sangat ampuh jika digunakan pada serangga. Zat ini sering digunakan sebagai
bahan utama insektisida (Murdiyati dan Sembiring, 2000).
Komoditas tembakau mempunyai peran sangat penting dalam
pembangunan nasional. Pemerintah telah menetapkan hasil tembakau dan industri
tembakau (IHT) sebagai industri prioritas karena kontribusinya yang besar dalam
penyediaan lapangan kerja dan pendapatan negara. Agribisnis tembakau mampu
menyediakan lapangan kerja bagi kurang lebih 10 juta orang, dan pendapatan
negara sekitar Rp 42 trilyun, serta pemasukan devisa melalui ekspor tembakau
sebesar Rp 1,9 trilyun (Titik, 2007).
Permasalahan yang sangat dirasakan pada beberapa tahun ini adalah
rendahnya produktivitas, meskipun berbagai upaya telah dilakukan, volume
produksi pasar masih belum terpenuhi. Penyebab belum terpenuhinya kebutuhan
pasar tersebut cukup kompleks, antara lain akibat serangan hama dan penyakit,
disamping faktor fisik lingkungan seperti iklim, terutama curah hujan dan faktor
Salah satu penyakit penting pada tanaman tembakau adalah hangus batang
(Damping off) atau rebah semai yang disebabkan oleh jamur Pythium spp. Sampai
saat ini penyakit ini masih banyak dijumpai menyerang bibit tembakau dan
dianggap cukup berbahaya. Penyakit ini dapat menyebabkan turunnya produksi
sampai 20%, karena tidak baiknya bibit. Jamur ini pada umumnya berkembang di
daerah tropikal (Erwin, 2000).
Untuk mengendalikan penyakit petani cenderung menggunakan pestisida
sintetis secara berlebihan sehingga menimbulkan dampak buruk bagi kesehatan,
pencemaran lingkungan dan gangguan keseimbangan ekologis. Oleh karena itu
perhatian pada alternatif pengendalian yang lebih ramah lingkungan semakin
besar untuk menurunkan penggunaan pestisida sintetis dan salah satunya adalah
dengan pengendalian hayati (Istikorini, 2002).
Pengendalian hayati terhadap cendawan patogenik memberi harapan untuk
dikembangkan di lapangan. Banyak peneliti yang menarik manfaat jamur
antagonis sebagai agensia yang efektif untuk mengendalikan berbagai patogen
dalam tanah (Istikorini, 2002).
Trichoderma dan Gliocladium merupakan jamur yang umum terdapat
dalam tanah, tumbuh dengan cepat dan bersifat antagonistik terhadap jamur lain.
Mekanisme antagonis jamur tersebut terjadi dengan cara kompetisi, mikoparasitik,
dan antibiosis. Biakannya dapat diperoleh dengan cara mengisolasi dari tanah.
(Abadi, 2003).
Keberhasilan pengendalian hama dengan menggunakan jamur
entomopatogen maupun pengendalian patogen penyebab penyakit dengan
yang akan diaplikasikan, yaitu kerapatan konidia dalam setiap mililiter air. Jumlah
konidia berkaitan dengan banyaknya biakan cendawan yang dibutuhkan
(Prayogo, 2006).
Tujuan Penelitian
Untuk mengetahui jenis jamur antagonis yang efektif untuk
mengendalikan jamur Pythium sp. Penyebab rebah kecambah pada tanaman
tembakau (Nicotiana tabaccum L.)
Untuk mengetahui tingkat konsentrasi (kerapatan konidia) jamur
antagonis yang efektif untuk mengendalikan jamur Pythium sp. Penyebab rebah
kecambah pada tanaman tembakau (Nicotiana tabaccum L.).
Hipotesa Penelitian
Beberapa jamur antagonis efektif untuk mengendalikan jamur
Pythium sp. penyebab rebah kecambah pada tanaman tembakau
(Nicotiana tabaccum L.)
Diduga ada tingkat kerapatan konidia tertentu dari jamur antagonis yang
efektif untuk mengendalikan jamur patogen
Kegunaan Penelitian
Sebagai salah satu syarat untuk mendapatkan gelar sarjana di Fakultas
Pertanian Universitas Sumatera Utara, Medan.
TINJAUAN PUSTAKA
Penyakit Rebah Kecambah Tembakau Biologi Penyebab Penyakit (Pythium sp.)
Menurut Alexopoulus dan Mims (1979) jamur Pythium sp. dapat
diklasifikasikan sebagai berikut :
Kingdom : Mycetae
Divisio : Eumycota
Sub Divisio : Mastigomycotina
Kelas : Oomycetes
Ordo : Peronosporales
Famili : Pythiaceae
Genus : Pythium
Spesies : Pythium sp.
Alat perkembang biakan seksual terdiri atas oogonium dan anteredium
yang biasanya tumbuh berdekatan pada satu hifa. Oogonium berupa bola,
berisikan satu oosfer yag berinti banyak dan diselubungi oleh lapisan periplasma.
Anteredium dibawah oogonium, bentuknya langsing memanjang atau seperti
gada. Bila anteredium bersinggungan dengan oogonium, maka anteredium
menghasilkan saluran yang masuk ke dalam oosfer (Dwidjoseputro, 1978).
Pythium mempunyai sporangium (konidium) yang bulat. Sporangium akan
membentuk zoospora (spora yang dapat bergerak dan berenang di air). Zoospora
Pythium juga akan membentuk struktur istirahat yakni membentuk klamidospora
yang akan bertahan di dalam tanah (Gutierez and Melton, 1999).
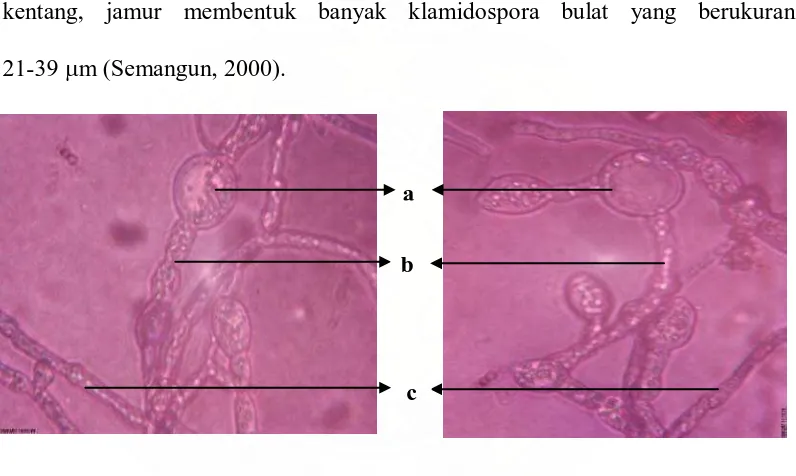
Jamur Pythium sp. mempunyai miselium kasar, lebarnya kadang-kadang
sampai 7 µm. Selain membentuk sporangium biasa, (berbentuk bulat atau
lonjong), jamur juga membentuk sporangium yang bentuknya tidak teratur seperti
batang atau bercabang-cabang yang dipisahkan dari ujung hifa. Bagian ini sering
disebut presporangium dan ukurannya dapat mencapai 800 x 20 µm. Pada agar
kentang, jamur membentuk banyak klamidospora bulat yang berukuran
21-39 µm (Semangun, 2000).
Gambar 1. Pythium sp. (Perbesaran 400 X)
Keterangan : a. Sporangium, b. Sporangiofor, c. Miselium
a
b
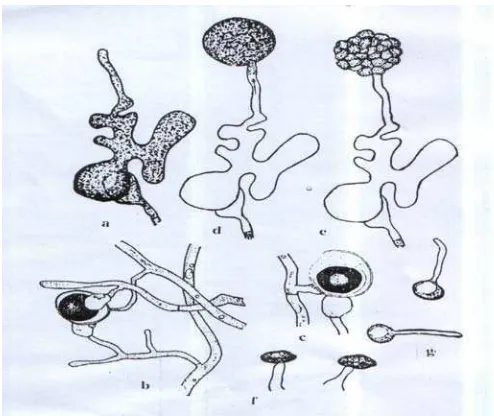
Gambar 2. Ilustrasi Pythium sp.
Keterangan : a. Presporangium, b. Oogonium, c. Oospora yang Masak, d. Pembentukan Sporangium, e. Pembentukan Zoospora,
f. Zoospora, g. Zoospora Berkecambah Sumber : Semangun 2000
Gejala Penyakit
Gejala khas yang disebabkan penyakit rebah kecambah dapat terlihat pada
pagi hari, dimana disekitar tanaman sakit tampak terdapat benang-benang seperti
rumah labah-labah dengan tetes-tetes embun yang tergantung. Sering menyerang
tanaman yang masih muda dan dekat tanah yang menyebabkan hawar daun atau
bercak daun yang lebar (Semangun, 1996).
Penyakit timbul pada hari-hari pertama setelah pemindahan. Pangkal
batang berlekuk sepanjang 1-15 cm dan membusuk. Tanaman yang sakit “busuk
batang” ini biasanya tidak menunjukkan gejala kelayuan yang jelas. Kulit batang
rusak dan empulur batang berlubang. Apabila batang belum berkayu maka
tanaman akan rebah (Semangun, 2000).
Pythium sp. juga mengakibatkan pre emergance damping off yaitu
benih menunjukkan gejala busuk dan berwarna kehitaman disertai dengan
miselium putih pada permukaan benih dan post emergence damping off atau
kecambah yang telah muncul ke permukaan menjadi rebah dan mati karena
memiliki batang yang lunak atau karena busuk (Duble, 2000).
Daur Hidup Penyakit
Pythium merupakan jamur tanah (soil inhibitant) yang dapat bertahan lama
dengan hidup sebagai saprofit pada bahan-bahan organik dalam tanah.
Pemencaran dalam kebun pada umumnya terjadi bersama-sama dengan tanah atau
bahan organik yang terangkut air (Semangun, 2004).
Jamur Pythium sp. tersebut umum terdapat dalam tanah dan dalam
bahan-bahan organik yang mengalami perombakan. Jamur ini bersifat polyfag
sehingga dapat mempunyai beberapa jenis tanaman inang antara lain lamtoro
(Leucana leucocephala), bayam duri (Amaranthus sp), kucingan (Mimosa invisa),
kerokot (Portulaca oleracea). Jamur Pythium ini hidup menyebar pada tanah yang
terinfeksi, dan pertumbuhan hyfa akan cepat menyebar dari tanaman yang satu
ke tanaman yang lain pada pembibitan yang terlalu padat (Semangun, 2000).
Pythium umumnya dapat dipencarkan oleh air dan tanah buangan. Jamur
ini dapat hidup pada tanaman yang mati maupun jasad binatang. Jamur ini bersifat
sebagai saprofit atau sebagai parasit tingkat rendah yang menyerang jaringan akar
tanaman. Ketika tanah basah terinfeksi Pythium, maka bibit atau tanaman muda
Faktor Yang Mempengaruhi
Perubahan aerasi mempengaruhi kerentanan tanaman, virulensi patogen
atau kedua-duanya, sehingga timbulnya penyakit akan dipengaruhi oleh keadaan
aerasi tanah, begitu juga dengan penyebaran biji yang terlalu rapat memberikan
lingkungan yang sangat baik kepada parasit yang perkembangannya dibantu oleh
kelembaban yang tinggi (Triharso, 1992).
Suhu optimal untuk Pythium dapat menyerang tanaman tembakau
bervariasi cukup besar antara 24–350 C. Walaupun demikian pertumbuhan dari
beberapa jenis akan menurun atau terhambat pada kondisi pH rendah (pH > 5)
(Guiterrez and Melton, 1999).
Penyebaran penyakit ini sangat dipengaruhi oleh kelembaban yang tinggi
dan penerimaan cahaya sinar matahari yang kurang baik di pembibitan.
Perkembangan penyakit ini juga dibantu oleh kerapatan bibit dan embun yang
banyak terjadi di waktu malam (Semangun, 2000).
Jamur Antagonis Trichoderma koningii
Koloni Trichoderma pada media biakan PDA tumbuh dengan cepat pada
suhu 25-300 C dan tidak tumbuh pada suhu 350 C. Koloni ini akan berubah warna
menjadi hijau tua sedangkan bagian bawahnya tidak berwarna.
(Samuel, et al, 2005).
Pada media biakan, pada suhu 200 C koloni Trichoderma tumbuh cepat dan
dapat mencapai diameter 9 cm dalam 4 hari. Mula-mula pertumbuhan seperti
anyaman miselium dengan permukaan halus, karena terjadi pembentukan hifa-hifa
mempertahankan diri dengan pembentukan klamidospora. Trichoderma menyukai
suasana masam untuk pertumbuhannya. Pertumbuhan optimum terjadi antara
pH 3,5-5,5 karena pada suasana masam ini Trichoderma membentuk suatu zat
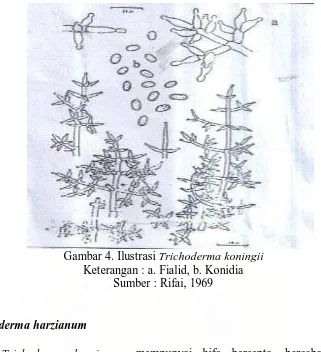
yang mudah menguap yaitu antibiotika gliotoksin (Rifai, 1969).
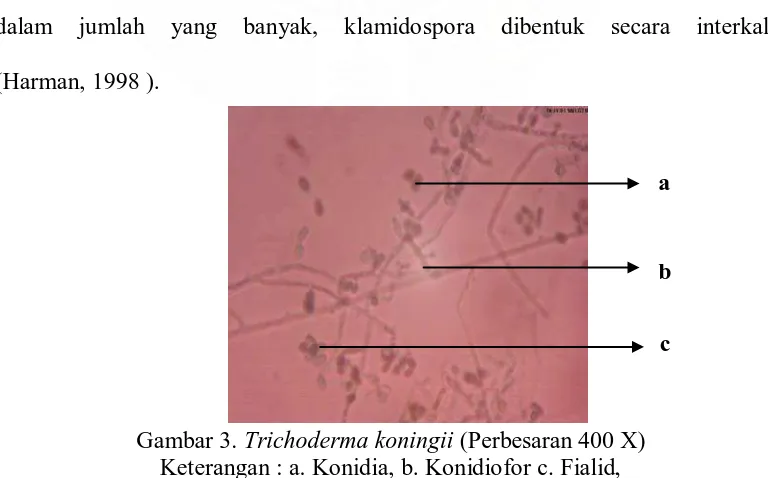
Miselium Trichoderma koningii terdiri dari hifa-hifa yang hialin (terang),
berdinding mulus, bersepta dan bercabang banyak. Konidiofor tegak lurus,
muncul dari yang rendah, dari cabangnya akan keluar cabang yang lain, dimana
cabangnya selalu berhadapan yang berbentuk seperti pucuk dan sudut terminal
dibatasi dengan konidia head. Konidia kecil umumnya berbentuk seperti bol,
berwarna terang atau hialin (Gilman, 1971).
Trichoderma koningii mempunyai sporodokia bercabang kurang teratur
pada lingkaran, sporodokia berbentuk piramida yang kasar, fialides dan cabang
cenderung bercabang satu-satu dan secara menyeluruh bentuk konidiofor lebih
cenderung linier daripada bentuk piramida, hifa berdiameter 5-10 µm. Konidia
berdinding halus dan pendek silindris dengan ukuran 3-5 µm yang dilepaskan
dalam jumlah yang banyak, klamidospora dibentuk secara interkalar
(Harman, 1998 ).
Gambar 3. Trichoderma koningii (Perbesaran 400 X) Keterangan : a. Konidia, b. Konidiofor c. Fialid,
a
b
Gambar 4. Ilustrasi Trichoderma koningii Keterangan : a. Fialid, b. Konidia
Sumber : Rifai, 1969
Trichoderma harzianum
Trichoderma harzianum mempunyai hifa bersepta, bercabang dan
mempunyai dinding licin, tidak berwarna, diameter 1,5-12 µm. Percabangan hifa
membentuk sudut siku-siku pada cabang utama. Cabang-cabang utama konidiofor
berdiameter 4-5 µm dan menghasilkan banyak cabang-cabang sisi yang dapat
tumbuh satu-satu tetapi sebagian besar berbentuk dalam kelompok yang agak
longgar dan kemudian berkembang menjadi daerah-daerah seperti cincin. Pada
ujung konidiofor terbentuk konidiospora berjumlah 1-3, berbentuk pendek,
dengan kedua ujungnya meruncing dibandingkan dengan bagian tengah,
berukuran 5-7 x 3-3,5 µm, diujung konidiofor terdapat konidia berbentuk bulat,
berdinding rata dengan warna hijau suram, hijau keputihan, hijau terang atau agak
Gambar 5. Trichoderma harzianum (Perbesaran 400 X) Keterangan : a. Konidia, b. Fialid, c. Konidiofor
Gambar 6. Ilustrasi Trichoderma harzianum Keterangan : a. Konidiofor, b. Fialid, c. Konidia
Sumber : Rifai, 1969
Beberapa ciri morfologi jamur Trichoderma harzianum yang menonjol
antara lain koloninya berwarna hijau muda sampai hijau tua yang memproduksi
konidia aseksual berbentuk globus dengan konidia tersusun seperti buah anggur
dan pertumbuhannya cepat (fast grower ) (Harman, 1998).
Trichoderma viridae
Trichoderma viride dapat diisolasi dari tanah. Suhu optimum untuk
pertumbuhannya adalah 150-300 C dan maksimum 300–360 C. Koloni pada
medium OA (Oat Agar) mencapai diameter lebih dari 5 cm dalam waktu 9 hari,
semula berwarna hialin, kemudian menjadi putih kehijauan dan selanjutnya hijau
redup terutama pada bagian yang banyak konidia. Konidiofor dapat bercabang
menyerupai piramida, yaitu pada bagian cabang lateral secara berulang-ulang,
sedangkan kearah ujung percabangan menjadi bertambah pendek. Fialid
berukuran 1,8–2,5 µm. Konidia berbentuk semi bulat hingga oval pendek,
berukuran 2,8–3,2 x 2,5–2,8 µm dan berdinding kasar. Klamidospora umumnya
ditemukan dalam miselia dari koloni yang sudah tua, terletak interkalar dan
kadang-kadang terminal (Gandjar, dkk., 1999).
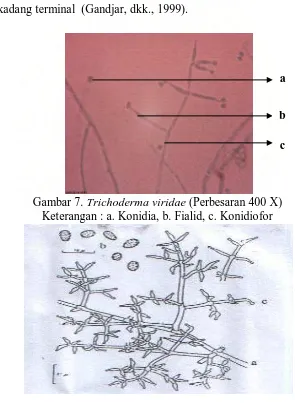
Gambar 7. Trichoderma viridae (Perbesaran 400 X) Keterangan : a. Konidia, b. Fialid, c. Konidiofor
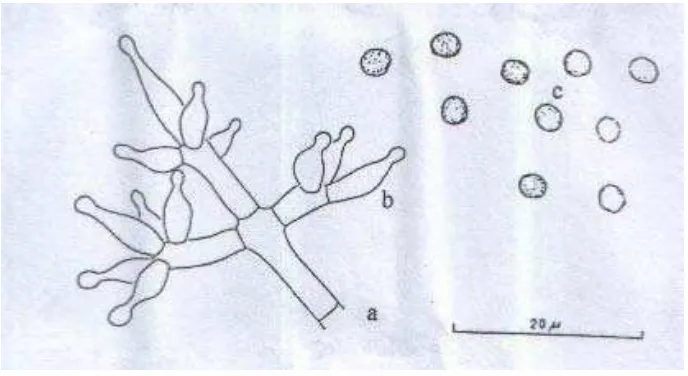
Gambar 8. Ilustrasi Trichoderma viridae Keterangan : a. Konidiofor, b. Konidia, Fialid
Sumber : Rifai, 1969.
a
Koloni muda T. viridae tumbuh sangat cepat, bisa mencapai 5-8 cm
selama 7 hari dalam media PDA, tipis seperti kapas yang menjadi semakin hijau
saat konidia berkembang. Sporodokia kasar berbentuk piramid, dengan
cabang-cabang panjang dekat pangkal dan cabang-cabang-cabang-cabang lebih pendek di atasnya.
Cabang disudut poros utama berdekatan, biasanya dalam lingkaran dan juga
menghasilkan fialid yang lateral dilingkaran yang sama, seperti terminal
lingkaran fialid. Konidia T. viridae bulat gemuk, biasanya diameternya 3,6-4,5
µm. Terkadang konidianya terlihat kasar dengan jelas, tetapi kadang-kadang
terlihat ramping (Sinulingga, 1989).
Jamur T. viridae lebih menyukai suasana asam, dengan suasana asam
tersebut, T. viridae akan menghasilkan anti biotika gliotoksin dan viridin
(Basuki dan Situmorang, 1994).
Gliocladium virens
Gliocladium spp. adalah salah satu jamur yang bersifat antagonis terhadap
patogen tanah. Pertumbuhan jamur Gliocladium optimal pada suhu 26-280 C dan
pada pH optimum 5-6 (Domsch, et al., 1980).
Gliocladium menghasilkan hifa, konidiofor, fialid dan konidia. Hifa
bersepta dan hialin. Cabang terakhir memunculkan pialides berbentuk botol.
Konidia bersel satu, oval sampai bentuk silinder. Konidiofor tegak, diakhiri
dengan brus padat seperti susunan cabang yang memuat fialid runcing. Konidia
tidak berwarna, pink atau hijau dan dihasilkan dalam massa basah yang padat dari
Gambar 9. Gliocladium virens (Perbesaran 400 X) Keterangan : a. Konidiofor, b. Fialid, c. Konidia
Gambar 10. Ilustrasi Gliocladium virens Keterangan : a. Konidia, b. Konidiofor, c. Fialid
Sumber : Rifai, 1969
Konidiofor jamur dari Gliocladium virens ini bersepta, bagian atas
berbentuk penicilite membentuk satu sikat yang pendek seperti Penicillium.
Konidia hialin atau cerah dan bersel satu ( Barnett, 1960 ).
Perkembangan Gliocladium sangat cepat, penyebaran dan
koloni-koloninya seperti kapas atau benang-benang. Dalam seminggu
pertumbuhannya akan menutupi keseluruhan permukaan cawan. Tampak depan
koloni, awalnya putih sampai krem dan dapat menjadi pink sampai merah atau
a
hijau gelap. Setelah matang, sebaliknya tidak berwarna, putih dan menguning.
jamur ini juga tidak hanya menghasilkan berbagai toksin dan antibiotik, tetapi
menghasilkan berbagai enzim seperti ekso dan endo glikonase, selobiase dan
kitinase (Mahr, 2005).
Mekanisme Antagonis
Mikroorganisme antagonis adalah mikroorganisme yang mempunyai
pengaruh yang merugikan terhadap mikrooraganisme lain yang tumbuh dan
berasosiasi dengannya. Antagonisme meliputi (a) kompetisi nutrisi atau sesuatu
yang lain dalam jumlah terbatas tetapi diperlukan oleh OPT, (b) antibiosis sebagai
hasil dari pelepasan antibiotika atau senyawa kimia yang lain oleh
mikroorganisme dan berbahaya bagi OPT dan (c) predasi, hiperparasitisme,
mikroparasitisme atau bentuk yang lain dari eksploitasi langsung terhadap OPT
oleh mikroorganisme yang lain (Istikorini, 2002).
Pengendalian dengan jamur antagonis umumnya secara mikoparasitik,
kompetitif, antibiosis atau amansalisme. Keberhasilan pengendalian secara biologi
oleh jamur antagonis yang dicampurkan ke dalam tanah, dipengaruhi oleh
lamanya waktu berhubungan (incorporration) antara antagonis dengan patogen.
Jamur antagonis tersebut memerlukan suatu media untuk dapat bertahan hidup
dalam ekosistem baru dan mampu menjalankan fungsinya sebagai antagonis
(Cook dan Baker (1983) dalam Hardaningsih, 1995)
Waktu pemberian inokulum jamur antagonis lebih awal memungkinkan
untuk jamur tersebut memperbanyak diri dan beradaptasi hingga potensinya lebih
inokulum yang tinggi berarti memberi modal awal agar populasinya tinggi
di dalam tanah sehingga menekan perkembangan musuhnya
(Rachmawati dkk, 1995).
Sifat antagonis jamur Trichoderma spp. telah diteliti sejak lama. Inokulasi
Trichoderma ke dalam tanah dapat menekan serangan penyakit layu yang
menyerang di persemaian, hal ini disebabkan oleh adanya pengaruh toksin yang
dihasilkan jamur ini (Khairul, 2000).
Trichoderma merupakan jamur saprofit yang hidup dalam tanah, serasah
dan kayu mati. Trichoderma memparasit miselium jamur lain dengan menembus
dinding sel untuk mengambil zat makanan dari dalamnya sehingga jamur
patogenik menjadi mati. Dalam kompetisi Trichoderma mempunyai kemampuan
memperebutkan sumber makanan atau disekitar perakaran tanaman menghasilkan
enzim -1,3 glukanase dan kitinase (Suwahyono dan Wahyudi, 2005).
Menurut Harman (1998) mekanisme utama pengendalian patogen tanaman
yang bersifat tular tanah dengan menggunakan jamur Trichoderma spp. dapat
terjadi melalui:
• Mikoparasit (memarasit miselium jamur lain dengan menembus dinding sel
dan masuk ke dalam sel untuk mengambil zat makanan dari dalam sel
sehingga jamur menjadi mati).
• Menghasilkan antibiotik seperti alametichin, paracelsin, trichotoxin yang
dapat menghancurkan sel jamur melalui pengrusakan terhadap permeabilitas
membran sel, dan enzim chitinase, laminarinase yang dapat menyebabkan lisis
• Mempunyai kemampuan berkompetisi memperebutkan tempat hidup dan
sumber makanan.
• Mempunyai kemampuan melakukan interferensi hipa. Hifa Trichoderma spp.
akan mengakibatkan perubahan permeabilitas dinding sel.
Gliocladium virens dapat mengendalikan patogen tanah dengan beberapa
mekanisme kerja yaitu: secara parasitisme, antibiosis, kompetisi dan pengeluaran
zat – zat beracun. G. virens akan melilitkan dirinya sendiri ke sekeliling patogen
dan melepaskan enzim-enzim yang menghancurkan dinding sel patogen, sehingga
patogen tersebut mudah terserang. G. virens menghasilkan antibiotik yang
berspektrum luas berupa gliotoxin, viridin, dan enzim–enzim seperti
endoglucanase, cellobiase dan chitinase yang dapat mematikan berbagai patogen
BAHAN DAN METODA
Tempat Dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Penyakit Tumbuhan Fakultas
Pertanian Universitas Sumatera Utara, Medan. Dengan ketinggian tempat ± 25 m.
di atas permukaan laut. Penelitian dilaksanakan pada bulan September sampai
Desember 2007
Bahan dan Alat
Bahan yang digunakan adalah media PDA, alkohol 70%, kloroks 0,5%,
aquades, media dedak, kapas, biakan murni jamur Pythium sp., benih tembakau,
tanah humus, kompos, biakan murni Trichoderma koningii,
Trichoderma harzianum, Trichoderma viride, Gliocladium virens.
Alat yang digunakan adalah cawan petri, tabung reaksi, erlenmeyer, jarum
kait, objek glass, timbangan, shaker, handsprayer, pinset, kotak inokulasi,
mikroskop, lampu bunsen, autoclave, oven, selotip, bak perkecambahan, glass
ukur, haemocytometer, kantong plastik, karung goni.
Metode Penelitian
Penelitian ini dilakukan dengan menggunakan Rancangan Acak Lengkap
(RAL) non faktorial yang terdiri dari 13 perlakuan yaitu :
J0 : Tanpa Jamur Antagonis.
J1 : Jamur Trichoderma koningii dengan kerapatan konidia 104 konidia/ml air.
J3 : Jamur Trichoderma koningii dengan kerapatan konidia 108 konidia/ml air.
J4 : Jamur Trichoderma harzianum dengan kerapatan konidia 104 konidia/ml
air.
J5 : Jamur Trichoderma harzianum dengan kerapatan konidia 106 konidia/ml
air.
J6 : Jamur Trichoderma harzianum dengan kerapatan konidia 108 konidia/ml
air.
J7 : Jamur Trichoderma viridae dengan kerapatan konidia 104 konidia/ml air.
J8 : Jamur Trichoderma viridae dengan kerapatan konidia 106 konidia/ml air.
J9 : Jamur Trichoderma viridae dengan kerapatan konidia 108 konidia/ml air.
J10 : Jamur Gliocladium virens dengan kerapatan konidia 104 konidia/ml air.
J11 : Jamur Gliocladium virens dengan kerapatan konidia 106 konidia/ml air.
J12 : Jamur Gliocladium virens dengan kerapatan konidia 108 konidia/ml air.
Setiap perlakuan perlakuan diulang sebanyak tiga (3) kali.
Jumlah ulangan diperoleh dengan menggunakan rumus :
(t-1) (r-1) ≥ 15 (13-1) (r-1) ≥ 15
12 r-12 ≥ 15
12 r ≥ 15
r ≥ 2,25 dibulatkan menjadi tiga (3).
Jumlah tanaman setiap perlakuan adalah sebanyak 100 tanaman, yang
Model linear yang digunakan adalah :
Yij = µ + Ti + ∑ij : i = 1,2,….. t j = 1,2,….. r
Dimana :
Yij = Nilai pengamatan pada perlakuan ke-i dan ulangan ke-j
µ = Nilai tengah umum
Ti = Pengaruh perlakuan ke-i
∑ij = Galat percobaan pada perlakuan ke-i dan ulangan ke-j
(Sastrosupadi, 2000).
Pelaksanan Penelitian
Pembuatan Potato Dextrose Agar (PDA)
Kentang dicuci bersih dan dikupas, seterusnya 200 gr dipotong kecil-kecil,
kemudian dimasak dengan aquadest 500 ml sampai mendidih, lalu disaring
ekstraknya dengan kain muslin. Pada waktu yang sama dididihkan aquadest steril
sebanyak 500 ml bersama dengan agar sebanyak 20 gr, setelah larut disatukan
dengan ekstrak kentang ke dalam beaker glass yang berukuran 1 liter, setelah itu
dimasukkan ke dalam erlenmeyer. Ditutup dengan kapas steril yang dilapisi
dengan alumunium foil, lalu dimasukkan ke dalam autoclave untuk disterilkan
selama 15 menit dengan suhu 1210 C dan tekanan 1,5 Atm, kemudian PDA
dibiarkan hingga panasnya menjadi hangat kuku dan siap dituang ke dalam cawan
Penyediaan Inokulum Pythium sp.
Sumber inokulum diambil dari tanaman yang terserang penyakit rebah
kecambah yang disebabkan oleh jamur Pythium sp. Dipotong-potong batas antara
tanaman yang sakit dan sehat dengan ukuran 3-4 mm dan direndam dengan
kloroks 1 % selama 1 menit, selanjutnya dicuci dengan aquadest steril sebanyak
2 kali. Potongan diambil dan diletakkan pada cawan petri yang berisi kertas tissue
supaya kering. Tahap selanjutnya potongan-potongan tersebut ditanam pada
cawan petri yang berisi PDA. Jamur yang tumbuh dipisahkan untuk mendapatkan
biakan murni. Biakan murni jamur patogen kemudian diperbanyak pada media
yang sama pada cawan petri. Biakan yang akan digunakan adalah biakan yang
berumur 2 minggu (Supeno, 1999).
Pembuatan Suspensi Jamur Pythium sp.
Pembuatan suspensi jamur patogen dilakukan dengan cara : biakan murni
jamur patogen. di dalam cawan petri diberi aquades 10 ml, kemudian dikikis,
sehingga bagian yang terdapat pada bagian atas terlepas, selanjutnya suspensi
dimasukkan ke dalam erlenmeyer dan ditambahkan dengan aquades steril
sehingga volumenya menjadi 100 ml (Sumaraw, 1999). Sespensi kemudian
diguncang dengan menggunakan shaker dengan kecepatan 200 rpm
selama 30 menit untuk membebaskan sporangium dari miselium
(Burns dan Benson, 2000). Suspensi jamur patogen yang telah didapat kemudian
diteteskan pada haemocytometer untuk menghitung kerapatan sporangium.
Kerapatan sporangium yang digunakan untuk aplikasi adalah 106 sporangium/ml
Kerapatan sporangium dihitung dengan menggunakan rumus:
S = t x 2,5. 103
keterangan :
S : Jumlah sporangium
t : Jumlah sporangium di dalam kotak yang besar
2,5. 103 : Konstanta
(Syafiuddin, 1992).
Pembiakan Jamur Antagonis
Jamur antagonis yang digunakan diperoleh dari BP2TP
(Balai Pengembangan Proteksi Tanaman Perkebunan) Sumatera Utara.
Jamur antagonis dibiakkan di dalam cawan petri, isolat diperbanyak dalam
media dedak yang diletakkan di kantong plastik. Isolat yang sudah ada kemudian
ditanamkan ke dalam media dedak. Isolat jamur antagonis yang diperbanyak dapat
digunakan setelah berumur 2 minggu (Sudantha, 1999).
Pembuatan Suspensi Jamur Antagonis
Untuk persiapan aplikasi, jamur antagonis yang telah berumur 2 minggu
diambil sebanyak 10 gr dan dimasukkan ke dalam erlenmeyer, lalu ditambahkan
dengan aquades steril sehingga volumenya menjadi 100 ml (Julak, 2006),
kemudian dishaker dengan kecepatan 200 rpm selama 30 menit
agar konidia-konidianya terlepas dari miselium, setelah itu disaring dengan
menggunakan kain muslin. Suspensi kemudian diambil 1 tetes
konidianya (Prayogo dan Hardaningsih, 2001). Kerapatan konidia yang digunakan
untuk aplikasi adalah 104, 106 dan 108 konidia/ml air (sesuai dengan perlakuan).
Apabila dalam perhitungan kerapatan konidia terlalu rapat dan sulit untuk
dihitung maka dilakukan pengenceran kembali sampai tingkat kerapatan
betul-betul bisa dihitung (Julak, 2006).
Kerapatan konidia dapat dihitung dengan menggunakan rumus :
(t x d)
S = x juta konidia per ml (n x 0,25)
Keterangan :
S : Jumlah konidia
t : Total konidia di dalam semua kotak yang dihitung
d : Faktor pengenceran. (d =1 jika tidak diencerkan, d =10 jika suspensi
diencerkan 1:10 dan seterusnya).
n : Jumlah semua kotak yang dihitung
(Gabriel dan Riyatno dalam Sulistyorini dkk., 1995)
Persiapan Media Semai
Media semai yang digunakan adalah berupa campuran top soil dan
kompos dengan perbandingan 1 : 1. Campuran disterilkan dengan cara mengukus
dalam drum, dipanaskan pada suhu 1000 C selama 1 jam. Setelah dikukus, tanah
dikering anginkan dengan cara menebarkannya diatas karung di dalam ruangan
yang tertutup dengan sirkulasi udara yang baik, setelah itu tanah diisi
ke dalam bak-bak perkecambahan (Murdiyati dan Sembiring, 2000). Bak
Inokulasi Jamur Pythium sp.
Inokulasi jamur Pythium sp. dilakukan pada media pada bak
perkecambahan dengan cara menyemprot suspensi Pythium sp. diatas permukaan
tanah sebanyak 30 ml (Rachmawaty dkk., 1995). Dibiarkan selama 1 minggu
dengan ditutupi plastik yang bertujuan untuk mengurangi kontaminan dan
menjaga kelembaban tetap tinggi (Santoso dkk., 1999).
Aplikasi Jamur Antagonis
Jamur antagonis diaplikasi 1 minggu setelah jamur Pythium
diinokulasikan. aplikasi dilakukan dengan cara menyemprot suspensi di atas
permukaan tanah sebanyak 30 ml dan ditutup kembali dengan plastik selama
1 minggu sebelum penyemaian dilakukan (Murdan dan Thoyibah, 1997).
Penyemaian Benih
Penyemaian benih dilakukan 1 minggu setelah aplikasi jamur antagonis,
sebelumnya dilakukan seleksi pada benih yang akan ditanam. Direndam dengan
air, dilakukan desinfeksi dengan menggunakan larutan alkohol 70 % selama
3 menit. Selanjutnya dibilas dengan air steril (Santoso dkk, 1999). Penyemaian
dilakukan pada bak-bak perkecambahan dengan menanam 100 benih pada
tiap-tiap bak.
Peubah Pengamatan
• Persentase Perkecambahan
Pengamatan persentase perkecambahan benih tembakau dilakukan sebanyak
dua kali yaitu 7 dan 14 hari setelah semai karena ada perbedaan lama dormansi
tembakau yang telah berkecambah. Persentase perkecambahan ini dapat dihitung
dengan menggunakan rumus :
a
P = X 100% a + b
keterangan :
P = Persentase Perkecambahan
a = Jumlah benih yang berkecambah normal
b = Jumlah benih yang tidak berkecambah
• Intensitas Serangan Damping off (Rebah Kecambah)
Pengamatan parameter intensitas serangan rebah kecambah
(Pythium sp.) dilakukan pada saat tanaman berumur 40-45 hari setelah semai. Hal
ini dilakukan karena bibit tembakau dapat dipindahtanamkan ke lapangan setelah
berumur 40-45 hari setelah semai (Murdiyati dan Sembiring, 2000).
Pada umur 40-45 hari setelah semai, tanaman dibongkar dan akar dicuci
dengan air mengalir, kemudian dihitung intensitas serangan rebah kecambah atau
busuk pangkal akar.
Menurut Filonow dan Dole (1999) intensitas serangan rebah kecambah
dan busuk pangkal akar (Pythium sp.) dihitung dengan menggunakan rumus :
IS = ( )x100% NxZ
nxv
∑
dimana :
IS = Intensitas serangan
n = Jumlah tanaman pada tiap skoring
N = Jumlah tanaman yang diamati
Z = Nilai skoring tertinggi
Skala serangan yang digunakan adalah :
Skala 0 : Tanaman sehat
Skala 1 : 1-25 % busuk
Skala 2 : 26-50 % busuk
Skala 3 : 51-75 % busuk
Skala 4 : >75 % busuk
HASIL DAN PEMBAHASAN
Persentase Perkecambahan Benih Tembakau
Hasil pengamatan terhadap persentase perkecambahan benih tembakau
dapat dilihat pada lampiran 1-3. dari hasil analisa sidik ragam dapat dilihat bahwa
perlakuan jamur antagonis (Trichoderma koningii, Trichoderma harzianum,
Trichoderma viridae dan Gliocladium virens) berpengaruh sangat nyata terhadap
persentase perkecambahan pada setiap pengamatan (7 dan 14 hari setelah semai).
Untuk mengetahui antara perlakuan mana yang berbeda nyata dapat dilihat pada
tabel 1.
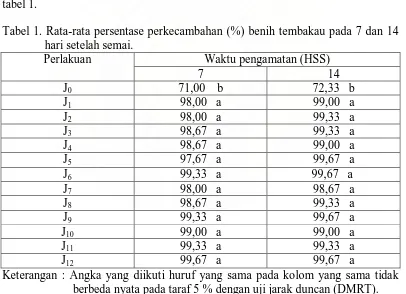
Tabel 1. Rata-rata persentase perkecambahan (%) benih tembakau pada 7 dan 14 hari setelah semai.
Perlakuan Waktu pengamatan (HSS)
7 14 berbeda nyata pada taraf 5 % dengan uji jarak duncan (DMRT).
HSS : Hari Setelah Semai
Dari tabel 1. dapat dilihat bahwa perlakuan J0 (kontrol/tanpa pemberian
jamur antagonis) pada setiap pengamatan berbeda nyata terhadap masing-masing
dengan jamur antagonis tidak menunjukkan perbedaan yang nyata pada setiap
pengamatan.
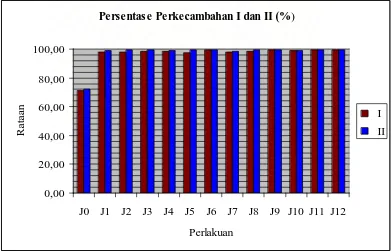
Pada pengamatan 1 (7 HSS), persentase perkecambahan tertinggi terdapat
pada perlakuan J12 (Gliocladium virens 108) yaitu sebesar 99,67 % dan terendah
pada perlakuan J0 (kontrol) yaitu sebesar 71,00 %. Pada pengamatan 2 (14 HSS)
persentase perkecambahan tertinggi terdapat pada perlakuan
J6 (Trichoderma harziuanum 108) yaitu sebesar 99,67 % dan terendah pada
perlakuan J0 (kontrol) yaitu sebesar 72,33 %.
Beda rataan pengaruh pemberian jamur antagonis terhadap persentase
perkecambahan benih tembakau dapat dilihat pada histogram berikut :
Persentas e Perkecambahan I dan II (%)
0,00
Gambar 11. Histogram Pengaruh Pengaruh Pemberian Jamur Antagonis Terhadap Persentase Perkecambahan Benih Tembakau
Dengan menghitung selisih persentase perkecambahan 2 (14 HSS) dengan
persentase perkecambahan 1 (7 HSS) pada tabel 1. dapat dilihat bahwa ada benih
J2 (1,33), J3 (0,66), J4 (0,33), J5 (2,00), J6 (0,34), J7 (0,66), J8 (0,66) dan J9 (0,39).
Hal ini menunjukkan bahwa sebelum pengamatan 2 (14 HSS) biji tembakau masih
dalam keadaan dorman. Dari data pengamatan 2 (14 HSS) persentase
perkecambahan (Tabel 1.) dapat dilihat bahwa tidak ada perlakuan yang mencapai
persentase perkecambahan yang 100 %, hal ini menunjukkan bahwa ada benih
yang tidak berkecambah, hal ini terjadi karena benih telah mati yang ditandai
dengan gejala busuk dan berubah warna menjadi kehitaman. Hal tersebut di atas
menunjukkan bahwa benih tersebut telah terserang rebah kecambah pada fase Pre
emergance. Duble (2000) menyatakan bahwa Pythium sp. Juga menyebabkan Pre
emergence damping off yaitu matinya kecambah sebelum muncul ke permukaan,
yang ditandai dengan benih menjadi busuk kehitaman dan disertai dengan
miselium putih pada permukaan benih.
Intensitas Serangan
Hasil pengamatan intensitas serangan damping off (rebah kecambah) dapat
dilihat pada lampiran 5-6. dari hasil analisa sidik ragam dapat dilihat bahwa
perlakuan jamur antagonis (Trichiderma koningii, Trichoderma harzianum,
Trichoderma viridae dan Gliocladium virens) berpengaruh nyata terhadap
intensitas serangan rebah kecambah. Untuk mengetahui perlakuan mana yang
berbeda nyata maka dilakukan uji jarak duncan. Hasilnya dapat dilihat pada
Tabel 2. Rata-rata Intensitas Serangan Rebah Kecambah (%)
Perlakuan Intensitas Serangan (%)
J0 55,44 a berbeda nyata pada taraf 5 % dengan uji jarak duncan (DMRT).
Dari hasil pengamatan intensitas serangan Pythium sp (Tabel 2.) dapat
dilihat bahwa intensitas serangan tertinggi terdapat pada perlakuan J0 (kontrol
yaitu sebesar 55,44 % dan terendah terdapat pada perlakuan J6 yaitu sebesar
38,33%. Perlakuan J0 berbeda nyata dengan J10 dan berbeda sangat nyata terhadap
perlakuan lainnya.
Dari tabel 2. dapat dilihat bahwa dengan perlakuan jamur antagonis maka
intensitas serangan jamur Pythium sp. semakin kecil bila dibandingkan dengan
kontrol (tanpa jamur antagonis). Hal ini terjadi karena jamur antagonis tersebut
dapat menghambat dan menekan perkembangan dari jamur Pythium sp. dengan
berbagai mekanisme antagonis. Istikorini (2002) menyatakan mekanisme dalam
pengandalian patogen tular tanah dengan menggunakan jamur antagonis dapat
terjadi melalui mikoparasit, antibiosis yang dapat menyebabkan pengrusakan
permeabilitas membran sel dan lisis pada dinding sel, kompetisi dan interferensi
jamur Pythium sp. relatif besar bila dibandingkan dengan perlakuan yang lain. Hal
ini disebabkan jamur patogen tersebut bebas menginfeksi jaringan tanaman karena
tidak ada jamur antagonis yang bersifat sebagai kompetitor yang dapat
menghambat perkembangannya.
Adapun pengaruh perlakuan jamur antagonis terhadap intensitas serangan
jamur Pythium sp. dapat dilihat pada histogram berikut :
Intensitas Serangan (%)
Gambar 12. Gambar Histogram Pengaruh Pengaruh Perlakaun Jamur Antagonis Terhadap Intensitas Serangan Jamur Pythium sp.
Dari data intensitas serangan rebah kecambah dapat dilihat adanya
perbedaan yang nyata antar perlakuan, tetapi bila dilihat dari angka-angkanya
memang ada kecenderungan intensitas serangan tersebut tergolong cukup besar.
Hal ini terjadi karena belum begitu besar pengaruh dari jamur antagonis yang
diaplikasikan. Hal ini disebabkan karena jamur antagonis yang diaplikasikan
tersebut belum berkembang di dalam tanah, ini dikarenakan tidak ada media
pembawa pada ekosistem barunya, sehingga jamur antagonis tersebut perlu
beradaptasi terlebih dahulu. Hardaningsih (1995) menyatakan jamur antagonis
sehingga mampu menjalankan fungsinya sebagai antagonis. Oleh sebab itu bahan
pembawa harus disertakan dalam aplikasi.
Pada pengamatan pengamatan intensitas serangan (tabel 1.) dapat dilihat
bahwa semakin tinggi kerapatan konidia dari jamur antagonis yang dicobakan
maka semakin rendah intensitas serangan dari jamur Pythium sp. Hal ini terjadi
karena perbedaan dari jumlah populasi jamur antagonis di dalam tanah. Dengan
meningkatnya populasi jamur antagonis ini maka aktivitas dalam menekan
patogen tular tanah juga meningkat, atau dengan kata lain semakin banyak
populasi jamur antagonis maka semakin banyak musuh atau kompetitor dari
Pythium sp. sehigga populasinya semakin tertekan. Rachmawati dkk (1995)
menyatakan waktu pemberian inokulum jamur antagonis lebih awal
memungkinkan untuk jamur memperbanyak diri dan menyesuaikan diri,
sedangkan dosis tinggi berarti mempertinggi populasi di dalam tanah.
Untuk mengetahui pengaruh kerapatan konidia dari jamur antagonis dalam
menekan perkembangan jamur Pythium sp. dapat dilihat pada lampiran 3. hasilnya
disajikan pada tabel 3 berikut.
Tabel 3. Pengaruh kerapatan konidia dari jamur antagonis terhadap intensitas serangan jamur Pythium sp.
Perlakuan Intensitas serangan (%)
Kontrol 55,44
104 106 108
Trichoderma koningii 49,16 44,48 38,63
Trichoderma harzianum 44,35 42,54 38,33
Trichoderma viridae 49,80 47,30 42,72
Gliocladium virens 50,55 48,22 42,72.
Dari tabel 3 dapat dilihat semakin tinggi kerapatan konidia dari jamur
jamur antagonis yang paling rendah intensitas serangannya (paling efektif dalam
menekan perkembangan jamur Pythium sp.) adalah secara berurutan adalah
Trichoderma harzianum lalu Trichoderma koningii, Trichoderma viridae dan
Gliocladium virens. Hal ini dikarenakan mekanisme antagonis dari
masing-masing jamur. Jamur Trichoderma dapat berkompetisi cepat dengan patogen.
Harman (1998) menyatakan mekanisme utama dalam pengendalian patogen tular
tanah dengan menggunakan Trichoderma spp. dapat melalui mikoparasitik,
antibiotik yang dapat menguap seperti alanatechin, paracelsin, trichotoxin yang
dapat menghancurkan sel, kompetisi dan interferensi hifa. Suwahyono dan
Wahyudi (2005) juga menyatakan Trichoderma menghasilkan enzim -1,3 glukanase dan kitinase.
Gliocladium virens juga dalam mengendaliakan patogen tular tanah
dengan berbagai mekanisme yang hampir sama dengan Trichoderma yaitu
parasitisme, antibiosis, kompetisi, dan mengeluarkan zat-zat beracun bagi
patogen. Mahr (2005) menyatakan Gliocladium dapat mengendaliakan patogen
tular tanah dengan mekanisme parasitisme, kompetisi, menghasilkan antibiotik
yang berspektrum luas berupa gliotoxin, viridin dan menghasilkan enzim-enzim
seperti enoglucanase, cellubiase dan chitinase yang dapat mematikan berbagai
KESIMPULAN DAN SARAN
Kesimpulan
1. Perlakuan jamur antagonis (Trichoderma koningii,
Trichoderma harzianum, Trichoderma viridae dan Gliocladium virens)
berpengaruh sangat nyata terhadap persentase perkecambahan.
2. Perlakuan jamur antagonis (Trichoderma koningii,
Trichoderma harzianum, Trichoderma viridae dan Gliocladium virens)
berpengaruh nyata terhadap Intensitas serangan jamur Pythium sp.
3. Intensitas serangan Pythium sp. tertingi terdapat pada J0 (kontrol) yaitu
sebesar 55,44% dan terendah pada perlakuan J6 (T. harzianum 108) yaitu
sebesar 38,63 %.
4. Jenis jamur antagonis yang efektif untuk menekan perkembangan jamur
Pythium sp. secara berurutan adalah T. harzianum, T. Koningii,
T. Viridae dan Gliocladium virens).
5. Kerapatan konidia yang efektif dalam mengendalikan jamur Pythium sp.
adalah 108 konidia/ml air.
Saran
Perlu dilakukan penelitian lebih lanjut di lapangan karena kondisi
DAFTAR PUSTAKA
Abadi, A. L. 2003. Ilmu Penyakit Tumbuhan. Bayu Media Publishing. Malang. Hlm. 68-69.
Agrios, G. N. 1978. Plant Pathology. Academic Press. New York. P.209-210.
Alexopoulos, C. J and C. W. Mims. 1979. Introductory Mycology. Third Edition. John Wiley and Sons, New York. P. 170-172.
Barnett, H. L. 1960. Ilustrated Genera of Imperfect Fungi. 2nd.ed. Department of Plant Pathology, Bacteriology and Entomology, West Virginia University, Margantown, West Virginia, Burgess Publishing Company, Minneapolis. P.52-54.
Basuki dan A. Situmorang. 1994. Trichoderma koningii dan Pemanfaatannya Dalam Pengendalian Penyakit Akar Putih (Rigidoporus microporus) Pada Tanaman Karet. Pusat Penelitian Karet Sei Putih. Hlm. 19-20.
Brown, F., A. Kerr., F. D. Morgan and I. H. Rarbery. 1980. Plant Protection Hedges and Bell Pty Ltd, Melbourne. P. 50-52
Burns, J. R and D. M. Benson. 2000. Biocontrol of Damping off Catharanthus roseus Caused by Pythium ultimum with Trichoderma virens and Binucleate Rhizoctonia Fungi.
http://www.google.com/search?q=cache:S9Enx5Qd2y0J:199.86.26.56/pd/p dfs/2000/04032R.pdf+control+damping+off+pythium&hl=id&ct=clnk&cd =28&gl=id [20 Maret 2007].
Deptan, 2005. Benih Tembakau (Nicotiana tabaccum L.) Kelas Benih Dasar (BD) dan Benih Sebar (BS).
Domsch, K. H., W. Cams, and T. H. Anderson, 1980. Compedium of Soil Fungi, Academic Press, London. P. 798-799.
Duble, R. L. 2000. Pythium Blight.
http://aggiehorticulture.tamu.edu/PLANTanswers/publications/PythBlight. [22April 2006].
Dwidjoseputro, D. 1978. Pengantar Mikologi. Edisi Kedua. Penerbit Alumni.Bandung. Hlm. 81-83.
Filonow, A. B and Dole, J. M.1999. Biological Control of Damping-off and Root Rot of Greenhouse-Grown Geraniums and Poinsettias.
Gandjar, I., Samson, R. A., Tweel-Vermeulen, K., Oetari, A., Santoso., I. 1999. Pengenalan kapang tropik umum., Universitas Indonesia. Depok, Jakarta. Hlm. 133-134.
Gilman, J. C. 1971. A Manual Of Soil Fungi. The Lowa State University Press. Ames Lowa, USA. Hlm. 212-214.
Guiterrez, W. A and T. A. Melton, 1999. Pythium Root Rot in Tobacco Greenhouse.
http://images.google.co.id/imgres?imgrul=http://www.ces.ncsu.edu/depts/ pp/notes/tobacco/tdin008/pythium. [2 Februari 2007].
Hardaningsih, S. 1995. Efektivitas Gliocladium roseum Untuk Megendalikan Penyakit Terbawa Benih Pada Tanaman Kacang-Kacangan. Prosiding Kongres Nasional XII dan Seminar Nasional PFI, Mataram. Hlm 185-188.
Harman, G. E., 1998. Trichoderma spp. Proc. Am. Acad. Sci. USA.
[22April 2006].
Istikorini, Y. 2002. Pengendalian Penyakit Tumbuhan Secara Hayati Yang Ekologis dan berkelanjutan.
Julak, 2006. Pengembangan Agens Hayati.
[29 april 2007]
Khairul, U. 2000. Pemanfaatan Bioteknologi Untuk Meningkatkan Produksi Pertanian.
Mahr, S. 2005. Gliocladium virens. Know Your Friends Vol. V No. 9, University
of Wisconsin-Madison. [14 April 2006].
Murdan dan Thoyibah, K. 1997. Pengaruh Aplikasi Trichoderma harzianum Terhadap Populasi Rhizoctonia solani Pada Padi Gogo. Prosiding Kongres
Murdiyati, A. S dan Sembiring, H. 2000. Tembakau (Nicotiana tabaccum). Balai Penelitian Tembakau dan Tanaman Serat. Malang, Jawa Timur.
Prayogo, Y. 2006. Upaya Mempertahankan Keefektifan Cendawan
Entomopatogen untuk Mengendalikan hama tanaman pangan. Jurnal Litbang Pertanian 25(2) 47-52.
Prayogo, Y dan Hardaningsih, S. 2001. Potensi Jamur Gliocladium roseum Untuk Mengendalikan Penyakit Antraknosa (Colletotrichum manihotis ) Pada Ubi Kayu. Prosiding Kongres Nasional XVI dan Seminar Ilmiah PFI, Bogor. Hlm. 112-114.
Rachmawaty, A., Ambarwati, H. T. dan Toekidjo, M. 1995. Kajian Pengendalian Penyakit Busuk batang Vanili Dengan Trichoderma viridae. Prosiding Kongres Nasional XIII dan Seminar Ilmiah PFI, Mataram. Hlm. 207-210.
Rifai, M. A. 1969. Revision of Genus Trichoderma. Commmon Wealth Micologycal Paper. Surrey, England. P. 15-17.
Samuel, G. J., P. Chaverri., D. F. Farr and E. B. Mc Cray. 2005. Trichoderma Online, Systematic Botany and Mycology Laboratory, ARS, USDA.
[14 April 2006].
Santoso, E. Maman, T dan Simon, T. N. 1999. Studi Antagonis Trichoderma harzianum Rifai Terhadap Pythium sp. Penyebab Penyakit Lodoh Pada Semai Sengon (Paraserianthes falcataria (L) Nielsen). Prosiding Kongres Nasional XV dan Seminar Ilmiah PFI, Purwekerto. Hlm. 553-558.
Sastrosupadi, A., 2000. Rancangan Percobaan Praktis Bidang Pertanian. Kanisius, Yogyakarta. Hlm. 53-56.
Semangun, H. 1996. Pengantar Ilmu Penyakit Tumbuhan. Gadjah Mada University Press, Yogyakarta. Hlm. 83-84.
.2000. Penyakit-Peyakit Penting Tanaman Perkebunan Di Indonesia. Gadjah Mada University Press, Yogyakarta. Hlm. 661-665.
. 2004. Penyakit-Penyakit Tanaman Hortikultura. Gadjah Mada University Press, Yogyakarta. Hlm. 59.
Sudantha, I. M. 1999. Pengendalian Secara Hayati Jamur Sclerotium rolfsii Pada Tanaman Kedelai Menggunakan Biofungisida Biotric. Prosiding Kongres Nasional XV dan Seminar Nasional PFI Purwekerto.Hlm. 121-125.
Sulistyorini, Mulyadi dan Sulistyowati, L. 1995. Antagonisme Jamur Trichoderma sp. Dengan Jamur Fusarium oxysporum f. Sp. Cubense. Pada Tanaman Pisang di Rumah Kaca. Prosiding Kongres Nasional XVIII dan Seminar Ilmiah PFI Mataram. Hlm. 572-576
Sumaraw, S. M. 1999. Periode Kritis Tanaman Tomat Terhadap Serangan
Alternaria solani (Ell. & G. Martin) Sor. Dan Faktor penentunya. Buletin Hama Dan Penyakit Tumbuhan 11 (2) : 67-72.
Supeno, B. 1999. Uji Patogenisitas jamur Trichoderma harzianum yang Digunakan Sebagai Agen Pengendali Hayati. Prosiding Kongres Nasional XV dan Seminar Nasional PFI Purwekerto. Hlm. 48-51.
Suwahyono, U dan P. Wahyudi. 2005. Penggunaan Biofungisida Pada Usaha
Perkebunan. Direktorat Tekhnologi Bioindustri-BPPTP.
http://www.iptek.net.id/ind/terapan.a [10 Mei 2006].
Syafiuddin, 1992. Pengelolaan Laboratorium. Pusat Penelitian Perkebunan Sungei Putih, Deli Serdang. Hlm 20.
Titik, 2007. Lokakarya Tembakau.
http://www.balittas.info/index.php?option=isi&task=view&id [14 Maret 2007].
Triharso, 1992. Beberapa Gatra Pengendalian Penyakit Tumbuhan dan Kemungkinan Penerapannya Di Indonesia.
Whittaker, B. 2001 Haemocytometers Procedure.
2. Data Persentase Perkecambahan I (7 HSS) (%)
Perlakuan Ulangan Total Rataan
I II III
3. Analisa Sidik Ragam Persentase Perkecambahan I (7 HSS)
4. Uji Jarak Duncan Persentase Perkecambahan I (7 HSS)
5. Data Persentase Perkecambahan II (14 HSS) (%)
Perlakuan Ulangan Total Rataan
6. Analisa Sidik Ragam Persentase Perkecambahan II (14 HSS)
SK dB JK KT F Hit F 0,05 F 0,01
Perlakuan 12 2018,26 168,19 10,44 ** 2,15 2,96
Galat 26 418,67 16,10
Total 38 2436,92
FK = 368699,08
Keterangan : ** = Sangat Nyata
* = Nyata
tn =
Tidak Nyata
7. Uji Jarak Duncan Persentase Perkecambahan II (14 HSS) (%) SY 2,316791179
P 2 3 4 5 6 7 8 9 10 11 12 SSR.05 2,91 3,06 3,14 3,21 3,27 3,3 3,34 3,36 3,38 3,385 3,41 LSR.05 6,742 7,089 7,275 7,437 7,576 7,645 7,738 7,784 7,831 7,842 7,900
Rataan Pembanding 72,33 98,67 99,00 99,33 99,67 72,33 -
98,67 91,92
a 99,00 91,91
b 99,33 92,06
8. Data Intensitas Serangan Rebah Kecambah (%)
Perlakuan Ulangan Total Rataan
I II III
9. Daftar Sidik Ragam Intensitas Serangan Rebah Kecambah
10. Uji Jarak Duncan Intensitas Serangan Rebah Kecambah
SY 3,344415552
P 2 3 4 5 6 7 8 9 10 11 12
SSR.05 2,91 3,06 3,14 3,21 3,27 3,3 3,34 3,36 3,38 3,385 3,41
LSR.05 9,732 10,234 10,501 10,736 10,936 11,037 11,170 11,237 11,304 11,321 11,404
38,33 38,63 42,54 42,72 44,35 44,48 47,30 48,22 49,16 49,80 50,55 55,44
a
b
c