annuum L.): KERAGAMAN ISOLAT DAN STRATEGI
PENGENDALIANNYA MELALUI INDUKSI
VARIASI SOMAKLONAL
IFA MANZILA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa disertasi berjudul “Chilli Veinal Mottle Potyvirus (ChiVMV) Penyebab Penyakit Belang pada Cabai (Capsicum annuum L.): Keragaman Isolat dan Strategi Pengendaliannya Melalui Induksi Variasi Somaklonal” adalah karya saya sendiri, dengan arahan Komisi Pembimbing dan belum pernah diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir setiap topik disertasi ini.
Bogor,12 April 2011
IFA MANZILA Chilli Veinal Mottle Potyvirus (ChiVMV) the causal agent of mottle diseases on Chilli Pepper (Capsicum annuum L.): Isolates diversity and its control strategy through induction of somaclonal variation. Supervised by SRI HENDRASTUTI HIDAYAT, IKA MARISKA, SRIANI SUJIPRIHATI
Chilli veinal mottle potyvirus (ChiVMV) is one of important viruses infecting chilli pepper plant. It was reported that ChiVMV infection may cause 50% to 100% yield losses. The virus has a very wide host range and strain diversity. The aim of this research are to characterize biological variation of ChiVMV and to obtain plant resistance source via somaclonal variation through induced mutation. Six isolates of ChiVMV was collected from different geographical region of chilli pepper production area. Based on their infection on 10 genotypes of chilli pepper, it was indicated that they have differences in virulence level and symptom type. Isolate collected from Cikabayan, Bogor, Jawa Barat (ChiVMV CKB) was able to infect all 10 genotypes with severe symptoms showing mottle, vein banding, leaf cramping and malformation. Analysis of coat protein gene indicated that ChiVMV isolates collected in this study can be differentiated into 3 groups although they have close relationship with other strains of ChiVMV published earlier in GeneBank. However, further analysis of amino acid revealed that ChiVMV CKB has different motif of octapeptide compared to other strains. The most virulent strain, ChiVMV CKB, was used for evaluation of somaclonal plants produced by in vitro propagation combined with induced mutation using EMS. Twenty somaclonal plants showed resistant response to ChiVMV infection and potential to be used as genetic resources to develop resistant plant.
IFA MANZILA. Chilli Veinal Mottle Potyvirus (ChiVMV) Penyebab Penyakit Belang Pada Cabai (Capsicum annum L.): Keragaman Isolat dan Strategi Pengendaliannya Melalui Induksi Variasi Somaklonal. Dibimbing oleh SRI HENDRASTUTI HIDAYAT, IKA MARISKA, SRIANI SUJIPRIHATI.
Chilli veinal mottle potyvirus adalah salah satu virus utama yang menyerang tanaman cabai. Walaupun keberadaannya di Indonesia tergolong baru, namun penyebarannya dapat ditemukan hampir disetiap pertanaman cabai. Infeksi ChiVMV dapat mengakibatkan penurunan hasil 50% hingga 100%. Untuk mengatasi terjadinya ledakan penyakit, menggunakan varietas yang tahan terhadap virus merupakan salah satu alternatif. Namun sampai saat ini belum diperoleh varietas cabai tahan ChiVMV. Bila sumber gen ketahanan terhadap virus masih terbatas, maka salah satu upaya peningkatan sumber gen ketahanan tersebut dapat dilakukan melalui induksi keragaman somaklonal yang dikombinasi dengan induksi mutasi.
Penelitian dilakukan pada Juli 2007 sampai Desember 2009 dengan tujuan : 1) mendapatkan informasi mengenai keragaman isolat ChiVMV yang menginfeksi tanaman cabai (Capsicum annuum) pada sentra produksi cabai di Indonesia berdasarkan variasi biologi dan molekuler, 2) mendapatkan informasi tingkat virulensi ChiVMV dan respon beberapa galur cabai terhadap infeksi ChiVMV, 3) mendapatkan varian somaklonal tanaman cabai melalui induksi dengan ethyl methane sulfonate (EMS), 4) mendapatkan tanaman varian somaklonal tanaman cabai yang tahan terhadap ChiVMV. Penelitian di lakukan di laboratorium Biologi Sel dan Jaringan Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian, Cimanggu Bogor dan Laboratorium Virologi Tumbuhan serta rumah kaca Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor.
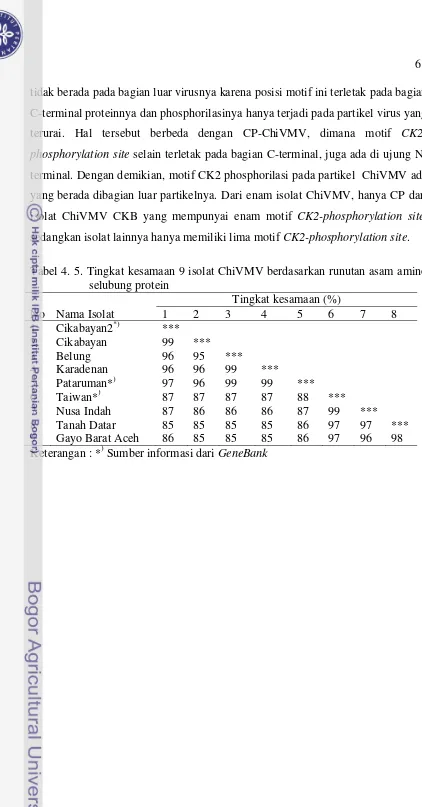
ChiVMV Tanah Datar (TD), ChiVMV Nusa Indah (NI), ChiVMV Gayo Barat (GB), dan ChiVMV Taiwan (GeneBank DQ854948). Ketiga kelompok tersebut memiliki jarak genetik terdekat berturut-turut yaitu (0,05 sampai 0,06), (0,05) dan (0,02 sampai 0,48). Hasil penelitian ini menunjukkan bahwa perbedaan gejala yang tidak terlalu nyata diantara isolat-isolat ChiVMV berhubungan dengan tingkat variabilitas gen selubung protein yang rendah. Berdasarkan analisis asam amino isolat ChiVMV CKB memiliki susunan asam amino yang sangat berbeda dengan isolat ChiVMV lainnya. Asam amino pada isolat ChiVMV CKB, motif octapeptide-nya telah termutasi secara total menjadi motif EMETEVPQ; sedangkan pada CP ChiVMV BL dan KR hanya termutasi menjadi TQEEDTER. Apakah mutasi motif octapeptide pada CP ChiVMV CKB menyebabkan isolat ChiVMV CKB menjadi virulen, masih perlu dikaji secara mendalam.
Tanaman yang berhasil diaklimatisasi dan dapat bertahan hidup adalah tanaman mutan somaklon dari genotipe Gelora. Tanaman mutan somaklon tersebut mampu menghasilkan buah dan benih cabai. Penampilan tanaman mutan somaklon tidak jauh berbeda dengan tanaman normal. Walaupun demikian kedua tanaman mutan somaklon cenderung memiliki tinggi tanaman dan tinggi cabang yang lebih rendah dibandingkan tanaman normal.
Evaluasi ketahanan untuk tanaman mutan somaklon dilakukan berturut-turut terhadap 245 dan 243 benih mutan somaklonl 1 (M1.1) dan mutan somaklon 2 (M1.2) yang dipilih secara acak. Setelah inokulasi ChiVMV, jumlah tanaman bergejala pada populasi M1.1 adalah 229 tanaman, sedangkan pada populasi M1.2 adalah 223 tanaman. Persentase tanaman terinfeksi dari kedua populasi mutan somaklon tersebut berturut turut adalah 95,5% dan 91,7%, sedangkan tanaman yang tidak memperlihatkan gejala atau toleran berturut-turut adalah 6,5% dan 8,23%. Konfirmasi melalui deteksi DAS-ELISA menunjukkan bahwa jumlah tanaman terinfeksi pada masing-masing tanaman mutan somaklon lebih tinggi dibandingkan hasil pengamatan berdasarkan gejala. Hasil deteksi dengan ELISA memastikan bahwa 20 dari total 488 tanaman cabai uji berasal dari 2 mutan somaklon tidak terinfeksi ChiVMV. Hasil tersebut menunjukkan adanya fenomena gejala lemah atau gejala laten. Dengan demikian ke 20 tanaman tersebut digolongkan tahan ChiVMV dan dapat digunakan sebagai sumber gen ketahanan didalam meningkatkan perluasan varietas melalui perakitan tanaman yang memiliki sifat unggul lainnya.
Kata kunci: Capsicum annuum, Chilli veinal mottle potyvirus, induksi mutasi, keragaman biologi, keragaman molekuler.
© Hak cipta milik Institut Pertanian Bogor, tahun 2011
Hak cipta dilindungi Undang Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
annuum L.): KERAGAMAN ISOLAT DAN STRATEGI
PENGENDALIANNYA MELALUI INDUKSI
VARIASI SOMAKLONAL
IFA MANZILA
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor
pada
Program Studi Entomologi-Fitopatologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji Luar Komisi pada Ujian Tertutup: Dr Ir Endang Nurhayati, MS Dr Ir Dewi Sukma, MSi
Penyakit Belang pada Cabai (Capsicum annuum L.): Keragaman Isolat dan Strategi Pengendaliannya Melalui Induksi Variasi Somaklonal
Nama Mahasiswa : IFA MANZILA
NIM : A461060091
Disetujui
Komisi Pembimbing
Dr Ir Sri Hendrastuti Hidayat, MSc Prof Dr Ir Sriani Sujiprihati, MS Ketua Anggota
Dr Ir Ika Mariska, MSc, APU Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Entomologi-Fitopatologi
Dr Ir Sri Hendrastuti Hidayat, MSc Dr Ir Dahrul Syah, MSc Agr
Puji dan syukur penulis panjatkan kehadirat Allah SWT. Karena berkat dan rahmat-Nya sehingga disertasi yang berjudul ”Chilli Veinal Mottle Potyvirus (ChiVMV) Penyebab Penyakit Belang pada Cabai (Capsicum annum L.):
Keragaman Isolat dan Strategi Pengendaliannya melalui Induksi Variasi
Somaklonal” dapat terselesaikan.
Penulis menyampaikan rasa terima kasih yang tak terhingga kepada Dr Ir Sri Hendrastuti Hidayat MSc selaku Ketua komisi pembimbing, Prof Dr Ir Sriani Sujiprihati MS, dan Dr Ir Ika Mariska MSc, APU selaku anggota komisi pembimbing, atas segala kesabaran dan bimbingan, kritik, saran , serta dukungan moril yang sangat besar peranannya dalam terselesaikannya disertasi ini.
Penulis juga mengucapkan terima kasih kepada Kepala Badan Litbang Pertanian, Ketua Komisi Pembinaan Tenaga Badan Litbang Pertanian, Kepala Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian(BB-BIOGEN), yang telah menugaskan dan memberi kesempatan kepada penulis untuk melanjutkan pendidikan, serta pimpinan dan staf bendahara Badan Litbang Pertanian yang telah membantu mempermudah penyaluran dana pendidikan penulis.
Kepada Ketua Kelompok Peneliti Biokimia BB-BIOGEN, yang telah memberi ijin dan kesempatan kepada penulis untuk melanjutkan pendidikan. Kepada Kepala Program Penelitian Badan Litbang Pertanian dalam proyek Kerjasama Kemitraan Penelitian Pertanian dengan Perguruan Tinggi (KKP3T) penulis mengucapkan terima kasih atas bantuan dana penelitian yang berjudul
INDUKSI VARIASI SOMAKLONAL UNTUK MENDAPATKAN GALUR
CABAI (Capsicum annuum L.) TAHAN CHILLI VEINAL MOTTLE
POTYVIRUS.
Kepada Dr Ir Endang Nurhayati MSc dan Dr Ir Dewi Sukma MSi yang telah berkenan untuk menjadi penguji pada ujian sidang tertutup penulis mengucapkan terima kasih.
Kepada Ketua Program Studi Entomologi-Fitopatologi dan semua staf dosen IPB penulis mengucapkan terima kasih atas ilmu yang telah diberikan,
Penulis juga menyampaikan rasa terima kasih dan penghargaan kepada teman-teman Laboratorium Virologi, Tuti Susanti Legiastuti, Dr I Gede Rai Maya Temaja, Dr Jumsu Trisno, Irwan Lakani MSi, Rika MSi, Rita Noveriza MSc, Sri Budi Utami Sp, Devi Agustina MSi, Fitrianingrum Sp, Wawan MSi, Endang Opriana MSi, Latifah MSi, Mila MSi, Putri Sp, Damayanti Sp, Ani Rahmini MSi, Adik-adik mahasiswa S1, Pak Emput. Ucapan terima kasih juga penulis sampaikan kepada teman-teman PS Entomologi-Fitopatologi terutama kepada Dr Yusmani; Dr N Usyati, Dr Rita Harni, Dr. Iwa Munara, Samsudin MSi, Efi Taufik MSi.
Ucapan terima kasih penulis sampaikan kepada Dr Tri Puji Prayitno MSc, Dr I Made Samudera, Dr Chairani, Yadi Suryadi MSc, Alina Ahdiyah MSi.
Secara khusus penulis menyampaikan penghargaan dan terima kasih kepada yang tercinta, Ayahanda Abdul Aziz (Alm), Ibunda H. Siti Zubaidah, dan semua kakak, adik-adik, keponakan atas segala pengertian, dorongan, dan doa yang tiada henti sehingga penulis dapat menyelesaikan pendidikan. Ungkapan terima kasih juga disampaikan kepada ananda tersayang Muhamad Alif Nadhirahman dan Daniella Ridha Artanti atas segala dorongan semangat, pengertian, kasih sayang, motivasi dan inspirasi selama penulis menempuh studi.
Akhirnya penulis berharap mudah-mudahan tulisan ini dapat bermanfaat bagi kita semua.
Bogor, 12 April 2011
Penulis dilahirkan di Jakarta pada tanggal 02 Januari 1965 dari pasangan Bapak Abdul Aziz (Alm) dan ibu Hj. Siti Zubaidah. Penulis merupakan putri ke empat dari delapan bersaudara.
Tahun 1983 penulis lulus dari SMA Negeri 38 Jakarta dan pada tahun yang sama masuk Universitas Nasional Jakarta Jurusan Biologi. Tahun 1987 penulis mendapat gelar Sarjana Biologi. Di tahun yang sama penulis diterima bekerja di Pusat Pengembangan Agribisnis (Konsultan). Sejak tahun 1993, penulis bekerja sebagai staf peneliti pada Kelti Fitopatologi yang sekarang berganti nama menjadi Kelti Biokimia, Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian, Jl. Tentara Pelajar 3A Bogor, Jawa Barat. Tahun 1996 penulis mendapat kesempatan untuk melanjutkan studi Program Magister Sains di Program Pascasarjana IPB dengan beasiswa dari BB-BIOGEN. Tahun 1999 penulis lulus dan mendapat gelar Magister Sains (M.Si). Di tahun yang sama penulis menikah dan dikaruniai dua orang anak putra dan putri, Muhamad Alif Nadhirahman Nugroho (10 tahun) dan Daniella Ridha Artanti Nugroho (8 tahun). Tahun 2006 penulis diterima sebagai mahasiswa Program Doktor (S3) pada program studi Entomologi dan Fitopatologi Sekolah Pascasarjana IPB dengan beasiswa dari Badan Penelitian dan Pengembangan Pertanian, Departemen Pertanian.
Halaman
Diagram alur ruang lingkup penelitian ………... 6
Daftar Pustaka ... 7
II. TINJAUAN PUSTAKA ………. 9
Karakter Molekuler Chilli Veinal Mottle Potyvirus ... Hama dan Penyakit Tanaman Cabai ... Gejala infeksi ChiVMV pada tanaman cabai ... 9 12 13 Kisaran Inang dan Mekanisme Penularan ChiVMV ... 14
Deteksi dan Karakterisasi Virus ... 14
Ketahanan Tanaman terhadap ChiVMV ... 16
Pembentukan Variasi Somaklonal ... 18
Penyebab Variasi Somaklonal ... 21
Mutasi Secara Fisik dan Kimia ... 21
Variasi Somaklonal untuk mendapatkan Resistensi terhadap Penyakit... Pemanfaatan dan Penerapan Variasi Somaklonal... 24 25 Daftar Pustaka ... 26
Hasil ... 38
Pembahasan ... 44
Simpulan dan Saran... 46
Daftar Pustaka ... 47
IV.
ANALISIS GEN SELUBUNG PROTEIN
Chilli Veinal
Mottle Potyvirus
DARI BEBERAPA DAERAH DI
INDONESIA
49 Abstrak ... 49Abstract ... 50
Pendahuluan ... 51
Bahan dan Metode ... 52
Hasil ... 56
Pembahasan ... 65
Simpulan dan Saran... 69
Daftar Pustaka …... 70
V. INDUKSI KALUS DAN REGENERASI TUNAS DAN AKAR CABAI (Capsicum annuum L.) MELALUI KULTUR IN VITRO... 74 Abstrak ... 74
Abstract ... 75
Pendahuluan ... 76
Bahan dan Metode ... 77
Hasil ... 80
Pembahasan ... 80
Simpulan dan Saran... 88
VI. PENGARUH PERLAKUAN Ethyl Methane Sulfonate PADA TANAMAN CABAI (Capsicum annuum L.) DAN KETAHANANNYA TERHADAP Chilli veinal mottle potyvirus (ChiVMV)
91
Abstrak ... 91
Abstract ... 92
Pendahuluan ... 93
Bahan dan Metode ... 94
Hasil ... 97
Pembahasan ... 97
Simpulan dan Saran... 106
Daftar Pustaka ... 106
VII. PEMBAHASAN UMUM ... Daftar Pustaka ……….
109 113
VIII. SIMPULAN DAN SARAN UMUM...
115
DAFTAR TABEL
Halaman
2.1 Fungsi beberapa protein yang terdapat dalam struktur genom Potyvirus ...
10
3.1
3.2
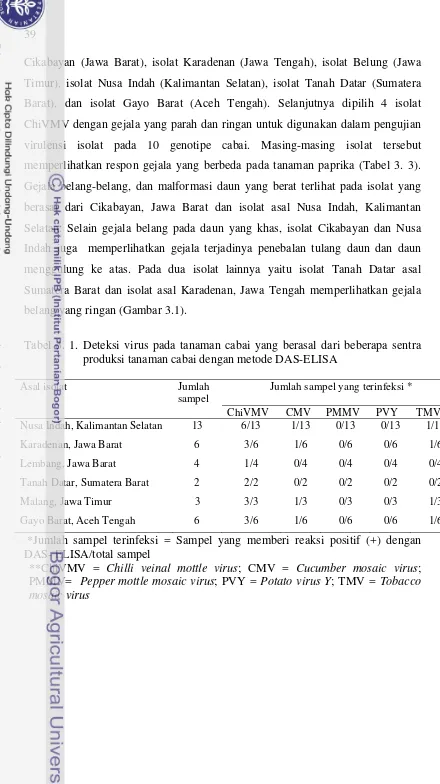
Deteksi beberapa virus pada tanaman cabai yang berasal dari beberapa sentra produksi tanaman cabai dengan metode DAS-ELISA ... Deskripsi gejala tanaman yang terinfeksi ChiVMV secara tunggal dari beberapa lokasi penanaman cabai ...
39
40
3.3 Deskripsi isolat ChiVMV yang digunakan dalam pengujian virulensi ...
40
3.4 Hasil inokulasi ChiVMV isolat Cikabayan pada 10 genotipe cabai ……….
42
3.5 Hasil inokulasi ChiVMV isolat Nusa Indah pada 10 genotipe cabai ………
42
3.6 Hasil inokulasi ChiVMV isolat Tanah Datar pada 10 genotipe cabai ………..……….
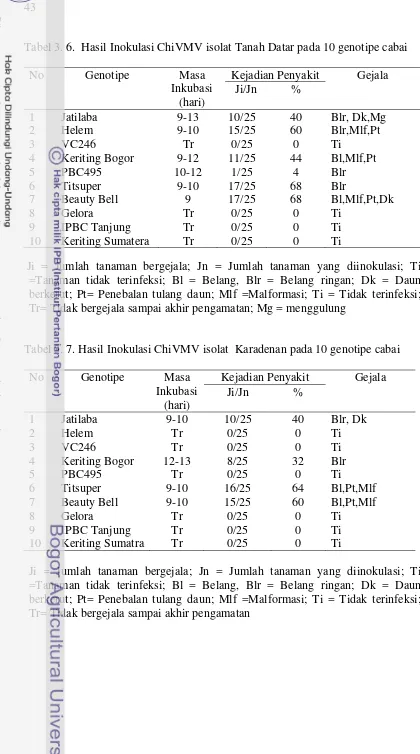
43
3.7 Hasil inokulasi ChiVMV isolat Karadenan pada 10 genotipe cabai ……….
43
4.1 Isolat-isolat Chilli veinal mottle potyvirus asal Indonesia dan beberapa virus asal Asia (GeneBank) yang digunakan dalam analisis CP- ChiVMV………..………...
55
4.2
4.3
Deskripsi gejala isolat-isolat ChiVMV yang berasal dari Karadenan (KR), Cikabayan (CKB), Tanah Datar (TD), Nusa Indah (NI), Belung (BL) dan Gayo Barat (GB) ...
Ukuran panjang gen CP beberapa isolat ChiVMV ...
56
58
4.4 Tingkat kesamaan isolat ChiVMV yang berasal dari beberapa daerah di Indonesia berdasarkan runutan nukleotida gen Coat protein ...
58
4.5 Tingkat kesamaan 9 isolat ChiVMV berdasarkan runutan asam amino seelubung protein ...
4.6 Motif CK2I-phospholylation site pada CP ChiVMV berdasarkan analysis menggunakan MyHits ExPASy...
64
5.1 Pembentukan kalus dari eksplan daun muda cabai genotype Gelora, Sudra, dan Chili 109 pada media MSdengan tiga taraf konsentrasi BAP ………..….……….……….
81
5.2 Pembentukan kalus dari eksplan hipokotil cabai genotipe Gelora,Sudra, dan Chili 109 pada media MS dengan tiga taraf
konsentrasi BAP ………..…….………
82
5.3 Pembentukan kalus dari eksplan ujung akar cabai genotipe Gelora, Sudra, dan Chili 109 pada media MS dengan tiga taraf konsentrasi BAP…..…….. ……….………..……….
83
5.4 Pembentukan kalus embriogenik dari kalus cabai cv Gelora, Sudra dan Chili 109 yang ditanam pada media induksi kalus embriogenik dengan tiga taraf konsentrasi 2,4D ………
84
5.5 Waktu inisiasi tunas, jumlah tunas, tinggi tunas, serta jumlah daun yang terbentuk pada kalus yang berasal dari eksplan daun muda cabai genotipe Gelora, Sudra, dan Chili 109 yang ditanam pada tiga media regenerasi yang mengandung tiga taraf konsentrasi BAP ………..………
86
5.6
6.1
Respon pembentukan akar pada tunas yang berasal dari eksplan daun muda cabai genotipe Gelora dan Chili 109 terhadap dua taraf konsentrasi NAA yang berbeda …..……….. Pengelompokan tipe ketahanan tanaman berdasarkan reaksi terhadap infeksi ChiVMV...
87
97
6.2 Pengaruh konsentrasi EMS dan waktu perendaman terhadap kematian jaringan eksplan cabai ………
99
6.3 Waktu inisiasi tunas, jumlah tunas, tinggi tunas, dan jumlah daun yang terbentuk pada eksplan tunas terminal Jatilaba, PBC495 dan Gelora yang ditanam pada media MS +.BAP 5 mg l-1 + TDZ 0,5
mg l-1*) ………..
101
6.4 Karakter varian morfologi pada tanaman mutan somaklon (M1.1 dan M1.2) hasil induksi mutasi dengan EMS 0,5% dan waktu perendaman 60 menit ...
101
6.5 Karakter buah yang dihasilkan oleh tanaman mutan somaklonal hasil induksi mutasi dengan EMS 0,5% dan waktu perendaman 60 menit ...
6.7 Penapisan dan evaluasi respon mutan somaklon cabai hasil kombinasi induksi mutasi dengan EMS dan ketahananya terhadap ChiVMV ………...
DAFTAR GAMBAR
Halaman
1. 1
2. 1
Diagram alur penelitian ”Chilli Veinal Mottle Potyvirus (ChiVMV) Penyebab Penyakit Belang Pada Cabai (Capsicum annum): Keragaman Isolat dan Strategi Pengendaliannya Melalui Induksi Variasi Somaklonal” ………..
Organisasi genom potyvirus...
6
10
3. 1 Variasi gejala infeksi beberapa isolat ChiVMV pada Tanaman cabai paprika genotipe Beauty Bell ...
41
4. 1 Berbagai tipe belang pada permukaan daun tanaman cabai paprika genotipe Beauty Bell yang terinfeksi ChiVMV ...
56
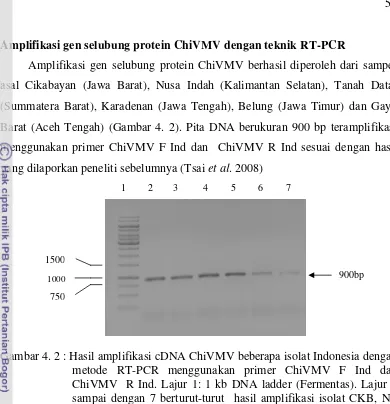
4. 2 Hasil amplifikasi cDNA ChiVMV isolat Indonesia dengan metode RT-PCR menggunakan primer ChiVMV F Ind dan ChiVMV R Ind ...
57
4. 3 Analisis filogenetika 12 isolat ChiVMV yang berasal dari beberapa daerah yang berbeda di Indonesia dan Asia (GeneBank) ...
59
4. 4 Analisis homologi asam amino CP-ChiVMV yang berasal dari Cikabayan, Jawa Barat (ChiVMV CKB), Karadenan, Jawa Tengah (ChiVMV KR), Belung, Jawa Timur (ChiVMV BL), Nusa Indah, Kalimantan Selatan(ChiVMV NI), Tanah Datar, Sumatra Barat (ChiVMV TD) dan Gayo Barat, Aceh Tengah (ChiVMV GB). ………..
62
4. 5 Motif protein yang terdapat pada CP-ChiVMV berdasarkan analisis MYHits ExPASy………...
63
4. 6 Analisis filogenetika asam amino CP-ChiVMV yang berasal dari Jawa Barat (Cikabayan), Jawa Tengah (Karadenan), Jawa Timur (Belung), Kalimantan Selatan (Nusa Indah), Sumatra Barat (Tanah Datar), Aceh Tengah (Gayo Barat) terhadap isolat Indonesia dan Asia yang ada pada GeneBank (Cikabayan2, Pataruman dan Taiwan)...
65
5. 1 Pertumbuhan kalus dari eksplan daun muda cabai genotipe Gelora pada media MS+2,4- D +Thidiazuron 0,1mg/l …..……...
5. 2 Perkembangan kultur cabai varietas Gelora mulai dari eksplan hingga pembentukan tunas………..
87 a
6. 1 A: Kecambah cabai merah berumur 21 hari yang dipakai sebagai sumber eksplan dari genotipe gelora, B: Ujung tunas terminal ………..
95
6. 2 Respon eksplan genotipe cabai‘Gelora‘terhadap perlakuan berbagai konsentrasi EMS dengan waktu perendaman 60 menit A) 0.25%, B) 0.5%, C) 1% ...
98
6. 3 Aklimatisasi planlet cabai setelah perlakuan EMS 0,5% dengan perendaman selama 60 menit...
102
6. 4 Tanaman mutan somaklon genotipe Gelora…………...……… 103
6. 5 Buah cabai yang dipanen dari tanaman mutan somaklon …….... 104
6. 6 Penapisan dan evaluasi tanaman mutan somaklonal cabai terhadap infeksi ChiVMV ………..…..………..
105
DAFTAR LAMPIRAN
Halaman
1 Perunutan DNA yang berasal dari 12 isolat ChiVMV Indonesia dan Asia (Gene Bank) menunjukkan nukleotida yang identik ………..
Latar Belakang
Tanaman cabai (Capsicum annun L.) merupakan salah satu komoditas andalan hortikultura di Indonesia. Menurut data Direktorat Jenderal Bina Produksi Hortikultura (2009) luas panen cabai merupakan luas panen terbesar diantara tanaman sayuran lainnya yaitu 103.837 ha. Tanaman tersebut ditanam di seluruh provinsi di Indonesia dan memiliki nilai ekonomis yang cukup baik sehingga mendapat prioritas untuk dikembangkan.
Produksi cabai di Indonesia masih sangat rendah yaitu 6,72 ton/ha apabila dibandingkan dengan potensi produksi yang dapat mencapai 12,99 ton/ha. Produksi nasional cabai dari tahun 2003 sampai tahun 2009 mengalami penurunan yaitu berturut-turut 774.408 dan 668.970 ton (Direktorat Jendral Hortikultura 2009). Padahal permintaan cabai nasional terus meningkat dari waktu ke waktu sejalan dengan meningkatnya rata-rata konsumsi cabai dan meningkatnya jumlah penduduk.
Beberapa faktor penyebab turunnya produksi cabai secara nasional adalah berkurangnya luas panen, belum tepatnya cara bercocok tanam, belum berimbangnya pemupukan dan sukarnya mendapatkan benih yang bermutu dan murah. Selain faktor-faktor di atas, rendahnya produksi cabai nasional juga diakibatkan oleh adanya gangguan hama dan penyakit (Duriat et al. 1996). Direktorat Perlindungan Tanaman Hortikultura (2009) mencatat beberapa penyakit penting pada tanaman cabai diantaranya adalah antraknosa, bercak daun Cercospora, bercak Phytophthora, layu Fusarium, layu bakteri dan penyakit yang disebabkan oleh infeksi virus. Hasil beberapa laporan penelitian menunjukkan bahwa virus utama yang menyerang tanaman cabai dan hampir ditemukan di setiap pertanaman cabai adalah Geminivirus, Cucumber mosaic virus (CMV) dan Chilli veinal mottle virus (ChiVMV) (Sulandari et al. 2006, Taufik et al. 2005, Trisno et al. 2009)
Dilaporkan oleh AVRDC (2003) bahwa kehilangan hasil akibat infeksi ChiVMV bisa mencapai 100%. Hasil survei yang dilakukan Taufik et al. (2005) memperkuat bukti penyebaran ChiVMV yang sangat luas di Indonesia. Infeksi virus tersebut dapat ditemukan pada setiap pertanaman cabai yang diamati di Jawa Barat, Jawa Tengah, dan Sulawesi Selatan walaupun kejadian penyakit berbeda-beda untuk setiap tempat.
Tanaman cabai yang terinfeksi, pada daunnya akan memperlihatkan gejala belang-belang hijau gelap, dan kadang-kadang pola-pola tersebut menyatu ke tulang daun di dekatnya, leaf cupping, epinasti dan nekrosis. Gejala yang disebabkan oleh ChiVMV bervariasi tergantung pada inang, strain virus, waktu infeksi dan kondisi lingkungan. (CABI 2005). Infeksi yang terjadi pada fase pertumbuhan awal mengurangi ukuran daun yang diikuti dengan distorsi, serta produksi buah yang lebih sedikit dan lebih kecil (Shah dan Khalid 2001).
ChiVMV termasuk jenis virus yang sulit dikendalikan antara lain karena virus ini ditularkan oleh serangga vektor yaitu Aphid spp. secara non persisten. Penyebaran virus ini terjadi dalam waktu yang cepat dikarenakan oleh aktifitas serangga vektor. Disamping itu ChiVMV juga memiliki kisaran inang yang cukup luas. Selain menginfeksi Capsicum annuum, ChiVMV dilaporkan menginfeksi C. frutescens, Lycopersicon esculentum, Solanum melongena, Datura stramonium, Nicotiana spp, dan Chenopodium spp. (Green et al. 1999).
buah dan membahayakan, mencemari lingkungan serta membutuhkan biaya yang besar. Dengan demikian penggunaan varietas tahan merupakan pilihan yang tepat untuk mengendalikan virus karena metode ini relatif lebih aman dan murah bila dibandingkan dengan metode pengendalian yang lain (Dolores 1998) .
Beberapa pendekatan dalam melakukan perakitan varietas tahan virus dapat dilakukan diantaranya adalah pendekatan konvensional, rekayasa genetik dan melalui pemanfaatan kultur in vitro yang dikombinasi dengan induksi mutasi menggunakan mutagen kimia. Pendekatan konvensional untuk pengembangan varietas tahan virus memiliki beberapa keterbatasan, diantaranya adalah sumber gen ketahanan terhadap virus masih belum ditemukan pada koleksi plasma nutfah cabai di Indonesia. Selain itu, kultivar tahan yang dihasilkan melalui pemuliaan konvensional seringkali mudah terpatahkan karena perubahan genetik dari virus yang cepat akibat adanya rekombinasi dan adanya variasi genetik yang tinggi dari virus. Kultivar tahan yang dihasilkan mungkin hanya spesifik untuk strain atau isolat tertentu. Bila sumber gen ketahanan terhadap virus sangat terbatas, maka diperlukan pendekatan lain seperti pemanfaatan teknik kultur in vitro untuk mendapatkan varian somaklonal. Teknik ini banyak dilakukan karena selain dapat menghasilkan tanaman dalam jumlah yang banyak, juga dapat menghasilkan keragaman somaklonal. Keragaman somaklonal dapat dilakukan melalui beberapa perlakuan, diantaranya melalui perlakuan zat pengatur tumbuh (ZPT), subkultur berulang dengan periode kultur in vitro yang panjang (Ahloowalia 2004). Keragaman genetik melalui kultur in vitro dapat ditingkatkan apabila dikombinasikan dengan perlakuan mutagen fisik dan kimiawi (Girija dan Dhanavel 2009). Pemanfaatan teknik tersebut adalah upaya untuk meningkatkan keragaman genetik tanaman dan memperoleh gen baru yang lebih luas (Mattjik 2005). Sifat ketahanan tanaman terhadap beberapa cekaman biotik seperti misalnya cendawan, virus dan bakteri telah dapat diperbaiki dengan pendekatan ini.
suatu strain virus yang menginfeksi tanaman cabai perlu diketahui sehingga dapat diambil langkah-langkah pengendaliannya. Isolat-isolat ChiVMV di India, Vietnam, Taiwan, dan China telah berhasil diidentifikasi secara molekuler. Di Indonesia, keragaman genetik ChiVMV berdasarkan perunutan basa DNA belum banyak dilaporkan. Usaha identifikasi melalui teknik hibridisasi asam nukleat dan PCR telah dirintis oleh beberapa peneliti (Taufik 2006; Opriana 2009). Namun demikian, informasi yang lebih mendalam mengenai urutan DNA dari ChiVMV yang ada di Indonesia untuk menunjukkan adanya keragaman genetik diantara ChiVMV belum pernah dilakukan.
Dalam rangka pengembangan genotipe cabai yang tahan terhadap ChiVMV telah dilakukan penelitian berjudul “ Chilli Veinal Mottle Potyvirus (ChiVMV) Penyebab Penyakit Belang Pada Cabai (Capsicum annum): Keragaman Isolat dan Strategi Pengendaliannya Melalui Induksi Variasi Somaklonal” melalui tahapan survey ChiVMV, isolasi dan karakterisasi strain ChiVMV, induksi mutasi, dan evaluasi ketahan tanaman mutan somaklon (Gambar 1.1)
Tujuan Penelitian
1. Memperoleh informasi tentang sebaran ChiVMV pada pertanaman cabai di beberapa sentra produksi di Indonesia melalui survey dan deteksi menggunakan metode Double antibody sandwich – Enzyme linked immunosorbend assay (DAS-ELISA) dan Polymerase chain reaction (PCR). 2. Mendapatkan informasi tentang tingkat virulensi isolat-isolat ChiVMV
terhadap 10 genotipe cabai.
3. Mengetahui keragaman gen selubung protein beberapa isolat-isolat ChiVMV Indonesia.
Hipotesis
1. ChiVMV telah menyebar di beberapa sentra produksi cabai di Indonesia diantaranya di Jawa Barat, Jawa Tengah, Jawa Timur, Kalimantan Selatan, Sumatera Barat, Aceh Tengah.
2. Isolat-isolat ChiVMV memiliki tingkat virulensi yang berbeda terhadap 10 genotipe cabai tanaman uji.
3. Strain-strain ChiVMV di Indonesia memiliki keragaman pada gen selubung proteinnya
4. Teknik kultur in vitro dapat meningkatkan keragaman somaklonal tanaman
5. Variasi somaklonal yang dikombinasikan dengan mutagen kimia ethyl methane sulphonate pada tunas terminal dapat menghasilkan genotipe baru dengan karakter agronomis dan sifat ketahanan terhadap ChiVMV yang berbeda.
Gambar 1. 1. Diagram alur penelitian“ Chilli Veinal Mottle Potyvirus (ChiVMV) Penyebab Penyakit Belang Pada Cabai (Capsicum annum):
Keragaman Isolat dan Strategi Pengendaliannya Melalui Induksi Variasi Somaklonal”
Mutan somaklon yang tahan ChiVMV
Evaluasi tanaman mutan somaklon untuk karakter Agronomis (M0) Optimasi dan evaluasi berbagai konsentrasi dan lama perendaman mutagen EMS pada beberapa eksplan genotipe cabai
Uji Virulensi isolat ChiVMV terhadap 10 genotipe cabai
Regenerasi planlet dari tunas ganda yang telah diperlakukan mutagen EMS
Evaluasi Tanaman M1 terhadap infeksi strain ChiVMV yang paling virulen
Survei sebaran ChiVMV di beberapa sentra produksi cabai di Jawa, Sumbar, Kalsel, Aceh Tengah
Studi regenerasi kalus dan tunas terminal membentuk tunas adventif dan tunas ganda dalam media kultur in vitro
DAFTAR PUSTAKA
Ahloowalia BS, Prakash J, Savangikar VA, Savangikar C. 2004. Plant tissue culture. International Atomic Energy Agency. Austria. P. 3-10
AVRDC. 2003. AVRDC Progress Report 2002. Shanhua, Tainan, Taiwan. Hlm 182
[CABI] Centre in Agricultural and Biological Institute. 2005. Chilli veinal mottle virus. Crop Protection Compendium [CD-ROM]. London: CABI Publish. [DBPH] Direktorat Bina Program Tanaman Pangan dan Hortikultura RI. 2009.
Luas panen, rata-rata hasil dan produksi tanaman hortikultura di Indonesia. Departemen Pertanian. Jakarta
[Ditlinhorti] Direktorat Perlindungan Tanaman Hortikultura 2009. Luas Pertanaman Cabai Merah. (http:www.deptan.go.id/ditlinhorti/da-its-2009 (5 Maret 2010)
[Ditjen Hort] Direktorat Jendral Hortikultura. 2009. Perkembangan luas panen sayuran tahun 2003-2009. http://www.deptan.go.id [25 Desember 2010]. Dolores LM. 1996. Management of pepper viruses. Proceeding of the AVNET II
Final Workshop Philippines 21-25 Februari 1995. AVRDC.
Duriat AS. 1996. Cabai merah: Komoditas Prospektif dan Andalan. Di dalam: Duriat AS, Widjaja W. Hadisoeganda A, Soetiarso TA dan Prabaningrum L, editor. TeknologiProduksi Cabai Merah. Pusat Penelitian dan Pengembangan Hortikultura, Badan Penelitian dan Pengembangan Pertanian. Hlm 1-3
Girija M, Dhanavel D. 2009. Mutagenic effectiveness and efficiency of gamma rays Ethyl Methane Sulfonate and their combined treatments in Cowpea (Vigna ungiculata L. Walp). Glob J of Mol Scien 4(2):68-75.
Green SK, Hiskias Y, Lesemann DE, Vetten HJ, 1999. Characterization of chilli veinal mottle virus as a potyvirus distinct from pepper veinal mottle virus. Petria 9(3):332.
Mattjik NA. 2005. Peran Kultur Jaringan dalam Perbaikan Tanaman, Fakultas Pertanian, IPB. Bogor. Hlm 102.
Ong CA. 1995. Symptomatic variants of CVMV in Malaysia. Proceeding of the AVNET II Midterm Workshop Philippines 21-25 Februari 1995. AVRDC. Shah H, Khalid S. 2001. Sceening of exotic Pepper Lines Against Local Isolate
Sulandari S, Suseno R, Hidayat SH, Harjosudarmo J, Sosromarsono S. 2006. Deteksi dan kajian kisaran inang virus penyebab penyakit daun keriting kuning cabai. Hayati 13:1-6
Taufik M, Astuti AP, Hidayat SH. 2005. Survey infeksi Cucumber mosaic virus dan Chilli veinal mottle virus pada tanaman cabai dan seleksi ketahanan beberapa kultivar cabai. J. Agrikultura 16:146-152.
Karakter Molekuler Chilli Veinal Mottle Potyvirus
Chilli veinal mottle potyvirus (ChiVMV) adalah salah satu virus penyebab penyakit pada tanaman cabai. Virus tersebut pertamakali diisolasi oleh Burnett pada tahun 1947 dari Capsicum annuum di Malaysia. Partikel virus berbentuk batang lentur dengan panjang sekitar 750 nm dan diameter kira-kira 12 nm (International Taxonomy on Committee of Viruses, 2002). ChiVMV termasuk dalam kelompok atau genus Potyvirus (famili Potyviridae) dengan genom berupa RNA utas tunggal berorientasi positif (+ ssRNA) berukuran 9711 nukleotida (nt) (Fauquet et al. 2005). Genus Potyvirus sendiri termasuk kelompok virus yang paling banyak menyerang tanaman, yaitu mencapai lebih dari 100 jenis virus ( Ong 1995).
Potyvirus memiliki selubung protein yang berfungsi untuk penularan melalui kutu daun, pergerakan virus dari sel ke sel dan pergerakan virus secara sistemik, pembentukan selubung virus, dan replikasi virus (Tabel 2. 1) (Urcuqui-Inchima et al. 2001). Menurut Moury et al. (2005), ChiVMV dapat dibedakan dari Pepper veinal mottle virus berdasarkan runutan asam amino selubung protein. Tingkat kesamaan runutan asam amino kedua jenis virus tersebut hanya mencapai 80%, sedangkan antara strain yang berbeda dalam spesies yang sama mempunyai tingkat kesamaan mencapai 83%-99% (Fauquet et al. 2005).
Tabel 2. 1. Fungsi beberapa protein yang terdapat dalam struktur genom Potyvirus*)
Protein Fungsi protein
P1 Proteinase; yang diduga berperan dalam perpindahan virus dari sel ke sel
Hc-Pro Sarana /media penularan virus dengan bantuan serangga kutu daun P3 Fungsi sebenarnya belum diketahui dengan pasti, tetapi
kemungkinannya berperan dalam replikasi virus
CI Replikasi genom
CP Selubung protein, yang berhubungan dengan penularan melalui serangga vektor, dan perpindahan virus dari sel ke sel.
NIa-VPg VPg (protein yang menempel pada ujung 5’RNA untuk permulaan sintesis RNA)
Nia-Pro Proteinase major
Nib Replikasi genom (RNA dependent RNA polymerase/RdRp)
6K1&6K2 Belum diketahui dengan pasti, kemungkinannya berhubungan dengan replikasi RNA; mengatur fungsi translokasi Nia nuclear *
Sumber : Uncuqui-Inchima et al. (2001)
Gambar 2. 1. Organisasi genom potyvirus (Shukla et al. 1994)
Ekspresi genom Potyvirus terjadi melalui translasi poliprotein dari genom virus. Poliprotein kemudian mengalami pemotongan dalam sitoplasma menjdi protein fungsional dan struktural sesuai dengan gen yang disandikannya. Pemotongan poliprotein dilakukan dengan protease yang terjadi selama dan sesudah translasi. Protease yang memotong poliprotein juga disandikan oleh gen yang terdapat dalam genom Potyvirus.
virion protein dalam jaringan vaskuler melalui interaksi dengan Hc-Pro pada domain C- dan N- terminalnya. Selain berperan di dalam perpindahan virus pada jaringan vaskuler, HC-Pro juga berfungsi menekan mekanisme pertahanan tanaman menggunakan antiviral yang disebut RNA silencing (pembungkaman RNA). Viral genome-linked protein (VPg) yang berada pada ujung 5’ genom virus adalah protein multifungsi yang berperan pada saat amplifikasi dan pergerakan virus. Protein ini merupakan bagian N-proximal dari protein inklusi inti (NIa) dan terpisah secara autokalatik dari domain C-proximal proteinase (NIa-Pro). VPg berikatan secara kovalen dengan ujung 5’ RNA virus melalui ikatan fosfodiester pada residu asam amino tirosin yang terletak di bagian N-proximal. Keberadaan VPg sangat diperlukan untuk proses infeksi virus. VPg juga berinteraksi dengan faktor inisiasi translasi (eIF(iso)4E) (Schaad et al. 2000), dan diperlukan untuk infeksi secara sistemik (Leornard et al. 2000) Dalam genom Potyvirus terdapat daerah yang tidak berubah (conserved) dan daerah yang bervariasi. Daerah yang conserved adalah daerah Hc-Pro dan Nib. Daerah yang bervariasi adalah P1, P3, dan CP. Protein P3 merupakan daerah yang conserved di antara strain (Eleman et al. 1997) .
selubung. Selanjutnya virus menyebar ke sel sekelilingnya melalui plasmodesmata.
Keragaman genetik pada genus Potyvirus telah banyak dilakukan berdasarkan gen-gen yang terlibat didalam pembentukan selubung protein dan daerah 3’UTR. Daerah tersebut diketahui merupakan daerah yang bervariasi diantara kelompok Potyvirus. Shukla dan Ward (1988) menggunakan runutan asam amino selubung protein (CP) untuk menilai hubungan kekerabatan berbagai virus dalam kelompok Potyvirus. Hasil kajian tersebut menunjukkan virus-virus yang berbeda mempunyai kesamaan runutan asam amino CP 38% hingga 71%, sedangkan untuk strain dari virus yang sama tingkat kesamaannya mencapai 90% sampai 99%.Demikian pula hasil analisis runutan nukleotida 3’UTR strain-strain Peanut stripe virus (PStV) menunjukkan bahwa strain virus tersebut mempunyai kesamaan antara 97,9% sampai 100% (Akin 2002). Penelitian mengenai keragaman pada tingkat molekuler berdasarkan runutan nukleotida sistron penyandi selubung protein dan 3’ UTR dilakukan pula oleh Tsai et al. (2008) pada ChiVMV, dimana tingkat kesamaan asam amino dan runutan nukleotida isolat ChiVMV di Asia termasuk Indonesia masing-masing berkisar 94,8% dan 89,5%.
Hama dan Penyakit Tanaman Cabai
tungau (Polyphagotarsonemus latus Banks). Direktorat Jendral Perlindungan Tanaman Hortikultura (2009) mencatat beberapa penyakit penting pada tanaman cabai diantaranya adalah antraknosa, bercak daun Cercospora, busuk Phytophthora, layu Fusarium, layu bakteri dan penyakit yang disebabkan oleh infeksi virus seperti Pepper veinal mottle virus(PMMV) , Genimivirus, Cucumber mosaic virus (CMV). Potato virus Y (PVY), Tobacco mosaic virus (TMV).
Gejala Infeksi ChiVMV pada Tanaman Cabai
Menurut Ong (1995) virus ini pertama kali dilaporkan oleh Burnett pada tahun 1947 pada Capsium annum di Malaysia. Selanjutnya virus ini telah menyebabkan penyakit dibanyak negara Asia dimana cabai ditanam secara komersial. Di Indonesia, keberadaan ChiVMV telah dilaporkan oleh Duriat et al. (1989). Gejala yang timbul karena infeksi ChiVMV pada tanaman cabai sangat bervariasi, tergantung pada strain virus, umur tanaman pada waktu terinfeksi, dan lingkungan. Umumnya gejala yang ditimbulkan pada tanaman cabai sangat nyata terlihat pada daun. Daun yang terinfeksi oleh ChiVMV menampakkan gejala belang-belang hijau gelap, bercak-bercak hijau gelap, kadang-kadang pola-pola tersebut menyatu ke tulang daun di dekatnya, leaf cupping, epinasti dan nekrosis (Ong 1995; Sulyo et al. 1995; Chiemsombat dan Kittipakorn 1996).
Kisaran Inang dan Mekanisme Penularan ChiVMV
Beberapa penulis melaporkan tanaman yang dapat menjadi inang bagi ChiVMV diantaranya adalah Nicotiana tabacum, N. benthamiana, Physalis minima, P. floridana, C. annum, C. frutescens, N. glutinosa. Nicandra physalodes, Solanum melongena dan S. aethiopicum (Womdim et al. 2001).
ChiVMV dapat ditularkan melalui inokulasi mekanis, penyambungan dan serangga vektor seperti A.craccivora, A. gossypii, A. spiraecola, M. persicae, Toxoptera citricidus, Hystreroneura setariae dan R. maydis secara non persisten, tetapi tidak dapat ditularkan melalui biji (Ong et al. 1979). Infeksi ChiVMV pada tanaman cabai terjadi secara sistemik pada seluruh fase pertumbuhan tanaman.
Deteksi dan Karakterisasi ChiVMV
Teknik serologi dengan metode ELISA untuk mendeteksi keberadaan ChiVMV telah banyak digunakan. Hasil deteksi dengan metode tersebut menunjukkan bahwa teknik DAS-ELISA cukup sensitif yaitu mampu mendeteksi ChiVMV sampai pengenceran 1:1000 (Opriana, 2009).
Teknik RT-PCR digunakan untuk virus yang memiliki tipe genom RNA. Enzim transkriptase balik (reverse trancriptase) yang digunakan dalam RT-PCR adalah enzim DNA polimerase dan molekul RNA yang berperan sebagai cetakan didalam mensintesis molekul DNA (cDNA) yang komplementer. RT-PCR adalah metode yang sangat sensitif, cepat dan banyak digunakan untuk mendeteksi virus tanaman seperti ChiVMV, Chysanthemum B carlavirus (CVB) (Tsai et al. 2008; Ram et al. 2005 ).
Analisis perunutan nukleotida dan asam amino saat ini memiliki peranan yang tidak kalah penting didalam melakukan deteksi dan karakterisasi virus. Dari hasil analisis perunutan nukleotidan dan asam amino dapat diketahui tingkat kesamaan nukleotida dan dapat menentukan kelompok suatu virus maupun strain-strain dari virus yang sama (Shukla et al 1994). Analisis tersebut digunakan sebagai pelengkap proses deteksi dan karakterisasi virus. Teknik yang selama ini dilakukan adalah menggunakan inang diferensial, serologi, dan RT-PCR dimana masing-masing metode tersebut mempunyai kelebihan dan kekurangan.
Keunggulan masing-masing metode deteksi sangat ditentukan oleh berbagai faktor. Identifikasi virus dengan kajian biologi memerlukan waktu yang cukup lama karena harus mempersiapkan tanaman inang indikator, tetapi biaya yang dikeluarkannya tidak banyak. Metode serologi dan RT-PCR adalah metode yang lebih dapat dipercaya dan lebih sensitif sebagai metode pendeteksian virus atau indexing, dibandingkan dengan kajian biologi, sering terjadi bahwa virus tidak terdeteksi pada kajian biologi, tetapi menunjukkan hasil positif dengan metode serologi dan RT-PCR yang dapat mendeteksi virus pada konsentrasi rendah (Moury et al. 2005). Hanya saja metode ini pun masing-masing menemukan kendala, dimana metode RT-PCR tidak dapat membedakan virus pada kelompokan virus yang sama atau tidak dapat mengetahui variabilitas yang terjadi diantara strain-strain virus itu sendiri.
Ketahanan Tanaman terhadap ChiVMV
Sistem pertahanan tanaman terhadap infeksi patogen secara umum terjadi melalui satu atau beberapa cara, yaitu struktural maupun reaksi biokimia. Ketahanan secara struktural adalah bentuk penghambatan fisik oleh tanaman yang mengakibatkan patogen tidak dapat melakukan penetrasi dan berkembang, sedangkan ketahanan secara biokimia, yaitu tanaman menghasilkan senyawa yang bersifat toksik, atau menghambat pertumbuhan patogen (Agrios 2005).
yang rentan dicirikan oleh adanya gejala yang jelas dan replikasi virus yang tinggi, sementara respon inang yang tahan terdiri atas imun, agak tahan, toleran dan hipersensitif. Imun dicirikan oleh tidak adanya gejala dan ketidakmampuan virus untuk bereplikasi. Toleran dicirikan oleh adanya gejala dan replikasi virus namun tidak mempengaruhi kehilangan hasil. Hipersensitif ditunjukkan oleh adanya gejala khas (lesio lokal) (Fraser 2000).
Untuk mendapatkan kultivar yang tahan terhadap patogen seorang pemulia tanaman biasanya melakukan seleksi atau skrining terhadap beberapa kultivar yang berasal dari koleksi plasma nutfah, kultivar komersial, spesies liar sekerabat, spesies lain dalam satu genus, atau genus lain. Hasil seleksi diperoleh genotipe yang tahan terhadap patogen yang akan dihibridisasi dengan tetua yang mempunyai sifat unggul lainnya seperti produksi yang tinggi. Untuk memindahkan sifat tahan ke tetua yang mempunyai sifat produksi tinggi dapat dilakukan metode back cross atau silang balik selama beberapa kali sehingga diperoleh individu yang mempunyai sifat atau karakter yang tahan terhadap patogen namun memiliki sifat tetua ulang (recurent parents) (Mangoendidjojo 2003)
beberapa genotipe cabai terhadap ChiVMV namun, hasil yang diperoleh masih sedikit (Millah 2007; Latifah 2007). Oleh karena itu diperlukan teknik lain yang memungkinkan untuk mendapatkan tanaman yang tahan terhadap penyakit, yaitu melalui variasi somaklonal.
Pembentukan Variasi Somaklonal
Kultur in vitro atau kultur jaringan adalah suatu metode untuk mengisolasi bagian dari tanaman seperti protoplasma, sel, sekelompok sel, jaringan, dan organ, serta menumbuhkannya dalam kondisi aseptik (Gunawan 1988). Teknik ini seringkali dapat menginduksi terjadinya keragaman genetik pada populasi tanaman yang dihasilkan. Oleh karena itu, keragaman genetik yang terjadi akibat kultur in vitro disebut keragaman somaklonal (variation somaclonal) (Larkin dan Scowcroft 1981). Saat ini banyak penelitian yang menekankan pentingnya variasi somaklonal untuk perbaikan tanaman hortikultura. Variasi yang muncul selama proses kultur in vitro disebut variasi somaklonal dan merupakan variasi yang umum terjadi antar tanaman yang berasal dari kultur jaringan atau kultur sel. Menurut Ahloowalia (2001), variasi somaklonal yang terjadi dapat mengakibatkan perubahan. Perubahan tersebut diantaranya adalah defisiensi klorofil, aneuploidi, resistensi terhadap penyakit atau kadang-kadang muncul variasi yang sebelumnya tidak pernah ada di alam. Variasi dapat juga terjadi pada sifat seperti tinggi tanaman, luas daun, panjang daun, ketebalan batang, vigor, pembungaan, fertilitas dan hasil.
somaklonal akan dibatasi penggunaannya jika perubahan yang terjadi terlalu jauh dari harapan atau terlalu drastis dan mengubah banyak gen.
Untuk menghasilkan tanaman somaklonal dengan suatu karakter baru maka perlu diketahui faktor-faktor kritis yang mempengaruhi variasi somaklonal. Faktor-faktor tersebut adalah (1) genotipe, (2) lingkungan kultur (zat pengatur tumbuh), (3) sumber eksplan, dan (4) lama fase kalus dan lama durasi kultur (Arous et al. 2001). Genotipe merupakan faktor penting di dalam menimbulkan variasi somaklonal, karena genotipe dapat mempengaruhi frekuensi regenerasi dan frekuensi variasi somaklonal yang terjadi. Christopher dan Rajam (1999) mencatat frekuensi keragaman genotipe yang tinggi terjadi pada beberapa kultivar cabai Capsicum praetermissum, C. baccatum dan C. annuum cvs. G4.
pada tanaman Coffea arabica L. dan C. canephora perlakuan 7 mg/l BAP menghasilkan jumlah tunas per eksplan hampir sama dengan perlakuan 2 mg/l TDZ tetapi persentase eksplan membentuk tunas pada perlakuan TDZ lebih tinggi dibandingkan perlakuan BAP (Giridhar et al. 2004). Selain keduanya, zat pengatur tumbuh 2,4 D adalah termasuk zat pengatur tumbuh yang sering kali mengakibatkan variabilitas kromosom. Konsentrasi 2,4 D yang berpengaruh terhadap peningkatan variabilitas pada tanaman horseradish (Amoracia rusticana L.) adalah 0,1 µM yang dikombinasikan dengan 0, 0,1, dan 1,0 µM BA. Bila konsentrasi 2,4D lebih dari 0,1 µM kalus tidak beregenerasi (Yuliadi 2008). Dalam perbanyakan in vitro, sesungguhnya hampir selalu diperoleh planlet yang di luar tipe yang biasanya dibuang. Setelah penelitian mengenai variasi somaklonal dimulai dan dirasakan manfaatnya dalam pemuliaan tanaman maka justru yang di luar tipe ini yang menjadi perhatian. Setiap spesies berbeda jenis dan frekuensi variasinya dan setiap kultivar atau genotipe pada spesies yang samapun berbeda variasi somaklonnya. Mekanisme terjadinya keragaman somaklonal diantaranya disebabkan oleh perubahan genetik spesifik, misalnya mutasi titik (single nucleotide changes), perubahan jumlah kopi gen tertentu, aktivasi transposable elemen, perubahan jumlah kromosom, chromosomal rearrangements, dan metilasi DNA. Metilasi diketahui meningkatkan frekuensi mutasi CG ke AT (Keappler dan Philip 1993).
Penyebab Variasi Somaklonal
Penyebab munculnya variasi somaklonal ada dua yaitu variasi genetik yang memang sudah ada dalam eksplan dan variasi induksi atau variasi epigenetik yang muncul selama fase kultur in vitro. Variasi genetik bersifat stabil baik melalui perbanyakan seksual dan aseksual, sedangkan variasi epigenetik tidak stabil dan berpotensi dapat balik (reversible) (Keappler et al. 2000). Timbulnya keragaman genetik selama proses in vitro dipengaruhi oleh faktor internal maupun ekstenal. Faktor internal yang dapat mempengaruhi frekuensi munculnya variasi somaklonal dalam kultur in vitro adalah genotipe tanaman induk, sumber eksplan yang digunakan, umur jaringan dan tingkat ploidi, sedangkan faktor eksternal adalah konsentrasi berbagai komponen media pertumbuhan, jumlah subkultur, dan konsentrasi zat pengatur tumbuh serta proses regenerasinya (Nwauzoma et al. 2002; Jayasankar 2005). Mutasi gen merupakan mutasi yang paling diharapkan terjadi dalam pemuliaan yang menggunakan variasi somaklonal, karena mutasi gen hanya akan merubah sifat tertentu yang dikendalikan gen tersebut. Menurut Arnim (2005) mutasi gen bisa terjadi di tingkat DNA (perubahan satu basa), di tingkat protein (perubahan kode triplet untuk asam amino), atau dapat terjadi mutasi ke arah liarnya dan bahkan dapat terjadi mutasi balik.
Mutasi Secara Fisik dan Kimia
diinduksi dengan agen penginduksi mutasi (mutagen). Mutasi buatan dimaksudkan untuk mendapatkan keragaman genetik yang tercermin dari mutan-mutan yang dihasilkan. Selanjutnya mutan-mutan-mutan-mutan yang memiliki karakter yang dikehendaki diseleksi secara langsung dan diperbanyak secara vegetatif atau mutan tersebut diserbuk sendiri untuk menstabilkan karakter mutan tersebut (Poehlman 1996).
Mutasi buatan merupakan mutasi yang sengaja dilakukan sebagai salah satu cara untuk menimbulkan keragaman genetik. Mutasi buatan ini biasanya diinduksi secara fisik, kimia dan biologi. Berbagai unsur fisik seperti suhu, cahaya dengan gelombang tertentu (sinar x, y) dapat mengakibatkan mutasi. Bahan kimiawi yang mengandung senyawa yang bersifat mutagen diantaranya etil metan sulfonat (EMS), dietil sulfat (dES), nitroso etil urea (ENH), nitroso metil urea (MNH), dan etilenamin (EI) (Van Harten 1998).
Kelebihan penggunaan agen mutagenik kimia adalah (1) sebagian besar mutasi yang terjadi merupakan mutasi titik; (2) kerusakan kromosom lebih kecil, dan (3) mutasi terjadi dengan frekuensi tinggi. Kelemahannya adalah (1) penetrasi jaringan multisel seringkali sulit, (2) reproduksibilitas rendah, dan (3) agen mutagenik kimia sangat berbahaya karena bersifat karsinogenik (Van Harten 1998).
sehingga dapat merubah struktur kromosom (delesi, inversi, duplikasi dan translokasi). Radiasi juga dapat merusak benang-benang spindel yang berfungsi menarik kromosom ke kutub-kutubnya pada fase metafase dalam proses mitosis sehingga akan merubah jumlah kromosom dan dapat menyebabkan euploidi dan aneuploidi.
Variasi Somaklonal untuk mendapatkan Resistensi terhadap Penyakit
Pada saat ini teknik in vitro dan mutagenesis merupakan metode yang paling banyak digunakan untuk meningkatkan keragaman pada tanaman. Induksi mutasi merupakan suatu cara untuk memperoleh mutan-mutan yang diharapkan membawa sifat yang menguntungkan tanaman, dan telah banyak dilakukan oleh beberapa peneliti. Pada banyak tanaman yang diperbanyak secara vegetatif induksi mutasi yang dikombinasikan dengan teknik kultur in vitro merupakan salah satu metode yang efektif untuk meningkatkan hasil tanaman, namun hambatan yang sering dijumpai pada tanaman berbiak vegetatif adalah timbulnya kimera setelah perlakuan mutagen fisik maupun kimia (Linberger 2007).
Agar efektif, seleksi untuk mendapatkan tanaman yang tahan terhadap penyakit harus memenuhi tiga syarat. Pertama, kultur in vitro menghasilkan keragaman yang tinggi. Kedua, metode seleksi terhadap somaklon dengan sifat-sifat yang diinginkan harus dapat dilakukan dengan mudah. Ketiga, perubahan yang terjadi adalah perubahan genetik yang dapat diturunkan pada zuriatnya dan tetap stabil pada waktu tanaman diperbanyak baik secara seksual maupun aseksual (Ahlowalia dan Maluszynski 2001).
Pemanfaatan dan Penerapan Variasi Somaklonal
Variasi somaklonal dapat memberikan kontribusi yang nyata pada pemuliaan tanaman. Walaupun variasi tidak mempengaruhi semua sifat dan tidak selalu menguntungkan di dalam pertanian, tetapi dengan seleksi kemungkinan dapat diperoleh genotipe-genotipe yang berguna dari sumber variasi tersebut. Beberapa contoh pemanfaatan variasi somaklonal adalah peningkatan ketahanan terhadap herbisida klorosulfuran pada tanaman jagung, ketahanan terhadap Erwinia carotovora pv. carotovora pada Zantesdechia spp. (Araceae), toleransi terhadap garam pada ubijalar serta tanaman kedelai toleran aluminium (Hughes 1983; Snijder et al. 2004; Luan et al. 2007; Mariska et al. 2004).
Contoh lain pemanfaatan variasi somaklonal adalah untuk membentuk tanaman genotipe unggul baru pada pisang di Indonesia yang sulit dilakukan karena tingkat ploidi yang tinggi dan steril. Tanaman pisang yang diberi perlakuan radiasi dengan sinar gamma 1000 rad dapat menginduksi sifat ketahanan terhadap penyakit layu Fusarium (Panama disease) yang disebabkan oleh Fusarium oxysporum Schlect f.sp. cubesense (Smith et al. 2006, Mariska et al. 2006)
selama 3 jam. Perlakuan tersebut dapat meningkatkan kandungan vitamin C, umur genjah dan menginduksi perubahan morfologi (Daskalov 1991; Daskalov 2001; Jabeen dan Mirza 2004).
Perlakuan irradiasi pada Glycine max L (kedelai) menggunakan sinar gamma dan UV, yang dikombinasikan dengan mutagen kimia (EMS, DES, NMH, DMS) menghasilkan mutan yang berproduksi tinggi, tahan virus, toleran aluminium dan kekeringan, protein tinggi, genjah, kadar minyak meningkat dan toleran lahan masam (Bhatnagar dan Tiwari 1991, Mariska et al 2004).
DAFTAR PUSTAKA
Agrios GN. 2005. Plant Pathology. Ed ke-5. New York: Elsevier Academic Press.
Ahlowalia BS, M. Maluszynski 2001. Induced mutation A new paradigma in plant breeding. Euphytica 118:167-173.
Ahlowalia BS, Maluszynski M, Nichterlein K. 2004. Global impact og mutation-derived. Review. Euphytica 135:187-204.
Akin MH. 2002. Variabilitas strain-strain PStV pada tingkat moleku berdasarkan gen protein selubung dan 3’UTR (Untranslated region) genom RNS PStV. J.Perlin. Tan. Ind. 8:86-93
Arnim AG (2005). Molecular Approches to the Study og Plant Development. Di dalam Trigiano RN, Gray JD, editor. Plant Developmen and Biotechnology. CRC. Press. New York. P. 119-129
Arous S, Boussaid M, Marrakchi M. 2001. Plant regeneration from zygotic embryo hypocotyls of Tunisian chili (Capsicum annuum L.) J. Appl. Hort. 3(1): 17-22.
Bhatnagar PS, Tiwari SP. 1991. Soybean improvement through mutation breeding in India Vol. 1 IAEA : 381-391
Christopher T, Rajam MV. 1999. Effect of genotype, explants and medium on in vitro regeneration of red pepper. Plant Cell, Tissue and Organ Culture 46:245-250
Clark MF, Adams AN. 1977. Characteristics of the microplate methode of enzyme-linked immunosorbent assay for the detection of plant viruses. J. Gen. Virol. 34:475-483
Daskalov S. 1991. Experimental mutagenesis and mutation breeding in pepper Capsicum. Mutation Breeding Newsl. 10:13-20
Daskalov S. 2001. Gornoriohovska Kapia F1. A new hybrid pepper variety based on radiation induced male sterility. Mutation Breeding Newsl. 45:4-5
[Ditlinhorti] Direktorat Perlindungan Tanaman Hortikultura 2007. Luas Pertanaman Cabai Merah. (http:www.deptan.go.id/ditlinhorti/da-its-2003 (5 Maret 2007)
Duriat AS. 1989. The status of pepper virus diseases in Indonesia. Paper presented at ADB germplasm improvment subnetwork planning meeting, 31 May-21 June. Tainan, Taiwan. AVRDC.
Eleman-Verdaguer ME, Goudon-Urbino C, Dubern J, Beachy RN, Fauquet C. 1997. Analysis of the sequence diversity of the PI, HC, P3, Nib and CP genomic regions of several yam mosaic potyvirus isolates: implications for the intraspecies molecular diversity of potyviruses. Journal of General Virology 78: 1253-1264
Fauquet CM, Mayo CM, Maniloff J, Desselberger U, Ball LA, eds, 2005. Virus taxonomy, VIII th Report of the ICTV. Elsevier/Academic Press, London, USA. pp 819-829.
Fraser RSS. 2000. Special aspects of resistance to viruses. Di dalam Slusarenko AJ, Fraser RSS, van Loon LC, editor. 2000. Mechanisms of Resistance to Plant Diseases. Kluwer Academic Publishers, London p 485-495
Fratini R, Ruiz MR. 2002. Comperative study of different cytokinins in the induction of morfogenesis in lentil (Lensculinaris medic). In Vitro Cell Dev. Biol. Plant. 38:46-51
Giridhar P, Vinod K, Indu EP, Ravishankar GA, Chandrasekar A. 2004.
Thidiazuron induced somatic embryogenesis in Coffea arabica L. dan C. canephora P. ex Fr. Acta Bot. Croat. 63:25-33.
Gunawan LW. 1988. Teknik Kultur Jaringan Tumbuhan. Lab. Kultur Jaringan PAU. BIOTEK, Bogor, IPB
Hughes K. 1983. Selection for herbicide resistance. Di dalam Evan DA, Sharp WR, Amirato PV, Yamada Y. Handbook of Plant Cell Culture, New York, Macmillan. 3: 442-460
Hull R. 2002. Matthews ‘Plant Virology, Ed. Ke-4. San Diego; Academic Press. Hussien G, Harun AR, Shamsudin S. 2008. Study on mutagenesis of signals grass
(Brachiaria decumbens) by gamma irradiation. http://www.google.w.id/search?q=radiosensits/+plant&hl=id&stored=60850
=N
Hwang SC, Ko WH. 2004. Cavendish Banana Cultivars Resistant to Fusarium wilt acquired through somaclonal variation in Taiwan. Plant Disease. 88(6):580-588
Imelda M, Deswina P, Hartati S, Estiati A, Atmowijoyo S. 2000. Chemical mutation by Ethyl Methane Sulfonate (EMS) for Bunchy top virus resistence in Banana. Ann Bogorien n. s. 7: 19-25.
International Committee on Taxonomy of Viruses. 2002. Chilli veinal mottle virus. http://www.ncbi.nlm.nih.gov/ICTVdB/5701016.htm[18 Mei 2008]
Jain SM. 2001. Tissue Culture-derived variation in crop improvement. Euphytica. 118:153-156
Jabeen N, Mirza B. 2004. Ethyl methane sulfonate induces morphological mutations in Capsicum annuum. Int. J. Agrt. Biol. 6: 340-345.
Jayasankar S. 2005. Variation in tissue culture. Di dalam Trigiano RN, Gray JD, editor. Plant Developmen and Biotechnology. CRC. Press. New York. P. 301-310.
Keappler SM, Keappler HF, Rhee Y. 2000. Epigenetic aspect of somaclonal variation in plants. Plant Mocular Biology. 42:251-269.
Khan H, Siddique I, Anis M. 2006. Thidiazuron induced somatic embryogenesis and plant regeneration in Capsicum annuum. Biol. Plant. 50(4):789-792. Kumari SG, Makkouk KM, Attar N. 2006. An Improved Antiserum for Sensitive
Serologic Detection of Ckickpea chlorotic dwarf virus. J. Phytophatology 154, 129-133 (2006)
Larkin PJ, Scowcroft WR. 1981. Somaclonal variation a novel souce of variability from cell culture. Theor.Appl.Genet. 60:197-214
Latifah 2007. Metode penapisan dan uji ketahanan cabai (Capsicum annuum L.) terhadap Chilli veinal mottle virus dan cucumber mosaic virus [tesis]. Bogor: Institut Pertanian Bogor.
Leonard S, Plante D, Wittmann S, Daigneault N, Fortin MG, Laliberte JF. 2000. Complex formation between potyvirus VPg and translation eukaryotic initiation factor 4E correlates with virus infectivity. J. Virol. 74:7730-7737 Linberger RD. 2007. Origin, Developmental propagation of chimaras.
http://www.aggie-horticulture. Tamu.edu/tissucult/chimeras/s.html
Luan YS, Juan Z, Xiao-Rong G, Li-jia A. 2007. Mutation induced by ethyl methane sulfonate (EMS), in vitro screening for salt tolerance and plant regeneration of sweet potato (Ipomoea batatas L). Plant Cell, Tiss and Cult 88(1):77-81
Mangoendidjojo W. 2003. Dasar-dasar Pemuliaan Tanaman. Kanisius, Yogyakarta. 182 hal.
Mariska I, Kosmiatin M, Lestari EG, Roostika I. 2006. Seleksi in vitro tanaman pisang ambon kuning untuk ketahanan terhadap penyakit layu fusarium. Laporan Akhir Rusnas Buah Tropis. BB-Biogen. Bogor. 20 hlm..V. Noviati. 2004. Peningkatan ketahanan tanaman kedelai terhadap aluminium melalui kultur in vitro. Jurnal Litbang Pertanian 23(2):46-52.
Mariska I, Syamsudin E, Sopandie D, Hutami S, Husni A, Kosmiatin M, Noviati A. 2004. Peningkatan ketahanan tanaman kedelai terhadap aluminium melalui kultur in vitro. Jurnal Litbang Pertanian 23(2):46-52.
Moury B, Palloix A, Caranta C, Gognalons P. 2005. Serological, molecular, and pathotype diversity of pepper veinal mottle virus and chilli veinal mottle virus. Phytopathology 95:227-232.
Nasir M. 2002. Bioteknologi Molekuler. Teknik rekayasa genetic tanaman. PT. Citra Aditya Bakti. Bandung. Hal 59-78
Nwauzoma AB, Tenkouano A, Crouch JH, Pillay DV, Daniel KLA. 2002. Yield and disease resistance of plantain (Musa spp, AAB group) somaclones in Nigeria. Euphytica 123:323-331
Ong CA. 1995. Symptomatic variants of CVMV in Malaysia. Proceeding of the AVNET II Midterm Workshop Philippines 21-25 Februari 1995. AVRDC. Prabaningrum L, Moekasan TK. 1996. Hama-hama tanaman cabai merah dan
pengendaliannya. Di dalam: Duriat AS, Widjaja W. Hadisoeganda A, Soetiarso TA dan Prabaningrum L, editor. Teknologi Produksi Cabai Merah. Pusat Penelitian dan Pengembangan Hortikultura, Badan Penelitian dan Pengembangan Pertanian: Hlm 48-63
Poehlman JM, Sleper DA 1996. Breeding Filed Crop (Fourth Edition). Iowa State University Pree, Ames. IOWA.
Poerba YS. 2004. Penampilan genotype hasil mutasi induksi Talinum paniculatum JACQ (GAERTN). Berita Biologi 7(3):127-135
Ram R, Verma N, Singh AK, Singh L, Hallan V, Zaidi AA. 2005. Indexing and production of virus-free chrysanthemums. Biologia Plantarum 49(1): 149-152.
Shah H, Khalid S. 2001. Screening of exotic Pepper Lines Against Local Isolate of Chilli veinal mottle potyvirus. On Line Journal of Biological Sciences 1(11):1078-1080. Asian Network for Scientific Information. [21 Agustus 2005]
Shukla DD, Ward CW, Brunt AA. 1994. The Potyviridae. CAB International, Printed and bound in the UK at the University Press, Cambridge, h 92-105 Singh SK, Yerramilli V, Khawale RN. 2007. Molecular marker-assisted selection
Smith MK, Hamill SD, Langdon PW, Giles JE, Doogan VJ, Pegg KG. 2006. Towards the development of a Cavendish banana resistant to race 4 of fusarium wilt: gamma irradiation of micropropagated Dwarf Parlitt (Musa spp, AAA group Cavendish subgroup) Australian Journal of Experimental Agriculture. 46:107-113
Snijder RC, Cho HR, Hendriks MMWB, Lindhout P, van Tuyl JM. 2004. Genetic variation in zantedechia spp (Araceae) for resistance to soft rot caused by Erwinia carotovora subsp. Carotovora. Euphytica 135:119-128
Sulyo Y, Duriat AS, Gunaeni N, Korlina E. 1995. Determination of CMV and CVMV strains in Indonesia. Proceeding of the AVNET II Midterm Workshop Philippines 21-25 Februari 1995. AVRDC.
Svetleva DL, Crino P. 2005. Effect of ethyl methane sulfonate (EMS) and N-nitrose-N-ethyl urea (ENU) on callus growth of common bean. J. of Central European Agric. 6(1): 59-64
Taufik M, Astuti AP, Hidayat SH. 2005. Survei infeksi Cucumber mosaic virus dan Chilli veinal mottle virus pada tanaman cabai dan seleksi ketahanan beberapa kultivar cabai. J. Agrikultura 16:146-152.
Tsai WS, Huang YC, Zhang DY, Reddy K, Hidayat SH, Srithongchai W, Green SK, Jan FJ. 2008. Molekular characterization of the CP gene and 3’UTR of Chilli veinal mottle virus from South and Southeast Asia. Plant Pathology 57, 408-416.
Uncuqui-Inchima S, Haenni AL, Bernardi F. 2001. Potyvirus proteins: a wealth of functions. Virus Research 74:157-175.
Van Harten AM. 1998. Mutation Breeding : Theory and Practical Application, Cambridge: Cambridge Univ. Pr. P. 111-203
Womdim NR, Swai IS, Chadha ML, Selassie GK, Marchoux G. 2001. Occurence of Chilli veinal mottle virus in Solanum aethiopicum in Tanzania. Plant Dis. 85:801.
Abstrak
Infeksi Chilli veinal mottle potyvirus (ChiVMV) di daerah sentra tanaman cabai di Indonesia dilaporkan cukup tinggi. Isolat ChiVMV berhasil dikumpulkan dari Jawa Barat (Cikabayan), Jawa Tengah (Karadenan), Jawa Timur (Belung), Kalimantan Selatan (Nusa Indah), Sumatera Barat (Tanah Datar), dan Aceh Tengah (Gayo Barat). Pengamatan terhadap gejala infeksi di lapangan menunjukkan adanya variasi gejala yang cukup tinggi, mulai dari belang ringan sampai belang berat yang diikuti dengan penebalan tulang daun. Penelitian tingkat virulensi dilakukan terhadap empat isolat yaitu ChiVMV Cikabayan (Jawa Barat), ChiVMV Nusa Indah (Kalimantan Selatan), ChiVMV Tanah Datar (Sumatera Barat) dan ChiVMV Karadenan (Jawa Tengah), yang memperlihatkan tingkat keparahan gejala yang berbeda. Perbedaan virulensi ke empat isolat ChiVMV tersebut selanjutnya dievaluasi berdasarkan kemampuannya menginfeksi 10 genotipe cabai yaitu Jatilaba, Helem, VC 246, Keriting Bogor, PBC 495, Titsuper, Beauty Bell, Gelora, IPBC Tanjung, dan Keriting Sumatera. Masing-masing isolat ChiVMV diinokulasi pada tiap genotipe cabai dengan metode inokulasi mekanis. Pengamatan dilakukan terhadap masa inkubasi, tipe gejala yang muncul, dan kejadian penyakit. Isolat Cikabayan dan Nusa Indah mampu menginfeksi semua genotipe cabai uji dengan masa inkubasi tercepat 3 hari pada genotipe “Titsuper” dan “Beauty Bell”; sementara isolat Karadenan dan Tanah Datar hanya mampu menginfeksi berturut-turut 4 dan 6 genotipe cabai uji. Walaupun ada perbedaan kisarana inang, tetapi variasi gejala yang muncul diantara ke empat isolat hampir sama, yaitu mencakup belang, penebalan tulang daun, daun berkerut, dan malformasi. Hal tersebut mengindikasikan kemungkinan adanya keragaman genetik antar isolat ChiVMV dan perlu dilakukan penelitian lebih lanjut terutama berkaitan dengan sifat molekuler masing-masing isolat.
Kata kunci : Chilli veinal mottle potyvirus, genotipe cabai, virulensi
______________________
Abstract
Infection of Chilli veinal mottle potyvirus (ChiVMV) has been reported from chilli pepper growing area in Indonesia. Field observation showed wide variation of symptom development starts from mild mottle to severe mottle and vein banding. A research was conducted to study the difference of isolates of ChiVMV collected from West Java (Cikabayan), Central Java (Karadenan), East Java (Belung), South Kalimantan (Nusa Indah), and West Sumatera (Tanah Datar) based on their response on 10 genotypes of chilli pepper i.e. Jatilaba, Helem, VC246, Keriting Bogor, PBC485, Titisuper, Beauty Bell, Gelora, IPBCTanjung, dan Keriting Sumatera. Each isolates of ChiVMV was mechanically inoculated to each chilli pepper genotypes, and observation was conducted every day to record incubation period, symptoms type, and disease incidence. Cikabayan and Nusa Indah isolates were able to infect all chilli pepper genotypes with the shortest incubation period of 3 days occurred in “Tistsuper” and “Beauty Bell” genotypes; whereas Karadenan and Tanah Datar isolates only infected 4 and 6 chilli pepper genotypes, respectively. Although the 4 isolates of ChiVMV showed differences in their host range, but most of them developed similar symptoms ranging from mottle, vein banding, leaf cupping, and malformation. This results indicated possible genetic diversity among isolates of ChiVMV which required further investigation, especially to study their molecular characters.
PENDAHULUAN
Beberapa anggota Potyvirus telah dilaporkan dapat menginfeksi tanaman cabai, diantaranya adalah Chilli veinal mottle virus (ChiVMV). Virus ini pertama kali dilaporkan oleh Burnet pada tahun 1947 menginfeksi Capsicum annuum di Malaysia dan dapat menyebabkan penurunan produksi hingga 60% (Ong et al. 1995). Selanjutnya dilaporkan bahwa virus ini telah menyebabkan penyakit di banyak negara Asia seperti India, Thailand, Taiwan, Korea, Filipina (Ravi et al. 1997; Siriwong et al. 1995; Green dan Kim 1991) dimana cabai di tanam secara komersial. Di Indonesia, keberadaan ChiVMV telah dilaporkan oleh Duriat et al. (1996), Taufik et al. (2005), Subekti et al. (2006) dan Opriana (2009).
Tanaman cabai yang terinfeksi pada daunnya akan memperlihatkan gejala belang-belang hijau gelap, bercak-bercak hijau gelap, dan kadang kadang pola-pola tersebut menyatu ke tulang daun di dekatnya, leaf cupping, epinasti dan nekrosis. Tanaman cabai yang terinfeksi secara umum menjadi kerdil dan mengalami malformasi pada daun. Kadang-kadang buah juga menunjukkan gejala belang-belang atau distorsi sehingga produksi dan kualitasnya menjadi rendah (Ong 1995; Sulyo et al. 1995; Chiemsombat dan Kittipakorn 1996). Gejala yang disebabkan oleh ChiVMV bervariasi tergantung pada inang, strain virus, waktu infeksi dan kondisi lingkungan. Virus ini dapat ditularkan oleh beberapa spesies kutu daun dan dapat pula ditularkan secara mekanis. Beberapa tanaman yang menjadi inang ChiVMV selain C. annuum, adalah C. frutescens, Lycopersicon esculentum, Solanum melongena, Datura stramonium, Nicotiana spp, dan Chenopodium spp (Green et al. 1999).
Penelitian tentang ChiVMV yang telah dilakukan di Indonesia diantaranya berkaitan dengan kajian respon beberapa genotipe cabai terhadap infeksi ChiVMV (Taufik 2005), virulensi isolat ChiVMV (Opriana 2009), dan pengaruh infeksi ChiVMV terhadap produksi tanaman (Subekti et al. 2006).
diinokulasi dengan beberapa isolat ChiVMV yang berbeda. Hasil infeksi ChiVMV terhadap pertumbuhan dan hasil tanaman cabai yang dilakukan oleh Subekti et al. (2006) membuktikan bahwa terdapat perbedaan masa inkubasi dan keparahan gejala yang muncul berkaitan dengan sistem ketahanan yang dimiliki oleh tanaman dan tingkat virulensi virus yang menginfeksi. Selain itu infeksi virus menyebabkan bobot buah tiap tanaman berkurang, walaupun ada juga yang sebaliknya.
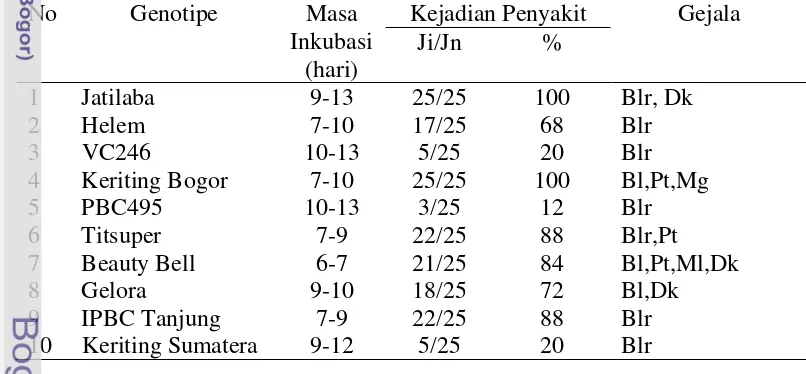
Untuk mempelajari sifat infeksi ChiVMV maka dilakukan penelitian yang bertujuan untuk mengetahui virulensi keempat isolat ChiVMV yang berasal dari Jawa Barat, Jawa Tengah, Kalimantan Selatan dan Sumatra Barat pada 10 genotipe cabai (Jatilaba, Helem, VC 246, Keriting Bogor, PBC 495, Titsuper, Beauty Bell, Gelora, IPBC Tanjung, Keriting Sumatera) sebagai upaya untuk melakukan karakterisasi terhadap strain-strain virus yang berbeda.
BAHAN DAN METODE
Waktu dan Tempat
Penelitian dilakukan di laboratorium Virologi dan rumah kaca Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor dari bulan Juni 2007 sampai dengan Februari 2008.
Bahan Penelitian
Materi genotipe cabai yang digunakan terdiri atas 10 genotipe cabai yang berasal dari koleksi plasma nutfah Departemen Agronomi dan Hortikultura IPB yaitu Jatilaba, Helem, VC246, Keriting Bogor, PBC495, Titsuper, Beauty Bell, Gelora, IPBC Tanjung dan Keriting Sumatera.