ISOLASI DAN IDENTIFIKASI PRODUK
BIOTRANSFORMASI ARTEMISININ OLEH
GALUR MIKROORGANISME ENDOFIT
Artemisia annua
OLEH
:
DIAN MALINI OKTOVINA
PROGRAM PASCASARJANA
INSTITUT PERTANIAN BOGOR
"Katakanlah : Kalau sekiranya lautan menjadi tinta untuk (menulis) kalimat-kalimat Tuhanku, sungguh habislah taut i t u sebelum habis (ditulis) kalimat-kalimat Tuhanku, meskipun kami datangkan tambahan sebanyak i t u (pula)"
(Al-Kahfi : 109)
DIBALIK STERILISASI
(Jeda sesaat di Laboratorium KBA, Agustus 2001)
Bila saatnya tiba ... diriku terbungkus kertas-kertas usang
dan terlipat-lipat kaku, membujur di antara himpitan karet-karet gelang .
tentu tak kubayangkan betapa sesak, panas, dan pengapnya udara siang dan malam ...
biriku tertumpuk dalam barisan ke-99 di antara 584 peserta sterilisasi yang lain
sakit mungkin,
Tapi ku tak berdaya, diam dan hanya menunggu menit-menit terakhir setelah letup mengeluarkan asapnya,
tiba-tiba tekananku menjadi tinggi seiring naiknya jarum pressure
bahsyat ... ku terguncang dan makin terhimpit di antara yang lainnya Buat apa mengeluh ...
ternyata diriku masih beruntung berada dalam dinding besi yang kokoh, ...
bila ku lihat yang lainnya pecah dalam himpitan
Setelah semua uap menyelimuti tubuhku ...
Seketika ku terhentak, tersentak ketika dinding besi dibuka Panas berganti udara luar menyeruak
Nyaris ku terbatuk, tapi papa tak kunjung mengangkatku dari kepulan asap panas
kemudian ku didudukkan dalam ruang tunggu yang nyaris panas juga Oh malang ...
. Kini ku hanya diam menunggu uap-uap air ini tersapu
ban ku hanya mampu berkata lirih, Mama
...
Kupersembahkan untuk :
ABSTRACT
DIAN MALINI OKTOVINA. Isolation and Identification of the Biotransformation
Product Artemisinin by Endophitic Microorganism Strains of Artemisia annua. Under
the direction of ENDANG GUMBIRA-SA'ID, MULYORNI RAHAYUNINGSIH, and PARTOMUAN SIMANJUNTAK.
Isolation of the biotransforrnation product artemisinin from endophitic bacteria is a new alternative for the production of the multidrug-resistant malaria compounds. The bacteria strain, AT 12, has been proved particularly potential as an artemisinin
source (0,75 % w/w).
This study was carried out to isolate and to identify the biotransformation product artemisinin as an antimalarial active compound from endophitic
microorganism strains of Artemisia annua. The product was determined using TLC,
HPLC-UV, IR spectroscopy, and GC-MS methods.
The initial positively identification of artemisinin was indicated with the same
Rf. The IR spectrum exhibited the chara~teristic bands for 6-lactone (1750-1735
cm'l, 1250-1 1 1 1 cm-') and endoperoxide fimction (-1 1 15 crn-', 890-830 cm-I).
Comparison of chromatogram data of the HPLC-UV with the standmd convinced
they were the same compound. As a result, the GC-MS gave a positively
identification for the majority of GC peaks. The mass spectrum af the peak ( t ~ 27.94
min) has a molecular ion of artemisinin with one hydrogen loss at m/z 281,
ISOLASI DAN IDENTIFIKASI PRODUK
BIOTRANSFORMASI ARTEMISININ OLEH
GALUR MIKROORGANISME ENDOFIT
Artemisia annua
DIAN MALINI OKTOVINA
Tesis
sebagai salah satu syarat untuk memperoleh gelar
Magister Sains pada .
Program Studi Teknologi Industri Pertanian
PROGRAM PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Isolasi dan Identifikasi Produk Biotransformasi Artemisinin
oleh Galur Mikroorganisme Endofit Artemisia annua
Narna Mahasiswa : Dian Malini Oktovina
Nomor Pokok : 99584
Program Studi : Teknologi Industri Pertanian
Menyetujui,
(Prof. Dr. Ir. Endang ira-Sa'id, MADev)
Ket Li
Ir. Mulvorini R a h a d n g s i h , MSi Dr. Partomuan Simaniuntak, MSc
Anggota Anggota
Mengetahui,
2. Ketua Program Studi
Teknologi Industri Pzrtanian
-'
(Dr. Ir. Irawadi Jamaran)
3. Direktur Program Pascasarj ana
9
'
(Prof. Dr. Ir. Svafrida Manuwoto, MSc)
RIWAYAT
HIDUP
Penulis dilahirkan di Pekalongan pada tanggal 26 Oktober 1976 sebagai anak
kedua dari tiga bersaudara, anak dari pasangan Moezarnil Zamahsari d m Azizah. Pendidikan sarjana ditempuh di Jurusan Biologi, Fakultas Matematika d m Ilmu
Pengetahuan Alam IPB, lulus pada tahun 1999. Pada tahun yang sama, penulis
diterima di Program Studi Teknologi Industri Pertanian pada Program Pascasarjana IPB.
Selama mengikuti program S2, penulis menjadi anggota Lembaga Swadaya
Masyarakat Konsorsium Nasional Pengendalian Hutan dan Alam Indonesia (KONPHALINDO) dan Himpunan Kimia Bahan Alam Indonesia (HKBAI). Penulis juga aktif mengajar di beberapa lcnlbaga pendidikan dan bimbingan belajar di Bogor
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga tesis dengan judul Isolasi dan Identifikasi Produk Biotransforrnasi Artemisinin oleh Galur Mikroorganisme Endofit Artemisia annua ini berhasil diselesaikan.
Terima kasih penulis ucapkan kepada Bapak Prof. Dr. Ir. Endang Gumbira- Sa'id, MADev, Ibu Ir. Mulyorini Rahayuningsih, MSi, dan Bapak Partomuan Simanjuntak, MSc selaku pembimbing, serta Ibu Dr. Ir. Ratna Siri Hadioetomo yang telah memberi saran. Di samping itu penghargaan diberikan kepada staf Unit Laboratorium Kimia Bahan Alam, Pusat Penelitian Bioteknologi-LIPI, Cibinong Mbak Titi, Mas Judhi Rachrnat, Bustan, dan Teguh yang telah membantu selarna pelaksanaan penelitian. Kepada Ibu, Bapak, Nenek, Mas Anto, dan Fitra, penulis ucapkan terima kasih atas segala doa dan kasih sayangnya. Ungkapan terima kasih juga disampaikan kepada Nani, Pak Sugeng, rekan-rekan TIP'99 khususnya Arief dan Linda, warga Cirahayu 6 khususnya Rina dan Jeanny, rekan-rekan KSM dan Tribisswara.
Semoga tesis ini dapat bermanfaat.
Bogor, Januari 2002
DAFTAR IS1
Halaman
DAFTAR TABEL
... .
.
...
ixDAFTAR GAMBAR
...
.
.
...
xDAFTAR LAMPIRAN
...
xiPENDAHULUAN
...
.
.
.
...
1Latar Belakang
...
1Tujuan
...
2Hipotesis
...
.
.
.
.
.
...
3Ruang Lingkup
...
3TINJAUAN PUSTAKA
...
4Artemisinin dan Turunannya
...
4... ...
Struktur M aArtemisinin
.
.
4...
Sifat Fisiko-Kimia Artemisinin
...
.
.
7Perkembangan Metode Isolasi Artemisinin
...
.
.
.
.
...
8Produk Biotransformasi dan Potensi Mikroorganisme Endofit
...
:...
9METODOLOGI PENELITIAN
...
1 1Waktu dan Tempat Penelitian
...
1 1Bahan dan Alat
.
.
...
1 1Metode Penelltian
...
1 1Penyiapan Contoh Isolat Kultur
...
1 1Penapisan Contoh Isolat Kultur
...
1 2 Penyiapan Medium Fermentasi...
..
...
13Penyiapan Inokulum
...
.,.
...
1 3Fermentasi Kultur
...
.
.
.
...
1 3Isolasi Produk Biotransformasi Arternisinin
... .
.
...
1 4Identifikasi dan Karakterisasi Struktur
....:.... ...
.
.
...
14HASIL DAN PEMBAHASAN
...
1 7Penapisan Contoh Isolat Kultur
...
17Karakteristik Isolat Terpilih
.
.
...
.
.
...
22Fermentasi Kultur Terpillh
...
.
.
...
2 2Pengaruh Tingkat Perturnbuhan Kultur Terhadap Produksi Senyawa
Biotransformasi Artemisinin
...
2 5.
.
.
Ekstraksi dan Fraksinasi
...
.
.
...
2 6...
Identifikasi Produk Biotransformasi Artemisinin
...
.
.
.
.
26Uji
. .
TLC...
.,...
2 6Uji
HPLC
...
28...
Identifikasi dan Karakterisasi Struktur 3 1
...
Spektnun IR 3 1
GC-MS
...
.
.
.
.
...
3 2KESIMPULAN DAN SARAN
...
.
.
...
38...
Kesimpulan 38
Saran
...
...
...
3 9 DAFTAR PUSTAKA... .. . .
...
4 0LAMPIRAN
...
4 4DAFTAR
TABEL
Halaman
...
Hasil uji TLC kultur fermentasi fungi endofit AT 21 dan AT 22 19
...
Hasil uji TLC kultur fermentasi bakteri endofit AT 11 dan AT 12 21
...
Hasil uji TLC kultur fermentasi bakteri endofit AT 12
...
28Identifikasi berbagai gugus f h g s i dalam spektrum
IR
contoh kultur...
bakteri AT 12 dengan artemisinin standar 3 1 Perbandingan kromatogram GC contoh kultur bakteri AT 12 dan
artemisinin standar terhadap puncak-puncak dengan waktu retensi sama
...
33 Hasil analisis fiagrnentasiMS
contoh kultur bakteriAT 12
danartemisinin standar
...
34DAFTAR GAMBAR
Berbagai senyawa kimia artemisinin) ,dan turunannya hasil
isolasi dari tanaman Artemisia spp.
...
...
. . .
.
...
. .. .. .
. .
5 Struktur kimia artemisinin...
6 Tahapan isolasi, purifikasi mikroorgzrnisme endofit, ekstraksi danidentifikasi produk biotransformasi attemisinin
. . .
. .. ..
..
.
.
.. ..
.
. . ..
.
.. ..
.
.
.
..
. ...
.
. . . .
16 Pertumbuhan sel kultur fungi endofit AT 2 1 dan AT 22 selamafermentasi 14 hari
.,... .. .. ..
..
...
.
.
..
.
..
...
.. ..
. . .
..
. .
.,
.
,. . .
, , ,.
.
. . .
.
.
,.
.
. . .
1 8Perubahan nilai pH kultur fungi endofit AT 2 1 dan AT 22 selama
fermentasi 14 hari
.,....
.. ..
.. .... ...
. ...
.. ..
..
.
,....
,.
,.
,..
. . . .
,.
,.
.
.
,. .
, ,. .
,,. .
.
.
. .
.
.
. . .
1 8Morfologi sel bakteri endofit AT 12 pada perbesaran 1000 kali
... ...
22 Pertumbuhan seldan
perubahan nilai pH kultur bakteri endofitAT 12 selama fermentasi
.
...
.
.
.
.
.
.
...
23 Penampakan daerah refraktil subterminal sel bakteri AT 12 padakultur fermentasi jam ke-30
...
.
.
...
24 Kromatogram hasil uji HPLC-detektdrUV
artemisinin standar dancontoh kultur AT 12
...
.... ...,... .
.,.,.,,
,,.,,.
. . .
,,.
...
.
,, ,. . .
30DAFTAR LAMPIRAN
Kromatogram hasil uji HPLC-detektor UV artemisinin standar
...
dan contoh biomassa kultur fungi AT 22
...
.
.
.
45Kromatogram hasil uji HPLC-detektor UV artemisinin standar
dan contoh kultur bakteri AT 1 1 hari ke-3
...
46 Kromatogram hasil uji HPLC-detektor UV artemisinin standar...
dan contoh kultur bakteri AT 11 hari ke-7 47
Kromatogram hasil uji HPLC-detektor UV artemisinin standar
dan contoh kultur bakteri AT 12 hari ke-1
...
48 Kromatogram hasil uji HPLC-detektor UV artemisinin standardan contoh kultur bakteri AT 12 hari ke-7
...
49 Morfologi sel bakteri endofit AT 11 pada perbesaran 1000 kali...
50Perhitungan kadar produk biotransformasi artemisinin (% blb)
...
dalam kultur bakteri endofit AT 12
...
.
.
.
.
51...
Spektrum IR artemisinin standar dan contoh kultur sel bakteri AT 12 52
...
Morfologi sel h n g i endofit AT 21 pada perbesaran 1000 kali 53
Morfologi sel fungi endofit AT 22 pada perbesaran 1000 kali
...
53Spektrum massa artemisinin standar dan contoh kultur bakteri AT 12
(tR 13. 77 menit)
...
54Spektrum massa artemisinin standar dan contah kultur bakteri A T 12
...
...
(tR
1
4. 3 1 menit).
.
55Spektrwn massa artemisinin standar dan contoh kultur bakteri AT 12
...
(tR 2 1. 74 menit) 56
Spektrum rnassa artemisinin standar dan contoh kultur bakteri AT 12
(tR 27. 94 menit)
...
57...
Spektrum massa contoh kultur bakteri AT 12 ( t ~ 22, 84 menit) 58
Kromatogram hasil uji TLC artemisinin standar dan contoh kultur
...
PENDAHULUAN
Latar Belakang
Penyakit malaria merupakan masalah kesehatan yang utama di banyak negara di dunia. Bagi negara-negara tropis keadaan tersebut cukup mengkhawatirkan karena tingkat mortalitas penderita yang tinggi. WHO (1996) melaporkan bahwa sekitar 300-500 juta orang dijangkiti oleh parasit malaria. Hasil konferensi malaria di India pada Agustus 1997 melaporkan bahwa setiap tahunnya sekitar tiga juta orang meninggal akibat malaria dan sepertiganya adalah anak-anak. Malaria bahkan lebih mematikan dibanding penyakit AIDS karena dapat mengakibatkan kematian hanya dalam waktu 40 jam.
Obat antimalaria yang pertama kali digunakan adalah kuinin, suatu alkaloid yang diekstrak dari kulit batang pohon kina (Cinchona). Selain itu juga digunakan obat-obat sintetik seperti klorokuin, meflokuin, primakuin, pirimetamin, halofantrin, dan sebagainya (Sukarban dan Zunilda 1995). Namun pengendalian malaria menjadi bertambah sulit karena meningkatnya resistensi parasit Plasmodium terhadap obat- obat tersebut. Beberapa galur
P.
falciparum menjadi kebal terhadap klorokuin dan obat antimalaria lainnya. Oleh karena itu sangat perlu untuk meneliti senyawa- senyawa antimalaria baru yang diperlukan sebagai ohat alternatif yang lebih ampuh untuk mengatasi malaria, termasuk malaria resisten multidrugs (Ziffer et al. 1992; Geldre et al. 1997).Artemisinin (dikenal sebagai qinghaosu), suatu seskuiterpena lakton yang memiliki jembatan endoperoksida, adalah senyawa aktif yang berkhasiat antimalaria (Titulaer et al. 1990). Selama ini produksi artemisinin dan prekursornya, asam artemisinat, mengandalkan beberapa herba genus Artemisia. Kohler et al. (1997) melaporkan teknik ekstraksi dengan supercritical carbon dioxide (SOD) dari surnber
tinggi dalam memerangi
P.
./irlcij>trrlrnr baik yang peka maupun kebal klorokuin (QACRG 1979).Sebagaimana rnetabolit sekunder umumnya, kandungan artemisinin dalam tanaman sangat rendah (0,O 1 -0,5%). Hanya empat spesies dari sekitar 300 spesies
dalam genus Artemisia yang mengandung artemisinin, yaitu A. annua, A, apiacea, A.
lancea, dan A. sacrorum (Klayman 1993; Chan et al. 1997; Sari 2000). Hal tersebut telah menyebabkan kesulitan dalam penyediaan artemisinin skala besar
disamping harganya yang relatif mahal (Geldre et al. 1997).
Salah satu cara terbaru dalam memproduksi senyawa metabolit sekunder sejenis yang terdapat dalam tanaman adalah dengan memanfaatkan mikroorganisme endofit yang hidup dalam jaringan tanaman. Mikroorganisme endofit adalah mikroorganime yang hidup dan berasosiasi di dalam jaringan tanaman inang. Asosiasi yang terjadi umumnya bersifat mutualistik, namun ada beberapa di antaranya yang bersifat patogenetik. Mikroorganisme endofit diisolasi dari jaringan tanaman diturnbuhkan pada medium fermentasi dengan komposisi tertentu. Di dalam medium fermentasi, mikroorganisme endofit menghasilkan senyawa sejenis seperti yang terkandung pada
tanaman dengan bantuan aktivitas enzim. (Petrini et al. 1992). Eksplorasi
mikroorganisme endofit potensial merupakan alternatif baru untuk mendapatkan rendemen artemisinin dan turunannya secara lebih ekonomis dan menculcupi.
Penelitian ini dilatarbelakangi oleh masih adanya kesulitan dalarn penyediaan artemisinin skala besar sebagai senyawa altarnatif antimalaria. Selama ini hanya herba yang secara serius digali potensinya sebagai sumber artemisinin. Oleh karena itu perlu dilakukan eksplorasi galur mikroorganisme endofit sebagai sumber potensial artemisinin.
Tujuan
Penelitian ini bertujuan untuk mengisolasi dan mengidentifikasi produk biotransformasi artemisinin sebagai zat aktif antimalaria dari galur mikroorganisme
endofit Artemisia annua terpilih. Galur tersebut berkemampuan memicu sekresi
Hipotesis
Galur mikroorganisme (fungi dan bakteri) endofit. yang sesuai dapat ditumbuhkan dalam komposisi medium optimal. Produk biotransformasi mempunyai profil kromatografi dan spektrum yang sama dengan artemisinin standar. Galur yang terpilih mengandung artemisinin, sehingga juga dapat dijadikan sebagai sumber potensial artemisinin.
Ruang Lingkup
Ruang lingkup penelitian ini n~eliputi: (i) penapisan isolat milroorganisme endofit terpilih dalam medium pertumbuhan optimal, (ii) fermentasi kultur terpilih,
(iii) isolasi produk biotransformasi artemisinin, dan (iv) identifikasi serta
TINJAUAN PUSTAKA
Artemisinin dan Turunnnnya
Artemisinin, suatu seskuiterpena lakton tipe kadinan yang memiliki jembatan endoperoksida, adalah senyawa aktif yang berkhasiat antimalaria dan efektif terhadap parasit Plasmodium yang resisten terhadap klorokuin dan malaria serebral (Titulaer et al. 1990). Tinjauan oleh Edwards (1997), Bagchi et al. (1997), dan Kawamoto et al.
(1998) menyebutkan bahwa turunan semi sintetik artemisinin (Gambar 1) yang banyak digunakan ialah artemether, arteether, dan artesunat, yaitu eter metil, eter etil, dan ester hemisuksinat dari dihidroartemisinin serta arteannuin
By
deoksiartemisinin, asarn artemisinat, dan sodium artelinat.Struktur Kimia Artemisinin
Hasil analisis spektrum massa resolusi tinggi ( d z 282,1470 M.') dan analisis unsur (63,72% C; 7,86% H; dan 28,42% 0 ) menunjukkan bahwa rumus molekul artemisinin adalah C15Hz205 (Zheng 1994). Analisis kristalografi sinar-X menunjukkan bahwa 15 atom karbon dan 5 atom oksigen dalam molekul artemisinin terangkai dalam empat cincin heterosiklik. Cincin A
merupakan sikloheksana berkonformasi kursi. Cincin D adalah 6-lakton yang berperan terhadap bentuk pelekukan kursi. Cincin B dan C merupakan oksiheterosiklik jenuh. Data parameter struktural membuktikan bahwa cincin AID, A/B, dan CID semuanya terikat secara cis, sedangkan D/B secara trans
artemlo W n
-
art emisiten arteannuin Bdeoksbrtemidrin
.
- -
-
-
.
-
THO?
,,llll~q
q
HO'
HOOC HdOC
0 0
4q
am mkdBfe nisinat a ~ m~ m # m t
W P
H
rnanru h A rrtaidtul edemida albhol artemido leton
R WJ artsmother
r W$l$ rttetttrer N, oodiwm artelinate artsrunsts
Ga~nbar 1 . Berbagai senyawa ki~nia artemisinin dan turunannya hasil isolasi dari tanaman
Arlemisia spp. (Brown 1994; Ferreira dan Janick 1996; Meslinick et al. 1996;
Artemisinin memiliki struktur unik yang berbeda dengan senyawa antimalaria yang telah ada. Umumnya senyawa antimalaria memiliki cincin heterosiklik yang mengandung atom nitrogen (termasuk golongan alkaloid),
seperti kuinin dan klorokuin (Meshnick et al. 1996). Namun artemisinin
merupakan golongan seskuiterpena dengan gugus endoperoksida tanpa adanya
atom nitrogen. Tinjauan oleh Meshnick et al. (1996) menduga bahwa kunci
aktivitas antimalaria terletak pada gugus endoperoksida karena senyawa turunan yang tidak mempunyai gugus endoperoksida, seperti deoksiartemisinin,
dihidrodeoksiartemisinin, artemisilakton, arteannuin A, arteannuin E,
artemisinol, artemisia alkohol, dan artemisia keton ternyata tidak aktif.
Bagchi et 'al. (1997) turut melaporkan bahwa uji toksisitas artemisinin dan
arteether lebih tinggi dibandingkan senyawa turunan tanpa jembatan
endoperoksida (arteannuin
B
dan asam artemisinat). Struktur cincin kompleksperoksida (beberapa contoh peroksida organik) yang terbukti mempunyai aktivitas antimalaria. Mekanisme aksi artemisinin diduga melibatlcan dua tahap reaksi, yaitu aktivasi dan alkilasi. Artemisinin diaktivasi oleh besi molekuler untuk menghasilkan radikal bebas dan senyawa antara elektrofilik (pengalkilasi) melalui pemenggalan jembatan endoperoksida. Spesies reaktif tersebut akan bereaksi dengan merusak protein membran parasit.
Sifat Fisiko-Kimia Artemisinin
Artemisinin merupakan kristal jarum dengan sistem kristal ortorombik
(Chan et a 1 1997),
[ a ] " ~
+66,3 dengan densitas 1,30 g/cm3. Beberapaliteratur menunjukkan kisaran titik leleh yang bervariasi, antara lain 156-1 57 OC
(QACRG 1979), 153-154 OC (Klayman et al. 1984), 150-152 OC (Acton et al.
1986), dan 154 OC (ElSohly et al. 1990). Senyawa seskuiterpena ini larut
dalam pelarut aprotik, seperti kloroform, aseton, etil eter, dan etil asetat, tetapi sedikit larut dalarn pelarut air dan minyak (Klayman 1985). Tinjauan oleh Geldre et al. (1997) menyatakan bahwa studi stabilitas termal menunjukkan stabilitas artemisinin sampai 150 OC, tetapi akan terdegradasi menjadi beberapa
produk bila dipanaskan pada 180-200
'c.
Tinjauan oleh Kohler et al. (1997) dan Brown (1994) menyebutkan beberapa metode analisis artemisinin, di antaranya dengan uji kromatografi cair kinerja tinggi dengan deteksi ultra violet dan elektro kimia (HPLC-UVIEC),
kromatografi lapis tipis (TLC), kromatografi gas (GC), enzimatis (enzyme-
immunoassay), resonansi magnetik inti proton dan karbon ('H
-
I3c
NMR), danspektroskopi massa resolusi tinggi (MSIMS). Analisis artemisinin cukup sulit dilakukan karena beberapa faktor. Senyawa ini relatif tidak stabil, kandungan di dalam tanaman rendah, dan senyawa lain di dalam ekstrak kasar dapat
mengganggu pendeteksiannya. Identifikasi dengan TLC tidak dapat diandalkan
gelombang 2 10 nm dalain identifikasi menggunakan HPLC-UV n~enyebabkan
puncak artemisinin tidak tampak (Geldre et al. 1997). .
Perkenlbangan Mctode Isolasi Artemisinin
Berbagai metode isolasi arten~isinin terus diteliti dan dikembangkan. Hal ini
disebabkan kandungan arten~isinin yung rendah dalam tanaman (< 0,13%) (Chan et
al. 1995) sehingga dibutuhkan sumber lain (seperti dari mikroorganisme endofit)
untuk dapat menghasilkan artemisinin dengan rendemen tinggi.
Pada tahun 1972, QACRG melakukan isolasi artemisinin dari A. annua yang
tumbuh di Cina. Kimiawan Cina yang tergabung dalam QACRG tersebut hanya mengatakan bahwa pelarut yang digunakan adalah dietil eter, tanpa menjelaskan prosedurnya dengan rinci.
Klayman et al. (1984) melakukan penelitian secara menyeluruh mengenai
isolasi artemisinin dari A. annua yang tumbuh di Washington, D.C. Pelarut yang
digunakan adalah berbagai pelarut organik bertitik didih rendah, seperti dikloro metana, kloroform, dietil eter, petroleum eter, dan dimetil keton. Hasil seleksi menunjukkan bahwa jenis pelarut petroleum eter (td. 30-60 OC) dinilai paling baik
untuk kepentingan tersebut. Sementara fraksinasi dilakukan dengan metode
kromatografi kolom menggunakan fase gerak 7,5% etil asetatlkloroform. Ekstraksi
daun A. annua menghasilkan 0,06% artemisinin (153-154 OC). Namun metode ini
masih memiliki kelemahan karena artemisinin yang dihasilkan masih terkotori oleh -1 0% artemisiten, sehingga perlu pemurnian lebih lanjut dengan metode HPLC.
Acton et al. (1986) menyarankan penggunaan Ito multilayer coil separator-
extractor untuk fraksinasi dan pemurnian artemisinin. Penggunaan radas Ito ini
diketahui lebih praktis dan ekonomis dibandingkan dengan HPLC. Sementara
ekstraksi dari A. annua yang tumbuh di Silver Spring, MD, Amerika Serikat
!
menghasilkan 0,07% artemisinin murni (1 50-152 OC). Kohler et al. (1997)
melaporkan teknik isolasi terbaru dengan mengekstraksi artemisinin berikut
prekursornya (asam arternisinat) dari A. unnua menggunakan supercritical carbon
Produk Biotransformasi dan Potensi Mikroorganisme Endofit
Beberapa cara sintesis artemisinin telah dilaporkan, namm akibat molekul yang agak kompleks maka senyawa ini tidak mungkin disintesis secara kimia dengan cara
yang murah. Vandenberghe et al. (1995) menambahkan bahwa herba A. annua tetap
merupakan sumber yang praktis bagi senyawa antimalaria ini. Salah satu
pendekatannya ialah meningkatkan kadar atau produktivitas biosintesis artemisinin melalui rekayasa genetika. Hal ini hanya dapat dilakukan apabila proses enzimatik yang mengatur jalur biosintesis artemisinin diketahui, sehingga jalur ini dapat dikendalikan. Prekursor utama seskuiterpena, farnesil pirofosfat, disintesis dari asam mevalonat. Farnesil pirofosfat dapat bersiklikasi menghasilkan antara lain rangka
germakran dan kadinan. Setelah oksidasi, dihasilkan asam artemisinat (asam
artenuat). Telah disarankan oleh Nair dan Basile (1993) bahwa asam artemisinat ini dapat mengalami biokonversi menjadi arteannuin B, dan selanjutnya via artemisiten menjadi artemisinin.
Beberapa galur fungi diketahui berperan dalam hidroksilasi mikrobial senyawa seskuiterpena. Adanya gugus hidroksil tunggal di dalam senyawa artemisinin membatasi jumlah dan macam turunan yang diproduksi. Hidroksilasi mikrobial dapat memungkinkan preparasi senyawa-senyawa baru turunan artemisinin yang lebih beragam dengan aktivitas antimalarianya. Penentuan suatu metode mikrobial yang dapat mengintroduksikan suatu gugus hidroksil ke dalam salah satu metil yang tidak
teraktivasi atau gugus metilen perlu diperhatikan (Ziffer et al. 1992).
Hufford et al. (1995) melaporkan bahwa arteether yang diperoleh dari
. dihidroartemisinin, suatu hasil reduksi artemisinin dengan NaBH4, mengalami
metabolisme oleh mikrooorganisme Cunninghamella elegans ATCC 9245
menghasilkan la-hidroksiarteether dan 9P-hidroksiarteether yang dapat dipisahkan
dari kultur C. elegans, , metabolit dapat dipisahkan dari kultur fermentasi Streptomyces
lavendular L 1 05.
Produksi metabolit sekunder ini dapat dilakukan dengan beberapa cara. Psopagasi kultur miksoorganisme yang potensial dapat dilakukan sehingga diperoleh
besar dan waktu yang lebih singkat. Produksinya dapat pula dilakukan secara langsung, yaitu dengan menyiapkan kultur contoh yang dilanjutkan dengan kultur dalam fermentor.
Beberapa galur mikroorganisme endofit digunakan untuk mengintroduksi gugus
hidroksil ke dalam senyawa artemisinin dan berbagai turunannya. Ziffer et al.
(1992) menggunakan spesies fungi Beauveria sulfurescens dalam proses
biotransformasinya sehingga dihasilkan senyawa intermediet atau prekursor untuk sintesis senyawa turunan lebih lanjut.
Produksi turunan artemisinin melalui hidroksilasi mikrobial pada kondisi preservasi jembatan endoperoksida diperlukan untuk aktivitas antimalaria. Turunan- turunan artemisinin yang terhidroksilasi tersebut dapat digunakan untuk menghasilkan alternatif artemisinin yang berguna. Produk turunan disiapkan dengan
mereduksi lakton menjadi suatu ketal yang memiliki gugus hidroksil (Ziffer et al.
1992). Tinjauan oleh Kawamoto et al. (1998) menyebutkan bahwa spesies fungi
METODOLOGI PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan mulai dari bulan Juni sampai November 2001 di Laboratorium Kilnia Bahan Alam, Laboratorium Fermentasi, dan Laboratorium Pakan, Pusat Penelitian Biotcknologi-LIPI, Cibinong. Analisis spektroskopi infra
merah (IR) dan kromatograti gas spcktrum lnassa (GC-MS) masing-masing dilakukan
di Laboratorium Terpadu-II'B, Bogor dan Laboratorium Pengawasan Doping- Departemen Kesehatan, Jakarta.
Bahan dan Alat
Bahan-bahan yang digunakan adalah isolat beberapa galur fungi endofit (AT 21
dan AT 22) serta bakteri endofit (AT 11 dail AT 12) koleksi Laboratorium Kimia Bahan Alam, medium (xyz, potato dextrose agar (PDA), sabouraud dextrose agar (SDA), nutrient agar (NA)), bahan kimia lain (asam borat, kloroform, n-heksana, etil asetat, metanol, asetonitril, serium sulfat, lcristal ungu, iodin, safranin) silika gel, pasir laut, alkohol, dan akuades.
Alat-alat yang digunakan meliputi shaker, laminar air flow, vorteks, microwave, pH meter, spektrofotometer UV-Vis, IR, instrumen CC, TLC, HPLC, dan GC-MS, mikroskop, otoklaf, neraca analitik, vaccum Jilter, kertas saring, serta peralatan gelas. Sebagai standar digunakan artemisinin produksi Aldrich, Chem. Co., USA.
Metode Penelitian
Penyiapan Contoh Isolat Kultur
Isolat yang diujikan adalah beberapa galur mikroorganisme endofit, yaitu
-
(SDA) miring (untuk fungi) dan nutrient agar (NA) miring (untuk bakteri) dalam tabung reaksi untuk selanjutnya diinkubasi selama tujuh dan dua hari pada suhu ruang. Isolat tersebut ditapis dalam medium xyz untuk selanjutnya disimpan dalanlfreezer sampai waktunya dipergunakan.
Penapisan Contoh Isoiat Kultur
Sebanyak satu lup dari tiap-tiap isolat diinokulasikan ke dalam 20 ml medium xyz dalam tabung reaksi 50 ml secara simplo. Kultur selanjutnya diinkubasi dalam shaker pada 200 rpm, suhu ruang, selama 7-14 hari.
Pengamatan dilakukan setiap hari selama berlangsungnya ferrnentasi, meliputi: (i) penentuan konsentrasi sel bakteri dengan metode turbidimetri pada panjang gelombang 660 nrn, (ii) penentuan biomassa kering sel fungi, (iii) pengukuran pH dengan menggunakan pH meter, dan (iv) pengamatan mikroskopis dengan perbesaran 400 dan 1000 kali.
Isolasi dilakukan dengan mengekstraksi sebanyak tiga kali terhadap f 20
ml contoh fermentasi dengan 15 ml kloroform dan diuapkan. Contoh
diekstraksi dengan cara dihomogenisasi dengan alat vorteks hingga tercampur rata. Lapisan bawah (jernih) yang terbentuk merupakan filtrat yang terdiri atas
kloroform dan campuran metabolit sekunder. Sernentara lapisan atas
merupakan medium yang terekstraksi bersama pelarut. Masing-masing filtrat yang terbentuk dipisahkan dan dilteringkan. Ekstrak kering selanjutnya diuji dengan TLC dan HPLC. Kemurnian produk diuji dengan melakultan purifikasi lebih lanjut dengan menginjeksikan contoh pada instrumen HPLC setelah dilakukan fraksinasi dengan kromatografi kolom.
Contoh isolat yang digunakan merupakan isolat terpilih hasil penapisan
dalain medium xyz, selanjutt~ya digunakan dalam fermentasi dan isolasi produk
Penyiapan Medium Fermcntasi
Medium fermentasi yang digunakan dalam penelitian ini adalah medium
xyz. Inforniasi nicngenai komposisi medium tersebut belum dapat
dipublikasikan. Medium fermentasi disiapkan dalam labu Erlenmeyer berukuran 250 ml dengan volume kerja 100 ml. Bahan-bahan medium tersebut selanjutnya disterilisasi dalam otoklaf pada suhu 1 21°c, 1 atm selama 15 menit. Setelah dingin semua bahan dicampurkan secara aseptis.
Penyiapan Inokulum
Tnokulum disiapkan dengan dua tahapan. Mula-mula biakan disegarkan
pada medium potato dextrose agar (PDA) miring (untuk fungi) dan nutrient
agar (NA) miring (untuk bakteri) dalam tabung reaksi untuk selanjutnya
diinkubasi selama tujuh dan dua hari pada suhu ruang. Selanjutnya, biakan diinokulasikan ke dalam 100 ml medium pembibitan dengan inenggunakan 5 ml air steril. Medium pembibitan dibuat dengan komposisi yang sama dengan
medium fermentasi, Kultur pembibitan selanjutnya dinkubasi dalam shaker
pada 200 rpm dan suhu ruang, selama 24 jam.
Fermentasi Kultur
Sebanyak 10% inokulum dari labu pembibitan diiinokulasikan ke dalam 100 ml medium fermentasi dalam labu Erlenmeyer 250 ml secara duplo. Kultur
selanjutnya dinkubasi dalam shaker pada 200 rpm dan suhu ruang, selama 7-14
hari.
Pengamatan dilakukan setiap hari selama berlangsungnya ferrnentasi, meliputi: (i) penentuan konsentrasi sel bakteri dengan metode turbidimetri pada
panjang gelombang 660 nrn, (ii) penwtuan biomassa kering sel fungi, (iii)
pengukuran pH dengan menggunakm pH meter, dan (iv) pengamatan
mikroskopis dengan perbesaran 400 dan 1000 kali.
Kultur sel terpilih difermentasi kembali dengan peningkatan skala
dilakukan dalam enam labu Erlenmeyer 250 ml dengan tiap-tiap volume kerja 50 ml. Produksi kedua dilakukan secara simplo dalam botol Schott 1000 ml dengan volume kerja 600 nll yang dilengkapi dengan aerator.
Isolasi Produk Iliotransformasi Artcmisinin
Isolasi dilakukan dengan mcngekstraksi sebanyak tiga kali terhadap 5 ml
conto11 fermentasi dengan 5 1111 kloroform dan diuapkan. Contoh diekstraksi
dengan cara dihomogenisasi dengan alat vorteks hingga tercampur rata. Lapisan bawal~ (jernih) yang terbentuk merupakan filtrat yang terdiri atas
kloroform dan campuran metabolit sekunder. Sementara lapisan atas
merupakan medium yang terekstraksi bersama pelarut. Masing-masing filtrat yang terbentuk dipisahkan dan dikeringkan. Ekstrak kering selanjutnya diuji dengan TLC dan HPLC. Kemurnian produk diuji dengan melakukan purifikasi lebih lanjut dengan menginjeksikan contoh pada instrumen HPLC setelah dilakukan fraksinasi dengan kromatografi kolom.
Identifikasi dan Karakterisasi Struktur
Mula-mula ekstrak kering dilarutkan dengan beberapa tetes kloroform. Uji TLC dilakukan dengan menotolkan contoh dan standar pada pelat TLC (silika gel 60 F254), Fase geraknya terdiri atas n-heksana : etil asetat (5:l).
Penanda noda yang digunakan adalah serium sulfat. Hasil uji TLC digunakan
untuk identifikasi dengan uji HPLC. Uji ini menggunakan identifikasi nilai Rf
contoh terhadap standar. Nilai Rf diperoleh berdasarkan perbandingan antara jarak yang ditempuh zat dalam contoh dengan jarak yang ditempuh pelarut.
Uji
TLC
yang menunjukkan adanya noda dengan warna khas dilanjutkandengan uji HPLC. Ekstrak kering dilarutkan dengan 0,5 ml kloroform
kemudian dipekatkan. Sebanyak 10-50 p1 hasil preparasi ini diinjeksikan pada
instrumen HPLC. Fase geraknya terdiri atas bebeiapa sistem yang divariasikan,
yaitu: (i) n-heksana : etil asetat (5:l); (ii) asetonitril : air (1:l); (iii) asetonitril :
yang terdeteksi akan keluar berupa puncak kromatogram dengan waktu retensi
yang dibandingkan dengan standar. Identifikasi produk biotransformasi
artemisinin dan turunannya dilakukan dengan menginterpretasikan data-data
spektrum IR dan kromatogram GC-MS dari artemisinin hasil isolasi dengan
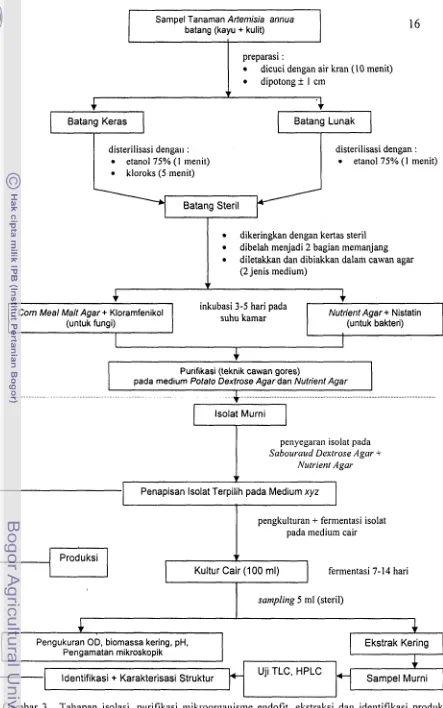
Gambar 3 . Tallapan isolasi, purifikasi mik~.oorganisrne endofit, ekstraksi dan identifikasi produk biotransforlnasi artcmisinin.
Sampel Tanaman Artemisia annua
batang (kayu + kulit)
preparasi :
dicuci dengan air kran (10 menit) dipotong
+
1 cm4
Batang Keras
disterilisasi dengall : etanol 75% (1 menit) kloroks (5 menit)
disterilisasi dengan : etanol 75% (1 menit)
dikeringkan dengan kertas steril dibelah menjadi 2 bagian memanjang diletakkan dan dibiakkan dalam cawan agar (2 jenis medium)
v
4
4
Nutrient Agar + Nistatin (untuk bakteri) Corn Meal Malt Agar + Kloramfenikol
(untuk fungi)
inkubasi 3-5 hari pada suhu kamar
1
4
I
Purifkasi (teknik cawan gores)
pada medium Potato Dextrose Agar dan Nutrient Agar
. . . , . . . . , . . . , . . . , . . . . . , . . . , . . . , , . . , . . . , , . . . . .... .. ... .. ... ... ... . .... . ... ... .... lsolat Murni
I
penyegaran isolat pada
Sabouraud Dextrose Agar + Nutrient Agar
v
Penapisan lsolat Terpil;ih pada Medium xyz
pengkulturan + fermentasi isolat pada medium cair
Produksi v
Kultur Cair (100 ml)
sampling 5 ml (steril)
4 ,
4
fermentasi 7-14 hari
Pengukuran OD, biomassa kering, pH,
Pengamatan mikroskopik Ekstrak Kering
*
4
HASIL DAN BEMBAHASAN
Panapisan Contoh Isolat Kultur
Isolat yang diujikan pada awal percobaah meliputi beberapa galur
mikroorganisme endofit, yaitu fungi AT 21 dan AT 22 serta bakteri AT 11 dan AT
12 koleksi Laboratorium Kimia Bahan Alan, Pusat Penelitian Biotelaologi-LIPI, Cibinong. Di antara keempat galur tersebut, bakteri AT 12 mempunyai profil uji
p r ~ d u k biotransformasi artemisinin yang dinilai paling memadai. Beberapa
parameter yang menentukan antara lain: (i) pertumbuhan sel kultur, (ii) nilai pH selama fermentasi kultur, serta (iii) uji TLC dan HPLC.
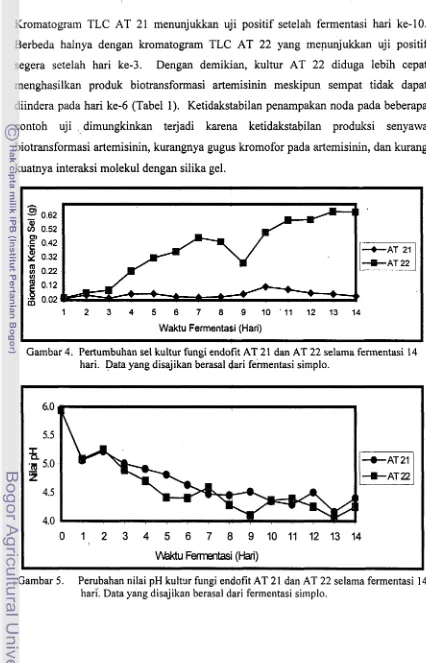
Gambar 4 memperlihatkan bahwa laju pertumbuhan sel kultur fungi AT 22
lebih tinggi dari pada fungi AT 21. Hal ini ditandai dengan bobot biomassa kering
sel AT 22 yang 13 kali lebih besar (0,65 g) dibandingkan AT 21 (0,05 g) setelah
fermentasi berlangsung 14 hari.
Sementara profil pH selama fermentasi 14 hari unt~lk kedua galur tersebut relatif sama seperti tampak pada Gambar 5 dengan kisaran nilai pH 4,Q5-5,93.
Ki~aran tersebut terrnasuk kedalam kisaran pH optimum pertumbuhan (43-53) bagi
fungi (Crueger dan Crueger 1984). Nilai pH kultur pada awal fermentasi mengalami
pemurunan. Pada kultur fungi AT 21 terdeteksi penurunan nilai pH dari 5,93 menjadi
5,06. Demikian pula pada kultur fungi AT 22, nilai pH semula 5 9 3 menjadi 5,08. Produk biotransformasi artemisinin yang terdeteksi pun masih relatif rendah. Diduga, katalisis enzim ekstrasel yang kurang sempwrna mempengaruhi ha1 tersebut. Perlu adanya penambahan buffer ataupun sistem kontrol pH untuk menjaga kisaran nilai
pH. Menurut Judoamidjojo et al. (1989), fluktuasi nilai pH berkaitan dengan
kestabilan pembentukan dall katalisis enzim, fungsi membran dan komponen sel. Tampaknya, nilai pH yang teramati cenderung fluktuatif sehingga mengganggu pertumbuhan sel dan produksi metabolit yang diinginkan (Darwis dan Sukara 1990). Identifikasi produk biotransformasi artemisinin dengan uji TLC menunjukkan
Kromatogram TLC AT 21 menunjukkan uji positif setelah fermentasi hari ke-10.
Berbeda halnya dengan kromatogram TLC AT 22 yang menunjukkan uji positif
segera setelah hari ke-3. Dengan demikian, kultur AT 22 diduga lebih cepat menghasilkan produk biotransformasi arternisinin meskipun sempat tidak dapat diindera pada hari ke-6 (Tabel 1). Ketidakstabilan penampakan noda pada beberapa contoh uji dimungkinkan terjadi karena ketidakstabilan produksi senyawa biotransformasi artemisinin, kurangnya gugus kromofor pada artemisinin, dan kurang kuatnya interaksi molekul dengan silika gel.
h
0.62 0.52 0.42
y 0.32
1
0.22g
0.120.02
1 2 3 4 5 6 7 8 9 1 0 ' 1 1 1 2 1 3 1 4
Waktu Fermentasi (Hari)
Gambar 4. Pertumbuhan sel kultur fungi endofit AT 21 dan AT 22 selama fer~nentasi 14 hari. Data yang disajikan berasal dari fei-mentasi simplo.
6.0
5.5
5
.R 5.0 +AT21
2
4.5
4.0
0 1 2 3 4 5 6 7 8 9 1 0 1 1 1 2 1 3 1 4
[image:111.557.67.493.63.726.2]W u Fermentasi (Hari)
6 7 8 9 10 1 1 12 13 14 Biomassa Filtrat Biomassa Filtrat Biomassa Filtrat Biomassa Filtrat Biomassa ~ i l t r a t -
Biomassa I Filtrat Biomassa Filtrat Biomassa Filtrat Bion~assa Filtrat Biomassa (-1 (-1 (-) (-1 (-1 (-) (-1 (-1 (-) (-1 (+) (-) (+) (-) (+) (+) (+) (+I (+) (+I (-) (+I (+I (+) (+) (+) (+) 2 3 3 4 3 4 1 1 1 1 1 I I coklat (2) ungu coklat ungu coklat (2) ungu (2) coklat ungu (2) coklat (2) ungu (2) coklat ungu (2) kuning (2) 0,28 0,65 0,27 0,59 0,20 0,s 1 0,61 0,28 0,16 0 3 5 0,35 0,28 0,67 0,57 0,25 0,17 0,55 0,34 0,25 0,70 0,53 ungu ungu-hitam ungu-hitam coklat ungu-hitam coklat ungu-hitan~
0 2 5
0,25
Hasil uji HPLC terhadap contoh kultwr fungi endofit menunjukkan bahwa
kromatogram dengan identifikasi positif hanya dijurnpai pada c ~ n t o h biomassa kultur
AT 22 hari ke-4 (Lampiran 1). Pada kromatogram HPLC standar artemisinin terlihat
pita elusi dengan waktu retensi 9,15 menit. Sementara pada kromatogram contoh terlihat dua pita elusi yang saling berdekatan dengan8 waktu retensi masing-masing 9,22 menit dan 10,09 menit. Pita elusi pertarna diidentifikasi sebagai puncak produk biotransformasi artemisinin sedangkan pita elusi kedua diduga sebagai senyawa pengotor ataupun produk dekomposisi.
Berdasarkan hasil perbandingan parameter uji terhadap dua kultur sel bakteri
endofit, yaitu AT 11 dan AT 12 terpilih kdtur AT 12. Fermentasi' pada tahap
penapisan ini berlangsung selama tujuh hari. Profil tingkat pertumbuhan kultur dan nilai pH tidak mengikuti pola kurva pertumbuhan Monod. Fermentasi kultur sel bakteri umumnya berlangsung singkat (54-72 jam), namun pada tahap ini tidak dilakukan sampling pada setiap kurun waktu kritis pembelahan yang biasanya berkisar tiga jam sampai berakhirnya fase logaritmik. Namun diketahui dari profil urnum tingkat pertumbuhan kultur bahwa nilai OD kultur sel AT 12 lebih tinggi
(0,56) dibandingkan nilai OD kultur sel AT 1 1 (0,15) pada saat pemanenan produk di
akhir fermentasi. Sementara profil pH selarna fermentasi untuk kedua galur tersebut
relatif sama. Kisaran pH kultur fermentasi AT 11 adalah 4,80-5,38 sementara kultur
AT 12 memiliki kisaran nilai pH antara 4,34-4,99.
Identifikasi produk biotransformasi artemisinin dengan uji TLC menunjukkan
Hasil uji HPLC terhadap contoh kultur bakteri endofit AT 11 dan AT 12 menunjukkan identifikasi positif (Lampiran 2-5). Pada kromatogram HPLC standar artemisinin terlihat pita elusi dengan waktu retensi 1,0,20 menit, sedangkan pada kromatogram contoh kultur AT 11 hari ke-3 dan hari ke-7 terlihat pita-pita elusi dengan waktu retensi masing-masing 11,55 dan 11,71 menit. Kromatogram contoh kultur AT 12 hari ke-1 dan hari ke-7 memperlihtttkan pita-pita elusi dengan waktu retensi masing-masing 11,36 menit dan 11,42 menit. Produk biotransformasi artemisinin yang dihasilkan oleh kultur AT 12 diduga berkadar lebih tinggi dibandingkan kultur AT 11. Hal ini dapat dilihat dari perbandingan luas puncak keduanya seperti terlihat pada Lampiran 2-5.
Hasil pengamatan mikroskopis dengan perbesaran 1000 kali memperlihatkan bahwa sel vegetatif bakteri basil AT 12 berukuran lebih besar (Gambar 6 ) daripada sel vegetatif bakteri basil AT 11 (Lampiran 6). Hal ini kemungkinan berkaitan dengan kadar enzim ekstrasel yang disekresikan oleh kantung kelenjar sel tersebut dalam memicu pembentukan produk biotransformasi artemisinin.
Karakteristik 1sdat Terpilih
lsolat terpilih yang digunakan dalam fermentasi dan isolasi produk
biotransformasi adalah bakteri endofit galur AT 12. Galur AT 12 sengaja dipilih
dengan beberapa pertimbangan antara lain waktu fermentasi relatif singkat (72 jam), laju pertumbuhan sel kultur relatif tinggi, nilai pH yang cenderung stabil (4,52-5,76),
dan uji positif pada kromatogram TLC dan HPLC untuk menghasilkan produk
biotransformasi artemisinin.
Hasil identifikasi menunjukkan bahwa galur AT 12 merupakan bakteri Gram
positif dengan sel vegetatif berbentuk batang (basil) serta bersifat motil. Pada medium padat, koloninya tarnpak berwarna putih kekuningan dengan permukaan
kasar dan tepian tidak teratur. Galur AT 12 juga memiliki endospora di bagian
subterminal sel seperti tampak pada Gambar 6 berikut.
Gambar 6. Morfologi sel bakteri endofit AT 12 pada perbesaran 1000 kali. Sel
dengan endospora subterminal ditunjukkan di dalam lingkaran.
Fermentasi Kultur Terpilih
Fermentasi kultur terpilih dilakukan dalam sistem batch. Pada sistem ini, setelah medium diinokulasi tidak dili~kukan lagi pengaturan konsentrasi substrat ataupun metabolit-metabolit cair yang dihasilkan selama fermentasi (Stanbury dan Whitaker 1993).
Perigamatan'terhadap pertumbuhan sel kultur bakteri AT 12 dan perubahan pH
memperlihatkan adanya fase lag yang cukup panjang, yaitu berlangsung sampai 15
jam. Hal ini disebabkan karena medium fermentasi tidak dikondisikan pada pH netral
atau pH optimum pertumbuhan. Menurut Stanbury dan Whitaker (1993), fase lag umumnya diusahakan berlangsung sesingkat mungkin. Kondisi medium fermentasi dibuat sedemikian untuk mengetahui kondisi alamiah kultur. Oleh karena itu sel-sel bakteri AT 12 tidak segera membelah dengan cepat sehingga baru memasuki fase logaritmi k setelah jam ke- 15. Pertumbuhan secara eksponensial ini berlangsung hingga jam ke-30. Setelah memasuki jam ke-30, pertumbuhan sel kultur terlihat statis hingga akhir jam ke-58, walaupun cenderung mengalami penurunan segera
setelah jam ke-42. Fermentasi kultur diakhiri setelah berlangsung 72 jam karena
pertumbuhan sel telah terhenti.
Pengamatan terhadap nilai pH selama berlangsungnya fase logaritmik memperlihatkan adanya penurunan, yakni dari 4,9 menjadi 4,6. P e n m a n pH
disebabkan karena proses katabolisme surnber karbon oleh sel AT 12 yang
menyebabkan terakumulasinya asam di dabarn medium. Menurut Benoit et al.
(1990), asam-asam yang terakumulasi dari proses tersebut pada umumnya meliputi asam laktat, asam piruvat, dan asarn asetat.
B
E
'
8
0.8'9 0.6
0.4
.z 0.2 +pH
-
.-2 0 4.5
0 3 6 9 12 15 18 24 30 36 42 48 54 58 72
Waktu Fermentasi (Jam)
Gambar 7. Pertumbuhan sel dan perubahan nildi pH kultdr bakteri endofit AT 12 selama
Pertumbuhan sel kultur AT 12 tampak tidak optimum karena kondisi aerasi
minimum. Menurut Flores el ul. (1997), banyaknya transfer .oksigen ke dalam
medium kultur fermentasi bakteri sejenis mendukung pembentukan spora yang lebih banyak.
Kultur mulai memasuki fase stasioner setelah 24 jam fermentasi. Diduga, bersamaan itu pula sel mengalami sporulasi. Proses ini ditandai dengan terbentuknya
daerah refraktil yang menandakan adanya endospora di bagian subterminal sel AT 12
yang teramati di bawah mikroskop (Gambar 8). Menurut Crueger dan Crueger
(1984), sporulasi dimulai segera setelah medium terbatas. Selain karena keterbatasan nutrisi, proses spomlasi juga dapat dipengaruhi oleh aerasi, suhu, dan pH yang ekstrim (Vandekar dan Dulmage 1982).
Gambar 8. Penampakan daerah refraktil subterminal sel bakteri AT 12 pada kultur
fermentasi jam ke-30.
Nilai pH kultur kembali meningkat selama fase stasioner. Peningkatan nilai pH terjadi karena asam asetat yang terakumulasi dalam medium dimanfaatkan kembali
oleh sel sebagai sumber energi selama sporulasi (Benoit et ul. 1990). Selain itu
Pengaruh Tingkat Pertumbuhan Kultur Terhadap Produksi Senyawa Biotransformasi Artemisinin
Metabolit sekunder umumnya diproduksi pada saat fase pertumbuhan stasioner. Namun diketahui pada kasus tertentu, metabolit sekunder tersebut diproduksi pada akhir fase logaritmik (Crueger dan Crueger 1984). Fenomena di atas dijurnpai pula berdasafkan hasil pengamatan. Diketahui, produk biotransformasi artemisinin mulai
dihasilkan pada kurun akhir fase logaritmik (jam ke-24). Uji
TLC
memperlihatkanadanya noda sejajar senyawa artemisinin standar dimulai pada contoh kultur 24 jam
(Tabel 3). Pembentukan produk metabolisme sekunder umumnya dimulai saat
beberapa sumber nutrisi di dalam medium mulai terbatas. Keterbatasan nutrisi tersebut memungkinkan terakumulasinya suatu enzim induser ataupun proses metabolisme sekunder itu sendiri (Crueger dan Crueger 1984).
Waktu fermentasi yang menunjukkan usia kultur diduga berhubungan dengan
pembentukan dan penyempurnaan kerja enzim ekstrasel. Kerja enzim yang
mensekresikan produk biotransformasi artemisinin tersebut telah dimulai saat memasuki fase lag atau adaptasi. I'crtumbuhan kultur dalam kurun waktu fermentasi singkat akan memaksimalkan katalisis enzirn ekstrasel. Apabila waktu fermentasi diperpanjang maka terjadi penghambatan produk oleh substrat. Selama fermentasi, sumber karbon seperti sukrosa dikonversi menjadi glukosa dan fruktosa oleh katalisis invertase. Terbentuknya glukosa yang diakumulasi secara bertahap dalam jumlah cukup tinggi memungkinkan penghambatan produk biotransformasi artemisinin. Hal ini disebabkan karena kandungan glukosa yang tinggi menyebabkan ketidakstabilan kerja enzim ekstrasel.
Pertumbuhan sel kultur bakteri AT 12 yang tidak optimum pada hasil fermentasi menunjukkan bahwa jumlah sel bakteri endofit tersebut rendah. Ketidakseimbangan antara jumlah sel bakteri endofit dengan substrat mempengaruhi
rendahnya laju produksi senyawa yang diinginkan. Rendahnya populasi sel
Ekstraksi dan Fraksinasi
Ekstraksi kultur terpilih, yaitu bakteri endofit AT 12 (15 ml) dengan kloroform
menghasilkan resin oily berwarna coklat kerkuningan. Rendemen resin oily terbesar
( 17 mg) didapatkan pada contoh kultur fermentasi jam ke-72. Ekstraksi dilakukan
sebanyak tiga kali agar senyawa aktif yang diinginkan terekstrak sempurna di dalam
pelarut kloroform (Houghton dan Raman 1998). Menurut Nur dan Adijuwana
( 1 988), ekstraksi secara bertahap terbukti lebih efektif dari pada ekstraksi tunggal.
Contoh yang telah diekstraksi dengan cara divorteks diinkubasi selama beberapa waktu (kira-kira 20-45 menit) hingga terbentuk lapisan bawah berwarna
jernih. lnkubasi tersebut sekaligus bertujuan untuk penjenuhan. . Penjenuhan
dilakukan untuk menyediakan semacam jernbatan agar terjadi pemindahan selektif
senyawa artemisinin dan turunan sejenisnya ke dalam'fase kloroform (ElSohly et al.
1990). Tahap ini juga bertujuan ilntuk mengurangi jumlah komponen yang akan
difraksinasi dengan kromatografi kolom. Resin oily selanjutnya diuapkan sehingga
diperoleh residu kering fase kloroform oily yang siap difiaksinasi dan diuji TLC.
Fraksinasi dilakukan dengan kromatografi kolom menggunakan sistem gradien elusi. Fase diamnya adalah silika gel 60 (70-230 mesh), sedangkan fase geraknya adalah n-heksana : etil asetat (5: 1 ). Fraksi-fraksi hasil kromatografi kolom diuji
melalui TLC. Fraksi-fraksi dengan nilai Rf sama digabungkan.
Identifikasi Produk Biotransformasi Artemisinin
Tahap ini merupakan uji pendahuluan untuk mengetahui apakah kultur terpilih
(bakteri
AT
12) mengandung produk biotransformasi artemisinin yang dilanjutkandengan uji spektroskopi
IR
dan ujiGC-MS,
dengan pembanding artemisinin standar.Uji TLC
Identifikasi dengan uji TLC didasarkan pada prinsip pemisahan, yaitu perbedaan polaritas antara fase gerak dengan senyawa prpduk biotransforrnasi artemisinin dalam contoh. Senyawa dengan kepolaran tinggi cenderung lebih mudah dipisahkan dari pada senyawa dengan kepolaran rendah. Produk biotransformasi artemisinin n~erupakan senyawa yang kurang polar (non polar) sehingga nilai Rf-nya cukup besar.
Hasil uji TLC terhadap rcsidu fermentasi 72 jam kultur bakteri AT 12 menunjukkan identifikasi positif, yaitu adanya noda sejajar senyawa artemisinin
standar dimulai pada contoh kultur 24 jam (Tabel 3, Lampiran 16). Seluruh
contoh uji men~iliki nilai kisaran Rf yang hampir sama dengan nilai Rf senyawa
artemisinin standar (0,31). Noda $enyawa artemisinin standar berwarna
kuning-jingga sementara noda contoh benvarna ungu. Diduga pula, residu- residu contoh uji masih bercampur dengan senyawa pengotor yang terdapat dalam kultur fermentasi sehingga merniliki penampakan warna yang berbeda dengan senyawa standarnya yang relatif murni. Hasil identifikasi yang positif pada contoh uji hanya memiliki noda tipis. Noda tipis di atas mengindikasikan produk biotransformasi artemisinin yang terkandung dalam contoh uji berkadar rendah. Di antara noda-noda tersebut, yang berintensitas cukup tinggi hanya dijumpai pada kromatogram contoh uji jam ke-24 dan ke-30. Kurun waktu tersebut diketahui merupakan fase akhir logaritmik saat metabolit sekunder mulai dihasilkan dengan titik pertumbuhan kultur sel tertinggi seperti
ditunjukkan pada kurva Gambar 7. Identifikasi dengan TLC diduga kurang
dapat diandalkan karena penampakan noda molekul kurang jelas. Hal ini disebabkan kurangnya gugus kromofor pada artemisinin dan kurang kuatnya interaksi molekul dengan silika gel.
Hasil uji TLC terhadap residu kultur fermentasi 72 jam dengan peningkatan skala menunjukkan bahwa contoh yang diekstraksi memberikan identifikasi positif. Terlihat bahwa dengan menggunakan penanda noda serium sulfat terbentuk noda kuning keunguan yang sejajar atau hampir sejajar dengan senyawa artemisinin standar berwarna kuning-jingga. Nilai Rf contoh hasil
produksi memiliki nilai Rf yang hampir sama dengan standarnya, yakni sekitar
0,2 8. Hasil ini menunjukkan identifikasi positif awal, yaitu senyawa yang
diperoleh diduga produk biotransformasi artemisinin. Namun, noda yang tanlpak setelah serium sulfat disemprotkan cukup tipis. Hal ini menunjukkan pula bahwa senyawa produk biotransformasi artemisinin yang diperoleh
berkadar rendah. Ilasil uji TLC
di
atas digunakan untuk identifikasiselanjutnya, yaitu dengan uji IIPLC.
Uji HI'LC
untuk menganalisis komponen dalam suatu campuran secara kuantitatif pada arah resolusi dan kepekaan yang tinggi (< 50 ng). Penggunaan kolom fase balik (hidrokarbon terikat pada kemasan silika) jenis p-Bondapak C-18 (Waters, Associates) dipilih karena beberapa tinjauan menyebutkan adanya kecocokan untuk analisis sejenis.
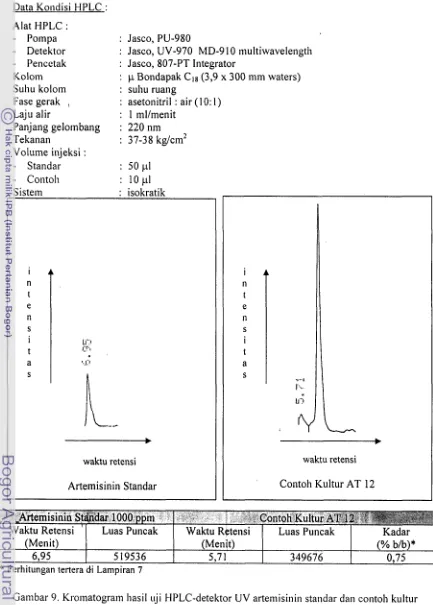
Pada kromatogram HPLC standar artemisinin dan contoh hasil produksi (Gambar 9) terlihat pita elusi dengan waktu retensi masing-masing 6,95 menit dan 5,71 menit. Puncak tersebut diidentifikasi sebagai puncak produk biotransformasi artemisinin.
Kurangnya gugus kromofor pada senyawa artemisinin menyebabkan senyawa tersebut hanya menunjukkan serapan UV pada h I 220
nm.
Pendeteksian artemisinin secara langsung kurang spesifik karena adanya tumpang tindih dengan senyawa lain yang juga menunjukkan serapan pada daerah h 1 220 nrn. Penggunaan deteiktor UV dalam analisis ini sebenarnya memerlukan modifikasi kimia terhadap contoh sebelum dianalisis. Modifikasi ini dimaksudkan untuk mempertajam serapan artemisinin di daerah UV. Selain itu untuk menghindari dekomposisi artemisinin mengingat sifatnya yang kurang stabil terhadap termal (Geldre et al. 1997). I
Pada analisis HPLC, efisiensi beberapa sistem fase gerak sebagai pelarut pengekstraksi juga dibandingkan. Sistem ,fase gerak tersebut adalah: (i) n-
heksana : etil asetat
(5:
1); (ii) asetonitril : air (1: 1); (iii) asetonitril : air (10: 1); (iv) asetonitril : air (1 : 10);
dan(v)
metanol : air (1 0: 1). Sementara fase diamnya berupa kolom y Bondapak C18 3,9x
300 mm (Waters, Associates). Kandungan artemisinin dalam ekstrak sistem fase asetonitril : air (10:l) (0,75% atau sekitar 5,61 ppm) lebih tinggi dibandingkan dengan sistem fase gerak yang lain dengan waktu retensi yang lebih si~gkat, yaitu Rf contoh $7 1 menit dan Rf standar 6,95 menit. Hasil ini menunjukkan bahwa sistem fase gerak asetonitril :I
Waktu Retensi 'I
Luas PuncakI
Waktu RbtensiI
Luas PuncakI
KadarI
Data Kolidisi HPLC :
Alat HPLC :
-
Pompa : Jasco, PU-980-
Detektor : Jasco, UV-970 MD-9 10 multiwavelength-
Pencetak : Jasco, 807-PT IntegratorKolom : p Bondapak C18 (3,9 x 300 mm waters) Suhu kololn : suhu ruang
Fase gerak
,
: asetonitril : air (10: 1) Laju alir : 1 ml/menitPanjang gelo~nbang : 220 nm Tekanan : 37-38 kg/cm2 Volurne injeksi :
-
Standar : 50 pl [image:123.555.71.504.79.684.2]-
Contoll : lop1Gambar 9. Kromatogran~ hasil ilji tlPLC-detektor UV artemisinin standar dan contoh kultur
A'T 12.
Sistem : isokratik
-
I A
(Menit) 6,95 n t e n S I t a S
I A
Lr:l I::?,
I, '
'..I..I n t e n S I t a S
*
Perhitungan tertera di Lampiran 75 19536
h-&
_______,
waktu retensi Artemisinin Standar .I...., ).,.,,. 1.1":~+
waktu retensi Contoh Kultur AT 12
(Menit)
5,71 349676
Identifikasi dan Karakterisasi Struktur
Spektrurn IR
Identifikasi contoh uji hasil produksi (sel bakteri AT 12) dilakukan
dengan membandingkan spektrum IR contoh dengan standar artemisinin
(Lampiran 8). Tabel 4 menyajikan berbagai gugus fungsi dalarn spektrum contoh kultur bakteri AT 12 setelah difraksinasi dan artemisinin standar sebagai senyawa pembanding.
Tabel 4. Identifikasi berbagai gugus fungsi dalam spektrum IR contoh ltultur bakteri
Spektrum IR artemisinin standar memperlihatkan adanya serapan dua
gugus penting dalam molekul artemisinin, yaitu 6-lakton dan endoperoksida (Klayman 1993). Adanya gugus 6-lakton ditunjukkan oleh keberadaan pita- pita serapan uluran C=O dan C - 0 masing-masing pada daerah 1750-1 735 cm-'
dan 1250- 1 1 1 1 cm"
.
Sementara keberadaan gugus endoperoksida dideteksipada pita-pita serapan di daerah 890-830 cm" dan -1 115 cm-l. Cincin sikloheksana berkonformasi kursi diidentifikasi dari adanya serapan di daerah 1055- 1000 cm" dan 1005-925 cm-' (Zheng 1994; Silverstein dan Webster 1998).
Spektrum IR dari contoh kultur bakteri AT 12 memiliki kemiripan dengan
spektrum artemisinin standar. Pita-pita serapan yang banyak muncul di daerah sidik jaris sulit untuk diidentifikasi. Pita-pita tersebut diduga muncul karena adanya senyawa-senyawa lain (senyawa-senyawa pengotor). Temuan oleh
ole11 artemisiten (- 10%). Kedua senyawa tersebut memiliki kemiripan struktur sehingga dapat terkromatografikan bersama.
GC-MS
Contoh untuk spektroskopi massa (MS) berasal dari efluen yang keluar dari kolom kromatografi gas (GC). Efluen yang berupa gas bertekanan rendah (yakni helium) selanjutnya akan memasuki sumber ion untuk difragmentasi
dengan berkas elektron berenergi tinggi (Silverstein et al. 1986). Hasil analisis
contoh dengan uji GC-MS sesuai untuk identifikasi komponen dari suatu campuran.
Pada spektroskopi massa, molekul-molekul ditembak dengan berkas elektron berenergi tinggi dan hasilnya direkam sebagai spektrum dari pecahan- pecahan (fragmen) ion bermuatan positif. Molekul yang ditembak dengan
elelttron berenergi tinggi tersebut menghasilkan suatu ion moleltul
(M.')
ataukation radikal. Ion molekul tidak hanya berupa kation tetapi juga suatu radikal
karena berisi sejumlah elektron ganjil. Ion-ion yang terdeteksi dalam
fragmentasi bermuatan positif yakni ion molekul, ion pecahan, dan kation radikal (Nur 1989).
Hasil kromatografi GC menunjukkan adanya 2 1 puncak dengan waktu
retensi yang relatif sama baik pada kromatogra