ISOLASI DAN IDENTIFIKASI BAKTERI ENDOFIT DALAM BATANG TANAMAN Artemisia Annua L.
YANG DIUJI POTENSI ANTIBAKTERINYA TERHADAP Eschericia coli DAN Staphylococcus aureus
Skripsi
Diajukan Untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi ( S. Farm. )
Program Studi Farmasi
Oleh :
Antonius Alfian Yuan Dias Priharta NIM : 038114064
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
Skripsi ini dipersembahkan untuk : Yesus Kristus
Bapak Bernardinos Dias Sidharta Ibu Caecilia Enita Amarwati
Crezensia Alfiora Dea Dema Dias Oktabenita Felisita Anesti Kusumastuti
Without Love, I’m Nothing . . . .
PRAKATA
Puji dan syukur ke hadirat Tuhan Yesus Kristus yang telah melimpahkan berkat, kesabaran, kekuatan, dan karunia-Nya, sehingga penulis dapat menyelesaikan skripsi ini dengan baik. Skripsi yang penulis susun berjudul ISOLASI DAN IDENTIFIKASI BAKTERI ENDOFIT DALAM BATANG TANAMAN Artemisia Annua L. YANG DIUJI POTENSI ANTIBAKTERINYA TERHADAP Eschericia coli DAN Staphylococcus aureus.
Skripsi ini disusun untuk memenuhi salah satu syarat memperoleh gelar Sarjana Farmasi (S.Farm) Program Studi Farmasi, Fakultas Farmasi Universitas Sanata Dharma Yogyakarta. Pada kesempatan ini tidak lupa penulis mengucapkan banyak terimakasih kepada :
1. Tuhan Yesus Kristus yang telah memberi rahmat dan berkat-Nya serta perlindungan dan bimbingan-Nya pada setiap umat-Nya.
2. Bapak, Ibu, dan adik Dhea atas doa, kasih sayang, perhatian, dan dukungannya baik moril maupun materiil yang selalu diberikan padaku.
3. Ibu Maria Dwi Budi Jumpowati, S.Si., selaku dosen pembimbing utama yang telah memberikan bimbingan, pengarahan, waktu, kesabaran, dan saran hingga skripsi ini dapat tersusun.
4. Ibu Yustina Sri Hartini, M.Si., Apt., selaku dosen penguji yang telah banyak memberikan saran dan masukan kepada penulis.
5. Bapak Ign. Y. Kristio Budiasmoro, M.Si., selaku dosen penguji yang telah banyak memberikan saran dan masukan kepada penulis.
6. Pihak BPTO Tawangmangu, terutama Bapak Agus. Terimakasih telah
membantu dalam pengadaan dan determinasi tanaman Artemisia annua L. 7. Eyang Putri beserta keluarga besar di Klaten, terimakasih atas doa, perhatian,
kasih sayang, nasehat, dan dukungan untukku.
8. Pakdhe dan Budhe beserta keluarga, terutama Budhe Erlin, terimakasih atas perhatian, nasehat, dan dukungan untukku.
9. Felisita, terimakasih untuk doa, perhatian, cinta, kesabaran, serta dukungan yang sangat berkesan untukku.
10.Pak Kartatmo, Pak Mukmin, Mas Narto selaku Staff Sekretariat Fakultas Farmasi Universitas Sanata Dharma, terimakasih telah membantu dalam memperlancar administrasi hingga tersusunnya skripsi ini.
11.Mas Sarwanto, Mas Sigit, Mas Wagiran selaku Laboran Laboratorium Biologi Farmasi, terimakasih atas semua bantuannya selama ini.
12.Teman-teman kelompok C 2003 : Anien, Siska, Eveline, Hartono, Komang, Indhu, Devi, Titien, Ratna, Yulia, Madya, Punto, Esti, Tata, Budi, Rosa, Vera, Ratih, dan Maria. Terimakasih atas kerjasama dan kebersamaannya selama ini. Che 03 Never Die...
13.Anak-anak kontrakan : Abang Aan, Hengky, Manto, Irwan, Ndaroe, Topan, dll. Thanks untuk kebersamaaannya. Keep the Spirit..
14.Anak-anak No Label cabang Teknik Sipil Atma Jaya, thanks untuk kebersamaaannya. Tetap semangat mengejar wanita sampai Nirwana..
15.Teman-teman KKN USD XXXIII Gantiwarno Kelompok 29 : Mbak Non (PBI), Valent (MIPA), Melinda (Psi), Sandra (S.Ing), Ika (P.Mat), Dika (IKOM), Punto (PBI), dan Bu Parlan selaku Ibu Pondokan, terimakasih atas
bantuan, dukungan dan kebersamaannya selama ini.
16.Lukas Eko, teman skripsi Rosa, dan Bayu (PBI), terimakasih atas kerjasama, bantuan, dan kebersamaannya selama ini.
17.Yoyok, thanks telah membawakan tanaman Artemisia annua L. dari Tawangmangu sampai ke Jogja.
18.Teman-teman angkatan 2003 yang tidak mungkin saya sebutkan satu persatu, terimakasih atas kebersamaannya selama ini.
19.Semua pihak yang telah membantu dan mendukung penulis hingga tersusunnya skripsi ini.
Penulis sangat menyadari bahwa dalam skripsi ini masih banyak terdapat kesalahan dan kekurangan, oleh karena itu saran dan kritik yang sifatnya membangun sangat penulis harapkan demi kesempurnaan penulisan ini.
Akhirnya penulis berharap semoga skripsi ini bermanfaat bagi pengembangan ilmu farmasi pada khususnya dan kemajuan ilmu pengetahuan pada umumnya.
Yogyakarta, 21 November 2007 Hormat penulis
Antonius Alfian Yuan Dias Priharta
INTISARI
Tanaman Artemisia annua L.merupakan tanaman yang digunakan sebagai obat anti malaria. Pada tanaman A.annua L ini diketahui ada mikrobia endofit yang membentuk koloni dalam jaringan pada daerah batang sampai akar (Simanjuntak dkk, 2004). Mikrobia endofit tumbuh di jaringan vaskular dari tanaman inangnya (Stone et al, 2000). Mikrobia endofit diketahui dapat memperbaiki pertumbuhan tanaman karena kemampuannya menekan pertumbuhan mikrobia-mikrobia patogen dengan cara kompetisi, menghasilkan senyawa antibiotik, atau menginduksi ketahanan tanaman (Pudaritadesantamaria, 2004).
Tujuan penelitian ini adalah mengetahui adanya isolat bakteri endofit dalam batang tanaman A.annua L., menguji potensi antibakteri dari isolat bakteri endofit tersebut terhadap bakteri Eschericia coli dan Staphylococcus aureus serta mengetahui identitas bakteri endofit penghasil senyawa antibakteri tersebut.
Penelitian ini merupakan penelitian eksperimental murni dan bersifat eksploratif-deskriptif. Isolasi bakteri endofit dari batang tanaman A.annua L. dilakukan dengan metode streak plate, potensi antibakteri diuji dengan metode
paper disc. Identifikasi bakteri endofit dilakukan dengan pengamatan morfologi
koloni, morfologi sel, dan uji biokimia.
Hasil dari penelitian ini adalah senyawa antibakteri yang dihasilkan bakteri endofit yang diisolasi dari tanaman A.annua L. mempunyai potensi antibakteri terhadap bakteri Eschericia coli dan Staphylococcus aureus, serta diketahui identitas bakteri endofit penghasil senyawa antibakteri tersebut adalah genus
Amphibacillus.
Kata kunci : Bakteri endofit, zona hambat, Artemisia annua L.,Eschericia coli,
Staphylococcus aureus, Amphibacillus.
ABSTRACT
Artemisia annua. L. is a plant which is used as antimalaria. At this
A.annua. L. is known that is endophytic mikrobia forming colony in tissue at stem
area until root (Simanjuntak et al, 2004). Endophytic mikrobia grew in vascular tissue from the plant (Stone et al, 2000). Endophytic microbia can fix up the development of the plant because its ability to suppress the pathogenic development in survival way, producing antibiotic compounds, or inducting the vurnability of the plant (Pudaritadesantamaria, 2004).
The purpose of this research was to find the endophytic bacteria isolate toward Eschericia coli and Staphylococcus aureus, and to find the identity of the endophytic bacteria which produced this antibacteria compounds.
This result was pure experimental research and it was an explorative descriptive research. The endophytic bacteria isolation from A.annua. L.’s stem was used streak plate method, the antibacterial potential was tested using paper
disc method. The identification of endophytic bacteria was using colony
morphology observation, cell morphology, and biochemical test.
The result of this research were an antibacterial compounds which was produced by endophytic bacteria was isolated from A.annua. L, had the potential antibacteria to E.coli and S.aureus, and it was known that the identity of the endophytic bacteria which produced this antibacteria compounds was
Amphibacillus.
Key words : endophytic bacteria, inhibition zone, Artemisia annua L.,
Eschericia coli, Staphylococcus aureus, Amphibacillus.
DAFTAR ISI
Halaman Judul... ii
Halaman Persetujuan Pembimbing... iii
Halaman Pengesahan... iv
Halaman Persembahan... v
Prakata... vi
Pernyataan Keaslian Karya... ix
Intisari... x
Abstract... xi
Daftar Isi... xii
Daftar Tabel... xvi
Daftar Gambar... xvii
Daftar Lampiran... xviii
BAB I. PENDAHULUAN A. Latar Belakang... 1
1. Permasalahan... 3
2. Keaslian Penelitian... 3
3. Manfaat Penelitian... 4
B. Tujuan Penelitian... 4
BAB II. PENELAAHAN PUSTAKA A. Antibiotik... 5
B. Mikrobia Endofit... 7
C. Artemisia annua L. ... 10
D. Rekombinasi Genetik... 12
E. Bakteri Uji... 14
F. Metode Pengujian Potensi Senyawa Antimikrobia... 16
G. Identifikasi Mikrobia... 18
H. Keterangan Empiris... 21
BAB III. METODOLOGI PENELITIAN A. Jenis dan Rancangan Penelitian... 23
B. Variabel dan Definisi Operasional... 23
C. Bahan dan Alat Penelitian... 25
D. Tahapan Penelitian... 28
1. Determinasi tanaman Artemisia annua L. ... 28
2. Pengumpulan batang Artemisia annua L. ... 28
3. Pembuatan MS Medium (Murashige-Shoog Medium)... 28
4. Disinfeksi Batang Artemisia annua L. ... 31
5. Penanaman Batang Artemisia annua L. pada MS Medium... 31
6. Isolasi Bakteri Endofit dengan Metode Streak Plate... 32
7. Pengujian Potensi Antibakteri dari Isolat Bakteri Endofit Terhadap E.coli dan S.aureus Secara Difusi Paper disc... 32
8. Identifikasi Bakteri Endofit... 33
E. Analisis Hasil... 40
BAB IV. HASIL PENELITIAN DAN PEMBAHASAN 1. Determinasi Tanaman Artemisia annua L. ... 43
2. Pengumpulan Batang Tanaman Artemisia annua L. ... 43
3. Pembuatan MS Medium (Murashige-Shoog Medium)... 44
4. Disinfeksi Batang Tanaman Artemisia annua L. ... 46
5. Penanaman Batang Artemisia annua L. pada MS Medium... 47
6. Isolasi Bakteri Endofit dengan Metode Streak Plate... 49
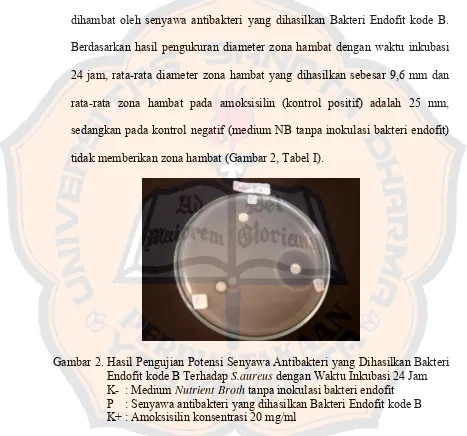
7. Pengujian Potensi Antibakteri dari Senyawa Antibakteri yang Dihasilkan Isolat Bakteri Endofit kode B dan kode D Terhadap S.aureus dan E.coli Secara Difusi Paper disc... 52
8. Pengujian Potensi Antibakteri dari Senyawa Antibakteri yang Dihasilkan Isolat Bakteri Endofit dengan Bakteri Uji S.aureus... 54
9. Pengujian Potensi Antibakteri dari Senyawa Antibakteri yang Dihasilkan Isolat Bakteri Endofit dengan Bakteri Uji E.coli... 59
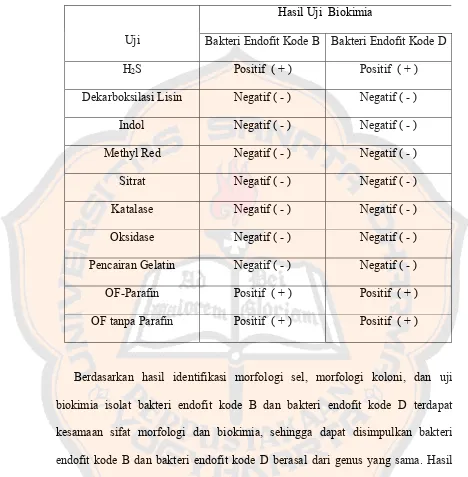
10. Identifikasi Bakteri Endofit kode B dan Bakteri Endofit kode D... 63
a. Pengamatan Morfologi Sel Isolat Bakteri Endofit kode B dan Bakteri Endofit kode D... 64
b. Pengamatan Morfologi Koloni Isolat Bakteri Endofit kode B dan Bakteri Endofit kode D... 71
c. Uji Biokimia... 73
BAB V. KESIMPULAN DAN SARAN
A. Kesimpulan... 85
B. Saran... 85
DAFTAR PUSTAKA... 86
LAMPIRAN... 90
BIOGRAFI PENULIS... 102
DAFTAR TABEL
Tabel I. Hasil Pengukuran Diameter Zona Hambat dari Senyawa Antibakteri yang Dihasilkan Bakteri Endofit kode B Terhadap
S.aureus dengan Waktu Inkubasi 24 Jam... 56 Tabel II. Hasil Pengukuran Diameter Zona Hambat dari Senyawa
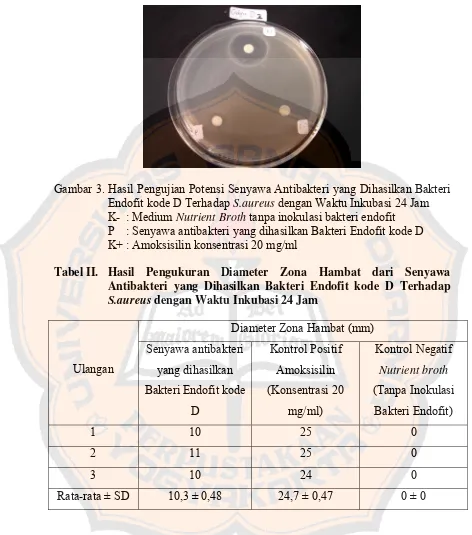
Antibakteri yang Dihasilkan Bakteri Endofit kode D Terhadap
S.aureus dengan Waktu Inkubasi 24 Jam... 57 Tabel III. Hasil Pengukuran Diameter Zona Hambat dari Senyawa
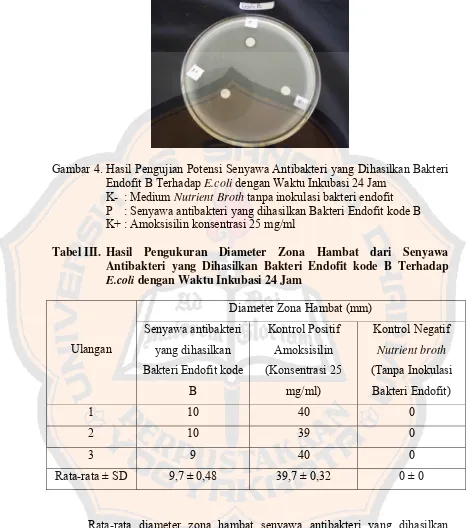
Antibakteri yang Dihasilkan Bakteri Endofit kode B Terhadap
E.coli dengan Waktu Inkubasi 24 Jam ... 60 Tabel IV. Hasil Pengukuran Diameter Zona Hambat dari Senyawa
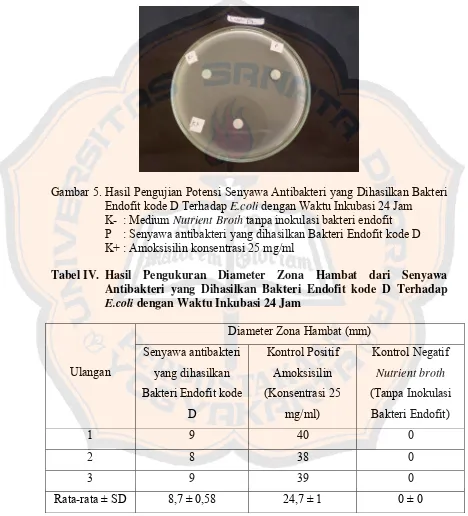
Antibakteri yang Dihasilkan Bakteri Endofit kode D Terhadap
E.coli dengan Waktu Inkubasi 24 Jam ... 61 Tabel V. Hasil Uji Biokimia Bakteri Endofit kode B dan Bakteri Endofit
kode D... 82 Tabel VI. Hasil Identifikasi Bakteri Endofit kode B, Bakteri Endofit kode D,
dan Bakteri Genus Amphibacillus ... 84
DAFTAR GAMBAR
Gambar 1. Skema Kerja Penelitian ... 42
Gambar 2. Hasil Pengujian Potensi Senyawa Antibakteri yang Dihasilkan Bakteri Endofit kode B Terhadap S.aureus dengan Waktu Inkubasi 24 Jam ... 55
Gambar 3. Hasil Pengujian Potensi Senyawa Antibakteri yang Dihasilkan Bakteri Endofit kode D Terhadap S.aureus dengan Waktu Inkubasi 24 Jam ... 57
Gambar 4. Hasil Pengujian Potensi Senyawa Antibakteri yang Dihasilkan Bakteri Endofit kode B Terhadap E.coli dengan Waktu Inkubasi 24 Jam ... 60
Gambar 5. Hasil Pengujian Potensi Senyawa Antibakteri yang Dihasilkan Bakteri Endofit kode D Terhadap E.coli dengan Waktu Inkubasi 24 Jam ... 61
Gambar 6. Pengecatan Gram Isolat Bakteri Endofit kode B ... 65
Gambar 7. Pengecatan Gram Isolat Bakteri Endofit kode D ... 66
Gambar 8. Pengecatan Spora Isolat Bakteri Endofit kode B ... 67
Gambar 9. Pengecatan Spora Isolat Bakteri Endofit kode D ... 68
Gambar 10. Pengecatan Acid Fast Isolat Bakteri Endofit kode B ... 69
Gambar 11. Pengecatan Acid Fast Isolat Bakteri Endofit kode D ... 70
DAFTAR LAMPIRAN
Lampiran 1. Surat Keterangan Determinasi Tanaman A.annua L... 90
Lampiran 2. Tanaman A.annua L... 92
Lampiran 3. Isolasi Bakteri Endofit pada MS Medium dengan Waktu Inkubasi 3 hari ... 92
Lampiran 4. Isolasi Kembali Bakteri Endofit dengan Metode Streak Platting dengan Waktu Inkubasi 24 Jam ... 93
Lampiran 5. Hasil Uji Motilitas Bakteri Endofit kode B dan Bakteri Endofit kode D pada Medium Semi Solid ... 93
Lampiran 6. Hasil Uji Morfologi Koloni Bakteri Endofit kode B dan Bakteri Endofit kode D pada Nutrient Broth ... 94
Lampiran 7. Hasil Uji Morfologi Koloni Bakteri Endofit kode B dan Bakteri Endofit kode D pada Nutrient Agar Tegak ... 94
Lampiran 8. Hasil Uji Morfologi Koloni Bakteri Endofit kode B dan Bakteri Endofit kode D pada Nutrien Agar Miring ... 95
Lampiran 9. Hasil Uji Asam sulfida (H2S) ... 95
Lampiran 10. Hasil Uji Dekarboksilasi Lisin ... 96
Lampiran 11. Hasil Uji Indol ... 97
Lampiran 12. Hasil Uji Methylen Red (MR) ... 97
Lampiran 13. Hasil Uji Sitrat ... 98
Lampiran 14. Hasil Uji Katalase ... 99
Lampiran 15. Hasil Uji Oksidase ... 99
Lampiran 16. Hasil Uji Gelatin ... 100 Lampiran 17. Hasil Uji Oksidasi-Fermentasi (OF) tanpa Paraffin ... 100 Lampiran 18. Hasil Uji Oksidasi-Fermentasi (OF) dengan Paraffin ... 101
BAB I PENDAHULUAN
A. Latar Belakang
Antibiotik merupakan substansi yang dihasilkan oleh mikrobia yang dalam konsentrasi rendah mampu menghambat pertumbuhan atau membunuh mikrobia lain. Setiap antibiotika mempunyai aktivitas penghambatan hanya terhadap kelompok mikrobia tertentu yang disebut spektrum penghambatan (Suwandi, 1989)
Pada tanaman A.annua L ini diketahui bahwa ada mikrobia endofit yang membentuk koloni dalam jaringan pada daerah batang sampai akar, dari hasil identifikasi diketahui bahwa mikrobia tersebut adalah Bacillus polymixa
(Simanjuntak, Bustanusallam, Malini, Otovina, Rahayuningsih, & Said, 2004).
Bacillus polymixa termasuk dalam genus Bacillus yang mempunyai ciri sel
berbentuk batang, gram positif, fakultatif anaerob, membentuk endospora, motil, dan bersifat katalase positif (Holt, Krieg, Sneath, Staley, & Williams, 2000).
(Tan & Zou, 2001). Kemampuan mikrobia endofit memproduksi metabolit sekunder yang sesuai dengan tanaman inangnya merupakan peluang yang sangat besar dan dapat diandalkan untuk memproduksi metabolit sekunder dari mikrobia endofit yang diisolasi dari tanaman inangnya tersebut (Radji, 2005). Bakteri endofit Bacillus polymixa hasil isolasi dari tanaman A.annua L., dapat memproduksi metabolit artemisinin yang sangat potensial sebagai anti malaria (Simanjuntak, dkk, 2004).
Pada isolasi mikrobia endofit, diperlukan media yang dapat menyokong pertumbuhan tanaman inang bakteri endofit (Mucciarelli, Scannerini, Bertea, & Maffei, 2001). Media Murashige-Skoog (MS) merupakan media yang digunakan untuk hampir semua macam tanaman karena mengandung konsentrasi garam-garam mineral yang tinggi dan senyawa N dalam bentuk NO3- dan NH4+ (Hendaryono,1994).
Staphylococcus aureus dapat menghemolisis darah dan mengkoagulasi
plasma, juga menginfeksi bisul, impetigo, dan infeksi luka yang menimbulkan nanah. Eschericia coli dapat menyebabkan infeksi saluran kemih, terjadinya diare, sepsis, dan meningitis. (Jawetz, Melnick, & Adelberg, 1996). S.aureus (gram positif) dan E.coli (gram negatif) dipilih untuk mengetahui keefektifan potensi antibakteri dari senyawa yang dihasilkan oleh bakteri endofit terhadap bakteri gram positif dan gram negatif, sehingga dapat diketahui spektrum penghambatan dari senyawa antibakteri tersebut.
Jan G. Bruhn dan Lars Bohlin pada tahun 1997 memperkenalkan
pengetahuan molekuler yang menyelidiki hubungan struktur dan aktifitas dari bahan-bahan alam dengan potensinya sebagai obat. Bahan-bahan alam yang berpotensi sebagai obat dapat menjadi model atau prekursor dalam penemuan obat baru (Samuelsson, 1999). Untuk memperoleh antibiotik baru perlu dilakukan pencarian sumber penghasil antibiotik (Suwandi, 1989). Oleh karena itu, eksplorasi mikrobia endofit potensial merupakan alternatif untuk mendapatkan senyawa antibiotik baru. (Simanjuntak, dkk, 2004).
1. Permasalahan
Dari latar belakang yang telah diuraikan di atas, permasalahan yang muncul dalam penelitian ini adalah :
a. Apakah bakteri endofit dapat diisolasi dari batang A.annua L. ?
b. Apakah senyawa yang dihasilkan bakteri endofit yang diisolasi dari batang
A.annua L.mempunyai potensi antibakteri terhadap E.coli dan S.aureus ?
c. Bagaimana identitas bakteri endofit penghasil senyawa antibakteri terhadap E.coli dan S.aureus tersebut ?
2. Keaslian Penelitian
menggunakan bakteri uji Bacillus subtilis dan Salmonella thypii. 3. Manfaat penelitian
a. Manfaat teoritis
Penelitian ini diharapkan dapat memberikan informasi tentang senyawa yang dihasilkan bakteri endofit yang diisolasi dalam batang
A.annua L. yang memiliki potensi antibakteri.
b. Manfaat praktis
Penelitian ini diharapkan dapat menemukan isolat bakteri endofit penghasil senyawa antibakteri yang dapat mendukung bidang kefarmasian dan mampu memberikan informasi tentang senyawa antibakteri yang dihasilkan oleh bakteri endofit sebagai model atau prekursor dalam rangka penemuan obat baru di masa yang akan datang.
c. Manfaat metodologis
Metode yang digunakan dalam penelitian ini dapat digunakan dan terus dikembangkan dalam usaha pencarian bakteri endofit penghasil senyawa antibakteri.
B. Tujuan Penelitian Penelitian ini bertujuan untuk:
1. Mengisolasi bakteri endofit dalam batang A.annua L.
2. Menguji potensi senyawa yang dihasilkan bakteri endofit yang diisolasi dari batang A.annua L. terhadap E.coli dan S.aureus.
3. Mengetahui identitas bakteri endofit penghasil senyawa antibakteri terhadap
BAB II
PENELAAHAN PUSTAKA
A. Antibiotik
Antibiotik didefinisikan sebagai produk metabolit yang dihasilkan oleh organisme tertentu, yang dalam konsentrasi rendah bersifat merusak atau menghambat mikrobia lain. Dengan kata lain, antibiotik merupakan zat kimia yang dihasilkan oleh suatu mikrobia yang dapat menghambat mikrobia lain (Pelczar & Chan, 1988)
Antibiotik adalah zat-zat kimia yang dihasilkan oleh fungi dan bakteri, yang mempunyai khasiat mematikan atau menghambat pertumbuhan mikrobia, sedangkan toksisitasnya bagi manusia relatif kecil. Turunan zat tersebut yang dibuat secara semi-sintetis termasuk kelompok ini, begitu pula senyawa sintesis dengan khasiat antibakteri lazimnya disebut antibiotik (Pelczar & Chan, 1988).
Resistensi mikrobia terhadap antibiotika akibat perubahan permeabilitas dapat terjadi akibat perubahan pada reseptor obat, penurunan kapasitas transpor obat dan perubahan struktur dinding sel. Mekanisme ini merupakan mekanisme tersering dalam hal resistensi terhadap tetrasiklin dan sulfonamida. Resistensi bakteri karena modifikasi obat secara enzimatik banyak ditemukan terhadap antibiotika beta-laktam, kloramfenikol dan aminoglikosida. Enzim-enzim yang memodifikasi antibiotika tersebut dapat disandi oleh gen kromosom maupun gen ekstrakromosom, misalnya pada Staphylococcus yang resisten terhadap penisilin G, menghasilkan β laktamase yang merusak obat tersebut (Jawetz dkk, 1996). Resistensi bakteri terhadap antibiotika karena perubahan reseptor dapat ditemukan pada resistensi terhadap streptomisin. Telah diketahui bahwa pada bakteri yang resisten, ribosomnya berbeda dibandingkan dengan bakteri yang sensitif terhadap streptomisin. Hal ini disebabkan terjadinya mutasi noktah satu asam amino pada ribosom 30S. Dampak klinis resistensi tipe ini tidak begitu penting karena sifatnya tidak menyebar. Contoh lain resistensi jenis ini adalah resistensi terhadap penisilin pada bakteri Neisseria gonorrhoeae sebagai akibat perubahan pada penicillin
binding protein (PBP) (Sjahrurachman, 1996).
dimodifikasi untuk menghasilkan senyawa dengan efek farmakologis yang diinginkan (Samuelsson, 1999).
B. Mikrobia Endofit
Mikrobia endofit adalah mikrobia yang hidup di dalam jaringan tanaman pada periode tertentu dan mampu hidup dengan membentuk koloni dalam jaringan tanaman tanpa membahayakan inangnya (Radji, 2005). Mikrobia endofit tumbuh di jaringan vaskular dari tanaman inangnya (Stone et al, 2000). Jaringan vaskular (pembuluh) terdapat di seluruh tubuh tanaman, mengangkut zat-zat antara akar dan tunas (Campbell, Reece, Mitchell, 2002). Setiap tanaman tingkat tinggi dapat mengandung beberapa mikrobia endofit yang mampu menghasilkan senyawa biologi atau metabolit sekunder yang diduga sebagai akibat transfer genetik
(genetic recombination) dari tanaman inangnya ke dalam mikrobia endofit (Tan &
Zou, 2001).
aslinya untuk diambil sebagai simplisia, yang kemungkinan memerlukan waktu yang relatif lama untuk dipanen (Radji, 2005).
Mikrobia endofit meningkatkan adaptasi ekologi inangnya dengan menaikkan toleransi mereka pada “stress” lingkungan (lingkungan yang kurang menguntungkan) dan juga menaikkan resistensi inangnya terhadap fitopatogen dan atau herbivora termasuk serangga yang memakan tanaman inang. Mikrobia endofit juga dapat melindungi inangnya dari serangan bakteri atau fungi patogen dari lingkungan disekitarnya (Tan & Zou, 2001).
Berbagai jenis mikrobia endofit telah berhasil diisolasi dari tanaman inangnya, dan telah berhasil dibiakkan dalam medium pembenihan yang sesuai. Demikian pula metabolit sekunder yang diproduksi oleh mikrobia endofit tersebut dapat diisolasi dan dimurnikan serta dielusidasi struktur molekulnya (Radji, 2005).
dihasilkan oleh endofit Streptomyces spp. strain NRRL 30562 yang merupakan endofit yang diisolasi dari tanaman Kennedia nigriscans, dapat menghambat pertumbuhan Bacillus anthracis dan Mycobacterium tuberculosis yang multiresisten terhadap berbagai obat anti TBC (Castillo et al, 2002).
Ditinjau dari hubungan tersebut, mikrobia endofit berpotensi untuk digunakan pada pengobatan modern, pertanian, dan industri. Fungi dan bakteri adalah mikrobia yang paling umum membentuk koloni pada jaringan tanaman, yang selanjutnya disebut mikrobia endofit (Strobel & Daisy, 2003). Endofit umumnya tidak ditemukan pada organ yang spesifik tetapi kebanyakan spesies mikrobia endofit diisolasi dari batang dan juga dari daun (Anonim, 2005).
Untuk mengidentifikasi suatu jenis mikrobia perlu dilakukan isolasi untuk memperoleh biakan murni. Menurut Pelczar & Chan (1986) setiap koloni yang berlainan mewakili macam mikrobia yang berbeda sehingga hal ini dapat digunakan untuk melakukan isolasi suatu mikrobia. Untuk mengisolasi mikrobia di bawah kondisi laboratorium perlu disediakan nutrien dan kondisi fisik yang akan memenuhi persyaratan tipe mikrobia tertentu yang sedang ditelaah. Sejalan dengan hal tersebut, berbagai macam medium digunakan di dalam mikrobiologi, dikombinasikan dengan berbagai kondisi fisik untuk inkubasi (Pelczar & Chan, 1986).
hanya dapat diteliti dengan menggoreskan secara hati- hati permukaan jaringan yang telah dibersihkan dengan etanol dan NaOCl (pemutih). Penambahan dan waktu untuk pencelupan dalam NaOCl beragam sesuai dengan jaringan dari inang (Anonim, 2005).
Mikrobia endofit dapat diisolasi dari permukaan jaringan tanaman yang telah dibersihkan dan ditumbuhkan pada medium pertumbuhan yang sesuai. Pada isolasi mikrobia endofit, diperlukan medium yang dapat menyokong pertumbuhan tanaman inang bakteri endofit (Mucciarelli, Scannerini, Bertea, & Maffei, 2001). Medium Murashige-Skoog (MS) merupakan medium yang digunakan untuk hampir semua macam tanaman karena mengandung konsentrasi garam-garam mineral yang tinggi dan senyawa N dalam bentuk NO3- dan NH4+ (Hendaryono,
1994). Jaringan tanaman yang dikultur memerlukan unsur hara makro dan unsur hara mikro dari dalam medium tumbuh, dari dalam medium kultur juga harus ada bahan-bahan lain yang berguna untuk merangsang pertumbuhan serta perkembangan sel jaringan yang dikulturkan. Pemisahan eksplan dari tanaman induk menyebabkan perubahan biosintesa dalam tanaman tersebut, sehingga pemberian unsur hara kedalam medium kultur untuk membantu eksplan supaya dapat tumbuh dan berkembang. Bahan-bahan itu adalah bahan organik yang meliputi karbohidrat, vitamin, asam amino, serta zat yang mengatur pertumbuhan (Katuuk, 1989)
C. Artemisia annua L.
Anuma (Jawa) (Anonim, 1999)
Tanaman A.annua L. merupakan terna semusim, tinggi 30–100 cm. Batang tegak, bulat persegi, berwarna hijau kecoklatan. Daun majemuk, bentuk oval, lonjong, panjang 10-18 cm, lebar 6-15 cm, ujung runcing, pangkal tumpul, anak daun bentuk oval, tepi bergerigi, pertulangan daun tegas, warna ungu kehijauan, hijau. Bunga majemuk, bentuk tandan, terletak di ujung batang, panjang mencapai 30 cm, kelopak hijau, bentuk bintang, berlekuk lima, mahkota halus mengelilingi cawan bunga tempat benang sari dan putik, diameter 2-3 mm, warna putih gading. Biji berbentuk lanset, kecil, berwarna coklat. Akar serabut, berwarna putih kekuningan. Bagian daun dari tanaman A.annua L. biasa digunakan sebagai obat demam (anti piretik) dan dapat juga digunakan sebagai obat anti malaria. Kandungan kimia dari tanaman A.annua L. yaitu saponin, flavonoida, polifenol, dan minyak atsiri (Anonim, 1999).
A.annua L. adalah tumbuhan obat berupa perdu berasal dari Cina. Di
Cina tumbuhan ini disebut qinghao. Di Amerika Serikat tumbuhan ini dikenal dengan nama sweet annie atau wormwood. Sejak zaman dulu, menurut catatan
“Chinese Handbook of Prescriptions for Emergency Treatments,” yang dicetak
tahun 340 sebelum Masehi, orang Cina menggunakannya untuk mengobati demam (Anonim, 2005).
artemisia ketone (3%) (Juteau, Masotti, Bessiere, Dherbomez, & Viano, 2002). Minyak tersebut merupakan metabolit sekunder yang kaya akan senyawa terpenoid. Contoh umum terpenoid adalah methanol, camphor (monoterpen),
famesol, dan artemisinin (sesquiterpenoid). Artemisinin dan derivatifnya alpha-arteether digunakan sebagai antimalaria. Terpen atau terpenoid aktif terhadap bakteri, fungi, virus, dan protozoa. Mekanisme kerja terpen belum diketahui dengan baik dan dispekulasi terlibat dalam perusakan membran sel oleh senyawa lipofilik (Anonim, 2005). Pada tanaman A.annua L ini diketahui bahwa ada mikrobia endofit yang membentuk koloni dalam jaringan pada daerah batang sampai akar, dari hasil identifikasi diketahui bahwa mikrobia tersebut adalah
Bacillus polymixa (Simanjuntak dkk, 2004). Mikrobia endofit dapat memproduksi
senyawa metabolit sekunder sesuai dengan tanaman inangnya. Dari hasil penelitian Simanjuntak (2004), diketahui bahwa mikrobia endofit (Bacillus
polymixa) hasil isolasi dari tanaman A.annua L dapat memproduksi senyawa
antimalaria artemisinin.
D. Rekombinasi Genetik
Setiap tanaman tingkat tinggi dapat mengandung beberapa mikrobia endofit yang mampu menghasilkan senyawa biologi atau metabolit sekunder yang diduga sebagai akibat terjadinya transfer genetik (genetic recombination) dari tanaman inangnya ke dalam mikrobia endofit (Tan & Zou, 2001).
DNA yang berada di sekitar bakteri (DNA asing) dapat berupa potongan DNA atau fragmen DNA yang berasal dari sel bakteri lainnya atau organisme lainnya. DNA yang masuk ke dalam sel bakteri selanjutnya dapat berintegrasi dengan DNA bakteri sehingga terbentuk DNA rekombinan (Tjahjoleksono, 2005).
Proses transfer genetik ini melibatkan juga enzim restriksi, enzim restriksi adalah enzim yang dapat memotong molekul DNA pada lokasi-lokasi spesifik yang jumlahnya terbatas, potongan molekul DNA ini disebut fragmen restriksi. Fragmen restriksi berupa fragmen DNA untai-ganda dengan sedikitnya satu ujung untai-tunggal, yang disebut ujung lengket (Campbell et al, 2002). Ujung lengket plasmid bakteri endofit akan berpasangan dengan ujung lengket yang berkomplementer dari fragmen DNA A.annua L sehingga didapatkan plasmid rekombinan. Sel bakteri endofit kemudian mengambil plasmid rekombinan dengan mekanisme transformasi. Transformasi merupakan pengambilan DNA oleh bakteri dari lingkungan di sekelilingnya. DNA yang berada di sekitar bakteri (DNA asing) dapat berupa potongan DNA atau fragmen DNA yang berasal dari sel bakteri lainnya atau organisme lainnya (Tjahjoleksono,2005). Menurut Radji (2005), kemampuan bakteri endofit dalam memproduksi senyawa metabolit sekunder yang sesuai dengan tanaman inangnya merupakan suatu koevolusi antara bakteri endofit dengan tanaman inangnya. Koevolusi adalah pengaruh mutual pada evolusi dari dua spesies berbeda yang berinteraksi satu sama lain dan yang secara timbal balik saling mempengaruhi adaptasi masing-masing (Campbell
E . Bakteri Uji
Pewarnaan Gram memilahkan bakteri menjadi kelompok Gram-positif dan Gram-negatif. Bakteri Gram-positif berwarna ungu karena tetap mengikat kompleks zat warna kristal violet-yodium meskipun diberi larutan pemucat (alkohol 95%). Bakteri Gram-negatif berwarna merah karena kompleks kristal violet-yodium larut sewaktu pemberian larutan pemucat, dan dapat diwarnai oleh cat lawan yang berwarna merah (Lay, 1994). Dalam penelitian ini, bakteri yang digunakan sebagai bakteri uji bersifat gram positif yaitu Staphylococcus aureus
dan sebagai gram negatif adalah Eschericia coli.
1. Eschericia coli
E.coli merupakan bakteri gram negatif yang berbentuk batang lurus,
bergerak dengan flagel atau tidak dapat bergerak, mudah tumbuh dengan pembenihan sederhana. Pada pembiakan, E.coli membentuk koloni bulat konveks, halus, dan pinggir-pinggir nyata (Jawetz et al, 1986). E.coli
termasuk dalam genus Eschericia, dengan ciri berukuran 1,1-1,5 μm x 2,0-6,0 m, bersifat fakultatif anaerob, tumbuh dengan optimal pada suhu 37
μ 0
C. Memberikan reaksi negatif untuk tes oksidase, hidrolisis urea, tes H2S, dan tes
sitrat, mereduksi nitrat, memberikan reaksi positif untuk tes katalase dan tes
Methylen Red (Holt et al, 2000).
E.coli adalah anggota flora usus normal, umumnya tidak menyebabkan
E.coli adalah penyebab yang paling lazim dari infeksi saluran kemih dan merupakan penyebab infeksi saluran kemih pertama pada kira-kira 90% wanita muda. E.coli yang menyebabkan diare sangat sering ditemukan di seluruh dunia, dan diklasifikasikan oleh ciri khas sifat-sifat virulensinya (Jawetz et al, 1996).
Bila pertahanan inang normal tidak mencukupi, E.coli dapat memasuki aliran darah dan menyebabkan sepsis. E.coli merupakan penyebab meningitis pada bayi, dan E.coli merupakan penyebab pada sekitar 40% kasus meningitis neonatal (Jawetz et al, 1996).
2. Staphylococcus aureus
S.aureus adalah jenis bakteri yang berbentuk bulat, berdiameter kurang
lebih 1 m, hidup bergerombol seperti buah anggur. Berdasar pengecatan gram, S.aureus termasuk gram positif yang ditunjukkan dengan warna ungu.
S.aureus mempunyai ciri dapat memfermentasi manitol yang dapat
memberikan warna kuning keemasan pada tes biokimiawi, memberi reaksi positif terhadap reaksi katalase dan koagulasi (Jawetz et al, 1996).
μ
S.aureus termasuk dalam genus Staphylococcus yang mempunyai ciri non
motil, tidak mempunyai spora, dan bersifat fakultatif anaerob. Koloni dari
Staphylococcus tidak tembus cahaya (opaque), berwarna putih atau krem, dan
kadang berwarna kuning sampai orange, memberi reaksi negatif pada tes oksidasi, mereduksi nitrat menjadi nitrit. Staphylococcus sering ditemukan pada produk makanan, sampah, dan air (Holt et al, 2000).
kolonisasi antara lain pada kulit dan selaput lendir manusia, juga menginfeksi berupa bisul, impetigo, dan infeksi luka yang menimbulkan nanah (Jawetz et al, 1996).
Pada suhu 300C pertumbuhannya sangat cepat, sedangkan pembentukan pigmen terbaik pada suhu 200C. Koloni pada pembenihan padat berbentuk bulat, halus, menonjol, dan berkilauan, membentuk pigmen warna kuning.
S.aureus dapat menjadi resisten terhadap banyak zat antimikrobia dan
menyebabkan masalah pengobatan menjadi sulit. Penanahan setempat adalah kekhususan infeksi S.aureus (Trihendrokesowo, 1986).
F. Metode Pengujian Potensi Senyawa Antimikrobia
Potensi antimikrobia dapat ditetapkan dengan berbagai cara antara lain :
1. Metode Difusi
Cara ini berdasarkan kemampuan obat untuk berdifusi dalam medium tempat mikrobia dapat berkembang biak secara optimal. Disk antibiotik diletakkan di atas agar atau bila dengan metode sumuran antibiotik dimasukkan dalam sumuran. Besarnya daerah difusi tergantung dengan daerah pertumbuhan atau hambatan mikrobia uji dan sebanding dengan kadar obat yang diberikan. Pada pelaksanaannya, metode difusi ada beberapa cara, yaitu:
a. Cara Kirby Bouwer
antibiotik diletakkan di atas medium lalu diinkubasikan pada suhu 37oC selama 18-24 jam, setelah itu dibaca hasilnya. Cara ini dikenal 2 macam zona, yaitu:
1). Zona radikal adalah suatu daerah di sekitar disk yang sama sekali tidak ditemukan adanya pertumbuhan mikrobia.
2). Zona irradikal adalah suatu daerah disekitar disk yang menunjukkan pertumbuhan mikrobia yang dihambat oleh antibiotik tersebut tetapi tidak dimatikan (Hugo & Russel, 1987; Anonim, 1986).
b. Cara paper disc
Cara ini adalah cara yang paling banyak digunakan untuk menentukan kepekaan mikrobia terhadap berbagai macam obat-obatan. Cara ini menggunakan cakram kertas saring atau tablet yang mengandung suatu obat dengan kekuatan tertentu yang diletakkan pada lempeng agar yang telah ditanami mikrobia yang akan diperiksa. Hambatan akan terlihat sebagai daerah yang tidak memperlihatkan adanya pertumbuhan mikrobia di sekitar cakram. Lebar hambatan ini tergantung pada daya resap obat ke dalam agar dan kepekaan mikrobia terhadap obat tersebut.
mengukur seluruh garis tengah hambatan dan cakram (Bonang & Koeswardono, 1982).
c. Cara sumuran
Penyiapan dilakukan seperti cara Kirby Bouwer. Setelah biakan siap, dibuat sumuran dengan diameter tertentu dan tegak lurus terhadap permukaan agar, ke dalam sumuran diteteskan larutan uji lalu diinkubasi selama 24 jam 37oC, setelah itu hasilnya dibaca seperti cara
Kirby Bouwer (Hugo & Russel, 1987).
2. Metode dilusi
Metode ini menggunakan senyawa anti mikrobia dengan kadar menurun secara bertahap, baik dengan medium cair atau padat. Kemudian medium diinokulasikan mikrobia uji dan diinkubasi. Tahap akhir dilarutkan senyawa antimikrobia dengan kadar yang menghambat atau mematikan. Pada uji kepekaan cara dilusi agar memakan waktu dan penggunaannya dibatasi pada keadaan tertentu saja. Uji kepekaan cara dilusi cair dengan menggunakan tabung reaksi, tidak praktis dan jarang dipakai, namun kini ada cara yang sederhana dan banyak dipakai yakni menggunakan
microdilution plate. Keuntungan mikrodilusi cair adalah bahwa uji ini
memberi hasil kuantitatif yang menunjukkan jumlah antimikrobia yang dibutuhkan untuk mematikan mikrobia uji (Jawetz et al ,2001).
G. Identifikasi Mikrobia
sifat-sifat biokimianya (fisiologi), patogenisitas dan serologinya (Jutono, Soedarsono, Hartadi, Kabirun, Suhadi & Soesanto,1980)
Pada identifikasi mikrobia mula-mula diamati morfologi individual secara mikroskopik dan pertumbuhannya pada berbagai medium. Karena suatu bakteri tidak dapat dideterminasi hanya berdasar sifat-sifat morfologinya saja, maka perlu diteliti pula sifat-sifat biokimia dan faktor-faktor yang mempengaruhi pertumbuhannya. Mikrobia yang morfologinya sama mungkin berbeda dalam kebutuhan nutrisi serta persyaratan ekologi lainnya (temperatur, pH, dan sebagainya). Patogenesis mikrobia patogen dapat dipakai untuk membantu identifikasi dan determinasi bakteri tersebut. Apabila suatu bakteri memiliki sifat yang hampir sama (terutama yang patogen), maka perlu diselidiki sifat ekologinya (Jutono dkk,1980).
Untuk determinasi bakteri digunakan buku panduan baku determinasi oleh Holt et al (2000), yang memuat sifat-sifat bakteri yang telah dikenal.
1. Sifat Morfologi
a. Morfologi sel individual, meliputi : 1) Ukuran, bentuk, dan rangkaian sel.
2) Ada tidaknya spora dan kedudukan spora.
3) Ada tidaknya flagella, kedudukan dan jumlah flagella. 4) Ada tidaknya kapsula.
5) Reaksi- reaksi pengecatan.
beberapa tipe medium yaitu medium agar miring, tegak dan cair. Pada medium agar miring koloni bakteri diinokulasikan sepanjang agar secara goresan dengan ose, pada medium agar tegak koloni bakteri diinokulasikan secara tusukan, dan pada medium cair koloni bekteri diinokulasikan langsung pada medium (Jutono dkk, 1980).
2. Sifat Biokimia
Pengujian sifat biokimia meliputi : a. Pembentukan asam sulfida (H2S)
Uji ini bertujuan untuk menunjukkan adanya pembentukan H2S pada
medium TSIA (Triple Sugar Iron Agar) (Jutono dkk, 1980). b. Dekarboksilase lisin
Uji ini bertujuan menunjukkan kemampuan bakteri dalam mendekarboksilasi berbagai asam amino (Lay, 1994).
c. Pembentukan Indol
Uji pembentukan Indol menunjukkan adanya indol dan triptofan (Jutono dkk, 1980).
d. Uji Methylen Red (MR)
Uji Methylen Red digunakan untuk menentukan adanya fermentasi asam campuran (Lay, 1994).
e. Uji Sitrat
f. Uji katalase
Katalase adalah enzim yang mengkatalisasikan penguraian hidrogen peroksida ( H2O2 ) menjadi air dan O2. Pada bakteri yang bersifat
katalase-positif terlihat pembentukan gelembung udara sekitar koloni (Lay, 1994)
g. Tes oksidase
Uji ini berfungsi untuk menentukan adanya oksidase sitokrom yang ditemukan pada mikrobia tertentu (Lay, 1994).
h. Uji pencairan gelatin
Gelatin adalah protein yang diperoleh dari tulang, tulang rawan atau tenunan ikat hewani lainnya. Hidrolisis gelatin oleh mikrobia tersebut dikatalisis oleh eksoenzim yang disebut gelatinase. Gelatin yang dicerna tidak mampu membentuk gel dan bersifat cair (Lay, 1994).
i. Uji oksidasi fermentasi (OF)
Uji ini bertujuan untuk menentukan kemampuan mikrobia untuk memetabolisme karbohidrat secara oksidasi atau fermentasi (Lay, 1994).
H. Keterangan Empiris
Setiap tanaman tingkat tinggi dapat mengandung beberapa mikrobia endofit yang mampu menghasilkan senyawa biologi atau metabolit sekunder yang diduga sebagai transfer genetik (genetic recombination) dari tanaman inangnya ke dalam mikrobia endofit (Tan & Zou, 2001).
A.annua L. telah diketahui merupakan tanaman yang menjadi inang
bakteri yang membentuk koloni dalam jaringan pada daerah batang sampai akar (Simanjuntak, dkk, 2004). Selain itu minyak essensial yang dihasilkan tanaman
A.annua L. juga diketahui menunjukkan aktivitas antibiotik (Juteau et al, 2002).
Bahan-bahan alam yang berpotensi sebagai obat dapat menjadi model atau prekursor dalam penemuan obat baru (Samuelsson, 2000). Untuk memperoleh antibiotik baru perlu dilakukan pencarian sumber penghasil antibiotik (Suwandi, 1989). Oleh karena itu, eksplorasi mikrobia endofit potensial merupakan alternatif untuk mendapatkan senyawa antibiotik baru. (Simanjuntak, dkk, 2004).
Pengujian potensi antibakteri dari senyawa antibakteri dalam medium produksinya dilihat dengan mengukur diameter zona hambat. Data untuk identifikasi isolat bakteri endofit tersebut berupa data-data morfologi koloni, morfologi sel, dan sifat-sifat biokimianya. Data hasil identifikasi bakteri endofit kemudian dideterminasi dengan buku panduan determinasi bakteri (Holt et al, 2000) untuk mengetahui genus dari bakteri endofit yang diisolasi dari tanaman
A.annua L tersebut. Penelitian ini ditujukan untuk mengisolasi dan
mengidentifikasi bakteri endofit dari batang tanaman A.annua L, dan untuk menguji potensi isolat bakteri endofit dari tanaman A.annua L terhadap E.coli
BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk jenis penelitian eksperimental murni dan bersifat eksploratif-deskriptif. Penelitian ini dilakukan di Laboratorium Mikrobiologi, Fakultas Farmasi Universitas Sanata Dharma.
B. Variabel dan Definisi Operasional 1. Variabel penelitian
a. Variabel bebas : senyawa antibakteri yang dihasilkan bakteri endofit yang diisolasi dari batang tanaman A. annua L.
b. Variabel tergantung : diameter zona hambat (mm).
c. Variabel pengacau terkendali : waktu inkubasi 24, 48, 72, 120 jam, suhu inkubasi 370C; medium kultur tanaman inang yaitu MS (Murashige-Shoog) medium; medium isolasi bakteri endofit, medium pemeliharaan bakteri endofit, E.coli, dan S.aureus yaitu NA (Nutrient Agar); medium produksi senyawa antibakteri yang dihasilkan bakteri endofit yaitu NB (Nutrient Broth); batang tanaman A.annua L. yang sehat dan berumur 6 bulan; volume isolat bakteri endofit penghasil senyawa antibakteri yang diinokulasikan dalam paper disk sebanyak 40 μL; volume suspensi E.coli
dan S.aureus setara dengan larutan standar Mc Farland II (6.108 CFU/ml)
2. Definisi operasional
a. Artemisia annua L. diperoleh dari Balai Penelitian Tanaman Obat
(BPTO) Tawangmangu dan diketahui bahwa ada suatu spesies bakteri yang membentuk koloni dalam jaringan vaskular daerah batang sampai akar tanaman A.annua L. ini.
b. Senyawa antibakteri adalah substansi yang dihasilkan oleh isolat bakteri endofit dalam tanaman A.annua L. yang mampu menghambat pertumbuhan atau membunuh E. coli dan S.aureus.
c. Bakteri endofit dari tanaman A.annua L. adalah bakteri yang membentuk koloni dalam suatu sistem jaringan vaskular dari tanaman A.annua L. yang dapat ditumbuhkan di MS Medium dan dapat menghasilkan senyawa yang mempunyai potensi antibakteri terhadap E.coli dan
S.aureus.
d. Potensi antibakteri adalah kemampuan suatu zat atau substansi yang dihasilkan oleh bakteri endofit dari tanaman A.annua L. yang mampu menghambat atau mematikan bakteri E.coli dan S.aureus, ditandai dengan adanya area hambatan di sekitar paper disk.
e. Eshericia coli ATCC 35218 dan Staphylococcus aureus ATCC 25923
dari Laboratorium Mikrobiologi Fakultas Kedokteran Universitas Gadjah Mada, adalah bakteri uji, yaitu bakteri gram negatif dan bakteri gram positif yang bersifat patogen terhadap manusia.
f. MS (Murashige-Shoog) medium adalah medium kultur tanaman A.annua
untuk mendukung pertumbuhan eksplan ( batang tanaman A.annua L. ) dan mengandung senyawa nitrogen yang berguna dalam regenerasi sel eksplan.
C. Bahan dan Alat Penelitian 1. Bahan penelitian
a. Tanaman Artemisia annua L. diperoleh dari Balai Penelitian Tanaman Obat (BPTO) Tawangmangu dan berumur 6 bulan.
b. Biakan murni Eschericia coli ATCC 35218 dan Staphylococcus aureus
ATCC 25923 dari Laboratorium Mikrobiologi Fakultas Kedokteran Universitas Gadjah Mada.
c. Medium kultur tanaman A.annua L yaitu MS (Murashige-Shoog) medium dengan komposisi : NH4NO3, KNO3, CaCl2.2H2O,
MgSO4.7H2O, KH2PO4, unsur hara mikro, sukrosa, agar, vitamin,
hormon BAP dan 2,4 Diklorofenoksi Asetat, FeSO4.7H2O dan Na2
EDTA,
d. Medium isolasi bakteri endofit yaitu Nutrien Agar (Oxoid) takaran 28g/L dengan komposisi (g/L) : “Lab-lemco” powder 1,0; yeast extract 2,0; peptone 5,0; sodium chloride 5,0 agar 15,0.
e. Medium produksi senyawa anti bakteri yaitu medium Nutrient Broth (Oxoid) takaran 37 g/L dengan komposisi (g/L) : “Lab-lemco” powder 1,0; yeast extract 2,0; peptone 5,0; sodium chloride 5,0.
1) Nutrien Agar (Oxoid) takaran 28g/L dengan komposisi (g/L) : “Lab-lemco” powder 1,0; yeast extract 2,0; peptone 5,0; sodium chloride 5,0 agar 15,0.
2) Nutrien Broth (Oxoid) takaran 37 g/L dengan komposisi (g/L) : “Lab-lemco” powder 1,0; yeast extract 2,0; peptone 5,0; sodium chloride 5,0.
g. Bahan untuk uji biokimia :
1) Uji Oksidase : reagens tetramethyl-paraphenyldiamine. 2) Uji Katalase : reagens hydrogen peroksida (H2O2).
3) Uji hydrogen sulfida : medium TSIA (Triple Sugar Iron Agar) (Oxoid).
4) Uji Dekarboksilasi lisin : medium LIA (Lisin Iron Agar) (Oxoid). 5) Uji Indol : medium peptone water dan reagens Kovac.
6) Uji MR : medium MR – VP (Methyl Red – Voges Proskauer), methyl red.
7) Uji hidrolisis gelatin : dengan komposisi Nutrient Broth (Oxoid) dan 12% gelatin.
8) Uji Fermentasi karbohidrat : medium O-F (Difco). 9) Uji Sitrat : medium Simmon’s Citrate (Oxoid).
10)Uji Pergerakan mikrobia : Nutrient Broth (Oxoid), 0,2% – 0,4% Agar
h. Bahan untuk pengecatan bakteri :
1) Pengecatan Gram : kristal violet, larutan iodine, alkohol 95%, safranin.
2) Pengecatan Spora : Malachite green 5%, safranin.
3) Pengecatan Acid Fast : cat Ziehl Neelson Carbolfuchsin, methylen blue, alkohol 95%.
i. Paper disc dengan diameter 6 mm.
j. Kontrol positif : Amoxicilin untuk injeksi (Danoxilin®)
k. Kontrol negatif yaitu medium Nutrien Broth tanpa inokulasi mikrobia endofit.
l. Larutan standar Mc Farland II (setara dengan kepadatan bakteri 6.108 CFU/ml).
m. Aquadest steril. n. Alkohol 70%. o. Minyak emersi.
p. Sodium hipoklorit (Bayclin) untuk pembersihan batang A.annua L.
q. Tween 80 sebagai wetting agent pada proses pembersihan batang
A.annua L.
2. Alat penelitian
Mikroskop cahaya (Olympus Type CH 30); mikropipet (Nichiryo 5000 DG),
Shaker Resiprok (Imorius Utrecht); beker glass (Pyrex), lemari pendingin
(Sharp, Japan), Cawan petri (Pyrex), kaca steril, pisau, botol kultur, Pipet volume, Pipet tetes, glass firm, Tabung sentrifuge, Tabung reaksi, kaca arloji, Erlenmeyer, Pinset, lampu spiritus, jarum inokulasi, penggaris, jarum ose, dan alat- alat gelas.
D. Tahapan Penelitian 1. Determinasi Tanaman Artemisia annua L.
Determinasi tanaman A.annua L. dilakukan oleh Balai Penelitian Tanaman Obat ( BPTO ), Tawangmangu, Karanganyar, Jawa Tengah, dengan menggunakan kunci determinasi menurut Backer ( 1968 )
2. Pengumpulan Batang Artemisia annua L.
Sampel batang yang sehat (bagus/ tidak rapuh) tanaman A.annua L. yang diperoleh dari Balai Penelitian Tanaman Obat ( BPTO ) Tawangmangu, Karanganyar, Jawa Tengah, dipilih yang telah berumur dewasa, yakni yang berumur 6 bulan. Sampel yang berupa batang disimpan di dalam kantong plastik untuk mengurangi penguapan selama perjalanan dan penyimpanan sementara.
3. Pembuatan MS Medium (Murashige-Shoog Medium) a. Penimbangan unsur makro
Ditimbang bahan-bahan untuk unsur makro, antara lain : 1,65 g NH4NO3 ; 1,9 g KNO3 ; 0,44 g CaCl2.2H2O ; 0,37 g MgSO4.7H2O ; 0,17
b. Pembuatan larutan stok
1) Pembuatan larutan stok hara mikro
Ditimbang bahan-bahan untuk stok mikro, antara lain : 41,5 mg kalium iodida; 310,0 mg asam borat; 845,0 mg mangansulfat-tetrahidrat; 430,0 mg sengsulfat-heptahidrat; 1,25 mg tembaga (II) sulfat; 12,5 mg natriummolibdat-dihidrat; 1,25 mg kobalt (II) klorida-heksahidrat.
Masing-masing bahan tersebut dimasukkan satu persatu ke dalam Beaker Glass 500 ml yang telah diisi dengan 300 ml aquadest, diaduk hingga larut. Kemudian dipindahkan ke dalam labu ukur 500 ml, diencerkan dengan aquadest sampai tanda. Untuk 1 liter medium dibutuhkan 5 ml larutan stok ini.
2) Pembuatan larutan stok besi
3) Pembuatan larutan stok vitamin
Erlenmeyer diisi dengan 50 ml aquadest, kemudian berturut-turut dimasukkan 250,0 mg asam nikotinat; 250,0 mg piridoksin; 50,0 mg tiamin; dan 100,0 mg glisin. Diaduk hingga jernih, kemudian dipindahkan ke dalam labu ukur 500 ml. Ditambahkan aquadest sampai tanda. Untuk 1 liter medium membutuhkan 5 ml larutan stok. 4) Pembuatan larutan stok mio-inositol
Ditimbang 10,0 mg mio-inositol, kemudian dimasukkan ke dalam Beaker Glass satu liter yang terlebih dahulu telah diisi dengan 700 ml aquadest. Setelah larut, dipindahkan ke dalam labu ukur 1 liter dan diencerkan dengan aquadest sampai tanda. Untuk 1 liter medium dibutuhkan larutan stok sebanyak 10,0 ml.
c. Pembuatan MS Medium (Murashige-Shoog Medium)
medium dibagi menjadi tiga bagian untuk membuat variasi zat pengatur tumbuh. Kemudian ditambahkan zat pengatur tumbuh auksin (2,4-D). pH larutan medium diatur 5,2- 5,6. Jika terlalu alkali ditambahkan HCl 1N, tetapi jika terlalu asam ditambahkan KOH 1N. Larutan medium dipindahkan ke dalam botol kultur dengan ketebalan medium kurang lebih satu cm. Botol tersebut kemudian ditutup dengan aluminium foil, kemudian disterilisasi dengan autoklaf (121 °C, 15 menit). Medium yang telah disterilkan tersebut selanjutnya disimpan ke dalam inkubator.
4. Desinfeksi Batang Artemisia annua L.
Batang dicuci dengan air mengalir selama ± 5-10 menit. Setelah itu, batang dicuci dalam 10 ml bayclin (commercial bleaching yang mengandung 5,3% sodium hypokhlorit) dan 20 tetes Tween 80, kemudian bilas dengan aquadest steril sampai bersih.
5. Penanaman Batang Artemisia annua L. pada MS Medium
6. Isolasi Bakteri Endofit dengan Metode Streak Plate
Setelah didapatkan pertumbuhan bakteri endofit, kemudian dilakukan isolasi bakteri endofit pada Nutrient Agar dalam cawan petri untuk mendapatkan biakan murni bakteri endofit. Satu ose mikrobia yang didapat diinokulasikan pada nutrient agar secara streak plate. Diinkubasikan pada suhu 37oC selama 24 jam. Akan didapat koloni- koloni bakteri yang terpisah. Koloni bakteri dari goresan terakhir diinokulasikan secara goresan ke dalam medium NA miring untuk stok mikrobia.
7. Pengujian Potensi Antibakteri dari Isolat Bakteri Endofit Terhadap E.coli dan S.aureus Secara Difusi Paper disc
a. Pembuatan Suspensi Bakteri Uji
Diambil ± 1 ose dari stok bakteri uji dari biakan murni E.coli ATCC 35218 dan S.aureus ATCC 25923, kemudian diinokulasikan pada Nutrien Broth (NB) 9 ml sampai konsentrasi 6 x 108 CFU/ml (Larutan Standar Mac Farland II).
b. Skrining Bakteri Endofit yang Memiliki Potensi Antibakteri terhadap E.coli dan S.aureus
Biakan murni bakteri endofit yang diperoleh dari tahap 6 diuji potensi antibakterinya terhadap E.coli dan S.aureus dengan metode Paper Disc
Agar Diffusion Technique. Biakan bakteri endofit tersebut kemudian
ditumbuhkan dalam medium Nutrient Broth dan digojog menggunakan
shaker inkubator pada suhu 37° C dengan kecepatan 170 rpm selama 3-4
mengandung metabolit sekunder bakteri endofit (supernatan) dilakukan dengan sentrifugasi pada kecepatan 5000 rpm selama 1 jam, supernatan dipakai untuk skrining bakteri endofit penghasil senyawa antibakteri. Sesudah supernatan disiapkan, paper disc steril diinokulasi 40 μl supernatan. Untuk mengurangi ekses air, paper disc dikeringanginkan di atas kaca arloji steril selama kurang lebih 1 jam. Mikrobia uji yaitu E.coli
dan S.aureus ditumbuhkan dalam NA secara pour platting pada petri yang
berbeda, yaitu dengan mengambil suspensi bakteri uji E.coli dan S.aureus
sebanyak 1 ml kemudian diinokulasikan ke dalam 20 ml Nutrient Agar yang sedang mencair pada temperatur 50oC lalu dituang ke dalam cawan petri dan digoyang perlahan- lahan untuk mencampur kultur bakteri dengan agar. Setelah agar memadat, paper disc yang telah diinokulasi supernatan ditempatkan di permukaan medium. Inkubasi dilakukan pada suhu 37oC selama 24 jam atau sampai terbentuknya zona jernih di sekitar
paper disc. Potensi penghambatan diukur dengan mengukur diameter zona
jernihnya menggunakan penggaris.
8. Identifikasi Bakteri Endofit a. Morfologi sel
1) Pengecatan Gram
ditetesi larutan iodine dan didiamkan selama 1,5 menit. Dicuci dengan air mengalir dan diberi larutan peluntur safranin, didiamkan selama 20 detik, kemudian dicuci dengan air mengalir, dikeringanginkan. Diamati dibawah mikroskop dengan perbesaran 1000X dengan menggunakan minyak immersi. Jika sel bakteri berwarna ungu berarti isolat bakteri endofit yang diisolasi termasuk bakteri gram positif. Tetapi jika sel bakteri berwarna merah berarti isolat bakteri endofit termasuk bakteri gram negatif.
2) Pengecatan Spora
Dibuat pulasan isolat bakteri endofit yang mempunyai potensi penghambatan paling baik pada tahap 7 dari kultur umur 48 jam dan difiksasi di atas pembakar spiritus. Ditetesi dengan malachite green dan dipanasi selama 1 menit. Dicuci dengan air mengalir lalu diberi cat safranin dan didiamkan selama 30 detik kemudian dicuci di bawah air mengalir lalu dikeringanginkan dan diamati di bawah mikroskop dengan perbesaran kuat 1000X dengan minyak immersi. Spora berwarna hijau dan sel vegetatif berwarna merah.
3) Pengecatan Acid Fast
Didinginkan, dicuci dengan air mengalir dan dikeringanginkan. Dicuci dengan larutan peluntur sambil digoyang- goyangkan sampai seluruh warna dari carbolfuchsin tidak tampak. Dicuci dengan air mengalir dan dikeringkan. Setelah itu ditambahkan dengan metylen biru selama 20-30 detik. Dicuci kembali dan diamati dengan perbesaran kuat 1000X. Bakteri yang tidak tahan terhadap pencucian asam akan berwarna biru sedangkan bakteri yang tahan asam akan berwarna merah.
4) Uji pergerakan
Isolat bakteri endofit yang mempunyai potensi penghambatan paling baik pada tahap 7 dari kultur umur 48 jam diinokulasi dengan cara tusukan dalam agar tegak dengan kandungan agar 0,2% – 0,4%. Akan tampak pergerakan bakteri yang berupa serabut- serabut halus disekitar tusukan, pergerakan bakteri ini disebabkan karena bakteri memiliki flagela.
b. Morfologi Koloni
bekas tusukan, kilat, topografi, warna, ciri- ciri optik, bau, konsistensi dan warna medium.
c. Uji biokimia
1) Uji pembentukan H2S
Diinokulasikan kultur isolat bakteri endofit yang mempunyai potensi penghambatan paling baik pada tahap 7 dari kultur umur 48 jam dengan jarum inokulasi secara tusukan pada medium TSIA miring dan pada permukaan medium diinokulasi secara goresan dengan menggunakan ose. Diinkubasikan selama 48 jam pada suhu 37oC. Pengamatan uji H2S dilakukan dengan cara membandingkan medium
yang diinokulasi isolat bakteri endofit terhadap kontrol (tanpa inokulasi bakteri endofit). Pembentukan H2S ditunjukkan dengan
terbentuknya endapan hitam yang berarti bakteri mampu menghasilkan senyawa desulfurase, selain itu dapat digunakan untuk mengamati fermentasi gula. Jika pada bagian bawah medium berwarna kuning sedang bagian atas berwarna merah berarti terjadi fermentasi glukosa. Jika baik pada bagian atas ataupun bawah medium berwarna kuning dan kadangkala disertai pembentukan gas berarti laktosa atau sukrosa atau keduanya difermentasikan. Dan jika seluruh medium berwarna merah berarti ketiga macam gula tidak difermentasikan.
2) Uji dekarboksilasi lisin
jam dengan cara tusukan dalam medium Lysin Iron Agar (LIA)
kemudian diinkubasikan pada suhu 37oC selama 24 jam dan 48 jam. Pengamatan uji dekarboksilasi lisin dilakukan dengan membandingkan medium LIA yang diinokulasikan isolat bakteri endofit terhadap kontrol (tanpa inokulasi bakteri endofit) yang berwarna ungu. Hasil diamati, positif bila terjadi perubahan warna dari ungu menjadi kuning pada umur 24 jam dan kemudian berwarna ungu kembali. Perubahan warna menjadi kuning menandakan bakteri dapat melakukan fermentasi dan kembali berwarna ungu yang berarti lisin mengalami dekarboksilasi.
3) Uji Indol
4) Uji Methyl Red
Diinokulasikan kultur isolat bakteri endofit yang mempunyai potensi penghambatan paling baik pada tahap 7 dari kultur umur 48 jam dengan jarum inokulasi pada masing- masing tabung yang berbeda berisi medium MR-VP. Diinkubasi pada suhu 37oC selama 48 jam. Pengamatan uji Methyl Red dilakukan dengan membandingkan medium yang diinokulasikan isolat bakteri endofit terhadap kontrol (tanpa inokulasi bakteri endofit). Pada uji MR ditambah reagen methyl red. Bakteri yang tidak dapat memfermentasikan gula akan merubah warna menjadi merah pada uji MR. Sedangkan apabila terjadi fermentasi gula, medium akan berubah menjadi kuning.
5) Uji sitrat
Diinokulasikan 1 ose kultur isolat bakteri endofit yang mempunyai potensi penghambatan paling baik pada tahap 7 dari kultur umur 48 jam pada medium simmon’s citrate secara miring. Diinkubasi pada suhu 37oC selama 24 jam. Pengamatan uji sitrat dilakukan dengan membandingkan medium simmon’s citrate yang diinokulasikan isolat bakteri endofit terhadap kontrol (tanpa inokulasi bakteri endofit). Perubahan warna dari hijau menjadi biru menunjukkan bahwa bakteri mampu menggunakan sitrat sebagai satu- satunya sumber karbon. 6) Uji katalase
Ditambahkan 1 tetes 30% H2O2. diamati dengan melihat terjadi atau
tidaknya pembentukan gelembung udara di sekitar koloni bakteri endofit setelah diberi reagens 30% H2O2 dan dibandingkan dengan
kontrol (tanpa inokulasi bakteri endofit). jika terjadi gelembung udara berarti bakteri memiliki enzim katalase.
7) Uji Oksidase
Pada kertas saring diteteskan reagens tetrametil paraphenildiamin. Pada kertas saring yang diberi reagens diletakkan 1 ose kultur isolat bakteri endofit yang mempunyai potensi penghambatan paling baik pada tahap 7 dari kultur umur 48 jam. Diamati hasilnya dengan melihat apakah terjadi perubahan warna koloni bakteri menjadi ungu tua setelah diberi reagens dan dibandingkan dengan kontrol (tanpa inokulasi bakteri endofit). Jika terjadi warna ungu tua setelah didiamkan selama 10 menit berarti hasil positif bahwa bakteri uji memiliki enzim oksidase sitokrom. Sedangkan hasil negatif ditandai dengan tidak terjadinya perubahan warna.
8) Uji hidrolisis gelatin
dibandingkan dengan kontrol (tanpa inokulasi bakteri endofit). Apabila terjadi pencairan gelatin berarti bakteri mampu menghasilkan eksoenzim gelatinase.
9) Uji fermentasi karbohidrat
Dua tabung berisi medium O-F diinokulasi dengan kultur isolat bakteri endofit yang mempunyai potensi penghambatan paling baik pada tahap 7 dari kultur umur 48 jam menggunakan jarum inokulasi secara tusukan dan dua tabung sebagai kontrol (tanpa inokulasi bakteri endofit), tabung pertama ditetesi parafin dan tabung kedua tanpa ditetesi parafin kemudian diinkubasikan pada suhu 37o selama 48 jam. Hasil diamati dengan melihat perubahan warna medium O-F. Warna awal medium O-F adalah hijau. Jika pada medium yang ditutup paraffin tetap berwarna hijau sedangkan yang tidak ditutup paraffin warna mediumnya berubah menjadi kuning berarti bakteri endofit mampu memetabolisme karbohidrat secara oksidasi. Tetapi jika pada tabung dengan medium O-F yang ditutup paraffin ataupun tidak ditutup paraffin, warna mediumnya berubah menjadi kuning berarti bakteri endofit mampu memetabolisme karbohidrat secara fermentasi.
E. Analisis Hasil
Medium yang digunakan untuk isolasi bakteri endofit dari batang Artemisia
annua L. adalah MS (Murashige-Shoog)medium. Isolat bakteri endofit kemudian
penghasil senyawa antibakteri diujikan pada S aureus dan E.coli menggunakan metode difusi dengan paper disk, potensi antibakteri diketahui dengan cara mengukur zona hambat yang terbentuk di sekitar paper disk dengan menggunakan penggaris. Identifikasi bakteri endofit dilakukan dengan melihat sifat morfologi sel, morfologi koloni dan pengujian sifat biokimia. Dari sifat- sifat tersebut dapat diidentifikasi bakteri endofit yang bersifat antibakteri terhadap S.aureus dan
E.coli dengan buku panduan determinasi bakteri (Holt et al, 2000) sehingga dapat
Pengumpulan batang tanaman Artemisia annua L.
Pembersihan batang tanaman Artemisia annua L.
Penanaman batang tanaman Artemisia annua L pada MS medium untuk isolasi bakteri endofit
Isolasi dan Reisolasi bakteri endofit secara streak plate
Isolat murni bakteri endofit
Skrining bakteri endofit dengan metode paper disk
Identifikasi bakteri endofit
Morfologi sel : Morfologi koloni : Sifat biokimia : - sifat gram Medium cair (NB) - H2S
- rangkaian sel - tekstur permukaan - dekarboksilasi lisin - bentuk sel - kekeruhan - indol
- pergerakan - bau - MR - endapan - sitrat Medium padat (NA) - katalase - bentuk pertumbuhan - oksidase - konsistensi - gelatin - warna - fermentasi
Determinasi isolat bakteri endofit menggunakan panduan baku Bergey’s Manual
of Determinative Bacteriology (Holt et al, 2000)
Genus isolat bakteri endofit
BAB IV
HASIL PENELITIAN DAN PEMBAHASAN
1. Determinasi Tanaman Artemisia annua L.
Identifikasi tanaman (disebut juga dengan determinasi tanaman) adalah penentuan nama ilmiah suatu tanaman yang didasarkan pada acuan suatu sistem klasifikasi tanaman (Stace, 1989). Determinasi tanaman bertujuan untuk memastikan kebenaran tanaman yang digunakan untuk penelitian. Tanaman yang akan digunakan dalam penelitian adalah Artemisia annua L. yang dideterminasi sampai tingkat spesies. Determinasi tanaman dilakukan oleh Balai Penelitian Tanaman Obat (BPTO), Tawangmangu, dengan menggunakan kunci determinasi menurut Backer (1968) (Lampiran 1).
Berdasarkan determinasi hingga kategori spesies tersebut, maka tanaman yang digunakan dalam penelitian ini adalah Artemisia annua L. (Lampiran 2).
Artemisia annua L. merupakan anggota familia Asteraceae (sinonim
Compositae) (Backer & Brink,1965).
2. Pengumpulan Batang Tanaman Artemisia annua L.
Batang tanaman yang akan digunakan untuk penelitian diperoleh dari Balai Penelitian Tanaman Obat ( BPTO ), Tawangmangu, dan dipilih tanaman
A.annua L. yang berumur dewasa dan sehat ( berumur ± 6 bulan ). Mikrobia
tersebut adalah xilem, yang mengirim air dan mineral yang terlarut ke atas dari akar ke tunas, dan floem, yang mengangkut makanan yang dibuat di daun yang sudah dewasa ke akar dan ke bagian-bagian sistem tunas (Campbell et al, 2002). Pada tanaman yang terlalu muda, jaringan vaskular yang terbentuk belum sempurna sehingga kemungkinan munculnya bakteri endofit kecil karena nutrien yang diperlukan untuk tumbuhnya bakteri endofit kurang. Apabila batang tanaman yang dipilih kurang sehat kemungkinan jaringan tanaman di dalam batang tersebut sudah ada yang rusak sehingga tidak dapat menghasilkan nutrien secara maksimal untuk tumbuhnya bakteri endofit. Jaringan tanaman yang sehat dapat menghasilkan nutrien yang cukup untuk tumbuhnya bakteri endofit (Pudaritadesantamaria, 2004). Nutrien adalah substansi yang digunakan untuk biosintesis dan sebagai sumber energi untuk mendukung pertumbuhan mikrobia (Prescott, Harley & Klein, 1999). Digunakan batang tanaman A.annua L. karena dalam batang A.annua L. terdapat jaringan vaskular sebagai tempat tumbuh bakteri endofit.
3. Pembuatan MS Medium (Murashige-Shoog Medium)
berguna dalam regenerasi sel eksplan. Bakteri endofit dalam batang tanaman
A.annua L. dapat tumbuh karena mendapat nutrien dalam jaringan vaskular
batang tanaman A.annua L. (Stone et al, 2000). Jaringan vaskular berfungsi untuk transportasi nutrien tanaman A.annua L., jadi nutrien yang digunakan tanaman A.annua L. untuk tumbuh digunakan juga oleh bakteri endofit tersebut untuk tumbuh, sehingga diharapkan bakteri endofit tersebut juga dapat tumbuh dalam MS medium.
4. Desinfeksi Batang Tanaman Artemisia annua L.
Pembersihan batang tanaman A.annua L. dilakukan untuk menghilangkan menghilangkan kotoran dan mikrobia kontaminan dari permukaan batang tanaman A.annua L., sehingga pada tahap isolasi bakteri endofit dari batang
A.annua L. akan diperoleh isolat murni bakteri endofit. Cara pembersihannya
80 yang masih menempel pada batang yang dapat mengganggu pertumbuhan bakteri endofit.
5. Penanaman Batang Artemisia annua L. pada MS Medium
Batang yang telah dibersihkan kemudian dipotong menggunakan pisau steril sepanjang ± 0,5-0,8 cm dan ditanam menggunakan pinset steril secara aseptis ke permukaan medium MS. Penanaman batang dalam posisi horisontal
dengan bekas potongan tertanam di permukaan MS medium, kemudian
diinkubasikan selama 2-3 hari. Setelah inkubasi, tampak pertumbuhan bakteri endofit di sekitar batang A.annua L. (Lampiran 3).
Bakteri endofit ini hanya akan tumbuh di sekitar batang A.annua L. karena bakteri endofit ini pada awalnya memperoleh nutrien dari batang
A.annua L.. Pertumbuhan bakteri endofit di MS Medium akan tampak berbeda
dengan mikrobia kontaminan. Mikrobia kontaminan akan memenuhi seluruh permukaan MS Medium setelah inkubasi.
Munculnya bakteri endofit tersebut karena terdapat hubungan simbiosis antara bakteri endofit dan tanaman A.annua L., di mana bakteri endofit memperoleh nutrien dan pelindungan dari tanaman A.annua L.. Peran nutrien yang diperoleh dari tanaman A.annua L. bagi bakteri endofit adalah sebagai sumber energi sesuai kebutuhan sel bakteri endofit, dan sebagai bahan pembangun sel bakteri endofit. Sebagai timbal baliknya, tanaman A.annua L. memperoleh substansi dari bakteri endofit yang berguna untuk mendukung pertumbuhan tanaman A.annua L.. Bakteri endofit memproduksi
lainnya yang mendukung pertumbuhan tanaman (Tan & Zou, 2001). Bakteri endofit juga memberikan perlindungan kepada tanaman inang dari berbagai mikrobia patogen dengan cara kompetisi, menghasilkan senyawa antibiotik, atau menginduksi ketahanan tanaman. Bakteri endofit yang diisolasi dari akar pisang telah diketahui dapat menghambat pertumbuhan Fusarium oxysporum
penyebab penyakit layu Fusarium pada tanaman pisang (Pudaritadesantamaria, 2004).
Bakteri endofit mengkoloni jaringan vaskular dari tanaman A.annua L., sehingga bakteri endofit tersebut hidup di lingkungan yang kaya akan nutrien, oleh karena itu transpor nutrien dari tanaman A.annua L. ke dalam bakteri endofit dapat terjadi dengan mekanisme difusi pasif dan difusi terfasilitasi. Difusi pasif adalah proses berpindahnya molekul dari konsentrasi yang tinggi menuju konsentrasi rendah, kecepatan dari difusi pasif dipengaruhi oleh besarnya gradien kadar dari molekul. Kecepatan dari difusi nutrien menembus membran sel dapat ditingkatkan dengan menggunakan protein carrier yang terdapat dalam plasma membran sel, mekanisme ini disebut difusi terfasilitasi. Protein carrier menyerupai enzim yang spesifik untuk setiap nutrien yang akan ditransportkan (Prescott, 1999).
Bakteri endofit dalam batang A.annua L dapat memproduksi senyawa metabolit sekunder sesuai dengan tanaman inangnya, metabolit sekunder yang berpotensi sebagai antibiotik ini diduga sebagai hasil transfer genetik (genetic
recombination) dari A.annua L. ke dalam bakteri endofit. Mekanisme transfer