KONEKTIVITAS DAN KERAGAMAN GENETIK PADA KARANG
LUNAK Sarcophyton trocheliophorum SERTA IMPLIKASINYA
TERHADAP KAWASAN KONSERVASI LAUT
ARADEA BUJANA KUSUMA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Konektivitas dan Keragaman Genetik pada Karang Lunak Sarcophyton trocheliophorum serta Implikasinya terhadap Kawasan Konservasi Laut adalah benar karya saya dengan arahan dari Komisi Pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
ARADEA BUJANA KUSUMA. Konektivitas dan Keragaman Genetik pada Karang Lunak Sarcophyton trocheliophorum serta Implikasinya terhadap Kawasan Konservasi Laut. Dibimbing oleh DIETRIECH GEOFFREY BENGEN dan HAWIS MADDUPPA.
Konektivitas genetik menjadi kunci konservasi karena berperan penting dalam mempertahankan dan memulihkan populasi dari kerusakan. Kerusakan pada ekosistem terumbu karang dapat menjadi pemicu kepunahan organisme laut. Salah satu organisme yang tidak terhindar dari kerusakan tersebut ialah Sarcophyton trocheliophorum. Kerusakan tersebut dapat mengganggu struktur populasi serta konektivitas genetik S. trocheliophorum sehingga menyebabkan menurunnya keragaman genetik S. trocheliophorum.
Tujuan dari penelitian ini adalah menganalisis konektivitas genetik dan keragaman genetik dari S. trocheliophorum yang terdapat pada tiga populasi di Perairan Jawa, Sulawesi dan Nusa Tenggara serta mendeskripsikan implikasinya terhadap kawasan konservasi di Indonesia. Penelitian ini menggunakan penanda genetik ND2 untuk menganalisis struktur populasi, konektivitas, dan keragaman genetik.
Konektivitas genetik terdapat pada tiga populasi dengan nilai fst 0.227 hingga 0.558, hal ini mengindikasikan bahwa semua populasi memiliki kekerabatan genetik yang dekat. Pola arus diduga yang mendistribusikan larva S. trocheliophorum dari suatu pulau ke pulau lain sebagai batu loncatannya. Tanakeke (populasi perairan P. Sulawesi) diduga sebagai pusat konektivitas dari S. trocheliophorum. Pulau tersebut terhubung pada pulau-pulau lain di Barat dan Timur Indonesia. Keragaman genetik S. trocheliophorum pada Perairan Jawa, Sulawesi, Nusa Tenggara masing-masing 0.600, 0.815, dan 0.972. Keragaman genetik pada populasi Perairan Jawa lebih kecil dibandingkan pada Populasi Perairan Sulawesi dan Nusa Tenggara. Hal ini dimungkinkan karena banyaknya aktivitas manusia pada pesisir utara Laut Jawa, sehingga berdampak pada menurunnya ukuran populasi S. trocheliophorum. Oleh karena itu perlu adanya perlindungan yang ketat pada populasi Tanakeke dan Jawa untuk menjaga kelestarian keanekaragaman hayati Indonesia.
SUMMARY
ARADEA BUJANA KUSUMA. Genetic Connectivity and Genetic Diversity of Softcoral Sarcophyton trocheliophorum and its Implication for Marine Protected Area. Supervised by DIETRIECH GEOFFREY BENGEN and HAWIS MADDUPPA.
Genetic connectivity is the key of conservation to recovery population from damage. Damage of coral reef ecosystem could lead to marine biodiversity extinction. Sarcophyton trocheliophorum is one of marine ornamental coral which could not dodge from damage. These damage would interfere population structure and genetic connectivity of S. trocheliophorum, and it could decrease genetic diversity.
The research aimed to analize genetic connectivity, and genetic diversity of S. trocheliophorum in three population of Java, Nusa Tenggara, and Sulawesi waters, and to describe its implication for marine protected area. Genetic marker ND2 was used to analyze population structure, genetic connectivity, and genetic diversity.
Totally 39 samples were colected from three population. Genetic connectivity found in all population with fst value were 0.227 to 0.558, indicated that all population have close genetic relationship. Current expected distribut the larva of S. trocheliophorum to islands in population as stepping stones. Tanakeke island (Sulawesi population) might be as a center connectivity of S. trocheliophorum. This island connected with islands in west and east Indonesia. Genetic diversity in Java, Sulawesi, Nusa Tenggara population were 0.600, 0.815, and 0.972, respectively. Genetic diversity in Java population is smallest than Sulawesi and Nusa Tenggara. It might be caused by human activity in Java coasts and impacted on decrease of their unit population, therefore Tanakeke and Java island need to be protected.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Kelautan
KONEKTIVITAS DAN KERAGAMAN GENETIK PADA KARANG
LUNAK Sarcophyton trocheliophorum SERTA IMPLIKASINYA
TERHADAP KAWASAN KONSERVASI LAUT
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Konektivitas dan Keragaman Genetik pada Karang Lunak Sarcophyton trocheliophorum serta Implikasinya terhadap Kawasan Konservasi Laut
Nama : Aradea Bujana Kusuma NIM : C551120071
Disetujui oleh Komisi Pembimbing
Prof Dr Dietriech Geoffrey Bengen, DEA Ketua
Dr Hawis Madduppa, MSi Anggota
Diketahui oleh
Ketua Program Studi Ilmu Kelautan
Dr Ir Neviaty P. Zamani, MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan April 2013 ini ialah Konektivitas Genetik, dengan judul Konektivitas dan Keragaman Genetik pada Karang Lunak Sarcophyton trocheliophorum serta Implikasinya terhadap Kawasan Konservasi Laut.
Kesuksesan penulis mengikuti pendidikan di Sekolah Pascasarjana IPB ini tidak lepas dari dukungan berbagai pihak. Penulis menyampaikan banyak terima kasih yang setulusnya kepada:
1. Prof Dr Dietriech Geoffrey Bengen, DEA dan Bapak Dr Hawis Madduppa, MSi selaku pembimbing yang telah banyak memberikan arahan, motivasi, ide dan waktu untuk penulis
2. Dr Ir Neviaty P. Zamani, MSc selaku ketua Program Studi Ilmu Kelautan.
3. Ayah, Ibu, adik-adik tercinta serta keluarga besar tersayang terimakasih atas doa, motivasi, dan semangat selama penulis menempuh studi.
4. Beginer Subhan, MSi dan Dondy Arafat, MSi yang telah banyak membantu dalam proses pengumpulan data.
5. Romanus Edy Prabowo MSc, PhD dan Bertoka Fajar SPN S.Kel, MSi yang selalu memberikan masukan dalam penulisan tesis ini.
6. Prof Sri Juwana, Drh Retno Triastuti dan Wini Kania yang telah membantu dan melancarkan penelitian ini.
7. Teman-teman seperjuangan di Laboratorium Marine Biosistematika dan Biodiversity ITK IPB serta yang selalu memberikan semangat untuk menyelesaikan penelitian ini. ilmiah ini membawa manfaat bagi seluruh civitas IPB khususnya dan masyarakat Indonesia umumnya
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Manfaat Penelitian 3
Ruang Lingkup Penelitian 3
METODE 4
Waktu dan Lokasi Penelitian 4
Pengambilan Sampel 4
Bahan 4
Alat 4
Prosedur Analisis Karakter Molekuler 5
Analisis Data 7
HASIL DAN PEMBAHASAN 9
Struktur Populasi dan Konektivitas Genetik 9
Keragaman Genetik 12
SIMPULAN DAN SARAN
Simpulan 16
Saran 16
DAFTAR PUSTAKA 16
LAMPIRAN 19
DAFTAR TABEL
1. Bahan-bahan yang digunakan dalam penelitian 5
2. Alat-alat yang digunakan dalam penelitian 5
3. Kategori nilai keragaman genetik, struktur populasi dan jarak genetik 8 4. Analisis uji jarak berpasangan (Fst) pada populasi S. trocheliophorum
dipopulasi Perairan Sulawesi, Jawa dan Nusa Tenggara 10 5. Jarak Genetik dalam dan antar populasi S. trocheliophorum dipopulasi
Perairan Sulawesi, Jawa dan Nusa Tenggara 10
6. Jumlah haplotipe (Hn), keragaman haplotipe (Hd), keragaman
nukleotida (π) dan jumlah sampel (n) S. trocheliophorum pada populasi Perairan Jawa, Sulawesi dan Nusa Tenggara, Indonesia 13
DAFTAR GAMBAR
1. Peta lokasi pengambilan sampel S. trocheliophorum 4
2. Diagram Alir Analisis Molekuler 6
3. Bentuk morfologi karang lunak S. trocheliophorum 7 4. Sebaran haplotipe S. trocheliophorum beserta pola arus dominan
( ) dan musiman (---) yang ada di Indonesia 11 5. Konektivitas haplotipe S. trocheliophorum antara populasi Perairan
Jawa (Hijau) Sulawesi (Kuning) dan Nusa Tenggara (Merah). 11
DAFTAR LAMPIRAN
1. Persiapan preparasi sampel S. trocheliophorum 19 2. Hasil elektroforesis sampel S. trocheliophorum dengan panjang
fragmen 750 bp 19
PENDAHULUAN
Latar Belakang
Konektivitas genetik merupakan jejak genetik yang ditinggalkan suatu organisme dalam proses migrasi atau distribusinya dari satu lokasi ke lokasi lain (Hellberg et al., 2002). Konektivitas genetik berperan penting dalam mempertahankan populasi dan pemulihan dari kerusakan (Almany et al., 2009). Oleh karena itu konektivitas genetik dapat dijadikan suatu informasi mengenai suatu pergerakan dari larva organisme laut yang bisa dimanfaatkan sebagai kunci konservasi. Pola konektivitas suatu organime dipengaruhi oleh beberapa faktor, diantaranya yaitu penyebaran larva dan reproduksi (Jackson 1986).
Jarak pulau yang saling berdekatan di Indonesia berperan sebagai “stepping stone” untuk mempermudah penyebaran larva. Selain itu pola arus yang kuat di Indonesia juga membantu dalam proses penyebaran larva. Menurut Benayahu dan Loya (1986) arus merupakan alat bantu yang sangat penting dalam proses distribusi larva hewan sessil, sehingga dapat membuat adanya suatu konektivitas antar organisme. Salah satu hewan sesil yang penyebaranya dipengaruhi oleh arus adalah Sarcophyton trocheliophorum (Benayahu dan Loya 1986).
Sarcophyton trocheliophorum merupakan salah satu anggota penyusun komunitas karang. Tubuh karang ini lunak, akan tetapi dengan adanya penyokong yang terbuat dari kalsium karbonat (spikula atau sklerit), membuat tubuh karang ini lentur dan tidak mudah putus (Manuputty 2002). Secara umum koloni S. trocheliophorum berbentuk seperti jamur dan lobus (Manuputty 1996). Distribusi genus Sarcophyton terdapat pada daerah kedalaman 1 - 35 m di seluruh perairan Indo-Pasifik (Benayahu 1985, McFadden et al., 2006). S. trocheliophorum berkembangbiak dengan cara gonochoric. Larva Sarcophyton sp. yang dihasilkan dari reproduksi tersebut mampu bertahan 14 hari dalam kolom air (Benayahu dan Loya 1986). Sedangkan perkembangbiakan aseksualnya dilakukan dengan secara fragmentasi (Fabricus dan Philip 2001).
2
ekosistem terumbu karang sebagai habitat S. trocheliophorum (Hoegh-Guldberg 2011).
Perubahan kondisi lingkungan laut dapat menyebabkan perubahan komposisi spesies di dalam ekosistem terumbu karang, sedangkan dampak dari perubahan tersebut dapat merusak konektivitas genetik S. trocheliophorum. Padahal konektivitas genetik yang terjaga baik akan membantu menjaga keragaman genetik S. trocheliophorum. Keragaman genetik merupakan suatu ukuran variasi genetik pada suatu populasi (Hughes et al., 2008) yang ditentukan oleh adanya masukan genetik dari populasi lain (Beardmore 1983). Keragaman genetik yang tinggi sangat membantu suatu organisme dalam merespon perubahan lingkungan dan iklim serta penyakit.
Konektivitas genetik dapat memberikan informasi untuk membantu dalam proses pengelolaan kawasan perlindungan laut secara berkelanjutan. Akan tetapi Wijayanti et al, (2009) menyebutkan bahwa konektivitas genetik antar terumbu sering diabaikan ketika mendesain suatu kawasan. Hal ini menunjukan bahwa konektivitas genetik belum digunakan sebagai dasar pembentuan kawasan perlindugan laut. Padahal konektivitas genetik sangat penting untuk menjamin kelangsungan populasi atau perlindungan biodiversitas Indonesia. Telah banyak penelitian yang melaporkan konektivitas dan keragaman genetik karang, beberapa diantaranya adalah konektivitas dan keragaman genetik dari Pocillopora damicornis (Adjeroud et al., 2014), Montastraea annularis (Foster et al., 2012), dan Montastraea cavernosa (Goodbody-Gringley et al., 2011). Akan tetapi penelitian tersebut lebih banyak dilakukan oleh peneliti luar negeri, penelitian untuk konektivitas dan keragaman genetik S. trocheliophorum di Indonesia belum pernah dilakukan. Padahal Indonesia mempunyai karakteristik biota, geografis dan lingkungan yang menarik untuk dikaji.
Populasi Perairan Jawa, Sulawesi, dan Nusa Tenggara memiliki karakteristik yang bervariasi. Populasi Perairan Jawa mempunyai tingkat pencemaran yang tinggi dibandingkan dengan populasi lain, sementara populasi Perairan Nusa Tenggara memiliki beberapa lokasi yang merupakan suatu perairan semi tertutup. Arus lintas Indonesia (Arlindo) yang mengalir di populasi Perairan Sulawesi membuat lokasi di populasi ini memiliki karakteriktik lingkungan unik.
Karakteristik geografis dan lingkungan yang berbeda-beda pada populasi Perairan Jawa, Sulawesi dan Nusa Tenggara akan membuat perbedaan pada keragaman genetik dan struktur populasi genetik dari S. trocheliophorum. Oleh karena itu perlu adanya pengukuran mengenai konektivitas dan keragaman genetik S. trocheliophorum di tiga populasi tersebut sehingga dapat membantu dalam proses perlindungan keanekargaman hayati Indonesia.
Perumusan Masalah
Berdasarkan uraian diatas maka dapat dirumuskan permasalahan sebagai berikut:
1. Bagaimana struktur populasi, konektivitas dan keragaman genetik S. trocheliophorum yang terdapat pada populasi Perairan Jawa, Sulawesi dan Nusa Tenggara?
3 Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. Menganalisis struktur populasi, konektivitas dan keragaman genetik S. trocheliophorum yang terdapat pada populasi Perairan Jawa, Sulawesi dan Nusa Tenggara.
2. Mendeskripsikan implikasi dari struktur populasi, konektivitas, dan keragaman genetik S. trocheliophorum terhadap kawasan konservasi laut di Indonesia.
Manfaat Penelitian
Penelitian ini diharapkan dapat bermanfaat untuk mengetahui struktur populasi, konektivitas dan keragaman genetik S. trocheliophorum sehingga dapat diketahui pola distribusinya. Selain itu dapat mempermudah dalam proses pembentukan kawasan konservasi yang berkesinambungan antar pulau dengan mengetahui pola distribusi S. trocheliophorum, sehingga dapat membantu dalam proses perlindungan keanekargaman hayati Indonesia.
Ruang Lingkup Penelitian
4
METODE
Waktu dan Lokasi Penelitian
Penelitian ini dilaksanakan pada bulan April 2013 - Febuari 2014. Pengambilan sampel karang lunak dilakukan di perairan laut Jawa (Pulau Tunda dan P. Panggang), perairan Nusa Tenggara (P. Labuan Bajo dan Gili Tapan) dan perairan Sulawesi (Pulau Sembilan, P. Tanakeke dan P. Dutungan) (Gambar 1). Analisis molekuler dilakukan di Laboratorium Biodiversitas dan Biosistematika Kelautan FPIK IPB.
Gambar 1 Peta lokasi pengambilan sampel Sarcophyton trocheliophorum Pengambilan Sampel
Metode pengambilan sampel dilakukan secara purposive random sampling. Sampel karang lunak dikoleksi dengan menggunakan alat SCUBA/snorkel dari kedalaman 5 - 7 m. Untuk identifikasi awal, koloni karang yang akan dikoleksi terlebih dahulu didokumentasikan dengan kamera bawah air (Gambar 3). Pengambilan sampel dilakukan secara non-destruktif yaitu dengan mengambil sampel tanpa merusak koloni tersebut. Pengambilan jaringan karang dilakukan dengan mengambilnya sepanjang 3 cm, jaringan kemudian dibilas dengan air tawar yang bertujuan untuk menghilangkan zooxanthellae lalu diawetkan dalam ethanol 96%.
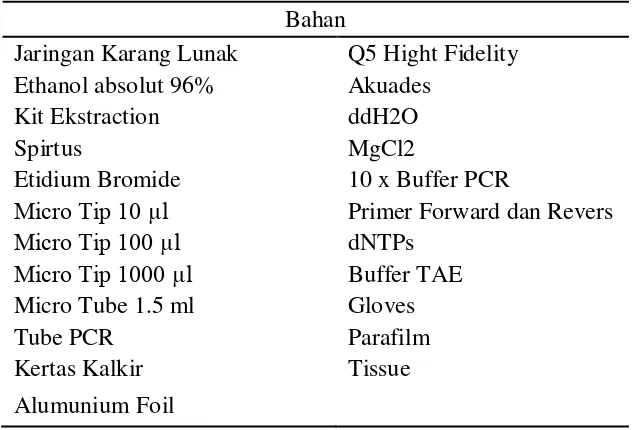
Bahan
Bahan-bahan yang digunakan dalam penelitian ini meliputi bahan-bahan yang digpakai dalam pengambilan sampel maupun dalam analisis molekuler, terdapat pada Tabel 1.
Alat
5 Tabel 1 Bahan-bahan yang digunakan dalam penelitian.
Tabel 2 Alat-alat yang digunakan dalam penelitian. Alat
Alat Scuba UV transilunimator
Snorkle Mesin Elektroforesis
Pisau Micro Pipet 10 µl
Gunting Micro Pipet 100 µl
Cawan Petri Micro Pipet 1000 µl
Bunsen Oven
Inkubator Mesin PCR
Mini Spin Microsmash
Vortek Pinset
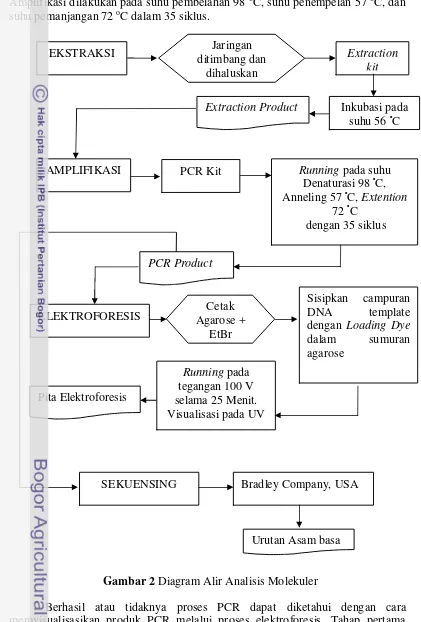
Prosedur Analisis Karakter Molekuler
Prosedur analisis molekuler diawali dengan ekstraksi, PCR, elektroforesis dan sekuensing. Proses ekstraksi diawali dengan pencucian jaringan dengan menggunakan aquades untuk menghilangkan pengaruh ethanol. Ekstraksi DNA dilakukan dengan menggunakan extraction kit (Qiagen Kit). Selanjutnya dilakukan penggerusan jaringan dengan menggunakan microsmash untuk mempermudah proses lisis jaringan dalam tahap inkubasi. Jaringan yang telah halus ditambahkan dengan reagen dari qiagen kit lalu diinkubasi pada suhu 56 ºC hingga jaringan lisis. Pemisahan DNA dilakukan dengan menggunakan centrifuge dengan kecepatan 13000 rpm.
Setelah dihasilkan template DNA dari proses ekstraksi, dilanjutkan dengan amplifikasi. Proses amplifikasi DNA dengan menggunakan primer (16S647F: 5-ACACAGCTCGGTTTCTATCTACCA-3 dan ND21418R:5- ACATCGGGAGC CCACATA-3) untuk fragmen ND2 (France and Hoover, 2002). 3 µl template
Bahan
Jaringan Karang Lunak Q5 Hight Fidelity Ethanol absolut 96% Akuades
Kit Ekstraction ddH2O
Spirtus MgCl2
Etidium Bromide 10 x Buffer PCR
Micro Tip 10 µl Primer Forward dan Revers
6
DNA direaksikan dengan 12.5 µl Q5 high fidelity master mix, 7 µl ddH2O, primer forward dan reverse masing-masing 1,25 µl dalam proses amplifikasi DNA. Amplifikasi dilakukan pada suhu pembelahan 98 oC, suhu penempelan 57 oC, dan suhu pemanjangan 72 oC dalam 35 siklus.
Berhasil atau tidaknya proses PCR dapat diketahui dengan cara memvisualisasikan produk PCR melalui proses elektroforesis. Tahap pertama Karang
lunak
Gambar 2 Diagram Alir Analisis Molekuler EKSTRAKSI ditimbang dan Jaringan
dihaluskan
AMPLIFIKASI PCR Kit Running pada suhu
Denaturasi 98 ᵒC, Anneling 57 ᵒC, Extention
72 ᵒC dengan 35 siklus
PCR Product
7 elektroforesis adalah pembuatan gel agarosa 1.5 % dengan pewarna Etidium Bromide (4 µl) dan larutan TAE 1X 100 ml sebagai media elektroforesis. Agarose tersebut dipanaskan pada microwave dan kemudian agarose dicetak dalam cetakan bersisir hingga membeku. Selanjutnya 4 µl produk Hasil PCR diambil dan dicampurkan dengan Loading dye (1 µl), kemudian disisipkan di sumuran dalam cetakan agarose yang terendam dalam larutan TAE 1 X. Elektroforesis dilakukan pada tegangan 100 V selama 25 menit. Pita hasil elektroforesis dapat dilihat dengan menggunakan sinar ultraviolet pada UV transluminator.
Jika hasil PCR positif mengandung DNA yang diinginkan, maka kemudian dikirim ke Barkley, USA untuk dilakukan sekuensing. Sekeunsing atau pengurutan DNA merupakan suatu teknik untuk menentukan urutan basa nukleotida pada molekul DNA, hal ini bertujuan untuk menentukan identitas genetik. Prinsip dari sekuensing ini yaitu untuk menentukan urutan basa ACGT yang dijadikan sebagai cetakan (template) untuk kemudian diamplifikasi menggunakan enzim (Zein 2013). Prosedur analisis karakter molekuler umum dapat dilihat pada Gambar 2.
Gambar 3 Bentuk Morfologi S. trocheliophorum Analisis Data
Struktur Populasi, dan Konektivitas Genetik
8
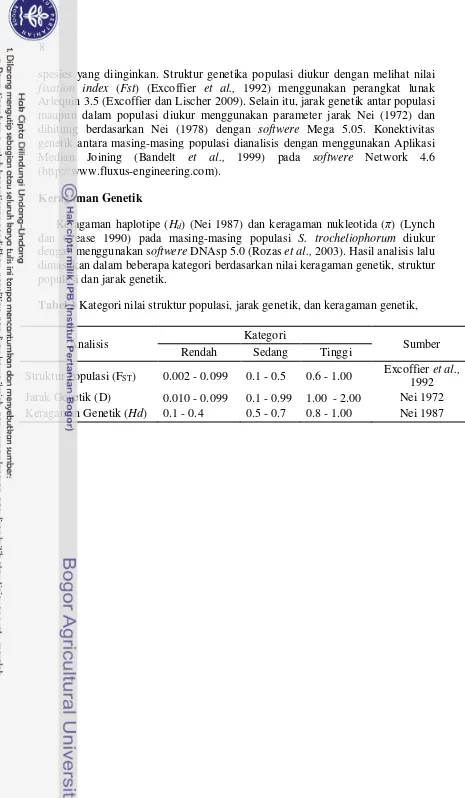
spesies yang diinginkan. Struktur genetika populasi diukur dengan melihat nilai fixation index (Fst) (Excoffier et al., 1992) menggunakan perangkat lunak Arlequin 3.5 (Excoffier dan Lischer 2009). Selain itu, jarak genetik antar populasi maupun dalam populasi diukur menggunakan parameter jarak Nei (1972) dan dihitung berdasarkan Nei (1978) dengan softwere Mega 5.05. Konektivitas genetik antara masing-masing populasi dianalisis dengan menggunakan Aplikasi Median Joining (Bandelt et al., 1999) pada softwere Network 4.6 (http://www.fluxus-engineering.com).
Keragaman Genetik
Keragaman haplotipe (Hd) (Nei 1987) dan keragaman nukleotida (π) (Lynch
dan Crease 1990) pada masing-masing populasi S. trocheliophorum diukur dengan menggunakan softwere DNAsp 5.0 (Rozas et al., 2003). Hasil analisis lalu dimasukan dalam beberapa kategori berdasarkan nilai keragaman genetik, struktur populasi dan jarak genetik.
Tabel 3 Kategori nilai struktur populasi, jarak genetik, dan keragaman genetik,
Analisis Kategori Sumber
Rendah Sedang Tinggi
9
HASIL DAN PEMBAHASAN
Struktur Populasi dan Konektivitas Genetik
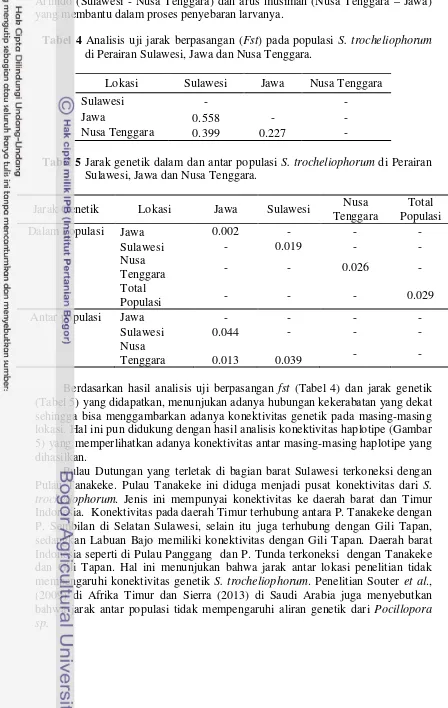
Hasil analisis panjang fragmen DNA dari semua sampel menunjukan panjang fragmen 750-bp. Hasil seluruh sampel yang didapatkan memiliki kemiripan sebesar 98-100% dengan S. trocheliophorum pada Genebank. Analisis jarak genetik dalam populasi dapat dilihat pada Tabel 5. Jarak genetik S. trocheliophorum terbesar dimiliki oleh populasi Perairan Nusa Tenggara, yaitu 0.026 diikuti oleh populasi Perairan Sulawesi 0.019 dan terkecil pada populasi Perairan Jawa 0.002. Jarak genetik menunjukan hubungan genetik yang terdapat antar populasi. Jarak genetik di tiga populasi, menunjukan adanya hubungan genetik yang sangat dekat. Hal ini sesuai dengan pernyataan Nei (1972) yang menyebutkan bahwa nilai jarak genetik 0.010 – 0.099 masuk dalam kategori rendah. Semakin rendah nilai dari jarak genetik menandakan adanya hubungan genetik yang sangat dekat.
Besarnya jarak genetik yang dimiliki populasi Perairan Nusa Tenggara ini diduga karena dua lokasi yang mewakili populasi ini yaitu Gili Tapan dan Labuan Bajo mempunyai perbedaan topografi. Gili Tapan merupakan sebuah kawasan semi tertutup, karena adanya P. Medang yang menghalangi perairan Gili Tapan. Sedangkan Labuan Bajo merupakan perairan terbuka. Hal ini menyebabkan larva S. trocheliophorum yang berasal dari Labuan Bajo sulit untuk masuk ke Gili Tapan, ataupun sebaliknya.
Populasi Perairan Sulawesi juga memiliki jarak genetik yang cukup besar dibandingkan dengan populasi Perairan Jawa, akan tetapi lebih kecil dari populasi Perairan Nusa Tenggara. Jarak yang jauh antara P. Dutungan dan P. Tanakeke dengan P. Sembilan yang terletak didalam Teluk Bone memungkinkan larva S. trocheliophorum sulit untuk melintas. Berbeda dengan dua populasi yang lain, populasi Perairan Jawa memiliki jarak genetik yang sangat kecil. Hal ini karena letak dari P. Panggang dan P Tunda yang berdekatan. Arus yang mengalir ke barat (Mei – September) dan timur (November - Maret) di Laut Jawa membantu adanya pertukaran larva pada tiap musim.
10
aliran genetik yang terdapat pada tiga populasi diduga dipengaruhi oleh arus Arlindo (Sulawesi - Nusa Tenggara) dan arus musiman (Nusa Tenggara – Jawa) yang membantu dalam proses penyebaran larvanya.
Tabel 4 Analisis uji jarak berpasangan (Fst) pada populasi S. trocheliophorum di Perairan Sulawesi, Jawa dan Nusa Tenggara.
Lokasi Sulawesi Jawa Nusa Tenggara
Sulawesi - -
Jawa 0.558 - -
Nusa Tenggara 0.399 0.227 -
Tabel 5 Jarak genetik dalam dan antar populasi S. trocheliophorum di Perairan Sulawesi, Jawa dan Nusa Tenggara.
Jarak Genetik Lokasi Jawa Sulawesi Nusa
Tenggara (Tabel 5) yang didapatkan, menunjukan adanya hubungan kekerabatan yang dekat sehingga bisa menggambarkan adanya konektivitas genetik pada masing-masing lokasi. Hal ini pun didukung dengan hasil analisis konektivitas haplotipe (Gambar 5) yang memperlihatkan adanya konektivitas antar masing-masing haplotipe yang dihasilkan.
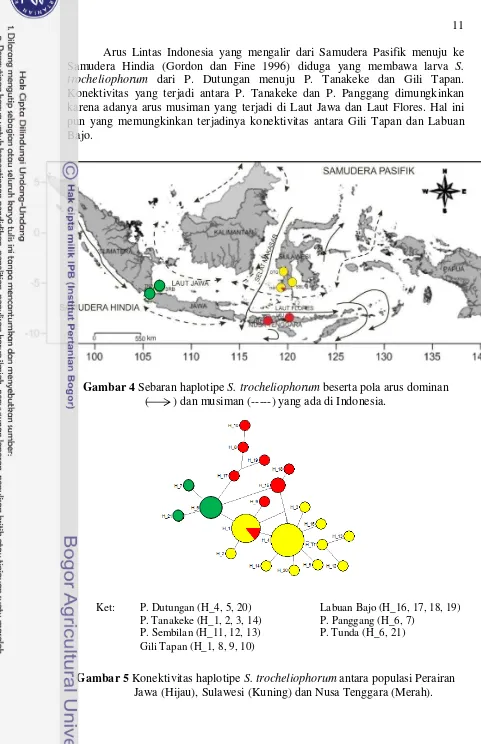
11 Arus Lintas Indonesia yang mengalir dari Samudera Pasifik menuju ke Samudera Hindia (Gordon dan Fine 1996) diduga yang membawa larva S. trocheliophorum dari P. Dutungan menuju P. Tanakeke dan Gili Tapan. Konektivitas yang terjadi antara P. Tanakeke dan P. Panggang dimungkinkan karena adanya arus musiman yang terjadi di Laut Jawa dan Laut Flores. Hal ini pun yang memungkinkan terjadinya konektivitas antara Gili Tapan dan Labuan Bajo.
Gambar 4 Sebaran haplotipe S. trocheliophorum beserta pola arus dominan ( ) dan musiman (---) yang ada di Indonesia.
Gambar 5 Konektivitas haplotipe S. trocheliophorum antara populasi Perairan Jawa (Hijau), Sulawesi (Kuning) dan Nusa Tenggara (Merah).
Ket: P. Dutungan (H_4, 5, 20) Labuan Bajo (H_16, 17, 18, 19) P. Tanakeke (H_1, 2, 3, 14) P. Panggang (H_6, 7)
P. Sembilan (H_11, 12, 13) P. Tunda (H_6, 21) Gili Tapan (H_1, 8, 9, 10)
12
Konektivitas di tiga populasi diduga terjadi karena reproduksi dari S. trocheliophorum yang bersifat gonochoric (Fabricus dan Philip 2001). Larva Sarcophyton sp. yang bersifat statis dan mampu bertahan 14 hari dikolom air berenang mengikuti arus perairan (Benayahu dan Loya 1986). Hal ini memberikan peluang hidup yang besar bagi larva S. trocheliophorum untuk dapat terdistribusi dan menetap jauh dari populasi asal. Menurut Manuputty (2005) koloni baru dapat terpisah sejauh 10 -100 km dari induknya. Arus yang mengalir diduga membawa larva S. trocheliophorum keberbagai populasi dan terjadi percampuran antar populasi, seperti yang terjadi antara Populasi P. Tanakeke - Gili Tapan. Percampuran yang terjadi didalam populasi P. Tanakeke dimungkinkan oleh adanya arus lintas indonesia yang berasal dari Samudera Pasifik, selain itu juga adanya arus musiman yang terjadi di Laut Flores. Menurut Botsford et al., (2009) menyebutkan bahwa pola sirkulasi arus akan memberikan informasi mengenai penyebaran larva dari karang lunak sehingga dapat mengetahui pola konektivitasnya.
Berdasarkan konektivitas genetik yang didapatkan dari tiga populasi, populasi Perairan Sulawesi khususnya Pulau Tanakeke merupakan pusat konektivitas S. trocheliophorum. P. Tanakeke terkoneksi ke berbagai Pulau di Barat dan Timur Indonesia (Gambar 4). Oleh karena itu perlu adanya perhatian yang lebih atau pembentukan kawasan konservasi laut di P. Tanakeke agar lokasi tersebut tetap menjadi pusat keragaman genetik dan tetap memasok larva S. trocheliophorum ke wilayah Barat dan Timur Indonesia. Hal ini dikarenakan konektivitas secara spasial dan temporal dapat digunakan sebagai implikasi pengelolaan ekosistem terumbu karang, khususnya untuk merancang kawasan konservasi laut (Munday et al., 2009). Pengelolaan ekosistem terumbu karang kawasan konservasi laut yang menyeluruh dan terpadu antar pulau akan memberikan dampak yang besar, karena dapat saling mendukung bagi kelestarian satu sama lain. Kelestarian ekosistem terumbu karang akan menjaga potensi S. trocheliophorum sebagai karang hias dan juga bahan ekspor.
Keragaman Genetik
13 sedang, dan 0.100 - 0.400 merupakan kategori rendah. Nuryanto (2009) menyebutkan bahwa keragaman genetik yang tinggi mencerminkan besarnya ukuran populasi, sedangkan penurunan ukuran populasi akan mengurangi keragaman genetik.
Nilai keragaman genetik yang rendah pada populasi Perairan Jawa menunjukan ukuran populasi S. trocheliophorum yang rendah di lokasi tersebut. Nilai keragaman genetik yang kecil pada populasi Perairan Jawa dimungkinkan karena adanya limbah domestik dan pabrik yang berasal dari teluk jakarta. Dampak penurunan kualitas perairan Teluk Jakarta hingga ke perairan Kepulauan Seribu yang berjarak 50 km (Sachoemar dan Wahjono 2007). Hal ini dapat mengganggu pertumbuhan S. trocheliophorum yang berdampak pada kematian. Keragaman genetik pada populasi Perairan Jawa berbanding terbalik dengan populasi di Perairan Nusa Tenggara sebesar 0.972. Tingginya keragaman genetik ini menunjukan semakin tinggi ukuran populasi di Perairan Nusa Tenggara. Nusa Tenggara berdasarkan data kualitas lingkungan hidup menepati posisi ke tiga dari semua provinsi di Indonesia dengan tingkat pencemaran yang rendah (KLH 2011). Populasi di Perairan Sulawesi mempunyai nilai keragaman genetik 0.815. Walaupun masih dalam kategori keragaman genetik yang tinggi, nilai tersebut lebih kecil dibandingkan dengan nilai yang diperoleh populasi Perairan Nusa Tenggara. Penurunan keragaman genetik ini dimungkinkan karena pencemaran dan degradasi terumbu karang yang terjadi di Kepulauan Spermonde (Erdmann 1995, Edinger et al., 1998).
Tabel 6 Jumlah haplotipe (Hn), keragaman haplotipe (Hd), keragaman nukleotida
(π) dan jumlah sampel (n) S. trocheliophorum pada populasi Perairan Jawa, Sulawesi dan Nusa Tenggara, Indonesia.
Populasi N Keragaman Genetik
Hn Hd π
Jawa 6 3 0.600 0.002
Sulawesi 24 11 0.815 0.019
Nusa Tenggara 9 8 0.972 0.019
Total Populasi 39 21 0.914 0.028
Tangkap lebih yang terjadi pada perairan pesisir berdampak terhadap penurunan keragaman genetik pada suatu populasi. Penangkapan ikan dengan menggunakan bom maupun dengan menggunakan racun sianida juga mempengaruhi komunitas terumbu karang. Pariwisata yang tidak ramah lingkungan turut menyumbang tekanan terhadap ekosistem terumbu karang sehingga menyebabkan kerusakan dan berdampak pada menurunnya ukuran populasi S. trocheliophorum pada ekosistem terumbu karang.
14
terpapar panas lebih dari 39 jam (Strychar et al., 2005). Hasil penelitian yang dilakukan oleh Woo et al. (2012) membuktikan bahwa stres lingkungan yang terjadi pada karang lunak Scleronephthya gracillimum mengakibatkan adanya perubahan pada ekpresi gen, sebagai respon terhadap perubahan lingkungan. Bila perubahan yang terjadi tidak bersifat letal dan diwariskan ke generasi berikutnya maka akan meningkatkan variasi di dalam populasi, akan tetapi bila perubahan tersebut bersifat letal maka akan menurunkan ukuran populasi.
Keragaman genetik yang kecil pada populasi Perairan Jawa dapat disebabkan karena tidak adanya isolasi jarak pada kedua pulau yang mewakili populasi ini. Jarak antara P. Tunda dan P. Panggang yang dekat (±80 Km) dan arus musiman yang mengalir memudahkan pertukaran larva-larva S. trocheliophorum. Pertukaran larva tersebut dapat menyebabkan semakin dekatnya hubungan kekerabatan diantara kedua pulau tersebut. Hal ini terlihat dari nilai jarak genetik dalam populasi perairan P. Jawa sebesar 0.002 (Tabel 5). Mudahnya pertukaran tersebut memungkinkan naiknya intensitas pertukaran sehingga menyebabkan inbreeding. Inbreeding berbahaya bagi suatu populasi, karena dapat menyebabkan menurunnya keragaman genetik (Valtuena 2014). Akan tetapi alasan ini masih lemah karena diduga P. Tunda dan P. Panggang memperoleh masukan genetik dari beberapa populasi disekitarnya seperti P. Biawak dan Kepulauan Karimunjawa.
Isolasi geografis yang terjadi pada Gili Tapan di Populasi perairan Nusa Tenggara menjadi sebuah hambatan bagi penyebaran larva S. trocheliophorum, sehingga sulit terjadi pertukaran susunan gen dengan S. trocheliophorum yang berada pada Labuan Bajo. Dalam kurun waktu yang lama kedua populasi tersebut akan semakin berbeda, karena masing-masing populasi menjalani evolusi dengan cara yang berbeda-beda. Hal ini sesuai dengan dengan nilai jarak genetik yang didapatkan antara Labuan Bajo dan Gili Tapan yaitu 0.026. Jarak genetik tersebut memiliki hubungan kekerabatan yang paling jauh dibandingkan dengan populasi yang lain. Jarak genetik yang jauh inilah yang memungkinkan keragaman genetik pada populasi Perairan Nusa Tenggara lebih besar dibandingkan dengan populasi yang lain.
Hasil penelitian menunjukan populasi di Perairan Sulawesi memiliki keragaman genetik (Tabel 6) yang besar berdasarkan kategori dari Nei (1987). Besarnya keragaman genetik ini dimungkinkan karena masukan genetik dari Populasi Filipina menuju P. Dutungan dan P. Tanakeke yang terbawa arus dari Samudera Pasifik. Letak P. Sembilan yang masuk dalam Teluk Bone juga memungkinkan adanya variasi genetik yang besar.
15 dengan pernyataan Bengen (2002) yang menyatakan bahwa salah satu upaya perlindungan ekosistem pesisir dan laut adalah dengan menetapkan suatu kawasan dipesisir dan laut sebagai kawasan konservasi. Pembentukan kawasan konservasi bertujuan untuk melindungi habitat yang kritis, mempertahankan dan meningkatkan kualitas sumberdaya, melindungi keanekaragaman hayati dan melindungi proses-proses ekologi.
Upaya selanjutnya untuk memperbaiki keragaman genetik S. trocheliophorum yaitu dengan cara menginduksi S. trocheliophorum dari populasi lain. Induksi bertujuan untuk menaikan keragaman genetik yang rendah karena menurunnya ukuran populasi akibat inbreeding. Induksi ini bisa dilakukan ketika melakukan transplantasi. Saat ini transplantasi karang masih menggunakan karang dalam satu populasi, oleh karena itu kemungkinan terjadinya inbreeding cukup besar. Akan tetapi cara ini masih menimbulkan perdebatan, karena dapat merusak konektivitas alamiah dari S. trocheliophorum.
Konektivitas genetik erat kaitannya dengan keragaman genetik. Konektivitas genetik yang terjaga dengan baik akan mempengaruhi tingginya keragaman genetik pada suatu populasi. Menurut Beardmore (1983) keragaman genetik suatu populasi akan meningkat jika terdapat suatu masukan genetik dari populasi lain atau biasa disebut dengan migrasi genetik. Hal ini dikarenakan migrasi yang besar akan menyebabkan terjadinya perkawinan silang dan percampuran gen antar populasi yang berbeda, sehingga akan diperoleh variasi gen yang berbeda-beda.
16
SIMPULAN DAN SARAN
Simpulan
Hasil penelitian ini dapat disimpulkan bahwa struktur populasi genetik di tiga populasi menunjukan adanya hubungan genetik yang dekat antar populasi. Konektivitas genetik terhubung diantara populasi Perairan Jawa, Sulawesi, Nusa Tenggara. Keragaman haplotipe S. trocheliophorum terkecil terdapat pada populasi perairan Jawa dan paling besar pada populasi Perairan Nusa Tenggara dan Sulawesi. Besarnya keragaman genetik pada populasi Perairan Sulawesi dan Tanakeke yang menjadi pusat konektivitas diharapkan dapat perhatian lebih agar P. Tanakeke tetap dapat memasok larva-larva S. trocheliophorum keberbagai populasi lain.
Saran
Berdasarkan hasil yang telah didapatkan, maka penulis menyarankan agar dilakukan penelitian lebih lanjut dengan menambahkan jumlah sampel dan jumlah lokasi penelitian seperti pada populasi Sumatera, P. Karimunjawa, P. Bawean dan beberapa pulau di timur Indonesia, sehingga dapat menggambarkan lebih jelas konetivitas dan keragaman genetik S. trocheliophorum.
DAFTAR PUSTAKA
Adjeroud M, Guérécheau A, Vidal-Dupiol J, Flot J, Arnaud-Haond S, & Bonhomme F. 2014. Genetic diversity, clonality and connectivity in the scleractinian coral Pocillopora damicornis: a multi-scale analysis in an insular, fragmented reef system. Marine Biology. 161(30): 531-541. Almany GR, SR Connolly, DD Heath, JD Hogan, GP Jones, LJ McCook, M
Mills, RL Pressey & DH Williamson. 2009. Connectivity, biodiversity conservation and the design of marine reserve networks for coral reefs. Coral Reefs, 28: 339–351.
Bandelt HJ, Forster P, & Röhl A. 1999. Median-joining networks for inferring intraspecific phylogenies. Mol Biol Evol. 16:37-48.
Beardmore JA. 1983. Extinction, Survival, and Genetic Variation. dalam: Genetics and Conservation. Schonewald-cox CMS, Chambers M, Macbryde B, & Thomas WL (Editor). The Benjamin/Cummings Publishing Company, Inc. London
Benayahu Y & Loya Y. 1986. Sexual reproduction of a softcoral: Synchronous and brief annual spawning of Sarcophyton glaucum (Quoy & Gairmard. 1833). Biol. Bull. 170: 32-42.
Benayahu Y. 1985. Faunistic compotition and pattern in the distribution of softcoral (Octocorallia Alcyonacea) along the coral reefs of Sinai Peninsula. Proc. 5th Int. Coral Reef Symp. Tahiti, 6:255-260.
Bengen DG. 2002. Sinopsis ekosistem sumberdaya alam pesisir dan laut serta prinsip pengelolaannya. Pusat Kajian Sumberdaya Pesisir dan Lautan. Institut Pertanian Bogor. Bogor. 66 hal.
17 of coral reef metapopulations in marine protected areas: matching empirical efforts to predictive needs. Coral Reefs. 28:327–337.
Edinger EN, Jompa J, Limmon GV, Widjatmoko W, & Risk MJ. 1998. Reef degradation and coral biodiversity in Indonesia: Effects of land-based pollution, destructive fishing practices and changes over time. Mar Pollut Bull 36: 617–630.
Erdmann M. 1995. An ABC guide to coral reef fisheries in southwest Sulawesi, Indonesia. Naga, ICLARM Quarterly. 18(2):4–6.
Excoffier L & Lischer H. 2009. Arlequin ver 3.5 user manual ; An integrated software package for population genetics data analysis. Swiss Institute of Bioinformatics.
Exoffier L, Smouse PE, & Quattro JM. 1992. Analysis of moleculer variance inferred from metric distance among DNA haplotipes; application to human mitochondrial DNA restriction data. Genetics. (131): 479-491. Fabricus K & A Philips. 2001. Softcoral and Sea fans. Australia Institute Of Complementary insights from empirical and Modelled gene flow. Molecular Ecology. 21: 1143–1157.
Goodbody-Gringley G, Woollacott RM, Giribet G. 2011. Population structure and connectivity in the Atlantic scleractinian coral Montastraea cavernosa (Linnaeus, 1767). Marine Ecology. 1–17.
Gordon AL & Fine RA. 1996. Pathways of water between the Pacific and Indian Oceans in the Indonesian seas. Nature. 379 : 146-149.
Green ER & Shirley F. 1999. The Global Trade in Coral. World conservation monitoring centre. World Conservation Press, Cambridge, UK. 60 hal. Hellberg ME, Burton RS, Neigel JE, & Palumbi SR. 2002. Genetic assessment of
connectivity among marine population. Bulletin of Marine Science, 70(1): 273–290.
Hoegh-Guldberg O. 2011. Coral reef ecosystems and anthropogenic climate change. Reg Environ Change, 11: 215–227.
Hughes AR, Brian D, Inouye, Marc TJJ, Nora U, & Mark V. 2008. Ecological consequences of genetic diversity. Ecology Letters. 11: 609–623.
Jackson JBC. 1986. Modes of dispersal of clonal benthic invertebrates: consequences for species distribution sand genetic structure of local populations. Bull Mar Sci32: 588−606.
KLH. 2011. Laporan Indeks Kualitas Lingkungan Hidup Indonesia. 70 hal
Lande R. 1988. Genetics and demography in biological Conservation. Science. 241(4872): 1455-1460.
Lynch M & Crease TJ. 1990. The analysis of population survey data on DNA sequence variation. Moleculer Biology Evolution, 7: 337–394.
18
Manuputty AEW. 2002. Karang lunak (soft coral) perairan Indonesia (Buku I, Laut Jawa & Selat Sunda). Jakarta (ID): Lembaga Ilmu Pengetahuan Indonesia. Pusat Penelitian Oseanografi. 91 hal
Manuputty AEW. 1996. Pengenalan beberapa karang lunak (Octocorallia, Alcyonacea) di Lapangan. Oseana. 21(4): 1-11.
McFadden CS, Alderslade P, van Ofwegen LP, Johnsen H, & Rusmevichientong A. 2006. Phylogenetic relationships within the tropical softcoral genera Sarcophyton and Lobophytum (Anthozoa, Octocorallia). Invertebrate Biology. 125(4): 288–305.
Munday PL, Leis JM, Lough JM, Paris CB, Kingsford MJ, Berumen ML, & Lambrechts J. 2009. Climate change and coral reef connectivity. Coral Reefs. 28: 379–395.
Nei M. 1987. Moleculer evolutionary genetics. Columbia University. Press. New York. 512 hal.
Nei M. 1978. Estimation of average heterozygosity and genetic distance from a small number of individuals. Genetics, 89: 583-590.
Nei M. 1972. Genetic distance between population. American Nature, 106: 283-292.
Nuryanto A & M. Kochzius. 2009. Highly restricted gene flow and deep evolutionary lineages in the giant clam Tridacna maxima. Coral Reefs, 28: 607–619.
Perwati LK. 2009. Analisis derajat ploidi dan pengaruhnya terhadap variasi ukuran stomata dan spora pada Adiantum raddianum. Bioma. 11(2): 39-44.
Poehlman JW & JS Quick. 1983. Crop Breeding in Hungry World, In K.M. Rawal and M.N. Wood (Eds.) Crop Breeding. The American Society of Agronomy, Inc. and The Crop Science of Society, Inc. Madison Wisconsin. USA.
Rozas J, Sanchez-DeI BJC, Messeguer, Rozas XR. 2003. DnaSP, DNA polymorphism analyses by the coalescent and other methods. Bioinformatics, 19: 2496–2497.
Sachoemar SI, Wahjono HD. 2007. Pencemaran lingkungan perairan di Teluk Jakarta. JAI. 3(1): 1-14.
Sierra VR. 2013. Genetic Connectivity of the Reef Building Coral Pocillopora sp. in the Red Sea. Thesis. University of Bremen. Jerman.
Souter P, Henriksson O, Olsson N & Grahn M. 2009. Patterns of genetic structuring in the coral Pocillopora damicornis on reefs in East Africa. BMC ecology. 9: 1-19.
Spalding M, Ravilious C, & Green EP. 2000. World atlas of coral reefs. United Nations Environment Programme World Conservation Monitoring Centre, Cambridge, U.K.
Strychar KB, Coates TM, Sammarco PW, Piva TJ, & Scott PT. 2005. Loss of Symbiodinium from bleached soft corals Sarcophyton ehrenbergi, Sinularia sp. and Xenia sp. Journal of Experimental Marine Biology and Ecology. 320: 159–177.
19 likehood, evolutionary distance and maximum parsimony method. Moleculer Biology Evolution, 28(10): 2731-2739.
Valtuena FJ, Lopez J, Olivencia AO, Riano TR, & Gonzales M. 2014. Contrasting inbreeding depression in early and late stages of the life cycle of a Mediterranean shrub, Anagyris foetida (Leguminosae). Turkish Journal of Botany. 38: 334-346.
Wijayanti DP, Indrayanti E, & Suryono CA. 2009. Kajian konektivitas genetik antar terumbu sebagai dasar perencanaan kawasan restorasi karang dalam upaya menghadapi global warming. Semarang (ID):Universitas Diponegoro. 30 Hal.
Wilkinson C. 2002. Status of coral reefs of the world:2002. Australian Institute of Marine Science. Australia.
Woo S , Sungjin H, Joon IS, Chaolun AC, Dongsung K, & Seungshic Y. 2012. Transcriptomic signature in soft coral exposed to abiotic stresses. Proceedings of the 12th International Coral Reef Symposium : 1-2
20
21 Lampiran 1 Persiapan preparasi sampel S. trocheliophorum
22
Lampiran 4. Urutan fragmen DNA S. trocheliophorum
23