POTENSI ANTIPENUAAN FORMULA EKSTRAK AIR DAUN
JAMBU BIJI (Psidium guajava) DAN DAUN KEDAWUNG
(Parkia javanica)
RAHAYU SESMITA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DANSUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Potensi Antipenuaan Formula Ekstrak Air Daun Jambu Biji (Psidium guajava) dan Daun Kedawung (Parkia javanica) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2015
Rahayu Sesmita
ABSTRAK
RAHAYU SESMITA. Potensi Antipenuaan Formula Ekstrak Air Daun Jambu Biji (Psidium guajava) dan Daun Kedawung (Parkia javanica). Dibimbing oleh DYAH ISWANTINI PRADONO dan IRMANIDA BATUBARA.
Psidium guajava dan Parkia javanica yang dikenal dengan jambu biji dan kedawung merupakan tanaman yang memiliki kemampuan sebagai antioksidan. Penelitian ini bertujuan menentukan kandungan senyawa, aktivitas antioksidan, total fenol dan potensi antipenuaan dari ekstrak air daun jambu biji dan kedawung. Berdasarkan hasil uji fitokimia, komponen kimia yang terkandung dalam ekstrak daun jambu biji dan kedawung adalah golongan flavonoid, steroid, tanin dan saponin. Ekstrak tunggal kedawung (F3) memiliki aktivitas antioksidan lebih tinggi dibanding formulasi lainnya (IC50 30.24 ppm) tetapi lebih rendah daripada asam askorbat IC5017.16 ppm. Kandungan total fenol kedawung (F3) lebih besar daripada formula lainnya tetapi lebih kecil daripada asam askorbat. Ekstrak air daun jambu biji dan kedawung memiliki aktivitas inhibisi terhadap senyawa AGEs sehingga dapat dimanfaatkan sebagai antipenuaan akan tetapi tidak memiliki hubungan yang beraturan antara konsentrasi sampel dan aktivitas inbibisinya.
Kata kunci: AGEs, antipenuaan, antioksidan, glikosilasi, Jambu biji, kedawung
ABSTRACT
RAHAYU SESMITA. Antiaging Potential of Aqueous Leaf Extract Formulas of
Psidium guajava and Parkia javanica. Supervised by DYAH ISWANTINI PRADONO dan IRMANIDA BATUBARA.
Guava (Psidium guajava) and kedawung (Parkia javanica) are potential as antioxidant. This study aims to determine metabolite compounds, antioxidant activity, total phenols and potential antiaging of aqueous leaf extract of guava and
kedawung. Based on the test of phytochemicals, chemical components in both extracts are flavonoid, steroids, tannins and saponins. Antioxidant activity of F3 (kedawung extract) was higher than that of other formulas (IC50 30.24 ppm) but lower than that of ascorbic acid (IC50 17.16 ppm). The total phenolic compound of
kedawung was higher than that of other formulas but lower than that of ascorbic acid. The aqueous extract of both species are proven for their inhibition activity of AGEs and can be used as antiaging; however, there is irregular relationship between concentration of the sample and the inhibition activity.
Keywords: AGEs, antiaging, antioxidant, glycocylation, Psidium guajava, Parkia
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Kimia
POTENSI ANTIPENUAAN EKSTRAK AIR DAUN JAMBU
BIJI (Psidium guajava) DAN DAUN KEDAWUNG
(Parkia javanica)
RAHAYU SESMITA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Potensi Antipenuaan Formula Ekstrak Air Daun Jambu Biji (Psidium guajava) dan Daun Kedawung (Parkia javanica) Nama : Rahayu Sesmita
NIM : G44100020
Disetujui oleh
Prof Dr Dyah Iswantini Pradono, MScAgr Pembimbing I
Dr Irmanida Batubara, MSi Pembimbing II
Diketahui oleh
Prof Dr Dra Purwantiningsih Sugita, MS Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah yang
berjudul “Potensi Antipenuaan Formula Ekstrak Air Daun Jambu Biji (Psidium guajava) dan Daun Kedawung (Parkia javanica)”. Karya ilmiah ini disusun berdasarkan penelitian yang dilaksanakan pada bulan Maret-September 2014 di Laboratorium Pusat Studi Biofarmaka, Institut Pertanian Bogor.
Terima kasih penulis ucapkan atas semua bimbingan, dukungan, dan kerja sama yang telah diberikan oleh Prof Dr Dyah Iswantini Pradono, MSc.Agr selaku pembimbing I dan Dr Irmanida Batubara, MSi selaku pembimbing II. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, tante, pak etek, ayah Ed, bunda, almarhum uda, teman-teman GGS serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat. Terima Kasih.
Bogor, Januari 2015
DAFTAR ISI
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN viii
DAFTAR TABEL viii
PENDAHULUAN 1
METODE 2
Bahan dan Alat 2
Preparasi Sampel 3
Penentuan Kadar Air 3
Maserasi 3
Uji Aktivitas Antioksidan dengan Metode DPPH 4
Penentuan Kadar Fenolik Total 5
Uji Potensi Antipenuaan:Pengukuran Absorbans Senyawa AGEs 6
HASIL DAN PEMBAHASAN 6
Kadar Air dan Maserasi 6
Fitokimia 7
Aktivitas Antioksidan 8
Kadar Fenolik Total 9
Uji Potensi Antipenuaan Pengukuran Kadar Inhibisi Reaksi Glikasi Albumin 11
SIMPULAN DAN SARAN 12
Simpulan 12
Saran 13
DAFTAR PUSTAKA 13
DAFTAR GAMBAR
1 Titik selektivitas SCD untuk formulasi ekstrak jambu biji, kedawung
dan asam askorbat 5
2 Nilai IC50 masing-masing formula 9
3 Kandungan fenol total dalam ekstrak air daun jambu biji dan
kedawung 10
4 Profil hubungan antara aktivitas antioksidan (IC50) dan kandungan
fenol total (%b/b EAG). 10
5 Korelasi aktivitas antioksidan (IC50) dan kandungan fenol total 11 6 Aktivitas inhibisi ekstrak air daun jambu biji, kedawung, obat
antipenuaanmerek N, dan kosmetik antipenuaan merek P. 12
DAFTAR LAMPIRAN
1 Bagan alir lingkup kerja penelitian 16
2 Hasil determinasi sampel tanaman 17
3 Penentuan kadar air simplisia daun jambu biji dan kedawung 18 4 Penentuan rendemen ekstrak daun jambu biji dan kedawung 18
5 Aktivitas antioksidan formula 1 19
6 Aktivitas antioksidan formula 2 20
7 Aktivitas antioksidan formula 3 21
8 Aktivitas antioksidan formula 4 22
9 Aktivitas antioksidan formula 5 23
10 Aktivitas antioksidan formula 6 24
11 Aktivitas antioksidan formula 7 25
12 Pembuatan kurva standar asam galat 26
13 Penentuan fenolik total 27
14 Potensi antipenuaan ekstrak daun jambu biji, kedawung, obat merek
N, dan kosmetik merek P 28
DAFTAR TABEL
1 Rancangan komposisi untuk formulasi 5
PENDAHULUAN
Secara alamiah, setiap makhluk hidup atau organisme akan menjadi tua, tetapi proses ini sering kali terjadi lebih cepat yang disebut penuaan dini. Penuaan dini dapat disebabkam antara lain oleh faktor genetik, gaya hidup, lingkungan, mutasi gen, rusaknya sistem kekebalan, dan radikal bebas. Faktor radikal bebas paling sering diungkapkan sebagai penyebab penuaan dini tersebut (Kosasih et al. 2006) karena mampu merusak banyak komponen selular seperti protein, lipid, dan DNA (Hamilton et al. 2001). Reaktivitas radikal bebas dapat menyebabkan kerusakan oksidatif di tingkat molekular maupun selular (Troen 2003). Radikal bebas dapat mengoksidasi protein, yang berakibat pada pembentukan ikatan silang protein, oksidasi asam-asam amino, terputusnya ikatan hidrogen, ikatan van der Waals, dan lain-lain. Salah satu cara untuk mengurangi atau mencegah kerusakan oksidatif pada tingkat selular dan molekular yang dapat memicu terjadinya proses penuaan dini ialah dengan senyawa yang bersifat sebagai antioksidan. mengatasi atau meredam radikal bebas sehingga diharapkan proses penuaan dapat dihambat (Kosasih et al. 2006).
Halliwell (2001) dalam Yagi et al. (2013) mengemukakan bahwa radikal bebas berperan dalam pembentukan senyawa advanced glycation end products
(AGEs). AGEs merupakan senyawa yang dapat memicu penuaan (Povichit et al.
2010 dan Yagi et al. 2013), dan terbentuk karena terjadinya modifikasi protein oleh glukosa melalui reaksi glikosilasi (Yagi et al. 2013). Reaksi glikosilasi merupakan reaksi nonenzimatik yang diawali oleh ikatan antara gugus aldehida dari glukosa dan gugus amino ujung-N pada protein (Suhartono et al. 2004). Menurut Mary et al. (2004), reaksi glikosilasi di dalam plasma akan membentuk senyawa dikarbonil dan AGEs sebagai produk modifikasi protein yang terakumulasi pada berbagai organ selama proses penuaan. Senyawa AGEs bersifat sitotoksik dan terbentuk karena ketidakseimbangan antara oksidan dan prooksidan yang merupakan patogenesis dari penuaan kulit. Senyawa fenolik berperan penting dalam proses antiglikosilasi dan antioksidan yang mengarah kepada penghambatan penuaan, karena memiliki kemampuan meredam radikal bebas (Suwannalert et al. 2012, Sharafzadeh 2013).
Senyawa alam dapat digunakan sebagai antipenuaan seperti dilaporkan oleh Ravichandran et al. (2005). Krim anti-kerut yang merupakan poliherbal dari ekstrak Aloe vera, Papaver rhoeas, Vitis vinifera, Citrus limon, Solanum lycopersicum, Santalum album, Rubia cordifolia, Saussurea lappa, Lensculinaris,
Symplocos racemosa, Amomum subulatum, Curcuma longa, Glycyrrhiza glabra,
2
Sebelumnya banyak beredar produk kecantikan yang menggunakan bahan-bahan berbahaya dan telah dilarang penggunaannya oleh Badan POM RI seperti merkuri, hidrokuinon, asam retinoat, zat warna rodamin, dan dietilena glikol. Penggunaan bahan berbahaya ini dapat menyebabkan kanker kulit, kanker payudara, kanker leher rahim, kanker paru-paru, dan jenis kanker lainnya (BPOM 2011). Tanaman yang dapat dimanfaatkan sebagai antioksidan di antaranya jambu biji dan kedawung. Menurut Hayati (2011), daun jambu biji dan daun kedawung memiliki aktivitas antioksidan paling baik dibandingkan dengan salam, sirih merah, dan bangle.
Jambu biji dan kedawung merupakan tanaman asli Indonesia yang dapat digunakan sebagai obat-obatan tradisional. Tanaman daerah tropis mempunyai potensi yang cukup besar untuk dikembangkan sebagai bahan obat, di antaranya sebagai sumber antioksidan. Antioksidan alami mampu melindungi tubuh terhadap kerusakan yang disebabkan oleh spesies oksigen reaktif, menghambat penyakit degenerative, serta menghambat peroksidasi lipid pada makanan. Suatu tanaman dapat memiliki aktivitas antioksidan apabila mengandung senyawaan yang mampu menangkal radikal bebas seperti flavonoid. Beberapa penelitian telah dilakukan untuk melihat hubungan antara kandungan fenol, flavonoid, dan aktivitas antioksidan (Hayati 2011). Keefektifan antioksidan dapat dipengaruhi oleh beberapa faktor seperti kelarutan, ketersediaan hayati, dan retensi jaringan (Tuminah 2000). Potensi dan stabilitas antioksidan dapat ditingkatkan melalui mekanisme formulasi, yaitu dengan menggabungkan sejumlah ekstrak tunggal sehingga ekstrak gabungan memiliki daya inhibisi yang lebih baik daripada ekstrak tunggalnya (Iswantini et al. 2004).
Penelitian tentang manfaat daun jambu biji dan daun kedawung telah banyak dilakukuan. Akan tetapi, daun jambu biji dan daun kedawung sebagai penghambat proses penuaan (antipenuaan) akibat reaksi AGEs belum pernah diteliti. Oleh karena itu, penelitian ini bertujuan mengkaji peran daun jambu biji dan daun kedawung dalam menghambat proses penuaan yang diakibatkan oleh AGEs. Kemampuan menghambat proses penuaan ditandai dengan aktivitas inhibisi yang menunjukkan menurunkan pembentukan senyawa AGEs. Penelitian diharapkan dapat memberikan nilai tambah manfaat daun jambu biji dan daun kedawung sebagai antioksidan bahan alam yang mampu menghambat penuaan.
METODE
Bahan dan Alat
2
Sebelumnya banyak beredar produk kecantikan yang menggunakan bahan-bahan berbahaya dan telah dilarang penggunaannya oleh Badan POM RI seperti merkuri, hidrokuinon, asam retinoat, zat warna rodamin, dan dietilena glikol. Penggunaan bahan berbahaya ini dapat menyebabkan kanker kulit, kanker payudara, kanker leher rahim, kanker paru-paru, dan jenis kanker lainnya (BPOM 2011). Tanaman yang dapat dimanfaatkan sebagai antioksidan di antaranya jambu biji dan kedawung. Menurut Hayati (2011), daun jambu biji dan daun kedawung memiliki aktivitas antioksidan paling baik dibandingkan dengan salam, sirih merah, dan bangle.
Jambu biji dan kedawung merupakan tanaman asli Indonesia yang dapat digunakan sebagai obat-obatan tradisional. Tanaman daerah tropis mempunyai potensi yang cukup besar untuk dikembangkan sebagai bahan obat, di antaranya sebagai sumber antioksidan. Antioksidan alami mampu melindungi tubuh terhadap kerusakan yang disebabkan oleh spesies oksigen reaktif, menghambat penyakit degenerative, serta menghambat peroksidasi lipid pada makanan. Suatu tanaman dapat memiliki aktivitas antioksidan apabila mengandung senyawaan yang mampu menangkal radikal bebas seperti flavonoid. Beberapa penelitian telah dilakukan untuk melihat hubungan antara kandungan fenol, flavonoid, dan aktivitas antioksidan (Hayati 2011). Keefektifan antioksidan dapat dipengaruhi oleh beberapa faktor seperti kelarutan, ketersediaan hayati, dan retensi jaringan (Tuminah 2000). Potensi dan stabilitas antioksidan dapat ditingkatkan melalui mekanisme formulasi, yaitu dengan menggabungkan sejumlah ekstrak tunggal sehingga ekstrak gabungan memiliki daya inhibisi yang lebih baik daripada ekstrak tunggalnya (Iswantini et al. 2004).
Penelitian tentang manfaat daun jambu biji dan daun kedawung telah banyak dilakukuan. Akan tetapi, daun jambu biji dan daun kedawung sebagai penghambat proses penuaan (antipenuaan) akibat reaksi AGEs belum pernah diteliti. Oleh karena itu, penelitian ini bertujuan mengkaji peran daun jambu biji dan daun kedawung dalam menghambat proses penuaan yang diakibatkan oleh AGEs. Kemampuan menghambat proses penuaan ditandai dengan aktivitas inhibisi yang menunjukkan menurunkan pembentukan senyawa AGEs. Penelitian diharapkan dapat memberikan nilai tambah manfaat daun jambu biji dan daun kedawung sebagai antioksidan bahan alam yang mampu menghambat penuaan.
METODE
Bahan dan Alat
3 sapi (BSA) 30% b/v, asam oksalat 31.5 g/500mL, asam trikloroasetat (TCA) 400 g/L, asam tiobarbiturat TBA 50 mmol/L, obat antipenuaan merek N, dan kosmetik antipenuaan merek P.
Alat-alat yang digunakan pada penelitian ini meliputi cawan, neraca analitik, oven, eksikator, peralatan kaca, maserator, penguap putar, kertas saring, mikropipet, dan spektrofotometer (Ultra violet-Tampak).
Preparasi Sampel
Prosedur penelitian dimulai dengan pembuatan simplisia dari daun jambu biji dan daun kedawung kemudian ditentukan kadar airnya. Serbuk diekstraksi dan ekstrak yang dihasilkan dihitung rendemennya kemudian di uji fitokimia yang mengacu pada Harborne (1987), ditentukan aktivitas antioksidannya dengan metode DPPH (Mosquera et al. 2009), dan di uji potensi antipenuaan dengan metode pengukuran kadar inhibisi reaksi glikasi albumin (Sheikh et al. 2004).
Penentuan Kadar Air (AOAC 2007)
Setiap sampel ditimbang sebanyak 1 g kemudian dimasukkan ke dalam cawan porselen yang telah dikeringkan sebelumnya di dalam oven dengan suhu 105 °C selama 30 menit hingga bobotnya konstan. Cawan porselen berisi sampel tersebut kemudian dipanaskan di dalam oven bersuhu 105°C selama 5 jam, lalu didinginkan di dalam eksikator. Bobot tetap sampel bubuk ditimbang hingga diperoleh hasil yang konstan. Kadar air ditetapkan berdasarkan jumlah bobot kering contoh, sebanyak 3 kali ulangan (triplo).
Kadar air dapat ditentukan dengan rumus berikut:
d r ir
Keterangan:
A = bobot sampel sebelum dikeringkan (g) B= bobot sampel setelah dikeringkan (g)
Maserasi
Daun jambu biji dan kedawung dibuat serbuk berukuran 80 mesh, kemudian masing-masing ditentukan kadar airnya dan diekstraksi. Sampel diekstraksi menggunakan pelarut akuades dengan nisbah 1 g sampel: 10 mL pelarut selama 3×12 jam. Ekstrak kemudian dipekatkan dan ditimbang untuk menentukan rendemen.
Uji Fitokimia (Harborne 1987) Uji Alkaloid
4
pereaksi Mayer, Wagner, dan Dragendorf. Uji positif adanya alkaloid berturut-turut ditunjukkan dengan terbentuknya endapan yang berwarna putih, cokelat, dan merah jingga.
Uji Triterpenoid dan Steroid
Sebanyak 0.25 g ekstrak ditambahkan 5 mL etanol kemudian dipanaskan pada 50 °C dan setelah itu disaring. Filtratnya diuapkan hingga kering kemudian dilarutkan dengan eter.
Lapisan eter diteteskan di atas pelat tetes kemudian dikeringudarakan. Pereaksi Liebermann-Burchard ditambahkan di atas pelat tetes berisi sampel. Hasil uji positif triterpenoid ditunjukkan dengan terbentuknya warna merah, sedangkan hasil uji positif steroid ditunjukkan dengan terbentuknya warna hijau atau biru.
Uji Saponin dan Tanin
Sebanyak 0.5 g ekstrak ditambahkan 10 mL akuades kemudian dipanaskan hingga mendidih selama 5 menit. Setelah 5 menit, larutan tersebut disaring, lalu filtrat dibagi 2. Pada uji saponin dilakukan dengan filtrat didinginkan, lalu dikocok hingga berbusa. Hasil uji positif saponin ditunjukkan dengan tidak menghilangnya busa pada larutan setelah 10 menit. Pada uji tannin, filtrat ditambahkan larutan FeCl3 1%. Uji positif ditandai dengan terbentuknya warna biru tua atau hijau kehitaman.
Uji Fenol dan Flavonoid
Sebanyak 0.25 g ekstrak ditambahkan 15 mL air kemudian dididihkan selama 2 menit dan disaring. Untuk uji fenol, 5 mL filtrat ditambahkan NaOH 10% beberapa tetes. Terbentuknya warna merah menunjukkan adanya senyawa fenolik. Untuk uji flavonoid dilakukan dengan 5 mL filtrat dibagi ke dalam 3 tabung reaksi lalu ke dalam masing-masing tabung ditambahkan 0.1 g serbuk Mg, 1 mL HCl pekat, dan 1 mL n-amil alkohol. Hasil uji positif flavonoid ditunjukkan apabila terbentuk warna merah, kuning atau jingga.
Uji Aktivitas Antioksidan dengan Metode DPPH (Mosquera et al. 2009) Sebanyak 0.0025 g DPPH ditimbang, lalu dilarutkan dengan etanol dalam
l bu t k r 5 mL sehingg konsentr siny menj di 25 μM. L rut n ekstr k
dibuat dengan konsentrasi 0, 20, 40, 80, 100, dan 120 ppm dengan pelarut etanol dalam labu takar 10 mL. Larutan asam askorbat sebagai kontrol positif disiapkan dengan konsentrasi 0, 2.5, 5, 10, dan 15 ppm dalam labu takar 10 mL. Sebanyak 1 mL sampel dan kontrol positif masing-masing dimasukkan ke dalam tabung reaksi
d n l rut n DPPH 25 μM dit mb hk n seb nyak 4 mL ke dalam setiap tabung sesaat sebelum campuran tersebut diinkubasi. Suhu inkubasi diatur pada 37 °C selama 30 menit dan diukur absorbansnya pada panjang gelombang 517 nm, masing-masing 3 kali ulangan (triplo). Kapasitas penghambatan radikal bebas dihitung berdasarkan persamaan
5 A adalah absorbans blangko (kontrol negatif) dan B adalah absorbans sampel. Aktivitas penangkapan pada setiap konsentrasi dialurkan untuk menghitung konsentrasi efektif ekstrak yang dapat menghambat 50% radikal DPPH). Aktivitas antioksidan juga diuji pada formulasi jambu biji, kedawung, dan asam askorbat dengan menggunakan model rancangan sentroid simpleks (SCD) yang merupakan salah satu metode rancangan campuran menggunakan perbedaan proporsi komponen dalam suatu formula dengan menjaga jumlah totalnya konstan (Das et al. 2006). Pada penelitian ini, model SCD dilakukan dengan 3 peubah banyaknya titik ditentukan dengan rumus 2q-1 (Mayang 2007), dengan q mewakili jumlah peubah yang digunakan, yaitu asam askorbat (X1), jambu biji (X2), dan kedawung (X3) (Gambar 3). Rancangan tersebut menghasilkan 7 formula, yaitu F1 (asam askorbat), F2 (jambu biji), F3 (kedawung), F4 (jambu biji-asam askorbat), F5 (kedawung-asam askorbat), F6 (jambu biji-kedawung), F7 (jambu biji-kedawung-asam askorbat) (Tabel 1).
Gambar 1 Titik selektivitas SCD untuk formulasi ekstrak jambu biji, kedawung, dan asam askorbat
Tabel 1 Rancangan komposisi untuk formulasi asam askorbat (X1), ekstrak jambu biji (X2) dan kedawung (X3)
Formula
Komponen Asam askorbat
(X1)
Jambu biji (X2)
Kedawung (X3)
1 1 0 0
2 0 1 0
3 0 0 1
4 ⁄ ⁄ 0
5 0 ⁄ ⁄
6 ⁄ 0 ⁄
7 ⁄ ⁄ ⁄
Penentuan Kadar Fenolik Total (Sadono 2011)
6
Kira-kira 10 mg sampel dilarutkan. Sebanyak 2 mL larutan sampel tersebut atau standar asam galat dimasukkan ke dalam tabung reaksi lain, lalu ditambahkan 5 mL akuabides dan 0.5 mL larutan Folin-Ciocalteau 50% b/v, dan didiamkan 5 menit. Selanjutnya ditambahkan 1 mL larutan Na2CO3 5% b/v, lalu campuran divorteks dan diinkubasi pada suhu ruang dalam kondisi gelap selama 1 jam. Setelah diinkubasi, larutan diukur serapannya dengan spektrofotometer UV-Vis pada panjang gelombang 725 nm. Data dinyatakan dalam %b/b EAG (ekuivalen asam galat).
Uji Potensi Antipenuaan Pengukuran Kadar Inhibisi Reaksi Glikasi Albumin (Sheihk et al. 2004)
Sebanyak 1 mL larutan glukosa 3% b/v ditambahkan ke dalam I mL larutan albumin 5% b/v. Kemudian 1 mL gentamisin 20 mg/mL ditambahkan untuk mencegah kontaminasi, lalu diikuti 1 mL sampel dengan berbagai konsentrasi, dan diinkubasi selama 3 hari pada suhu kamar. Setelah masa inkubasi, larutan dimasukkan ke dalam kantung dialisis dan didialisis dalam 10 mL bufer fosfat (pH 7.4) selama 3 jam.
Larutan yang telah didialisis ditambahkan 1 mL TCA 400 g/L, kemudian disentrifugasi selama 10 menit dengan kecepatan 3000 rpm. Supernatan dibuang, lalu ditambahkan lagi 1 mL TCA 400 g/L ke dalam endapan, disentrifugasi kembali dengan waktu dan kecepatan yang sama. Supernatan dibuang, lalu penambahan 1 mL TCA 400 g/L dan sentrifugasi diulang sekali lagi. Ke dalam endapan ditambahkan 1 mL bufer fosfat (pH 7.4) dan 0.5 mL asam oksalat dan dimasukkan ke dalam penangas air sampai larutan mendidih. Setelah didinginkan dan dibiarkan pada suhu kamar, ditambahkan 1 mL TCA 400 g/L ke dalam setiap sampel, kemudian di sentrifugasi selama 10 menit dengan kecepatan 3000 rpm. Supernatan dipisahkan dan di tambah 1 mL TBA 50 mmol/L ke dalam 1 mL larutan supernatant, lalu disimpan dalam penangas air dengan suhu 40⁰C selama 30 menit. Kemudian, di ukur absorbansi sampel dengan spektrofotometer pada panjang gelombang 443 nm.
HASIL DAN PEMBAHASAN
Kadar Air dan Maserasi
6
Kira-kira 10 mg sampel dilarutkan. Sebanyak 2 mL larutan sampel tersebut atau standar asam galat dimasukkan ke dalam tabung reaksi lain, lalu ditambahkan 5 mL akuabides dan 0.5 mL larutan Folin-Ciocalteau 50% b/v, dan didiamkan 5 menit. Selanjutnya ditambahkan 1 mL larutan Na2CO3 5% b/v, lalu campuran divorteks dan diinkubasi pada suhu ruang dalam kondisi gelap selama 1 jam. Setelah diinkubasi, larutan diukur serapannya dengan spektrofotometer UV-Vis pada panjang gelombang 725 nm. Data dinyatakan dalam %b/b EAG (ekuivalen asam galat).
Uji Potensi Antipenuaan Pengukuran Kadar Inhibisi Reaksi Glikasi Albumin (Sheihk et al. 2004)
Sebanyak 1 mL larutan glukosa 3% b/v ditambahkan ke dalam I mL larutan albumin 5% b/v. Kemudian 1 mL gentamisin 20 mg/mL ditambahkan untuk mencegah kontaminasi, lalu diikuti 1 mL sampel dengan berbagai konsentrasi, dan diinkubasi selama 3 hari pada suhu kamar. Setelah masa inkubasi, larutan dimasukkan ke dalam kantung dialisis dan didialisis dalam 10 mL bufer fosfat (pH 7.4) selama 3 jam.
Larutan yang telah didialisis ditambahkan 1 mL TCA 400 g/L, kemudian disentrifugasi selama 10 menit dengan kecepatan 3000 rpm. Supernatan dibuang, lalu ditambahkan lagi 1 mL TCA 400 g/L ke dalam endapan, disentrifugasi kembali dengan waktu dan kecepatan yang sama. Supernatan dibuang, lalu penambahan 1 mL TCA 400 g/L dan sentrifugasi diulang sekali lagi. Ke dalam endapan ditambahkan 1 mL bufer fosfat (pH 7.4) dan 0.5 mL asam oksalat dan dimasukkan ke dalam penangas air sampai larutan mendidih. Setelah didinginkan dan dibiarkan pada suhu kamar, ditambahkan 1 mL TCA 400 g/L ke dalam setiap sampel, kemudian di sentrifugasi selama 10 menit dengan kecepatan 3000 rpm. Supernatan dipisahkan dan di tambah 1 mL TBA 50 mmol/L ke dalam 1 mL larutan supernatant, lalu disimpan dalam penangas air dengan suhu 40⁰C selama 30 menit. Kemudian, di ukur absorbansi sampel dengan spektrofotometer pada panjang gelombang 443 nm.
HASIL DAN PEMBAHASAN
Kadar Air dan Maserasi
7 menunjukkan contoh dapat disimpan dalam jangka waktu yang lama dan tidak rentan terhadap serangan mikrob.
Ekstraksi yang dilakukan dalam penelitian ini adalah metode maserasi. Metode maserasi merupakan metode yang sangat sederhana dan dapat mengurangi kerusakan komponen yang tidak tahan panas. Daun jambu biji dan daun kedawung dibuat serbuk terlebih dahulu dengan ukuran 80 mesh untuk memperluas permukaannya sehingga interaksi dengan pelarut semakin banyak dan mengoptimumkan proses ektraksi. Pelarut yang digunakan adalah akuades dengan perbandingan 1 gram sampel : 10 mL pelarut selama 3x12 jam. Rendemen ekstrak air daun jambu biji dan kedawung berturut-turut 16.76% dan 28.96% (Lampiran 4). Hasil rendemen ini lebih besar dari ekstrak etanol 30% daun jambu biji dan kedawung menggunakan metode maserasi sebesar 10.93% dan 15.35% (Hayati 2011).
Fitokimia
Analisis fitokimia merupakan salah satu cara untuk mengetahui senyawa metabolit sekunder yang terdapat pada suatu tanaman secara kualitatif.Senyawa metabolit sekunder diklasifikasikan menjadi 3 kelompok utama yaitu senyawa terpenoid, senyawa fenolik, dan senyawa bernitrogen (Mazid et al. 2011). Golongan senyawa yang dapat berpotensi sebagai antioksidan yaitu senyawa fenolik, seperti fenilpropanoid, flavonoid, antosianin, tanin, melanin, fenol monosiklik, dan lignin (Mahardika 2013). Analisis fitokimia dilakukan terhadap ekstrak kasar daun jambu biji dan kedawung.
Tabel 2 Hasil uji fitokimia ekstrak daun jambu biji dan kedawung
Komponen Sampel
Keterangan: (-): komponen tidak terdeteksi, (+): komponen terdeteksi
8
ini sesuai dengan yang dikemukakan oleh Ayoola et al. (2008) dan Sunarni et al. (2007) bahwa P. guajava mengandung flavonoid dan tanin yang merupakan senyawa fenol yang berpotensi sebagai antioksidan yang disebabkan adanya gugus hidroksi pada struktur molekulnya.
Aktivitas Antioksidan
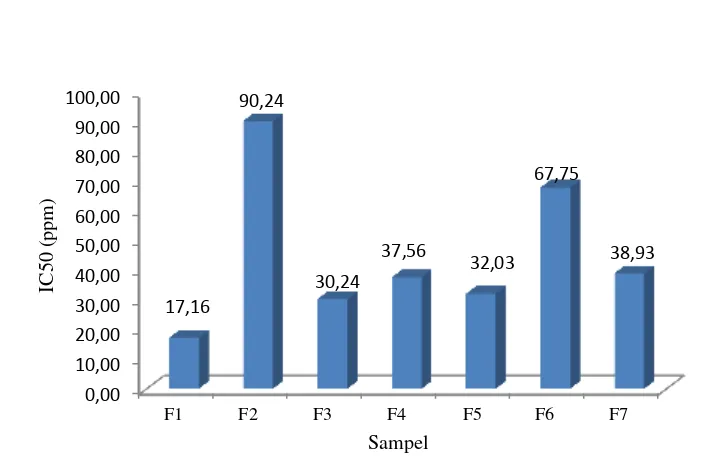
Radikal bebas merupakan molekul yang kehilangan elektron, sehingga molekul tersebut menjadi tidak stabil dan selalu berusaha mengambil elektron dari molekul atau sel lain. Radikal bebas bersifat tidak stabil dan sangat reaktif dalam mendapatkan pasangan elektronnya sehingga menyebabkan terbentuknya radikal baru. Salah satu mekanisme untuk mengatasi radikal bebas adalah melalui antioksidasi yang memerlukan senyawa antioksidan yang dapat menghambat terjadinya proses oksidasi dengan cara menghambat terjadinya reaksi oksidasi pada tahap inisiasi atau propagasi (Velioglu et al. 1998). Aktivitas antioksidan yaitu kemampuan suatu bahan untuk meredam senyawa radikal bebas yang ada disekitarnya (Saragih 2014). Penentuan aktivitas antioksidan daun jambu biji dan daun kedawung didasarkan pada penangkapan radikal bebas DPPH ( 1,1-Diphenyl-2-picrilhydrazil). DPPH merupakan radikal yang bersifat stabil.Penggunaan metode DPPH dalam penelitian karena metode yang sederhana, mudah, dan menggunakan sampel dalam jumlah yang sedikit dengan waktu yang singkat (Hanani et al. 2005). Prinsip kerja dari metode ini adalah proses reduksi senyawa radikal bebas DPPH oleh antioksidan. Proses reduksi ditandai dengan perubahan warna larutan dari ungu menjadi kekuningan yang mengakibatkan terjadinya penurunan nilai absorbansi. Penurunan nilai absorbansi menunjukkan adanya aktivitas antioksidan, sehingga semakin rendah nilai absorbansi maka semakin tinggi aktivitas antioksidannya.
9
Gambar 2 Nilai IC50 masing-masing formula (F1 (asam askorbat); F2 (jambu biji), F3 (kedawung); F4 (jambu biji-asam askorbat); F5 (kedawung-asam askorbat); F6 (jambu biji-kedawung); F7 (jambu biji-kedawung-asam askorbat).
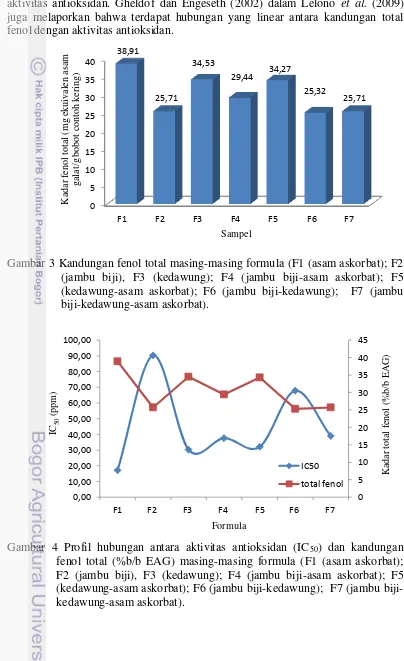
Kadar Fenolik Total
Analisis kandungan total fenolik dilakukan untuk mengetahui potensi ekstrak daun jambu biji dan kedawung sebagai penangkap radikal bebas. Penentuan kandungan total fenolik ekstrak daun jambu biji dan kedawung dilakukan menggunakan persamaan kurva standar asam galat. Penggunaan asam galat sebagai standar dikarenakan senyawa ini sangat efektif untuk membentuk senyawa kompleks dengan reagen Folin-Ciocalteu, sehingga reaksi yang terjadi lebih sensitif dan intensif (Kiay et al. 2011). Kurva kalibrasi larutan standar asam galat dibuat terlebih dahulu dengan konsentrasi 10, 30, 50, 70, dan 100 ppm. Pembuatan kurva kalibrasi berguna untuk menentukan kadar fenol dalam contoh menggunakan persamaan regresi dari kurva kalibrasi. Persamaan regresi kurva kalibrasi larutan standar asam galat yaitu y = 0.018x - 0.059 dengan nilai koefisien korelasi (r) yaitu 0,998 (Lampiran 12). Nilai r yang mendekati 1 menunjukkan bahwa persamaan yang diperoleh linier.
10
menyatakan bahwa terdapat hubungan yang linier positif antara aktivitas antioksidan dengan kandungan total fenol pada ekstrak buah jambu biji dan belimbing manis. Holasova et al. (2002) dalam Lelono et al. (2009) juga mengatakan bahwa kandungan total fenol meningkat seiring meningkatnya aktivitas antioksidan. Gheldof dan Engeseth (2002) dalam Lelono et al. (2009) juga melaporkan bahwa terdapat hubungan yang linear antara kandungan total fenol dengan aktivitas antioksidan.
11
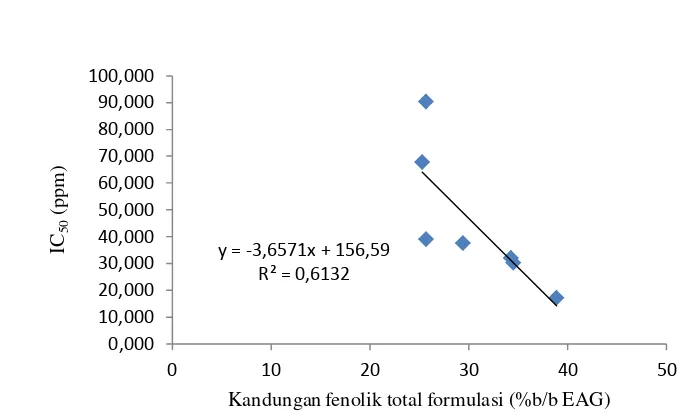
Gambar 5 Korelasi aktivitas antioksidan (IC50) dan kandungan fenol total (%b/b EAG).
Hubungan antara kandungan senyawa fenolik total dengan nilai IC50-nya mempunyai koefisien korelasi r2= 0.613, (y= -3.657+156.5) (Gambar 5). Hasil ini menunjukkan 61.30% aktivitas radikal formulasi yang diuji merupakan hasil kontribusi dari senyawa fenolik. Hasil ini menunjukkan bahwa senyawa yang berperan sebagai antioksidan tidak hanya senyawa fenolik akan tetapi adanya kontribusi dari senyawa lainnya yang juga memiliki aktivitas antioksidan.
Uji Potensi Antipenuaan Pengukuran Kadar Inhibisi Reaksi Glikasi Albumin (Sheihk et al. 2004)
Reaksi glikasi merupakan reaksi nonenzimatik yang diawali oleh ikatan antara gugus aldehida dari glukosa dengan amino terminal-N pada protein (Suhartono et al. 2004). Reaksi ini akan membentuk senyawa Advanced Glycation End Product (AGEs) di dalam plasma sebagai produk modifikasi protein yang terakumulasi pada berbagai organ selama proses penuaan (Mary et al. 2004). Penurunan senyawa AGEs yang terbentuk digambarkan sebagai aktivitas inhibisi yang menunjukkan kemampuan ekstrak dalam mengurangi reaksi glikasi sehingga akumulasi AGEs dapat dikurangi dan proses tua dapat dihambat (antipenuaan). Ekstrak air daun jambu biji dan kedawung memiliki aktivitas inhibisi terhadap reaksi glikasi albumin akan tetapi kenaikan konsentrasi ekstrak tidak memberikan kenaikan % inhibisi pada pembentukan senyawa AGEs.
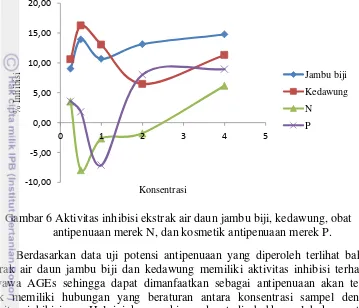
Gambar 5 menunjukkan hubungan antara konsentrasi sampel dengan aktivitas inhibisi. Pada gambar tersebut dapat dilihat bahwa ekstrak daun jambu biji dan kedawung meningkat pada konsentrasi 0.5 ppm akan tetapi aktivitas inhibisi menurun dan kemudian meningkat kembali pada konsentrasi 2 ppm dan 4 ppm. Aktivitas inhibisi maksimal yang dicapai ekstrak daun jambu biji dan kedawung terjadi pada konsentrasi 0.5 ppm. Sedangkan pada kontrol positif yang digunakan yaitu obat antipenuaan dengan merek N dan kosmetik antipenuaan dengan merek P dapat dilihat bahwa produk ini tidak memberikan aktivitas inhibisi pada konsentrasi yang sangat kecil hal ini ditunjukkan dengan nilai
y = -3,6571x + 156,59
12
aktivitas inhibisi yang baru terlihat pada konsentrasi 2 ppm untuk obat antipenuaan N dan pada konsentrasi 4 ppm untuk kosmetik antipenuaan P (Lampiran 14).
Gambar 6 Aktivitas inhibisi ekstrak air daun jambu biji, kedawung, obat antipenuaanmerek N, dan kosmetik antipenuaan merek P.
Berdasarkan data uji potensi antipenuaan yang diperoleh terlihat bahwa ekstrak air daun jambu biji dan kedawung memiliki aktivitas inhibisi terhadap senyawa AGEs sehingga dapat dimanfaatkan sebagai antipenuaan akan tetapi tidak memiliki hubungan yang beraturan antara konsentrasi sampel dengan aktivitas inhibisinya. Hal ini kemungkinan dapat disebabkan oleh konsentrasi yang digunakan untuk masing-masing sampel tidak berada pada konsentasi maksimumnya untuk memberikan aktivitas inhibisi dan juga dapat disebabkan karena rentang konsentrasi yang digunakan sangat kecil sehingga perubahan aktivitas inhibisi sulit untuk dilihat.
SIMPULAN DAN SARAN
Simpulan
13 fenol ekstrak tunggal kedawung (F3) lebih besar daripada formula lainnya tetapi lebih kecil dari asam askorbat (F1). Uji aktivitas antioksidan dan total fenol menunjukkan hubungan yang linear positif.
Saran
Penelitian lebih lanjut perlu dilakukan untuk menentukan konsentrasi optimum ekstrak yang digunakan untuk menghasilkan aktivitas inhibisi yang lebih baik.
DAFTAR PUSTAKA
Ayoola GA, Coker HAB, Adesegun SA, Adepoju-Bello AA, Obaweya K, Ezennia EC, Atangbayila TO. 2008. Phytochemical screening and antioxidant activities of some selected medicinal plants used for malaria therapy in Southwestern Nigeria. Tropical Journal of PharmaceuticalReseach.7:1019-1024.
Badan Pengawas Obat dan Makanan. 2011. Peraturan Kepala Badan POM Republik Indonesia Nomor: HK.0.3.1.23.07.11.6662 Tahun 2011 Tentang Persyaratan Cemaran Mikroba dan Logam Berat Dalam Kosmetik. Badan Pengawas Obat dan Makanan RI.Online (diakses 1 Februari 2013).http://www.pom.go.id/public/hukum_perundangan/pdf/Per_bhn_kos _FNL.pdf.
Chollom SC, Agada GOA, Bot DY, Okolo MO, Dantong DD, Choji TP, Echeonwu BC, Bigwan EI, Lokason S. 2012. Phytochemical analysis and antiviral potential of aqueous leaf extract of Psidium guajava against Newcastle disease virus in ovo. J Appl Pharm Scie. 2 (10):045-049.
Das B, A Manna, D Chakraborty, S Deb. 2006. Application of simplex centroid design for the preparation of hydrophilic matrix tablets of diclofenac sodium and statistical optimization of release rate. Journal of Scientific & Industrial Research. 65:725-728.
Hakim H, Yana MS, Lia DJ, Didin M. 2008.Aktivitas antioksidan tirosinase beberapa stilbenoid dari tumbuhan Moraceae dan Dipterocarpaceae yang potensial untuk bahan kosmetik. Jurnal Matematika Sains. 13(2):32-42. Halliwell B. 2001. Role of free radicals in the neurodegenerative diseases:
therapeutic implications for antioxidant treatment. Drugs & Aging 18, 685–716.
Hamilton M, Remmen HV, Drake JA, Yang H, Guo ZM, Kewitt K, Walter CA, Richardson A. 2001. Does oxidative damage to DNA increase with age?
Proc. Nat. Acad. Sci. USA, 98, 10469-10474.
14
Hayati T. 2011. Aktivitas antioksidan beberapa tanaman obat menggunakan zeolit alam sebagai bahan penopang [Tesis]. Bogor (ID): Institut Pertanian Bogor. Iswantini D, Darusman LK, Rahminiwati M, Iskandar HR. 2004. Formula ekstrak
gabungan Apium graveolens dan Sida rhombifolia L. Sebagai fitofarmaka untuk penyakit gout: inhibitor xantin oksidase. Scientific Journal of Bogor Agricultural University.
Kahkonen MP, Hopia AI, Vuorela HJ, Rauha JP, Pihlaja K, Kujala TS, Heinonen M. 1999. Antioxidantactivity of extracts containing phenolic compounds. J Agric Food Chem. (47):3954-62.
Kosasih EN, Tony S, Hendro H.2006. Peran Antioksidan pada Lanjut Usia.
Pusat Kajian Nasional Masalah Lanjut Usia. Jakarta.
Kiay N, Suryanto E, Mamahit L. 2011. Efek lama peredaman ekstrak Kalamansi (Citrus microcarpa) terhadap aktivitas antioksidan tepung pisang Goroho (Musa spp.). Chem. Prog. 4: 27-33.
Kim Sang-Suk, Hyun Chang-Gu, Lee Jongsung, Lim Jihee, Kim Ji-Young, Park Deokhoon. 2007. In vitro screening of Jeju medicinal plants for cosmeceutical materials. J. Appl. Biol. Chem 50(4): 215-220.
Lee M, Kim H, Chae S, Uddin M, Lee HW, Choi G, Kim YH, Rang A, Kang BJ. 2013. Antiaging activity of Korean pine (Pinus koraiensis) leaf extracts demonstrated through the induction of mitochondrial biogenesis in mice. J. Med. Plant. Res. 7(25):1833-1838.
Lelono RAA, Tachibana S, Kazutaka I. 2009. Invitro antioxidative activities andpolyphenol content of Eugeniapolyantha weight grown in Indonesia.
Pakistan J Biol Sci. 12(24):1564-1570.
Mahardika C. 2013. Fraksionasi ekstrak kulit petai berpotensi antioksidan [Skripsi]. Bogor (ID): Institut Pertanian Bogor.
Mary J, Vougier S, Picott CR, Perichon M, Petropoulos I, Friguet B . 2004. Enzymatic reactions involved in the repair of oxidized proteins. Exp. Gerontol. 39:17-23.
Mayang A. 2007. Formulasi dan Optimasi Produk Biskuit Berbahan Baku Sagu Ubi Jalar dan Kacang Hijau [Skripsi]. Bogor (ID):Institut Pertanian Bogor. Mazid M, Khan TA, Mohammad F. 2011. Role of secondary metabolites in
defenses mechanism of plants. Biol Med. 3(2):232-249.
Mosquera O, Correa YM, Nino J. 2009. Antioxidant activity of plants extract from Colombian flora. Braz J Pharmacogn. 19(2A):382-387.
Povichit N, Phrutivorapongkul A, Suttaji M, Chaiyasut C, Leelapornpisid P. 2010. Phenolic content and in vitro inhibitory effects on oxidation and protein glycation of some Thai medicinal plants. Pak. J. Pharm. Sci. 23(4):403-408.
Ravichandran G V, Shivaram B, Kolhapure. 2005. Evaluation of the efficacy and
15 Rohman A, Sugeng R, Rizka D, Dimas BP. 2009. Penangkapan radikal
2,2-difenil-1-pikrilhidrazil oleh ekstrak buah Psidium guajava L dan Averrhoa carambolla L. Jurnal Kefarmasiaan Indonesia. 7(1):1-5.
Sadono A. 2011. Aktivitas antioksidan dan analisis komposisi senyawa fenolik dari pohon bidara laut (Strychnos ligustrina) [Skripsi]. Bogor(ID): Institut Pertanian Bogor.
Saragih R. 2014. Uji kesukaan panelis pada the daun torbangun (Coleus amboinicus). E-journal WIDYA Kesehatan dan Lingkungan. 1 (1):46-52. Sharafzadeh S. 2013. Medicinal plants as anti-ageing materials: a review. Glob.J.
Med. Plant Res. 1(2): 234-236.
Sheikh N, Safari MR, Kashani KM, Araghchian M, Zeraati F. 2004. Study on the effect of garlic on the in vitro albumin glycation reaction. Acta Medica Iranica. 42 (1): 16-18.
Smith M, Marley K, Seigler D, Singletary K, Meline B. 2000. Bioactive properties of wild blueberry fruits. Journal of Food Science. 65 (2):352-356.
Stalling AF, Lupo MP. 2009. Practical uses of botanicals in skin care. J. Clin. Aesth.Derm. 2(1), 36-40.
Suhartono E, Setiawan B, Edyson, Mashuri. 2004. Modifikasi protein akibat reaksi Maillard dan pengaruhnya terhadap kadar tirosin. Jurnal Profesi Medika. 4(2):20-8.
Sunarni T, Suwidjiyo P dan Ratna A. 2007. Flavonoid Antioksidan Penangkap Radikal dari Daun Kepel (Stelechocarpus burahol (Bl.) Hook f. & Th.).
Majalah Farmasi Indonesia. 18(3):111- 116.
Suwannalert P, Povichit N, Puchadapirom P, Junking M. 2012. Antiaging activity and non toxic dose of phytooxyresveratrol dari Artocarpus lakoocha Roxb.
Tropical Journal of Pharmaceutical Research. 11 (1): 69-74.
Tengamnuay P, Pengrungruanqwong K, Pheansri I, Likhitwitayawuid K. 2006.
Artocarpus lakoocha heartwood extract as a novel cosmetic ingredient: evaluation of the in vitro anti-tyrosinase and in vivo skin whitening activities. Int J Cosmet Sci. 28(4):269-276.
Tuminah S. 2000. Radikal bebas dan antioksidan-kaitannya dengan nutrisi dan penyakit kronis. Cermin Dunia Kedokteran. 49-51.
Troen BR. 2003. The biology of aging.Mt.Sinai. J. Med. 70:3-22.
Velioglu YS, Mazza G, Gao L, Oomah BD. 1998. Antioxidant activity and total phenolics in selected fruits, vegetables, and grain product. J. Agric. Food. Chem. 46:4113-4117.
Winarno FG. 1997. Kimia Pangan dan Gizi. Jakarta: Gramedia.
16
LAMPIRAN
Lampiran 1 Bagan alir lingkup kerja penelitian
Daun Kedawung Daun Jambu Biji
Ekstrak Daun Jambu Biji
Ekstrak Daun Kedawung Simplisia
Uji Fitokimia
Penentuan Kadar Fenolik
Total
Uji Antioksidan
Uji
Antipenuaan Kadar Air
18
Lampiran 3 Penentuan kadar air simplisia daun jambu biji dan kedawung
Sampel Ulangan
Lampiran 4 Penentuan rendemen ekstrak daun jambu biji dan kedawung
Sampel
Sampel ekstrak daun jambu biji
endemen bobot s mpel k d r ir obot ekstr k
2 . . 2 . .
Contoh perhitungan: Ulangan 1 formula 1
Persamaan regresi linear asam galat y = 0.018x - 0.059 Konsentrasi (mg/L)= x
19
onsentr si mg L . . 5 . .
onsentr si b b konsentr si mg L volume mL bobot mg p
Lampiran 5 Aktivitas antioksidan formula 1 (1,0,0) Konsentrasi
Ulangan 1 Konsentrasi 1.25 ppm
nhibisi bl ngko s mpel
bl ngko . . .
.
Kurva hubungan % inhibisi dengan log konsentrasi Persamaan regresi linear: y = 46.94x - 9.124
20
Nilai IC50 diperoleh saat y = 50, maka 50 = 46.94x - 9.124
x = 1.2596
x dalam bentuk log konsentrasi, maka nilai IC50 sebesar 18.180 ppm
er t 5 5 ul ng n ul ng n 2 ul ng n
n
. . .5 . ppm
Lampiran 6 Aktivitas antioksidan formula 2 (0,1,0) Konsentrasi
Ulangan 1 Konsentrasi 20 ppm
nhibisi bl ngko s mpel
bl ngko . 5 . . 5
.
21 Persamaan regresi linear: y = 57.12x – 62.06
Nilai IC50 diperoleh saat y = 50, maka 50 = 57.12x – 62.06
x = 1.9618
x dalam bentuk log konsentrasi, maka nilai IC50 sebesar 91.58 ppm
er t 5 5 ul ng n ul ng n 2 ul ng n
n
.5 . .2 .2 ppm
Lampiran 7 Aktivitas antioksidan formula 3 (0,0,1) Konsentrasi
Ulangan 1 Konsentrasi 20 ppm
nhibisi bl ngko s mpel
bl ngko .2 . .2
.
Kurva hubungan % inhibisi dengan log konsentrasi
22
Persamaan regresi linear: y = 60.76x - 38.78 Nilai IC50 diperoleh saat y = 50, maka 50 = 60.76x - 38.78
x =1.4612
x dalam bentuk log konsentrasi, maka nilai IC50 sebesar 28.920 ppm
er t 5 5 ul ng n ul ng n 2 ul ng n
Ulangan 1 Konsentrasi 20 ppm
nhibisi bl ngko s mpel
bl ngko . . 5 .
.
23 Persamaan regresi linear: y = 61.89x –63.48
Nilai IC50 diperoleh saat y = 50, maka 50 = 61.89x –63.48
x =1.8336
x dalam bentuk log konsentrasi, maka nilai IC50 sebesar 68.17 ppm
er t 5 5 ul ng n ul ng n 2 ul ng n
n
. . . . 5 ppm
Lampiran 9 Aktivitas antioksidan formula 5 ⁄2 ⁄2 Konsentrasi
(ppm)
Absorbansi % Inhibisi
1 2 3 1 2 3
0 1.203 1.22 1.216
20 0.883 0.863 0.838 26.60 29.26 31.09 40 0.521 0.528 0.512 56.69 56.72 57.89 60 0.204 0.231 0.215 83.04 81.07 82.32 80 0.088 0.087 0.087 92.68 92.87 92.85 100 0.067 0.065 0.064 94.43 94.67 94.74
IC50 (ppm) 32.84 32.15 31.09
Rerata 32.03
Contoh Perhitungan:
Ulangan 1 Konsentrasi 20 ppm
nhibisi bl ngko bl ngko s mpel
24
Kurva hubungan % inhibisi dengan log konsentrasi Persamaan regresi linear: y = 103.4x –106.8
Nilai IC50 diperoleh saat y = 50, maka 50 = 103.4x –106.8
x =1.5164
x dalam bentuk log konsentrasi, maka nilai IC50 sebesar 32.840 ppm
er t 5 5 ul ng n ul ng n 2 ul ng n
Ulangan 1 Konsentrasi 20 ppm
nhibisi bl ngko s mpel
0,0000 0,5000 1,0000 1,5000 2,0000 2,5000
25
Kurva hubungan % inhibisi dengan log konsentrasi Persamaan regresi linear: y = 100.7x –108.4
Nilai IC50 diperoleh saat y = 50, maka 50 = 100.7x –108.4
x = 1.5730
x dalam bentuk log konsentrasi, maka nilai IC50 sebesar 37.411ppm
er t 5 5 ul ng n ul ng n 2 ul ng n
Ulangan 1 Konsentrasi 20 ppm
26
. 5 . 2 . 5 2 .
Kurva hubungan % inhibisi dengan log konsentrasi Persamaan regresi linear: y = 93.72x – 98.73
Nilai IC50 diperoleh saat y = 50, maka 50 = 93.72x – 98.73
x =1.5870
x dalam bentuk log konsentrasi, maka nilai IC50 sebesar 38.6367 ppm
er t 5 5 ul ng n ul ng n 2 ul ng n
n
. .2 . . ppm
Lampiran 12 Pembuatan kurva standar asam galat Konsentrasi
0,0000 0,5000 1,0000 1,5000 2,0000 2,5000
27
Kurva larutan standar asam galat
Lampiran 13 Penentuan fenolik total
28
Lampiran 14 Potensi antipenuaan ekstrak daun jambu biji, kedawung, obat merek N, dan kosmetik merek P
Sampel Konsentrasi (ppm)
Absorbansi % Inhibisi Rerata (%)
1 2 1 2
Jambu
Biji 0 0.061 0.061
0.25 0.056 0.055 8.20 9.84 9.02
0.5 0.053 0.052 13.11 14.75 13.93
1 0.054 0.055 11.48 9.84 10.66
2 0.052 0.054 14.75 11.48 13.11
4 0.051 0.053 16.39 13.11 14.75
Kedawung 0 0.063 0.059
0.25 0.055 0.054 12.70 8.47 10.59
0.5 0.05 0.052 20.63 11.86 16.25
1 0.053 0.053 15.87 10.17 13.02
2 0.057 0.057 9.52 3.39 6.46
4 0.053 0.055 15.87 6.78 11.33
N 0 0.057 0.056
0.25 0.055 0.054 3.51 3.57 3.54
0.5 0.061 0.061 -7.02 -8.93 -7.97
1 0.058 0.058 -1.75 -3.57 -2.66
2 0.056 0.059 1.75 -5.36 -1.80
4 0.052 0.054 8.77 3.57 6.17
P 0 0.056 0.056
0.25 0.054 0.054 3.57 3.57 3.57
0.5 0.055 0.055 1.79 1.79 1.79
1 0.059 0.061 -5.36 -8.93 -7.14
2 0.05 0.053 10.71 5.36 8.04
4 0.051 0.051 8.93 8.93 8.93
Contoh Perhitungan
Sampel jambu biji ulangan 1 konsentrasi 0.25 ppm
nhibis bl ngko s mpel
bl ngko