ABSTRAK
IIS ISMAWATI. Studi Patologi Kerang Hijau (Perna viridis) asal Muara Kamal, Teluk Jakarta. Dibimbing oleh DEWI RATIH AGUNGPRIYONO dan MAWAR SUBANGKIT.
Kerang hijau (Perna viridis) merupakan spesies yang bersifat filter feeder yang jumlahnya berlimpah dan memiliki waktu hidup yang lama. Sehingga spesies ini dapat dijadikan indikator biologis terhadap cemaran lingkungan. Kondisi patologis yang diakibatkan oleh cemaran lingkungan dan infeksi dapat diamati dengan pewarnaan jaringan. Penelitian ini bertujuan untuk mempelajari gambaran patologi organ kerang hijauyang dibudidayakan di perairan Muara Kamal, Teluk Jakarta. Dua puluh satu kerang hijau berbagai ukuran dan umur diamati perubahan patologi anatomi dan histopatologi. Ditemukan perubahan patologi degeneratif dengan lesio pigmentasi serta hilangnya silia pada epitel. Lesio tersebut diduga akibat pencemaran logam berat Hg, Pb, dan Cd meskipun berdasarkan pengukuran nilainya dalam batas normal. Infiltrasi hemosit ditemukan pada berbagai organ sebagai reaksi pertahanan. Infeksi protozoa Nematopsis spp. ditemukan pada lumen insang, jaringan ikat mantel dan saluran cerna.
Kata kunci: histopatologi, kerang hijau, Perna viridis
ABSTRACT
IIS ISMAWATI. Pathology Study in Green Mussel (Perna viridis) from Muara Kamal, Jakarta Bay. Supervised by DEWI RATIH AGUNGPRIYONO and MAWAR SUBANGKIT.
Green mussel (Perna viridis) is a filter feeder organism that is abundant in nature and have a long life span. The mussel have become a biologic indicator for environmental contamination. Pathological conditions caused by environmental contaminants and infections can be observed by staining the tissue section. The aim of this study was to observe histopathological finding of green mussel cultured at Muara Kamal, Jakarta Bay. Twenty one green mussels of various size and age were observed. The lesions found were degenerative lesions such as pigmentation and loss of epithelial cilia. These lesions were considered due to low heavy metals contamination since the measurement of Hg, Pb, and Cd level still in the normal range. Hemocytes infiltration observed in some tissue were thought as body defense reaction. The protozoan Nematopsis spp. infection were detected in gills lumina, connective tissue of mantle and within digestive tract.
STUDI PATOLOGI KERANG HIJAU (
Perna viridis
) ASAL
MUARA KAMAL, TELUK JAKARTA
IIS ISMAWATI
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Studi Patologi Kerang Hijau (Perna viridis) asal Muara Kamal, Teluk Jakarta adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2015
Iis Ismawati
ABSTRAK
IIS ISMAWATI. Studi Patologi Kerang Hijau (Perna viridis) asal Muara Kamal, Teluk Jakarta. Dibimbing oleh DEWI RATIH AGUNGPRIYONO dan MAWAR SUBANGKIT.
Kerang hijau (Perna viridis) merupakan spesies yang bersifat filter feeder yang jumlahnya berlimpah dan memiliki waktu hidup yang lama. Sehingga spesies ini dapat dijadikan indikator biologis terhadap cemaran lingkungan. Kondisi patologis yang diakibatkan oleh cemaran lingkungan dan infeksi dapat diamati dengan pewarnaan jaringan. Penelitian ini bertujuan untuk mempelajari gambaran patologi organ kerang hijauyang dibudidayakan di perairan Muara Kamal, Teluk Jakarta. Dua puluh satu kerang hijau berbagai ukuran dan umur diamati perubahan patologi anatomi dan histopatologi. Ditemukan perubahan patologi degeneratif dengan lesio pigmentasi serta hilangnya silia pada epitel. Lesio tersebut diduga akibat pencemaran logam berat Hg, Pb, dan Cd meskipun berdasarkan pengukuran nilainya dalam batas normal. Infiltrasi hemosit ditemukan pada berbagai organ sebagai reaksi pertahanan. Infeksi protozoa Nematopsis spp. ditemukan pada lumen insang, jaringan ikat mantel dan saluran cerna.
Kata kunci: histopatologi, kerang hijau, Perna viridis
ABSTRACT
IIS ISMAWATI. Pathology Study in Green Mussel (Perna viridis) from Muara Kamal, Jakarta Bay. Supervised by DEWI RATIH AGUNGPRIYONO and MAWAR SUBANGKIT.
Green mussel (Perna viridis) is a filter feeder organism that is abundant in nature and have a long life span. The mussel have become a biologic indicator for environmental contamination. Pathological conditions caused by environmental contaminants and infections can be observed by staining the tissue section. The aim of this study was to observe histopathological finding of green mussel cultured at Muara Kamal, Jakarta Bay. Twenty one green mussels of various size and age were observed. The lesions found were degenerative lesions such as pigmentation and loss of epithelial cilia. These lesions were considered due to low heavy metals contamination since the measurement of Hg, Pb, and Cd level still in the normal range. Hemocytes infiltration observed in some tissue were thought as body defense reaction. The protozoan Nematopsis spp. infection were detected in gills lumina, connective tissue of mantle and within digestive tract.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan
pada
Fakultas Kedokteran Hewan
STUDI PATOLOGI KERANG HIJAU (
Perna viridis
) ASAL
MUARA KAMAL, TELUK JAKARTA
IIS ISMAWATI
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala karunia-Nya sehingga karya ilmiah yang berjudul “Studi Patologi Kerang Hijau (Perna viridis) asal Muara Kamal, Teluk Jakarta” ini dapat diselesaikan. Shalawat dan salam tercurahkan kepada Rosulullah Muhammad SAW, keluarga, sahabat dan umatnya yang setia sampai akhir jaman.
Terima kasih penulis ucapkan kepada Drh Dewi Ratih Agungpriyono, PhD APVet dan Drh Mawar Subangkit, MSi APVet selaku pembimbing, yang telah banyak memberi bimbingan dan arahan kepada penulis dalam melaksanakan penelitian dan penulisan tugas akhir. Ucapan terima kasih juga penulis sampaikan kepada semua staf laboratorium Histopatologi FKH IPB, teman-teman dan semua pihak yang telah membantu, memberikan dukungan serta saran dalam pelaksanaan penelitian dan penulisan tugas akhir ini. Ungkapan terima kasih juga disampaikan kepada ibu, bapak, serta seluruh keluarga atas do’a, kasih sayang dan materi yang telah diberikan selama penulis melakukan studi di FKH IPB.
Penulis menyadari bahwa dalam penulisan karya ilmiah ini tidak lepas dari keterbatasan dan kekurangan, oleh karena itu penulis mengharapkan kritik dan saran dari semua pihak yang bersifat membangun. Selain itu penulis juga berharap semoga karya ilmiah ini dapat bermanfaat bagi penulis maupun bagi pembaca.
Bogor, Januari 2015
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 1
Manfaat Penelitian 1
METODE 1
Waktu dan Tempat 1
Bahan 2
Alat 2
Prosedur Penelitian 2
Preparasi Sampel dan Pembuatan Preparat Histopatologi 2
Pembacaan Histopatologi 2
HASIL DAN PEMBAHASAN 3
Patologi Anatomi 3
Histopatologi 3
Insang 3
Mantel 7
Organ Pencernaan 9
Ginjal 13
Jantung 15
Gonad 15
Logam Berat 17
SIMPULAN DAN SARAN 19
Simpulan 19
Saran 19
DAFTAR PUSTAKA 19
DAFTAR TABEL
DAFTAR GAMBAR
1 Gambaran patologi anatomi kerang hijau pada kelompok L, M dan S
setelah dipisahkan dari cangkangnya 3
2 Insang kerang hijau normal (n=L5) 4
3 Brankhitis disertai endapan pigmen pada epitel insang kerang hijau
(n=M2) 4
4 Proliferasi sel goblet Insang kerang hijau (n= S7) 5 5 Protozoa pada lumen insang kerang hijau (n= L6) 6 6 Nematopsis spp. dalam jaringan penghubung organ digesti kerang hijau
(n=S7) 7
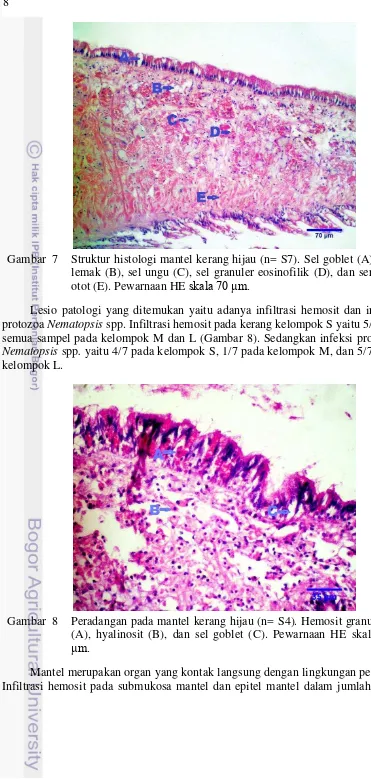
7 Struktur histologi mantel kerang hijau (n= S7) 8
8 Peradangan pada mantel kerang hijau (n= S4) 8
9 Organ digesti kerang hijau (n= S7) 9
10 Lambung kerang hijau (n= S7) 10
11 Style sac kerang hijau (n= S7) 10
12 Enteritis pada kerang hijau (n= L3) 11
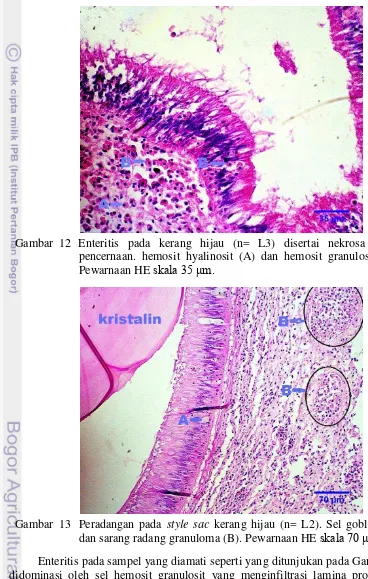
13 Peradangan pada style sac kerang hijau (n= L2) 11 14 Peradangan kelenjar pencernaan kerang hijau (n=S4) 12
15 Kelenjar Pencernaan kerang hijau (n=L5). 13
16 Nefritis interstisialis kerang hijau (n=L2) 14
PENDAHULUAN
Latar Belakang
Kerang hijau (Perna viridis) merupakan salah satu komoditas perikanan yang banyak dikonsumsi masyarakat Indonesia sebagai sumber protein hewani yang murah dan bergizi tinggi. Seratus gram daging kerang mengandung 49.8 % air, 21.9 % protein, 14.5 % lemak, 18.5 % karbohidrat dan 4.3 % abu (Affandi 2002). Selain dimanfaatkan dagingnya sebagai bahan pangan, protein kerang mengandung zat bioaktif sebagai anti tumor, anti leukemia, anti inflamasi, anti bakteri dan anti virus (Chellaram et al. 2011; Chakraborty et al. 2014).
Kerang dikenal juga sebagai organisme filter-feeder yang hidup menetap (sessile) sehingga kelainan morfologinya dapat menggambarkan kondisi lingkungan dari tempat hidupnya. Kerang hijau jumlahnya cukup berlimpah dan distribusinya luas, meliputi daerah Indo Pasifik, selatan perairan Jepang, perairan-perairan India, Semenanjung Malaysia, Singapura, Laut Cina Selatan, Thailand, Filipina, Indonesia hingga Papua New Guinea (Setyobudiandi 2004). Oleh karena itu, kerang hijau dijadikan sebagai bioindikator cemaran lingkungan. Kondisi patologis yang ditimbulkan akibat cemaran atau infeksi pada kerang salah satunya dapat diamati melalui pengamatan histopatologi (Zhou et al. 2008). Pemeriksaan histopatologi kerang hijau di Indonesia masih belum banyak dipelajari sehingga dilakukan penelitian mengenai studi patologi kerang hijau.
Tujuan Penelitian
Penelitian ini bertujuan untuk mempelajari gambaran patologi kerang hijau yang dibudidayakan di Muara Kamal, Teluk Jakarta, Jakarta Utara.
Manfaat Penelitian
Manfaat dari penelitian ini yaitu dapat memberikan informasi mengenai jenis lesio patologi yang ditemukan pada kerang hijau. Lesio yang ditemukan dapat dijadikan model dalam mempelajari penyakit pada kelompok invertebrata laut. Sebagai indikator pencemaran lingkungan, dapat diketahui tingkat pencemaran di Teluk Jakarta.
METODE
Waktu dan Tempat
2
Pemeriksaan Penyakit Ikan dan Lingkungan Serang, Kementrian Kelautan dan Perikanan.
Bahan
Kerang yang digunakan sebagai studi kasus patologi adalah kerang hijau (Perna viridis) yang berasal dari tambak budidaya kerang hijau di Muara Kamal, Teluk Jakarta, Jakarta Utara. Buffer Neutral Formalin (BNF) 10%, xylene, etanol 70%, etanol 80%, etanol 90%, etanol 95%, dan etanol absolut, parafin cair, perekat entelan dan pewarnaan Haematoksillin-Eosin.
Alat
Peralatan yang digunakan yaitu tissue cassette, automatic tissue processor Sakura®, tissue embedding console Sakura®, rotary microtome American optical Spencer®, penangas air, gelas objek, gelas penutup, mikroskop cahaya
Olympus®, dan digital kamera mikroskop.
Prosedur Penelitian
Preparasi Sampel dan Pembuatan Preparat Histopatologi
Kerang hijau dengan berbagai ukuran diperoleh dari nelayan pengumpul kerang di Muara Kamal, Teluk Jakarta, Jakarta Utara. Kerang-kerang tersebut dikelompokan menjadi tiga ukuran. Ukuran besar (L= large) panjang tubuh > dari 3 cm, sedang (M= medium) panjang tubuh > dari 2 cm dan kecil (S= small) panjang tubuh 1.5-2 cm, masing-masing sebanyak 7 ekor yang terdiri atas jantan dan betina. Masing-masing kerang dipisahkan dari cangkangnya dan dimasukan ke dalam larutan fiksatif BNF 10%. Spesimen dipotong melintang menjadi lima bagian dan diletakan dalam tissue cassette. Selanjutnya dibuat preparat histopatologi dan diwarnai dengan pewarnaan Haematoksillin-Eosin (HE) yang diadaptasi dari metode Humason (1967). Kerang hijau segar dalam bentuk beku, sebanyak 1.5 kg dikirim ke Laboratorium Loka Pemeriksaan Penyakit Ikan dan Lingkungan Serang, untuk diperiksa kadar kandungan logam berat Hg, Pb, dan Cd.
Pembacaan Histopatologi
3
HASIL DAN PEMBAHASAN
Patologi Anatomi
Pengamatan struktur tubuh kerang hijau setelah dipisahkan dari cangkangnya, secara makroskopis tidak menunjukan adanya kelainan patologi anatomi untuk setiap kelompok ukuran, tetapi terlihat adanya perbedaan warna pada kelompok M dan L yaitu krem dan jingga, sedangkan pada kelompok S menunjukan warna krem yang seragam. Perbedaan warna tersebut menunjukan perbedaan kelamin pada kerang. Gonad kerang jantan berwarna putih (krem) dan gonad kerang betina berwarna merah hingga jingga (Yap dalam Al-Barwani 2013). Sehingga diketahui sampel berjenis kelamin jantan sebanyak 15 sampel dan kelamin betina 6 sampel.
Gambar 1 Gambaran patologi anatomi kerang hijau pada kelompok L, M dan S setelah dipisahkan dari cangkangnya.
Histopatologi
Insang
4
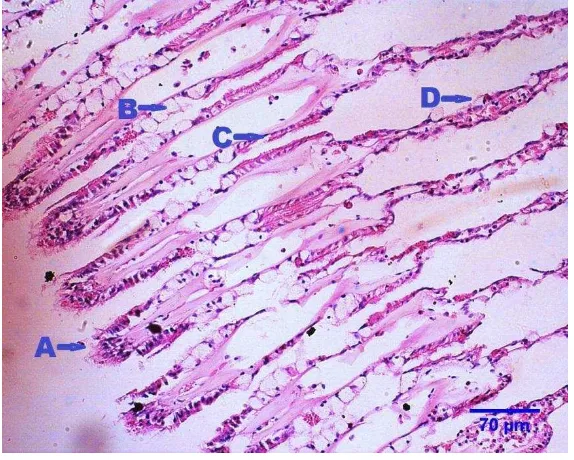
Gambar 2 Insang kerang hijau normal (n=L5), zona frontal (A), sel goblet (B), zona intermediet (C) dan inter filament junction (D). Pewarnaan HE skala 70 μm.
Gambar 3 Brankhitis disertai endapan pigmen pada epitel insang kerang hijau (n=M2). Hemosit granulosit (A) dan endapan pigmen (B). Pewarnaan HE skala 35 μm.
5 yang berperan dalam sistem imun seluler pada kerang yang berada dalam hemolimfe (Bhargavan 2008; Delahaut 2012). Bhargavan (2008), menyatakan hemosit tidak terbatas pada sistem hemolimfe tetapi dapat bergerak bebas keluar dari sinus ke jaringan ikat sekitar mantel, rongga usus dan lumen. Sel ini berperan penting dalam proses fisiologis seperti pertukaran gas, osmoregulasi, transportasi nutrisi dan eksresi, perbaikan jaringan dan pertahanan tubuh. Peranan dalam perbaikan tubuh dengan cara migrasi dalam jumlah besar ke daerah yang rusak dan memasuki luka sementara epitel beregenerasi.
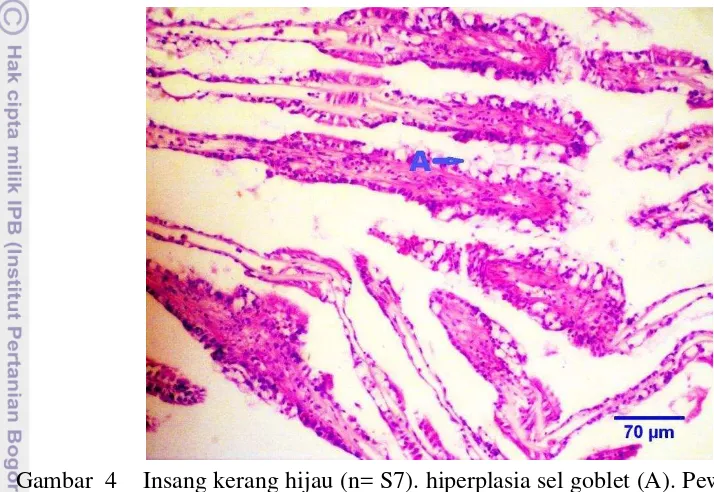
Gambar 4 Insang kerang hijau (n= S7). hiperplasia sel goblet (A). Pewarnaan HE skala 70 μm.
Proliferasi sel goblet pada insang merupakan respon pertahanan lokal terhadap polutan. David dan Fontanetti (2005), menyatakan peningkatan sekresi lendir sebagai mekanisme awal untuk mengeliminasi polutan seperti logam berat, dengan cara menangkap dan menyelimuti logam berat sebelum merusak jaringan. Hal ini sejalan dengan laporan pencemaran di Teluk Santos, Brazil kerang pada lokasi B yang memiliki kandungan logam Hg 0,70 μg/l dan Pb 15,00 μg/l menunjukan peningkatan produksi lendir, tetapi pada lokasi C meskipun memiliki kandungan pencemar yang tinggi (Hg 0,66 μg/l dan Pb 219,66 μg/l), tidak menunjukan peningkatan produksi lender (CETESB dalam David dan Fontanetti 2005).
6
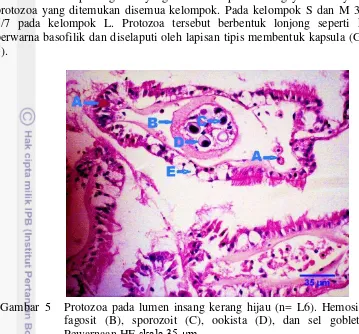
Perubahan patologi lain yang ditemukan pada insang yaitu adanya infeksi protozoa yang ditemukan disemua kelompok. Pada kelompok S dan M 3/7 dan 5/7 pada kelompok L. Protozoa tersebut berbentuk lonjong seperti kacang berwarna basofilik dan diselaputi oleh lapisan tipis membentuk kapsula (Gambar 5).
Gambar 5 Protozoa pada lumen insang kerang hijau (n= L6). Hemosit (A), fagosit (B), sporozoit (C), ookista (D), dan sel goblet (E). Pewarnaan HE skala 35 μm.
Protozoa yang ditemukan pada kerang hijau yang ditunjukan Gambar 5 diduga adalah Nematopsis. Morfologi protozoa tersebut menyerupai protozoa yang menginfeksi kerang-kerangan di perairan Chonbury Thailand yang dilaporkan oleh Tuntiwarunuruk et al. (2004) dan diidentifkiasi sebagai
Nematopsis spp. yang ditemukan dalam lumen insang kerang hijau, berupa ookista yang terisolasi dalam vakuola parasitiforus dari fagosit sel inang. Setiap fagosit terdiri atas 1-7 ookista dan dikelilingi oleh membran. Padovan et al. (2003) melaporkan, satu fagosit mengandung 15-19 ookista pada kerang Mytella falcata, lebih sering 3-5 ookista.
Ookista mengandung sporozoit tunggal (Monozoic) dan ada beberapa ookista terlihat kosong, serta sporozoit tidak berkapsul. Ookista monozoic (sporocysts) bersifat resisten dalam tubuh inang (Padovan et al. 2003). Ultrastruktur ookista Nematopsis terdiri atas sporozoit yang dilapisi dinding tebal dan mikrofibril yang melapisi dinding ookista (Padovan et al. 2003; Abdel-Baki et al. 2012). Struktur ketebalan dinding Nematopsis yang memungkinkan sifat resisten ookista Nematopsis dalam tubuh kerang.
7
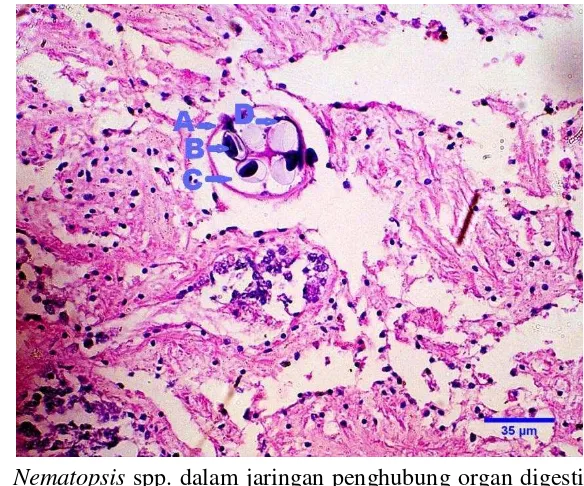
Gambar 6 Nematopsis spp. dalam jaringan penghubung organ digesti kerang hijau (n=S7). fagosit (A), sporozoit (B), vakuola parasitiforus (C) dan ookista (D). Pewarnaan HE skala 35 μm.
Nematopsis, selain pada insang juga ditemukan pada organ mantel dan jaringan interstisial digesti (Gambar 6). Ookista Nematopsis dalam jaringan kerang hijau yang diamati, tidak menimbulkan lesio yang signifikan pada jaringan inang akan tetapi apabila infeksinya berlebihan dapat mengakibatkan kerusakan jaringan sekitar. Ceuta dan Boehs (2012) menyatakan, meskipun prevalensi gregarine Nematopsis tinggi, intensitas infeksi umumnya rendah dengan tidak menunjukan kerusakan yang signifikan pada inang. Namun beberapa kerang dengan infeksi yang intensif pada jaringan penghubung labial palp, sangat memungkinkan mempengaruhi fungsi organ seperti proses makan. Beberapa studi mencatat tidak ada kerusakan yang serius pada kerang Mytella guyanensis (Pinto dan Boehs 2008), pada tiram bakau Crassostrea rizophorae (Sabry et al. 2007), kerang Perna perna (Lima et al. 2001) dan kerang hijau (Tuntiwaranuruk et al. 2004). Selain itu Tuntiwaranuruk juga mengungkapkan tingkat infeksi antar spesies kerang dipengaruhi oleh habitat, musim dan curah hujan yang mempengaruhi suhu dan salinitas air laut.
Mantel
8
Gambar 7 Struktur histologi mantel kerang hijau (n= S7). Sel goblet (A), sel lemak (B), sel ungu (C), sel granuler eosinofilik (D), dan serabut otot (E). Pewarnaan HE skala 70 μm.
Lesio patologi yang ditemukan yaitu adanya infiltrasi hemosit dan infeksi protozoa Nematopsis spp. Infiltrasi hemosit pada kerang kelompok S yaitu 5/7 dan semua sampel pada kelompok M dan L (Gambar 8). Sedangkan infeksi protozoa
Nematopsis spp. yaitu 4/7 pada kelompok S, 1/7 pada kelompok M, dan 5/7 pada kelompok L.
Gambar 8 Peradangan pada mantel kerang hijau (n= S4). Hemosit granulosit (A), hyalinosit (B), dan sel goblet (C). Pewarnaan HE skala 35 μm.
9 berlebihan menunjukan adanya respon pertahanan tubuh. Reaksi pertahanan yang ditunjukan pada Gambar 8 ditandai dengan infiltrasi sel hemosit granulosit dan agranulosit (hyalinosit) serta desquamasi silia. Granulosit mengandung enzim hydrolitik dan oksidatif serta lebih aktif dalam fagositosis. Fagositosis merupakan proses hemosit mendegradasikan benda asing. Sebelum fogositosis terjadi, hemosit mendekati sel target melalui gerakan kemotaksis maupun khemokinesis (Delahaut 2012). Respon pertahanan tersebut tidak spesifik terhadap sesuatu agen penyebab. Hal-hal yang dapat mengaktivasi respon pertahanan pada mantel antara lain bakteri, parasit, polutan logam berat, temperatur lingkungan (Humprey dan Norton 2005).
Organ Pencernaan
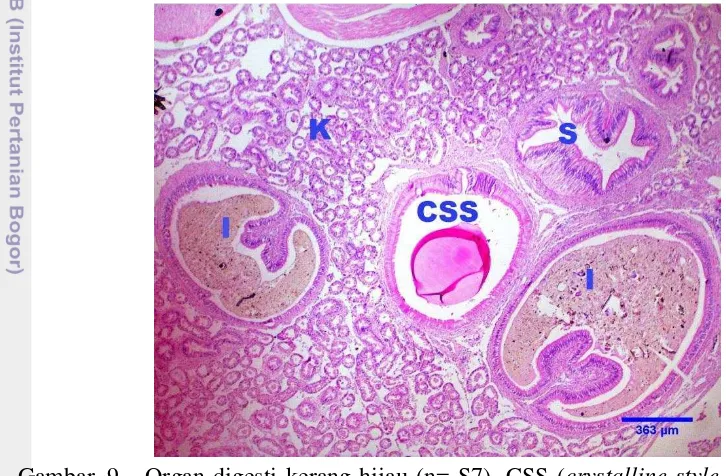
Struktur histologi saluran cerna pada kerang hijau hampir sama dengan mamalia yaitu terdiri atas mukosa dan submukosa. Saluran cerna dilapisi oleh epitel silindris sebaris bersilia dan lapisan lamina propia, serta dikelilingi oleh kelenjar pencernaan (Gambar 9).
Gambar 9 Organ digesti kerang hijau (n= S7). CSS (crystalline style sac), I (Intestine), K (kelenjar pencernaan), S (stomach). Pewarnaan HE skala 363 μm.
10
Gambar 10 Lambung kerang hijau (n= S7). Silia (A), epitel silindris (B), Lp (lamina propia). Pewarnaan HE skala 70 μm.
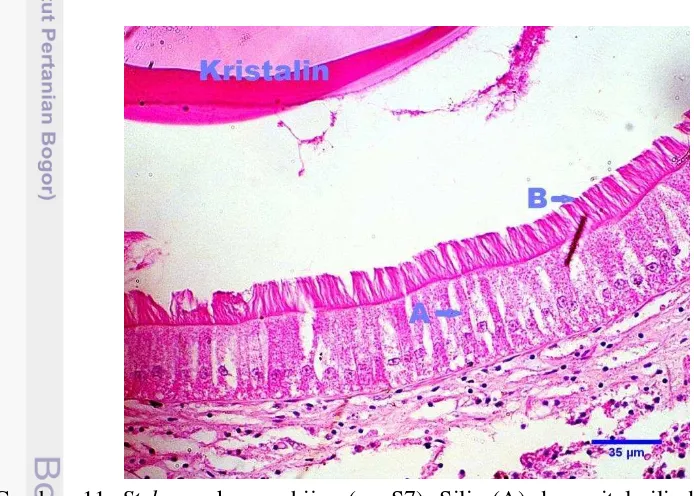
Gambar 11 Style sac kerang hijau (n= S7). Silia (A) dan epitel silindris (B). Pewarnaan HE skala 35 μm.
Bagian posterior lumen lambung ditemukan adanya kristal berwarna merah muda seperti gelatin berbentuk bulat. Bagian yang mengandung kristal ini merupakan perpanjangan dari lambung yang membentuk kantung yang disebut
crystalline style sac (Bower dan Blackbourn 2003). Struktur style sac memiliki epitel silindris yang sama tinggi dengan sitoplasma eosinofilik granuler dan inti bulat berderet ditengah, serta memiliki silia yang tinggi dan tebal (Gambar 11).
11 mukoprotein yang melepaskan enzim pencernaan untuk mengubah pati menjadi gula yang dapat dicerna (Helm dan Bourne 2004).
Lesio patologi yang ditemukan pada saluran pencernaan yaitu adanya infiltrasi hemosit. Infiltrasi hemosit pada lambung, usus, style sac dan kelenjar pencernaan kelompok S, M dan L yaitu 6/7 (Gambar 12 dan 13).
Gambar 12 Enteritis pada kerang hijau (n= L3) disertai nekrosa epitel pencernaan. hemosit hyalinosit (A) dan hemosit granulosit (B). Pewarnaan HE skala 35 μm.
12
dengan variasi ukuran pada lamina propia. Pada beberapa bagian lamina propia juga ditemukan adanya akumulasi hemosit (granulositoma) multifokus seperti yang terlihat dalam Gambar 13. Infiltrasi hemosit tersebut menyebabkan peradangan yang disertai dengan pelepasan silia epitel pencernaan serta peningkatan jaringan ikat disekitar akumulasi hemosit multifokus, sehingga diduga peradangan bersifat kronis.
Bignell et al. (2008), menyatakan reaksi peradangan dengan infiltrasi hemosit menyebar pada jaringan ikat atau membentuk akumulasi multifokus sel radang dikaitkan dengan infeksi protozoa Marteilia sp, inflamasi parah sering disertai dengan granulositoma baik satu maupun beberapa lesio dalam jaringan ikat. Sedangkan penelitian lain menyebutkan prevalensi granulositoma meningkat pada kerang asal lokasi yang terkontaminasi logam berat (Sunila 1986; Myint dan Tyler dalam Stentiford et al. 2004). Namun berdasarkan pengamatan pada penelitian ini reaksi peradangan tersebut bersifat tidak spesifik karena disekitar daerah peradangan tidak terlihat adanya infeksi parasit.
Saluran pencernaan kerang dikelilingi oleh kelenjar pencernaan yang sering disebut dengan hati pada kerang atau hepatopankreas (Helm dan Bourne 2004). Kelenjar pencernaan berupa tubulus-tubulus yang terdiri atas sel pencernaan dan sel piramid basofilik (Zaldibar et al. 2008; McElwain dan Bullard 2013). Kelenjar pencernaan sebagai organ pusat aktivitas metabolisme pada kerang, serta terlibat dalam mekanisme pertahanan kekebalan tubuh, detoxikasi dan regulasi homeostasis (Mangorez et al. 2002; Moore dan Allen 2002).
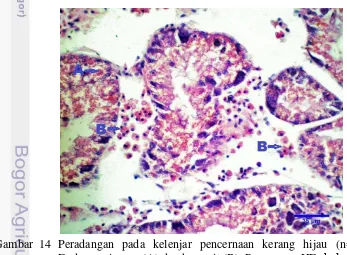
Lesio patologi yang ditemukan pada kelenjar pencernaan selain infiltrasi hemosit juga adanya pigmentasi pada sel kelenjar pencernaan dengan jumlah lesio pada kelompok S 3/7, M dan L 6/7 (Gambar 14).
13 pada Gambar 14. Zaldibar et al. (2008), menyatakan bahwa sel pencernaan dan sel piramid basofilik kelenjar pencernaan memiliki kemampuan berproliferasi. Mitosis pada sel pencernaan dengan BrdU histokimia memperjelas bahwa regenerasi sel dihasilkan oleh autologous dari sel pencernaan dan sel basofilik yang matang (Zaldibar et al. 2004). Zaldibar et al. (2008) juga menjelaskan, proliferasi sel kelenjar pencernaan dipengaruhi oleh musim, dimana proliferasi meningkat pada musim panas.
Lesio lain yang ditemukan pada kelenjar pencernaan yaitu ditemukannya badan inklusi eosinofilik intrasitoplasmik disertai infiltrasi hemosit pada kelompok L sebanyak 1/7 (Gambar 15). Lesio tersebut menyerupai viral-like inclusion bodies yang ditemukan pada kelenjar pencernaan kerang Bathymodiolus heckerae (Ward et al. 2004), kerang Mytilus sp (Bignell et al. 2008). Namun badan inklusi tersebut belum diidentifikasi secara pasti penyebabnya
Gambar 15 Kelenjar Pencernaan kerang hijau (n=L5). Hemosit granulosit (A), badan inklusi eosinofilik intrasitoplasmik (B), fibrosis (C). Pewarnaan HE skala 35 μm.
.
Ginjal
14
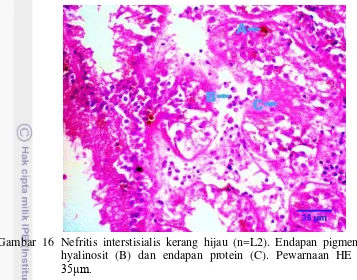
Gambar 16 Nefritis interstisialis kerang hijau (n=L2). Endapan pigmen (A), hyalinosit (B) dan endapan protein (C). Pewarnaan HE skala 35μm.
Endapan pigmen (pigmentasi) yang ditemukan pada organ ginjal, insang dan kelenjar pencernaan ditandai dengan adanya infiltrasi hemosit. Bignell et al. (2011), menyatakan pigmen coklat pada usus, kelenjar pencernaan, gonad dan ginjal mengiringi reaksi inflamasi akibat peningkatan stresor pada organ tersebut. Pigmentasi pada organ ginjal pada penelitian ini menyerupai pigmen lipofuscin, seperti yang pernah dilaporkan oleh Bignell et al. (2008); Bignell et al. (2011) pada kerang Mytilus sp.
Pigmentasi dapat disebabkan oleh respon seluler enzim phenoloksidase terhadap infeksi mikroorganisme seperti protozoa Marteilia sydneyi melalui proses enzimatis fagolisosom (Raftos et al. 2014). Sedangkan menurut Stentiford
et al. (2004) dan Bignell et al. (2011), pigmen kuning sampai kecoklatan juga dapat berupa endapan lipofuscin. Lipofuscin merupakan produk akhir dari reaksi peroksidatif dari membran lipoprotein yang diautofagositosis dalam kompartemen lisosom. Lisosom merupakan organel utama yang bertangggung jawab untuk detoksikasi senyawa beracun dari sitosol, membran lisosom rentan terhadap stres yang disebabkan xenobiotik (McVeight et al. 2006). Peningkatan lipofuscin dianggap sebagai reaksi seluler akibat kontaminan anorganik dan organik (Byrne dan O’Halloran 2001). Lipofuscin terakumulasi dalam lisosom sebagai granul tidak larut, butiran ini terdiri atas modifikasi protein, degradasi produk lipid, karbohidrat, dan logam (Viarengo et al. 2007). Begum (2012), menyatakan di dalam lisosom lipofuscin dapat mengandung granul mineral logam (Cd dan Zn) melalui ikatan metalloprotein.
15 mengalami infiltrasi hemosit berlebihan pada interstisial ginjal kerang hijau. Sehingga peningkatan massa tersebut mungkin disebabkan oleh peradangan kronis.
Jantung
Organ jantung yang diamati sebagian besar tidak menunjukan perubahan yang spesifik. Perubahan signifikan pada jantung yaitu adanya peningkatan akumulasi hemosit pada ruang ventrikel jantung dan tidak terlihat adanya perubahan pada miokardium (Gambar 17).
Gambar 17 Leukositosis pada ruang ventrikel kerang hijau (n= L3). Miokardium (A) dan Hemosit (B). Pewarnan HE skala 70 μm. Peningkatan hemosit pada ruang ventrikel jantung kerang hijau, bersifat patofisiologis karena tidak terlihat adanya kerusakan pada miokardium. Ventrikel jantung kerang terdapat sistem hemolimfe yang didalamnya mengandung hemosit, struktur ini berperan dalam proses sirkulasi dari jantung ke berbagai sinus jaringan secara langsung (Bhargavan 2008). Respon hemosit yang ditunjukan pada ruang ventrikel jantung berupa leukositosis. Leukositosis pada ruang ventrikel jantung sebagai respon pertahanan awal kerang untuk mengeliminasi kontaminan.
Gonad
16
Gambar 18 Infiltrasi hemosit pada gonad betina kerang hijau (n= L3). Ovum (A) dan hemosit (B). Pewarnaan HE skala 70 μm.
Gambar 19 Akumulasi hemosit pada gonad jantan kerang hijau (n= L5). Folikel testis (A), jaringan ikat (B), dan akumulasi hemosit (C). Pewarnaan HE skala 70 μm.
17 logam berat (Lowe dan Pipa dalam Bignell et al. 2011), kontaminan tersebut mengakibatkan penghambatan perkembangan folikel gonad dalam kerang.
Logam Berat
Pengujian akumulasi logam berat Cd, Pb, dan Hg dalam tubuh kerang, dilakukan untuk mendukung diagnosa. Hal ini dikarenakan lesio yang ditemukan tidak spesifik, tetapi berdasarkan kajian literatur lesio histopatologi yang telah dijelaskan pada masing-masing organ sebagian besar dikaitkan dengan pencemaran logam berat. Hasil pengujian mendeteksi adanya logam berat Cd, Pb dan Hg sebesar 0.03 mg/kg, 0.02 mg/kg dan 0.16 mg/kg. Akumulasi logam berat dalam tubuh kerang membuktikan adanya pencemaran lingkungan disekitar perairan teluk Jakarta. Logam berat dapat masuk ke perairan Teluk Jakarta melalui aliran sungai yang membawa limbah industri dan rumah tangga, yang selanjutnya terakumulasi dalam biota laut seperti kerang hijau melalui rantai makanan karena kerang hijau memiliki sifaf filter feeder dan sessile. Kerang diketahui memiliki afinitas yang tinggi terhadap logam berat Cd melalui ikatan protein metallothionin (OSUSRL 2008). Akumulasi ringan dari logam berat tersebut diduga menjadi pemicu terjadinya perubahan degeneratif, dan infiltrasi sel radang non spesifik pada beberapa organ tiap kelompok ukuran seperti yang ditunjukan pada Tabel 1.
18
Tabel 1 Lesio histopatologi organ pada tiap kelompok ukuran sampel K
19
SIMPULAN DAN SARAN
Simpulan
Lesio patologi yang ditemukan pada kerang hijau asal Muara Kamal, Teluk Jakarta menunjukan perubahan degeneratif berupa pigmentasi dan hilangnya epitel silia diakibatkan oleh cemaran logam berat derajat ringan ditemukan pada organ insang, mantel, pencernaan, dan ginjal. Infiltrasi hemosit sebagai reaksi pertahanan ditemukan pada berbagai organ seperti insang, mantel, pencernaan, ginjal, jantung dan gonad. Lesio lain yang ditemukan yaitu adanya infeksi protozoa Nematopsis spp. pada lumen insang, submukosa mantel dan jaringan interstisial saluran pencernaan.
Saran
Perlu dilakukan kajian respon anatomi dan histopatologi kerang hijau yang bukan hasil budidaya yang berumur dewasa, untuk melihat dampak logam berat yang terakumulasi di jaringan.
DAFTAR PUSTAKA
Aarab N, Godal BF, Bechmann RK. 2011. Seasonal variation of histopathological and histochemical markers of PAH exposure in blue mussel (Mytilus edulis
L.). Marine Environmental Research 73 (3): 213-236
Abdel-Baki AS, Al-Quraishy S, Dkhil MA, AL Nasr I, Oliveira E, Casal G, Azevedo C. 2012. Ultrastructural characteristics of Nematopsis sp. Oocysts (Apicomplexa: Porosporidae), a parasite of the clam Meretrix meretrix
(Veneridae) from the Arabian Gulf, Saudi arabia. Folia parasitologi 59(2): 81-86
Affandi R. 2002. Fisiologi Hewan Air. Bogor (ID): Institut Pertanian Bogor. Al-Barwani SM, Arshad A, Amin SMN, Bujang JS. 2013. Incidence of
hermaphrodite in green mussel Perna viridis along the coast of Peninsular Malaysia. Asian journal of animal and veterinary advance 8(2): 376-382 Begum G. 2012. Ecotoxicology. Croatia (IN): InTech pub.
[BSN] Badan Standarisasi Nasional. 2009. SNI 7387.2009. Batas maksimum cemaran logam berat dalam pangan. Jakarta (ID): BSN
Bhargavan B. 2008. Haematological responses of green mussel perna viridis (Linnaeus) to heavy metals copper and mercury [Thesis]. Cochin (IN): Cochin University Of Science and Technology.
Bignell JP, Dodge MJ, Feist SW, Lyons B, Martin PD, Taylor NGH, Stone D, Travalent L, Stentiford GD. 2008. Mussel histopathology: and effects of season, disease and species. Aquatic Biology 2: 1-15
20
Bower SM, Blackbourn J. 2003. Geoduck clam (Panopea abrupta): anatomi, histology, development, pathology, parasites and symbionts [Internet]. 2010; [diunduh 2014 Juli 12]. Tersedia pada: http://www.pac.dfo- mpo.gc.ca/science/species-especes/shellfish-coquillages/geopath/index-eng.html
Byrne PA, O’Halloran JO. 2001. The role of bivalve molluscs as tools in estuarine sediment toxicity testing: a riview. Hydrobiologia 465: 209-217
Ceuta LO, Boehs G. 2012. Parasites of the mangrove mussel Mytella guyanensis (Bivalvia: Mytilidae) in Camamu Bay, Bahia, Brazil. Braz. J. Biol. 72(3): 421-427.
[CETESB] Companhia de Tecnologia de Ambiental do Estado de Sao Paulo Chellaram C, Anand PT, Kumaran S. 2011. Centra nervous system depressant
properties of reef associated gastropods, Drupa margariticola and Trochus tentorium from Gulf of Mannar, Southesatern India. Journal of chemical and pharmaceutical research 3(1): 154-159.
Chakraborty K, Joseph D, Chakkalakal SJ. 2014. Toxicity a nutraceutical formulation derived from green mussel Perna viridis. BioMed Research International: 1-15
David JAO, Fontanetti CS. 2005. Surface morphology of Mytella falcata gill filaments three region of the Somtos estuary. Braz. J. morphol. Sci. 22 (4): 203-210
Delahaut V. 2012. Development of a challenge test for the Blue Mussels, Mytilus edulis [Thesis]. Ghent (BE): Faculty of Bioscience Engineering, Universiteit Gent.
Gosling E. 2003. Bivalve molluscs. Biology, ecology and culture. New Jersey (US): Blackwell Science pub.
Helm MM, Bourne N. 2004. Hatchery Culture of Bivalve. A practical manual. Rome (IT): FAO Fisheries Department.
Humason LG. 1967. Animal Tissue Techniques. 2nd edition. San Francisco (US): WH Freeman and company. Inc.
Humprey JD, Norton JH. 2005. The Pearl Oyster Pinctada maxima (Jameson, 1901): An atlas of functional anatomy, pathology and histopatholohy. Australia (AU): Northern Territory Government Printing Office.
Jin Y H, Clark AB, Slebos RJC, Al‐Refai H, Taylor JA, Kunkel T A. 2003. Cadmium is a mutagen that acts by inhibiting mismatch repair. Nature Genetics. 34: 326‐329.
Lima FC, Abreu MG, Mesquita EFM. 2001. Monitoramento histopatolόgico de mexilhᾶo Perna perna da Lagoa de Itaipu, Niterόi, RJ. Arquivo brasileiro de Medicina Veterinária e Zootecnia 53: 203-206
McElwain A, Bullard SA. 2013. Histological atlas of freshwater mussels (Bivalvia, Unionidae): Villosa Nebulosa (Ambleminae: Lampsilini),
Fusconaia cerina (Ambleminae: Pleurobemini) and Strophitus connasaugaensis (Unioninae: Anondontini). Malacologia 57(1): 99-239. McVeigh A, Moore M, Allen JI, Dyke P. 2006. Lysosomal responses to
nutritional and contaminant stress in mussel hepatopancreatic digestive cells: A modelling study. Marine Environmental Research (62): 433-438.
21 Minimize Cadmium Residues in Shellfish: Sampling and Analysis of Cadmium in U.S. West Coast Bivalve Shellfish [Report]. Astoria (US): Oregon State University.
Padovan IP, Tavares LA, Corral L, Padovan PA, Azevedo C. 2003. Fine structure of the oocyst of Nematopsis mytella (Apicomplexa, Porosporidae), a parasite of the mussel Mytella falcata and of the oyster Crassostrea rizophorae
(Mollusca, Bivalvia) From the Northeastern Atlantic coast of Brazil. Braz. J. Morphol. Sci. 20(3): 141-145
Pinto TR, Boehs G. 2008. Nematopsis sp (Apicomplexa: Eugregarinida) Mytella guyanensis (Lamarck, 1819) (Bivalvia: Mytilidae) da regiᾶo estuarina do Rio Cachoeira, Ilhéus, Bahia, Brasil. Braz. J. Vet. R and Anim. Science. 45: 95-100
Raftos DA, Kuchel R, Alaidaileh S, Butt D. 2014. Infectious microbial diseases and host defense responses in Syndey rock oyster. Frontiersin Microbiology, Aquatic Microbiology 5(135): 1-12
Sabry RC, Gesteira TCV, Boehs G. 2007. First record of parasitism in the mangrove oyster Crassostrea rhizophorae (Bivalvia: Ostreidae) at Jaguaribe River estuary-Ceara, Brazil. Braz. J. Biol. 67: 755-758
Satarug S, Haswell‐Elkins MR, Moore MR. 2000. Safe levels of cadmium intake to prevent renal toxicity in human subjects. Br. J. Nutrition. 84: 791‐802 Setyobudiandi I. 2004. Beberapa Aspek Biologi Reproduksi Kerang Hijau Perna
viridis L, 1758 pada Kondisi Perairan yang Berbeda [Disertasi]. Bogor (ID): Institut Pertanian Bogor.
Siahaan B (2013). Patologi infestasi cacing Camallanus sp pada ikan manfish (Pterophyllum scalare) asal Raiser Cibinong [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Stentiford GD, Green M, Feist SW. 2004. Histopathological investigation of horse mussels from Strangford Lough, Northern Ireland. Strangford Lough Eological Change Investigation (SLECI). Belfast (UK): QUB.
Sunila I. 1986. Histopathological change in the mussel Mytilus edulis L. at the outlet from a titanium dioxide plan in Northern Baltic. Ann. Zool. Fennici 23: 61-70
Teh SJ. 2009. Occurrence of microcystin in Salmon and Steelhead Fish tissues in the Klamath River in 2007. Oregon (US): CH2M HILL Inc.
Tuntiwaranuruk C, Chalermwat K, Uptham ES, Kruatracue M, Azevedo C. 2004. Investigation of Nematopsis spp. Oocysts in 7 species of bivalve from Chonburi Province, Gulf of Thailand. Dis Aquat Org. 58: 47-53
Vasanthi LA, Revanthi P, Arulvasu C, Munuswamy N. 2012. Biomarkers of metal toxicity and histology of Perna viridis from Ennore estuary, Chennai, south east cost of India. Ecotoxicology and Environmental Safety 84: 92-98.
Viarengo A, Lowe D, Bolognesi C, Fabbri E, Koehler A. 2007. The use of biomarkers in biomonitoring: A 2-tier approach assessing the level of pollutant-induced stress syndrome in sentinel organisms. Comparative Biochemistry and Physiology C Toxicology & Pharmacology 146: 281-300. Ward ME, Shields JD, Van Dover CL. 2004. Parasitism in species of
22
Zaldibar B, Cancio I, Marigomez I (2004). Circatidal variation in epithelial cell proliferation in the mussel digestive gland and stomach. Cell Tissue Res. (318): 395-402.
Zaldibar B, Canico I, Marigomez I. 2008. Epithelial cell renewal in the digestive gland and stomach of mussels: season, age and tidal regime related variation.
Histol. Histopathol 23: 281-290.
23
RIWAYAT HIDUP
Penulis dilahirkan di Purwakarta pada tanggal 14 Desember 1986, dari pasangan Darsep dan Ade Rokmanah sebagai anak pertama dari dua bersaudara. Pendidikan formal penulis dimulai dari SD Negeri 1 Cikopo, Purwakarta (1992-1998), SLTP Negeri 2 Campaka, Purwakarta (1998-2001), SMU Negeri 1 Cikampek, Karawang (2001-2004), D3 Teknisi Reproduksi Satwa FKH-IPB (2004-2007) melalui jalur USMI dan pada tahun 2010 penulis melanjutkan program Sarjana di Fakultas Kedokteran Hewan IPB, melalui jalur alih jenis.
Selama masa perkuliahan penulis aktif dalam organisasi Himpunan Minat Profesi Satwaliar FKH IPB (2011-2014) sebagai anggota. Jurnalis website FKH IPB (2013) dan setiap akhir pekan atau liburan kuliah diisi dengan magang di klinik hewan Citrapet and vet mulai dari 2011 sampai sekarang.
PENDAHULUAN
Latar Belakang
Kerang hijau (Perna viridis) merupakan salah satu komoditas perikanan yang banyak dikonsumsi masyarakat Indonesia sebagai sumber protein hewani yang murah dan bergizi tinggi. Seratus gram daging kerang mengandung 49.8 % air, 21.9 % protein, 14.5 % lemak, 18.5 % karbohidrat dan 4.3 % abu (Affandi 2002). Selain dimanfaatkan dagingnya sebagai bahan pangan, protein kerang mengandung zat bioaktif sebagai anti tumor, anti leukemia, anti inflamasi, anti bakteri dan anti virus (Chellaram et al. 2011; Chakraborty et al. 2014).
Kerang dikenal juga sebagai organisme filter-feeder yang hidup menetap (sessile) sehingga kelainan morfologinya dapat menggambarkan kondisi lingkungan dari tempat hidupnya. Kerang hijau jumlahnya cukup berlimpah dan distribusinya luas, meliputi daerah Indo Pasifik, selatan perairan Jepang, perairan-perairan India, Semenanjung Malaysia, Singapura, Laut Cina Selatan, Thailand, Filipina, Indonesia hingga Papua New Guinea (Setyobudiandi 2004). Oleh karena itu, kerang hijau dijadikan sebagai bioindikator cemaran lingkungan. Kondisi patologis yang ditimbulkan akibat cemaran atau infeksi pada kerang salah satunya dapat diamati melalui pengamatan histopatologi (Zhou et al. 2008). Pemeriksaan histopatologi kerang hijau di Indonesia masih belum banyak dipelajari sehingga dilakukan penelitian mengenai studi patologi kerang hijau.
Tujuan Penelitian
Penelitian ini bertujuan untuk mempelajari gambaran patologi kerang hijau yang dibudidayakan di Muara Kamal, Teluk Jakarta, Jakarta Utara.
Manfaat Penelitian
Manfaat dari penelitian ini yaitu dapat memberikan informasi mengenai jenis lesio patologi yang ditemukan pada kerang hijau. Lesio yang ditemukan dapat dijadikan model dalam mempelajari penyakit pada kelompok invertebrata laut. Sebagai indikator pencemaran lingkungan, dapat diketahui tingkat pencemaran di Teluk Jakarta.
METODE
Waktu dan Tempat
PENDAHULUAN
Latar Belakang
Kerang hijau (Perna viridis) merupakan salah satu komoditas perikanan yang banyak dikonsumsi masyarakat Indonesia sebagai sumber protein hewani yang murah dan bergizi tinggi. Seratus gram daging kerang mengandung 49.8 % air, 21.9 % protein, 14.5 % lemak, 18.5 % karbohidrat dan 4.3 % abu (Affandi 2002). Selain dimanfaatkan dagingnya sebagai bahan pangan, protein kerang mengandung zat bioaktif sebagai anti tumor, anti leukemia, anti inflamasi, anti bakteri dan anti virus (Chellaram et al. 2011; Chakraborty et al. 2014).
Kerang dikenal juga sebagai organisme filter-feeder yang hidup menetap (sessile) sehingga kelainan morfologinya dapat menggambarkan kondisi lingkungan dari tempat hidupnya. Kerang hijau jumlahnya cukup berlimpah dan distribusinya luas, meliputi daerah Indo Pasifik, selatan perairan Jepang, perairan-perairan India, Semenanjung Malaysia, Singapura, Laut Cina Selatan, Thailand, Filipina, Indonesia hingga Papua New Guinea (Setyobudiandi 2004). Oleh karena itu, kerang hijau dijadikan sebagai bioindikator cemaran lingkungan. Kondisi patologis yang ditimbulkan akibat cemaran atau infeksi pada kerang salah satunya dapat diamati melalui pengamatan histopatologi (Zhou et al. 2008). Pemeriksaan histopatologi kerang hijau di Indonesia masih belum banyak dipelajari sehingga dilakukan penelitian mengenai studi patologi kerang hijau.
Tujuan Penelitian
Penelitian ini bertujuan untuk mempelajari gambaran patologi kerang hijau yang dibudidayakan di Muara Kamal, Teluk Jakarta, Jakarta Utara.
Manfaat Penelitian
Manfaat dari penelitian ini yaitu dapat memberikan informasi mengenai jenis lesio patologi yang ditemukan pada kerang hijau. Lesio yang ditemukan dapat dijadikan model dalam mempelajari penyakit pada kelompok invertebrata laut. Sebagai indikator pencemaran lingkungan, dapat diketahui tingkat pencemaran di Teluk Jakarta.
METODE
Waktu dan Tempat
2
Pemeriksaan Penyakit Ikan dan Lingkungan Serang, Kementrian Kelautan dan Perikanan.
Bahan
Kerang yang digunakan sebagai studi kasus patologi adalah kerang hijau (Perna viridis) yang berasal dari tambak budidaya kerang hijau di Muara Kamal, Teluk Jakarta, Jakarta Utara. Buffer Neutral Formalin (BNF) 10%, xylene, etanol 70%, etanol 80%, etanol 90%, etanol 95%, dan etanol absolut, parafin cair, perekat entelan dan pewarnaan Haematoksillin-Eosin.
Alat
Peralatan yang digunakan yaitu tissue cassette, automatic tissue processor Sakura®, tissue embedding console Sakura®, rotary microtome American optical Spencer®, penangas air, gelas objek, gelas penutup, mikroskop cahaya
Olympus®, dan digital kamera mikroskop.
Prosedur Penelitian
Preparasi Sampel dan Pembuatan Preparat Histopatologi
Kerang hijau dengan berbagai ukuran diperoleh dari nelayan pengumpul kerang di Muara Kamal, Teluk Jakarta, Jakarta Utara. Kerang-kerang tersebut dikelompokan menjadi tiga ukuran. Ukuran besar (L= large) panjang tubuh > dari 3 cm, sedang (M= medium) panjang tubuh > dari 2 cm dan kecil (S= small) panjang tubuh 1.5-2 cm, masing-masing sebanyak 7 ekor yang terdiri atas jantan dan betina. Masing-masing kerang dipisahkan dari cangkangnya dan dimasukan ke dalam larutan fiksatif BNF 10%. Spesimen dipotong melintang menjadi lima bagian dan diletakan dalam tissue cassette. Selanjutnya dibuat preparat histopatologi dan diwarnai dengan pewarnaan Haematoksillin-Eosin (HE) yang diadaptasi dari metode Humason (1967). Kerang hijau segar dalam bentuk beku, sebanyak 1.5 kg dikirim ke Laboratorium Loka Pemeriksaan Penyakit Ikan dan Lingkungan Serang, untuk diperiksa kadar kandungan logam berat Hg, Pb, dan Cd.
Pembacaan Histopatologi
3
HASIL DAN PEMBAHASAN
Patologi Anatomi
Pengamatan struktur tubuh kerang hijau setelah dipisahkan dari cangkangnya, secara makroskopis tidak menunjukan adanya kelainan patologi anatomi untuk setiap kelompok ukuran, tetapi terlihat adanya perbedaan warna pada kelompok M dan L yaitu krem dan jingga, sedangkan pada kelompok S menunjukan warna krem yang seragam. Perbedaan warna tersebut menunjukan perbedaan kelamin pada kerang. Gonad kerang jantan berwarna putih (krem) dan gonad kerang betina berwarna merah hingga jingga (Yap dalam Al-Barwani 2013). Sehingga diketahui sampel berjenis kelamin jantan sebanyak 15 sampel dan kelamin betina 6 sampel.
Gambar 1 Gambaran patologi anatomi kerang hijau pada kelompok L, M dan S setelah dipisahkan dari cangkangnya.
Histopatologi
Insang
4
Gambar 2 Insang kerang hijau normal (n=L5), zona frontal (A), sel goblet (B), zona intermediet (C) dan inter filament junction (D). Pewarnaan HE skala 70 μm.
Gambar 3 Brankhitis disertai endapan pigmen pada epitel insang kerang hijau (n=M2). Hemosit granulosit (A) dan endapan pigmen (B). Pewarnaan HE skala 35 μm.
5 yang berperan dalam sistem imun seluler pada kerang yang berada dalam hemolimfe (Bhargavan 2008; Delahaut 2012). Bhargavan (2008), menyatakan hemosit tidak terbatas pada sistem hemolimfe tetapi dapat bergerak bebas keluar dari sinus ke jaringan ikat sekitar mantel, rongga usus dan lumen. Sel ini berperan penting dalam proses fisiologis seperti pertukaran gas, osmoregulasi, transportasi nutrisi dan eksresi, perbaikan jaringan dan pertahanan tubuh. Peranan dalam perbaikan tubuh dengan cara migrasi dalam jumlah besar ke daerah yang rusak dan memasuki luka sementara epitel beregenerasi.
Gambar 4 Insang kerang hijau (n= S7). hiperplasia sel goblet (A). Pewarnaan HE skala 70 μm.
Proliferasi sel goblet pada insang merupakan respon pertahanan lokal terhadap polutan. David dan Fontanetti (2005), menyatakan peningkatan sekresi lendir sebagai mekanisme awal untuk mengeliminasi polutan seperti logam berat, dengan cara menangkap dan menyelimuti logam berat sebelum merusak jaringan. Hal ini sejalan dengan laporan pencemaran di Teluk Santos, Brazil kerang pada lokasi B yang memiliki kandungan logam Hg 0,70 μg/l dan Pb 15,00 μg/l menunjukan peningkatan produksi lendir, tetapi pada lokasi C meskipun memiliki kandungan pencemar yang tinggi (Hg 0,66 μg/l dan Pb 219,66 μg/l), tidak menunjukan peningkatan produksi lender (CETESB dalam David dan Fontanetti 2005).
6
Perubahan patologi lain yang ditemukan pada insang yaitu adanya infeksi protozoa yang ditemukan disemua kelompok. Pada kelompok S dan M 3/7 dan 5/7 pada kelompok L. Protozoa tersebut berbentuk lonjong seperti kacang berwarna basofilik dan diselaputi oleh lapisan tipis membentuk kapsula (Gambar 5).
Gambar 5 Protozoa pada lumen insang kerang hijau (n= L6). Hemosit (A), fagosit (B), sporozoit (C), ookista (D), dan sel goblet (E). Pewarnaan HE skala 35 μm.
Protozoa yang ditemukan pada kerang hijau yang ditunjukan Gambar 5 diduga adalah Nematopsis. Morfologi protozoa tersebut menyerupai protozoa yang menginfeksi kerang-kerangan di perairan Chonbury Thailand yang dilaporkan oleh Tuntiwarunuruk et al. (2004) dan diidentifkiasi sebagai
Nematopsis spp. yang ditemukan dalam lumen insang kerang hijau, berupa ookista yang terisolasi dalam vakuola parasitiforus dari fagosit sel inang. Setiap fagosit terdiri atas 1-7 ookista dan dikelilingi oleh membran. Padovan et al. (2003) melaporkan, satu fagosit mengandung 15-19 ookista pada kerang Mytella falcata, lebih sering 3-5 ookista.
Ookista mengandung sporozoit tunggal (Monozoic) dan ada beberapa ookista terlihat kosong, serta sporozoit tidak berkapsul. Ookista monozoic (sporocysts) bersifat resisten dalam tubuh inang (Padovan et al. 2003). Ultrastruktur ookista Nematopsis terdiri atas sporozoit yang dilapisi dinding tebal dan mikrofibril yang melapisi dinding ookista (Padovan et al. 2003; Abdel-Baki et al. 2012). Struktur ketebalan dinding Nematopsis yang memungkinkan sifat resisten ookista Nematopsis dalam tubuh kerang.
7
Gambar 6 Nematopsis spp. dalam jaringan penghubung organ digesti kerang hijau (n=S7). fagosit (A), sporozoit (B), vakuola parasitiforus (C) dan ookista (D). Pewarnaan HE skala 35 μm.
Nematopsis, selain pada insang juga ditemukan pada organ mantel dan jaringan interstisial digesti (Gambar 6). Ookista Nematopsis dalam jaringan kerang hijau yang diamati, tidak menimbulkan lesio yang signifikan pada jaringan inang akan tetapi apabila infeksinya berlebihan dapat mengakibatkan kerusakan jaringan sekitar. Ceuta dan Boehs (2012) menyatakan, meskipun prevalensi gregarine Nematopsis tinggi, intensitas infeksi umumnya rendah dengan tidak menunjukan kerusakan yang signifikan pada inang. Namun beberapa kerang dengan infeksi yang intensif pada jaringan penghubung labial palp, sangat memungkinkan mempengaruhi fungsi organ seperti proses makan. Beberapa studi mencatat tidak ada kerusakan yang serius pada kerang Mytella guyanensis (Pinto dan Boehs 2008), pada tiram bakau Crassostrea rizophorae (Sabry et al. 2007), kerang Perna perna (Lima et al. 2001) dan kerang hijau (Tuntiwaranuruk et al. 2004). Selain itu Tuntiwaranuruk juga mengungkapkan tingkat infeksi antar spesies kerang dipengaruhi oleh habitat, musim dan curah hujan yang mempengaruhi suhu dan salinitas air laut.
Mantel
8
Gambar 7 Struktur histologi mantel kerang hijau (n= S7). Sel goblet (A), sel lemak (B), sel ungu (C), sel granuler eosinofilik (D), dan serabut otot (E). Pewarnaan HE skala 70 μm.
Lesio patologi yang ditemukan yaitu adanya infiltrasi hemosit dan infeksi protozoa Nematopsis spp. Infiltrasi hemosit pada kerang kelompok S yaitu 5/7 dan semua sampel pada kelompok M dan L (Gambar 8). Sedangkan infeksi protozoa
Nematopsis spp. yaitu 4/7 pada kelompok S, 1/7 pada kelompok M, dan 5/7 pada kelompok L.
Gambar 8 Peradangan pada mantel kerang hijau (n= S4). Hemosit granulosit (A), hyalinosit (B), dan sel goblet (C). Pewarnaan HE skala 35 μm.
9 berlebihan menunjukan adanya respon pertahanan tubuh. Reaksi pertahanan yang ditunjukan pada Gambar 8 ditandai dengan infiltrasi sel hemosit granulosit dan agranulosit (hyalinosit) serta desquamasi silia. Granulosit mengandung enzim hydrolitik dan oksidatif serta lebih aktif dalam fagositosis. Fagositosis merupakan proses hemosit mendegradasikan benda asing. Sebelum fogositosis terjadi, hemosit mendekati sel target melalui gerakan kemotaksis maupun khemokinesis (Delahaut 2012). Respon pertahanan tersebut tidak spesifik terhadap sesuatu agen penyebab. Hal-hal yang dapat mengaktivasi respon pertahanan pada mantel antara lain bakteri, parasit, polutan logam berat, temperatur lingkungan (Humprey dan Norton 2005).
Organ Pencernaan
Struktur histologi saluran cerna pada kerang hijau hampir sama dengan mamalia yaitu terdiri atas mukosa dan submukosa. Saluran cerna dilapisi oleh epitel silindris sebaris bersilia dan lapisan lamina propia, serta dikelilingi oleh kelenjar pencernaan (Gambar 9).
Gambar 9 Organ digesti kerang hijau (n= S7). CSS (crystalline style sac), I (Intestine), K (kelenjar pencernaan), S (stomach). Pewarnaan HE skala 363 μm.
10
Gambar 10 Lambung kerang hijau (n= S7). Silia (A), epitel silindris (B), Lp (lamina propia). Pewarnaan HE skala 70 μm.
Gambar 11 Style sac kerang hijau (n= S7). Silia (A) dan epitel silindris (B). Pewarnaan HE skala 35 μm.
Bagian posterior lumen lambung ditemukan adanya kristal berwarna merah muda seperti gelatin berbentuk bulat. Bagian yang mengandung kristal ini merupakan perpanjangan dari lambung yang membentuk kantung yang disebut
crystalline style sac (Bower dan Blackbourn 2003). Struktur style sac memiliki epitel silindris yang sama tinggi dengan sitoplasma eosinofilik granuler dan inti bulat berderet ditengah, serta memiliki silia yang tinggi dan tebal (Gambar 11).
11 mukoprotein yang melepaskan enzim pencernaan untuk mengubah pati menjadi gula yang dapat dicerna (Helm dan Bourne 2004).
Lesio patologi yang ditemukan pada saluran pencernaan yaitu adanya infiltrasi hemosit. Infiltrasi hemosit pada lambung, usus, style sac dan kelenjar pencernaan kelompok S, M dan L yaitu 6/7 (Gambar 12 dan 13).
Gambar 12 Enteritis pada kerang hijau (n= L3) disertai nekrosa epitel pencernaan. hemosit hyalinosit (A) dan hemosit granulosit (B). Pewarnaan HE skala 35 μm.
12
dengan variasi ukuran pada lamina propia. Pada beberapa bagian lamina propia juga ditemukan adanya akumulasi hemosit (granulositoma) multifokus seperti yang terlihat dalam Gambar 13. Infiltrasi hemosit tersebut menyebabkan peradangan yang disertai dengan pelepasan silia epitel pencernaan serta peningkatan jaringan ikat disekitar akumulasi hemosit multifokus, sehingga diduga peradangan bersifat kronis.
Bignell et al. (2008), menyatakan reaksi peradangan dengan infiltrasi hemosit menyebar pada jaringan ikat atau membentuk akumulasi multifokus sel radang dikaitkan dengan infeksi protozoa Marteilia sp, inflamasi parah sering disertai dengan granulositoma baik satu maupun beberapa lesio dalam jaringan ikat. Sedangkan penelitian lain menyebutkan prevalensi granulositoma meningkat pada kerang asal lokasi yang terkontaminasi logam berat (Sunila 1986; Myint dan Tyler dalam Stentiford et al. 2004). Namun berdasarkan pengamatan pada penelitian ini reaksi peradangan tersebut bersifat tidak spesifik karena disekitar daerah peradangan tidak terlihat adanya infeksi parasit.
Saluran pencernaan kerang dikelilingi oleh kelenjar pencernaan yang sering disebut dengan hati pada kerang atau hepatopankreas (Helm dan Bourne 2004). Kelenjar pencernaan berupa tubulus-tubulus yang terdiri atas sel pencernaan dan sel piramid basofilik (Zaldibar et al. 2008; McElwain dan Bullard 2013). Kelenjar pencernaan sebagai organ pusat aktivitas metabolisme pada kerang, serta terlibat dalam mekanisme pertahanan kekebalan tubuh, detoxikasi dan regulasi homeostasis (Mangorez et al. 2002; Moore dan Allen 2002).
Lesio patologi yang ditemukan pada kelenjar pencernaan selain infiltrasi hemosit juga adanya pigmentasi pada sel kelenjar pencernaan dengan jumlah lesio pada kelompok S 3/7, M dan L 6/7 (Gambar 14).
13 pada Gambar 14. Zaldibar et al. (2008), menyatakan bahwa sel pencernaan dan sel piramid basofilik kelenjar pencernaan memiliki kemampuan berproliferasi. Mitosis pada sel pencernaan dengan BrdU histokimia memperjelas bahwa regenerasi sel dihasilkan oleh autologous dari sel pencernaan dan sel basofilik yang matang (Zaldibar et al. 2004). Zaldibar et al. (2008) juga menjelaskan, proliferasi sel kelenjar pencernaan dipengaruhi oleh musim, dimana proliferasi meningkat pada musim panas.
Lesio lain yang ditemukan pada kelenjar pencernaan yaitu ditemukannya badan inklusi eosinofilik intrasitoplasmik disertai infiltrasi hemosit pada kelompok L sebanyak 1/7 (Gambar 15). Lesio tersebut menyerupai viral-like inclusion bodies yang ditemukan pada kelenjar pencernaan kerang Bathymodiolus heckerae (Ward et al. 2004), kerang Mytilus sp (Bignell et al. 2008). Namun badan inklusi tersebut belum diidentifikasi secara pasti penyebabnya
Gambar 15 Kelenjar Pencernaan kerang hijau (n=L5). Hemosit granulosit (A), badan inklusi eosinofilik intrasitoplasmik (B), fibrosis (C). Pewarnaan HE skala 35 μm.
.
Ginjal
14
Gambar 16 Nefritis interstisialis kerang hijau (n=L2). Endapan pigmen (A), hyalinosit (B) dan endapan protein (C). Pewarnaan HE skala 35μm.
Endapan pigmen (pigmentasi) yang ditemukan pada organ ginjal, insang dan kelenjar pencernaan ditandai dengan adanya infiltrasi hemosit. Bignell et al. (2011), menyatakan pigmen coklat pada usus, kelenjar pencernaan, gonad dan ginjal mengiringi reaksi inflamasi akibat peningkatan stresor pada organ tersebut. Pigmentasi pada organ ginjal pada penelitian ini menyerupai pigmen lipofuscin, seperti yang pernah dilaporkan oleh Bignell et al. (2008); Bignell et al. (2011) pada kerang Mytilus sp.
Pigmentasi dapat disebabkan oleh respon seluler enzim phenoloksidase terhadap infeksi mikroorganisme seperti protozoa Marteilia sydneyi melalui proses enzimatis fagolisosom (Raftos et al. 2014). Sedangkan menurut Stentiford
et al. (2004) dan Bignell et al. (2011), pigmen kuning sampai kecoklatan juga dapat berupa endapan lipofuscin. Lipofuscin merupakan produk akhir dari reaksi peroksidatif dari membran lipoprotein yang diautofagositosis dalam kompartemen lisosom. Lisosom merupakan organel utama yang bertangggung jawab untuk detoksikasi senyawa beracun dari sitosol, membran lisosom rentan terhadap stres yang disebabkan xenobiotik (McVeight et al. 2006). Peningkatan lipofuscin dianggap sebagai reaksi seluler akibat kontaminan anorganik dan organik (Byrne dan O’Halloran 2001). Lipofuscin terakumulasi dalam lisosom sebagai granul tidak larut, butiran ini terdiri atas modifikasi protein, degradasi produk lipid, karbohidrat, dan logam (Viarengo et al. 2007). Begum (2012), menyatakan di dalam lisosom lipofuscin dapat mengandung granul mineral logam (Cd dan Zn) melalui ikatan metalloprotein.
15 mengalami infiltrasi hemosit berlebihan pada interstisial ginjal kerang hijau. Sehingga peningkatan massa tersebut mungkin disebabkan oleh peradangan kronis.
Jantung
Organ jantung yang diamati sebagian besar tidak menunjukan perubahan yang spesifik. Perubahan signifikan pada jantung yaitu adanya peningkatan akumulasi hemosit pada ruang ventrikel jantung dan tidak terlihat adanya perubahan pada miokardium (Gambar 17).
Gambar 17 Leukositosis pada ruang ventrikel kerang hijau (n= L3). Miokardium (A) dan Hemosit (B). Pewarnan HE skala 70 μm. Peningkatan hemosit pada ruang ventrikel jantung kerang hijau, bersifat patofisiologis karena tidak terlihat adanya kerusakan pada miokardium. Ventrikel jantung kerang terdapat sistem hemolimfe yang didalamnya mengandung hemosit, struktur ini berperan dalam proses sirkulasi dari jantung ke berbagai sinus jaringan secara langsung (Bhargavan 2008). Respon hemosit yang ditunjukan pada ruang ventrikel jantung berupa leukositosis. Leukositosis pada ruang ventrikel jantung sebagai respon pertahanan awal kerang untuk mengeliminasi kontaminan.
Gonad
16
Gambar 18 Infiltrasi hemosit pada gonad betina kerang hijau (n= L3). Ovum (A) dan hemosit (B). Pewarnaan HE skala 70 μm.
Gambar 19 Akumulasi hemosit pada gonad jantan kerang hijau (n= L5). Folikel testis (A), jaringan ikat (B), dan akumulasi hemosit (C). Pewarnaan HE skala 70 μm.
17 logam berat (Lowe dan Pipa dalam Bignell et al. 2011), kontaminan tersebut mengakibatkan penghambatan perkembangan folikel gonad dalam kerang.
Logam Berat
Pengujian akumulasi logam berat Cd, Pb, dan Hg dalam tubuh kerang, dilakukan untuk mendukung diagnosa. Hal ini dikarenakan lesio yang ditemukan tidak spesifik, tetapi berdasarkan kajian literatur lesio histopatologi yang telah dijelaskan pada masing-masing organ sebagian besar dikaitkan dengan pencemaran logam berat. Hasil pengujian mendeteksi adanya logam berat Cd, Pb dan Hg sebesar 0.03 mg/kg, 0.02 mg/kg dan 0.16 mg/kg. Akumulasi logam berat dalam tubuh kerang membuktikan adanya pencemaran lingkungan disekitar perairan teluk Jakarta. Logam berat dapat masuk ke perairan Teluk Jakarta melalui aliran sungai yang membawa limbah industri dan rumah tangga, yang selanjutnya terakumulasi dalam biota laut seperti kerang hijau melalui rantai makanan karena kerang hijau memiliki sifaf filter feeder dan sessile. Kerang diketahui memiliki afinitas yang tinggi terhadap logam berat Cd melalui ikatan protein metallothionin (OSUSRL 2008). Akumulasi ringan dari logam berat tersebut diduga menjadi pemicu terjadinya perubahan degeneratif, dan infiltrasi sel radang non spesifik pada beberapa organ tiap kelompok ukuran seperti yang ditunjukan pada Tabel 1.
18
Tabel 1 Lesio histopatologi organ pada tiap kelompok ukuran sampel K
19
SIMPULAN DAN SARAN
Simpulan
Lesio patologi yang ditemukan pada kerang hijau asal Muara Kamal, Teluk Jakarta menunjukan perubahan degeneratif berupa pigmentasi dan hilangnya epitel silia diakibatkan oleh cemaran logam berat derajat ringan ditemukan pada organ insang, mantel, pencernaan, dan ginjal. Infiltrasi hemosit sebagai reaksi pertahanan ditemukan pada berbagai organ seperti insang, mantel, pencernaan, ginjal, jantung dan gonad. Lesio lain yang ditemukan yaitu adanya infeksi protozoa Nematopsis spp. pada lumen insang, submukosa mantel dan jaringan interstisial saluran pencernaan.
Saran
Perlu dilakukan kajian respon anatomi dan histopatologi kerang hijau yang bukan hasil budidaya yang berumur dewasa, untuk melihat dampak logam berat yang terakumulasi di jaringan.
DAFTAR PUSTAKA
Aarab N, Godal BF, Bechmann RK. 2011. Seasonal variation of histopathological and histochemical markers of PAH exposure in blue mussel (Mytilus edulis
L.). Marine Environmental Research 73 (3): 213-236
Abdel-Baki AS, Al-Quraishy S, Dkhil MA, AL Nasr I, Oliveira E, Casal G, Azevedo C. 2012. Ultrastructural characteristics of Nematopsis sp. Oocysts (Apicomplexa: Porosporidae), a parasite of the clam Meretrix meretrix
(Veneridae) from the Arabian Gulf, Saudi arabia. Folia parasitologi 59(2): 81-86
Affandi R. 2002. Fisiologi Hewan Air. Bogor (ID): Institut Pertanian Bogor. Al-Barwani SM, Arshad A, Amin SMN, Bujang JS. 2013. Incidence of
hermaphrodite in green mussel Perna viridis along the coast of Peninsular Malaysia. Asian journal of animal and veterinary advance 8(2): 376-382 Begum G. 2012. Ecotoxicology. Croatia (IN): InTech pub.
[BSN] Badan Standarisasi Nasional. 2009. SNI 7387.2009. Batas maksimum cemaran logam berat dalam pangan. Jakarta (ID): BSN
Bhargavan B. 2008. Haematological responses of green mussel perna viridis (Linnaeus) to heavy metals copper and mercury [Thesis]. Cochin (IN): Cochin University Of Science and Technology.
Bignell JP, Dodge MJ, Feist SW, Lyons B, Martin PD, Taylor NGH, Stone D, Travalent L, Stentiford GD. 2008. Mussel histopathology: and effects of season, disease and species. Aquatic Biology 2: 1-15
STUDI PATOLOGI KERANG HIJAU (
Perna viridis
) ASAL
MUARA KAMAL, TELUK JAKARTA
IIS ISMAWATI
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
19
SIMPULAN DAN SARAN
Simpulan
Lesio patologi yang ditemukan pada kerang hijau asal Muara Kamal, Teluk Jakarta menunjukan perubahan degeneratif berupa pigmentasi dan hilangnya epitel silia diakibatkan oleh cemaran logam berat derajat ringan ditemukan pada organ insang, mantel, pencernaan, dan ginjal. Infiltrasi hemosit sebagai reaksi pertahanan ditemukan pada berbagai organ seperti insang, mantel, pencernaan, ginjal, jantung dan gonad. Lesio lain yang ditemukan yaitu adanya infeksi protozoa Nematopsis spp. pada lumen insang, submukosa mantel dan jaringan interstisial saluran pencernaan.
Saran
Perlu dilakukan kajian respon anatomi dan histopatologi kerang hijau yang bukan hasil budidaya yang berumur dewasa, untuk melihat dampak logam berat yang terakumulasi di jaringan.
DAFTAR PUSTAKA
Aarab N, Godal BF, Bechmann RK. 2011. Seasonal variation of histopathological and histochemical markers of PAH exposure in blue mussel (Mytilus edulis
L.). Marine Environmental Research 73 (3): 213-236
Abdel-Baki AS, Al-Quraishy S, Dkhil MA, AL Nasr I, Oliveira E, Casal G, Azevedo C. 2012. Ultrastructural characteristics of Nematopsis sp. Oocysts (Apicomplexa: Porosporidae), a parasite of the clam Meretrix meretrix
(Veneridae) from the Arabian Gulf, Saudi arabia. Folia parasitologi 59(2): 81-86
Affandi R. 2002. Fisiologi Hewan Air. Bogor (ID): Institut Pertanian Bogor. Al-Barwani SM, Arshad A, Amin SMN, Bujang JS. 2013. Incidence of
hermaphrodite in green mussel Perna viridis along the coast of Peninsular Malaysia. Asian journal of animal and veterinary advance 8(2): 376-382 Begum G. 2012. Ecotoxicology. Croatia (IN): InTech pub.
[BSN] Badan Standarisasi Nasional. 2009. SNI 7387.2009. Batas maksimum cemaran logam berat dalam pangan. Jakarta (ID): BSN
Bhargavan B. 2008. Haematological responses of green mussel perna viridis (Linnaeus) to heavy metals copper and mercury [Thesis]. Cochin (IN): Cochin University Of Science and Technology.
Bignell JP, Dodge MJ, Feist SW, Lyons B, Martin PD, Taylor NGH, Stone D, Travalent L, Stentiford GD. 2008. Mussel histopathology: and effects of season, disease and species. Aquatic Biology 2: 1-15