PENENTUAN WAKTU OPTIMAL PENGUJIAN INTEGRITAS
MEMBRAN PLASMA SPERMATOZOA BABI
MENGGUNAKAN
HYPO-OSMOTIC SWELLING
(HOS)
TEST
I NENGAH DONNY ARTIKA
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Penentuan Waktu Optimal Pengujian Integritas Membran Plasma Spermatozoa Babi Menggunakan Hypo-osmotic Swelling (HOS) Test adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2014 I Nengah Donny Artika
ABSTRAK
I NENGAH DONNY ARTIKA. Penentuan Waktu Optimal Pengujian Integritas Membran Plasma Spermatozoa Babi Menggunakan Hypo-osmotic Swelling (HOS) Test. Dibimbing oleh R Iis Arifiantini Msi
Keutuhan membran plasma merupakan faktor penting untuk menentukan fertilitas spermatozoa. Penelitian ini bertujuan untuk menentukan waktu optimum untuk pengujian membran plasma yang utuh (MPU) pada semen segar babi menggunakan hypo-osmotic swelling (HOS) test. Sebanyak 10 ekor babi dari bangsa Landrace, Duroc dan Yorkshire yang telah dewasa digunakan sebagai sumber semen. Semen dikoleksi menggunakan pemijatan massase. Semen yang diperoleh dievaluasi secara makroskopis dan mikroskopis. Pengujian MPU dilakukan dengan cara memasukkan 50 µL semen ke dalam mikrotub berisi 1 ml larutan hipoosmotik (150 mOsm Kg-1). Campuran larutan diinkubasi pada suhu 37oC. Sperma yang
bereaksi dan yang tidak bereaksi terhadap larutan HOS dievaluasi mulai jam ke 0 dan setiap 15 menit dengan total 200 sel sperma. Hasil penelitian menunjukkan bahwa waktu optimal sperma bereaksi maksimal terhadap larutan HOS adalah 60 menit setelah inkubasi.
Kata kunci: Keutuhan membran plasma, HOS test, semen babi.
ABSTRACT
I NENGAH DONNY ARTIKA. Determination of Optimal Time for Spermatozoa Membran Integrity Test of Boar Spermatozoa Using Hypoosmotic Swelling
(HOST) Test. Supervised by R Iis Arifiantini Msi
Spermatozoa plasma membrane integrity was important for spermatozoa fertility. The objective of this study was to determine the optimal time to test spermatozoa plasma membrane of raw boar semen using hypo osmotic swelling (HOS) test. A total of 10 sexualy mature boars from three breed (landrace, Duroc, and Yorkshire) used as a spermatozoa source. Semen were collected using hand glove method. Immediatley after collection the semen were evaluate macro and microscopically. The HOS test was conducted by putting 50 µL semen into 1 ml HOS medium (150 mOsm Kg-1) incubated at 37oC. Two hundred reacted and not
reacted spermatozoa cell to HOS medium were evaluate at 0 min and every 15 minutes. Result showed that the optimum response to HOS was obtained at 60 minutes after incubation.
Judul Skripsi : Penentuan Waktu Optimal Pemeriksaan Integritas Membran Plasma Spermatozoa Babi Menggunakan Hypo-osmotic Swelling (HOS) Test
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan
pada
Fakultas Kedokteran Hewan
PENENTUAN WAKTU OPTIMAL PENGUJIAN INTEGRITAS
MEMBRAN PLASMA SPERMATOZOA BABI
MENGGUNAKAN
HYPO-OSMOTIC SWELLING
(HOS)
TEST
I NENGAH DONNY ARTIKA
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
Judul skripsi : Penentuan Waktu Optimal Pengujian Integritas Membran Plasma Spermatozoa Babi Mengunakan Hypo-osmotic Swelling (HOS) Test
Nama : I Nengah Donny Artika NIM : B04100052
Disetujui oleh
Prof Dr Dra R Iis Arifiantini MSi Pembimbing I
Diketahui oleh
Drh Agus Setiyono MS PhD APVet Wakil Dekan Fakultas Kedokteran Hewan
PRAKATA
Puji dan syukur penulis panjatkan kepada Ida Sang Hyang Widhi Wasa, Tuhan Yang Maha Esa karena atas segala waranugraha-Nya skripsi ini dapat diselesaikan. Judul yang dipilih dalam skripsi ini ialah Penentuan Waktu Optimal Pengujian Integritas Membran Plasma pada Semen Babi dengan Menggunakan Hypo-osmotic Swelling (HOS) Test.
Terima kasih penulis ucapkan kepada Ibu Prof Dr Dra R Iis Arifiantini, MSi selaku pembimbing. Ibu Prof Dr drh Tuty L Yusup dan Dr Ir W Marlene Nalley yang selalu memberikan dukungan, semangat dan sharing ilmunya. Terimakasih juga penulis ucapkan untuk Balai Inseminasi Buatan Daerah (BIBD) Unit Pelaksana Teknis Dinas (UPTD) Peternakan Provinsi Bali di Baturiti, ucapan terimakasih juga untuk bapak Alex sebagai pemilik peternakan babi PT. Adi Farm yang berlokasi di Kabupaten Karanganyar, Solo yang telah bersedia membantu dalam pengambilan dan pengujian sample pada penelitian ini. Pada kesempatan ini penulis tidak lupa mengucapkan terimakasih kepada partner penelitian Nurul Hafsari dan Mulyani Nofriza yang telah berjuang bersama-sama dalam penelitian. Ungkapan terima kasih juga disampaikan kepada bapak, ibu serta seluruh keluarga, atas doa dukungan moral maupun materi dan kasih sayangnya.
Semoga skripsi ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
TINJAUAN PUSTAKA 3
Ternak Babi 3
Inseminasi Buatan 3 Pengujian Integritas Membran Plasma Spermatozoa 3 Koleksi Semen 4 Semen Babi 5 Spermatozoa 5 METODE 7 Waktu dan Tempat 7 Bahan 7 Alat 7 Prosedur 7 HASIL / PEMBAHASAN 9
Kualitas semen Segar 9
Integritas Membran Plasma Spermatozoa 10
SIMPULAN 15
SARAN 15
DAFTAR PUSTAKA 15
LAMPIRAN 18
DAFTAR TABEL
1 Nilai karakteristik semen segar babi 10
2 Persentase jumlah spermatozoa yang bereaksi positif Hypo-osmotic 12 3 Persentase jumlah spermatozoa yang bereaksi positif Hypo-osmotic
swelling (HOS) test antar breed selama masa inkubasi 13
DAFTAR GAMBAR
1 Hasil pengujian membran plasma dengan HOS tes 11 2 Grafik reaksi spermatozoa positif terhadap larutan HOS 12 3 Perubahan volume spermatozoa sebagai respon terhadap kondisi
hipoosmotik 13
DAFTAR LAMPIRAN
1 Hasil analisis data menggunakan uji Anova dengan uji lanjut
Duncan pada selang kepercayaan 99% (P > 0.01) 18 2 Hasil Uji - t proporsi HOS positif dari berbagai breed pada selang
PENDAHULUAN
Latar Belakang
Babi (Sus Sp.) merupakan salah satu konsumsi utama masyarakat khususnya di Eropa dan Amerika dan di negara tersebut peternakan babi mencapai 20-30% dari total peternakan yang ada. Di Indonesia konsumsi daging babi ini tidak begitu besar dikarenakan hanya bisa dinikmati oleh golongan non muslim, namun dalam lima tahun terakhir produksi daging babi di Indonesia terus mengalami peningkatan. Menurut Balai Pusat Statistik (BPS) dalam lima tahun terakhir populasi babi mengalami peningkatan sebesar 4.37%, data tahun 2009 hanya 6.974.732 ekor dan tahun 2013 meningkat menjadi 8.245.712 ekor hal ini menunjukkan bahwa peternakan babi di Indonesia semakin maju.
Inseminasi buatan (IB) merupakan cara yang efektif untuk mendapatkan genetik unggul dengan resiko minimal terhadap penularan penyakit (Maes et al. 2008). Penerapan teknologi IB pada peternakan babi meningkat secara signifikan pada satu dekade terakhir (Maes et al. 2011), begitu juga di Indonesia teknologi IB pada babi telah banyak dilakukan di provinsi Sumatera Utara, Jawa Tengah, Bali, Kalimantan Barat, Sulawesi, dan Papua menggunakan semen cair. Inseminasi dengan semen beku belum banyak digunakan karena harganya yang cukup mahal. Keberhasilan IB sebagian besar bergantung pada kualitas semen dan prosedur inseminasi.
Kualitas semen yang baik diketahui melalui proses evaluasi semen setelah penampungan. Evaluasi semen yang dilakukan di Balai Inseminasi Buatan Daerah (BIBD) Unit Pelaksana Teknis Daerah (UPTD) Peternakan Provinsi Bali di Baturiti dan peternakan Adhi Farm, Solo masih terbatas pada metode pengujian standard yang meliputi pengujian makroskopis seperti volume, konsistensi, warna, dan pH serta pengujian mikroskopis yang meliputi motilitas dan konsentrasi. Pengujian kualitas semen, selain yang telah disebutkan di atas juga dapat dilakukan dengan beberapa parameter lain seperti viabilitas, pengujian tudung akrosom dan pengujian integritas membran.
Lechniak et al. (2002) menyebutkan bahwa integritas fungsional dan struktur membran plasma spermatozoa sangat penting bagi kehidupan spermatozoa, karena berperanan penting dalam proses fusi ke dalam ovum saat fertilisasi. Spermatozoa juga harus mempunyai energi yang cukup untuk pergerakan, protein dan senyawa lain yang penting selama berada dalam saluran reproduksi betina serta memiliki membran plasma yang baik sehingga dapat melakukan fertilisasi dengan baik (Purdy et al. 2010). Pengujian keutuhan membran plasma dapat dilakukan dengan beberapa teknik di antaranya menggunakan mikroskop cahaya atau mikroskop fluorescent yang dikombinaskan dengan pewarnaan vital (Brito et al. 2003), flow cytometry (Hallap et al. 2004) dan hypo-osmotic swelling (HOS) tes (Jeyendran et al. 1984).
2
dilakukan pada hewan domestik yaitu pada kerbau (Padrik et al. 2012), kuda (Nie dan Wanzel 2001), dan domba (Nalley dan Arifiantini 2013).
Pengujian HOS didasarkan pada kemampuan spermatozoa membengkak setelah dimasukkan ke dalam larutan hipoosmotik. Spermatozoa dengan kerusakan fungsi membran tidak mengalami pembengkakan dan ekornya tidak mengalami invaginasi/melingkar (Jeyendran et al. 1984).
Babi memiliki karakteristik semen yang unik, berbeda dengan ternak lain seperti sapi, domba dan kambing. Semen babi mengandung gelatin yang merupakan sekresi dari kelenjar bulbouretralis dan akan keluar pada saat ejakulasi. Gelatin yang menyelimuti sel spermatozoa akan memengaruhi kecepatan larutan hipoosmotik memasuki sel, sehingga diperlukan waktu yang tepat untuk melakukan pengujian HOS. Selain itu cara penampungan semen di Indonesia masih belum bisa memisahkan fraksi gelatin secara sempurna, dengan demikian akan memengaruhi kecepatan masuknya larutan hipoosmotik ke dalam sel spermatozoa yang akan berpengaruh terhadap waktu pengujian.
Mengingat karakteristik semen babi yang berbeda dan adanya perbedaan kecepatan masuknya larutan hipoosmotik ke dalam sel spermatozoa maka penelitian ini dilakukan untuk menentukan waktu optimal dalam pengujian integritas membran plasma spermatozoa babi menggunakan larutan HOS.
Tujuan Penelitian
Penelitian ini bertujuan untuk memperoleh waktu yang optimal untuk melakukan pengujian integritas membran plasma menggunakan Hypo-osmotic Swelling (HOS) Test.
Manfaat Penelitian
3
TINJAUAN PUSTAKA
Ternak Babi
Babi (Sus Sp.) merupakan salah satu konsumsi utama masyarakat khususnya di Eropa dan Amerika dan di negara tersebut peternakan babi mencapai 20-30% dari total peternakan yang ada. Babi mempunyai karakteristik produktivitas yang sifat unik bila dibandingkan dengan ternak lain seperti sapi, domba dan kambing. Perbedaan yang penting adalah bahwa babi merupakan hewan polytocous (melahirkan anak lebih dari satu) menghasilakan ovum banyak dan memelihara anak dalam jumlah banyak (Blakely dan Bade 1991). Peternakan babi di Indonesia saat ini sudah mengalami perkembangan, peternakan babi dilakukan secara komersial (industri peternakan), dan sebagian besar masih merupakan peternakan rakyat.
Tipe babi yang umum dikenal ada tiga tipe yaitu, babi tipe lemak (Lard type), tipe daging (meat type atau pork type), dan tipe sedang (bacon type). Dunia peternakan semakin berkembang dan masyarakat sudah mulai mengenal bangsa babi antara lain, Landrace, Yorkshire (Large White), Berkshire, Chester White, Duroc, Hampshire, Saddleback, Poland China, Spotted Poland China, Tamworth dan Hereford. Jenis babi yang banyak dikembangkan di Indonesia adalah bangsa Landrace, Duroc, Yorkshire, Hampshire dan Berkshire. Babi jantan dewasa berbobot sekitar 320 - 410 kg, dan induk berbobot sekitar 250 - 340 kg (Sihombing 2006).
Inseminasi Buatan
Teknologi inseminasi buatan (IB) melalui penyediaan sumber spermatozoa yang berasal dari pejantan bermutu unggul merupakan salah satu usaha yang dilakukan untuk peningkatan genetik dan populasi ternak babi (Sumardani et al. 2008). Evaluasi semen perlu dilakukan untuk mengetahui kualitas semen yang dikoleksi dan untuk mengetahui kadar pengenceran serta jumlah pelayananan terhadap betina yang diinseminasi. Secara umum evaluasi yang dilakukan adalah evaluasi secara makroskopis untuk mengetahui volume, pH, warna dan konsistensi serta evaluasi mikroskopis untuk mengetahui konsentrasi spermatozoa, gerakan individu (motilitas), dan morfometri spermatozoa. Pengujian secara mikroskopis dapat dilakukan dengan pewarnaan eosin-nigrosin dan pewarnaan Williams. Pewarnaan spermatozoa berfungsi untuk membantu proses pengamatan morfologi dan morfometri spermatozoa. (Arifiantini 2012) Evaluasi semen secara makroskopis dan mikroskopis merupakan evaluasi standard yang diterapkan di Balai Inseminasi Buatan (BIB)
Pengujian integritas membran plasma spermatozoa
Pengujian keutuhan membran plasma menggunakan HOS test pertama kali dilakukan pada manusia oleh Jeyendran et al. (1984), memungkinkan dilakukannya spesialisasi reproduksi untuk menentukan membran plasma yang intak dan
fungsional. Membran plasma “membengkak” karena masuknya air dalam kondisi
4
Aplikasi pada spesies yang berbeda perlu ditentukan osmolaritas spesifik dari larutan yang digunakan sesuai dengan spesies yang di evaluasi. Pada babi larutan yang digunakan bervariasi antara 50 sampai 150 mOsm Kg-1 telah dilaporkan oleh (Vazquez et al. 1997). Selain itu penggunaan air suling dengan tekanan osmotik 0 mOsm Kg-1 telah dilakukan untuk uji pada kuda (Dell’Aqua et al. 2002)dan anjing
(Quintela et al. 2010). Menurut Revell dan Mrode (1994) terdapat korelasi positif antara hasil dari HOS test atau modifikasinya dengan persentase keberhasilan IB pada betina, sehingga memungkinkan HOS test menjadi metode paling sederhana dan diterima dalam evaluasi semen di industri IB
Pengujian HOS berdasarkan pada kemampuan spermatozoa membengkak setelah dimasukan ke dalam larutan hipoosmotik (Carbita et al. 1999). Pada larutan hipoosmotik, cairan masuk ke dalam sel melewati membran plasma spermatozoa. Spermatozoa dengan membran plasma yang fungsional membengkak mulai dari ekor. Reaksi ini merupakan bentuk respon sel dalam mencapai keseimbangan antara lingkungan intra dan ekstraseluler. Fenomena membengkaknya spermatozoa yang dapat dilihat dari ekornya yang melingkar disebut HOS reaktif (HOS positif). Spermatozoa dengan kerusakan fungsi membran tidak mengalami pembengkakan dan ekornya tidak mengalami invaginasi/melingkar (Jeyendran et al. 1984). Osmolaritas larutan yang digunakan harus cukup untuk memberikan efek optimal tanpa menyebabkan lisis membran spermatozoa (Rota et al. 1999). Fertilisasi tidak akan terjadi jika membran spermatozoa secara biokimia tidak aktif walaupun secara struktural tetap utuh, sehingga pengujian HOS merupakan indikator yang lebih baik dibandingkan dengan pewarnaan supravital (Tamuli dan Watson 1992).
Koleksi Semen
Koleksi semen babi dapat dilakukan dengan beberapa metode di antaranya adalah metode vagina buatan, dan glove hand methode yaitu pemijatan pada bagian korpus penis. Penampungan semen dapat menggunakan seekor betina berahi ataupun dummy (betina tiruan). Vagina buatan yang digunakan dalam penampungan semen dimodifikasi sedemikian rupa dan suhunya disesuaikan dengan vagina babi betina yang sebenarnya. Vagina buatan yang akan digunakan diisi dengan 300 mL air dengan suhu 50 oC, kemudian dilicinkan dengan jelly. Kolektor semen jongkok atau duduk di atas bangku pendek di sebelah kanan pemancing dengan vagina buatan pada tangan kiri dan tangan kanan memegang corong karet. Tangan kanan memegang ujung distal penis dan diarahkan ke vagina buatan memasuki corong karet. Pejantan akan menggerakkan penisnya ke depan dan ke belakang beberapa kalin ejakulasi akan terjadi selama 5 sampai 20 menit (Toelihere 1993).
5 mudah dipegang. Semen babi mengandung gelatin, sehingga di bagian permukaan tabung dilapisi dengan kain kasa untuk menyaring gelatin agar tidak tercampur dengan semen.
Semen Babi
Semen merupakan sekresi dari organ kelamin jantan yang terdiri dari spermatozoa dan plasma semen (Garner dan Hafez 2000). Spermatozoa pada semen dihasilkan oleh testes di bawah pengaruh hormon gonadotropin dan hormon gonad, sedangkan plasma semen merupakan campuran sekresi dari epididimis dan kelenjar-kelenjar kelamin seperti kelenjar vesikularis dan kelenjar prostat. Seekor babi jantan menghasilkan 125 sampai 500 mL semen per ejakulat, pH semen babi berkisar antara 7.3 sampai 7.9 dan konsentrasi spermatozoa babi dapat mencapai 100 juta sampai 150 juta sel spermatozoa per mL. Jumlah spermatozoa yang progresif harus sekitar 65 sampai 75% untuk fertilitas yang tinggi.
Plasma semen sangat berperan dalam keberhasilan reproduksi karena digunakan sebagi media transport dan energi bagi spermatozoa. Plasma semen memiliki larutan buffer nitrat, bikarbonat, kation, pH antara 7.3-7.8 dan memiliki tekanan osmotik hampir sama dengan darah. Plasma semen secara biokimiawi mengandung persenyawaan organik spesifik seperti fruktosa, asam sitrat, sorbitol, inositol, glycerylphosphoryl-choline (GPC), ergotionin dan prostaglandin. Plasma semen juga mengandung protein sekitar 3.7% yang terdiri dari asam–asam amino, peptida dan mucoprotein, serta terdapat berbagai enzim, vitamin, lipid dan asam lemak (Toelihere 1993). Keunikan dari semen babi dibandingkan dengan semen hewan mamalia yang lain yaitu semen babi dapat disimpan dengan tetap mempertahankan kualitasnya pada kisaran suhu 15-20 oC serta daya simpan semen babi yang relatif singkat yaitu kisaran 3-7 hari tergantung pada bahan pengencer yang digunakan (Johnson et al. 2000; Gadea 2003)
Spermatozoa
Spermatozoa merupakan gamet jantan yang diproduksi oleh tubuli seminiferi testis. Spermatozoa sebagai hasil akhir proses spermatogenesis merupakan sel yang berbentuk memanjang dengan bagian kepala pipih dan ekor yang panjang. Spermatozoa normal pada babi terdiri atas kepala dan ekor dimana kepala berbentuk oval memanjang, lebar dan datar. Pada bagian kepala memegang peranan sangat penting dalam keberhasilan fertilisasi, karena terdapat enzim hyaloronidase yang dapat menembus dinding sel telur dan membawa kromosom (heredity) yang mengandung deoxy ribonucleid acid (DNA) serta dilindungi oleh tudung akrosom (Garner dan Hafez 2000).
6
pangkal ekor spermatozoa memanfaatkan karbohidrat dan fruktosa sebagai sumber pembentukan energi (Garner dan Hafez 2000).
7
METODE
Waktu dan Tempat
Penelitian ini dilakukan di Balai Inseminasi Buatan Daerah (BIBD) Unit Pelaksana Teknis Daerah (UPTD) Peternakan Provinsi Bali di Baturiti dan peternakan babi PT. Adi Farm, berlokasi di Kabupaten Karanganyar, Solo. Penelitian dilaksanakan selama dua bulan yang dimulai pada bulan Februari sampai dengan bulan April 2014.
Bahan
Sebagai sumber semen digunakan 10 ekor babi jantan dengan breed yang berbeda yaitu Landrace (6 ekor), Duroc (3 ekor), dan Yorkshire (1 ekor). 7 ekor babi di BIB Baturiti dan 3 ekor di PT Adi Farm, Solo. Bahan yang digunakan dalam pengujian semen adalah NaCl fisiologis; pewarna eosin nigrosin; larutan HOS 150 mOsm Kg-1; dan larutan formol saline.
Alat
Alat yang digunakan adalah gunting, meteran atau jangka sorong, dummy sow, penampung semen, penangas air (water bath), mikroskop, heating table, termometer, gelas objek, cover glass, counter, haemositometer neubauer, fotometer SDM 5, micro pipet, pipet tetes, micro tube, pH indikator paper dan alat untuk sterilisasi.
Prosedur Penampungan Semen
Sebelum penampungan semen dilakukan, terlebih dahulu dipersiapkan aquabides, penampung semen dan kertas saring/kasa. Penampungan semen dilakukan dengan metode pemijatan (massage)/gloves hand method pada korpus penis dengan bantuan dummy sow. Babi jantan dibawa ke kandang penampungan semen, dibiarkan melakukan courtship (percumbuan) dan menaiki dummy sow tersebut, sampai terjadi protrusi dan ereksi. Penis dipegang dan ditarik ke arah samping oleh kolektor semen, difiksir dengan tekanan tertentu serta diarahkan pada tabung penampung semen yang telah dilengkapi dengan kasa untuk memisahkan gelatin dan semen.
Evaluasi Semen
8
dengan menilai persentase motilitas spermatozoa dengan cara meneteskan 1 tetes semen pada gelas objek kemudian ditambahkan satu tetes larutan NaCl fisiologis, dihomogenkan dan diambil satu tetes untuk dipindahkan ke gelas objek yang lain. Pengamatan motilitas pada mikroskop cahaya (Olympus CX21) dengan pembesaran 10 x 40 (400x). Pengamatan dilakukan pada lima lapang pandang dengan penilaian 0-100% dengan interval 5% (Arifiantini 2012).
Pengujian viabilitas dilakukan menggunakan pewarna eosin nigrosin. Satu tetes semen diteteskan pada gelas objek, ditambahkan satu tetes eosin nigrosin kemudian dihomogenkan dan dibuat preparat ulas. Pengujian dilakukan dengan mikroskop cahaya (Olympus CX21) pada pembesaran 10 x 40 (400x). Penilaian dilakukan dengan melihat warna kepala spermatozoa. Kepala spermatozoa yang menyerap warna menunjukkan spermatozoa yang mati dan spermatozoa hidup tidak menyerap warna. Spermatozoa hidup dan mati dihitung hingga 200 sel atau 10 lapang pandang kemudian dihitung dengan cara: spermatozoa hidup dibagi dengan jumlah spermatozoa terhitung (hidup dan mati) dikali 100% (Arifiantini 2012).
Perhitungan konsentrasi menggunakan photometer SDM 5. Mesin dinyalakan dengan menekan tombol ON, kemudian dibiarkan 10 menit untuk penghangatan (warm up). Pilih Method 3 untuk penilaian konsentrasi pada semen babi. Alat dikalibrasi dengan memasukan larutan kalibrasi (Cuvet diisi 4 mL NaCl fisiologis, masukan pada bagian cuvet dalam mesin). Perhitungan konsentrasi spermatozoa dilakukan dengan cara memasukan volume semen sebesar 100 µL ke dalam cuvet yang berisi 4 mL larutan NaCl fisiologis, selanjutnya alat dijalankan untuk melakukan perhitungan secara otomatis (Arifiantini 2012).
Pembuatan Larutan Hipoosmotik
Larutan hipoosmotik dibuat dengan cara mencampurkan 1.351 g fruktosa dan 0.735 g Na-sitrat ke dalam gelas piala. Aquabidest ditambahkan ke dalam gelas piala sampai mencapai 100 mL, dengan demikian akan terbentuk larutan dengan osmolaritas 150 mOsm Kg-1 (Revell dan Mrode 1994). Tekanan osmotik larutan dikonfirmasi dengan menggunakan osmometer.
Pengujiann Integritas Membran Plasma
Pengujian integritas membran plasma dilakukan sebagai berikut. Sebanyak 50 µL semen dimasukkan ke dalam mikrotub berisi 1 ml larutan hipoosmotik. Campuran larutan kemudian diinkubasi pada suhu 37 oC dan di evaluasi menggunakan mikroskop cahaya (Olympus CX21) dengan pembesaran 10x40 (400x). Spermatozoa yang bereaksi terhadap larutan hipoosmotik ditandai dengan ekor melingkar dan spermatozoa yang tidak bereaksi ditandai dengan ekor lurus dihitung sebanyak 200 sel. Pemeriksaan dilakukan setiap 15 menit dan dihentikan pada saat inkubasi mencapai 90 menit. Data yang diperoleh merupakan persentase spermatozoa yang bereaksi positif terhadap larutan HOS.
Prosedur Analisis data
9
HASIL DAN PEMBAHASAN
Kualitas Semen Segar
Evaluasi atau analisis semen dilakukan untuk melihat kuantitas (volume dan kosentrasi) dan kualitas semen (Arifiantini 2012). Hasil evaluasi semen segar merupakan tahap awal untuk menentukan kelayakan semen yang akan diperoses lebih lanjut. Secara makroskopis volume semen yang diperoleh dari penelitian ini adalah 326.67 ± 141.33 mL (Tabel 1), volume ini termasuk normal sesuai dengan Ax et al (2000) bahwa volume semen babi jantan tanpa gelatin adalah 200 sampai 250 mL dengan rata-rata 200 mL. Menurut Johnson et al. (2000), faktor-faktor yang memengaruhi volume semen saat ditampung adalah variasi umur, tingkat rangsangan, frekuensi ejakulasi, dan kualitas pakan.
Nilai fisiologis derajat keasaman (pH) semen segar yang diperoleh selama penelitian berkisar antara 7.2 dan 7.5 dengan rata-rata 7.32 ± 0.12 (Tabel 1). Hasil ini sejalan dengan hasil penelitian Gadea (2003), yakni pH semen babi rata-rata 7.4 ± 0.2, berkisar antara 7.3 - 7.8 (Garner dan Hafez 2000). Semen babi berwarna putih keruh dengan konsistensi yang encer.
Secara mikroskopis dievaluasi gerakan spermatozoa, viabilitas (spermatozoa hidup dan konsentrasi spermatozoa. Gerakan spermatozoa yang optimal harus dinilai pada suhu 37 oC. Mikroskop yang digunakan untuk mengevaluasi semen sebaiknya menggunakan heating table. Semen babi tidak memiliki gerakan massa, hal ini disebebkan oleh konsentrasi spermatozoa yang rendah sehingga tidak terbentuk gelombang masa spermatozoa. Gerakan yang dinilai adalah persentase spermatozoa yang bergerak maju ke depan atau disebut motilitas spermatozoa. Motilitas ini sangat penting dievaluasi karena menentukan kemampuan gerak spermatozoa mencapai sel telur pada saat fertilisasi di dalam saluran kelamin betina. Motilitas spermatozoa pada penelitian ini berada pada rentangan antara 60- 75% dengan rata-rata sebesar 68.89 ± 6.01 (Tabel 1). Hasil ini masih lebih rendah daripada hasil penelitian dari Zou dan Yang (2000) yang menyatakan motilitas spermatozoa babi dapat mencapai 92%. Banyak faktor yang memengaruhi motilitas spermatozoa pada penelitian ini, terutama kondisi fisiologis ternak, lingkungan dan pakan yang diberikan. Secara umum kualitas spermatozoa yang digunakan pada penelitian ini memiliki kualitas yang baik, dan dapat diproses lebih lanjut.
Spermatozoa yang hidup dalam penelitian ini adalah 79.49 ± 5.52 %, nilai ini termasuk baik karena masih dalam kisaran normal menurut Sumardani et al. (2008). Konsentrasi spermatozoa sangat penting dalam penentuan kualitas spermatozoa. Konsentrasi, volume dan persentase motilitas spermatozoa dapat menggambarkan tingkat pengenceran dan banyaknya betina yang dapat diinseminasi. Konsentrasi spermatozoa yang diperoleh dalam penelitian ini rata-rata 175.50 ± 82.14 x 106 sel/ml (Tabel 1). Konsentrasi spermatozoa yang diperoleh
dalam penelitian ini sesuai dengan yang diperoleh Shipley (1997) yaitu berkisar antara 150 – 450 x 106 sel/ml. Konsentrasi spermatozoa dapat bervariasi pada setiap penampungan. Tingkat konsentrasi spermatozoa dalam ejakulat dipengaruhi oleh kondisi fisiologis individu.
10
tersebut disebabkan semen babi terdiri atas tiga fraksi yaitu pra-spermatozoa, kaya-spermatozoa dan pasca-kaya-spermatozoa. Fraksi pra-kaya-spermatozoa tidak mengandung spermatozoa, hanya berupa cairan jernih dan gelatin dari kelenjar bulbouretralis (Kelenjar Cowper) yang mencapai 20% dari total volume semen. Fraksi kaya spermatozoa mengandung 20 - 30% spermatozoa dengan konsentrasi 600 – 1000 x 106sel/mL (Ax et al. 2000), dan sisanya merupakan fraksi pasca-spermatozoa yang mengandung cairan dari kelenjar aksesoris lainnya, yaitu kelenjar prostat dan kelenjar vesicularis. Pada peternakan dengan manajemen yang baik, sangat kecil kemungkinan terjadinya defisiensi kualitas pakan dan kuantitas protein yang diberikan kepada pejantan. Pemberian ransum dengan protein yang rendah dapat mengakibatkan pengurangan konsumsi makanan, penurunan berat badan, kelemahan, dan penurunan libido dan produksi spermatozoa.
Tabel 1 Nilai karakteristik semen segar babi
Karakteristik semen Nilai rataan
Volume (mL) 326.67 ± 141.33
Warna Putih keruh
Konsistensi Encer
pH 7.32 ± 0.12
Motilitas spermatozoa (%) 68.89 ± 6.01
Spermatozoa hidup (%) 79.49 ± 5.52
Konsentrasi spermatozoa (106 sel/mL) 175.50 ± 82.14 Integritas membran plasma spermatozoa babi
Membran plasma merupakan lapisan semipermeabel yang menyelimuti sel spermatozoa. Menurut Curry dan Watson (1995), integritas membran plasma serta fungsinya penting untuk menjaga viabilitas sel. Bagian ini menjadi struktur penting dari sel sebagai gerbang yang menghubungkan lingkungan ekstra seluler dan intra seluler, dengan demikian keutuhan struktur dan fungsi membran plasma sangat penting untuk dievaluasi dalam pengujian kualitas spermatozoa. Membran plasma memiliki kemampuan permeabilitas yang selektif untuk mengatur aktivitas metabolik intrasel, pH, dan komposisi ion.
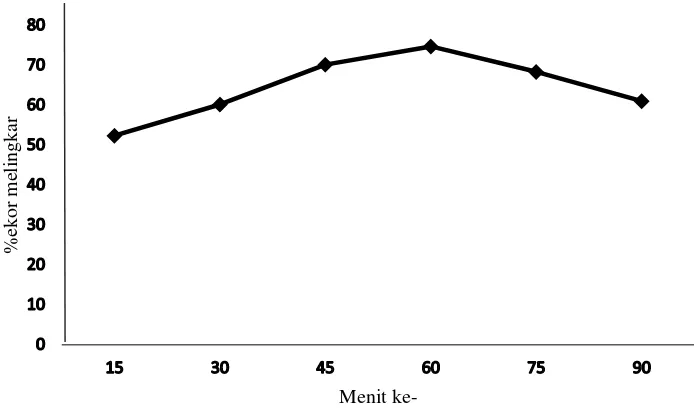
Pada penelitian ini semen babi pada menit ke 15 sudah menunjukkan HOS positif antara 36.27 sampai 63.50% dengan rata-rata 52.32 ± 9.05. Pada 30 menit inkubasi, sel yang positif terhadap larutan HOS semakin meningkat antara 47.44 sampai dengan 77.00% dengan rata-rata 60.13 ± 9.56. Peningkatan reaksi spermatozoa yang positif terhadap larutan HOS terus terjadi dan puncaknya terlihat pada menit ke-60 (Tabel 2).
11 larutan hipoosmotik yang terlalu lama sehingga membran plasma mengalami kerusakan dan tidak reaktif lagi terhadap larutan hipoosmotik.
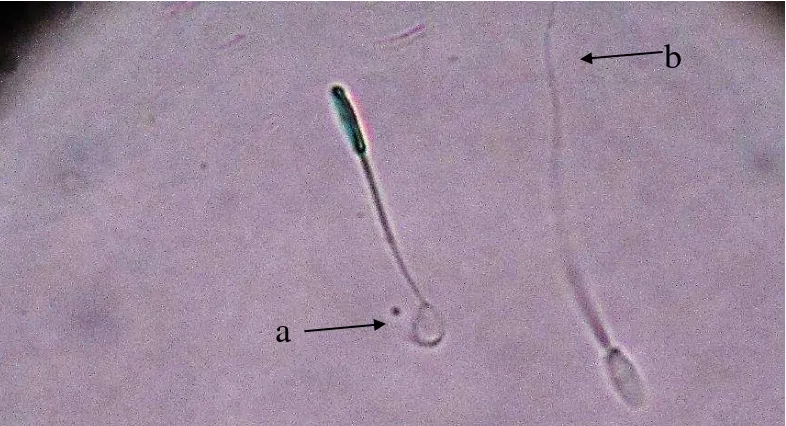
Sel spermatozoa akan bereaksi ketika dimasukkan ke dalam larutan hipoosmotik, hal ini terjadi karena larutan hipoosmotik akan masuk ke dalam sel melewati membran plasma. Akibat perbedaan tekanan osmotik dari larutan tersebut dengan tekanan osmotik luar sel lebih tinggi, maka larutan tersebut akan masuk ke dalam sel dan menyebabkan kebengkakan, fenomena inilah yang dapat diamati dan diukur untuk menguji integritas membran plasma (Vaszquez et al. 1997). Fenomena ini lebih mudah diamati pada ekor spermatozoa (Gambar 1), daripada kepala karena membran plasma yang mengelilingi ekor tampak lebih longgar (Jeyendran et al. 1984; Vazquez et al. 1997).
Spermatozoa dengan kerusakan fungsi membran tidak mengalami pembengkakan dan ekornya tidak mengalami invaginasi/melingkar (Jeyendran et al. 1984). Waktu yang paling tepat untuk melakukan pengujian integritas membran plasma spermatozoa pada babi berdasarkan hasil penelitian ini adalah pada menit ke-60 inkubasi (Gambar 2).
Gambar 1 Hasil pengujian integritas membran plasma dengan HOS test. a (spermatozoa HOS positif ) dan b (Spermatozoa HOS negatif)
Stabilitas volume sel merupakan proses lanjut dari mekanisme regulasi volume, akumulasi atau pelepasan osmolit dan metabolit organik serta transportasi ion melalui membran plasma. Fungsi sel harus dipertahakan dalam menghadapi perubahan tekanan osmotic. Spermatozoa beberapa mamalia (babi, tikus, banteng dan manusia) telah ditemukan memiliki kemampuan regulasi volume, dibagi menjadi dua yaitu regulatory volume decrease (RVD) merupakan respon terhadap tekanan hipoosmotik dan regulatory volume increase (RVI) yaitu sel mampu mengembalikan volumenya setelah mengalami pengerutan karena lingkungan hipertonis (Petrukina et al. 2007).
Pengujian HOS didasarkan pada kemampuan spermatozoa membengkak setelah dimasukkan ke dalam larutan hipoosmotik. Ketepatan waktu pengujian HOS sangat penting dilakukan, bila waktu pengujian terlalu cepat, maka
a
12
spermatozoa belum bereaksi secara optimal. Sebaliknya jika dilakukan terlalu lama sejak inkubasi kemungkinan waktu optimal bereaksi sudah hilang. Menurut Lang et al. (1998) mekanisme regulasi volume sel merupakan faktor penting untuk menjaga kelangsungan hidup sel. Sel harus dapat menghindari perubahan volume berlebihan yang dapat membahayakan integritas struktural dan kestabilan lingkungan intraselular.
Tabel 2 Persentase jumlah spermatozoa yang bereaksi positif Hypo-osmotic swelling (HOS) test selama masa inkubasi
Huruf superscrip berbeda yang mengikuti angka pada baris yang sama menunjukkan beda sangat
nyata (p<0.01)
Gambar 2 Grafik reaksi spermatozoa positif terhadap larutan HOS Pada pengujian integritas membran plasma dengan HOS test maka dapat dilihat fungsi membran dalam melakukan regulasi volume melalui mekanisme RVD. Mekanisme regulasi volume terjadi jika terdapat perbedaan tekanan osmotik
13 ekstra selular dan intraselular. Keadaan hipotonis di luar sel menyababkan air masuk ke dalam sel untuk mencapai kembali keseimbangan osmotik. Pengujian HOS pada waktu yang tepat perlu dilakukan mengingat adanya kemampuan spermatozoa mengaktifkan RVD untuk menyeimbangkan tekanan osmotik luar dan dalam sel (Gambar 3). Pada penelitian ini mekanisme RVD terjadi setelah menit ke-60 yaitu pada menit ke-75, ditandai dengan menurunnya reaksi HOS positif hingga pada menit ke-90 reaksi HOS positif terus menurun dan mendekati nilai HOS positif pada menit ke 15.
Gambar 3 Perubahan volume spermatozoa sebagai respon terhadap kondisi hipoosmotik.
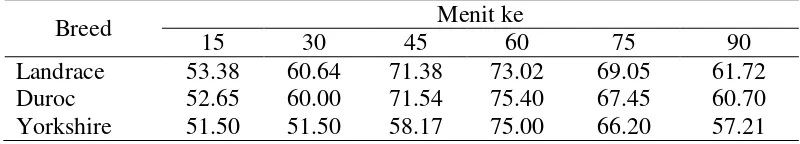
Pada penelitian ini reaksi HOS positif antar breed pada setiap waktu pengamatan disajikan pada Tabel 3. Data tersebut diuji dengan uji t-test dan menunjukan hasil yang tidak berbeda (p > 0.05) hal ini sesuai dengan pernyataan Amorim et al. (2009) bahwa reaksi spermatozoa pada larutan HOS dipengaruhi oleh spesies hewan, jenis larutan, osmolalitas, dan waktu inkubasi, tidak dipengaruhi oleh bangsa/breed. Fungsi membran plasma spermatozoa sangat fundamental dalam mengatur volume sel, karena akan menentukan kelangsungan hidup spermatozoa.
Tabel 3 Persentase jumlah spermatozoa yang bereaksi positif Hypo-osmotic swelling (HOS) test antar breed selama masa inkubasi
Breed Menit ke
15 30 45 60 75 90
Landrace 53.38 60.64 71.38 73.02 69.05 61.72
Duroc 52.65 60.00 71.54 75.40 67.45 60.70
Yorkshire 51.50 51.50 58.17 75.00 66.20 57.21 Optimalnya pengujian pada menit ke-60 dalam penelitian ini juga dilaporkan oleh Padrik et al. (2012) pada sapi Estonian Holstein dengan menggunakan tekanan hipoosmotik yang sama (150 mOsm kg-1). Fonseca et al. (2005) melaporkan pengujian integritas membran pada semen kambing dengan larutan HOS 125 mOsm kg-1 pada 37 oC dalam waktu 60 menit. Pada spermatozoa kuda Nie dan Wanzel (2001) menyatakan, inkubasi selama 60 menit dengan larutan hypoosmotic 100 mOsm kg-1 menunjukkan persentase HOS reaktif yang lebih tinggi
dibandingkan dengan larutan hipoosmotik lainnya.
14
optimal pada menit ke-60 inkubasi. Pengujian yang dilakukan lebih cepat atau lambat akan mendapatkan hasil yang kurang akurat.
15
SIMPULAN DAN SARAN
Simpulan
Waktu optimal untuk melakukan pemeriksaan integritas membran plasma adalah pada menit ke-60 dengan larutan hipoosmotik 150 mOsm Kg-1. Tidak ada perbedaan yang nyata antara breed dan waktu pemeriksaan integritas membran plasma spermatozoa babi dengan hypo-osmotic swelling (HOS) test
Saran
Penelitian lanjutan perlu dilakukan dengan menggunakan sample dari breed yang lain yang banyak diternakan di Indonesia dengan jumlah sample yang lebih banyak untuk mendapatkan data yang lebih akurat. Selain itu perlu juga dilakukan penelitian ini pada semen babi yang telah ditambahkan pengencer
DAFTAR PUSTAKA
Amorim EA, Torres CA, Graham JK, Amorim LS, Santos LV. 2009. The hypo-osmotic swelling test in fresh rabbit spermatozoa. Anim Reprod Sci. 111: 338‒ 343.
Arifiantini I. 2012. Teknik Koleksi dan Evaluasi Semen pada Hewan. Bogor (ID): IPB Pr
Ax RL, Dally M, Didion BA, Lenz RW, Love CC, Varner DD, Hafez B, Bellin ME. 2000. Semen Evaluation. In: Hafez ESE, Hafez B, editor. Reprod in farm Anim.7th Ed. Philadelphia (US): Williams & Wilkins
Blakely, J dan Bade DH. 1991. Ilmu Peternakan. Edisi keempat. Yogyakarta (ID) Gajah Mada University Pr.
Brito LFC, Barth AD, Bilodeau-Roessels S, Panich PL, Kastelic JP. 2003. Comparison methods to evaluate the plasmalemma of bovine sperm and their relationship with in vitro fertilization rate. Theriogenology. 60: 1539-1551 Carbita ER, Alvarez E, Anel MP, Herraez. 1999. The hypo-osmotic sweelling test
performed with coulter counter: a method to assay functional integrity of sperm membrane in rainbow trout. Anim ReprodSci. 55: 279-287.
Curry MR, Watson PF. 1995. Sperm structure and function. Di dalam: Grudzinskas JG, Yovich JL. Editor. Gametes-The Spermatozoon. Cambridge (UK): Cambridge University Pr.
Dell’aqua Jr JA, Papa FO, Zahn FS. 2002. Novo teste osmótico de avaliação da integridade da membrana plasmática de sêmen congelado eqüino. Rev Bras Rep Anim. (26): 189-191.
Fonseca JF, Torres CAA, Maffili VV, Borges AM, Santos ADF, Rodriques MT. Oliveira RFM. 2005. The hypoosmotic swelling test in fresh goat spermatozoa. Anim Reprod sci. 2: 139-144.
16
Garner DL, Hafez ESE. 2000. Spermatozoa and Seminal Plasma. In: Hafez B, Hafez ESE. 2000. Reprod in Farm Anim. 7th ed. Philadelphia (US): Lippincott Williams & Wilkins. 96-109.
Hallap T, Nagy S, Haard M, Jaakma U, Larsson B, Rodriquez-Martinez H. 2004. Variations in quality of frozen-thawed semen from Swedish Red and White siresat 1 and 4 years of age. J of Andrology. 27:166‒171.
Jeyendran RSHH, Van Der Ven M, Perez-Pelaez BG, Crabo LJD, Zaneveld LJ. 1984. Development of an assay to assess the functional integrity of the human sperm membrane and its relationship to other semen characteristics. J Reprod Fertil. 70: 219-228
Johnson LA, Weitze KF, Fiser P, Maxwell WMC. 2000. Storage of boar semen. J Anim Sci. 62: 143-172.
Lang F, Gillian L, Busch L, Markus R, Harald Vo Lkl, Siegfried W, Erich G. 1998. Functional significance of cell volume regulatory mechanisms. Phys Rev. 78 (1): 248-273
Lechniak DA, Kedzierski D, Stanislawski D. 2002. The use of HOS test to evaluate membrane functionality of boar sperm capacitated in vitro. Reprod Dom Anim. 37(6): 379-380.
Maes D, Nauwynck H, Rijsselaere T, Mateusen B, Vyt Ph, de Kruif A, Van SA. 2008. AI transmitted diseases in swine: an overview. Theriogenology 70: 1337-1345
Maes D, López A, Rijsselaere T, Vyt P, Van A. 2011. Artificial insemination in pigs. In Artificial insemination in farm animals ed. M. Manafi. In Tech Rijeka Croatia. 79-94
Nalley WMM, Arifiantini RI. 2013. The Hypo-osmotic swelling test in fresh garut ram spermatozoa. J.Indonesian Trop Anim Agric. 38(4): 212-216
Nie GJ, Wanzel JGW. 2001. Adaptation of the semen hypo-osmotic swelling test to assess functional integrity of stallion spermatozoal plasma membranes. Theriogenology 59: 735-742.
Padrik P, Hallap T, Kaart T, Bulitko T, Jaakma U. 2012. Relationships between the results of hypo-osmotic swelling tests, sperm motility, and fertility in Estonian Holstein dairy bulls. Czech J Anim Sci. 57 (10): 490-497
Petrunkina AM, Waberski D, Gunzel-Apel AR, Topfer-Peterson E. 2007. Determinants of sperm quality and fertility in domestic species. Society for Reprod and Fertil. 1470-1626.
Purdy PH, Moce E, Stobart R, Murdoch WJ, Moss GE, Larson B, Ramsey S, Graham JK, Blackburn HD. 2010. The fertility of ram sperm held for 24h at 5°C prior to cryopreservation. Anim Reprod Sci. 118: 231-235.
Perez-Llano BJLP Lorenzo YA. Trejo P. Garcia-Casado P. 2001. Hypoosmotic swelling test for the prediction of boar sperm fertility. Theriogenology 56: 387-398.
Quintela AT, Oliveira IRS, Souza AO. 2010. Water-induced hypo-osmotic test for the evaluation of canine sperm membrane integrity. Anim Reprod. (7):70-74. Revell SG, Mrode RA. 1994. An osmotic resistance test for bovine semen.
Anim.Reprod. Sci.. 36: 77-86.
17 Shipley CF. 1997. Breeding Soundness examination of the boar. Swine Healt Prod.
7(3): 117-120
Sihombing DTH. 2006. Ilmu Ternak Babi. Cetakan kedua. Yogyakarta (ID). Gadjah Mada University Pr.
Sumardani NLG, Tuty LY, Siagian PH. 2008. Viabilitas spermatozoa babi dalam pengencer BTS (Beltsville Thawing Solution) yang dimodifikasi pada penyimpanan berbeda. Med Pet. 31(2):81-86
Tamuli MK, Watson PF (1992): Effect of temperature of incubation on the development of resistance to cold stress and hypo-osmotic stress in boar spermatozoa incubated for up to 24 hours. Proc. 12th Int. Cong. Anim Reprod
Sci. 1484-1486.
Toelihere MR. 1993. Inseminasi Buatan pada Ternak. Bandung (ID): Angkasa Vazquez JM, Martinez EA, Martinez P. 1997. Hypoosmotic swelling of boar
spermatozoa compared to other methods for analyzing the sperm membrane. Theriogenology 47: 913-922
Yeste M, Briz M, Pinart ES. Sancho E. Bussalleu S. 2010. The osmotic tolerance of boar spermatozoa and its usefulness as sperm quality parameter. Anim Reprod Sci. 119: 265-274
18
LAMPIRAN
Lampiran 1 Hasil analisis data menggunakan uji Anova dengan uji lanjut Duncan pada selang kepercayaan 99% (P > 0.01)
ONEWAY HOSpositif babi BY waktu /MISSING ANALYSIS
/POSTHOC=DUNCAN ALPHA(0.01).
Oneway
[DataSet2]
ANOVA
Sum of Squares df Mean Square F Sig.
HOSpositif Between Groups 3170.350 5 634.070 8.123 .000
Within Groups 4215.300 54 78.061
Total 7385.650 59
babi Between Groups .000 5 .000 .000 1.000
Within Groups 495.000 54 9.167
Total 495.000 59
Post Hoc Tests
Homogeneous Subsets
HOSpositif
Duncan
waktu N
Subset for alpha = 0.01
1 2 3
15 10 52.0000
30 10 59.2000 59.2000
90 10 60.8000 60.8000
75 10 67.8000 67.8000
45 10 69.6000 69.6000
60 10 73.7000
Sig. .039 .018 .165
19
Mean 64,86489 64,62343352
20
RIWAYAT HIDUP
Penulis dilahirkan di Jatiluwih pada tanggal 24 Agustus 1992, merupakan anak ke-2 dari pasangan I Ketut Suarma dan Ni Wayan Murtini.
Pendidikan kanak-kanak hingga Sekolah Lanjutan Tingkat Atas diselesaikan di Bali, Pada tahun 1997 penulis mengambil pendidikan di Taman Kanak-Kanak Kumara Giri Jatiluwih dan lulus pada tahun 1998, kemudian melanjutkan di SD No. 1 Jatiluwih dan lulus pada tahun 2004. Sekolah Lanjutan Tingkat Pertama dilanjutkan di SMP Negeri 3 Penebel dan lulus tahun 2007, Sekolah Lanjutan Tingkat Atas di SMA Negeri 1 Tabanan dan lulus tahun 2010.
Penulis diterima di Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI) sebagai mahasiswa Fakultas Kedokteran Hewan. Selama menjadi mahasiswa penulis aktif di beberapa organisasi kampus. Penulis pernah menjadi staf departemen sosial dan lingkungan BEM FKH IPB periode 2011-2012, ketua divisi humas Kesatuan Mahasiswa Hindu Dharma IPB periode 2011-2012, pada periode 2013-2014 penulis juga pernah menjabat sebagai ketua Himpunan Profesi Satwaliar, selain itu penulis aktif di beberapa kepanitiaan seperti ketua panitia Donor Darah FKH IPB 2012 dan ketua makrab ACROMION 47, di organisasi luar kampus penulis pernah menjabat sebagai pengurus BRAHMACARYA Bogor.
Penulis pernah menjadi asisten mata kuliah Ilmu Teknologi Reproduksi pada tahun 2013 dan 2014 dan asisten mata kuliah Embriologi pada tahun 2014