PENENTUAN WAKTU OPTIMAL
PENGUJIAN KEUTUHAN MEMBRAN PLASMA SPERMATOZOA SEMEN BEKU SAPI LIMOUSIN DAN FRISIEN HOLSTEIN MENGGUNAKAN HYPO-OSMOTIC
SWELLING (HOS) TEST
RIZAL DWI HARDYANA
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
BOGOR
2012
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi dengan judul Penentuan Waktu Optimal Pengujian Keutuhan Membran Plasma Spermatozoa Semen Beku Sapi Limousin dan Frisien Holstein Menggunakan Hypo-Osmotic Swelling (HOS) Test adalah karya saya dengan arahan dari pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal dan dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Agustus 2012
Rizal Dwi Hardyana
B04080064
ABSTRACT
RIZAL DWI HARDYANA. Optimal Time Determination to Test Spermatozoa Membrane Integrity of Limousin and Frisien Holstein Frozen Semen Using Hypo- Osmotic Swelling (HOS) Test. Directed by Prof. Dr. Dra. R. Iis Arifiantini, MSi.
The study was conducted to determine the optimal time to test the integrity of plasma membrane of Limousin and Frisien Holstein (FH) bull frozen semen spermpatozoa using hypoosmotic swelling (HOS) test. A total of 15 samples from each bull used. All samples were incubated in a hypoosmotic solution with osmolarity of 150 mOsm Kg
-1for 60 minutes. The hypoosmotic solution made by admix 1.351 g fructose, 0.735 Na-citrate and water until the volume was 100 ml.
Every 15 minutes the whole sample was evaluated the percentage of spermatozoa that reacts to the solution. Optimal time was obtained at 30’ and 45’, both on Limousin and FH frozen semen. The mean percentage of reacted Limousin bull spermatozoa at 30’ and 45’ respectively were 53.90 ± 6.81 % and 52.47 ± 8.00 %.
Whereas the FH bull spermatozoa was 44.52 ± 6.26 % and 44.46 ± 8.42 %.
Spermatozoa from frozoen semen needs time to react to hypoosmotic solution due to the added of freezing diluent. This causes the spermaozoa did not react immediately to the hypoosmotic solution. Plasma membrane integrity is very important for sperm fertility. Fertility enzymes contained in the head of spermatozoa, thus if the plasma membrane of the head broken, spermatozoa will lose their fertility. Similarly in the tail, if the plasma membrane broken, spermatozoa will lose their motility.
Key words : HOS test, plasma membrane integrity, Limousin frozen semen, FH
frozen semen
RINGKASAN
RIZAL DWI HARDYANA. Penentuan Waktu Optimal Pengujian Keutuhan Membran Plasma Spermatozoa Semen Beku Sapi Limousin dan Frisien Holstein Menggunakan Hypo-Osmotic Swelling (HOS) Test. Dibimbing oleh Iis Arifiantini.
Tujuan penelitian ini adalah untuk mengetahui waktu yang paling optimal untuk pengujian keutuhan membran plasma spermatozoa semen beku sapi Limousin dan Frisien Holstein (FH) dengan menggunakan metode hypo-osmotic swelling (HOS) test. Teknologi Inseminasi Buatan (IB) mulai diperkenalkan di Indonesia pada tahun 1952 tetapi aplikasinya secara masal di lapangan baru dimulai sejak tahun 1973 dengan menggunakan semen beku yang diimpor dari New Zealand (Selandia Baru). Untuk tujuan IB, spermatozoa dapat disimpan dahulu dalam bentuk semen cair maupun semen beku. Untuk menghasilkan semen beku yang berkualitas tinggi diperlukan bahan pengencer semen yang mampu mempertahankan kualitas spermatozoa selama proses pendinginan, pembekuan, maupun pada saat thawing. Untuk melakukan fertilisasi, spermatozoa harus bergerak mencapai tempat pembuahan dengan menggunakan energi yang diperoleh dari pengencer, sehingga motilitas sering dijadikan indikator fertilitas spermatozoa namun demikian pergerakan spermatozoa dipengeruhi oleh integritas struktur morfologi spermatozoa. Metode HOS test adalah salah satu teknik untuk mengevaluasi keutuhan membran plasma spermatozoa pada hewan domestik, namun pengujian untuk semen baku sapi jarang dilakukan. Penentuan waktu optimal ini dialakukan dengan menginkubasi spermatozoa dari semen beku dalam larutan dengan osmolaritas 150 mOsm Kg
-1pada suhu 37 °C selama 60 menit.
Hasil pengamatan persentase laju reaksi spermatozoa sapi Limousin
terhadap larutan hipoosmotik pada menit ke-0, 15, 30, 45, dan 60 berturut-turut
adalah 33.16 ± 10.55 %, 46.88 ± 9.63 %, 53.90 ± 6.81 %, 52.47 ± 8.00 %, 42.46 ±
9.43 %. Sedangkan persentase sapi FH berturut-turut adalah 27.19 ± 6.11 %,
35.97 ± 6.14 %, 44.52 ± 6.26 %, 44.42 ± 8.41 %, 33.17 ± 9.63 %. Dari hasil
pengamatan tersebut diketahui bahwa pada spermatozoa Limousin dan FH waktu
yang paling optimal untuk melakukan pengujian keutuhan membran plasma
spermatozoa semen baku adalah pada menit ke-30 sampai 45. Pada waktu tersebut
jumlah persentase spermatozoa yang bereaksi mencapai puncak.
© Hak Cipta milik IPB, tahun 2012 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis
dalam bentuk apapun tanpa izin IPB
PENENTUAN WAKTU OPTIMAL
PENGUJIAN KEUTUHAN MEMBRAN PLASMA SPERMATOZOA SEMEN BEKU SAPI LIMOUSIN DAN FRISIEN HOLSTEIN MENGGUNAKAN HYPO-OSMOTIC
SWELLING (HOS) TEST
RIZAL DWI HARDYANA
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
BOGOR
2012
Judul Skripsi : Penentuan Waktu Optimal Pengujian Keutuhan Membran Plasma Spermatozoa Semen Beku Sapi Limousin dan Frisien Holstein Menggunakan Hypo-Osmotic Swelling (HOS) Test.
Nama : Rizal Dwi Hardyana
NIM : B04080064
Disetujui,
Prof. Dr. Dra. R. Iis Arifiantini, MSi Pembimbing
Diketahui,
Drh. Agus Setiono, MSi, PhD, APvet Wakil Dekan Fakultas Kedokteran Hewan IPB
Tanggal Lulus :
KATA PENGANTAR
Puji dan syukur senantiasa penulis panjatkan kepada Allah SWT. Karena atas segala karunianyalah sehingga penulis bisa menyelesaikan penelitian yang berjudul Penentuan Waktu Optimal Pengujian Keutuhan Membran Plasma Spermatozoa Semen Beku Sapi Limousin dan Frisien Holstein Menggunakan Hypo-Osmotic Swelling (HOS) Test.
Terimaksih yang sebesar-besarnya penulis sampaikan kepada Ibu Prof. Dr.
Dra. R. Iis Arifiantini, MSi. sebagai pembimbing skripsi atas segala kesabaran, pengorbanan, bimbingan serta dukungan moral sehingga penulis dapat menyelesaikan penulisan karya tulis ini dengan baik. Kepada Bapak drh.
Mochidin Noordin, Ibu Dr. drh. Savitri Novelina, MSi, PAvet dan Ibu drh.
Herwin Pisestyani, MSi selaku dosen penguji yang telah memberi banyak masukan pada penulisan karya ilmiah ini. Kepada Bapak Dr. drh. Amrozi selaku kepala Unit Rehabilitasi dan Reproduksi (URR) yang telah memberikan izin melakukan penelitian di laboratorium fisiologi reproduksi, serta kepada Bapak Bondan, Bapak dan Ibu Anda dan segenap staf URR.
Ucapan terimakasih juga penulis sampaikan kepada Bapak Dikdik Taupik Siddik, Mamah Yani Sutiyani, Teteh Dian Eka Astuti, Ade Moch. Bintang Aulia, Bibi Linlin, serta seuruh keluarga besar yang tanpa henti memberikan kasih sayang, doa, semangat serta dukungan yang tak terhingga sehingga penulis dapat menyelesaikan studi sarjana di FKH IPB. Selanjutnya penulis ucapkan terima kasih kepada teman-teman satu penelitian, Innes, Irin dan Rice. Serta tak lupa sahabat tercinta selama di FKH, Aming dan Ibon. Teman-teman Team Mawar, segenap teman-teman AVENZOAR, dan teman-teman NoesCamp 146. Kepada Oktaviani Solestiawati yang telah memberikan semangat dan kasih sayang.
Penulis menyadari skripsi ini masih jauh dari sempurna, untuk itu penulis mengucapkan terima kasih atas kritik dan saran yang sifatnya membangun dari semua pihak demi kesempurnaan karya ilmiah ini. Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2012
Rizal Dwi Hardyana
RIWAYAT HIDUP
Penulis lahir di Bandung, Jawa Barat pada tanggal 24 September 1990 dari Ayah Dikdik Taupik Siddik dan Ibu Yani Sutiyani. Penulis merupakan putra kedua dari tiga bersaudara.
Penulis menempuh sekolah dasar di SD Negeri 7 Rancaekek Kab. Bandung dan lulus tahun 2002, kemudian melanjutkan ke SLTP Negeri 1 Rancaekek Kab.
Bandung dan lulus tahun 2005. Pendidikan SMA penulis selesaikan di SMA Negeri 1 Cisarua Kab. Bandung Barat dan lulus pada tahun 2008. Pada tahun yang sama, penulis masuk Fakultas Kedokteran Hewan Institut Pertanian Bogor melalui jalur Undangan Saringan Masuk IPB (USMI).
Selama menjadi mahasiswa, penulis aktif di Lingkung Seni Sunda (LISES)
Gentra Kaheman IPB, Paguyuban Mahasiswa Bandung (PAMAUNG), Himpunan
Minat dan Profesi (HIMPRO) Satwa Liar, serta Badan Eksekutif Mahasiswa
(BEM) Kabinet Katalis periode 2009-2010.
DAFTAR ISI
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 2
Manfaat ... 2
Hipotesis ... 2
TINJAUAN PUSTAKA ... 3
Karakteristik Semen Sapi ... 3
Semen Beku ... 4
Hypo-osmotic Swelling Test ... 5
MATERI DAN METODE ... 7
Waktu dan Tempat Penelitian ... 7
Sampel Semen ... 7
Bahan dan Alat ... 7
Metode ... 7
Pembuatan Larutan Hipoosmotik ... 7
Pengujian HOS Test ... 7
Perhitungan ... 7
HASIL DAN PEMBAHASAN ... 9
SIMPULAN DAN SARAN ... 21
Simpulan ... 21
Saran ... 21
DAFTAR PUSTAKA ... 22
LAMPIRAN ... 26
DAFTAR TABEL
Tabel 1 Persentase jumlah spermatozoa sapi Limousin yang bereaksi terhadap larutan hipoosmotik selama masa inkubasi ... 11 Tabel 2 Persentase jumlah spermatozoa sapi FH yang bereaksi terhadap
larutan hipoosmotik selama masa inkubasi ... 12
DAFTAR GAMBAR
Gambar 1 Spermatozoa bereaksi dengan membran plasma utuh (ekor melingkar, a), spermatozoa tidak bereaksi dengan membran plasma tidak utuh (ekor lurus, b) (Saili et al. 2010). ... 8 Gambar 2 Diagram Venn untuk menunjukkan sub-populasi spermatozoa
dalam satu ejakulat berdasarkan parameter kualitas spermatozoa (Morrell & Rodriguez-Martinez 2009). ... 10 Gambar 3 Grafik laju reaksi spermatozoa sapi Limousin terhadap larutan
hipoosmotik selama masa inkubasi. ... 13 Gambar 4 Grafik laju reaksi spermatozoa sapi FH terhadap larutan
hipoosmotik selama masa inkubasi. ... 13 Gambar 5 Reaksi spermatozoa dengan ekor membengkok yang berada pada
larutan hipoosmotik. ... 14 Gambar 6 Ilustrasi regulasi pengaturan volume pada spermatozoa. ... 16 Gambar 7 Perubahan volume spermatozoa sebagai respon terhadap kondisi
hipoosmotik. ... 17
DAFTAR LAMPIRAN
Lampiran 1 Persentase spermatozoa sapi Limousin bereaksi terhadap larutan hipoosmotik ... 27 Lampiran 2 Persentase spermatozoa sapi FH bereaksi terhadap larutan
hipoosmotik ... 28 Lampiran 3 Uji statistik data spermatozoa sapi Limousin dangan uji
Duncan ... 29
Lampiran 4 Uji statistik data spermatozoa sapi FH dengan uji Duncan ... 31
PENDAHULUAN
Latar Belakang
Teknologi Inseminasi Buatan (IB) mulai diperkenalkan di Indonesia pada tahun 1952 tetapi aplikasinya secara masal di lapangan baru dimulai sejak tahun 1973 dengan menggunakan semen beku yang diimpor dari New Zealand (Selandia Baru). Untuk menghindari ketergantungan pada semen beku impor maka pada tahun 1976 didirikan Balai Inseminasi Buatan (BIB) Lembang (Jawa Barat) dan diikuti BIB Singosari (Jawa Timur) pada tahun 1982, keduanya menjadi BIB nasional yang melayani kebutuhan semen beku di Indonesia (Batubara 2002).
Dengan adanya UU no. 44 tahun 1999 mengenai otonomi daerah yang memberikan kewenangan mengatur dan memajukan daerahnya sendiri tanpa ada campur tangan pemerintah pusat, maka daerah terpacu dalam mendirikan balai inseminasi buatan dengan nama BIBD, seperti di Lampung, Palembang, Padang, Medan, Bali, Jawa Tengah, Kalimantan Selatan dan Blora (Arifiantini 2004).
Untuk tujuan IB, spermatozoa dapat disimpan terlebih dahulu dalam bentuk semen cair maupun semen beku. Semen diencerkan menggunakan bahan pengencer yang mengandung buffer, sumber energi, antibiotik dan lipoprotein yang dapat mempertahankan kualitasnya selama penyimpanan. Dalam bentuk semen cair, semen ejakulat dapat disimpan selama empat hari pada suhu 4 ºC dengan motilitas lebih dari 40 % sehingga masih layak digunakan untuk IB (Yulnawati & Setiadi 2005).
Setelah ditemukannya gliserol oleh Polge, pemanfaatan semen beku mulai berkembang (Arifiantini et al. 2005a) dengan kemasan yang pertama kali digunakan berbentuk pellet. Untuk menghasilkan semen beku yang berkualitas tinggi dibutuhkan bahan pengencer semen yang mampu mempertahankan kualitas spermatozoa selama proses pendinginan, pembekuan, maupun pada saat thawing (Aboagla & Terada 2004).
Salah satu tujuan teknologi reproduksi dari hewan domestik adalah untuk
mengetahui kemampuan fertilitasnya (Rodriguez-Martinez 2003). Dengan
demikian, peternakan biasanya menilai kualitas (konsentrasi spermatozoa,
motilitas, morfologi, viabilitas, dan keutuhan akrosom) dari semen sebelum
dugunakan untuk inseminasi buatan (Ruiz-Sanchez et al. 2006), dan tes yang lainnya telah dikembangkan (Gadea 2005).
Untuk melakukan fertilisasi, spermatozoa harus bergerak mencapai tempat pembuahan dengan menggunakan energi yang diperoleh dari pengencer, sehingga motilitas sering dijadikan indikator fertilitas spermatozoa. Namun demikian pergerakan spermatozoa dipengaruhi oleh integritas struktur morfologi spermatozoa (Yulnawati & Setiadi 2005).
Hypoosmotic Swelling (HOS) Test adalah salah satu teknik untuk mengevaluasi keutuhan membran plasma spermatozoa pada hewan domestik termasuk sapi (Correa & Zavos 1994), kuda (Neild et al. 1999), dan babi (Zou &
Yang 2000), tetapi dilakukan pada semen segar. Pengujian untuk semen beku sapi jarang dilakukan. Keutuhan membran plasma bagi spermatozoa mutlak diperlukan untuk memenuhi fungsinya sebagai pelindung organel di dalam sel dan penyaring bagi pertukaran zat intraseluler dan ekstraseluler. Demikian halnya dengan kondisi tudung akrosom yang harus tetap utuh untuk menjaga keamanan enzim- enzim fertilisasi yang terdapat di dalam vesikel akrosom.
Tujuan
Penelitian ini bertujuan untuk menentukan waktu yang paling optimal untuk pengujian keutuhan membran plasma spermatozoa semen beku sapi Limousin dan Frisien Holstein (FH) dengan menggunakan metode hypoosmotic swelling (HOS) test.
Manfaat
Mendukung hasil evaluasi motilitas dan scoring individu yang saat ini telah dilakukan untuk pengujian semen beku.
Hipotesis
Bahan pengencer yang terdapat dalam semen beku akan mengurangi
sensitivitas membran plasma terhadap larutan hipoosmotik.
TINJAUAN PUSTAKA
Karakteristik Semen Sapi
Menurut Garner dan Hafez (2000), semen merupakan cairan suspensi sel yang di dalamnya mengandung spermatozoa dan sekresi kelenjar assesorius dari organ kelamin jantan. Semen terdiri atas dua bagian yaitu spermatozoa dan plasma semen. Sejumlah parameter digunakan untuk menilai kualitas dari semen, diantaranya volume, konsentrasi spermatozoa, motilitas spermatozoa, jumlah spermatozoa hidup, jumlah spermatozoa abnormal dan komposisi biokimiawinya, serta tes fungsional.
Kepadatan spermatozoa pun ternyata penting untuk menentukan dosis dan/atau kapasitas fertilitas dari semen tersebut. Motilitas progresif penting karena dapat memperkirakan penilaian usia hidup semen. Spermatozoa dikatakan motil apabila spermatozoa tersebut bergerak ke depan (progresive motility), sedangkan spermatozoa yang bergerak melingkar disebut sebagai non-progresive motility (Arifiantini et al. 2005b).
Semen sapi yang normal berwarna seperti susu atau krem keputih–putihan dan keruh dengan konsentrasi encer. Hal ini disebabkan oleh volume yang kecil tetapi mempunyai konsentrasi spermatozoa yang tinggi. Konsentrasi spermatozoa merupakan salah satu parameter yang sering kali dipakai sebagai salah satu kriteria penentuan kualitas semen. Konsentrasi spermatozoa adalah jumlah spermatozoa yang terkandung dalam setiap mililiter semen. Konsentrasi spermatozoa sapi adalah 0.8-2.0 × 10
9spermatozoa/ml (Salisbury & VanDemark 1985), sedangkan menurut Schuh (2001) adalah 3.6-12 × 10
9spermatozoa/ejakulasi.
Motilitas adalah daya gerak maju spermatozoa, merupakan ciri spermatozoa
hidup dan normal yang menjadi salah satu kriteria untuk menentukan kualitas
semen. Pemeriksaan terhadap motilitas sermatozoa dapat dilakukan dengan
melihat gerakan massa pada semen segar atau dengan menghitung persentase
spermatozoa yang motil progresif pada semen yang telah diencerkan atau setelah
pembekuan dan thawing (Evans & Maxwell 1987). Menurut Zesfin et al. (2001),
motilitas spermatozoa pada sapi kelompok umur muda 65 ± 13.81 % dan
kelompok umur sapi dewasa rata-rata 62.22 ± 14.77 %.
Semen Beku
Semen beku adalah semen yang berasal dari pejantan terpilih yang diencerkan sesuai prosedur, dibekukan dan disimpan pada suhu -196 °C. Tujuan dari pengawetan semen adalah agar semen yang diperoleh masih dapat digunakan dalam jangka waktu yang lama, sehingga fertilitas semen tetap terjaga. Semen beku yang dibutuhkan adalah sekurang-kurangnya lima sampai sepuluh juta spermatozoa yang motil progresif tiap inseminasi untuk mendapat rata-rata fertilisasi yang optimal (Yanti 2005).
Terdapat beberapa cara pengawetan semen. Menurut Salisbury dan VanDemark (1985), dua teknik pengawetan semen agar keoptimalan fertilitas spermatozoa dapat dipertahankan. Teknik yang pertama yaitu dengan menyediakan ion-ion esensial, enzim-enzim, zat-zat makanan dan vitamin- vitamin. Teknik lain adalah dengan penghambatan secara fisik dan kimiawi semua aktifitas minimal yang penting dalam spermatozoa. Teknik pertama memerlukan pengetahuan yang lengkap tentang fungsi dan kebutuhan-kebutuhan spermatozoa serta usaha untuk memenuhi kebutuhan tersebut. Teknik kedua ini relatif lebih mudah dilaksanakan dengan cara menurunkan temperatur sehingga proses metabolisme dapat dihambat.
Sampai saat ini proses pembekuan semen mengalami beberapa masalah seperti terjadinya cold shock, osmotic shock, kerusakan intraseluler akibat terbentuknya kristal es, perubahan permeabilitas membran yang mengakibatkan kematian sel saat pencairan kembali (thawing) (Achmadi 2001). Beberapa upaya dapat dilakukan untuk mengatasi permasalahan diatas diantaranya penggunaan gliserol secara perlahan untuk mencegah osmotic shock serta pemberian kesempatan equilibrasi atau adaptasi untuk keseimbangan molekuler antara spermatozoa dengan bahan pengencer (Salisbury & VanDemark 1985).
Menurut Awad (2011), kebanyakan protokol kriopreservasi semen masih
menggunakan gliserol sebagai media krioprotektan, seperti yang dicontohkan
Polge et al. (1949). Gliserol, bersama metanol dan etilen glikol termasuk
kelompok yang dapat menembus ke dalam sel spermatozoa. Gliserol adalah
krioprotektan yang paling umum digunakan untuk spermatozoa ternak. Namun,
jika gliserol digunakan dalam konsentrasi tinggi memiliki beberapa toksisitas dan
mungkin krioprotektan tersebut yang menyebabkan kerusakan osmotik terbesar untuk spermatozoa karena permeabilitasnya menembus membran plasma spermatozoa lebih rendah daripada air dan krioprotektan lainnya (Guthrie et al.
2002).
Dalam proses kriopreservasi (pembekuan) semen, akibat perlakuan suhu yang sangat rendah (-196 °C) akan terbentuk kristal-kristal es dan peningkatan konsentrasi elektrolit intraseluler yang menyebabkan kerusakan sel spermatozoa.
Untuk mengurangi efek ini, di dalam pengencer harus ditambahkan senyawa krioprotektan. Selain gliserol yang berperan sebagai krioprotektan intraseluler, juga dikenal berbagai macam gula seperti laktosa yang dapat berfungsi sebagai krioprotektan ekstraseluler (Rizal & Herdis 2005).
Hypo-osmotic Swelling Test
Hypo-osmotic Swelling (HOS) Test pada awalnya dirancang penggunaannya pada spermatozoa manusia untuk mengevaluasi aktivitas biokimia dari fisik membran plasma secara utuh (Jeyendran et al. 1984). Hal ini didasarkan pada pengamatan bahwa jika spermatozoa dengan membran sel fungsional ditempatkan pada larutan hipoosmotik, air mengalir melalui membran dan masuk ke dalam sel, sehingga membangun kembali keseimbangan antara kompartemen cairan ekstraseluler dan cairan intraseluler. Sel tersebut meningkatkan volumenya dan membran yang menutupi ekor spermatozoa mengembang, menyebabkan flagellum menggulung di dalamnya. Ekor melingkar dimulai pada ujung distal ekor dan berlanjut menuju bagian tengah dan kepala saat tekanan osmotik pada media pembekuan menurun (Fonseca et al. 2005).
Spermatozoa pada semen beku mengalami kondisi hipertonik selama pembekuan–pencairan, dan kondisi isotonik selama pembersihan sperma in vitro atau ketika berada pada saluran reproduksi betina selama IB (Ball & Peters 2004).
Osmotic shock berarti perubahan seluler (melingkarnya ekor spermatozoa) yang terjadi selama paparan kondisi isotonik spermatozoa setelah terpapar kondisi hipertonik.
Saat terekspos larutan hipoosmotik, secara biokimia spermatozoa aktif
meningkatkan volume mereka dalam rangka untuk membangun keseimbangan
antara kompartemen cairan intraseluler dan cairan ekstraseluler (Fonseca et al.
2005). Fonseca et al. (2005) juga menyatakan bahwa pembengkakan
menyebabkan perubahan baik dalam ukuran maupun bentuk sel yang dapat
dievaluasi dengan menggunakan phase contrast microscope.
MATERI DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Juli 2011 sampai dengan April 2012.
Penelitian ini dilaksanakan di laboratorium Fisiologi Reproduksi Unit Rehabilitasi Reproduksi Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Sampel Semen
Sampel semen berasal dari Balai Inseminasi Buatan Lembang, Jawa Barat sebanyak 15 straw dari sapi Limousin dan 15 straw dari sapi Frisien Holstein (FH) yang diambil secara acak. Sampel dimasukkan ke dalam container yang berisi nitrogen cair dengan suhu -196 °C.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah 30 straw sampel semen beku dari BIB Lembang, Na-sitrat, fruktosa, dan nitrogen cair.
Alat–alat yang digunakan pada penelitian ini adalah, mikroskop (Olympus CH 20), water bath, counter, object dan cover glass, tabung Eppendorf, mikropipet dan tip, meja pemanas, container, dan pipet tetes.
Metode Pembuatan Larutan Hipoosmotik
Sebanyak 1.351 g fruktosa dan 0.735 g Na-sitrat ditimbang dan dimasukkan ke dalam gelas piala. Lalu ditambahkan aquabidest ke dalam gelas piala sampai dengan volume 100 ml maka akan terbentuk larutan dengan osmolaritas 150 mOsm Kg
-1(Revell & Mrode 1994).
Pengujian HOS Test
Sebanyak 400µl larutan hipoosmotik disiapkan di dalam tabung Eppendorf.
Semen beku di-thawing dalam water bath dengan suhu 37 °C selama 30 detik.
Straw dikeringkan dengan menggunakan tissue. Straw dipotong pada kedua
sumbatnya dan isi straw dikeluarkan seluruhnya, lalu 50 µl semen dimasukkan ke
dalam tabung Eppendorf. Larutan yang telah dicampur dihomogenkan dengan
cara membentuk angka delapan. Ambil satu tetes dengan pipet, teteskan pada
object glass, lalu tutup dengan cover glass dan lihat di bawah mikroskop (Olympus CH 20) dengan perbesaran 40 × 10, hitung spermatozoa yang normal dan yang telah bereaksi dengan larutan hipoosmotik pada 10 lapang pandang, untuk mendapatkan data HOS test pada menit ke-0.
Campuran semen dalam larutan hipoosmotik disusun dalam rak pada water bath berisi air dengan suhu 37 °C. Pengujian keutuhan membran plasma semen beku dilakukan pada menit ke 0, 15, 30, 45, dan 60. Pengujian dilakukan dengan cara mengambil satu tetes dengan pipet tetes dan diletakkan pada object glass, lalu tutup dengan cover glass dan lihat dibawah mikroskop dengan perbesaran 40
× 10, hitung spermatozoa yang normal dan yang telah bereaksi pada 10 lapang pandang.
Perhitungan
Perhitungan spermatozoa yang bereaksi dilakukan pada 10 lapang pandang dan persentasenya dihitung dengan rumus:
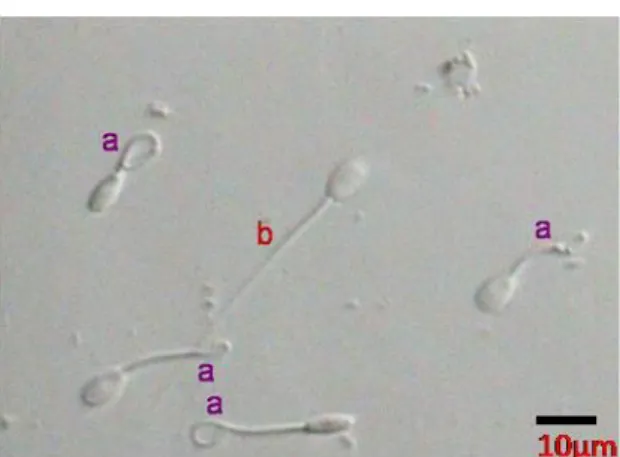
Gambar 1 Spermatozoa bereaksi dengan membran plasma utuh (ekor melingkar, a), spermatozoa tidak bereaksi dengan membran plasma tidak utuh (ekor lurus, b) (Saili et al. 2010).
HASIL DAN PEMBAHASAN
Semen merupakan salah satu komponen penting dalam penghantaran spermatozoa baik secara konseptus alami maupun inseminasi buatan (IB).
Keberhasilan IB sangat dipengaruhi oleh kualitas semen yang digunakan.
Inseminasi di Indonesia sebagian besar menggunakan semen beku. Dalam pembuatannya semen beku mengalami berbagai macam kerusakan mulai dari efek larutan pengencer yang hipertonik, kerusakan akibat pembekuan dan akibat thawing. Untuk menjamin kualitas semen maka dilakukan serangkaian uji kualitas setelah thawing diantaranya adalah motilitas dan scoring individu.
Spermatozoa diselaputi oleh membran plasma. Membran plasma ini akan mengalami kerusakan akibat pembekuan. Kerusakan membran plasma spermatozoa bisa terjadi di bagian ekor atau bagian kepala. Kerusakan di bagian kepala akan menyebabkan hilangnya enzim-enzim yang terdapat di bagian akrosom sehingga spermatozoa kehilangan kemampuan untuk membuahi ovum, tetapi spermatozoa masih bisa bergerak kerena mitokondria di bagian ekor masih berfungsi. Sebaliknya jika kerusakan terjadi pada bagian ekor maka enzim aspartat aminotransferase yang berfungsi untuk merombak adenosin trifosfat (ATP) menjadi adenosin difosfat (ADP) dan adenosin monofosfat (AMP) hilang akibatnya spermatozoa akan kehilangan daya geraknya.
Pengujian terhadap rasio spermatozoa yang hidup dan mati atau keutuhan membran plasma spermatozoa dengan teknik HOS test perlu dilakukan untuk menjamin bahwa membran plasma spermatozoa dari semen beku masih baik, selain indikator motilitas dan scoring individu yang selama ini sudah dilakukan.
Metode HOS test dapat memberikan informasi tentang integritas membran spermatozoa.
Terdapat berbagai pendapat berbeda mengenai konsep penilaian kualitas spermatozoa dan kemungkinan perbedaan spesies pada kepentingan parameter individual, kualitas spermatozoa juga dapat dinilai dari jumlah spermatozoa, motilitas dan normalitas morfologi spermatozoa (Colenbrander et al. 2003).
Selain itu terdapat perameter tambahan, yaitu keutuhan membran plasma dan
keutuhan kromatin (Graham 2001; Rodriguez-Martinez 2007). Menurut Morrell
dan Rodriguez-Martinez (2009), terdapat hubungan yang kuat antara fertilitas dan
motilitas post-thawing, jumlah akrosom normal, keutuhan membran plasma, serta abnormalitas spermatozoa pada sejumlah spesies seperti kerbau (Ahmed et al.
2003), sapi (Al-Makhzoomi et al. 2008), dan antara morfologi, integritas kromatin dan pregnancy rates pada kuda (Morrell et al. 2008).
Gambar 2 Diagram Venn untuk menunjukkan sub-populasi spermatozoa dalam satu ejakulat berdasarkan parameter kualitas spermatozoa (Morrell &
Rodriguez-Martinez 2009).
Semen beku berbeda dengan semen segar. Semen beku sudah ditambahkan berbagai macam bahan sehingga melapisi/menyelimuti permukaan membran plasma. Oleh karena itu perlu dicari waktu yang optimal agar hasil pengujian menjadi lebih valid.
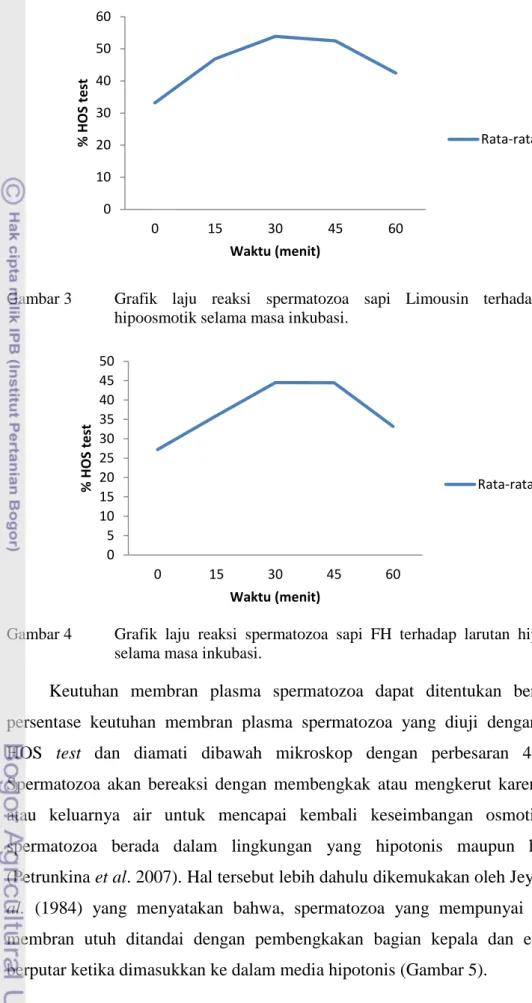
Hasil pengujian keutuhan membran plasma utuh (MPU) dengan metode HOS test pada semen beku sapi Limousin dan FH, didapatkan waktu yang paling optimal untuk melakukan pengujian tersebut adalah pada menit ke 30-45 masa inkubasi (Tabel 1 dan 2). Inkubasi ini dilakukan dalam larutan hipoosmotik dengan osmolaritas 150 mOsm Kg
-1pada suhu 37 °C.
Motilitas
Keutuhan Kromatin
Morfologi normal Viabilitas
Tabel 1 Persentase jumlah spermatozoa sapi Limousin yang bereaksi terhadap larutan hipoosmotik selama masa inkubasi
Ulangan Masa Inkubasi (menit)
0 15 30 45 60
1 31.51 37.62 51.22 51.78 49.47
2 19.79 50.00 54.84 62.96 57.14
3 24.00 30.23 38.89 50.38 49.02
4 39.13 45.16 51.51 63.64 61.22
5 23.86 49.81 50.76 45.83 34.16
6 21.43 48.15 45.83 45.83 42.37
7 27.42 65.18 51.09 34.1 31.25
8 53.09 61.97 66.67 45.45 39.58
9 31.82 42.86 52.43 53.12 33.80
10 22.73 37.04 57.89 56.06 38.00
11 44.12 51.85 56.18 63.46 36.58
12 30.43 33.33 64.44 58.06 50.00
13 36.58 50.00 59.42 52.94 47.37
14 50.00 50.00 53.64 48.98 31.34
15 41.46 50.00 53.68 54.54 35.56
Rata-rata 33.16d 46.88b,c 53.90a 52.47a,b 42.46c
SD 10.55 9.63 6.81 8.00 9.43
Superskrip dengan notasi yang berbeda menyatakan perbedaan yang nyata (p<0.05).
Pada awal masa inkubasi menit ke-0, sebanyak 33.16 ± 10.55 % spermatozoa sapi Limousin bereaksi terhadap larutan hipoosmotik, sedangkan sapi FH sebanyak 27.19 ± 6.11 % spermatozoa yang bereaksi. Perbedaan yang signifikan (P<0.05) terjadi pada menit ke-0 sampai ke-15, baik pada spermatozoa sapi Limousin maupun FH, yaitu 46.88 ± 9.63 % untuk sapi Limousin dan 35.97 ± 6.14 % untuk sapi FH.
Puncak reaksi dari spermatozoa terhadap larutan hipoosmotik terjadi pada menit ke-30 dan ke-45, tidak terdapat perbedaan yang signifikan dari persentase diantara kedua masa inkubasi tersebut. Spermatozoa sapi Limousin menunjukkan 53.90 ± 6.81 % dan 52.47 ± 8.00 % spermatozoa bereaksi, sedangkan spermatozoa sapi FH menunjukkan 44.52 ± 6.26 % dan 44.46 ± 8.42 %.
Penurunan terjadi pada masa inkubasi terakhir (menit ke-60), terjadi penurunan yang signifikan dari menit ke-45 menuju menit ke-60. Semen beku sapi Limousin menurun hingga 42.46 ± 9.43 %, sedangkan semen beku FH menjadi 33.17 ± 9.63
%.
Tabel 2 Persentase jumlah spermatozoa sapi FH yang bereaksi terhadap larutan hipoosmotik selama masa inkubasi
Ulangan Masa Inkubasi (menit)
0 15 30 45 60
1 25.93 40.00 50.00 51.35 37.78
2 34.15 34.88 41.86 41.02 26.78
3 27.50 30.35 36.73 42.00 30.00
4 25.00 29.03 42.11 43.02 36.96
5 20.00 29.27 46.67 56.52 53.53
6 34.02 42.31 41.93 49.27 13.14
7 26.47 32.14 37.93 48.15 36.00
8 23.08 44.44 55.56 57.50 41.03
9 39.65 43.75 52.50 50.00 37.10
10 22.50 30.95 43.33 35.94 29.69
11 20.00 27.03 32.50 45.45 40.28
12 36.96 43.88 45.90 40.91 39.13
13 24.59 41.38 48.93 28.57 23.08
14 23.08 35.05 41.82 46.85 23.08
15 25.00 35.05 50.00 30.43 30.00
Rata-rata 27.19c 35.97b 44.52a 44.46a 33.17b
SD 6.11 6.14 6.26 8.42 9.63
Superskrip dengan notasi yang berbeda menyatakan perbedaan yang nyata (P<0.05).
Pada awal pengamatan relatif belum banyak spermatozoa yang bereaksi
terhadap larutan hipoosmotik. Hal ini dapat disebabkan karena pengaruh dari
bahan pengencer yang diberikan sebelum pembekuan semen. Bahan pengencer ini
mengurangi sensitivitas membran plasma spermatozoa terhadap larutan
hipoosmotik. Pada masa inkubasi yang lebih lama, jumlah spermatozoa yang
bereaksi semakin meningkat hingga menit ke-45. Bahan pengencer semen beku
lama kelamaan akan habis dan pengaruhnya semakin berkurang sehingga
spermatozoa semakin banyak yang bereaksi. Semakin lama masa inkubasi maka
membran plasma spermatozoa ini akan rusak hingga tidak bereaksi terhadap
larutan hipoosmotik. Hal inilah yang menyebabkan penurunan yang signifikan
sampai akhir pengamatan. Reaksi spermatozoa semen beku dari sapi Limousin
dan FH tersebut dapat dilihat dalam Gambar 3 dan Gambar 4.
Gambar 3 Grafik laju reaksi spermatozoa sapi Limousin terhadap larutan hipoosmotik selama masa inkubasi.
Gambar 4 Grafik laju reaksi spermatozoa sapi FH terhadap larutan hipoosmotik selama masa inkubasi.
Keutuhan membran plasma spermatozoa dapat ditentukan berdasarkan persentase keutuhan membran plasma spermatozoa yang diuji dengan metode HOS test dan diamati dibawah mikroskop dengan perbesaran 40 × 10.
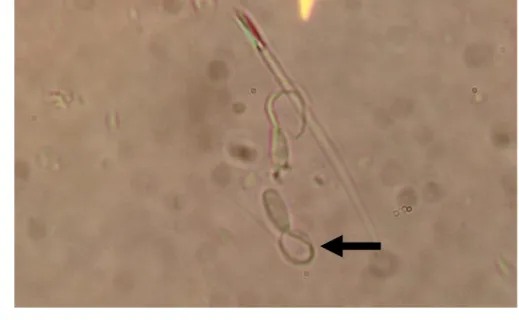
Spermatozoa akan bereaksi dengan membengkak atau mengkerut karena masuk atau keluarnya air untuk mencapai kembali keseimbangan osmotik ketika spermatozoa berada dalam lingkungan yang hipotonis maupun hipertonis (Petrunkina et al. 2007). Hal tersebut lebih dahulu dikemukakan oleh Jeyendran et al. (1984) yang menyatakan bahwa, spermatozoa yang mempunyai integritas membran utuh ditandai dengan pembengkakan bagian kepala dan ekor yang berputar ketika dimasukkan ke dalam media hipotonis (Gambar 5).
0 10 20 30 40 50 60
0 15 30 45 60
% HOS test
Waktu (menit)
Rata-rata
0 5 10 15 20 25 30 35 40 45 50
0 15 30 45 60
% HOS test
Waktu (menit)
Rata-rata
Gambar 5 Reaksi spermatozoa dengan ekor membengkok yang berada pada larutan hipoosmotik.
Membran plasma yang meyelubungi sebuah sel berfungsi membatasi keberadaan sebuah sel dan memelihara perbedaan pokok antara bagian intrasel dan bagian ekstrasel. Membran plasma tersebut merupakan sebuah sekat atau sebagai filter yang mempunyai kemampuan memilih bahan yang masuk dan keluar sel sehingga tetap dapat memelihara perbedaan kadar ion di luar dan di dalam sel (Nawang 2005).
Spermatozoa dilindungi oleh membran plasma yang berfungsi sebagai pelindung terhadap berbagai pengaruh lingkungan. Selain itu, membran plasma juga berfungsi sebagai pengatur transport ion-ion dan air dari dalam keluar sel atau pun sebaliknya. Jika membran plasma spermatozoa mengalami kerusakan maka membran tidak dapat menjalankan fungsinya dengan normal sehingga kualitas spermatozoa yang bersangkutan akan menurun (Arifiantin et al. 1999).
Metode HOS test mengevaluasi fungsi membran, tetapi variabel lainnya mungkin terlibat dalam potensi fertilitas, terutama di bawah kondisi in vitro (Rota et al.
1999). Menurut Jeyendran et al. (1984) kemampuan spermatozoa membengkak dalam larutan hipoosmotik menunjukkan membran tersebut berfungsi.
Penurunan kualitas spermatozoa selama penyimpanan, baik persentase
motilitas progresif maupun keutuhan membran plasma diduga akibat banyaknya
spermatozoa yang mati dan menjadi toksik terhadap spermatozoa yang masih
hidup, sehingga secara umum kualitasnya menjadi menurun. Keberadaan zat yang bersifat toksik baik yang berasal dari spermatozoa mati maupun yang berasal dari bahan pengencer yang telah mengalami oksidasi akibat penyimpanan dapat menyebabkan tingginya kadar radikal bebas yang dapat merusak keutuhan membran plasma spermatozoa. Apabila membran plasma spermatozoa sudah mengalami kerusakan, maka metabolisme spermatozoa akan terganggu dan mulai kehilangan motilitasnya sehingga mengakibatkan kematian spermatozoa (Yulnawati & Setiadi 2005).
Sebetulnya teori yang sangat sederhana yang mendasari metode HOS test ini, teori tersebut adalah hukum osmosis. Seperti yang telah kita ketahui bila sel (spermatozoa) terpapar pada media hipoosmotik, maka air akan mengalir ke dalamnya sampai mencapai keseimbangan osmotik antara intrasel dan ekstrasel, sehingga sel akan membengkak. Kebengkakan ini akan menyebabkan pembengkokan pada ekor yang mudah dilihat.
Seperti halnya membran plasma pada sel lain yang bersifat semipermeabel yang apabila dibatasi oleh larutan yang berbeda tekanan osmotiknya, maka air akan mengalir masuk melintasi membran dari kompartemen hipoosmotik ke kompartemen hiperosmotik. Hal tersebut yang menyebabkan banyaknya air pada larutan yang hiperosmotik dan tekanan osmotiknya mengecil, sedangkan banyaknya air pada larutan hipoosmotik semakin berkurang dan tekanan osmotiknya semakin besar. Keadaan ini akan terus berjalan sampai dengan tekanan osmotik kedua kompartemen seimbang.
Penggunaan metode HOS Test untuk menguji fertilitas spermatozoa telah dilakukan sejak lama. Ekor spermatozoa sapi akan membengkok dan melingkar seperti spiral bila spermatozoa tersebut berada dalam cairan hipoosmotik.
Pembengkokan ini adalah akibat gangguan kontraksi dan relaksasi ekor oleh
karena adanya aliran ion atau bahan yang berat molekulnya dari ekor ke medium
hipoosmotik tersebut. Menurut Fonseca et al. (2005) ekor melingkar dimulai dari
ujung distal ekor dan berlanjut menuju bagian tengah dan kepala saat tekanan
osmotik pada media pembeku menurun.
Gambar 6 Ilustrasi regulasi pengaturan volume pada spermatozoa.
Seperti sel lainnya, spermatozoa mengontrol volumenya ketika berada dalam keadaan hipotonis dengan pembukaan channel K
+dan Cl
-(Gambar 6a).
Saat air masuk ke dalam sel untuk mencapai keseimbangan antara tonisitas internal dan eksternal sel, channel terbuka untuk pengeluaran K
+untuk menurunkan gradien konsentrasi (konsentrasi K
+intraselular secara normal lebih tinggi dibandingkan dengan ekstraselular). Untuk mempertahankan netralitas elektris, Cl
-keluar bersamaan. Keseluruhan pengeluaran ion menurunkan tonisitas intraselular dan konsekuensinya adalah air masuk ke dalam sel, sehingga pembengkakan menurun atau bakan kembali ke keadaan semula (RVD-regulatory volume decrease) (Petrunkina et al. 2007).
Pada sel somatik, aktivasi dari channel K
+dan Cl
-sangat sensitif terhadap pembengkakan sel, seperti pada saluran osmolit. Aktivasi tersebut diketahui melibatkan arus sinyal yang diperantarai oleh protein phosphorylation dan dephosphorylation (Petrunkina et al. 2007). Seperti yang terlihat pada Gambar 6b,
Membengkak
aktivasi dari mekanisme transport untuk mengatur volume sel diperantarai oleh protein kinase C (PKC) dan protein phosphatase (PP). Dengan memelihara serine dan threonin sisa dari tahap phosphorilasi, aktivitas PKC terlihat untuk menjaga channel ion tertutup, sementara itu penghambatan PKC atau peningkatan aktivitas PP menyebabkan channel terbuka dan mengawali proses RVD (Gambar 7).
Gambar 7 Perubahan volume spermatozoa sebagai respon terhadap kondisi hipoosmotik.
Menurut Hafez (1987), membran plasma merupakan salah satu yang mempengaruhi motilitas spermatozoa dan dapat diuji keutuhannya dengan menggunakan metode HOS test. Proses pembekuan semen dan proses thawing mengakibatkan kerusakan pada membran plasma, hal ini disebabkan oleh penurunan dan peningkatan suhu semen yang sangat drastis sehingga terjadi perubahan metabolisme yang sangat cepat. Spermatozoa dengan membran plasma utuh dan berfungsi dengan baik akan bertambah besar volumenya jika disimpan dalam suatu media yang hipoosmotik. Media tersebut akan menggunakan tekanan osmotik yang cukup besar untuk mengakibatkan aliran masuk ke dalam spermatozoa sehinga spermatozoa menjadi bengkak (Jeyendran et al. 1984).
Menurut Yeung et al. (1999) kemampuan mengatur volume sangat penting
untuk mencapai fertilitas. Seperti yang disebutkan di atas, spermatozoa
membengkak ditandai dengan pembengkokan ekor, efek inilah yang merusak
motilitas spermatozoa, yang akibatnya transport spermatozoa dan penetrasi sel
telur akan terganggu. Pada hewan domestik, kemampuan mengontrol volume ini
sangat erat kaitannya dengan kemampuan spermatozoa membuahi telur in vivo
(Petrunkina et al. 2007; Khalil et al. 2006).
Dalam proses pembekuan semen, diperlukan larutan pengencer yang dapat menjamin kebutuhan fisik dan kimia spermatozoa. Selama pembekuan ini terjadi pembentukan kristal-kristal es akibat dari penurunan suhu yang sangat rendah (- 196 °C), disamping itu juga terjadi perubahan konsentrasi elektrolit yang menyebabkan terjadinya kerusakan pada spermatozoa. Pemberian senyawa krioprotektan ke dalam pengencer dapat mengurangi efek yang tidak menguntungkan bagi spermatozoa (Rusiyantono 2008). Krioprotektan dibedakan menjadi dua jenis menurut cara kerjanya, krioprotektan intraseluler dan krioprotektan ekstraseluler. Krioprotektan yang paling berperan penting dalam melindungi sel adalah krioprotektan intraseluler karena dapat menembus membran sel. Salah satu contoh krioprotektan intraseluler yang sering digunakan adalah gliserol dan etilen glikol, keduanya dapat memodifikasi pembentukan kristal es melalui pencegahan peningkatan konsentrasi elektrolit yang dapat membahayakan sel yang dibekukan.
Gliserol merupakan krioprotektan yang lazim digunakan dalam proses pembekuan semen. Selain dapat memodifikasi pembentukan kristal es, gliserol juga dapat mencegah pengumpulan molekul H
2O dari kristalisasi es pada daerah titik beku larutan. Sedangkan etilen glikol merupakan salah satu krioprotektan yang telah dilaporkan keberhasilannya dalam proses pembekuan sel yang lebih besar dari spermatozoa, misalnya ovum (Rusiyantono 2004).
Dari hasi pengamatan terlihat bahwa dari menit ke-0 sampai menit ke-45 persentase spermatozoa yang bereaksi semakin meningkat. Hal ini menandakan bahwa pada awal inkubasi belum semua spermatozoa bereaksi hingga akhirnya mencapai waktu yang optimal yaitu pada menit ke-45. Hasil ini berbeda dengan penelitian yang dilakukan pada semen segar sapi oleh Revell dan Mrode (1994).
Pada penelitian tersebut spermatozoa yang bereaksi pada awal inkubasi sangat tinggi dan berangsur-angsur menurun. Hasil tersebut menunjukkan bahwa ketika pemberian larutan hipoosmotik dilakukan, spermatozoa langsung bereaksi dengan larutan tersebut. Peristiwa tersebut terjadi terus menerus hingga akhirnya membran sel rusak dan spermatozoa tidak bereaksi lagi.
Jika dibandingkan dengan penelitian pada semen segar, hasil penelitian ini
sesuai dengan hipotesis awal yakni adanya pengaruh bahan pengencer yang
diberikan pada semen beku pada sensitivitas membran plasma spermatozoa terhadap larutan hipoosmotik. Hasil tersebut didukung oleh Rusiyantono (2008) yang menyatakan bahwa, pemberian krioprotektan dalam media pengencer dapat memberikan pengaruh positif terhadap integritas sel.
Pada saat pembekuan dan thawing terjadi tekanan yang tinggi terhadap spermatozoa akibat penurunan suhu yang drastis saat pembekuan dan peningkatan suhu yang drastis juga saat thawing. Pada saat tersebut pemberian krioprotektan, baik gliserol maupun etilen glikol, mampu memberikan perlindungan yang optimum terhadap keutuhan membran plasma dan integritas spermatozoa. Dengan demikian, maka proses metabolisme akan berjalan dengan baik, sehingga motilitas dan daya hidup spermatozoa akan terlindungi.
Gliserol dan etilen glikol dapat dengan mudah memasuki intrasel melaui membran sel dengan cara difusi bebas. Gliserol dan etilen glikol menggantikan posisi sebagian molekul air yang memang harus keluar supaya tidak terjadi kristal es intraseluler saat pembekuan sehingga tidak terjadi efek solusi. Selain itu, gliserol dan etilen glikol mempunyai gugus hidroksil yang mampu mengikat air, sehingga tidak semua air bisa keluar. Sel akan kekeringan sampai mati ketika kehilangan 65 % molekul air. Kehadiran krioprotektan yang mampu mengikat air, secara langsung mencegah molekul air yang membeku di dalam sel menyatu untuk membentuk kristal es yang ukurannya lebih besar dan memiliki daya rusak yang besar terhadap sel. Gliserol dan etilen glikol yang membeku mempunyai permukaan yang halus sehingga tidak merusak membran sel, sehingga keutuhan membran plasma tetap terjaga (Supriatna & Pasaribu 1992).
Pengujian keutuhan membran plasma ini dianggap penting karena hal tersebut sangat berperan dalam proses fertilisasi untuk keberhasilan IB. Rusaknya membran plasma biasa disertai dengan rusaknya tudung akrosom, sehingga menyebabkan keluarnya enzim-enzim yang diperlukan dalam proses fertilisasi.
Rusaknya bagian ini menyebabkan kegagalan program IB karena tidak terjadi
fertilisasi dan akhirnya tidak terjadi kebuntingan (Herdis et al. 2003). Lebih lanjut
Herdis et al. (2003) menambahkan pada spermatozoa, bagian membran plasma
dan akrosom lebih peka dibandingkan inti dan bagian lokomotor. Membran luar
akrosom spermatozoa lebih sensitif dibandingkan bagian dalam akrosom spermatozoa.
Kerusakan atau perubahan tudung akrosom merupakan salah satu bentuk abnormalitas dari kepala spermatozoa. Perubahan bentuk tudung akrosom dapat berupa pembengkakan (swollen), pecah (ruptured), berkerut (ruffled) dan terlepas (detached). Kerusakan tudung akrosom menyebabkan berkurangnya kemampuan spermatozoa dalam proses fertilisasi. Keadaan ini terjadi karena pada selubung akrosom mengandung bahan-bahan akrosomal yaitu enzim-enzim penting untuk proses fertilisasi, seperti hyaluronidase, CPE (corona penetrating ezyme) dan akrosin (Vercarcel et al. 1997).
Kerusakan tudung akrosom menyebabkan ketidakmampuan spermatozoa melakukan reaksi akrosom. Reaksi akrosom merupakan suatu proses eksositosis yang ditandai dengan terjadinya fusi antara membran plasma spermatozoa dengan membran luar akrosom di bagian anterior kepala spermatozoa, sehingga memungkinkan enzim-enzim hidrolitik yang dikandung dalam kantung akrosom tersebut keluar melalui pori-pori yang terbentuk, dan selanjutnya enzim-enzim tersebut akan melisiskan lapisan luar sel telur (Flesch & Gadella 2000).
Pengujian keutuhan membran plasma spermatozoa sangat penting dilakukan untuk menguji fertilitas spermatozoa. Pada semen segar, tidak terdapat faktor yang mempengaruhi reaksi antara spermatozoa dan larutan hipoosmotik.
Sedangkan pada semen beku terdapat bahan pengencer yang mengandung
krioprotektan yang dapat menghambat reaksi antara spermatozoa dan larutan
hipoosmotik.
SIMPULAN DAN SARAN
Simpulan
Waktu optimal untuk pengujian membran plasma utuh dengan HOS test pada spermatozoa semen beku sapi Limousin dan FH adalah pada menit ke-30 sampai ke-45 masa inkubasi pada 37 °C dalam larutan dengan osmolaritas 150 mOsm Kg
-1.
Saran
Perlu dilakukan uji lanjutan semen beku sapi Limousin dan FH pada suhu
dan tekanan osmotik yang berbeda. Perlu juga dilakukan pengujian terhadap
semen beku sapi ras lain dan hewan ternak lain.
DAFTAR PUSTAKA
Aboagla EME, Terada T. 2004. Effects of egg yolk during the freezing step of cryopreservation on the viability of goat spermatozoa. Theriogenology 62:
1160-1172.
Achmadi AS. 2001. Kaji banding kualitas dan keutuhan membran plasma semen beku sapi setiap jalur distribusi [skripsi]. Bogor: Fakultas Kedokteran Hewan, Institut Pertainan Bogor.
Ahmed Z, Anzar M, Shahab M, Ahmad N, Andrabi SMH. 2003. Sephadex and sephadex ion-exchange filtration improves the quality and freezability of low grade buffalo semen ejaculates. Theriogenology 59: 1189-202.
Al-Makhzoomi A, Lundeheim N, Håård M, Rodriguez-Martinez H. 2008. Sperm morphology and fertility in progeny-tested AI dairy bulls in Sweden.
Theriogenology 70(4): 682-91.
Arifiantini I, Yusuf TL, Indah O. 2005a. Kaji banding dua teknik pengemasan menggunakan tiga macam pengencer untuk pembekuan semen sapi Friesian Holstein (FH). Seminar Nasional Teknologi Pertanian dan Veteriner 2005.
Arifiantini I, Yusuf TL, Yanti D. 2005b. Kaji banding kualitas semen beku sapi Friesian Holstein menggunakan pengencer dari berbagai Balai Inseminasi Buatan di Indonesia. Anim Prod 7 (3): 168 – 176.
Arifiantini I. 2004. Preservasi dan kriopreservasi semen dalam upaya konservasi dan grading up kuda lokal serta mendukung terciptanya kuda pacu Indonesia. Makalah. Sekolah Pascasarjana, Institut Pertanian Bogor.
Arifiantini I, Purwantara B, Putra WW. 1999. Pengujian keutuhan membran plasma spermatozoa semen cair domba menggunakan larutan hipoosmotik.
Prosiding Seminar Hasil-Hasil Penelitian Bidang Ilmu Hayat. Bogor: Pusat Antar Universitas Ilmu Hayat IPB.
Awad MM. 2011. Effect of some permeating cryoprotectnants on CASA motility results in cryopreserved bull spermatozoa. Anim Reprod Sci 123: 157-162.
Ball PJH, Peters AR. 2004. Reproduction in Cattle. Ed ke-3. Oxford: Blackwell Publishing.
Batubara I. 2002. Pengkajian teknik penanganan dan kualitas semen beku sapi produksi Balai Inseminasi Buatan Lembang – Singosari pada setiap tahap jalur distribusi di Indonesia [tesis]. Bogor: Sekolah Pasca Sarjana, Institut Pertanian Bogor.
Colenbrander B, Gadella BM, Stout TAE. 2003. The predictive value of semen analysis in the evaluation of stallion fertility. Reprod Domest Anim 38: 305- 11.
Correa JR, Zavos PM. 1994. The hypoosmotic swelling test: its employment as an
assay to evaluate the functional integrity of the frozen-thawed bovine sperm
membrane. Theriogenology 42:351-360.
Evans G, Maxwell WMC. 1987. Salamons Artificial Insemination of Sheep and Goats. Sidney: Boutterworth.
Flesch FM, Gadella BM. 2000. Dynamics of the mammalian sperm plasma membrane in the process of fertilization. Biochim Biophys Acta 1469: 197- 235.
Fonseca JF, Torres CAA, Maffili VV, Borges AM, Santos ADF, Rodrigues MT, Oliviera RMF. 2005. The hypoosmotic swelling test in fresh goat spermatozoa. Anim Reprod 2 (2): 139-144.
Gadea J. 2005. Sperm factors related to in vitro and in vivo porcine fertility.
Theriogenology 63: 431–444.
Garner DL, Hafez ESE. 2000. Reproduction in Farm Animals. Ed ke-7. Lippincott Wiliams. Philadelphia.
Graham JK. 2001. Assessment of semen quality: a flow cytometric approach.
Anim Reprod Sci 68: 239-47.
Guthrie HD, Liu J, Critser JK. 2002. Osmotic tolerance limits and effects of cryoprotectants on motility of bovine spermatozoa. Biol Reprod 67: 1811–
1816.
Hafez ESE. 1987. Reproduction in Farm Animals. Philadelphia: Lea and Febiger.
Herdis, Toliehere MR, Supriatna I, Purwantara B, Adikara RTS. 2003. Integritas dan daya hidup spermatozoa pada pembekuan semen domba garut (Ovis arios) dengan pengencer dasar tris susu skim dan kuning telur. J Sains dan Teknol Indo 2 (3): 62-68.
Jeyendran RS, Van der Ven HH, Perez-Pelaez M, Crabo BG, Zaneveld LJ. 1984.
Development of an assay to assess the functional integrity of the human sperm membrane and its relationship to other semen characteristics. J Reprod Fertil 70: 21 9-228.
Khalil AAY, Petrunkina AM, Sahin E, Waberski D, To¨pfer-Petersen E. 2006.
Enhanced binding of sperm with superior volume regulation to oviductal epithelium. J of Andrology 27: 754–765.
Morrell JM, Johannisson A, Dalin A-M. 2008. Sperm morphology and chromatin integrity on Swedish warmblood stallions and their relationship to pregnancy rates. Acta Vet Scand 50: 2.
Morrell JM, Rodriguez-Martinez H. 2009. Biomimetic techniques for improving sperm quality in animal breeding: a review. The open Andr J: 1-9.
Nawang SS. 2005. Integritas membran spermatozoa mencit pada pemberian per oral fasa air daun Justicia gendarussa Burm.f dengan metode hypo-osmotic swelling test [skripsi]. Surabaya: Fakultas Farmasi, Universitas Airlangga.
Neild D, Chaves G, Flores M, Mora N, Beconi M, Agüero A. 1999. Hypoosmotic test in equine spermatozoa. Theriogenology 51:721-727.
Petrunkina AM, Waberski D, Gunzel-Apel AR, Topfer-Peterson E. 2007.
Determinants of sperm quality and fertility in domestic species. Society for
Reprod and Fertil: 1470-1626.
Polge C, Smith AU, Parkes AS. 1949. Revival of spermatozoa after vitrification and dehydration at low temperatures. Nature 164: 666– 676.
Revell SG, Mrode RA. 1994. An osmotic resistance test for bovine semen. Anim Reprod Sci 36: 77-86.
Rizal M, Herdis. 2005. Daya hidup spermatozoa epididimis domba garut yang dikriopreservasi menggunakan modifikasi pengencer tris. Hayati 12 (2): 61- 66.
Rodriguez-Martinez H. 2003. Laboratory semen assessment and prediction of fertility: still utopia? Reprod Domest Anim 38: 312–318.
Rodríguez-Martinez H. 2007. State of the art in farm animal sperm evaluation.
Reprod Fertil Dev 19: 91-101.
Rota A, Penzo N, Vincenti L, Mantovani R. 1999. Hypoosotic swelling (HOS) as a screening assay for testing in vitro fertility of bovine spermatozoa.
Theriogenology 53: 1415-1420.
Ruiz-Sanchez AL, O’Donoghue R, Novak S, Dyck MK, Cosgrove JR, Dixon WT, Foxcroft GR. 2006. The predictive value of routine semen evaluation and IVF technology for determining relative boar fertility. Theriogenology 66:
736–748.
Rusiyantono Y. 2004. Toxicity and viability of goat embryos in freezing process using vitrification methods. J. Agroland 11(1): 104-108.
Rusiyantono Y. 2008. Penambahan krioprotektan dalam bahan pengencer untuk pembuatan semen baku melalui teknologi sederhana dalam menunjang pelaksanaan IB di daerah. Prosiding Seminar Nasional Sapi Potong.
Saili T, Setiadi MA, Agungpriyono S, Toliehere MR, Boediono A. 2010.
Pengaruh pengeringbekuan terhadap morfologi spermatozoa domba.
[Terhubung bererkala].
http://takdirsaili.wordpress.com/2010/02/03/pengaruh-pengeringbekuan/ [28 Januari 2012]
Salisbury GW, VanDemark NL. 1985. Fisiologi Reproduksi dan Inseminasi Buatan pada Sapi. Yogyakarta: Gadjah Mada University Pess.
Schuh H. 2001. Comparison between liquid and deep frozen semen for artificial insemination in developing countries. [Terhubung Berkala]
http://www.fao.org/ag/aga/agap/war/warall/u6600b0m.htm [28 Januari 2012]
Supriatna I, Pasaribu FH. 1992. In vitro fertilisasi, transfer embrio dan pembekuan embrio. Bogor: Direktorat Jendral Pendidikan Tinggi. Pusat Antar Universitas.
Vercarcel A, de las Heras MA, Peres L, Moses DF, Baldassare H. 1997.
Assessment of membrane-intact ram spermatozoa after freezing and
thawing, by stimulaneous lectin/Hoechst 332558 staining. Anim Reprod Sci
(45)4: 299-309.
Yanti D. 2005. Kaji banding kualitas semen beku sapi FH (Frisien Holstein) menggunakan pengencer dari berbagai Balai Inseminasi Buatan di Indonesia [Skripsi]. Bogor: Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Yeung CH, Sonnenberg-Riethmacher E, Cooper TG. 1999. Infertile spermatozoa of c-ros tyrosine kinase receptor knockout mice show flagellar angulation and maturational defects in cell volume regulatory mechanisms. Biol of Reprod 61: 1062–1069.
Yulnawati, Setiadi MA. 2005. Motilitas dan keutuhan membran plasma spermatozoa epididimis kucing selama penyimpanan pada suhu 4 °C. Media Kedokteran Hewan Vol. 21, No. 3.
Zesfin Z, Putra ZD, Ramadaleni. 2001. Potensi spermatozoa pada epididymis testis sapi pesisir. Panduan Seminar dan Abstrak. Pengembangan Peternakan Berbasis Sumberdaya Lokal. Fakultas Peternakan Institut Pertanian Bogor.
Zou CX, Yang ZM. 2000. Evaluation on sperm quality of freshly ejaculated boar
semen during in vitro storage under different temperatures. Theriogenology
53: 1477-1488.
LAMPIRAN
Lampiran 1 Persentase spermatozoa sapi Limousin bereaksi terhadap larutan hipoosmotik
no batch straw waktu
0 15 30 45 60
80869.2 31,51 37,62 51,22 51,78 49,47
80868.3 19,79 50 54,84 62,96 57,14
80755.2 24 30,23 38,89 50,38 49,02
80755.3 39,13 45,16 51,51 63,64 61,22
80755.4 23,86 49,81 50,76 45,83 34,16
80869.4 21,43 48,15 45,83 45,83 42,37
80872.2 27,42 65,18 51,09 34,1 31,25
80872.5 53,09 61,97 66,67 45,45 39,58
80869.6 31,82 42,86 52,43 53,12 33,8
80868.6 22,73 37,04 57,89 56,06 38
80868.7 44,12 51,85 56,18 63,46 36,58
80872.6 30,43 33,33 64,44 58,06 50
80872.7 36,58 50 59,42 52,94 47,37
80755.6 50 50 53,64 48,98 31,34
80755.7 41,46 50 53,68 54,54 35,56
rata2 33,158 46,88 53,8993333 52,4753333 42,45733 sd 10,5478103 9,632353962 6,813794272 8,002651227 9,4269973
Lampiran 2 Persentase spermatozoa sapi FH bereaksi terhadap larutan hipoosmotik
no batch straw waktu
0 15 30 45 60
30697.2 25,93 40 50 51,35 37,78
30697.3 34,15 34,88 41,86 41,02 26,78
30697.4 27,5 30,35 36,73 42 30
30693.2 25 29,03 42,11 43,02 36,96
30693.3 20 29,27 46,67 56,52 53,53
30693.4 34,02 42,31 41,93 49,27 13,14
30185.1 26,47 32,14 37,93 48,15 36
30185.2 23,08 44,44 55,56 57,5 41,03
30185.3 39,65 43,75 52,5 50 37,1
30693.5 22,5 30,95 43,33 35,94 29,69
30693.6 20 27,03 32,5 45,45 40,28
30693.7 36,96 43,88 45,9 40,91 39,13
30697.5 24,59 41,38 48,93 28,57 23,08
30185.5 23,08 35,05 41,82 46,85 23,08
30185.6 25 35,05 50 30,43 30
rata2 27,19533 35,96733 44,518 44,46533 33,172
sd 6,115095 6,140345 6,259212 8,415876 9,633684
Lampiran 3 Uji statistik data spermatozoa sapi Limousin dangan uji Duncan
The SAS System 10:35 Thursday, April 1, 2012 1 The GLM Procedure Class Level Information Class Levels Values perlakuan 5 1 2 3 4 5
Number of Observations Read 75 Number of Observations Used 75
The SAS System 10:35 Thursday, April 1, 2012 2 The GLM Procedure Dependent Variable: respon
Sum of
Source DF Squares Mean Square F Value Pr > F
Model 4 4234.738200 1058.684550 13.12 <.0001
Error 70 5647.278600 80.675409 Corrected Total 74 9882.016800
R-Square Coeff Var Root MSE respon Mean
0.428530 19.62238 8.981949 45.77400
Source DF Type I SS Mean Square F Value Pr > F
perlakuan 4 4234.738200 1058.684550 13.12 <.0001
Source DF Type III SS Mean Square F Value Pr > F
perlakuan 4 4234.738200 1058.684550 13.12 <.0001
The GLM Procedure
Duncan's Multiple Range Test for respon NOTE: This test controls the Type I comparisonwise error rate, not the experimentwise error
rate.
Alpha 0.05 Error Degrees of Freedom 70 Error Mean Square 80.67541
Number of Means 2 3 4 5
Critical Range 6.541 6.882 7.108 7.272
Means with the same letter are not significantly different.
Duncan Grouping Mean N perlakuan A 53.899 15 3
A
B A 52.475 15 4 B
B C 46.880 15 2 C
C 42.457 15 5 D 33.158 15 1