BIOAKTIVITAS BUAH KAWISTA (
Limonia acidissima
) BIMA
DAN PENENTUAN SIDIK JARINYA MENGGUNAKAN
KROMATOGRAFI LAPIS TIPIS
RESVINA DEWI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Bioaktivitas Buah Kawista (Limonia acidissima)dan Penentuan Sidik Jarinya Menggunakan Kromatografi Lapis Tipis adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari2013
ABSTRAK
RESVINA DEWI. Bioaktivitas Buah Kawista (Limonia acidissima)Bimadan Penentuan Sidik Jarinya Menggunakan Kromatografi Lapis Tipis. Dibimbing oleh LATIFAH K. DARUSMAN dan RUDI HERYANTO.
Buah kawista merupakan buah tropis yang memiliki aktivitas antioksidan. Aktivitas antioksidan pada buah ini akan dipengaruhi oleh perbedaan tingkat kematangannya. Penelitian ini bertujuan menganalisis aktivitas antioksidan buah kawista dan mengembangkan analisis sidik jarinya dengan metode kromatografi lapis tipis (KLT) yang dikembangkan menjadi densitogram. Penentuan sidik jari diperlukan dalam menentukan mutu bahan baku. Sidik jari dikembangkan dalam bentuk pola KLT. Pola KLT tersebut diolah dengan perangkat lunak ImageJ menjadi densitogram. Buah kawista pada 3 tingkat kematangan berbeda diekstraksi dengan pelarut metanol. Ekstraktersebut positif mengandung flavonoid, saponin dan tanin yang diuji secara kualitatif. Nilai IC50
yang terbaik diperoleh dari ekstrak buah matang dan ekstrak buah tua hasil hidrolisis dalam metanol. Nilai IC50 berturut-turut sebesar 97.78 µg/mL dan 320.70 µg/mL. Nilai
LC50yang terbaik diperoleh dari ekstrak buah matang dalam etil asetat dan hasil hidrolisis
dalam metanol dengan nilai 58.71 µg/mL dan 64.15 µg/mL. Sidik jari dengan spot terbanyak dan keterpisahan densitogram terbaik diperoleh pada komposisi pelarut kloroform:etil asetat:asam format:asam asetat dengan nisbah (6:3:1:0.5). Hal ini ditunjukkan dari densitogram hasil evaluasi KLT dengan piranti lunak
imageJmenghasilkan densitogram dengan keterpisahan yang baik serta jumlah spot yang banyak, sehingga dapat dijadikan suatu kendali mutu dari ekstrak kawista sebagai antioksidan.
Kata kunci: analisis sidik jari, bioaktivitas, ImageJ, kawista, KLT
ABSTRACT
RESVINADEWI Bioactivityof Kawista(Limonia acidisima) BimaFruit
andDeterminationof FingerprintwithThin Layer Chromatography Supervised byLATIFAHK.DARUSMANandRUDI HERYANTO.
Kawistais a tropical fruitwichhas antioxidant activity. The antioxidant activity ofthefruitis affected by the maturity ofthe fruit.The objectives of atudy we are toanalyze theantioxidantactivity ofthefruit andfingerprintanalysiswiththin layer chromatography (TLC)methodthatwas developedtoa densitogram. Determination offingerprintis requiredin determining the qualityof raw materials. The fingerprint was developedin TLCpatterns. The TLC patterns we are analysed by ImageJ software and produce densitogram. Three different maturity levels of kawista fruit were extracted with methanol solvent. These extracts were positively contained flvanoid, saponin and tanins that had been qualitatively tested. The best value of IC50was from ripe fruit and old fruit hydrolyzed in methanol.
The IC50we are97.78 µg/mL and 320.70 µg/mL. The best value of LC50is from ripe fruit
extract in both solvents, ethyl acetat and methanol. The value of LC50we are 58.71 and
64.15 µg/mL. The fingerprint witha lot spotand
thebestdensitogramseparationobtainedon the composition ofthe solvent
combination of chloroform:ethyl acetate:formicat acid:acetate acid, with comparison 6:3:1:0.5. This was based on densitogram with good resolution and high number of spots. Therefore it can be usedin quality control of kawista extract as an antioxidant.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tidak merugikan kepentingan IPB
BIOAKTIVITAS BUAH KAWISTA (
Limonia acidissima
) BIMA
DAN PENENTUAN SIDIK JARINYA MENGGUNAKAN
KROMATOGRAFI LAPIS TIPIS
RESVINA DEWI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Bioaktivitas Buah Kawista (Limonia acidissima)dan Penentuan Sidik Jarinya Menggunakan Kromatografi Lapis Tipis
Nama : Resvina Dewi
NIM : G44080001
Disetujui oleh
Prof Dr Ir Latifah K Darusman, MS Pembimbing I
Rudi Heryanto, SSi, MSi Pembimbing II
Diketahui oleh
Prof Dr Ir Tun Tedja Irawadi, MS Ketua Departemen Kimia
PRAKATA
Segala puji dan syukur penulis ucapkan kehadirat Allah SWT yang senantiasa memberikan rahmat dan hidah-Nya sehingga penulis dapat menyelesaikan karya ilmiah berjudul “Bioaktivitas Buah Kawista (Limonia acidissima)dan Penentuan Sidik Jarinya Menggunakan Kromatografi Lapis
Tipis”.Penelitian ini bertujuan mengetahui aktivitas antioksidan dari buah kawista
dengan perbedaan umur buah serta sidik jarinya dengan metode kromatografi lapis tipis. Penelitian ini dilakukan sejak April 2012 sampai November 2012 di Laboratorium Kimia Analitik, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam dan Laboratorium Uji Pusat Studi Biofarmaka, Institut Pertanian Bogor.
Penulis menyampaikan ucapan terima kasih kepada Ibu Prof. Dr. Ir. Latifah K Darusman, MS dan Bapak Rudi Heryanto, S.Si, M.Si selaku pembimbing yang selalu memberi bimbingan, motivasi dan saran selama penelitian dan penyusunan karya ilmiah ini. Ucapan terima kasih yang sedalam-dalamnya kepada kedua orangtua, adik-adik tercinta dan Agus M. Hasbi atas doa, dukungan, kasih sayang serta semangat yang telah diberikan. Terima kasih pula penulis ucapkan kepada staf dan peneliti di PSB-IPB(Mbak Salina, Mas Antonio, Pak Zaim, Mbak Wiwi, Ibu Nunuk, Mbak Kiki dan Mas Endi) dan bagian Laboratorium Kimia Analitik (Pak Eman, Bu Nunung, Pak Ridwan dan Pak Kosasih) yang telah membantu dalam penelitian ini. Ucapan terimakasih saya sampaikan kepada teman-teman
kimia 45 atas dukungan, do’a dan kebersamaannya selama 3 tahun di kimia.
Bogor, Februari 2013
DAFTAR ISI
DAFTAR TABEL x
DAFTAR GAMBAR x
DAFTAR LAMPIRAN x
PENDAHULUAN 1
TINJAUAN PUSTAKA 2
Kawista dan Keragaman Kimiawinya 2
Bioaktivitas Buah Kawista 4
Analisis Kendali Mutu dengan Metode KLT 6
Optimasi Analisis Sidik Jari 6
METODE 8
Alat dan Bahan 8
Metode 8
HASIL DAN PEMBAHASAN 12
Ekstrak dan Karakteristik Fitokimia Buah Kawista 12
Aktivitas Antioksidan Ekstrak Kawista 14
Toksisitas Ekstrak Kawista 15
Sidik Jari Ekstrak Kawista dengan KLT 16
Evaluasi KLT dengan Piranti Lunak ImageJ 19
SIMPULAN DAN SARAN 22
Simpulan 22
DAFTAR PUSTAKA 22
DAFTAR TABEL
1 Rancangan komposisi fase gerak 12
2 Uji fitokimia ekstrak buah kawista 14
3 Nilai aktivitas antioksidan buah kawista 15
4 Uji toksisitas ekstrak buah kawista 16
5 Jumlah spot hasil piranti lunak ImageJ 17
6 Jumlah spot eluen terbaik metode kedua 19
DAFTAR GAMBAR
1 Daun dan buah kawista 3
2 Strukturkumarin 4
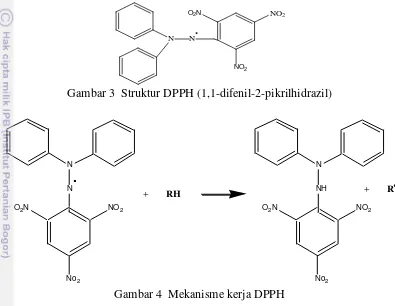
3 Struktur DPPH (1,1-difenil-2-pikrilhidrazil) 5
4 Mekanisme kerja DPPH 5
5 Sepuluh titik selektivitas Simplex Centroid Design 8
6 Fitur ImageJ 8
7 Persen rendemen ekstrak buah kawista 14
8 Visualisasi gambar pada (a) UV 254 nm dan (b) UV 366 nm 18 9 Kromatogram buah kawista pada (a) UV 254 nm dan (b) UV 366 nm 18 10 Densitogram (a) kawista tua, (b) kawista matang, dan (c) standar kuersetin20 11 Densitogram (a) ekstrak kawista tua hasil hidrolisis dalam metanol;
(b) ekstrak kawista matang hasil hidrolisis dalam metanol; dan (c) standar
kuersetin 21
DAFTAR LAMPIRAN
1 Diagram alir penelitian 25
2 Kadar air buah kawista 26
3 Hasil rendemen ekstrak buah kawista27 4 Foto hasil uji fitokimia28
5 Data hasil uji aktivitas antioksidan dengan metode DPPH 30 6 Data uji toksisitas ekstrak buah kawista matang hasil partisi etil asetat
terhadap larva udang A. Salina 32
7 Hasil proses smoothing 34
1
PENDAHULUAN
Tanaman berpotensi obat banyak terdapat di Indonesia. Oleh karena itu saat ini banyak penelitian yang dilakukan peneliti Indonesia yang mengkaji potensi suatu tanaman asal Indonesia sebagai khasiat kesehatan. Saat ini pengobatan tradisional dengan menggunakan tanaman obat telah banyak digunakan karena memiliki beberapa keuntungan diantaranya lebih aman dan tidak memiliki resiko yang berarti bagi tubuh (Wijayakusuma 2000). Dewasa ini banyak tumbuhan di Indonesia yang telah diketahui potensinya sebagai obat, tetapi masih banyak tanaman yang memiliki potensi sebagai tanaman obat belum diketahui manfaat utuhnya di Indonesia, salah satunya adalah kawista asal Kota Bima, Nusa Tenggara Barat.
Kawista atau Limonia acidissima merupakan tanaman asal Family Rutaceae (jeruk-jerukan) dengan genus Feronia. Tumbuhan ini sebagian besar banyak tumbuh pada daerah tropis. Buah ini berasal dari India dan Sri Lanka, tetapi saat ini kawista telah menyebar ke seluruh dunia, terutama di kawasan Asia Tenggara. Limonia acidissimatelah dikenal sebagai tanaman obat kuno Yunani dan Romawi serta menjadi tanaman obat paling penting di India, karena kandungan antioksidan buah ini sangat tinggi (Thakur et al. 2010). Prospek kawista kedepannya sangat besar untuk dikembangkan karena didukung oleh beberapa faktor, terutama keunggulan komperatif daerah tropis dan dukungan pemerintah. Kondisi Indonesia yang beriklim tropis menjadikan tanaman kawista mudah tumbuh dan berkembang. Hingga saat ini tercatat bahwa tanaman kawista tersebar di berbagai daerah di Indonesia seperti pulau Jawa, pulau Sumatera, Nusa tenggara, dan Sulewesi (Ghiselli 1998; Shui 2004).
Buah kawista yang matang mempunyai khasiat sebagai obat, yaitu untuk menurunkan panas, pengelat dan bersifat tonikum, dan obat sakit perut. Di Indo-Cina, duri dan kulit batang kawista digunakan dalam berbagai ramuan obat tradisional untuk mengobati haid yang berlebihan, gangguan hati, gigitan dan sengatan binatang, dan untuk mengobati mual-mual (Sukamto 1999). Menurut Ilango et al. (2009) buah kawista dapat digunakan dalam pengobatan tumor, asma, sembelit, lemah jantung, dan hepatitis. Hasil penelitian menyatakan bahwa buah kawista mengandung flavonoid, glikosida, saponin, tanin, kumarin, dan turunan tiramin. Banyak penelitian yang telah menyatakan bahwa buah kawista yang matang memiliki potensi sebagai tanaman obat karena memiliki banyak khasiat, salah satunya adalah sebagai antioksidan. Aktivitas antioksidan dipengaruhi oleh komponen kimia dalam buah dan komponen kimia tersebut dapat dipengaruhi oleh tingkat kematangan dari buah tersebut. Selain berpotensi sebagai antioksidan buah kawista juga berpotensi sebagai antidiabetes serta daun kawista berpotensi sebagai anti hepatoprotektif. Pada cangkang buah dilaporkan memiliki senyawa anti jamur yaitu psoralena, xanthotoxin, 2,6-dimetoksibenzakuinon dan osthenolbersama dengan beberapa senyawa alkaloid, kumarin, flavonon, lignan, sterol dan triterpen yang ditemukan memilki aktivitas antimikroba.
digital kromatogramnya menjadi densitogram yang kedepannya dapat digunakan sebagai metode kendali mutu.
Analisis sidik jari merupakan metode yang digunakan sebagai kendali mutu dalam suatu proses produksi, metode ini dapat menyajikan informasi yang spesifik secara menyeluruh dari suatu sampel (Liang et al. 2004). Analisis sidik jari menggunakan KLT telah banyak digunakan oleh industri obat di Amerika, Eropa, dan Cina karena adanya beberapa keuntungan dalam penggunaanya, yaitu sederhana, selektif dan sensitif, cepat, biaya relatif murah, dapat mengujikan beberapa sampel dalam waktu bersamaan, kromatogramnya dapat dilihat secara visual, dan penggunaan pelarut yang sedikit (Liang et al. 2004).
Penelitian ini menggunakan metode DE-TLC dengan bantuan piranti perangkat lunak ImageJ. Metode digitally enchanced thin layer chromatography (DE-TLC) merupakan penggabungan metode fotografi dengan KLT konvensional yang dapat digunakan untuk menganalisis secara kuantitatif maupun kualitatif dengan menggunakan bantuan perangkat lunak pengolah gambar (Hess 2007). Peranti lunak Image J adalah suatu piranti lunak untuk mengolah gambar yang berbasiskan program Java dan dapat diperoleh secara bebas untuk umum. Program ini dikembangkan oleh reseach service branch (RSB), Institut Nasional Kesehatan Mental (NIMH), bagian dari Institut Kesehatan Nasional (NH), Batesdha, Maryland, USA (Ferreira dan Rasband 2011).
TINJAUAN PUSTAKA
Kawista dan Keragaman Kimiawinya
Kawista atau Limonia acidissima merupakan jenis tanaman yang termasuk ke dalam suku jeruk-jerukan (Rutaceae). Tanaman ini masih kerabat dekat dengan maja, yaitu sejenis jeruk-jerukan yang berasal dari Asia tropika dan subtoprika. Menurut Jones (1992) diacu dalam Sukamto (1999), tanaman kawista dahulunya berasal dari India terutama di daerah-daerah kering. Selain tumbuh subur di daerah kering India, tanaman ini diperkirakan pula tumbuh subur di daerah-daerah kering Srilanka, Myanmar, dan Indo-China. Kemudian menyebar ke Malaysia dan Indonesia. Tanaman ini biasanya tumbuh di daerah tropic mushon yang sewaktu-waktu mengalami musim kering. Mengenai adaptasinya, menurut Sukamto (1999), tanaman ini mempunyai adaptasi yang baik pada daerah yang kering dan tanah yang berpasir. Di Indonesia, kawista umumnya ditanam di pekarangan pada daerah pantai. Kawista diperoleh di padang-padang rumput yang kering terutama dekat laut dan kearah daratan tanaman ini sering ditanam. Karena persebarannya yang luas ini maka tanaman kawista memiliki nama-nama yang berbeda tergantung kepada daerahnya masing-masing. Nama-nama tersebut yaitu olifantsappel (Belanda), wood-apple (Inggris), maja (Jakarta), kawista (Sunda), kawis, kawista, kinca (Jawa), bila, kabista, karabista (Madura) (Sukamto 1999).
kantung-3
kantung minyak yang berbau aromatik bila diremas. Buah berbentuk bulat mencapai diameter 10 cm. Kulit buahnya tebal dan keras, mengelubak, berwarna putih keabuan. Daging buahnya berwarna merah kecoklatan menyerupai daging buah asam, beraroma yang khas. Buah mengandung biji-biji yang banyak, panjang 5-6 mm dan berambut (Jones 1992; Sukamto 1999).
Menurut Ilango et al. (2009) buah kawista dapat digunakan dalam pengobatan tumor, asma, sembelit, lemah jantung dan hepatitis. Hasil penelitian menyatakan bahwa buah kawista mengandung flavonoid, glikosida, saponin, tanin, kumarin (Gambar 2)dan turunan tiramin. Selain berpotensi sebagai antioksidan buah kawista juga berpotensi sebagai antidiabetes serta daunnya sebagai hepatoprotektif. Pada cangkang buah dilaporkan memiliki senyawa anti jamur, yaitu psoralena, xanthotoxin, 2,6-dimetoksibenzakuinon, dan ostenol. Kulit batang tanaman menghasilkan 2S-5,3-dihidroksi-4-metoksi-6,
6-dimetilkromeno-(7,8.2”,3”)-flavon bersama dengan beberapa senyawa alkaloid, kumarin, flavanon,
lignan, sterol dan triterpen yang ditemukan memiliki aktivitas antimikroba.
Gambar 1Daun dan buah kawista (Limonia acidissima)
Buah kawista mengandung berbagai macam metabolit sekunder yang bermanfaat untuk tubuh, salah satunya adalah flavonoid. Flavonoid merupakan senyawa metabolit sekunder yang terdapat pada tanaman hijau, kecuali alga. Flavonoid yang lazim ditemukan pada tumbuhan tingkat tinggi (Angiospermae) adalah flavon dan flavonol, isoflavon, flavanon, khalkon, dan dihidrokhalkon, proantosianidin,dan lain sebagainya. Golongan flavon, flavonol, flavanon, isoflavon, dan khalkon juga sering ditemukan dalam bentuk aglikonnya. Menurut Markham (1988), flavonoid tersusun dari dua cincin aromatis yang dapat atau tidak dapat membentuk cincin ketiga dengan susunan C6-C3-C6.
O O
Gambar 2 Struktur kumarin
satu contohnya adalah flavonol dan flavononol merupakan senyawa yang terdapat dalam tumbuhan berpembuluh (Markham 1998).
Bioaktivitas Buah Kawista
Banyak penelitian yang telah menyatakan bahwa buah kawista memiliki berbagai macam bioaktivitas, salah satunya, yaitu aktivitas antioksidan. Antioksidan dinyatakan sebagai senyawa yang secara nyata dapat memperlambat oksidasi, walaupun dengan konsentrasi yang lebih rendah dibandingkan dengan substrat yang dapat dioksidasi. Antioksidan merupakan senyawa yang terdapat dalam membran sel maupun ruang ekstra sel yang mempunyai sifat dapat menghambat atau mencegah kehancuran sel akibat reaksi oksidasi. Selain itu, antioksidan dapat menangkap berbagai jenis oksidasi yang bersifat reaktif (O2-, H2O2, -OH, -HOCl, dsb), dengan cara mengubah pembentukan molekul radikal bebas atau dengan memperbaiki kerusakan-kerusakan yang diakibatkannya (Widjaja 1997). Oleh karena itu, antioksidan merupakan substansi yang diperlukan tubuh untuk menetralisir radikal bebas dan mencegah kerusakan yang ditimbulkan oleh radikal bebas.
Radikal bebas merupakan molekul atau atom yang yang tidak stabil karena memiliki satu atau lebih elektron yang tidak berpasangan pada orbital terluarnya. Radikal bebas merupakan substansi reaktif yang dibentuk dalam sel-sel tubuh sebagai hasil proses metabolisme. Radikal bebas sangat berbahaya karena kereaktifannya dalam mencari pasangan elektronnya, bereaksi dengan cepat pada biomolekul melalui banyak jenis reaksi, antara lain penangkapan hidrogen, donor elektron dan penangkapan elektron bersama. Reaksi ini akan berlangsung terus-menerus dalam tubuh dan bila tidak dihentikan akan menimbulkan berbagai penyakit. Untuk itu, tubuh memerlukan suatu antioksidan karena mampu menangkap radikal bebas tersebut, sehingga tidak dapat menginduksi sebagai penyakit (Ng 2000; Pourmorad 2006). Berdasarkan sumber antioksidan dibagi menjadi dua kelompok, yaitu antioksidan sintetik (antioksidan yang diperoleh dari hasil sintesa reaksi kimia) dan antioksidan alami (antioksidan hasil ekstraksi bahan alami). Antioksidan sintetik yang diizinkan dalam pangan diantaranya butylated hydroxyanisol (BHA), butylated hydroxytoluene (BHT), propil galat, dan tokoferol (Pourmorad 2006).
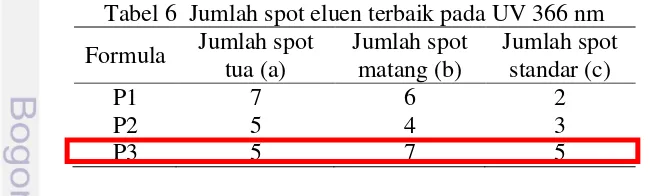
Penentuan aktivitas antioksidan dalam suatu ekstrak metabolit sekunder tanaman dapat digunakan berbagai macam metode salah satunya, yaitu metode DPPH. DPPH (1,1-difenil-2-pikrilhidrazil) merupakan senyawa radikal bebas yang relatif stabil apabila disimpan dalam kondisi penyimpanan yang baik. Metode DPPH ini dapat digunakan untuk menentukan IC50, yaitu konsentrasi yang efektif untuk menghambat 50% dari proses oksidasi oleh radikal bebas (Molyneux 2004). Metode uji antioksidan DPPH dipilih karena memilki beberapa keuntungan diantaranya sederhana dalam proses pengerjaannya, memerlukan waktu pengerjaan yang singkat dalam mengevaluasi aktivitas antioksidan dari ekstrak bahan alam. Senyawa DPPH merupakan senyawa radikal bebas yang relatif stabil apabila disimpan dalam kondisi penyimpanan yang baik.
5
elektronnya tidak berpasangan sehingga bila senyawa tersebut dilarutkan dalam etanol atau metanol akan memberikan warna ungu. Apabila DPPH bereaksi dengan senyawa yang mempunyai daya antioksidan maka akan memudarkan warna ungu dari larutan DPPH karena terjadi pengikatan satu elektron atom yang tidak berpasangan membentuk difenil picrylhidrazin yang stabil. Pada spektrofotometer dapat diamati pada panjang gelombang 518 nm.Mekanisme reaksi dapat dilihat pada Gambar 4 (Molyneux 2004).
N N.
NO2
O2N NO2
Gambar 3 Struktur DPPH (1,1-difenil-2-pikrilhidrazil)
N
Gambar 4 Mekanisme kerja DPPH
Selain aktivitas antioksidan, buah kawista juga memiliki aktivitas toksik yang baik. Uji toksisitas merupakan uji pendahuluan untuk mengamati aktivitas farmakologi suatu senyawa. Larva udang memiliki kulit yang tipis dan peka terhadap lingkungannya sehingga banyak digunakan dalam uji toksisitas. Zat atau senyawa asing yang ada di lingkungan akan terserap ke dalam tubuh secara difusi dan langsung mempengaruhi kehidupannya. Prinsip uji toksisitas adalah bahwa komponen bioaktif selalu bersifat toksik jika diberikan dengan dosis rendah (Hamburger dan Hostettman 1991). Uji toksisitas ini dapat menentukan suatu bioaktivitas suatu tanaman yang berpotensi sebagai anti kanker.
Analisis Kendali Mutu dengan Metode KLT
Kromatografi lapis tipis (KLT) dikenal sebagai kromatografi planar, merupakan teknik yang digunakan untuk memisahkan campuran komponen berdasarkan distribusi komponen tersebut di antara dua fase, yaitu fase diam dan fase gerak. Prinsip KLT adalah cuplikan atau contoh diteteskan pada lapisan tipis kemudian dimasukkan ke dalam wadah berisi fase gerak sehingga cuplikan tersebut terpisah menjadi komponen-komponennya. Setiap komponen akan bergerak dengan laju tertentu yang dinyatakan dengan faktor retensi (Rf), yaitu perbandingan antara jarak yang ditempuh fase gerak dengan jarak komponen. Komponen yang mempunyai afinitas yang besar terhadap fase gerak atau afinitas yang lebih kecil terhadap fase diam akan bergerak lebih cepat daripada komponen yang mempunyai sifat sebaliknya (Gritter et al. 1991).
Fase diam dalam KLT yaitu lapisan tipis silika gel, alumunium oksida, atau selulosa sebagai fase diam yang dilapiskan pada gelas, kaca atau logam. Fase geraknya adalah pelarut campuran yang ditempatkan dalam bejana pengembang. Pemilihan pelarut yang digunakan berdasarkan nilai konstanta dielektrik dari pelarut yang digunakan, semakin tinggi nilai konstanta dielektriknya maka pelarut tersebut berifat polar. Penelitian yang dilakukan menggunakan campuran pelarut yang memiliki sifat polar, semipolar, dan nonpolar. Pelarut yang digunakan adalah pelarut yang dapat memisahkan komponen yang diharapkan sama dengan standar yang akan digunakan. Saat ini telah dikembangkan metode KLT semiautomatis Camag Linomat. Alat ini dikendalikan oleh suau mikroprosesor yang menyebabkan larutan ekstrak dapat ditotolkan pada pelat KLT dan biasanya dalam bentuk pita dengan mengkompresikan tekanan udara atau nitrogen, sehingga tidak memerlukan kontak langsung dengan pelat dan dapat mengurangi kerusakan alat (Fitrianti 2011).
Metode KLT telah banyak digunakan dalam berbagai penelitian salah satunya digunakan dalam penentuan analisis sidik jari. Analisis sidik jari adalah analisis yang dapat dimanfaatkan untuk evaluasi dan kontrol kualitas multikomponen dari tanaman obat. Komponen kimia dalam tanaman obat sangat bergantung pada musim panen, sumber tanaman, proses pengeringan dan faktor lainnya, sehingga perlu dilakukan penentuan komponen kimia dalam tanaman obat untuk menjamin kepercayaan dalam mengetahui efek samping dari komponen aktif (Borges et al. 2007).
Banyak penelitian yang telah menggunakan metode KLT dalam menentukan kendali mutu suatu kualitas multikomponen salah satunya, yaitu Andhika (2011) menggunakan metode KLT untuk menentukan kualitas multikomponen daun jambu biji sebagai tanaman yang memiliki aktivitas antioksidan. Metode sidik jari dapat membantu mengetahui senyawa penciri dari suatu bahan alam yang ingin diketahui secara pasti dengan menggunakan bentuk dan pola kurva atau grafik yang ditunjukkan dari suatu teknik analisis (Khanpara et al. 2010).
Optimasi Analisis Sidik Jari
7
untuk visualisasi KLT. Optimasi sidik jari dilakukan dengan beberapa tahap, yaitu menentukan fase gerak terbaik dengan menggunakan suatu rancangan campuran, pemilihan panjang gelombang yang sesuai untuk visualisasi KLT, dan mengolah gambar hasil visualisasi KLT dengan bantuan piranti lunak ImageJ. Tahap pertama dilakukan pemilihan pelarut dengan bantuan rancangan campuran. Rancangan campuran adalah kelas rancangan permukaan respon dengan jumlah dari semua komponen adalah satu. Rancangan campuran merupakan rancangan yang digunakan pada percobaan dengan campuran bahan. Dalam rancangan ini, faktornya adalah komponen atau bahan dari campuran sehingga taraf dari masing-masing faktor tidak saling bebas (Montgomery 1991). Rancangan campuran digunakaan saat suatu sistem terdiri atas campuran beberapa komponen yang jumlah totalnya konstan, yaitu 100%.
Respon yang diperoleh merupakan fungsi dari proporsi relatif tiap komponen dalam sistem. Pada rancangan campuran dapat digunakan dua komponen atau lebih. Bertambahnya jumlah komponen yang terlibat akan menambah jumlah dimensi ruang yang dipakai untuk menggambarkan campuran. Objek paling sederhana yang menggambarkan dimensi campuran disebut sebagai simplex (Brereton 2005). Rancangan simplex centroid dengan axial design dapat digambarkan dalam bentuk segitiga pada Gambar 5 saat digunakan tiga komponen, rancangan campuran dapat mengikuti raancangan simplex-latitice, simplex-centroid, maupun simplex centroid dengan axial design.
Gambar 5Sepuluh titik selektivitas Simplex Centroid Design
Simplex centroid diperkenalkan oleh Scheffe pada tahun 1963 untuk memberikan ulasan percobaan dari respon permukaan dibagian tengah bidang. Salah satu cara untuk menggambarkan model adalah mempertimbangkan struktur dari percobaan tiga faktor. Titik tengah ditempatkan dalam model dengan menemukan rata-rata tingkatan dari semua faktor yang terlibat. Penelitian mengenai pengoptimuman fase gerak menggunakan simplex centroid design (SCD) telah dilakukan oleh Borges et al. (2007) serta Soares et al. (2007).
Institute of Mental Health (NH), Bathesda, Maryland, USA (Ferreria dan Rasband 2011).
ImageJ dapat menghitung area dan piksel dari suatu gambar, mengikuti jarak, sudut, membuat profil dari densitogram, dan garis kurva. Program ini didukung dengan pengatur gambar seperti pengatur ketajaman, kehalusan, kecerahan, warna, sudut dan penyaring dari gambar yang akan diolah (Hess 2007). ImageJ membantu stacks (menganalisis, memproses, menyimpan, dan mencetak 8-bit, 16-bit, dan 32-bit gambar). Program ini dapat membaca gambar yang berasal dari daerah Bima-NTB. Seluruh buah tua dan muda berasal dari satu pohon, sedangkan buah kawista matang berasal dari berabagai pohon, metanol, n-heksana, HCl 2 N, etil asetat, serbuk DPPH, etanol, DMSO, kloroform dan aseton. Alat-alat yang digunakan, antara lain multi-well plate reader, multi-plate, KLT Camag Linomat V dan Camag Reportsar serta alat-alat lain yang lazim digunakan di laboratorium.
Metode
Metode penelitian secara umum mengikuti diagram alir pada Lampiran 1 yang meliputi preparasi sampel, penentuan kadar air, ekstraksi sampel, uji antioksidan, uji toksisitas, dan penentuan sidik jari menggunakan KLT.
Preparasi sampel
9
diserut atau dikikis dengan menggunakan sendok. Selanjutnya hasil serutan dijemur menggunakan sinar matahari hingga kering, sehingga diperoleh sampel berupa simplisia. Simplisia tersebut digiling sehingga diperoleh sampel berupa
serbuk dengan ukuran 30−45 mesh.
Penentuan Kadar Air (AOAC 2007)
Cawan porselin dipanaskan pada suhu 105°C selama 30 menit kemudian didinginkan dalam desikator dan ditimbang. Sebanyak 2 g sampel serbuk dimasukkan ke dalam cawan dan dimasukkan ke dalam oven pada suhu 105°C selama 5 jam ke dalam oven hingga diperoleh bobot konstan, kemudian didinginkan dalam desikator dan ditimbang. Kadar air contoh dapat ditentukan dengan persamaan:
Keterangan:
A= Bobot sampel awal sebelum dikeringkan dengan oven (g) B = Bobot sampel setelah dikeringkan dengan oven (g)
Ekstraksi Sampel
Sampel serbuk buah kawista diekstrak dengan metode maserasi menggunakan pelarut metanol (Thakur et al. 2010). Ekstraksi dilakukan selama 24 jam 3 kali perendaman, 3 kali penyaringan, dan 3 kali ulangan. Selanjutnya filtrasi dari metanol dipartisi dengan menggunakan n-heksana dengan tujuan melepas komponen lemaknya (Harbone 1987). Hasil partisi pada fase organik (pelarut metanol) diambil dan dipekatkan hingga diperoleh 1/10 dari volume awal. Dilanjutkan dengan hidrolisis larutan tersebut dengan menggunakan HCl 2N (1:1) pada suhu 95°C selama 60 menit (Thakur et al. 2010).
Hasil hidrolisis dipartisi dengan menggunakan etil asetat sebanyak 3 kali ulangan dengan perbandingan volume 1:1,sehingga diperoleh 2 larutan yang berdeda kepolarannya. Kedua hasil ekstraksi tersebut dipekatkan dengan penguap putar pada suhu 40°C.
Uji Fitokimia (Harbone 1987)
Uji Flavonoid. Ekstrak buah kawista ditimbang sebanyak 0.1 g dan dilarutkan ke dalam 10 mL air panas. Sebanyak 5 mL filtrat direaksikan dengan 0.5 g serbuk mg, 2 mL alkohol klorohidrat (HCl 37% dan metanol 95% dengan volume 1:1) dan 2 mL amil alkohol. Kemudian dikocok dengan kuat. Hasil positif uji flavonoid ditunjukkan dengan perubahan warna menjadi warna jingga/kuning/merah pada lapisan amil alkohol.
Uji Saponin. Sebanyak 5 mL filtrat dari ekstrak 0.1 g dalam 10 mL air panas dimasukkan ke dalam tabung reaksi, kemudian dikocok dengan menggunakan vortex selama 10 detik. Hasil positif uji saponin akan menghasilkan buih yang stabil pada larutan.
tetes FeCl3 1%. Uji positif ditunjukkan adanya perubahan warna larutan menjadi hitam kehijauan.
Uji Alkaloid. Sejumlah 1 g ekstrak ditambah dengan 10 mL CHCl3 dan beberapa tetes NH4OH, kemudian disaring ke dalam tabung reaksi tertutup. Ekstrak kloroform dalam tabung reaksi dikocok dan ditetesi dengan 10 tetes larutan H2SO4 2 M dan lapisan asamnya dipisahkan ke dalam tabung reaksi lain. Lapisan asam diteteskan ke lempeng tetes dan ditambahkan pereaksi Mayer, Wagner, dan Dregendorf yang akan menimbulkan endapan dengan warna berturut-turut putih, cokelat, dan merah jingga jika ekstrak positif mengandung alkaloid.
Uji Aktivitas Antioksidan (Thakur et al. 2010)
Ekstrak pekat dilarutkan dengan pelarut DMSO beberapa tetes hingga larut kemudian ditera dengan pelarut etanol hingga diperoleh larutan stok dengan konsentrasi 1000 µg/mL. Sebanyak 100 µl larutan DPPH 125 µM dalam etanol ditambahkan ke dalam 100 µl larutan ekstrak sehingga volume total diperoleh sebesar 200 µl. Campuran larutan tersebut diinkubasi pada suhu 37°C selama 30 menit. Serapan larutan akan dibaca menggunakan multi-well plate reader pada panjang gelombang 517 nm. Larutan ekstrak yang memiliki aktivitas antioksidan akan mengubah warna larutan DPPH menjadi kuning. Kapasitas penangkapan radikal bebas DPPH dihitung dengan persamaan:
Nilai IC50 diperoleh dari persaman kurva regresi linier antara konsentrasi (sumbu x) dan % inhibisi (sumbu y).
Uji Toksisitas Buah Kawista (Shermin 2012)
Uji toksisitas dilakukan pertama kali dengan menetaskan telur larva Artemia salina dalam air laut selama 48 jam. Kemudian ekstrak pekat dilarutkan dengan larutan DMSO beberapa tetes hingga larut dan ditera dengan air laut hingga diperoleh konsentrasi stok sebesar 1000 µg/mL. Larutan stok diencerkan menjadi konsentrasi 400, 200, 100, 50, 25 dan 12.5 µg/mL. Sebanyak 1000 µl cairan air laut beserta 10 ekor larva udang dicampur dengan 1000 µl larutan standar ke dalam plat. Campuran tersebut diinkubasi pada suhu ruang selama 24 jam. Pengamatan dilakukan setelah 24 jam inkubasi. Larutan ekstrak yang memilki aktivitas toksisitas akan memiliki jumlah larva udang mati yang tinggi. Dengan menghitung % kematian larva dengan rumus sebagai berikut :
11
Analisis Sidik Jari Menggunakan Kromatografi Lapis Tipis (KLT)
Penentuan fase gerak. Instrumentasi dan kondisi alat KLT diaplikasikan dalam bentuk pit dengan lebar 5 mm pada silika gel F254 Merck menggunakan CAMAG Linomat V dilengkapi dengan perangkat lunak WinCATS yang dibantu dengan Camag Reporstar. Sampel diaplikasikan konstan dengan volume injeksi 10 µL dan jarak antara pita 5 mm. Twin trough chamber CAMAG dijenuhkan terlebih dahulu selama 30 menit dengan fase gerak yang telah ditentukan. Pelat KLT yang berisi cuplikan dimasukkan ke dalam bejana kromatografi. Pengembangan dilakukan hingga fase gerak mencapai jarak 0.5 cm dari tepi atas pelat kemudian diangkat dan dikeringkan terlebih dahulu sebelum diaplikasikan ke Camag Repostar.
Pemilihan Fase Gerak. Pemilihan fase gerak terbaik menggunakan dua metode, yaitu metode dengan menggunakan rancangan Simplex Centroid Desaign dan metode dengan mengkombinasikan pelarut terbaik sesuai zat aktif yang diduga ada pada sampel kawista. Metode dengan menggunakan rancangan SCD diawali dengan menggunakan 3 pelarut tunggal, yaitu asam format, kloroform dan etil asetat. Sebanyak 10 mL dari ketiga pelarut tersebut dimasukkan ke dalam bejana kromatografi kemudian dijenuhkan selama 30 menit. Pelat KLT yang telah ditotolkan sampel dimasukkan ke dalam bejana kromatografi dan dielusi dengan fase gerak sampai fase gerak mencai ±0.5 cm dari tepi atas pelat. Pelat KLT diangkat, dikeringkan dan dideteksi. Deteksi dilakukan untuk melihat pita yang muncul pada pelat KLT dengan cahaya UV 254, 366 nm dengan CAMAG Reporstar 3. Ketiga pelarut ini dikombinasikan berdasarkan kesepuluh perbandingan komposisi pelarut tersebut dapat dilihat pada Tabel 1.
Tabel 1 Rancangan komposisi fase gerak Fase
terbaik dari beberapa pustaka yang sering digunakan untuk pemisahan flavonoid seperti etil asetat, kloroform, dan sebagainya. Selain itu menurut Harborne (1987) menyatakan bahwa antosianin memiliki fase gerak terbaik, yaitu etil asetat : asam format : HCl 1%. Selanjutnya dari hasil kombinasi tersebut akan diolah dengan piranti lunak ImageJ.
Pengolahan gambar dengan ImageJ
Program ImageJ diaktifkan, dipilih menu File lalu Open, kemudian pilih gambar KLT yang sudah diambil dengan CAMAG® Repostar 3 format gambar dalam bentuk JPEG. Menu Rectangular diaktifkan dan tandai gambar. Kemudian pilih menu Analyze lalu pilih Gels, kemudian dipilih select first lane. Atur kontra dengan cara memilih menu 9 Image pilih Type pilih RGB Color, kemudian Adjust atur Brigthness dan Contrast sampai didapat gambar titik yang jelas. Kembali pilih menu Analyze lalu Gels kemudian plot lane maka akan tampil kurva yang sesuai dengan gambar titik pada KLT. Hasil Plot line tersebut kemudian diubah menjadi Line Graph dengan menggunakan Menu Analyze Line Graph. Kurva tersebut akan diolah dengan The Unscramble agar diperoleh kurva XYCoordinate yang menggambarkan hubungan antara luas area dengan nilai Rf. Selain itu dapat diperoleh puncak-puncak kurva yang menggambarkan jumlah pita KLT melalui proses smoothing.
Hasil pengolahan gambar dengan menggunakan ImageJ, maka akan diperoleh data jumlah pita KLT yang terdapat pada pelat KLT. Selanjutnya data tersebut dioptimasi dengan menggunakan analisis statistik Desain Expert versi 8.06 sehingga akan diperoleh model terbaik dalam pemilihan pelarut.
HASIL DAN PEMBAHASAN
Ekstrak dan Karakteristik FitokimiaBuah Kawista
Buah kawista yang dianalisis merupakan buah kawista yang berasal dari kota Bima-NTB. Pengambilan sampel dilakukan berdasarkan perbedaan diameter buahnya. Buah dengan diameter 6 sampai 7.6 cm dikategorikan sebagai buah muda dan buah berdiameter 8 hingga 8.5 cm dikategorikan sebagai buah tua, sedangkan buah matang berdiameter sekitar ±10 cm. Sampel buah kawista dibuat menjadi serbuk bertujuan agar memudahkan untuk mengekstrak zat aktifnya karena memiliki permukaan yang lebih luas, sehingga memudahkan pelarut mengambil zat aktifnya. Sebelum buah kawista di ekstraksi, buah kawista harus ditentukan kadar airnya terlebih dahulu karena akan berpengaruh pada proses penyimpanan sampel serta merupakan salah satu persyaratan sebagai obat tradisional dari Keputusan Menteri Kesehatan Republik Indonesia No. 661/Menkes/sk/vii/1994.
13
tua lebih besar dibandingkan buah kawista muda. Begitupun pada buah kawsita matang memiliki warna lebih merah gelap dan sangat berlendir, sehingga kadar airnya akan lebih tinggi daripada buah kawista muda dan tua. Hasil kadar air rerata ketiga jenis sampel buah kawista dibawah 10%. Hasil ini sesuai dengan Keputusan Menteri Kesehatan Republik Indonesia No. 661/Menkes/sk/vii/1994 mengenai persyaratan obat tradisional bahwa kadar air sediaan serbuk tidak lebih dari 10%. Kadar air suatu sampel akan mempengaruhi rendemen suatu ekstrak karena kadar air termasuk faktor koreksi pada perhitungan rendemen.
Ekstraksi buah kawista dilakukan dengan metode maserasi, hidrolisis dengan asam dan partisi. Ekstraksi maserasi dilakukan dengan pelarut metanol dan dipartisi dengan pelarut n-heksana. Hidrolisis dengan menggunakan asam bertujuan agar senyawa fenolik bebas yang terekstrak dari pelarut metanol berubah menjadi glikosida fenolik yang pada penelitian sebelumnya dihasilkan aktivitas antioksidan yang tinggi (Taheri et al. 2010). Partisi dilakukan dengan tujuan memisahkan senyawa yang berbeda sifat kepolarannya (Khopkar 2002). Pada penelitian ini dilakukan partisi dengan menggunakan n-heksana dengan tujuan menghilangkan lemak dari buah kawista (Taheri et al. 2010). Partisi menggunakan etil asetat juga dilakukan dengan tujuan sebagai pebanding pelarut yang terbaik yang dapat menghasilkan ekstrak yang memberi aktivitas antioksidan yang terbaik (Attarde et al. 2011). Rendemen yang didapatkan dari ketiga jenis buah kawista tersebut berbeda (Gambar 7). Terdapat perbedaan rendemen yang diperoleh dari kedua pelarut tersebut (Lampiran 3). Rendemen tertinggi diperoleh dari pelarut metanol pada buah kawista matang. Rendemen buah kawista matang pada pelarut metanol diperoleh sebesar 16.604%.
Gambar 7 Persen rendemen ekstrak buah kawista
Tabel 2 Uji fitokimia estrak buah kawista
Sampel Falvonoid Saponin Tanin Alkaloid
EA M EA M EA M EA M
M : ekstrak hasil hidrolisis menggunakan HCl 2 N dalam metanol (-) : tidak mengandung senyawa metabolit sekunder
(+) : mengandung senyawa metabolit sekunder sesuai intensitasnya Perbedaan hasil fitokimia untuk kedua pelarut terlihat dari intensitas tanin dan saponin diperoleh beragam.Hal ini terlihat dari intensitas warna hijau kehitaman yang cukup tinggi serta buih yang terbentuk lebih banyak dibandingkan dengan hasil ekstrak sisa partisi. Buah kawista terpartisi oleh etil asetat menghasilkan intensitas warna hijau kehitaman yang lebih baik dibandingkan dengan ekstrak dari sisa partisi. Hal ini dikarenakan pelarut etil asetat dapat mengekstrak senyawa yang bersifat semi polar seperti saponin dan tanin.Ekstrak buah kawista hasil hidrolisis pada pelarut metanol menghasilkan uji positif pada flavonoid karena metanol bersifat polar, sehingga dapat mengekstrak senyawa bersifat polar. Salah satunya adalah antosianin yang diduga memiliki aktivitas antioksidan pada ekstrak buah kawista (Thakur et al.2010).
Aktivitas Antioksidan Ekstrak Kawista
Penentuan aktivitas antioksidan dari ekstrak buah kawista hasil partisi etil asetat dan hasil hidrolisis pada pelarut metanol dilakukan dengan metode penangkapan radikal DPPH (2,2 difenil-1-pikrihidrazil). Metode ini dipilih karena mudah, cepat, dan sensitivitas tinggi terhadap suatu senyawa (Koleva et al. 2001). Penangkapan radikal bebas menyebabkan elektron menjadi berpasangan yang akan mengurangi intensitas atau hilangnya warna ungu dari radikal DPPH yang sebanding dengan jumlah elektron yang telah berikatan (Sunarni 2005).
15
Tabel 3 Nilai aktivitas antioksidan buah kawista
Sampel IC50 (µg/mL)
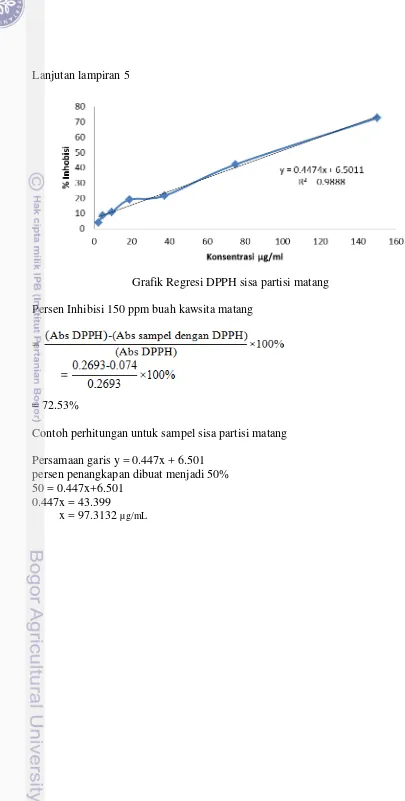
M : ekstrak hasil hidrolisis menggunakan HCl 2 N dalam metanol Hasil uji aktivitas antioksidan terlihat bahwa nilai IC50 terbaik diperoleh dari buah matang dan tua dari hasil hidrolisis dengan asam dalam metanol dengan IC50 berturut-turut diperoleh sebesar 97.78±3.33 µg/mL dan 320.71±12.38 µg/mL. Nilai IC50 diperoleh menunjukkan bahwa ekstrak dapat menangkap 50% radikal bebas pada DPPH (Lampiran 5). Penelitian ini menggunakan vitamin C sebagai kontrol positif. Nilai IC50 vitamin C pada penelitian ini diperoleh sebesar 2.828
µg/mL. Hasil IC50 pada buah kawista sangat berbeda jauh dengan kontrol positif karena vitamin C merupakan senyawa antiradikal yang memiliki kinetika reaksi yang cepat, sehingga mudah bereaksi dengan radikal DPPH.
Data di atas menunjukkan bahwa ekstrak buah kawista matang memiliki aktivitas lebih baik dibandingkan dengan ekstrak buah kawista tua karena memiliki nilai IC50 lebih kecil daripada ekstrak tua hasil hidrolisis dalam metanol.Perbedaan usia atau fisiologi ternyata sangat berpengaruh terhadap nilai IC50 yang dihasilkan. Banyaknya flavonoid dalam suatu senyawa akan bertambah seiring dengan bertambahnya usia buah tersebut. Hal ini sesuai dengan hasil uji fitokimia (Tabel 2), bahwa buah kawista semakin matang akan semakin banyak flavonoid. Sehingga dapat disimpulkan bahwa pada ekstrak buah kawista matang dari hasil hidrolisis dalam metanol memiliki aktivitas antioksidan yang sangat baik.
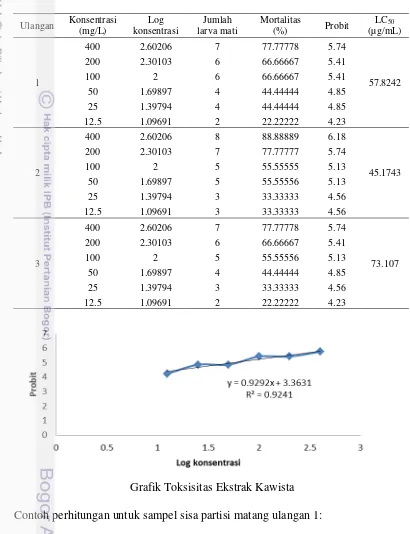
Toksisitas Ekstrak Kawista
Tabel 4 Uji toksisitas ekstrak buah kawista
Ket: jika diikuti oleh huruf yang sama maka nilai tersebut tidak berbeda nyata
Proses penetasan larva udang A. salina menggunakan air laut dengan bantuan aerator untuk menjaga agar kadar oksigen yang terlarut. Telur akan sulit menetas jika oksigen dalam air kurang. Umur larva udang yang digunakan adalah 24 jam setelah menetas. Kondisi larva udang pada umur tersebut masih lunak, sehingga memudahkan senyawa asing dalam air laut masuk dan menyebabkan kematian. Kematian larva udang yang disebabkan masuknya senyawa asing dijadikan dasar untuk pengujian toksisitas ekstrak aktif buah kawista. Pada penelitian ini nilai kematian dikonversi menjadi nilai probit yang diperoleh dari tabel probit hubungannya lebih linear. Selain itu hubungan antara persen kematian dengan dosis bersifat logistik, sehingga tidak dapat menghasilkan suatu linearitas yang baik.
Uji toksisitas digunakan untuk menentukan toksisitas senyawa kimia yang terkandung dalam tanaman obat dan untuk menentukan potensi bioaktif senyawa bahan alam (Sukadirman et al. 2004). Hasil uji toksisitas dinyatakan dengan nilai LC50. Nilai LC50 yaitu konsentrasi ekstrak yang dibutuhkan untuk menurunkan kemampuan hidup larva udang sebesar 50%. Jika nilai LC50 dibawah 1000 µg/mL maka suatu senyawa atau ekstrak aktif dari suatu sampel memiliki potensi bioaktif (Meyer et al. 1982).
Hasil penelitian menunjukkan bahwa seluruh ekstrak buah kawista baik yang terpartisi oleh etil asetat maupun yang berasal dari metanol yang telah dihidrolisis memiliki sifat toksisitas karena nilai LC50 masih berada di bawah 1000
µg/mL. Jenis sampel yang memiliki aktivitas toksik yang tinggi yaitu ekstrak buah kawista matang dengan 2 pelarut berbeda menunjukkan nilai LC50 yang terbaik.
Sidik Jari Ekstrak Kawista dengan KLT
17
Tabel 5 Jumlah spot hasil piranti lunak ImageJ Formula
Pada prinsipnya bahwa ImageJ merupakan suatu piranti lunak yang dapat mengubah citra dari bentuk pita menjadi bentuk densitogram dan terkuantifikasi dengan baik. Selain itu, ImageJ juga mampu memperlihatkan besar kecilnya kandungan suatu komponen di dalam sampel dengan jelas, terutama pada komponen pencirinya. Semakin besar konsentrasi komponennya, semakin tinggi puncak yang dihasilkan karena intensitas warna gambar yang semakin terang dan sebaliknya. Berdasarkan tabel di atas, banyaknya pita darihasil pengolahan dari ImageJ tersebut sesuai dengan banyaknya pita dari hasil penampakan dengan cahaya UV 254 nm dan 366 nm pada rancangan SCD komposisi fase gerak paling banyak memunculkan pita dengan keterpisahan cukup baik adalah asam format berbanding etil asetat berbanding asam format (F9).Pola KLT tertera pada Gambar 8.
(a) (b)
Gambar 8 Visualisasi gambar hasil eluen terbaik dari metode SCD (a) UV 254 nm dan (b) UV 366 nm.
Spot pertama dari kiri merupakan spot dari ekstrak kawista tua, spot kedua merupakan spot dari ekstrak kawista matang dan spot ketiga merupakan spot dari standar kuersetin. Hasil dari optimasi pelarut dengan SCD yang telah diolah dengan menggunakan piranti lunak ImageJ terlihat bahwa seluruh sampel baik buah kawista tua, matang dan standar memiliki kesamaan komponen fase gerak, yaitu kloroform, etil asetat dan asam format, yaitu dengan perbandingan etil asetat lebih banyak dibanding dengan asam format dan kloroform. Hal ini karena sifat
dari flavonoid yang semipolar, sehingga kombinasi pelarut antara etil asetat, kloroform dan asam format dengan komposisi dominan adalah etil asetat akan mengelusi senyawa yang bersifat semipolar.
Metode kedua yaitu kombinasi pelarut berdasarkan berbagai pustaka diperoleh 3 kombinasi terbaik, yaitu pertama (P1) kloroform : etil asetat : asam format : air, kedua (P2) kloroform : etil asetat : asam format : HCl 2N dan ketiga (P3) kloroform : etil asetat : asam format : asam asetat dengan perbandingan (6:3:1:0,5). Hasil ini terlihat pada Gambar 9. Hasil dari visualisasi ini diolah dengan piranti lunak ImageJ. Pengolahan gambar dengan ImageJ dihasilkan suatu densitogram, dari densitogram tersebut diperoleh suatu kombinasi pelarut yang terbaik, yaitu kloroform : etil asetat : asam format : asam asetat (P3). Hal ini didasarkan pada banyaknya pita serta keterpisahan pita kromatogramnya.
Gambar 9 Visualisasi gambar hasil kombinasi pelarut berdasrkan pustaka (1) kombinasi pertama, (2) kombinasi kedua dan (3) kombinasi ketiga Pemilihan pelarut berdasarkan pustaka dari zat aktif antosianin didasarkan oleh hasil penelitian dari Thakur et al. (2010) yang mengatakan bahwa zat aktif yang diduga berperan positif pada aktivitas antioksidan buah kawista adalah antosianin. Hasil ketiga kombinasi tersebut diolah dengan piranti ImageJ sehingga diperoleh hasil yang disajikan pada Tabel 6.
Tabel 6 Jumlah spot eluen terbaik pada UV 366 nm Formula Jumlah spot yaitu, kloroform:etil asetat:asam format:asam asetat (P3). Hal ini dikarenakan bahwa jumlah spot lebih banyak. Penampakan dari semua komponen dilakukan dengan 2 cara cahaya, yaitu UV 254 nm dan 366 nm berdasarkan cara ini diperoleh jumlah spot yang berbeda-beda dan keterpisahan yang beragam. Hasil yang diperoleh di atas menunjukkan penampakan jumlah pita pada UV 366 nm terlihat jelas karena menunjukkan jumlah pita yang banyak dan keterpisahan yang baik (Lampiran 7). Hal ini disebabkan karena banyak spot yang berflouresensi pada UV 366 nm akibat adanya kromofor dari flavonoid yang memiliki ikatan
19
rangkap terkonjugasi. Pengolahan gambar dengan menggunakan bantuan piranti lunak ImageJ diperoleh berbagai macam jumlah smoothing gambar dengan tujuan agar memperoleh jumlah pita yang terpisah secara jelas. Proses smoothing merupakan proses penyaringan data agar dihasilkan data yang dapat mewakili suatu densitogram sehingga menghasilkan suatu densitogram yang lebih terlihat jelas.
Perbedaan metode yang digunakan dalam mencari pelarut terbaik sangat mempengaruhi hasil dari jumlah spot yang diperoleh. Pada metode pertama yang menggunakan rancangan SCD diperoleh eluen terbaik asam format : kloroform : etil asetat (F9). Dalam pelarut terbaik ini diperoleh jumlah spot yang banyak tetapi tidak memberikan spot yang terpisah dengan baik. Hal ini ditunjukkan dari densitogram yang memiliki puncak yang interval koordinat jarak yang melebar untuk ketiga spot yang ada. Hasil dari kedua metode diperoleh eluen terbaik, yaitu kloroform : etil asetat : asam format : asam asetat (P3) menunjukkan pemisahan yang baik pada spot ekstrak kawista matang, karena menghasilkan spot yang banyak dan keterpisahan yang baik. Halini lebih jelas terlihat pada densitogram.
Evaluasi KLT dengan Piranti Lunak ImageJ
Analisis sidik jari merupakan suatu cara yang digunakan untuk menunjukkan informasi senyawa kimia dari suatu sampel dalam bentuk spektrogram, kromatogram, atau grafik lain yang didapatkan dari teknik analisis secara menyeluruh (Liang et al. 2009). Metode ini dilakukan karena dapat digunakan sebagai metode kendali mutu, metode validasi dan dapat digunakan untuk mengklasifikasikan suatu sampel tanaman. Pada penelitian ini dilakukan analisis pola sidik jari secara densitogram dengan membandingkan hasil KLT sampel buah kawista dengan standar kuarsetin. Kuersetin merupakan jenis flavonoid yang banyak ditemukan di berbagai tanaman sehingga pada penelitian ini digunakan sebagai standar.
a.
b.
c.
Gambar 10 Densitogram (a) kawista tua, (b) kawista matang dan (c) standar kuersetin dari metode rancangan SCD
21
a.
b.
c.
Gambar 11 Densitogram (a) ekstrak kawista tua hasil hidrolisis dalam metanol; (b) ekstrak kawista matang hasil hidrolisis dalam metanol; dan (c) standar kuarsetin metode kombinasi eluen antosianin
SIMPULAN DAN SARAN
Simpulan
Bioaktivitas terbaik diperoleh dari ekstrak kawista matang dari hasil hidrolisis asam dalam metanol karena memiliki nilai IC50 dan LC50 terbaik.ImageJ merupakan salah satu piranti lunak yang dapat digunakan untuk mengubah respon KLT menjadi densitogram yang menggambarkan pola sidik jari suatu sampel. Hasil eluen terbaik diperoleh dari kombinasi pelarut berdasarkan pustaka, yaitu kloroform : etil asetat : asam format : asam asetat dengan perbandingan volume sebesar 6:3:1:0.5. Densitogram yang dihasilkan dari ekstrak kawista tua dan ekstrak kawista matang memiliki beberapa nilai AU dan koordinat jarak yang sama dengan standar. Hasil analisis pola sidik jari dari sampel matang diperoleh keterpisahan yang baik, sehingga dapat dijadikan sebagai kendali mutu pada suatu buah kawista sebagai antioksidan.
Saran
Perlu dilakukannya analisis kadar antosianin secara kualitatif sehingga lebih diketahui zat aktif dari ekstrak kawista.
DAFTAR PUSTAKA
Andhika N.A. 2011. Sidik jari kromatografi lapis tipis dari daun tiga jenis jambu biji [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Attarde D L, Chaudhari B J dan Bhambar R S. 2011. Phytochemical investigation and in vitro antioxidant activity of extracts from leaves of Limonia acidissma linn (Rutaceae). Journal of Pharmacy Research 4(3): 766-768. doi: ISSN: 0974-6943
[AOAC] Association of Offical Analytical Chemistry. 1971. Official Methods Of Analysis of AOAC International 971.28. Meyrland: AOAC International. Braithwaite A, Smith FJ. 1999. Chromatographic Method. Netherlands (NL):
Kluwer Academic.
Borges CN, Bruns RE, Almeida AA, Scarminio IS. 2007. Mixture design for the fingerprint optimization of chromatographic mobile phases and extraction solutions for Camellia sinensis. Analytica Chimica Acta 595:28-37.
[BPOM] Badan Pengawas Obat dan Makanan. 2004. Monografi Ekstrak Tumbuhan Obat Indonesia. Jakarta (ID): BPOM RI.
Brereton RG. 2005. Chemometrics Data Analysis for the Laboratory and Chemical Plant. London (GB): J Willey.
Darusman LK, Heryanto R, Rafi M, Wahyuni WT. 2007. Potensi daerah sidik jari spketrum inframerah sebagai penanda bioaktivitas ekstrak tanaman obat. Jurnal Ilmiah Pertanian Indonesia 12(3):154-162.
23
layer chromatography [tesis]. Lousiana (BR): Program Pascasarjana, University of Suriname.
Ferreira TA, Rasband W. 2010. The ImageJ User Guide Version 1.45. Canada (CA): McGill University.
Fitrianti SA. 2011. Diferensiasi temulawak, kunyit, dan bangle berdasarkan interpertasi kromatografi lapis tipis menggunakan ImageJ [Skripsi]. Bogor (ID): Institut Pertanian Bogor.
Ghiselli A, Nardini M, Baldi A, Scaccini C. 1998. Antioxidant activity of different phenolics fractions separated from an Italian Red Wine. J Agri Food Chem 46:367.
Gritter R, Bobbitt JM, Schwating AE. 1991. Pengantar Kromatografi. Padmawinata K, penerjemah. Bandung: Penerbit ITB. Terjemahan dari: Introduction to Chromatography.
Hamburger M, Hostettmann K. 1991. Bioactivity in plant: The link between phytochemistry and medicine. Phytochemistry 12: 3864-3847
Harbone JB. 1987. Metode Fitokimia. Padmawinata K, Soediro I, penerjemah; Niksholihin S, editor. Bandung (ID): penerbit ITB. Terjemahan dari: Phytochemical Method.
Hess AV. 2007. Digitally enhanced thin-layer chromatography:an inexpensive, new technique for qualitative and quantitative analysis. J Chemical Education. (84):842-847.
Ilango K dan Chitra V. 2009. Antidiabetic and antioxidant activity of Limonia acidissima Linn. in alloxan induced rats. Der Pharma Lettre.1:117-125. Khopkar. 2002. Konsep Dasar Kimia Analitik. Saptorahardjo, penerjemah. Jakarta
(ID): UI Pr. Terjemahan dari: Basic Concept Of Analytical Chemistry. Koleva I I, van Beek TA, Lissen JPH, de Graat A, Evstatieva LN. 2001. Screening
of plant extract for antioxidant activity: a compary study on three testing methods. Phytochem Anas 13:8-17
Liang XM, Yu Jin, Yan PW, Gao-wa Jin, Qing Fu dan Yuan-sheng Xiao. 2009. Qualitative and quantitative analysis in quality control of traditional Chinese medicines. J Chromatogr A 1216: 2033-2044
Markham KR. 1988. Cara Mengidentifikasi Flavonoid. Padmawinata K. penerjemah. Bandung (ID): penerbit ITB. Terjemahan dari: Techniques of Flavonoid Identification.
Meyer JL dan Eric TS. 1982. Brine shrimp: a convenient general bioassay for active plant constituents. Plant Med 82: 583-591
Molyneux P. 2004. The use of the stable free radical diphenylpicrilhydrazil (DPPH) for estimating antioxidant activity. J Sci Technol 26:211-219
Montgomery DC. 1991. Design and Analysis of Experiment 3rd Ed. New York: John Willey & Sons.
Pourmorad F, Hosseinimehr SJ, Shahabimajd N. 2006. Antioxidant activity,phenol, and flavonoid contents of some selected Iranian medicinal plants. African Journal of Biotechnology 5(11): 1142-1145.
Sharma M, Moises C, Kevin R. 2011. Identification of the Pr1 gene product completes the anthocyanin biosynthesis pathway of maize. Genetica Society of America 188: 69-79. doi : 10.1534/genetics.110.126136
Shermin S, Fahmia A, Monira A, Choudhury M. 2012. Antioxidant and cytotoxic activity of Limonia acidissima Bangladesh (IN): UniversityDhaka
Sukadirman, Rahman A, Pratiwi FN. 2004. Uji praskrining aktivitas antikanker ekstrak eter dan ekstrak metanol Marchantia cf. Planiloba Steph. dengan metode uji kematian larva udang dan profil densitometri ekstrak aktif. Surabaya (ID): Universitas Airlangga
Sukamto LA. 1999. Morfogenesis berbagai eksplan kawista (Limonia acidissima L.) yang ditumbuhkan secara kultur [prosiding]. Bogor (ID) : LIPI
Soares PK, Burns RE, Scarminio IS. 2007. Statistical mixture design-principal component optimization for selective compound extraction from plant material. Journal of Separation Science 30: 3302-3310.
Thakur, Seema M dan Phapale R. 2010. Antioxidant activity and antimutagenic effect of phenolic compounds in Feronia limonia L. swingle fruit. International Journal of Pharmaticeutical Science. 2: 68-73. doi: ISSN-0975-1491
25
Lampiran 1 Diagram alir penelitian
Preparasi sampel buahkawista
Penentuan kadar air sampel
Ekstrak metanol bebas lemak Ekstrak kawista
dalammetanol
Partisi dengan etilasetat
Uji aktivitas antioksidan
Sisa metanol hasilhidrolisis
Analisis sidik jari denganmetode KLT Uji toksisitas denganmetode
BSLT
Ekstraksi denganmetanol
Ekstraksi dengan n-heksana
Uji Fitokimia
Pengolahan gambar pita KLT denganmenggunakan piranti lunak ImageJ
27
Lampiran 3 Hasil rendemen ekstrak buah kawista
Jenis
sampel Ulangan Berat sampel (g) Bobot ekstrak (g)
Rendemen (%)
Rata-rata (%)
Standar Deviasi
Muda 1 50.0146 3.4379 6.388343 5.746886 0.008024
2 50.0039 3.231 6.005164
3 50.0171 2.6434 4.847151
Tua 1 50.0194 3.7286 6.92786 6.710758 0.00528
2 50.0168 3.2876 6.108785
3 50.0286 3.8705 7.095629
Matang 1 50.021 4.8108 8.706375 9.35113 0.006387
2 50.0113 4.9929 9.983544
3 50.0071 4.6824 9.36347
Contoh perhitungan sampel muda ulangan 1: Bobot ekstrak =
=
= 3.4379 g
= 6.388343 g
Lampiran 4 Foto hasil uji fitokimia
Foto hasil uji Jenis Uji
sampel ekstrak kawista muda sisa partisi
Saponin, Tanin dan Flavonoid
Sampel ekstrak kawista tua sisa partisi
Flavonoid, tanin dan Saponin
Sampel ekstrak kawista matang sisa partisi
Saponin, flavonoid dan tanin
Sampel ekstrak kawista muda etil asetat
29
Lanjutan lampiran 4
Sampel ekstrak kawista tua etil asetat
Saponin, tanin dan Flavonoid
Sampel ekstrak kawista matang etil asetat
Flavonoid, tanin dan saponin
Sampel ekstrak kawista uji alkaloid
Lampiran 5 Data hasi uji aktivitas antioksidan dengan metode DPPH
III 150.00 2.176091259 70.66832
31
Lanjutan lampiran 5
Grafik Regresi DPPH sisa partisi matang Persen Inhibisi 150 ppm buah kawsita matang
= 72.53%
Contoh perhitungan untuk sampel sisa partisi matang Persamaan garis y = 0.447x + 6.501
persen penangkapan dibuat menjadi 50% 50 = 0.447x+6.501
0.447x = 43.399
Lampiran 6 Data uji toksisitas ekstrak buah kawista matang hasil partisi etil asetat terhadap larva udang A. Salina
Ulangan Konsentrasi Contoh perhitungan untuk sampel sisa partisi matang ulangan 1: Persamaan garis y = 0.929x + 3.363
5 = 0.929x+3.363 0.929 x = 1.37 x = 1.4747
33
Lanjutan lampiran 6
Hasil ANOVA dan Uji Duncan
Ekstrak buha kawista hasil hidrolisis dalam metanol ANOVA
Varian Sum of Squares df Mean Square F Sig.
Between Groups .107 2 .054 4.278 .070
Within Groups .075 6 .013
Total .183 8
Uji Duncan
VAR00010 N Subset for alpha = 0.05
a b
MT 3 64.1540
T 3 222.3454
M 3 118.3974
Sig. 1.000 .945
Means for groups in homogeneous subsets are
displayed.
Ekstrak kawista etil asetat Analisis Anova
ANOVA
Varian Sum of Squares df Mean Square F Sig.
Between Groups 2.274 2 1.137 77.349 .000
Within Groups .088 6 .015
Total 2.362 8
Uji Duncan
VAR00010 N
Subset for alpha = 0.05
A b c
3 3 58.7015
2 3 296.6929
1 3 746.6068
Sig. 1.000 1.000 1.000
Lampiran 7 Hasil proses smoothing dengan menggunakan The Unscramble
Hasil densitogram sebelum proses smoothing data
35
Lampiran 8 Nilai AU dan koordinat jarak dari densitogram Nilai AU dan koordinat jarak dari rancangan SCD
Densitogram Puncak Koordinat Jarak AU
A 1 1 – 48 300
2 49 – 97 350
3 113 – 129 200
4 255 – 241 150-200
B 1 25 – 65 200
2 161 – 193 150
3 193 – 225 150-200
C 1 1 – 21 150-200
2 21 – 41 300
3 51 – 91 350
4 111 – 181 200
Nilai UA dan koordinat jarak fase gerak antosianin
Densitogram Puncak Koordinat Jarak AU A
1 29 – 71 150-200
2 141 – 181 300
3 191 – 221 250
B
1 20 – 69 350
2 69 – 120 250
3 154 – 171 100
4 290 – 341 250
5 375 – 426 200
C
1 1 – 15 100-150
2 40 – 67 350
3 111 – 135 150-200
RIWAYAT HIDUP
Penulis dilahirkan di Bima pada tanggal 9 Juni 1990 dari pasangan Bapak Alizar dan Ibu Ermis. Penulis merupakan anak pertama dari empat bersaudara. Penulis lulus dari Sekolah Menengah Atas Negeri 1 Kota Bima pada tahun 2008 dan pada tahun yang sama penulis lulus seleksi Ujian Seleksi Masuk IPB (USMI). Penulis memilih Program Studi Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.