PENGARUH HERBISIDA AMINOSIKLOPILAKLOR TERHADAP KETERJADIAN PARTENOKARPI PADA TANAMAN KELAPA SAWIT
(Elaeis guineensis Jacq) MENGHASILKAN DAN DAYA KENDALINYA TERHADAP GULMA
(Skripsi)
Oleh
FERNANDO ISKANDAR DAMANIK
Skripsi
Sebagai Salah Satu Syarat untuk Mencapai Gelar SARJANA PERTANIAN
pada
Jurusan Agroteknologi
FAKULTAS PERTANIAN UNIVERSITAS LAMPUNG
ABSTRAK
PENGARUH HERBISIDA AMINOSIKLOPILAKLOR TERHADAP KETERJADIAN PARTENOKARPI PADA TANAMAN KELAPA SAWIT
(Elaeis guineensis Jacq) MENGHASILKAN DAN DAYA KENDALINYA TERHADAP GULMA
Oleh
Fernando Iskandar Damanik
Penelitian ini bertujuan untuk mengetahui pengaruh herbisida aminosiklopilaklor terhadap keterjadian partenokarpi pada tanaman kelapa sawit menghasilkan dan untuk mengetahui efektivitas herbisida tersebut dalam mengendalikan gulma. Penelitian ini dilaksanakan di kebun milik petani di Kecamatan Natar, Kabupaten Lampung Selatan dan Laboratorium Gulma Fakultas Pertanian Universitas Lampung. Penelitian disusun dengan menggunakan Rancangan Kelompok Teracak Sempurna yang terdiri atas 6 perlakuan yaitu herbisida aminosiklopilaklor dengan dosis 50, 100, 200 g/ha, herbisida pembanding
informasi yang pasti mengenai partenokarpi pada buah kelapa sawit sampai dengan 12 minggu setelah aplikasi. Hal ini disebabkan tidak semua tanaman kelapa sawit mengeluarkan tandan/bunga baru sawit selama penelitian
DAFTAR ISI
Halaman
DAFTAR ISI. ... i
DAFTAR TABEL. ... iii
DAFTAR GAMBAR. ... viii
I. PENDAHULUAN. ... 1
1.1 Latar Belakang dan Masalah. ... 1
1.2 Tujuan Penelitian. ... 5
1.3 Landasan Teori. ... 5
1.4 Kerangka Pemikiran. ... 9
1.5 Hipotesis. ... 10
II. TINJAUAN PUSTAKA. ... 11
2.1 Botani Tanaman Kelapa Sawit. ... 11
2.1.1 Akar. ... 11
2.1.2 Batang. ... 12
2.1.3 Daun. ... 12
2.1.4 Bunga. ... 12
2.1.5 Buah. ... 13
2.1.6 Penyerbukan dan Pembuahan pada Kelapa Sawit. ... 14
2.2 Partenokarpi. ... 15
2.3 Gulma. ... 17
2.4 Pengendalian Gulma. ... 18
2.5 Herbisida. ... 18
2.5.2 Aminopiralid. ... 20
2.5.3 Triklopir. ... 20
2.5.4 Herbisida dan Partenokarpi. ... 22
III. BAHAN DAN METODE. ... 23
3.1 Tempat dan Waktu Penelitian. ... 23
3.2 Bahan dan Alat. ... 23
3.3 Metode Penelitian. ... 23
3.4 Pelaksanaan Penelitian. ... 24
3.5 Pengamatan. ... 26
IV. HASIL DAN BAHASAN. ... 30
4.1 Keterjadian Partenokarpi. ... 30
4.2 Persen Penutupan Gulma Total. ... 33
4.3 Persen Keracunan Gulma Total. ... 34
4.4 Bobot Kering Gulma Total. ... 35
4.5 Bobot Kering Gulma Pergolongan. ... 36
4.5.1 Bobot kering gulma golongan daun lebar. ... 36
4.5.2 Bobot kering gulma golongan rumput. ... 38
4.5.2. bobot kering gulma golongan teki. ... 39
4.6 Bobot Kering Gulma Dominan. ... 40
4.6.1 Bobot kering gulma Cleome rutidospermae. ... 40
4.6.2 Bobot kering gulma Axonopus compressus. ... 42
4.6.3 Bobot kering gulma Digitaria ciliaris. ... 43
V. KESIMPULAN DAN SARAN. ... 45
5.1 Kesimpulan. ... 45
5.2 Saran. ... 46
DAFTAR TABEL
Tabel Halaman
1. Perlakuan herbisida yang diuji. ... 24
2. Pengaruh herbisida terhadap penututpan gulma total. ... 33
3. Pengaruh herbisida terhadap persentase keracunan gulma total(%) 35
4. Pengaruh herbisida terhadap bobot kering gulma total(g/0,5 m2). 36
5. Pengaruh herbisida terhadap bobot kering gulma golongan daun lebar (g/0,5 m2). ... 37
6. Pengaruh herbisida terhadap bobot kering gulma golongan Rumput (g/0,5 m2) . ... 39
7. Pengaruh herbisida terhadap bobot kering gulma golongan Teki (g/0,5 m2) . ... 40
8. Pengaruh herbisida terhadap bobot kering gulma Cleome rutidospermae (g/0,5 m2) . ……….… 41
9. Pengaruh herbisida terhadap bobot kering gulma Axonopus compressus(g/0,5 m2). ... 42
10.Pengaruh herbisida terhadap bobot kering gulma Digitaria Ciliaris (g/0,5 m2) . ... 44
LAMPIRAN 11.Penutupan gulma total 2 MSA. ...……….………. 49
12.Analisis ragam untuk penutupan gulma total 2 MSA. ……….. 49
13. Pentupan gulma total 4 MSA. ...………... 49
14.Analisis ragam untuk penutupan gulma total 4 MSA. ...………... 50
15.Penutupan gulma total 8 MSA. ...……….. 50
17.Penutupan gulma total 12 MSA. ………. 51
18.Analisis ragam untuk penutupan gulma total 12 MSA. ...………….. 51
19.Keracunan gulma total 2 MSA. ……… 51
20.Transformasi √(√(x+0,5))keracunan gulma total pada 2 MSA. …..… 52
21.Analisis ragam untuk keracunan gulma total 2 MSA ………….…... 52
22.Keracunan gulma total 4 MSA. ………... 52
23.Transformasi √(√(x+0,5))keracunan gulma total pada 4 MSA. ……… 53
24.Analisis ragam untuk keracunan gulma total 4 MSA. ……….. 53
25.Keracunan gulma total 8 MSA. ..………... 53
26.Transformasi √(√(x+0,5))keracunan gulma total pada 8 MSA. …….. 54
27.Analisi ragam untuk keracunan gulma total 8 MSA. ...………. 54
28.Keracunan gulma total 12 MSA. ………... 54
29.Transformasi √(√(x+0,5))keracunan gulma total pada 12 MSA. 55
30.Analisis ragam untuk keracunan gulma total 12 MSA. ……… 55
31.Bobot kering gulma total 2 MSA. ……….… 55
32.Transformasi √(√(x+0,5))bobot kering gulma total pada 2 MSA. ….. 56
33.Analisis ragam untuk bobot kering gulma total 2 MSA. ………...… 56
34.Bobot kering gulma total 4 MSA. ……….…….... 56
35.Analisis ragam untuk bobot kering gulma 4 MSA. ………...… 57
36.Bobot kering gulma 8 MSA. ……….… 57
37.Analisis ragam untuk bobot kering gulma 8 MSA. ………...…… 57
38.Bobot kering gulma total 12 MSA. ………...… 58
39.Analisis ragam untuk bobot kering gulma 12 MSA. ………. 58
41.Transformasi √(√(x+0,5))bobot kering gulma golongan daun lebar
pada 2 MSA. ………..……... 59 42.Analisis ragam untuk bobot kering gulma golongan daun lebar
2 MSA. ………...………..…….. 59 43.Bobot kering gulma golongan daun lebar 4 MSA. ………... 59 44.Analsis ragam untuk bobot kering gulma golongan daun lebar
4 MSA. ……… 60 45.Bobot kering gulma golongan daun lebar 8 MSA. ………...… 60 46.Analisis ragam untuk bobot kering gulma golongan daun lebar 8
MSA. ...………... 60 47.Bobot kering gulma golongan daun lebar 12 MSA. ……….….... 61 48.Analisis ragam untuk bobot kering gulma golongan daun lebar
12 MSA. ………....…… 61 49.Bobot kering gulma golongan rumput 2 MSA. ………….……..….… 61 50.Transformasi √(√(x+0,5))bobot kering gulma golongan rumput
pada 2 MSA. ……….….…...… 62 51.Analisis ragam untuk bobot kering gulma golongan rumput
2 MSA. ……….………… 62 52.Bobot kering gulma golongan rumput 4 MSA. ……….…...….. 62 53.Analisis ragam untuk bobot kering gulma golongan rumput
4 MSA. ……….…… 63 54.Bobot kering gulma golongan rumput 8 MSA. ……….…...… 63 55.Analisis ragam untuk bobot kering gulma golongan rumput
8 MSA. ………. 63 56.Bobot kering gulma golongan rumput 12 MSA. ……….…….… 64 57.Analisis ragam untuk bobot kering gulma golongan rumput
12 MSA. ……….……... 64 58.Bobot kering gulma golongan teki 2 MSA. ….………. 64 59.Transformasi (√(√(x+0,5)) bobot kering gulma golongan teki pada
2 MSA. ……….. 65 60.Analisis ragam untuk bobot kering gulma golongan teki2 MSA. …... 65 61.Bobot kering gulma golongan teki 4 MSA. ……… 65 62.Transformasi √(√(x+0,5))bobot kering gulma golongan
64.Bobot kering gulma golongan teki 8 MSA. ………. 66 65.Analisis ragam untuk bobot kering gulma golongan teki8 MSA. ….. 67 66.Bobot kering gulma golongan teki 12 MSA. ……….. 67 67.Transformasi √(√(x+0,5))bobot kering gulma golongan
teki pada 8 MSA. ………. 67 68.Analisis ragam untuk bobot kering gulma golongan teki
12 MSA. ……….. 68 69.Bobot kering gulma Chleome rutidospermae 2 MSA. ……… 68 70.Transformasi √(√(x+0,5))bobot kering gulma Chleome
rutidospermae pada 2 MSA. ……….….… 68 71.Analisis ragam untuk bobot kering gulma Chleome rutidospermae
2 MSA. ……… 69 72.Bobot kering gulma Chleome rutidospermae 4 MSA. ………….…... 69 73.Transformasi √(√(x+0,5))bobot kering gulma Chleome
rutidospermae pada 4 MSA. ……….………...… 69 74.Analisis ragam untuk bobot kering gulma Chleome rutidospermae
4 MSA. ……….……….…… 70 75.Bobot kering gulma Chleome rutidospermae 8 MSA. ……… 70 76.Transformasi √(√(x+0,5))bobot kering gulma Chleome
rutidospermae pada 8 MSA. ……….………...… 70 77.Analisis ragam untuk bobot kering gulma Chleome rutidospermae
MSA. ……… 71 78.Bobot kering gulma Chleome rutidospermae 12 MSA. ……….. 71 79.Transformasi √(√(x+0,5))bobot kering gulma Chleome
rutidospermae pada 12 MSA. ……….………. 71 80.Analisis ragam untuk bobot kering gulma Chleome rutidospermae
12 MSA. ………...… 72 81.Bobot kering gulma Axonophus compressus 2 MSA. ……….. 72 82.Transformasi √(√(x+0,5))bobot kering gulma Axonophus
compressus pada 2 MSA. ……….… 72 83.Analisis ragam untuk bobot kering gulma Axonophus compressus
2 MSA. ………....… 73 84.Bobot kering gulma Axonophus compressus 4 MSA. ………..…...… 73 85.Analisis ragam untuk bobot kering gulma Axonophus compressus
86.Bobot kering gulma Axonophus compressus 8 MSA . ..………. 74 87.Analisis ragam untuk bobot kering gulma Axonophus compressus
8 MSA. ……… 74 88 Bobot kering gulma Axonophus compressus 12 MSA. …………..…. 74 89. Analisis ragam untuk bobot kering gulma Axonophus compressus
12 MSA. .………..… 75
90. Bobot kering gulma Digitaria ciliaris 2 MSA. ……… 75 91. Transformasi √(√(x+0,5))bobot kering gulma Digitaria ciliaris pada
2 MSA. ……….………. 75
92. Analisis ragam untuk bobot kering gulma Digitaria ciliaris pada 2 MSA. ………..… 76
93. Bobot kering gulma Digitaria ciliaris pada 4 MSA. ……….... 76 94. Transformasi √(√(x+0,5))bobot kering gulma Digitaria ciliaris
pada 4 MSA. ...……….… 76 95. Analisis ragam untuk bobot kering gulma Digitaria ciliaris pada
4 MSA. ..………..… 77 96. Bobot kering gulma Digitaria ciliaris pada 8 MSA. ………. 77 97. Transformasi √(√(x+0,5))bobot kering gulma Digitaria ciliaris pada
8 MSA. ...……….. 77 98. Analisis ragam untuk bobot kering gulma Digitaria ciliaris pada
8 MSA. ..……….… 78 99. Bobot kering gulma Digitaria ciliaris pada 12 MSA. ……….… 78
100. Transformasi √(√(x+0,5))bobot kering gulma Digitaria ciliaris
pada 12 MSA. .……… 78 101. Analisis ragam untuk bobot kering gulma Digitaria ciliaris pada
DAFTAR GAMBAR
Gambar Halaman
1. Rumus bangun aminosiklopilaklor. ….……….. 19
2. Rumus bangun aminopiralid. ……… 20
3. Rumus bangun triklopir. ……… 21
4. Areal yang diaplikasikan herbisida. ………... 25
5. Tata letak percobaan. ……….. 26
6. Bunga betina kelapa sawit normal dan buah partenokarpi. ………. 27
7. Bagan pengambilan sampel gulma. ………. 28
8. Perkembangan bunga/buah kelapa sawit pada perlakuan aminosiklopilaklor 50 g/ha pada 2,4,8,dan 12 MSA. ……….. 31
9. Bunga/buah kelapa sawit yang muncul pada perlakuan mekanis... 31
I. PENDAHULUAN
1.1Latar Belakang dan Masalah
Subsektor perkebunan merupakan salah satu sektor pertanian yang dapat
meningkatkan kesejahteraan rakyat dalam pembangunan perekonomian Indonesia. Pada saat ini, subsektor perkebunan dapat menjadi penggerak pembangunan nasional karena adanya dukungan sumber daya yang besar, berorientasi pada ekspor, dan komponen impor yang kecil, dan menghasilkan devisa non migas dalam jumlah yang besar.
Kelapa sawit (Elaeis) merupakan komoditi unggulan di Indonesia. Pengembangan kelapa sawit memegang peranan penting sebagai sumber
penerimaan devisa negara. Tahun 2010 devisa dari perkebunan mencapai USD20 miliar yang berasal dari kelapa sawit USD15,5 miliar, karet USD7,8 miliar dan kopi USD1,7 miliar (Direktorat Jenderal Perkebunan, 2011).
Bagian yang paling populer pada kelapa sawit adalah daging buah yang banyak
menghasilkan minyak sawit mentah atau CPO (crude palm oil) yang diolah
menjadi minyak makanan, minyak industri, maupun bahan bakar nabati
Menurut Direktorat Jenderal Perkebunan (2011), luas areal perkebunan kelapa
sawit di Indonesia tahun 2009 mencapai 7,5 juta hektare dan merupakan
perkebunan kelapa sawit yang terluas di dunia. Demikian pula produksi minyak
sawit Indonesia tahun 2009 mencapai 21,5 juta ton dan menduduki posisi pertama
di dunia melampaui Malaysia. Hal ini merupakan prestasi yang luar biasa dari
perkebunan kelapa sawit Indonesia.
Untuk mempertahankan prestasi tersebut, masih banyak kendala yang harus diatasi dalam budidaya kelapa sawit. Beberapa kendala dalam budidaya kelapa sawit adalah adanya gangguan hama dan penyakit, dan gulma. Menurut
Sastrosayono (2006), gulma di perkebunan kelapa sawit harus dikendalikan supaya secara ekonomi tidak berpengaruh terhadap produksi. Adanya gulma di perkebunan kelapa sawit akan merugikan, karena menghambat jalan pekerja, mempersulit pengawasan, gulma menjadi pesaing tanaman kelapa sawit dalam memperoleh air dan unsur hara, serta kemungkinan menjadi inang hama dan penyakit.
Upaya yang dilakukan dalam pengendalian gulma pada perkebunan kelapa sawit salah satunya dengan cara menggunakan herbisida. Penggunaan herbisida
Beberapa herbisida yang sering digunakan untuk mengendalikan gulma pada perkebunan kelapa sawit adalah diuron, paraquat, fluroxipyr, imazapir, metil metsulfuron, dan glifosat (Pahan, 2006).
Namun demikian, penggunaan herbisida untuk mengendalikan gulma pada pertanaman kelapa sawit haruslah tidak menimbulkan dampak negatif bagi tanaman kelapa sawit itu sendiri. Berdasarkan penelitian Keong (1987), setelah mengaplikasikan beberapa macam herbisida, didapati bahwa pikloram efektif dalam menyebabkan terjadinya partenokarpi pada buah kelapa sawit. Menurut Pardal (2001), partenokarpi adalah buah yang terbentuk tanpa melalui polinasi dan fertilisasi.
Partenokarpi pada tanaman kelapa sawit merupakan hal yang merugikan, karena kelapa sawit menjadi tidak memiliki inti sawit yang merupakan bagian yang memiliki nilai ekonomis lebih tinggi dibanding Crude Palm Oil (CPO). Pikloram merupakan herbisida yang sering digunakan untuk mengendalikan gulma berkayu, dan merupakan herbisida golongan piridin. Beberapa turunan herbisida golongan piridin adalah diquat, triklopir (Moenandir, 1990).
Herbisida dengan merek dagang MAT28 adalah herbisida dengan bahan aktif aminosiklopilaklor. MAT28 dengan cepat diserap oleh daun dan akar dan ditranslokasikan ke daerah meristematik tanaman, herbisida ini merupakan
kelompok zat pengatur tumbuh yang memengaruhi keseimbangan hormon auksin. (DuPont, 2012).
Aminopiralid adalah herbisida generasi kelompok zat pengatur tumbuh. Herbisida ini terdaftar dengan cara kerja yang menyerupai 2,4-D, klopiralid, triklopir, pikloram dan dikamba. Herbisida ini efektif untuk mengendalikkan daun lebar yang diaplikasikan pascatumbuh (Tu dkk., 2001).
Triklopir adalah herbisida layaknya auksin sintetik. Jenis herbisida yang membunuh gulma target dengan meniru hormon pertumbuhan tanaman auksin (indole acetic acid), dan bila diberikan pada dosis yang efektif, menyebabkan pertumbuhan tanaman tidak terkendali dan tidak terorganisir yang menyebabkan kematian tanaman (Tu dkk., 2001).
Berdasarkan latar belakang yang telah dikemukakan maka disusun perumusan masalah penelitian sebagai berikut:
1. Bagaimana pengaruh herbisda aminosiklopilaklor dan kombinasi
aminopiralid+triklopir terhadap keterjadian partenokarpi pada kelapa sawit? 2. Bagaimana efikasi herbisda aminosiklopilaklor dan kombinasi
1.2 Tujuan Penelitian
Berdasarkan latar belakang dan perumusan masalah yang telah diuraikan, dapat disusun tujuan penelitian sebagai berikut:
1. Untuk mengetahui pengaruh herbisida aminosiklopilaklor dan kombinasi aminopiralid+triklopir terhadap keterjadian partenokarpi pada tanaman kelapa sawit.
2. Untuk mengetahui efikasi herbisida aminosiklopilaklor dan kombinasi aminopiralid+triklopir dalam mengendalikan gulma di kebun kelapa sawit.
1.3 Landasan Teori
Untuk menyusun penjelasan teoritis terhadap pertanyaan yang telah dikemukakan, penulis menggunakan landasan teori sebagai berikut:
Pada umumnya buah hanya akan terbentuk sesudah terjadi penyerbukan dan pembuahan pada bunga. Walaupun demikian mungkin pula buah terbentuk tanpa adanya penyerbukan dan pembuahan. Peristiwa terbentuknya buah yang
Buah merupakan bagian yang penting dari tanaman karena organ ini merupakan tempat yang sesuai bagi perkembangan, perlindungan, dan penyebaran biji. Pada buah normal, pembentukan buah dimulai dengan adanya proses persarian
(polinasi) kepala putik (stigma) oleh serbuk sari (polen) secara sendiri (self pollination) atau oleh bantuan angin, serangga penyerbuk (polinator), dan manusia (cross pollination). Selanjutnya polen berkecambah dan membentuk tabung polen (pollen tube) untuk mencapai bakal biji (ovule). Peristiwa
bertemunya polen (sel jantan) dengan bakal biji (sel telur) di dalam bakal buah (ovary) disebut pembuahan (fertilisasi). Kemudian bakal buah akan membesar dan berkembang menjadi buah bersamaan dengan pembentukan biji. Akhirnya akan dihasilkan buah yang fertil (berbiji) (Pardal, 2001).
Buah yang terbentuk tanpa melaui polinasi disebut partenokarpi. Partenokarpi biasanya tanpa biji (seedless). Partenokarpi ada dua jenis, yaitu partenokarpi alami dan buatan. Partenokarpi alami ada dua tipe, yaitu partenokarpi obligator atau partenokarpi yang terjadi tanpa adanya pengaruh dari luar, dan partenokarpi fakultatif atau partenokarpi yang terjadi karena adanya pengaruh dari lingkungan yang tidak sesuai untuk fertilisasi. Sedangkan partenokarpi buatan dapat
dilakukan dengan aplikasi zat pengatur tumbuh (fitohormon) (Pardal, 2001).
giberelin (GA) antara lain berperanan dalam merangsang pertumbuhan jaringan muda, pembungaan dan peningkatan pembelahan sel.
Menurut Nitsch (1952) yang dikutip oleh Sukamto (1979), banyak bukti yang menunjukkan adanya hubungan kandungan auksin dengan kegagalan
pembentukan buah. Auksin berpengaruh terhadap perkembangan dan
pertumbuhan buah, hal ini ditunjukkan bila pusat bakal buah termasuk sel telur (ovule) dihilangkan, maka tidak terbentuk buah, tetapi terbentuk buah bila rongga tersebut dibubuhi pasta lanolin yang mengandung auksin.
Moenandir (1990) mengemukakan bahwa 2,4-D memiliki aktivitas auksin. Dalam banyak hal proses metabolisme tumbuhan, 2,4-D dapat menggantikan asam indol asetat, sehingga memiliki peran dalam memberi pengaruh pada pertumbuhan sel dan reaksi biokimiawi. Ada beberapa macam auksin sebagai herbisida yaitu 2,4-D; 2,4,5-T; MCPA, dan turunan asam pikolinat seperti pikloram.
Klasifikasi herbisida menurut cara kerjanya dibagi menjadi delapan golongan, yaitu penghambat aktifitas meristem, penghambat sintesis pigmen, penghambat fotosintesis, penghambat respirasi, perusak membran sel, penghambat enzim dan sintesis asam amino, penghambat sintesis lipida, dan herbisida kelompok hormon tumbuhan ( Sriyani, 2012). Dari delapan besar kelompok mekanisme kerja herbisida tersebut, kelompok hormon tumbuhan merupakan golongan dari herbisida yang akan diuji (aminosiklopilaklor, aminopiralid, dan triklopir).
adalah herbisida generasi baru yang memiliki cara kerja seperti auksin dalam metabolisme tumbuhan, herbisida ini dengan cepat diserap oleh daun dan akar kemudian ditranslokasikan ke daerah meristematik tanaman. Aminosiklopilaklor efektif digunakan untuk mengendalikan gulma berkayu, terutama gulma golongan daun lebar ( DuPont, 2012).
Aminopiralid merupakan herbisida sistemik yang digunakan untuk mengendalikan gulma daun lebar. Herbisida ini ditranslokasikan keseluruh jaringan tanaman dan terakumulasi pada jaringan meristematik, termasuk akar. Aminopiralid
merupakan herbisida golongan piridin dengan bentuk asam karboksilat. Herbisida ini mempengaruhi keseimbangan hormon auksin (National Pesticides Information Center, 2002).
Keong (1987) menyatakan bahwa ada dampak negatif herbisida yang
menyebabkan terjadinya buah partenokarpi pada kelapa sawit. Adapun herbisida yang menyebabkan partenokarpi tersebut adalah pikloram, dikamba dan 2,4-D.
Menurut Sriyani (2012), herbisida tersebut di atas merupakan kelompok zat pengatur tumbuh, yang salah satu pengaruhnya pada tanaman adalah perubahan kesetimbangan hormon. Berdasarkan pernyataan tersebut, herbisida MAT28 dapat disejajarkan dengan herbisida kelompok zat pengatur tumbuh karena
1.4 Kerangka Pemikiran
Berdasarkan landasan teori yang telah dikemukakan, berikut ini disusun kerangka pemikiran untuk memberikan penjelasan teoritis terhadap perumusan masalah. Buah yang terbentuk tanpa melalui polinasi dan fertilisasi disebut buah
partenokarpi. Buah partenokarpi biasanya tanpa biji karena tanpa melalui fertilisasi. Partenokarpi menguntungkan untuk peningkatan produktivitas buah terutama buah komersil (hortikultura), namun partenokarpi kurang
menguntungkan dalam program produksi benih atau biji, terutama dalam praktik budidaya kelapa sawit, karena bagian yang memiliki nilai ekonomis tinggi adalah minyak inti sawit yang terdapat pada biji sawit.
Partenokarpi ada dua jenis, yaitu partenokarpi alami dan buatan. Partenokarpi alami ada dua tipe, yaitu partenokarpi obligator atau partenokarpi yang terjadi tanpa adanya pengaruh dari luar, dan partenokarpi fakultatif atau partenokarpi yang terjadi karena adanya pengaruh dari luar/lingkungan yang tidak sesuai untuk fertilisasi. Sedangkan partenokarpi buatan dapat dilakukan dengan aplikasi zat pengatur tumbuh (fitohormon).
Dalam pengendalian gulma secara kimiawi (herbisida), beberapa herbisida yang sering digunakan adalah herbisida dengan kinerja mempengaruhi kesetimbangan hormon auksin seperti triklopir, fluroksipir, 2,4 D; dll. Sedangkan penggunaan auksin sintetis sebagai herbisida pada perkebunan kelapa sawit diketahui menimbulkan partenokarpi seperti yang diteliti oleh Keong (1987). Pada
saja terjadi, karena translokasi herbisida ini pada tanaman mengakibatkan terganggunya kesetimbangan hormon terutama hormon auksin.
1.5 Hipotesis
Berdasarkan kerangka pemikiran yang telah dikemukakan dapat disusun hipotesis sebagai berikut:
1. Terjadi pembentukan buah partenokarpi kelapa sawit akibat perlakuan herbisida aminosiklopilaklor dan kombinasi aminopiralid+triklopir.
II. TINJAUAN PUSTAKA
2.1 Botani Tanaman Kelapa Sawit
Sastrosayono (2006) menjelaskan bahwa tanaman kelapa sawit secara taksonomi dapat diklasifikasikan sebagai berikut:
Divisi : Spermatophyta Subdivisi : Angispermae Kelas : Monocotyledonae Ordo : Palmales
Famili : Palmaceae Genus : Elaeis
Spesies : Elaeis guineensis Jacq
2.1.1 Akar
2.1.2 Batang
Batang kelapa sawit berbentuk silinder. Sampai dengan umur 12 tahun batang masih tertutupi oleh sisa pelepah yang ditunas, sehingga memberi kesan lebih besar. Ukuran batang bervariasi antara 30 cm - 60 cm tergantung kondisi lingkungan. Pertumbuhan memanjang kelapa sawit dapat mencapai ketinggian 15 – 18 meter (Perkebunan Nusantara X, Tanpa Tahun).
2.1.3 Daun
Daun kelapa sawit adalah daun majemuk yang dibentuk di dekat titik tumbuh, terdiri atas pelepah dan anak daun. Jumlah pelepah yang terbentuk kurang lebih 20 - 24 pelepah per tahun. Panjang pelepah dapat mencapai 7 – 9 meter dengan anak daun setiap pelepah antara 250 – 400 helai. Sejak terbentuk primordial sampai dengan spear (pelepah yang belum membuka) membutuhkan waktu 2 tahun (Perkebunan Nusantara X, Tanpa Tahun).
2.1.4 Bunga
Susunan bunga terdiri dari karangan bunga yang terdiri dari bunga jantan (tepung sari) dan bunga betina dan bunga betina (putik), namun ada kelapa sawit yang hanya memproduksi bunga jantan. Umumnya bunga jantan dan bunga betina terdapat dalam dua tandan yang terpisah. Namun adakalanya bunga jantan dan betina
sangat jarang terjadi, praktis tanaman kelapa sawit melaksanakan penyerbukan secara silang (Sastrosayono, 2006).
2.1.5 Buah
Menurut Sastrosayono (2006), tanaman kelapa sawit berbuah saat berumur 18 bulan setelah tanam. Buah kelapa sawit menempel pada karangan disebut tandan buah. Tandan buah tumbuh diketiak daun dan akan mencapai ukuran maksimal pada umur 4-5 bulan. Pada umur ini mulai dibentuk zat-zat minyak yang disusun dalam sel-sel pengisi di sela-sela sabut buah. Minyak sabut (CPO) berwarna jingga karena mengandung karoten. Bersamaan dengan pembentukan minyak, warna kulit buah akan berubah dari ungu menjadi oranye kemerah-merahan.
Buah kelapa sawit memiliki bagian-bagian sebagai berikut.
1. Eksokarp atau kulit luar yang keras dan licin. Ketika buah masih muda, warnanya hitam atau ungu tua, semakin tua warnanya berubah menjadi oranye merah atau kuning oranye.
2. Mesokarp atau sabut. Diantara jaringan-jaringannya ada sel pengisi seperti spons atau karet busa yang mengandung minyak.
3. Endokarp atau tempurung. Ketika buah masih muda, endokarp memiliki tekstur lunak dan berwarna putih, ketika sudah tua, endokarp berubah menjadi keras dan berwarna hitam. Ketebalan endokarp tergantung pada varietasnya. Contohnya varietas Dura memiliki cangkang relatif tebal antara 2 – 8 mm, sedangkan varietas Psifera memiliki cangkang yang sangat tipis.
2.1.6 Penyerbukan dan pembuahan pada kelapa sawit
Tanaman kelapa sawit merupakan tanaman berumahbsatu (monocieus), dimana bunga jantan dan bunga betina tumbuh secara terpisah pada satu tanaman. Masa masak atau “anthesis” dari kedua jenis bunga tersebut sangat jarang atau tidak pernah bersamaan. Ini berarti bahwa proses pembuahan bunga betina dengan
diperolehnya tepung sari dari tanaman lainnya. Proses penyerbukan dapat terlaksana apabila ada perantara yang mampu memindahkan tepung sari dari satu tanaman ke tanaman lain yang mempunyai bunga betina yang sedang mekar atau “receptive”. Hasil penelitian membuktikan bahwa proses penyerbukan tersebut sebagian besar berlangsung dengan bantuan serangga dan sebagian kecil oleh angin (Siregar, 2006).
Pada pembentukan buah, seringkali bagian bunga selain bakal buah ikut tumbuh dan setelah terjadi penyerbukan dan pembuahan bagian-bagian bunga selain bakal buah segera mejadi layu dan gugur. Bagian-bagian bunga yang kadang-kadang tidak gugur melainkan ikut tumbuh dan tinggal pada buah, biasanya tidak mengubah bentuk dan sifat buah itu sendiri sehingga tidak merupakan suatu bagian yang penting dari buah. Misalnya, daun-daun pelindung, daun-daun kelopak, tangkai kepala daun, dan kepala putik (Siregar, 2006).
(stament) dan putik.(pistilum). Sedangkan bunga sempurna adalah bunga yang memiliki dua organ kelamin jantan dan betina (Soetarso, 1991).
Setelah terjadi penyerbukan yang diikuti dengan pembuahan, bakal buah tumbuh menjadi buah, dan bakal biji tumbuh menjadi biji. Bagi tumbuhan biji
(spermatophyta), biji ini merupakan alat perkembangbiakan yang utama, karena biji mengandung calon tumbuhan baru (lembaga). Dengan dihasilkannya biji, maka tumbuhan dapat mempertahankan jenisnya, dan dapat pula menyebar ke lain tempat ( Tjitrosoepomo, 2002).
2.2 Partenokarpi
Buah merupakan bagian yang penting dari tanaman karena organ ini merupakan tempat yang sesuai bagi perkembangan, perlindungan, dan penyebaran biji. Pada buah normal, pembentukan buah dimulai dengan adanya proses persarian (polinasi) kepala putik (stigma) oleh serbuk sari (polen) secara sendiri (self pollination) atau oleh bantuan angin, serangga penyerbuk (polinator), dan manusia (cross
pollination). Selanjutnya polen berkecambah dan membentuk tabung polen (pollen tube) untuk mencapai bakal biji (ovule). Peristiwa bertemunya polen (sel jantan) dengan bakal biji (sel telur) di dalam bakal buah (ovary) disebut pembuahan (fertilisasi). Kemudian bakal buah akan membesar dan berkembang menjadi buah bersamaan dengan pembentukan biji. Akhirnya akan dihasilkan buah yang fertil (berbiji) (Pardal, 2001).
Partenokarpi ini kurang menguntungkan bagi program produksi benih/biji , namun tidak bagi pebisnis jenis tanaman komersial (hortikultura) karena menghasilkan buah tanpa biji atau berbiji lunak (Pardal, 2001).
Buah yang terbentuk tanpa melaui polinasi disebut partenokarpi. Partenokarpi biasanya tanpa biji (seedless). Partenokarpi ada dua jenis, yaitu partenokarpi alami dan buatan. Partenokarpi alami ada dua tipe, yaitu partenokarpi obligator atau partenokarpi yang terjadi tanpa adanya pengaruh dari luar, dan partenokarpi fakultatif atau partenokarpi yang terjadi karena adanya pengaruh dari
luar/lingkungan yang tidak sesuai untuk fertilisasi. Sedangkan partenokarpi buatan dapat dilakukan dengan aplikasi zat pengatur tumbuh (fitohormon) (Pardal, 2001).
Auksin berperan dalam pertumbuhan untuk memacu proses pemanjangan sel. Hormon auksin dihasilkan pada bagian koleoptil (titik tumbuh). Jika terkena cahaya matahari, auksin menjadi tidak aktif. Kondisi fisiologis ini mengakibatkan bagian yang tidak terkena cahaya matahari akan tumbuh lebih cepat dari bagian yang
terkena cahaya matahari. Akibatnya, tumbuhan akan memmbengkok ke arah cahaya matahari. Auksin yang diedarkan ke seluruh bagian tumbuhan mempengaruhi pemanjangan, pembelahan, dan diferensiasi sel tumbuhan. Auksin yang dihasilkan pada tunas apikal (ujung) batang dapat menghambat tumbuhnya tunas lateral (samping) atau tunas ketiak. Bila tunas apikal batang dipotong, tunas lateral akan menumbuhkan daun-daun. Peristiwa ini disebut dominansi apikal.
dan gugurnya daun, serta mampu membantu proses partenokarpi. Partenokarpi adalah proses pembuahan tanpa penyerbukan.
Pemberian hormon auksin pada tumbuhan akan menyebabkan terjadinya
pembentukan buah tanpa biji, akar lateral (samping), dan serabut akar. Pembentukan akar lateral dan serabut akar menyebabkan proses penyerapan air dan mineral dapat berjalan optimum (Salisbury dan Ross, 1992).
2.3 Gulma
Menurut Sembodo (2010), gulma merupakan tumbuhan yang merugikan
kepentingan manusia, baik dibidang usaha tani maupun bidang yang lainnya seperti perikanan, peternakan, kesehatan, estetika, lingkungan hidup dan sebagainya, sehingga manusia berusaha untuk mengendalikannya.
Selain hama dan penyakit, kehadiran gulma di areal perkebunan sangat merugikan, karena terjadi persaingan antara gulma dan tanaman pokok dalam memperoleh air, unsur hara, dan cahaya ( Sembodo, 2010). Secara teknis, gulma menghambat kegiatan pemeliharaan dan kegiatan panen pada perkebunan kelapa sawit.
Pengendalian gulma (weed control) adalah tindakan atau usaha pengelolaan gulma dengan cara menekan pertumbuhan atau mengurangi populasinya. Dalam
2.4 Pengendalian Gulma
Pengendalian gulma bertujuan untuk menghindari terjadinya persaingan antara tanaman kelapa sawit dengan gulma dalam pemanfaatan unsur hara, air dan cahaya. Selain itu pengendalian gulma juga bertujuan untuk mempermudah kegiatan panen. Contoh gulma yang dominan di areal pertanaman kelapa sawit adalah Imperata cylindrica, Mikania micrantha, Cyperus rotundus, Otochloa nodosa, Melostoma malabatricum, Lantana camara, Gleichenia linearis dan sebagainya. Pengendalian gulma dilakukan dengan cara penyiangan di piringan (circle weeding), penyiangan gulma yang tumbuh di antara tanaman LCC, membabat atau membongkar gulma berkayu dan kegiatan buru lalang (wiping) ( BPTP Lampung, 2008).
Menurut Barus (2003), salah satu pengendalian gulma yang dilakukan diperkebunan besar adalah dengan menggunakan herbisida. Herbisida adalah senyawa kimia yang digunakan untuk mengendalikan pertumbuhan gulma.
2.5 Herbisida
Beradasarkan translokasinya dalam tumbuhan, herbisida dibedakan menjadi dua golongan, yaitu herbisida kontak dan herbisida sistemik. Herbisida kontak adalah herbisida yang mematikan bagian gulma yang terkena larutan herbisida. Herbisida kontak tidak ditranslokasikan ke jaringan gulma, sedangkan herbisida sistemik adalah herbisida yang dapat diserap dan ditanslokasikan keseluruh jaringan gulma (Barus, 2003).
atas tanah. Absorpsi berarti penyerapan. Tumbuhan menyerap herbisida sama seperti menyerap air, nutrisi, dan mineral melalui peristiwa osmosis, difusi, dan imbibisi (Moenandir,1990).
2.5.1 Aminosiklopilaklor
Aminosiklopilaklor adalah salah satu jenis bahan aktif dari herbisida baru yang dikembangkan oleh DuPont Crop Protection. Aminosiklopilaklor (MAT28) adalah herbisida generasi baru yang memiliki cara kerja seperti auksin dalam metabolisme tumbuhan, herbisida ini dengan cepat diserap oleh daun dan akar kemudian
ditranslokasikan ke daerah meristematik tanaman. Aminosiklopilaklor efektif digunakan untuk mengendalikan gulma berkayu, terutama gulma golongan daun lebar ( DuPont, 2012).
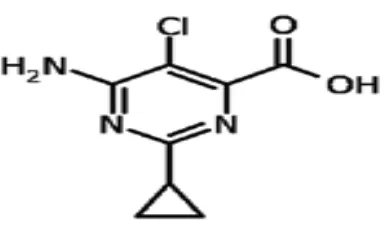
Nama umum: Aminosiklopilaklor
Nama Kimia: 6-amino-5-chloro-2-cyclopropyl-4-pyrimidinecarboxylic acid Rumus Empiris: C8H8ClN3O2
[image:31.595.222.414.550.669.2]Rumus Bangun:
Kinerja aminosiklopilaklor dalam tumbuhan menghambat aktifitas protein, mencegah transportasi polar auksin dan IAA dari daerah meristematik tumbuhan, dan meningkatkan akumulasi ABA, dan meningkatkan pembentukan hydrogen peroksida (DuPont, 2012).
2.5.2 Aminopiralid
Aminopiralid adalah herbisida generasi kelompok zat pengatur tumbuh. Herbisida ini terdaftar dengan cara kerja yang menyerupai 2,4-D, klopiralid, triklopir, pikloram dan dicamba. Herbisida ini efektif untuk mengendalikkan daun lebar yang
dialikasikan pascatumbuh (Dowagro, 2012).
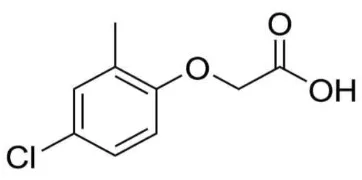
Nama kimia : 4-amino-3 ,6-dichloropyridine-2-carboxylic acid Nama Umum : Aminopiralid
[image:32.595.218.399.489.579.2]Rumus Empiris: C6H4Cl2N2O2 Rumus bangun :
Gambar 2. Rumus bangun aminopyralid (Dowagro, 2012)
2.5.3 Triklopir
dapat sama sekali dalam mengendalikan gulma rerumputan. Ada 2 formula dasar dari triklopir yakni garam triethyamine dan butoksi etil ester. Triklopir dapat segera didegredasikan oleh mikroorganisme dalam tanah sehingga tidak menimbulkan residu. Rata-rata paruh hidup triklopir dalam tanah adalah 30 hari (Tu dkk, 2001).
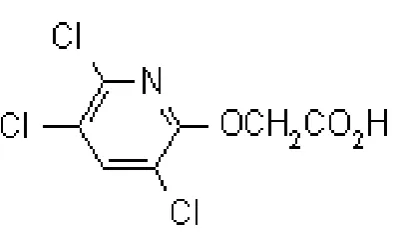
Nama Umum : Triklopir
Nama Kimia : [(3,5,6-trichloro-2-pyridyl)oxy]acetic acid Rumus Empiris : C7H4Cl3NO
[image:33.595.220.417.312.431.2]Rumus Bangun :
Gambar 3. Rumus bangun triklopir (Tomlin, 2011).
pembuluh vascular. Sebaliknya, konsentrasi tinggi triklopir dapat menghambat pembelahan sel dan pertumbuhan (Tu dkk, 2001).
2.5.4 Herbisida dan partenokarpi
Keong (1987) mengemukakan bahwa herbisida pikloram, dicamba, dan 2,4 D bertanggung jawab terhadap terjadinya partenokarpi pada kelapa sawit. Herbisida ini diketahui memiliki aktifitas mempengaruhi kesetimbangan hormon auksin.
Dalam bukunya, Salisburry and Ross (1992),mengemukakan tentang penelitian yang dilakukan oleh Boyce Thompson Institute, New York, yang menemukan bahwa 2,4-D memiliki aktivitas auksin. Penelitian berikutnya menunjukkan bahwa 2,4-2,4-D, NAA dan senyawa tertentu yang berkerabat merupakan herbisida atau pembunuh
tumbuhan yang efektif. Ada beberapa macam auksin sebagai herbisida yang banyak digunakan, yaitu 2,4-D; 2,4,5-T; MCPA, dan turunan asam pikolinat seperti
pikloram (dengan nama dagang Tordon). Kegiatan herbisida sebagai auksin dalam perkembangan buah adalah pada waktu biji matang berkembang, biji mengeluarkan auksin ke bagian-bagian bunga akibat berlebihnya hormon auksin, sehingga
III. BAHAN DAN METODE
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di kebun milik petani di desa Muara Putih, Kecamatan Natar, Kabupaten Lampung Selatan dan Laboratorium Gulma Fakultas Pertanian Universitas Lampung dari bulan November 2012 sampai dengan Maret 2013.
3.2 Bahan dan Alat
Bahan-bahan yang digunakan adalah tanaman kelapa sawit menghasilkan, herbisida berbahan aktif aminosiklopilaklor (MAT28 240 SL) 50, 100, 200 g/ha dan kombinasi herbisida berbahan aktif aminopiralid+triklopir (GARLON MIX EW) 384+216 g/ha.
Alat yang digunakan adalah knapsack sprayer (alat semprot punggung), gelas ukur, ember plastik, kuadratik, meteran, sabit, timbangan, oven, dan alat tulis.
3.3 Metode Penelitian
herbisida yang diuji ditampilkan pada Tabel 1. Herbisida yang diuji adalah herbisida aminosiklopilaklor 50, 100, dan 200 g/ha dan sebagai pembanding digunakan aminopiralid+triklopir 384+216 g/ha. Sedangkan untuk
[image:36.595.128.498.261.481.2]membandingkan pengaruh penggunaan herbisida digunakan perlakuan kontrol atau tanpa pengendalian gulma.
Tabel 1. Perlakuan herbisida yang diuji
No Perlakuan Bahan Aktif Dosis bahan aktif (g/ha) 1 MAT28 240 SL Aminosiklopilaklor 50 2 MAT28 240 SL Aminosiklopilaklor 100 3 MAT28 240 SL Aminosiklopilaklor 200 4 Garlon-Mix EW Aminopiralid+triklopir 384+216
5 Penyiangan Mekanis - -
6 Kontrol - -
Data bobot kering gulma dan persentase penutupan gulma dianalisis dengan menggunakan sidik ragam. Homogenitas data diuji dengan uji Bartlet, sedangkan aditivitas data diuji dengan uji Tukey. Sedangkan untuk membedakan nilai tengah perlakuan digunakan uji beda nyata terkecil (BNT) pada taraf 5%.
3.4 Pelaksanaan Penelitian
jumlah tanaman pada masing-masing plot adalah dua tanaman. Jumlah tanaman pada masing-masing plot adalah dua tanaman. Pembuatan petak percobaan dilakukan dengan memberi nomor perlakuan dan ulangan pada batang pohon dengan menggunakan cat.
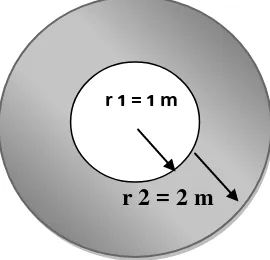
[image:37.595.233.368.390.520.2]Areal yang diaplikasikan herbisida adalah piringan kelapa sawit dengan jari-jari dua meter terluar dari total 3 meter jari-jari.. Luas masing-masing piringan adalah 25.12 m2. Areal yang diaplikasikan herbisida ditunjukkan oleh Gambar 4. Sedangkan Tata letak perlakuan ditunjukkan pada Gambar 4. Aplikasi herbisida dilakukan dengan menggunakan alat semprot punggung dengan menggunakan nozel berwarna merah. Hasil kalibrasi per-ulangan adalah 1500 ml ( 600 L/ha).
Gambar 4. Areal yang diaplikasikan herbisida
Keterangan:
r 1 : batang kelapa sawit (1 meter)
IV U
III
II
[image:38.595.107.380.83.232.2]I
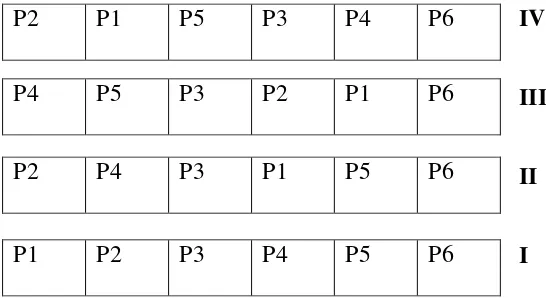
Gambar 5. Tata letak percobaan
Keterangan:
1. Herbisida aminosiklopilaklor 50 g/ha 2. Herbisida aminosiklopilaklor 100 g/ha 3. Herbisida aminosiklopilaklor 200 g/ha
4. Kombinasi herbisida aminopiralid+triklopir 384+216 gr/ha 5. Penyiangan mekanis
6. Kontrol
Sebelum aplikasi herbisida, terlebih dahulu dilakukan pengambilan sampel gulma untuk mengetahui komposisi gulma, persentase penutupan, dan mengetahui jenis gulma dominan. Pengambilan sampel gulma dilakukan dengan menggunakan metode kuadrat berukuran 0.5 m x 0.5 m dan ditempatkan secara acak pada areal percobaan sehingga mewakili komposisi gulma pada petak percobaan.
3.5 Pengamatan
Pengamatan dilakukan pada minggu ke 2, 4, 8, dan 12. Adapun variabel pengamatan yang diamati adalah keterjadian partenokarpi pada kelapa sawit,
P2 P1 P5 P3 P4 P6
P4 P5 P3 P2 P1 P6
P2 P4 P3 P1 P5 P6
persentase penutupan, persentase keracunan pada gulma, bobot kering gulma total, bobot kering gulma pergolongan, dan bobot kering gulma dominan.
Partenokarpi adalah buah yang terbentuk tanpa melaui polinasi. Partenokarpi biasanya tanpa biji (seedless). Ciri-buah partenokarpi pada kelapa sawit ditunjukkan dengan bakal buah yang tidak mekar atau kuncup. Perbandingan buah normal dengan buah partenokarpi ditunjukkan pada Gambar 6.
[image:39.595.178.461.279.478.2]
Gambar 6. Bunga betina kelapa sawit normal (a) dan (b) buah partenokarpi kelapa sawit ( Pusat Penelitian Kelapa Sawit Marihat pada www.iopri.org, 2012).
Adapun kriteria pengamatan partenokarpi adalah sebagai berikut: 0 = Tidak ada partenokarpi
Untuk mendapatkan kriteria pengamatan partenokarpi (skoring) diperoleh dengan cara:
Pengambilan sampel gulma dilakukan sebanyak 4 kali yaitu pada 2, 4, 8, dan 12 minggu setelah aplikasi setelah aplikasi (MSA) ditunjukkan pada Gambar 7. Gulma diambil dengan menggunakan metode kuadrat berukuran 0.5 m x 0.5 m sebanyak satu titik pengambilan pada masing-masing tanaman untuk setiap sampel. Gulma yang ada didalam kuadran kemudian dipotong tepat setinggi permukaan tanah. Gulma yang masih hidup kemudian dipilah menurut spesiesnya kemudian dikeringkan dengan menggunakan oven selama 48 jam pada suhu 800c.
Pengeringan gulma dilakukan di Laboratorium Ilmu Gulma Universitas Lampung.
[image:40.595.196.446.449.565.2]
Gambar 7. Bagan pengambilan sampel gulma
Keterangan :
1 : Pengambilan sampel gulma 2 MSA 2 : Pengambilan sampel gulma 4 MSA 3 : Pengambilan sampel gulma 8 MSA 4 : Pengambilan sampel gulma 12 MSA
1
2 4
3
1
2 4
Persentase keracunan dan penutupan gulma diamati setiap 2, 4, 8, dan 12 MSA oleh 2 orang pengamat. Pengamatan dilakukan dengan metode visual pada setiap
V. KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil penelitian yang telah dilakukan dapat diambil kesimpulan sebagai berikut:
1. Herbisida aminosiklopilaklor dosis 50, 100, dan 200 g/ha dan herbisida pembanding aminopiralid+triklopir 384+216 g/ha yang digunakan dalam pengendalian gulma pada pertanaman kelapa sawit menghasilkan belum mampu memberikan informasi yang pasti mengenai partenokarpi pada kelapa sawit sampai dengan 12 minggu setelah aplikasi. Hal ini disebabkan tidak semua tanaman kelapa sawit mengeluarkan tandan buah/bunga selama penelitian berlangsung.
2. Herbisida aminosiklopilaklor dosis 50,100, dan 200 g/ha mampu mengendalikan pertumbuhan gulma total pada pertanaman kelapa sawit sampai dengan 8 MSA.
3. Herbisida aminosiklopilaklor dosis 50, 100, 200 g/ha dan
golongan rumput hingga 8 MSA, tetapi tidak mampu mengendalikan gulma golongan teki.
4. Herbisida aminosiklopilaklor dosis 50, 100, 200 g/ha dan aminopiralid+ triklopir 384+216 g/ha mampu mengendalikan gulma dominan Cleome rutidospermae hingga 12 MSA, Axonopus compressus hingga 8 MSA dan Digitaria ciliaris hingga 4 MSA.
5. 2 Saran
PUSTAKA ACUAN
Balai Pengkajian Teknologi Pertanian Lampung, 2008. Teknologi Budidaya Kelapa Sawit. Bandar lampung. http://lampung.litbang.deptan.go.id/ind/ images/stories/publikasi/sawit.pdf (diakses pada tanggal 7 Oktober 2012). Barus, E. 2003. Pengendalian Gulma Di Perkebunan : Efektivitas dan Efisiensi
Aplikasi Herbisida. Kanisius. Yogyakarta. 105 hal
Direktorat Jenderal Perkebunan. 2011. Lintasan 30 Tahun Pengembangan Kelapa Sawit di Indonesia : http://ditjenbun.deptan.go.id/tahunanbun/tahunan (diakses pada tanggal 7 Oktober 2012).
DowAgro, 2012. Herbisida Milestone. www. Dowagrosciences.co.id diakses pada tanggal 16 oktober 2012.
DuPont. 2012. Technical Bulletin of Aminocyclophyrachlor (Tutorial DPX MAT 28). DuPont Agricultural Bulletin, 8 hal.
Keong, W. C. 1987. Development of parthenocarpic fruits in oil palm (Elaeis guineensis Jacq.) due to application of herbicides. Journal Planter 1987 Vol. 63 No. 732 pp. 90-95. http://www.cabdirect.org/abstracts/ (Diakses pada tanggal 7 oktober 2012).
Moenandir, J. 1990. Fisiologi Herbisida. Jakarta. Rajawali.
National Pesticides Information Center, 2002. Triclopyr : General Fact Sheet, Oregon State University. http://npic.orst.edu/factsheets/triclogen.pdf (diakses pada tanggal 15 juni 2013).
Pahan, I. 2006. Panduan Lengkap Kelapa Sawit. Jakarta. Penebar Swadaya. Cetakan I, 412 hal.
Pardal, J. S. 2001. Pembentukan Buah Partenokarpi Melalui Rekayasa Genetika. Biogen.litbang.Deptan.go.id/terbitan/pdf/agrobio/. Balai Penelitian
Pardal, J. S., M. Ika, E.G. Lestari, dan Slamet. 2004. Regenerasi Tanaman dan Transformasi Genetic Salak Pondoh untuk Rekayasa Partenokarpi. Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian. Jurnal Bioteknologi Pertanian, Vol 9, No. 2, 2004. pp 49-55.
Pusat Penelitian Kelapa Sawit Marihat. 2012. Buah Mantel Kelapa Sawit. http//www.iopri.org// (Diakses pada 7 Oktober 2012).
Perkebunan Nusantara X, Tanpa Tahun. Vademecum Budidaya Kelapa Sawit dan Karet. Bandar Lampung. 163 hal.
Salisbury, F. B. dan C. W. Ross. 1992. Fisiologi Tumbuhan. Bandung : ITB Press.173 hal.
Sastrosayono, S. 2006. Budidaya Kelapa Sawit. Agromedia Pustaka. Yogyakarta. 66 hal.
Sembodo, D. R. J. 2010. Gulma dan Pengelolaannya. Graha Ilmu. Yogyakarta. 168 hal.
Siregar, A. Z. 2006. Kelapa Sawit: Minyak Nabati Berprospek Tinggi. Universitas Sumatera Utara, Medan.
Sriyani, N. 2012. Mekanisme Kerja Herbisida. Bahan Mata Kuliah Herbisida Lingkungan. Fakultas Pertanian- Universitas Lampung. 27 hal.
Soetarso. 1991. Ilmu Pemuliaan Tanaman. Jurusan Budidaya Pertanian Fakultas Pertanian Universitas Gajah Mada, Yogyakarta. 22 hal.
Sukamto, L. A. 1979. Tissue Culture Propagation of Atemoya and Starfruit. Proceedings 4th Annual Hawai Tropical Fruits Growers Confrence. Hawai, p 33-35.http://pustaka2.ristek.go.id/katalog/index.php/search
katalog/downloadDatabyId/522/522.pdf (diakses pada 7 Oktober 2012). Tomlin, C.D.S. 2011. The e-Pesticides manual. British Crop Protecion Council. Tu, M., Callie Hurd, John M. Randall. 2001. "Weed Control Methods Handbook:
Tools & Techniques for Use in Natural Areas". U.S. Government Documents (Utah Regional Depository). Paper 533.
http://digitalcommons.usu.edu/govdocs/533 (diakses pada tanggal 15 juni 2013).