i ABSTRAK
SINTESIS DAN KARAKTERISASI NANOTITANIA DARI TITANIUM ISOPROPOKSIDA SEBAGAI FUNGSI KONSENTRASI CaCl2
Oleh
JOHAR SITOHANG
Telah dilakukan sintesis dan karakterisasi nanotitania dengan metode sol-gel. Bahan awal yang digunakan adalah campuran titanium isopropoksida (TTIP) sebagai sumber titania (TiO2), methanol sebagai pelarut dan CaCl2 sebagai garam untuk reaksi. Dalam penelitian ini sampel yang disintesis adalah lima sampel TiO2 dengan perbandingan molar CaCl2 masing-masing 0,06; 0,08; 0,10; 0,11; 0,12 M sebanyak 200 µL yang diaduk selama 12 jam. Setelah diuapkan, sampel dikalsinasi pada temperatur 400 oC selama 12 jam. Sampel TiO2 berbentuk bubuk dikarakterisasi menggunakan X-Ray Diffraction (XRD), Scanning Electron Microscopy (SEM), Transmission Electron Microscopy (TEM) dan uji fotokatalis terhadap methylene blue (MB) dengan konsentrasi 5 ppm. Hasil karakterisasi XRD dengan konsentrasi CaCl2 0,12 M menunjukkan fasa kristal yang terbentuk didominasi fasa anatase, mikrostruktur TiO2 menunjukkan adanya pencampuran aglomerasi dan butir-butir kecil dalam skala nano. Rasio persentase massa Ti dan O adalah 57,87% dan 42,13%. Hasil Karakterisasi TEM dengan molaritas CaCl2 0,06 - 0,012 M menunjukkan ukuran butiran partikel dalam kisaran 15 - 23 nm. Hasil UV-Vis dengan konsentrasi CaCl2 0,12 M menunjukkan degradasi warna MB setelah 75 menit diperoleh 90,9% dibawah lampu UV dan 94,4% dibawah sinar matahari.
ii ABSTRACT
SYNTHESIS AND CHARACTERIZATION OF NANOTITANIA FROM TITANIUM ISOPROPOXIDE AS THE FUNCTION OF CaCl2
CONCENTRATION BY
JOHAR SITOHANG
Synthesis and characterization of nanotitania has been carried out by sol-gel method in methanol. Starting materials used are titanium isopropoxide (TTIP) as a titania (TiO2) source, methanol as solvent, and CaCl2 as salt for the reaction. This research is to synthesize of 5 samples of titania with the molar ratio of CaCl2 0,06, 0,08, 0,10, 0,11, and 0,12 M, respectively with 200 µL of TTIP. Samples were stirred for 12 hours in room temperature. After drying, the samples were calcined 400 ºC for 12 h. Samples then was characterized by X-Ray Diffraction (XRD), Scanning Electron Microscopy (SEM), Transmission Electron Microscopy (TEM), and photocatalyst test in methylene blue (MB) of 5 ppm. The result of XRD showed the phase is anatase. The microstructure of TiO2 still has an agglomeration mixture and small grains in nano scales. The ratio of mass percentage of Ti and O is 57,87% and 42,13%. The result of TEM characterization with 0,06 - 0,012 molarity of the CaCl2 showing that the particle size is in the range 15 - 23 nm. The degradation of MB after 75 min was obtained of 90,9% and 94,4% under UV ray and sunlight.
SINTESIS DAN KARAKTERISASI NANOTITANIA DARI TITANIUM ISOPROPOKSIDA SEBAGAI FUNGSI KONSENTRASI CaCl2
Oleh
JOHAR SITOHANG
Skripsi
Sebagai Salah Satu Syarat untuk Memperoleh Gelar SARJANA SAINS
Pada Jurusan Fisika
Fakultas Matematika dan Ilmu Pengetahuan Alam
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUN ALAM UNIVERSITAS LAMPUNG
v
RIWAYAT HIDUP
Penulis bernama Johar Sitohang dilahirkan di Huta Nagatimbul, Desa Baringin, Kecamatan Parlilitan pada tanggal 07 November 1990 sebagai anak keenam dari delapan bersaudara dari pasangan Abner Sitohang dan Jenna Sihotang.
Penulis menyelesaikan pendidikan Sekolah Dasar Negeri No 173509 Baringin pada tahun 2003, Sekolah Menengah Pertama (SMP) di SLTP Negeri 2 Parlilitan pada tahun 2006 dan Sekolah Menengah Atas (SMA) di SMA Gajah Mada Bandar Lampung pada tahun 2009.
vii
Dengan rasa syukur atas kasih dan anugrah Tuhan Yesus Kristus karya kecil ini
kupersembahkan kepada:
“ Umaku naso marnaloja manamiangkon au jala dang diboto
ho panas ni ari
manang udan namangula lao pasikkolan hami gellengmu, Mauliatema ma disude
na akka pengorbananmi sai ganjang mau umurmu jala sai las ma roham
”.
“
Abang, ito dan Adekku yang tak henti-hentinya selalu memotivasi,
memberikan doa sepanjang waktu dan sumbangan dana sampai perkuliahan
selesai”.
vi
MOTO
“Segala perkara dapat kutanggung didalam Dia yang memberi kekuatan
kepadaku”. (Filipi 4:13)
“
Allah tidak pernah mempertanyakan kemampuan dan ketidakmampuan kita,
melainkan kesediaan kita
”
. (Fletcher)
“Jalani hidupmu dengan santai, senang dan
tenang lalu nikmati setiap hari
”.
(Penulis)
ix
SANWACANA
Pujian dan syukur penulis panjatkan kehadirat Tuhan Yang Maha Kuasa, karena penulis menyadari atas berkat dan lindunganNya skripsi ini dapat diselesaikan. Skripsi dengan judul “ Sintesis dan Karakterisasi Nanotitania dari Titanium Isopropoksida sebagai Fungsi Konsentrasi CaCl2” adalah salah satu syarat
untuk memperoleh gelar sarjana Sains di Universitas Lampung.
Penulisan skripsi ini tidak terlepas dari bimbingan, bantuan, informasi serta motivasi dari berbagai pihak. Oleh karena itu, dengan segala ketulusan dan kerendahan hati penulis sampaikan banyak terima kasih kepada:
1. Bapak Posman Manurung, sebagai dosen pembimbing pertama, yang telah memberikan bimbingan, saran, solusi, pengarahan, waktu, dan bantuan yang begitu besar sehingga dapat menyelesaikan skripsi ini.
2. Bapak Rudy. T. M. Situmeang, sebagai dosen pembimbing kedua, yang telah memberikan bimbingan yang berdasarkan motivasi sehingga dalam penyelesaian ini skripsi ini menjadi lebih sempurna.
x
4. Bapakku A. Sitohang (+) yang amat kusayangi, kubanggakan dan sangat merindukanmu. Sangat berterimakasih atas perjuangan dimasa hidupmu yang tak kenal lelah untuk memperjuangkan kami anakmu.
5. Mamakku tercinta yang tak kenal lelah dan selalu memotivasi, memberikan doa dan semangat yang tiada henti dalam setiap detik hidupku.
6. Abang Makmur Sitohang, Bertoni Sitohang, ito Roma Sitohang, Marini Sitohang, Rianti Sitohang, Mariana Sitohang, Adek Hotmauli Sitohang yang telah berjuang untuk mendanai penulis selama kuliah dan selalu memberikan semangat dan doa.
7. Ibu Liza di Laboratorium Kimia Anorganik FMIPA Unila yang telah menyediakan peralatan penulis dalam penelitian.
8. Siti Fadillah dan Dani partner penelitian, teman berbagi suka dan duka dalam penelitian.
9. Bang Hasting Simbolon, Indra Pardede, Pascoli Hanes, Fredy Sidauruk, Muhammad Sholeh, Hartono Simanjuntak, Franata Simanjuntak, Jonni Parlindungan Nainggolan, Uli Hotmauli Situmorang dan semua angkatan 2009 yang selalu membantu dan memotivasi penulis dalam penelitian.
Bandar Lampung, April 2015 Penulis
xi DAFTAR ISI
Halaman
ABSTRAK ... i
HALAMAN PERSETUJUAN ... iii
HALAMAN PENGESAHAN ... iv
RIWAYAT HIDUP ... v
MOTTO ... vi
PERSEMBAHAN ... vii
KATA PENGANTAR ... viii
SANWACANA ... ix
DAFTAR ISI ... xi
DAFTAR GAMBAR ... xiii
DAFTAR TABEL ... xvi
I. PENDAHULUAN A.Latar Belakang ... 1
B. Rumusan Masalah ... 4
C.Batasan Masalah ... 4
D.Tujuan Penelitian ... 5
E. Manfaat Penelitian ... 5
II. TINJAUAN PUSTAKA A.Definisi Nanopartikel... 6
B. Titanium Dioksida (TiO2) ... 7
C.Struktur Titanium Dioksida ... 9
D.Kalsium Klorida (CaCl2) ... 12
xii
F. Sintesis Nanotitania dengan Variasi Garam ... 14
G.Sintesis Nanopartikel dengan Metode Sol-gel ... 17
H.X-Ray Diffraction (XRD) ... 22
I. Transmission Electron Microscopy (TEM) ... 23
xvi
DAFTAR TABEL
Tabel Halaman
2.1 Karakteristik fasa-fasa TiO2 ... 11
4.1 Hasil analisis puncak-puncak fasa sampel TiO2 ... 38
4.2 Ukuran partikel partikel TiO2 konsentrasi CaCl2 0,06 M ... 48
4.3 Ukuran partikel partikel TiO2 konsentrasi CaCl2 0,08 M... 49
4.4 Ukuran partikel partikel TiO2 konsentrasi CaCl2 0,10 M ... 51
4.5 Ukuran partikel partikel TiO2 konsentrasi CaCl2 0,11 M ... 52
4.6 Ukuran partikel partikel TiO2 konsentrasi CaCl2 0,12 M ... 53
4.7 Ukuran Partikel pada masing-masing konsentrasi CaCl2... 54
4.8 Standar absorbansi MB dalam 1; 2; 3 dan 4 ppm ... 62
4.9 Penurunan konsentrasi MB yang diaktivasi lampu UV ... 63
xiii DAFTAR GAMBAR
Gambar Halaman 2.1 Struktur kristal fasa anatase TiO2. Sumber: Software yang
digunakan untuk menggambar PCW versi 2.3 yang menunjukkan bulatan biru (Ti+4) dan bulatan hijau (O-2) (Nolze
and Kraus, 1999) dan data referensi oleh Howard et al, (1991) ... 10
2.2 Struktur kristal TiO2 (rutil). Model TiO2 yang digunakan adalah TiO2 sistem tetragonal dengan parameter kisi a = b = 4,594 Å dan c = 2,959 Å (Kennedy and Stampe, 1991). Software yang digunakan untuk membuat pemodelan adalah PCW yang menunjukkan bulatan hijau (Ti+4) dan bulatan coklat (O-2) (Kraus and Nolze, 1995) ... 11
2.3 Skema umum proses pembuatan sol-gel ... 19
2.4 Diagram X-Ray Difraktometer ... 22
2.5 Komponen utama TEM ... 25
3.1 Diagram alir penelitian TiO2 ... 32
4.1 Hasil Preparasi TiO2 dengan larutan CaCl2 yang ditunjukkan pada botol kiri 0,06; 0,08; 0,10; 0,11; 0,12M ... 36
4.2 Hasil pengeringan TiO2 pada suhu 65 oC ... 35
4.3 Hasil kalsinasi TiO2 pada suhu 400 oC ... 36
xiv ditransmisikan) dengan panjang gelombang 665 nm (Ardizzone et al., 1993) ... 56
4.14 Proses uji aktifitas fotokatalitik TiO2 pada penguraian MB dengan aktivasi (a) Sinar matahari (b) Lampu UV (c) Hasil penyinaran dengan sinar matahari selama 75 menit (d) Hasil penyinaran dengan lampu UV selama 75 menit ... 57
4.15 Hubungan absorbansi terhadap panjang gelombang (nm) dengan sinar matahari selama 75 menit ... 59
4.16 Hubungan absorbansi terhadap panjang gelombang (nm) dengan Lampu UV selama 75 menit ... 59
xv
4.18 Hubungan anatara waktu radiasi (menit) terhadap degradasi (%)
saat diberikan lampu UV ... 63 4.19 Hubungan anatara waktu radiasi (menit) terhadap absorbansi
(a.u) saat diberikan lampu UV ... 64 4.20 Hubungan waktu radiasi terhadap persentase degradasi MB saat
diberi sinar matahari ... 66 4.21 Hubungan waktu radiasi terhadap absorbansi MB diberi sinar
1
I. PENDAHULUAN
A. Latar Belakang
Nanopartikel saat ini menjadi perhatian para peneliti untuk pengembangan dalam ilmu pengetahuan dan teknologi. Bahan material dalam skala nano yang dapat meningkatkan sifat fisik, mekanik dan kimia suatu material tanpa harus merusak struktur atomnya. Dalam penelitian Willem dan Wildenberg (2005) mengatakan karakteristik spesifik dari nanopartikel bergantung pada ukuran, distribusi, morfologi, dan fasanya. Nanopartikel adalah koloid padat yang memiliki ukuran dengan kisaran 1-100 nm (Hosokawa et al., 2007). Nanopartikel terdiri dari makro molekul material yang sudah direduksi ukuran secara top-down (pembuatan struktur yang kecil dari material yang berukuran besar) secara bottom-up (penggabungan atom-atom atau molekul-molekul menjadi partikel yang berukuran lebih besar (Alleman, 1993).
2
struktur atomnya, titanium dioksida (TiO2) adalah salah satu jenis nanomaterial yang cukup berkembang (yang sangat menarik untuk diteliti saat ini). Sifat fisika dan kimia yang baik menjadikan TiO2 sebagai bahan yang terus dikembangakan untuk diaplikasikan ke berbagai teknologi. Titanium dioksida merupakan nanomaterial yang bersifat semikonduktor yang dapat menghantar listrik, sifat logam yang kuat, ringan dan memiliki kerapatan yang rendah (Setiawati et al., 2006).
Pengembangan bahan TiO2 sampai pada skala nanoteknologi dengan pemanfaatan sebagai bahan fotokatalisis untuk ultraviolet (Seery et al., 2007), katalis (Pelaez et al., 2010), keramik (Haugen et al., 2004), disentisasi zat warna dengan sel surya (O'regan, and Grätzel, 1991; Shin et al., 2011), dan pengolahan air minum berbasis sel surya (Salih et al, 2007). Selain itu, secara potensial nanopartikel dapat dibutuhkan ke dalam bidang nanotoksikologi untuk mempelajari tentang pengaruh ukuran nanopartikel tersebut.
3
NaCl dan HCl, pengontrolan ukuran partikel dengan konsentrasi larutan garam yang berbeda-beda (Look et al., 1992).
Fungsional nanopartikel TiO2 monodisperse berbasis fluorescent (berdiameter >70 nm) dilaporkan dapat diperoleh menggunakan EuCl3 untuk mengontrol kekuatan ion dengan konsentrasi larutan garam yang berbeda (Tan et al., 2006). Eun et al., 2009 melaporkan bahwa TiO2 monodisperse adalah bola berongga (berdiameter >40 µm) yang disintesis menggunakan fungsional nanopartikel yang melekat pada perangkat mikrofluida.
Banyak metode yang sudah dilakukan dalam pembuatan bahan nano TiO2 seperti metode sol-gel (Guan et al., 2001), metode mikroemulsion (Hseieh et al., 2008), metode presipitasi (Parida et al., 2009) dan metode hidrothermal (Lu et al., 2008). Pada penelitian ini, metode yang digunakan adalah metode sol-gel. Pemakaian metode ini didasari oleh proses yang mudah dilakukan, ramah lingkungan, biaya relatif lebih murah dan proses sintesis monodisperse yang homogen. Menurut Han et al., (2011) proses sederhana dalam pengembangan bahan nano titania monodisperse untuk fotokatalis dengan metode sol-gel menggunakan CaCl2 dengan konsentrasi 0,05 M sampai 0,15 M dapat ditemukan ukuran nanopartikel pada kisaran 10-300 nm.
4
TiO2 kemudian dikalsinasi pada 400 oC selama 12 jam untuk menghasilkan nanokristalin anatase TiO2. Untuk mengetahui struktur kristal bahan diuji dengan karakterisasi X-ray diffraction (XRD) dan Transmisi Electron Microscopy (TEM) sebagai penguji terbentuknya nanopartikel titania yang kecil.
B. Rumusan Masalah
Berdasarkan latar belakang yang telah dikemukakan, maka dibuat rumusan masalah dari penelitian yaitu bagaimana pengaruh konsentrasi CaCl2 dengan TTIP pada pembentukan fasa kristalin dan ukuran rata-rata partikel TiO2 setelah kalsinasi 400 oC?
C. Batasan Masalah
Penelitian ini dibatasi pada beberapa masalah, yakni:
1. Pembahasan dibatasi pada sintesis nanotitania berbasis TTIP dan CaCl2 dengan metode sol-gel.
2. Konsentrasi molaritas larutan CaCl2 dimulai dari 0,06; 0,08; 0,10; 0,11 dan 0,12 M.
3. Suhu kalsinasi yang digunakan pada penelitian ini adalah 400 oC.
5
D. Tujuan Penelitian
Sesuai dengan rumusan permasalahan yang diajukan maka tujuan yang ingin diperoleh adalah:
1. Mengetahui sintesis TTIP dengan menggunakan metode sol-gel serta pengaruh molaritas CaCl2 terhadap struktur dan mikrostruktur pada suhu 400 oC.
2. Mengetahui kemampuan degradasi katalis TiO2 terhadap Methylene blue (MB) dengan lampu UV dan sinar matahari.
3. Mengetahui sifat material yang dihasilkan melalui karakterisasi dengan XRD, SEM, EDS, TEM dan analisis spektrum UV-Vis.
E. Manfaat Penelitian
Penelitian ini diharapkan dapat bermanfaat terutama bagi para peneliti dibidang fisika nanomaterial, kimia-fisika. Adapun manfaat adalah sebagai berikut:
1. Dapat mensintesis TiO2 dari bahan isopropoksida.
2. Memberikan informasi mengenai pembentukan nanotitania dengan menggunakan metode sol-gel.
3. Hasil penelitian ini diharapkan dapat dimanfaatkan sebagai dasar untuk mengembangkan sintesis nanotitania dari bahan titanium isopropoksida dengan metode sol gel.
6
II. TINJAUAN PUSTAKA
A. Definis Nanopartikel
Nanomaterial merupakan suatu pondasi nanosains dan nanoteknologi yang memiliki potensi untuk merevolusi cara di mana bahan dan produk yang berdampak komersial yang signifikan dimasa mendatang dalam dunia teknologi seperti elektronik, kedokteran dan bidang lainya (Alagarasi, 2011). Pengembangan metoda sintesis nanopartikel merupakan salah satu bidang yang menarik minat peneliti dalam pembuatan nanopartikel dengan ukuran yang kurang dari 100 nm yang memiliki sifat kimia dan fisika yang lebih baik dibandingkan dengan material sejenis yang memiliki ukuran lebih besar (Hosokawa et al, 2007).
7
B. Titanium Dioksida (TiO2)
Titanium adalah sebuah unsur kimia dalam tabel periodik yang memiliki simbol Ti dan nomor atom 22 merupakan logam transisi yang ringan, kuat, tahan terhadap korosi sehingga banyak digunakan untuk mesin turbin, industri kimia, serta tahan panas (1680 ºC – 3260 ºC). Reverend William Gregor merupakan penemu pertama titanium pada tahun 1791 di Inggris yang pada waktu itu diberi nama ilmenite. Logam titanium keberadaanya selalu berikatan dengan mineral lainya seperti ilmenite, leucoxene, anatase, brookite dan sphene yang ditemukan dalam titanat. Titanium juga dapat ditemukan dalam batu bara, abu, tanaman, dan dalam tubuh manusia (Carp et al, 2004).
Sedangakan TiO2 adalah nanomaterial yang bersifat semikonduktor yang dapat menghantarkan listrik, sifat logam yang kuat, ringan dan memiliki kerapatan yang rendah (Fitriana, 2014). TiO2 merupakan senyawa yang tersusun atas ion Ti4+ dan O2- dalam octahedron. Keelektronegatifan atom Ti dan atom O dalam skala Pauling adalah 1,54 dan 3,44. Perbedaan keelektronegatifan antara kedua atom tersebut adalah 1,90. Dengan demikian senyawa TiO2 adalah senyawa ionik yang dibentuk dari ion-ion Ti4+ dan ion O2- . Perananan TiO2 dalam bidang industry adalah sebagai pigmen, adsorben, pendukung katalitik, dan semikonduktor (Setiawati et al, 2006).
8
surya (Hariyadi, 2010), fotokatalis (Palupi, 2006), sensor biologis dan kimia, serta produk kesehatan hingga pigmentasi cat (Gratzel, 2003). TiO2 sering digunakan karena memiliki daya oksidatif dan stabilitas yang tinggi terhadap fotokorosi, murah, mudah didapat dan tidak menimbulkan bahaya keracunan (Smestad, 1998). Aplikasi ini tidak hanya bergantung pada sifat-sifat bahan TiO2 itu sendiri tetapi juga dengan modifikasi bahan TiO2 dan interaksinya dengan lingkungan (Chen, 2007). Meskipun unsur yang tidak reaktif, TiO2 dapat bereaksi dengan unsur-unsur non logam seperti hidrogen, halogen, oksigen, karbon boron, silikon dan sulfur pada suhu tertentu. Senyawa TiO2 dikenal tidak toksik, memiliki stabilitas termal cukup tinggi dan kemampuanya dapat dipergunakan berulang kali tanpa kehilangan aktivitas katalitiknya (Fatimah, 2009).
9
C. Struktur Titanium Dioksida
TiO2 mempunyai 3 macam struktur kristal, yaitu anatase, rutil, dan brookit (Fujishima et al, 1999). Sifat lain TiO2 yang dihasilkan dari proses sintesis merupakan memiliki beberapa fasa tambahan sebagai bentuk tegangan tinggi, seperti monoklinik baddelite orthrombik α-PbO2 yang keduanya ditemukan di Ries Crater, Bavaria (Goresy et al, 2011).
Anatase merupakan bentuk yang paling sering digunakan karena memiliki luas permukaan serbuk yang lebih besar serta ukuran partikel yang lebih kecil dibandingkan rutil. Fasa anatase mulai muncul pada rentang suhu 400 – 650 °C dan cenderung bertransformasi menjadi rutil pada suhu 915 °C (Afrozi, 2010). Fase rutil dipreparasi dengan kalsinasi anatase pada suhu tinggi. Fasa rutil TiO2 menunjukkan fotoaktivitas yang lebih rendah daripada fasa anatase. Selain itu, bandgap energi anatase lebih besar daripada rutil sehingga memiliki aktivitas fotokatalitik yang tinggi. Namun, beberapa sumber melaporkan bahwa preparasi rutil pada suhu rendah telah berkembang dan menghasilkan fotoaktivitas yang cukup tinggi (Palmisano, 2007). Pada fasa brookite dengan struktur kristalnya orthrombik yang menyebabkan sulit untuk dipreparasi sehingga biasanya hanya kristal pada fasa rutil dan anatase yang umum digunakan pada untuk berbagai aplikasi industri.
10
sepuluh oktahedral lainya dengan cara masing-masing dua diberbagai tepi dan delapan berbagai sudut. Struktur kristal dalam fasa anatase ditunjukkan pada Gambar 2.1.
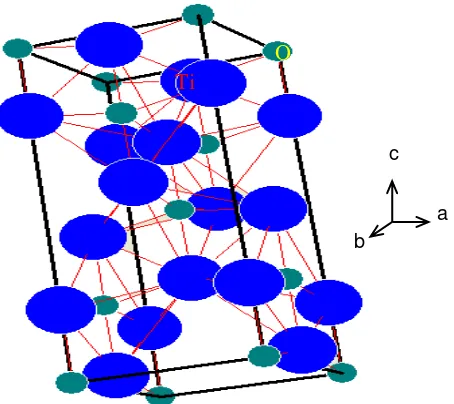
Gambar 2.1. Struktur kristal fasa anatase TiO2. Sumber: Software yang digunakan untuk menggambar PCW versi 2.3 yang menunjukkan bulatan biru (Ti+4) dan bulatan hijau (O2-) (Nolze and Kraus, 1999) dan data referensi oleh Howard et al, (1991).
Dalam Gambar 2.1 menunjukkan struktur kristal TiO2 fasa anatase. Ti+4 ditunjukkan dengan bulatan besar yang berwarna biru (13 atom) dan O2- ditunjukkan dengan bulatan kecil yang berwarna hijau (19 atom). Gambar fasa anatase di atas disebut juga ditetragonal karena bidangnya dapat dibagi dua menjadi tetragonal. Struktur kristal dalam fasa rutil yang ditunjukkan dalam Gambar 2.2.
O
Ti
a c
11
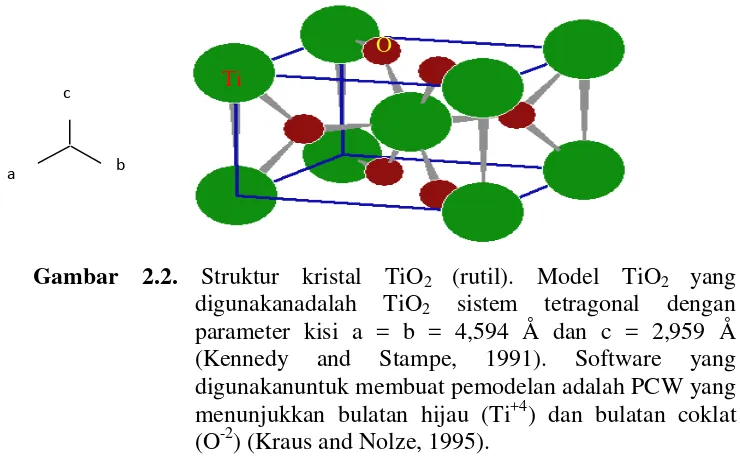
Gambar 2.2. Struktur kristal TiO2 (rutil). Model TiO2 yang digunakanadalah TiO2 sistem tetragonal dengan parameter kisi a = b = 4,594 Å dan c = 2,959 Å (Kennedy and Stampe, 1991). Software yang digunakanuntuk membuat pemodelan adalah PCW yang menunjukkan bulatan hijau (Ti+4) dan bulatan coklat (O-2) (Kraus and Nolze, 1995).
Gambar 2.2 menunjukkan struktur kristal TiO2 fase rutil, Ti4 ditunjukkan bulatan besar berwarna hijau dan 1,35 Å untuk O2
oleh bulatan kecil berwarna coklat. Struktur kristal rutil pertama kali ditemukan oleh Vegard pada tahun 1916 (Thomas dan Zhou, 1992). Setiap atom titanium dikelilingi oleh 6 atom oksigen diperkirakan pada enam sudut yang teratur dan setiap atom oksigen dengan tiga atom titanium diperkirakan pada sudut tiga sama sisi. Karakterisasi dari fasa-fasa TiO2 ditunjukkan pada Tabel 2.1.
Tabel 2.1. Karakteristik dari fasa-fasa TiO2.
Karakteristik Rutile Anatase Brookite
Bentuk Kristal Tetragonal Tetragonal Orthogonal
12
D. Kalsium Klorida (CaCl2)
Garam dalam ilmu kimia merupakan senyawa ionik yang terdiri dari ion positif (kation) dan ion negatif (anion), sehingga dapat membentuk senyawa netral (tanpa bermuatan). Kalsium klorida merupakan salah satu jenis garam yang terdiri dari unsur kalsium (Ca+) dan klorin (Cl-). Garam ini berwarna putih dan mudah larut dalam air. Kalsium klorida tidak berbau, tidak berwarna, dan tidak mudah terbakar. Kalsium klorida termasuk dalam tipe ion halida, dan padat pada suhu kamar. Kalsium klorida dapat berfungsi sebagai sumber ion kalsium dalam larutan, tidak seperti banyak senyawa kalsium lainnya, kalsium klorida mudah larut. Zat ini dapat berguna untuk menggantikan ion dari larutan.
Proses pembuatan kalsium klorida bisa dengan pencampuran asam klorida dan kalsium hidroksida seperti pada reaksi berikut:
Ca(OH)2 + HCl CaCl2 + H2O ... (2.1) Kalsium klorida dapat dihasilkan juga dari kalsium karbonat dan asam klorida.
CaCO3 + HCl CaCl2 + H2CO3 ... (2.2) Adapun batu kapur digunakan dalam pembuatan kalsium klorida karena mengandung kalsium dengan kadar yang paling tinggi yaitu sebesar 98,9% (Asalim, 2011).
13
rumput laut sehingga dapat menghasilkan abu soda dan untuk keperluan medis (Ahfiladzum, 2011; Asalim, 2011).
E. Titanium Isopropoksida
TTIP merupakan suatu cairan berwarna jerami yang memiliki titik didih 238 oC pada suhu kamar dengan Standard Temperature and Pressure (STP). Titanium isopropoksida, juga sering disebut sebagai titanium tetraisopropoxide adalah senyawa kimia dengan rumus Ti{OCH(CH3)2}4 yang mempunyai molekul tetra hedral diamagnetik dan salah satu struktur alkoksida yang kompleks. Alkoksida berasal dari alkohol bulkier seperti isopropanol. Biasanya titanium alkokisida ini digunakan dalam sintesis bahan ilmu organik. Titanium isopropoksida merupakan suatu monomer dalam pelarut nonpolar. Adapun proses dekomposisi TTIP dapat dijelaskan dengan reaksi sebagai berikut:
Ti(OC3H7)4 Ti(OC3H7)4-x + x(OC3H7) (< 350K) ... (2.3) OC3H7 C3H6O + H (600 K) ... (2.4) OC7H7 C3H6 + OH (620 K) ... (2.5) 2Ti(OC3H7) 2Ti + HOC3H7 + OC3H6 (890 K) ... (2.6) Ti(OC3H7) (Ti – OH) + C3H6 (930 K) ... (2.7) 2TiOH + O2 2TiO2 + H2 (>1000 K) ... (2.8)
14
ligan isopropoxy mengalami dekomposisi menjadi propylene dan hydroxyl (persamaan reaksi 2.5). Sedangkan TTIP yang belum terdekomposisi pada persamaan 2.3, akan mengalami proses dekomposisi pada temperatur yang lebih tinggi. Pada temperatur 890 K, TTIP yang belum terdekomposisi sempurna akan mengalami dekomposisi menjadi titanium, isopropanol dan aceton (persamaan reaksi 2.6). Selanjutnya pada temperatur 930 K, TTIP yang belum terdekomposisi sempurna akan mengalami dekomposisi menjadi titanium hydroxyl dan propylene (persamaan reaksi 2.7). Pada tahap akhir pendekomposisian terjadi pada temperatur lebih dari 1000 K, titanium hydroxyl bereaksi dengan oksigen sehingga dihasilkan titanium oksida dan hidrogen (Cho et al., 2001).
F. Sintesis Nanotitania dengan Variasi Garam
15
pembentukan terjadi merata diseluruh larutan. Tergantung konsentrasi, pembentukan partikel yang terlihat mulai setelah beberapa detik atau menit terdapat suspensi butiran TiO2 yang merata. Setelah pengadukan beberapa menit dihentikan, lalu dikumpulkan pada filter Millipore dan dicuci dengan etanol dan siap dikarakterisasi. Dari berbagai konsentrasi garam dalam etanol menunjukkan perubahan nano tidak berpengaruh signifikan pada ukuran partikel tetapi tidak mempengaruhi distribusi ukuran partikel. Partikel monodisperse TiO2 yang lebih bagus dapat di peroleh dengan penambahan garam halida alkali dan nitrat. Dengan halida alkali bahwa ukuran partikel berkurang dengan peningkatan kekuatan ion reaksi larutan. Garam lithium klorida didapatkan ukuran partikel lebih dari 500 nm sedangkan dengan penggunaan cesium klorida menghasilkan ukuran partikel 200 nm. Namun, pada medium KCl mendapatkan ukuran partikel yang signifikan 50 nm. Dalam hal ini kekuatan ion dapat mengikat sebagian besar molekul air sehingga zeta potensial meningkat secara signifikan dengan diikuti peningkatan kationnya.
16
proses refluks. Kedua macam sampel Fe-TiO2 dikarakterisasi dengan XRD, spektrofotometer Fourier Transform Infrared (FTIR) dan spektrofotometer Diffuse Reflectance UV-Vis (DR-UV). Hasil analisis XRD menunjukkan bahwa Fe-TiO2 yang disintesis dengan metode sol gel memiliki ukuran kristal yang relatif lebih kecil (12 nm) apabila dibandingkan dengan metode impregnasi (46 nm). Hasil analisis FTIR kedua macam sampel Fe-TiO2 menunjukkan adanya persamaan yaitu adanya daerah serapan pada bilangan gelombang 2200 cm-1 yang mengindikasikan bahwa Fe telah terdoping ke dalam TiO2. Hasil analisis DR-UV kedua macam sampel Fe-TiO2 menunjukkan terjadinya kenaikan responsivitas terhadap sinar tampak dan pergeseran serapan tepi menuju panjang gelombang yang lebih besar yaitu menuju daerah sinar tampak.
17
ukuran partikel nanometer yang terkecil dan sebaliknya dengan konsentrasi yang terkecil mendapatkan nanometer yang besar.
G. Sintesis Nanopartikel dengan Metode Sol-Gel
Beberapa metode proses sintesis nanotitania dengan metode sol-ge dilakukan karena ukuran dari partikel, ketebalan film dan porositas dapat dikontrol dengan menyesuaikan beberapa parameter seperti temperatur hidrotermal, kondisi sintering dan konsentrasi sol. Dalam hal ini, proses sol-gel memiliki keuntungan seperti sifat kemurnian, homogenitas, struktur mikro yang dapat dikontrol, proses pengolahan yang mudah, suhu rendah, dan kemampuan untuk melapisi substrat (Alphonse, 2010). Selain itu, investasi peralatan untuk proses sintesis dengan metode sol-gel relatif lebih murah dibanding teknik deposisi secara fisika (Yuwono et al, 2010).
18
reaksi kimia dalam larutan pada suhu rendah (Ferdiansyah, 2009). Pada proses tersebut terjadi perubahan fasa dari suspensi koloid (sol) membentuk fasa cair kontinyu (gel) yang akhirnya akan berubah menjadi padatan nanostruktur. Pada proses sol-gel prekursor logam yang reaktif seperti metal alkoksida terhidrolisis dengan air, dan senyawa yang terhidrolisis dibiarkan mengalami kondensasi satu sama lain untuk membentuk endapan nanopartikel metaloksida. Endapan tersebut nantinya dibiarkan untuk mengering dan perlu dilakukan kalsinasi pada temperatur tinggi untuk membentuk nanopartikel metal oksida yang kristalin (Skandan and Singhal, 2006).
19
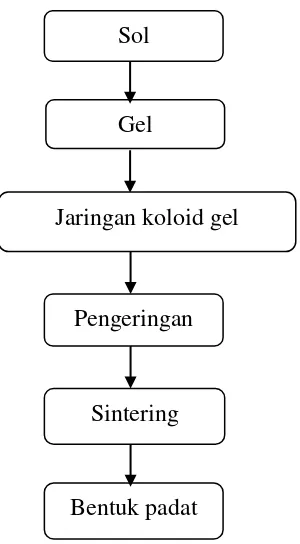
Gambar 2.3. Skema umum proses pembuatan sol-gel.
Gambar 2.3 menunjukkan proses sol-gel meliputi pembentukan larutan, pembentuka gel, penuaan (aging), pengeringan dan pemadatan (densification). Mekanisme-mekanisme yang terlibat dalam rangkaian proses sol-gel terdiri dari tahapan hidrolisi dan kondensasi (Yuwono, 2010). Tahapan secara detil proses sol-gel berikut:
1. Hidrolisis
Pada tahap pertama proses sol-gel, prekursor berupa alkoksida logam (M(OR)n,) dilarutkan dalam alkohol dan terhidrolisis dengan penambahan air pada kondisi asam, netral atau basa menghasilkan sol-koloid. Hidrolisis ini dapat terjadi karena serangan atom oksigen dari molekul air sehingga gugus (-OR) pada prekursor digantikan dengan gugus hidroksil (-OH) seperti ditunjukkan pada persamaan reaksi 2.9 berikut:
Sol
Gel
Jaringan koloid gel
Pengeringan
Sintering
20
M (OR)z + H2O M(OR) (z-1) (OH) + ROH ... (2.9) Secara detil reaksi hidrolisis di atas terjadi melalui beberapa tahapan reaksi sebagai berikut:
a. Kation Mz+ dari prekursor alkoksida atau garam mengalami serangan nuklofilik oleh atom oksigen dari molekul air.
b. Selanjutnya, terjadi transfer proton dari molekul air ke group –OR pada atom logam prekursor.
c. Gugus hidroksil menempel ke atom logam dengan menggantikan gugus pada prekursor dan di ikuti dengan pelepasan molekul R-OH.
Secara skematis tahapan reaksi hidrolisis yang terjadi dapat dituliskan dalam persamaan berikut.
M(OR)4 + H2O (HO) M (OR)3+ R - OH ... (2.10) (OH)M(OR)3 + H2O (HO)2M(OR)2 + R - OH ... (2.11) (OH)M(OR)2+ H2O (HO)3M(OR) + R - OH ... (2.12) (OH)3M(OR) + H2O M(OH)4 + R – OH ... (2.13) Proses hidrolisis yang lebih lambat dan terkontrol umunya menghasilkan ukuran partikel yang lebih kecil dan karakteristik yang lebih unik. Oleh karena itu parameter-parameter yang perlu dikontrol yaitu konsentrasi air, alkohol, prekursor, pH larutan, temperatur proses, pemilihan prekursor (struktur molekul, karakteristik ikatan).
2. Kondensasi
21
Singhal, 2006). Pada tahap kondensasi, molekul-molekul alkoksida yang telah terhidrolisis dalam bentuk group hidroksida (M-OH) akan saling terhubung membentuk molekul-molekul logam yang lebih besar melalui reaksi berantai. Bentuk molekul-molekul yang dihasilkan tersebut mirip dengan molekul polimer, sehingga tahap kondensasi ini sering disebut reaksi polimerisasi. Pada tahap kondensasi, dapat terjadi pelepasan alkohol atau air melalui persamaan reaksi berikut.
Kondensasi alkohol:
M – OR + HO – M M – O – M + R – OH ... (2.14) Kondensasi air:
M – OH + HO – M M – O – M + H – OH ... (2.15) Terjadinya kedua sub-reaksi diatas menunjukkan bahwa tahapan kondesasi dapat dimulai tanpa harus menunggu tahap hidrolisis pada reaksi 2.10 - 2.13 secara sempurna selesai. Kedua sub reaksi 2.14 dan 2.15 sama-sama akan menghasilkan jembatan M-O-M. Oleh sebab itu, kedua tahapan hidrolisis dan kondensasi dapat terjadi secara simultan sesaat setelah hidrolisis dimulai dan menghasilkan M-OR dan M-OH.
3. Pematangan (Aging)
Pada tahapan pematangan, gel yang telah terbentuk akan akan didiamkan menjadi lebih kaku, kuat dan menyusut didalam larutan. Proses ini lebih dikenal dengan nama proses aging.
4. Pengeringan
22
H. X-ray diffraction (XRD)
X-ray difraktometer adalah merupakan instrumen yang digunakan untuk mengidentifikasi struktur kristal dan fasa dalam suatu bahan dengan memanfaatkan radiasi gelombang elektromagnetik sinar-X. XRD dilengkapi beberapa komponen penting seperti: tabung sinar-X, monokromator, detektor, dan beberapa alat optik lain. Bagan XRD ditunjukkan pada Gambar 2.4.
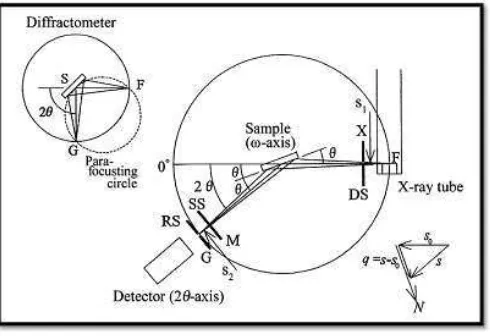
Gambar 2.4. Diagram X-Ray Difraktometer (Waseda et al, 2011)
Gambar 2.4 menunjukkan sinar-X dihasilkan di suatu tabung sinar katode dengan pemanasan kawat pijar untuk menghasilkan elektron-elektron, kemudian elektron-elektron tersebut dipercepat terhadap suatu target dengan memberikan suatu voltase, dan menembak target dengan elektron. Ketika elektron-elektron mempunyai energi yang cukup untuk mengeluarkan elektron-elektron dalam target, spektrum karakteristik sinar-X dihasilkan. Spektrum ini terdiri atas beberapa komponen-komponen, yang paling umum adalah Kα dan Kβ. Kα terdiri
23
Kα2. Panjang gelombang yang spesifik merupakan karakteristik dari bahan target
(Cu, Fe, Mo, Cr). Kertas perak atau kristal monokromator akan menyaring dan menghasilkan sinar-X monokromatik yang diperlukan untuk difraksi. Tembaga adalah bahan sasaran yang paling umum untuk diffraksi kristal tunggal, dengan
radiasi CuKα = 1,5406 Å. Saat sampel dan detektor diputar, intensitas Sinar-X pantul itu direkam. Ketika geometri dari peristiwa sinar-X tersebut memenuhi persamaan Bragg, interferensi konstruktif terjadi dan suatu puncak di dalam intensitas terjadi. Detektor akan merekam sinyal penyinaran ini dan mengkonversi sinyal itu menjadi suatu arus yang akan dikeluarkan pada layar komputer.
Hukum Bragg merupakan perumusan matematika tentang persyaratan yang harus dipenuhi agar berkas sinar-X yang dihamburkan tersebut merupakan berkas difraksi. Sinar-X dihasilkan dari tumbukan antara elektron kecepatan tinggi dengan objek target. Persamaan hukum Bragg ditulis:
λ= 2 d sin θ ... (2.16) dengan d adalah jarak antar bidang, λ adalah panjang gelombang sinar-X, θ sudut hamburan difraksi. Dari persamaan tersebut, maka dapat diketahui ukuran unit sel dan distribusi atom yang terdapat pada unit sel tersebut (Puri and Babbar, 1997).
I. Transmission Electron Microscopy (TEM)
24
sampel dan menggambarkan ke layar. Berbeda dengan SEM yang hanya memindai permukaan sampel, TEM mampu menganalisa semua bagian sampel dan merekam pola difraksi struktur sampel. Pola difraksi berisi informasi tentang susunan atom kristal. TEM memiliki resolusi yang sangat tinggi sampai 0,1 nm. Penemuan TEM ini dapat merevolusi berbagai bidang ilmu termasuk kimia dan biologi terutama dalam mempelajari struktur atom yang memungkinkan bisa mendapatkan ukuran, bentuk maupun reaktivitas dari atom yang sangat akurat.
Pada dasarnya seperti namanya, mikroskop elektron tranmisi atau TEM menggunakan berkas elektron energi tinggi yang melewati spesimen dan membentuk gambar pada layar. Elektron difokuskan dengan lensa elektromagnetik dan gambar diamati pada layar fluorescent atau di layar monitor. Elektron yang dipercepat dengan potensial tinggi (beberapa ratus kV) akan memberikan panjang gelombang yang jauh lebih kecil daripada cahaya. Sebagai contoh jika tegangan percepatan 200 kV, elektron memiliki panjang gelombang 0,025 Å. Pada TEM ini, karena energi kinetik elektron sangat tinggi sehingga
panjang gelombangnya pendek maka sebagian elektron mampu menembus
sampel. Prinsip kerja ini mirip seperti alat rontgenyang mampu menembus daging
manusia sedangkan bagian tulang memantulkan kembali sinar-X.TEM memindai
obyek menggunakan pola pemindaian dimana obyek tersebut dipindai dari satu
sisi ke sisi lainnya (raster) yang menghasilkan lajur-lajur titik (dots) yang
membentuk gambar seperti yangdihasilkan oleh CRT pada televisi / monitor.
25
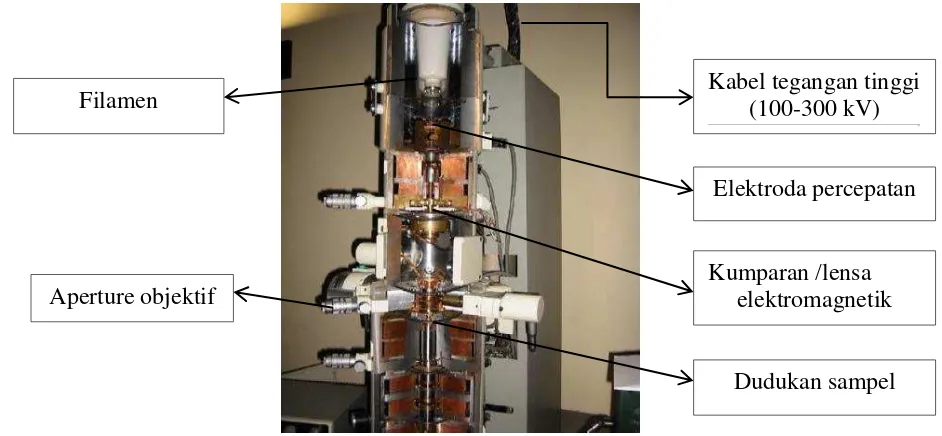
menembus bagian keras dari sampel sehingga berkas elektron yang tertangkap oleh layar merupakan bayangan dari partikel. Komponen TEM sepertinya rumit tetapi memiliki komponen utama seperti pada Gambar 2.5.
Gambar 2.5. Komponen utama TEM
Komponen utama yang dimiliki oleh TEM adalah (Muid, 2012):
1. Filamen (elektron gun), berfungsi untuk menghasilkan berkas elektron yang dipercepat ke kolom.
2. Serangkaian kumparan elektromagnetik yang memastikan bahwa sinar elektron simetris dan terfokus saat melewati bawah kolom.
3. Serangkaian lensa elektromagnetik yang bertindak untuk menerangi sampel dan memperbesar sampel pada layar fluorescent / kamera.
4. Serangkaian lubang/aperture (skala mikron lubang di film logam) yang dilewati berkas dan yang memberi efek pada sifat berkas elektron.
Kumparan /lensa elektromagnetik Kabel tegangan tinggi
(100-300 kV)
Aperture objektif
Dudukan sampel Filamen
26
5. Pemegang sampel yang memastikan posisi sampel berada dalam jalur sinar elektron. Pemegang sampel ini dapat dikontrol untuk posisi sampel dan orientasi (x, y, z atau ketinggian, kemiringan dan rotasi).
6. Layar atau monitor yang mengubah sinyal elektron ke bentuk yang dapat dilihat manusia.
27
III. METODE PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan September 2014 sampai November 2014 di laboratorium Kimia Anorganik Fisik Universitas Lampung, Kalsinasi di Laboratorium Kimia analisis Politeknik kesehatan Tanjung Karang. Analisis ukuran partikel dan struktur kristal dilakukan di Jurusan Kimia FMIPA Universitas Gajah Mada.
B. Alat dan Bahan Penelitian 1. Alat
Dalam penelitian ini alat yang digunakan antara lain : labu ukur 50 ml, beaker glass 50 ml, Magnetic Strirrer, pipet ukur 200 µl, mikro pipet 1 ml, pipet tetes, cawan crucibel, oven, furnace, spatula stainlees stell, timbangan digital sartorius dengan ketelitian 0,0001 gram, botol selai, plastik penutup botol selai, pH meter serta karakterisasi sampel menggunakan XRD merek Shimadzu XD 610 dan TEM merek JEOL JEM 1400.
2. Bahan
28
analysi 99,8% dari Merck, aquabidest steril. Bahan bantu penelitian terdiri dari HCl 32%, aquades, tisu, aluminium foil, kertas label.
C. Prosedur Penelitian
Langkah-langkah dalam pembuatan nanotitania adalah sebagai berikut.
1. Menyiapkan larutan CaCl2 dengan konsentrasi masing-masing 0,06 M; 0,08 M; 0,10 M; 0,11 M; dan 0,12 M yang telah dilarutkan ke dalam aquabidest sterill 50 mL.
2. Sintesis nanotitania dari TTIP
29
3. Kalsinasi
Proses kalsinasi dilakukan dengan menggunakan tungku pembakaran atau furnace. Alat ini telah disediakan penyesuaian temperature yang terkendali secara otomatis dengan system digital. Dalam penelitian ini, kalsinasi dilakukan pada temperature 400 ºC dengan waktu penahanan selama 12 jam. Adapun proses kalsinasinya adalah larutan mula-mula dipanaskan sampai temperatur 200 ºC dengan laju temperatur 5 ºC/menit selama 1 jam dan ditahan selama 1 jam. Kemudian temperatur dinaikkan sampai 400 ºC dengan laju temperatur 5 ºC/menit, ditahan selama 10 jam. Setelah 10 jam, temperatur dibiarkan kembali ke temperatur ruang.
D. Karakterisasi Sampel
1. Karakterisasi XRD bahan TiO2
XRD yang dilakukan pada sampel TiO2 dengan sudut difraksi 10 sampai dengan 80o, stepsize 0,02o dengan counting time 1 detik. Kuat arus 30 mA dan tegangan operasi 20 sampai 40 kV. Prosedur kerja alat ini dapat dijelaskan sebagai berikut:
1. Mengatur tegangan anoda sebesar 30 kV dan kuat arus sebesar 15 mA. Ini berguna untuk menghsilkan tembakan elektron pada target Cu.
2. Meletakan sampel yang akan dianalisis pada kaca dan memasangkanya pada lempengan tipis berbentuk bulatan (sampel holder) dengan lilin perekat. 3. Meletakan sampel yang telah disimpan pada sampel holder pada sampel
30
4. Memasukkan parameter pengukuran pad software melalui komputer, yaitu present time pada 1 detik, step counting pada 0,02o dan rentang sudut difraksi
2 pada 10-80o.
5. Mengoperasikan alat difraktometer dengan perintah “start” pada menu
komputer.
6. Melihat dan mengambil hasil difraksi dari sampel pelet itu pada komputer dengan itensitas difraksi pada sudut 2 tertentu yang mana hasil-hasilnya dapat dicetak oleh mesin printer dan dapat disimpan dalam bentuk file.dat/file.xy.
2. Karakterisasi TEM bahan TiO2
Karakterisasi TEM dilakukan untuk mengetahui struktur nano suatu bahan dari TiO2 yang mampu menghasilkan resolusi hingga 0,1 nm (atau 1 angstrom). Pada penelitian ini TEM yang digunakan bermerek JEOL JEM 1400 dengan prosedur alat sebagai berikut:
1. Membersihkan sampel pelet dengan ultrasonic cleaner menggunakan media aceton.
2. Memotong spesimen dengan ukuran 3 mm dan ketebalan 300 m. Serta menembak dengan ion argon sampai berlubang.
3. Mengatur virtual source di bagian atas yang mewakili gun elektron untuk menghasilkan elektron monokromatik.
31
mengenai sampel. Lensa kedua (biasanya dikontrol tombol
“intensitas/brightness”) untuk mengubah ukuran spot pada sampel.
5. Membatasi berkas dengan aperture dari kondensor (biasanya dapat dipilih pengguna), merobohkan sudut tinggi elektron (yang jauh dari sumbu optik, garis putus-putus di tengah-tengah)
6. Menumbuk berkas elektron pada spesimen. Kemudian, bagian bagiannya ditransmisikan.
7. Memfokuskan bagian yang ditransmisikan dengan lensa objektif menjadi sebuah gambar.
8. Memilih opsional logam area apertur untuk membatasi sinar dan objective aperture ini meningkatkan kontras dengan menghalangi difraksi elektron yang high angle, memilih apertur memungkinkan untuk memeriksa secara berkala difraksi elektron dengan pengaturan struktur atom dalam sampel
32
E. Diagram Alir
Ringkasan penelitian ini dapat diwujudkan dalam diagram alir yang dapat dilihat pada
Gambar 3.1.
Gambar 3.1. Diagram alir penelitian TiO2 Preparasi 50 ml Methanol
Meneteskan larutan 200 µl CaCl2
- larutan methanol dimasukkan kedalam labu ukur 50 ml sampai batas garis
Menguapkan dalam oven 75 ºC
diaduk selama 10 menit
Kalsinasi endapan pada 400 ºC selama12 jam
68
V. KESIMPULAN
69
DAFTAR PUSTAKA
Afrozi, A. S., 2010. Sintesis dan Karakterisasi Katalis Nanokomposit Berbasis Titania untuk Produksi Hidrogen dari Gliserol dan Air. Tesis. Jakarta: Fakultas Teknik. Universitas Indonesia, hal.31.
Ahfiladzum. 2011. Kalsium Klorida. http://naynienay.wordpress.com/2010/03/04/ kalsium-klorida/. 5 Maret 2011.
Alagarasi, A. 2011. Introduction to nanomaterials. National Centre for Catalysis 166 Research (NCCR) internal bulletin (Unpublished). Chennai, India. Available online at: http://www.nccr.iitm.ac.in/2011.pdf
Ali, R., and Siew, O.B. 2006. Photodegradation New Methylene Blue in Aqueous Solution Using Zinc Oxide and Titanium Dioxide as Catalyst. Journal Teknologi University of Teknologi Malaysia. Malaysia, pp. 31-42.
Alleman E., Gurny R., Doelker E., 1993, Drug-loaded Nanoparticles-Preparation Methods and Drug Targeting Issues, European Journal of Pharmaceutics and Biopharmaceutics., 39: 173-191.
Alphonse., Pierre., Varghese., Aneesha., Tendero., Claire., 2010. Stable Hydrosols for TiO2 Coatings. Journal of Sol-Gel Science and Technology, Vol. 56. p.250-263. ISSN 0928-0707.
Ardizzone, S., Gabbrielli, G and Plazzari., 1993. Absorption of Methylene Blue at Solid Liquid and Water Air Interfaces Colloids Surface. Journal of Cotton Science, Vol.2. p. 64-69.
Asalim., E., 2011. Pembuatan Kalsium Klorida dari Batu Kapur dan Asam Klorida dengan Kapasitas Produksi 30.000ton/Tahun. Tugas Akhir. Universitas Sumatera Utara: Medan. Hal 1-2.
Asteti, F.S., and Syarif, G.D., 2007. Pembuatan Film Tipis TiO2 Fotokatalis pada Kaca dan Aplikasinya untuk Degradasi metil biru. Prosiding Seminar Nasional Sains dan Teknologi Nuklir PTNBR – BATAN. hal. 133-137. Carp, O., Huisman, C. L., and Reller, A., 2004. Photoinduced Reactivity of
70
Chen., Xiaobo and Samuel S.M. 2007. Titanium Dioxide Nanomaterials: Syntesis, Properties, Modifications and Aplications. Chemical Reviews. 107. p.2891-2959.
Cho, S. I., Chung, C. H., dan Moo, S. H. 2001. Temperatur Programmed Desorption Study on the Decomposition Mechanism of Ti(OC3H7)4 on Si(100). Journal of Electrochemical Society. 148, p. 599.
Dhamayanti, Y., Wijaya, K., dan Tahir, I., 2005, Fotodegradasi Zat Warna Methyl Orange Menggunakan Fe2O3-Montmorillonit dan Sinar Ultraviolet, Prosiding Seminar Nasional DIES ke 50 FMIPA UGM, hal. 22–29.
Darmawan, R. P., Wardhani, S dan Purwonugroho, D., 2013. Pengaruh Penambahan NO3 terhadap Degradasi Methyl Orange Menggunakan Fotokatalis TiO2-Bentonit. Student Journal, Vol.1, No.1, pp. 140-146. Universitas Brawijaya Malang.
Eiden-Assmann, S., Widoniak, J., and Maret, G., 2004. Synthesis and Characterization of Porous and Nonporous Monodisperse Colloidal TiO2 Particles. Journal Chemistry of Materials, Vol. 16.p. 6-11.
Elaziouti, Laouedj, N., and Ahmed, B. 2011. ZnO-Assisted Photocatalytic Degradation of Congo Red and Benzopurpurine 4B in Aqueous Solution. Journal of Chemical Engineering and Process Technology, Vol.2. pp. 2157-7048.
Enggrit, D. E., 2011. Preparasi Nanopartikel Titania Menggunakan Aseton Beramonia sebagai Media Reaksi serta Hasil Karakterisasinya. Tesis. Universitas Indonesia: Depok. Hal 6.
Eun, H.T., Kim, S,H., Jeong, W,J., Jeon, S,J., Kim, S,H., and Yang S,M., 2009. Single-Step Fabrication of Monodisperse TiO2 Hollow Spheres with Embedded Nanoparticles in Microfluidic Devices. Chemistry of Material, 21 (2), pp 201–203.
Fatimah, I. 2009. Dispersi TiO2 kedalam SiO2-Montmorillonit: Efek Jenis Prekursor. Journal Penelitian Saintek. Vol.14. p. 41-58.
Ferdiansyah, A. H., 2009. Aplikasi Lapisan Tipis Titanium Dioksida (TiO2) sebagai Agen Pembersih Mandiri pada Panel Kaca Bangunan. Teknik Metalurgi dan Material. Universitas Indonesia: Depok.
Fitriana, F.N., 2014. Sintesis Dan Karakterisasi Superkapasitor Berbasis Nanokomposit TiO2 /C. Skripsi. Universitas Negeri Malang: Malang. p. 10. Force, E. R and Lynd, L.E., 1984. Titanium-Mineral Resources of the United
71
Fujishima, A, K. Hashimoto, T., Watanabe., 1999. TiO2 Photocatalysis
Fundamentals and Aplications. Books. BKC inc. Japan.p.176.
Goresy, A.I., Chen, M., Dubrovinsky, L., Gillet, P and Graup, G. 2001. An Ultradense Polymorph of Rutile with Seven Coordinated Titanium from Ries Crater. Science. 293.p.1467-1470.
Gratzel, M., 2003, Review: Dye-Sensitized Solar Cells. Journal of Photochemistry and Photobiology., Vol. 4. pp. 145-153.
Guan, Z.S., Zhang, X.T., Ma, Y., Cao, Y.A. and Yao, J.N. 2001. Photocatalytic Activity of TiO2 Prepared at Low Temperature by A Photo-Assisted Sol-Gel Method. Journal of Materials Research. Vol.16.p. 907–909.
Hariyadi, H., 2010, Pengaruh Ukuran Partikel TiO2 terhadap Efisiensi Sel Surya Jenis DSSC (Dye Sensitized Solar Cell). Skripsi. Jurusan Fisika, FMIPA Univ Diponegoro, Semarang.
Han, C., Luque, R., and Dionysiou, D. D., 2011. Facile Preparation of Controllable Size Monodisperse Anatase Titania Nanoparticles. Chemical Communications. Vol.48.p1860-1862.
Haugen, H., Will, J., Kohler., A., Hopfner, U., Aigner, J., Wintermantel, E., 2004. Ceramic TiO2-Foams: Characterisation of a Potential Scaffold. Journal of the European Ceramic Society, Vol. 24, Issue 4, April 2004, p. 661–668. Hoffman, M. R., S. T. MArtin, W.Choi, and D. W. Bahnemann , 1995,
Enviromental Applications of Semiconductor Photocatalysis, Chemical Reviews, Vol. 95, No. 1, W, pp.69-96.
Hosokawa, M., Nishino, K., Yokoyama, T., 2007. Nanoparticle Technology Handbook. Elsevier B.V :Oxford
Howard, C. J., Sabine, T. M., and Dicson, F., 1991. Structure and Termal Parameter for Rutile and Anatase. Acta Crystallographica, 4B. pages 462-468.
Hsieh, C.S., Zhu, H., Wei, T.Y., Chungc, Z.J., Yang, W.D., and Ling, Y.H., 2008. Applying the Experimental Statistical Method to Deal the Preparatory Conditions of Nanometric-sized TiO2 Powders from a Two-emulsion Process. Journal of the European Ceramic Society. Vol. 28. p. 1177–1183. Hunter, B. A. 2001. Rietveld Analysis Using a Visual Interface. ANSTO Neutron
Scattering. PMB 1, Menai, N.S.W. 2234. Australia. page 1.
72
Kim D. H, Choi D.K, Kim S-J, Lee KS., 2008 The Effect of Phase Type on Photocatalytic Activity in Transition Metal Doped TiO2 Nanoparticles. Catalysis Communications, Vol.9. pp:654–657.
Kisi, E. H. 1994. Rietveld Analysis of Powder Diffraction Pattern. Material Forum. Page 135-153.
Lestari, W.M., Saputro,H.S dan Wahyuni,S., 2013. Sintesis dan Karakterisasi Nanokatalis CuO/TiO2 yang Diaplikasikan pada Proses Degradasi Limbah Fenol. Indonesian Journal of Chemical Science. Vol.2.pp.154-159.
Linsebigler, A.L., G. Lu, J.T. Yates. 1995, Photocatalysis on TiO2 Surfaces: Principles, Mechanism, and Selected Result. Chemical. Review., 95, p.735-758.
Look, J,L., And Zukoski, C.F., 1992. Shear Induced Aggregation during the Precipitation of Titanium Alkoxides. Journal of Colloid and lntelface Science, Vol. 153. p. 461-482.
Lu, C.H., Wu, W.H. and Kale, R.B. 2008. Microemulsion-Mediated Hydrothermal Synthesis of Photocatalytic TiO2 Powders. Journal of Hazardous Materials. Vol.154: 649–654.
Nabok, A., 2000. Organic and Inorganic Nanostructures. Nanotecnology Series. Artech House.
Nogueira, R. F. P and Jardim, W. F. 1993. Photodegradation of Methylene Blue Using Solar light and Semiconduktor (TiO2). Journal of Chemical Education. 70. p. 861-862.
Nolze, G and W. Kraus., 1999. Sofware Power Cell for Windows Versi 2.3 Federal Institute for material Research and testing Berlin. Germany.
Ollis, D. F., Al-Ekabi . 1993. Photocatalytic Purification and Treatment of Water and Air. Elsevier: Amsterdam. Pp.321-335.
O'regan, B and Grätzel, M., 1991. A Low-Cost, High-Efficiency Solar Cell Based on Dye-Sensitized Colloidal TiO2 Films. Nature, vol. 353. P. 737 – 740. Palmisano. 2007. Optical Properties of TiO2 Suspensions: Influence of pH and
Powder Concentration on Mean Particle Size. Journal of Industrial and Engineering Chemistry, Vol.46: 7620-7626.
73
Parida, K.M. and Naik, B., 2009. Synthesis of Mesoporous TiO2 Spheres by Template Free Homogeneous Coprecipitation Method and Their Photo-catalytic Activity under Visible Light Illumination. Journal of Colloid and Interface Science, Vol. 333: 269–276.
Pelaez, M., Falaras, P., Likodimos, V., Kontos, G.A., Cruz, A., Kevin O'shea, K., dan Dionysiou, D., 2010. Synthesis, Structural Characterization and Evaluation of Sol–Gel Based NF-TiO Films with Visible Light-Photoactivation for the Removal of Microcystin-LR. Jurnal Applied Catalysis B: Environmental, Vol. 99. Issue 3. P. 378-387.
Puri, R. K., dan Babbar, V. K., 1997. Solid State Physics. Books. S.Chand and Company Ltd. ISBN: 8121914760. New Delhi. p.306.
Qiu, S., 2006. Synthesis, Processing and Characterization of Nanocrystalline Titanium Dioxide. Thesis. Materials and Aerospace Engineering at the University of Central Florida Orlando. p. 42
Rahmawati, F., S. Wahyuningsih, and N. Handayani,, 2006, Modifikasi Permukaan Lapis Tipis Semikonduktor TiO2 Bersubstrat Grafit dengan Elektrodeposisi Cu. Jurnal Penelitian, Surakarta, pp. 735-758.
Reyes, C. D., Rodriguez, G. G., Espinosa, M. E. P., Cab, C., Coss, R. D and Oskam, G., 2008. Phase-pure TiO2 Nanoparticles: Anatase, Brookite and Rutile. Nanotecnology, Vol.19. p. 10-20.
Robson, F. D. R., Cecilia, C. G. E. S and Thomas, A. G. R., 2005. Thermal Study of the Anatase-Rutile Structural Transitions in Sol-Gel Synthesized Titanium Dioxide Powders. Journal Serbian Chemistry Social. 70. 4. p. Water and Health, vol. 53. p. 335-339.
Sasikumara, C., Raoa, D. S., Srikantha. S., Ravikumarb, B.,. Mukhopadhyayc, N. K., Mehrotrab., 2004. Effect of Mechanical Activation on the Kinetics of Sulfuric Acid Leaching of Beach Sand Ilmenite from Orissa, India. Hydrometallurgy 75. 189-204.
74
Setiawati, T. S., Amalia I. S., Sulistioso G. S., dan Wisnu A. A., 2006. Sintesis Lapisan Tipis TiO2 dan Analisis Sifat Fotokatalisnya. Jurnal Sains Material Indonesia. Edisi Khusus. p. 141-146.
Seery, M. K., George, R., Floris, P dan Pillai, S. C., 2007. Silver Doped Titanium Dioxide Nanomaterials for Enhanced Visible Light Photocatalysis. Journal of Photochemistry and Photobiology A: Chemistry, Vol.189. p. 25-263. Shin, B., Won, J., Son, T., Kang, S.Y., dan Kimc, K.C., 2011. Barrier Effect of
Dendrons on TiO2 Particles in Dye Sensitized Solar Cells. Journal Chemical Communications, vol. 47. p. 1734–1736.
Simatupang, L. R., 2008. Efek Medan Listrik Pada Sintesis Senyawa Titanium Dioksida Amorf. Skripsi. Institut Teknologi Bandung. hal. 27-31.
Sitorus, V., 2013. Uji Fotokatalis Bahan TiO2-SiO2 pada Methylene Blue sebagai Fungsi Variasi Perbandingan Molar. Skripsi. Universitas Lampung: Bandar Lampung. hal 50.
Skadan, G. and Singhal, A., 2006. Perpectives on the Science and Technology of Nanoparticle Sinthesis, Nanomaterials Handbook. Taylor and Francis Group. p.11.
Smestad, G. P., Gratzel, M., 1998. Demonstrating Electron Transfer and Nanotechnology: A Natural Dye-Sensitizied Nanocrystalline Energy Converter. Journal of chemical Education, Vol. 75. p. 752-756.
Tan, M., Wang, G.,Ye, Z., and Yuan, J., 2006. Synthesis and Characterization of Titania-Based Monodisperse Fluorescent Europium Nanoparticles for Biolabeling. Journal of Luminescence, Vol. 117. p. 20-28.
Tjahjanto, T. R dan Gunlazuardi, J., 2001. Preparasi Lapisan Tipis TiO2 sebagai Fotokatalis: Keterkaitan antara Ketebalan dan Aktivitas Fotokatalisis. Makara, Jurnal Penelitian Universitas Indonesia, vol.5, no 2. p.81-91. Thomas, C., and Zhou, G., 1992. Crystallography in modern Chemistry. A
Willey-Interscience, Publication. p.1-12.
Waseda, Y., Matsubara, E., dan Shinoda, K., 2011. X-Ray Diffraction Crystallography, Springer, Verlag Berlin Heidelberg. p.423-430
William, D. B. and Carter, C. B., 1996. Transmission Electron Microscopy, Plenum Press, New York.
75
Young, R. A,. 1993. The Rietveld Method. International Union of Crystallography, Oxford University Press.
Yuwono, A.H., 2010. Teknik Sintesis Bottom-Up: Fabrikasi Nanopartikel Oksida Inorganik dengan Proses Sol-Gel dan Surfactant Templating, In Workshop MNI. Departement Metalurgi dan Material. Universitas Indonesia.