ABSTRACT
(Amphiprion percula) was conducted to initiation the preventive action and treatment of infection the bacterial disease. The research was conducted in the Laboratory of Aquaculture, Agricultural Faculty, Lampung University and Laboratory of Testing, The Fish Quarantine Station Quality Control and Safety of Fishery Product Class I Lampung. Clownfish samples from Main Center of Mariculture Development of Lampung that was random taken by observing the clinical signs of the disease appear. Bacteria were isolated from five different organs are wound, gills, liver, kidneys and digestive tract. Bacteria isolated and then purified before test Koch's Postulates. Koch's Postulates test was done by injecting candidate of pathogenic bacteria isolates to the healthy clownfish with dose 109CFU/ml and observed clinical signs of the disease appear during the seven days. The isolated bacteria of Koch’s Postulates test were manual identified by observing the morphology of colonies, morphology of bacteria and biochemical character. The results showed that there were three types of pathogenic bacteria on the clownfish are Vibrio alginolyticus, Acinetobacter calcoaceticus and Pseudomonas cepacia. The clinical signs that arise due infection of three pathogenic bacteria in early infection have in common. Bacteria V. alginolyticus from digestive tract, whereas bacteria A. calcoaceticus and P. cepacia from liver.ABSTRAK
IDENTIFIKASI BAKTERI PATOGEN
PADA IKAN BADUT (Amphiprion percula)
Oleh
TRI MEILINDA
Penelitian mengidentifikasi bakteri patogen pada ikan badut (Amphiprion percula) dilakukan untuk menginisiasi tindakan pencegahan dan pengobatan dari infeksi penyakit bakterial. Penelitian dilakukan di Laboratorium Budidaya Perikanan Fakultas Pertanian Universitas Lampung, dan Laboratorium Pengujian Stasiun Karantina Ikan Pengendalian Mutu dan Keamanan Hasil Perikanan Kelas I Lampung. Sampel ikan badut yang sakit berasal dari Balai Besar Pengembangan Budidaya Laut Lampung yang diambil secara acak dari ikan badut yang sakit dengan mengamati gejala penyakitnya. Bakteri diisolasi dari lima organ yang berbeda yaitu luka, insang, hati, ginjal dan saluran pencernaan. Bakteri hasil isolasi kemudian dimurnikan untuk dilakukan pengujian Postulat Koch. Pengujian Postulat Koch dilakukan dengan menyuntikkan kandidat isolat bakteri pada ikan badut yang sehatdengan dosis 109 CFU/ml dan diamati gejala penyakit yang muncul selama tujuh hari. Isolat bakteri patogen diidentifikasi secara manual dengan mengamati morfologi koloni, morfologi bakteri dan karakter biokimianya dari hasil uji biokimia. Hasil penelitian menunjukkan terdapat tiga jenis bakteri patogen pada ikan badut yaitu Vibrio alginolyticus, Acinetobacter calcoaceticus dan Pseudomonas cepacia. Gejala yang muncul akibat infeksi ketiga bakteri patogen tersebut pada awal infeksi memiliki kesamaan dengan asal organ V. alginolyticus dari saluran pencernaan, A. calcoaceticus dan P. cepacia ditemukan di hati.
I. PENDAHULUAN
1.1 Latar Belakang
Ikan hias merupakan salah satu komoditas perikanan yang menjadi
komoditas perdagangan yang potensial di dalam maupun di luar negeri. Ikan
hias dapat dijadikan sebagai sumber pendapatan devisa bagi negara. Indonesia
merupakan salah satu negara terkaya akan keanekaragaman jenis ikan hias
dibandingkan dengan negara penghasil ikan hias lainnya. Berdasarkan Pusat
Data, Statistik dan Informasi Sekretariat Jenderal Kementerian Kelautan dan
Perikanan, kontribusi ikan hias air laut terhadap nilai ekspor di Indonesia
mencapai 61,8% dari US$ 13.262.362 (KKP, 2012).
Jenis ikan hias laut yang memiliki nilai jual tinggi di pasar internasional
salah satunya yaitu ikan badut dari genus Amphiprion. Burgess (1990)
menyatakan bahwa terdapat 34 jenis Amphiprion yang telah teridentifikasi, ditemukan pada perairan dangkal sampai dalam pada dasar yang berkarang. Ikan
badut memiliki corak warna dan kombinasi warna yang bervariasi bergantung
pada jenisnya. Ciri khas inilah yang membuat ikan badut memilki banyak
penggemar terutama dari jenis Amphiprion percula. Ikan badut merupakan jenis
ikan hias dari famili Pomacentridae. Famili Pomacentridae termasuk persentase
tertinggi dalam perdagangan internasional ikan hias yaitu sebesar 42% (IMA,
Permintaan ikan badut saat ini cukup tinggi, baik untuk pemenuhan
pasar dalam negeri maupun pengiriman ke luar negeri. Negara tujuan pemasaran
seperti Australia, Jepang, Jerman dan Perancis. Perkembangan kondisi pasar
yang menjanjikan tersebut, tentu akan memacu para eksportir untuk
mengeksploitasi di alam secara tidak terkendali (Ari dan Murdjani, 2008).
Eksploitasi yang dilakukan secara terus menerus di alam jika tidak diimbangi
dengan kegiatan penangkaran dapat menyebabkan kelangkaan. Oleh karena itu,
ikan badut telah mulai dibudidayakan (Al Qodri et al., 2009).
Budidaya ikan badut tidak terlepas dari adanya serangan penyakit.
Sama halnya dengan jenis ikan laut lainnya, ikan badut rentan terserang penyakit
(Kurniastuty et al., 2009). Penyakit bakterial merupakan salah satu penyakit yang sering menyerang ikan badut. Penyakit bakterial tersebut dapat
mengakibatkan kualitas dan jumlah produksi ikan badut menjadi menurun.
Penurunan kualitas tersebut disebabkan karena serangan penyakit bakteri dapat
mengurangi keindahan ikan badut.
Penelitian tentang penyakit bakterial pada ikan badut masih sangat
jarang dilakukan di Indonesia. Penelitian Alkinbowale et al. (2006)
menyebutkan bahwa bakteri Vibrio alginolyticus ditemukan dapat menyerang ikan badut pada bagian insang dan hati. Selain itu, Dhayanithi et al. (2010) juga menyebutkan bahwa terdapat beberapa jenis bakteri patogen yang dapat
menyerang A. sebae dan A. ocellaris diantaranya Aeromonas hydrophila,
Enterobacter sp., Escherichia coli, Pseudomonas aeruginosa, Proteus sp., Streptococcus sp., Vibrio cholerae, V. alginolyticus, V. parahaemolyticus dan
terhadap keberhasilan pembenihan ikan badut, maka identifikasi bakteri patogen
pada ikan badut perlu dilakukan. Identifikasi dan penelitian tentang penyakit
ikan yang ada diharapkan akan berguna dalam menentukan jenis penyakit ikan
yang disebabkan oleh serangan bakteri patogen, sehingga dapat dipergunakan
untuk memantau, mencegah dan menanggulangi timbulnya penyakit secara luas.
1.2 Tujuan Penelitian
1. Mengidentifikasi jenis bakteri patogen pada ikan badut.
2. Mengobservasi berbagai gejala penyakit pada ikan badut yang ditimbulkan
oleh bakteri patogen.
1.3 Manfaat
Penelitian tentang identifikasi bakteri patogen pada ikan badut
diharapkan menjadi masukan dan referensi bagi perkembangan ilmu
pengetahuan khususnya tentang penyakit bakterial yang terjadi pada ikan badut
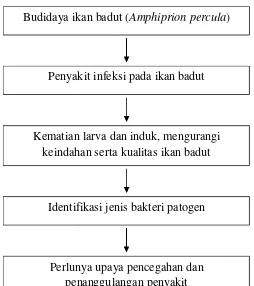
1.4 Kerangka Pikir
Gambar 1. Kerangka pikir penelitian Budidaya ikan badut (Amphiprion percula)
Penyakit infeksi pada ikan badut
Kematian larva dan induk, mengurangi keindahan serta kualitas ikan badut
Identifikasi jenis bakteri patogen
II. TINJAUAN PUSTAKA
2.1 Biologi Ikan Badut (Amphiprion percula)
Klasifikasi ikan badut menurut Burges (1990) dan Michael (2008) adalah
sebagai berikut:
Kingdom : Animalia
Filum : Chordata
Kelas : Actynopterigii
Subkelas : Neopterygii
Ordo : Perciformes
Subordo : Labroidei
Famili : Pomacentridae
Subfamili : Amphiprioninae
Genus : Amphiprion
Spesies :Amphiprion percula
Allen (1991) menyebutkan bahwa Amphiprion percula memiliki panjang
maksimum 11cm. Selain itu, Allen et al. (2003) menjelaskan bahwa Amphiprion
percula berwarna jingga dengan tiga garis putih, garis tengah tampak menonjol ke depan, serta jumlah tepi hitam pada garis dan sirip bervariasi. Distribusi
penyebarannya meliputi Papua Nugini, Kepulauan Solomon, Britania Raya,
ditemukan di laguna, tetapi juga dapat ditemukan di puncak terluar karang dan
permukaan air (Allen, 1991). Spesies ini dapat hidup pada kedalaman 1 sampai
15 m (Lieske and Myers, 2001). Semua ikan badut hidup bersimbiosis
mutualistik dengan anemon tertentu (Allen, 1991). Ikan badut tidak dapat pergi
jauh dari anemon sebagai inangnya. Ikan badut biasanya bersimbiosis dengan
Stichodactyla mertensii di laguna, sementara di habitat terumbu karang terluar paling sering ditemukan di Heteractis magnifica. Ikan badut umumnya hidup berpasangan, tetapi dalam anemon laut yang berukuran besar pasangan ikan laut
akan saling berbagi tempat (Allen, 1991). Michael (2008) menyebutkan bahwa
ikan badut juga dapat bersimbiosis dengan H. crispa dan S. gigantea.
Gambar 2.Amphiprion percula (Drury, 2008)
Sumarjito et al. (2010) menyebutkan bahwa dalam simbiosis ini, ikan mendapat proteksi dan memakan material non-metabolik yang tidak termakan
oleh anemon. Suharti (1990) menjelaskan bahwa ikan badut merupakan
kelompok hewan diurnal dan bersifat omnivorus.
Ikan badut termasuk ke dalam golongan hewan protandous
berjenis kelamin jantan dan kemudian akan berubah menjadi betina (Myers,
1999). Ikan badut mampu menghasilkan telur 67 – 649 (rata-rata 331) dalam
setiap sarang. Telur tersebut akan menetas setelah delapan hari dari waktu
pemijahan. Ikan badut memiliki daya tetas dan tingkat ketahanan hidup yang
tinggi (Michael, 2008). Setiawati et al.(2005) menyebutkan bahwa diketahui
standar deviasi jumlah telur ikan badut sebesar 244,29. Standar deviasi telur
yang menetas 236,01 dan telur yang rusak sebesar 104,75. Daya tetas (HR)
rata-rata dari telur ikan badut sebesar 78,49%.
2.2 Postulat Koch
Postulat Koch dilakukan untuk mengetahui bahwa suatu bakteri sebagai
penyebab penyakit tertentu. Robert Koch (seorang ilmuwan Jerman)
menyebutkan hubungan sebab akibat antara organisme dan penyakit spesifik,
mengemukakan sebuah postulat (dalil) suatu bakteri yang dianggap patogen. Isi
dari Postulat Koch adalah (Irianto, 2006) :
1. Mikroorganisme yang dicurigai harus segera diselidiki, agar segera
diketahui jika penyakit sedang berjangkit;
2. Mikroorganisme itu dapat diambil (diisolasi) dan ditumbuhkan menjadi
biakan murni (pure culture) di laboratorium.
3. Jika biakan murni itu disuntikkan kepada hewan yang sehat, maka akan
menimbulkan penyakit yang sama.
4. Mikroorganisme yang disuntikkan pada hewan yang sehat tersebut dapat
2.3 Bakteri Patogen pada Ikan Laut
2.3.1 Vibrio sp.
Vibrio sp. termasuk ke dalam family Vibrionaceae memiliki sifat Gram negatif, fakultatif anaerobik, fermentatif, bentuk sel batang dengan ukuran
panjang antara 2-3µm, menghasilkan katalase dan oksidase dan bergerak dengan
satu flagella pada ujung sel (Austin,1988).
Vibrio sp. terutama dari jenis Vibrio harveyi merupakan salah satu bakteri patogen yang paling banyak menyebabkan penyakit pada budidaya
krustasea. Bakteri ini penyebab penyakit kunang-kunang atau penyakit
berpendar, karena krustasea yang terinfeksi akan terlihat terang dalam keadaan
gelap (malam hari). Pada dasarnya bakteri ini bersifat oportunistik dan akan
menjadi patogen jika pada media pemeliharaannya terjadi goncangan secara
drastik, seperti perubahan suhu, pH, salinitas, dan faktor lainnya (Panrenrengi et
al., 1993). Roza (1993) menjelaskan bahwa V. harveyi yang menyerang larva udang windu (Penaeus monodon) dapat menyebabkan perubahan warna pada
hepatopankreas dari kecoklat-coklatan menjadi kehitaman yang pada akhirnya
hepatopankreas hancur dan larva udang mati.
Jenis-jenis bakteri selain Vibrio harveyi yang dapat menyebabkan penyakit pada biota laut adalah V. anguillarum, V. alginolyticus, V.
parahaemolyticus, V. marinus, V. algosus, V. fuscus, V. hypalus. Seng (1994) menyatakan bahwa V. alginolyticus dan V. parahaemolyticus merupakan bakteri potensial penyebab kematian pada kerapu. V. alginolyticus dan V.
menyebutkan bahwa bakteri V. alginolyticus ditemukan dapat menyerang ikan badut pada bagian insang dan hati.
2.3.2 Aeromonas sp.
Genus Aeromonas termasuk ke dalam famili Vibrionaceae.Aeromonas sp. merupakan bakteri Gram negatif, cytocrome oxidative-positif dan fakultatif
anaerobik. Aeromonas sp. yang motil memiliki flagella pollar tunggal tanpa endospora dan kapsul (Schoch and Cunha, 1984). Jenis Aeromonas hydrophila, merupakan bakteri yang dapat ditemukan secara luas dalam lingkungan perairan
dan telah lama diketahui sebagai bakteri patogen bagi biota air tawar maupun air
laut (Post, 1983). Aeromonas sp. merupakan salah satu bakteri patogen yang
sering menyerang kakap putih (Lates calcalifer). Gejala penyakit yang disebabkan bakteri Aeromonas sp. yaitu pendarahan pada kulit, nekrosis pada sirip yang menyebabkan sirip terkikis dan mengakibatkan gerakan ikan
terganggu (Kurniastuty dan Dewi, 1999).
Bakteri Aeromonas hydrophila bersifat Gram negatif, berbentuk batang
dan motil. Bakteri ini merupakan agensia penyebab hemoragik septisemia
(Bacterial Hemmoraghic Septicemia, BHS) atau MAS (Motile Aeromonas
Septicemia) pada beragam spesies ikan air tawar. Tanda-tanda klinis infeksi
A. hydrophila bervariasi, tetapi umumnya ditunjukkan adanya hemoragik pada kulit, insang, rongga mulut, dan borok pada kulit yang dapat meluas ke jaringan
otot. Selain itu, sering pula tanda-tanda klinis ditunjukkan dengan terjadinya
2.3.3 Streptococcus sp.
Austin dan Austin (2007) menjelaskan bahwa organisme penyebab
penyakit ini diklasifikasikan ke dalam genus Streptococcus dan famili
Streptococcaceae. Bakteri Streptococcus sp. dapat menyerang ikan air laut maupun air tawar. Holt et al. (1994) menjelaskan bahwa bakteri ini termasuk ke
dalam golongan bakteri Gram positif, bersifat non motil, tidak membentuk
kapsul dan spora, non acid fast serta ada dalam bentuk berpasangan. Austin dan Austin (1987) menyebutkan bahwa penyakit yang diakibatkan oleh bakteri
Streptococcus pada ikan pertama kali dilaporkan tahun 1957 pada budidaya ikan rainbow trout (Oncorhynchus mykiss) di Jepang.
Gejala eksternal yang jelas pada ikan yang terinfeksi bakteri tersebut
akan tampak normal sampai sesaat sebelum mati. Salah satu gejala yang tampak
adalah ikan menjadi melemah dan tidak ada hemoragik pada jaringan tubuh atau
perubahan struktur kulit (Anonim, 1993). Pada beberapa kasus terdapat
eksoptalmia dan hemoragik pada kelopak mata. Gejala internal pada ikan yang
terinfeksi ditandai dengan enteritis, hepatitis dan pembesaran ginjal. Selain itu,
anus dan usus menunjukkan peradangan karena adanya cairan mukoid yang
berwarna agak merah pada usus, pembengkakan ginjal, hati berwarna merah tua
dan menjadi kurang berfungsi (Austin and Austin, 2007).
2.3.4 Pseudomonas sp.
Bakteri Pseudomonas sp. termasuk dalam famili Pseudomonadaceae dan genus Pseudomonas berasal dari bahasa latin yang berarti semu. Bakteri tersebut
memiliki morfologi Gram negatif berbentuk batang, bersifat motil, biasanya
Bakteri Pseudomonas sp. terutama dari jenis P. aeruginosa mempunyai ciri-ciri sebagai berikut: warna koloni kuning dengan diameter 2,42 mm
mempunyai bentuk sel batang, dan bersifat motil. Karakteristik biokimia adalah
reaksi Gram negatif,oksidase, produksi indol, penggunaan karbon dari citrat
negatif dan positif terhadap katalase. Bakteri ini secara luas dapat ditemukan di
alam, contohnya di tanah, air, tanaman, dan hewan. P. aeruginosa adalah patogen oportunistik. Bakteri ini merupakan penyebab utama infeksi pneumonia
nosokomial. Meskipun begitu, bakteri ini dapat berkolonisasi pada manusia
normal tanpa menyebabkan penyakit (Holt et al., 1994).
Kurniastuty et al. (1999) menjelaskan bahwa bakteri Pseudomonas sp.
merupakan salah satu penyebab penyakit fin rot atau penyakit sirip rontok pada ikan kerapu tikus (Cromileptes altivelis), penyakit ini memiliki gejala sirip
rontok, ekor geripis dan luka pada bagian bawah sirip.
2.3.5 Lingkungan
Lingkungan yang baik akan meningkatkan daya tahan ikan, sedangkan
lingkungan yang kurang baik akan menyebabkan ikan mudah stres. Stres
merupakan respon fisiologis dalam membangun dan mempertahankan
keseimbangan atau adaptasi terhadap perubahan lingkungan (Adams, 1990).
Stres akan menurunkan ketahanan tubuh ikan terhadap serangan penyakit (Nabib
dan Pasaribu, 1989). Salah satu faktor ketahanan tubuh yaitu antibodi yang
produksinya akan sangat dipengaruhi lingkungan terutama suhu air. Kondisi
lingkungan yang sangat mempengaruhi terjadinya infeksi bakteri patogen adalah
yang tinggi, kadar amonia yang tinggi, perubahan suhu air dan pH air yang
rendah (Strange et al., 1977; Walter and Plumb,1980).
Pemeliharaan kondisi kualitas air untuk mencegah infeksi bakteri
patogen dilakukan dengan cara menjaga ketersediaan air yang cukup, bebas
pestisida dan polutan. Hal lain yang penting adalah menjaga oksigen terlarut
yang cukup, menghindari konsentrasi amonia dan karbondioksida yang tinggi,
mencegah akumulasi bahan organik dan perubahan suhu yang mendadak serta
berfluktuasi terlalu besar (Plumb, 1992). Kondisi parameter kualitas air yang
III. METODE PENELITIAN
3.1 Waktu dan Tempat
Penelitian mengenai identifikasi bakteri patogen pada ikan badut
dilaksanakan pada bulan Maret – Mei 2013. Penelitian dilaksanakan di
Laboratorium Budidaya Perikanan Program Studi Budidaya Perairan Fakultas
Pertanian Universitas Lampung dan Laboratorium Penguji Stasiun Karantina
Ikan, Pengendalian Mutu dan Keamanan Hasil Perikanan Kelas I Lampung.
3.2 Alat dan Bahan Penelitian
Alat-alat yang digunakan dalam penelitian antara lain petri disk, jarum
ose, tabung reaksi, pinset, gunting, spektrofotometer, pembakar bunsen,
mikropipet, mikroskop, gelas objek, gelas penutup, labu Erlenmeyer, kaca
pembesar, pipet tetes, timbangan analitik, kompor gas, spuit, ember, batu aerasi,
selang aerasi, autoklaf, hot plate.
Bahan yang digunakan dalam penelitian ini antara lain sampel ikan
badut yang sakit berukuran 3-5 cm (umur 4-6 bulan), media TSA (Trypticase
Soy Agar), NaCl 2,5% (Natrium Chlorida), media TSB (Tryptic Soy Broth), media TCBS (Thiosulfate Citrate Bile Salts Sucrose), media GSP (Glutamate
3.3 Prosedur Penelitian
3.3.1 Pengambilan Sampel
Pengambilan sampel dilakukan secara non random, yaitu dengan
mengambil ikan badut yang memiliki gejala penyakit baik dalam keadaan hidup,
hampir mati atau mati (Nitimulyo dan Triyanto, 1989). Sampel yang digunakan
adalah ikan badut dengan panjang 3-5 cm yang berumur 4-6 bulan yang berasal
dari Balai Besar Pengembangan Budidaya Laut (BBPBL) Lampung. Beberapa
gejala awal yang dapat membantu pengambilan sampel adalah pembuluh darah
tampak jelas terutama pada sirip, perubahan warna bintik-bintik merah atau
hemoragik, tampak lemah, selalu di permukaan atau di dasar, anoreksia,
bernafas cepat, berenang tidak beraturan, posisi tubuh miring, tegak atau
terbalik, atau buta.
3.3.2 Pengamatan Gejala Penyakit
3.3.2.1Pengamatan gejala eksternal (external examination)
Pengamatan dilakukan terhadap gejala yang timbul pada bagian luar
tubuh. Tanda-tanda atau gejala penyakit yang terlihat dari luar sangat bervariasi,
bergantung jenis atau intensitas serangan penyakit. Gejala yang dapat diamati
pada ikan yang terserang bakteri patogen diantaranya pembuluh darah tampak
jelas terutama pada sirip, perubahan warna bintik-bintik merah atau haemoragik,
kelihatan lemah, selalu di permukaan atau di dasar, tidak mau makan, bernafas
cepat, berenang tidak beraturan, posisi tubuh miring, tegak atau terbalik, atau
3.3.2.2Pengamatan gejala internal (internal examination)
Pemeriksaan gejala dalam dilakukan dengan cara membedah (sectio) ikan badut dan mengamati gejala yang timbul pada organ dalam seperti: insang,
alat pencernaan, hati, dan ginjal.
3.3.3 Isolasi dan Pemurnian Bakteri
Isolasi bakteri dari sampel ikan badut dilakukan dari luka ataupun secara
aseptik dari organ insang, ginjal, hati, dan alat pencernaan menggunakan ose
steril pada media TSA dengan penambahan NaCl 2,5%, media GSP 2,5% NaCl
dan media TCBS. Inkubasi dilakukan pada suhu kamar selama 18-24 jam.
Pemurnian bakteri dilakukan dengan memisahkan bakteri yang
mempunyai morfologi koloni berbeda. Pengamatan morfologi koloni meliputi
bentuk koloni, elevasi, bentuk, tepi dan warna koloni. Pengamatan koloni bakteri
meliputi bentuk sel bakteri dan pengecatan Gram. Isolat bakteri murni kemudian
disimpan dalam agar miring yang diberi parafin cair steril.
3.3.4 Pengujian Postulat Koch
Postulat Koch berisi empat kriteria yang diperlukan untuk membuktikan
bahwa mikroba spesifik merupakan penyebab penyakit tertentu. Koloni bakteri
murni yang diduga sebagai penyebab penyakit dikultur dalam media cair TSB
dengan penambahan NaCl 2,5%, kemudian diinkubasi selama 24 jam. Kultur
bakteri tersebut digunakan untuk reinfeksi ikan badut. Reinfeksi dilakukan
dengan cara menginfeksi kembali ikan badut dengan bakteri secara suntikan
menggunakan konsentrasi 109 CFU/ml per ekor bertujuan untuk meningkatkan virulensi bakteri sehingga menunjukkan bakteri tersebut dapat menyebabkan
penyakit atau tidak. Ikan badut merupakan ikan yang sensitif sehingga ikan
badut perlu dibius terlebih dahulu sebelum dilakukan penyuntikan agar ikan
badut tidak stres dan mati. Pembiusan dilakukan secara perendaman dengan
menggunakan minyak cengkeh dengan dosis 0,1 ml minyak cengkeh dalam 1L
air laut. Ikan badut yang telah direinfeksi dipelihara selama 7 hari dan diamati
gejala penyakitnya setiap hari. Isolat bakteri yang menimbulkan gejala penyakit
seperti pada pengambilan sampel awal merupakan bakteri patogen pada ikan
badut. Ikan yang mengalami kematian dihitung rata-rata waktu kematiannya.
Rerata waktu kematian (Mean Time to Death, RWK) ikan pada uji Postulat Koch diperhitungkan (Hubert, 1980) sebagai berikut:
3.3.5 Reisolasi
Reisolasi dilakukan untuk mengetahui bakteri hasil reinfeksi apakah
sama dengan bakteri yang disuntikkan pada saat direinfeksi. Reisolasi dilakukan
setelah ada ikan badut yang mati atau memiliki gejala penyakit yang parah dari
3.3.6 Identifikasi bakteri
Identifikasi bakteri patogen penyebab penyakit pada ikan badut yang
meliputi morfologi koloni, morfologi sel bakteri dan pengujian biokimia.
Pengamatan morfologi koloni dan pengecatan Gram dilakukan untuk
mengetahui apakah bakteri tersebut sama dengan bakteri yang menyebabkan
penyakit.
3.3.6.1Pengamatan morfologi koloni
Pengamatan morfologi koloni dilakukan pada isolat bakteri yang telah
murni dan terpisah. Bakteri lalu diinokulasi pada media TCBS dan GSP
kemudian diinkubasi pada suhu kamar selama 24-48 jam. Pengamatan ini
meliputi bentuk, tepi, elevasi, warna dan ukuran (Anonim, 1994).
3.3.6.2Pengamatan morfologi sel bakteri
Pengamatan morfologi koloni dilakukan dengan pengecatan Gram.
Pengecatan Gram dilakukan untuk mengetahui jenis Gram, dan bentuk sel
bakteri. Pengecatan bakteri dimulai dengan membuat sediaan tipis satu ose
bakteri ditambah akuades secukupnya pada gelas objek yang difiksasi di atas
nyala api sampai kering dan agar tidak terlepas saat dibilas dengan air. Sediaan
tersebut lalu digenangi dengan larutan Kristal violet (Gram A) selama 1-2 menit
setelah itu larutan Kristal violet dibuang dan dibilas dengan air
mengalir.Kemudian, sediaan digenangi dengan larutan iodin (Gram B) selama 1
menit kemudian cat Gram B dibuang dan dibilas dengan air mengalir.
Selanjutnya, sediaan digenangi dengan larutan pemucat (Gram C) selama 30
selama 1 menit kemudian dicuci dengan air mengalir dan kering anginkan.
Sediaan diamati di bawah mikroskop dengan perbesaran kuat menggunakan
minyak imersi. Bakteri Gram negatif berwarna merah dan bakteri Gram positif
berwarna ungu (Anonim, 1994).
3.3.6.3Pengujian Biokimia
1. Uji katalase
Pengujian ini dilakukan untuk mengetahui bakteri yang dapat
menghasilkan enzim katalase. Pengujian dilakukan dengan meneteskan H2O2 3%
pada gelas objek, kemudian satu ose koloni bakteri digoreskan pada larutan
tersebut. Katalase positif (+) ditunjukkan dengan timbulnya gelembung udara
sedangkan katalase negatif (-) tidak timbul gelembung udara (Anonim, 1994).
2. Uji Oksidatif-Fermentatif
Pengujian ini dilakukan untuk mengetahui kemampuan bakteri dalam
menguraikan glukosa. Pengujian dilakukan dengan menggunakan medium O/F
(medium Hugh dan Leifson) yang mengandung 1 % glukosa pada tabung
reaksi.Bakteri diinokulasi pada dua medium tegak, yang salah satu tabung
ditutup paraffin cair steril setinggi 1 cm dari permukaan medium, kemudian
diinkubasi pada suhu kamar selama 24-48 jam. Medium pada tabung tanpa
paraffin cair steril berubah warna dari biru menjadi kuning dan tabung lainnya
tetap biru berarti bakteri bersifat oksidatif. Medium pada kedua tabung berubah
warna dari biru menjadi kuning berarti bakteri bersifat fermentatif. Medium
dikedua tabung tidak berubah berarti bakteri tidak memecah glukosa dalam
3. Uji Motilitas, Indol dan Ornithin (MIO)
Pengujian tiga sifat kimia ini menggunakan medium motility, indol dan
ornithin (MIO). Bakteri yang tumbuh menyebar dari garis tusukan menunjukkan
sifat motil, sedangkan bila tumbuhnya hanya mengikuti garis tusukan
menunjukkan sifat non motil (Anonim, 1994).
Pengujian indol dilakukan untuk mengetahui kemampuan bakteri dalam
menghasilkan indol dari trypthophan. Pengujian dilakukan dengan menambah 5
tetes reagen Ehrlich dalam medium. Reaksi positif ditandai dengan terbentuknya
lapisan tipis (cincin) berwarna merah muda antara medium dengan reagen
Ehrlich. Pembentukan ornithin memiliki tanda yaitu terjadinya perubahan
sebagian warna medium menjadi kuning.
4. Uji Oksidase
Pengujian oksidase dilakukan untuk mengetahui adanya enzim oksidase
pada bakteri. Satu ose koloni bakteri digoreskan pada kertas oksidase.
Pengamatan dilakukan dengan melihat reaksi yang ditimbulkan, apabila hasil
goresan berwarna biru pada kertas oksidase menunjukkan bahwa bakteri yang
diuji mempunyai enzim oksidase positif dan jika tidak terjadi perubahan warna
menunjukkan hasil oksidase negatif (Anonim, 1994).
5. Uji Sitrat
Uji sitrat dilakukan untuk mendeterminasi kemampuan bakteri
menggunakan asam sitrat sebagai sumber karbon untuk metabolisme. Uji sitrat
24-48 jam pada suhu kamar. Pengamatan dilakukan dengan melihat perubahan
warna yang terjadi pada medium. Hasil uji positif jika bakteri tumbuh dengan
merubah warna media dari hijau menjadi biru dan hasil negatif jika bakteri yang
diinokulasikan tidak tumbuh serta tidak terjadi perubahan warna.
6. Uji Triple Sugar Iron Agar (TSIA)
TSIA pada prinsipnya digunakan untuk mendeterminasi bakteri yang
mampu menggunakan gabungan beberapa karbohidrat khusus. Satu ose bakteri
dari biakan murni diisolasikan ke dalam media TSIA agar miring dengan metode
goresan dan secara tusukan dan kemudian diinkubasi selama 24-48 jam pada
suhu ruang. Pengamatan dilakukan dengan melihat perubahan warna yang
terjadi pada goresan maupun tusukan. Warna merah menunjukkan reaksi alkali
yang ditulis dengan simbol (K), jika berubah warna menjadi kuning
menunjukkan reaksi asam yang diberi simbol (A) dan apabila tidak terjadi
perubahan warna maka ditulis dengan simbol NR yang berarti tidak terjadi
reaksi (Anonim, 1994).
7. Uji Lysin Iron Agar (LIA)
Uji LIA dilakukan untuk mengetahui kemampuan bakteri dalam
memproduksi Lysine Dikarboxylase dapat diketahui dan juga produksi H2S.
Lysin Iron Agar adalah agar semi solid yang mengandung dekstrose dan
L-lysine sebagai unsur utama serta brom cresol purple sebagai indikator. Jika
bakteri hanya memfermentasi dekstros maka dasarnya akan berwarna kuning,
tetapi bakteri yang memfermentasi dekstros serta mendekarboksilase L-lysine,
keseluruhan berwarna ungu dengan adanya indikator brom crose purple. Uji LIA
dilakukan dengan mengambil satu ose biakan bakteril, kemudian dimasukan ke
dalam dasar tabung agar dan dioleskan ke seluruh permukaanya kemudia
diinkubasi pada suhu 37ºC selama 24 jam. Terjadinya warna ungu pada seluruh bagian berarti tes positif. Jika tidak ada perubahan warna atau dasarnya
berwarna kuning maka tes dinyatakan negatif (Buller, 2004).
3.4 Analisis Data
Data hasil penelitian akan dianalisis secara deskriptif dan data disajikan
dalam bentuk gambar dan tabel. Pengumpulan data dilakukan untuk mengetahui
jenis-jenis bakteri patogen yang dapat menyerang ikan badut khususnya di balai
V. SIMPULAN DAN SARAN
5.1 Simpulan
Berdasarkan hasil penelitian dapat disimpulkan bahwa:
1. Tiga bakteri patogen pada ikan badut (Amphiprion percula), yaitu Vibrio
alginolyticus, Pseudomonas cepacia dan Acinetobacter calcoaceticus. 2. Bakteri V. alginolyticus ditemukan di saluran pencernaan, sedangkan bakteri
P. cepacia dan A. calcoaceticus ditemukan di hati.
3. Gejala klinis yang ditimbulkan ketiga jenis bakteri patogen tersebut adalah
pada ikan yang terinfeksi bakteri V. alginolyticus akan mengalami pendarahan pada hati, pembengkakan gelembung renang dan asites. Ikan
yang terinfeksi bakteri A. calcoaceticus mengalami hemoragik pada sirip
ekor, nekrosis pada punggung, insang pucat dan hepatomegali. Sedangkan,
ikan yang terinfeksi bakteri P. cepacia mengalami ulcer pada punggung,
5.2 Saran
1. Perlu dilakukan penelitian secara histopatologi untuk mengetahui seberapa
besar tingkat keganasan bakteri patogen dengan melihat kerusakan jaringan
yang terjadi.
2. Sebagian besar bakteri berasal dari organ pencernaan dapat dimanfaatkan
DAFTAR PUSTAKA
Adams, S. M. 1990. Status and Use of Biological Indicators for Evaluating the Effects of Stress on Fish. dalam Biological Indicators of Stress in Fish. American Fisheries Society Symposium. Maryland: 1-8 p. Akinbowale O.L., H. Peng and M.D. Barton. 2006. Antimicrobial resistance in
bacteria isolated from aquaculture sources in Australia. Journal of Applied Microbiology. University of South Australia. Australia. Allen, G. R. 1972. The Anemonefish: Their Classification and Biology. T. F. H.
Public, Inc. New Jersey. 288 p. Identification: Tropical Pasific. New world publication, Inc. Florida, USA. 67 p.
Al Qodri, A.H., S. Antoro dan P. Hartono. 2009. Biologi Clownfish. dalam Budidaya Clownfish (Amphiprion sp.). Balai Besar Pengembangan Budidaya Laut Lampung: 5-10 p.
Anonim, 1993. Hama dan Penyakit Ikan Karantina Golongan Bakteri. Pusat Karantina Pertanian dan Jurusan Perikanan Fakultas Pertanian Universitas Gajah Mada. Yogyakarta. 29 p.
, 1994. Determinasi Bakteri Patogenik Penyebab Penyakit Ikan. Jurusan Perikanan Fakultas Pertanian Universitas Gajah Mada. Yogyakarta. 122 p.
Austin B. 1988. Marine microbiology. Cambridge University press. Cambridge, England. 222p.
Austin, B., dan Austin, D. A. 2007. Bacterial Fish Pathogens: Disease in farmed and Wild Fish. Praxis Publishing Ltd, Chichester, UK. Germany.
Buller, N. B. 2004. Bacteria from Fish and Other Aquatic Animals. CABI Publishing. Oxford, UK. 394 p.
Burgess, W. 1990. ATLAS of Marine Aquarium Fishes. T.F.H. Publication. USA.
Casadevall, A., and L. Pirofski. 1999. Host-pathogen Interaction: Redifining the basic Concepts of Virulence and Pathogenicity. Infection and Immunity67 (8): 3703 -3713 p.
Cowan, S. T. and Steel. 1974. Manual for the Identification of Medical Bacteria. Second Edition. Cambridge University. Cambridge. 238p
Dhayanithi, N.B., T.T. Ajith and K. Kathiresan. 2010. Effect of neem extract against the bacteria isolated from marine fish. Journal of Environmental Biology. Annamalai University. India.
Diani, S. 1993. Masalah Penyakit Pada Budidaya Ikan Laut. dalam Prosiding Symposium Perikanan Indonesia I. Buku II Bidang Budidaya Perikanan. F. Chalik (eds). 157-162 p.
Drury, F. 2008. Marine Symbiosis: Clownfish and Anemones. PSA Journal. Wheaton, USA.
Ewald, P.W.1993. The Evolution of virulence. Science America268: 86-93 p.
Gregory, W. J. dan Paul C. M.N. 1986. Infection Control. Published by: The University of Chicago Press. Vol. 7, No. 5: 281-284 p.
Holt, J. G., N. R. Krieg, P. H. A Sneath., J. T. Staley dan S. T. Williams. 1994.
Bergey’s Manual of Determinative Bacteriology. 9th Edition. A
Waverly Company Williams and Wilkins. Baltimore.
Aeromonas hyrdophila subsp. Hydrophila (Chester 1901) Stanier 1943 (Approved list 1980). International J. of Syst ematic and Evolu tionary Microbiology, 52: 705- 712 p.
Irianto, A. 2005. Patologi Ikan Teleostei. Gadjah Mada University Press. Yogyakarta. 256 hal.
Irianto, Koes. 2006. Mikrobiologi ‘Menguak Dunia Mikroorganisme’ Jilid 1&2. Penerbit Yrama Widya, cetakan-1. Bandung.
Jawetz, E., Melnick, J.L., Adelberg, E.A. 2001. Mikrobiologi Kedokteran. EGC Penerbit Buku Kedokteran, Jakarta, 753 hlm
Jawetz, E., J.L Melnick, E.A Adelberg, G.F Brooks, J.S Butel & I.N Ornston. 1996. Mikrobiologi Kedokteran. Terj. dari Medical Microbiology. 20th Eds. Setiawan, , (Ed.). 1996. EGC, Jakarta, xiii: 753 hlm. IMA. 2001. Eksploitasi dan Perdagangan Dalam Perikanan Karang di
Indonesia. CSO 2001. Bogor.
Kementerian Kelautan dan Perikanan. 2012. Statistik Ekspor Hasil Perikanan 2011. Buku I. Pusat Data, Statistik dan Informasi Sekretariat Jenderal Kementerian Kelautan dan Perikanan. 509 hlm. Hlm 2: 103.
Kurniastuty dan J. Dewi. 1999. Hama dan Penyakit pada Budidaya Ikan Kakap Putih. dalam Budidaya Ikan Kakap Putih (Lates calcalifer, Bloch) di Karamba Jaring Apung. Balai Budidaya Laut. Lampung. 73 p. Kurniastuty, P. Hartono dan A. Hermawan. 1999. Hama dan Penyakit. dalam
Pembenihan Ikan Kerapu Tikus (Cromileptes altivelis). Balai Budidaya Laut Lampung. 66-71 p.
Kurniastuty, H. Marnis dan J. Dewi. 2009. Hama dan Penyakit Clownfish (Amphiprion ocellaris). Dalam Budidaya Clownfish (Amphiprion sp.). Balai Besar Pengembangan Budidaya Laut Lampung. 81-86 p. Lieske, E and Myers, R. 2001. Reef fishes of the world. Periplus Editions.
Singapore. 400 p.
Mims, C.A. 1987. The pathogenesis of infectious disease. 3rd Ed. Department of Mikrobiology Guys Hospital Medical School. Academic Press, London. 342 p.
Myers R., 1999. Miconesian reff fish: a field guide for divers and aquarist, Barrigada: Territory of Guam: Coral Graphics
Nabib, R., dan F.H. Pasaribu. 1989. Patologi dan Penyakit Ikan. PAU Bioteknologi, Institute Pertanian Bogor. Bogor. 156 p.
Nitimulyo, K. H. 1991. Penyakit Bakterial pada Ikan Air Tawar yang terdapat Di Indonesia dan Luar Negeri. Workshop Penetapan Hama dan Penyakit Ikan Karantina. Bogor. 30 p.
Nitimulyo, K. H dan Triyanto. 1989. Audiovisual Identifikasi Bakteri Penyakit Ikan. PAU Bioteknologi Universitas Gadjah Mada. Yogyakarta. 16p.
Panrengrengi, A. Z., D.R. Boer dan I. Rusdi. 1993. Identifikasi dan Patogenesitas Beberapa Bakteri Vibrio pada Larva Kepiting Bakau (Scylla serrata). Jurnal Penelitian Budidaya Pantai 9 (3) : 125-130.
Plumb, J. A. 1992. Disease Control in Aquaculture. dalam Disease in Asian Aquaculture I. M. Shariff., R. P. Subasinghedan J. R. Arthur (eds). Fish Health Section. Asian Fisheries Society. Manila : 3-17 p.
Post, G. W. 1983. Textbook of Fish Health. TFH Publication. Hongkong. 256 p. Roberts, R.J . 1993. Motil Aeromonad Septicemia. Dalam: Inglish,V., R.J.
Roberts & N.R. Bmmage (Eds.).1993. Bacterial diseases of fish. Institut of Aquaculture. BlackwellScience Lid, USA. 143-156 p.
Roza, D 1993. Pengendalian Populasi Vibrio harveyi di Hatchery Udang Windu. Dalam Prosiding Simposium Perikanan Indonesia I. Buku II Bidang Budidaya Perikanan. F. Chalik (eds) :275-278.
Schoch, P. E dan B. A Cunha. 1984. Infection Control. Published by: The University of Chicago Press. Chicago, USA. 542-544 p.
Seng, L. T., 1994. Parasite and Disease of Culture Marine Finfish in South East Asia. Pusat Pengkajian Sains Kajihayat, University Sains Malaysia. Setiawati, K.M., D. Kusumawati, J. H. Hutapea, D. R. Boer, N. A. Giri, Wardoyo,
Penelitian dan Pengembangan Budidaya Laut. Singaraja. Bali. 35-37 hal
Strange, R. J., C. B. Scherck dan J. T. Golden. 1977. Corticoid Stress Responses to Handling and Temperature in Salmonids. Transactions of the American Fisheries Society 106 (3) : 213-218 p.
Sudheesh, P. S. and H-S Xu. 2001. Pathogenicity of Vibrio parahaemolyticus in Tiger Prawn Penaeus monodon Fabricius: Possible Role of Extracellular Proteases. Aquaculture. 196 : 37- 46 p.
Suharti, S. R. 1990. Mengenal Kehidupan Kelompok Ikan Anemon (Pomacentridae). dalam: Oseana vol. XV No. 4. P2O-LIPI. Jakarta : 135-145 p.
Supriyadi. 2006. Analisis Risiko Agens Hayati untuk Pengendalian Patogen pada Tanaman. Jurnal Litbang Pertanian 25(3), Balai Penelitian Tanaman Obat dan Aromatik. Bogor.