ABSTRACT
PRADESIGN OF ISOPROPANOLAMINE PLANT FROM PROPYLENE OXIDE AND AMMONIA
CAPACITY 15.000 TONS/YEAR (Design Reactor (RE-201))
By ADELINA
A plant to produce isopropanolamine from propylene oxide and ammonia is planned to be located at Tanjung Siapi-Api, Palembang, South Sumatera. The plant is established by considering availability of raw materials, transportation facilities, readily available labor and environmental conditions.
Capacity of the plant is 15.000 tons/year operating 24 hour/day and 330 working days/ year. The plant required 1746,11 kg/hr propylene oxide and 2944,534 kg/hr ammonia.
Quantity of labor is around 143 people. The plant is managed as a Limited Liability Company (PT), which is headed by a Director who is assisted by a Director of Production and Director of Finance. The company is organized in the form of line and staff structure. From analysis of the plant economy is obtained:
Fixed Capital Investment (FCI) = Rp 240,590,020,360,-
Working Capital Investment (WCI) = Rp 42,457,062,416,-
Total Capital Investment (TCI) = Rp 283,047,082,776,-
Break Even Point (BEP) = 55%
Shut Down Point (SDP) = 25,11%
Pay Out Time after Taxes (POT)a = 2,63 year
Return on Investment after Taxes (ROI)a = 23,75 %
Internal Rate Return (IRR) = 29,17%
Annual Net Profit (Pa) = Rp 67,247,410,190/year
ABSTRAK
PRARANCANGAN PABRIK ISOPROPANOLAMIN DARI PROPILEN OKSIDA DAN AMONIAK
KAPASITAS 15.000 TON/TAHUN (Perancangan Reaktor (RE-201))
Oleh ADELINA
Pabrik isopropanolamin berbahan baku propilen oksida dan amoniak, akan didirikan di Tanjung Siapi-api, Palembang, Sumatera Selatan. Pabrik ini berdiri dengan mempertimbangkan ketersediaan bahan baku, sarana transportasi yang memadai, tenaga kerja yang mudah didapatkan dan kondisi lingkungan.
Pabrik direncanakan memproduksi isopropanolamin sebanyak 15.000 ton/tahun, dengan waktu operasi 24 jam/hari, 330 hari/tahun. Bahan baku yang digunakan adalah propilen oksidasebanyak 1746,11 kg/jam dan amoniak sebanyak 2944,534 kg/jam.
Jumlah karyawan sebanyak 143 orang dengan bentuk perusahaan adalah Perseroan Terbatas (PT) menggunakan struktur organisasi line dan staff.
Dari analisis ekonomi diperoleh:
Fixed Capital Investment (FCI) = Rp 240,590,020,360,-
Working Capital Investment (WCI) = Rp 42,457,062,416,-
Total Capital Investment (TCI) = Rp 283,047,082,776,-
Break Even Point (BEP) = 55%
Shut Down Point (SDP) = 25,11%
Pay Out Time after Taxes (POT)a = 2,63 tahun
Return on Investment after Taxes (ROI)a = 23,75 %
Internal Rate Return (IRR) = 29,17%
Annual Net Profit (Pa) = Rp 67,247,410,190/tahun
PRARANCANGAN PABRIK ISOPROPANOLAMIN
DARI PROPILEN OKSIDA DAN AMONIAK
KAPASITAS 15.000 TON/TAHUN
(Tugas Khusus Reaktor 01 (RE-201))
Oleh
ADELINA
Skripsi
Sebagai salah satu syarat untuk mencapai gelar
SARJANA TEKNIK
Pada
Jurusan Teknik Kimia
Fakultas Teknik Universitas Lampung
JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK
UNIVERSITAS LAMPUNG
PRARANCANGAN PABRIK ISOPROPANOLAMIN
DARI PROPILEN OKSIDA DAN AMONIAK
KAPASITAS 15.000 TON/TAHUN
(Tugas Khusus Reaktor 01 (RE-201))
(
Skripsi
)Oleh
ADELINA
JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK
UNIVERSITAS LAMPUNG
DAFTAR GAMBAR
Gambar Halaman
1.1. Jumlah Impor Isopropanolamindi Indonesia Setiap Tahun ... 4
2.1. Diagram Alir Proses ... 37
4.1. Mix Point 1 (MP-101) ... 41
4.2. Reaktor 1 (RE-201) ... 42
4.3. Reaktor 2 (RE-202) ... 43
4.4. Split Point (SP-201) ... 44
4.5. Menara Distilasi 1 (DC-301) ... 44
4.6. Menara Distilasi 2 (DC-302) ... 46
4.7. Menara Distilasi 3 (DC-303) ... 48
6.1. Diagram Alir Pengolahan Air ... 102
6.2. Cooling Tower ... 110
6.3. Diagram Cooling Water Sistem ... 111
6.4. Deaerator ... 120
7.1. Peta Pulau Sumatera ... 135
7.2. Lokasi Pabrik ... 136
7.3. Tata Letak Pabrik dan Fasilitas Pendukung ... 137
7.4. Tata Letak Alat Proses ... 138
8.1. Struktur Organisasi Perusahaan ... 144
9.1. Grafik BEP dan SDP ... 171
iii
DAFTAR ISI
Halaman
DAFTAR ISI ... iii
DAFTAR TABEL ... v
DAFTAR GAMBAR ... x
I. PENDAHULUAN A. Latar Belakang ... 1
B. Kapasitas Perancangan ... 3
C. Lokasi Pabrik ... 5
II. DESKRIPSI PROSES A. Macam-macam proses pembuatan isopropanolamin ... 8
B. Pemilihan Proses ... 10
C. Uraian Proses ... 33
III. SPESIFIKASI BAHAN DAN PRODUK A. Bahan Baku ... 38
B. Produk ... 39
IV. NERACA MASSA DAN ENERGI A. Neraca Massa ... 41
B. Neraca Energi ... 50
V. SPESIFIKASI PERALATAN A. Peralatan Proses ... 55
B. Peralatan Utilitas ... 76
VI. UTILITAS DAN PENGOLAHAN LIMBAH A. Unit Pendukung Proses ... 101
B. Pengolahan Limbah ... 122
C. Laboratorium ... 123
D. Instumentasi Dan Pengendalian Proses ... 127
VII. TATA LETAK DAN LOKASI PABRIK A. Lokasi Pabrik ... 130
iv
C. Prakiraan Areal Lingkungan ... 134
VIII. SISTEM MANAJEMEN DAN ORGANISASI PERUSAHAAN A. Bentuk Perusahaan ... 139
B. Struktur Organiasi Perusahaan ... 142
C. Tugas dan Wewenang... 145
D. Status Karyawan dan Sistem Penggajian ... 153
E. Pembagian Jam Kerja Karyawan ... 154
F. Penggolongan Jabatan dan Jumlah Karyawan ... 156
G. Kesejahteraan Karyawan ... 161
IX. INVESTASI DAN EVALUASI EKONOMI A. Investasi ... 164
B. Evaluasi Ekonomi ... 169
C. Angsuran Pinjaman ... 172
D. Discounted Cash Flow ... 172
X. KESIMPULAN DAN SARAN A. Kesimpulan ... 174
B. Saran ... 174
DAFTAR PUSTAKA LAMPIRAN
LAMPIRAN A PERHITUNGAN NERACA MASSA LAMPIRAN B PERHITUNGAN NERACA ENERGI LAMPIRAN C SPESIFIKASI PERALATAN
LAMPIRAN D UTILITAS
v
DAFTAR TABEL
Tabel Halaman
1.1 Data Kebutuhan Isopropanolamin di Indonesia ... 3
2.1 Harga Bahan Baku dan Produk ... 10
2.2 Nilai ΔH0 f (298) bahan baku dan produk ... 17
2.3 Nilai ΔH0 f masing-masing komponen ... 20
2.4 Nilai ΔH0 f masing-masing komponen ... 22
2.5 Nilai ΔH0 f (298) bahan baku dan produk ... 24
2.6 Nilai ΔG0 f (298) bahan baku dan produk ... 30
2.7 Perbandingan Proses ... 32
4.1 Data Hasil Perhitungan Neraca Massa MP 101 ... 41
4.2 Data Hasil Perhitungan Neraca Massa Reaktor (RE-201) ... 42
4.3 Data Hasil Perhitungan Neraca Massa Reaktor (RE-202) ... 43
4.4 Data Hasil Perhitungan Neraca Massa SP 201 ... 44
4.5 Data Hasil Perhitungan Neraca Massa Menara Distilasi 1 (DC-301) ... 45
4.6 Data Hasil Perhitungan Neraca Massa Kondenser (CD-301) ... 45
4.7 Data Hasil Perhitungan Neraca Massa Reboiler (RE-301) ... 46
4.8 Data Hasil Perhitungan Neraca Massa Menara Distilasi 2 (DC-302) ... 47
4.9 Data Hasil Perhitungan Neraca Massa Kondenser (CD-302) ... 47
4.10 Data Hasil Perhitungan Neraca Massa Reboiler (RE-302) ... 48
4.11 Data Hasil Perhitungan Neraca Massa Menara Distilasi 3 (DC-303) ... 49
4.12 Data Hasil Perhitungan Neraca Massa Kondenser (CD-303) ... 49
4.13 Data Hasil Perhitungan Neraca Massa Reboiler (RE-302) ... 50
4.14 Neraca Energi HE-101 ... 50
4.15 Neraca Energi CO-101 ... 51
4.16 Neraca Energi HE-201 ... 51
4.17 Neraca Energi CO-301 ... 51
vi
4.19 Neraca Energi CO-303 ... 52
4.20 Neraca Energi RE-201 ... 52
4.21 Neraca Energi RE-202 ... 53
4.22 Neraca Energi DC-301 ... 53
4.23 Neraca Energi DC-302 ... 53
4.24 Neraca Energi DC-303 ... 54
4.25 Neraca Energi MP ... 54
5.1 Spesifikasi Tangki Amoniak (ST-101) ... 55
5.2 Spesifikasi Centrifugal Fan (FA – 01)... 55
5.3 Spesifikasi Tangki Propilen Oksida(ST-102) ... 56
5.4 Spesifikasi Pompa (PP – 02) ... 56
5.5 Spesifikasi Cooler (CO-101) ... 57
5.6 Spesifikasi Heater (HE-101) ... 58
5.7 Spesifikasi Reaktor (RE-201) ... 59
5.8 Spesifikasi Pompa (PP –03) ... 59
5.9 Spesifikasi Reaktor (RE-202) ... 60
5.10 Spesifikasi Pompa (PP-04) ... 61
5.11 Spesifikasi Heater (HE-201) ... 61
5.12 Spesifikasi Pompa (PP-05) ... 62
5.13 Spesifikasi Menara Distilasi (DC-301) ... 62
5.14 Spesifikasi Reboiler (RB-301) ... 63
5.15 Spesifikasi Kondensor (CD-301) ... 64
5.16 Spesifikasi Accumulator (AC-301) ... 64
5.17 Spesifikasi Pompa (PP-06) ... 65
5.18 Spesifikasi Menara Distilasi (DC-302) ... 65
5.19 Spesifikasi Reboiler (RB-302) ... 66
5.20 Spesifikasi Kondensor (CD-302) ... 66
5.21 Spesifikasi Accumulator (AC-302) ... 67
5.22 Spesifikasi Pompa (PP-07) ... 68
5.23 Spesifikasi Pompa (PP-08) ... 69
5.24 Spesifikasi Cooler (CO-301) ... 69
vii
5.26 Spesifikasi Menara Distilasi (DC-303) ... 70
5.27 Spesifikasi Reboiler (RB-303) ... 71
5.28 Spesifikasi Kondensor (CD-303) ... 71
5.29 Spesifikasi Accumulator (AC-303) ... 72
5.30 Spesifikasi Pompa (PP-09) ... 73
5.31 Spesifikasi Pompa (PP-10) ... 73
5.32 Spesifikasi Cooler (CO-302) ... 73
5.33 Spesifikasi Tangki Diisopropanolamin (ST-302) ... 74
5.34 Spesifikasi Cooler (CO-303) ... 75
5.35 Spesifikasi Tangki Triisopropanolamin (ST-303) ... 76
5.36 Spesifikasi Bak Sedimentasi (BS-101) ... 76
5.37 Spesifikasi Bak Penggumpal (BP-101) ... 77
5.38 Spesifikasi Tangki Penampungan Larutan Alum (TP-101) ... 77
5.39 Spesifikasi Tangki Penampungan Larutan Klorin (TP-102) ... 78
5.40 Spesifikasi Tangki Penampungan Larutan NaOH (TP-103) ... 78
5.41 Spesifikasi Clarifier (CL-101) ... 79
5.42. Spesifikasi Sand Filter (SF-101) ... 79
5.43 Spesifikasi Tangki Penyimpanan Air Filter (TP-104) ... 80
5.44 Spesifikasi Tangki Penyimpanan Air Domestik (DOWT-104) ... 81
5.45 Spesifikasi Hot Basin (HB-101) ... 81
5.46 Spesifikasi Tangki Inhibitor (TP-201) ... 82
5.47 Spesifikasi Tangki Dispersan (TP-202) ... 82
5.48 Spesifikasi Tangki Cooling Tower (CT-101) ... 83
5.49 Spesifikasi Cold Basin (CB-101) ... 83
5.50 Spesifikasi Tangki Air Kondensat (SCT-301) ... 84
5.51 Spesifikasi Tangki Larutan Asam Sulfat (TP-302) ... 84
5.52 Spesifikasi Cation Exchanger (CE-101) ... 85
5.53 Spesifikasi Anion Exchanger (AE-101) ... 86
5.54 Spesifikasi Tangki Hidrazin (TP-303) ... 86
5.55 Spesifikasi Deaerator (DA-01) ... 87
5.56 Spesifikasi Pompa Utilitas (PU-01) ... 87
viii
5.58 Spesifikasi Pompa Utilitas (PU-03) ... 89
5.59 Spesifikasi Pompa Utilitas (PU-04) ... 89
5.60 Spesifikasi Pompa Utilitas (PU-05) ... 90
5.61 Spesifikasi Pompa Utilitas (PU-06) ... 91
5.62 Spesifikasi Pompa Utilitas (PU-07) ... 91
5.63 Spesifikasi Pompa Utilitas (PU-08) ... 92
5.64 Spesifikasi Pompa Utilitas (PU-09) ... 93
5.65 Spesifikasi Pompa Utilitas (PU-10) ... 93
5.66 Spesifikasi Pompa Utilitas (PU-11) ... 94
5.67 Spesifikasi Pompa Utilitas (PU-12) ... 94
5.68 Spesifikasi Pompa Utilitas (PU-13) ... 95
5.69 Spesifikasi Pompa Utilitas (PU-14) ... 95
5.70 Spesifikasi Pompa Utilitas (PU-15) ... 96
5.71 Spesifikasi Tangki Bahan Baku Generator (TB-101) ... 96
5.72 Spesifikasi Boiler (B0-101)... 97
5.73 Spesifikasi Compressor (CP-401) ... 97
5.74 Spesifikasi Tangki Penyimpanan Brine (TP-401)... 97
5.75 Spesifikasi Cooler (CO-401) ... 98
5.76 Spesifikasi Pompa Utilitas (PU-16-17) ... 98
5.77 Spesifikasi Centrifugal (CF-101) ... 99
5.78 Spesifikasi Compressor (AC-501) ... 99
5.79 Spesifikasi Compressor (AC-101) ... 99
5.80 Spesifikasi Expander (EV-101) ... 100
6.1 Kebutuhan Air Pabrik ... 102
6.2 Peralatan yang Membutuhkan Air Pendingin ... 114
6.3 Peralatan yang Membutuhkan Steam ... 119
6.4 Tingkat Kebutuhan Informasi dan Sistem Pengendalian ... 128
6.5 Pengendalian Variabel Utama Proses ... 129
7.1 Perincian Luas Area Pabrik Isopropanolamin... 134
8.1 Jadwal Kerja Masing-Masing Regu ... 156
8.2 Perincian Tingkat Pendidikan ... 157
ix
8.4 Perincian Jumlah Karyawan Berdasarkan Jabatan ... 159
9.1 Fixed Capital Investment ... 165
9.2 Manufacturing cost ... 166
9.3 General Expenses ... 167
9.4 Biaya Administratif ... 168
9.5 Minimum Acceptable Present Return Of Investment ... 169
9.6 Acceptable Payout Time Untuk Tingkat Resiko Pabrik ... 170
MOTTO
“Takut akan Tuhan adalah
permulaan pengetahuan, tetapi
orang bodoh menghina hikmat dan didikan” –
Amsal 1:7
“Segala perkara dapat kutanggu
ng di dalam Dia yang
memberi
kekuatan padaku” –
Filipi 4:13
Sebuah Karya kecilku....
Dengan segenap hati kupersembahkan tugas akhir ini kepada:
Tuhan Yesus Kristus,
Atas anugrah-Nya semua ini ada
Atas kehendak-Nya semua ini aku dapatkan
Atas kekuatan dari-Nya aku bisa bertahan.
Orang tuaku sebagai tanda baktiku, terima kasih atas segalanya,
doa, kasih sayang, pengorbanan, dan keikhlasannya.
Ini hanyalah setitik balasan yang tidak bisa dibandingkan dengan
berjuta-juta pengorbanan dan kasih sayang
yang tidak pernah berakhir.
Abang dan Adik ku atas segalanya, kasih sayang dan doa.
Guru-guruku sebagai tanda hormatku,
terima kasih atas ilmu yang telah diberikan.
Kepada Almamaterku tercinta,
semoga kelak berguna dikemudian hari.
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 09 Februari 1990, sebagai anak kedua dari tiga bersaudara, dari pasangan Bapak L. Sianturi dan Ibu M. Br. Siahaan.
Lulus dari Sekolah Dasar (SD) di SD Strada Budi Luhur Bekasi pada tahun 2002, Sekolah Lanjutan Tingkat Pertama (SLTP) di SLTP Strada Budi Luhur Bekasi pada tahun 2005 dan Sekolah Menengah Atas (SMA) di SMAN 54 Jakarta pada tahun 2008.
Tahun 2008, penulis terdaftar sebagai Mahasiswa Jurusan Teknik Kimia Fakultas Teknik Universitas Lampung melalui jalur SNMPTN. Aktif di organisasi HIMATEMIA-FT Unila sebagai Anggota Hubungan Luar pada tahun 2010-2011.
Sebuah Karya kecilku....
Dengan segenap hati kupersembahkan tugas akhir ini kepada:
Tuhan Yesus Kristus,
Atas anugrah-Nya semua ini ada
Atas kehendak-Nya semua ini aku dapatkan
Atas kekuatan dari-Nya aku bisa bertahan.
Orang tuaku sebagai tanda baktiku, terima kasih atas segalanya,
doa, kasih sayang, pengorbanan, dan keikhlasannya.
Ini hanyalah setitik balasan yang tidak bisa dibandingkan dengan
berjuta-juta pengorbanan dan kasih sayang
yang tidak pernah berakhir.
Abang dan Adik ku atas segalanya, kasih sayang dan doa.
Guru-guruku sebagai tanda hormatku,
terima kasih atas ilmu yang telah diberikan.
Kepada Almamaterku tercinta,
semoga kelak berguna dikemudian hari.
SANWACANA
Puji dan syukur penulis panjatkan kepada Tuhan Yesus Kristus, atas karunia dan rahmatNya, sehingga tugas akhir ini dengan judul “Prarancangan Pabrik Isopropanolamin Dari Propilen Oksida Dan Amoniak dengan Kapasitas 15.000 Ton/Tahun” dapat diselesaikan dengan baik.
Tugas akhir ini disusun dalam rangka memenuhi salah satu syarat guna memperoleh derajat kesarjanaan (S-1) di Jurusan Teknik Kimia Fakultas Teknik Universitas Lampung.
Penyusunan tugas akhir ini tidak lepas dari bantuan dan dukungan dari beberapa pihak. Oleh karena itu penulis mengucapkan terima kasih kepada:
1. Bapak Ir. Azhar, M.T., selaku Ketua Jurusan Teknik Kimia Universitas Lampung.
2. Bapak Edwin Azwar, S.T., P.GD., M.T.A, Ph.D., selaku dosen pembimbing I, yang telah memberikan pengarahan, masukan, bimbingan, kritik dan saran selama penyelesaian tugas akhir.
4. Bapak Dr. Joni Agustian, S.T., M.Sc. dan Bapak Donny Lesmana, S.T., M.Sc., selaku Dosen Penguji yang telah memberikan saran dan kritik, juga selaku dosen atas semua ilmu yang telah penulis dapatkan. Serta seluruh Dosen Teknik Kimia Universitas Lampung, atas semua ilmu dan bekal masa depan yang akan selalu bermanfaat.
5. Papa L. Sianturi dan Mama M. br. Siahaan tercinta atas pengorbanan, doa, cinta dan kasih sayang yang selalu mengiringi disetiap langkahku. Abang-adikku Ricky Hotman Sianturi dan Evalina Anggia Merpa Sianturi atas doa dan semangatnya.
6. Arisanti Eva, selaku rekan seperjuangan dalam suka dan duka yang telah membantu penulis dalam penyelesaian laporan tugas akhir, akhirnya selesai! 7. Seluruh saudara/i di Teknik Kimia Unila angkatan 2008, terkhususnya senasib
seperjuangan Andani Diah, Lisa, Oky, Reo, Yuliana, Iffah, Raysa, Rizka, Fuzie. Terimakasih atas bantuan semangatnya selama penulis menyelesaikan tugas akhir ini.
8. Teman-teman Pondok Indah, terkhusus Novita Tarigan, Shari Putri, Cicilia Maligia, Jeniffer Togatorop atas keseharian yang menyenangkan dan tak terlupakan. Keluarga FKMK-FT terkhusus Tosty, Manuel, Merry, Nico dan Dita. Brother and Sister from another parents: Judika Sianturi, Ferwin Siburian, Nella Silalahi atas dukungan dan waktu yang diberikan untuk mendengarkan keluh kesah penulis.
Penulis berharap agar skripsi ini dapat diterima dan bermanfaat bagi perkembangan ilmu pengetahuan.
Bandar Lampung, April 2015 Penulis,
BAB I
PENDAHULUAN
A. Latar Belakang
Pada saat ini Indonesia sedang mengalami perkembangan di berbagai bidang industri. Salah satu industri yang banyak berkembang adalah industri bahan kimia. Namun ketergantungan impor luar negeri masih lebih besar dibandingkan ekspornya. Indonesia masih banyak mengimpor bahan baku atau produk industri kimia dari luar negeri. Salah satunya adalah isopropanolamin yang merupakan bahan intermediet yang terdiri dari Monoisopropalamin (MIPA), Diisopropalamin (DIPA), Triisopropalamin (TIPA) yang memiliki fungsi penting, baik sebagai bahan baku maupun sebagai bahan penunjang.
Isopropanolamin banyak digunakan untuk keperluan rumah tangga maupun kebutuhan industri, diantaranya :
1. Surfaktan
2
2. Reaksi antara isopropanolamin dengan asam lemak pada suhu kamar membentuk isopropanolamin soap yang banyak ditemukan didalam kosmetik, pelitur, tekstil, produk-produk untuk tanaman, pembersih,
metalworking fluid, dan farmasi.
3. Garam-garam dari isopropanolamin dan asam anorganik penting sebagai bahan kimia intermediet dan juga digunakan sebagai bahan pencegah/penghambat korosi, antistatic agent, pelapisan kaca,
electroplating, tinta, metalworking. 4. Refinery gas
5. Monoisopropalamin (MIPA) dan triisopropalamin (TIPA) banyak digunakan dalam pemurnian gas karena kemampuannya dalam menyerap CO2, H2S dan kandungan asam yang lain.
6. TIPA berkonsentrasi rendah digunakan sebagai bahan tambahan dalam klinker semen untuk meningkatkan efisiensi grinding mill.
(Othmer,1999)
3
isopropanolamin dari negara tetangga, sehingga pendirian pabrik isopropanolamin ini diharapkan mampu mengantisipasi permintaan dalam dan luar negeri. Sehubungan dengan hal-hal tersebut, maka sangat tepat apabila di Indonesia didirikan pabrik isopropanolamin dengan tujuan untuk memenuhi kebutuhan isopropanolamin dalam negeri, mengurangi ketergantungan impor dan membuka lapangan kerja baru untuk mengurangi jumlah pengangguran di Indonesia.
B. Kapasitas Perancangan
Analisis pasar dilakukan berdasarkan kebutuhan isopropanolamin yang diperoleh dari data nilai ekspor-impor isopropanolamin setiap tahun dari BPS (Badan Pusat Statistik) Indonesia.
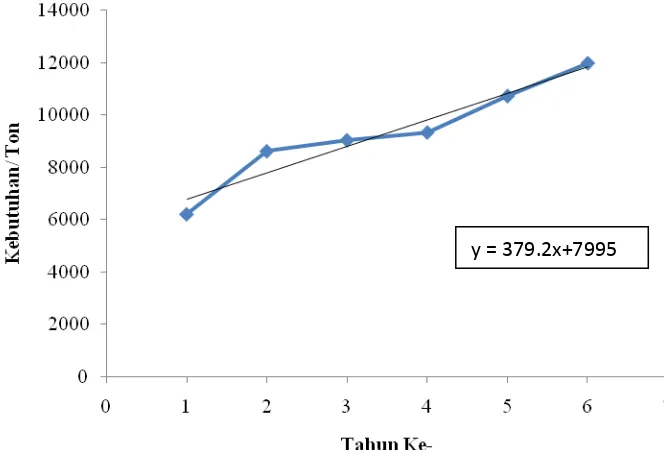
Tabel 1. Data kebutuhan isopropanolamin diIndonesia
No. Tahun Impor (ton) Ekspor (ton) Kebutuhan isopropanolamin(ton)
1 2008 6307,63 100,01 6.207,62
2 2009 10366,79 1745,63 8.621,16
3 2010 10854,16 1812,23 9041,93
4 2011 9519,58 178,94 9.340,64
5 2012 10938,86 206,18 10.732,68
6 2013 13549,19 1557,74 11.991,45
4
Gambar 1. Jumlah impor isopropanolamin di Indonesia setiap tahun
Persamaan garis hasil regresi linier yang diperoleh adalah sebagai berikut: y = 379,2x + 7.995 ……..(1) Pada tahun 2020 saat pembuatan pabrik isopropanolamin, diperkirakan impor sebanyak (ton/tahun) = 379,2 (13) + 7.995
= 12.924,6
Sehingga untuk mencukupi kebutuhan isopropanolamin di Indonesia pada tahun ke-13 yaitu tahun 2020 dengan kapasitas kebutuhan di Indonesia sebesar 13.000 ton/tahun. Maka pra rancangan pabrik isopropalamin berkapasitas 15.000 ton/tahun untuk memenuhi kebutuhan di Indonesia dan sisanya dapat diekspor.
5
C. Lokasi Pabrik
Untuk menentukan lokasi pendirian suatu pabrik, perlu diperhatikan beberapa pertimbangan yang menentukan keberhasilan dan kelangsungan kegiatan industri pabrik tersebut, baik produksi maupun distribusinya. Oleh karena itu pemilihan lokasi pabrik harus memiliki pertimbangan tentang biaya distribusi dan biaya produksi yang minimum agar pabrik dapat terus beroperasi dengan keuntungan yang maksimal. Faktor-faktor lain selain biaya yang perlu dipertimbangkan dalam menentukan lokasi pabrik adalah diantaranya adalah ketersediaan bahan baku,letak dan sarana transportasi, utilitas, tersedianya tenaga kerja dan karakterisasi lokasi. Berdasarkan pertimbangan di atas, maka lokasi pabrik isopropanolamin dipilih di daerah Palembang, Sumatera Selatan dengan pertimbangan sebagai berikut:
1. Penyediaan bahan baku
6
Dilihat dari segi bahan baku, maka pemilihan lokasi di daerah Palembang, Sumatera Selatan adalah tepat karena dekat dengan sumber bahan baku. 2. Letak dan Sarana Transportasi
Lokasi pabrik dekat dengan penghasil bahan baku isopropanolamin yaitu amoniak serta mudah dalam pengadaan bahan baku propilen oksida yang diimpor dari Singapura karena pabrik yang dirancang akan didirikan dekat dengan Sungai Musi yang merupakan salah satu jalur transportasi yaitu dengan jalan pengkapalan sehingga mempermudah pemasokan bahan baku dan pemasaran produk baik untuk dalam negeri maupun luar negeri (ekspor). Transportasi lewat darat juga dapat dilakukan dengan mudah. Telekomunikasi di Palembang cukup baik dan berjalan dengan lancar.. 3. Unit Pendukung (Utilitas)
Utilitas yang dibutuhkan adalah tenaga listrik, air dan udara. Kebutuhan tenaga listrik didapat dari generator pembangkit tenaga listrik yang dibangun sendiri. Air dapat diambil dari air Sungai Musi dan air tanah. Bahan bakar untuk generator dan boiler dapat diperoleh dari Pertamina sebagai pemasok bahan bakar solar.
4. Tenaga Kerja
7
5. Karakterisasi lokasi
37
BAB II
DESKRIPSI PROSES
A. Macam-macam Proses Pembuatan Isopropanolamin
Secara umum, isopropanolamin dapat diproduksi melalui beberapa proses, yaitu:
1. Proses aqueous
Prosedur aqueous phase merupakan proses pembuatan isopropanolamin yang ekonomis dan paling aman. Proses ini tanpa menggunakan katalis, namun menggunakan air yang cukup banyak. Reaksi dijalankan pada temperatur 32°C dan tekanan 1 atm dengan rasio mol amoniak : propilen oksida = 5 : 1. Reaksi yang terjadi adalah:
NH3(l) + C3H6O(l) → C3H9NO(l)
(Amoniak) (PO) (MIPA)
C3H9NO(l) + C3H6O(l) → C6H15NO2(l)
(MIPA) (PO) (DIPA)
C6H15NO2(l) + C3H6O(l) → C9H21NO3(l)
9
Konversi terhadap propilen oksida adalah sebesar 98,8%, dan distribusi produk yang dihasilkan yaitu monoisopropanolamin 49,3%, diisopropanolamin 45,5%, dan triisopropanolamin 5,2%.
(Huang et.al., 2001) 2. Proses anhydrous
Propilen oksida direaksikan dengan ammonia dalam fase cair dengan rasio molar 1:10 sampai 1:80 pada tekanan 40 atm sampai 200 atm dan pada temperatur antara 20°C sampai 250°C. Kondisi operasi yang disarankan dalam proses anhydrous ini adalah pada tekanan 110 atm dan temperatur 150°C, dengan rasio molar propilen oksida dan ammonia 1:40. Konversi propilen oksida sebesar 95%. amoniak dan propilen oksida dalam storage tank dipompa ke dalam mixer untuk dicampur, kemudian dipompa menuju
preheater untuk dipanaskan dari 35°C menjadi 75°C. Campuran ini kemudian diumpankan ke dalam reaktor yang berisi katalis cation exchange resin. Keluaran reaktor yang berisi campuran monoisopropanolamin, diisopropanolamin, triisopropanolamin, dan amoniak yang tidak bereaksi diumpankan ke dalam menara distilasi untuk dipisahkan.
10
B. Pemilihan Proses
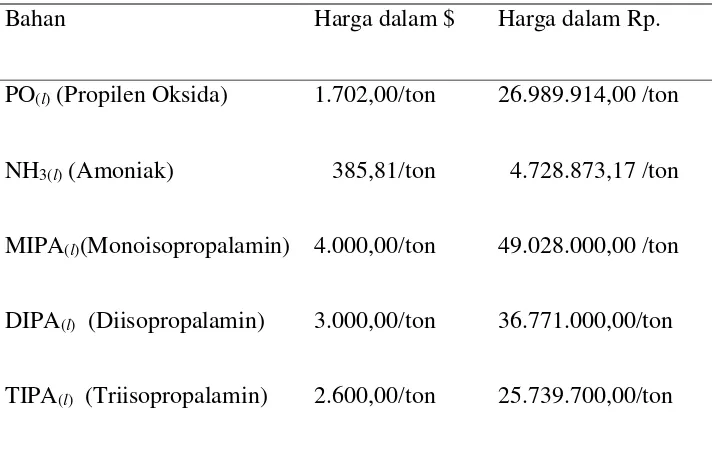
[image:32.595.159.515.166.392.2]1. Berdasarkan Tinjauan Ekonomi Tabel 2.1. Harga bahan baku dan produk
Bahan Harga dalam $ Harga dalam Rp.
PO(l)(Propilen Oksida) 1.702,00/ton 26.989.914,00 /ton
NH3(l) (Amoniak) 385,81/ton 4.728.873,17 /ton
MIPA(l)(Monoisopropalamin) 4.000,00/ton 49.028.000,00 /ton
DIPA(l) (Diisopropalamin) 3.000,00/ton 36.771.000,00/ton
TIPA(l) (Triisopropalamin) 2.600,00/ton 25.739.700,00/ton
a. Proses aqueous
Selektivitas:
- MIPA : 49,3 % - DIPA : 45,5 % - TIPA : 5,2 % Konversi PO : 98,8 %
Kapasitas produk : 15.000 ton Isopropanolamin tiap tahun.
Dengan reaksi I :
NH3 (l) + PO (l) → MIPA (l)
11
Sisa 1032161,8 117310,5 111402,4 Dengan reaksi II :
MIPA (l) + PO (l) → DIPA (l)
Mula 111402,4 117310,5 - Bereaksi 102815,6 102815,6 102815,6 Sisa 8586,8 14494,9 102815,6
Dengan reaksi III :
DIPA (l) + PO (l) → TIPA (l)
Mula 102815,6 14494,9 -
Bereaksi 11750,4 11750,4 11750,4 Sisa 91065,2 2744,6 11750,4
Untuk menghasilkan isopropanolamin 15.000 ton diperlukan 228712,8
kmol PO.
Menentukan NH3 masuk reaktor
A (NH3)umpan = 5 x (PO)umpan
A = 5 x 228712,8 kmol
A = 1143564,1 kmol
Bahan baku yang dibutuhkan:
12
Massa PO yang dibutuhkan untuk menghasilkan 15.000 ton isopropanolamin = 13.265.344 kg = 13.265,3 ton
Harga PO = 1.702,00 $ /ton x 13.265,3 ton = 22.577.615,5 $
Mol NH3 mula-mula = 1.143.564,1 kmol
Massa NH3 yang dibutuhkan untuk menghasilkan 15.000 ton
isopropanolamin = 19.440.590,32 kg = 19.440,590 ton Harga NH3 = 385,81 $/ ton x 19.440,590 ton
= 7.500.374 $
Jumlah harga bahan baku:
= (22.577.615,5 $ + 7.500.374 $)= 30.077.989,7 $
Massa produk MIPA
Mol MIPA = 8.586,8 kmol
Massa MIPA = 644.009,58 kg = 644,009 ton
Harga produk MIPA = 4.000 $/ ton x 644,009 ton = 2.576.038,3 $
Massa DIPA yang dihasilkan :
Mol DIPA = 91.065,2 kmol
Massa DIPA = 12.111.674 kg = 12.111,67 ton
Harga produk DIPA = 3.000 $/ ton x 12.111,67 ton = 36.335.021 $
Massa TIPA yang dihasilkan :
Mol TIPA = 11.750,4kmol
13
Harga produk TIPA = 2.600 $/ ton x 2.244,3 ton = 5.835.223,9 $
Jumlah harga produk:
= 2.576.038,3 $ + 36.335.021 $ + 5.835.223,9 $ = 44.746.283 $
Keuntungan per tahun = Harga Produk – Harga Reaktan
= 44.746.283 $ - 30.077.989,7 $
= 14.668.293 $
= Rp 181.270.766.374,79
b. Proses anhydrous
Selektivitas:
- MIPA : 95,6 % - DIPA : 4,3 % - TIPA : 0,1 % Konversi PO : 95%
Kapasitas produk : 15.000 ton MIPA tiap tahun
Mol MIPA = Massa MIPA kapasitas BM
Mol MIPA = . . kg= . kmol
Mol DIPA = ,, x . = . , kmol
14
Dengan reaksi I :
NH3 (l) + PO (l) → MIPA (l)
Mula A B -
Bereaksi 209.077,96 209.077,96 209.077,96 Sisa A-209.077,96 B-209.077,96 209.077,96
Dengan reaksi II :
MIPA (l) + PO (l) → DIPA (l)
Mula 209.077,96 B-209.077,96 -
Bereaksi 9.077,96 9.077,96 9.077,96 Sisa 200.000 B-218.155,93 9.077,96
Dengan reaksi III :
DIPA (l) + PO (l) → TIPA (l)
Mula 9.077,96 B-218.155,93 -
Bereaksi 82,15 82,15 82,15 Sisa 8.995,82 B-218.238,08 82,15
Menentukan Propilen Oksida
PO sisa reaksi = (100% - 95%) x PO umpan
B-218.238,08 = 0,05 x B
0,95b = 218.238,08
15
Menentukan NH3 masuk reaktor
A (NH3)umpan = 40 x (PO)umpan
A = 40 x 229.724,29 kmol
A = 9.188.971,68 kmol
Bahan baku yang dibutuhkan:
Mol PO = 229.724,29 kmol
Massa PO yang dibutuhkan untuk menghasilkan 200.000 kmol MIPA = mol PO x BM PO
= 229.724,29 kmol x 58 kg/kmol = 13.324.009 kg = 13.324 ton
Harga PO = 2.202,00 $ /ton x 13.324 ton = 29.339.448 $
Mol NH3 mula-mula = 8.431.480,84 kmol
Massa NH3 yang dibutuhkan untuk menghasilkan 200.000 kmol MIPA
= mol NH3 x BM NH3
= 9.188.971,68 kmol x 17 kg/kmol = 156.212.519 kg = 156.212,5 ton
Harga NH3 = 385,81 $/ ton x 156.212,5 ton
= 60.268.344,63 $
Jumlah harga bahan baku:
16
Massa produk MIPA = 15.000.000 kg = 15.000 ton
Harga produk MIPA = 4.000 $/ ton x 15.000 ton = 60.000.000 $
Massa DIPA yang dihasilkan :
Mol DIPA = 8.995,82 kmol
Massa DIPA = 8.995,82 kmol x 133 kg/kmol
= 1.196.444,06 kg = 1.196,44 ton
Harga produk DIPA = 3.000 $/ ton x 1.196,44 ton = 3.589.320 $
Massa TIPA = 82,15 kmol x 191 kg/kmol
= 15.690,65 kg = 15,69 ton
Harga produk TIPA = 2.100 $/ ton x 15,69 ton = 32.949 $
Jumlah harga produk:
= 60.000.000 $ + 3.589.320 $ + 32.949 $ = 63.622.269 $
Keuntungan per tahun = Harga Produk – Harga Reaktan
= 63.622.269 $ - 89.607.792,63 $
= - 25.985.523,63 $
17
2. Berdasarkan Tinjauan Termodinamika Panas reaksi (∆HR)
Tinjauan secara termodinamika ditujukan untuk mengetahui sifat reaksi (endotermis/eksotermis) dan reaksi berlangsung secara spontan atau tidak. Penentuan sifat reaksi eksotermis atau endotermis dapat ditentukan dengan perhitungan panas
pembentukan standar (H°f) pada P= 1 atm dan T = 298,15 K.
Pada proses pembentukan isopropanolamin terjadi reaksi sebagai berikut:
a. Proses aqueous
Reaksi 1 :
NH3 + PO MIPA
Harga ΔH°f masing-masing komponen pada suhu 298,15 K dapat
[image:39.595.144.335.527.626.2]dilihat pada Tabel 2.2. sebagai berikut :
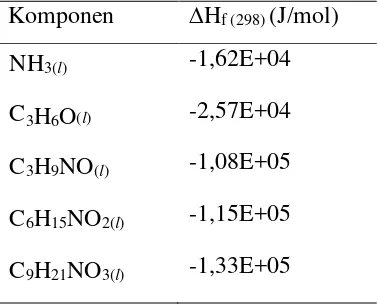
Tabel 2.2. Nilai ∆Hf (298) bahan baku dan produk
Komponen ∆Hf (298) (kJ/kmol)
NH3(l) -4,59E+01
C3H6O(l) -9,29E+01
C3H9NO(l) -2,39E+02
(Reid and Prauznitz, 1897)
∆HRx = ∆HR + ∆HRx(298)o + ∆Hp
... (2.6)
∆H = R ∑ ni ∫TT pR dT ... (2.7)
18
Δ pm
R = A + BTam+ Tam− T T + T T ... (2.9)
ΔHRo(298) = ΔHof produk - ΔHof reaktan ... (2.10)
∆HR= ∆H1+ ∆HRo+ ∆H2
Sehingga panas untuk masing - masing reaksi untuk suhu T, K dapat dihitung dengan persamaan:
Dari persamaan reaksi (2.1)
ΔHRo(298oK) = ΔHfo C3H9NO(l)- (ΔHfo C3H6O+ ΔHfo NH3)
= -2,39.102 – (-92,9+(-45,9))
= -1,00.102 kJ/kmol
∆H1 = ΔCpmh x Δt
Δ pm
R NH3= − , . + (3,36 x 301,5) + ((-1,44.10
-2/3) x
((4x301,52) -(298x330))) + (( 2,04.10-5) / (298x330))
Δ pm
R NH3= -4,77.10
2 kJ/kmol
ΔCpmh NH3 = -3,97.103 kJ/kmol K
∆H NH3 = -27.786,3 kJ/kmol
Δ pm
R C3H6O = 53,3 + (5,15.10
-1 x 301,5) + ((1,8.10-3/3) x
((4x301,52) -(298x330))) + ((2,78.10-6) / (298x330))
Δ pm
R C3H6O = 46,1 kJ/kmol
T = 330 K
ΔH1
T = 298 K
ΔHR°298
T = 298 K
ΔH2
19
ΔCpmh C3H6O = 3,84.102 kJ/kmol K
∆H C3H6O = 2.685,092 kJ/kmol
∆H1= ∆H NH3 +∆H C3H6O
∆H1= -27.786,3 kJ/kmol + 2.685,092 kJ/kmol
∆H1= -25101,2 kJ/kmol
∆H2 = ΔCpmh x Δt
Δ pm
R C3H9NO= 12 + (1,26 x 301,5) + ((-3,32. 10
-03/3) x (( 4 x 301,5 2) – (298 x 330)) + (3,39.10 -06)/ (298 x 330)
Δ pm
R C3H9NO =90,6 kJ/kmol
ΔCpmh C3H9NO = 7,53.102 kJ/kmol K
ΔH C H NO = -5.270,49 kJ/kmol
∆HR= ∆H1+ ∆HRo+ ∆H2
∆HR = -25101,2 kJ/kmol +(-1,00.102 kJ/kmol)+ (-5.270,49 kJ/kmol)
∆HR = -3,05.104 kJ/mol
Reaksi 2 :
MIPA + PO DIPA
Harga ΔH°f masing-masing komponen pada suhu 298,15 K dapat dilihat
20
Tabel 2.3. Harga ΔHof Masing-Masing Komponen
Komponen Harga ΔHof (J/mol)
PO -9,29E+01
MIPA -2,39E+02
DIPA -4,54E+02
Sehingga panas untuk masing - masing reaksi untuk suhu T, K dapat dihitung dengan persamaan:
Dari persamaan reaksi (2.1)
ΔHRo(298oK) = ΔHfo C6H15NO(l)- (ΔHfo C3H6O+ ΔHfo C3H9NO)
=-92,9 – (-2,39.102+(-4,54.102))
= -1,22.102 kJ/kmol
∆H1 = ΔCpmh x Δt
Δ pm
R C3H6O = -53,3 + (5,15.10
-1 x 301,5) + ((-1,8.10-3/3) x
((4x301,52) -(298x330))) + ((2,78.10-6) / (298x330))
Δ pm
R C3H6O = 44,9 kJ/kmol
ΔCpmh C3H6O = 3,73.102 kJ/kmol K
∆H C3H6O = 2.610,42 kJ/kmol
Δ pm
R C3H9NO= 12 + (1,26 x 301,5) + ((-3,32. 10
-03/3) x (( 4 x 301,5 2) – (298 x 330)) + (3,39.10 -06)/ (298 x 330)
Δ pm
21
ΔCpmh C3H9NO = 7,73102 kJ/kmol K
ΔH C H NO = 5.408,092kJ/kmol
∆H1= ∆H C3H6O + ∆H C3H9NO
∆H1= 2.610,42 kJ/kmol + 5.408,092kJ/kmol
∆H1= 8018,511 kJ/mol
∆H2 = ΔCpmh x Δt
Δ pm
R C6H15NO= -9,46 + (2,38 x 301,5) + ((-5,61. 10
-03/3) x (( 4 x
301,5 2) – (298 x 330)) + (5,07.10 -06)/ (298 x 330)
Δ pm
R C6H15NO = 197 kJ/kmol
ΔCpmh C6H15NO = 1,64.103 kJ/kmol K
ΔH C H NO = -11.487,4kJ/kmol
∆HR= ∆H1+ ∆HRo+ ∆H2
∆HR = 8018,511 kJ/mol +(-1,22.102 kJ/kmol)+( -11.487,4kJ/kmol)
∆HR = -3,59.103 kJ/mol
Reaksi 3 :
DIPA + PO TIPA
Harga ΔHo
f masing-masing komponen pada suhu 298,15 K dapat dilihat
22
Tabel 2.4. Harga ΔHof Masing-Masing Komponen
Komponen Harga ΔHof (J/mol)
PO -9,29E+01
DIPA -4,54+02
TIPA -6,64E+02
Sehingga panas untuk masing - masing reaksi untuk suhu T, K dapat dihitung dengan persamaan:
Dari persamaan reaksi (2.1)
ΔHRo(298oK) = ΔHfo C9H21NO3(l)-(ΔHfo C3H6O+ΔHfo C9H15NO2)
=-92,9 – (-4,54.102+(-6,64.102))
= -1,17.102 kJ/kmol
∆H1 = ΔCpmh x Δt
Δ pm
R C3H6O = 53,3 + (5,15.10
-1 x 301,5) + ((-1,8.10-3/3) x
((4x301,52) -(298x330))) + ((2,78.10-6) / (298x330))
Δ pm
R C3H6O = 44,9 kJ/kmol
ΔCpmh C3H6O = 3,73.102 kJ/kmol K
∆H C3H6O = 2.610,42 kJ/kmol
Δ pm
R C6H15NO= -9,46 + (2,38.10
-01 x 301,5) + ((-5,61. 10-3/3) x (( 4
x 301,5 2) – (298 x 330)) + (5,07.10 -06)/ (298 x 330)
Δ pm
R C6H15NO = 1,97.10
23
ΔCpmh C6H15NO = 1,64.103 kJ/kmol K
ΔH C H NO = 11487,37 kJ/kmol
∆H1= ∆H C3H6O + ∆H C6H15NO2
∆H1= 2.610,42 kJ/kmol + 11487,37 kJ/kmol
∆H1= 14097,79 kJ/mol
∆H2 = ΔCpmh x Δt
Δ pm
R C6H15NO2 = -30,9 + (3,49 x 301,5) + ((-7,9. 10
-3/3) x (( 4 x
301,5 2) – (298 x 330)) + (6,75.10 -06)/ (298 x 330)
Δ pm
R C9H21NO3 = 3,03.10
2 kJ/kmol
ΔCpmh C9H21NO3 = 2,52.103 kJ/kmol K
ΔH C H NO = -17656,6 kJ/kmol
∆HR= ∆H1+ ∆HRo+ ∆H2
∆HR = 14097,79 kJ/mol +(-1,17.102 kJ/kmol)+(-17656,6 kJ/kmol)
∆HR = 3,68.103 kJ/kmol
Karena harga ΔH298.15K negatif, maka reaksi bersifat eksotermis.
b. Proses anhydrous
Reaksi 1 :
NH3 + PO MIPA
Harga ΔH°f masing-masing komponen pada suhu 298,15 K dapat
24
Tabel 2.5. Nilai ∆Hf (298) bahan baku dan produk
Komponen ∆Hf (298) (J/mol)
NH3(l) -4,59E+04
C3H6O(l) -9,29E+04
C3H9NO(l) -2,39E+06
C6H15NO2(l) -4,54E+06
C9H21NO3(l) -6,64E+06
(Reid and Prauznitz, 1897)
∆HRx = ∆HR + ∆HRx(298)o + ∆Hp
... (2.6)
∆H = R ∑ ni ∫TT pR dT ... (2.7)
∆H = ΔCpmh x Δt ... (2.8)
Δ pm
R = A + BTam+ Tam− T T + T T ... (2.9)
ΔHRo(298) = ΔHof produk - ΔHof reaktan ... (2.10)
∆HR= ∆H1+ ∆HRo+ ∆H2
Sehingga panas untuk masing - masing reaksi untuk suhu T, K dapat dihitung dengan persamaan:
Dari persamaan reaksi (2.1)
T = 373K
ΔH1
T = 298 K
ΔHR°298
T = 298 K
ΔH2
25
ΔHRo(298oK) = ΔHfo C3H9NO(l)- (ΔHfo C3H6O+ ΔHfo NH3)
= -2,39E+06 – (-9,29E+04+(-4,59E+04))
= -100.350 J/kmol = -100,35 kJ/kmol
∆H1 = ΔCpmh x Δt
Δ pm
R NH3= , + (2,38.10
-2 x 335,5) + ((-1,71.10-5/3) x
((4x335,52) -(298x373))) + (( -1,19.10-8) / (298x373))
Δ pm
R NH3= 29,24 J/mol
ΔCpmh NH3 = 243,1 J/mol K
∆H NH3 = -1121297 J/mol = -1121,297 kJ/mol
Δ pm
R C3H6O = -8,46 + (3,26.10
-1 x 335,5) + ((1,71.10-5/3) x
((4x335,52) -(298x373))) + ((4,82.10-8) / (298x373))
Δ pm
R C3H6O =-30,83 J/mol
ΔCpmh C3H6O = -256,34J/mol K
∆H C3H6O = -93636,8 J/mol = -93,6368 kJ/mol
∆H1= ∆H NH3 +∆H C3H6O
∆H1= -1121,297 kJ/mol + -93,6368 kJ/mol
∆H1= -1214,9338 kJ/mol
∆H2 = ΔCpmh x Δt
Δ pm
R C3H9NO= -7,49 + (4,1.10
-01 x 335,5) + ((-2,83. 10-04/3) x (( 4 x
335,5 2) – (298 x 373)) + (8,35.10 -08)/ (298 x 373)
Δ pm
R C3H9NO = -47,16J/mol
26
ΔH C H NO = -58.812,5,96J/mol = -58,81 kJ/mol
∆HR= ∆H1+ ∆HRo+ ∆H2
∆HR = -1214,9338 kJ/mol+ (-100,35 kJ/kmol) + (-58,81 kJ/mol)
∆HR = -1374,09 kJ/mol
Reaksi 2 :
MIPA + PO DIPA
Harga ΔH°f masing-masing komponen pada suhu 298,15 K dapat dilihat
pada Tabel 2.3 sebagai berikut :
Sehingga panas untuk masing - masing reaksi untuk suhu T, K dapat dihitung dengan persamaan:
Dari persamaan reaksi (2.1)
ΔHRo(298oK) = ΔHfo C6H15NO2(l)- (ΔHfo C3H6O+ ΔHfo C3H9NO)
= -4,54E+06 – (-9,29E+04+(-2,39E+06))
= -122270 J/kmol = -122,27 kJ/kmol
∆H1 = ΔCpmh x Δt
Δ pm
R C3H6O = -8,46 + (3,26.10
-1 x 335,5) + ((1,71.10-5/3) x
((4x335,52) -(298x335,5))) + ((4,82.10-8) / (298x335,5))
Δ pm
R C3H6O =-30,83 J/mol
ΔCpmh C3H6O = -256,34J/mol K
27
Δ pm
R C3H9NO= --7,49 + (4,1.10
-01 x 335,5) + ((-2,83. 10-04/3) x (( 4
x 335,5 2) – (298 x 373)) + (8,35.10 -08)/ (298 x 373)
Δ pm
R C3H9NO = -39,25 J/mol
ΔCpmh C3H9NO = -326,36 J/mol K
ΔH C H NO = 225678 J/mol = 225,678 kJ/mol
∆H1= ∆H C3H6O + ∆H C3H9NO
∆H1= -93,6368 kJ/mol + 225,678 kJ/mol
∆H1= 132,0412 kJ/mol
∆H2 = ΔCpmh x Δt
Δ pm
R C6H15NO2= -18,4 + (7,16.10
-01 x 301,5) + ((-4,39. 10-04/3) x ((
4 x 371 2) – (298 x 448)) + (1,09.10 -07)/ (298 x 448)
Δ pm
R C6H15NO2 = -80,35 J/mol
ΔCpmh C6H15NO2 = -668,11 J/mol K
ΔH C H NO =-498853 J/mol = -498,853 kJ/mol
∆HR= ∆H1+ ∆HRo+ ∆H2
∆HR = 132,0412 kJ/mol + (-122,27 kJ/kmol) + (-498,853 kJ/mol)
∆HR = -489,0818 kJ/mol
Reaksi 3 :
28
Harga ΔH°f masing-masing komponen pada suhu 298,15 K dapat dilihat
pada Tabel 2.3 sebagai berikut :
Sehingga panas untuk masing - masing reaksi untuk suhu T, K dapat dihitung dengan persamaan:
Dari persamaan reaksi (2.1)
ΔHRo(298oK) =ΔHfo C9H21NO3(l)-(ΔHfo C3H6O+ ΔHfo C6H15NO2)
= -6,64E+06 – (-9,29E+04 +(-4,54E+06))
= -116534,3 J/kmol = -116,5343 kJ/kmol
∆H1 = ΔCpmh x Δt
Δ pm
R C3H6O = -8,46 + (3,26.10
-1 x 335,5) + ((1,71.10-5/3) x
((4x335,52) -(298x335,5))) + ((4,82.10-8) / (298x335,5))
Δ pm
R C3H6O =-30,83 J/mol
ΔCpmh C3H6O = -256,34J/mol K
∆H C3H6O = -93636,8 J/mol = -93,6368 kJ/mol
Δ pm
R C6H15NO2= -18,4 + (7,16.10
-01 x 335,5) + ((-4,39. 10-04/3) x ((
4 x 335,5 2) – (298 x 373)) + (1,09.10 -07)/ (298 x 373)
Δ pm
R C6H15NO2 = -68,07 J/mol
ΔCpmh C6H15NO2 =-565,95 J/mol K
ΔH C H NO = -401000 J/mol = -401 kJ/mol
∆H1= ∆H C3H6O + ∆H C6H15NO2
∆H1= -93,6368 kJ/mol + -401 kJ/mol
29
∆H2 = ΔCpmh x Δt
Δ pm
R C9H21NO3= -8,457 + (0,33 x 335,5) + ((-1,98. 10
-04/3) x (( 4 x
335,52) – (298 x 448)) + (9,81.10 -08)/ (298 x 448)
Δ pm
R C6H15NO2 = -65,49 J/mol
ΔCpmh C6H15NO2 = -544,54 J/mol K
ΔH C H NO =-1410000 J/mol = -1410 kJ/mol
∆HR= ∆H1+ ∆HRo+ ∆H2
∆HR = -494,6368 kJ/mol + (-116,5343 kJ/kmol) + (-1410 kJ/mol)
∆HR = -2021,17 kJ/mol
Karena harga ∆HR negatif, maka reaksi bersifat eksotermis.
Energi Bebas Gibbs (∆G)
Perhitungan energi bebas gibbs (∆G) digunakan untuk meramalkan arah reaksi kimia cenderung spontan atau tidak. ΔGo bernilai positif (+)
menunjukkan bahwa reaksi tersebut tidak dapat berlangsung secara spontan, sehingga dibutuhkan energi tambahan dari luar yang cukup besar. Sedangkan ΔGo bernilai negatif (-) menunjukkan bahwa reaksi tersebut
dapat berlangsung secara spontan dan tidak membutuhkan energi.
ΔGo (298oK) = ΔGo produk - ΔGo reaktan ... (2.10)
ΔG = ΔH –TΔS ... (2.11)
30
[image:52.595.186.375.143.296.2]a. Proses aqueous
Tabel 2.6. Nilai ∆Gf (298) bahan baku dan produk
Komponen ∆Hf (298) (J/mol)
NH3(l) -1,62E+04
C3H6O(l) -2,57E+04
C3H9NO(l) -1,08E+05
C6H15NO2(l) -1,15E+05
C9H21NO3(l) -1,33E+05
(Reid and Prauznitz, 1897)
Reaksi 1 :
NH3 + PO MIPA
ΔGo (298oK) = (ΔGo C
3H9NO(l) ) - (ΔGo NH3(l) + (ΔGo C3H6O(l))
= (-1,08E+05) – ((-1,62E+04) + (-2,57E+04)) = -6,61E+4 J/mol = -66,1 kJ/kmol
ΔG = − − , x (− + , ) + , +
= − , kJ/kmol
Reaksi 2 :
MIPA + PO DIPA
ΔGo (298oK) =(ΔGoC
6H15NO2(l))-(ΔGoC3H9NO(l)+ (ΔGo C3H6O(l))
= (-1,15E+05) – ((-1,08E+05) + (-2,57E+04)) = -1,73E+5 J/mol = -173 kJ/kmol
31
= − , kJ/kmol
Reaksi 3 :
DIPA + PO TIPA
ΔGo (298oK) =(ΔGoC
9H21NO3(l))-(ΔGoC6H15NO2(l)+ΔGo C3H6O(l))
= (-1,33E+05) – ((-1,15E+05) + (-2,57E+04)) = -9,18E+4 J/mol = -918 kJ/kmol
ΔG = − − , x ( +− + − , + , )
= − , kJ/kmol
b. Proses anhydrous
Reaksi 1 :
NH3 + PO MIPA
ΔGo (298oK) = (ΔGo C
3H9NO(l) ) - (ΔGo NH3(l) + (ΔGo C3H6O(l))
= (-1,08E+05) – ((-1,62E+04) + (-2,57E+04)) = -6,61E+4 J/mol = -66,1 kJ/kmol
ΔG = − , − x (− , + , ) + − , — ,
= − , kJ/kmol
Reaksi 2 :
DIPA + PO TIPA
ΔGo (298oK) =(ΔGoC
6H15NO2(l))-(ΔGoC3H9NO(l)+ (ΔGo C3H6O(l))
32
ΔG = − , − x (− , + ) + − , — ,
= − , kJ/kmol
Reaksi 3 :
DIPA + PO TIPA
ΔGo (298oK) =(ΔGoC
9H21NO3(l))-(ΔGoC6H15NO2(l)+ΔGo C3H6O(l))
= (-1,33E+05) – ((-1,15E+05) + (-2,57E+04)) = -9,18E+4 J/mol = -918 kJ/kmol
ΔG = − , − x ( − , +− + − , — , )
[image:54.595.124.515.77.832.2]= − , kJ/kmol
Tabel 2.7. Perbandingan Proses
Proses
Proses aqueous
(Proses I)
Proses anhydrous
(Proses II)
Langkah proses
Pembuatan isopropalamin membutuhkan bahan baku amoniak dan propilen oksida dengan rasio mol 5:1dan menggunakan air sebagai katalis.
Pembuatan isopropalamin membutuhkan bahan baku amoniak dan propilen oksida dengan rasio mol 40:1 dan menggunakan katalis
Kondisi Operasi
P = 1,3 atm T = 32 °C
P = 80 atm T = 140 °C
Konversi 98,8% 95%
33
(∆HR) DIPA: -6,51. 104 kJ/kmol
TIPA: -1,94. 105 kJ/kmol
DIPA: -489,0818 kJ/kmol TIPA: -2021,17 kJ/mol
Energi Bebas Gibbs (∆G)
MIPA: -40.981,26 kJ/kmol DIPA: -21.526,99 kJ/kmol TIPA: -7.905,72 kJ/kmol
MIPA: -794,125 kJ/kmol DIPA: -2190,759 kJ/kmol TIPA: -918 kJ/kmol
Keuntungan Rp 181.270.766.374,79
Mengalami kerugian karena membutuhkan ammonia yang banyak yang menyebabkan biaya bahan baku lebih besar dari produknya
Dari Tabel 2.7. dapat dilihat bahwa proses pembuatan isopropanolamin dengan metode aqueous phase adalah proses yang paling baik untuk dipilih. Kelebihan proses ini adalah:
1. Konversi terhadap Propilen Oksida tinggi.
2. Kondisi operasi sangat menguntungkan jika ditinjau dari segi keamanan dan perancangan alat. Reaktor bekerja pada suhu dan tekanan yang mudah dicapai.
3. Biaya investasi dan biaya operasi rendah.
C. Uraian Proses
34
1. Tahap penyimpanan bahan baku 2. Tahap penyiapan bahan baku 3. Tahap pembentukan produk 4. Tahap pemurnian produk
1. Tahap penyimpanan bahan baku
Bahan baku isopropanolamin yaitu amoniak dan propilen oksida disimpan dalam fasa gas dan fasa cair.
2. Tahap penyiapan bahan baku
Amoniak dari tangki penyimpanan (ST-101) diumpankan ke mix point
(MP-101) untuk dicampur dengan air dan hasil recycle yang berasal dari
split point dan menara distilasi pertama. Kemudian keluaran mix point 1 didinginkan dalam cooler 101 (CO-101) hingga suhu 32oC sebelum diumpankan ke reaktor (RE-201). Propilen oksida dari ST-102 langsung diumpankan ke dalam reaktor untuk direaksikan dengan amoniak.
3. Tahap pembentukan produk
Di dalam reaktor terjadi reaksi yang bersifat eksotermis dan irreversible
sebagai berikut :
NH3(l) + C3H6O(l) C3H9NO(l) (MIPA)
C3H9NO(l) + C3H6O(l) C6H15NO2(l) (DIPA)
C6H15NO2(l) + C3H6O(l) C9H21NO3(l) (TIPA)
35
Karena reaksi bersifat eksotermis maka untuk mempertahankan kondisi operasi diperlukan pendingin.
4. Tahap pemurnian produk
36
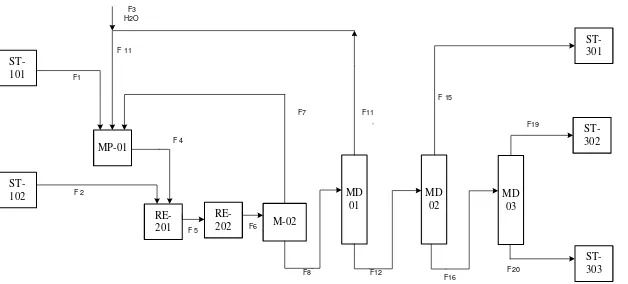
37 ST-302 ST-303 MP-01 RE-201 M-02 MD 01 MD 02 F1 F 11 F7 F 4 F 2 F 5 F8 F11 F3 H2O F12 F 15 F20 ST-101 ST-102
BAB III
SPESIFIKASI BAHAN BAKU DAN PRODUK
A. Spesifikasi Bahan Baku 1. Amoniak
Rumus Molekul : NH3
Wujud : Gas
Berat Molekul : 17.03 g/gmol
Titik Leleh : -77.76 oC
Titik Didih (1 atm) : -33.35 oC
(Perry, 1997)
Temperatur Kritis : 132 °C
Spesific gravity : 0.639
Batas eksplosif di udara : 16 - 25 % vol (650 ˚C)
Batas eksplosif di oksigen : 15 - 79 % vol (650 ˚C)
(Othmer, 1999) 2. Propilen Oksida
Rumus Molekul : C3H6O
Wujud : cair
Berat Molekul : 58.08 g/gmol
Specific gravity : 0.829
(Perry, 1997)
39
Titik lebur (1 atm) : -111.93 oC
Temperatur kritis : 209.1 oC
(Othmer, 1999)
3. Air
Rumus Molekul : H2O
Wujud : cair
Berat Molekul : 18.02 g/gmol
Titik didih (1 atm) : 100 oC
Titik lebur (1 atm) : 0 oC
Temperatur kritis : 374 oC
(Perry, 1997)
B. Spesifikasi Produk
1. Monoisopropanolamin
Rumus Molekul : C3H9NO
Wujud : cair
Warna : tidak berwarna
Berat Molekul : 75 g/gmol
Specific gravity : 0,96
Titik Leleh : 2 °C
Titik Didih (1 atm) : 159 °C
Temperatur Kritis : 337 °C
40
2. Diisopropanolamin
Rumus Molekul : C6H15NO2
Wujud : cair
Warna : tidak berwarna
Berat Molekul : 133 g/gmol
Specific gravity : 0,992
Titik Leleh : 28 °C
Titik Didih (1 atm) : 249 °C
Temperatur Kritis : 393 °C
(Perry, 1997) 3. Triisopropanolamin
Rumus Molekul : C9H21NO3
Wujud : cair
Warna : tidak berwarna
Berat Molekul : 191 g/gmol
Specific gravity : 0,998
Titik Leleh : 29 °C
Titik Didih (1 atm) : 306 °C
Temperatur Kritis : 468 °C
DAFTAR PUSTAKA
Anonim, 1972, Continuous Process for preparing Monoalkanolamine from Ammonia and Alkylene Oxide, United States Patent, USA
Anonim, 2013, equipment Cost, www.matche.com (Accessed 18 Januari 2015) Aries, R.S., Newton, R.D., 1955, Chemical Engineering Cost Estimation,
McGraw-Hill Book Company, New York
BASF Company, 2005, BASF’s New Isopropanolamine Plant Started Up, www.basf.com (Accessed 16 April 2014)
Brown.G.George., 1950, Unit Operation 6ed, Wiley&Sons, USA.
Brownell, L.E., Young, E.H., 1959, Process Equipment Design Vessel Design, Michigan
Coulson, J.M., and Richardson, J.F., 1989, An Introduction to Chemical Engineering, Allyn and Bacon Inc., Massachusets
Evans, F.L., 1980, “Equipment Design Handbook”, Vol. 1, 2nd ed., Gulf Publishing
Co., Houston.
Fogler.A.H.Scott, 1999, Elements of Chemical Reaction Engineering, Prentice Hall International Inc, New Jersey.
Geankoplis, C.J., 2003, Transport Processes and Unit Operations, 4nd ed.,
Prentice-Hall International, Tokyo
Himmeblau.David., 1996, Basic Principles and Calculation in Chemical Engineering, Prentice Hall Inc, New Jersey.
Huang, et.al., 2001, Reaction Kinetics of Isopropanolamine Preparation in Ammonia System, Journal of Nanjing University of Technology, Nanjing
Kirk, R.E., Othmer, V.R., 1999, Encyclopedia of Chemical Technology, John Wiley & Sons Inc., New York
Ludwig, E.E., 1965, Applied Process Design for Chemical and Petrochemical Plants, volume 1, Gulf Publishing Company, Houston
Megyesy.E.F., 1983, Pressure Vessel Handbook, Pressure Vessel Handbook Publishing Inc, USA.
Nanjing Hongbaoli Co.Ltd, 2007, Products and Services, www.hongbaoli.com (Accessed 16 March 2014)
Perry, R.H., Green, D., 1997, Perry’s Chemical Engineers’ Handbook, 7th ed.,
McGraw Hill Companies Inc., USA.
Peters, M.S., Timmerhaus, K.D., West, R.E., 2003, Plant Design and Economics for Chemical Engineers, 5th ed., Mc-Graw Hill, New York.
Powell, S.T., 1954, Water Conditioning for Industry, 1st ed., McGraw-Hill Book
Company, Inc., New York.
PT. Pupuk Sriwidjaja Palembang, 2010, Publikasi Berita, www.pusri .co.id (Accessed 16 May 2014)
Rase, H.F., Holmes, J.R., 1977, Chemical Reactor Design for Process Plant, vol 2 : Principles and Techniques, John Wiley & Sons Inc., Kanada
Smith, J.M., Van Ness, H.C., Abbott, M.M., 2001, Introduction to Chemical Engineering Thermodynamics, 6th ed, McGraw-Hill Book Company, Inc.,
New York.
Ullmann’s, 1999, Encyclopedia of Industrial Chemistry, vol.A11, VCH
Verlagsgesellschaft, Weinheim
Ullrich, G.D., 1984, A Guide to Chemical Engineering Process Design and Economics, John Wiley & Sons, New York.
Vilbrandt, F.C., Dryden, C.E., 1959, Chemical Engineering Plant Design, 4th ed., McGraw-Hill Book Company, Japan
Walas, S.M., 1988, Chemical Process Equipment, 3rd ed., Butterworths series in chemical engineering, USA