DELIGNIFIKASI SEKAM PADI OLEH JAMUR PELAPUK
PUTIH UNTUK PRODUKSI BIOETANOL DENGAN TEKNIK
AMOBILISASI SEL
Zymomonas mobilis
LAITA NURJANNAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis yang berjudul “Delignifikasi
Sekam Padi oleh Jamur Pelapuk Putih untuk Produksi Bioetanol dengan Teknik Amobilisasi Sel Zymomonas mobilis” adalah karya saya dengan arahan dari
komisi pembimbing dan belum pernah dipublikasikan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Maret 2014
Laita Nurjannah
RINGKASAN
LAITA NURJANNAH. Delignifikasi Sekam Padi oleh Jamur Pelapuk Putih untuk Produksi Bioetanol dengan Teknik Amobilisasi Sel Zymomonas mobilis.
Dibimbing oleh I MADE ARTIKA dan SURYANI.
Sekam padi mengandung 33.71% karbohidrat kasar (lignoselulosa), bahan ini banyak tersedia di bumi untuk produksi biofuels dan produk bernilai lainnya. Limbah sekam padi tersusun atas polimer karbohidrat, selulosa dan hemiselulosa, dan polimer aromatik, lignin. Salah satu metode untuk delignifikasi sekam padi adalah dengan menggunakan jamur pelapuk putih. Jamur pelapuk putih yang digunakan pada penelitian ini adalah Trametes versicolor dan Phanerochaete chrysosporium. Tujuan penelitian ini adalah delignifikasi sekam padi dengan menggunakan jamur pelapuk putih dan pemanfaatan sekam padi tersebut sebagai sumber karbon untuk produksi bioetanol oleh Z. mobilis. Metode yang digunakan adalah persiapan biomassa dan mikroba, uji kandungan kimia sekam padi, uji enzim ligninase, delignifikasi sekam padi oleh Trametes versicolor, dan produksi bioetanol.
Hasil penelitian menunjukkan bahwa jamur T. versicolor dan P. chrysosporium memiliki enzim ligninase. Kadar lignin yang terdapat pada total biomassa sekam padi sebesar 23.61%, setelah delignifikasi menggunakan jamur T. versicolor menjadi 16.20%. Pengurangan lignin yang terjadi sebesar 7.41% dari total biomassa sekam padi (waktu inkubasi 20 hari). Jika dihitung berdasarkan total lignin, persentase pengurangan lignin sebesar 31.38%. Proses delignifikasi pun menyebabkan penurunan kadar holoselulosa, selulosa, dan zat ekstraktif, serta kenaikan kadar hemiselulosa. Jamur T. versicolor dapat mendegradasi lignin sekam padi dengan baik pada suhu ruang dan waktu inkubasi 20 hari. Kadar etanol yang dihasilkan selama 5 hari fermentasi tanpa teknik amobilisasi sel
Zymomonas mobilis pada jam ke-0, 24, 48, 72, 96, dan 120, berturut-turut sebesar 0, 1.62 g/L, 4.12 g/L, 5.19 g/L, 13.3 g/L, dan 18.39 g/L dengan peningkatan kadar etanol yang cukup tinggi dari hari ke hari. Hasil fermentasi selama 5 hari dengan teknik amobilisasi sel Z. mobilis pada jam ke-0, 24, 48, 72, 96, dan 120, berturut-turut sebesar 0, 5.51 g/L, 11.14 g/L, 21.47 g/L, 21.85 g/L, dan 24.18 g/L. Produksi bioetanol dengan menggunakan teknik amobilisasi sel bakteri Z. mobilis
menghasilkan etanol yang lebih tinggi dengan rata-rata peningkatan sebesar 8.3% dibandingkan dengan produksi bioetanol tanpa amobilisasi sel bakteri Z. mobilis.
SUMMARY
LAITA NURJANNAH. Delignification of Rice Husks by White-rot Fungi for Bioethanol Production by Zymomonas mobilis Cells Immobilization Technique. Under the direction of I MADE ARTIKA and SURYANI.
Rice husks contains 33.71% of lignocelluloses the most abundantly available raw material on the earth for the production of biofuels and other valuable products. It is composed of carbohydrate polymers, cellulose and hemicellulose, and an aromatic polymer, lignin. One of the methods for removing the lignin component of rice husks is by delignification using white-rot fungi. The white-rot fungi used were Trametes versicolor and Phanerochaete chrysosporium. The aim of the study was to carry out delignification of rice husks using white-rot-fungi and to use rice husks as carbon source for bioethanol production by Z. mobilis. The study was consisted of biomass and microbial preparation, chemical assay of rice husks, ligninase enzyme test, delignification process of rice husks by Trametes versicolor, and production of bioethanol.
Results showed that T. versicolor and P. chrysosporium have ligninase enzyme. The precentage of lignin from the total biomass rice husk was 23.61%, and following delignification process by T. versicolor for 20 days, the remaining lignin was 16.20% making the percentage of rice husk lignin reduced by 7.41%. If the reduction was calculated based on the total lignin, the percent lignin reduction was 31.38% w/w. The biodelignification process also decreased percentage of holocellullose, cellulose, and extractive substance, and accordingly increased the percentage of hemicellulose. Based on the ability of T. versicolor to degrade lignin of the rice husk at room temperature (28ºC) as mentioned above, it can be concluded that T. versicolor has potential to be used for delignification process. Production of ethanol by fermentation for 5 days without cell immobilization technique Zymomonas mobilis with sampling at 0, 24, 48, 72, 96, and 120 hours, the results were 0, 1.62 g/L, 4.12 g/L, 5.19 g/L, 13.3 g/L, and 18.39 g/L. The concentration of bioethanol increased day by day. Fermentation for 5 days with Z. mobilis cell immobilization technique with sampling at 0, 24, 48, 72, 96, and 120 hours, the results were 0, 5.51 g/L, 11.14 g/L, 21.47 g/L, 21.85 g/L, and 24.18 g/L. Production of bioethanol using immobilized Z. mobilis cells was higher (averages 8.3%) than the production of bioethanol non-immobilized Z. mobilis
cells.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biokimia
DELIGNIFIKASI SEKAM PADI OLEH JAMUR PELAPUK
PUTIH UNTUK PRODUKSI BIOETANOL DENGAN TEKNIK
AMOBILISASI SEL
Zymomonas mobilis
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Delignifikasi Sekam Padi oleh Jamur Pelapuk Putih untuk Produksi Bioetanol dengan Teknik Amobilisasi Sel Zymomonas mobilis
Nama : Laita Nurjannah
NIM : G851120131
Disetujui oleh Komisi Pembimbing
Dr.Ir. I Made Artika, M.App.Sc Ketua
Dr. Suryani, SP, M.Sc. Anggota
Diketahui oleh
Ketua Program Studi Biokimia
Prof. Dr.drh. Maria Bintang, MS.
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, MSc.Agr
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas segala rahmat, berkah, dan karunia-Nya sehingga penulis dapat menyelesaikan penyusunan tesis ini. Shalawat serta salam semoga tercurah kepada Nabi Muhammad SAW, keluarga, sahabat, dan para pengikutnya hingga akhir zaman. Tesis ini berjudul Delignifikasi Sekam Padi oleh Jamur Pelapuk Putih untuk Produksi Bioetanol dengan Teknik Amobilisasi Sel Zymomonas mobilis. Kegiatan penelitian yang merupakan salah satu syarat memperoleh gelar Magister Sains pada Departemen Biokimia ini dilakukan dari bulan September 2013 hingga Februari 2014 bertempat di Laboratorium Departemen Biokimia, FMIPA Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada Dr.Ir. I Made Artika, M.App.Sc dan Dr. Suryani, SP, M.Sc sebagai dosen pembimbing utama serta pembimbing kedua yang banyak memberi bimbingan dan arahan kepada penulis dalam penyusunan tesis ini. Tak lupa penulis sampaikan juga terima kasih kepada seluruh warga Biokimia IPB, ayah, ibu, dan seluruh keluarga yang senantiasa memberi dukungan serta doa. Semoga hasil penelitian ini dapat memberi manfaat bagi kemajuan ilmu pengetahuan khususnya bidang biokimia.
Bogor, Maret 2014
DAFTAR ISI
Delignifikasi Sekam Padi oleh Trametes versicolor 10
Produksi Bioetanol 11
4 HASIL DAN PEMBAHASAN 12
Aktivitas Ligninase T. versicolor dan P.chrysosporium secara Kualitatif 12 Delignifikasi Sekam Padi oleh Trametes versicolor 15
DAFTAR TABEL
1 Komposisi kimia sekam padi 3
2 Kandungan kimia sekam padi sebelum dan sesudah delignifikasi 16
DAFTAR GAMBAR
1 Profil jamur pelapuk putih 5 2 Profil bakteri dan kapang untuk fermentasi 7
3 Kultur jamur pelapuk putih 13
4 Aktivitas ligninase secara kualitatif 14
5 Kondisi delignifikasi sekam padi oleh jamur T. versicolor 15 6 Kandungan kimia sekam padi sebelum dan sesudah delignifikasi 16 7 Kadar etanol pada fermentasi tanpa amobilisasi sel dan amobilisasi sel
Zymomonas mobilis 19
8 Kadar gula pereduksi pada fermentasi tanpa amobilisasi sel dan
amobilisasi sel Zymomonas mobilis 20
9 Perbandingan kadar gula pereduksi dan kadar etanol pada fermentasi
tanpa amobilisasi sel Zymomonas mobilis 20
10 Perbandingan kadar gula pereduksi dan kadar etanol pada fermentasi
dengan amobilisasi sel Zymomonas mobilis 21
DAFTAR LAMPIRAN
1 Bagan alir penelitian 26
2 Kromatogram standar etanol 27
3 Kromatogram kadar etanol sekam padi tanpa amobilisasi sel
Zymomonas mobilis pada jam ke-24 27
4 Kromatogram kadar etanol sekam padi tanpa amobilisasi sel
Zymomonas mobilis pada jam ke-48 28
5 Kromatogram kadar etanol sekam padi tanpa amobilisasi sel
Zymomonas mobilis pada jam ke-72 28
6 Kromatogram kadar etanol sekam padi tanpa amobilisasi sel
Zymomonas mobilis pada jam ke-96 29
7 Kromatogram kadar etanol sekam padi tanpa amobilisasi sel
Zymomonas mobilis pada jam ke-120 29
8 Kromatogram kadar etanol sekam padi dengan amobilisasi sel
Zymomonas mobilis pada jam ke-24 30
9 Kromatogram kadar etanol sekam padi dengan amobilisasi sel
Zymomonas mobilis pada jam ke-48 30
10 Kromatogram kadar etanol sekam padi dengan amobilisasi sel
Zymomonas mobilis pada jam ke-72 31
11 Kromatogram kadar etanol sekam padi dengan amobilisasi sel
Zymomonas mobilis pada jam ke-96 31
12 Kromatogram kadar etanol sekam padi dengan amobilisasi sel
1
PENDAHULUAN
Latar Belakang
Limbah sering diartikan sebagai bahan yang tidak berguna. Pertanian merupakan salah satu sektor yang banyak menghasilkan limbah diantaranya adalah sekam padi. Peningkatan jumlah limbah akan menimbulkan masalah bagi lingkungan. Oleh karena itu, perlu adanya alternatif pemanfaatan sekam padi agar lebih bermanfaat.
Pemanfaatan sekam padi untuk energi masih sedikit dikembangkan oleh para peneliti. Biomassa sekam padi dapat digunakan sebagai sumber bahan bakar alternatif pengganti minyak bumi yang cocok dikembangkan di Indonesia. Indonesia memiliki sekam padi yang sangat melimpah mengingat Indonesia merupakan negara agraris. Limbah sekam padi, biasanya diperoleh sekitar 20–30 % dari bobot gabah, hasil lainnya dedak antara 8–12%. Menurut BPS (2013), Jawa Barat memproduksi padi sebesar 12.009.422 ton.
Penelitian untuk mengembangkan sumber energi alternatif diharapkan dapat mengurangi ketergantungan terhadap minyak bumi. Pemanfaatan biomassa sekam padi sebagai bahan bakar misalnya bioetanol dapat menjadi salah satu alternatif yang baik untuk dikembangkan. Hal ini juga akan berdampak pada penghasilan para petani, dengan adanya pemanfaatan sekam padi ini diharapkan pendapatan para petani akan meningkat. Pendapatan tidak hanya didapatkan dari padi, namun bisa juga dari sekam padinya.
Pemanfaatan biomassa sekam padi ini dilakukan menggunakan metode delignifikasi mengingat sekam padi banyak mengandung lignin. Metode yang dilakukan dengan menggunakan mikroba (biodelignifikasi). Mikroba yang digunakan untuk delignifikasi sekam padi adalah jamur pelapuk putih. Biodelignifikasi merupakan proses degradasi lignin untuk membebaskan serat dari ikatannya dengan menggunakan enzim dari mikroba seperti fungi dan bakteri. Metode ini dilakukan karena delignifikasi secara kimia memiliki beberapa kelemahan diantaranya kebutuhan bahan kimia, energi yang tinggi, dan limbah cair dari delignifikasi yang menggunakan bahan kimia tergolong limbah yang berbahaya karena bersifat toksik dan mencemari lingkungan (Martina et al. 2002). Jamur pelapuk putih yang digunakan pada penelitian ini adalah Trametes versicolor dan Phanerochaete chrysosporium. Jamur-jamur ini berperan dalam menguraikan bahan yang mengandung lignoselulosa. Menurut Balai Penelitian Pascapanen Pertanian (BPPP) tahun 2001, sekam padi mengandung 33.71% karbohidrat kasar. Oleh karena itu, sekam padi dapat dijadikan sumber karbon untuk pembuatan bioetanol.
Produksi bioetanol dapat dilakukan dengan menggunakan metode amobilisasi sel. Menurut Amekan (2011), amobilisasi sel dapat dilakukan pada
2
Z. mobilis dapat memproduksi etanol dari glukosa, akan tetapi sumber karbon dari sekam padi berupa selulosa sehingga diperlukan enzim selulase, maka pada penelitian ini digunakan kapang Trichoderma viride sebagai penghasil enzim selulase untuk menghidrolisis selulosa menjadi glukosa.
Penelitian ini bertujuan untuk delignifikasi sekam padi dengan jamur pelapuk putih sehingga dapat dimanfaatkan sebagai sumber karbon untuk produksi bioetanol. Bioetanol diharapkan dapat menjadi salah satu solusi untuk mengurangi ketergantungan terhadap bahan bakar minyak bumi. Selain itu, pemanfaatan limbah sekam padi pun dapat dikembangkan terus agar lingkungan terbebas dari limbah (zerowaste).
Perumusan Masalah
Pemanfaatan limbah sekam padi masih kurang dilakukan, selain itu limbah ini dapat mengotori lingkungan. Delignifikasi sekam padi dengan jamur pelapuk putih dapat menjadikan sekam padi sebagai sumber karbon untuk produksi bioetanol, pemanfaatan tersebut diharapkan dapat menjadi solusi alternatif untuk mengurangi limbah dan ketergantungan terhadap bahan bakar minyak bumi.
Tujuan Penelitian
Penelitian ini bertujuan :
1. Delignifikasi sekam padi dengan menggunakan jamur pelapuk putih 2. Produksi bioetanol dengan teknik amobilisasi sel Z. mobilis
Manfaat Penelitian
Manfaat dari penelitian ini adalah limbah sekam padi dapat didelignifikasi oleh jamur pelapuk putih dan hasilnya dapat digunakan sebagai bahan dasar pembuatan bioetanol dengan bantuan bakteri Z. mobilis.
2
TINJAUAN PUSTAKA
Sekam Padi
Sekam padi merupakan kulit buah padi berupa lapisan keras yang meliputi
kariopsis, terdiri dari dua belahan yang disebut lemma dan palea yang saling bertautan. Saat proses penggilingan, sekam padi akan terpisah dari butir beras dan menjadi bahan sisa atau limbah penggilingan. Sekam padi dikategorikan sebagai biomassa yang dapat digunakan untuk berbagai kebutuhan seperti bahan baku industri, pakan ternak, dan energi atau bahan bakar. Sekam padi yang diperoleh dari proses penggilingan padi sekitar 20-30% dari bobot gabah. Di Indonesia, jumlah sekam dapat mencapai 13.2 juta ton per tahun (Deptan 2011).
3 baku pada industri bahan bangunan, dan campuran pada industri bata merah. Bahan ini juga bisa digunakan sebagai sumber energi panas, kadar selulosa yang tinggi dapat memberikan pembakaran yang merata dan stabil (BPPP 2001).
Tabel 1 Komposisi kimia sekam padi
Limbah pertanian seperti jerami, bonggol jagung, dan kulit kacang- kacangan merupakan limbah lignoselulosa yang masih mempunyai nilai ekonomis bila dilakukan pengolahan lebih lanjut. Bahan lignoselulosa dapat diperoleh dari residu hasil pertanian, fraksi besar municipal solid waste (MSW), pupuk kandang, dan residu hasil hutan. Sejalan dengan perkembangan bioteknologi, pemanfaatan mikroba dalam proses biokonversi limbah berbahan lignoselulosa dapat dilakukan guna mendapatkan nilai tambah dari bahan limbah tersebut menjadi produk lain seperti pupuk, bioetanol, pakan ternak, dan sebagainya. Bioetanol dapat digunakan untuk mengganti bahan bakar bensin untuk keperluan transportasi. Dalam proses penggunaan bahan lignoselulosa sebagai sumber karbon, harus melalui beberapa tahapan antara lain delignifikasi untuk melepas selulosa dan hemiselulosa dari ikatan kompleks lignin dan depolimerisasi untuk mendapatkan gula bebas (Anindyawati 2010). Konversi bahan lignoselulosa menjadi etanol pun pada dasarnya terdiri atas tiga tahap, yaitu perlakuan pendahuluan, sakarifikasi, dan fermentasi. Perolehan fuel-grade ethanol dilakukan dengan pemurnian yang terdiri atas destilasi dan dehidrasi.
Beberapa faktor yang mendorong semakin banyaknya penelitian pemanfaatan bahan lignoselulosa untuk produksi bioetanol antara lain kebutuhan dan konsumsi energi terus meningkat dari tahun ke tahun, sementara sumber daya alam tersebut masih berasal dari sumber daya alam yang tidak terbarukan, seperti minyak, gas, dan batu bara. Selain itu, bioetanol memiliki karakteristik yang lebih baik dibandingkan dengan bensin karena dapat meningkatkan efisiensi pembakaran dan mengurangi emisi gas rumah kaca (Hambali et al. 2007). Penggunaan bahan lignoselulosa pun lebih menarik dibandingkan dengan bahan berpati karena tidak bersaing dalam penggunaan untuk kepentingan pangan (Singhania 2009).
4
bercabang–cabang dan mempunyai struktur tiga dimensi yang terbuat dari fenil propanoid yang saling terhubung dengan ikatan yang bervariasi. Lignin membentuk matriks yang mengelilingi selulosa dan hemiselulosa, penyedia kekuatan pohon, dan pelindung dari biodegradasi. Selulosa merupakan polimer linier glukan dengan struktur rantai yang seragam. Unit-unit glukosa terikat dengan ikatan glikosidik -β–(1→4). Hemiselulosa merupakan istilah umum bagi polisakarida yang larut dalam alkali. Hemiselulosa sangat dekat asosiasinya dengan selulosa dalam dinding sel tanaman (Howard et al. 2003).
Delignifikasi oleh Jamur Pelapuk Putih
Delignifikasi adalah degradasi lignin pada lignoselulosa sehingga dapat dijadikan sumber karbon untuk biofuel. Perlakuan pendahuluan atau delignifikasi merupakan tahapan yang banyak menghabiskan biaya. Biodelignifikasi adalah degradasi lignin dengan menggunakan makhluk hidup. Degradasi lignin adalah langkah yang sangat penting dalam siklus karbon (Cohen 2001), yang dimediasi oleh enzim oksidatif.
Jamur pelapuk putih (JPP) yang hidup pada bahan organik lignoselulosa mengeluarkan enzim ekstraselular yang bisa mendegradasi bahan tersebut sebagai nutrisinya, terutama lignin, sehingga disebut enzim ligninolitik. Sistem degradasi lignin pada jamur pelapuk putih melibatkan kerja enzim ekstraseluler yang diproduksi sendiri oleh jamur tersebut. Ada tiga jenis enzim ekstraseluler yang diproduksi oleh jamur pelapuk putih yang bersifat tidak selektif namun efektif dalam menyerang lignin. Enzim-enzim tersebut ialah lignin peroksidase (LiP), mangan peroksidase (MnP), dan lakase (Lac) (Howard et al. 2003) dikenal sebagai lignin modifying enzymes (LMEs). Jamur pelapuk putih tidak bisa menggunakan lignin sebagai sumber energinya, sehingga proses degradasi tersebut diduga sebagai suatu cara agar selulosa yang terdapat di dinding sel dapat diakses oleh JPP.
Jamur pelapuk putih kelas Basidiomycetes merupakan jamur yang efektif mendegradasi lignin. Jamur yang termasuk dalam jenis Basidiomycetes yang umum digunakan untuk mendegradasi lignin antara lain Omphalina sp., Marasmus sp., Phanerochaete chrysosporium, Trametes versicolor, dan lain-lain (Lobos et al.2001; Sun dan Cheng 2002; Siswanto et al. 2007). Jamur pelapuk kayu ini biasanya tidak hanya membentuk koloni pada sampah hasil hutan dan pohon-pohon yang tumbang, tetapi juga pada pohon yang masih hidup (Eriksson
et al. 1990 dalam Lankinen 2004). Jamur pelapuk kayu sendiri dibagi menjadi jamur pelapuk putih, jamur pelapuk coklat dan jamur pendekomposisi sampah (Steffen 2003). Menurut Anita et al. 2011, jamur Trametes versicolor lebih cepat mensekresi enzim ligninase dibandingkan dengan jamur Phanerochaete chrysosporium. Hal tersebut dilihat dari warna merah yang terbentuk pada media di hari pertama inkubasi.Warna merah tersebut merupakan indikator mulai dihasilkannya enzim lakase dan peroksidase oleh jamur pelapuk putih (Thorn 1996; Akhtar et al. 1997).
5 selulosa dan hemiselulosa yang tidak terlalu berpengaruh. Akibatnya, terjadi penurunan kekuatan fisik kayu dan pembengkakan jaringan kayu.
JPP merupakan satu-satunya organisme yang mampu mendegradasi lignin secara sempurna menjadi CO2 dan H2O (Bukcley dan Dobson 1998). Keunikan
dan kemampuannya mendegradasi lignin sangat selektif sehingga relatif tidak merusak serat selulosanya (Srebotnik dan Messner 1994). Penurunan berat dapat dijadikan parameter infeksi JPP pada suatu bahan. Hal ini disebabkan lignin dan hemiselulosa terdegradasi oleh JPP menjadi suatu polimer sederhana atau monomer. Degradasi akan menyebabkan penurunan kadar lignin dan selulosa sehingga terjadi penurunan berat bahan secara langsung. Semakin tinggi tingkat kerusakan oleh JPP maka penurunan berat akan semakin besar. Selain penurunan dapat terjadi perubahan warna akibat degradasi pigmen (zat ekstraktif) oleh jamur JPP mengakibatkan perubahan warna menjadi putih (Warlinda 2006). Kemampuan lignolitik beberapa jenis jamur terutama JPP digunakan untuk mendegradasi lignin tanpa mengurangi kadar karbohidrat seperti pada proses bio-pulping, bio-bleaching, dan pemanfaatan residu hutan serta komponen lignoselulitik lain sebagai pakan ternak. Di alam, JPP berperan sebagai organisme saprofit yang berperan penting dalam siklus karbon (Boddy dan Rayner 1988). Jamur T. versicolor dan P. chrysosporium dapat dilihat pada Gambar 1.
(A) (B)
Gambar 1 Profil jamur pelapuk putih. (A) Trametes versicolor (Chris Hiscoke (UK)), (B) Phanerochaete chrysosporium (Thom Volk)
Amobilisasi Sel
6
aliran tinggi memungkinkan memperoleh produktivitas volumetris yang tinggi, menguntungkan kondisi lingkungan mikro yaitu kontak antar sel, gradien produk nutrisi, gradien pH untuk sel, memberikan hasil yang lebih baik sebagai biokatalis (perolehan dan laju yang tinggi), memperbaiki stabilitas genetik (pada beberapa kasus tertentu), dan melindungi sel dari kerusakan akibat pergeseran (Shuler dan Kargi 1992). Keuntungan lain teknik amobilisasi adalah 1) memungkinkan untuk dilakukannya reaksi enzim beberapa tahap, 2) aktivitas enzim yang tinggi, 3) stabilitas operasional secara umum tinggi, 4) tidak diperlukan tahap ekstraksi/pemurnian enzim, 5) biomassa yang diamobilisasi dapat digunakan untuk konsentrasi substrat yang lebih tinggi dan dapat dilakukan pemisahan sel dengan mudah serta umur sel dapat diperpanjang (Suhardi 2000).
Teknik amobilisasi dibedakan menjadi dua yaitu amobilisasi aktif dan amobilisasi pasif. Amobilisasi aktif adalah penjebakan (entrapment) atau pengikatan (binding) oleh gaya fisika atau kimia. Penjebakan secara fisika dapat menggunakan berbagai macam bahan seperti bahan berpori (agar, alginat, karagenan, poliakrilamid, kitosan, gelatin, kolagen), saringan dari logam berpori, poliuretan, gel silika, polistiren, dan selulosa triasetat. Sedangkan amobilisasi pasif menggunakan metode pelekatan (attachment) dalam bentuk biofilm, yaitu lapisan-lapisan pertumbuhan sel pada permukaan media pendukung. Media ini bisa bersifat inert maupun aktif secara biologis (Shuler dan Kargi 1992).
Amobilisasi sel mikroba telah banyak digunakan dalam industri fermentasi. Keuntungan dari teknologi amobilisasi sel ini adalah penggunaan yang berkelanjutan, stimulasi produksi metabolit, dan perlindungan sel terhadap lingkungan yang tidak menguntungkan. Amobilisasi sel ini mengarah pada peningkatan kepadatan sel secara optimal dan efisiensi proses. Potensi penggunaan sel amobil pada industri susu fermentasi telah diuji secara luas (Denkova 2005).
Produksi Etanol oleh Mikroba
Secara umum sintesis bioetanol yang berasal dari biomassa terdiri atas dua tahap utama, yaitu hidrolisis dan fermentasi. Pada metode terdahulu proses hidrolisis dan fermentasi dilakukan secara terpisah. Fermentasi yang terbaru adalah sakarifikasi dan fermentasi simultan (Surya 2010).
Hidrolisis dan fermentasi akan menjadi lebih efektif dan efisien jika dilaksanakan secara berkelanjutan tanpa melalui tenggang waktu yang lama, proses ini dikenal sebagai proses sakarifikasi dan fermentasi simultan (SFS). Sakarifikasi dan fermentasi simultan adalah kombinasi antara hidrolisis dengan enzim dan fermentasi yang dilakukan dalam suatu reaktor. Proses ini memiliki keuntungan yaitu polisakarida yang terkonversi menjadi monosakarida tidak kembali menjadi polisakarida karena monosakarida langsung difermentasi menjadi etanol (Samsuri et al.2007).
bermacam-7 macam, termasuk enzim selulase dan kitinase. Kapang umumnya memiliki selulase karena habitatnya pada bahan-bahan organik yang mengandung selulosa. Selulase terdiri dari komponen endo-β-1,4-glukanase, ekso-β-1,4-glukanase dan
β-1,4 glukosidase (selobiase). Kapang Trichoderma viride menghasilkan ketiga jenis enzim selulase tersebut (Crueger dan Crueger 1982).
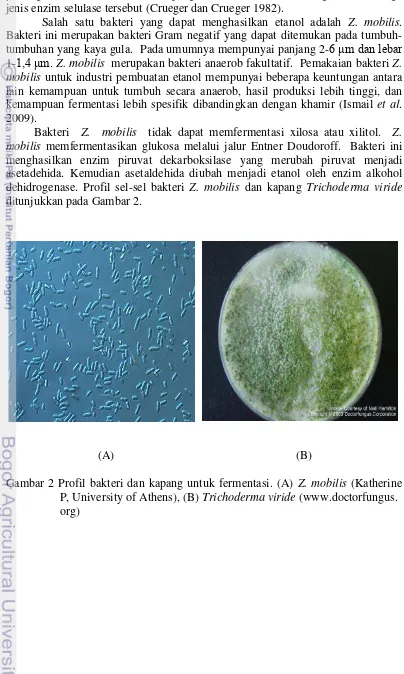
Salah satu bakteri yang dapat menghasilkan etanol adalah Z. mobilis. Bakteri ini merupakan bakteri Gram negatif yang dapat ditemukan pada tumbuh-tumbuhan yang kaya gula. Pada umumnya mempunyai panjang 2-6 μm dan lebar 1-1,4 μm. Z. mobilis merupakan bakteri anaerob fakultatif. Pemakaian bakteri Z. mobilis untuk industri pembuatan etanol mempunyai beberapa keuntungan antara lain kemampuan untuk tumbuh secara anaerob, hasil produksi lebih tinggi, dan kemampuan fermentasi lebih spesifik dibandingkan dengan khamir (Ismail et al. 2009).
Bakteri Z. mobilis tidak dapat memfermentasi xilosa atau xilitol. Z. mobilis memfermentasikan glukosa melalui jalur Entner Doudoroff. Bakteri ini menghasilkan enzim piruvat dekarboksilase yang merubah piruvat menjadi asetadehida. Kemudian asetaldehida diubah menjadi etanol oleh enzim alkohol dehidrogenase. Profil sel-sel bakteri Z. mobilis dan kapang Trichoderma viride
ditunjukkan pada Gambar 2.
(A) (B)
8
3
BAHAN METODE
Waktu dan Tempat
Penelitian ini dilakukan selama 6 bulan (September 2013-Februari 2014). Tempat pelaksanaannya di Laboratorium Biokimia, Departemen Biokimia, Institut Pertanian Bogor. Uji kadar etanol dengan kromatografi gas dilakukan di BB Biogen (Balai Besar Litbang Bioteknologi dan Sumber Daya Genetik Pertanian). Uji kimia sekam padi dilakukan di Laboratorium Kimia Hasil Hutan, Fakultas Kehutanan IPB.
Bahan
Bahan yang digunakan dalam penelitian ini adalah biomassa limbah pertanian yaitu sekam padi (padi varietas Ciherang). Mikroba yang digunakan adalah Trametes versicolor dan Phanerochaete chrysosporium. Bahan-bahan lain yang digunakan antara lain media potato dextrose agar (PDA), media potato dextrose broth (PDB), media nutrient agar (NA), media nutrient broth (NB), 1.0% pyrogallol, 0.4% H2O2, reagent 0.1 M 1-naphthol, etanol 96%, benzena,
akuades, larutan asam sulfat 72%, sodium klorit, asam asetat glasial, NaOH, asam nitrat, Na2SO3, asam asetat 10%, asam 3.5 dinitrosalisilat, CH3COOH, H2SO4,
Na-algnat, dan CaCl2.
Alat
Alat-alat yang digunakan dalam penelitian ini terdiri atas cawan Petri, tabung reaksi, labu Erlenmeyer, autoklaf, lempeng penangas, pengaduk magnetik, jarum ose, laminar air flow, oven, mesin penggiling, saringan 80 mesh, soxhlet, corong Buchner, jidal (Thimble), filter gelas, penangas air, pengaduk, pipet, lemari pendingin, dan kromatografi gas.
Metode
Persiapan Biomassa dan Mikroba
Biomassa sekam padi digiling dan disaring sehingga diperoleh ukuran 80 mesh. Pada uji pendahuluan (uji enzim ligninase) untuk optimasi mikroba pendelignifikasi digunakan white-rot fungi yaitu Trametes versicolor dan
Phanerochaete chrysosporium. Berdasarkan hasil optimasi lalu dipilih mikroba terbaik untuk proses delignifikasi. Kultur mikroba ditumbuhkan pada media PDA dan diinkubasi pada suhu ruang selama 5-7 hari. Mikroba yang digunakan untuk fermentasi simultan bioetanol adalah Trichoderma viride dan Zymomonas mobilis. Kultur tersebut disimpan pada suhu 4°C.
Uji Kandungan Kimia Sekam Padi
Uji yang dilakukan meliputi zat ekstraktif, uji kadar lignin, uji kadar holoselulosa, uji kadar hemiselulosa, dan uji kadar selulosa.
9 dengan etanol-benzena 1:2 selama 6 jam. Setelah itu, sekam dipindahkan ke dalam corong buchner, pelarut dihilangkan dengan vakum, thimble dicuci dengan etanol untuk menghilangkan benzena. Sekam dipindahkan ke dalam thimble, lalu diekstraksi dilakukan dengan etanol 95% selama 4 jam. Sekam dipindahkan ke dalam corong buchner, pelarut dihilangkan dengan vakum, thimble dicuci dengan air destilata untuk menghilangkan etanol. Selanjutnya sekam dipindahkan ke dalam gelas piala 1000 mL dan ditambahkan 500 mL air panas. Serbuk sekam dikeringkan di udara dan disimpan dalam wadah tertutup (BSN 1989).
Zat ekstraktif = bobot awal- bobot kering sampel (g) x 100% bobot kering sampel (g)
Klason Lignin. Pengukuran ini berdasarkan SNI nomor 0492. Sebanyak 1 gram sampel sekam dimasukkan ke dalam gelas piala. Lalu ditambahkan larutan asam sulfat 72% sebanyak 15 mL. Penambahan asam dilakukan secara perlahan dan bertahap sambil diaduk dengan suhu dijaga pada 20ºC. Setelah tercampur sempurna, gelas piala disimpan pada suhu 20ºC selama 2 jam sambil diaduk sesekali. Air sebanyak 300-400 mL ditambahkan ke dalam labu Erlenmeyer 1000 mL, sampel dipindahkan ke dalam labu Erlenmeyer. Sampel dilarutkan dengan air hingga mencapai konsentrasi 3% dengan total volume 575 mL. Sampel dididihkan selama 4 jam, volume sampel dijaga dengan menambahkan air panas. Lignin disaring dengan filter gelas dan dicuci dengan air panas hingga bebas asam. Sampel dikeringkan dalam oven pada suhu 105ºC hingga bobotnya konstan, didinginkan, dan ditimbang (BSN 2008).
Lignin = bobot lignin (g) x 100% bobot kering sampel (g)
Holoselulosa. Sebanyak 2 gram sampel sekam dimasukkan ke dalam labu Erlenmenyer 250 mL. Kemudian ditambahkan 80 mL air destilata, 1 gram sodium klorit, dan 0.5 mL asam asetat glasial. Setelah itu dipanaskan pada penangas air dengan suhu 70ºC. Permukaan air dalam penangas air dijaga agar tidak lebih tinggi dari larutan di dalam labu Erlenmeyer. Lalu, ditambahkan 1 gram sodium klorit dan 0.5 mL asam asetat setiap interval pemanasan selama 1 jam, penambahan dilakukan sebanyak 4 kali. Sampel disaring dengan menggunakan filter gelasdan dicuci dengan air panas. Sampel ditambahkan 25 mL asam asetat 10%, lalu dicuci dengan air panas hingga bebas asam. Sampel di oven pada suhu 105ºC hingga beratnya konstan dan ditimbang (Browning 1967).
Holoselulosa = bobot holoselulosa (g) x 100% bobot kering sampel (g)
10
pelan. Setelah itu, setiap interval waktu 5 menit, ditambahkan 5 mL larutan NaOH 17.5%. Penambahan ini dilakukan sebanyak 3 kali sehingga volume total NaOH 17.5% sebanyak 25 mL. Saat penambahan terakhir, sampel dibiarkan selama 30 menit sehingga total waktu perlakuan selama 45 menit. Kemudian ditambahkan 33 mL air destilata, diaduk, dan dibiarkan selama 1 jam pada suhu 20ºC. Sampel disaring dengan cawan saring lalu dibilas dengan 100 mL NaOH 8.3%. Pembilasan dilanjutkan dengan air destilata hingga semua sampel terpindahkan ke dalam cawan saring. Setelah itu pembilasan dilanjutkan dengan 250 mL air destilata. Sampel dikeringkan pada suhu 105ºC selama 24 jam. Kemudian didinginkan dalam desikator dan ditimbang bobotnya hingga konstan (BSN 2009).
Alfa selulosa = bobot alfa selulosa (g) x 100% bobot kering sampel (g)
Selulosa. Sebanyak 2 gram sampel dimasukkan ke dalam labu Erlenmeyer 300 mL, ditambahkan 125 mL larutan asam nitrat 3.5% dan dipanaskan dalam
waterbath selama 12 jam pada suhu 80ºC. Lalu sampel disaring dengan air destilata hingga tidak berwarna, lalu dikeringkan di udara. Sampel dimasukkan ke dalam labu Erlenmeyer, lalu ditambahkan 125 mL larutan campuran NaOH dan Na2SO3 dan dipanaskan selama 2 jam pada suhu 50ºC. Sampel disaring dengan
cawan saring dan dibilas dengan air destilata hingga filtrat tidak berwarna. Kemudian ditambahkan 50 mL larutan sodium klorit 10% dan dicuci dengan air hingga diperoleh endapan berwarna putih. Lalu ditambahkan 100 mL asam asetat 10% dan dicuci hingga bebas asam. Sampel dikeringkan ke dalam oven pada suhu 105ºC dan ditimbang hingga bobotnya tetap (Cross dan Bevan 1912).
Selulosa = bobot selulosa (g) x 100% bobot kering sampel (g)
Uji Enzim Ligninase
Untuk menguji adanya enzim-enzim pendegradasi lignin (ligninase) meliputi lignin peroksidase dan lakase, dilakukan tes totol dengan meneteskan larutan 1.0% pirogalol yang telah dicampur dengan 0.4% H2O2 (komposisi 1:1)
pada bagian tepi kultur jamur pelapuk putih yang diuji (yang masih aktif tumbuh). Kultur diamati tiga jam, 24 jam, dan 72 jam setelah penetesan. Warna kuning kecoklatan pada bagian yang ditetesi reagen pirogalol tersebut menunjukkan adanya aktivitas enzim lignin peroksidase (Agustini et al. 2011).
Enzim lakase dideteksi dengan menggunakan reagen 0.1 M 1-naftol yang dilarutkan dalam etanol 96%. Cara dan waktu pengamatan dilakukan seperti uji lignin peroksidase di atas. Warna merah keungu-unguan pada bagian yang ditetesi reagen 0.1 M 1-naftol menjadi indikator positif adanya enzim lakase yang disintesis oleh jamur pelapuk putih pada kultur tersebut (Stalpers 1978).
Delignifikasi Sekam Padi oleh Trametes versicolor
11 menunjukkan pertumbuhan yang sangat baik saat uji enzim ligninase. Sebanyak 240 gram sekam padi direndam dalam akuades selama 24 jam, kemudian disterilisasi dengan menggunakan autoklaf 121ºC selama 15 menit. Setelah itu, diinokulasikan dengan suspensi jamur Trametes versicolor sebanyak 100 ml. Suspensi jamur sebelumnya ditumbuhkan pada media PDB yang sebelumnya diinkubasi selama 7 hari. Biomassa tersebut lalu diinkubasi dalam suhu ruang selama 20 hari. Kemudian, dilakukan analisis terhadap zat ekstraktif, kadar lignin, holoselulosa, hemiselulosa, dan selulosa (modifikasi Akhtar et al. 1997).
Produksi Bioetanol
Sekam padi yang telah mengalami delignifikasi dengan jamur pelapuk putih, digunakan untuk fermentasi bioetanol. Mikroba yang digunakan untuk fermentasi bioetanol adalah Trichoderma viride dan Zymomonas mobilis.
Peremajaan Trichoderma viride dilakukan pada media PDA dengan suhu ruang selama 5-7 hari. Peremajaan Zymomonas mobilis dilakukan pada media NA dengan suhu ruang selama 24-48 jam.
Amobilisasi sel. Amobilisasi ini hanya dilakukan pada bakteri Zymomonas mobilis. Sebelum melakukan amobilisasi sel bakteri ini, maka konsentrasi alginat optimum ditentukan terlebih dahulu dengan menggunakan variasi natrium alginat steril 1%, 2%, 3%, dan 4%. Butiran gel yang terbentuk paling baik digunakan untuk amobilisasi sel. Sel ditambahkan ke dalam natrium alginat steril. Butiran gel yang dibuat dengan meneteskan suspensi sel dalam natrium alginat dengan
syringe ke dalam 50 mL larutan CaCl2 0.2 M steril sambil diaduk dengan
pengaduk bermagnet dengan kecepatan 100 rpm. Butiran gel yang sudah terbentuk dibiarkan selama 2 jam dalam larutan CaCl2 0.2 M pada suhu 4ºC
supaya gel yang terbentuk lebih mengeras. Selanjutnya butiran gel disaring dengan kertas saring steril kemudian dipindahkan ke dalam labu Erlenmeyer steril untuk dicuci dengan akuades steril sebanyak 3 kali. Pencucian dengan akuades steril bertujuan untuk menghilangkan larutan kalsium klorida yang masih menempel pada butiran gel dan sel yang tidak terjebak oleh natrium alginat (Becerra et al. modifikasi 2001).
Fermentasi Bioetanol. Sekam hasil biodelignifikasi (10 gram) dimasukkan ke dalam media fermentasi (100 mL) dengan komposisi (NH4)2HPO4 1 g/L,
MgSO4.7H2O 0.05 g/L, dan yeast extract 2 g/L dengan pH media 5 (Ito et al.
2003). Setelah itu ditambahkan 5% isolat Trichoderma viride dan 10% inokulum cair Zymomonas mobilis (v/v) yang telah diamobilisasi dengan Ca-alginat yang sudah dioptimasi dari tahapan sebelumnya. Inkubasi selama 5 hari pada suhu 30ºC. Setiap 0, 24, 48, 72, 96, 120 jam dilakukan pengambilan sampel, kemudian dianalisis kadar gula pereduksi dan kadar etanol (Ito et al. 2003). Fermentasi bioetanol tanpa amobilisasi sel juga dilakukan sebagai pembanding. Metode analisis hasil fermentasi sebagai berikut:
12
dan 0.056% Kemudian nilai gula pereduksi dicari dengan metode DNS. Hasil yang didapatkan diplotkan dalam grafik secara linier. Metode analisisnya, sebanyak 1 mL sampel dimasukkan ke dalam tabung reaksi dan ditambah 3 mL pereaksi DNS, dipanaskan dalam air mendidih selama 5 menit, kemudian didinginkan sampai suhu kamar. Lalu sampel diukur pada panjang gelombang 550 nm (Miller 1959).
b. Kadar etanol
Pengukuran kadar etanol yang dihasilkan dari sel amobil Z. mobilis dan tanpa diamobil dilakukan menggunakan GC (Gas Chromatography). Kolom yang digunakan adalah kolom OV-17. Gas pembawa adalah nitrogen. Laju alir 20-50 ml/menit dengan detektor FID (Flame Ionization Detector). Penentuan dilakukan dengan membandingkan waktu retensi sampel dengan waktu retensi standar etanol. Standar etanol yang diinjeksikan dengan konsentrasi 1% (v/v).
Kadar etanol = luas area sampel x [standard] luas area standar
4
HASIL DAN PEMBAHASAN
Aktivitas Ligninase T. versicolor dan P.chrysosporium secara Kualitatif
Berdasarkan aktivitas ligninase jamur Trametes versicolor dan
Phanerochaete chrysosporium secara kualitatif dapat dilihat jamur yang terbaik untuk proses delignifikasi sekam padi. Selain itu, pertumbuhan jamur pun diamati untuk melengkapi pemilihan jamur pada tahap delignifikasi. Hal ini dilakukan agar delignifikasi dilakukan oleh jamur terbaik sehingga bisa menghasilkan penurunan lignin yang tinggi.
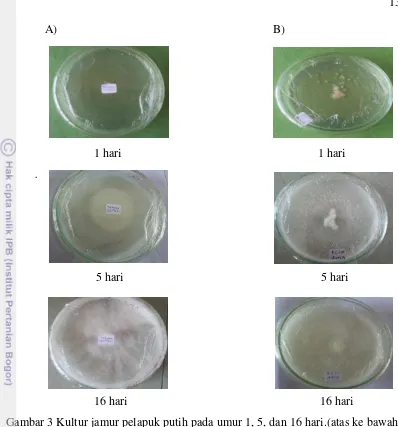
Jamur T. versicolor dan P. chrysosporium ditumbuhkan pada media PDA pada suhu ruang (28ºC). Isolat dengan pertumbuhan yang baik digunakan untuk uji selanjutnya. Kultur jamur tersebut dapat dilihat pada Gambar 3. Hasil menunjukkan bahwa jamur T. versicolor dan P. chrysosporium tumbuh dengan baik di media PDA pada suhu ruang (28ºC). Kedua jamur ini akan digunakan untuk uji enzim ligninase.
Berdasarkan pengamatan selama 16 hari, pertumbuhan T. versicolor lebih lambat daripada pertumbuhan P. chrysosporium. Pada hari pertama, jamur T. versicolor belum memperlihatkan adanya pertumbuhan, namun P. chrysosporium
sudah memiliki tanda pertumbuhan. Pada hari kelima pun hifa P. chrysosporium
sudah hampir menutupi sebagian permukaan cawan Petri, sedangkan hifa T. versicolor tumbuh membentuk bulatan di tengah cawan Petri. Pada hari ke-16 pertumbuhan hifa kedua jamur sudah menutupi seluruh permukaan cawan Petri. Hifa T. versicolor terlihat lebih tebal daripada hifa P. chrysosporium.
13 A) B)
1 hari 1 hari
.
5 hari 5 hari
16 hari 16 hari
Gambar 3 Kultur jamur pelapuk putih pada umur 1, 5, dan 16 hari.(atas ke bawah). (A) T. versicolor. (B) P. chrysosporium.
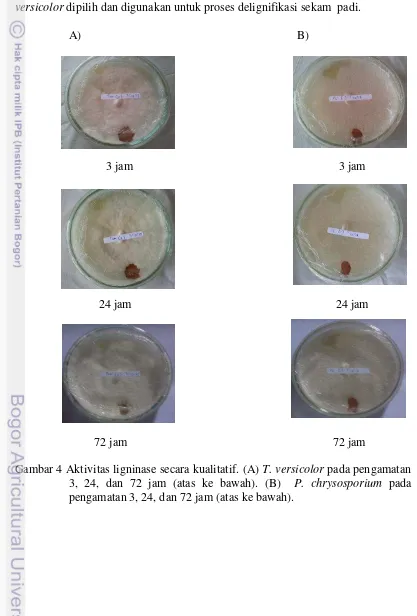
Uji enzim ligninase dilakukan untuk mengetahui adanya keberadaan enzim ligninase yang terdapat pada jamur pelapuk putih T. versicolor dan P. chrysosporium. Warna kuning kecoklatan pada bagian yang ditetesi reagen pirogalol tersebut menunjukkan adanya enzim lignin peroksidase (EC 1.11.1.14). Warna merah keungu-unguan pada bagian yang ditetesi reagen 0.1 M 1-naftol menjadi indikator positif adanya enzim lakase (EC 1.10.3.2) yang disintesis oleh jamur pelapuk putih pada kultur tersebut (Stalpers 1978). Hasil uji ini dapat dilihat pada Gambar 4.
14
tersebut diduga sebagai suatu cara agar selulosa yang terdapat di dinding sel dapat diakses oleh jamur pelapuk putih.
Berdasarkan pengamatan pada pertumbuhan dan uji enzim ligninase, T. versicolor menunjukkan pertumbuhan yang lebih baik ditandai dengan banyaknya hifa yang tumbuh dan adaptif terhadap suhu kamar. Jamur P. chrysosporium
tumbuh pada suhu kamar, tapi itu tampak kurang optimal mungkin karena suhu pertumbuhan optimum adalah 35-40ºC (Irawati 2006). Oleh karena itu, jamur T. versicolor dipilih dan digunakan untuk proses delignifikasi sekam padi.
A) B)
3 jam 3 jam
24 jam 24 jam
72 jam 72 jam
15 Delignifikasi Sekam Padi oleh Trametes versicolor
Jamur yang ditambahkan pada sekam padi merupakan jamur yang berumur 7 hari yang ditumbuhkan pada media PDB pada suhu ruang. Proses delignifikasi dilakukan pada plastik tahan panas. Proses ini dapat dilihat pada Gambar 5.
Jamur T. versicolor tumbuh dengan baik saat proses delignifikasi. Hifa jamur ini menutupi bagian permukaan tumpukan serbuk sekam padi. Jamur banyak tumbuh di bagian atas hingga ke bagian tengah tumpukan serbuk sekam padi. Jamur ini sedikit tumbuh di bagian bawah tumbukan serbuk sekam padi. Kemungkinan hal ini disebabkan pada bagian bawah tumpukan serbuk sekam padi tidak terdapat cukup udara untuk proses respirasi jamur. Hal ini juga terjadi pada jamur pelapuk putih Omphalina sp (Loebis 2008).
Pada awal penelitian, kandungan kimia sekam padi telah diuji yaitu meliputi kadar lignin, holoselulosa, selulosa, hemiselulosa, dan zat ekstraktif. Setelah dilakukan delignifikasi dengan menggunakan jamur pelapuk putih T. versicolor dengan waktu inkubasi 20 hari, kandungan kimia sekam padi pun diuji kembali untuk mengetahui pengurangan kadar lignin.
Sekam mengandung senyawa organik berupa lignin dan kitin, selulosa, hemiselulosa, senyawa nitrogen, lipid, vitamin B, dan asam organik, sedangkan senyawa anorganik berupa silika (Ismunadji et al.1988). Dalam proses degradasi, penggunaannya sebagai substrat harus melalui beberapa tahapan antara lain delignifikasi untuk melepas selulosa dan hemiselulosa dari ikatan kompleks lignin dan depolimerisasi untuk mendapatkan gula bebas (Anindyawati 2010).
Uji kandungan kimia sekam padi sebelum dan sesudah delignifikasi dibandingkan, hasil menunjukkan bahwa terdapat pengurangan lignin pada sekam padi. Hal ini menunjukkan bahwa jamur T. versicolor mampu mendelignifikasi sekam padi dengan enzim ligninase yang dimilikinya. Kandungan kimia sekam padi sebelum dan sesudah delignifikasi dapat dilihat pada Tabel 2 dan Gambar 6.
16
Tabel 2 Kandungan kimia sekam padi sebelum dan sesudah delignifikasi
Catatan: * terjadi peningkatan kadar hemiselulosa
Gambar 6 Kandungan kimia sekam padi sebelum (■) dan sesudah delignifikasi (□)
Kadar lignin sekam padi yang terukur adalah berat lignin yang tersisa dari sekam padi yang diberi perlakuan hidrolisis asam terhadap holoselulosanya. Kadar lignin yang terdapat pada total biomassa sekam padi sebesar 23.61%, setelah delignifikasi menggunakan jamur T. versicolor menjadi 16.20%. Persentase pengurangan lignin yang terjadi sebesar 7.41% dari total biomassa sekam padi (waktu inkubasi 20 hari). Jika dihitung berdasarkan total lignin, persentase pengurangan lignin yang terjadi sebesar 31.38%. Jika dibandingkan dengan penelitian Irawati (2006), kandungan kadar lignin kayu sengon yang telah didelignifikasi oleh jamur P. chrysosporium yangmenurun berturut-turut sebesar 2.51-12.59% (dalam waktu inkubasi 30 hari), maka jamur T. versicolor ini dapat mendegradasi lignin sekam padi dengan sangat baik walaupun tumbuh bukan pada habitat aslinya yaitu kayu. Jamur pelapuk putih ini merupakan kelas
Basidiomycetes yang efektif mendegradasi lignin. Jamur yang termasuk dalam jenis Basidiomycetes yang umum digunakan untuk mendegradasi lignin antara lain Omphalina sp., Marasmus sp., Phanerochaete chrysosporium, Trametes versicolor, dan lain-lain (Lobos et al. 2001; Sun dan Cheng 2002; Siswanto et al.
2007).
Proses delignifikasi tidak hanya mengurangi kadar lignin pada sekam padi, namun kadar holoselulosa dan selulosa pun berkurang. Hal ini terjadi karena
Perlakuan Sebelum Sesudah Selisih
Lignin (% b/b) 23.61 16.20 7.41
Holoselulosa (% b/b) 67.08 50.65 16.43
Selulosa (% b/b) 33.07 13.02 20.05
Hemiselulosa (% b/b) 34.01 37.63 *3.62
17 jamur menggunakan selulosa yang terdapat pada sekam padi untuk pertumbuhannya. Proses ini terlihat dari kadar selulosa yang berkurang dari total biomassa sekam padi sebesar 33.07% menjadi 13.02%. Persentase pengurangannya sebesar 20.05%. Jika dihitung berdasarkan total selulosa, persentase pengurangan selulosa menjadi 60.64%. Hasil ini juga selaras dengan penelitian Irawati (2006) yang menyatakan bahwa penurunan selulosa serbuk kayu sengon sebesar 21.06-42.41% dibanding kontrol.
Kadar holoselulosa yang terdapat pada total biomassa sekam padi sebesar 67.08%, setelah proses delignifikasi berkurang menjadi 50.65%. Persentase pengurangannya sebesar 16.43%. Jika dihitung berdasarkan total holoselulosa, persentase pengurangan holoselulosa menjadi 24.49%.
Kadar hemiselulosa sekam padi yang terukur adalah selisih dari kadar holoselulosa sekam padi dan kadar selulosanya. Kadar hemiselulosa dari total biomassa sekam padi mengalami kenaikan setelah proses delignifikasi selama waktu inkubasi 20 hari, yaitu dari 34.01% menjadi 37.63%. Persentase kenaikan hemiselulosa sebesar 3.62%. Hal ini terjadi karena terjadi pengurangan kadar selulosa pada hari ke-20 sehingga menyebabkan kenaikan kadar hemiselulosa. Data ini didukung penelitian dari Irawati (2006) yang menyebutkan bahwa kadar hemiselulosa tertinggi terdapat pada kombinasi perlakuan serbuk kayu meranti dengan waktu inkubasi 20 hari (38.91%).
Kadar zat ekstraktif pada biomassa sekam padi pun berkurang dari 5.87% menjadi 3.69%. Pengurangan ini terjadi karena sudah banyak zat yang digunakan oleh jamur. Persentase pengurangannya sebesar 2.18%. Jika dihitung berdasarkan total zat ekstraktif, persentase pengurangannya sebesar 37.19%. Isolasi zat ekstraktif ini berfungsi untuk menghilangkan zat-zat yang dapat menggangu pembacaan data kadar lignin, holoseluosa, selulosa, dan hemiselulosa.
Hasil penelitian ini menunjukkan bahwa delignifikasi biomassa sekam padi dengan menggunakan jamur pelapuk putih T. versicolor berhasil dilakukan dengan baik. Hasil delignifikasi sekam padi ini dapat digunakan untuk memproduksi bioetanol karena sekam padi yang sudah berkurang ligninnya dapat dijadikan sumber karbon. Delignifikasi dengan menggunakan jamur juga menjadi alternatif delignifikasi yang lebih ramah lingkungan.
Produksi Bioetanol
Sekam padi hasil delignifikasi oleh T. versicolor digunakan sebagai sumber karbon dalam fermentasi bioetanol. Fermentasi ini menggunakan kapang
Trichoderma viride dan bakteri Zymomonas mobilis. Kapang berfungsi sebagai penghasil enzim selulase yang digunakan untuk menghidrolisis selulosa pada sekam padi menjadi glukosa. Menurut Volk (2004), keunggulan kapang T. viride
18
untuk memproduksi bioetanol melalui jalur Entner Doudoroff. Jalur ini hanya dimiliki oleh prokariota. Glukosa diubah menjadi 6 fosfoglukonat didehidrasi menjadi 2-keto-3-deoksi-6-fosfoglukonat, lalu dipecah menjadi piruvat dan gliseraldehida-3-fosfat (G3P) dengan bantuan aldolase. Proses G3P menjadi piruvat sama seperti pada jalur metabolisme glukosa yang lain. Hasil akhir berupa 2 piruvat, 1 ATP, 1 NADPH, dan 1 NADH.
Bakteri Z. mobilis menghasilkan enzim piruvat dekarboksilase yang merubah piruvat menjadi asetadehida. Kemudian asetaldehida diubah menjadi etanol oleh enzim alkohol dehidrogenase. Keistimewaan bakteri ini adalah tidak ada produk samping kecuali karbondioksida (CO2), tidak seperti khamir dan
bakteri lainnya yang mempunyai produk samping berupa asam-asam organik (Purwoko 2007).
Fermentasi dilakukan dengan teknik sakarifikasi dan fermentasi simultan. Sakarifikasi adalah proses hidrolisis selulosa menjadi glukosa, pada penelitian ini dilakukan oleh enzim selulose yang dihasilkan oleh kapang Trichoderma viride.. Glukosa yang dihasilkan akan digunakan secara langsung oleh Z. mobilis.
Menurut penelitian Loebis (2008), fermentasi dengan menggunakan teknik sakarifikasi dan fermentasi simultan pada tandan kosong kelapa sawit selama 5 hari menggunakan Trichoderma sp dan Saccharomyces cerevisiae menghasilkan etanol yang lebih tinggi yaitu sebesar 0.33% dibandingkan dengan metode terpisah yang menghasilkan kadar etanol sebesar 0.27%. Fermentasi dengan menggunakan jerami padi menghasilkan kadar etanol sebesar 3.139% (gula 15 padi dengan sakarifikasi dan fermentasi simultan tanpa amobilisasi sel Z. mobilis
sebesar 1.84% (18.39 g/L).
19
Gambar 7 Kadar etanol pada fermentasi dengan amobilisasi sel (□) dan tanpa amobilisasi sel Z. mobilis (♦)
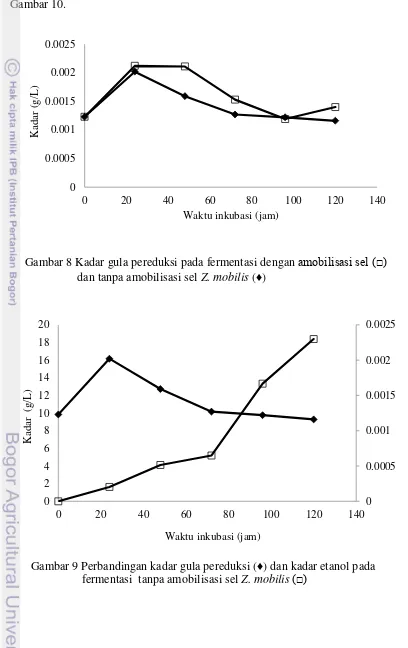
Kadar etanol berkaitan erat dengan kadar gula pereduksi. Glukosa menjadi sumber karbon untuk produksi etanol. Kadar gula pereduksi pada fermentasi tanpa amobilisasi sel Z. mobilis dengan pengambilan sampel pada jam ke- 0, 24, 48, 72, 96, dan 120, hasilnya 0.00123 g/L, 0.00202 g/L, 0.00159 g/L, 0.00127 g/L, 0.00122 g/L, dan 0.00116 g/L. Hasilnya menunjukkan bahwa pada jam 0 sampai jam ke-24 terjadi peningkatan kadar gula pereduksi, hal ini disebabkan karena kapang T. viride sudah mulai memecah selulosa menjadi glukosa. Pada jam ke-48 sampai dengan jam ke-120 terjadi penurunan kadar gula pereduksi. Hal ini terjadi karena glukosa dipakai bakteri Z. mobilis untuk memproduksi etanol. Kadar gula pereduksi pada fermentasi dengan amobilisasi sel Z. mobilis dengan pengambilan sampel pada jam ke- 0, 24, 48, 72, 96, dan 120, hasilnya 0.00123 g/L, 0.00212 g/L, 0.00210 g/L, 0.00153 g/L, 0.00119 g/L, dan 0.00140 g/L. Pada jam ke-24 terjadi peningkatan kadar gula pereduksi, hal ini terjadi sama seperti pada fermentasi tanpa amobilisasi sel yaitu kapang T. viride sudah mulai memecah selulosa menjadi glukosa. Dari jam ke-48 sampai jam ke-96 terjadi penurunan kadar gula pereduksi, hal ini pun terjadi karena gula dipakai bakteri Z. mobilis untuk memproduksi etanol Namun, pada jam ke-120 terjadi peningkatan gula pereduksi, hasil ini sesuai dengan tingginya kadar etanol pada jam ke-120.
Hasil produksi etanol pun dibandingkan dengan jumlah gula pereduksi yang terdapat pada media. Semakin tinggi kadar etanol yang dihasilkan, maka akan terjadi penurunan kadar gula pereduksi. Hal ini terjadi karena gula digunakan untuk memproduksi etanol. Kurva gula pereduksi pada fermentasi tanpa amobilisasi dan amobilisasi terdapat pada Gambar 8.
Fermentasi dengan menggunakan teknik amobilisasi sel Z. mobilis
20
bakteri Z. mobilis pun dapat menghasilkan kadar etanol yang lebih tinggi. Kurva perbandingan kadar etanol dengan kadar gula pereduksi pada fermentasi tanpa amobilisasi sel terdapat pada Gambar 9. Kurva perbandingan kadar etanol dengan kadar gula pereduksi pada fermentasi dengan amobilisasi sel terdapat pada Gambar 10.
Gambar 8 Kadar gula pereduksi pada fermentasi dengan amobilisasi sel (□) dan tanpa amobilisasi sel Z. mobilis (♦)
Gambar 9 Perbandingan kadar gula pereduksi (♦) dan kadar etanol pada fermentasi tanpa amobilisasi sel Z. mobilis (□)
21
Gambar 10 Perbandingan kadar gula pereduksi (♦) dan kadar etanol pada fermentasi dengan amobilisasi sel Z. mobilis (□)
5
SIMPULAN DAN SARAN
Simpulan
Sekam padi dapat didelignifikasi dengan menggunakan jamur pelapuk putih
Trametes versicolor. Produksi bioetanol dengan menggunakan fermentasi sakarifikasi dan fermentasi simultan dengan menggunakan kapang Trichoderma viride dan bakteri Zymomonas mobilis telah berhasil untuk produksi bioetanol. Produksi bioetanol dengan menggunakan sel bakteri Zymomonas mobilis yang diamobilisasi menghasilkan kadar etanol yang lebih tinggi dengan rata-rata peningkatan sebesar 8.3% dibandingkan dengan produksi bioetanol tanpa amobilisasi sel bakteri Zymomonas mobilis.
Saran
Saran dari penelitian ini adalah perlu adanya optimasi waktu inkubasi untuk delignifikasi sekam padi dengan menggunakan jamur Trametes versicolor. Adanya optimasi waktu inkubasi diharapkan dapat diperoleh hasil delignifikasi dan produksi bioetanol yang optimum.
DAFTAR PUSTAKA
Agustini L, Irianto RSB, Turjaman M, Santoso E. 2011. Isolat dan karakterisasi enzimatis lignoselulitik di tiga tipe ekosistem taman nasional. Jurnal Penelitian Hutan dan Konservasi Alam 8(2): 197-210.
22
Amekan Y. 2011. Pemanfaatan alginat dari algae Sargassum binderi (sonder) sebagai matriks amobilisasi sel Saccharomyces cerevisiae d-01 untuk produksi bioetanol pada reaktor batch dengan sirkulasi. [Internet] http://sinta.ukdw.ac.id (9 Desember 2013).
Anindyawati T. 2010. Potensi selulase dalam mendegradasi lignoselulosa limbah pertanian untuk pupuk organik. Berita Selulosa 45(2):70-77.
Anita SH, Yanto DHY, Fatriasasi W. 2011. Pemanfaatan lignin hasil isolasi dari lindi hitam proses biopulping bambu betung (Dendrocalamus asper) sebagai media selektif jamur pelapuk putih. Penelitian Hasil Hutan 29 (4): 312-321. Beccera M, Baroli B, Fadda AM, Mendez JB, Siso MIG. 2001. Lactose
bioconversion by calcium-alginat immobilization of Kluyveromyces lactis
cells. Enzyme Microb Technol 29: 506-512.
Boddy L, Rayner ADM. 1988. Fungal Decomposition of Wood. Its Biology and Ecology. New York (US): John Willey and Sons.
Buckley KF, Dobson ADW. 1998. Extracellular lignolytic enzyme production and polymeric dye decolourization in immobilized culture of Chrysosporium lignorum CLI. Biotechnol 20: 301-306.
Browning BL. 1967. Methods of Wood Chemistry. Interscience Publ. Vol. II. New York (US).
[BPPP] Balai Penelitian Pascapanen Pertanian. 2001. Peluang Agribisnis Arang Sekam. Jakarta (ID): BPPP.
[BPS] Badan Pusat Statistik. 2013. Tanaman pangan. [Internet] http://www.bps.go.id/tnmn_pgn.php (8 February 2014).
[BSN] Badan Standardisasi Nasional. 1989. Standar Nasional Indonesia Nomor 1032 tentang Cara Uji Kadar Sari Ekstrak Benzena Dalam Pulp dan Kayu. Jakarta (ID): Indonesia.
[BSN] Badan Standardisasi Nasional. 2008. Standar Nasional Indonesia Nomor 0492 tentang Pulp dan Kayu, Cara Uji Kadar Lignin Metode Klason. Jakarta (ID): Indonesia.
[BSN] Badan Standardisasi Nasional. 2009. Standar Nasional Indonesia Nomor 0444 tentang Pulp, Cara Uji Kadar Selulosa Alfa, Beta dan Gamma. Jakarta (ID): Indonesia.
Cohen R, Hadar Y, Yarden O. 2001. Transcript and activity levels of different
Pleurotus ostreatus peroxidases are differentially affected by Mn2+. Environ Microbiol 3(5):312-322.
Cross CF, Bevan EJ. 1912. Researches on Cellulose III. London (GB): Longmans Green.
Crueger W, Crueger A. 1982. Biotechnology: A Textbook of Industrial Microbiology. Sunderland (GB):Sinauer Associates, Inc.
Denkova Z R, Murgov ID. 2005. Soy milk yoghurt. Biotechnol and Biotechnology Equip19(1): 193-195.
[Deptan RI] Basis Data Statistik Pertanian 2011. [Internet]. http://www.bps.go.id/tnmn_pgn.php (12 november 2013).
Hambali E, Mujdalipah S, Tambunan AH, Pattiwiri AW, Hendroko. 2007.
Teknologi Bioenergi. Jakarta (ID): Agromedia Pustaka.
23 Irawati D. 2006. Pemanfaatan serbuk kayu untuk produksi etanol. [tesis]. Bogor
(ID):Institut Pertanian Bogor.
Ismail T, Iksanti L, Jayanti ND. 2009. Etanol dari molases menggunakaan
Zymomonas mobilis yang diamobolisasi dengan karaginan pada reaktor kontinyu. Makalah pada Seminar Nasional Teknik Kimia Indonesia, 19-20 Oktober 2009, Bandung (ID).
Ismunadji M, Partohardjono S, Syam M, Widjono A. 1988. Padi. Bogor (ID): Badan Penelitian dan Pengembangan Pertanian.
Ito H, Wada M, Honda Y, Kuwahara M, Watanabe T. 2003. Bioorganosolve Prectreatments for simultanequs saccharification and fermentation of Buch wood by ethanolysis and white-rot fungi. J of Biotechnol 103 : 273-280. Lankinen P. 2004. Ligninolytic enzymes of the basidiomycetous fungi Agaricus
bisporus and Phlebia radiata on lignocellulose-containing media. [disertasi]. Helsinki(FI): University of Helsinki.
Lobos SM, Tello R, Polanco LF, Larrondo A, Manubens L, Salas, Vicuna R. 2001. Enzymology and molecular genetics of the ligninolytic system of the basidiomycete Ceriporiopsis subvermispora. Curr Sci 81 (8): 992-997.
Loebis EH. Optimasi proses hidrolisis kimiawi dan enzimatis tandan kosong kelapa sawit menjadi glukosa untuk produksi etanol. [tesis]. Bogor (ID): Institut Pertanian Bogor.
Martina A, Yuli N, Sutisna M. 2002. Optimasi beberapa faktor fisik terhadap laju degradasi selulosa kayu albasia Paraserianthes falcataria (L) Nielsen dan karboksimetilselulosa (CMC) serta enzimatik oleh jamur. J NatIndonesia 4(2): 156-163.
Miller GC. 1959. Use of dinitrosalicylic acid reagent for the determination of reducing sugar. Anal Chem 31: 420-428.
Mulyono AMW, Handayani CB, Tari AIN, Zuprizal. 2011. Fermentasi etanol dari jerami padi. Proceedings Seminar Hasil Penelitian dan Pengabdian Masyarakat; 2011 Feb 26; Sukoharjo, Indonesia. Sukoharjo (ID). hal 23. Purwoko T. 2007. Fisiologi Mikroba. Jakarta (ID):Bumi Aksara.
Reniati D. 2009. Produksi etanol menggunakan Zymomonas mobilis yang diamobilisasi dengan Ca-alginat. [skripsi]. Surabaya (ID): ITS.
Samsuri M, Gozan M, Mardias R, Baiquni M, Hermansyah H, Wijanarko A, Prasetya B, Nasikin M. 2007. Pemanfaatan selulosa bagas untuk produksi etanol melalui sakarifikasi dan fermentasi serentak dengan enzim xilanase.
Makara Teknologi 11:17-24.
Shuler ML, Kargi F. 1992. Bioprocess Engineering : Basic Concept. New Jersey (US): Prentice-Hall International, Inc.
Singhania. 2009. Cellulolytic Enzymes. Biotechnology for Agro-Industrial Residues Utilization. Chapter 20, 371-381.
Siswanto, Suharyanto, Fitria R. 2007. Produksi dan karakterisasi lakase
Omphalinasp. Menara Perkebunan, 75 (2):106-115.
Srebotnik E, Messner K. 1994. Simple method that uses differential staining and light microscopy to asses the selectivity of wood delignification by white-rot fungi. Appl. Environt. Microbial 60 (4): 1383-1386.
Stalpers JA. 1978. Identification of wood-inhabiting Aphyllophorales in pure culture. Centraalbureau Voor Schimmelcultures, Baarn. Studies in Mycology
24
Suhardi SH, Hardiyati E, Wisjnuprapto. 2000. Karakterisasi aktivitas
Sporotrichum pulverulentum rs01 dalam proses biodegradasi klorolignin.
Seminar Nasional Ensim dan Bioteknologi II, Jakarta (ID),hal 95 – 103.
Sun Y, Cheng J. 2002. Hydrolysis of lignocellulosic materials for ethanol production: a review. Biores Technol 83: 1-11.
Surya L. 2010. Produksi bioetanol dari limbah tanaman jagung melalui sakarifikasi dan fermentasi simultan menggunakan biakan Zymomonas mobilis
dan Pichia stipitis. [skripsi]. Bogor (ID):Institut Pertanian Bogor.
Taherzadeh MJ, Karimi K. 2008. Pretreatment of lignocellulosic wastes to
improve ethanol and biogas production: a review”, Internat J Molecul Sci 9: 1621-1651.
Thorn RG, Reddy CA, Harris D, Paul EA. 1996. Isolation of saprophytic Basidiomycetes from soil. Appl and Environ Microbiol 62 (11): 4288-4292. Volk TJ.2004. Trichoderma viride, the dark green parasitic mold and maker of
fungal-digested jeans. [Internet] http://botit. botany.wisc. edu/toms_fungi/ nov2004 .html.(9 Desember 2013).
25
26
Lampiran 1 Bagan alir penelitian
Serbuk sekam padi (80 mesh)
Delignifikasi oleh jamur pelapuk putih (Trametes versicolor) selama 20 hari
Uji kimia sekam padi
Peremajaan Trametes
versicolor dan Phanerochaete crysosporium,
Uji enzim ligninase
Produksi bioetanol dengan dan tanpa teknik amobilisasi
Inokulasi Trichoderma viridedan Zymomonas mobilis
Uji kimia sekam padi
27 Lampiran 2 Kromatogram standar etanol
Lampiran 3 Kromatogram kadar etanol sekam padi tanpa amobilisasi sel
28
Lampiran 4 Kromatogram kadar etanol sekam padi tanpa amobilisasi sel
Zymomonas mobilis pada jam ke-48
Lampiran 5 Kromatogram kadar etanol sekam padi tanpa amobilisasi sel
29 Lampiran 6 Kromatogram kadar etanol sekam padi tanpa amobilisasi sel
Zymomonas mobilis pada jam ke-96
Lampiran 7 Kromatogram kadar etanol sekam padi tanpa amobilisasi sel
30
Lampiran 8 Kromatogram kadar etanol sekam padi dengan sel Zymomonas mobilis yang diamobilisasi pada jam ke-24
31 Lampiran 10 Kromatogram kadar etanol sekam padi dengan sel Zymomonas mobilis yang diamobilisasi pada jam ke-72
32
33
RIWAYAT HIDUP
Penulis dilahirkan di Kabupaten Cianjur, Provinsi Jawa Barat pada tanggal 28 Januari 1989 dari ayah bernama Yayan Suhyar Rukmana dan ibu bernama Rumsiti Ratnawati. Penulis merupakan anak tunggal.
Tahun 2008 penulis menyelesaikan pendidikan Sekolah Menengah Atas di SMA Negeri 1 Cianjur dan pada tahun yang sama lolos seleksi masuk IPB melalui jalur USMI. Program sarjana, penulis mengambil mayor Biokimia, di Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor (IPB). Penulis juga mengambil mayor Biokimia, di Departemen Biokimia untuk studi masternya.
Selama mengikuti perkuliahan penulis aktif dalam kegiatan organisasi kemahasiswaan di IPB dan organisasi mahasiswa daerah, diantaranya menjadi anggota UKM Forces (Forum for Scientific Studies) pada tahun 2008-2012, anggota UKM IAAS (International Association of Students in Agricultural and Related Sciences) pada tahun 2008-2012, Sekretaris Himpunan Mahasiswa Cianjur pada tahun 2009, Badan Pengawas Himpunan Mahasiswa Biokimia pada tahun 2009, dan Ketua Green Environment Biochemist Community pada tahun 2010.
Penulis juga pernah aktif dalam beberapa kepanitiaan seperti panitia IAAS Olympic 2008 dan 2009, Lomba Karya Ilmiah Populer 2009, Round Table Discussion 2009, Masa Perkenalan Kampus Mahasiswa Biokimia 2010, dan Sikrab Endorfin 2012. Pada tahun 2011 penulis melakukan praktik lapangan di Laboratorium Rekayasa Protein dan Bioproses, Pusat Penelitian Bioteknologi-LIPI Jalan Raya Bogor KM.46, Cibinong 16911 Bogor dengan judul “Isolasi Plasmid pPICZα-B dan pAF-ScFv-101 untuk Ekspresi Protein Rekombinan pada
Pichia pastoris”.