TRANSFORMASI GENETIK PADI (Oryza sativa L.) DENGAN
GEN PaCS PENYANDI SITRAT SINTASE MENGGUNAKAN
PERANTARA Agrobacterium tumefaciens
RUDI WARDANA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Transformasi Genetik Padi (Oryza sativa L.) dengan Gen PaCS Penyandi Sitrat Sintase Menggunakan Perantara Agrobacterium tumefaciens adalah benar karya bersama saya dengan komisi pembimbing, dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
Transformasi Genetik Padi (Oryza sativa L.) dengan Gen PaCS Penyandi Sitrat Sintase Menggunakan Perantara Agrobacterium tumefaciens. Dibimbing oleh SUHARSONO dan UTUT WIDYASTUTI.
Peningkatan produksi padi (Oryza sativa L.) dapat dilakukan dengan menerapkan intensifikasi dan ekstensifikasi pertanian. Penerapan ekstensifikasi pertanian terkendala oleh berkurangnya lahan pertanian akibat konversi lahan pertanian menjadi lahan perindustrian, perumahan, dan perkantoran. Pemanfaatan lahan marginal terutama tanah jenis ultisol dapat menjadi alternatif untuk menerapkan ekstensifikasi pertanian. Tetapi, tanah ultisol bersifat masam dan berpotensi mengandung Al yang dapat menghambat pertumbuhan tanaman. Perakitan tanaman padi yang toleran cekaman aluminium dapat dilakukan dengan mengintroduksi gen yang berkaitan dengan aktifitas toleransi terhadap cekaman aluminum. Sitrat sintase (CS) terlibat dalam biosintesis asam sitrat. Sitrat memiliki kemampuan mengkelat Al paling kuat diantara asam organik lain. Pada beberapa tanaman, ekspresi gen CS meningkatkan toleransinya terhadap cekaman Al. Penelitian ini bertujuan untuk mentransformasi genetik padi dengan gen penyandi sitrat sintase menggunakan perantara Agrobacterium tumefaciens.
Transformasi genetik dilakukan dengan perendaman selama 10 menit kalus embriogenik umur 3 minggu yang berasal dari embrio biji padi kultivar Kasalath dan Nipponbare dalam suspensi Agrobacterium tumefaciens strain LBA4404 yang mengandung plasmid pMSH1-PaCS dengan gen penanda seleksi higromisin. Ko-kultivasi dilakukan selama tiga hari pada kondisi gelap. Seleksi kalus transgenik menggunakan media yang mengandung higromisin 20 mg/L. Kalus yang resisten higromisin diregenerasikan di media 2N6R yang mengandung 5 mg/L kinetin. Subkultur dilakukan setiap 2 minggu sekali pada media yang sama.
Eksplan kalus yang digunakan untuk transfomasi pada padi kultivar Kasalath sebanyak 135 kalus dan Nipponbare sebanyak 240 kalus. Kalus kultivar Kasalath dan Nipponbare yang tahan higromisin sebanyak 2 % dan 35,8% dari jumlah eksplan kalus yang ditransformasi. Terdapat 13 kalus dari kultivar Nipponbare yang beregenerasi menghasilkan tunas dan masing-masing kalus menghasilkan tanaman padi transgenik putatif, sedangkan kalus padi kultivar Kasalath yang diregenerasikan tidak ada yang menghasilkan tunas. Penambahan antibiotik cefotaksim sebanyak 200 mg/L pada media regenerasi dapat menurunkan daya regenerasi dari kedua kultivar.
Konfirmasi gen penanda seleksi higromisin dengan primer 35S-F dan hpt-R pada sepuluh nomor kultivar Nipponbare transgenik putatif menghasilkan amplikon dengan ukuran 1100 pb. Konfirmasi gen PaCS dengan menggunakan primer forward 35S-F dan PaCS-R menghasilkan amplikon dengan ukuran 1630 pb untuk padi kultivar Nipponbare transgenik nomor 10, sedangkan untuk padi kultivar Nipponbare transgenik nomor 1 sampai 9 menghasilkan amplikon 900 pb. Kata kunci: Agrobacterium tumefacien, Oryza sativa L., sitrat sintase,
SUMMARY
Genetic Transformation of Rice (Oryza sativa L.) with PaCS Gene Encoding for Citrate Synthase mediated by Agrobacterium tumefaciens. Supervised by SUHARSONO and UTUT WIDYASTUTI.
Enhancement in rice (Oryza sativa L.) production can be done by implementation of agricultural intensification and extensification. Implementation of agricultural extensification is constrained by reduction of agricultural land due to land conversion into industries, residentials, and offices. Utilization of marginal lands, especially those with ultisol soil types, can be an alternative to implement agricultural extensification. However, ultisol soil is acidic and potentially containing Al which can inhibit plant growth. Rice tolerant can be generated by introducing gene related to tolerant activity to aluminum stress. Citrate synthase (CS) is involved in citric acid biosynthesis. Citrate has been known to have the most powerful Al-chelating ability among other organic acids. In some plants, the CS gene expression increase plants tolerance to Al stress. This study aims to perform the genetic transformation of rice with gene encoding citrate synthase mediated by Agrobacterium tumefaciens.
Genetic transformation was conducted by immersion of 3-weeks-old embryogenic callus developed from rice seed embryo of cultivar Kasalath and Nipponbare, for 10 minutes in Agrobacterium tumefaciens LBA4404 strain suspension containing pMSH1-PaCS plasmid with hygromycin selection marker gene. Co-cultivation had been done for three days under dark conditions. Selecion of transgenic callus was conducted using media containing hygromycin 20 mg/L. Hygromycin resistant callus was regenerated in 2N6R media containig 5 mg/L kinetin, then was sub-cultured every 2 weeks to the same media.
The result showes that only 2% from 135 cultivar Kasalath callus and 35.8% from 240 Nipponbare callus were hygromycin resistant. There were 13 cultivar Nipponbare callus regenerated and produced shoots, where each callus generated putative transgenic rice plants. Meanwhile, there was no regenerating shoot formation from the regenerated cultivar Kasalath rice callus. The addition of 200 mg/L cefotaxime antibiotic on regeneration medium could decrease the regeneration of both cultivars.
Confirmation of hygromycin selection marker gene was conducted using the 35S-F and hpt-R primer on ten numbers of putative transgenic cultivar Nipponbare, which generated amplicons with size of 1100 bp. Confirmation of PaCS gene using the 35S-F and PaCS-R primer resulted amplicons with size of 1630 bp in number 10 of cultivar Nipponbare transgenic rice, and amplicons with size of 900 bp in number 1 to 9.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biologi Tumbuhan
TRANSFORMASI GENETIK PADI (Oryza sativa L.) DENGAN
GEN PaCS PENYANDI SITRAT SINTASE MENGGUNAKAN
PERANTARA Agrobacterium tumefaciens
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Transformasi Genetik Padi (Oryza sativa L.) dengan Gen PaCS Penyandi Sitrat Sintase Menggunakan Perantara Agrobacterium tumefaciens
Nama : Rudi Wardana NIM : G353120061
Disetujui oleh Komisi Pembimbing
Prof Dr Ir Suharsono, DEA Ketua
Dr Ir Utut Widyastuti, MSi Anggota
Diketahui oleh
Ketua Program Studi Biologi Tumbuhan
Dr Ir Miftahudin, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul yang dipilih dalam penelitian ini adalah Transformasi Genetik Padi (Oryza sativa L.) dengan Gen PaCS Penyandi Sitrat Sintase Menggunakan Perantara Agrobacterium tumefaciens. Penelitian ini didanai oleh Proyek Penelitian Desentralisasi Baru IPB dengan kontrak no: 48/IT3.11/LT/2014 atas nama Prof Dr Ir Suharsono, DEA.
Terima kasih penulis ucapkan kepada Prof Dr Ir Suharsono, DEA dan Dr Ir Utut Widyastuti, MSi selaku pembimbing yang telah banyak memberi nasihat, saran dan bimbingan. Terima kasih juga penulis ucapkan kepada Dr Ir Aris Tjahjoleksono, DEA sebagai penguji luar komisi pada ujian tesis, dan Dr Ir Miftahudin, MSi selaku ketua Program Studi Biologi Tumbuhan (BOT). Di samping itu, penghargaan penulis sampaikan kepada Ibu Pepi Elvavina dan Nia Dahniar, SP selaku teknisi laboratorium Biorin dan kultur jaringan yang telah memberikan arahan dan bantuan selama proses penelitian. Tak lupa penulis ucapkan terima kasih kepada Bapak Asep, Adi Supardi, Sairi dan Ibu Sara yang telah membantu dalam tahapan aklimatisasi di rumah kaca. Kepada Bapak Mulya, penulis juga mengucapkan terima kasih atas bantuan peyediaan bahan kimia dan peralatan. Terima kasih juga penulis ucapkan kepada warga Biorin, Kultur jaringan dan teman-teman BOT 2012 yang telah banyak memberikan kenangan serta motivasi selama ini. Ungkapan terima kasih juga disampaikan kepada Bapak, Ibu, dan seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini dapat memberikan manfaat bagi pengembangan ilmu pengetahuan.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
2 TINJAUAN PUSTAKA 3
Transformasi Genetik Padi 3
Cekaman Aluminiun dan Mekanisme Toleransi 4
Asam Sitrat dan Enzim Sitrat Sintase 6
3 METODE 7
Waktu dan Tempat Penelitian 7
Bahan Penelitian 7
Metode Penelitian 8
4 HASIL DAN PEMBAHASAN 10
Transformasi Genetik Padi (Oryza sativa L.) dengan Gen PaCS 10 Uji Integrasi Transgen pMSH1-PaCS pada Padi Transgenik Putatif T0 16
5 SIMPULAN DAN SARAN 19
Simpulan 19
Saran 19
DAFTAR PUSTAKA 19
LAMPIRAN 27
DAFTAR TABEL
1 Persentase kalus padi Kasalath dan Nipponbare yang tahan higromisin 13 2 Perbandingan daya regenerasi padi Kasalath dan Nipponbare 14
DAFTAR GAMBAR
1 Model respon toksisitas dan mekanisme toleransi cekaman Al pada
sel tumbuhan 5
2 Peta fisik daerah T-DNA dari vektor pMSH1-PaCS 7
3 Tahap transformasi genetik padi 8
4 Tahapan pembentukan kalus sebagai eksplan di media induksi kalus
yaitu media 2N6 11
5 Tahapan transformasi 12
6 Perkembangan kalus non-transgenik di media seleksi (2NBKC) 14
7 Tahapan regenerasi Oryza sativa L 15
8 Tahapan aklimatisasi tanaman padi transgenik putatif 16 9 Hasil PCR padi Nipponbare untuk gen aktin dan gen hpt 16
10 Hasil analisis PCR padi OsNCS 17
DAFTAR LAMPIRAN
1 Komposisi media dasar N6 27
2 Komposisi media AB plate 28
3 Komposisi media dasar Murashige-Skoog (MS) 29
4 Komposisi vitamin Kao-MiChayluk (KM) 30
1
PENDAHULUAN
Latar Belakang
Produksi padi di Indonesia naik dari tahun 2012 sampai 2013, dengan persentase peningkatan produksi padi sekitar 0,31%. Total produksi padi tahun 2013 mencapai 38 juta ton sedangkan kebutuhan padi hanya 33 juta ton (PBS 2013). Intensifikasi dan ekstensifikasi merupakan langkah yang paling signifikan dalam hal menaikkan produksi padi. Langkah intensifikasi seperti penggunaan bibit unggul, pemupukan serta perbaikan teknologi pascapanen terbukti dapat meningkatkan produksi padi (Setyono 2010; Suardana et al. 2013). Menurut Marlina (2012), penggunaan pupuk organik dan pestisida organik mampu menaikkan produksi padi hingga mencapai 5,57 ton/ha. Upaya untuk meningkatkan produksi padi melalui intensifikasi tidak akan mampu mencapai target yang maksimal apabila tanpa diimbangi dengan ekstensifikasi. Ekstensifikasi merupakan langkah yang sangat signifikan untuk menaikkan produksi padi, tetapi langkah ekstensifikasi terkendala oleh konversi lahan pertanian menjadi lahan perindustrian, perumahan, dan perkantoran yang akan berimplikasi terhadap berkurangnya lahan pertanian produktif (Kusnadi et al. 2011). Usaha yang bisa dilakukan adalah dengan memanfaatkan lahan marginal yang tersebar luas di Indonesia, yang terdiri atas tanah kering dengan luas total terjadinya proses pencucian (leached) basa-basa seperti N, P, K, Ca dan Mg yang mendukung tingkat kesuburan tanah (Prasetyo dan Suriadikarta 2006). Al pada pH rendah <5.0 akan berbentuk Al3+ atau (Al(H2O)63+) yang bersifat toksik, dan
akan mengalami deprotonasi menjadi Al(OH)2+ seiring dengan naiknya pH. Al dengan bentuk Al(OH)2+ tidak bersifat toksik. Sedangkan pada pH netral akan berbentuk Al(OH)3 yang akan larut dan mengendap membentuk Al(OH)4- pada
larutan basa (Delhaize & Ryan 1995).
2
cekaman Al (Poschenrieder et al. 2008; Matsumoto & Motoda 2012). Al3+ dapat menggangu pertumbuhan dan perkembangan tanaman meskipun dengan konsentrasi rendah (Sharma & Dubey 2008).
Mekanisme toleransi cekaman Al pada beberapa jenis tanaman berkaitan dengan aktivitas eksudasi Asam organik, yang terdiri dari oksalat, malat, dan asam sitrat (Ryan et al. 1995, Ryan et al. 2009; Ma et al. 2001). Kemampuan sitrat untuk mengkelat Al lebih tinggi daripada malat, dengan perbandingan pengkelatan Al-sitrat 1:1 sedangkan Al-malat 1:3 (Hue et al. 1986; Ma et al. 2001). Menurut Appanna et al. (2002) pengkelatan Al oleh asam organik dapat meningkatkan pH di dalam sel. Isolasi gen sitrat sintase bisa dari tanaman (Koyama et al. 1999), maupun dari bakteri terutama genus Pseudomonas. Menurut de la Fuente et al. (1997), bakteri Pseudomonas aeruginosa mampu meningkatkan sekresi sitrat pada saat mengalami cekaman Al. Selain itu P. fluorescens juga mampu meningkatkan sekresi sitrat apabila mengalami cekaman Al (Mailloux et al. 2008).
Isolasi gen sitrat sintase yang berasal dari bakteri Pseudomonas aeruginosa telah berhasil dilakukan, dengan ukuran gen 1287 pb (Donald et al. 1989). Gen ini kemudian disebut dengan gen PaCS. Isolasi gen PaCS juga berhasil dilakukan yang kemudian diintroduksi pada tanaman tembakau (Nicotiana tabacum) dan jarak pagar (Jatropha curcas). Tanaman tembakau transgenik yang mengandung gen PaCS memperlihatkan toleransinya terhadap cekaman Al daripada tanaman non-transgenik (Tistama 2012). Menurut Deng et al. (2009), eksudasi sitrat pada akar tanaman tembakau transgenik meningkat apabila mengalami cekaman Al. Introduksi gen PaCS juga berhasil dilakukan pada rumput laut jenis K. alvarezii (Daud 2013). Menurut Wang et al. (2013), ekspresi berlebih gen CS pada tanaman Brassica napus dapat meningkatkan toleransinya terhadap cekaman Al dan defisiensi P, sebab ekspresi gen CS tidak hanya meningkatkan sintesis dan eksudasi sitrat, tetapi juga terjadi perubahan pada metabolisme malat.
Tujuan Penelitian
Penelitian ini bertujuan untuk mentransformasi genetik padi (Oryza sativa L.) kultivar Kasalath dan Nipponbare dengan gen PaCS penyandi sitrat sintase menggunakan perantara Agrobacterium tumefaciens.
Manfaat Penelitian
3
2
TINJAUAN
PUSTAKA
Transformasi Genetik Padi
Padi adalah tanaman serealia yang masuk dalam genus Oryza. Jenis padi yang banyak dibudidayakan di Asia yaitu Oryza sativa L. Berdasarkan letak geografinya Oryza sativa diklasifikasikan menjadi tiga kelompok yaitu indica, japonica (Kato et al. 1928) dan javanica (Morinaga & Kuriyama 1958). Padi sub spesies indica tersebar luas di wilayah Asia Tenggara, japonica di area yang dingin seperti Cina, Korea dan Jepang, sedangkan padi javanica khusus berada di wilayah Indonesia (Yoshida 1981). Padi japonica umumnya lebih responsif pada kultur in vitro dan transformasi dibandingan padi indica. Kasalath adalah kultivar dari subspesies padi indica sedangkan Nipponbare adalah kultivar dari subspesies padi japonica. Kedua kultivar tersebut memiliki respon yang baik dalam kultur in vitro dan banyak digunakan sebagai tanaman model untuk transformasi genetik (Nishimura et al. 2006; Hiei & Komari 2008).
Beberapa metode yang digunakan dalam transformasi genetik padi yaitu: elektroporasi (Zhang et al. 1988), polyethylene glycol (PEG) (Li et al. 1990), microprojectile bombardment (Cao et al. 1992), dan Agrobacterium tumefaciens (Hiei & Komari 1994). Transformasi genetik dengan menggunakan perantara Agrobacterium tumefaciens memiliki beberapa keuntungan diantaranya: menghasilkan salinan transgen tunggal (Paz et al. 2004), efisiensi tinggi, dan dapat membawa gen sisipan berukuran besar (Hiei et al. 1997). Metode lain seperti elektroporasi dan microprojectile bombardment memiliki kendala seperti banyaknya jumlah salinan transgen (Allen et al. 1993), dan tidak mengikuti kaidah pewarisan sifat mendelian (segregasi) (Spencer et al. 1995). Menurut Hiei et al. (1997), terdapat beberapa faktor yang mendukung keberhasilan transformasi genetik padi dengan perantara Agrobacterium yaitu, tipe dan tahapan dari jaringan yang diinfeksi, jenis vektor, genotipe padi, kondisi kultur jaringan, dan ko-kultivasi. Genotipe dan eksplan merupakan faktor penting untuk menghasilkan kalus embriogenik dan regenerasi tanaman padi (Rueb et al. 1994). Kalus embriogenik tanaman padi dapat diinduksi dari berbagai jaringan dan organ seperti helai daun (Yan & Zhao 1982), akar (Abe & Futsuhara 1985), embrio biji matang (Masuda et al. 1989), dan embrio yang belum matang (Koetije et al. 1989). Penggunaan eksplan embrio biji matang memiliki kelebihan daripada embrio belum matang, salah satunya yaitu kalus embriogenik yang diinduksi dari embrio matang lebih mudah preparasinya dan lebih efektif jika digunakan untuk transformasi genetik (Li et al. 1990; Hiei et al. 1994). Kondisi kultur jaringan dan pemilihan jenis media dasar seperti LS, MS dan N6 untuk induksi kalus padi, menghasilkan penampilan kalus embriogenik yang bervariasi meliputi jumlah, warna, ukuran, bentuk, dan lama induksi (Lee et al. 2002). Selain itu, pemilihan vektor dan strain penting dilakukan untuk kultivar yang sulit ditransformasi, misalnya pemilihan A. tumefaciens strain LBA4404 yang mampu untuk meningkatkan efisiensi transformasi genetik padi (Hiei et al. 1997).
4
1997), gen kitinase untuk ketahanan terhadap patogen kapang (Lin et al. 1995; Yamamoto et al. 2000), dan gen Bt (Aguda et al. 2001). Selain itu, transformasi genetik padi untuk ketahanan terhadap kekeringan dan aluminium juga dilakukan dengan introduksi gen manganese superoxide dismutase (MnSOD) (Wang et al. 2005), gen Nrat1 (Nramp aluminum transporter 1) (Xia et al. 2010), gen Magnesium Transporter OsMGT1 (Chen et al. 2012), gen Cu/ZnSOD (Davis 2012), gen Metallothionein Tipe II (MaMt2) (Fitriah 2013).
Cekaman Aluminium dan Mekanisme Toleransi
Cekaman abiotik seperti aluminium adalah faktor pembatas utama dalam pertumbuhan tanaman di lahan masam. Toksisitas aluminium meningkat seiring dengan menurunnya pH tanah (Miyasaka et al. 2006). Pada tanah masam dengan pH <5.0, Al tersedia dalam bentuk hexaaquaaluminum (Al(H2O)6)3+ atau Al3+
bereaksi dengan ligan di sekitar tanah masam dengan membentuk ikatan kimia tertentu (Kinraide 1990). Seiring dengan peningkatan pH pada tanah, Aluminium mengalami hidrolisis dan berbentuk Al(OH)2+ atau Al(OH)+2 (Abreu et al. 2003).
Pada pH mendekati netral, Al akan berbentuk padat Al(OH)3 (gibsit), sedangkan
pada kondisi sedikit basa Al akan membentuk spesies amfoter Al(OH)-4
(Aluminat) (Delhaize & Ryan 1995). Banyak akar tanaman pertanian yang sensitif terhadap Al3+ walaupun dengan konsentrasi rendah (konsentrasi mikromolar), gejala awal yang dapat diamati yaitu terhambatnya perpanjangan akar dalam waktu kurang dari satu jam (Matsumoto & Motoda 2012). Sebagai akibatnya, terjadi gangguan terhadap penyerapan air dan nutrisi lainnya (Kochian 1995), yang juga dapat menurunkan kualitas produksi gabah pada tanaman sereal (Raman et al. 2002).
Tingkat toksisitas aluminium yang sangat tinggi dapat menyebabkan perpanjangan akar sepenuhnya berhenti, dan tanaman mulai mati tanpa pemulihan. Penghambatan pemanjangan akar juga disertai dengan perubahan morfologi yaitu kekakuan dinding sel di bagian apeks akar (Kopittke et al. 2008). Pemendekan pada zona elongasi akar gandum disebabkan oleh penurunan panjang sel dan peningkatan diameter sel di bagian korteks yang dapat menyebabkan pecahnya lapisan epidermis (Sasaki et al. 1996). Faktor utama yang menyebabkan kekakuan pada dinding sel gandum adalah peningkatan lignin pada dinding sel oleh aktifitas pembentukan hidrogen peroksida (H2O2) melalui reaksi katalitik
dismutasi ion superoksida (O2-) oleh Cu-Zn-superoksida dismutase (SOD) yang
dibantu oleh NAD(P)H oxidase (Babourina et al. 2006). Efek fisiologis lain yang penting dari cekaman Al pada sel tumbuhan yaitu terjadi perubahan membran, gangguan enzimatik, serta gangguan pada sintesis DNA (Meriga et al. 2004; Achary & Panda 2010).
5
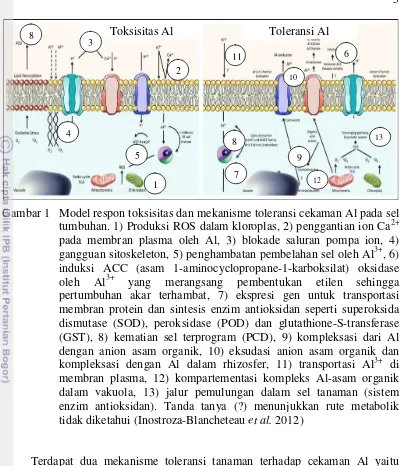
Gambar 1 Model respon toksisitas dan mekanisme toleransi cekaman Al pada sel tumbuhan. 1) Produksi ROS dalam kloroplas, 2) penggantian ion Ca2+ pada membran plasma oleh Al, 3) blokade saluran pompa ion, 4) gangguan sitoskeleton, 5) penghambatan pembelahan sel oleh Al3+, 6) induksi ACC (asam 1-aminocyclopropane-1-karboksilat) oksidase oleh Al3+ yang merangsang pembentukan etilen sehingga pertumbuhan akar terhambat, 7) ekspresi gen untuk transportasi membran protein dan sintesis enzim antioksidan seperti superoksida dismutase (SOD), peroksidase (POD) dan glutathione-S-transferase (GST), 8) kematian sel terprogram (PCD), 9) kompleksasi dari Al dengan anion asam organik, 10) eksudasi anion asam organik dan kompleksasi dengan Al dalam rhizosfer, 11) transportasi Al3+ di membran plasma, 12) kompartementasi kompleks Al-asam organik dalam vakuola, 13) jalur pemulungan dalam sel tanaman (sistem enzim antioksidan). Tanda tanya (?) menunjukkan rute metabolik tidak diketahui (Inostroza-Blancheteau et al. 2012)
6
sitrat, oksalat dan malat, membentuk kompleks stabil dengan Al (Jones & Ryan 2004; Ma et al. 2001; Guo et al. 2007), dengan kemampuan pengkelatan Al-sitrat >Al-oksalat >Al-malat (Jones & Ryan 2004), hal ini disebabkan oleh afinitas Al untuk donor oksigen dengan ligan (Barcelo´ & Poschenrieder 2002). Eksudasi asam organik dari sel-sel ujung akar dimediasi oleh saluran ion dalam membran plasma yang juga diinduksi oleh Al (Ma el al. 2001; Zhang el al. 2001). Peningkatan akumulasi dan effluks sitrat dapat dilakukan dengan meningkatkan produksi sitrat atau dengan mengurangi katabolisme sitrat (Neumann et al. 2000). Peningkatan sintesis sitrat bisa dicapai dengan meningkatkan aktivitas enzim yang terlibat dalam sintesis sitrat seperti sitrat sintase (CS), malat dehidrogenase (MDH), dan fosfoenolpiruvat karboksilase. Peralihan sitrat menjadi bentuk lain bisa dikurangi dengan menurunkan aktivitas enzim yang terlibat dalam pemecahan sitrat seperti akonitase (ACO) dan dehidrogenase isocitrate (Anoop et al. 2003).
Asam Sitrat dan Enzim Sitrat Sintase
Siklus asam sitrat memiliki beberapa nama, diantaranya siklus asam trikarboksilat (TCA) dan siklus Krebs (setelah ditemukan oleh Hans Krebs). Siklus asam sitrat menyebabkan oksidasi bertahap yang merubah piruvat menjadi karbon dioksida, dan elektron yang dihasilkan ditransfer ke NAD dan FAD, selain itu satu molekul ATP disintesis langsung dari ADP dan Pi. Semua reaksi ini terjadi di dalam matriks mitokondria (Hopkins 2006). Sitrat dikeluarkan dari mitokondria oleh protein pembawa trikarboksilat (Barbier-Brygoo et al. 2000), dan kelebihan sitrat di sitoplasma akan dikeluarkan dari sel untuk mencegah turunnya pH di sitoplasma (Massonneau et al. 2001). Enzim yang berperan dalam siklus TCA adalah enzim sitrat sintase. Menurut Yang et al. (2012), terdapat beberapa enzim pada siklus TCA tanaman Citrus grandis yang aktifitasnya meningkat jika mengalami cekaman Al, diantaranya enzim NAD malat dehidrogenase, sitrat sintase, akotinase dan NAD-isositrat dehidrogenase.
7
3
METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan mulai bulan Maret 2013 sampai dengan Februari 2014 di Laboratorium Biotechnology Research Indonesia–The Netherlands (BIORIN) dan Laboratorium Biologi Molekuler dan Seluler Tanaman (BMST), Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB) IPB Bogor.
Bahan Penelitian
Bahan yang digunakan dalam penelitian ini adalah padi dari kultivar Kasalath yang merupakan subspesies indica dan kultivar Nipponbare merupakan subspesies japonica. Bakteri Agrobacterium tumefaciens strain LBA4404 yang membawa plasmid pMSH1-PaCS dengan promoter 35S-CaMV. Peta fisik daerah T-DNA dari vektor pMSH1-PaCS disajikan pada Gambar 2.
Gambar 2 Peta fisik daerah T-DNA dari vektor pMSH1-PaCS. RB= Right Border, LB= Left Border dari T-DNA; NPTII= gen neomycin phosphotransferase II; HPT= gen hygromycin phosphotransferase, P35S = promoter 35S dari cauliflower mosaic virus (CaMV); PNOS= promoter gen nopalin synthase; PaCS= gen Citrate Sintase dari Pseudomonas aeruginosa; T= terminator gen nopalin synthase (Tistama 2012)
Deteksi keberadaan gen PaCS di bawah kendali promoter 35S-CaMV dan terminator TNos yang terintegrasi di genom tanaman padi transgenik menggunakan primer spesifik. Primer spesifik yang digunakan untuk identifikasi gen PaCS adalah 35S-F (5‘-AAA CCT CCT CGA TTC CAT T-3‘), PaCS-F (5’-ATG GCT GAC AAA AAA GCG CAG-3’), PaCS-R (5’-TCA GCC GCG ATC CTT GAG GGC-3’). Primer yang digunakan untuk identifikasi gen ketahanan higromisin hpt adalah 35S-F dan hpt-R (5‘-ACT ATC GGC GAC TAC TTC TAC A-3‘). Pasangan primer untuk identifikasi gen aktin padi adalah 3UTRact-F (5‘-TCG GAC CCA AGA ATG CTA AG-3‘), dan 3UTRact-R (5‘-GCC GGT TGA AAA CTT TGT CC-3‘). Pasangan primer untuk promoter sampai terminator adalah 35S-F dan TNos-R (5‘-CTC ATA AAT AAC GTC ATG CAT TAC A-3‘). Pasangan primer untuk gen half PaCS adalah 35S-F dan half PaCS-R (5’GGA TGC AGT TCC CAG GTT GA-3’).
8
Metode Penelitian
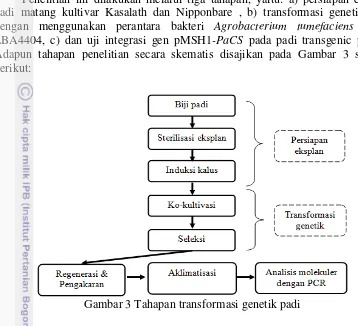
Penelitian ini dilakukan melalui tiga tahapan, yaitu: a) persiapan eksplan padi matang kultivar Kasalath dan Nipponbare , b) transformasi genetik padi dengan menggunakan perantara bakteri Agrobacterium tumefaciens strain LBA4404, c) dan uji integrasi gen pMSH1-PaCS pada padi transgenic putatif. Adapun tahapan penelitian secara skematis disajikan pada Gambar 3 sebagai berikut:
Gambar 3 Tahapan transformasi genetik padi
Persiapan eksplan padi
Kulit biji padi dibuang kemudian disterilisasi dengan cara direndam dalam etanol 70% selama 1 menit, kemudian dibilas dengan akuades steril sebanyak 2 kali dan selanjutnya direndam dalam larutan sodium hipoklorit (NaOCl) 2% yang dicampur dengan 1 tetes Tween-20 selama 60 menit kemudian digoyang. Biji padi selanjutnya dibilas dengan air steril sebanyak lima kali, dan ditiriskan pada tissue steril. Biji padi ditanam pada media 2N6 (media dasar N6, myo-inosol 0.1 g/L, sukrosa 30 g/L, casamino acid 0,5 g/L, prolin 0,5 g/L, 2,4-D 2 mg/L, gelrite 4 g/L, dan pH 5,8) selama 7 hari di ruang gelap dengan suhu 28oC (Hiei & Komari 2008). Media dasar N6 disajikan pada Lampiran 1. Kalus dipisahkan dari endosperm dan tunas, dan ditanam kembali pada media 2N6 baru selama 14 hari di ruangan terang pada suhu 28oC. Sebelum kalus ditransformasi dengan perantara bakteri A. tumefaciens yang membawa plasmid pMSH1-PaCS, kalus disegarkan dengan cara 1 kalus dipotong menjadi berdiameter akhir 5 mm dan ditanam pada media 2N6 baru.
Transformasi genetik padi dengan A. tumefaciens
pMSH1-9 PaCS disebar pada media AB plate (Lampiran 2) yang mengandung antibiotik streptomisin, kanamisin, dan higromisin dengan konsentrasi masing-masing 50 mg/L, dan diinkubasi pada suhu 28oC di ruang gelap selama 3 hari. Satu ose dari koloni yang tumbuh disuspensikan di media MSLA (media dasar MS, vit KM, sukrosa 20 g/L, asetosiringon 20 mg/L), hingga OD600 mencapai nilai 0,01. Media
dasar MS dan vitamin KM disajikan pada Lampiran 3 dan 4. Eksplan kalus direndam dalam suspensi tersebut selama 10 menit, kemudian ditiriskan pada tissue steril dan ditanam pada media Ko-Kultivasi N6-As (media 2N6 yang mengandung, sukrosa 20 g/L, glukosa 10 g/L, asetosiringon 20 mg/L). Eksplan kemudian diinkubasi selama 3 hari pada suhu 28oC di ruang gelap.
Pencucian dan Seleksi
Setelah 3 hari di media ko-kultivasi, eksplan dicuci dengan akuades steril sebanyak 5 kali. Selanjutnya direndam selama 15 menit di dalam akuades yang mengandung 200 mg/L cefotaxime. Kalus kemudian ditiriskan pada tissue steril dan dipindahkan pada media seleksi 2NBKCH20 (Lampiran 5) selama 20 hari pada ruangan terang dengan suhu 25oC (Hiei & Komari 2008).
Regenerasi
Kalus yang bertahan hidup pada media seleksi dengan ciri-ciri berwarna putih kekuningan, berukuran 0.5 – 1.5 mm ditanam di media regenerasi 2N6R (media dasar N6, sukrosa 30 g/L, sorbitol 30 g/L, prolin 0.5 g/L, casamino acid 0,5 g/L, myo-inosol 0.1 g/L, FeEDTA 10 ml/l, kinetin 5 mg/L, gelrite 4 g/L, AA acid 50 ml/l, pH media 5.8) selama 8 minggu pada ruang terang (3000 lux) secara kontinyu dengan suhu 28oC. Subkultur dilakukan setiap 2 minggu sekali dengan menggunkan media yang sama (2N6R) hingga kalus tersebut beregenerasi membentuk tunas dan akar. Pada 2 minggu pertama, media regenerasi ditambah dengan 200 mg/L cefotaxim. Tanaman padi yang sudah beregenerasi kemudian dipindah pada media MS0 (media dasar MS, sukrosa 30 g/L, gelrite 4 g/L, pH media 5,8) yang ditumbuhkan pada suhu 25oC dengan penyinaran kontinyu (3000 lux) selama 2 minggu.
Aklimatisasi
Tanaman transgenik putatif ditanam pada media arang sekam selama 2 minggu tanpa terpapar sinar matahari secara langsung. Tanaman tersebut kemudian ditanam pada pot yang berisi campuran tanah dan kompos dengan perbandingan 1:1. Pot yang berisi padi transgenik putatif T0 tersebut diletakkan
10
Isolasi DNA Genom dan Uji Integrasi Transgen pMSH1-PaCS Padi Transgenik T0
Isolasi DNA genom tanaman padi transgenik menggunakan metode CTAB (Suharsono dan Widyastuti 2006). Deteksi integrasi gen PaCS pada tanaman padi menggunakan PCR dengan kombinasi primer spesifik yaitu 3’UTRact-F dan 3UTRact-R, 35S-F dan hpt-R, 35S-F dan PaCS-R, PaCS-F dan PaCS-R, PaCS-F dan TNos-R, 35S-F dan half PaCS-R. Komposisi yang digunakan dalam reaksi PCR terdiri dari 100 ng DNA genom, 0.5 mM primerforward dan 0.5 mM primerreverse, 10 l Dream TaqTMGreen PCR Master Mix, ditambah dengan ddH2O hingga volume
20 l. Amplifikasi dilakukan menggunakan mesin PCR (Applied Biosystem). Kondisi PCR yang digunakan meliputi pra-PCR 95oC selama 4 menit; denaturasi 94oC selama 30 detik; anneling primer 58oC selama 45 detik; extension 72oC selama 2 menit; siklus ini diulang sebanyak 40 kali, dan extension akhir 72oC selama 5 menit; serta pasca-PCR 20oC selama 5 menit. Hasil PCR dielektroforesis dalam gel agarose 1% selama 30 menit dengan voltase 100 volt, kemudian gel direndam dalam ethidium bromida (0.5 g/ml) selama 10 menit untuk memberikan pewarnaan, selanjutnya direndam dalam akuades selama 5 menit (Paz et al. 2006). Visualisasi dilakukan pada UV transilluminator dan didokumentasikan dengan gel doc.
4
HASIL DAN PEMBAHASAN
Transformasi Genetik Padi (Oryza sativa L.) dengan Gen PaCS
Penelitian transformasi genetik Oryza sativa L. dengan gen PaCS ini menggunakan kalus yang berasal dari embrio biji padi matang dari Kasalath dan Nipponbare. Kalus diperoleh dengan cara menginduksi biji padi di media 2N6 yang mengandung 2,4-D 2 mg/l sebagai zat pengatur tumbuh. Menurut Meneses et al. (2005), hormon auksin terutama 2,4-D dapat menginduksi sel untuk membentuk kalus serealia dan memacu terbentuknya kalus embriogenik secara optimal. Hal ini berkaitan dengan fungsi 2,4-D yang mampu memacu hipermethilasi pada DNA. Biji mulai membentuk kalus pada hari ke 3 setelah ditanam di media induksi kalus. Setelah dipisahkan dari endosperma dan tunas, kalus yang dibiakkan pada media yang sama selama 3 minggu membentuk kalus embriogenik dengan ciri-ciri berwarna putih kekuningan dan berbentuk globular dengan ukuran diameter kalus 0,5 – 1 cm. Ciri kalus embriogenik ini sesuai dengan yang dikemukakan oleh Zuraida et al. (2011). Kombinasi auksin seperti 2,4-D dan sitokinin dengan konsentrasi yang rendah dapat menginduksi kalus embriogenik (Sellars et al. 1990). Selain itu penambahan nitrogen (N) organik yang berasal dari asam amino dapat meningkatkan keberhasilan terbentuknya kalus embriogenik (Purnamaningsih 2006).
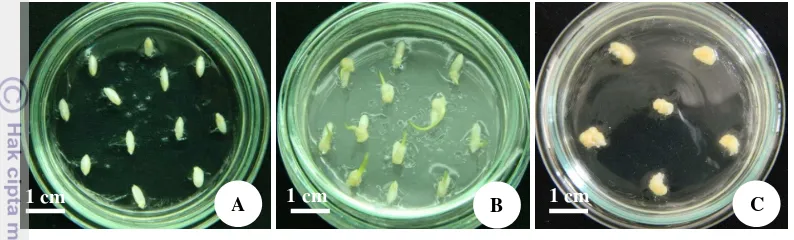
11 diketahui. Kalus embriogenik yang diperoleh dipotong kecil-kecil dengan ukuran diameter kalus ± 5 mm dan disubkultur pada media yang sama selama 3 hari di ruang terang, dengan tujuan untuk penyegaran kalus, sehingga kualitas kalus akan lebih bagus sebelum di ko-kultivasi.
Gambar 4 Tahapan pembentukan kalus sebagai eksplan di media induksi kalus yaitu media 2N6. A) biji yang ditanam di media induksi kalus; B) kalus yang terbentuk, umur 5 hari setelah tanam (HST); C) kalus embriogenik dengan diameter kalus 0,5 – 1 cm, umur 25 HST
Transformasi genetik dilakukan dengan merendam kalus di suspensi MSLA yang mengandung 20 mg/l asetosiringon dan A. tumefaciens yang membawa plasmid pMSH1-PaCS. Metode perendeman merupakan metode yang banyak dipakai, sebab memiliki efisiensi yang tinggi dalam proses transformasi genetik ke dalam sel tanaman (Hong et al 2007, Sharma et al. 2009, Ozawa & Takaiwa 2010). Kondisi gelap pada saat ko-kultivasi dapat meningkatkan efisiensi infeksi Agrobacterium ke dalam sel inang. Hal ini disebabkan oleh pengaruh cahaya yang dapat menghambat kerja operon flaABC untuk membentuk flagelin sehingga jumlah flagella yang terbentuk juga berkurang dan akhirnya menyebabkan kemampuan bergerak Agrobacterium juga menurun (Oberpichler et al. 2008). Penambahan asetosirigon pada media ko-kultivasi dilakukan untuk meningkatkan keberhasilan transformasi genetik, sebab asetosiringon memiliki kemampuan untuk menginduksi gen virA pada Agrobacterium tumefaciens sehingga dapat menginfeksi kalus yang kemudian akan mentrasfer T-DNA-nya ke dalam genom tanaman padi. Ko-kultivasi selama 3 hari pada suhu 28oC dan dengan OD600 = 0.04 dapat meningkatkan frekuensi transformasi (Ozawa K 2009), akan tetapi jika lebih dari 3 hari dapat menyebabkan pertumbuhan Agrobacterium menjadi overgrowth, sehingga akan berdampak pada penurununan frekuensi transformasi (Shrawat et al. 2007).
Ko-kultivasi di media 2N6-As akan menyebabkan tumbuhnya A. tumefaciens di sekitar kalus (Gambar 5A), sehingga pencucian dengan menggunakan antibiotik cefotaksim perlu dilakukan untuk menghilangkan pertumbuhan A. tumefaciens berlebih pada kalus. Pertumbuhan berlebih A. tumefaciens pada kalus yang ditransformasi akan menurunkan persentase jumlah kalus transgenik yang dihasilkan, sebab kalus akan bertekstur lembek dan busuk (Gambar 5C). Pencegahan overgrowth dengan temperatur yang tinggi (30-32oC) (Toki et al. 2006), dan konsentrasi antibiotik yang tepat (Saika & Toki 2010) dapat meningkatkan efisiensi transformasi. Konsentrasi dan durasi cefotaksim
A B C
12
yang dipakai dalam pencucian kalus ini adalah 200 mg/l dan direndam selama 15-20 menit. Cefotaksim memiliki spectrum aktivitas yang luas untuk menghambat pertumbuhan bakteri (gram positif maupun negatif) dengan konsentrasi rendah serta memiliki efek toksisitas yang rendah untuk organisme eukariotik, aktivitasnya yaitu dengan cara memblokade biosintesis dinding sel mucopeptida dan menghambat ikatan peptidoglikan dengan cara mengikat dan menginaktifasi transpeptidase (Mathias & Boyd 1986). Penggunaan cefotaksim dengan konsentrasi yang tinggi dan dengan durasi yang lama akan menyebabkan keracunan pada kalus, sehingga kalus akan berwarna kecoklatan yang kemudian mati. Pernyataan serupa disampaikan oleh Pipatpanukul et al. (2004), bahwa penggunaan antibiotik carbenicillin dan cefotaksim dengan konsentrasi sebesar 250 mg/l dapat menghambat regenerasi kalus padi cv. RD6.
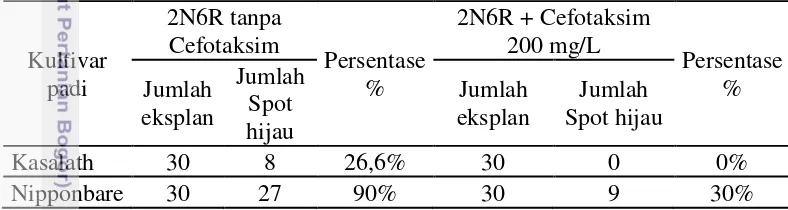
Seleksi kalus transgenik dilakukan pada media seleksi yang mengandung higromisin 20 mg/l selama 4 minggu. Subkultur dilakukan setiap 2 minggu sekali pada media yang sama untuk memaksimalkan kerja higromisin. Kalus non-transgenik akan terseleksi dengan memperlihatkan ciri-ciri kalus berwarna coklat, kering serta tidak berproliferasi, sedangkan kalus transgenik tetap hidup dengan ciri-ciri kalus berwarna kuning cerah dan berproliferasi (Gambar 5B). Berdasarkan hasil perhitungan jumlah kalus yang tahan higromisin dibagi dengan jumlah total eksplan yang ditransformasi, maka diperoleh efisiensi transformasi Kasalath sebanyak 2%, sedangkan Nipponbare sebanyak 35,8% kalus (tabel 1). Hasil ini sesuai dengan penelitian yang dilakukan oleh Fitriah (2013), yang menunjukkan bahwa padi kultivar indica kurang efisien daripada kultivar Japonica dengan efisiensi transformasi Kasalath 14,04%, sedangkan Nipponbare 19,39%.
Gambar 5 Tahapan transformasi. A) ko-kultivasi selama 3 hari (kondisi gelap) di media 2N6-AS; B) kalus tahan higromisin 20 mg/L (berproliferasi dan berwarna kuning cerah) dan kalus tidak tahan higromisin 20 mg/L (berwarna coklat dan kering) di media seleksi (2NBKCH20); C) over growthA. tumefaciens dapat membusukkan kalus
A B C
13 Tabel 1 Persentase kalus padi Kasalath dan Nipponbare yang tahan higromisin
Kultivar
Beberapa faktor yang mampu meningkatkan efisiensi transformasi diantaranya adalah pemilihan kultivar, tipe dan umur eksplan yang tepat untuk diinfeksi, penggunaan vektor yang tepat, kondisi kultur in-vitro dan juga kondisi ko-kultivasi (Hiei et al. 1997). Berdasarkan data yang diperoleh terbukti bahwa Nipponbare lebih efisien daripada Kasalath (Tabel 1), sebab menurut Zhang et al. (1998) menyatakan bahwa padi Kasalath masuk pada indica grup I yang sering disebut dengan “true indica rice”. Kultivar ini bersifat rekalsitran yang berpengaruh buruk terhadap efisiensi transformasi dan regenerasi (Wünn et al. 1996). Sifat rekalsitran ini akan berdampak pada menurunnya kemampuan pembentukan kalus embriogenik, mengurangi kemampuan kalus beregenerasi, serta terjadi perubahan warna kalus menjadi kecoklatan sampai hitam dan akhirnya mati setelah melewati tahapan ko-kultivasi (Lin & Zhang 2005; Ramesh et al. 2009). Sifat rekalsitran padi Kasalath dikaitkan dengan kandungan poliamin yang lebih rendah daripada Nipponbare (Dewi dan Purwoko 2008). Poliamin dapat meningkatkan sintesis DNA dan aktivitas mitosis sel (Kaur-sawhney et al. 1979). Menurut Robie & Minocha (1989), peningkatan biosintesis poliamin (spermidin dan spermin) dapat membentuk kalus embriogenik, sebab spermidin mampu menghambat prekursor ACC (1-AminoCyclopropane-1-Carboxylic acid) untuk membentuk etilen. Sebaliknya, peningkatan biosintesis etilen dapat menurunkan biosintesis poliamin dengan menghambat aktivitas ADC (arginine decarboxylase) (Roustan et al. 1990). Etilen dapat menghambat pengembangan tanaman melalui penghentian dalam pembelahan sel. Selain itu, penggunaan antibiotik dengan konsentrasi tinggi memiliki pengaruh terhadap penurunan efisiensi transformasi padi indica, hal ini disebabkan oleh efek antibiotik yang dapat meracuni kalus, yang pada akhirnya kalus menjadi kecoklatan dan mati (Khanna & Raina 1999).
14
antibiotik menunjukkan ciri regenerasi tahap awal, yaitu munculnya bintik hijau pada kalus setelah 7 hari berada di media 2N6R.
Gambar 6 Perkembangan kalus non-transgenik di media seleksi (2NBKC). A) kalus di media seleksi tanpa antibiotik; B) kalus di media seleksi ditambah cefotaksim 200 mg/L; C) kalus di media seleksi ditambah cefotaksim 200 mg/L dan higromisin 20 mg/L
Tabel 2 Perbandingan daya regenerasi padi Kasalath dan Nipponbare
Kultivar
Berdasarkan hasil pengamatan daya regenerasi kalus di atas menunjukkan bahwa penambahan antibiotik cefotaksim sebanyak 200 mg/l pada media regenerasi dapat menurunkan daya regenerasi kalus padi Nipponbare dan Kasalath. Semakin tinggi konsentrasi cefotaksim pada media, dapat menurunkan efisiensi regenerasi tanaman (Kazemi et al. 2014). Penggunaan 500 µg/L cefotaksim dapat menurunkan daya regenerasi pada kalus tembakau, hal ini dihubungkan dengan peningkatan metilasi pada DNA (Schmitt et al. 1997). Cefotaksim memiliki aktifitas yang sama dengan hormon mirip auksin pada media tanpa ZPT, walaupun jalur metabolismenya belum bisa dijelaskan (Holford & Newbury 1992). Hormon auksin dapat memacu terjadinya hipermetilasi pada DNA, sehingga akan menyebabkan dediferensiasi sel yang dapat menurunkan daya regenerasi kalus (Meneses et al. 2005). Daya regenerasi Nipponbare lebih tinggi daripada Kasalath (Tabel 2). Perbandingan daya regenerasi ini membuktikan bahwa padi Kasalath memiliki sifat rekalsitran, sehingga untuk meningkatkan efisiensi regenerasi perlu dilakukan optimasi pada media regenerasi yang digunakan.
Kalus transgenik yang dihasilkan ditanam pada media regenerasi (2N6R) untuk menghasilkan tanaman transgenik putatif. Kalus dari kedua kultivar mengalami perubahan yaitu munculnya bintik hijau pada permukaan kalus setelah
A B C
15 1 minggu di media 2N6R (Gambar 7A). Tunas akan muncul dari bintik hijau tersebut setelah 2 minggu di media 2N6R (Gambar 7B). Hasil penelitian ini menunjukkan bahwa, tidak semua bintik hijau yang muncul akan membentuk tunas, bahkan beberapa bintik hijau yang terbentuk, berubah menjadi kecoklatan dan kemudian mati. Kalus juga akan mengalami dediferensiasi yang menyebabkan pembelahan sel tidak terkontrol (Lestari dan Yunita 2008). Pembelahan sel yang tidak terkontrol ini disebabkan oleh ketidakseimbangan hormon eksternal dan internal sel (Thorpe 1984).
Tanaman transgenik putatif yang dihasilkan ada 13 tanaman dari Nipponbare, sedangkan untuk Kasalath tidak terdapat tanaman yang dihasilkan. Perbedaan daya regenerasi kalus dapat dipengaruhi oleh, beberapa faktor seperti genotipe tanaman, karakter fisiologis eksplan, takaran dan campuran garam yang sesuai serta penggunaan zat pengatur tumbuh (zpt) pada media juga dapat mempengaruhi potensi dalam induksi dan regenerasi kalus tanaman padi (Ge et al. 2006). Perbedaan genotipe antara subspesies japonica (Nipponbare) yang lebih responsif daripada subspesies indica (Kasalath), berhubungan dengan tingginya kandungan etilen dan ACC serta aktifitas ACC oksidase pada subspesies indica. Oleh karena itu, jumlah kalus yang terbentuk dan daya regenerasi yang dihasilkan lebih tinggi japonica daripada indica (Dewi dan Purwoko 2008). Daya regenerasi juga dipengaruhi oleh pemilihan jenis gel dan konsentrasinya. Menurut Sahoo et al. (2011) penggunaan gel jenis agarose 1% dapat meningkatkan efisiensi regenerasi sebesar 84-92% untuk kalus non-trasnforman dan 42-59% untuk kalus transgenik.
Gambar 7 Tahapan regenerasi Oryza sativa L. A) muncul bintik hijau pada kalus setelah 14 hari dimedia 2N6R; B) tunas muncul dari bintik hijau setelah 5 hari; C) multiplikasi daun dan akar terjadi setelah 1 bulan di media 2N6R
Kalus embriogenik beregenerasi dengan membentuk tunas dan akar secara serentak setelah 14 hari di media 2N6R. Menurut Purnamaningsih (2006), regenerasi kalus embriogenik melewati tahapan pendewasaan dan perkecambahan dengan membentuk calon maresitem akar dan tunas secara serentak. Tanaman hasil regenerasi di tanam di media MS0 selama 14 hari hingga tanaman tumbuh secara optimal. Aklimatisasi dilakukan untuk mengadaptasikan tanaman sebelum ditanam pada kondisi yang sebenarnya. Media yang digunakan adalah arang sekam yang direndam air selama ± 15 menit agar memiliki kelembapan yang cukup. Aklimatisasi dilakukan selama 14 hari diluar ruangan yang tidak terkena cahaya matahari secara langsung. Tanaman tersebut selanjutnya ditanam di media
A B C
16
tanah yang dicampur kompos (1:1). Tanaman dipelihara sampai menghasilkan biji yang kemudian disebut dengan biji padi transgenik T1.
Gambar 8 Tahapan aklimatisasi tanaman padi transgenik putatif. A) tanaman padi di media MS0; B) tanaman padi di media arang sekam; C) tanaman padi di media tanah dicampur kompos (1:1)
Uji Integrasi Transgen pMSH1-PaCS pada Padi Transgenik Putatif T0
Konfirmasi gen PaCS pada tanaman padi transgenik T0 dimulai dengan
konfirmasi higromisin sebagai gen penanda seleksi pada plasmid pMSH1-PaCS. Terdapat 13 tanaman transgenik putatif yang dihasilkan dari Nipponbare. Isolasi DNA genom hanya bisa dilakukan untuk 10 tanaman, sedangkan sisanya masih berada dalam kultur jaringan. Tanaman padi transgenik ini kemudian disebut dengan OsNCS. PCR dengan primer 35S-F dan hpt-R menunjukkan bahwa 10 tanaman transgenik putatif Nipponbare OsNCS mengandung promoter 35S-CaMV dan gen hpt dengan ukuran 1100 pb. Padi Nipponbare non-transgenik (NT) tidak mempunyai fragmen DNA tersebut. Hal ini menunjukkan bahwa primer adalah spesifik untuk mengamplifikasi gen hpt di bawah kendali promoter 35S-CaMV. Amplifiksi gen aktin (3’UTR actin) padi juga dilakukan untuk mengetahui kualitas DNA genom tanaman hasil isolasi, sebab gen aktin merupakan housekeeping gene yang selalu ada d dalam sel. PCR menggunakan primer aktin menghasilkan amplikon dengan ukuran 109 pb untuk semua tanaman termasuk tanaman non-transgenik. Hal ini menunjukkan bahwa DNA genom hasil isolasi berkualitas baik.
Gambar 9 Hasil PCR padi Nipponbare untuk gen aktin dan gen hpt. A) PCR untuk gen aktin, B) PCR untuk gen hpt. M= marka DNA 1kb, P= plasmid pMSH1-PaCS, NT= padi non-transgenik, 1-10= OsNCS
A B C
2 cm 2 cm 5 cm
250 pb
1000pb 109 pb
17 Ketelitian hasil PCR tergantung dari kualitas DNA yang digunakan sebagai cetakan. Semakin tinggi tingkat kontamininasi pada DNA cetakan seperti senyawa fenolik, dan senyawa metabolik sekunder lain pada tumbuhan semakin rendah ketelitiannya. Bahan-bahan tersebut dapat mempengaruhi hasil PCR khususnya mengganggu penempelan primer pada DNA cetakan sehingga primer tidak menempel secara spesifik pada DNA template (Nkongolo et al. 1998). Konsentrasi DNA cetakan yang terlalu tinggi juga dapat menyebabkan hasil PCR yang tidak spesifik, sehingga DNA cetakan perlu diencerkan.
Hasil amplifikasi dengan menggunakan primer 35S-F danPaCS-R terhadap 10 galur OsNCS menunjukkan bahwa hanya satu galur OsNCS10 yang mengandung gen PaCS di bawah kendali promoter 35S-CaMV dengan ukuran 1630 pb (Gambar 10A). Hasil amplifikasi tersebut sesuai dengan ukuran gen PaCS dan promoter 35S-CaMV yang berukuran 1630 pb yang terdapat di plasmid pMSH1-PaCS. Hasil amplifikasi dengan menggunakan primer yang sama pada sembilan galur OsNCS lainnya menunjukkan bahwa kesembilan galur tersebut mengandung potongan gen PaCS yang berukuran 900 pb. Amplifikasi dengan menggunakan primer PaCS-F dan PaCS-R menghasilkan amplikon yang berukuran 1287 pb untuk galur OsNCS10 yang sama dengan ukuran gen PaCS di pMSH1-PaCS, sedangkan sembilan galur OsNCS lainnya menghasilkan amplikon sebesar 600 pb (Gambar 10B).
Gambar 10 Hasil analisis PCR padi OsNCS. A) menggunakan primer 35S-F dan PaCS-R, B) menggunakan primer PaCS-F dan PaCS-R, C) menggunakan primer PaCS-F dan TNos-R, D) menggunakan primer PaCS-F dan half PaCS-R. M= marka DNA 1kb, P= plasmid pMSH1 -PaCS, NT= non-transgenik, 1-10= OsNCS
18
mengalami pemotongan pada bagian tengah. Amplifikasi menggunakan primer PaCS-F dan TNos-R menghasilkan amplikon sebesar 1800 pb pada galur OsNCS10 (Gambar 10C), sedangkan pada galur OsNCS nomor 1 sampai 9 tidak menghasilkan amplikon sehingga gen PaCS yang terintegrasi ke dalam genom kesembilan galur OsNCS ini terpotong di daerah hilir dan terminator Nos. Pemotongan ini dapat terjadi akibat aktifitas enzim DNA nuklease yang memotong daerah hilir TDNA yang tidak dilindungi oleh gen virE2 pada saat proses masuknya gen dari bakteri ke dalam sel tanaman atau pada saat integrasi gen ke dalam kromosom tanaman.
Fenomena terpotongnya gen PaCS dibagian tengah tersebut masih belum bisa dijelaskan. Menurut Tzfira et al. (2004), T-DNA di dalam nukleus akan membentuk utas ganda (DS), yang kemudian terpotong menjadi dua yaitu T-DNA1 dan T-DNA2. Potongan tersebut bereligasi dengan double-stranded breaks DSBs dengan bantuan DNA-repair proteins (DSB-RP). Diduga pemotongan tersebut berada tepat di gen PaCS, sehingga pada saat terjadi religasi terdapat pasang basa yang hilang akibat peristiwa tersebut.
Tanaman padi transgenik yang dihasilkan masih perlu diuji tantang dengan cekaman aluminium untuk mengetahui aktifitas gen PaCS. Ekspresi gen PaCS akan menghasilkan asam sitrat yang dapat mengkelat aluminium. Kemampuan asam sitrat untuk mengkelat Al3+ dikaitkan dengan tiga gugus karboksil yang dimilikinya. Asam sitrat akan membentuk ion sitrat dengan cara melepaskan proton H+ pada gugus karboksilnya. Sitrat dalam bentuk ion ini akan cenderung mengikat kation logam seperti Al3+ dengan membentuk struktur cincin yang komplek, sehingga struktur tersebut memiliki ikatan yang erat dan sulit bereaksi dengan unsur lain (Marwati et al. 2007). Eksudasi asam sitrat di daerah rhizosfer adalah mekanisme ekslusi Al3+ tumbuhan terhadap cekaman aluminium. Menurut Delhaize & Ryan (1995), terdapat tiga kemungkinan mekanisme ekslusi Al yaitu, interaksi antara Al dengan protein kanal secara langsung, interaksi dengan reseptor spesifik pada permukaan membran, dan Al memasuki sitoplasma kemudian mengaktifkan jalur transduksi sinyal untuk membuka protein kanal.
19
5
SIMPULAN DAN SARAN
Simpulan
Transformasi genetik padi dengan gen PaCS telah berhasil dilakukan, dengan efisiensi transformasi dan regenerasi tunas yaitu sebesar 35,8% dan 15,1% untuk Nipponbare sedangkan Kasalath 2% dan 0%. Penambahan cefotaksim sebesar 200 mg/L pada media regenerasi (2N6R) dapat menurunkan daya regenerasi tunas padi. Gen PaCS yang terintegrasi ke dalam genom padi Nipponbare transgenik berhasil dikonfirmasi pada nomor 10, sedangkan nomor 1 sampai 9 mengalami pemotongan pada bagian tengah, dengan menghasilkan amplikon setengah (900pb) dari ukuran sebenarnya (1630pb). Hasil amplifikasi dari promoter 35S-CaMV sampai pada terminator Nos pada gen PaCS menghasilkan amplikon sebesar 1800 pb untuk tanaman transgenik nomor 10, sedangkan pada tanaman transgenik nomor 1 sampai 9 tidak mengamplifikasi kombinasi primer tersebut.
Saran
Peningkatan efisiensi regenerasi kalus menjadi tunas transgenik putatif perlu dilakukan dengan menggunakan media regenerasi tanpa penambahan antibiotik baik higromisin atau cefotaksim.
Uji tantang tanaman padi transgenik dengan cekaman aluminium perlu dilakukan untuk mengetahui aktifitas gen PaCS. Pada konstruksi vektor ekspresi gen, sebaiknya gen target ditempatkan pada posisi bagian kanan (right border) dari T-DNA untuk memastikan supaya gen target dapat terintegrasi terlebih dahulu pada genom tanaman.
DAFTAR PUSTAKA
[PBS]. Badan Pusat Statistik (ID). 2013. Tanaman Pangan. [online]. http://www.pbs.go.id/tnmn_pgn.php
Abe T, Futsugara Y. 1985. Efficient plant regeneration by somatic embryogenesis from root callus tissues of rice. J Plant Physiol. 121: 111–118
Abreu CH, Muraoka T, Lavorante AF. 2003. Exchangeable aluminum evaluation in acid soils. Sci Agric. 60:543–548.
Achary VMM, Panda BB. 2010. Aluminium-induce DNA damage and adaptive response to genotoxic stress in plant cells are mediated through reactive oxygen intermediates. Mutagenesis. 25:201–209
Aguda RM, Datta K, Tu J, Datta SK, Cohen MB. 2001. Expression of Bt genes under control of different promoters in rice at vegetative and flowering stages. IRRN. 26(1).
20
Anoop VM, Basu U, McCammon MT, McAlister-Henn L, Taylor GJ. 2003. Modulation of citrate metabolism alters aluminium tolerance in yeast and transgenic canola overexpressing a mitochondrial citrate synthase. Plant Physiol. 132:2205-2217.
Appana VD, Hamel RD, Levasseur R. 2002. The metabolism of aluminum citrate and biosynthesis oxalic acid in Pseudomonas flourescens. Curr Microbiol 47(1):32-39.
Ariani, Mewa. 2010. Diversifikasi konsumsi pangan pokok mendukung swasembada beras. Proseding pecan serealia Nasional. Banten: PBTP. ISBN:978-979-8940-29-3.
Babourina O, Ozturk L, Cakmak I, Rengel Z. 2006. Reactive oxygen species production in wheat roots is not linked with changes in H+ fluxes during acidic and aluminum stresses. Plant Signal Behav. 1:70–75.
Barbier-Brygoo H, Vinauger M, Colcombet J, Ephritikhine G, Frachisse JM, Maurel C. 2000. Anion channels in higher plants: functional characterization, molecular structure and physiological role. Biochim Biophys Acta. 1565:199– 218.
Barcelo´ J, Poschenrieder C. 2002. Fast root growth responses, root exudates, and internal detoxification as clues to the mechanisms of aluminium toxicity and resistance: a review. Environ Exp Bot. 48:75–92.
Beeckmans S. 1984. Some structural and regulatory aspects of citrate syntase. Int J Biochem. 16(4): 341-351.
Cao J, Duan X, McElroy D, Wu R. 1992. Regeneration of herbicide resistant transgenic rice plants following microprojectile-mediated transformation of suspension culture cells. Plant Cell. 11:586- 59.
Chen ZC, Yamaji N, Motoyama R, Nagamura Y and, Ma JF. 2012. Up-regulation of a magnesium transporter gene OsMGT1 is required for conferring aluminum tolerance in rice. Plant Physiol. 159(4):1624-1633.
Cheng X, Sardana R, Kaplan H, Altosaar I. 1997. Agrobacterium-transformed rice plants expressing synthetic cryIA(b) and cryIA(c) genes are highly toxic to striped stem borer and yellow stem borer. PNAS. 95(6):2767–2772.
Christou P, Ford TL, Kofron M. 1991. Production of transgenic rice (Oriza sativa L.) plants from agronomically important indica and japonica varieties via electric discharge particle acceleration of exogenous DNA into immature zygotic embryos. Nat Biotechnol. 9:957-962.
Datta SK, Datta K, Soltanifar N, Donn G, Potrykus I. 1992. Herbicide-resistant Indica rice plants from IRRI breeding line IR72 after PEG-mediated transformation of protoplasts. Plant Mol Biol. 20(4):619-629.
Daud RF. 2013. Introduksi gen sitrat sintase ke dalam rumput laut Kappaphycus alvarezii menggunakan Agrobacterium tumefaciens [tesis]. Bogor (ID): Institut Pertanian Bogor.
Davis LMM. 2012. Transformasi genetik padi japonica (Oriza sativa L. Subsp. japonica) dengan gen penyandi superoksida dismutase dari Melastoma malabatricum menggunakan perantara Agrobacterium tumefaciens [tesis]. Bogor (ID): Institut Pertanian Bogor.
21 Delhaize E, Ryan P, Randall P. 1993. Aluminum tolerance in wheat (Triticum
aestivum L.) II. Aluminum-stimulated excretion of malic acid from root apices. Plant Physiol. 103:695–702
Delhaize E, Ryan PR, 1995. Aluminum toxicity and tolerance in plants. Plant Physiol. 107:315-321.
Deng W, Luo K, Li Z, Yang Y, Hu N, Wu H. 2009. Overexpression of Citrus junos mitochondrial citrate synthase gene in Nicotiana benthamiana confers aluminum tolerance. Planta. 230(2):355-365.
Dewi, I.S. dan B.S. Purwoko. 2008. Role of polyamines in inhibition of ethylene biosynthesis and their effects on rice anther culture development. Indo J. Agric Sci. 9(2):60-67.
Donald LJ, Molgat GF, Duckworth HW. 1989. Cloning, sequencing, and expression of the gene for NADH sensitive citrate synthase of Pseudomonas aeruginosa. J. of Bact. 171(10):5542-5550.
Eticha D, Staß A, Horst WJ. 2005. Localization of aluminium in the maize root apex: can morin detect cell wall-bound aluminium? J. Exp Bot. 56:1351–1357. Fitriah N. 2013. Transformasi genetik padi (Oriza sativa L.) dengan gen penyandi
metallothionein tipe II dari Melastoma malabatricum L. menggunakan perantara Agrobacterium tumefaciens [tesis]. Bogor (ID): Institut Pertanian Bogor.
Ge, Chu XZ, Lin Y, Wang S. 2006. A tissue culture system for different germplasms of Indica rice. Plant CellRep. 25:392-402.
Guo P, Bai G, Carver B, Li R, Bernardo A, Baum M. 2007. Transcriptional analysis between two wheat near-isogenic lines contrasting in aluminum tolerance under aluminum stress. Mol Genet Genomics. 277:1–12.
Hiei Y, Komari T and Kubo T. 1997. Transformation of rice mediated by Agrobacterium tumefaciens. Plant Mol Biol. 35:205-218.
Hiei Y, Komari T. 2008. Agrobacterium-mediated transformation of rice using immature embryos or calli induced from mature seed. Nature Protocols 3(5):824-834.
Hiei Y, Ohta S, Komari T, Kumashiro T. 1994. Efficient transformation of rice (Oriza sativa L.) mediated by Agrobacterium and sequence analysis of the boundaries of the T-DNA. Plant J. 6(2):271-282.
Hong HP, Zhang H, Olhoft P, Hill S, Wiley H, Toren E, Hillebrand H, Jones T, Cheng M. 2007. Organogenic callus as the target for plant regeneration and transformation via Agrobacterium in soybean (Glycine max (L.) Merr.). In Vitro Cellular & Developmental Biology Plant. 43:558-568.
Hopkins, William G. 2006. Photosynthesis and Respiration. Chelsea House. Publishers. New York. 168 p.
Holford P, Newbury HJ. 1992. The effects of antibiotics and their breakdown products on the in vitro growth of Antirrhinum majus, Plant Cell. 11:93-96. Hue NV, Craddock GR, Adam F. 1986. Effect of organic acids on aluminum
toxicity in Subsoil. Soil Sci Am J. 20: 28-34.
22
Jones DL, Ryan PR. 2004. Nutrition/aluminum toxicity. In: Murphy D, Murray B, Thomas B (eds) Encyclopedia of Applied Plant Science. Academic Press, London, pp 656–664.
Kato S, Kosaka H, Hara S. 1928. On the affinity of rice varieties as shown by the fertility of hybrid plants. Bull Sci Facult Terkult Kyushu Imp Univ. 3:132-147. Kaur-sawhney R, Flores HE, Galston AW. 1979. Polyamine-induced DNA
synthesis and mitosis in oat leaf Protoplasts. Plant Physiol. 65:368-371.
Kazemi EM, Jonoubi1 P, Majd A, Pazhouhandeh M. 2014. Reduction of negative effects of cefotaxime in tomato transformation by using FeEDDHA. Intl J. Farm & Alli Sci. 3(5):538-542.
Khanna HK, Raina SK. 1999. Agrobacterium-mediated transformation of indica rice cultivars using binary and super binary vectors. Aust. Plant Physiol. 26:311-324.
Kinraide TB. 1990. Assessing the rhizotoxicity of the aluminate ion, Al(OH)-4.
Plant Physiol. 94:1620–1625.
Kochian LV. 1995. Cellular mechanisms of aluminum toxicity and resistance in pland. Annu Rev Plant Biol. 46:237-260.
Koetije DS, Grimes HD, Wang YC, Hodes TK. 1989. Regeneration of indica rice (Oryza sativa L.) from primary callus derived from immature embryos. Plant Physiol. 135:184–190.
Kopittke PM, Blamey FPC, Menzies NW. 2008. Toxicities of soluble Al, Cu, and La include rupture on rhizodermal and root critical cells of cowpea. Plant Soil 303:217–227.
Koyama H, Takita E, Kawamura A, Harai T, Shibata D. 1999. Overexpression of mithochondria citrate synthase gene improves the growth of carrot cells in Al-phosphate medium. Plant Cell Physiol. 40(5): 482-488.
Kusnadi N, Tinaprilla N, Susilowati SH, Purwoto A. 2011. Analisis efisiensi usahatani padi di beberapa sentra produksi padi di Indonesia. Jurnal Agro Ekonomi. 29(1):25–48.
Lee K, Jeon H, Kim M. 2002. Optimization of a mature embryo-based in vitro culture system for high-frequency somatic embryogenic callus induction and plant regeneration from japonicarice cultivars. Plant Cell. 71:237–244.
Lestari EG, Yunita R. 2008. Induksi Kalus dan Regenerasi Tunas Padi Varietas Fatmawati. Bul Agron. 36(2):106–110.
Li XF, Ma JF, Matsumoto H. 2002. Aluminum-induced secretion of both citrate and malate in rye. Plant Soil. 242:235–243.
Li Z, Burow MD, Murai N. 1990. High frequency generation of fertile transgenic rice plants after PEG-mediated protoplast transformation. Plant Mol Biol. 8(4):276-291.
Lin W, Anuratha CS, Datta K, Potrykus I, Muthukrishnan S, Datta SK. 1995. Genetic Engineering of Rice for Resistance to Sheath Blight. Nature Biotechnology. 13:686-691.
Lin YJ, Zhang Q. 2005. Optimising the tissue culture conditions for high efficiency transformation of Indica rice. Plant Cell Rep. 23:540-547.
23 Mailloux RJ, Lemire J, Kalyuzhnyi S, Appanna V. 2008. A novel metabolic
network leads to enhanced citrate biogenesis in Pseudomonas flourescens exposed to aluminum toxicity. Extremophiles. 12: 451-459.
Marlina N, Saputro EA, Amir N. 2012. Respon tanaman padi (Oryza sativa L.) terhadap takaran pupuk organik plus dan jenis pestisida organik dengan system of rice intensification (SRI) di lahan pasang surut. Jurnal Lahan Suboptimal. 1(2):138-148.
Marwati T, Rusli MS, Mulyono E. 2007. Pemucatan minyak daun cengkeh dengan metode khelasi menggunakan asam sitrat. J. Tek Ind Pert. 17(2),61-68. Massonneau A, Langlade N, Leon S, Smutny J, Vogt E, Neumann G, Martinoia E.
2001. Metabolic changes associated with cluster root development in white lupin (Lupinus albus L.): relationship between organic acid excretion, sucrose metabolism and energy status. Planta. 213:534–542.
Masuda K, Kudo-Shiratori A, Inoue M. 1989. Callus transformation and plant regeneration from rice protoplasts purified by density gradient centrifugation. Plant Sci. 62:337–246.
Mathias RJ, Boyd LA. 1986. Cefotaxime stimulates callus growth, embryogenesis and regeneration in hexaploid bread wheat (Triticum aestivum L. EM. THELL). Plant Sci. 46:217-223.
Matsumoto H, Motoda H. 2012. Aluminum toxicity recovery processes in root apices. possible association with oxidative stress. Plant Sci 185-186:1-8.
Meneses A, Flores D, Munoz M, Arrieta G, Espinosa AM. 2005. Effect of 2.4-D, Hydric stress and light on indica rice (Oryza sativa) somatic embryogenesis. Rev Biol Trop (Int J) 53(3-4):361-368.
Meriga B, Reddy BK, Rao KR, Reddy LA, Kishor Kavi PB. 2004. Aluminum-induced production of oxygen radicals, lipids peroxidation and DNA damage in seedling of rice (Oryza sativa). J. Plant Physiol. 161:63–68.
Mitchell CG. 1996. Identification of multienzyme complex of the tricarboxylic acid cycle enzymes containing citrate synthase isoenzymes from Pseudomonas aeruginosa. Biochem J. 313:769-774.
Miyasaka SC, Hue NV, Dunn MA. 2006. Aluminum. In Baker AV, Pilbeam DJ (eds). Handbook of Plant Nutrition. CRC Press. 632 pp.
Morinaga T, Kuriyama H. 1958. Intermediate type of rice in the subcontinent of India and Java. Jap. J. Breeding 7:253-259.
Mossor-Pietraszewska T. 2001. Effect of aluminum on plant growth and metabolism. Acta Biochim Pol. 3:367–686.
Mulyani A, Hikmatullah, Subagyo H. 2004. Karakteristik dan potensi tanah masam lahan kering di Indonesia. hlm. 1-32 dalam Prosiding Simposium Nasional Pendayagunaan Tanah Masam. Pusat Penelitian dan Pengembangan Tanah dan Agroklimat, Bogor.
Neumann G, Massonneau A, Martinoia E, Romheld V. 1999. Physiological adaptations to phosphorous deficiency during proteoid root development in white lupins. Planta. 208:373–382.
Nishimura A, Aichi I, Matsuoka M. 2006. A protocol for Agrobacterium -mediated transformation in rice. Nature Protocols. 6(1):2796-2802