TRANSFORMASI GENETIK PADI INDICA (Oryza sativa L.
Subsp. Indica) CV. KASALATH dengan GEN MmCu/Zn-SOD
PENYANDI SUPEROKSIDA DISMUTASE
EFA RIANA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Transformasi Genetik Padi Indica (Oryza sativa L. Subsp. Indica) cv. Kasalath dengan gen MmCu/Zn-SOD Penyandi Superoksida Dismutase adalah benar karya bersama saya dengan komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, November 2015
Efa Riana
RINGKASAN
EFA RIANA. Transformasi Genetik Padi Indica (Oryza sativa L. Subsp. Indica) cv. Kasalath dengan Gen MmCu/Zn-SOD Penyandi Superoksida Dismutase. Dibimbing oleh SUHARSONO dan UTUT WIDYASTUTI.
Peningkatan produksi padi nasional dapat ditempuh ekstensifikasi lahan pertanian ke lahan marginal. Permasalahan utama lahan marginal adalah cekaman abiotik yang menginduksi cekaman oksidatif pada tanaman sehingga menyebabkan produksi spesies oksigen reaktif (ROS) secara berlebih. ROS menyebabkan kerusakan sel karena menyebabkan terjadinya peroksidasi lipid, dan degradasi rantai DNA. Superoksida dismutase (SOD) dapat mendetoksifikasi ROS. Beberapa tanaman transgenik yang mengekspresikan gen MmCu/Zn-SOD
secara berlebihan mempunyai toleransi terhadap cekaman abiotik lebih tinggi daripada tanaman non-transgenik. Tujuan penelitian ini adalah untuk melakukan transformasi genetik padi Indica cv. Kasalath dengan gen MmCu/Zn-SOD
penyandi superoksida dismutase.
Biji matang padi Indica cv. Kasalath diinduksi menjadi kalus di media 2N6 yang mengandung 2 mg/l 2.4-D selama 7 hari di ruang gelap. Sebanyak 60 kalus hasil pemotongan dari 45 kalus direndam dalam suspensi A. tumefaciens
LBA4404 yang membawa plasmid pGWB-MmCu/Zn-SOD. Plasmid
pGWB-MmCu/Zn-SOD mengandung gen MmCuZn-SOD dibawah kendali promoter 35S CaMV. Kokultivasi dilakukan di media 2N6-AS yang mengandung 2 mg/l 2.4-D dan 20 mg/l asetosiringon berlangsung selama 3 hari dalam kondisi gelap. Kalus hasil transformasi diseleksi di media 2N6KH50 yang mengandung 50 mg/l higromisin dan diregenerasikan di media N6R yang mengandung 100 mg/L kinetin.
Efisiensi transformasi padi Indica kultivar Kasalath adalah sebesar 50%. Sebanyak 4 dari 30 kalus yang tahan higromisin menghasilkan 4 tunas yang beregenerasi sehingga efisiensi regenerasi pada penelitian ini adalah sebesar 13,3%. Analisis integrasi gen dengan PCR menggunakan primer spesifik untuk mendeteksi daerah antara promoter 35S CaMV dan gen MmCu/Zn-SOD
menunjukkan bahwa seluruh tanaman transgenik mengandung gen MmCu/Zn-SOD di bawah kendali promoter 35S CaMV. Analisis segregasi pada generasi T1 dan generasi T2 padi cv Kasalath transgenik menunjukkan bahwa resistensi terhadap higromisin yang disandi oleh gen hpt diwariskan kepada generasi berikutnya dengan mengikuti pola Mendelian dengan rasio 3 resisten : 1 sensitif. Rasio segregasi 3:1 mengindikasikan bahwa jumlah gen hpt yang terintegrasi ke dalam genom padi cv. Kasalath transgenik adalah satu salinan. Karena gen
MmCu/Zn-SOD terpaut dengan gen hpt, maka gen MmCu/Zn-SOD diwariskan secara stabil kepada generasi berikutnya dan hanya satu salinan yang terintegrasi di dalam genom padi cv. Kasalath transgenik.
SUMMARY
EFA RIANA. Genetic Transformation of Indica Rice cv. Kasalath with
MmCu/Zn-SOD Gene Encoding for Superoxide Dismutase. Supervised by SUHARSONO and UTUT WIDYASTUTI.
Rice production can be increased by extending area of cultivation to the marginal land. The main problem in marginal land is abiotic stress that induce oxidative stress in plants which causes over production and accumulation of reactive oxygen species (ROS). ROS causes cell damage through lipid peroxidation and DNA cleavage. Superoxide dismutase (SOD) can detoxify ROS. Several transgenic plants overexpressing MmCu/Zn-SOD genes excessively increase their tolerance to abiotic stress. The objective of this research is to transform genetically Indica rice cv. Kasalath by MmCu/Zn-SOD gene encoding superoxide dismutase.
The formation of callus was induced from mature seeds cultivated on the 2N6 media containing 2 mg/l, 2.4-D for 7 days in dark. A total of 60 calli derived from 40 initial calli was immersed in the A. tumefaciens LBA4404 suspension carrying plasmid pGWB-MmCu/Zn-SOD. Plamid pGWB-MmCuZn-SOD contains MmCu/Zn-SOD under the control of 35S CaMV promoter. Cocultivation was carried out on 2N6-AS media containing 2 mg/l 2.4-D and 20 mg/l acetosyringone for 3 days in the dark. Transformed calli were selected on 2N6KH50 media containing 50 mg/l hygromycin and regenerated on N6R media containing 100 mg/l kinetin.
Transformation efficiency of Indica rice cv. Kasalath was 50%. Four of 30 hygromycin resistant calli successfully regenerated to become 4 shoots, therefor the efficiency of regeneration was 13.3%. Gene integration analysis by PCR showed that all transgenic plants contain MmCu/Zn-SOD under control of 35S CaMV promoter. Segregation analysis in T1 and T2 generation showed that the resistance to higromycin encoded by hpt gene was stably inherited to the descendence following Mendelian pattern with 3 resistants : 1 sensitive ratio, indicates single copy of hpt gene integrated in the genom of transgenic rice cv. Kasalath. Since MmCu/Zn-SOD gene is linked to hpt gene, it can be concluded that MmCu/Zn-SOD gene is also stably inherited to the descendence following Mendelian pattern and only one copy of MmCu/Zn-SOD gene integrated into the genom of transgenic rice cv. Kasalath.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biologi Tumbuhan
TRANSFORMASI GENETIK PADI INDICA (Oryza sativa L.
Subsp. Indica) cv. KASALATH dengan GEN MmCu/Zn-SOD
PENYANDI SUPEROKSIDA DISMUTASE
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga penulis bisa menyelesaikan rangkaian penelitian dan
penulisan tesis yang berjudul “Transformasi Genetik Padi Indica (Oryza sativa L. Subsp. Indica) cv. Kasalath dengan gen MmCu/Zn-SOD Penyandi Superoksida Dismutase”. Penelitian ini didanai oleh Proyek Penelitian Desentralisasi Baru IPB dengan kontrak no:48/IT3.11/LT/2014 atas nama Prof Dr Ir Suharsono, DEA.
Terima kasih penulis sampaikan kepada Prof Dr Ir Suharsono, DEA dan Dr Ir Utut Widyastuti, MSi selaku komisi pembimbing yang telah banyak memberi perhatian dan bimbingan selama penelitian dan penulisan naskah tesis ini. Penulis juga menyampaikan terimakasih kepada Dr Ir Miftahuddin, MSi selaku Ketua Program Studi Biologi Tumbuhan dan Dr Hamim selaku penguji atas saran dan masukannya. Ungkapan terimakasih juga penulis sampaikan kepada Beasiswa Unggulan DIKTI tahun 2012, jajaran teknisi laboran Lab. Biologi Molekular dan Selular Tanaman dan Lab. BIORIN, PPSHB, IPB, khususnya Ibu Nia Dahniar, Ibu Pepi Elvavina, Pak Abdul Mulya, dan Pak Adi Supardi, rekan-rekan mahasiswa yang melakukan penelitian di laboratorium tersebut dan rekan-rekan mahasiswa Program Studi Biologi Tumbuhan Sekolah Pascasarjana IPB angkatan 2012, atas segala bantuan dan dukungan kepada penulis selama masa penelitian dan penyusunan tesis ini.
Ungkapan terimakasih yang sebesar-besarnya penulis sampaikan kepada keluarga tercinta, Bapak, Ibu, adik-adik dan suami, atas doa, dukungan dan kasih sayang yang selalu diberikan kepada penulis. Semoga Allah selalu melimpahkan RahmatNya.
Semoga karya ilmiah ini bermanfaat bagi pengembangan ilmu pengetahuan.
Bogor, November 2015
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
2 TINJAUAN PUSTAKA 2
Padi (Oryza sativa) 2
Mekanisme Transformasi Agrobacterium 3
Superoksida Dismutase 4
3 METODE 6
Waktu dan Tempat Penelitian
6Bahan Penelitian 7
Metode Penelitian 7
Induksi kalus embrionik 7
Infeksi A. tumefaciens dan kokultivasi 7
Seleksi 8
Regenerasi 8
Analisis integrasi transgen MmCu/Zn-SOD generasi T0 8
Analisis segregasi gen hpt 8
4 HASIL DAN PEMBAHASAN 9 Transformasi Padi Indica cv. Kasalath 9
Analisis Integrasi Transgen MmCu/Zn-SOD Generasi T0 12
Analisis Segregasi Gen hpt pada Generasi T1 dan Generasi T2 13
5 SIMPULAN DAN SARAN 15 Simpulan 15
Saran 15
DAFTAR PUSTAKA 15
LAMPIRAN 20
DAFTAR TABEL
1 Efisiensi transformasi dan efisiensi regenerasi padi Indica kultivar
Kasalath 11
2 Pola segregasi biji T1 padi Indica cv. Kasalath transgenik SOD 14 3 Pola segregasi biji T2 padi Indica cv. Kasalath transgenik SOD 14
DAFTAR GAMBAR
1 Proses transformasi genetik Agrobacterium tumefaciens ke sel tanaman 4
2 Peta daerah T-DNA plasmid pGWB-MmCu/Zn-SOD 7
3 Transformasi padi Indica cv. Kasalath 10
4 Analisis transgen MmCu/Zn-SOD padi Kasalath generasi T0 12 5 Tanaman padi Kasalath transgenik SOD yang menghasilkan biji T1 13 6 Analisis resistensi tanaman padi cv Kasalath pada media MS0H50 13
DAFTAR LAMPIRAN
1 Komposisi media AB plate 20
2 Komposisi media dasar N6 21
1
PENDAHULUAN
Latar Belakang
Padi (Oryza sativa L.) merupakan salah satu tanaman pangan yang sangat penting di dunia karena menyuplai kebutuhan pangan pokok hampir setengah penduduk dunia. Peningkatan jumlah penduduk di Indonesia berbanding lurus dengan meningkatnya permintaan pangan pokok beras. Untuk memenuhi kebutuhan tersebut perlu dilakukan peningkatan produksi beras nasional (Deptan 2010). Ekstensifikasi pertanian padi merupakan salah satu cara yang dapat ditempuh untuk meningkatkan produksi beras, namun akibat tingginya konversi lahan pertanian menjadi pemukiman penduduk dan kawasan industri mengharuskan ekstensifikasi dilakukan ke lahan marjinal. Lahan marginal merupakan lahan yang memiliki mutu rendah karena memiliki faktor pembatas diantaranya ketersediaan air dan unsur hara (Yuwono 2009). Luas lahan marjinal potensial untuk budidaya pertanian adalah 76,22 juta ha atau 52% dari total lahan kering yang ada di Indonesia (Abdurachman et al. 2008). Masalah utama lahan marjinal adalah cekaman abiotik seperti kekeringan, salinitas, suhu ekstrim, defisiensi hara dan toksisitas mineral yang membatasi pertumbuhan dan produktifitas tanaman padi. Cekaman abiotik menginduksi timbulnya cekaman oksidatif pada tanaman akibat produksi berlebih dan akumulasi spesies oksigen reaktif (ROS) (Boo dan Jung 1999; Lee et al. 2001; Yammamoto et al. 2001; Kuo dan Kao 2003; Sharma dan Dubey 2005; Chawla dan Jain 2012).
Spesies oksigen reaktif (ROS) merupakan bentuk oksigen yang tereduksi oleh elektron dan memiliki sifat yang sangat reaktif. Tingginya kadar ROS memberikan resiko terhadap modifikasi protein, kerusakan sel akibat peroksidasi lipid, degradasi untai DNA dan toksisitas metal, sehingga berpengaruh terhadap kelangsungan hidup organisme (Bowler et al. 1992). Kondisi ini tidak mendukung pertumbuhan padi secara maksimal sehingga perakitan padi toleran cekaman abiotik khususnya padi Indika perlu dilakukan. Padi Indika dibudidayakan di daerah tropis.
Superoksida dismutase (SOD) merupakan enzim antioksidan yang mampu menetralkan radikal bebas dengan mengkatalisis radikal superoksida menjadi molekul O2 dan H2O2 sehinggga SOD menjadi sistem pertahanan terhadap radikal superoksida dari spesies oksigen reaktif (Bowler et al. 1992; Fridovic 1995; Tseng
et al. 2008). Gen penyandi SOD telah diisolasi dari jagung (Cannon et al. 1987), tomat (Perl-Treves et al. 1988), Nicotiana plumbaginigolia (Alscher et al. 2002) dan Melastoma malabatricum L (Hannum 2011). Beberapa penelitian menunjukkan bahwa tanaman transgenik yang mengekspresikan gen SOD secara berlebihan mengalami peningkatan toleransi terhadap cekaman abiotik, contohnya tembakau toleran temperatur tinggi (Sen Gutpa et al. 1993), padi toleran salinitas (Tanaka et al. 1999) dan cabe toleran cekaman kekeringan (Chatzidimitriadou et al. 2009).
Gen utuh MmCu/Zn-SOD penyandi superoksida dismutase cuprum/zink (copper/zinc) sitosolik dari tanaman toleran aluminium, Melastoma malabatricum
2
untuk mengendalikan ekspresi gen MmCu/Zn-SOD telah berhasil dikonstruksi (Hannum 2011). Transformasi genetik padi dengan gen MmCu/Zn-SOD dari
Melastoma malabatricum diharapkan dapat menghasilkan tanaman transgenik yang lebih toleran terhadap cekaman abiotik.
Tujuan Penelitian
Tujuan penelitian ini adalah untuk mendapatkan tanaman padi Indica cv. Kasalath transgenik yang mengandung gen penyandi superoksida dismutase (MmCu/Zn-SOD) dari Melastoma malabactricum melalui transformasi genetik dengan perantara Agrobacterium tumefaciens.
Manfaat Penelitian
Padi transgenik yang diperoleh dari penelitian ini dapat ditanam di lahan marginal sehingga dapat meningkatkan produksi secara nasional. Gen MmCu/Zn-SOD yang terdapat di dalam tanaman padi cv. Kasalath transgenik dapat dipindahkan ke tanaman padi yang mempunyai sifat unggul melalui persilangan konvensional untuk menghasilkan padi unggul yang dapat ditanam di lahan marginal.
2 TINJAUAN PUSTAKA
Padi (Oryza sativa)
Padi merupakan tanaman pangan yang paling luas dibudidayakan di dunia dan menyuplai kebutuhan pangan pokok hampir setengah penduduk dunia. Total konsumsi beras dunia pada tahun 2014 sebesar 415.5 juta ton. FAO (2014) menerbitkan data produksi padi dunia mengalami penurunan sebesar 0.4% lebih rendah dari tahun 2013 dikarenakan kondisi cuaca yang tidak menentu seperti musim hujan yang disertai banjir atau musim kering dalam waktu yang lama. Kondisi ini menyebabkan sebagian besar negara produsen utama dibagian utara mengalihkan lahan untuk penanaman palawija. Rekayasa genetika tanaman padi dengan gen target penyandi resistensi terhadap cekaman biotik maupun abiotik bisa menjadi solusi untuk meningkatkan produksi padi dalam waktu singkat (Ignacimuthu et al 2000).
Padi merupakan tanaman serealia semusim yang tergolong kedalam ordo Oryzeae, famili Poaceae yang terdiri atas 12 genus. Oryza merupakan salah satu genus yang paling banyak dibudidayakan. Genus Oryza diperkirakan terdiri atas 22 spesies, 20 diantaranya merupakan spesies liar dan dua lainnya, Oryza glaberrima dan Oryza sativa adalah spesies yang dibudidayakan. Oryza sativa
3
Oryza sativa didomestikasi pertamakali di Asia Tenggara, India dan Cina antara 8000 hingga 150000 tahun yang lalu (Normile 2004). Padi ditanam oleh lebih dari 110 negara. Padi Indica tersebar didaerah tropis sedangkan padi
japonica tumbuh dengan baik di iklim sub tropis. Luas areal pertanian padi sebesar 10% dari total lahan pertanian dunia (144 juta ha). Berdasarkan sistem budidaya, padi dikelompokkan kedalam empat ekosistem yaitu padi gogo (upland), padi sawah irigasi (submerged rice), padi sawah tadah hujan (lowland) dan padi rawan banjir (floodprone) (Khush 1997).
Mekanisme Transformasi Agrobacterium
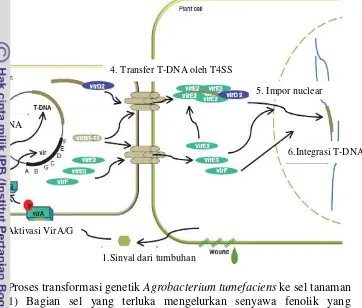
Agrobacterium tumefaciens banyak dimanfaatkan oleh ahli biologi tanaman pada studi genetika molekuler untuk mengintroduksi DNA ke sel tanaman. Sel tanaman ditransformasi dengan Agrobacterium tumefaciens dengan memindahkan potongan DNA dari plasmid Ti (tumor inducing) (Gambar 1). Plasmid Ti ditemukan hanya dalam persentase kecil pada populasi A.tumefaciens yang ada di tanah. Potongan DNA merupakan segmen salinan yang disebut T-DNA (transferred DNA). T-DNA dibatasi oleh 25 pasang basa berulang yang mengapit T-DNA. Secara alami T-DNA menyandi enzim untuk sintesis zat pengatur tumbuh tanaman, menghasilkan senyawa penyebab terbentuknya tumor, dan mensintesis opin. Opin mampu merangsang konjugasi plamid Ti sehingga meningkatkan populasi bakteri yang bisa memanfaatkan opin (Greene dan Zambryski 1993). Opin merupakan senyawa turunan asam amino yang digunakan secara ekslusif oleh A. tumefaciens sebagai sumber nitrogen (Tzfira dan Citovski 2006).
Proses transfer T-DNA ke genom tanaman dimediasi oleh protein-protein yang disandi daerah virulensi (vir) (Stachel dan Nester 1986). Gen-gen virulensi yang terlibat dalam proses transformasi diatur secara ketat sehingga ekspresi terjadi hanya pada daerah sel tumbuhan yang luka akibat infeksi A. tumefaciens.
Ekspresi gen dikontrol oleh gen VirA dan VirG, dua protein yang berperan dalam sistem regulasi. Protein dari virA ini akan menginduksi fosforilasi produk dari
virG (Zupan dan Zambrysk 1995). Pada proses penginderaan sinyal, histidin kinase VirA mengaktifkan protein VirG dengan mentransfer fosfat ke asprartat VirG. VirG yang terfosforilasi berikatan spesifik dengan segment promoter gen
vir berukuran 12 bp sehingga mengaktifkan VirG sebagai faktor transkripsi (Brencic dan Winans 2005). Senyawa fenol seperti asetosiringon dan gula berfungsi untuk induksi gen vir (Shimoda et al. 1990). Induksi gen vir
mengawali proses transfer utas sekuen DNA dari plasmid Ti. Utas sekuen T-DNA akan dikenali dan dipotong oleh protein VirDI dan VirD2 yang memiliki aktivitas endonuklease. Protein VirD2 tetap terikat kovalen pada ujung 5’ utas T-DNA setelah pemotongan dari plasmid Ti. VirD2 berperan melindungi T-T-DNA dari aktivitas endonuklease dan menentukan batas ujung 5’ T-DNA yang akan ditransfer kedalam sel tanaman (de la Riva et al. 1998).
Proses pemindahan T-DNA ke nukleus sel tumbuhan dimediasi oleh sinyal lokasi inti atau nucleus location signals (NSL) pada VirD2 dan VirE2 mengarahkan kompleks T-DNA ke nukleus. Tahap terakhir adalah integrasi T-DNA ke dalam genom tanaman inang melalui kompleks pori nukleus atau
4
sel inti melibatkan peran VirE2 yang mengandung dua daerah NSL sebagai DNA transorporter transmembran (Duckely et al, 2005 ; Tzfira dan Citovsky 2006). Mekanisme molekuler intergrasi T-DNA ke sel inti tanaman inang belum dideskripsikan secara jelas. Integrasi terjadi kemungkinan melalui rekombinasi antara utas ganda T-DNA dengan genom sel inang (Tzfira dan Citovsky 2005).
.
Gambar 1 Proses transformasi genetik Agrobacterium tumefaciens ke sel tanaman 1) Bagian sel yang terluka mengelurkan senyawa fenolik yang ditangkap oleh Vir A 2) Vir A mengaktifkan Vir G yang mengaktivasi gen gen Vir lainnya 3) Sintesis T-DNA dan ekspresi gen vir di
Agrobacterium 4) T-DNA dan protein Vir ditransfer ke sel tanaman melalui bakteri T4SS (type IV secretion system) untuk membentuk kompleks protein T-DNA 5) kompleks T-DNA ditransfer ke nucleus sel tanaman 6) T-DNA terintegrasi kedalam kromosom (Pitzschke dan Hirt 2010)
Superoksida Dismutase
Pembentukan spesies oksigen reaktif (ROS) memberikan dampak terhadap kerusakan sel tanaman. Spesies oksigen reaktif (ROS) diinisiasi dari berbagai cekaman lingkungan diantaranya suhu ekstrim, intensitas cahaya yang tinggi, kekeringan, salinitas tinggi, logam berat, dan berbagai racun dari herbisida. Sistem pertahanan tumbuhan dalam menangkal ROS adalah dengan meningkatkan aktivitas antioksidan baik berupa sistem antioksidan enzimatik maupun non enzimatik (Alscher et al. 2002). Antioksidan enzimatik meliputi semua enzim
1.Sinyal dari tumbuhan 2. Aktivasi VirA/G
3.Sintesis T-DNA
4. Transfer T-DNA oleh T4SS
5. Impor nuclear
5 yang memiliki aktivitas antioksidatif diantaranya superoksida dismutase (SOD), askorbat peroksidase (APX), katalase (CAT), glutation peroksidase (GPX), dan glutationin S-transferase (GST) (Mittler 2002).
Superoksida dismutase (SOD) merupakan enzim antioksidan yang ada di seluruh organisme aerob. SOD tersebar di kompartemen subseluler tempat ROS diproduksi. Produksi ROS meningkat melalui berbagai variasi cekaman ekstrim yang mengubah ROS menjadi molekul radikal bebas. Enzim SOD berperan menetralkan radikal bebas senyawa ROS dengan cara mengkatalisis reaksi ion superoksida menjadi oksigen (O2) dan hidrogen peroksida (H2O2). Aktivitas SOD diinduksi oleh berbagai bentuk cekaman. Cekaman diasumsikan sebagai mediator utama dalam regulasi gen SOD. Pengaruh cekaman tertentu terhadap ekspresi gen
SOD diatur oleh situs subseluler dimana cekaman oksidatif dihasilkan (Bowler et al.1992). Penelitian pada Nicotiana plumbaginifolia, menunjukkan respon MnSOD mitokondria meningkat terhadap pembentukan radikal di mitokondria, sedangkan respon FeSOD kloroplas meningkat terhadap radikal bebas yang terjadi di kloroplas (Tsang et al. 1991, Bowler et al. 1989). Induksi ekspresi SOD memerlukan faktor transkripsi tunggal. Protein OxyR pada Salmonella typhimurium merupakan regulator transkripsi hidrogen peroksida yang menginduksi aktivasi gen SOD pada saat teroksidasi (Greenberg et al. 1990)
Superoksida dismutase dikelompokkan kedalam tiga tipe berdasarkan kofaktornya yaitu : copper/zinc (Cu/Zn-SOD), Mangan (Mn-SOD) and besi (Fe-SOD). Setiap tipe terletak di kompartemen seluler yang berbeda. Fe-SOD terdapat di kloroplas, Mn-SOD terdapat di mitokondria dan peroksisom, dan Cu/Zn-SOD terdapat di kloroplas, sitosol dan kemungkinan diruang ekstraseluler (Mittler 2002). Metaloenzim SOD merupakan enzim intraseluler yang terdapat hampir disemua kompartemen subseluler organisme aerob. Superoksida dismutase rentan terhadap cekaman oksidatif yang diinisiasi dari berbagai bentuk cekaman lingkungan. Superoksida dismutase merupakan antioksidan utama dalam sistem pertahanan organisme dari efek keracunan dan peningkatan konsentrasi ROS (Gill dan Tuteja 2010).
Induksi SOD terhadap respon perubahan kondisi lingkungan yang beragam memperlihatkan bahwa SOD memainkan peranan penting dalam mekanisme pertahanan tumbuhan terhadap cekaman lingkungan. Fenomena ini memberikan prospek terhadap pengembangan agronomi tanaman melalui rekayasa genetik. Untuk melihat peran dari enzim ini, gen SOD harus diekspresikan dan aktivitas enzim harus ditingkatkan. Teknologi antisense dan rekayasa promoter diperlukan dalam rekayasa tanaman trasgenik (Bowler et al.
1992). Beberapa tanaman transgenik dengan ekspresi berlebih gen SOD telah berhasil dikembangkan dalam rangka meningkatkan toleransi ketahanan terhadap cekaman oksidatif yang disebabkan oleh ozon, suhu dingin, kekeringan dan cekaman aluminium (Van Camp et al. 1994; McKersie et al. 1996; McKersie et al. 1999; Basu et al. 2001). Beberapa studi menunjukkan adanya korelasi antara aktivitas enzim antioksidan dan toleransi cekaman oksidatif, dimana ekspresi berlebih gen SOD dapat memacu toleransi terhadap stress oksidatif jika satu atau lebih enzim antioksidan seperti APX, dehidroaskormat reduktase dan monodehidrosiaskorbat reduktase juga ada dalam kosentrasi tinggi (Foyer et al.
6
peroksidase ditemukan sebagai kunci utama dalam mengelola cekaman oksidatif pada padi gogo yang disebabkan oleh kekeringan (Srivalli et al. 2003).
Ekspresi berlebih SOD mampu meningkatkan sistem pertahanan terhadap cekaman yang spesifik. Ekspresi berlebih aktivitas Mn-SOD pada kloroplas daun tembakau mampu melindungi daun dari kerusakan akibat cekaman oksidatif yang disebabkan ozon (Van Camp et al. 1994). Dua klon alfalfa (Medicago sativa) yang ditansformasi dengan Mn-SOD yang ditargetkan ke mitokondria memperlihatkan peningkatan aktivitas Mn-SOD terhadap cekaman musim dingin dibandingkan dengan aktivitas Cu/Zn-SOD pada mitokondria (McKersie et al.
1999). Pengamatan terhadap tanaman tomat yang ditransfer gen Cu/Zn-SOD pada kloroplas dan sitosol, menunjukkan bahwa gen Cu/Zn-SOD pada sitosol memperlihatkan ekspresi toleransi lebih tinggi dibandingkan gen Cu/Zn-SOD pada kloroplas (Perl et al. 1993). Tanaman alfalfa transgenik (Medicago sativa) Mn-SOD memperlihatkan toleransi signifikan terhadap cekaman kekeringan setelah 3 tahun uji coba lapangan (McKersie et al. 1996). Peningkatan aktivitas mangan superoksida dismutase juga terlihat pada akar tanaman gandum (Triticum aestivum) transgenik yang dipapar dengan 100 µM aluminium (Basu et al. 2001).
Aktivitas isozim superoksida dismutase dapat diketahui dengan identifikasi berdasarkan sensitivitas terhadap KCN dan H2O2. Setiap kelompok SOD memiliki sensitivitas yang berbeda untuk kedua inhibitor tersebut. Kelompok Mn-SOD memiliki aktivitas yang resisten terhadap kedua inhibitor, Cu/Zn-SOD sensitif terhadap kedua inhibitor, sedangkan Fe-SOD sensitif terhadap inhibitor H2O2 dan resisten terhadap KCN (Gill dan Tuteja 2010). Gen utuh penyandi copper/zinc superoksida dismutase sitosolik dari tanaman pengakumulasi aluminium (Melastoma malabactricum) telah berhasil diisolasi. Gen MmCuZn-SOD memiliki ukuran 824 pb, terdiri dari 459 pb open reading frame (ORF) yang menyandi 152 asam amino. Gen MmCuZn-SOD diekspresikan pada jaringan akar, batang dan daun (Hannum 2011).
Aktivitas SOD pada tanaman transgenik akan mengubah keseimbangan O2./H202 didalam sel, dan ini akan menambah atau mengurangi pembentukan OH·. Hal ini selanjutnya akan menentukan apakah perubahan rekayasa genetika gen SOD menguntungkan atau merugikan bagi tanaman. Jika pertahanan tanaman terhadap stress oksidatif dapat diperkuat dengan introduksi gen baru dan semua komponen fisiologi terjaga seimbang, toleransi terhadap cekaman kemungkinan akan meningkat (Bowler 1992). Manipulasi sistem pertahanan terhadap cekaman sebaiknya dilakukan disemua komponen enzim antioksidan untuk memperoleh pertahanan terhadap cekaman yang kuat (Shaaltiel dan Gressel 1986).
3 METODE
Waktu dan Tempat Penelitian
7 LPPM IPB Bogor dan Laboratorium Biotechnology Research Indonesia–The Netherlands (BIORIN).
Bahan Penelitian
Benih padi yang digunakan adalah padi Indica cv. Kasalath koleksi laboratorium BIORIN IPB. Bakteri yang digunakan untuk transformasi adalah
Agrobacterium tumefaciens strain LBA4404 yang membawa plasmid
pGWB-MmCu/Zn-SOD. Plasmid pGWB-MmCu/Zn-SOD mengandung MmCu/Zn-SOD dibawah kendali promoter 35S CaMV di dalam daerah T-DNA. Peta T-DNA di plasmid pGWB-MmCu/Zn-SOD disajikan pada Gambar 2 (Hannum 2011).
Gambar 2. Peta daerah T-DNA yang terdapat di plasmid pGWB-MmCu/Zn-SOD. RB=right border, Pnos::NPTII = gen marka seleksi neomycin phosphotransferase II; P-35S= promoter konstitutif 35S CaMV;
MmCu/Zn-SOD= gen penyandi superoksida dismutase; AttB1 dan AttB2= situs rekombinasi sistem gateway; sGFP= gen green flourescent protein; Tnos= Terminator nopaline synthase ; 35S::HPT = gen hygromycim phosphotransferase dibawah kendali promoter 35S CaMV; LB= left border (Hannum 2011)
Metode Penelitian
Induksi kalus embrionik
Gabah padi dikupas lalu bijinya dicelupkan ke dalam etanol 70% selama 1 menit, kemudian dibilas dengan akuades steril sebanyak 2 kali. Selanjutnya biji padi direndam dalam larutan sodium hipoklorit (NaOCl) 2% yang dicampur 1 tetes tween-20 selama 60 menit sambil digoyang. Biji padi dibilas dengan akuades steril sebanyak lima kali, dan ditiriskan di tisu steril. Biji padi ditanam di media induksi kalus 2N6 (garam dan vitamin N6, 0.1 g/l myo-inositol, 30 g/l sukrosa, 0.5 g/l casamino acid, 0.5 g/l prolin, 2 mg/l 2.4-D, 4 g/l gelrite, dan pH 5.8) selama 7 hari di ruang gelap dengan suhu 28 oC (Hiei dan Komari 2008). Kalus yang diperoleh dipisahkan dari biji dan tunas yang terbentuk. Kalus yang berdiameter lebih dari 1 cm dipotong menjadi 2 atau 4 bagian. Kalus selanjutnya ditanam di media 2N6 baru selama 3 hari pada suhu 28 0C dalam kondisi terang sebelum ditransformasi.
Infeksi A. tumefaciens dan kokultivasi
Bakteri A.tumefaciens LBA4404 yang membawa plasmid
8
dan Michayluk, sukrosa 20 g/l, asetosiringon 20 mg/l), hingga suspensi inokulum mencapai nilai 0.01 pada OD600. Kalus yang berukuran 0.5–1 mm direndam dalam suspensi A.tumefaciens selama 10 menit. Selanjutnya kalus ditanam di media kokultivasi 2N6-AS (N6, 20 g/l sukrosa, 10 g/l glukosa,0.5 g/l casamino acid, 2 mg/l 2.4-D, 20 mg/l asetosiringon, 4 g/l gelrite, dan pH 5.8) selama 3 hari pada suhu 25 0C dalam kondisi gelap. Komposisi media dasar N6 disajikan pada Lampiran 2.
Seleksi
Kalus hasil kokultivasi dicuci dengan akuades steril sebanyak 5 kali, kemudian kalus direndam di dalam akuades steril yang mengandung 200 mg/l cefotaximee selama 15 menit. Kalus ditiriskan di tisu steril, kemudian kalus ditanam di media seleksi 2N6KCH50 (Lampiran 3) selama 14 hari pada suhu 28 0 10ml/L FeDTA 100x, 10xN6 major salt, 100xN6 minor salt, 100 mg/L kinetin, 4 gr/L gelrite, pH 5.8). Kalus dikultur selama 4 minggu pada suhu 28 0C dalam kondisi terang. Kalus disubkultur setiap 2 minggu ke media yang sama hingga terbentuk tunas dan akar. Planlet dipindahkan ke media pengakaran MS0 (30 g/l sukrosa, 3 gr/l gelrite, pH 5.8) dan ditumbuhkan selama 2 minggu, dalam kondisi terang (3000 lux) pada suhu 28 0C. Tanaman transgenik putatif generasi T0 yang diperoleh kemudian diaklimatisasi sebelum dipindah ke tanah. Efisiensi regenerasi dihitung menggunakan rumus :
Analisis integrasi transgen MmCu/Zn-SOD generasi T0
DNA tanaman padi Kasalath transgentik putatif diisolasi dari daun muda menggunakan metode cetyltrimethylammonium bromide (CTAB) (Suharsono & Widyastuti 2006). Analisis polymerase chain reaction (PCR) menggunakan primer spesifik untuk transgen MmCu/Zn-SOD dibawah kendali promoter 35S CaMVyaitu primer 35sF (forward): 5’-AAA CCT CCT CGG ATT CCA
TT-3’ dan primer MmSOD R2 (reserve): 5’-CAT CTC CAA CGG TGA CAT TG-3’ (Hannum 2011).
Analisis segregasi gen hpt
Tanaman Kasalath transgenik SOD generasi T0 yang membawa gen
MmCu/Zn-SOD ditanam di polibag dan dibiarkan melakukan penyerbukan sendiri Efisiensi Transformasi = Jumlah kalus resisten higromisin
Jumlah kalus yang diinfeksi A.tumefaciens x100%
Efisiensi Regenerasi = Jumlah tunas yang beregenerasi
9 hingga menghasilkan biji T1. Analisis segregasi dilakukan dengan menumbuhkan biji T1 yang telah disterilisasi di media MS0 padat yang mengandung 50 mg/l higromisin, pH 5.8 pada suhu 25 0C. Tanaman yang tumbuh dari biji T1 resisten higromisin ditanam di polibag dan dibiarkan melakukan penyerbukan sendiri hingga menghasilkan biji T2. Biji T2 dipanen terpisah untuk setiap individu. Pola segregasi gen hpt pada biji T2 ditentukan dengan menumbuhkan biji T2 di media MS0 mengandung 50 mg/l higromisin. Pengamatan resistensi terhadap higromisin dilakukan 10 hari setelah tanam. Keturunan dari tanaman transgenik heterozigot yang mengandung satu salinan gen hpt yang terintegrasi ke dalam genomnya, bersegregasi dengan perbandingan 3 resisten : 1 sensitif. Perbandingan 3:1 digunakan sebagai dasar uji chi square (χ2) dengan derajat bebas (df=n-1) dan nilai kesalahan 0.05. Nilai χ2 dihitung menggunakan rumus:
Keterangan :
Oi= nilai pengamatan fenotipe ke-i Ei= nilai harapan fenotipe ke-i n = jumlah genotipe
Jika nilai nilai χ2 hitung lebih kecil dari nilai χ2 tabel, maka populasi tersebut bersegrasi mengikuti perbandingan 3:1, dan sebaliknya.
4 HASIL DAN PEMBAHASAN
Transformasi Padi Indica cv. Kasalath
Proses tranformasi genetik padi dilakukan melalui beberapa tahap, dari induksi kalus dari biji di media 2N6 hingga aklimatisasi tanaman transgenik (Gambar 3). Pembengkakan daerah skutelum pada embrio terjadi 2–3 hari setelah biji dikulturkan di media 2N6. Skutelum selanjutnya berkembang menjadi kalus primer embrionik. Kalus embrionik dipisahkan dari biji dan tunas. Kalus yang terbentuk memiliki bentuk globular berwarna putih kekuningan berdiameter 0.5 – 1 cm (Hiei dan Komari 2008; Lestari dan Yunita 2008; Noor et al. 2011). Kalus yang berdiameter lebih dari 1 cm dipotong menjadi 2 atau 4 bagian kalus (Hiei dan Komari 2008). Kalus embrionik hasil pemotongan ditransformasi melalui perantara A.tumefaciens. Konsentrasi suspensi A.tumefaciens yang rendah (0,01 pada OD600) dalam 20 ml media MSLA mengandung 20 mg/l asetosiringon serta kokultivasi di media 2N6-AS mengurangi kerusakan pada kalus selama diinfeksi
10
Gambar 3 Tahapan transformasi genetik padi Indica cv. Kasalath. (A)= Induksi kalus embrionik dari biji matang, (B)= Kalus di media seleksi nN6CH50, (C)= Kokultivasi, (D)= Titik-titik hijau calon tunas muncul dari kalus (umur 2 minggu di media regenerasi), (E)= Planlet padi umur 4 minggu di media regenerasi, (F)= Aklimatisasi tanaman Kasalath transgenik putatif yang mengandung gen MmCu/Zn-SOD
Kalus hasil kokultivasi dicuci dengan akuades steril mengandung antibiotik 200 mg/l cefotaxime sebelum ditanam ke media seleksi yang mengandung 50 mg/l higromisin. Cefotaxime berperan dalam mengeliminasi A. tumefaciens yang berpengaruh terhadap efisiensi transformasi dan regenerasi (Tang et al. 2004). Efisiensi transformasi kalus embrionik diperoleh sebanyak 50% (Tabel 1). Efisiensi transformasi ditentukan berdasarkan rasio jumlah kalus yang tahan higromisin terhadap jumlah kalus yang ditransformasi. Beberapa penelitian menunjukkan bahwa padi Indica memiliki variasi pada efisiensi transformasi di antaranya 22% (Rashid et al.1995), 5.6-6.2% (Arockiasamy dan Ignacimuthu 2007), 2.0-7.6% (Nandakumar et al. 2007), 29% (Fitriah 2010), 14% (Mulyaningsih et al. 2010), dan 9.3% (Karthikeyan et al. 2011).
Efisiensi transformasi dipengaruhi oleh beberapa faktor yaitu pemilihan jaringan kultur, kondisi medium kultur, kondisi kokultivasi, dan regulasi antara faktor genetik dan faktor fisiologis (Hiei et al. 1994; Katiyar 1999; Saika dan Toki 2010). Pemilihan jenis jaringan yang akan ditransformasi merupakan langkah awal untuk mendapatkan keberhasilan persentase tinggi pada proses transformasi. Skutela biji padi matang merupakan material paling baik untuk ditransformasi dengan perantara Agrobaterium (Hiei et al. 1994). Perkembangan kalus embrionik untuk dapat bergenerasi dipengaruhi oleh konsentrasi 2.4-D dan komposisi agen pemadat. Konsentrasi 2.4-D paling baik digunakan untuk memacu proliferasi kalus yang efektif pada regenerasi adalah 2-2.5 mg/l. Agen
(A) (B)
(D) (E)
(C)
(F)
1 cm 1 cm 1 cm
11 pemadat (gelrite) yang optimum untuk pembentukan dan perkembangan kalus adalah berkisar 3-4 mg/l (Kumar et al. 2005). Konsentrasi 2.4-D yang rendah menyebabkan perkembangbiakan kalus terhambat, sedangkan konsentrasi 2.4-D yang tinggi menyebabkan sel kalus mengalami nekrosis (Karthikeyan et al. 2011). Keberhasilah transformasi juga ditentukan dari penambahan asetosiringon pada media kokultivasi dan pengaturan suhu kultur antara 22 0C dan 28 0C. Asetosiringon merupakan senyawa yang berperan dan menginduksi gen vir untuk mentransfer T-DNA ke genom tanaman target (Godwin et al. 1992; Hiei et al. Jumlah kalus yang di infeksi Agrobacterium (A) 60 Jumlah kalus resisten higromisin (B) 30 Jumlah tunas yang beregenerasi (D) 4
Efisiensi transformasi (B/A) (%) 50
Efisiensi regenerasi (D/B) (%) 13
Pembentukan tunas dari kalus yang tahan higromisin mulai teramati sejak minggu pertama di media regenerasi. Pembentukan tunas diawali dengan munculnya titik-titik hijau pada kalus. Titik hijau membesar membentuk tunas dan akar setelah 4 minggu. Planlet dipindah ke media MS selama 2 minggu tanpa zat pengatur tumbuh untuk pembesaran tanaman. Tanaman padi diaklimatisasi sebelum ditanam di media tanah.
Sebanyak 4 dari 30 kalus tahan higromisin menghasilkan 4 tunas yang beregenerasi sehingga diperoleh efisiensi regenerasi sebesar 13% (Tabel 1). Hal ini tidak jauh berbeda dengan hasil efisiensi regenerasi yang diperoleh dari penelitian sebelumnya yaitu 6.06% (Fitriah 2010), 14-29% (Mulyaningsih et al.
2010) dan 40- 60% (Saika dan Toki 2010). Efisiensi regenerasi ditentukan berdasarkan rasio jumlah kalus yang beregenerasi membentuk tunas terhadap jumlah kalus yang tahan higromisin (Saika dan Toki 2010). Efisiensi regenerasi pada padi yang ditransformasi dengan menggunakan media Agrobacterium
dipengaruhi beberapa faktor di antaranya pemilihan eksplan, komposisi hormon pada media yang digunakan, ketersediaan nutrisi, suhu, durasi kokultivasi, virulensi Agrobacterium, OD bakteri yang digunakan, konsentrasi antibiotik sebagai marker seleksi dan periode kultur jaringan (Katiyar et al. 1999; Carlos at al. 2004; Pipatpanukul et al. 2004; Saharan et al. 2004; Tyagi et al. 2007). Sebanyak 2 dari 4 tunas yang beregenerasi berhasil diaklimatisasi. Sebanyak 2 tanaman Kasalath transgenik yang diperoleh masing-masing dinamai OSK-SOD1 (Oryza sativa cv. Kasalath SOD 1) dan OSK-SOD2 (Oryza sativa cv. Kasalath SOD 2).
12
aminosiklitol. Resistensi terhadap higromisin ditentukan oleh ekspresi gen am
yang terletak berdekatan dengan gen hpt dengan cara mengubah antibiotik dan struktural terkait higromisin. Keberadaan aminosiklitol fosfotransferase di
Escherichia coli menyebabkan bakteri ini resisten terhadap higromisin (Rao et al.
1983).
Analisis Integrasi Transgen MmCu/Zn-SOD Generasi T0
Identifikasi tanaman transgenik melalui deteksi keberadaan transgen
MmCu/Zn-SOD pada tanaman hasil transformasi dilakukan dengan PCR. Pasangan primer yang digunakan adalah 35S-F dan MmCu/Zn-SOD-R2 dengan ukuran fragmen DNA sebesar 633 pasang basa (pb) yang berasal dari amplifikasi
bagian ujung 3’ promoter 35S CaMV (363 pb) dan bagian ujung 3’ daerah penyandi gen MmCu/Zn-SOD (270 pb). Hasil PCR menunjukkan keberadaan transgen MmCu/Zn-SOD pada dua tanaman transgenik putatif generasi T0 (Gambar 4). Analisis PCR ini mendukung hasil seleksi kalus yang resisten di media selektif yang mengandung higromisin. Ekspresi gen MmCu/Zn-SOD
dibawah kendali promoter 35S CaMV efektif untuk meningkatkan ekspresi gen pada transformasi padi (Hiei et al. 1994).
1 cm
Gambar 4 Analisis integrasi MmCu/Zn-SOD padi Kasalath generasi T0 dengan PCR DNA. M = marka DNA 1 KB, 1 = Kasalath nontransgenik, 2= OSK-SOD1, 3 = OSK-SOD2.
Padi cv. Kasalath transgenik generasi T0 yang terintergrasi dengan gen
MmCu/Zn-SOD ditanam di polibag dan dibiarkan menyerbuk sendiri hingga menghasilkan biji T1 (Gambar 5). Biji T1 digunakan untuk analisis segregasi gen
hpt di media MS0 yang mengandung 50 mg/l higromisin. Generasi T0 pada tanaman transgenik setara dengan generasi F1 pada persilangan konvensional dan generasi T1 pada tanaman transgenik setara dengan generasi F2 pada persilangan konvensional. Oleh sebab itu, tanaman T1 akan mengalami segregasi.
M 1 2 3
633 pb
13
Gambar 5 Tanaman padi Kasalath transgenik SOD yang menghasilkan biji T1
Analisis Segregasi Gen hpt pada Generasi T1 dan Generasi T2
Biji T1 padi cv Kasalath transgenik OSK-SOD1 dan OSK-SOD2 hasil penyerbukan sendiri dievalusi untuk ketahanan higromisin. Biji T1 yang resisten dan sentitif dibedakan secara jelas pada media seleksi yang terdiri dari MS0 yang mengandung 50 mg/l higromisin. Tanaman transgenik menunjukkan pertumbuhan normal, sedangkan tanaman nontransgenik mati setelah 10 hari di media seleksi (Gambar 6).
Gambar 6 Analisis resistensi tanaman padi cv Kasalath pada media MS0H50 yang mengandung 50 mg/l higromisin. (A)= Biji padi Kasalath nontrangenik, (B)= Biji T1 padi Kasalath transgenik SOD
Uji chi-square dengan tingkat kesalahan α=0.05, menunjukkan bahwa
segregasi biji generasi T1 bersegregasi mengikuti pewarisan mendelian dengan rasio 3 resisten :1 sensitif (Tabel 2). Hal ini menunjukkan bahwa jumlah gen hpt
yang tersisip ke dalam genom tanaman transgenik adalah satu salinan. Hasil segregasi dengan rasio 3:1 juga diperoleh pada padi Indica cv IR50 transgenik P5CS (Anoop dan Gupta 2003) dan padi Indica cv. ADT 43 transgenik P5CS (Karthikeyan et al. 2011).
(A) (B)
1 cm 1 cm
14
Tabel 2 Pola segregasi biji T1 padi Indica cv. Kasalath transgenik SOD
Biji T1
Untuk memperoleh transgenik homozigot, biji generasi T1 Kasalath transgenik OSK-SOD1 dan OSK-SOD2 yang resisten higromisin ditanam di pobilag dan dibiarkan melakukan penyerbukan sendiri hingga menghasilkan biji T2. Homozigositas atau heterosigositas pada generasi T2 dianalisis dengan uji ketahanan higromisin. Dari tiga tanaman transgenik, satu tanaman yaitu OSK-SOD12 menghasilkan keturunan T2 yang semuanya resisten higromisin (Tabel 3). Hal ini menunjukkan bahwa OSK-SOD12 adalah homozigot. Tanaman transgenik homosigot sangat penting untuk perbanyakan tanaman transgenik melalui biji. Semua biji hasil penyerbukan sendiri dari tanaman transgenik ini adalah transgenik, sehingga tidak memerlukan transgenik. Selain itu, tanaman transgenik homosigot dapat disilangkan dengan tanaman non-transgenik dalam rangka perakitan varietas hybrid tanpa melalui seleksi. Gen yang terdapat di tanaman transgenik homosigot lebih mudah dipindahkan ke tanaman lain daripada yang terdapat di tanaman transgenik heterosigot.
Tabel 3 Pola segregasi biji T2 padi Indica cv. Kasalath transgenik SOD
Biji T2
15
5
SIMPULAN
Simpulan
Transformasi genetik padi Indica cv. Kasalath dengan gen penyandi superoksida dismutase (MmCu/Zn-SOD) dari Melastoma malabatricum
menghasilkan 2 tanaman transgenik. Analisis pewarisan gen hpt ada generasi T1 dan generasi T2 dari padi Indica cv. Kasalath transgenik menunjukkan bahwa gen
hpt diwariskan secara stabil kepada generasi selanjutnya, mengikuti hukum Mendel dengan satu salinan gen yang terintegrasi ke dalam genom. Gen
MmCu/Zn-SOD terpaut dengan gen hpt, maka inetgrasi dan pewarisannya juga seperti pada gen hpt.
Saran
Efisiensi regenerasi dapat ditingkatkan dengan menggunakan media regenerasi tanpa penambahan antibiotik. Fungsi gen MmCu/Zn-SOD terhadap ketahanan cekaman abiotik dapat dianalisis dengan uji tantang pada galur tanaman transgenik SOD dengan menggunakan transgenik homozigot.
DAFTAR PUSTAKA
Abdurachman A, Dariah A, Mulyani A. 2008. Strategi dan teknologi pengelolaan lahan kering mendukung pengadaan pangan nasional. Jurnal Litbang Pertanian. 2: 43-49.
Alscher RG, Erturk N, Healt LS. 2002. Role of superoxidase dismutase (SODs) in controlling oxidative stress in plants. J Exp Bot. 53:1331-1341.
Anoop N, Gupta AK. 2003. Transgenic Indica rice cv IR-50 overexpressing
Vigna aconitifolia d(1)-pyrroline-5-carboxylate synthetase cDNA shows tolerance to high salt. J Plant Biochem Biotechnol. 12:109–116.
Arockiasamy S. Ignacimuthu S. 2007. Regeneration of transgenic plants from two Indica rice (Oryza sativa L.) cultivars using shoot apex explants. Plant Cell Rep. 26: 1745-1753.
Basu U, Good AG, Taylor GJ. 2001. Transgenic Brassica napus plants overexpressing aluminium-induced mitochondrial manganese superoxide dismutase cDNA are resistant to aluminium. Plant Cell Environ.
24:1269–1278.
Boo YJ, Jung J. 1999. Water dificit-induce oxidative stress and antioxidative defenses in rice plants. J Plant Physiol. 155:255-261.
Bowler C, Montagu MV, Inze D. 1992. Superoxide dismutase and stress tolerance.
Annu Rev Plant Physiol Plant Mol Biol. 43:83-116.
16
Brencic A, Winans SC. 2005. Detection of response to signals involved in host-microbe interactions by plant-associated bacteria. Microbiol Mol Biol Rev.
69: 155–19.
Cannon RE, White JA, Scandalios JG. 1987. Cloning of cDNA for maize superoxide dismutase 2 (SOD2). Genetic. 84:179-183.
Carlos Henrique SC, Usha BZ, Nilupa G, Joseph A, Halina HK, Thomas KH, John DA. 2004. Agrobacterium-mediated transformation of sorghum; factors that affect transformation efficiency. Genet Mol Biol. 27:259–269. Chatzidimitriadou K, Nianiou–Obeidat I, Madesis P, Perl–Treves R. 2009.
Expression of SOD transgene in pepper confer stress tolerance and improve shoot regeneration. Electron J Biotechnol. 12: 1 – 9.
Chawla S, Jain V. 2012. Salinity induced oxidative stress and antioxidant system in salt tolerant and salt sensitive cultivars of rice (Oryza sativa L.) J Plant Biochem Biotechnol. 1:1-10.
de la Riva GA, González-Cabrera L, Vázquez-Padrón R, Ayra-Pardo C. 1998.
Agrobacterium tumefaciens: a natural tool for plant transformation.
Electron J Biotechnol. 1: 118–133.
[Deptan] Departemen Pertanian (ID). 2010. Roadmap Peningkatan Produksi Beras Nasional (P2BN) Menuju Surplus Beras 10 Juta Ton pada Tahun 2014. [diunduh 2013 Maret 23].
http://tanamanpangan.deptan.go.id/doc_upload/44_BAB%20I%20dan%20 II.pdf
Duckely M, Oomen C, Axthelm F, Van Gelder P, Waksman G, Engel A. 2005. The VirE1VirE2 complex of Agrobacterium tumefaciens interacts with single-stranded DNA and forms channels. Mol Microbiol. 58: 1130–1142.
[FAO] Food and Agriculture Organization of the United Nations. 2014. FAO Cereal Supply and Demand Brief. [terhubung berkala] http://www.fao.org/worldfoodsituation/csdb/en/. [25 Desember 2014] Fitriah N. 2010. Transformasi genetik padi (Oryza sativa L.) dengan gen penyandi
metallothionein tipe II dari Melastoma malabathtricum (MaMt2) menggunakan perantara Agrobacterium tumefaciens [tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Foyer CH, Descourvieres GP, Kunert KJ. 1994. Protection against oxygen radicals: an important defence mechanism studied in transgenic plants.
Plant Cell Environ. 17: 507–523.
Fridovich l. 1995. Superoxide dismutase. Annu Rev Biochem. 44:147-159.
Gill SS,Tuteja N. 2010. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants. Plant Physiol Biochem. 48: 909-930. Godwin ID, Ford-Lloyd BV, Newbury H. 1992. In vitro approaches to extending the host-range of Agrobacterium for plant transformation. Aust J Bot . 40:751–763.
Greenberg JT, Monach P, Chou JH, Josephy PD, Demple B. 1990. Positive control of a global antioxidant defense regulon activated by superoxide generating agents in Escherichia coli. Proc Nall Acad Sci. 87: 81-85 Greene EA, Zambryski, PC. 1993. Agrobacteria mate in opine dens. Curr Biol.
3: 507-509.
17
malabathricum [disertasi]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Hiei Y, Komari T. 2008. Agrobacterium mediated transformation of rice using immature embryos or calli induced from mature seed. Nat Protoc. 3: 824-834.
Hiei YS, Ohta, Komari T, Kumashiro T. 1994. Efficient transformation of rice (Oryza sativa L.) mediated by Agrobacterium and sequence analysis of the boundaries of the T-DNA. Plant J. 6: 271-282.
Ignacimuthu S, Arockiasamy S, Terada. R. 2000. Genetic transformation of rice: Current status and future prospects. Curr Sci. 79: 186-195.
Karthikeyan A, Pandian SK, Ramesh M. 2011. Agrobacterium-mediated transformation of leaf based derived callus tissue of popular Indica rice (Oryza sativa L. subsp. Indica cv.ADT 43). Plant Sci. 181:258-268.
Katiyar SK, Chandel G, Singh, Pratibha R. 1999. Genetic variation and effect of 2.4-D on in vitro plant regeneration in Indica rice cultivars. Rice. 36: 254-256.
Khush GS. 1997. Original, dispersal, cultivation and variation of rice. Plant Mol Biol. 35:25-34.
Kumar KK, Maruthasalam S, Loganathan M, Sudhakar D, Balasubramanian P. 2005. An improved Agrobacterium-mediated transformation protocol for recalcitrant elite Indica rice cultivars. Plant Mol Biol Rep. 23: 67–73. Kuo MC, Kao CH. 2003. Aluminium effects on lipid peroxidation and
antioxidative enzyme activities in rice leaves. Biol Plant. 46:149-152. Lee DH, Kim YS, Lee CB. 2001. The inductive responses of the antioxidant
enzymes by salt stress in the rice (Oryza sativa L.). J Plant Physiol. 158:737-745.
Lestari EG, Yunita R. 2008. Callus induction and shoot regeneration of in vitro
rice var. Fatmawati. Bul Agron. 36:106-110.
Lin YJ, Zhang QF. 2005. Optimizing the tissue culture conditions for high efficiency transformation of Indica rice. Plant Cell Rep. 23:540–547. McKersie BD, Bowley SR, Harjanto E, Leprince O. 1996. Water- deficit tolerance
and field performance of transgenic alfalfa overexpressing superoxide dismutase. Plant Physiol. 111:1177– 1181.
McKersie BD, Bowley SR, Jones KS. 1999. Winter survival of transgenic alfalfa overexpressing superoxide dismutase. Plant Physiol. 119:839–848
Mittler R. 2002. Oxidative stress, antioxidants and stress tolerance. Trends Plant Sci. 7: 405-410.
Mulyaningsih ES, Aswidinnoor H, Sopandie D, Ouwerkerk PBF, Loedin INS. 2010. Transformasi padi Indica kultivar Batutegi dan Kasalath dengan gen regulator HD-Zip untuk perakitan varietas toleran kekeringan.
J Agron Indonesia. 38: 1 – 7.
Nandakumar R, Babu S, Kalpana K, Reguchander T, Balasubramanian P, Samiyappan R. 2007. Agrobacterium-mediated transformation of indica rice with chitinase gene for enhanced sheath blight resistance. Biol Plant.
51: 142-148.
18
Normile D. 2004. Yangtze seen as earliest rice site. Science . 275: 309.
Perl A, Perl-Treves R, Galili S, Aviv D, Shalgi E, Malkin S, Galun E. 1993. Enhanced oxidative stress defence in transgenic potato expressing tomato CuZn superoxide dismutases. Theor Appl Genet. 85:568–576.
Perl-Trevers R, Nacmias B, Aviv D, Zeelon EP, Galun E. 1988. Isolation of two cDNA clones from tomato containing two different superoxide dismutase sequence. Plant Mol Biol. 11:609-623.
Pipatpanukul T, Bunnag S, Theerakulpisut P, Kosittrakul M. 2004. Transformation of Indica rice (Oryza sativa L.) cv. RD6 mediated by
Agrobacterium tumefaciens. Songklanakarin J. Sci. Technol. 26 : 1-13. Pitzschke A, Hirt H. 2010. New insights into an old story: Agrobacterium induced
tumour formation in plants by plant transformation. The EMBO J. 1: 1–12. Rao RN, Allen NE, Hobbs JN, Alborn WE, Kirst HA, Paschal JW. 1983. Genetic
and enzymatic basis of hygromycin B resistance in Escherichia coli.
Antimicrob Agent Chemother. 24: 689-695.
Rashid H, Yokoi S, Toriyama K, Hinata K. 1995. Transgenic plant production mediated by Agrobacterium in Indica rice. Plant Cell Rep. 15: 727-730. Shaaltiel Y, Gressel J. 1986. Multi enzyme oxygen radical detoxifying system
correlated with paraquat resistance in Conyza bonariensis. Pesticide Biochern Physiol. 26:22-28.
Saharan VR, Yadav C, Yadav NR, Ram K. 2004. Studies on improved
Agrobacterium– mediated transformation in two Indica rice (Oryza sativa
L.). African J Biotech. 3: 572-575.
Saika H, Toki S. 2010. Mature seed-derived callus of the model Indica rice variety Kasalath is highly competent in Agrobacterium-mediated transformation. Plant Cell Rep. 29:1351–1364.
Sen Gupta A, Heinen JL, Holaday S, Burke JJ, Allen RD. 1993. Increased resistance to oxidative stress in transgenic plants that overexpress chloroplastic Cu/Zn superxide dismutase. Proc Natl Acad Sci. 90:1629-1633.
Sharma P, Dubey RS. 2005. Drought induces oxidative stress and enhances the activities of antioxidant enzymes in growing rice seedling. Plant Growth Regul. 46:139-148.
Shimoda N, Toyoda-Yamamoto A, Nagamine J, Usami S, Katayama M, Sakagami Y, Machida Y. 1990. Control of expression of Agrobacterium
vir genes by synergistic actions of phenolic signal molecules and monosaccharides. Proc Natl Acad Sci. 87: 6684–6688.
Slooten L, Capiau K, Van Camp W,Van Montagu M, Sybesma C, Inze D. 1995. Factors affecting the enhancement of oxidative stress tolerance in transgenic tobacco overexpressing manganese superoxide dismutase in the chloroplasts. Plant Physiol. 107: 737–750.
Stachel SE, Nester EW. 1986. The genetic and transcriptional organization of the vir region of the A6 Ti plasmid of Agrobacterium tumefaciens. EMBO J. 5:1445-1454.
19 Tanaka Y, Hibino T, Hayashi Y, Tanaka A, Kishitani S, Takabe T, Yokata S, Takabe T. 1999. Salt tolerance of transgenic rice overexpressing yeast mitocondrial Mn – SOD in cloroplash. Plant Sci. 148: 131-138.
Tang W, Luo H, Newton RJ. 2004. Effects of antibiotics on the elimination of
Agrobacterium tumefaciens from loblolly pine (Pinus taeda) zygotic embryo explants and on transgenic plant regeneration. Plant Cell Tiss Org Cult. 70:71–81.
Tsang EWT, Bowler C, Herouart D, Van Camp W, Villarroel R. 1991. Differential regulation of superoxide dismutase in plants exposed to environmental stress. Plant Cell. 3:783- 92.
Tseng MJ, Liu CW, Yiu JC. 2008. Tolerance to sulfur dioxide in transgenic Chinese cabbage transformed with both the superoxide dismutase containing manganese and catalase genes of Escherichia coli. Sci Hort.
115:101-110.
Tyagi H, Rajasubramanian C, Dasgupta I. 2007. Regeneration and Agrobacterium
– mediated transformation of a popular Indica rice variety ADT 39. Curr Sci. 99: 678-683.
Tzfira T, Citovsky V. 2006. Agrobacterium-mediated genetic transformation of plant : biology and biotechnology. Curr Opin Plant Biotechnol. 17:147-154.
Van Camp W, Willekens H, Bowler C, Van Montagu M, Inze D, Langebartels C, Sandermann H. 1994. Elevated levels of superoxide dismutase protect transgenic plants against ozone damage. Bio/Techno. 12: 165–168.
Vaughan DA, Morishma H, Kadowaki K. 2003. Diversity in the Oryza genus.
Currt Opin in Plant Biol. 6:139-1546.
Yamamoto Y, Kobayashi Y, Matsumoto H. 2001. Lipid peroxidation is an early symptom triggered by aluminium, but not the primary cause of elongation inhibition in pae roots. JPlant Physiol. 125:199-208.
Yuwono NW. 2009. Membangun kesuburan tanah di lahan marginal. Jurnal Ilmu Tanah dan Lingkungan. 9: 137 141.
20
Lampiran 1 Komposisi media AB plate
Komposisi Bahan Konsentrasi mg/L
Bacto agar 15000
Glukosa 5000
Salt NH4Cl KCL
MgSO4.7H2O CaCl2.2H2O FeSO4.7H2O
1000 50 300 13.25
2.5 Buffer
NaH4PO4 KH2PO4
21 Lampiran 2 Komposisi media dasar N6
Komposisi Bahan Konsentrasi mg/L
N6 Minor Salt
MnSO4.4H2O ZnSO4.7H2O H3BO3 KI
4.4 1.5 1.6 8.0
N6 Major Salt
KNO3 (NH4)2SO4 CaCl2.2H2O KH2PO4 MgSO4.7H2O
283 463 166 400 185
N6 Vitamin
Gly
Nicotinic acid
Pyridoxine hydrochloride Thiamine hydrochloride
2.0 0.5 0.5 1.0
FeEDTA
FeSO4.7H2O Na2EDTA
22
Lampiran 3 Komposisi media 2NBKCH50
23
RIWAYAT HIDUP
Penulis dilahirkan di Rupat, Riau pada tanggal 4 Oktober 1988 dari pasangan bapak Zahidin SHI dan ibu Gusniwarti S.Pd.SD. Penulis merupakan anak pertama dari lima bersaudara.
Penulis menyelesaikan pendidikan menengah di SMA Negeri 1 Bengkalis, Riau pada tahun 2006. Pada tahun yang sama penulis, melanjutkan pendidikan sarjana di Jurusan Biologi FMPIA, Universitas Riau melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB). Tahun 2012 penulis menyelesaikan pendidikan sarjana Biologi. Pada tahun yang sama penulis melanjutkan pendidikan di Program Studi Biologi Tumbuhan, Sekolah Pascasarjana Institut Pertanian Bogor dengan sponsor dari program Beasiswa Unggulan Dikti (BU DIKTI) tahun 2012.