PEMURNIAN DAN KARAKTERISASI GLUKOSA OKSIDASE
DARI ISOLAT
Aspergillus niger
(IPBCC.08610)
EVA SELENIA DESI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK
CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Pemurnian dan Karakterisasi Glukosa Oksidase dari Isolat Aspergillus niger (IPBCC 08.610) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2015
Eva Selenia Desi
ABSTRAK
EVA SELENIA DESI. Pemurnian dan Karakterisasi Glukosa Oksidase dari Isolat
Aspergillus niger (IPBCC 08.610). Dibimbing oleh INDA SETYAWATI dan POPI ASRI KURNIATIN.
Glukosa oksidase (GOD) sedang banyak dikembangkan dalam berbagai aplikasi seperti pada industri makanan, obat-obatan, dan elektronik. Sumber GOD terbaik berasal dari Aspergillus niger karena diketahui memiliki aktivitas spesifik yang tinggi. Penelitian ini bertujuan untuk memurnikan glukosa oksidase dari
A.niger (IPBCC 08.610) dengan menggunakan teknik kromatografi kolom gel filtrasi dan karakterisasinya. Pemurnian menggunakan kromatografi filtrasi gel menghasilkan satu fraksi enzim yang memiliki kadar protein lebih tinggi (Fraksi 4) dibandingkan fraksi lainnya. Aktivitas spesifik fraksi hasil kromatografi adalah 31.92 U/mg dengan tingkat kemurnian 8.86 kali dibandingkan dengan ekstrak enzim kasar yaitu 3.61 U/mg. Estimasi bobot molekul hasil analisis metode SDS-PAGE menunjukkan 2 pita protein yang berukuran 161 kDa dan 84 kDa. Adapun nilai Km dan Vmaks glukosa oksidase dengan substrat glukosa adalah 39 mM dan 3.7 x 10-3 mmol/det.
Kata kunci: Aspergillus niger, glukosa oksidase, Km, Vmaks, kromatografi kolom filtrasi gel, pemurnian, SDS-PAGE.
ABSTRACT
EVA SELENIA DESI. Purification and Characterization of Glucose Oxidation from Isolate Aspergillus niger (IPBCC 080610). Supervised by INDA SETYAWATI and POPI ASRI KURNIATIN.
Glucose oxidase (GOD) is being developed in many fields such as in health, food industry and electronic devices. A.niger is the best source of GOD because its higher activity than GOD from other microorganisms. The aimed of this research was to purify glucose oxidase of A. niger (IPBCC 08.610) conducted by gel fitration column chromatography and characterize the protein. Purification with chromatography resulted a fraction of enzyme which had high protein level (Fraction 4). The spesific activity of this fraction was 31.92 U/mg and the fold of purification was 8.86 times compared to the spesific activity of crude extract. Molecular weight estimation by SDS-PAGE method shows that there are two bands of protein, 161 kDa and 84 kDa. In addition of enzyme kinetics, glucose oxidase had Km and Vmax value (glucose as a substrate), respectively 39 mM and 3.7 x 10-3 mmol/det.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
PEMURNIAN DAN KARAKTERISASI GLUKOSA OKSIDASE
DARI ISOLAT
Aspergillus niger
(IPBCC.08610)
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Skripsi : Pemurnian dan Karakterisasi Glukosa Oksidase dari Isolat
Aspergillus niger (IPBCC 08.610) Nama : Eva Selenia Desi
NIM : G84100062
Disetujui oleh
Inda Setyawati, STP MSi Pembimbing I
Popi Asri Kurniatin, SSiApt MSi Pembimbing II
Diketahui oleh
Dr Ir I Made Artika, MAppSc Ketua Departemen
PRAKATA
“Telah tampak kerusakan di darat dan di laut disebabkan karena
perbuatan tangan manusia; Allah menghendaki agar mereka merasakan sebagian
dari (akibat perbuatan mereka, agar mereka kembali (ke jalan yang benar)”
(Q.S.Ar Ruum: 41).
Puji syukur kehadirat Allah SWT yang telah memberikan limpahan rahmat serta karunia-Nya sehingga Penulis dapat menyelesaikan penelitian ini dengan judul Pemurnian dan Karakterisasi Glukosa Oksidase dari Isolat Aspergillus niger
(IPBCC 08.610). Penelitian ini dilaksanakan mulai bulan Februari 2014 di Laboratorium Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada Inda Setyawati, STP MSi serta Popi Kurniatin Asri, Ssi Apt MSi yang telah memberikan bimbingan, pengarahan, saran, serta waktunya selama penelitian ini. Ungkapan terima kasih yang tak terhingga penulis ucapkan kepada orang tua, keluarga, serta keluarga besar biokimia 47 atas doa, dukungan, dan kasih sayang yang telah diberikan.
Penulis menyadari masih terdapat banyak kekurangan dalam penyusunan penelitian ini. Oleh karena itu, penulis mengharapkan kritik dan saran yang membangun untuk perbaikan dalam penulisan selanjutnya. Semoga penelitian ini dapat bermanfaat baik bagi penulis maupun pembaca.
Bogor, Januari 2015
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
METODE 2
Bahan dan Alat 2
Metode Penelitian 2
HASIL 5
Fraksi Kasar dan Pemurnian Parsial Glukosa Oksidase 5
Elektroforegram Glukosa Oksidase 6
Kinetika Glukosa Oksidase 7
PEMBAHASAN 7
Fraksi Ekstrak Kasar Glukosa Oksidase 7
Fraksi Pemurnian Glukosa Oksidase secara Parsial 9
Elektroforegram Glukosa Oksidase 11
Kinetika Glukosa Oksidase 13
SIMPULAN DAN SARAN 14
Simpulan 14
Saran 14
DAFTAR PUSTAKA 15
LAMPIRAN 18
DAFTAR GAMBAR
1 Kurva kadar protein glukosa oksidase hasil pemurnian dengan kromatografi kolom filtrasi gel
2 Hasil analisis perkiraan bobot molekul glukosa oksidase 3 Kurva Lineweaver-Burk Glukosa Oksidase
DAFTAR LAMPIRAN
1 Bagan Alir Proses Penelitian 2 Kurva standar protein
3 Kadar protein dan aktivitas enzim glukosa oksidase 4 Contoh perhitungan kadar protein dan aktivitas enzim 5 Penentuan Km dan Vmaks
18 20 21 22 7 24
PENDAHULUAN
Glukosa oksidase (GOD) adalah enzim yang mengkatalisis oksidasi β -D-glukosa menjadi glukonolakton dan hidrogen peroksida dengan bantuan molekul oksigen sebagai akseptor elektron (Sabir et al. 2007). Glukosa oksidase banyak digunakan dalam aplikasi bidang farmasi, di antaranya sebagai biosensor untuk penentuan kadar glukosa dalam darah. Pada bidang industri makanan, enzim ini juga sering dimanfaatkan untuk menghilangkan glukosa dan oksigen dalam pengolahan suatu produk, sedangkan pada bidang energi terbarukan digunakan sebagai enzymatic biofuel cell (EFC). Glukosa oksidase juga berperan penting dalam menghilangkan beberapa bakteri pengganggu pada makanan seperti
Salmonella infantis, Staphylococcus aureus, Bacillus cereus, dan Listeria monocytogens.
Banyak mikroorganisme yang mampu memproduksi glukosa oksidase, di antaranya seperti Penicillium notatum, Penicillium chrysosporium, Aspergillus niger, dan Botrytis cinerea. Menurut penelitian yang dilakukan oleh Bankar et al.
(2009), glukosa oksidase yang paling baik adalah yang dihasilkan oleh
Aspergillus niger. Penapisan terhadap beberapa jenis fungi memperlihatkan bahwa A.niger merupakan sumber glukosa oksidase yang paling baik dan menghasilkan glukosa oksidase yang lebih stabil dibandingkan hasil produksi
Penicillium sp (Khurshid et al. 2011).
Iklim tropis menjadikan Indonesia memiliki tingkat kelembapan yang tinggi, hal ini mendorong pertumbuhan yang sangat aktif dari A.niger sehingga keberadaannya tidak sulit ditemukan. Keberlimpahan A.niger berbanding lurus dengan kebutuhan glukosa oksidase untuk pemanfaatannya dalam kemajuan teknologi. Hal ini yang mendorong para peneliti untuk melakukan eksplorasi lebih jauh mengenai A.niger sebagai bahan baku pembuatan glukosa oksidase. Berdasarkan penelitian Triana (2012) diketahui bahwa isolat lokal A. niger IPBCC (08.610) menghasilkan GOD dengan aktivitas spesifik sebesar 22.18 U/mg yang terendapkan dengan baik pada pengendapan 80 % ammonium sulfat dan diperoleh kemurnian enzim sebesar 6.92 kali. Sedangkan pada penelitian Abdullah (2013) diketahui GOD yang dihasilkan dari isolat yang sama memiliki aktivitas spesifik sebesar 43.176 U/mg dan kemurnian sebesar 6.17 kali dari hasil dialisis.
METODE
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini adalah biakan isolat
Aspergillus niger (IPBCC 08.610) koleksi Departemen Biologi IPB yang merupakan hasil isolasi dari tanah di daerah Tarakan, Kalimantan Timur, bahan media NA, sukrosa, pepton, (NH4)2HPO4, MgSO4, NaNO3, KCl, CaCO3, (NH4)2SO4, NaOH 2 N, glukosa, pasir kuarsa, glassbead, akuades steril, bufer (natrium fosfat 0.1 M pH 6.0; fosfat sitrat 0.1 M pH 5.6; kalium fosfat 0.1 M pH 7.0), pereaksi Lowry A (Na2CO3 2 % dalam NaOH 0.1 N), pereaksi Lowry B (CuSO4.5H2O 0.5 % dalam Na-K-tartrat.5H2O 1 %), pereaksi Lowry C (campuran 50 mL pereaksi Lowry A dengan 1 mL pereaksi Lowry B), pereaksi Lowry D (pereaksi Folin-Cioucalteau yang diencerkan dengan aquades 1:1), standar Bovine Serum Albumin (BSA), o-dianisidin, horseradish peroksidase, amonium sulfat,
sodium dodecyl sulfate (SDS) 2 % (b/v), ammonium persulfat (APS) 10 % (b/v), tetramethylethylendiamin (TEMED), gliserol, bromfenol biru 0.1 %, dan
Commasie brilliant blue R-25. Separating gel 10 % terdiri dari akrilamid 30%, bufer Tris-HCl 1.5 M pH 6.8, sodium dodecyl sulfate 10 % (b/v), H2O, ammonium persulfat 10 % (b/v) dan tetramethylethylendiamin. Stacking gel 5 % terdiri atas H2O, akrilamid 30 %, bufer Tris-HCl 1 M pH 8.8, sodium dodecyl
sulfate 10 % (b/v), APS 10 % (b/v) dan tetramethylethylendiamin.
Peralatan yang digunakan adalah alat-alat gelas, mortar, kertas saring, membran selulosa, neraca analitik OHAUS GA 200, waterbath, pH meter, inkubator, vortex, magnetic stirrer, spektrofotometer Genesys 10UV, Beckman
High Speed Centrifuge, autoklaf TOMY High Pressure Steam Sterilizer ES-315, perangkat SDS-PAGE dan beberapa peralatan di laboratorium analitik.
Metode Penelitian
Penyiapan Media Tumbuh dan Media Produksi Glukosa Oksidase (Modifikasi Singh dan Verma 2010)
Media tumbuh isolat A. niger terdiri atas media penyegaran, media starter dan media produksi. Bahan untuk media penyegaran adalah 1 gram PDA dilarutkan dalam 25 mL aquades. Media PDA kemudian dididihkan. Bahan-bahan untuk membuat media starter dilarutkan dalam 500 mL akuades. Komposisi media starter, yaitu 0.4 g/L (NH4)2HPO4; 0.2 g/L KH2PO4; 0.2 g/L MgSO4.7H2O; 10 g/L pepton; dan 70 g/L sukrosa. Media starter dibagi dalam sepuluh buah Erlenmeyer 250 mL masing-masing diisi dengan 50 mL media starter. Media produksi mengandung 0.4 g/L (NH4)2HPO4; 0.2 g/L KH2PO4; 0.2 g/L MgSO4.7H2O; 40 g/L CaCO3; 3.3 % sukrosa; dan 0.35 % glukosa. Media diatur pada pH 5.5 dengan penambahan larutan H3PO4 1 M. Sebanyak sepuluh buah Erlenmeyer 500 mL disiapkan dan masing-masing diisi dengan 100 mL media produksi. Setiap media disterilisasi dalam autoklaf 121 0C selama 15 menit.
Produksi Glukosa Oksidase (Singh & Verma 2010)
selama 3 hari. Suspensi spora dari stok media agar miring isolat A. niger
ditumbuhkan dalam media starter diinkubasi pada suhu 30 oC kecepatan 120 rpm selama 24 jam. Media starter kemudian dimasukkan ke dalam media produksi, diinkubasi pada suhu 30 0C kecepatan 120 rpm selama 48 jam (Triana 2012). Setelah inkubasi, miselium dipisahkan dari media pertumbuhan dengan cara disaring menggunakan kain kasa. Berat miselium yang dihasilkan ditimbang dan digunakan untuk tahap isolasi.
Isolasi Glukosa Oksidase dari A. niger (Modifikasi Firman & Aryantha 2003)
Enzim dalam sel diisolasi dengan cara penggerusan menggunakan mortar steril dalam suhu 4 oC. Miselium hasil penyaringan digerus sampai halus dengan menggunakan pasir kuarsa dengan perbandingan 1:1. Sel yang telah lisis ditambahkan dengan bufer natrium fosfat 0.1 M pH 6.0, kemudian disentrifugasi pada kecepatan 12000 rpm suhu 4 oC selama 20 menit. Supernatan yang dihasilkan merupakan ekstrak kasar glukosa oksidase. Ekstrak kasar diukur kadar protein dan aktivitasnya lalu dilakukan tahap pemurnian dengan amonium sulfat dan dialisis.
Pengukuran Kadar Protein Fraksi Enzim (Modifikasi Lowry et al. 1951)
Pengujian kadar protein dilakukan setelah pembuatan kurva standar. Kurva standar dibuat dari standar BSA dengan konsentrasi 100 – 600 g/mL. Kurva standar yang digunakan berjumlah dua buah. Keduanya menggunakan dua bufer yang berbeda, yaitu bufer natrium fosfat 0.1 M pH 6.0 dan fosfat sitrat 0.1 M pH 5.6. Kurva standar dengan bufer natrium fosfat digunakan untuk mengukur kadar protein enzim kasar sedangkan kurva standar dengan bufer fosfat sitrat digunakan untuk mengukur kadar protein fraksi amonium sulfat dan dialisis. Sebanyak 0.2 mL sampel ditambahkan 1 mL pereaksi Lowry C lalu dikocok dan diinkubasi selama 10 menit pada suhu ruang. Setelah itu ditambahkan 0.1 mL pereaksi Lowry D kemudian dikocok segera dan dibiarkan selama 30 menit pada suhu ruang. Absorbannya dibaca pada panjang gelombang 750 nm.
Uji Aktivitas Glukosa Oksidase (Modifikasi Bergmeyer 1988)
dihitung sebagai nilai absorbansi perwaktu (ΔA/Δt) dibagi dengan faktor
Pengendapan amonium sulfat dan dialisis (Baehaki 2012). Pemurnian glukosa oksidase dilakukan melalui pengendapan dengan amonium sulfat, dialisis, dan pemurnian dengan kromatografi kolom filtrasi gel. Pengendapan glukosa oksidase dilakukan dengan menambahkan amonium sulfat dengan tingkat kejenuhan 60 % - 80 %. Konsentrasi amonium sulfat 80 % digunakan berdasarkan hasil optimasi pengendapan amonium sulfat yang telah dilakukan pada penelitian sebelumnya (Triana 2012). Pengendapan dilakukan dengan cara menambahkan garam amonium sulfat sedikit demi sedikit selama 1.5 jam pada suhu 4 oC dan diaduk pelan dengan stirer kecepatan 250 rpm. Larutan didiamkan selama semalam penuh pada suhu 4 oC, kemudian disentrifus pada kecepatan 12000 rpm selama 15 menit untuk memisahkan partikel yang tidak larut. Presipitat kemudian dilarutkan dalam 1 mL bufer fosfat sitrat 0.1 M pH 5.6.
Setelah pengendapan amonium sulfat, lalu dilakukan dialisis yang memiliki
molecular weight cut off (MWCO) 12 kDa. Sebelum digunakan, membran diproses untuk menghilangkan kontaminan seperti gliserol, ion logam berat, atau komponen mikro mengandung sulfur. Persiapan membran dimulai dengan membran direbus dalam larutan NaHCO3 2 % dan EDTA 1mM selama 10 menit. Kemudian larutan NaHCO3 2 % dan EDTA 1mM dibuang dan diganti dengan aquades, setelah itu membran disimpan dalam lemari es (Bryer 1986). Fraksi amonium sulfat 80 % dimasukkan ke dalam kantong dialisis, dan didialisis selama 9 jam dengan menggunakan larutan bufer fosfat sitrat 0.001 M pH 5.6. Larutan bufer diganti setiap 3 jam.
Pemurnian dengan kromatografi kolom filtrasi gel (Bhatti et al. 2005).
Dialisat dimurnikan dengan menggunakan metode kromatografi kolom. GOD dimurnikan dalam kolom yang berisi Sephadex G-150 (2.46’26 cm) yang disetimbangkan dengan buffer fosfat sitrat 0.1 mmol pH 5.6. Tiap fraksi yang keluar ditampung sebanyak 2 mL dan dilakukan pengujian kadar protein dengan menggunakan metode Lowry serta diukur aktivitas enzimnya.
Karakterisasi Glukosa Oksidase
Elektroforesis SDS-PAGE (Sambrook & Russel 2001). Gel yang digunakan terdiri atas dua bagian, yaitu separating gel konsentrasi 10 % dan
dengan perbandingan sampel : loading buffer (5:1) dan dipanaskan selama 10 menit pada suhu 100 oC. Gel dielektroforesis dengan tegangan 100 V dan 80 mA selama 120 menit. Setelah proses running elektroforesis dilakukan, gel diwarnai dengan larutan pewarna selama 24 jam. Kemudian dicuci dengan akuades dan direndam kedalam larutan destaining selama semalam untuk hasil yang maksimal.
Kinetika kimia glukosa oksidase (Modifikasi Odebunmi & Owalude 2007). Larutan glukosa beragam konsentrasi (10 – 100 mM) digunakan sebagai substrat dalam pengujian glukosa oksidase lalu dibuat kurva hubungan antara konsentrasi glukosa dan aktivitas spesifik enzim. Setelah itu dibuat persamaan linear Lineweaver-Burk dan ditentukan nilai Km dan Vmaks nya menggunakan persamaan tersebut.
HASIL
Fraksi Kasar dan Pemurnian Parsial Glukosa Oksidase
Ekstrak kasar glukosa oksidase dari isolat A. niger (IPBCC 08.610) diketahui memiliki aktivitas spesifik sebesar 3.60 U/mg dengan yield sebesar 100 %. Glukosa oksidase ekstrak kasar diendapkan dengan fraksinasi ammonium sulfat dengan kejenuhan 60 %-80 %. Fraksi pemurnian dengan ammonium sulfat 80 % memiliki aktivitas spesifik 23.34 U/mg dan yield sebesar 16.19 % dengan tingkat kemurnian 6.48 kali (Tabel 1). Pemurnian dilanjutkan dengan menggunakan membran dialisis. Aktivitas spesifik glukosa oksidase hasil dialisis memiliki nilai sebesar 29.42 U/mg dengan yield 22.87 % dan tingkat kemurnian hingga 8.17 kali. Hasil dialisis kemudian dimurnikan dengan kromatografi kolom filtrasi gel. Kromatografi filtrasi gel menggunakan gel Sephadex G-150. Fraksi yang dihasilkan pada kromatografi sebanyak 25 fraksi dengan 3 fraksi aktif yaitu fraksi 4, 5, dan 6. Eluen yang digunakan untuk mengelusi sampel adalah bufer fosfat sitrat pH 5.6 dan memiliki volume elusi sebesar 2 mL/fraksi. Fraksi yang memiliki kadar protein tertinggi adalah fraksi 4 (Gambar 1), sehingga fraksi 4 digunakan untuk penentuan aktivitas spesifik glukosa oksidase. Aktivitas spesifik yang diperoleh dari fraksi 4 adalah sebesar 31.92 U/mg dan yield 9.82 % sehingga kemurnian yang dimiliki sebesar 8.86 kali.
Gambar 1 Kromatogram protein glukosa oksidase hasil pemurnian dengan kromatografi kolom filtrasi gel
-0.5
0 1 2 3 4 5 6 7 8 9 10111213141516171819202122232425
Tabel 1 Aktivitas glukosa oksidase pada tiap fraksi pemurnian
Keterangan : *Fraksi (NH4)2SO4 60-80% sudah didialisis
Elektroforegram Glukosa Oksidase
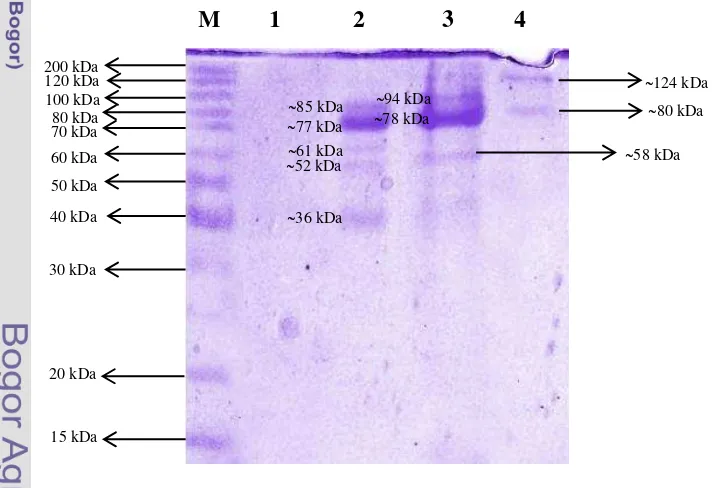
Hasil visualisasi pita protein yang terdapat pada Gambar 2 menunjukkan bahwa pita yang tampak pada lajur 2 (Fraksi ammonium sulfat 60-80 %) memiliki 5 buah pita yang masing-masing berukuran 85 kDa, 77 kDa, 61 kDa, 52 kDa, dan 36 kDa. Pita yang terdapat pada lajur 3 (Fraksi ammonium sulfat 60-80 % yang telah didialisis) memiliki 3 buah pita yang berukuran 94 kDa, 78 kDa, 58 kDa. Pada lajur 4 (Fraksi 4 kromatografi filtrasi gel) memiliki 2 buah pita yang berukuran 124 kDa dan 80 kDa. Penampakan pita tebal berukuran 80 kDa pada elektroforegram di lajur 4 (Gambar 2) diduga merupakan subunit glukosa oksidase. Glukosa oksidase dapat terpecah menjadi subunit enzim yang memiliki bobot molekul identik saat penambahan merkaptoetanol dan pemanasan.
Kinetika Glukosa Oksidase
Persamaan Lineweaver-Burk menunjukkan hubungan pengaruh dari konsentrasi susbstrat dengan aktivitas spesifik enzim. Nilai Vmaks dan Km glukosa oksidase isolat A. niger (IPBCC 08.610)hasil pemurnian kromatografi filtrasi gel (fraksi 4) yang diperoleh adalah sebesar 3.7 x 10-3 mmol/det dan 39 mM. Konsentrasi glukosa sebesar 39 mM merupakan jumlah glukosa yang dibutuhkan untuk mencapai setengah kecepatan maksimum.
Gambar 3 Kurva Lineweaver-Burk glukosa oksidase
PEMBAHASAN
Fraksi Ekstrak Kasar Glukosa Oksidase
Produksi Glukosa oksidase dilakukan pada dua media yang berbeda. Media pertama merupakan media starter yang mengandung pepton, glukosa, (NH4)2HPO4 ,KH2PO4, MgSO4.7H2O. Media kedua merupakan media produksi yang terdiri atas sukrosa, glukosa, CaCO3, (NH4)2HPO4 ,KH2PO4,MgSO4.7H2O. Sumber karbon yang digunakan dalam media produksi berasal dari sukrosa dan glukosa, sedangkan sumber nitrogen dalam media kultur berasal dari pepton. Penambahan sukrosa ke dalam media produksi lebih banyak dibandingkan glukosa, hal ini dilakukan karena sukrosa merupakan substrat yang dapat memproduksi glukosa oksidase dengan lebih optimal (Bankar et al. 2009). Menurut Simpson (2005) penambahan glukosa ke dalam media dalam jumlah berlebih dapat mengakibatkan penurunan massa miselia, pH kultur, serta konsentrasi glukosa oksidase. Pada pembuatan media, terdapat penambahan CaCO3. Fungsi penambahan CaCO3 dengan kadar 4 % pada pembuatan media produksi adalah untuk memaksimalkan pembentukan glukosa oksidase pada A. niger. Hal tersebut sudah dibuktikan pada penelitian yang dilakukan oleh Hatzinikolaou et al (1996) bahwa media produksi yang tidak terdapat komposisi
CaCO3 memiliki aktivitas glukosa oksidase dan katalase yang rendah. Selain itu, penambahan CaCO3 juga berfungsi untuk mempertahankan pH media pertumbuhan agar tidak terjadi asidifikasi selama proses kultivasi (Rogalski 1988 dalam Simpson 2005).
Penambahan (NH4)2HPO4 , KH2PO4 dan MgSO4.7H2O pada jumlah tertentu juga mempengaruhi aktivitas glukosa oksidase. (NH4)2HPO4 dengan kadar 0.2 % merupakan sumber fosfor yang baik bagi pertumbuhan A. niger karena dapat meningkatkan aktivitas glukosa oksidase. KH2PO4 dan MgSO4.7H2O memiliki porsi kebutuhan sebesar 0.02 %. Penambahan kedua bahan yang melebihi persen kebutuhannya akan mengakibatkan aktivitas glukosa oksidase rendah. MgSO4.7H2O mengandung ion Mg+2, menurut Hamid et al. (2003) penambahan Mg+2 yang berlebih akan menghambat produksi glukosa oksidase karena Mg+2 merupakan salah satu faktor inhibitor yang kuat dalam produksi glukosa oksidase. Ekstrak kasar diperoleh dari hasil isolasi A. niger (IPBCC 08.610) yang ditumbuhkan dalam media produksi setelah melalui tahap inkubasi selama 48 jam. Menurut penelitian yang dilakukan oleh Khursid et al. (2011) menyebutkan bahwa waktu produksi paling maksimal glukosa oksidase dilakukan dalam waktu 48 jam. Optimasi waktu produksi A. niger (IPBCC 08.610) juga dilakukan oleh Triana (2012), aktivitas total glukosa oksidase yang dihasilkan pada 48 jam lebih tinggi daripada waktu produksi selama 72 jam, nilai yang diperoleh yaitu sebesar 134.21 U dan 103.72 U. Pada penelitian ini, aktivitas total ekstrak kasar yang diperoleh lebih tinggi daripada yang diperoleh oleh Triana (2012) yaitu sebesar 1286.25 U. Unit merupakan satuan dari aktivitas enzim. Unit didefinisikan sebagai jumlah enzim yang diperlukan untuk menggunakan satu mikromol substrat per menit pada suhu dan temperatur tertentu.
Produksi glukosa oksidase tidak hanya dipengaruhi oleh faktor media dan waktu produksinya saja, melainkan terdapat faktor lain seperti aerasi dan agitasi, suhu dan pH produksi. Pada penelitian ini aerasi dan agitasi pada saat produksi sangat penting diperhatikan karena fungsi aerasi dan agitasi adalah untuk mensuplai kebutuhan oksigen mikroba (Simpson 2005). Pada produksi glukosa oksidase dari A. niger isolat lokal (IPBCC 08.610) yang dilakukan pada penelitian ini, kecepatan agitasi yang digunakan adalah 120 rpm dengan perbandingan aerasi sebesar 1 : 5, penentuan aerasi dan agitasi tersebut merujuk pada penelitian yang telah dilakukan sebelumnya oleh Singh dan Verma (2010) dan Khurshid et al.
(2011). Tingkat aerasi dan agitasi mempengaruhi kecepatan konsumsi oksigen dan ketersediannya selama proses kultivasi berlangsung. Laju konsumsi O2 oleh
A.niger ketika masa produksi cukup tinggi. Oksigen yang tidak mencukupi menyebabkan berkurangnya hasil dari produk mikroba seperti enzim (Jafari et al.
2007).
enzim di atas 45 oC dan pH di bawah 5,0. Enzim dapat mempercepat reaksi kimiawi dengan sempurna bila berada dalam suhu optimumnya, namun bila suhu operasi menyimpang dari suhu optimum maka aktivitas enzim akan menurun. (Bankar et al. 2009). Penyimpangan pH medium juga dapat menimbulkan pertumbuhan dan metabolisme mikroba terhenti dikarenakan protein dalam struktur enzim dan sistem transport yang terdapat pada membran sel berubah. (Bankar et al. 2009).
Fraksi Pemurnian Glukosa Oksidase secara Parsial
Pemurnian parsial yang digunakan dalam penelitian ini adalah dengan pengendapan ammonium sulfat secara bertingkat dan kromatografi kolom filtrasi gel. Hasil setiap fraksi pemurnian terhadap glukosa oksidase dari isolat A. niger
(IPBCC 08.0610) disajikan pada Tabel 1. Pada masing-masing tahap dilakukan pengukuran aktivitas dan kadar protein. Aktivitas spesifik menunjukkan unit aktivitas per mg protein sementara tingkat kemurnian merupakan hasil pembagian aktivitas spesifik pada suatu tahap pemurnian terhadap aktivitas spesifik ekstrak enzim kasar. Pengendapan protein dapat terjadi oleh perubahan pH atau kekuatan ion, adanya penambahan pelarut organik atau senyawa lainnya sehingga molekul protein berkumpul. Penambahan garam pada konsentrasi tinggi akan menyebabkan pengendapan protein. Efek salting out ini terjadi karena adanya kompetisi antara protein dan garam dalam interaksinya dengan molekul air. Pada konsentrasi garam yang tinggi, mayoritas molekul air berinteraksi lebih kuat dengan garam dibandingkan dengan protein sehingga membuat kelarutan protein menjadi rendah dan menyebabkan protein mengendap (Naz 2002).
Fraksinasi ammonium sulfat secara bertingkat yang digunakan pada penelitian ini berfungsi untuk memisahkan protein enzim dari protein lain, karena enzim adalah protein maka setelah pengendapan konsentrasi glukosa oksidase dalam campuran akan meningkat dengan konsentrasi yang lebih besar, aktivitas enzim terhadap substrat yang sama juga akan meningkat (Rosenberg 2005). Keuntungan menggunakan garam ammonium sulfat karena memiliki kelarutan tinggi, pH stabil, relatif lebih murah, bersifat non toksik, dan tidak mempengaruhi enzim. Penambahan garam dilakukan sedikit demi sedikit pada suhu rendah sambil diaduk. Pengadukan dengan bantuan stirrer pada kecepatan rendah bertujuan agar protein tidak terdenaturasi yang ditandai dengan adanya buih pada larutan (Rosenberg 2005). Hasil analisis menunjukkan bahwa terjadi peningkatan kemurnian glukosa oksidase fraksi 60-80 % sebesar 6.48 kali dari ekstrak kasar dan memiliki yield aktivitas sebesar 16.19 %. Dalam fraksi ini masih terdapat banyak protein selain glukosa oksidase sehingga molekul non protein harus dihilangkan dengan melakukan tahap pemurnian selanjutnya.
memungkinkan pertukaran tersebut namun tetap dapat menghalangi lolosnya protein dari kantung dialisis (Bollag dan Edelstein 1991). Pada penelitian ini kantung dialisis yang digunakan memiliki nilai cut off 12 kDa yang mampu menahan glukosa oksidase agar tidak keluar selama dialisis. Dialisis dilakukan pada fraksi amonium sulfat 60-80 % karena memiliki nilai kemurnian yang cukup tinggi. Hasil dialisis menunjukkan bahwa terjadi peningkatan tingkat kemurnian enzim sebesar 8.17 kali dari ekstrak kasar dan memiliki yield aktivitas sebesar 22.87 %. Hingga tahap ini terjadi peningkatan kemurnian yang ditandai dengan peningkatan aktivitas spesifik. Terjadinya pengenceran oleh larutan bufer yang menggantikan garam di dalam kantong akan memungkinkan terjadinya penurunan konsentrasi protein.
Tahap selanjutnya dari pemurnian glukosa oksidase adalah kromatografi kolom filtrasi gel. Pada penelitian ini, pemurnian dilakukan dengan menggunakan gel Sephadex G-150 dan memiliki daya pengembangan dari 5.000 hingga 300.000 yang berarti gel tersebut dapat digunakan untuk memisahkan protein-protein yang memiliki berat molekul antara 5.000-300.000. Oleh karena itu, Sephadex G-150 cukup baik digunakan untuk memisahkan bobot molekul glukosa oksidase. Kromatografi merupakan pemisahan diferensial komponen sampel diantara fase gerak dan fase diam. Fase diam terdiri atas partikel gel yang dikemas di dalam kolom, sedangkan fase gerak yang membawa campuran protein terdiri atas bufer elusi fosfat sitrat. Protein yang memiliki interaksi lebih besar terhadap fase diam akan terelusi lebih lambat dibandingkan dengan protein yang terikat dengan fase gerak (Scopes 1987 dalam Seftiono 2008). Protein yang memiliki ukuran menengah akan terelusi ke bawah dengan kecepatan antara, bergantung pada tingkat kemampuan menembus butiran. Untuk molekul dengan bentuk yang globular, lamanya waktu alir berbanding lurus dengan bobot molekul (Seftiono 2008).
Hasil pemurnian dengan kromatografi kolom filtrasi gel menghasilkan 3 fraksi aktif yaitu fraksi 4, 5, dan 6. Fraksi 4 memiliki aktivitas yang tinggi sekitar 63.20 U/mL, namun kedua fraksi yang lain yaitu fraksi 5 dan 6 menunjukkan aktivitas yang sangat rendah sebesar 1.25 U/mL dan 1.34 U/mL hal ini menunjukkan pada fraksi tersebut masih terdapat protein lain yang memiliki bobot molekul relatif sama dengan glukosa oksidase. Hasil pemurnian yang dihasilkan dari tahap ekstrak kasar, pengendapan amonium sulfat 60-80 %, dan kromatografi filtrasi gel (Tabel 1) menunjukkan protein total dari tahap ke tahap semakin kecil, hal ini menunjukkan bahwa terjadi pengurangan pengotor yang terdapat pada larutan, pengotor dapat berupa protein atau metabolit lain. Aktivitas spesifik menunjukkan tingkat kemurnian suatu protein, aktivitas spesifik pada setiap tahapan mengalami kenaikan karena terjadi pengurangan pengotor sehingga dari aktivitas spesifik ini menunjukkan bahwa hanya glukosa oksidase yang bekerja dalam bereaksi dengan substrat. Aktivitas spesifik glukosa oksidase fraksi 4 hasil pemurnian dengan kromatografi memiliki tingkat kemurnian sebesar 8.86 kali dengan yield 9.82 %.
dengan gugus penukar ion pada matriks sehingga hasil akhir yang diperoleh berupa glukosa oksidase murni. Karena pada penelitian ini tidak dilakukan pemurnian dengan kromatografi penukar ion melainkan hanya menggunakan kromatografi filtrasi gel, maka glukosa oksidase yang diinginkan belum seluruhnya terpisah secara sempurna. Hasil yang optimal juga dapat diperoleh jika pemurnian dilakukan dengan menggunakan gradien garam. Gradien garam diperlukan untuk mengurangi interaksi elektrostatik yang lemah antara matriks kromatografi dengan protein, sehingga protein yang menempel pada matriks dapat terelusi keluar dan terpisah dengan baik (Harvard Apparatus 2013). FPLC (Fast Performance Liquid Chromatography) juga dapat digunakan untuk mendapatkan hasil analisis protein yang lebih baik. Laju alir akan teratur dan fraksi yang keluar tidak melebihi volume yang seharusnya, sehingga fraksi aktif yang diperoleh adalah fraksi yang murni mengandung protein yang diinginkan serta memiliki resolusi yang baik (Agilent 2013).
Elektroforegram Glukosa Oksidase
Elektroforesis adalah teknik untuk memisahkan molekul berdasarkan muatan dan berat molekul (Bintang 2010). Jenis elektroforesis yang digunakan adalah jenis elektroforesis gel yang tersusun atas poliakrilamid. Berat molekul glukosa oksidase dari setiap fraksi akan divisualisasikan dengan metode SDS-PAGE. Gel penahan yang digunakan untuk analisis SDS-PAGE sebesar 5 % dengan gel pemisah 10 %. Gel tersebut mengandung akrilamida, TEMED, APS dan SDS. Gel akrilamid terbentuk akibat terjadinya proses polimerisasi akrilamida dengan metilenbisakrilamida dan amonium persulfat sebagai katalisator (Janson dan Ryden 1998). Fungsi penambahan SDS pada pembuatan gel yaitu untuk mengikat bagian hidrofobik pada protein, sehingga molekul terurai dari lipatannya dan muatan protein tersebut sama. Muatan yang sama bertujuan agar protein terpisah berdasarkan perbedaan bobot molekul (Lawati 2013). Selama elektroforesis digunakan arus sebesar 80 mA selama kurang lebih 2 jam. Pada proses ini protein yang memiliki bobot molekul lebih kecil akan bermigrasi lebih cepat daripada protein yang berbobot molekul lebih besar.
Sampel SDS-PAGE yang dianalisis jumlah pita dan bobot molekulnya adalah sampel dari ekstrak kasar, pengendapan 60-80 % ammonium sulfat, dialisis, dan kromatografi filtrasi gel. Penggunaan empat sampel ini diharapkan bobot molekul glukosa oksidase dapat ditentukan secara tepat. Gel diwarnai dengan pewarna coomassie brilliant blue yang memiliki limit deteksi sebesar 20-60 µg. Limit deteksi untuk setiap fraksi protein berbeda, untuk fraksi protein yang memiliki tingkat kemurnian tinggi maka limit deteksinya sekitar 0.5-5 µg sedangkan untuk fraksi protein yang masih terdapat banyak pengotor dari protein atau metabolit lainnya memiliki limit deteksi sekitar 20-60 µg (Harisha 2007). Pewarnaan dengan coomassie brilliant blue relatif kurang sensitif dibandingkan dengan pewarnaan dengan silver staining, namun pewarnaan dengan coomassie brilliant blue sangat umum dan baik digunakan pada semua jenis protein (Wenk & Fernandis 2007 dalam Seftiono 2008).
metabolit lain yang terkandung di dalam larutan sehingga glukosa oksidase masih ada yang terpusat di protein atau pengotor lainnya sehingga walaupun kadar protein yang dihasilkan dari hasil perhitungan memungkinkan pita untuk tervisualisasi pada elektroforegram namun glukosa oksidase belum tervisualisasikan dengan baik karena adanya gangguan tersebut. Selain itu untuk mendapatkan ekstrak kasar yang pekat dalam metode isolasi enzim sebaiknya penggunaan bufer tidak terlalu banyak sehingga larutan enzim yang dihasilkan tidak terlalu encer. Fraksi ammonium sulfat 60-80 % yang terdapat pada Gambar 2.2 menunjukkan sekitar lima buah pita dengan perkiraan berat molekul sekitar 85 kDa, 77 kDa, 61 kDa, 52 kDa, dan 36 kDa (Gambar 2.2). Hasil dialisis terdapat sekitar tiga buah pita dengan perkiraan 94 kDa, 78 kDa, 58 kDa (Gambar 2.3). Perkiraan pita pada hasil kromatografi filtrasi gel terdapat sekitar dua pita yang berukuran 124 kDa dan 80 kDa (Gambar 2.4). Menurut Singh dan Verma (2013) bobot molekul asli dari glukosa oksidase yang diisolasi dari A. niger adalah sebesar 160 kDa, sementara denaturasi dari SDS terhadap glukosa oksidase pada elektroforesis SDS-PAGE menunjukkan pita yang berukuran 80 kDa, hal tersebut mengindikasikan bahwa glukosa oksdiase merupakan protein homodimerik yang terdiri atas dua subunit yang serupa. Hasil yang diperoleh pada gambar 2 lajur 4 menunjukkan bahwa terdapat protein yang berukuran 80 kDa, hal ini menunjukkan bahwa pemurniaan dengan menggunakan kromatografi filtrasi gel berhasil memperoleh subunit glukosa oksidase yang murni walaupun belum terlalu sempurna karena masih terdapat satu buah pita yang tidak diinginkan yaitu 124 kDa. Terdapatnya pita protein dengan ukuran 124 kDa diperkirakan merupakan protein yang belum terpecah menjadi subunit glukosa oksidase.
Jumlah pita pada elektroforegram yang muncul akan sama dengan jumlah puncak yang terdapat pada kromatogram, namun pada penelitian ini jumlah puncak kromatogramnya tidak sama dengan jumlah pita pada elektroforegram, hal tersebut dapat terjadi karena faktor laju alir yang terlalu cepat sehingga fraksi yang tertampung terlalu banyak dan berakibat pada keterpisahan protein yang menjadi tidak sempurna. Hal tersebut dapat dilihat dari tingginya puncak fraksi 4 dibandingkan dengan fraksi 5 dan 6 yang cenderung belum terpisah sempurna. Besarnya laju alir dapat disebabkan karena distribusi gel yang tidak merata saat preparasi kolom sehingga gel yang berada dibawah lebih padat daripada gel yang berada diatas dan akibatnya laju alir di kolom bagian paling bawah akan lebih cepat terelusi keluar. Besarnya volume yang tertampung pada tiap fraksi juga harus diperhatikan, hal ini dapat mengakibatkan terelusinya protein lain yang berukuran serupa bersamaan dengan protein target dan menyebabkan timbulnya dua buah pita pada elektroforegram. Hal tersebut dapat disiasati dengan memperkecil volume elusi sehingga volume yang tertampung tidak terlalu besar dan memperkecil kemungkinan terelusinya protein non-target bersamaan dengan protein target (Fathin 2013). Kemungkinan lain dari terdapatnya dua pita pada elektroforegram hasil kromatografi adalah pita 124 kDa yang tampak, terjadi akibat adanya akumulasi protein dari sampel amonium sulfat dan dialisis yang tidak tampak pada Gambar 2.2 dan 2.3 sehingga protein-protein tersebut terakumulasi dan terlihat pada hasil kromatografi filtrasi gel.
ion terjadi proses pemisahan yang didasarkan pada substansi yang berbeda (Walsh 2002). Faktor yang membedakan substansi tersebut salah satunya adalah jenis muatan. Diketahui jenis muatan glukosa oksidase adalah negatif karena pH yang dimiliki glukosa oksidase di atas titik isoelektriknya yaitu 4.2 (Pazar dan Kleppe 1964). Jenis muatan mempengaruhi pengikatan protein terhadap matrik, jenis muatan yang berbeda atau bahkan tidak bermuatan akan menyebabkan protein yang tidak diinginkan menjadi tidak terikat dan ikut tercuci keluar, sehingga hanya protein target yang akan tertampung dan bersih dari kontaminan. Hasil visualisasi pita SDS-PAGE pada kromatografi (Gambar 2.4) menunjukkan pita yang lebih sedikit dibandingkan dengan jumlah ammonium sulfat (Gambar 2.2) dan dialisis (Gambar 2.3), hal ini menunjukkan bahwa beberapa protein dapat dipisahkan pada proses pemurnian bertingkat seperti ammonium sulfat dan kromatografi.
Kinetika Glukosa Oksidase
Karakter utama yang ditentukan dalam mempelajari sifat kinetik enzim adalah kecepatan katalitik maksimum (Vmaks) dan konsentrasi substrat pada saat kecepatan kinetik mencapai setengah maksimum (Km). Kecepatan reaksi suatu enzim pada setiap konsentrasi substrat dapat dihitung jika nilai Km dan Vmaks enzim tersebut diketahui (Lehninger et al. 2004). Kinetika glukosa oksidase A. niger isolat lokal dapat ditentukan melalui persamaan Lineweaver-Burk. Persamaan ini merupakan turunan dari persamaan Michaelis-Menten. Persamaan garis Lineweaver-Burk merupakan persamaan linear, sehingga lebih mudah digunakan secara matematis. Menurut Harisha (2007) invers kecepatan reaksi (1/v) diplot terhadap invers konsentrasi substrat (1/[S]).
Data yang dihasilkan merupakan hasil reaksi pada konsentrasi substrat yang berbeda yaitu dari 10 – 100 mM. Data yang diperoleh diplot ke dalam kurva (Gambar 2). Persamaan linear yang diperoleh dari uji kinetika adalah y = 10.569x + 268.19 dengan nilai r2 sebesar 0.9962. Persamaan tersebut memiliki variabel x untuk 1/[S] dan y untuk 1/v. Nilai Vmaks yang diperoleh adalah sebesar 3.7 x 10-3 mmol/det, sedangkan Km diperoleh dari gradien persamaan garis pada persamaan Lineweaver-Burk Km/Vmaks, sehingga nilai Km yang diperoleh dari perhitungan adalah 39 mM. Nilai Km adalah konsentrasi susbtrat yang diperlukan untuk mencapai setengah dari laju reaksi maksimum aktivitas enzim terhadap substrat. Nilai Km berbanding lurus dengan konsentrasi substrat, artinya jika nilai Km suatu enzim tinggi maka konsentrasi substrat yang dibutuhkan juga tinggi untuk dapat mencapai setengah laju reaksi maksimum. Konsentrasi glukosa pada penelitian ini sebesar 39 mM yang merupakan jumlah glukosa yang dibutuhkan untuk mencapai setengah kecepatan maksimumnya. Terdapat penelitian lain yang menunjukkan nilai Km lebih rendah dibandingkan penelitian ini yaitu nilai Km glukosa oksidase dari A. niger (Sigma tipe VIII) hasil fraksi pemurnian kromatografi kolom yang memiliki nilai sebesar 30 mM (Kalisz et al. 1991) dan Km glukosa oksidase dari
A. niger hasil penelitian Swoboda dan Vincent pada tahun 1965 yaitu sebesar 33 mM.
Semakin rendah nilai Km, maka semakin kuat ikatan antara enzim dengan substrat. Apabila nilai Km besar berarti enzim mempunyai afinitas rendah terhadap substrat, sehingga kesetimbangan reaksi kearah E+S (Campbell 2004). Nilai Km pada penelitian ini tergolong masih besar dibandingkan dengan penelitian yang telah dilakukan oleh Kalisz et al. pada tahun 1991, hal ini menunjukkan bahwa glukosa oksidase pada penelitian ini masih memiliki afinitas yang rendah terhadap substrat sehingga masih kurang efisien jika ingin digunakan untuk aplikasi lain, maka dari itu glukosa oksidase pada penelitian ini harus dimurnikan kembali untuk menghasilkan nilai Km yang lebih rendah. Perbedaan nilai Km dapat disebabkan oleh beberapa faktor, diantaranya adalah penggunaan konsentrasi bufer yang berbeda ketika meresuspensi glukosa oksidase selama tahap proses pemurnian dan berbedanya isolat A. niger yang digunakan juga dapat mempengaruhi nilai Km yang dihasilkan (Gaikwad et al. 2006 dalam Keyhanpour et al. 2012). Afinitas glukosa oksidase dapat ditingkatkan kembali dengan melakukan pemurnian lanjutan menggunakan kromatografi penukar ion sehingga nilai Km yang dihasilkan bisa lebih baik lagi.
SIMPULAN DAN SARAN
Simpulan
Pemurnian glukosa oksidase dari isolat Aspergillus niger (IPBCC 08610) dengan menggunakan ammonium sulfat 60-80 % dan kromatografi kolom filtrasi gel dapat meningkatkan pemurnian sebesar 6.48 kali dan 8.86 kali dibandingkan dengan ekstrak kasar enzim. Aktivitas spesifik tertinggi diperoleh pada glukosa oksidase hasil pemurnian dengan kromatografi kolom filtrasi gel yaitu sebesar 31.92 U/mg. Karakterisasi yang dilakukan menghasilkan perkiraan bobot molekul glukosa oksidase yaitu sebesar 80 kDa. Glukosa oksidase memiliki nilai Km sebesar 39 mM dengan Vmax sebesar 3.7 x 10-3 mmol/det.
Saran
DAFTAR PUSTAKA
Abdullah. 2013. Pemurnian dan Karakterisasi Enzim Glukosa Oksidase dari Isolat Lokal Aspergillus niger (IPBCC.08.610).[skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Agilent. 2013. Size exclusion chromatography for biomolecule analysis. USA: Agilent Technologies.
Baehaki A. 2012. Kolagenase Bacillus licheniformis F11 asal Palembang dan aplikasinya pada pembuatan peptida kolagen bioaktif. [tesis]. Bogor (ID) : Institut Pertanian Bogor.
Bankar SB, Bule MV, Singhal RS, Ananthanarayan L. 2009. Optimization of
Aspergillus niger fermentation for the production of glucose oxidase. Food Bioprocess Technol 2: 344-352.
Bennett E. P. Swoboda, Vincent Massey.1965. Purification and properties of the glucose oxidase from Aspergillus niger. J.Biol.Chem, 240:2209-2215. Bergmeyer HU. 1988. Methods of enzymatic analysis. 3rd Ed. Vol. II :
Samples,reagents, assesment of result.
Bhatti HN, Saleem N. 2009. Characterization of glucose oxidase from Penicillium notatum. Food Technol. Biotechnol 47 (3): 331–335.
Bintang M. 2010. Biokimia – Teknik Penelitian. Jakarta. Erlangga. Bollag DM, Edelstein Sj.1991. Protein Methods. New York: Wiley-Liss.
Campbell ER, Campbell WH, Gullaume G Barbier, Jochi RC. 2004. Purification and biochemical characterization of simplified eukaryotic nitrate reductase expressed in Pichia pastoris. Protein Expr Purif. 37(1):61-71.
Fathin M Faris. 2013. emurnian enzim β 1,3-1,4 Glukanase dari Bakteri
Burkholderia cepacia Endofitik Padi.[skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Firman P, Aryantha INP. 2003. Eksplorasi dan isolasi enzim gluksoa oksidase dari fungi imperfeksti (genus Penicilium dan Aspergillus) indigenus. Pertemuan Imnial Tahunan (PIT) Perhimpunan Mikrobiologi Indonesia ; Bandung 29-30 Agustus 2003.
Gaikwad PD, Shirale DJ, Grade VK, Savale PA, Kharat HJ, Kakde KP, Shirsat MD. 2006. Immobilization of GOD on electrochemically synthesized PANI films by cross-linking via glutaraldehyde for determination of glucose. Int J Elektrochem Sci. 1:425-434.
Hamid M, Khalil-ur-Rehman, Zia MA, Ashgar M. 2003. Optimization of various parameters for the production of glucose oxidase from rice polishing using
Aspergillus niger. Asian network Sci. Infor. Biotechnoli. 2:1-7.
Harisha S. 2007. Biotechnology procedures and experiments handbook. Infinity Science Press. New Delhi, India.
Harvard apparatus.2013. Guide to gel filtration or size exclusion chromatography. USA: Hill Road
Hatzinikolau et al. 1996. A new glucose oxidase from Aspergillus niger
HN Bhatti, M. Madeeha, M. Asgher, N. Batool. Purification and thermodynamic characterization of glucose oxidase from a newly isolated strain of
Aspergillus niger, Can. J. Microbiol 52. 519-524.
Jafari A.R, Sarrafzadeh M.H, Alemzadeh I, Vosoughi M. 2007. Effect of stirer speed and aeration rate on the production of glucose oxidase by
Aspergillus niger. Journal of Biological Sciences 7(2) : 270-275.
Janson J C, L.Ryden.1998. Protein Purification: Principles, High Resolution Methods, and Applications. 2nd edn. pp. 145-205.Wiley-VCH, New York Kalisz HM, Hecht HJ, Schomburg D, Schimd RD. 1991. Effects of carbohydrate
depletion on the structure stability and activity of GOD from Aspergillus niger. Biochem. Biophys. Acta 1080: 138-142.
Kim SJ et al.2005. Purification and characterization of fibrinolytic enzyme from cultured mycelia of Armillaria mellea. App Sci 252: 520-714.
Khurshid S, Kashmiri MA, Quershi Z, Ahmad W. 2011. Optimization of glucose oxidase production by Aspergillus niger. African Journal of Biotechnology
10(9): 1674-1678.
Lawati Nuni. 2013. Pemurnian parsial dan karakterisasi enzim kitinase dari
Beauveria bassina [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Lehninger A. 2004. Dasar-Dasar Biokimia. Jilid 1. Thenawidjaja M, penerjemah; Jakarta: Erlangga. Terjemahan dari: Principles of Biochemistry.
Lowry OH, Roserbrough NJ, Tarr AL, Randall RJ. 1951. Protein measurement with the folin phenol reagent. J.Biol.Chem: 265-275.
Naz S.2002. Enzymes and Food. Oxford University Press, Oxford.
Odenbunmi EO, Owalude SO. 2007. Kynetic and thermodynamic studies of glucose oxidase catalyzed oxidation reaction of glucose. J. Appl.Sci.Environt.Manage. 11: 95-100.
Pazar J.H, Kleppe K.1964.The Oxidation of Glucose and Related Compounds by Glucose Oxidase from Aspergillus niger. Biochemistry 3. 578-583.
Rogalski J, Fiedurek J, Lklezuk Z., Leonwicz A (1988). Optimation of glucose oxidase synthesis in submerged cultures of Aspergillus niger G-13 mutant.
Enzyme microbe. Technol 10. 508-511.
Rosenberg IM, 2005. Protein Analysis and Purification : Benchtop techniques.
New York (US). Springer Publishing.
Sabir S, Bhatti HN, Zia MA, Sheikh MA. 2007. Enhanced Production of glucose oxidase using Penicillium notatum and rice polish. Biotechnol 45 (4) 443-446.
Sambrook J, Russell DW. 2001. Molecular Cloning: A Laboratory Manual. USA: Cold Spring Harbor Laboratory Press.
Sandip B. Bankar, Mahesh V. Bule, Rekha S. Singhal, Laxmi Ananthanarayan. 2009. Glucose oxidase – An overview. Biotechnology advance 27 : 489 – 501.
Scopes RK.1987. Protein Purification Principle and Practice. New York: Springer Velag.
Simpson C. 2005. Isolation, purification and characterization of a novel glucose oxidase from Penicillium canescens Tt42. [tesis]. Afrika: Rhodes University.
Simpson C, Jordaan J, Gardiner NS, Whiteley C. 2007. Isolation, purification and characterization of a novel glucose oxidase from Penicillium sp. CBS 120262 optimally active at neutral pH. Protein Expression and Purification 51: 260–266.
Singh J, Verma N. 2010. Partition of glucose oxidase from Aspergillus niger in aqueous two-phase systems based on salt and polyethylene glycol. Braz.
Suhartono MT. 1989. Enzim dan Bioteknologi. Bogor: IPB PAU Bioteknologi.
Triana R. 2012. Pemurnian dan Karakterisasi Enzim Glukosa Oksidase dari Isolat Lokal Aspergillus niger (IPBCC.08.610).[skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Walsh G.2002. Protein Biochemistry and Biotechnology. John wiley and Sons: New York.
Lampiran 1 Bagan alir proses penelitian
A.niger ditumbuhkan dalam media
starter selama 24 jam, 120 rpm
A.niger dipindahkan dalam media
produksi selama 48 jam, 120 rpm
Miselia digerus dengan glass bead dengan perbandingan 1:1
Miselia
Disentrifugasi 12.000 rpm, 20 menit
*Supernatan (Fraksi kasar)
Pengendapan dengan amonium sulfat 0-60%
Supernatan
*Fraksi 0-60%
Diresuspensi dengan bufer fosfat sitrat 0.1 M, pH 5.6
Pelet
Pengendapan dengan amonium sulfat 60-80%
Disentrifugasi 12.000 rpm, 15 menit
Disentrifugasi 12.000 rpm, 15 menit
Pelet
Diresuspensi dengan bufer fosfat sitrat 0.1 M, pH 5.6
*Fraksi 60-80%
(Lanjutan) Lampiran 1 Bagan alir proses penelitian
*Fraksi dialisis
Dialisis dengan membran dialisis (MWCO 12 kDa), bufer fosfat
sitrat 0.001 M, pH 5.6, 9 jam
Kromatografi kolom filtrasi gel dengan Sephadex G-150, bufer
fosfat sitrat 10 mM
*Fraksi kromatografi Lanjutan bagan alir
@
Keterangan : *Semua fraksi dihitung kadar protein, aktivitas, dan dielektroforesis SDS-PAGE
0 Lampiran 2 Kurva standar protein
Kurva standar protein dengan bufer fosfat pH 6
Kurva standar protein bufer fosfat sitrat pH 5.6
Lampiran 3 Kadar protein dan aktivitas glukosa oksidase semua fraksi
Keterangan : *Fraksi (NH4)2SO4 60-80% sudah didialisis
Contoh perhitungan pada lampiran 4
Keterangan : *Fraksi (NH4)2SO4 60-80% sudah didialisis
Lampiran 4 Contoh perhitungan kadar protein dan aktivitas enzim (Enzim kasar ulangan pertama)
Kadar Protein enzim kasar
y = 8,04x10-4 x + 0.174 0.531 = 8,04x10-4 x + 0.174
0.357 = 8,04x10-4 x x = 0.357/ 8,04x10-4
x = 446.25 [µg/ml] Kadar protein dikali FP = 446.25 x 4
= 1.78 mg/mL
Aktivitas (mL) x volume total x t x volume enzim
(
1
8.3 x (0.463-0.058)) x 3.1 x 2
0.5 x 0.1
= 6.05 U/mL
Satu unit Glukosa Oksidase akan mengoksidasi 1.0 mikromol substrat β
-D-glukosa menjadi δ-glukonolakton dan H2O2 per menit. Keterangan:
ΔA = (At– A0)
Volume total = 3.1 mL
Koefisien ekstingsi o-dianisidin = 8.3 mM-1 cm-1
Tebal kuvet = 1 cm
Volume enzim = 0.1 mL
t = menit
Aktivitas Total (U) = Aktivitas (U/mL) x volume total Fraksi (mL) = 6.05 U/mL x 200 mL
= 1210.00 U
Protein Total (mg) = Protein (mg/mL) x volume total fraksi (mL) = 1.78 mg/mL x 200 mL
= 356 mg
Aktivitas spesifik (
mg) =
Aktivitas total ( )
protein total (mg)
= 1210.00
= 3.39 U/mg
Yield (%) = aktivitas total fraksi ( )
aktivitas total ekstrak kasar ( )
x
100
= 1210.00
1210.00 = 100 %
Kemurnian =
aktivitas spesifik fraksi (mg)
aktivitas spesifik ekstrak kasar (mg)
= 3.3λ /mg
Lampiran 5 Penentuan nilai Km dan Vmaks glukosa oksidase
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 14 Desember 1992 dari ayah bernama Sutopo dan ibu bernama Nurdiana. Penulis merupakan anak pertama dari 2 bersaudara. Pendidikan penulis dimulai dari SDN Pondok Kopi 04 Pagi, kemudian melanjutkan pendidikan ke jenjang Sekolah Menengah Pertama di SMP Negeri 139 Jakarta. Tahun 2010 penulis menyelesaikan pendidikan Sekolah Menengah Atas di SMA Negeri 103 Jakarta dan pada tahun yang sama lolos seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI) dan diterima di Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan penulis pernah menjadi asisten praktikum mata kuliah Pengantar Penelitian Biokimia 2013. Penulis juga aktif dalam kegiatan organisasi kampus sebagai anggota Kementrian Pendidikan BEM KM IPB 2011. Penulis juga pernah aktif dalam beberapa kepanitiaan seperti panitia Kompetisi Basket Asrama 2010, Dormitory Fair 2010, Biochemistry Champion League 2011-2012, Gebyar Nusantara 2011, Masa Perkenalan Mahasiswa Baru 2011, International Scholarship Education Expo 2011, Pesta Sains Nasional 2013, SPIRIT FMIPA 2013, Masa Perkenalan Fakultas 2012, Masa Perkenalan Kampus Mahasiswa Biokimia tahun 2012, ASPECT BEM FMIPA IPB 2012, Panitia Monitoring dan Evaluasi PKM IPB 2011-2014, Tri-University 2012, SUIJI 2012, IPB Green Living Movement 3 2013, dan Sehari Menjadi Mahasiswa FMIPA IPB 2013. Juni 2014, penulis mengikuti pelatihan pengenalan HACCP SNI CAC/RCP 1:2011, Bulan Januari-Februari 2013 penulis melakukan magang di Laboratorium Biokimia BB Biogen, dan Bulan Juli-Agustus 2013 penulis melakukan Praktik Lapang di Laboratorium Biokimia, Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik (BB Biogen) Bogor dengan judul Optimasi Isolasi DNA Bakteri Burkholderia cepacia untuk Amplifikasi Gen Penyandi β-1,4 Glukanase.