PENAPISAN KOMUNITAS BAKTERI RIZOSFER
SECARA
IN PLANTA
UNTUK MENINGKATKAN
PERTUMBUHAN JAGUNG DI LAHAN KERING
ERNIN HIDAYATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa disertasi berjudul Penapisan Komunitas Bakteri Rizosfer secara In Planta untuk Meningkatkan Pertumbuhan Jagung di Lahan Kering adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2015
Ernin Hidayati
RINGKASAN
ERNIN HIDAYATI. Penapisan Komunitas Bakteri Rizosfer secara In Planta untuk Meningkatkan Pertumbuhan Jagung di Lahan Kering. Dibimbing oleh ARIS TRI WAHYUDI, ANTONIUS SUWANTO dan RAHAYU WIDYASTUTI.
Indonesia mempunyai ketersediaan lahan kering yang luas yang potensial untuk pengembangan berbagai komoditas tanaman penting seperti jagung, namun peningkatan kapasitasnya masih terkendala oleh berbagai permasalahan antara lain kekeringan dan tingkat kesuburan tanah yang rendah. Aplikasi mikrob untuk meningkatkan produktivitas lahan kering telah banyak dilakukan. Meskipun demikian pencarian inokulum mikrob yang efektif yang sesuai dengan permasalahan lahan kering harus terus dilakukan. Dalam penelitian ini, dilakukan penapisan in planta untuk mendapatkan komunitas bakteri rizosfer yang potensial sebagai pemacu pertumbuhan tanaman jagung di lahan kering. Kelompok bakteri dominan yang merupakan bagian dari komunitas bakteri yang terseleksi secara in planta juga dipelajari untuk mengetahui karakter pemacu tumbuhnya serta potensi dan peranannya dalam pertumbuhan tanaman jagung pada penelitian skala rumah kaca.
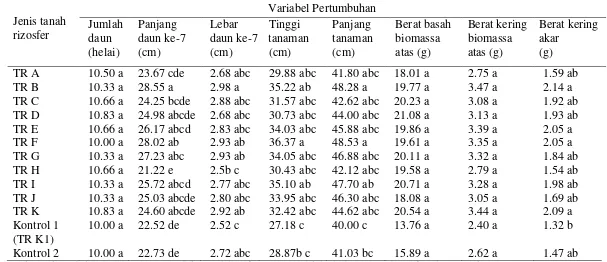
Sebanyak 11 sampel tanah rizosfer (TR A, TR B, TR C, TR D, TR E, TR F, TR G, TR H, TR I, TR J, dan TR K) dikoleksi dari tanaman jagung terpilih yang tumbuh di dua lokasi pengembangan lahan kering di Pulau Lombok, NTB. Hasil percobaan pada skala rumah kaca terhadap pengaruh penambahan 100 g tanah rizosfer pada media tanam jagung menunjukkan bahwa TR D memberikan pengaruh yang paling baik terhadap pertumbuhan. Pada kadar air media tanam 50% kapasitas lapang, perlakuan TR D menghasilkan rerata peningkatan berat basah biomassa bagian atas sebesar 47.1%, berat kering biomassa bagian atas sebesar 45.2% dan berat kering akar sebesar 33.4%.
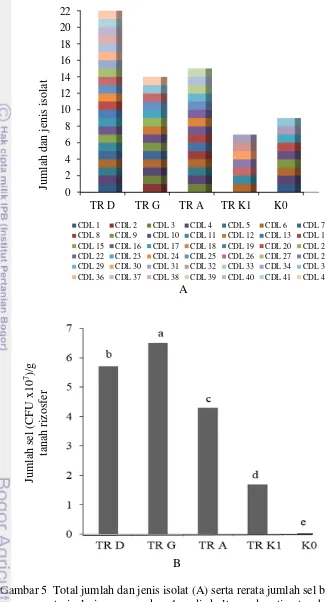
Berdasarkan kajian awal terhadap jumlah dan jenis bakteri yang dikultur menggunakan empat macam media kultur, diketahui bahwa TR D dihuni oleh paling sedikitnya 22 isolat bakteri dan 5.72 x 107 sel bakteri per gram tanahnya.
Jumlah isolat tersebut lebih banyak dibanding jumlah isolat yang ditemukan pada sampel tanah rizosfer lainnya. Analisis T-RFLP dengan pendekatan metagenom menunjukkan bahwa sebanyak 8 T-RF terdeteksi pada komunitas bakteri TR D. Jumlah T-RF tersebut lebih banyak dibanding jumlah T-RF yang terdeteksi pada komunitas lainnya. Pada pendekatan pengkulturan, sebanyak 7 T-RF terdeteksi pada komunitas TR D. Jumlah T-RF tersebut sama dengan jumlah T-RF yang terdeteksi pada komunitas TR A. Pada metagenom, keanekaragaman komunitas bakteri TR D berdasarkan indeks Shannon adalah 1.60. Tingkat keanekaragaman tersebut lebih tinggi dibanding komunitas lainnya. Pada pengkulturan, keanekaragaman komunitas bakteri TR D adalah 1.58. Tingkat keanekaragaman tersebut lebih rendah dibanding komunitas TR A dan lebih tinggi dibanding komunitas lainnya. Komunitas TR D tersusun antara lain oleh kelompok
Burkholderiales, Pseudomonas, Bacillus, Candidatus, Alphaproteobacteria, Betaproteobacteria, Rhizobiales, Sinobacteraceae, dan Acidobacteria.
sebesar 42.88% dan terdeteksi pada metagenom dengan tingkat kelimpahan relatif sebesar 17.38%.
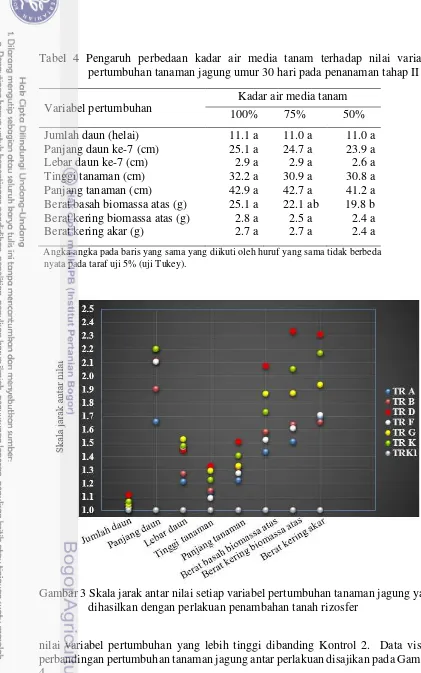
Pseudomonas sp. strain L485 merupakan sebagian kelompok Pseudomonas
sp. penyusun komunitas TR D. Bakteri ini merupakan bakteri rizosfer penghasil asam indol asetat (IAA) dan eksopolisakarida (EPS). Pada medium King’s cair yang mengandung 5 ppm L-triptofan, bakteri ini memproduksi IAA sebanyak 4.97 ppm pada saat jumlah sel mencapai 3.74 x 1010 sel per ml dan 11.95 ppm pada saat populasi sel berada pada tahap stasioner. Kultur berumur 3 hari yang tumbuh pada medium King’s agar dapat memproduksi EPS sebanyak 0.058 mg per mgsel kering dengan konsentrasi D-glukosa sebesar 30.272 ppm per mg EPS kering. Pada skala rumah kaca, dengan perlakuan dosis pupuk NPK 100%, 75%, 50%, dan 0% serta pengaturan kadar air media tanam 100%, 75% dan 50% kapasitas lapang menunjukkan bahwa aplikasi Pseudomonas sp. strain L485 pada kecambah dan media tumbuh dapat memacu pertumbuhan tanaman jagung. Di antara ketiga kondisi air media tanam yang diuji, rerata nilai variabel pertumbuhan paling tinggi terlihat pada perlakuan kadar air 50% kapasitas lapang. Bila dibandingkan dengan tanpa inokulum, pemberian inokulum Pseudomonas sp. strain L485 dapat meningkatkan berat basah biomassa bagian atas sebesar 51.2% dan berat kering biomassa bagian atas sebesar 48.2%. Peningkatan tertinggi terutama terlihat pada berat kering akar yaitu sebesar 66.7%.
SUMMARY
ERNIN HIDAYATI. In Planta Screening of Bacterial Community for Maize Growth Promoting in Dryland. Supervised by ARIS TRI WAHYUDI, ANTONIUS SUWANTO and RAHAYU WIDYASTUTI.
Indonesia has wide proportion of dryland and its potential for the development of a variety of important crops, such as maize. Increment of the dryland capacity is still constrained by various problems, among others, drought and low soil fertility. Microbial applications to increase the dryland productivity have been carried out. However, effective microbial inoculum for specific problems in the dryland should continue to explore. In this study, in planta screening was done to obtain potential rhizosphere bacterial community for growth promoting of maize in dryland. The dominant bacterial group from selected bacterial community was also analysed for plant growth promoting characteristics and its potency and role in the growth of maize in greenhouse.
A total of 11 rhizosphere soil samples (TR A, TR B, C TR, TR D, TR E, F TR, TR G, H TR, TR I, J TR, and TR K) were collected from selected maize grown in two farm of dryland development located in Lombok, West Nusa Tenggara. In green house screening, a 100 g of each rhizosphere soil sample was added to maize growth medium. The results showed that TR D gave the best growth performance of maize. In the 50% water content of growing media, TR D treatment generally showed increased fresh weight of upper biomass (47.1%), dry weight of upper biomass (45.2%) and highest increase of root dry weight (33.4%).
Based on cultivation method using four culture media showed that at least 22 bacterial isolates and 5.72 x 107 cells g-1 of soil were found in the TR D. Those number of isolate was higher compared with the others rhizosphere soil samples. T-RFLP analysis of bacterial community inhabitant of TR D showed that 8 T-RFs were detected based on metagenomic approach and 7 T-RFs based on cultivation-dependent approach. Those number of T-RF based on metagenomic approach was higher compared with the others communities in this study. Based on Shannon index, the diversity level of bacterial community of TR D was 1.6 in metagenomic and 1.58 in cultivation-dependent approach. The diversity level in metagenomic approach was higher compared with the others communities. The bacterial community structure of TR D included Burkholderiales, Pseudomonas, Bacillus, Candidatus, Alphaproteobacteria, Betaproteobacteria, Rhizobiales, Sinobactera-ceae, and Acidobacteria. Burkholderiales is the dominant group in metagenomic approach with eveness value was 45.83%. Pseudomonas sp. strain L485 is the dominant group in cultivation-dependent approach with eveness value was 42.88%.
Pseudomonas sp. strain L485 also detected in metagenomic with eveness value was 17.38%. Based on estimation of the dominance and existence in metagenomic and cultivation-dependent approaches, Pseudomonas sp. strain L485 was chosed to plant growth promoting characteristics and tested for its ability to promote the growth of maize in the greenhouse.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor
pada
Program Studi Mikrobiologi (MIK)
PENAPISAN KOMUNITAS BAKTERI RIZOSFER
SECARA
IN PLANTA
UNTUK MENINGKATKAN
PERTUMBUHAN JAGUNG DI LAHAN KERING
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
2
Penguji pada Ujian Tertutup: 1. Dr Ir Iman Rusmana, MSi
(Departemen Biologi, Fakultas MIPA IPB) 2. Dr Ir Suryo Wiyono, MScAgr
(Departemen Proteksi Tanaman, Fakultas Pertanian IPB)
Penguji pada Ujian Terbuka:
1. Dr Ir Suryo Wiyono, MScAgr
(Departemen Proteksi Tanaman, Fakultas Pertanian IPB) 2. Dr Edi Husen, MSc
3 Judul Disertasi : Penapisan Komunitas Bakteri Rizosfer secara In Planta
untuk Meningkatkan Pertumbuhan Jagung di Lahan Kering Nama : Ernin Hidayati
NIM : G361100071
Disetujui oleh Komisi Pembimbing
Prof Dr Aris Tri Wahyudi, MSi Ketua
Prof Dr Antonius Suwanto, MSc Anggota
Dr Rahayu Widyastuti, MScAgr Anggota
Diketahui oleh
Ketua Program Studi Mikrobiologi
Prof Dr Anja Meryandini, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
5
PRAKATA
Puji syukur penulis panjatkan kepada Allah Subhanahu Wa Ta’ala atas limpahan karunia dan kasih sayangNya sehingga disertasi ini berhasil diselesaikan. Penelitian ini dilaksanakan sejak Agustus 2012, dengan judul Penapisan Komunitas Bakteri Rizosfer secara In Planta untuk Meningkatkan Pertumbuhan Jagung di Lahan Kering.
Penulis menyampaikan penghargaan dan terima kasih yang mendalam kepada komisi pembimbing, Bapak Prof Dr Aris Tri Wahyudi, Bapak Prof Dr Antonius Suwanto dan Ibu Dr Rahayu Widyastuti, MScAgr atas semua bimbingan, arahan dan pembelajaran yang sangat bermakna yang diberikan dengan sepenuh hati dan penuh tanggung jawab. Serta atas segala kemudahan dalam berdiskusi dan urusan-urusan yang berkaitan dengan pembimbingan. Terima kasih juga penulis sampaikan kepada Bapak Dr Suryo Wiyono, MScAgr atas semua kebaikannya serta kritik dan sarannya sejak ujian lisan prakualifikasi calon doktor, ujian tertutup dan ujian terbuka. Kepada Bapak Dr Edi Husen, MSc penulis sampaikan terima kasih atas dukungan, kritik dan sarannya pada ujian terbuka, juga kepada Bapak Dr Iman Rusmana, MSi atas arahan, kritik dan saran perbaikan disertasi pada saat ujian tertutup. Penulis juga menyampaikan terima kasih kepada Ibu Dr Nisa Rahmania Mubarik, MSi atas kritik dan sarannya pada saat ujian lisan prakualifikasi calon doktor.
Ucapan terima kasih juga tak lupa disampaikan kepada Rektor dan Dekan FMIPA Universitas Mataram atas izin dan dukungan yang telah diberikan kepada penulis untuk mengikuti tugas belajar di IPB. Selain itu, kepada Bapak Prof Suwardji, PhD dan Bapak Sri Tejowulan, MSc PhD, penulis mengucapkan terima kasih atas diskusi dan kemudahan yang telah diberikan selama penulis melaksanakan penelitian di Fakultas Pertanian Universitas Mataram. Kepada Direktur PT Alaska Dwipa Perdana yang telah memberikan keleluasaan untuk menggunakan laboratoriumnya, penulis ucapkan terima kasih.
Untuk keluarga tercinta, suamiku terkasih M. Sukri Aruman, SPt dan putra putri tercinta M. Zamzami Sangga Firdaus dan Tiara Zahra Kamalia, adikku tersayang Eliza Roswati, SSiApt dan Arman Suryadi, SPt, ibundaku Hj. Hadeniyah dan ayahandaku H. Abdul Kadir (alm) yang terkasih dan tersayang, serta ibu mertua Seeinenn dan bapak mertuaku Guru Aruman (alm), terima kasih yang tulus penulis sampaikan atas dukungan, semangat, pengertian dan semua doa yang senantiasa diberikan.
Semoga disertasi ini bermanfaat. Amin.
Bogor, Juli 2015
6
Lahan Kering dan Pemanfaatannya untuk Pertanaman Jagung di NTB 6 Beberapa Upaya dalam Meningkatkan Produktivitas Lahan Kering 7
Peranan Bakteri dalam Pertumbuhan Tanaman 7
Upaya Pencarian dan Pengembangan Agen Hayati 8 Komunitas Mikrob sebagai Tolok Ukur Perubahan Lingkungan 9 Komunitas Bakteri Rizosfer pada Tanaman Jagung 10 3 METODE
Waktu dan Tempat Penelitian 12
Bahan 12
Alat 12
Penapisan Komunitas Bakteri Rizosfer secara In Planta 12 Kajian Awal Komunitas Bakteri Terkultur dari Sampel Tanah Rizosfer 15 Kajian Komunitas Bakteri Rizosfer Menggunakan Teknik T-RFLP
dengan Pendekatan Metagenom dan Pengkulturan
16 Kajian Karakter Pemacu Tumbuh dan Potensi Isolat Bakteri
Dominan sebagai Pemacu Tumbuh Tanaman Jagung
20
4 HASIL DAN PEMBAHASAN
Komunitas Bakteri Rizosferyang Menghasilkan Tanaman Jagung dengan Pertumbuhan Terbaik
24 Kajian Awal terhadap Jumlah dan Jenis Isolat Bakteri Penghuni Tanah Rizosfer
7
DAFTAR TABEL
1 Rerata nilai kumulatif variabel pertumbuhan tanaman jagung umur 30
hari pada penanaman tahap I 25
2 Pengaruh perbedaan kadar air media tanam terhadap rerata nilai variabel pertumbuhan tanaman jagung umur 30 hari pada penanaman tahap I 26 3 Rerata nilai kumulatif variabel pertumbuhan tanaman jagung umur 30
hari pada penanaman tahap II 27
4 Pengaruh perbedaan kadar air media tanam terhadap nilai variabel
pertumbuhan tanaman jagung umur 30 hari pada penanaman tahap II 28 5 Data parsial nilai variabel pertumbuhan tanaman jagung umur 30 hari
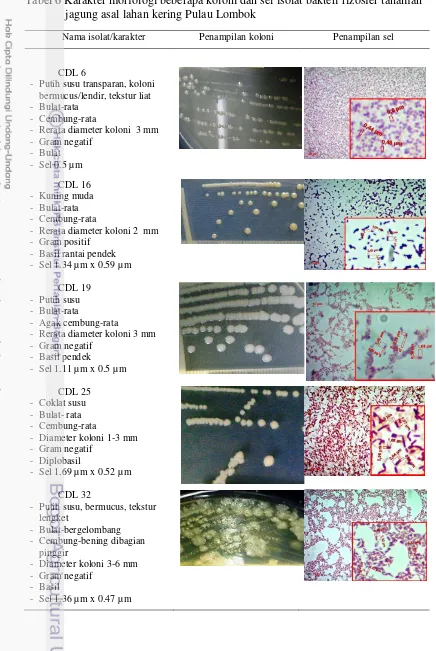
pada penanaman tahap III pada setiap perlakuan pemupukan 29 6 Karakter morfologi beberapa koloni dan sel isolat bakteri rizosfer
tanaman jagung asal lahan kering Pulau Lombok 32 7 Konsentrasi dan tingkat kemurnian DNA komunitas mikrob pada setiap
sampel tanah pada preparasi metagenom (A) dan pengkulturan (B) 40 8 Afiliasi filogenetik dari setiap ukuran T-RF 48 9 Perbandingan jumlah T-RF, tingkat keanekaragaman dan kemerataan
komunitas bakteri rizosfer hasil analisis T-RFLP dengan pendekatan
metagenom dan pengkulturan 50
10 Rerata nilai variabel pertumbuhan tanaman jagung umur 30 hari dengan perlakuan penambahan inokulum Pseudomonas sp. strain L485, pengaturan kadar air media tanam dan pemberian beberapa dosis pupuk 57 11 Rerata nilai variabel pertumbuhan tanaman jagung umur 30 hari pada
interaksi perlakuan pemberian inokulum Pseudomonas sp. strain L485 pada beberapa kadar air media tanam (100%, 75% dan 50% kapasitas
lapang) 61
DAFTAR GAMBAR
1 Diagram alir langkah kerja ( ) dan hasil penelitian ( ) 5 2 Distribusi area pertanaman jagung di Indonesia tahun 2000 6 3 Skala jarak antar nilai setiap variabel pertumbuhan tanaman jagung yang
dihasilkan dengan perlakuan penambahan tanah rizosfer 28 4 Perbandingan penampilan pertumbuhan tanaman jagung umur 30 hari
hasil penanaman tahap III pada beberapa dosis pupuk NPK. Kode lapang 1K: perlakuan penambahan TR K1 (tanah rizosfer steril); kode lapang 2K: perlakuan tanpa penambahan TR; kode lapang D: perlakuan
penambahan TR D 30
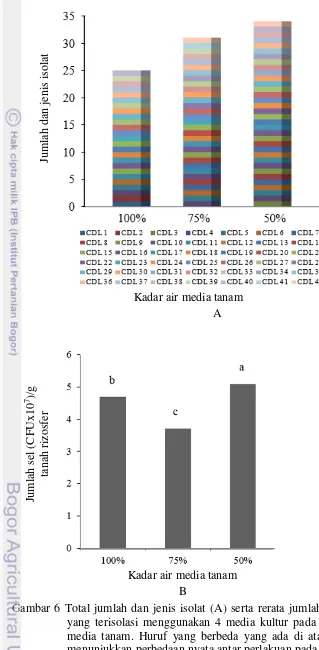
8
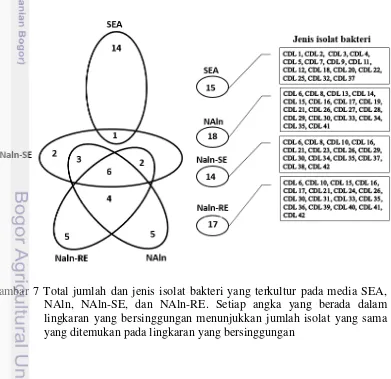
6 Total jumlah dan jenis isolat (A) serta rerata jumlah sel bakteri (B) yang terisolasi menggunakan 4 media kultur pada setiap kadar air media tanam. Huruf yang berbeda yang ada di atas grafik batang menunjukkan perbedaan nyata antar perlakuan pada taraf uji 5% (uji Tukey) 35 7 Total jumlah dan jenis isolat bakteri yang terkultur pada media SEA,
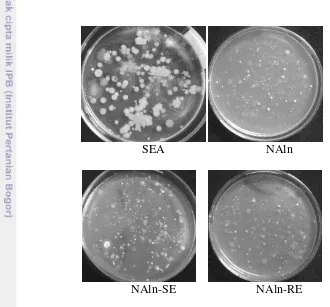
NAln, NAln-SE, dan NAln-RE. Setiap angka yang berada dalam lingkaran yang bersinggungan menunjukkan jumlah isolat yang sama yang ditemukan pada lingkaran yang bersinggungan 36 8 Perbedaan morfologi bakteri yang terkultur pada media SEA, NAln,
NAln-SE, dan NAln-RE dari pengenceran 10-3 setelah 6 hari inkubasi 37 9 Kemampuan antibiosis isolat CDL 19 (A), CDL 32 (B) dan CDL 25 (C)
saat ditumbuhkan pada medium SEA. Kemampuan antibiosis tidak muncul saat ditumbuhkan pada media NAln (D), NAln-SE (E) dan
NAln-RE (F) 39
10 Fragmen 16S rDNA komunitas bakteri yang diperoleh dengan pendekatan metagenom dan pengkulturan. M: marker, sumur 1: TR D,
sumur 2: TR A, sumur 3: TR K1, sumur 4: K0 41
11 Perbandingan profil fragmen 16S rDNA komunitas bakteri hasil potongan enzim EcoRI, BspI, HindIII, HhaI, dan MspI. U1: profil fragmen dari pendekatan pengkulturan, U2: profil fragmen dari
pendekatan metagenom 41
12 Perbandingan T-RF hasil pemotongan enzim MspI dan HhaI terhadap
isolat CDL 6, CDL 30 dan CDL 32 42
13 Perbandingan jumlah total T-RF yang diperoleh dengan pendekatan metagenom dan pengkulturan (A) serta jumlah dan ukuran T-RF yang muncul pada komunitas TR D, TR A, TR K1, dan K0 (B) 43 14 Perbandingan pola fingerprint T-RFLP komunitas bakteri rizosfer
dengan pendekatan metagenom (A) dan pengkulturan (B). Tanda lingkaran menunjukkan ukuran T-RF yang berbeda. Tanda panah menunjukkan ukuran T-RF yang sama yang diperoleh pada pendekatan metagenom dan pengkulturan pada sampel tanah yang sama 45 15 Kelimpahan relatif setiap ukuran T-RF yang muncul dari komunitas
bakteri rizosfer pada pendekatan metagenom (A) dan pengkulturan (B) 47 16 Komposisi komunitas bakteri rizosfer pada pendekatan metagenom (A)
dan pengkulturan (B) 49
17 Nilai koefisien keserupaan dan pengelompokan komunitas TR D, TR A, TR K1, dan K0 yang disusun berdasarkan korelasi Jaccard dengan metode UPGMA. Pendekatan metagenom (A) dan pengkulturan (B) 52 18 Kekeruhan kultur sel dan produksi IAA oleh Pseudomonas sp. strain
L485. Isolat ditumbuhkan pada 100 mL medium cair King’s yang mengandung 5 ppm L-triptofan dengan waktu inkubasi berbeda.
Kekeruhan kultur, Konsentrasi IAA 55
19 Produksi eksopolisakarida dan konsentrasi D-glukosa EPS pada
Pseudomonas sp. strain L485. Isolat ditumbuhkan pada medium King’s agar dengan waktu inkubasi berbeda. Konsentrasi D-glukosa EPS;
9 20 Perbandingan penampilan pertumbuhan antara tanaman jagung umur
30 hari tanpa pemberian inokulum (A) dan dengan pemberian inokulum
Pseudomonas sp. strain L485 (B) 59 21 Perbandingan nilai berat basah biomassa bagian atas tanaman jagung
umur 30 hari tanpa pemberian inokulum ( ) dan dengan pemberian inokulum Pseudomonas sp. strain L485 ( ) pada perlakuan penambahan beberapa dosis pupuk dan kadar air media tanam. Huruf yang berbeda yang ada di atas grafik batang pada masing-masing pasangan kombinasi perlakuan menunjukkan perbedaan nyata antar
perlakuan pada taraf uji 5% (uji Tukey) 60
22 Perbandingan nilai berat kering biomassa bagian atas tanaman jagung umur 30 hari tanpa pemberian inokulum ( ) dan dengan pemberian inokulum Pseudomonas sp. strain L485 ( ) pada perlakuan penambahan beberapa dosis pupuk dan kadar air media tanam. Huruf yang berbeda yang ada di atas grafik batang pada masing-masing pasangan kombinasi perlakuan menunjukkan perbedaan nyata antar
perlakuan pada taraf uji 5% (uji Tukey) 60
23 Perbandingan nilai berat kering akar tanaman jagung umur 30 hari tanpa pemberian inokulum ( ) dan dengan pemberian inokulum Pseudomonas
sp. strain L485 ( ) pada perlakuan penambahan beberapa dosis pupuk dan kadar air media tanam. Huruf yang berbeda yang ada di atas grafik batang pada masing-masing pasangan kombinasi perlakuan menunjukkan perbedaan nyata antar perlakuan pada taraf uji 5% (uji
Tukey) 61
DAFTAR LAMPIRAN
1 Lokasi pengambilan sampel tanah rizosfer tanaman jagung di Desa Akar Akar, Kabupaten Lombok Utara (A) dan Dusun Bukit Keramat
Pringgabaya, Kabupaten Lombok Timur (B) 73
2 Perhitungan kadar air media tanam pada penanaman tahap I. Angka
merupakan rerata dari 5 ulangan 74
3 Media dan komposisinya yang digunakan dalam penelitian 75 4 Matriks sebaran nilai variabel pertumbuhan tanaman jagung umur 30 hari
pada penanaman tahap I 76
5 Rerata nilai kumulatif variabel pertumbuhan tanaman jagung umur 30
hari pada penanaman tahap III 77
6 Ukuran T-RF hasil pemotongan enzim MspI yang muncul pada komunitas bakteri rizosfer tanaman jagung dengan pendekatan
metagenom dan pengkulturan 78
7 Uji hipersensitivitas Pseudomonas sp. strain L485 pada daun tembakau. Sebagai kontrol positif digunakan bakteri patogen Xanthomonasoryzae.
Strain L485 tidak menunjukkan respon HV berupa terbentuknya nekrosis seperti pada X. oryzae. Respon yang terbentuk serupa dengan yang ditunjukkan oleh medium King’s cair steril (kontrol negatif ) 80 8 Reaksi perubahan warna yang dihasilkan oleh Pseudomonas sp. strain
10
1
1
PENDAHULUAN
Latar Belakang
Kebutuhan akan lahan pertanian terus meningkat untuk memenuhi kebutuhan pangan global. Tingginya laju degradasi dan alih fungsi lahan pertanian subur yang cepat mengakibatkan ekspansi kegiatan pertanian mengarah pada lahan kering. Berdasarkan data MEA (2005), lebih dari 40% daratan dunia merupakan lahan kering. Luas lahan kering tersebut cenderung terus meningkat sejalan dengan meluasnya kekeringan sebagai akibat perubahan iklim global. Sejak tahun 1950 sampai 2008, area yang mengalami kekeringan meningkat sekitar 1.74% dan cenderung akan terus meluas pada masa yang akan datang (Dai 2011; Dai 2013). Tampak bahwa kekeringan merupakan salah satu masalah utama yang dihadapi dalam pengembangan pertanian global pada masa sekarang dan masa yang akan datang.
Indonesia mempunyai ketersediaan lahan kering seluas 78% dari luas daratannya (Abdurachman et al. 2008). Wilayah provinsi Nusa Tenggara Barat (NTB) merupakan bagian dari lahan kering tersebut. NTB mempunyai lahan kering bertipe iklim kering seluas 1673476.307 ha atau sekitar 83% dari luas wilayahnya yang meliputi Pulau Lombok dan Pulau Sumbawa. Namun dari total luas lahan kering yang ada, baru sekitar 626034.60 ha yang dapat dikembangkan (BAPPEDA NTB 2003). Ditinjau dari potensi, andalan dan unggulan yang dimiliki NTB, lahan kering tersebut sudah selayaknya dioptimalkan sesuai dengan kepentingan lokal untuk mempercepat laju pembangunan pertanian daerah. Lahan kering tersebut kini sedang giat dimanfaatkan untuk pertanaman berbagai komoditas, salah satu diantaranya adalah tanaman jagung. Sebagai komoditas unggulan, pengembangan tanaman jagung di lahan kering masih memerlukan berbagai upaya untuk meningkatkan pertumbuhan dan kapasitas produksinya.
Pada kenyataannya, pemanfaatan dan pengembangan pertanian lahan kering dari tahun ke tahun belum memberikan hasil yang memuaskan karena berbagai kendala (Suwardji & Tejowulan 2002). Menurut Abdurachman et al. (2008), pengembangan lahan kering untuk kegiatan pertanian terkendala oleh banyak faktor, terutama kekeringan dan tingkat kesuburan tanah yang rendah. Berbagai inovasi telah dilakukan untuk meningkatkan produktivitas lahan kering Indonesia, antara lain dengan melibatkan peranan mikrob. Penyertaan mikrob sebagai bagian dari pengembangan lahan kering merupakan langkah yang sudah tepat mengingat kontribusinya yang sangat penting bagi pertumbuhan tanaman, menjaga stabilitas ekosistem tanah, serta menjamin keberlanjutan ekosistem. Berbagai penelitian menjelaskan bahwa mikrob tanah berperan antara lain terhadap kesehatan tanah, produktivitas tanaman dan siklus karbon (van der Heijden et al. 2008; Fierer et al.
2
Komunitas bakteri rizosfer merupakan salah satu kelompok mikrob tanah yang hidup di daerah perakaran tanaman. Banyak jenis bakteri rizosfer telah dikembangkan sebagai agen hayati untuk memacu pertumbuhan tanaman. Agen hayati merupakan alternatif yang potensial dibanding pupuk kimia karena beberapa alasan antara lain tidak bersifat toksik serta aman dan murah bagi lingkungan. Oleh sebab itu, seiring dengan berbagai inovasi yang ada, pengembangan agen hayati perlu terus dilakukan. Namun permasalahan yang sering dihadapi dalam pengembangan agen hayati bahwa tidak semua jenis agen hayati efektif dan memberikan hasil yang konsisten selama aplikasi. Laporan banyaknya kasus hambatan dan kegagalan aplikasi agen hayati sejalan dengan laporan tingkat keberhasilan aplikasinya (Bashan & Dubrovsky 1996; Malusa et al. 2012; Mazid & Khan 2014). Penyebab kegagalan yang sering dilaporkan antara lain karena berkurangnya tingkat efektifitas agen hayati, ketidakmampuannya berkompetisi dengan mikrob indigenos dan ketidaksesuaian dengan kondisi lingkungan. Kemungkinan lain bahwa agen hayati berbasis strain tunggal dan multiple strain yang dikembangkan saat ini tidak mampu memberikan peranannya secara optimal dalam kompleksitas ekosistem tanah. Oleh sebab itu, perlu ditemukan strategi pengembangan agen hayati dan cara mendapatkan agen hayati yang efektif untuk tipe permasalahan lahan kering.
Beberapa peneliti berpendapat bahwa tidak ada strain bakteri pemacu tumbuh yang dapat bekerja dengan baik pada semua kondisi lahan (Bashan et al. 2014). Hasil penelitian Bashan dan Dubrovsky (1996) sebelumnya menjelaskan bahwa peningkatan hasil yang diberikan oleh pupuk hayati dapat menjadi tidak konsisten karena kondisi lingkungan dan agronomi yang berbeda. Pada kondisi tanah dan iklim yang berbeda, strain kemungkinan tidak berpengaruh terhadap pertumbuhan, bahkan dapat berdampak merusak tanaman yang sama (Upadhyay et al. 2011). Agar mampu bekerja lebih efektif, strain lokal dapat menjadi pilihan terutama untuk lahan suboptimal seperti lahan dengan kondisi kekurangan air (Bashan et al. 2014). Berkaitan dengan permasalahan dalam pengembangan tanaman jagung lahan kering, maka dalam penelitian ini pencarian sumber agen hayati dilakukan berbasis lokasi dengan menggali potensi komunitas bakteri rizosfer tanaman jagung dari lahan kering. Dalam bentuk konsorsium secara bersama-sama dalam komunitasnya, bakteri diharapkan lebih mampu memberikan peranannya secara lebih efisien dan efektif terutama karena adanya kesesuaian dengan kondisi lingkungan.
Proses pengembangan inokulan bakteri melibatkan berbagai tahapan. Potensi kesuksesan pengembangan inokulan bakteri yang dilakukan selama ini lebih diandalkan pada teknik formulasi dan metode aplikasi (Malusa et al. 2012; Bashan
et al. 2014). Pada tahap awal, sumber sampel dipilih dari berbagai tipe lingkungan atau rizosfer dari berbagai jenis tumbuhan. Selanjutnya dilakukan isolasi bakteri target, karakterisasi sifat pemacu tumbuh dan identifikasi isolat. Isolat terpilih kemudian diaplikasikan pada tanaman target pada skala rumah kaca (Bashan et al.
3 mendapatkan agen hayati yang efektif dan efisien sesuai dengan target aplikasi. Hal ini karena komunitas bakteri yang terseleksi secara in planta kemungkinan dihuni oleh bakteri yang berpotensi sebagai pemacu tumbuh. Selain komunitas bakteri secara keseluruhan, perlu juga dipelajari potensi dan peranan kelompok bakteri dominan yang merupakan bagian dari komunitas dalam memacu pertumbuhan tanaman jagung.
Penapisan strain bakteri yang dikembangkan sebagai inokulan umumnya masih berdasarkan pada informasi bakteri terkultur (culturable bacteria). Namun mengingat bahwa sekitar 99% mikrob tanah bersifat tidak dapat dikultur (Torsvik
et al. 2002), maka informasi berdasarkan bakteri terkultur kurang akurat karena belum mampu menggambarkan status keberadaan bakteri dalam komunitas alaminya. Oleh sebab itu, untuk mendapatkan gambaran yang lebih utuh mengenai struktur komunitas bakteri rizosfer yang diteliti, pendekatan pengkulturan dan metagenom digunakan untuk menggambarkan struktur komunitas. Kelompok bakteri dominan yang merupakan bagian dari komunitas juga ditentukan dengan mempertimbangkan status keberadaannya pada komunitas metagenomnya. Beberapa teknik analisis komunitas yang dapat digunakan antara lain
Temperature/Denaturing Gradient Gel Electroforesis (T/DGGE), Single Strand Conformation Polymorphism (SCCP), Amplified Ribosomal DNA Restriction Analysis (ARDRA), Restriction Fragment Length Polymorphism/ Terminal RFLP (RFLP/T-RFLP), Ribosomal Intergenic Spacer Analysis/Automatic RISA (RISA/ ARISA), dan pyrosequencing. Di antara berbagai analisis komunitas, T-RFLP lebih populer dan banyak digunakan. Menurut Caffaro-Filho et al. (2007), T-RFLP mempunyai kelebihan dibanding metode lain karena dapat menganalisis sampel dalam jumlah banyak dengan cepat, tingkat ketelitian tinggi, serta data profil dapat dianalisis secara kualitatif maupun kuantitatif menggunakan berbagai metode statistik untuk memperoleh kesimpulan secara komprehensif.
Perumusan Masalah
Indonesia mempunyai ketersediaan lahan kering yang luas yang potensial untuk pengembangan berbagai komoditas unggulan seperti jagung, namun peningkatan kapasitasnya masih terkendala antara lain oleh faktor kekeringan dan tingkat kesuburan tanah yang rendah. Pengembangan agen hayati perlu terus dilakukan untuk mendapatkan agen hayati yang lebih baik dan sesuai untuk mengatasi kendala spesifik lahan kering dan sebagai pemacu pertumbuhan tanaman jagung di lahan kering. Dalam penelitian ini, penggalian potensi bakteri pemacu tumbuh untuk tanaman jagung lahan kering dilakukan berdasarkan pendekatan komunitas bakteri rizosfer yang diseleksi secara in planta. Adapun perumusan masalah dalam penelitian ini adalah:
1. Apakah komunitas bakteri rizosfer yang terseleksi secara in planta dapat memacu pertumbuhan tanaman jagung pada kondisi kering?
2. Bagaimana struktur komunitas bakteri terseleksi?
4
Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. Memperoleh komunitas bakteri rizosfer pemacu pertumbuhan tanaman jagung lahan kering melalui penapisan in planta.
2. Memperoleh gambaran mengenai struktur komunitas bakteri rizosfer.
3. Menjelaskan karakter pemacu tumbuh dan potensi bakteri dominan yang merupakan bagian dari komunitas bakteririzosfer dalam memacu pertumbuhan tanaman jagung.
Manfaat Penelitian
Pemanfaatan komunitas bakteri rizosfer merupakan pengembangan dari agen hayati strain tunggal dan multiple strain yang ada sampai saat ini. Cara seleksi in planta dan inokulum berbasis komunitas bakteri rizosfer dapat diterapkan untuk mendapatkan agen hayati untuk tipe ekosistem lain, jenis tanaman lain atau untuk pengembangan agen hayati dengan keperluan tertentu. Komunitas bakteri rizosfer dan isolat bakteri yang merupakan bagian dari komunitas terseleksi dapat dieksplorasi lebih lanjut dan dikembangkan sebagai inokulan, terutama untuk tanaman jagung lahan kering. Gambaran struktur komunitas bakteri rizosfer yang terseleksi dapat dijadikan sebagai informasi awal bagi peneliti dan sebagai pembanding dalam mempelajari pola komunitas bakteri rizosfer tanaman jagung asal lahan kering Pulau Lombok, NTB. Pola struktur komunitas yang diperoleh juga dapat dijadikan sebagai pertimbangan dalam memanipulasi komunitas bakteri rizosfer untuk pertumbuhan tanaman.
Ruang Lingkup Penelitian
Kegiatan penelitian meliputi 1) penapisan komunitas bakteri rizosfer secara
in planta yang berasal dari tanah rizosfer tanaman jagung lahan kering Pulau Lombok, 2) isolasi bakteri rizosfer dan analisis komunitas bakteri dengan teknik T-RFLP melalui pendekatan metagenom dan pengkulturan, 3) analisis karakter pemacu tumbuh yang dimiliki bakteri rizosfer dominan, 4) uji kemampuan bakteri rizosfer dominan dalam memacu pertumbuhan tanaman jagung pada skala rumah kaca. Rangkaian kegiatan penelitian disajikan dalam bentuk diagram alir pada Gambar 1.
Nilai Kebaruan
5
TINJAUAN PUSTAKA
Individu-individu tanaman jagung terpilih sebagai sumber sampel tanah rizosfer Pemilihan individu tanaman jagung lahan kering
yang menunjukkan pertumbuhan yang lebih baik
Koleksi sampel tanah rizosfer dari tanaman jagung
terpilih Sampel-sampel tanah rizosfer
-Gambaran pertumbuhan tanaman pada
-Jenis sampel tanah rizosfer (komunitas bakteri) yang berpengaruh memberikan pertumbuhan yang terbaik
Aplikasi tanah rizosfer pada media tumbuh tanaman jagung dan seleksi tanaman jagung yang
mempunyai pertumbuhan yang lebih baik (Seleksi pada penanaman tahap I dan II pada
penelitian skala rumah kaca)
Gambaran pertumbuhan tanaman yang diberi perlakuan tanah rizosfer (komunitas bakteri) terbaik pada kondisi beberapa dosis pemupukan dan kadar air media tanam 50% Uji pengaruh pemberian sampel tanah rizosfer
terbaik terhadap pertumbuhan tanaman jagung pada beberapa dosis pemupukan dan kadar air media tanam 50% (Penanaman tahap III pada
penelitian skala rumah kaca )
Media-media kultur bakteri Desain media kultur bakteri
-Isolat bakteri rizosfer
-Gambaran awal komunitas bakteri terkulturpenghuni sampel tanah rizosfer terbaik dan beberapa sampel tanah rizosfer lainnya
-Informasi hubungan antara status komunitas bakteri terkulturpenghuni sampel tanah rizosfer dengan penampilan pertumbuhan tanaman jagung Kultivasi, isolasi, karakterisasi, dan
kajian awal komunitas bakteri penghuni sampel tanah rizosfer
-Pola fingerprint komunitas bakteri rizosfer pada pengkulturan dan metagenom, jumlah dan ukuran T-RF pada setiap komunitas, gambaran
keanekaragaman, kelimpahan, kesamaan antar komunitas, dan afiliasi filogenetik setiap ukuran T-RF. Informasi hubungan antara pola fingerprint
komunitas dengan penampilan pertumbuhan tanaman jagung.
-Gambaran struktur komunitas bakteri rizosfer PENELITIAN TAHAP I
Penapisan komunitas bakteri rizosfer secara in planta dari tanah rizosfer tanaman jagung asal lahan kering
PENELITIAN TAHAP II
Kajian komunitas bakteri rizosfer penghuni tanah rizosfer
Analisis komunitas bakteri penghuni melarutkan fosfat, degradasi kitin, produksi HCN, antifungi patogen, produksi IAA, dan produksi EPS
Karakter pemacu tumbuh dari isolat dominan
Uji kemampuan isolat dominan dalam memacu pertumbuhan tanaman jagung pada penelitian skala
rumah kaca
Informasi kemampuan isolat dominan dalam memacu pertumbuhan tanaman jagung pada penelitian skala rumah kaca PENELITIAN TAHAP III
Kajian potensi isolat dominan yang merupakan bagian dari komunitas
6
2 TINJAUAN PUSTAKA
Lahan Kering dan Pemanfaatannya untuk Pertanaman Jagung di NTB
Indonesia mempunyai beberapa tipe lahan suboptimal seperti lahan kering, rawa, lebak, pasang surut, dan gambut. Bila ditinjau dari luas lahan, potensi, ekologi, dan sosial ekonomi, maka lahan kering layak dioptimalkan pemanfaatannya sebagai lahan pertanian produktif (RENSTRA KEMENTAN 2009). Lahan kering merupakan hamparan lahan yang tidak pernah tergenang atau digenangi air pada sebagian kecil waktu dalam setahun, yang terdiri dari lahan kering dataran rendah dan lahan kering dataran tinggi (DITJEN PSP 2011).
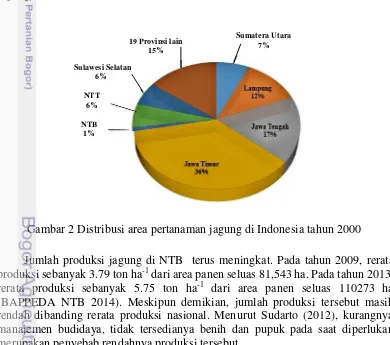
Dalam kebijakan peningkatan ketahanan pangan nasional, jagung merupakan komoditas pangan utama setelah padi. Provinsi NTB mempunyai potensi dan peluang dalam pengembangan tanaman jagung mengingat sumber daya lahan, jenis tanah, topologi, dan agroklimat yang sesuai, terutama di lahan kering (Sudarto 2012). Bersama dengan daerah lainnya, NTB merupakan salah satu daerah penghasil jagung di Indonesia. Berdasarkan data penelitian Swastika et al. (2004) menunjukkan bahwa pada tahun 2000 sekitar 1% dari total luas area pertanaman jagung di Indonesia berada di NTB (Gambar 2).
Jumlah produksi jagung di NTB terus meningkat. Pada tahun 2009, rerata produksi sebanyak 3.79 ton ha-1 dari area panen seluas 81,543 ha. Pada tahun 2013, rerata produksi sebanyak 5.75 ton ha-1 dari area panen seluas 110273 ha
(BAPPEDA NTB 2014). Meskipun demikian, jumlah produksi tersebut masih rendah dibanding rerata produksi nasional. Menurut Sudarto (2012), kurangnya manajemen budidaya, tidak tersedianya benih dan pupuk pada saat diperlukan merupakan penyebab rendahnya produksi tersebut.
Gambar 2 Distribusi area pertanaman jagung di Indonesia tahun 2000
NTB 1%
Sulawesi Selatan 6%
NTT 6%
19 Provinsi lain 15%
7 Beberapa Upaya dalam Meningkatkan Produktivitas Lahan Kering
Lahan kering mempunyai berbagai keterbatasan berkaitan dengan pengembangannya sebagai lahan pertanian. Berbagai upaya terus dilakukan untuk meningkatkan kapasitas pemanfaatannya. Usaha dan teknologi yang umum diterapkan untuk meningkatkan produktivitas lahan kering antara lain dengan konservasi air, melindungi tanah dari erosi, meningkatkan kadar lengas tanah, serta memperbaiki sifat fisik, kimia, dan biologi tanah (Idjudin & Marwanto 2008). Beberapa penelitian telah dilakukan untuk meningkatkan produktivitas tanaman pangan di lahan kering, misalnya mengembangkan model pengelolaan lahan kering dengan pola tumpang sari dan pergiliran tanaman (Pujiharti et al. 2008, Edy et al.
2011) dan pertanian yang terintegrasi dengan usaha ternak (Rahardjo & Suryo 2013). Metode untuk meningkatkan kandungan bahan organik dan fosfat merupakan bidang kajian yang telah banyak dilakukan, misalnya dengan penambahan fosfat alam dan kombinasi bakteri pelarut fosfat dan pupuk kandang (Noor 2008).
Pemanfaatan agen hayati merupakan salah satu metode yang banyak dikaji kemampuannya dalam meningkatkan pertumbuhan dan produksi tanaman di lahan kering. Surbakti et al. (2014) menggunakan Bradyrhizobium japonicum dan kombinasi pupuk jerami untuk mengetahui respon pertumbuhan dan produksi kedelai di lahan kering. Pada penelitian Astiko et al. (2013), mikoriza indigenos dikombinasikan dengan pupuk kandang digunakan untuk meningkatkan pertumbuhan dan produksi jagung di lahan kering Lombok Timur, NTB. Pemanfaatan mikoriza juga pernah dilakukan oleh Sastrahidayat et al. (2011). Selain itu, kombinasi berbagai jenis pupuk hayati dan pupuk kimia dosis rendah pernah dicoba di lahan kering untuk menyeleksi genotif tanaman jagung yang efisien hara (Moelyohadi et al. 2012).
Peranan Bakteri dalam Pertumbuhan Tanaman
Di dalam tanah, mikrob berada dalam agregat tanah dan dapat ditemukan melimpah pada daerah perakaran atau rizosfer. Mikrob rizosfer dapat bersifat menguntungkan dan merugikan bagi tanaman. Salah satu kelompok mikrob rizosfer yang menguntungkan adalah bakteri pemacu tumbuh tanaman (PGPR, plant growth promoting rhizobacteria). Kelompok bakteri ini telah lama diketahui peranannya sebagai pemacu pertumbuhan baik secara langsung maupun tak langsung. Mekanisme secara langsung antara lain dengan memfasilitasi penyediaan nutrien seperti nitrogen, fosfor dan besi, serta dengan menghasilkan fitohormon seperti sitokinin, giberelin, asam indol asetat, dan etilen. Mekanisme secara tak langsung antara lain sebagai biokontrol dengan menghasilkan siderofor, antibiotik dan enzim litik, serta menginduksi resistensi sistemik pada tanaman sebagai bentuk respon terhadap infeksi patogen (Glick 2012).
8
dua kelompok bakteri simbiotik penambat nitrogen yang telah dipelajari secara mendalam. Selain menambat nitrogen, Rhizobia juga mampu memobilisasi fosfat menjadi bentuk yang tersedia bagi tumbuhan (Alikhani et al. 2006). Selain fosfor dan nitrogen, besi juga merupakan elemen yang mempunyai peranan penting bagi semua organisme sehingga seringkali terjadi kompetisi dalam mendapatkan besi. Salah satu mekanisme PGPR adalah menghasilkan siderofor yaitu komponen dengan berat molekul rendah yang berperan sebagai agen pengkhelat besi.
Pseudomonas sp. merupakan salah satu bakteri yang selain mampu menghasilkan siderofor tetapi juga mampu menggunakan siderofor yang dihasilkan oleh mikrob lain dalam habitatnya (Loper & Henkels 1999).
Hormon pertumbuhan sangat penting sebagai mekanisme respon tumbuhan terhadap lingkungan. Terdapat empat kelompok utama fitohormon yaitu auksin, giberelin, etilen, sitokinin, dan asam absisat (Saharan & Nehra 2011). Beberapa jenis bakteri diketahui mampu menghasilkan fitohormon asam indol asetat (IAA,
indole-3-acetic acid). Kemampuan menghasilkan IAA sering digunakan sebagai salah satu dasar seleksi untuk mendapatkan PGPR yang efektif (Spaepen et al.
2007). Kajian produksi IAA pada Rhizobium menunjukkan bahwa bakteri tersebut menghasilkan IAA hanya bila berasosiasi dengan beberapa jenis legum sebagai inangnya (Basu & Gosh 2001). Selain IAA, etilen juga merupakan fitohormon yang penting bagi tumbuhan, namun dalam kondisi cekaman, hormon tersebut akan diproduksi secara berlebihan oleh tumbuhan sehingga dapat menghambat pertumbuhan. ACC deaminase yang dihasilkan oleh banyak jenis PGPR dapat menghidrolisis 1-aminocyclopropane-1-carboxylate (ACC) yang merupakan prekursor etilen.
Selain bermanfaat bagi tanaman, bakteri rizosfer juga dapat bersifat merugikan. Salah satu mekanismenya adalah dengan menimbulkan penyakit pada tanaman. PGPR mempunyai mekanisme dalam menekan pertumbuhan mikrob penyebab penyakit dengan cara menghasilkan antibiotik. Di antara berbagai jenis bakteri penghasil antibiotik, Pseudomonas kelompok fluoresen diketahui mampu menghasilkan antifungi phenazin (Mazurier et al. 2009) dan 2,4-diacetyl phloroglucinol (DAPG) (Showkat et al. 2014). PGPR juga dapat menghasilkan sianida dan kitinase sebagai mekanisme melawan patogen.
Tumbuhan mempunyai berbagai mekanisme pertahanan diri sebagai respon terhadap patogen dan parasit. Induced systemic resistance (ISR) dan systemic acquired resistance (SAR) merupakan dua bentuk resistensi pada tumbuhan, keduanya dibedakan berdasarkan sumber elisitor dan jalur regulasinya. Beberapa strain PGPR telah dikarakterisasi dengan baik berhubungan dengan kemampuannya dalam menginduksi resistensi pada berbagai jenis tumbuhan.
Upaya Pencarian dan Pengembangan Agen Hayati
Pupuk hayati pertama kali dikembangkan pada tahun 1885 oleh Nobbe dan Hiltner dalam bentuk kultur rhizobia. Setelah itu, pupuk hayati kemudian berkembang di berbagai negara. Penelitian dalam pencarian dan pengembangan pupuk hayati juga semakin giat dilakukan sampai saat ini. Penapisan in vitro
9 dilakukan tergantung pada tujuan yang diinginkan, misalnya isolasi mikrob endofit dari tanaman sehat untuk mendapatkan mikrob yang mampu melawan mikrob penyebab penyakit tanaman.
Husen et al. (2011) melakukan pengembangan inokulum untuk menemukan bakteri pemacu tumbuh dan penekan penyakit tanaman. Bakteri diisolasi dari rizosfer tanaman kedelai kemudian diuji kemampuannya dalam menghasilkan ACC deaminase. Selanjutnya dilakukan penelitian skala rumah kaca untuk melihat kemampuan isolat dalam meningkatkan pertumbuhan dan mereduksi penyakit pada kedelai. Kecambah kedelai diinokulasi dengan isolat dan ditanam pada media tanah steril dan nonsteril yang mengandung cendawan patogen seperti F. oxysporum, S. rolfsii dan R. solani. Metode yang mirip juga pernah dilakukan oleh Khalid et al.
(2004) dengan mengisolasi bakteri dari rizosfer tanaman gandum yang tumbuh di berbagai lokasi. Isolat yang menunjukkan pertumbuhan yang baik pada media agar-agar kemudian diuji kemampuannya dalam menghasilkan auksin. Kecambah gandum dengan kultivar yang berbeda diinokulasikan dengan isolat terpilih lalu ditumbuhkan pada kondisi gnotobiotik. Berdasarkan kemampuannya memproduksi auksin dan aktivitas pemacu tumbuhnya, empat isolat kemudian diuji kemampuannya dalam menghasilkan auksin pada tanah steril (pot percobaan) dan nonsteril (percobaan lapang). Pada skala pot percobaan, perlakuan inokulasi menunjukkan peningkatan biji gandum sebanyak 14.7% dan pada percobaan lapang sebanyak 27.5%.
Dalam upayanya mengembangkan konsorsium bakteri pendegradasi 2,4-dinitrotoluene (DNT) dan pemacu pertumbuhan tanaman, Thijs et al. (2014) juga melakukan isolasi dari tanah padang rumput dan tanah terkontaminasi DNT. Isolat diseleksi secara in vitro berdasarkan resistensinya terhadap beberapa bentuk cekaman, kemampuan degradasi DNT dan beberapa sifat pemacu tumbuh. Isolat terpilih kemudian diidentifikasi dan konsorsium dibuat dari enam isolat terpilih. Konsorsium diinokulasikan pada kecambah Arabidopsis thaliana yang ditumbuhkan secara vertikal pada media agar-agar. Respon tanaman diamati setelah 9 hari dengan melihat pertumbuhan akarnya. Menurut Thijs et al. (2014), lingkungan yang terkontaminasi juga berpotensi sebagai sumber isolat pemacu tumbuh dan penekan pengaruh DNT.
Komunitas Mikrob sebagai Tolok Ukur Perubahan Lingkungan
Komunitas mikrob tanah mempunyai peranan dan hubungan timbal balik dengan faktor lingkungan, sehingga keanekaragaman dan komposisinya dapat berubah sejalan dengan perubahan lingkungan. Oleh sebab itu, berbagai kondisi lingkungan dan proses perubahan lingkungan dapat dijelaskan dengan mempelajari keanekaragaman komunitas mikrob tanah. Banyak peneliti juga telah mempelajari komposisi komunitas mikrob untuk mengetahui dampak dari perlakuan yang diberikan pada ekosistem.
10
berkaitan dengan pola pengelolaan lahan petanian di Sumatera pernah dijelaskan oleh Prijambada et al. (2012) bahwa sistem pertanian berbasis pohon lebih mampu mempertahankan keanekaragaman komunitas mikrob tanah dibandingkan dengan sistem pertanian yang lebih intensif. Bever et al. (2013) dan beberapa peneliti juga pernah merekayasa komposisi mikrob untuk mengetahui pengaruhnya terhadap pertumbuhan tanaman.
Dengan mempelajari komposisi komunitas cendawan mikoriza arbuskular (AMF, arbuscular mycorrhizal fungi) diketahui bahwa penggunaan pupuk kandang berdampak pada peningkatan biomassa hifa dan spora AMF. Adapun pupuk anorganik hanya meningkatkan biomassa spora (Qin et al. 2015). Dampak penggunaan fungisida terhadap komunitas mikrob tanah pernah dilaporkan oleh Bending et al. (2007). Dampak fungisida dalam mereduksi aktivitas dehidrogenase bervariasi pada komunitas mikrob dengan tingkat keanekaragaman yang rendah tetapi tidak pada komunitas dengan tingkat keanekaragaman yang tinggi.
Komunitas Bakteri Rizosfer pada Tanaman Jagung
Rizosfer merupakan lingkungan yang sangat selektif yang terbentuk karena tumbuhan menyeleksi bakteri yang paling berperan terhadap pertumbuhannya melalui eksudat akar yang dikeluarkan (Saharan & Nehra 2011). Pada saat berinteraksi dengan tanah, tanaman juga secara langsung berinterkasi dengan mikrob tanah. Melalui nutrien yang disediakan, tanaman dapat mengubah komunitas mikrob yang berasosiasi dengannya dan menyeleksi komunitas bakteri rizosfernya sesuai dengan kebutuhan tanaman tersebut (Bell et al. 2015). Oleh sebab itu, komunitas dan keanekaragaman mikrob rizosfer berbeda pada setiap jenis tanaman (Garbeva et al. 2008). Efek rizosfer juga mengakibatkan perbedaan komposisi komunitas bakteri rizosfer dengan komunitas bakteri pada tanah yang jauh dari perakaran (Bouffaud et al. 2012; Garcia-Salamanca et al. 2012). Pada komoditas tanaman penting seperti jagung, kajian komunitas bakteri rizosfernya telah banyak dilakukan. Berbagai penelitian menunjukkan bahwa komunitas bakteri rizosfer tanaman jagung dipengaruhi antara lain oleh jenis tanah dan lokasi lahan, genotif tanaman serta tahap pertumbuhan tanaman.
Arruda et al. (2013) melakukan kajian terhadap komunitas bakteri tanaman jagung yang ditanam di 5 lokasi di Rio Grande, Brazil. Hasil analisis RFLP menunjukkan bahwa komunitas bakteri tersebut disusun oleh Gammaproteo-bacteria, Betaproteobacteria, Alphaproteobacteria, Firmicutes, Actinobacteria,
dan Bacteroidetes. Genus utama dari Gammaproteobacteria adalah Citrobacter, Klebsiella, Serratia, Pantoea, Stenotrophomonas, Enterobacter dan Pseudomonas.
Burkholderia merupakan genus yang paling melimpah di antara genus lain yang termasuk dalam Betaproteobacteria. Pada beberapa penelitian juga disebutkan bahwa Burkholderia merupakan kelompok bakteri yang umum ditemukan pada rizosfer tanaman jagung (Balandreau et al. 2001; Pirone et al. 2005). Bersama dengan Pantoea, Bacillus dan Klebsiella, Burkholderia juga terdeteksi sebagai endofit pada sampel tanaman jagung asal Brazil (Ikeda et al. 2013). Peiffer et al.
11
taxonomy unit) komunitas mikrob rizosfer lebih dipengaruhi oleh lokasi lahan dibandingkan dengan jenis persilangan. Hasil penelitian tersebut berbeda dengan Bouffaud et al. (2012) bahwa berdasarkan hasil penelitian skala rumah kaca, genotif tanaman jagung berpengaruh terhadap komunitas mikrob rizosfernya.
12
3
METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan mulai Agustus 2012 sampai Januari 2015. Lokasi pengambilan sampel tanaman jagung di Demplot Penelitian dan Pengembangan Lahan Kering Universitas Mataram di Desa Akar Akar, Kabupaten Lombok Utara, dan Dusun Bukit Keramat Pringgabaya, Kabupaten Lombok Timur. Penelitian skala rumah kaca bertempat di Rumah Kaca Gaharu Fakultas Pertanian, Universitas Mataram. Isolasi dan karakterisasi bakteri rizosfer dilakukan di Laboratorium Mikrobiologi FMIPA, Universitas Mataram. Analisis T-RFLP dan uji karakter pemacu tumbuh dilakukan di Laboratorium Mikrobiologi FMIPA Institut Pertanian Bogor.
Bahan
Bahan utama yang digunakan adalah tanaman jagung BISI 2 (Zea mays cv. BISI 2) (PT Bisi International Tbk, Surabaya) umur 2 bulan yang memiliki pertumbuhan yang lebih baik yang tumbuh di lahan kering Pulau Lombok dengan kondisi lahan berkapasitas produksi 5 ton ha-1; sampel tanah rizosfer yang dikoleksi dari tanaman jagung BISI 2 umur 2 bulan yang memiliki pertumbuhan yang lebih baik yang tumbuh di lahan kering Pulau Lombok; biji jagung BISI 2; pupuk NPK (Phonska, PT Petrokimia, Gresik); media kultur berupa Soil Extract Agar
(HIMEDIA, Mumbai, India), Nutrient Agar low nutrient (NAln), Nutrient Agar low nutrient+soil extract (NAln-SE), Nutrient Agar low nutrient+root extract (NAln-RE), King’s, Pikovskaya Agar, Malt Extract Agar, Nutrient Broth (HIMEDIA, Mumbai, India); kit ekstraksi DNA (Power Soil, Mo Bio Laboratories, Inc.); PCR
mix (GoTaq(R) Green, Promega); kit purifikasi DNA (QIAquick, Qiagen, Germany); primer 27F-FAM/1492R, primer 63F/1387R, dan enzim MspI (Fermentas).
Alat
Alat utama yang digunakan adalah mikroskop (Primo Star, Zeiss) dengan kamera RaciCam ERc 5s, alat sentrifugasi (miniSpin, Eppendorf), mesin PCR (Swift MiniPro, Esco Micro Pte. Ltd.), GelDoc (Bio-Rad), NanoDrop (Thermo Scientific, Inc.), perangkat elektroforesis (BioRad), vortex (Thermolyne 37600),
shaker waterbath (Memmert TZN4M), dan spektrofotometer (GENESYS 20, Thermo Spectronic).
Penapisan Komunitas Bakteri Rizosfer secara In Planta
Sampel tanah rizosfer dan penanganannya
13 Sampel TR dikoleksi pada bulan Agustus 2012 dari tanaman jagung yang tumbuh di dua lokasi pengembangan lahan kering di Pulau Lombok yaitu Desa Akar Akar, Kabupaten Lombok Utara (S 08º13’42.4’’, E 116º21'24.4'') dan Dusun Bukit Keramat Pringgabaya, Kabupaten Lombok Timur (S 08º31’39.3’’, E 116º 37'49.3''). Peta kedua lokasi tersebut disajikan pada Lampiran 1. Tanaman jagung yang dijadikan sebagai sumber sampel adalah individu tanaman yang berumur 2 bulan dan menunjukkan pertumbuhan yang lebih baik dibanding individu lainnya. Sebanyak 7 tanaman jagung (Kode A, B, C, D, E, F, dan G) terpilih dari 2 hektar luasan lahan pertanaman jagung di Desa Akar Aka, Kabupaten Lombok Utara dan 4 tanaman jagung (Kode H, I, J, dan K) terpilih dari 2 hektar luasan lahan pertanaman jagung di Dusun Bukit Keramat Pringgabaya, Kabupaten Lombok Timur.
Sampel TR dikoleksi dengan langkah sebagai berikut. Pangkal batang tanaman dipotong dan diambil bongkahan tanah perakarannya lalu bongkahan dimasukkan ke dalam kantong plastik berlabel. TR diambil dari daerah bongkahan yang paling padat perakarannya dan paling sedikit terpengaruh oleh dekomposisi serasah dan aktivitas akar rumput-rumputan yang tumbuh di atas tanah sekitar perakaran (Zhao et al. 2010). Helaian cabang akar dipotong kemudian dikibas-kibaskan untuk memisahkan akar dari partikel tanah yang tidak melekat pada akar. TR kemudian dikikis menggunakan spatula dan disimpan dalam kantong plastik steril. Sebanyak 11 sampel TR dikoleksi pada tahap ini (TR A, TR B, TR C, TR D, TR E, TR F, TR G, TR H, TR I, TR J, dan TR K).
Penanaman tahap I
Pada penanaman tahap I, 11 sampel TR diseleksi untuk mendapatkan TR yang dapat menghasilkan tanaman jagung dengan pertumbuhan yang lebih baik. Penanaman dilakukan di rumah kaca selama 30 hari masa tanam. Faktor uji berupa penambahan TR pada media tanam dan pengaturan kadar air media tanam pada 75% dan 50% kapasitas lapang. Ulangan dibuat sebanyak 3 kali. Percobaan didesain menggunakan Rancangan Acak Lengkap (RAL).
Persiapan kecambah jagung dan media tanam. Permukaan biji jagung didisinfeksi dengan NaOCl 0.5% selama 2 menit dan alkohol 75% selama 1 menit. Tingkat sterilitas permukaan biji diperiksa dengan meletakkan biji di atas permukaan medium Nutrient Agar lalu diinkubasi pada 28 0C selama 24 - 48 jam.
Selanjutnya biji dikecambahkan selama 2 hari dalam cawan petri menggunakan media kapas steril yang dilembabkan. Kecambah yang dipilih adalah kecambah yang mempunyai panjang radikula yang seragam yaitu antara 5 - 7 mm. Media tanam berupa 3 kg pasir sungai yang telah dicuci dan dikeringkan. Pasir diayak dengan pengayak tanah berdiameter lubang 3.35 mm. Sebanyak 3 kg pasir dikemas dalam kantong plastik lalu disterilisasi selama 1 jam selanjutnya pasir dikemas dalam pot percobaan (polybag).
14
Penyiraman dengan air steril dilakukan dua kali sehari yaitu pada jam 09.00 dan jam 13.00. Jumlah air yang diberikan disesuaikan dengan jumlah air pada setiap kapasitas lapang dan ditentukan dengan cara ditimbang. Pemberian pupuk dilakukan 5 hari setelah tanam. Pupuk yang diberikan berupa Urea (Daun Buah, PT Pupuk Kaltim) sebanyak 225 mg, SP-36 (Kebomas, PT Petrokimia Gresik) sebanyak 150 mg dan fosfat alam (Mekarindo, CV Bumi Mitra Niaga) sebanyak 200 mg, serta KCl (Kebomas, PT Petrokimia Gresik) sebanyak 150 mg. Dosis pupuk tersebut merupakan dosis pupuk 75% dari dosis rekomendasi. Pada penanaman tahap I dibuat dua perlakuan kontrol. Kontrol 1 (TR K1) berupa media tanam yang diberi pupuk dasar dengan dosis 75% dan ditambahkan 100 g tanah rizosfer yang telah disterilisasi terlebih dahulu. TR steril tersebut diberi kode TR K1. Kontrol 2 berupa media tanam yang diberi jenis pupuk yang sama tetapi dengan dosis 100%.
Analisis variabel pertumbuhan tanaman dan analisis statistik. Setelah 30 hari tanam, dilakukan pengukuran variabel pertumbuhan meliputi jumlah daun, lebar daun ke-7, panjang daun ke-7, panjang tanaman, tinggi tanaman, berat basah biomassa bagian atas, berat kering biomassa bagian atas, dan berat kering akar. Pemanenan dilakukan dengan memotong pangkal batang sehingga diperoleh dua bagian biomassa tanaman yaitu biomassa bagian atas dan biomassa bagian bawah (akar). TR dari setiap unit perlakuan dikoleksi dan disimpan pada suhu 4 – 7 0C untuk analisis selanjutnya. Berat basah biomassa bagian atas diukur segera setelah panen. Berat kering biomassa bagian atas dan akar diukur setelah dikeringkan menggunakan oven. Pengaruh perlakuan terhadap pertumbuhan tanaman jagung dianalisis menggunakan analysis of variance (ANOVA). Perlakuan yang menunjukkan adanya perbedaan nyata diuji lanjut dengan uji Tukey pada taraf 5% menggunakan program pengolahan data Minitab 16.
Penanaman tahap II
Sebanyak 5 sampel TR pada penanaman tahap I yang menghasilkan nilai variabel pertumbuhan yang lebih baik diseleksi kembali pada penanaman tahap II. Selain 5 sampel TR tersebut, dipilih juga satu sampel TR yang menghasilkan nilai variabel pertumbuhan yang paling rendah. Penanaman dilakukan di rumah kaca selama 30 hari masa tanam. Faktor uji terdiri dari perlakuan tanah rizosfer (TR A, TR B, TR D, TR F, TR G, TR K, dan TR K1) dan kadar air media tanam (100%, 75% dan 50% kapasitas lapang). Ulangan dibuat sebanyak 3 kali. Percobaan didesain menggunakan Rancangan Acak Kelompok (RAK).
Persiapan kecambah jagung, media tanam, penambahan tanah rizosfer, dan penyiraman dilakukan seperti pada penanaman sebelumnya. Adapun pupuk yang diberikan berupa pupuk NPK hanya pada dosis 75% dari dosis rekomendasi (234 mg). Sebagai pembanding digunakan perlakuan TR K1 (Kontrol 1) yaitu penambahan tanah rizosfer steril. Analisis variabel pertumbuhan tanaman dan analisis statistik dilakukan seperti pada penanaman sebelumnya.
Penanaman Tahap III
15 uji terdiri dari perlakuan tanah rizosfer dan pemupukan (dosis 100%, 75%, 50%, dan 0%). Ulangan dibuat sebanyak 3 kali. Percobaan didesain menggunakan Rancangan Acak Kelompok (RAK).
Persiapan kecambah jagung, media tanam, penambahan tanah rizosfer, dan penyiraman dilakukan seperti pada penanaman sebelumnya. Pupuk yang diberikan berupa pupuk NPK. Sebagai pembanding digunakan perlakuan TR K1 (Kontrol 1) yaitu penambahan tanah rizosfer steril dan perlakuan tanpa penambahan TR dijadikan (Kontrol 2). Analisis variabel pertumbuhan tanaman dan analisis statistik dilakukan seperti pada penanaman sebelumnya.
Kajian Awal Komunitas Bakteri Terkultur dari Sampel Tanah Rizosfer
Pada tahap penelitian ini dilakukan kajian terhadap jumlah dan jenis isolat bakteri yang menghuni sampel TR. Sampel TR yang dianalisis adalah sampel hasil penanaman tahap II. Sebagai pembanding dilakukan juga analisis terhadap sampel tanah alami lahan kering Pulau Lombok (K0) yang diambil dari lokasi yang sama tetapi tidak pernah ditanami tanaman komoditas.
Penyiapan media kultur
Bakteri dikultivasi menggunakan empat media kultur yaitu 1) media komersial Soil Extract Agar (SEA), 2) Nutrient Agar rendah nutrisi (NAln), 3)
Nutrient Agar rendah nutrisi yang ditambahkan 50% ekstrak tanah (NAln-SE), dan 4) Nutrient Agar rendah nutrisi yang ditambahkan 25% ekstrak akar tanaman jagung (NAln-RE). Media dan komposisinya disajikan pada Lampiran 3.
Ekstrak tanah dipersiapkan dengan langkah sebagai berikut. Tanah diambil dari lokasi pertanaman jagung di lahan kering Pulau Lombok. Tanah dibersihkan dari sisa serasah dan dikeringkan, lalu diayak menggunakan ayakan tanah dengan ukuran lubang 2 mm. Sebanyak 1 bagian tanah disuspensikan dengan 2 bagian air steril (w/v) lalu diaduk sampai membentuk lumpur tanah kemudian disterilisasi selama 1 jam (O'Neill et al. 2009). Lumpur tanah yang telah steril dibiarkan selama 24 jam pada suhu ruang sampai endapan dan supernatannya terpisah. Supernatan (ekstrak tanah) diambil dengan cara disaring menggunakan kapas steril yang disusun padat dan berlapis-lapis dengan ketebalan 8 cm. Ekstrak tanah yang diperoleh kemudian disimpan pada 6 - 7 0C.
Ekstrak akar dipersiapkan dengan langkah sebagai berikut. Akar tanaman jagung diambil dari tanaman jagung hibrida BISI 2 yang masih segar. Akar dicuci dan dikeringanginkan. Sebanyak 1 bagian akar dicampur dengan 2 bagian air steril (w/v) lalu dihaluskan dengan cara diblender, kemudian disterilisasi selama 20 menit. Campuran akar yang telah steril dibiarkan selama 24 jam pada suhu ruang sampai endapan dan supernatannya terpisah. Supernatan (ekstrak akar) diambil dan disimpan dengan cara yang sama seperti pada ekstrak tanah.
Kultivasi dan karakterisasi bakteri
Sebanyak 10 g sampel tanah disuspensikan dalam 90 ml garam fisiologis steril (NaCl 0.85%). Suspensi tanah dikocok pada kecepatan 125 rpm selama 15 menit.
Sebanyak 100 μl suspensi dari pengenceran 10-3, 10-4, 10-5, 10-6, dan 10-7 disebarkan
16
Pengamatan meliputi total jumlah sel dalam setiap gram sampel tanah yang diukur berdasarkan jumlah koloni yang muncul (CFU, colony forming unit), jumlah isolat yang muncul dan jumlah koloni masing-masing isolat. Pengamatan karakter kultur meliputi kecepatan pertumbuhan, ada dan tidaknya dominansi pertumbuhan, morfologi koloni (warna dan tekstur koloni, bentuk koloni, bentuk pinggiran dan permukaan koloni, ukuran diameter koloni) dan pigmentasi. Untuk menghindari identifikasi ganda, pengamatan karakter koloni isolat yang sama juga dilakukan pada keempat media kultur yang digunakan. Koloni dengan karakter yang berbeda kemudian diberi nama berbeda. Pengamatan karakter sel meliputi jenis kelompok Gram, bentuk dan susunan sel, serta panjang dan lebar sel. Pengamatan karakter sel dilakukan menggunakan mikroskop Primo Star (Zeiss) dengan kamera RaciCam ERc 5s dan program AxioVision Rel. 4.8. Isolat murni disimpan dalam bentuk biakan agar-agar miring dan disimpan pada 6 - 7 0C.
Uji antibiosis
Uji antibiosis dilakukan untuk melihat kemungkinan adanya kemampuan antibiosis yang dimiliki oleh isolat bakteri rizosfer yang diteliti. Isolat yang terduga mempunyai kemampuan antibiosis selanjutnya disebut isolat terduga sedangkan isolat lain yang diperoleh dalam penelitian ini yang diujikan terhadap isolat terduga selanjutnya disebut isolat uji. Isolat terduga digoreskan secara vertikal pada bagian pinggir media SEA, NAln, NAln-SE, dan NAln-RE lalu diinkubasi pada 28 0C. Setelah 2-3 hari inkubasi, isolat uji digoreskan secara horizontal pada jarak 5 mm dari isolat terduga. Inkubasi dilanjutkan sampai 2 minggu. Isolat terduga dianggap mempunyai kemampuan antibiosis bila mampu menghambat pertumbuhan isolat uji.
Kajian Komunitas Bakteri Rizosfer Menggunakan Teknik T-RFLP dengan Pendekatan Metagenom dan Pengkulturan
Empat komunitas bakteri yang dianalisis pada tahap ini adalah komunitas yang berasal dari sampel TR D, TR A dan TR K1 yang merupakan hasil penanaman tahap II. Sebagai pembanding dilakukan juga analisis komunitas bakteri dari sampel K0 (tanah alami lahan kering).
Ekstraksi genom dari preparasi metagenom
Pada preparasi metagenom, genom komunitas diperoleh melalui ekstraksi genom langsung dari masing-masing sampel tanah. Sebanyak 10 g sampel tanah disuspensikan dalam 90 ml garam fisiologis steril, lalu dikocok pada kecepatan 125 rpm selama 15 menit. Suspensi tanah dipindahkan ke dalam tabung falcon 50 ml, selanjutnya disentrifugasi pada 10000 x g selama 30 menit. Pelet tanah yang diperoleh dikeringkan pada 60 0C selama 30 menit. Ulangan dibuat sebanyak 3 kali.
Pelet tanah yang telah kering dikumpulkan dari ketiga ulangan lalu dicampur merata. Sebanyak 0.25 g pelet tanah kemudian dijadikan sebagai sumber genom.
17 horizontal, selanjutnya disentrifugasi pada 10000 x g selama 30 detik. Sebanyak 500 µl supernatan dipindahkan ke tabung koleksi 2 ml lalu ditambahkan 250 µl
Solution C2 dan divortex selama 5 detik kemudian diinkubasi pada 4 0C selama 5 menit. Setelah itu tabung disentrifugasi pada 10000 x g selama 1 menit. Sebanyak 600 µl supernatan diambil dan dipindahkan ke tabung koleksi yang baru. Sebanyak 200 µl Solution C3 ditambahkan ke dalam supernatan tersebut kemudian divortex
singkat. Setelah diinkubasi pada 4 0C selama 5 menit, tabung disentrifugasi pada 10000 x g selama 1 menit. Sebanyak 750 µl supernatan yang terbentuk dipindahkan
ke dalam tabung koleksi yang baru lalu ditambahkan 1200 μl Solution C4 dan divortex selama 5 detik. Supernatan kemudian disaring dengan Spin Filter dengan cara disentrifugasi pada 10000 x g selama 1 menit. Cairan hasil saringan dibuang dan Spin Filter diletakkan dalam tabung 2 ml yang baru, lalu dibilas dengan 500
μL Solution C5 dan disentrifugasi pada 10000 x g selama 30 detik. Setelah cairan hasil bilasan dibuang, selanjutnya disentrifugasi kembali pada 10000 x g selama 1 menit. Spin Filter diambil dan diletakkan dalam tabung koleksi 2 ml. Sebanyak 100
μl Solution C6 ditambahkan ke bagian tengah membran filter kemudian disentrifugasi pada 10000 x g selama 30 detik. Spin Filter diangkat dari tabung koleksi dan cairan suspensi DNA yang terkumpul di bagian bawah tabung koleksi kemudian disimpan pada 4 0C. Kualitas dan kuantitas genom hasil ekstraksi dianalisis menggunakan NanoDrop.
Ekstraksi genom dari preparasi pengkulturan
Sebanyak 10 g masing-masing sampel tanah disuspensikan dalam 90 ml diambil dengan cara menuangkan 1 ml air steril di atas koloni. Setelah itu koloni dikeruk dan dimasukkan ke dalam tabung falcon 50 ml kemudian dikeringkan pada 60 0C selama 30 menit. Koloni yang telah kering dikumpulkan dan dicampur merata.
Sebanyak 0.25 g koloni kering kemudian dijadikan sebagai sumber genom. Genom diekstraksi menggunakan kit ekstraksi DNA Power Soil dengan tahapan sesuai petunjuk manufaktur. Kualitas dan kuantitas genom hasil ekstraksi dianalisis menggunakan NanoDrop. Pada tahap ini juga dilakukan ekstraksi genom dari isolat murni (isolat tunggal) yang diperoleh pada tahap penelitian sebelumnya. Genom dari isolat murni selanjutnya diperlakukan sama seperti genom komunitas dari preparasi metagenom dan pengkulturan.
Amplifikasi dan purifikasi fragmen 16S rDNA
Fragmen 16S rDNA diamplifikasi menggunakan primer 27F berlabel 6–FAM
carboxyfluorescein (5’-AGAGTTTGATCCTGGCTCAG-‘3) dan 1492R non label
(5’-TACGGTTACCTTGTTACGACT-‘3). Total volume Polymerase Chain Reaction (PCR) dibuat sebanyak 50 µl yang terdiri dari 25 µl GoTaq(R) Green (Promega), 1 µl (10 pmol) masing-masing primer, 5 µl (sekitar 200 ng) DNA