KERAGAMAN PATOTIPE
Xanthomonas oryzae
pv.
oryzae
PADA TANAMAN PADI DI BEBERAPA KABUPATEN
DI SULAWESI SELATAN
ASYSYUURA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Keragaman Patotipe
Xanthomonas oryzae pv. oryzae di Beberapa Kabupaten di Sulawesi Selatan
adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2016
RINGKASAN
ASYSYUURA. Keragaman Patotipe Xanthomonas oryzae pv. oryzae pada Tanaman Padi di Beberapa Kabupaten di Sulawesi Selatan. Dibimbing oleh ABDJAD ASIH NAWANGSIH dan KIKIN HAMZAH MUTAQIN.
Sulawesi Selatan (Sulsel) adalah salah satu provinsi di wilayah timur Indonesia yang menjadi sentra produksi padi dalam mencukupi kebutuhan pangan nasional termasuk Sulawesi, Maluku dan Papua. Salah satu kendala dalam produksi padi adalah adanya faktor biotik yang mempengaruhi pertumbuhan tanaman diantaranya infeksi bakteri patogen Xanthomonas oryzae pv. oryzae yang menyebabkan penyakit hawar daun atau kresek. Tingginya kehilangan hasil panen yang disebabkan oleh bakteri ini mendorong diupayakannya cara pengendalian yang tepat. Berbagai strategi pengendalian yang telah diupayakan untuk menekan penyakit ini namun sejauh ini penggunaan varietas tahan masih dianggap lebih efisien dan relatif lebih mudah.
Informasi tentang perkembangan penyakit dan distribusi patotipe X. oryzae pv. oryzae dapat membantu dalam pengambilan keputusan tindakan pengendalian yang tepat, khususnya dalam penentuan varietas yang tahan terhadap bakteri tersebut untuk digunakan dalam pola tanam. Bakteri ini dilaporkan memiliki keragaman patotipe yang didasarkan pada kemampuan berbeda dalam menginfeksi tanaman padi pada berbagai varietas. Bakteri ini dilaporkan memiliki sifat yang mudah berubah dalam membentuk patotipe baru. Oleh karena itu pemantauan atau monitoring komposisi dan dominansi patotipe patogen perlu dilakukan secara teratur. Suatu varietas yang tahan terhadap bakteri X. oryzae pv. oryzae seringkali dijadikan komponen utama dalam pengendalian dan ditanam terus menerus yang dapat menjadi salah satu faktor memicu munculnya patotipe baru. Tujuan penelitian ini adalah untuk mengevaluasi sebaran dan keragaman patotipe X. oryzae pv. oryzae yang berada di area penanaman padi sawah dibeberapa kabupaten di Sulawesi Selatan.
Penelitian ini dilakukan dalam beberapa tahap yang meliputi pengambilan sampel tanaman sakit di lapangan yang meliputi Kabupaten Bantaeng, Barru, Jeneponto, Maros, Pangkep, Bone dan Takalar, isolasi dan pemurnian bakteri, identifikasi dan deteksi bakteri X. oryzae pv. oryzae hingga pengelompokan patotipe bakteri yang dilakukan dengan metode Kozaka yang menggunakan lima varietas tanaman padi diferensial yaitu Tetep, Kogyoku, Waseaikoku, Java14, dan Kinmase, masing-masing tanaman tersebut akan menunjukkan respon gejala yang berbeda jika diinokulasi X. oryzae pv. oryzae patotipe berbeda. Deteksi dan identifikasi dengan teknik polymerase chain reaction (PCR) menggunakan pasangan primer spesifik XOR-F(5'GCATGACGTCATCGTCCTGT-3') dan XOR-R2 (5'-CTCGGAGCTATATGCCGTGC-3') yang mengamplifikasi wilayah intergenik gen 16S-23S rDNA dengan ukuran DNA sasaran ± 470 pb. Amplikon DNA hasil PCR dilakukan perunutan dan dianalisis homologinya dengan bakteri lain yang tersimpan pada data GenBank melalui program BLAST dan dilakukan analisis kekerabatan menggunakan metode analisis filogenetika.
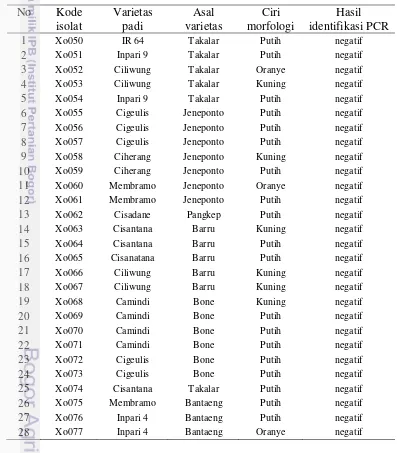
Dalam penelitian ini diperoleh 29 isolat bakteri yang positif sebagai X.
oryzaepv. oryzae yang terdiri dari patotipe III (6 isolat), patotipe IV (21 isolat),
Xo118, Xo132, Xo135, Xo131, Xo130, Xo111, Xo137, Xo136, Xo114 dan Xo127 dengan program BLAST menunjukkan isolat bakteri X. oryzae pv. oryzae asal Sulawesi Selatan-Indonesia memiliki kekerabatan yang dekat terhadap isolat dari negara lain seperti Cina, Korea, India, Jepang, dan Amerika dengan tingkat homologi berkisar 99.5-100%. Patotipe XII merupakan patotipe yang selama ini belum pernah dilaporkan di Sulawesi Selatan, dalam penelitian ini telah ditemukan di Kabupaten Pangkep dan Takalar.
Informasi terkini tentang distribusi dan komposisi patotipe X. oryzae pv.
oryzae di wilayah penanaman padi di Sulawesi Selatan ini dapat dimanfaatkan
sebagai dasar pertimbangan menentukan tindakan pengendalian yang akan digunakan. Penentuan tindakan pengendalian yang tepat dan efisien dapat menurunkan resiko kerusakan tanaman padi akibat bakteri X. oryzae pv. oryzae. Kata Kunci: PCR, Patotipe, Tanaman diferensial, Sulawesi Selatan, Xanthomonas
SUMMARY
ASYSYUURA. Diversity of Xanthomonas oryzae pv. oryzae pathotypes from Rice Fields in Some Districts in South Sulawesi Province. Supervised by ABDJAD ASIH NAWANGSIH and KIKIN HAMZAH MUTAQIN
South Sulawesi (Sulsel) is one of the provinces that become a main rice production in the eastern region of Indonesiato support national food sufficiency, including Sulawesi, Maluku and Papua. One of the constraintsin the production of rice is biotic factors, including a plant pathogenic bacteria Xanthomonas oryzae
pv. oryzae which causes leaf blight or commonly known as kresek disease. The
high yield losses caused by these bacteria become the consideration of the disease control priority. Various control strategies have been attempted to minimize the impact of bacterial infections including the use of resistant varieties, which is considered to be an efficient and relatively easier control to apply.
X. oryzae pv. oryzae is known to have many pathotypes indicated with the
difference ability to infect different varieties of rice. The knowledge of distribution of X. oryzae pv. oryzae pathotypes in a certain region is important to make decision of proper control of the disease, particularly in choosingwhich varieties whose resistance is suitable to bacterial pathotypes present in the area. Furthermore, the bacterium are often to form new pathotype therefore, monitoring the composition and dominance of pathotype in a region is required to conduct regularly. Once a variety known to be resistant to the pathogenic bacteria, the variety is usually used as the main component disease controland grown continously. This research objective was to evaluate the distribution and diversity
of X. oryzae pv. oryzae pathotypes from lowland rice grown in some districts in
South Sulawesi province.
This research was conducted in several phases including rice plant field sampling from seven districts of Bantaeng, Bone, Barru, Jeneponto, Maros, Pangkep, and Takalar, bacterial isolation, bacterial detection and identification , and bacterial pathotype grouping using Kozaka method involving five differential rice cultivar plants, i.e. Tetep, Kogyoku, Waseaikoku, Java14, and Kinmase. Each of those cultivars will show different disease symptom against different bacterial pathotypes which artificially inoculated. Detection and identification of the bacteria used in this work as X. oryzae pv. oryzae were also carried out with polymerase chain reaction (PCR) techniques using specific primer pair.The primer pair used is XOR-FGCATGACGTCATCGTCCTGT-3') and XOR-R2 (5'-CTCGGAGCTATATGCCGTGC-3')to amplify bacterial intergenic region of 16S-23S rDNA genes with the DNA amplicon target in a size of ± 470 bp.
oryzae pathotype XII is newly reported in this research to be present in this Southern Sulawesi region, i.e. in Pangkep and Takalar Districts.
This recent information about distribution and composition of X. oryzae pv.
oryzae’s patotypes present in rice growing area in South Sulawesi from this study
could be used as consideration for proper control of the disease. Better control strategy would save rice production from yield loss due to the pathogen supported by this study.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
1
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Fitopatologi
KERAGAMAN PATOTIPE
Xanthomonas oryzae
pv.
oryzae
PADA TANAMAN PADI DI BEBERAPA KABUPATEN
DI SULAWESI SELATAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
2
5
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian yang dilaksanakan sejak bulan Desember 2014 ini berjudul “Keragaman Patotipe
Xanthomonas oryzae pv. oryzae pada Tanaman Padi di Beberapa Kabupaten di
Sulawesi Selatan”.
Terima kasih penulis ucapkan kepada IbuDr Ir Abdjad Asih Nawangsih, MSi dan Bapak Dr Ir Kikin Hamzah Mutaqin, MSi selaku pembimbing dalam penelitian dan penulisan karya ilmiah ini, Dr Ir Abdul Munif, MScAgr selaku Penguji Luar Komisi dan Prof Dr Sri Hendrastuti Hidayat, MSc selaku Ketua Program Studi Fitopatologi IPB. Tidak lupa pula penulis ucapkan terima kasih kepada Bapak Ir Rinaldi Sjahril, MAgr PhD dosen Agronomi Universitas Hasanuddin Makassar yang telah memberikan kesempatan untuk menggunakan laboratorium dalam pelaksanaan penelitian yang penulis lakukan. Di samping itu, penghargaan penulis sampaikan kepada Bapak Ir Sudir dari Balai Besar Penelitian Tanaman Padi yang telah membantu memberikan informasi dan menyediakan benih varietas diferensial Kinmase, Kogyoku, Java 14, Tetep, Waseaikuko sejak penelitian ini dilaksanakan. Terimakasih juga disampaikan kepada Bapak Dr Ir Daniel Rahim, MSc dan Prof Dr Ir Baharuddin, Dipl.Ing. Agr dosen ilmu hama dan penyakit tumbuhan dari Universitas Hasanuddin Makassar atas saran dan nasihat yang sangat berharga. Penulis juga berterima kasih kepada teman-teman seangkatan yang namanya tidak dapat penulis sebutkan satu persatu untuk meluangkan waktunya dalam memberikan saran dan masukan agar penulisan karya ilmiah ini dapat diselesaikan.
Ungkapan terima kasih yang sebesar-besarnya juga disampaikan kepada ayah, ibu, dan adikku terkasih yang senantiasa memberikan semangat dan doa yang tidak pernah terputus serta seluruh keluarga dan teman terdekatlainnya yang turut mendoakan penulis sehingga penulis mampu menyelesaikan studi untuk mendapatkan pendidikan terbaik.
Manusia tak luput dari berbagai kesalahan sehingga kiranya penulisan karya tulis ini masih terus membutuhkan saran dan masukan agar menjadi jauh lebih baik.
7
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1PENDAHULUAN
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
2TINJAUAN PUSTAKA 3
Tanaman Padi 3
Penyakit Hawar Daun Bakteri pada Padi 3
Gejala Penyakit 5
Siklus Penyakit 6
Identifikasi dan Analisis DNA Xanthomonas oryzae pv. oryzae 7
Identifikasi dengan Teknik Molekuler 7
Analisis Runutan Nukleotida 8
3METODE 9
Tempat dan Waktu 9
Bahan dan Alat 9
Metode 9
Pengambilan Sampel 9
Isolasi dan Pemurnian Bakteri 10
Identifikasi Xanthomonas oryzae pv. oryzae dengan Teknik PCR 10 Uji Keragaman Patotipe Xanthomonas oryzae pv. oryzae 12
4HASIL DAN PEMBAHASAN 13
Isolasi dan Konfirmasi DNA Bakteri X. oryzae pv. oryzae 13 Isolat Bakteri X. oryzae pv. oryzae 13 Deteksi DNA bakteri X. oryzae pv. oryzae dari Jaringan
Tanaman Sakit 16
Identifikasi Bakteri X. oryzae pv. oryzae dengan PCR Koloni 17 Keragaman dan Distribusi Kelompok Patotipe Xanthomonas oryzae pv.
oryzaeAsal Sulawesi Selatan 19
Filogenetika Xanthomonas oryzae pv. oryzae berdasarkan
8
5SIMPULAN DAN SARAN
Simpulan 24
Saran 24
DAFTAR PUSTAKA 25
LAMPIRAN
RIWAYAT HIDUP
DAFTAR TABEL
1 Acuan pengelompokan patotipe dengan menggunakan varietas tanaman
diferensial 4
2 Program amplifikasi 11
3 Ciri morfologi koloni bakteri dan identifikasi molekuler 13 4 Kelompok patotipe X. oryzaepv. oryzae asal Sulawesi Selatan 21
DAFTAR GAMBAR
1 Gejala hawar daun bakteri di lahan pertanaman padi 5 2 Daerah sekuen intergenik prokariot 16S-23S rDNA 8
3 Isolat bakteri dari tanaman padi 15
4 Amplifikasi DNA bakteri X. oryzae pv. oryzae dari jaringan tanaman 17 5 Amplifikasi PCR koloni positif bakteri X. oryzae pv. oryzae
menggunakanprimer XOR-R2/XOR 18
6 Peta sebaran patotipe X. oryzae pv. oryzae di beberapa kabupaten di
Sulawesi Selatan 19
7 Pohon filogenetika bakteri X. oryzaepv. oryzae asal Sulawesi Selatan 23
DAFTAR LAMPIRAN
1 Nilai homologi runutan nukleotida X. oryzae pv. oryzae asal Sulawesi Selatan
1
1
PENDAHULUAN
Latar Belakang
Produksi beras di Indonesia menunjukkan fluktuasi dari waktu ke waktu yang dapat disebabkan oleh berbagai faktor. Salah satu faktor biotik yang berpengaruh adalah infeksi bakteri patogen pada tanaman padi Xanthomonas oryzae pv. oryzae yang merupakan penyebab penyakit hawar daun bakteri (HDB) atau kresek. Bakteri ini menjadi salah satu patogen utama pada pertanaman padi di sentra produksi padi Indonesia termasuk Sulawesi Selatan. BPTPH (2008) melaporkan bahwa salah satu faktor dominan dalam menurunkan hasil panen padi di daerah Sulawesi Selatan adalah infeksi bakteri X. oryzae pv. oryzae. Saat ini kerugian yang disebabkan oleh bakteri tersebut dapat mencapai 50-70% bahkan diatas 80% yang dapat dikategorikan dalam kondisi puso, hal ini bergantung pada stadia tanam saat penyakit tersebut timbul (Mew et al. 1982; Mew 1988,Reddy & Shang-Zhi 1989, Suparyono & Sudir 1992, Narasimhan & Kareem 1994, Lalitha et al. 2010).
Perkembangan suatu penyakit tumbuhan ditentukan oleh setidaknya tiga hal, yaitu kerentanan tanaman inang, virulensi patogen dan dukungan faktor lingkungan. Menurut Ou (1985), faktor lingkungan yang berpengaruh terhadap perkembangan penyakit HDB terutama adalah kelembapan, suhu, dan cara budidaya tanaman padi, khususnya dalam penentuan varietas dan teknik pemupukan. Berbagai strategi pengendalian terus diupayakan dalam menekan perkembangan bakteri patogen tersebut. Sejauh ini penggunaan varietas tahan terhadap infeksi bakteri tersebut menjadi komponen utama dalam teknik pengendalian karena dianggap lebih mudah dan efisien dari segi ekonomi meskipun teknik pengendalian yang lain terus dilakukan. Keefektifan penggunaan varietas tahan tentunya memiliki kendala karena sifat bakteri X. oryzaepv. Oryzae yang mudah mengalami perubahan dalam membentuk patotipe baru yang lebih virulen dan mematahkan gen ketahanan tanaman (Suparyono et al. 2004; Sudir et al. 2006; Sudir et al. 2009). Varietas tertentu dapat hanya efektif terhadap patotipe tertentu dan cocok pada wilayah tertentu (Sudir & Suprihanto 2006) sehingga pengembangan dan penanaman varietas tahan juga perlu disesuaikan dengan patotipe yang ada di suatu wilayah pertanaman untuk mengoptimalkan keefektifan pengendalian penyakit HDB (Ponciano et al. 2003).
2
dibutuhkan teknik identifikasi yang dapat dilakukan dalam waktu relatif lebih cepat dengan tingkat akurasi yang tinggi. Teknik deteksi dan identifikasi menggunakan metode molekuler seperti polymerase chain reaction (PCR) telah banyak dilaporkan mampu memberikan hasil yang lebih akurat dan efisien
Pemantauan pergeseran patotipe dilakukan untuk mengetahui patotipe yang dominan pada suatu wilayah pertanaman padi yang selanjutnya dapat dijadikan dasar untuk mengambil keputusan teknik pengendalian melalui rekomendasi varietas tahan yang memiliki gen ketahanan sesuai dengan gen virulen patotipe patogen yang ada di lapangan.
Tujuan Penelitian
Tujuan penelitian adalah mengevaluasi sebaran dan keragaman patotipe X.
oryzae pv. oryzae yang berkembang pada area penanaman padi sawah daerah
Sulawesi Selatan, melakukan identifikasi dengan teknik molekuler untuk mengonfirmasi kesamaan isolat bakteri yang berasal dari Sulawesi Selatan dengan isolat bakteri yang telah ada dan berkembang di daerah atau negara yang lain.
Manfaat Penelitian
3
2
TINJAUAN PUSTAKA
Tanaman Padi
Berdasarkan habitatnya, tanaman padi dapat digolongkan menjadi beberapa jenis yaitu padi gogo, padi sawah dan padi rawa. Padi dengan nama ilmiah Oryza
sativa L. termasuk dalam kingdom Plantae, divisi Spermatophyta, subdivisi
Angiospermae, kelas Monocotyledoneae, ordo Poales dan famili Poaceae.
Menurut Silitonga (2004) sebelum masuknya padi keIndonesia pada tahun 1500 SM, tanaman ini terlebih dahulu tersebar di wilayah Indochina. Selanjutnya tanaman ini dikembangkan hingga pada akhirnya jenis padi javanica hanya ada di Indonesia. Perkembangan budidaya tanaman padi saat ini terjadi seiring tingkat kebutuhan pangan yang bertambah sehingga keragaman varietas padi terus dikembangkan guna memenuhi tingkat kebutuhan masyarakat. Keragaman varietas padi yang dikembangkan memiliki konsekuensi munculnya masalah yang berkaitan dengan resistensi tanaman terhadap patogen penyebab penyakit diantaranya bakteri X. oryzae pv. Oryzae penyebab penyakit hawar daun bakteri (HDB). Resistensi tanaman yang menjadi sifat dari suatu varietas yang dikembangkan dapat menjadi faktor seleksi terhadap patogen untuk berkoevolusi memunculkan varian-varian patogen baru yang memiliki tingkat virulensi berbeda atau sering disebut sebagai pathotype.
Menurut Sudir et al. (2009) varietas padi IR 20 merupakan varietas modern yang pertama kali ditemukan di Asia yang memiliki gen ketahanan terhadap penyakit HDB. Suatu varietas tahan hanya efektif terhadap X. oryzae pv. oryzae dari patotipe tertentu dan juga hanya di lokasi tertentu sehingga dapat diasumsikan bahwa pada daerah yang berbeda, tindakan penanaman varietas padi yang sama dapat dilakukan atau justru tidak dianjurkan berdasarkan alasan tertentu terkait dengan perkembangan patogen yang mampu membentuk patotipe dalam menginfeksi tanaman inangnya (padi). Leach et al. (1990) dan George et al. (1996) mengelompokkan setiap patotipe berdasarkan karakter fenotipik maupun genotipiknya yang berasal dari wilayah geografi yang berbeda.
Penyakit Hawar Daun Bakteri pada Padi
Penyakit HDB merupakan penyakit utama padi sawah di Indonesia yang disebabkan oleh bakteri X. oryzae pv. oryzae. Perkembangan patogen ini pertama kali ditemukan di Indonesia pada tahun 1949 pada musin hujan dan dikenal sebagai penyakit kresek (Ou 1985; Mew 1988).
Terdapat dua jenis gejala yang ditimbulkan akibat infeksi X. oryzae pv. oryzae yaitu kresek dan hawar. Kresek merupakan gejala penyakit yang paling destruktif sedangkan hawar adalah gejala yang lebih umum.Infeksi terjadi pada tanaman padi setelah pembibitan hingga dewasa yang ditandai dengan water-soaked greyish atau corak keabu-abuan selama 1 – 2 minggu. Bagian ujung daun padi yang terinfeksi akan meluas hingga pelepah daun (Mew et al. 1993; Ou 1985).
4
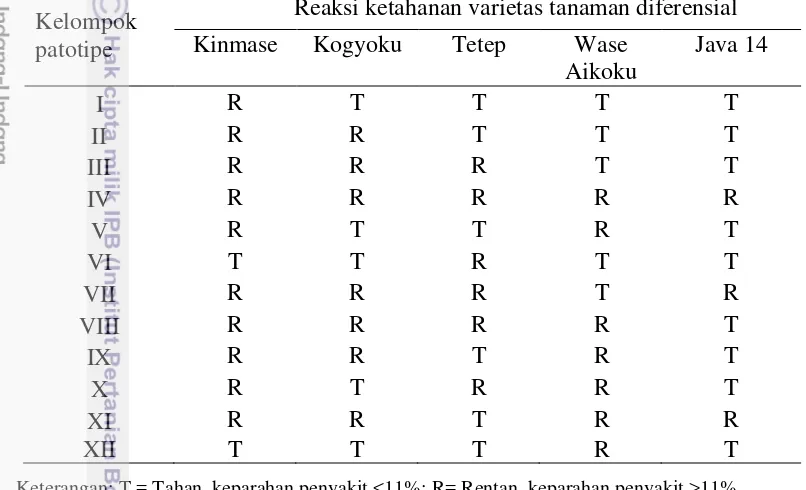
lahan yang terserang penyakit HDB sebesar 54 796 ha dan terus meningkat di masa tanam 2010 – 2011 yaitu sebesar 64 123 ha di seluruh Indonesia. Tinggi dan rendahnya data tersebut disebabkan oleh tingkat perubahan strain atau patotipe pada X. oryzae pv. oryzae yang cukup tinggi. Di Indonesia terdapat 12 kelompok patotipe yang telah diidentifikasi berdasarkan metode Kozaka. Pengelompokan 12 patotipe dapat dilakukan dengan melihat respons gejala pada 5 varietas yang berbeda (Tabel 1).
Tabel 1 Acuan pengelompokan patotipe X. oryzae pv. oryzae berdasarkan respon gejala pada varietas tanaman padi diferensial
Kelompok
Keterangan: T = Tahan, keparahan penyakit <11%; R= Rentan, keparahan penyakit >11%
Pengembangan tindakan pengendalian terhadap patogen penyebab HDB masih terus dilakukan. Sudir et al. (2009) menyatakan bahwa sampai saat ini penggunaan varietas tahan masih cukup populer dalam pengendalian serangan X.
oryzae pv. oryzae. Sejauh ini, perkembangan teknik pengendalian dalam bentuk
eksplorasi agens biokontrol terus dilakukan dan menunjukkan hasil yang optimal sebatas percobaan rumah kaca sehingga membutuhkan kajian yang lebih spesifik yang melibatkan gen ketahanan tanaman dan gen virulensi yang dimiliki patogen yang dalam kaitan ini mudah berubah membetuk patotipe baru.
Gejala Penyakit
5
Gambar 1 Gejala HDB di lahan pertanaman padi. Daun tanaman berwarna kuning kecoklatan hingga putih keabu-abuan dan tepi daun berombak (bagian yang diberi tanda panah) Penyakit hawar daun bakteri ini dapat terjadi pada setiap fase pertumbuhan tanaman padi. Gejala yang muncul pada tanaman muda berumur kurang dari 30 hari setelah tanam disebut kresek, sedangkan gejala yang timbul pada tanaman mencapai masa stadia anakan hingga pemasakan disebut hawar (blight). Terjadinya penyakit pada tanaman masih berumur muda dapat menyebabkan penurunan produksi padi yang lebih besar. IRRI (2009) mengungkapkan bahwa kresek merupakan gejala yang paling merusak dari penyakit HDB, sedangkan umumnya penyakit ini dapat dijumpai dengan gejala hawar. Disamping itu, penurunan hasil juga dapat terjadi berdasarkan tingkat keparahan penyakit yang ditimbulkan oleh bakteri patogen dan stadia infeksi tanaman yang dapat mencapai 50-70% bahkan diatas 80% dan dikategorikan dalam kondisi puso, hal ini bergantung pada stadia tanam saat penyakit tersebut timbul. Suparyono et al. (2003) melaporkan bahwa ambang kerusakan penyakit HDB pada tanaman padi stadia dewasa berkisar pada keparahan penyakit sebesar 20%, setiap keparahan penyakit naik sebanyak 10% dari ambang tersebut dapat menimbulkan kehilangan hasil yang meningkat antara 4-6%. Di Indonesia sendiri kehilangan hasil yang dapat terjadi sangat fluktuatif.
6
Bakteri X. oryzae pv. oryzae diketahui merupakan bakteri yang memiliki viabilitas patotipe yang tinggi. Telah dilaporkan bahwa saat ini terdapat 30 strain
X. oryzae pv. oryzae yang berbeda dari beberapa negara (Adhikari et al. 1999;
Mew 1988; Noda et al. 1996) sedangkan di Indonesia sendiri terdapat 12 strain yang tersebar di berbagai wilayah penghasil padi (Sudir 2003; Triny 2000). Bakteri X. oryzae pv. oryzae ini memiliki tingkat perbedaan genetik yang tinggi diantara perbedaan isolat lain yang berasal dari lingkungan yang berbeda khususnya isolat yang berasal dari asia (Adhikari et al. 1995). Tingginya variabilitas tersebut disebabkan adanya interaksi antara inang (Oryza sativa), bakteri X. oryzae pv. oryzae, lingkungan abiotik dan juga biotiknya. Perubahan dari salah satu komponen tersebut akan mempengaruhi patogenitas X. oryzae pv. oryzae (Kadir 2009).
Siklus Penyakit
Mekanisme infeksi yang dilakukan oleh bakteri penyebab penyakit (X.
oryzae pv. oryzae) dapat terjadi melalui hidatoda yang terdapat pada daun atau
dapat pula melalui luka pada daun dan bagian tanaman lainnya. Bakteri X. oryzae pv. oryzae juga dapat menginfeksi pada bagian akar tanaman. Bahkan Murty & Devadath (1984) menyatakan bahwa bakteri X. oryzae pv. oryzae dapat terbawa benih padi meskipun tidak berdampak terhadap perkembangan penyakit HDB yang tinggi, namun benih dapat menjadi tempat dorman bagi bakteri hingga mendapatkan inang yang tepat dan sesuai. Ou (1985); Brar dan Thind (1994) menyatakan bahwa bakteri X. oryzae pv. oryzae dapat bertahan hidup pada biji (benih), jerami dan serasah tanaman padi, gulma yang dapat berperan sebagai inang, dan bahkan dalam tanah dan air irigasi.
Penyebaran patogen pada tanaman padi dapat terjadi melalui angin kencang yang dapat menimbulkan luka pada tanaman dan dapat menyebabkan bakteri menyebar dari satu tanaman ke tanaman lainnya. Saat ini perkembangan serta distribusi bekteri melalui benih sangat berpeluang. Kejadian penyakit yang disebabkan oleh X. oryzae pv. oryzae yang terdapat dilapangan dapat mencapai 13-37% karena berasal dari benih yang digunakan (Shivalingaiah et al.2012).
Perkembangan penyakit HDB juga dapat dipengaruhi oleh berbagai faktor seperti gesekan daun tanaman yang memiliki jarak tanam yang dekat (Khaeruni 2001). Adanya gulma di area sekitar tanaman serta jerami padi yang terinfeksi bakteri dapat memicu kelangsungan hidup penyakit. Pengaruh lingkungan abiotik yang dapat menyebabkan perkembangan populasi bakteri adalah adanya faktor suhu, kelembaban, angin dan pengaruh cahaya. Suhu hangat (25-30 oC) serta kelembaban dan curah hujan yang tinggi dapat mendukung perkembangan penyakit.
Identifikasi dan Analisis DNA Xanthomonas oryzae pv. oryzae
Identifikasi dengan Teknik Molekuler
7 dengan yang lainnya. Bakteri X. oryzae pv. oryzycola memiliki beberapa kesamaan dengan bakteri X. oryzae pv. oryzae khususnya pada media agar yakni memiliki warna koloni yang berwarna kuning karena mengandung pigmen Xanthomonadin (Liu2006). Salah satu ciri yang khas dari bakteri genus Xanthomonas adalah menghasilkan koloni yang berwarna kuning (Nino-Liu et al. 2006).
Bakteri X. oryzae pv. oryzae tergolong bakteri gram negatif yang menyebabkan penyakit hawar daun pada tanaman padi (Swings et al. 1990). Bentuk bakteri X. oryzae pv. oryzae dideskripsikan berupa bentuk batang (bacillus) dan memiliki flagela. Ukuran sel yang dimiliki bakteri ini 1.2 x 0.3-0.5 m dan bersel tunggal. Selain itu, bakteri ini tidak membentuk spora dan tanpa kapsul. Apabila ditumbuhkan pada media nutrisi, koloni yang dihasilkan akan berwarna kuning pucat (Ou 1985; Lang et al. 2010). Pada awal pertumbuhannya (dalam waktu 2-4 hari) untuk varietas yang rentan dan tahan, sel bakteri berkembangbiak dari 103-104 menjadi 107-108 sel/ml. Selanjutnya perkembangbiakan X. oryzae pv. oryzae pada varietas tahan akan lebih lambat dibandingkan dengan varietas yang rentan.
Identifikasi bakteri X. oryzaepv. oryzae dengan teknik molekuler dapat menggunakan berbagai jenis primer yang menyandikan karakter spesifik dari bakteri tersebut. Fungsi utama penggunaan primer adalah menyediakan ujung 3’ -OH yang akan digunakan untuk menempelkan molekul DNA pertama dalam proses polimerisasi (Yuwono 2008). Daerah intergenik 16S-23S rDNA merupakan bagian spesifik dalam mengidentifikasi bakteri X. oryzae pv. oryzae yang ditunjukkan pada skematik (Gambar 2) dalam penggunaan salah satu primer spesifik untuk mengidentifikasi bakteri tersebut.
Daerah perantara pada lokus genetik prokariotik yang disebut internal transcribed spacer (ITS) merupakan daerah yang istimewa dalam menunjukkan polimorfisme tingkat tinggi dengan variasi spesies yang besar sehingga berguna untuk mengidentifikasi bakteri secara spesifik. Daerah ITS lebih informatif dari pada analisis 16S rDNA terutama pada strain typing.
Gambar 2 Daerah sekuen intergenik prokariot 16S-23S rDNA (daerah yang dilingkari). (Adachi & Oku, 2000)
Analisis Runutan Nukleotida
Perkembangan ilmu dan pengetahuan dalam biologi molekuler, khususnya pada pengkajian karakter bahan genetik telah menghasilkan kemajuan yang sangat pesat bagi perkembangan penelaahan suatu organisme. Beragam teknik analisis DNA yang dapat dilakukan seperti random amplified polymorphic (RAPD),
restrictionfragment length polymorphism (RFLP), dan degradative gradient gel
electrophoresis (DGGE) serta berbagai bentuk metode lainnya yang akan selalu
berkembang. Pada dasarnya teknik-teknik tersebut memanfaatkan teknik PCR yang mengamplifikasi sekuen DNA untuk melipat gandakan sekuen nukleotida
16S rDNA 23S rDNA
8
secara eksponensial. Pelipat gandaan suatu fragmen DNA dapat dilakukan sebesar 200 000 kali setelah dilakukan reaksi 20 siklus selama 220 menit (Mullis & Faloona 1989). Diketahui perkembangan teknik-teknik analisis DNA berdasarkan pada dua macam metode yang mampu menentukan runutan nukleotida suatu DNA (DNA sequencing) yaitu metode Maxam-Gilbert dan metode Sanger-Caulson.Pemotongan basa-basa DNA yang menggunakan regensia tertentu dialakukan pada metode Maxam-Gilbert sedangkan metode Sanger-Caulson didasarkan atas metode enzimatik menggunakan DNA polimerase (Yuwono 2006).
Amplifikasi fragmen DNA membutuhkan primer untuk menyandi daerah target. Primer spesifik (sekuen oligonukleotida khusus) menyandi daerah tertentu yang biasanya terdiri atas 10-20 nukleotida dan dirancang berdasarkan daerah konservatif dalam genom tertentu (Suryanto 2003). Perkembangan pengetahuan tentang keragaman genetik menjadi perkembangan ilmu yang semakin maju dalam bidang biologi molekuler. Untuk menunjang pengetahuan klasik tentang keragaman genetik suatu mikroorganisme, pendekatan dengan keragaman genetik yang dilakukan berdasarkan susunan nukleotida suatu DNA perlu unutk dilakukan sehingga pemanfaatannya dapat digunakan dengan tujuan konservatif bahkan dalam merancang tindakan pengendalian berbasis genetika dalam bidang ilmu penyakit tumbuhan.
9
3
METODE
Tempat dan Waktu
Penelitian ini dilaksanakan di Laboratorium Bakteriologi Tumbuhan IPB, Laboratotium Biosains Reproduksi Tanaman dan Pustlibang Bioteknologi Pertanian Universitas Hasanuddin Makassar pada bulan Desember 2014 - Juli 2015.
Bahan dan Alat
Isolat bakteri X. oryzae pv. oryzae yang diidentifikasi berasal dari isolasi sampel tanaman padi yang diambil dari lapangan dengan menunjukkan gejala hawar daun bakteri (HDB). Tahap ini dilakukan di laboratorium dengan teknik aseptik dalam laminar air flow.
Media biakan yang digunakan dalam pembiakan bakteri tersebut adalah
wakimoto agar (WA). Penenetuan patotipe bakteri penyebab HDB dilakukan
dengan clip methode pada tanaman padi diferensial dengan ketahanan genetik terhadap bakteri X. oryzae pv. oryzae yang telah diketahui.
Identifikasi dan karakterisasi molekuler dilakukan dengan teknik PCR yang menggunakan mesin thermocycler. Adapun visualisasi DNA yang muncul mengunakan elektroforesis dengan 1.5% gel agarose.
Metode
Penelitian ini dilaksanakan dengan beberapa tahap. Tahap awal adalah pengambilan sampel tanaman padi yang terserang HDB pada beberapa daerah sentra tanaman padi di Sul-Sel seperti Bantaeng, Jeneponto, Takalar, Maros, Pangkep, Barru dan Bone. Tahap selanjutnya adalah proses isolasi dan pemurnian bakteri target kemudian identifikasi koloni bakteri berdasarkan karakter morfologi serta identifikasi bakteri dengan teknik PCR, setelah itu pengelompokan patotipe dari isolat bakteri yang positif dengan menggunakan tanaman diferensial. Tahap terakhir adalah analisis sekuen DNA dari bakteri X. oryzae pv. oryzae yang dihasilkan pada tahap identifikasi yang selanjutnya disekuen berdasarkan program sekuen BLAST yang bertujuan untuk melihat kekerabatan bakteri tersebut sebagai konfirmasi kesamaan bakteri dengan negara ataupun daerah lain.
Pengambilan sampel
10
Isolasi dan Pemurnian Bakteri X. oryzae pv. oryzae
Pembuatan Media Wakimoto Agar (WA) Modifikasi IRRI (1996)
Pembuatan media biakan bakteri tersebut disiapkan dalambotol Schott 1000 ml dengan ekstrak kentang yang telah direbus pada 300 g kentang bersih yang dipotong dadu, dicampurkan 17 g sukrosa, 7 g pepton, 0.5 g Ca(NO3)2 4H2O, 1 g
Na2.HPO4.12H2O, 17 g bakto agar, dalam 1 L H2O destilata, diaduk dengan
magnetic stirrer diatas hot plate kemudian diautoklaf selama 30 menit pada suhu 121 oC, selanjutnya media didinginkan beberapa saat untuk selanjutnya dituang
pada cawan petri, media yang telah dituang kembali didiamkan hingga menjadi padat. Proses penuangan media dilakukan dalam laminar air flow cabinet.
Isolasi Bakteri X. oryzae pv. oryzae (IRRI 1996)
Daun yang mengalami gejala HDB dicuci dengan air, dipotong kecil berkisar 1 x 1 cm, direndam dengan etanol 70% selama 3 menit. Selanjutnya dibilas dengan air steril sebanyak dua kali selama 2 menit. Setelah itu, daun digores dengan menggunakan bantuan pinset, dan digoreskan kembali ke media cawan wakimoto agar (WA) yang telah diberi label sesuai kode sampel. Cawan Petri yang digoreskan daun bergejala disimpan selama 48 jam pada suhu ruang. Proses ini dilakukan dalam laminar air flow cabinet.
Pemurnian Bakteri X. oryzae pv. oryzae (IRRI 1996).
Media cawan yang telah ditumbuhi koloni bakteri ditandai dengan koloni kuning keputihan hal ini merupakan ciri spesifik koloni bakteri X. oryzae pv.
oryzae pada media Wakimoto. Satu ose koloni dari cawan diambil dengan
mengunakan tusuk sate dan digoreskan kembali pada media WA yang telah diberikan tanda berdasarkan penomoran isolat bakteri yang tumbuh pada tahap awal, kemudian disimpan pada suhu ruang untuk keperluan uji selanjutnya. Setiap proses isolasi dilakukan di dalam laminar air flow cabinet.
Identifikasi X. oryzae pv. oryzae dengan teknik PCR Penyiapan template DNA untuk PCR dari koloni Bakteri X. oryzae pv.
oryzae
Identifikasi bakteri dengan teknik PCR koloni yang dilakukan dengan modifikasi metode Dafa’alla et al. (2000) memerlukan penyiapan DNA template langsung dari koloni bakteri. Satu lup koloni bakteri dimasukkan ke dalam air destilata dengan volume 100 µl pada tabung eppendorf 1.5 ml, inkubasi dalam
waterbath dengan suhu 65 oC selama 2 jam (setiap 10 menit dibolak-balik),
supernatan yang telah ada digunakan sebagai template DNA.
Ekstraksi DNA Total dari Daun yang Terinfeksi Bakteri X. oryzae pv. oryzae
Penyiapan DNA template untuk reaksi dalam deteksi PCR terhadap bakteri dari tanaman sakit dilakukan dengan Ekstraksi DNA total metode modifikasi Zouhar et al.(2000). Daun tanaman bergejala diambil sebanyak 0.1g kemudian digerus dengan mortar yang ditambahkan dengan buffer ekstrak Carlson lysis
buffer(CLB). Diinkubasi dalam waterbath pada suhu 65 oC selama 2 jam (setiap
11 menit pada kecepatan 11000 rpm. Supernatan yang terbentuk dipindahkan pada tabung eppendorf yang baru. Supernatan ditambahkan larutan kloroform sebanyak 300 µl dan dibolak-balik selama 3 menit. Disentrifius kembali dengan kecepatan 14000 rpm selama 15 menit, supernatan yang dihasilkan dipindahkan lagi pada tabung ependorf yang baru.Supernatan kembali ditambahkan dengan larutan Na-Acetat 3 M sebanyak 40 µl dan dibolak-balik selama 5 menit.Selanjutnya diinkubasikan pada suhu -20 oC selama 24 jam. Supernatan yang telah diinkubasikan kembali disentrifius pada kecepatan 12000 rpm selama 15 menit. Setelah itu, supernatan dibuang dengan hati-hati. Pelet yang tertingal pada tabung eppendorf ditambahkan kembali dengan etanol 80% untuk proses pembersihan pelet sebanyak 400 µl kemudian disentrifius pada kecepatan 12000 rpm selama 3 menit. Buang supernatan yang dihasilkan kemudian keringkan pelet yang dihasilkan pada tabung eppendorf. Terakhir, dalam proses penyimpanan untuk keperluan identifikasi DNA dalam jangka waktu dekat ditambahkan ddH2O 40-50
µl sesuai dengan ketebalan dari endapan pelet yang dihasilkan. Amplifikasi DNA X. oryzae pv. oryzae.
Tahap identifikasi molekuler dilakukan dengan menggunakan teknik PCR yang menggunakan satu pasang primer spesifik yakni primer XOR-F (5'-GCATGACGTCATCGTCCTGT-3') dan XOR-R2 (5'-CTCGGAGCTATATGC-CGTGC-3') (Adachi & Oku, 2000). Pasangan primer ini dapat digunakan dalam memperjelas keberadaan DNA X. oryzae pv. oryzae pada ukuran 470 pb. Reaksi PCR tediri atas10.5µLGo Taq® green Master Mix (Promega), 9.5 µLddH2O, 2
µLDNA template, 1.5 µLprimerforward XOR-F pada 10 pM, 1.5 µLprimer
reverse XOR-R2 pada 10 pM. Program PCR dengan tahap amplifikasi yang
digunakan dapat dilihat pada Tabel 2 berikut :
Tabel 2 Program amplifikasi PCR menggunakan primer XOR-F/XOR-R2 untuk X. oryzae pv. oryzae
Elektroforesis DNA dilakukan dengan 1.5% gel agarosa yang diberikan penanda DNA pada salah satu sumurnya, bufer Tris Asetat EDTA (TAE) dan proses elektroforesis pada tegangan 100 Volt DC selama 30 menit. Selanjutnya hasil elektroforesis divisualisasi menggunakan menggunakan ethidium bromida dan didokumentasikan menggunakan gel doc UVITEC Cambridge.
Analisis sekuen DNA.
12
Uji keragaman patotipe berdasarkan tanaman diferensial dengan metode Kozaka (1969)
Hasil identifikasi X. oryzae pv. oryzae dengan teknik PCR yang menunjukkan reaksi positif Xanthomonas dilanjutkan dengan uji pada tanaman diferensial dengan metode Kozaka yang menggunakan 5 varietas sebagai tanaman indikator untuk menunjukkan pengelompokan patotipe X. oryzae pv. oryzae. Tanaman diferensial ini penting dilakukan untuk mendapatkan kelompok patotipe yang menginfeksi tanaman karena diketahui tanaman ini mengandung gen ketahanan tertentu terhadap infeksi bakteri X. oryzae pv. oryzae. Tanaman diferensial yang digunakan adalah varietas Kinmase, Kogyoku, Tetep, Waseaikoku, dan Java 14.
Inokulasi bakteri dilakukan dengan caraclip-method yakni dengan menggunting atau memotong ujung daun padi sekitar 2-3 cm dengan menggunakan gunting yang telah dicelupkan dalam suspensi X. oryzae pv. Oryzae yang berumur 48 jam, kemudian tanaman yang telah diinokulasikan bakteri tersebut disungkupkan dengan plastik kemudian diinkubasikan. Pengamatan penyakit yang telah diinokulasi dilakukan dengan cara mengukur panjang gejala yang muncul pada daun tanaman selama 14 hari setelah inokulasi. Rasio keparahan penyakit ditunjukkan berdasarkan panjang gejala yang ada dan perhitungan keparahan penyakit berdasarkan rasio gejala tersebut. Parameter pengamatan keparahan penyakit yaitu gejala yang kurang dari 11% tergolong tahan sedangkan yang lebih dari 11% tergolong rentan. Untuk menentukan jenis patotipe bakteri ini maka intensitas penyakit yang ditunjukan dihitung berdasarkan rumus berikut.
Keterangan : IP = Intensitas penyakit
a = Panjang gejala HDB pada tanaman (cm) b = Panjang daun secara keseluruhan (cm)
a
13
4
HASIL DAN PEMBAHASAN
Isolasi dan Konfirmasi DNABakteri X. oryzae pv. oryzae
IsolatBakteri X. oryzae pv. oryzae
Isolasi bakteri X. oryzae pv. oryzae dari tanaman padi di tujuh kabupaten di Sulawesi Selatan diperoleh 75 isolat bakteri yang ditumbuhkan pada media agar Wakimoto (Tabel 3) yang terdiri atas 33 isolat bakteri dengan koloni berwarna putih, 3 isolat berwarna oranye, dan 39 isolat berwarna kuning. Hasil isolat yang berbeda menunjukkan bahwa beberapa isolat tidak termasuk bakteri X. oryzae pv.
oryzae yang ditunjukkan dengan hasil negatif pada proses identifikasi secara
molekuler.
Tabel 3 Morfologi koloni bakteri dan identifikasi molekuler
No Kode
9 Xo058 Ciherang Jeneponto Kuning negatif
10 Xo059 Ciherang Jeneponto Putih negatif
11 Xo060 Membramo Jeneponto Oranye negatif
12 Xo061 Membramo Jeneponto Putih negatif
14
Tabel 3 (Lanjutan) Morfologi koloni bakteri dan identifikasi molekuler No Kode
65 Xo128 Cisantana Takalar Kuning positif
66 Xo129 IR 64 Takalar Kuning positif
67 Xo130 Camindi Bone Kuning positif
68 Xo131 Cigeulis Bone Kuning positif
69 Xo132 Membramo Jeneponto Kuning positif
15 Tabel 3 (Lanjutan) Morfologi koloni bakteri dan identifikasi molekuler
No Kode
72 Xo135 Cigeulis Jeneponto Kuning positif
73 Xo136 Membramo Bantaeng Kuning positif
74 Xo137 Inpari 4 Bantaeng Kuning positif
75 Xo138 Inpari 4 Bantaeng Kuning positif
Keragaman bentuk koloni yang dihasilkan pada proses isolasi menunjukkan bahwa media wakimoto yang digunakan menunjukkan hasil spesifik dalam menumbuhkan bakteri X. oryzae pv. oryzae dengan ciri morfologi kuning dengan elevasi bulat cembung dan memiliki lendir berwarna putih, selain itu pertumbuhan bakteri X. oryzae pv. oryzae pada media wakimoto akan tumbuh lebih subur jika dibandingkan dengan pertumbuhan pada media yang lain. Adapun jenis koloni bakteri yang berbeda akan tetap tumbuh pada media tersebut. Hal tersebut diduga disebabkan oleh berbagai jenis bahan yang digunakan memiliki nutrisi yang sama untuk menumbuhkan jenis bakteri yang lain meskipun ciri morfologi yang dihasilkan akan tetap berbeda. Adapun keragaman jenis koloni bakteri yang dihasilkan pada media Wakimoto yang digunakan ditunjukan pada Gambar 3.
A B C
Gambar 3 Isolat bakteri dari tanaman padi : Isolat berwarna putih Xo069 (A), Isolat berwarna oranye Xo052 (B), Isolat berwarna
kuning Xo137 (C).
Isolat bakteri yang tumbuh pada media agar Wakimoto memiliki perbedaan secara morfologi (Tabel 3). Bentuk koloni yang positif X. oryzae pv. oryzae berwarna kuning muda dengan sedikit lendir yang berwarna putih, hal tersebut juga ditunjang dengan hasil yang positif dengan teknik identifikasi molekuler yang dilakukan. Diperoleh isolat yang berwarna oranye diduga berasal dari spesies Xanthomonas spp. namun pathovar yang berbeda karena isolat yang tumbuh menunjukkan kecenderungan berwarna kuning yang lebih terang hal ini diduga karena isolat tersebut juga mengandung pigmen Xanthomonadin.
16
Bentuk gejala tanaman yang terinfeksi bakteri X. oryzae pv. oryzae terkadang tidak dapat secara langsung dibedakan dengan daun tanaman yang kering akibat kekurangan unsur hara. Meskipun demikian, penanggulangan dengan penggunaan pupuk yang berlebihan juga dapat berpengaruh terhadap perkembangan patogen khususnya dalam perkembangan bakteri X. oryzae pv. oryzae. Penggunaan pupuk N secara berlebihan dapat menyebabkan tanaman padi mudah atau rentan terinfeksi bakteri X. oryzae pv. oryzae karena jaringan tanaman tersebut akan menjadi lebih lunak. Selain itu, pemupukan dengan pupuk N secara berlebihan juga dapat menyebabkan tanaman memproduksi asam aspartat dan asam flusarat yang merupakan nutrisi yang baik bagi perkembangan X. oryzae pv. oryzae. Berbeda halnya dengan kebutuhan pupuk P dan K, jika pemberian pupuk ini kurang maka cenderung akan meningkatkan intensitas penyakit HDB. Berdasarkan hal tersebut diperlukan pemakaian pupuk yang seimbang guna menekan perkembangan penyakit.
Deteksi PCR Bakteri X. oryzaepv. oryzae dari Jaringan Tanaman Sakit
Deteksi PCR terhadap X. oryzae pv. oryzae dari jaringan tanaman sakit menggunakan DNA template hasil isolasi DNA total dari jaringan tanaman dan primer spesifik diperoleh hasil bahwa sebagian besar sampel tanaman sakit menunjukkan pita DNA pada ukuran 470 pb melalui visualisasi pada elektroforesis gel agarose yang mengonfirmasi bahwa sampel tanaman tersebut terinfeksi bakteri X. oryzae pv. oryzae.
17 Beberapa sampel tanaman yaitu varietas Cigeulis asal Bone, Inpari asal Maros dan Bantaeng, dan Membramo asal Bantaeng, dan IR64 asal Takalar Cigeulis asal Jeneponto tidak menghasilkan pita DNA pada ukuran panjang basah 470 bp. Beberapa varietas juga hanya menunjukkan pita DNA yang tipis seperti varietas Cisantana di wilayah Pangkep dan varietas Cigeulis di wilayah Jeneponto (Gambar 4).
Berbeda halnya dengan teknik identifikasi yang dilakukan dengan teknik PCR koloni, identifikasi bakteri dari jaringan tanaman lebih membutuhkan tingkat kehati-hatian dalam mengekstraksi DNA bakteri yang diharapkan. Hal tersebut disebabkan oleh adanya proses pemisahan DNA tanaman itu sendiri yang kemungkinan besar dapat terikut saat proses amplifikasi yang menyebabkan tidak munculnya pita DNA bakteri yang diharapkan.
Identifikasi Bakteri X. oryzae pv. oryzaedengan PCR Koloni
Hasil identifikasi berdasarkan teknik PCR koloni menggunakan primer spesifik untuk mengamplifikasi bakteri X. oryzae pv. oryzae. Diperoleh 29 isolat yang positif X. oryzae pv. oryzae dengan menunjukkan pita DNA pada 470 pb. Hasil amplifikasi dengan teknik PCR koloni tidak jauh berbeda dengan hasil amplifikasi yang dilakukan dengan teknik ekstraksi DNA bakteri dari tanaman yang juga menggunakan primer spesifik XOR-F/XOR-R2. Kedua teknik tersebut dapat digunakan untuk mengidentifikasi adanya mikroorganisme seperti bakteri yang menginfeksi tanaman (Lang et al. 2010).
Identifikasi dengan teknik PCR koloni menunjukkan beberapa isolat bakteri yang teramplifikasi dan menujukkan positif bakteri X. oryzae pv. oryzae. Adapun pada isolat bakteri 069 dan 052 tidak menunjukan pita DNA pada 470 pb sehinggaisolat bakteri tersebut dianggap bukan bakteri X. oryzae pv. oryzae. Hal ini juga didukung bahwa ciri morfologi koloni yang dihasilkan berwarna putih dan isolat 052 berwarna oranye.
Identifikasi koloni bakteri dengan teknik molekuler mampu diandalkan sebagai teknik identifikasi yang cepat dalam mendeteksi bakteri secara dini meskipun hanya menggunakan satu pasang jenis primer. Seperti yang dilaporkan oleh Tasliah et al. (2013) bahwa identifikasi molekuler dengan satu pasang primer sudah cukup mampu menyeleksi bakteri karena konsistensi dari primer spesifik yang digunakan, namun jika waktu dan fasilitasnya memungkinkan sebaiknya identifikasi secara lengkap melibatkan teknik pengamatan morfologi, pengujian fisiologi dan biokimia perlu dilakukan untuk mendukung kesimpulan identifikasi yang meyakinkan tentang suatu bakteri yang diamati. Hasil identifkasi bakteri X. oryzae pv. oryzae dengan teknik PCR koloni ditunjukkan pada Gambar 5.
18
Gambar 5 Amplifikasi PCR koloni positif bakteriX. oryzae pv. oryzaemenggunakan primer XOR-R2/XOR-F. M (Marker 100 pb), Kn + (Kontrol positif). Kode isolat lainnya mengikuti kode isolat pada Tabel 3
Keragaman dan Distribusi Kelompok Patotipe X. oryzae pv. oryzae
Berdasarkan hasil pengujian virulensi isolat bakteri terhadap 5 varietas diferensial maka diperoleh 3 jenis kelompok patotipe yang tersebar dibeberapa kabupaten di Sulsel. Kelompok patotipe tersebut adalah patotipe III, IV, dan XII. Kelompok patotipe yang dominan adalah kelompok patotipe IV sebesar 72%, sedangkan patotipe III yang dahulu dilaporkan banyak terdapat di Sulsel hanya mencapai 20.6% dan terakhir adalah patotipe XII 6.8%.
Keragaman patotipe X. oryzae pv. oryzae disebabkan oleh tingkat virulensi bakteri. Pengelompokan patotipe dapat dibedakan dengan adanya gen virulen yang dimiliki oleh bakteri tersebut yang berkaitan dengan gen ketahanan tanaman
500 pb
Xo130 Bn Xo131 Bn Xo135 Jpt Xo132 Jpt M
Xo120 Mr
Xo136 Btg Xo138 Btg Xo137 Btg Xo128 T
kl
M
Xo110 Br Xo111 Br Xo113 Br Xo112 Br Xo113 Jpt 101 Mrs Kn + 069 B
19 padi dan diasumsikan mengikuti konsep hubungan gen ke gen (Hopkins et al. 1992) konsep gen ke gen merupakan suatu konsep yang melibatkan satu gen tanaman terhadap gen lain yang mempengaruhi ketahanan tanaman terhadap gen patogen yang menginfeksinya (Agrios 2005).
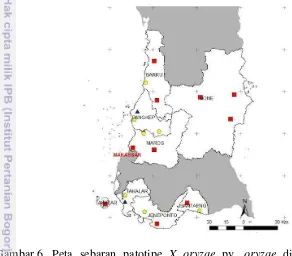
Sejumlah kelompok patotipe yang diperoleh berdasarkan hasil identifikasi dan pengelompokkan patotipe berdasarkan metode kozaka maka distribusi sebaran patotipe yang diperoleh dari sejumlah kabupaten di Sulawesi Selatan dapat dipetakan. Dominansi patotipe IV yang menginfeksi pertanaman padi terdapat di Kabupaten Barru, Bone, Maros, Jeneponto, dan Bantaeng (Gambar 6). Berbeda halnya dengan kabupaten Pangkep dan Takalar, meskipun tetap didominasi oleh patotipe IV namun di wilayah ini terdapat patotipe baru yang muncul yaitu patotipe XII.
Gambar 6 Peta sebaran patotipe X oryzae pv. oryzae di beberapa kabupaten di Sulawesi Selatan.
= Patotipe III, = Patotipe IV, = Patotipe XII
Perbedaan atau munculnya patotipe yang beragam pada suatu wilayah yang berbeda disebabkan oleh gen ketahanan tanaman terhadap HDB yang diperlukan setiap tanaman ikut berbeda dari satu lokasi dengan lokasi yang lain. Penyebaran dan perkembangan patogen juga dipengaruhi oleh kondisi lingkungan yang tersedia pada lokasi tertentu yang mungkin memiliki perbedaan. Kelembapan serta jarak tanam yang terlalu rapat menjadi penyebab mudahnya penularan penyakit pada tanaman (Khaeruni 2001).
Besarnya persentase kelompok patotipe IV yang dihasilkan menunjukkan bahwa kelompok patotipe ini masih menjadi patotipe yang dominan menginfeksi tanaman padi di sejumlah daerah di Sulawesi Selatan. Hal ini ditunjukkan oleh terdapatnya kelompok patotipe IV disetiap daerah pengambilan sampel (Tabel 4).
20
dan didominasi oleh patotipe IV namun perubahan dan pergeseran patotipe tidak terdapat di daerah yang lainnya seperti Kab. Maros yang tetap di dominasi oleh patotipe IV (Yuliani et al. 2012). Adanya perbedaan wilayah dan varietas padi yang ditanam mempengaruhi perbedaan pergeseran patotipe yang terjadi di wilayah tertentu. Keragaman genetik suatu patogen dapat berperan penting dalam menimbulkan patotipe baru pada suatu periode di lokasi tertentu (Hifni & Kardin 1998). Evolusi suatu patotipe X. oryzae pv. oryzae dapat terjadi seiring perkembangan varietas tahan yang terus ditingkatkan. Dapat disimpulkan bahwa pertanaman padi di wilayah Kabupaten Maros belum mengalami perubahan patotipe X. oryzae pv. oryzae namun mempengaruhi sejumlah wilayah yang berdekatan seperti Barru dan Pangkep.
Terdapatnya patotipe XII di wilayah Kabupaten Pangkep dan Takalar merupakan hal baru dalam perkembangan distribusi patotipe X. oryzae pv. oryzae yang ada di Sulawesi Selatan. Munculnya patotipe XII pada wilayah tersebut diduga karena jenis varietas yang ditanaman sudah rentan terhadap infeksi bakteri X. oryzae pv. oryzae. Penggunaan varietas yang sama sering dilakukan oleh pihak petani secara terus menerus. Tingkat ketahanan inang merupakan komponen penting dalam merespon serangan patogen hingga menimbulkan gejala hawar pada daun tanaman (Gupta et al 2001).
Hasil pengelompokan patotipe X. oryzae pv. oryzae juga menunjukkan bahwa perubahan patotipe yang terjadi memiliki peran dalam menginfeksi varietas-varietas padi yang tahan di pertanaman Sulawesi Selatan.
21 Tabel 4 Kelompok patotipe X. oryzae pv. oryzae asal Sulawesi Selatan
Kode isolat
Varietas
padi Asal
Intensitas keparahan penyakit pada tanaman diferensial Jepang (%)
Patotipe Tetep Java 14 Kinmase Kogyoku Wase Aikoku
i Filogenetika X. oryzae pv. oryzae berdasarkan Runutan Nukleotida
Analisis kesamaan (homologi) runutan nukleotida isolat asal Sulsel menunjukkan bahwa tingkat homologi yang sangat tinggi terhadap isolat yang berasal dari negara Cina, Korea, Jepang, India, dan Amerika. Nilai homologi yang dimiliki berada pada kisaran 99.5-100% (Lampiran 1). Pohon filogenetik antar isolat bakteri (Gambar 7) memperlihatkan pengelompokan isolat-isolat asal Sulsel yang berkerabat erat dengan isolat dari negara lain dengan nilai bootstrap berkisar 0.000-0.001. Berbeda halnya dengan isolat Xo114 asal Pangkep dan isolat Xo127 asal Takalar yang membentuk kelompok tersendiri, hal tersebut diduga disebabkan oleh adanya susunan nukleotida yang berbeda dari kelompok isolat yang lain pada urutan basa 37 dan 104 dengan tanda yang berwarna merah pada hasil runutan nukleotida (Lampiran 2).
Kesamaan isolat bakteri X. oryzae pv. oryzae yang diperoleh dari beberapa kabupaten yang ada di Sulsel belum dapat disamakan dengan isolat-isolat bakteri yang berasal dari daerah lain yang ada di Indonesia. Hal ini diduga karena belum adanya data runutan nukleotida yang didaftarkan pada NCBI yang berasal dari Indonesia. Berdasarkan hasil penelitian yang dilakukan dapat diasumsikan bahwa isolat bakteri asal Sulawesi Selatandapat saja dikatakan sama dengan isolat yang berasal dari beberpa daerah yang berbeda di Indonesia disebabkan oleh beberpa varietas yang banyak ditemukan di pertanaman padi di Sulsel sendiri hampir seluruhnya berasal dari daerah yang sama dan dominan berasal dari pulau Jawa.
Gambar 7 Pohon filogenetik bakteri X. oryzae pv. oryzae asal Sulsel (bootstrap 1000 kali ulangan).
Hasil konstruksi filogenetik yang dihasilkan sepenuhnya belum dapat menjawab tentang perbedaan patotipe dari isolat yang diperoleh dari hasil identifikasi. Hal tersebut didasarkan oleh asam nukleat atau nukleotida yang dihasilkan hanya mampu menunjukkan perbedaan spesies mikroorganisme yang
X. oryzae pv. oryzae AE013598 KOREA X. oryzae pv. oryzae KJ740440 INDIA X. oryzae pv. oryzae AY250998 CINA X. oryzae pv. oryzae AP008299 JEPANG X.oryzae pv. oryzae CP000967 USA X. Oryzae pv. oryzi col a CP011962 USA X. oryzae pv. oryzi col a JF938915 CINA X. Campestri s pv. zi nni ae JQ665725 KOREA X. campestri s pv. zi nni ae EF514223 HUNGARIA
0.000 0.001
0.002 0.003
ii
berbeda sehingga dibutuhkan tindak lanjut dalam penentuan kasta yang lebih detail agar dapat menunjukkan perbedaan spesifik terhadap perbedaan antara satu patotipe dengan patotipe lainnya.
iii
5
SIMPULAN DAN SARAN
Simpulan
Identifikasi berdasar morfologi dan PCR menggunakan primer spesifik ditunjukkan bahwa isolat-isolat bakteri yang diisolasi dari tanaman padi bergejala penyakit hawar daun adalah Xanthomonas oryzae pv. oryzae.
Berdasarkan identifikasi patotipe ditunjukkan bahwa patotipe yang dominan tersebar di Sulawesi Selatan adalah berturut turut patotipe IV dan patotipe III. Dalam penelitian ini juga teridentifikasi adanya patotipe XII yang selama ini belum pernah dilaporkan, namun tidak dominan. Terdapat patotipe yang berbeda yang dapat menyerang varietas yang sama pada lokasi yang berbeda. Selain itu, patotipe yang sama juga tersebar pada daerah yang sama dengan varietas yang berbeda. Patotipe XII sebagai patotipe yang baru ditemukan, secara signifikan berbeda pada lokasi yang berbeda dengan varietas yang juga berbeda. Hasil pengelompokkan dan distribusi patotipe bakteri X. oryzae pv. oryzae yang berasal dari lahan pertanaman padi di Sulawesi Selatan menunjukkan bahwa keragaman varietas dengan tingkat ketahanan yang berbeda terhadap infeksi bakteri X. oryzae
pv. oryzae mampu memperlambat laju perkembangan munculnya patotipe baru
yang menginfeksi tanaman padi sawah pada beberapa daerah yang ada di Sulawesi Selatan.
Bakteri X. oryzae pv. oryzae yang diperoleh dari Sulawesi Selatan memiliki kekerabatan yang sangat erat dengan bakteri yang berasal dari Amerika Serikat, Korea, India, Jepang dan Cina dengan tingkat homologi 99.5-100% yang menandakan bahwa isolat bakteri yang di uji merupakan isolat bakteri yang identik yang menginfeksi tanaman padi pada negara-negara tersebut.
Saran
iv
DAFTAR PUSTAKA
Adachi N, Oku T. 2000. PCR-mediated detection of Xanthomonas oryzae pv.
oryzae by amplification of the 16S-23S rDNA spacer region sequence. J
General Plant Pathology. 66(4): 303-309.
Adhikari TB, Basnyat RC, Mew TW. 1999. Virulence of Xanthomonas oryzae pv. oryzae on rice lines containing single resistance genes and gene combination. J Plant Dis. 83:46-50.
Adhikari TB, Cruz CMV, Zhang Q, Nelson RJ, Skinner DZ, Mew TW, Leach JE.. 1995. Genetic diversity of Xanthomonas oryzae pv oryzae in Asia. J ASM. 61(3):966-971.
Agrios GN. 2005. Plant pathology. 5th ed. Elsevier Academic Press. California. Brar JS,Thind BS. 1994. A new weed host of X. oryzae pv. oryzae the causal
agent of bacterial blight of rice. J Plant Prot. 2(1):79-80.
[BPTPH] Balai Proteksi Tanaman Pangan dan Hortikultura. 2008. Luas serangan penyakit kresek pada tanaman padi di Sulawesi Selatan. Maros (ID). Dafa’alla TH, Hobom G, Zahner H. 2000. Direct colony identification by
PCR-miniprep. J Mol Biol. 1: 65-66.
[Ditlin] Direktorat Perlindungan Tanaman Pangan. 2011. OPT Padi di Indonesia 2010. Direktorat Perlindungan Tanaman Pangan, Direktorat Jenderal Tanaman Pangan. Kementerian Pertanian. Jakarta (ID).
Felsenstein J. 1981. Evolutionary trees from DNA sequences: maximum likelihood approach. J Mol Evol. 17:68-76.
George MLC, Bustaman M, Cruz WT, Leach JE, Nelson RJ. 1996. Movement of
Xanthomonas oryzae pv. oryzae in Southest Asia detected using
PCR-based DNA fingerprint. J Phytopathol. 87:302-309.
Gupta VS, Rajebhosale MD, Sodhi M, Singh S, Gnanamanickam SS, Dhaliwal HS, Ranjekar PK. 2001. Assessment of genetic variability and strain identification of Xanthomonas oryzae pv. oryzae using RAPD-PCR and IS1112-based PCR. J Current Science. 80:1043-1049.
Hifni HR, Kardin MK. 1998. Pengelompokan isolat Xanthomonas oryzae pv. oryzae dengan menggunakan galur isogenik padi IRRI. J Hayati. 5(3):66-72.
Hopkins CM, White FF, Choi SH, Guo A, Leach JE. 1992. Identification of a family of avirulence genes from Xanthomonas oryzae pv. oryzae. J Mol Plant-Microb Interact. 5(1):451-459.
[IRRI] International Rice Research Institute. 1996. Standar evaluation system for rice. 5th ed. INGGER. IRRI. Philipinnes.
[IRRI] International Rice Research Institute. 2009. Knowledge Bank of Rice. http://www.knowledgebank.irri.0rg/rice.htm. diunduh 20 Oktober 2015. Kadir TS, Suryadi Y, Sudir, Machmud M. 2009. Penyakit bakteri padi dan cara
pengendaliannya. Inovasi Teknologi Padi. BB Padi. Hal 499-530.
Kadir TS. 2009. Menangkal HDB dengan Menggilir Varietas. Warta Penelitian dan Pengembangan Pertanian.31: 1-3.
v
oryzicola. J American Phytopathol Society. 94(3):311-319. DOI:
10.1094/PDIS-94-3-0311
Leach JE, White FF, Rhoads ML, Leung H. 1990. A repetitive DNA sequence differentiates Xanthomonas campestris pv. oryzae from other pathovar of
Xanthomonas campestris. Molecular Plant Microbe Interactions.
3:238-246.
Mew TW, Alvarez AM, Leach JE, Swings J. 1993. Focus on bacterial blight of rice. JPSlant Dis 77: 5-21.doi: 10.1094/PD-77-0005.
Mew TW, Alvarez AM, Leach JE, Swings J. 1993. Focus on bacterial blight of rice. J Plant Dis. 77:5-12.
Mew TW, Vera C, Rayes RC. 1982. Interaction of Xanthomonas campestris oryzae and resistance of rice cultivar. J Phytopathology 72(7): 786-789. Mew TW. 1988. An overview of the world bacterial blight situation. International
work shop on bacterial blight of rice. Manila: International Rice Research Institute.
Murty VST, Devadath S. 1984. Role of seed in survival and transmission of
Xanthomonas campestris pv. oryzae causing bacterial blight of rice.
JPhytophathologische Zeitschift. 110:15-19.
Narasimhan V, Kareem A. 1994. Simulation of the effect of bacterial leaf blight infection on yield reduction in rice. Analysis of damage mechanisms by pest and diseases and their effects on rice yield. In p 44-59 SARP Research Proceedings.
Nino-Liu DO, Ronald PC, Bogdanove AJ. 2006. Xanthomonas oryzae pathovars: Model pathogens of a model crop. J Mol Plant Pathol. 7:303-324.
Noda T, Yamamoto T, Kaku H, Horino O. 1996. Geographical distribution of pathogenic races of Xanthomonas oryzae pv. oryzae in Japan in 1991 and 1993. J Phytopathol. 62:549-553.
Nyvall RF. 1999. Field crop disease.3rd ed. State University Press. Ames, Iowa. Ou SH. 1985. Rice Disease. London: Common wealth Mycological Institute. Ponciano G, Ishihara H, Tsuyumu S, Leach JE. 2003. Bacterial effectors in plant
disease and defense: keys to durable resistance. J Plant Disease. 87(11):1272-1282.
Qi Z, Mew TW. 1989. Types of resistance in rice to bacterial blight. In p 125-134. Bacterial blight of rice. IRRI. Manila Philippines.
Reddy R, Shang-Zhi Y. 1989. Survival of Xanthomonas campestris pv. oryzae the causal organism of bacterial blight. In: Bacterial Blight of Rice, IRRI, editor. Proceedings of The International Workshop on Bacterial Blight of Rice. Manila. Philipphes. 14-18 March, 1988. P 65-78.
Shivalingaiah, Umesha S, Sateesh MK. 2012. Detection of Xanthomonas oryzae
pv. oryzae in rice seeds by molecular techniques. J Plant Science and
Biotechnology. 6(1):44-47.
vi
Sudir, Kadir TS, Suprihanto. 2006. Perubahan virulensi. Strain bakteri
Xanthomonas oryzae pv. oryzae penyebab penyakit hawar daun bakteri
padi. J Tanaman pangan. 25(2): 100-107.
Sudir, Suprihanto, Triny SK. 2009. Identifikasi patotipe Xanthomonas oryzae pv. oryzae, penyebab penyakit Hawar Daun Bakteri di sentra produksi padi di Jawa. J Tanaman Pangan. 28(3):131-137.
Sudir, Suprihanto. 2006. Perubahan virulensi strain Xanthomonas oryzaepv.
oryzae penyebab penyakit Hawar Daun Bakteri pada tanaman padi. J
Penelitian Tanaman Pangan. 25(2):100-107.
Suparyono, Sudir, Suprihanto. 2003. Komposisi patotipe patogen hawar daun bakteri pada tanaman padi stadium tumbuh berbeda. J Tanaman Pangan. 22(1):45-50.
Suparyono, Sudir, Suprihanto. 2004. Pathotype profile of Xanthomonas campestris pv. oryzae isolates from the rice ecosystem in Java. Indonesian. J Agri Sci. 5(2):63-69.
Suparyono, Sudir. 1992. Perkembangan penyakit bakteri hawar daun pada stadia tumbuh yang berbeda dan pengaruhnya terhadap hasil padi. Media Penelitian Sukamandi. 12: 6-9.
Swings J, Mooter VM, Vauterin L, Hoste B, Gillis M, Mew TW, Kersters K. 1990. Reclassification of the causal agents of bacterial blight Xanthomonas
campestris pv. oryzae and bacterial leaf streak (Xanthomonas campestris
pv. oryzicola) of rice as pathovars of Xanthomonas sp. J Systematic
Bacteriology. 40:309-311.
Tasliah, Mahrup, Prasetiyono J. 2013. Identifikasi Molekuler Hawar Daun Bakteri (Xanthomonas oryzae pv. oryzae) dan Uji Patogenesitasnya pada Galur-galur Padi Isogenik . J AgroBiogen. 9(2):49-57.
Triny SK. 2000. Penyakit hawar daun bakteri. Dalam tonggak kemajuan teknologi produksi tanaman pangan. Puslitbangtan Pertanian. Bulletin IPTEK Tanaman Pangaman. Badan Litbang (ID).
Yuliani D, Faizal A, Sudir. 2012. Identifikasi patotipe Xanthomonas oryzae pv. oryzae peneybab penyakit hawar daun bakteri padi di sentra produksi padi di Sulawesi Selatan. Di dalam: Prosiding seminar nasional hasil penelitian 2011 buku I Balai Besar Penelitian Tanaman Padi Sukamandi. Sukamandi (ID). Hlm 121-130.
Yuwono T. 2008. Biologi molekuler. Safitri A, editor. Jakarta (ID): Erlangga. Zouhar M, Rysanek P, Kocova M. 2000. Detection and differentiation of the
28 Lampiran 1 Tingkat homologi runutan nuleotida bakteri X. oryzae pv. oryzaeasal Bantaeng, Barru, Jeneponto, Takalar, Maros, Pangkep, dan Bone dengan
negara yang lain sesuai matriks kemiripan identitas
No Nama Spesies 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 1 Xo1363 BANTAENG-IDN ID
2 Xo1374 BANTAENG-IDN 100 ID 3 Xo1114 BARRU-IDN 100 100 ID 4 Xo1304 BONE-IDN 99.7 99.7 99.7 ID 5 Xo1314 BONE-IDN 99.7 99.7 99.7 99.7 ID 6 Xo1354 JEPOT-IDN 100 100 100 99.7 99.7 ID 7 Xo1323 JEPOT-IDN 100 100 100 99.7 99.7 100 ID 8 Xo1184 MAROS-IDN 100 100 100 99.7 99.7 100 100 ID 9 Xo1144 PANGKEP-IDN 99.5 99.5 99.5 99.2 99.2 99.5 99.5 99.5 ID 10 Xo12712 TAKALAR-IDN 99.5 99.5 99.5 99.2 99.2 99.5 99.5 99.5 100 ID 11 Xo1264 TAKALAR-IDN 100 100 100 99.7 99.7 100 100 100 99.5 99.5 ID 12 Xo1294 TAKALAR-IDN 100 100 100 99.7 99.7 100 100 100 99.5 99.5 100 ID 13 X. oryzae pv. oryzae CP000967 USA 100 100 100 99.7 99.7 100 100 100 99.5 99.5 100 100 ID 14 X. oryzae pv. oryzae AP008299 JEPANG 100 100 100 99.7 99.7 100 100 100 99.5 99.5 100 100 100 ID 15 X. oryzae pv. oryzae AY250998 CINA 100 100 100 99.7 99.7 100 100 100 99.5 99.5 100 100 100 100 ID 16 X. oryzae pv. oryzae AE013598 KOREA 100 100 100 99.7 99.7 100 100 100 99.5 99.5 100 100 100 100 100 ID 17 X. oryzae pv. oryzicola CP011962 USA 99.2 99.2 99.2 99 99 99.2 99.2 99.2 98.8 98.8 99.2 99.2 99.2 99.2 99.2 99.2 ID 18 X. campestris pv. zinniae JQ975042 KOREA 99 99 99 98.8 98.8 99 99 99 98.5 98.5 99 99 99 99 99 99 99.2 ID 19 Xanthomonas sp.EF050736 IRAN 99 99 99 98.8 98.8 99 99 99 98.5 98.5 99 99 99 99 99 99 99.2 99.5 ID 20 X. campestris pv. zinniae EF514223 HUNGARIA 99 99 99 98.8 98.8 99 99 99 98.5 98.5 99 99 99 99 99 99 99.2 99.5 99 ID
21 X.