PENENTUAN FASE PERTUMBUHAN DAN WAKTU PANEN
UNTUK PRODUKSI FLAVONOID TEMPUYUNG
(
Sonchus arvensis
L.)
FARDYANSJAH HASAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis berjudul Penentuan Fase Pertumbuhan dan Waktu Panen Untuk Produksi Flavonoid Tempuyung (Sonchus arvensis L.) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2017
Fardyansjah Hasan
FARDYANSJAH HASAN. Penentuan Fase Pertumbuhan dan Waktu Panen Untuk Produksi Flavonoid Tempuyung (Sonchus arvensis L.). Dibimbing oleh SANDRA ARIFIN AZIZ dan MAYA MELATI.
Tempuyung secara tradisional telah digunakan sebagai tumbuhan obat karena diketahui mengandung metabolit sekunder dengan beberapa fungsi utama yaitu sebagai antioksidan dan peluruh batu ginjal. Tujuan penelitian ini adalah untuk mempelajari produksi dan kadar flavonoid tempuyung liar pada beberapa fase pertumbuhan, kemudian menentukan waktu panen yang tepat untuk produksi biomassa dan kadar flavonoid secara organik dan konvensional serta membandingkan hasil penanaman organik dengan konvensional. Penelitian telah dilaksanakan pada bulan Mei sampai Desember 2015, penelitian pertama menggunakan sampel tempuyung liar yang ditemukan di halaman sekitar Institut Pertanian Bogor (6o33’23.0”LS dan 106o43’54.5”BT) dan penelitian kedua dilaksanakan di kebun percobaan IPB Cikarawang, Darmaga, Bogor (6o30 - 6o45’ LS dan 106o30’-106o45’ BT).
Penelitian pertama untuk mempelajari produksi dan kadar flavonoid tempuyung liar sebagai informasi awal untuk proses budidaya tempuyung. Sampel tempuyung dikelompokkan menjadi fase vegetatif (awal pemanjangan batang), kedua yaitu fase generatif awal (terbentuk kuncup bunga) dan terakhir yaitu fase generatif maksimum (setelah bunga mekar). Terdapat lima sampel tempuyung sebagai ulangan untuk setiap fase pertumbuhan. Data yang diperoleh dianalisis dengan uji t-Student dan uji korelasi Pearson. Penelitian kedua menentukan waktu panen untuk peningkatan produksi daun dan kadar flavonoid tempuyung. Penelitian terdiri atas dua percobaan terpisah yaitu organik dan konvensional yang masing-masing disusun menggunakan rancangan acak kelompok lengkap faktor tunggal yaitu waktu panen. Terdapat 4 perlakuan yang diulang sebanyak 3 kali yaitu: (1) Panen daun secara bertahap (daun bawah saat vegetatif) dan kemudian daun atas dipanen saat membentuk kuncup bunga, (2) Panen daun secara bertahap (daun bawah saat vegetatif) dan kemudian daun atas dipanen setelah bunga mekar, (3) Panen daun bawah bersamaan dengan daun atas saat membentuk kuncup bunga, (4) Panen daun bawah bersamaan dengan daun atas setelah bunga mekar. Data yang diperoleh dianalisis dengan menggunakan sidik ragam (α=5%) dan pada pengaruh yang berbeda nyata, dilakukan uji Duncan Multiple Range Test pada taraf nyata 5%. Uji t-Student (α=5%) juga dilakukan untuk membandingkan hasil percobaan organik dan konvensional.
Hasil penelitian menunjukkan (1) Pertumbuhan maksimum daun bawah tempuyung liar ditemukan pada fase vegetatif, sedangkan pertumbuhan maksimum daun atas ditemukan pada fase generatif awal. Kadar flavonoid total tempuyung liar tertinggi ditemukan pada fase generatif maksimum. (2) Panen daun bawah secara bertahap dan kemudian panen daun atas setelah bunga mekar menghasilkan biomassa daun atas tertinggi. Kadar flavonoid total tertinggi dihasilkan daun atas pada perlakuan panen daun secara bersamaan pada percobaan organik dan konvensional. (3) Tempuyung pada penanaman organik menghasilkan produksi daun yang lebih tinggi, sebaliknya produksi flavonoid total tertinggi dihasilkan penanaman konvensional dibandingkan penanaman organik.
FARDYANSJAH HASAN. Determination of Growth Stages and Harvest Time for Flavonoid Production of Perennial Sow-thistle (Sonchus arvensis L.). Supervised by SANDRA ARIFIN AZIZ and MAYA MELATI.
Sonchus arvensis L. has been traditionally used as a medicinal plant because it contains secondary metabolites with several functions as antioxidant and has been known to dissolve kidney stones. This research studied the production and flavonoid content of perennial sow-thistle as wild plants at different growth stages; to determine harvest time and flavonoids production of Perennial Sow-thistle with organic and conventional experiments; and comparing organic with conventional yield. The experiments were conducted in May 2015 until December 2015. The first experiment used wild plants of S. arvensis that were taken from open field (6o33’23.0”SL and 106o43’54.5”EL) and the second experiment was at IPB Cikarawang Farm, Darmaga, Bogor (6o30 - 6o45’ SL and 106o30’-106o45’’EL).
The first experiment aimed to study the production and flavonoid content of perennial sow-thistle growth as wild plants, as a basic information for S. arvensis
cultivation. Plant materials were harvested at three phenological stages i.e. vegetative stage (bolting phase), the second stage was early generative stage (the flower buds begin to form) and the last one was maximum generative stage (full flowering). Five plants were used as replications. The data were analyzed with Student t-testand Pearson correlation test. The second experiment was conducted to determine harvest time and flavonoids production of Perennial Sow-thistle with organic and conventional systems, then compare organic yield with conventional. This study consisted of organic and conventional experiments. This study used randomized block design single factor that is harvest time and 3 replications. There were 4 harvest time treatments i.e. (1) Leaves harvested gradually i.e. basal leaves at vegetative then stem leaves harvested at early generative stage, (2) Leaves harvested gradually i.e. basal leaves at vegetative then stem leaves harvested at maximum generative stage, (3) Basal leaves harvested together with stem leaves at early generative stage (4) Basal leaves harvested together with stem leaves at maximum generative stage. The data were analyzed using analysis of variance followed by DMRT (Duncan Multiple Range Test) at α=5%.
The results showed that (1) Maximum growth of basal leaves was found at vegetative stage, while maximum growth of stem leaves was at early generative stage. The highest flavonoid content of wild perennial sow-thistle was found at maximum generative stage. (2) Basal leaves were harvested at vegetative stage then stem leaves harvested at maximum generative stage produced the highest dry weight of stem leaves. Total flavonoids content were found highest in stem leaf when basal leaves harvested together with the stem leaves at budding and flowering time for both conventional and organic system. (3) Growth of S. arvensis with organic culture was better than that of conventional one, on the contrary total flavonoid content was higher from conventional culture.
© Hak Cipta Milik IPB, Tahun 2017
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Agronomi dan Hortikultura
PENENTUAN FASE PERTUMBUHAN DAN WAKTU PANEN
UNTUK PRODUKSI FLAVONOID TEMPUYUNG
(
Sonchus arvensis
L.)
FARDYANSJAH HASAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Puji dan syukur penulis panjatkan kehadirat Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga tesis yang berjudul “Penentuan Fase Pertumbuhan dan Waktu Panen Untuk Produksi Flvonoid Tempuyung (Sonchus arvensis L.)” berhasil diselesaikan dengan baik.
Penulis menyadari sepenuhnya bahwa penulisan tesis ini tidak mungkin diselesaikan sendiri tanpa bantuan dan dukungan dari berbagai pihak. Oleh sebab itu dengan penuh keikhlasan dan penghargaan yang tulus penulis mengucapkan terima kasih kepada:
1 Ibu Prof Dr Ir Sandra Arifin Aziz, MS selaku ketua komisi pembimbing dan Ibu Dr Ir Maya Melati MS MSc selaku anggota yang telah banyak meluangkan waktu untuk memberikan bimbingan, arahan, saran, masukkan serta nasehat kepada penulis. Selanjutnya kepada Bapak Prof Dr Ir MA Chozin, MAgr yang telah meluangkan waktu untuk menjadi penguji di luar komisi, terima kasih atas kritik, saran, masukkan yang konstruktif sehingga tesis ini menjadi lebih baik.
2 Ibu Dr Ir Maya Melati MS MSc selaku ketua program studi Agronomi dan Hortikultura yang telah memfasilitasi urusan administrasi selama pendidikan. 3 Direktorat Jenderal Pendidikan Tinggi (DIKTI) sebagai sponsor Beasiswa Pra S2
Saintek 2013 serta BPPDN 2014-2016
4 Kepada keluarga besar, Ayahanda Abdullah Hasan dan Ibunda Salma Bala SPd serta mertua Bapak Abd Imam Kasim dan Ibu Jeni Abas yang telah membantu, memotivasi dan mendoakan keberhasilan penulis selama pendidikan S2.
5 Istri tercinta, Nurfitriana SE serta anakku tercinta Kirana Kamania Azzahra Hasan atas pengertian, kesabaran, keikhlasan, pengorbanan, motivasi serta doanya selama menjalani pendidikan S2.
6 Rekan-rekan seperjuangan mahasiswa Pra S2 Saintek 2013.
7 Rekan-rekan Pascasarjana AGH 2014 (Ahmad, Bu Tatik, Fandi, Soleh, Ari, Halimah, Dwi, Rizka, Ririh, Evi, Bu Nani, Riana, Ayu, Devi, Ami, Deri, Pak Saijo, Pak Dul, Bu Lina)
8 Bapak/Ibu teknisi laboratorim AGH, Biofarmaka, teknisi lapang yang telah banyak membantu selama penelitian (Bu Ismi, Pak Joko, Mbak Ela, Mbak Hana, Pak Argani, Pak Sarta).
9 Teman-teman asrama Gorontalo Bogor terutama Rio Wando yang telah membantu penulis selama melaksanakan penelitian.
10 Serta kepada sahabat yang tak dapat disebutkan satu per satu yang telah banyak membantu penulis dalam penyelesaian tesis ini.
Semoga segala bantuan, bimbingan, nasehat dan motivasi yang telah diberikan kepada penulis senantiasa mendapat balasan yang setimpal dari Allah subhanahu wa
ta’ala.
Akhirnya, semoga penulisan tesis ini dapat memberikan manfaat kepada semua kalangan dan berguna bagi yang membutuhkan.
Bogor, Februari 2017
DAFTAR TABEL
Perbandingan Pupuk Organik dengan Anorganik
Perbandingan Produksi dan Kandungan Bioaktif Produk Organik Dibandingkan Konvensional
3 PRODUKSI DAUN DAN KADAR FLAVONOID TEMPUYUNG (Sonchus
arvensis L.) LIAR PADA FASE PERTUMBUHAN YANG BERBEDA Pendahuluan
Bahan dan Metode Hasil dan Pembahasan Simpulan
4 PENENTUAN WAKTU PANEN UNTUK PRODUKSI DAN KANDUNGAN FLAVONOID TEMPUYUNG (Sonchus arvensis L.)
1 Kriteria pengambilan sampel tempuyung liar
2 Kadar klorofil, karotenoid dan antosianin tempuyung pada beberapa fase pertumbuhan
3 Kadar flavonoid tempuyung pada beberapa fase pertumbuhan 4 Koefisien korelasi kadar bioaktif dan biomassa daun tempuyung 5 Rekapitulasi hasil uji t-Student pengamatan Mei dengan pengamatan
September
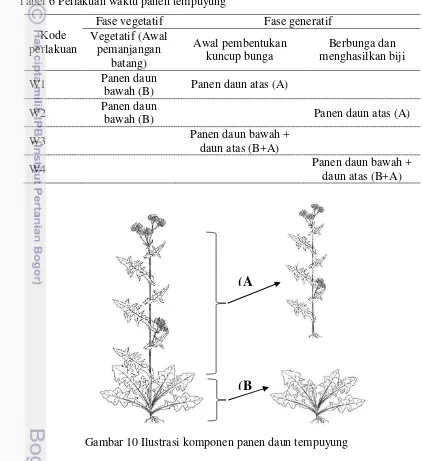
6 Perlakuan waktu panen tempuyung
7 Umur tanaman berdasarkan fase pertumbuhan 8 Kondisi iklim setiap dua minggu selama penelitian
9 Hasil analisis kimia tanah pada kedua jenis lahan percobaan 10 Rekapitulasi hasil uji t-Student peubah pertumbuhan tempuyung 11 Rekapitulasi hasil sidik ragam dan uji t-Student peubah panen secara
14 Rata-rata luas daun tempuyung pada waktu panen yang berbeda 15 Rata-rata bobot basah daun tempuyung pada waktu panen yang berbeda 16 Rata-rata bobot kering daun tempuyung pada waktu panen yang
berbeda
17 Rata-rata bobot batang, bunga dan total tanaman pada waktu panen yang berbeda
18 Rata-rata kadar klorofil total daun pada waktu panen yang berbeda 19 Hasil uji korelasi peubah produksi dan kadar bioaktif pada penanaman
organik
20 Hasil uji korelasi peubah produksi dan kadar bioaktif pada penanaman konvensional
DAFTAR GAMBAR
1 Bagan alir penelitian penentuan waktu panen dan produksi flavonoid tempuyung
2 Skema sederhana lintasan biosintesis flavonoid 3 Kondisi lokasi pengambilan sampel tempuyung liar
4 Keragaan tempuyung pada tiga fase pertumbuhan yang berbeda
5 Jumlah curah hujan (mm) dan rata- rata suhu udara (oC) di Kecamatan Darmaga
6 Rata-rata tinggi dan jumlah daun tempuyung pada fase pertumbuhan yang berbeda
7 Rata-rata luas daun terbesar tempuyung pada fase pertumbuhan yang berbeda
10 Ilustrasi komponen panen daun tempuyung
11 Kondisi tanaman tempuyung pada awal pemanjangan batang
12 Keragaan tanaman tempuyung saat membentuk kuncup dan saat mekar 13 Perbandingan keragaan tanaman tempuyung pada umur 10 MST 14 Gejala serangan cendawan puccinia dan hama gangsir
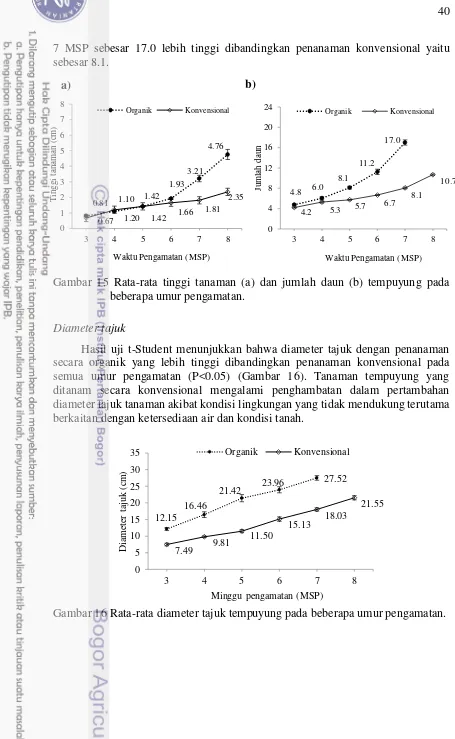
15 Tinggi tanaman dan Jumlah daun tempuyung pada beberapa umur pengamatan
16 Diameter tajuk tempuyung pada beberapa umur pengamatan
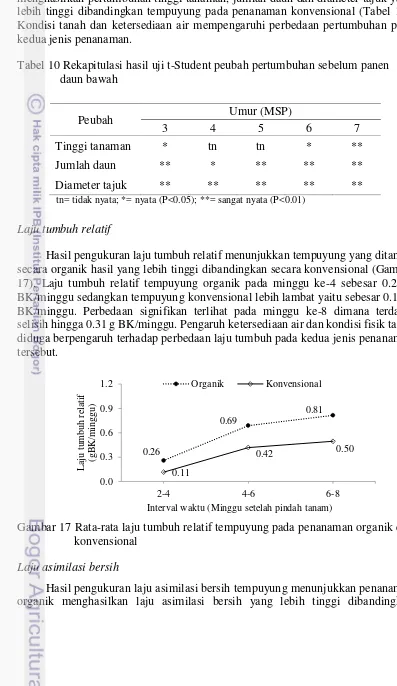
17 Laju tumbuh relatif tempuyung pada penanaman organik dan konvensional
18 Laju asimilasi bersih tempuyung pada penanaman organik dan konvensional
19 Potensi produksi daun per hektar pada waktu panen yang berbeda 20 Kadar antosianin daun pada waktu panen yang berbeda
21 Kadar hara nitrogen daun pada waktu panen yang berbeda 22 Kadar hara fosfor daun pada waktu panen yang berbeda 23 Kadar hara kalium daun pada waktu panen yang berbeda 24 Kadar flavonoid total daun pada waktu panen yang berbeda 25 Produksi flavonoid total pada waktu panen yang berbeda
26 Kadar luteolin daun tempuyung pada waktu panen yang berbeda 27 Kapasitas antioksidan daun pada waktu panen yang berbeda
28 Kondisi daun bawah pada fase generatif setelah tempuyung menghasilkan biji
29 Rata-rata jumlah daun dan bobot kering daun tempuyung liar dan budidaya
30 Rata-rata kadar flavonoid total dan bobot kering daun tempuyung liar dan budidaya
DAFTAR LAMPIRAN
1 Analisis kadar klorofil, karotenoid dan antosianin (Sims dan Gamon 2002)
2 Persiapan contoh untuk analisis kadar total flavonoid, dan kapasitas antioksidan
3 Analisis kadar flavonoid total (metode aluminium chloride colorimetric, Chang et al. (2002) dengan sedikit modifikasi)
4 Analisis kapasitas antioksidan (metode radikal bebas stabil, 1,1- diphenyl-2-picryl hydrazyl (DPPH) assay, modifikasi dari Brand-Williams et al. 1995)
Latar Belakang
Penggunaan obat tradisional di Indonesia merupakan bagian dari budaya bangsa dan banyak digunakan masyarakat sejak berabad-abad yang lalu, namun sampai saat ini masih belum dimanfaatkan dengan baik. Hal ini karena masih langkanya ketersediaan bahan dan belum berkembangnya pengetahuan tentang standar teknis budidaya untuk produksi yang optimal. Pemerintah telah menetapkan 66 jenis tanaman obat yang menjadi komoditas binaan dan salah satu dari tanaman obat tersebut adalah tempuyung (Sonchus arvensis L.) (Direktorat Jenderal Hortikultura 2012). Dalam program jangka pendek pemerintah tentang saintifikasi jamu tahun 2011, telah ditetapkan 15 jenis tanaman obat yang sangat dibutuhkan dan salah satunya adalah tempuyung (Januwati 2012).
Sonchus arvensis L. atau yang lebih dikenal dengan tempuyung adalah salah satu jenis tumbuhan obat yang telah diketahui dan digunakan masyarakat sebagai penghancur batu ginjal (Budiharto et al. 2001). Hasil penelitian Widyastuti (2010) dan Khan (2012) menunjukkan bahwa tempuyung mengandung senyawa flavonoid dan fenol yang berperan sebagai antioksidan. Mekanisme pelarutan batu ginjal diduga melalui pembentukan komplek antara 2 senyawa flavonoid daun tempuyung dengan kalsium yang menyusun batu ginjal (Katno dan Widyastuti 2004; Hidayati
et al. 2009). Tempuyung juga diketahui dan telah digunakan sebagai bahan obat tradisional untuk pengobatan kanker, asma, batuk, dan untuk menenangkan saraf (Xia dan Liang 2010). Hasil uji toksisitas juga menjelaskan bahwa sediaan bahan simplisia daun tempuyung aman dikonsumsi manusia (Budiharto et al. 2001). Ekstrak daun tempuyung dapat digunakan sebagai sumber antioksidan yang efektif, aman dan secara komersial dapat dikembangkan sebagai obat (Khan 2012).
Tempuyung umumnya ditemukan sebagai gulma, meskipun demikian beberapa hasil penelitian menunjukkan bahwa tempuyung dapat ditanam dan berpotensi untuk dikembangkan. Pertumbuhan dan hasil tempuyung dapat ditingkatkan dengan menambahkan pupuk organik serta pupuk N dan K di lahan marjinal (Surat et al. 2008), pemupukan NPK (Nurhayati et al. 2013) atau pemberian pupuk kandang kambing (Wardani dan Melati 2014) dan pupuk kandang sapi serta arang sekam (Gatari dan Melati 2014).
dibutuhkan untuk mendapatkan biomassa dan kadar flavonoid daun bawah maksimum yang tumbuh di permukaan tanah (roset) dan daun atas yang tumbuh pada batang. Hal tersebut dibutuhkan dalam rangka mendukung pengadaan bahan baku dalam pengembangan industri tanaman obat melalui penerapan teknologi budidaya tempuyung yang baik dan benar (Good Agricultural Practices) dan sebagai tambahan informasi untuk mempersiapkan Standard Operating Procedure
(SOP) budidaya tempuyung.
Budidaya secara organik menitikberatkan pada penggunaan bahan-bahan alami misalnya pupuk kandang untuk mendukung pertumbuhan tanaman sebaliknya budidaya konvensional identik dengan penggunaan bahan-bahan kimia berupa pupuk anorganik dan penggunaan pestisida kimia sintetis untuk meningkatkan pertumbuhan dan hasil tanaman. Penggunaan pupuk organik maupun anorganik mempunyai efektivitas yang berbeda dalam mendukung pertumbuhan tanaman. Pupuk organik diketahui dapat meningkatkan bahan organik tanah, mengurangi erosi, meningkatkan infiltrasi dan aerasi serta meningkatkan aktivitas biologis tanah yang berperan dalam mendukung pertumbuhan tanaman. Pupuk organik membutuhkan proses dekomposisi agar tersedia bagi tanaman sehingga lambat tersedia bagi tanaman. Pupuk anorganik berperan dalam menyediakan nutrisi yang dapat langsung diserap tanaman dan dapat diaplikasikan pada beberapa tahapan pertumbuhan sehingga mampu memberikan suplai nutrisi yang cukup dan cepat selama pertumbuhan tanaman (Jones 2012). Selain itu terdapat respon yang berbeda akibat pemupukan organik dan anorganik. Hasil penelitian Ibrahim et al. (2013) pada tanaman kacip fatimah menunjukkan bahwa pemupukan organik dapat meningkatkan kandungan fenolik, flavonoid dan kandungan gula terlarut total dibandingkan dengan pemupukan anorganik.
Perumusan Masalah
Fungsi tempuyung (Sonchus arvensis L.) sebagai bahan obat herbal telah banyak diketahui dan telah ditemukan kandungan fitokimia yang terkandung didalamnya. Produk daun tempuyung telah dipasarkan dan umumnya berasal dari industri rumah tangga dan sebagian produk industri terstandar. Bahan baku daun yang diperoleh umumnya didapatkan dari tempuyung yang tumbuh liar sehingga produksi yang dihasilkan masih belum optimal.
atas yang tumbuh pada batang. Lemna dan Messersmith (1990) menjelaskan bahwa saat tempuyung memasuki fase generatif, daun tua yang tumbuh di atas permukaan tanah mengalami senesen. Hal ini sangat penting diketahui karena fase pertumbuhan juga mempengaruhi kandungan bioaktif tempuyung. Mawalagedera (2014) melaporkan bahwa kadar fenolik, asam sinamat dan aktivitas antioksidan berubah seiring perkembangan umur tanaman Sonchus oleraceus. Oleh sebab itu dibutuhkan pengetahuan yang jelas mengenai fase pertumbuhan maupun waktu panen yang tepat untuk mendapatkan produksi biomassa maupun kadar flavonoid tempuyung yang optimal. Penelitian yang dilakukan diharapkan mampu meningkatkan produksi daun dan kandungan flavonoid melalui pemanenan daun pada waktu yang tepat.
Tujuan
Penelitian bertujuan untuk :
1. Mempelajari produksi dan kadar flavonoid tempuyung liar pada beberapa fase pertumbuhan.
2. Menentukan waktu panen yang tepat untuk produksi biomassa dan kadar flavonoid secara organik dan konvensional.
3. Membandingkan produksi biomassa dan kadar flavonoid tempuyung yang ditanam secara organik dan konvensional.
Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah:
1. Terdapat perbedaan produksi daun dan kadar flavonoid tempuyung liar pada fase pertumbuhan yang berbeda.
2. Waktu panen daun yang berbeda akan menyebabkan perbedaan produksi biomassa dan kadar flavonoid tempuyung.
3. Terdapat perbedaan produksi biomassa dan kadar flavonoid tempuyung yang ditanam secara organik dengan penanaman secara konvensional.
Ruang Lingkup Penelitian
Gambar 1 Bagan alir penelitian penentuan fase pertumbuhan dan waktu panen tempuyung
Tempuyung (Sonchus arvensis L.)
Percobaan I Tempuyung liar
Percobaan II Budidaya tempuyung organik dan konvensional
Identifikasi pola pertumbuhan dan produksi tempuyung
Penentuan waktu panen untuk produksi dan kadar flavonoid tempuyung
Output
Informasi produksi dan kadar flavonoid daun pada fase pertumbuhan yang berbeda
Output
Rekomendasi waktu panen untuk produksi dan kadar flavonoid
Peranan waktu panen untuk produksi flavonoid tempuyung
Pengambilan sampel tumbuhan pada 3 fase pertumbuhan :
1) Fase vegetatif sebelum pemanjangan batang. 2) Fase generatif saat kuncup
bunga.
3) Fase generatif maksimum setelah berbunga.
1) W1: Panen daun bawah saat vegetatif + panen daun atas saat kuncup bunga 2) W2 : Panen daun bawah saat vegetatif +
panen daun atas setelah berbunga dan menghasilkan biji
3) W3 : Panen daun bawah dan atas bersamaan saat kuncup bunga
2 TINJAUAN PUSTAKA
Taksonomi dan Botani Tempuyung
Tempuyung adalah tumbuhan yang umumnya tersebar di hampir seluruh daerah beriklim sedang (temperate) dan diduga berasal dari Eropa dan kemudian menyebar ke daerah-daerah baru seperti bagian barat Asia. Tempuyung termasuk tipe tanaman C3 dan beradaptasi pada berbagai jenis tanah tetapi umumnya tumbuh pada tanah dengan pH netral atau sedikit basa dan tidak dapat tumbuh pada tanah dengan kemasaman tinggi (Lemna dan Messersmith 1990). Daerah penyebaran tempuyung di Indonesia yaitu di pulau Sumatra dan Jawa (Holm et al. 1997).
Tempuyung (Sonchus avensis L.) diklasifikasikan sebagai berikut: Divisi : Spermatophyta,
Sub divisi : Magnoliophyta (Angiospermae) Kelas : Magnoliopsida (Dicotyledonae) Bangsa : Asterales
Suku : Asteraceae
Marga : Sonchus
Jenis : Sonchusavensis L.
(Integrated Taxonomic Information System 2010).
Tempuyung termasuk jenis herba menahun, tumbuh tegak dengan tinggi 0,6 m hingga 2 m, mengandung getah putih, dengan akar tunggang yang kuat. Batang berongga dan berusuk. Daun tunggal, bagian bawah tumbuh berkumpul pada pangkal membentuk roset akar. Helai daun berbentuk lanset atau lonjong, ujung runcing, pangkal bentuk jantung, tepi berbagi menyirip tidak teratur, panjang 6-48 cm, lebar 3-12 cm, warnanya hijau muda. Daun yang keluar dari tangkai bunga bentuknya lebih kecil dengan pangkal memeluk batang, letak berjauhan, berseling. Perbungaan berbentuk bonggol yang tergabung dalam malai, bertangkai, mahkota bentuk jarum, warnanya kuning cerah, lama kelamaan menjadi merah kecokelatan. Buah kotak, berusuk lima, bentuknya memanjang sekitar 4 mm, pipih, berambut, cokelat kekuningan (Reaume 2010).
Fitokimia Tempuyung
kuersetin, katekin, rutin, mierisitin dan kaemferol menunjukkan hasil masing- masing sebesar 0.871, 0.455, 0.780, 0.565, 0.457, 0.647, 0.947 µg.mg-1 berat kering. Penetapan tempuyung sebagai bahan obat telah dilakukan dan menjadikan luteolin sebagai senyawa identitas tempuyung dengan kadar 0.06% (Depkes RI, 2008).
Flavonoid
Flavonoid merupakan bentuk besar dari produk alami dan banyak ditemukan di jaringan tanaman, terutama di dalam sel atau pada permukaan organ tumbuhan (Stobiecki dan Kachlicki 2006). Flavonoid merupakan salah satu kelas dari polifenol yang terdiri dari beberapa sub kelas seperti flavone, flavonol, flavanonol, flavanon, flavan dan anthocyanin (Gambar 2). Kerangka dasar karbon pada flavonoid merupakan kombinasi antara jalur sikhimat dan jalur asetat-malonat yang merupakan dua jalur utama biosintesis cincin aromatik. Cincin A dari struktur flavonoid berasal dari jalur poliketida (jalur asetat-malonat), yaitu kondensasi tiga unit asetat atau malonat, sedangkan cincin B dan tiga atom karbon dari rantai propan berasal dari jalur fenilpropanoid (Shirley 2001). Keberadaannya dalam daun kemungkinan dipengaruhi oleh adanya proses fotosintesis sehingga daun muda belum terlalu banyak mengandung flavonoid (Markham 1988).
Menurut Peterson dan Dwyer (2000), antosianin adalah flavonoid bermuatan yang biasanya berikatan dengan gula. Antosianin bertanggung jawab atas sebagian besar adanya warna merah, biru dan ungu pada buah-buahan dan sayur-sayuran. Flavone umumnya ditemukan pada daun, sedangkan isoflavon seringkali ditemukan pada kacang-kacangan (legume) terutama kacang kedelai. Isoflavon berbeda dengan flavon hanya pada penempatan cincin benzene. Isoflavon umumnya dikenal karena aktivitas estrogeniknya. Seperti halnya flavanon, flavonol umumnya juga mengandung gula. Flavonoid yang paling mudah ditemukan (ubiquitious) dalam makanan adalah quersetin yang termasuk dalam kelas flavonol. Flavan adalah flavonoid yang mempunyai struktur kimia paling kompleks. Beberapa flavonoid yang termasuk dalam kelas flavan adalah katekin, procyanidin, theaflavin.
Gambar 2 Skema sederhana lintasan biosintesis flavonoid. Modifikasi dari Shirley (2001), Lakhanpal dan Rai (2007) dan Mohammed (2009)
Chalcone
Dihidroflavonol
L-sianidin
Klas Flavanol : Katekin, Epikatekin
Klas Antosianidin : Delpenidin, Sianidin
Klas Flavanon : Naringenin, Delpinidin Klas Flavon :
Apigenin, Luteolin
Klas Flavonol : Kuersetin, kaemferol,
myrisetin
Klas Flavan-4-ol : Taxifolin
Klas Isoflavon : Genistein, Daidzein
Isoflavanon Flavonoid
Karbohidrat Glikolisis Asam piruvat
Lintasan Asam Shikimat Eritrosa 4-fosfat
Malonil Koenzim A +
Lintasan Asam Malonat Asetil Koenzim A
Lintasan Fenilpropanoid
Fenilalanin 4- koumaril
Koenzim A Asam sinamat
Flavonoid merupakan senyawa pereduksi yang baik, menghambat banyak reaksi oksidasi, baik secara enzimatis maupun non enzimatis. Flavonoid bertindak sebagai penampung radikal hidroksi dan superoksida yang baik dengan demikian dapat melindungi lipid membran terhadap reaksi yang merusak. Aktivitas antioksidannya dapat menjelaskan alasan flavonoid tertentu dapat menjadi komponen aktif tumbuhan yang digunakan secara tradisional untuk mengobati gangguan fungsi hati (Robinson 1995). Flavonoid dikenal sebagai antioksidan dan memberikan daya tarik sejumlah peneliti untuk meneliti flavonoid sebagai obat yang berpotensi mengobati penyakit yang disebabkan oleh radikal bebas.
Waktu Panen
Tahapan pemanenan merupakan salah satu faktor yang sangat penting diperhatikan pada budidaya tanaman obat. Penanganan panen harus dilakukan secara benar karena akan berpengaruh terhadap mutu dan fitokimia yang terkandung di dalam tanaman obat. Periode panen merupakan waktu yang diperlukan untuk memanen hasil tanaman terhitung mulai dari tanaman tersebut ditanam. Waktu panen tanaman obat tidak seluruhnya tergantung pada umur tanaman, tetapi didasarkan pada pemanfaatannya (Syukur dan Hernani 2002).
Tempuyung merupakan jenis herba tahunan. Awal pertumbuhan vegetatif tempuyung dengan membentuk roset yaitu susunan daun yang melingkar dan tumbuh dekat permukaan tanah karena batang yang tumbuh pendek. Bentuk roset dapat membantu dalam menyediakan permukaan yang luas bagi tempuyung untuk melakukan fotosintesis (Lemna dan Messersmith 1990). Pertumbuhan daun roset tempuyung berkisar 12-14 helai, setelah itu akan muncul batang diikuti munculnya bunga (Mc Williams, 2004) selanjutnya pada pemanjangan akan muncul daun muda di sekitar batang (Wardani dan Melati 2014). Proses perkembangan tempuyung saat memasuki fase generatif diikuti dengan hilangya daun roset yang berada di atas permukaan tanah (Reaume, 2010). Lemna dan Messersmith (1990) menjelaskan bahwa kehilangan bobot pada struktur daun bagian bawah tempuyung berkaitan erat dengan alokasi cadangan ke bagian atas yang lebih muda kemudian berkaitan dengan peningkatan respirasi akar tua dan perkembangan akar. Perbedaan waktu optimum perkembangan daun bawah (roset) dan daun atas (batang) menjadi permasalahan khusus dalam penanganan dan penentuan waktu panen tempuyung.
Telah banyak dilaporkan berbagai hasil penelitian tentang perlakuan panen terhadap produksi tanaman. Hasil penelitian Li dan Strid (2005) menunjukkan bahwa pemanenan dengan cara pemangkasan pucuk pada tanaman Arabidopsis thaliana dapat meningkatkan kandungan antosianin. Antosianin meningkat secara linear antara 2-8 hari setelah pemangkasan yang menyebabkan tanaman berubah menjadi ungu. Hal ini diduga karena pemangkasan dapat menginduksi ekspresi gen
diperpanjang dari 8 minggu menjadi 16 minggu. Interval waktu panen yang berbeda mampu memberikan perbedaan produksi biomassa dan kandungan bioaktif daun. Hasil penelitian Moraes et al. (2013) pada tanaman Stevia rebaudiana
menunjukkan bahwa pemanenan daun dengan perlakuan interval waktu 3 kali dalam satu musim mampu meningkatkan produksi biomassa daun dan kandungan stevioside dibandingkan dengan panen sekali di akhir musim tanam.
Hasil penelitian terbaru Mawalagedera (2014) pada tanaman Sonchus oleraceus tentang pengaruh umur panen dan ekotipe tanaman terhadap kandungan fenol dan aktivitas antioksidan menunjukkan bahwa umur panen menunjukkan pengaruh yang signifikan terhadap perubahan kandungan fenol dan akitivitas antioksidan dibandingkan perbedaan ekotipe tanaman. Tanaman Sonchus oleraceus
yang dipanen pada umur 14 minggu (fase generatif) lebih tinggi kandungan total fenol dan aktivitas antioksidan dibandingkan tanaman yang dipanen umur 10 minggu (fase vegetatif).
Perbandingan Pupuk Organik dengan Anorganik
Pengertian pupuk
Pupuk adalah berbagai bahan, organik atau anorganik, alami atau sintetis, yang memasok nutrisi bagi tanaman yang dibutuhkan untuk pertumbuhan tanaman dan hasil yang optimal (Jones 2012). Pemerintah melalui peraturan No. 8 tahun 2001 juga mendefinisikan pupuk sebagai bahan kimia atau organisme yang berperan dalam penyediaan unsur hara bagi keperluan tanaman secara langsung atau tidak langsung (Kemenkumham 2014).
Pengertian pupuk organik
Selanjutnya Peraturan Menteri Pertanian No. 02/Pert/HK.060/2/2006 menjelaskan bahwa pupuk organik adalah pupuk yang sebagian besar atau seluruhnya terdiri atas bahan organik yang berasal dari tanaman dan atau hewan yang telah melalui proses rekayasa, dapat berbentuk padat atau cair yang digunakan menyuplai bahan organik untuk memperbaiki sifat fisik, kimia, dan biologi tanah (Kementan RI 2011).
Pupuk organik yang umumnya digunakan yaitu berasal dari kotoran hewan ternak. Manfaat dari penggunaan pupuk kandang telah lama diketahui bagi pertumbuhan tanaman pangan, ornamental, maupun perkebunan. Perhatian khusus dalam pemanfaatan pupuk kandang adalah kadar haranya yang sangat bervariasi. Komposisi hara ini sangat dipengaruhi oleh beberapa faktor seperti jenis dan umur hewan, jenis makanannya, alas kandang, dan penyimpanan serta pengolahan. Kandungan hara dalam pupuk kandang sangat menentukan kualitas dari pupuk kandang tersebut.
Pengertian pupuk anorganik
dari satu unsur (NPK, NK, NP), harus mengandung unsur minimal 10% berupa N, P2O5, maupun K2O untuk masing-masing unsur (Firmansyah 2011).
Jones (2012) menjelaskan bahwa pupuk anorganik bervariasi dalam penampilan tergantung pada proses pembuatan. Partikel dapat dari berbagai ukuran dan bentuk (kristal, pelet, butiran, atau debu) dan nilai pupuk dapat mencakup pupuk tunggal (hanya mengandung satu unsur hara), pupuk majemuk (mengandung dua atau lebih unsur hara dan umumnya digabungkan dalam campuran homogen oleh interaksi kimia) dan campuran pupuk yaitu pencampuran pupuk mineral secara fisik untuk mendapatkan rasio nutrisi yang diinginkan.
Perbandingan pupuk organik dengan anorganik
Perbedaan dasar pupuk organik dengan anorganik yaitu kandungan karbon atau lebih spesifik pada ikatan karbon-hidrogen yang lebih tinggi pada pupuk organik. Selanjutnya dijelaskan bahwa ikatan karbon-hidrogen yang tinggi menyebabkan pelepasan ion nutrisi pupuk organik lambat dan menekan terjadinya pencucian dibandingkan pupuk anorganik yang pelepasan nutrisi yang cepat dan mudah terjadi pencucian (Jones 2012).
Penggunaan pupuk organik secara berkesinambungan akan meningkatkan kualitas dan efektivitas bahan organik tanah, mengurangi erosi, meningkatkan infiltrasi dan aerasi, aktivitas biologis tanah yang lebih tinggi sebagai bahan terurai dalam tanah, dan peningkatan hasil setelah beberapa tahun aplikasi (efek residual). Sedangkan penggunaan pupuk anorganik di sisi lain dapat segera memasok nutrisi yang dibutuhkan oleh tanaman. Pemupukan dasar dapat menyediakan unsur hara untuk pertumbuhan dan perkembangan awal tanaman dan pemupukan lanjutan dapat dilakukan dengan membagi dosis pupuk berdasarkan tahapan pertumbuhan dan apabila terdapat gejala defisiensi (Jones 2012).
Terdapat faktor yang membatasi ketersediaan pupuk organik dan anorganik Pupuk organik
a) Umumnya dibutuhkan dalam jumlah yang banyak untuk mendapatkan hasil yang diinnginkan.
b) Investasi tambahan tenaga kerja panen (pupuk hijau) dan persiapan (kotoran ternak)
c) Ketersediaan bahan yang tidak stabil.
d) Tidak tersedianya benih untuk pupuk hijau adalah salah satu keterbatasan utama.
Pupuk anorganik
a) Membutuhkan kemampuan finansial yang tinggi
b) Ketersediaan juga menjadi kendala, terutama di daerah terpencil. c) Penerapan dilakukan secara musiman
d) Berisiko tinggi pada curah hujan rendah dan resiko yang lebih tinggi pada daerah curah hujan tinggi
Untuk mendapatkan pertumbuhan dan hasil yang optimum, nutrisi harus tersedia dalam jumlah yang tepat, proporsional dan dalam bentuk yang dapat digunakan pada saat yang tepat dan untuk memenuhi persyaratan tersebut maka dibutuhkan peran pupuk kimia (anorganik) maupun pupuk kandang (Ibrahim et al.
Perbandingan Produksi dan Kandungan Bioaktif Produk Organik Dibandingkan Konvensional
Perbandingan produksi dan kandungan nutrisi antara produk tanaman organik dengan konvensional telah banyak dilaporkan sejak awal tahun 1980 hingga 2007 dengan hasil yang beragam (Benbrook et al. 2008). Awalnya pola produksi pertanian difokuskan pada kuantitas produksi tanaman untuk pasar komersil. Oleh karena itu, pupuk anorganik umumnya digunakan sebagai praktik pertanian untuk meningkatkan produksi. Namun saat ini kesadaran konsumen terhadap kesehatan semakin meningkat terutama dengan mengoptimalkan komposisi gizi dengan meminimalkan residu kimia bahan pangan sehingga diperlukan praktek budidaya tanaman yang ramah lingkungan (Ibrahim et al. 2013).
Seufert et al. (2012) menjelaskan bahwa produktivitas pertanian organik di negara bekembang dan negara maju rata-rata 25% lebih rendah daripada pertanian konvensional. Selanjutnya untuk jenis buah-buahan (contoh: stroberi dan apel), rata-rata produktivitas buah organik adalah 3% lebih rendah daripada buah-buahan hasil perkebunan konvensional. Sayur-sayuran lebih tinggi perbedaan produktivitasnya yaitu 33%. Penelitian lain dilakukan oleh Sukristiyonubowo et al.
(2011) di tiga kecamatan di Kabupaten Sragen, Jawa Tengah pada periode tahun 2001-2008. Ketiga kecamatan tersebut menerapkan tiga sistem bertani padi yang berbeda: Anorganik, semi organik dan organik. Peneliti menyimpulkan bahwa pada tahap awal produktivitas sawah yang menerapkan sistem pertanian organik dan semi organik lebih rendah dibandingkan produktivitas sawah anorganik; sawah organik dan semi organik menghasilkan 1-2 ton.ha-1 untuk setiap musim tanam, sedangkan sawah anorganik mampu menghasilkan 6 ton.ha-1 untuk setiap musim tanam. Tetapi dalam beberapa periode selanjutnya, produktivitas sawah anorganik cenderung konstan, sebaliknya sawah organik dan semi organik terus meningkat dan di tahun 2008 produktivitas dari kedua sistem tersebut mampu bersaing dengan produktivitas pertanian padi anorganik.
Hasil studi komparatif untuk membandingkan 4 jenis tanaman obat yang dibudidayakan secara organik dengan inorganik (konvensional) menunjukkan bahwa tanaman yang dibudidaya secara organik menghasilkan lebih banyak komponen yang bermanfaat bagi kesehatan diantaranya adalah magnesium dan kalsium (Kumari et al. 2012). Selanjutnya Hakkinen dan Torronen (2001) melaporkan bahwa kultivar stroberi yang tumbuh pada kondisi organik menunjukkan kandungan fenol yang lebih tinggi dibandingkan kultivar yang tumbuh secara anorganik.
3 PRODUKSI DAUN DAN KADAR FLAVONOID TEMPUYUNG
(Sonchus arvensis L.) LIAR PADA FASE PERTUMBUHAN YANG BERBEDA
ABSTRAK
Tempuyung (Sonchus arvensis L.) merupakan salah satu jenis tumbuhan obat Indonesia yang umumnya digunakan sebagai peluruh kencing (diuretik), penghancur batu (litotripik) dan menghambat kristalisasi urin (antiurolotiasis). Penelitian ini mempelajari produksi dan kandungan flavonoid tempuyung liar sebagai informasi awal untuk proses budidaya tempuyung. Pengamatan di lapangan dilakukan terhadap karakter morfologi tempuyung kemudian dilakukan pengambilan sampel untuk diukur biomassa dan kandungan flavonoid. Penelitian dan pengambilan sampel telah dilaksanakan pada dua waktu yang berbeda yaitu pada bulan Mei 2015 dan September 2015. Sampel tempuyung liar diambil dari halaman sekitar Institut Pertanian Bogor (6o33’23.0”LS 106o43’54.5”BT), Darmaga, Bogor, Indonesia. Sampel tempuyung dikelompokkan dalam tiga fase pertumbuhan yaitu fase vegetatif (awal pemanjangan batang), kedua yaitu fase generatif awal (terbentuk kuncup bunga) dan terakhir yaitu fase generatif maksimum (setelah bunga mekar). Setiap fase pertumbuhan diwakili oleh lima tumbuhan sebagai ulangan. Data yang diperoleh dianalisis untuk membandingkan hasil antar fase pertumbuhan kemudian dilanjutkan dengan uji korelasi Pearson untuk melihat hubungan antar peubah pengamatan. Hasil penelitian menunjukkan bahwa pertumbuhan maksimum daun bawah tempuyung ditemukan pada fase vegetatif, sedangkan pertumbuhan maksimum daun atas ditemukan pada fase generatif awal. Kadar flavonoid total tertinggi ditemukan pada fase generatif maksimum.
Kata kunci: karakter morfologi, kuersetin, luas daun, luteolin
LEAF PRODUCTION AND FLAVONOID CONTENT OF PERENNIAL
SOW-THISTLE (Sonchusarvensis L.) AT DIFFERENT GROWTH
STAGES
ABSTRACT
were analyzed to compare the results between the phases of growth followed by the Pearson correlation tests to determine the relationship between variables. The results showed that maximum growth of basal leaves was found at vegetative stage, while maximum growth of stem leaves was at early generative stage. The highest flavonoid content of wild perennial sow-thistle was found at maximum generative stage.
Keyword: leaf area, luteolin, morphological character, quercetin
Pendahuluan
Tempuyung (Sonchus arvensis L.) merupakan salah satu tumbuhan obat yang biasa digunakan untuk mengatasi diuretik, lithotripik dan antiurolitik. Sonchus arvensis juga mempunyai peran dalam kesehatan manusia melalui proses detoksifikasi dan melancarkan sirkulasi darah manusia (Khan 2012), memiliki nilai yang tinggi, bergizi dan telah digunakan untuk pengobatan asma, batuk, untuk menenangkan saraf, memiliki sifat insektisida dan aktivitas anti-inflamasi (Xia dan Liang 2010). Ekstrak daun S.arvensis mengandung senyawa flavonoid dan fenolik yang dapat digunakan sebagai sumber antioksidan yang efektif, aman dan dapat secara komersial dapat dikembangkan sebagai obat (Khan 2012).
Tempuyung adalah tumbuhan asli Eurasia dan kemudian tersebar luas ke area baru termasuk di Asia bagian barat (Lemna dan Messersmith 1990). Tempuyung belum banyak dibudidayakan, tumbuh liar di daerah pada ketinggian 50-1650 m di atas permukaan laut (dpl), di tempat terbuka, atau sedikit ternaungi, dan di pematang. Tumbuhan ini banyak ditemukan di daerah dibudidayakan, selokan, padang rumput, daerah sampah, padang rumput, pinggir jalan, pantai, di sepanjang sungai, dan tepi danau (McWilliams 2004). Tempuyung merupakan salah satu jenis gulma penting karena adanya keunikan dalam reproduksi vegetatif. Tempuyung dapat bereproduksi dengan cepat melalui melalui akar (rizome) dan juga biji. Tempuyung termasuk tipe tumbuhan C3 dan mampu beradaptasi pada berbagai jenis tanah. Tempuyung mampu beradaptasi dengan berbagai jenis tanah dan umumnya ditemukan pada tanah dengan struktur lempung dan sulit berkembang pada daerah kering bertekstur pasir (Lemna dan Messersmith 1990).
Hakansson dan Walgren (1972) menjelaskan bahwa pada awal fase vegetatif, daun tumbuh melingkar di atas permukaan tanah (roset) yang memungkinkan peningkatan area fotosintesis tempuyung. Selanjutnya dijelaskan bahwa tempuyung akan mudah berbunga dan menghasilkan biji pada kondisi lingkungan yang menguntungkan dimana cahaya, nutrisi serta ketersediaan air tercukupi. Vanhala et al. (2006) menjelaskan akar tempuyung mulai menebal saat terbentuk 5-7 daun dan pada saat ini tanaman ini dianggap telah mencapai titik kompensasi yaitu tingkat minimum perakaran.
dan benar dalam rangka mendukung pengadaan bahan baku dalam pengembangan industri tanaman obat yang sesuai dengan Standard Operating Procedure (SOP).
Penelitian ini bertujuan untuk mempelajari pola pertumbuhan daun tempuyung dan mengevaluasi serta membandingkan produksi dan kandungan flavonoid daun tempuyung pada beberapa fase pertumbuhan. Hasil ini diharapkan memberikan informasi mengenai potensi produksi tempuyung dan kandungan kandungan bioaktif sebagai dasar dalam budidaya tempuyung.
Bahan dan Metode
Waktu dan Tempat
Penelitian telah dilaksanakan pada bulan Mei sampai September 2015. Pengamatan dilakukan pada dua waktu yang berbeda untuk mengetahui perbedaan pertumbuhan dan biomassa tempuyung. Pengamatan pertama dilakukan pada tanggal 15 Mei 2015 dan kedua pada tanggal 09 September 2015. Sampel tempuyung liar diambil di halaman sekitar Institut Pertanian Bogor (IPB). Analisis komponen pertumbuhan dan kadar pigmen dilakukan di laboratorium pasca panen Departemen Agronomi dan Hortikultura Fakultas Pertanian IPB. Uji kandungan fitokimia dilaksanakan di Laboratorium Pusat Studi Biofarmaka Tropika, IPB.
Bahan dan Alat
Bahan-bahan yang diperlukan pada percobaan ini antara lain sampel tempuyung liar, selanjutnya standar kuersetin dan luteolin (Sigma-Aldrich;St. Louis, MO), Metanol, Etanol, AlCl3, TBHQ, HCl, KH2PO4, potasium asetat, akuabidest, asetonitrile, aseton, tris-HCL, microtube, kertas saring Whatman no.2, saring Whatman 0.45 µm. Alat yang digunakan adalah penggaris, printer canon MP 230, timbangan merk Kern ALJ220-4, tabung reaksi, gelas ukur, erlenmeyer, micro pipet, oven Sanyo, Centrifuge heraeus labofuge-400R, saring vakum, vortex, UV1800 spectrophotometer UV-Vis Shimadzu yang dihubungkan dengan UV probe 2.34 untuk analisis spektrofotometri, High Performance Liquid Chromatography (HPLC) Hitachi LaChrom Elite L-200 series dengan kolom Zorbax SB C-18 (Japan).
Metode Penelitian
Metode yang digunakan yaitu pengamatan langsung dan mengumpulkan data primer mengenai karakter morfologi dan analisis kadar flavonoid tempuyung liar. Pengamatan dilakukan terhadap 3 fase pertumbuhan yang berbeda (Tabel 1).
Setiap fase pertumbuhan terdiri atas 5 sampel sebagai ulangan, sehingga terdapat 15 sampel tempuyung dalam satu waktu pengamatan. Jumlah total tempuyung yang dibutuhkan untuk dua waktu pengamatan yaitu 30 sampel.
No Fase Tumbuh Deskripsi
1 Fase Vegetatif
Fase vegetatif saat daun tumbuh roset diatas permukaan tanah sebelum pemanjangan batang
2 Fase Kuncup Awal fase generatif yaitu saat
pembentukan kuncup bunga.
3 Fase Generatif Lanjut Fase generatif setelah bunga mekar
Pelaksanaan Penelitian
Persiapan
Observasi awal dilakukan untuk menentukan 5 sampel tempuyung setiap fase pertumbuhan. Lokasi pengambilan sampel secara umum berbentuk persegi panjang sehingga pengambilan sampel dari setiap sudut dan satu di bagian tengah untuk mewakili kondisi umum pada lokasi penelitian. Selanjutnya dipilih sampel tempuyung yang tumbuh di atas permukaan tanah.
Pengambilan sampel
Sampel tempuyung yang terpilih kemudian diamati tinggi dan jumlah daun. Selanjutnya pengamatan destruktif dengan cara memotong pangkal batang di atas permukaan tanah. Seluruh sampel selanjutnya dibawa ke laboratorium untuk dipisahkan masing-masing bagian (daun, batang, bunga). Daun tempuyung pada fase generatif awal dipisahkan antara daun bagian bawah dengan daun atas yang ada pada batang. Selanjutnya diukur bobot basah, kering serta kandungan pigmen dan flavonoid.
Pengamatan
Variabel pengamatan sebagai berikut:
1. Tinggi (cm): Pengukuran tinggi tempuyung dilakukan dengan cara mengukur dari pangkal batang (di atas permukaan tanah) hingga titik tumbuh.
2. Jumlah daun: Dihitung seluruh daun yang telah membuka sempurna.
3. Bobot basah dan bobot kering daun. Pengukuran bobot basah dilakukan sesuai dengan fase pertumbuhan dengan cara menimbang hasil pangkasan daun segar yang dihasilkan setiap individu sampel. Bobot kering daun diukur setelah dioven pada suhu 50o C selama 3 x 24 jam.
4. Luas daun terbesar diukur dengan aplikasi blackspot 1.0 (Varma dan Osuri 2013).
5. Analisis pigmen klorofil, karotenoid dan antosianin dilakukan dengan mengambil sampel daun segar yaitu daun dengan ukuran terbesar. Analisis dilakukan berdasarkan metode Sims dan Gamon (2002) dengan sedikit modifikasi (lampiran 1).
7. Analisis kadar luteolin dan kuersetin menggunakan sampel kering daun tempuyung. Analisis dilakukan berdasarkan metode Hertog et al. (1992) (Lampiran 5).
8. Dilakukan perhitungan produksi flavonoid total tempuyung dengan rumus: Produksi flavonoid total = bobot kering (g/tan) x kadar flavonoid total (mg.g-1)
Analisis Data
Data hasil pengamatan dianalisis nilai rata-rata dan standar error masing-masing fase pertumbuhan dan waktu pengamatan. Selanjutnya dilakukan uji korelasi Pearson untuk mengetahui hubungan antar peubah menggunakan aplikasi SAS 9.2.
Hasil dan Pembahasan
Kondisi Umum
Deskripsi lokasi pengambilan sampel
Lokasi pengambilan sampel tempuyung berada di ruang terbuka sekitar Institut Pertanian Bogor, Darmaga (6o33’23.0”LS dan 106o43’54.5”BT). Tempuyung tumbuh dan berkembang pada kondisi cahaya penuh terutama pada pagi dan siang hari. Habitat tumbuh tempuyung secara umum berada di tepi saluran air dan di pinggir tembok bangunan (Gambar 3). Penyebaran populasi tempuyung pada lokasi pengamatan tidak merata dan cenderung mengelompok terutama di bagian tepi dekat tembok bangunan. Hasil pengamatan secara visual kondisi tanah menunjukkan dominasi liat pada tekstur tanah, kemudian banyak campuran batu kerikil maupun sisa bahan bangunan. Tempuyung cukup mendominasi penguasaan ruang tumbuh di sekitar lokasi pengambilan sampel. Selain tempuyung terdapat beberapa jenis gulma rumput seperti Axonopus compressus, Imperata cylindrica.
Pola pertumbuhan tempuyung
Pengamatan terhadap pola pertumbuhan tempuyung dilakukan pada tiga fase pertumbuhan yang berbeda yaitu; 1: Fase vegetatif saat daun tumbuh roset sebelum pemanjangan batang; 2: Fase generatif awal yaitu saat pembentukan kuncup bunga; 3 : Fase generatif maksimum yaitu setelah bunga mekar dan membentuk biji. Hasil pengamatan terhadap tiga fase pertumbuhan tempuyung menunjukkan bahwa terdapat perbedaan pola pertumbuhan daun tempuyung. Secara umum diketahui bahwa saat tempuyung memasuki fase generatif maksimum, daun bagian bawah (roset) telah mengalami senesen (Gambar 4).
Gambar 4 Keragaan tempuyung pada tiga fase pertumbuhan yang berbeda. (1) Fase vegetatif, (2) Fase generatif awal, (3) Fase generatif maksimum.
Curah hujan dan suhu udara
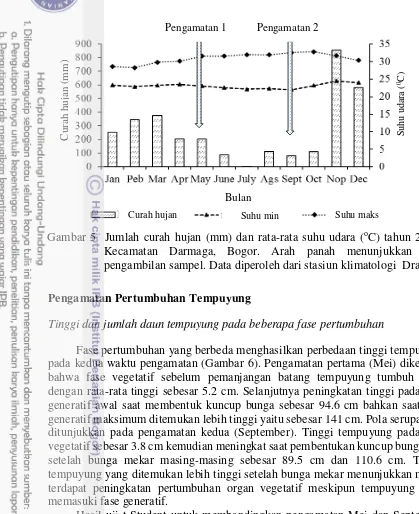
Pengambilan data iklim dilakukan untuk mengetahui kondisi aktual selama pertumbuhan tempuyung. Tempuyung membutuhkan waktu sekitar tiga bulan untuk mencapai fase generatif (bunga mekar) (Wardani dan Melati 2014). Oleh karena itu diambil perkiraan tiga bulan sebelum pengambilan sampel tempuyung liar untuk melihat perubahan iklim selama pertumbuhan tempuyung. Tiga bulan sebelum pengamatan pertama (bulan Februari hingga April 2015) menunjukkan curah hujan berada di atas 200 mm/bulan sehingga diketahui bahwa tempuyung tumbuh dan berkembang pada musim hujan. Selanjutnya curah hujan sebelum pengambilan sampel kedua yaitu bulan Juni hingga Agustus 2015 menunjukkan curah hujan berada di bawah 100 mm/bulan sehingga diketahu bahwa tempuyung tumbuh dan berkembang pada musim kemarau (Gambar 5).
1 2 3
Pengamatan Pertumbuhan Tempuyung
Tinggi dan jumlah daun tempuyung pada beberapa fase pertumbuhan
Fase pertumbuhan yang berbeda menghasilkan perbedaan tinggi tempuyung pada kedua waktu pengamatan (Gambar 6). Pengamatan pertama (Mei) diketahui bahwa fase vegetatif sebelum pemanjangan batang tempuyung tumbuh roset dengan rata-rata tinggi sebesar 5.2 cm. Selanjutnya peningkatan tinggi pada fase generatif awal saat membentuk kuncup bunga sebesar 94.6 cm bahkan saat fase generatif maksimum ditemukan lebih tinggi yaitu sebesar 141 cm. Pola serupa juga ditunjukkan pada pengamatan kedua (September). Tinggi tempuyung pada fase vegetatif sebesar 3.8 cm kemudian meningkat saat pembentukan kuncup bunga dan setelah bunga mekar masing-masing sebesar 89.5 cm dan 110.6 cm. Tinggi tempuyung yang ditemukan lebih tinggi setelah bunga mekar menunjukkan masih terdapat peningkatan pertumbuhan organ vegetatif meskipun tempuyung telah memasuki fase generatif.
Hasil uji t-Student untuk membandingkan pengamatan Mei dan September tidak menunjukkan perbedaan nyata tinggi tempuyung pada awal fase vegetatif dan awal fase generatif kecuali pada fase generatif maksimum yang ditemukan lebih tinggi pada pengamatan bulan Mei (Tabel 5).
Perbedaan fase pertumbuhan mempengaruhi jumlah daun pada kedua waktu pengamatan. Jumlah daun bawah pada pengamatan pertama (Mei) lebih banyak ditemukan saat fase vegetatif (P<0.05), kemudian ditemukan lebih rendah pada fase generatif awal (Gambar 6). Berikutnya daun atas ditemukan paling banyak pada fase generatif awal yaitu saat terbentuk kuncup bunga (P<0.05) dan ditemukan lebih rendah pada fase generatif maksimum. Hal ini berarti bahwa fase vegetatif merupakan fase pertumbuhan maksimum daun bagian bawah sedangkan fase perkembangan maksimum daun bagian atas saat tempuyung memasuki fase generatif awal. Pola serupa juga ditunjukkan pada pengamatan kedua (September) yaitu fase pertumbuhan maksimum daun bawah dan daun atas masing-masing saat
Pengamatan 1 Pengamatan 2
Gambar 5 Jumlah curah hujan (mm) dan rata-rata suhu udara (oC) tahun 2015 di Kecamatan Darmaga, Bogor. Arah panah menunjukkan waktu pengambilan sampel. Data diperoleh dari stasiun klimatologi Dramaga.
fase vegetatif awal dan fase generatif awal. Selanjutnya apabila dilihat secara umum berdasarkan fase pertumbuhan diketahui bahwa fase generatif awal menghasilkan jumlah daun total tertinggi karena masih mempunyai daun bagian bawah dan daun atas. Hasil uji t-Student pada kedua waktu pengamatan tidak menunjukkan perbedaan nyata jumlah daun pada ketiga fase pertumbuhan (Tabel 5).
Ket: (1) Fase vegetatif; (2) Fase generatif awal; (3) Fase generatif maksimum; (B) Daun bawah; (A) Daun atas;Angka yang diikuti huruf kecil yang berbeda menunjukkan perbedaan nyata pada pengamatan Mei; Angka yang diikuti huruf kapital yang berbeda menunjukkan perbedaan nyata pada pengamatan September berdasarkan Standar Error of Mean (SEM)
Gambar 6 Rata-rata tinggi (a) dan jumlah daun (b) tempuyung pada fase pertumbuhan yang berbeda
Luas daun pada beberapa fase pertumbuhan
Fase pertumbuhan mempengaruhi perbedaan luas daun tempuyung pada kedua waktu pengamatan. Hasil pengukuran luas daun pada pengamatan pertama (Mei) menunjukkan tidak terdapat perbedaan luas daun bawah pada fase vegetatif dengan saat fase generatif awal (Gambar 7). Sebaliknya luas daun atas terbesar ditemukan pada fase generatif awal (113.31 cm2) dan ditemukan lebih rendah saat fase generatif maksimum (89.29 cm2) (P<0.05). Penurunan luas daun bagian atas diduga berhubungan dengan kehilangan jumlah daun bagian atas saat memasuki fase generatif maksimum.
Terdapat perbedaan hasil pengukuran luas daun pada pengamatan kedua (September) dibandingkan dengan pengamatan pertama (Gambar 7). Luas daun bawah dan atas diketahui meningkat saat tempuyung memasuki fase berikutnya. Luas daun bawah saat fase vegetatif sebesar 63.98 cm2 lebih rendah dibandingkan saat fase generatif awal sebesar 93.31 cm2. Selanjutnya luas daun atas tertinggi ditemukan pada fase generatif maksimum sebesar 89.23 cm2. Hasil tersebut menunjukkan bahwa perkembangan organ vegetatif tetap berlangsung meskipun tempuyung telah memasuki fase generatif.
Hasil uji t-Student pada kedua waktu pengamatan menunjukkan luas daun saat fase vegetatif awal dan fase generatif awal pengamatan pertama (Mei) nyata lebih tinggi dibandingkan pengamatan kedua (September) (Tabel 5). Diduga bahwa perbedaan kondisi lingkungan mempengaruhi pola perkembangan daun tempuyung.
Ket: (1) Fase vegetatif; (2) Fase generatif awal; (3) Fase generatif maksimum; (B) Daun bawah; (A) Daun atas;Angka yang diikuti huruf kecil yang berbeda menunjukkan perbedaan nyata pada pengamatan Mei; Angka yang diikuti huruf kapital yang berbeda menunjukkan perbedaan nyata pada pengamatan September berdasarkan Standar Error of Mean (SEM)
Gambar 7 Rata-rata luas daun terbesar tempuyung pada fase pertumbuhan yang berbeda
Bobot basah dan bobot kering daun pada beberapa fase pertumbuhan
Perbedaan fase pertumbuhan berpengaruh terhadap perbedaan bobot basah dan bobot kering daun pada pengamatan pertama (Mei). Dapat dilihat pada Gambar 8 bahwa bobot basah maupun bobot kering daun bawah saat fase generatif awal ditemukan lebih rendah dibandingkan saat fase vegetatif. Selanjutnya bobot basah maupun bobot kering daun atas tertinggi ditemukan saat fase generatif awal. Hasil tersebut berarti bahwa terjadi penurunan bobot daun bagian bawah maupun daun bagian atas saat memasuki fase berikutnya dan diduga kehilangan jumlah daun dapat menurunkan biomassa daun tempuyung.
Hasil pengukuran bobot basah dan bobot kering daun pada pengamatan kedua (September) menunjukkan pola yang berbeda dengan pengamatan yang pertama. Bobot basah dan bobot kering daun bawah cenderung lebih tinggi saat fase generatif awal dibandingkan fase vegetatif (P>0.05) (Gambar 8). Selanjutnya diketahui juga bobot basah dan kering daun atas cenderung lebih tinggi saat fase generatif maksimum dibandingkan saat fase generatif awal (P>0.05). Hal ini menunjukkan bahwa terdapat kecenderungan peningkatan biomassa daun bagian bawah maupun daun bagian atas saat memasuki fase berikutnya. Berikutnya bila dilihat dari fase pertumbuhannya diketahui bahwa fase generatif awal saat tempuyung membentuk kuncup bunga secara umum menghasilkan bobot basah dan bobot kering daun total tertinggi karena pada fase ini masih terdapat daun bawah dan atas.
2.20
Hasil uji t-Student menunjukkan perbedaan antar waktu pengamatan (Tabel 5). Bobot basah dan bobot kering daun bawah pada fase vegetatif awal lebih tinggi pada pengamatan bulan Mei dibandingkan pengamatan bulan September (P<0.05). Selanjutnya bobot basah dan bobot kering daun atas saat fase generatif awal lebih tinggi pada pengamatan Mei dibandingkan pada pengamatan September. Faktor lingkungan (curah hujan, suhu) diduga menjadi penyebab perbedaan biomassa daun pada kedua waktu pengamatan.
Ket: (1) Fase vegetatif; (2) Fase generatif awal; (3) Fase generatif maksimum; (B) Daun bawah; (A) Daun atas; Angka yang diikuti huruf kecil yang berbeda menunjukkan perbedaan nyata pada pengamatan Mei berdasarkan Standar Error of Mean (SEM)
Gambar 8 Bobot basah (a) dan bobot kering (b) daun tempuyung pada fase pertumbuhan yang berbeda
Kadar Klorofil, Karotenoid dan Antosianin pada Fase Pertumbuhan yang Berbeda
Perbedaan fase pertumbuhan mempengaruhi kadar antosianin pada pengamatan Mei. Kadar antosianin daun bawah ditemukan lebih tinggi pada fase generatif awal dibandingkan fase vegetatif kemudian kadar antosianin daun atas ditemukan lebih tinggi pada fase generatif maksimum dibandingkan fase generatif awal (Tabel 2).
Perbedaan waktu pengamatan mempengaruhi perbedaan kadar pigmen tempuyung (Tabel 5). Hasil uji t-Student menunjukkan pengamatan September menghasilkan kadar klorofil total dan karotenoid yang lebih tinggi dibandingkan pengaatan Mei terutama pada fase vegetatif dan fase generatif maksimum (P<0.05).
Tabel 2 Kadar klorofil, karotenoid dan antosianin daun tempuyung pada beberapa fase pertumbuhan Ket : (1) Fase vegetatif; (2) Fase generatif awal; (3) Fase generatif maksimum; (B) daun bawah; (A) daun
atas; ; Angka yang diikuti huruf kecil yang berbeda menunjukkan perbedaan nyata pada pengamatan Mei; Angka yang diikuti huruf kapital yang berbeda menunjukkan perbedaan nyata pada pengamatan September; BB= Bobot basah
Kadar Flavonoid Tempuyung pada Beberapa Fase Pertumbuhan.
Perbedaan fase pertumbuhan tempuyung menghasilkan kadar bioaktif yang berbeda pada pengamatan pertama (Tabel 3). Kadar luteolin, kuersetin dan flavonoid total daun bawah saat tempuyung memasuki fase generatif awal ditemukan lebih tinggi dibandingkan saat fase vegetatif. Begitupun pada daun bagian atas yang ditemukan lebih tinggi saat fase generatif maksimum dibandingkan saat fase generatif awal kecuali kadar kuersetin.
Tabel 3 Kadar flavonoid tempuyung pada beberapa fase pertumbuhan
Fase Maksimum; (B) Daun bawah; (A) Daun atas; SK= Setara Kuersetin; BK= Bobot Kering.
Kadar flavonoid tertinggi yang ditemukan pada fase generatif maksimum diduga diakibatkan kondisi stres akibat kehilangan struktur daun bagian bawah sehingga memicu peningkatan produksi metabolit sekunder tempuyung.
Produksi Flavonoid Total Daun Tempuyung pada Beberapa Fase Pertumbuhan
Produksi senyawa bioaktif tempuyung diketahui berdasarkan kadar flavonoid total dan bobot kering daun tempuyung yang dihasilkan (Gambar 9). Produksi flavonoid total daun tertinggi pada pengamatan pertama (Mei) ditemukan pada daun bagian atas saat fase generatif awal yaitu sebesar 2.20 mg/tan. Produksi flavonoid daun bawah saat fase generatif awal ditemukan lebih rendah dibandingkan saat fase vegetatif. Terdapat kecenderungan produksi flavonoid total lebih rendah saat memasuki fase selanjutnya.
Selanjutnya pada pengamatan kedua (September) produksi flavonoid total daun tempuyung membentuk pola yang berbeda dengan pengamatan pertama yaitu terdapat kecenderungan produksi flavonoid yang lebih tinggi saat memasuki fase berikutnya (Gambar 9). Produksi flavonoid total daun bawah saat fase vegetatif sebesar 0.84 mg/tan kemudian saat fase generatif awal lebih tinggi yaitu 1.25 mg.tan-1 . Pola yang sama juga ditemukan pada daun bagian atas yaitu saat fase generatif awal sebesar 0.98 mg/tan kemudian pada fase generatif maksimum sebesar 1.26 mg/tan. Perbedaan pola produksi bioaktif pada kedua waktu pengamatan diduga berkaitan dengan perbedaan kondisi lingkungan yang mempengaruhi produksi dan metabolisme tempuyung.
Ket : Hasil tidak dianalisis; (1) Fase vegetatif; (2) Fase generatif awal; (3) Fase generatif maksimum; B=Daun bawah; A= Daun atas.
Gambar 9 Produksi flavonoid total tempuyung pada fase pertumbuhan yang berbeda
Koefisien Korelasi Bobot Daun dan Kadar Flavonoid Tempuyung
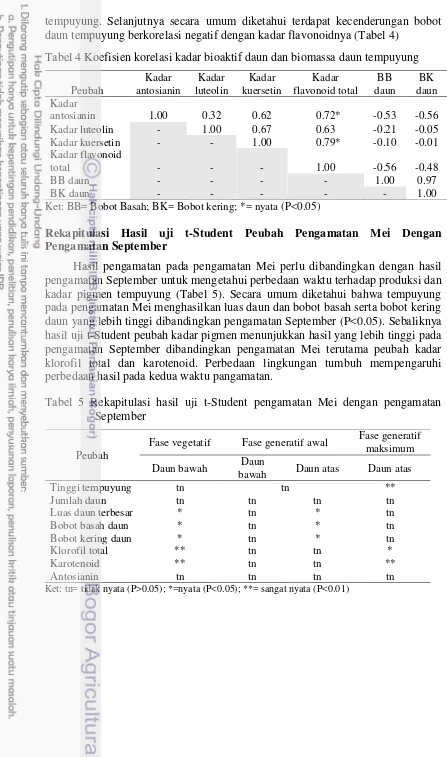
Beberapa hasil pengukuran variabel pengamatan perlu dijetahui hubunganya berdasarkan nilai koefisien korelasi. Kadar flavonoid total berkorelasi positif dengan kadar antosianin (P<0.05), kadar kuersetin dan kadar luteolin (P>0.05) daun
tempuyung. Selanjutnya secara umum diketahui terdapat kecenderungan bobot daun tempuyung berkorelasi negatif dengan kadar flavonoidnya (Tabel 4)
Tabel 4 Koefisien korelasi kadar bioaktif daun dan biomassa daun tempuyung
Peubah
Ket: BB= Bobot Basah; BK= Bobot kering; *= nyata (P<0.05)
Rekapitulasi Hasil uji t-Student Peubah Pengamatan Mei Dengan Pengamatan September
Hasil pengamatan pada pengamatan Mei perlu dibandingkan dengan hasil pengamatan September untuk mengetahui perbedaan waktu terhadap produksi dan kadar pigmen tempuyung (Tabel 5). Secara umum diketahui bahwa tempuyung pada pengamatan Mei menghasilkan luas daun dan bobot basah serta bobot kering daun yang lebih tinggi dibandingkan pengamatan September (P<0.05). Sebaliknya hasil uji t-Student peubah kadar pigmen menunjukkan hasil yang lebih tinggi pada pengamatan September dibandingkan pengamatan Mei terutama peubah kadar klorofil total dan karotenoid. Perbedaan lingkungan tumbuh mempengaruhi perbedaan hasil pada kedua waktu pangamatan.
Tabel 5 Rekapitulasi hasil uji t-Student pengamatan Mei dengan pengamatan September
Peubah
Fase vegetatif Fase generatif awal Fase generatif maksimum
Pembahasan
Berdasarkan hasil pengamatan diketahui bahwa tempuyung memiliki daun yang tumbuh melingkar di atas permukaan tanah (daun bawah) dan daun yang tumbuh pada batang (daun atas). Terdapat tiga fase pertumbuhan utama perkembangan daun tempuyung, yaitu pertama fase vegetatif. Pada fase ini daun bawah tumbuh maksimum membentuk roset di atas permukaan tanah sebelum batang memanjang (belum muncul daun atas). Fase berikutnya yaitu fase generatif awal yaitu pada fase ini tempuyung telah memasuki fase generatif dan ditandai dengan munculnya kuncup bunga. Fase terakhir yaitu fase generatif maksimum. Fase ini saat tempuyung telah berbunga dan menghasilkan biji dan kemudian diketahui daun bawah telah mengalami senesen (Gambar 4). Hasil pengamatan terhadap jumlah daun (Gambar 6) mengindikasikan daun bawah mengalami senesen saat tempuyung memasuki fase generatif bahkan pada fase generatif maksimum (setelah bunga mekar) tidak ditemukan struktur daun bagian bawah. Zolinger et al. (1991) menjelaskan bahwa perkembangan daun tempuyung awalnya membentuk roset dekat dengan permukaan tanah, kemudian daun tumbuh dan berkembang pada pemanjangan batang. Lemna dan Messersmith (1990) menjelaskan bahwa bobot daun pada struktur bagian bawah tempuyung yang hilang berkaitan erat dengan alokasi cadangan ke bagian atas yang lebih muda kemudian berhubungan dengan peningkatan respirasi akar tua dan perkembangan akar. Perbedaan fase pertumbuhan dan posisi daun diketahui mempengaruhi struktur tanaman. Penelitian Declerck RA (1995) pada tempuyung menunjukkan bahwa perbedaan fase pertumbuhan dan posisi daun mempengaruhi jumlah dan kerapatan stomata.
Hasil perhitungan produksi daun tempuyung pada kedua waktu menunjukkan hasil yang berbeda. Jumlah dan bobot daun tempuyung pada pengamatan bulan Mei cenderung lebih tinggi dibandingkan pada pengamatan bulan September. Diduga perbedaan kondisi lingkungan terutama curah hujan mempengaruhi pertumbuhan tempuyung. Hakansson dan Wallgren (1972) menjelaskan bahwa tempuyung tidak akan berbunga saat kondisi lingkungan tidak menguntungkan dan mampu berbunga dengan cepat pada saat air, cahaya dan nutrisi tersedia dengan optimal.
Hasil pengukuran kadar klorofil total (Tabel 2) menunjukkan daun bawah saat fase generatif awal menghasilkan kadar klorofil terendah pada pengamatan Mei (P>0.05) maupun pada pengamatan September (P<0.05). Selanjutnya kadar antosianin daun bawah ditemukan lebih tinggi saat tempuyung memasuki fase generatif awal pada kedua waktu pengamatan (P>0.05). Diduga bahwa daun bawah yang lebih tua telah senesen sehingga tersisa adalah daun yang lebih muda. Gamon dan Surfus (1999) menjelaskan bahwa kadar antosianin umumnya cenderung lebih tinggi pada daun muda yang mempunyai laju fotosintesis rendah. Sims dan Gamon (2002) menjelaskan bahwa kadar karotenoid mempunyai korelasi positif dengan kadar total klorofil daun sehingga dengan mengetahui kadar klorofil sudah bisa memprediksi kadar karotenoid.
Kadar flavonoid total daun tempuyung cenderung lebih tinggi saat memasuki fase generatif (Tabel 3). Telah banyak penelitian melaporkan kecenderungan peningkatan kandungan flavonoid saat tanaman memasuki fase generatif (Sellami
et al. 2009; Karray et al. 2010; Moraes et al. 2013). Males et al. (2003) dalam penelitiannya melaporkan bahwa bagian tajuk Crithmum maritimum yang dipanen pada awal pembungaan menghasilkan kadar flavonoid dan fenol tertinggi.
Kadar flavonoid total umumnya diteliti dan dihitung sebagai kuersetin yang merupakan kelompok flavonol (Wahyuningrum 2006; Rohaeti et al. 2011; Mualim 2012; Wardani dan Melati, 2014). Sebaliknya Departemen Kesehatan Republik Indonesia melalui farmakope herbal menetapkan senyawa identitas tempuyung adalah luteolin dari kelompok flavon (Depkes RI, 2008). Flavonoid total yang terukur merupakan sumbangan dari golongan flavon dan flavonol karena hanya kedua kelompok inilah yang mampu membentuk kompleks stabil dengan AlCl3 (Chang et al. 2002).
Luteolin dan kuersetin merupakan senyawa bagian dari kelompok flavonoid dan untuk mengkuantifikasikannya harus dilakukan dengan menggunakan High Performance Liquid Chromatography (HPLC). Hasil pengukuran kadar luteolin tempuyung menunjukkan adanya luteolin pada sampel tempuyung di semua fase pertumbuhan, sebaliknya kadar kuersetin menunjukkan jumlah yang lebih sedikit. Kuersetin merupakan senyawa yang paling sering dipelajari diantara senyawa kelompok flavonoid, tetapi penelitian terkini banyak memberikan informasi bahwa terdapat senyawa flavonoid yang lain yang juga berperan sebagai antioksidan, mekanisme anti karsinogenik dan salah satunya adalah senyawa luteolin. Luteolin adalah bagian dari kelompok flavon yang diketahui mengandung banyak manfaat kesehatan alami dalam sayuran (Seelinger et al. 2008). Beberapa penelitian serupa juga telah melaporkan perbandingan hasil kadar luteolin dan kuersetin yang berbeda pada beberapa jenis tanaman obat dan sayuran (Hertog et al. 1992; Andarwulan et al. 2011).
Hasil pengukuran kadar kuersetin dan luteolin diketahui bahwa terdapat pola peningkatan kadar daun bawah maupun daun atas seiring peningkatan umur tempuyung. Daun bawah saat fase generatif awal lebih tinggi kadar luteolin dan kuersetin dibandingkan daun bawah saat fase vegetatif. Begitupun daun atas saat fase generatif maksimum ditemukan menghasilkan kadar luteolin dan kuersetin yang lebih tinggi dibandingkan saat fase generatif awal. Beberapa hasil penelitian sebelumnya juga melaporkan perubahan signifikan kandungan flavonoid pada fase pertumbuhan yang berbeda (Sellami et al. 2009; Karray et al. 2010; Moraes et al.
2013). Penelitian yang dilakukan Sellami et al. (2009) tentang pengaruh fase pertumbuhan terhadap kandungan flavonoid Origanum majorana L. melaporkan bahwa perbedaan fase pertumbuhan dapat menghasilkan kandungan flavonoid yang berbeda. Selanjutnya dijelaskan bahwa kadar luteolin lebih tinggi ditemukan saat tanaman memasuki fase generatif dibandingkan saat masih fase vegetatif.