I. PENDAHULUAN
A. Latar belakang
Tanaman pisang menghasilkan salah satu komoditas unggulan di Indonesia yaitu buah pisang. Buah pisang adalah buah yang sangat bergizi yang merupakan sumber vitamin, mineral dan juga karbohidrat. Industri makanan pisang cukup berkembang di Indonesia, yaitu diolah menjadi tepung pisang, dodol, pure, keripik dan lain-lain. Selain itu, kulit pisang dapat dimanfaatkan untuk membuat cuka melalui proses fermentasi alkohol dan asam cuka. Sedangkan daun pisang dipakai sebagai pembungkus berbagai macam makanan trandisional. Produksi pisang di Indonesia pada tahun 2011 mencapai 5.899.640 ton (Badan Pusat Statistik, 2011).
Penyakit layu fusarium yang disebabkan oleh jamur Fusarium oxysporum f.sp. cubense merupakan salah satu kendala dalam upaya peningkatan produksi tanaman pisang. Keberadaan penyakit layu fusarium ini mempengaruhi
dan merusak sistem pembuluh sehingga menyebabkan tanaman layu dan akhirnya mati (Semangun, 2007).
Menurut Dinas Pertanian Lampung (2006) produksi pisang Lampung sebesar 523.038 ton yang dihasilkan dari 7.022.177 rumpun dan 131.942 rumpun dari jumlah rumpun tersebut terserang oleh penyakit. Penyakit yang mendominasi adalah layu fusarium sebanyak 56.292 rumpun. PT NTF (Nusantara Tropical Farm) merupakan salah satu sentra produksi pisang di Lampung. Pada tahun 2010, tingkat serangan penyakit layu fusarium di perkebunan PT NTF mencapai 8,1% dari total populasi tanaman sebanyak 833.111 (komunikasi personal PT NTF, 2012). Data tersebut menunjukkan layu fusarium pada tanaman pisang sangat merugikan secara ekonomis.
Sejauh ini usaha pengendalian dilakukan dengan menggunakan fungisida kimia sintetik (mankozeb). Penggunaan fungisida kimia sintetik dapat menimbulkan resistensi jamur patogen sehingga tanaman menjadi lebih mudah terserang
penyakit dan juga residu fungisida dapat mencemari lingkungan pada penggunaan fungisida yang tidak bijak. Selain itu, tindakan pengendalian secara kimiawi ini sering terlambat karena umumnya didasarkan pada gejala penyakit seperti layu, padahal infeksi oleh jamur tular tanah (soilborne) ini sering sulit dideteksi karena awal infeksi terjadi pada atau di bawah permukaan tanah (Semangun, 2007).
pengendalian biologi adalah jamur Trichoderma spp. Beberapa penelitian menunjukkan bahwa Trichoderma spp. dapat menekan pertumbuhan jamur Fusarium oxysporum (Herlina, 2009; Christopher et al., 2010; John et al., 2010), Colletotrichum acutatum (Stanley et al., 2004), Rigidoporus lignosus (Hutahaean & Junita, 2009), Rhizoctonia solani (Howell et al., 1999), Colletotrichum graminicola (Harman et al., 2004), dan Phytopthora capsici (Ahmed et al., 2000). Trichoderma spp. dapat menekan perkembangan patogen dengan cara antibiosis, mikoparasit, kompetisi, dan lisis (Dennis & Webster, 1971)
Salah satu upaya dalam peningkatan keefektifan metode pengendalian
Media starter atau media perbanyakan Trichoderma spp. digunakan untuk mempermudah dalam penyimpanan dalam waktu yang lama dan kegiatan
perbanyakan jamur secara massal. Peningkatkan keefektifan Trichoderma spp. di tanah untuk pengendalian penyakit tanaman dilakukan dengan penambahan bahan bahan organik lainnya pada saat dintroduksikan ke tanah atau sekitar perakaran tanaman. Bahan organik yang digunakan sebaiknya harus mempertimbangkan faktor ekonomi dan efisiensinya (Atmojo, 2003). Dalam hal ini harga yang relatif murah dan bahan yang mudah didapat menjadi faktor utama bahan-bahan starter tersebut layak digunakan. Dalam upaya mencari bahan organik yang efektif dan efisien dalam penggunannya maka dalam penelitian ini diuji beberapa bahan organik yaitu kompos, jerami padi, dan kulit singkong
B. Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui pengaruh kombinasi jamur Trichoderma spp. dan bahan organik terhadap perkembangan penyakit layu fusarium pada pisang.
C. Kerangka Pemikiran
patogen oleh enzim yang dihasilkan Trichoderma spp. Mikoparasitisme yaitu jamur bersifat parasit terhadap jamur lainnya (Dennis dan Webster, 1971). Beberapa hasil penelitian menunjukkan bahwa Trichoderma spp. dapat menekan pertumbuhan Fusarium oxysporum (Herlina, 2009; Christopher et al, 2010; John et al., 2010), Colletotrichum acutatum (Stanley et al., 2004), Rigidoporus lignosus (Hutahaean & Junita, 2009), Rhizoctonia solani (Howell et al., 1999),
Colletotrichum graminicola (Harman et al., 2004), dan Phytopthora capsici (Ahmed et al., 2000).
Layu fusarium merupakan salah satu penyakit penting pada tanaman pisang yang disebabkan oleh jamur Fusarium oxysporum f.sp. cubense. Jamur ini merupakan jamur tular tanah (soil borne). Klamidiospora jamur ini mampu bertahan selama lebih dari 30 tahun di dalam tanah walaupun tidak terdapat tanaman inangnya (Ploetz, 1990). Pengendalalian penyakit ini dengan menggunakan fungisida kimia sintetik tidak menunjukkan hasil yang maksimal. Penggunaan jamur antagonis Trichoderma spp. menjadi suatu pilihan pengendalian yang dapat
dipertimbangkan. Hal ini karena sifat kedua jamur ini yang sama yaitu
merupakan jamur tular tanah (soil borne), sehingga kedua jamur ini dapat saling berinteraksi dan berkompetisi. Nurbailis & Martinius (2011) melaporkan bahwa Isolat TV-T1Sk mempunyai kemampuan kolonisasi 93% pada akar bibit pisang dan juga bersifat endofit pada jaringan akar bibit pisang sehingga efektif menekan penyakit layu Fusarium dan meningkat pertumbuhan tanaman. Soesanto & Rahayuniati (2009) juga melaporkan bahwa Trichoderma spp. efektif
penurunan keparahan penyakit sebanyak 53,57% dan penurunan laju infeksi sebesar 61,48% pada pembibitan.
Aplikasi Trichoderma spp. di lapangan memiliki kendala. Salah satunya ialah rendahnya kemampuan adaptasi dan perkembangan populasi Trichoderma spp. pada rizosfir setelah diintroduksikan ke dalam tanah. Menurut Sinaga (1989), sebelum diintroduksikan ke dalam tanah agensia hayati sebaiknya diperbanyak secara massal pada bahan organik yang sesuai untuk pertumbuhan dan
perkembangan agar dapat beradaptasi pada lingkungan yang baru setelah diintroduksikan ke dalam tanah. Kemampuan tumbuh jamur antagonis sangat tergantung pada masukan energi dan nutrisi yang umumnya tersedia dalam media tanam. Jamur antagonis memperoleh energi dan nutrisi dari bahan-bahan hasil dekomposisi bahan organik dalam tanah dan mempergunakannya untuk aktivitas serta memperbanyak populasinya (Barakat & Al-Masri, 2009). Menurut Ginting & Maryono (2012), kandungan bahan organik yang relatif banyak pada medium tanam dapat menekan penyakit busuk pangkal batang lada. Untuk memperoleh jamur antagonis yang efektif dalam mengendalikan penyakit tanaman, jamur antagonis harus memiliki kualitas yang baik. Kualitas jamur antagonis antara lain ditentukan oleh jumlah propagula (konidia) yang terbentuk dan persentase
Bahan organik selain beperan dalam memberikan nutrisi terhadap pertumbuhan Trichoderma spp., menurut Atmojo (2003) bahan organik berperan penting terhadap sifat fisik, biologi dan kimia tanah lainnya. Peran bahan organik terhadap kimia tanah yaitu sebagai salah satu sumber hara makro maupun mikro. Sifat fisika tanah yang dipengaruhi yaitu, bahan organik mampu membentuk agregat tanah yang lebih baik dan memantapkan agregat yang telah terbentuk sehingga aerasi, permeabilitas dan infiltrasi menjadi lebih baik. Akibatnya adalah daya tahan tanah terhadap erosi akan meningkat, meningkatkan retensi air yang dibutuhkan bagi pertumbuhan tanaman. Peran bahan organik terhadap sifat biologi tanah yaitu mensuplai energi bagi organisme tanah, meningkatkan organisme saprofit dan menekan organisme parasit bagi tanaman (Stevenson, 1982). Dengan demikian, sifat fisika, kimia, dan biologi tanah yang baik akan dapat meningkatkan pertumbuhan tanaman pula sehingga apabila tanaman sehat, maka tanaman akan meningkat ketahanannya terhadap serangan patogen.
Dalam upaya mencari bahan organik yang efektif dan efisien dalam
bekatul mempunyai kemampuan menekan patogenitas Plasmodiophora
brassicae dan penyakit akar gada, baik pada tanah andosol maupun latosol.
Kompos merupakan bahan organik, seperti daun-daunan, jerami, alang-alang, rumput-rumputan, dedak padi, batang jagung, sulur, serta kotoran hewan yang telah, mengalami proses dekomposisi, sehingga dapat dimanfaatkan untuk memperbaiki sifat-sifat tanah. Selain itu kompos mengandung hara-hara mineral yang esensial bagi tanaman (Setyorini et al., 2006). Jerami padi merupakan bagian dari batang tumbuhan tanpa akar yang tertinggal setelah dipanen butir buahnya. Jerami padi mengandung 35,1% serat kasar, selulosa 33,0%, 6,96% lignin, dan 4,2% protein kasar. Kulit singkong mengandung 4,8% protein kasar, 21,2% serat kasar, 4,2% abu, 0,36% Ca, 0,112% P dan 0,227 % Mg (Devendra, 1977 & Sofyan, 2004 et al. dalam Setyorini et al. 2006).
D. Hipotesis
Hipotesis yang diajukan dalam penelitian ini ialah:
1. Isolat Trichoderma spp. dapat menekan pertumbuhan dan perkembangan penyakit layu fusarium pada tanaman pisang.
2. Penambahan bahan organik yang mengandung Trichoderma spp. dapat meningkatkan kepadatan populasi Trichoderma spp. yang diinfestasikan. 3. Kombinasi isolat Trichoderma spp. dan bahan organik dapat
II. TINJAUAN PUSTAKA
A. Tanaman Pisang Cavendish
1. Taksonomi
Menurut Tjitrosoepomo (1988) dalam sistematika (taksonomi) tanaman pisang cavendish diklasifikasian sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta Sub divisi : Angiospermae Kelas : Monocotyledonae Famili : Musaceae
Genus : Musa Spesies : Musa spp.
2. Morfologi
batang semu. Batang pisang sesungguhnya terdapat di dalam tanah, yaitu bonggol. Pada sepertiga bagian bonggol sebelah atas terdapat tunas anakan. Bunga pisang muncul dari primordia yang terbentuk pada bonggolnya yang kemudian memanjang ke atas hingga menembus inti batang semu dan keluar diujung batang semu tersebut. Panjang Tandan berkisar antara 60-100 cm dengan berat 15-30 kg. Setiap tandan terdiri dari 8-13 sisir dan setiap sisir ada 12 - 22 buah. Daging buah berwarna putih kekuningan, rasanya manis agak asam, dan lunak. Sedangkan kulit buah agak tebal berwarna hijau kekuningan sampai kuning muda halus (Rismunandar, 1990; Robinson & Souco, 2010).
3. Syarat Tumbuh
a. Iklim
Tanaman pisang dapat tumbuh dan berkembang dengan baik pada daerah yang memiliki iklim tropis basah, lembab dan panas. Walaupun demikian tanaman pisang masih dapat tumbuh di daerah subtropis. Selain itu pada kondisi tanpa air, pisang masih tetap tumbuh karena air disuplai dari batangnya yang berair tetapi produksinya sangat sedikit. Curah hujan optimal adalah 1,520–3,800 mm/tahun dengan 2 bulan kering. Variasi curah hujan harus diimbangi dengan ketinggian air tanah agar tanah tidak tergenang (Rismunandar, 1990; Robinson & Souco, 2010).
b. Media Tanam
tidak boleh menggenang karena pertanaman pisang harus diairi dengan intensif. Ketinggian air tanah di daerah basah adalah 50-200 cm, di daerah setengah basah 100-200 cm dan di daerah kering 50-150 cm. Tanah yang telah mengalami erosi tidak akan menghasilkan panen pisang yang baik. Tanah harus mudah
meresapkan air dan tanaman pisang tidak dapat tumbuh dan berkembang pada tanah yang mengandung garam 0,07% (Rismunandar, 1990; Robinson & Souco, 2010).
c. Ketinggian Tempat
Tanaman pisang cukup toleran terhadap ketinggian dan kekeringan. Di Indonesia, umumnya tanaman dapat tumbuh di dataran rendah sampai
pegunungan setinggi 2.000 m dpl. Sedangkan untuk pisang ambon, nangka dan tanduk tumbuh baik sampai ketinggian 1.000 m dpl (Rismunandar, 1990; Robinson & Souco, 2011).
4. Budidaya Tanaman Pisang
a. Pembibitan
Budidaya tanaman pisang Cavendish melalui pembibitan secara kultur jaringan terbagi dalam dua proses, yaitu proses di laboratorium dan nursery.
(1) Pembuatan Bibit secara Kultur Jaringan di Laboratorium
Tahap awal pembuatan bibit tanaman pisang secara kultur jaringan diawali
patogen. Setelah didapatkan eksplan yang baik kemudian ditumbuhkan pada media MS. Setelah itu planlet (bibit kecil) diaklimatisasi pada media pasir dan kompos dan diletakkan di rumah kaca atau tempat nurseri (Yusnita, 2004; Avivi & Ikrawati, 2004).
(2) Proses di Nurseri (Aklimatisasi)
Pada proses ini, dipersiapkan media berupa campuran pasir dan kompos
(perbandingan 1:2) kemudian disterilisasi dengan uap air panas selama beberapa jam. Setelah media dingin dimasukkan ke dalam bak plastik dan dicapur dengan pupuk NPK (dengan perbandingan 1:1:1) sebanyak 3 g setiap baknya. Kemudian planlet diambil dari media MS dan dibilas atau dicuci, kemudian dicelupkan ke dalam larutan Dithane dan larutan fungisida (Benlate dan Agrymycin 1 g/l lalu ditiriskan. Selanjutnya planlet ditanamkan ke media pasir dan kompos dalam bak plastik (Suhardiman, 1997; Avivi & Ikrawati, 2004).
Planlet yang telah dipindahkan ke dalam bak plastik disungkup dengan sungkup plastik selama 1 minggu agar kelembabaan mencapai 95%. Kemudian sungkup dibuka selama 1 minggu, lalu bibit diletakkan di tempat pembibitan dan media tanam disiram setiap hari. Tempat pembibitan harus terlindung dari sinar matahri langsung, misalnya dengan diberi net (jaring) pada atapnya. Setelah berumur 2-4 minggu bibit dalam bak plastik dipindahkan ke dalam polybag tang berisi
campuran tanah dan kompos dengan perbandingan 1:1. Polybag yang berukuran 18x24 cm disusun berjajar dengan kerapatan 64 buah polybag per m2.
b. Penanaman
Tempat yang akan ditanami pisang terlebih dahulu diberi ajir dengan jarak 2,5x4 m. Tempat-tempat yang diberi ajir tersebut digali untuk membuat lubang tanam berukuran 60 cm x 60 cm x 60 cm. Tanah galian lapisan atas dipisahkan dengan tanah galian lapisan bawah . Tanah galian tersebut dibiarkan selama satu minggu hingga kering. Setelah tanah galian kering, lapisan bawah tanah dimasukkan lagi ke bagian bawah. Tanah lapisan atas dicampur dengan 20 kg pupuk kandang yang sudah matang ditambah dengan 2 sendok makan pupuk NPK serta 1 sendok makan Furadan. Setelah tanah tercampur rata dengan pupuk , kemudian
dimasukkan ke dalam lubang tanam (Suhardiman, 1997; Avivi & Ikrawati, 2004).
Polybag yang berisi bibit pisang dibuka secara hati-hati, lalu bibit pisang hasil aklimatisasi dimasukkan ke dalam lubang tanam, masing-masing satu bibit. Penanaman sebaiknya dilakukan pada awal musim hujan sehingga tidak memerlukan penyiraman. Bila penanaman pisang dilakukan pada lahan yang sangat luas dan penanaman sering terlambat, perlu diusahan agar tidak terjadi kekeringan, misalnya dengan pemberian mulsa, pelindung, ataupun melakukan penyiraman (Suhardiman, 1997; Avivi & Ikrawati, 2004).
c. Pemeliharaan
(1) Sanitasi
Sanitasi merupakan usaha pembersihan rumput, gulma, sisa pelepah, dan daun kering di sekitar tanaman pisang. Sanitasi bertujuan untuk mencegah atau
mengendalikan serangan hama dan penyakit. Pembersihan rumput ataupun gulma tergantung beberapa faktor misalnya musim, pada musim hujan akan lebih banyak rumput yang tumbuh daripada musim kemarau, gangguan hama dan penyakit dan tenaga kerja (Suhardiman, 1997)
(2) Pembuatan Rorak
Pembuatan rorak di antara tanaman dapat berfungsi sebagai tempat mengubur gulma. Gulma yang membusuk dapat menambah kesuburan tanaman. Selain itu, pembuatan rorak dapat mencegah erosi dengan menampung air hujan yang mengalir di permukaan tanah sebelum tanaman cukup besar (Suhardiman, 1997).
(3) Penyapihan Anakan
Pisang yang telah berumur sekitar 3 bulan sebaiknya tidak terganggu oleh adanya anakan. Anakan pisang dapat menghambat peryumbuhan dan menyebabkan persaingan dengan induknya. Jumlah anakan harus dibatasi hanya sampai dua atau tiga batang saja supaya produksi dan kualitas buah tidak menurun. Jumlah anakan pisang dipengaruhi oleh kesuburan tanah dan pupuk yang diberikan. Pembuangan atau penyapihan anakan harus dilakukan secara hati-hati agar tidak melukai tanaman induk (Suhardiman, 1997).
(4) Pemangkasan
Pemangkasan dilakukan dengan memotong daun dan pelepah yang kering dan memotong jantung pisang. Pemotongan jantung pisang dilakukan apabila pembentukan sisir buah sudah sangat lambat dan kecil. Jenis pisang Cavendish dapat membentuk tandan buahdengan optimal sebanyak tujuh sampai delapan sisir. Pemotongan jantung diharapkan dapat memacu pertumbuhan buah dan mempercepat pemasakannya (Suhardiman, 1997).
(5) Pemupukan
Pisang memerlukan unsur-unsur hara makro, terutama kalium dalam jumlah besar. Untuk satu hektar, pisang memerlukan 207 kg urea, 138 kg super fosfat, 608 kg KCl dan 200 kg batu kapur sebagai sumber kalsium. Pupuk N diberikan dua kali dalam satu tahun yang diletakkan di dalam larikan yang mengitari rumpun
tanaman. Setelah itu larikan ditutup kembali dengan tanah. Pemupukan fosfat dan kalium dilaksanakan 6 bulan setelah tanam (dua kali dalam setahun)
(Rismunandar, 1990).
(6) Pengairan dan Penyiraman
B. Penyakit Layu Fusarium Pada Tanaman Pisang
1. Penyebab Penyakit Layu Fusarium
Penyakit layu fusarium disebabkan oleh Fusarium oxysporum f.sp. cubense (Foc) yang merupakan salah satu penyakit penting pada tanaman pisang. Klasifikasi jamur Fusarium oxysporum f.sp. cubense menurut Alexopoulus & Mims (1979) adalah sebagai berikut ini:
Kingdom : Mycetae
Divisi : Amastigomycota Subdivis : Deuteromycotina Kelas : Deuteromycetes Ordo : Hypocreales Famili : Nectriaceae Genus : Fusarium
Species : Fusarium oxysporum f.sp. cubense
Secara mikroskopis konodiofor bercabang-cabang dengan panjang rata-rata 70 µm. Cabang-cabang samping biasanya bersel 1, panjangnya sampai 14 µm. Konidium terbentuk pada ujung cabang utama atau cabang samping.
Mikrokonidium bersel 1 atau bersel 2, hialin, jorong atau memanjang, berukuran 5-7 x 2,5-3 µm. Makrokonodium berbentuk sabit, bertangkai kecil, umumnya bersel 4, hialin, berukuran 22-36 x 4-5 µm. Klamidiospora bersel 1, jorong atau bulat, berukuran 7-13 x 7-8 µm, terbentuk di tengah hifa atau pada
miselium yang terdapat di antara sel-sel, yaitu dalam kulit dan di jaringan parenkim di dekat tempat terjadinya infeksi (Semangun, 2007). Secara
makroskopis, koloni pada media mencapai diameter 3,5- 5,0 cm. miselium tampak jarang atau banyak seperti kapas, kemudian menjadi seperti beludru, berwarna putih dan biasanya agak keunguan yang tampak lebih kuat pada permukaan medium (Gandjar et al., 1999).
2. Ras dan Persebaran Fusarium oxysporum f.sp. cubense
Penyakit layu fusarium yang dikenal juga dengan sebutan penyakit Panama, pertama kali ditemukan di daerah Panama pada tahun 1890. Penyakit ini menghancurkan pertanaman pisang Ambon “Gros Michel” (AAA) di Amerika Tengah dan Caribbean pada tahun1910-an, saat ini penyakit layu fusarium sudah banyak ditemukan di daerah tropis maupun subtropis. Fusarium oxysporum f.sp. cubense mempunyai 4 ras yaitu ras 1 menyerang kultivar pisang ambon “Gros Michel”(AAA), Maqueno (AAB), Silk (AAB), Pome (AAB ), Pisang Awak (ABB), dan hasil hibrida “I.C.2” (AAAA). Ras 2 menyerang kultivar pisang batu “Bluggoe” (ABB), dan keturunan tetraploid. Ras 3 menyerang Heliconia spp.
Foc TR4 lebih virulen dibandingkan dengan Foc STR4, Foc TR4 mampu menyerang tanaman pisang dalam kondisi stress lingkungan maupun tidak stress lingkungan, sedangkan Foc STR4 hanya menyerang dalam kondisi stress
lingkungan (Sutherland et al., 2012). STR4 akan memiliki tingkat virulensi yang lebih tinggi apabila menyerang tanaman di daerah dengan suhu dingin, stress air dan pada tanah yang miskin unsur hara (Daly et al.,2006).
3. Daur Penyakit
Fusarium oxysporum f.sp. cubense adalah jamur tular tanah (soil borne) yang dapat bertahan lama dalam tanah sebagai klamidiospora, yang terdapat banyak dalam akar-akar tanaman yang sakit. Klamidiospora ini mampu bertahan selama lebih dari 30 tahun di dalam tanah walaupun tidak terdapat tanaman inangnya. Jamur dapat bertahan pada akar-akar rumput, dan pada tanaman yang mempunyai hubungan kerabat dekat dengan pisang, misalnya Heliconia spp. (Ploetz, 1990).
Infeksi jamur terjadi melalui akar, adanya luka pada akar akan meningkatkan infeksi. Akan tetapi jamur tidak dapat menginfeksi batang atau akar-rimpang meskipun bagian ini dilukai. Nematoda (Radhopholus similis) membantu dalam proses infeksi (Hwang, 1989). Fusarium oxyporum f.sp. cubense menghasilkan enzim yang dapat mendegradasi dinding sel, di antaranya endo-polygalacturonase (pg1), exo-polygalacturonase (pgx4), pectate lyase (pl1), dan xylanase
membentuk banyak spora dalam jaringan tanaman, dan mikrokonidium dapat terangkut dalam arus transpirasi (Semangun, 2007).
Penyakit terutama menular karena perakaran tanaman sehat berhubungan dengan spora yang dilepaskan oleh tanaman sakit di dekatnya. Pemakaian bahan tanaman yang sakit juga dapat memencarkan penyakit. Jamur dapat terbawa oleh tanah yang melekat pada alat-alat pertanian. Perendaman tanah dan air pengairan dapat juga menyebabkan terjadinya pemencaran setempat (Semangun, 2007).
4. Gejala Serangan
Gejala penyakit diawali dengan perubahan warna pada tepi daun bawah menjadi berwarna kuning tua, kemudian menjadi coklat dan akhirnya mengering. Tangkai daun patah di sekeliling batang palsu, terkadang lapisan luar batang terbelah dari permukaan tanah. Gejala yang paling khas adalah gejala pada bagian dalam. Jika pangkal batang dibelah membujur, maka akan terlihat garis-garis coklat atau hitam menuju ke semua arah, dari bonggol ke atas melalui jaringan pembuluh ke pangkal daun dan tangkai. Berkas pembuluh akar biasanya tidak berubah
warnanya, namun seringkali akar tanaman sakit berwarna hitam dan membusuk (Semangun, 2007).
5. Pengendalian Penyakit Layu Fusarium
a. Sterilisasi Area Pertanaman dan Alat Pertanian
Daerah yang endemik penyakit layu fusarium dilakukan fumigasi terlebih dahulu. Bahan aktif fumigant yang dipakai salah satunya ialah methyl bromide, setelah fumigasi dilakukan, maka area pertanaman tersebut tidak boleh ditanami dengan tanaman sampai dengan 24 bulan (Ploetz & Pegg, 2000). Selanjutnya sterilisasi alat-alat pertanian yang dipakai ialah dengan cara mencuci bersih dan penggunaan disinfektan, hal ini dilakukan supaya tidak adanya inokulum yang terbawa dari alat-alat pertanian yang dipakai. Tanaman yang sakit beserta dengan tanah di sekelilingnya dibongkar dan dikeluarkan dari kebun (Semangun, 2007).
Solarisasi tanah merupakan salah satu metode kultur teknis dalam pengendalian patogen akar (Agrios, 2005). Solarisasi tanah merupakan suatu metode untuk menaikkan suhu tanah dengan cara menutup permukaan tanah menggunakan plastik mulsa transparan. Metode tersebut bekerja sesuai dengan efek green house, temperatur tanah mencapai suhu 50-60 0C pada kedalaman 10 cm. Hal tersebut sudah cukup besar dalam mengendalikan patogen tular tanah (soil borne) (Horiuchi, 1982). Solarisasi tanah dapat menurunkan inokulum patogen sehingga akan mengurangi potensi terjadinya panyakit (Agrios, 2005).
b.Penggunaan Varietas Tahan
menurunkan kerugian ekonomi yang disebabkan oleh Foc ras 4 (Wardhana et al., 2004; Ploetz & Pegg, 2000) .
c. Pengendalian Hayati
pengendalian hayati merupakan penggunaan mikroorganisme antagonis pada saat setelah atau sebelum terjadinya infeksi patogen. Mekanisme dari biokontrol organisme yaitu dalam melemahkan atau membunuh patogen tanaman dengan perlawanan yaitu memparasit patogen secara langsung, memproduksi antibiotik (toksin), dan kemampuannnya dalam kompetisi ruang dan nutrisi, produksi enzim untuk melawan komponen sel patogen, menginduksi respon ketahanan tanaman, dan produksi metabolisme tanaman dalam mensetimulasi perkecambahan spora patogen (Agrios, 2005)
Beberapa jamur yang dapat dimanfaatkan sebagai agensia hayati diantaranya Gliocladium sp., Trichoderma sp., dan Chaetonium sp. (Djatnika & Nuryani, 1992). Selain itu bakteri Pseudomonas fluorescens dapat digunakan sebagai agensia hayati, memperbaiki sistem perakaran tanaman pisang, dan diharapkan dapat mengimbas ketahanan pisang terhadap penyakit layu fusarium. Penggunaan Fusarium non-patogenik dan mikoriza vesikula arbuskula dapat digunakan dalam pengendalian hayati penyakit layu fusarium (Semangun, 2007).
d. Kultur Jaringan
menjadi tanaman lengkap. Perbanyakan tanaman melalui kultur jaringan memiliki beberapa keuntungan, yaitu diperolehnya bibit yang seragam dalam jumlah besar dan bebas penyakit sehingga meningkatkan hasil dan mencegah penyebaran penyakit (Yusnita, 2004).
C. Trichoderma spp.
1. Taksonomi dan Morfologi
Klasifikasi jamur Trichoderma harzianum menurut Alexopoulus dan Mims (1979) adalah sebagai berikut ini :
Kingdom : Mycetae
Divisi : Amastigomycota Subdivis : Deuteromycotina Kelas : Deuteromycetes Ordo : Moniliales Famili : Moniliaceae Genus : Trichoderma Species : Trichoderma spp.
Trichoderma spp. merupakan jamur Deuteromycetes dengan konidiofor tegak, bercabang banyak, agak berbentuk kerucut, dapat membentuk klamidospora. Pada umumnya koloni dalam biakan tumbuh dengan cepat, berwarna putih sampai hijau. Koloni Trichoderma spp. pada media biakan PDA tumbuh dengan cepat pada suhu 25- 30º C. Koloni ini akan berubah warna menjadi hijau tua
Susunan sel Trichoderma bersel banyak berderet membentuk benang halus yang disebut dengan hifa. Hifa pada jamur ini berbentuk pipih, bersekat, dan
bercabang-cabang membentuk anyaman yang disebut miselium. Miseliumnya dapat tumbuh dengan cepat dan dapat memproduksi berjuta-juta spora, karena sifatnya inilah Trichoderma dikatakan memiliki daya kompetitif yang tinggi. Dalam pertumbuhannya, bagian permukaan akan terlihat putih bersih, dan
bermiselium kusam. Setelah dewasa, miselium memiliki warna hijau kekuningan. Jamur ini memiliki bagian yang khas antara lain miselium berseptat, bercabang banyak, konidia spora berseptat dan cabang yang paling ujung berfungsi sebagai sterigma. Konidiofornya bercabang berbentuk verticillate. Pada bagian ujung konidiofornya tumbuh sel yang bentuknya menyerupai botol (fialida), sel ini dapat berbentuk tunggal maupun berkelompok. Konidianya berwarna hijau cerah
bergerombol membentuk menjadi seperti bola dan berkas-berkas hifa terlihat menonjol jelas di antara konidia spora. Trichoderma berkembangbiak secara aseksual dengan membentuk spora di ujung fialida atau cabang dari hifa.
T. harzianum mempunyai hifa berseptat, bercabang dan mempunyai dinding licin, tidak berwarna , diameter 1,5-12 µm. Percabangan hifa membentuk sudut siku-siku pada cabang utama. Cabang-cabang utama konidiofor berdiameter 4-5 µm dan menghasilkan banyak cabang- cabang sisi yang dapat tumbuh satu-satu tetapi sebagian besar berbentuk dalam kelompok yang agak longgar dan kemudian berkembang menjadi daerah-daerah seperti cincin. Pada ujung konidiofor
hijau suram, hijau keputihan, hijau terang atau agak kehijauan (Gandjar et al., 1999).
T. pseudokoninggii pada awalnya berwarna krem, secara bertahap berubah menjadi kehijauan, pertama di sebagian koloni, kemudian seluruh koloni. Secara mikroskopis, hifa hialin memiliki lembar sampai dengan 10 µ m. Konidiofor bercabang menyerupai piramida, bercabang di sudut kanan sebelum ujung cabang dan pada cabang di bagian bawah (Gandjar et al., 1999).
2. Peranan Trichoderma spp.
a. Trichoderma spp. sebagai Agensia Hayati
Trichoderma spp. adalah jamur tular tanah (soil borne) yang dapat diisolasi dari perakaran tanaman. Trichoderma spp. berperan sebagai agensia hayati dalam pengendalian penyakit tanama, stimulator pertumbuhan tanaman dan sebagai organisme pengurai. Trichoderma spp. mempunyai kemampuan untuk dapat menghambat pertumbuhan beberapa jamur penyebab penyakit pada tanaman antara lain Fusarium oxysporum (Herlina, 2009; Christopher et al., 2010; John et al., 2010), Colletotrichum acutatum (Stanley et al., 2004), Rigidoporus lignosus (Hutahaean & Junita, 2009), Rhizoctonia solani (Howell et al., 1999),
Colletotrichum graminicola (Harman et al., 2004), dan Phytopthora capsici
(Ahmed et al., 2000). Menurut Harman (2004a), mekanisme utama pengengendalian patogen tanaman
nutrisi dari dalam sel sehingga jamur akan mati). Trichoderma spp. menghasilkan antibiotik seperti alametichin, paracelsin, trichotoxin yang dapat menghancurkan sel jamur patogen dengan merusak permiabilitas membran sel dan enzim
chitinase, laminarinase yang dapat menyebabkan lisis dinding sel. Trichoderma spp. mempunyai kemampuan berkompetisi yang tinggi dalam memperebutkan tempat hidup dan makanan. Selanjutnya Trichoderma spp. mempunyai kemampuan melakukan interfensi hifa. Hifa Trichoderma spp. akan mengakibatkan perubahan permeabilitas dinding patogen.
b. Trichoderma spp.sebagai Dekomposer
Sebagai organisme pengurai biakan jamur, Trichoderma spp. dalam media bahan organik dapait diberikan ke areal pertanaman. Limbah organik seperti sampah dedaunan, seresah, kotoran-kotoran binatang ternak tidak bisa langsung diberikan ke tanaman. Limbah organik harus dihancurkan/dikomposkan terlebih dahulu oleh mikroba tanah menjadi unsur-unsur hara yang dapat diserap oleh tanaman. Secara alami proses pengkomposan ini memakan waktu yang sangat lama,
berkisar antara 6 bulan hingga setahun sampai bahan organik tersebut benar-benar tersedia bagi tanaman. Proses penghancuran limbah organik dapat dipercepat dengan menggunakan mikroba penghancur (decomposer) yang memilki
c. Trichoderma spp. sebagai Pengimbas Ketahanan (Induksi Ketahanan)
Induksi ketahanan lokal maupun sistemik umumnya twerjadi pada tanaman sebagai respon serangan oleh mikroorganisme patogen, kerusakan fisik, serangan serangga maupun faktor lainnya. Induksi ketahanan oleh Trichoderma spp. tidak banyak dipelajari, hal ini mungkin karena mekanisme antagonis Trichoderma spp. dapat terjadi secara langsung yaitu melalui mikoparasit dan antibiosis. Pada tanaman yang terinduksi ketahanannya akan terjadi perubahan-perubahan faktor kimia di dalam tanaman tersebut sehingga akan terjadi pengurangan gejala akibat serangan patogen. Mekanisme induksi ketahanan terjadi dengan peningkatan aktivitas jalur sikhimat, sehingga meningkatkan produksi senyawa fenol. Turunan senyawa fenol dapat bersifat racun langsung terhadap patogen sehingga berfungsi sebagai fitoaleksin (Harman, 2004a)
D. Bahan Organik
Bahan organik mencakup semua bahan yang berasal dari jaringan tanaman dan hewan, baik yang hidup maupun yang telah mati pada berbagai tahap dekomposisi (Stevenson, 1982). Di samping berpengaruh terhadap pasokan hara tanah, bahan organik juga berperan penting terhadap sifat fisik dan kimia tanah lainnya.
1. Peran Bahan Organik Terhadap Kesuburan Fisik Tanah dan Pertumbuhan Tanaman
(1) Penambahan bahan organik dapat meningkatkan populasi mikroorganisme tanah baik jamur maupun actinomycetes. Melalui pengikatan secara fisik butir-butir primer oleh miselium jamur dan actinomycetes, maka akan terbentuk agregat walaupun tanpa adanya fraksi lempung. (2) Pengikatan secara kimia butir-butir lempung melalui ikatan antara bagian–bagian positif dalam butir lempung dengan gugus negatif (karboksil) senyawa organik yang berantai panjang (polimer). (3) Pengikatan secara kimia butir-butir lempung melalui ikatan antara bagian-bagian negatif dalam lempung dengan gugusan negatif (karboksil) senyawa organik berantai panjang dengan perantaraan basa-basa Ca, Mg, Fe dan ikatan hidrogen. (4) Pengikatan secara kimia butir-butir lempung melalui ikatan antara bagian-bagian negatif dalam lempung dengan gugus positif (gugus amina, amida, dan amino) senyawa organik berantai panjang (polimer) (Seta, 1987).
Pengaruh bahan organik terhadap sifat fisika tanah yang lain adalah terhadap peningkatan porositas tanah. Porositas tanah adalah ukuran yang menunjukkan bagian tanah yang tidak terisi bahan padat tanah yang terisi oleh udara dan air. Pengaruh bahan organik terhadap peningkatan porositas tanah di samping
berkaitan dengan aerasi tanah, juga berkaitan dengan status kadar air dalam tanah. Penambahan bahan organik akan meningkatkan kemampuan menahan air
sehingga kemampuan menyediakan air tanah untuk pertumbuhan tanaman
menahan air meningkat, dan berdampak pada peningkatan ketersediaan air untuk pertumbuhan tanaman (Scholes et al., 1994).
2. Peranan Bahan Organik Terhadap Kesuburan Kimia Tanah dan Pertumbuhan Tanaman
Pengaruh bahan organik terhadap kesuburan kimia tanah antara lain
terhadap kapasitas pertukaran kation, kapasitas pertukaran anion, pH tanah, daya sangga tanah dan terhadap keharaan tanah. Penambahan bahan organik akan meningkatkan muatan negatif sehingga akan meningkatkan kapasitas tukar kation (KTK). Bahan organik memberikan konstribusi yang nyata terhadap KTK tanah. Sekitar 20–70% kapasitas tukar tanah pada umumnya bersumber pada koloid humus (contoh: Molisol), sehingga terdapat korelasi antara bahan organik dengan KTK tanah (Stevenson, 1982).
Dalam suasana sangat masam (pH rendah), hidrogen akan terikat kuat pada gugus aktifnya yang menyebabkan gugus aktif berubah menjadi bermuatan positif (COOH2+ dan OH2+), sehingga koloid-koloid yang bermuatan negatif menjadi
rendah, akibatnya KTK turun. Sebaliknya dalam suasana alkali (pH tinggi) larutan tanah banyak OH-, akibatnya terjadi pelepasan H+ dari gugus organik dan terjadi peningkatan muatan negatif (COO- dan O-), sehingga KTK meningkat (Parfit, 1980).
Pengaruh penambahan bahan organik terhadap pH tanah dapat meningkatkan atau menurunkan tergantung oleh tingkat kematangan bahan organik yang kita
dekomposisi, biasanya akan menyebabkan penurunan pH tanah, karena selama proses dekomposisi akan melepaskan asam-asam organik yang menyebabkan menurunnya pH tanah. Namun apabila diberikan pada tanah yang masam dengan kandungan Al tertukar tinggi, akan menyebabkan peningkatan pH tanah, karena asam-asam organik hasil dekomposisi akan mengikat Al membentuk senyawa komplek (khelat), sehingga Al tidak terhidrolisis lagi. Peningkatan pH tanah juga akan terjadi apabila bahan organik yang kita tambahkan telah terdekomposisi lanjut (matang), karena bahan organik yang telah termineralisasi akan melepaskan mineralnya, berupa kation-kation basa.
3. Peranan Bahan Organik Terhadap Biologi Tanah dan Pertumbuhan Tanaman
Bahan organik merupakan sumber energi bagi fauna-makro dan fauna-mikro tanah. Penambahan bahan organik dalam tanah akan menyebabkan aktivitas dan populasi mikrobiologi dalam tanah meningkat, terutama yang berkaitan dengan aktivitas dekomposisi dan mineralisasi bahan organik. Beberapa mikroorganisme yang beperan dalam dekomposisi bahan organik adalah fungi, bakteri dan
bahan organik menyediakan energi untuk tumbuh dan bahan organik memberikan karbon sebagai sumber energi.
Pengaruh positif yang lain dari penambahan bahan organik adalah pengaruhnya pada pertumbuhan tanaman. Terdapat senyawa yang mempunyai pengaruh terhadap aktivitas biologis yang ditemukan di dalam tanah adalah senyawa perangsang pertumbuhan (auxin), dan vitamin (Stevenson, 1982). Senyawa-senyawa ini di dalam tanah berasal dari eksudat tanaman, pupuk kandang, kompos, sisa tanaman dan juga berasal dari hasil aktivitas mikrobia dalam tanah. Di samping itu, diindikasikan asam organik dengan berat molekul rendah,
III. BAHAN DAN METODE
A. Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di kebun PT NTF (Nusantara Tropical Farm) Way Jepara, Lampung Timur dan Laboratorium Penyakit Tumbuhan, Bidang Proteksi Tanaman UNILA dari November 2012 sampai Juni 2013.
B. Alat dan Bahan
Alat yang digunakan dalam penelitian ini antara lain cawan petri, tabung reaksi, labu erlenmeyer, mikroskop, gelas ukur, bor gabus, jarum ose, nampan plastik, alumunium foil, plastik penutup, plastik tahan panas, cutter, gelas preparat, gelas penutup, dan spidol permanen. Bahan yang digunakan antara lain ialah bahan tanaman (tanaman pisang Cavendish klon CJ30, umur 2 minggu dan dua bulan yang diproduksi oleh PT NTF), biakan Fusarium oxysporum f.sp. ras 4 (TR4), sampel tanah, bahan organik (kulit singkong, jerami padi, kompos), alkohol 70% dan 90%, media kultur jamur (PDA-L dan PDA-RSC).
C. Metode Penelitian
dilakukan terhadap tanah di sekitar rizosfer tanaman pisang sehat yaitu sebanyak lima tanaman. Uji efikasi Trichoderma spp. terhadap penekanan perkembangan penyakit layu fusarium disusun dalam rancangan acak kelompok lengkap dengan 12 perlakuan dan empat ulangan, setiap ulangan terdiri atas 10 tanaman.
Perlakuan:
(1) F0T0O0 = bibit pisang tanpa inokulasi Foc dan Trichoderma
(2) FT0O0 = bibit pisang diinokulasi Foc, tanpa Trichoderma, tanpa bahan
organik
(3) FT1O0 = bibit pisang diinokulasi Foc + Trichoderma di pembibitan
(4) FT0O1 = bibit pisang diinokulasi Foc + jerami padi
(5) FT0O2 = bibit pisang diinokulasi Foc + kulit singkong
(6) FT0O3 = bibit pisang diinokulasi Foc + kompos
(7) FT1O1 = bibit pisang diinokulasi Trichoderma di pembibitan + jerami padi +
Foc
(8) FT1O2 = bibit pisang diinokulasi Trichoderma di pembibitan + kulit
singkong + Foc
(9) FT1O3 = bibit pisang diinokulasi Trichoderma di pembibitan + kompos + Foc
(10) FT2O1 = bibit pisang diinokulasi Trichoderma di media tanah + jerami padi
+ Foc
(11) FT2O2 = bibit pisang diinokulasi Trichoderma di media tanah + kulit
singkong + Foc
(12) FT2O3 = bibit pisang diinokulasi Trichoderma di media tanah + kompos +
D. Pelaksanaan Penelitian
1. Skrining Trichoderma spp.
a. Isolasi Trichoderma spp. dari Tanah Kebun Pisang
Tanah diambil dari rizosfer tanaman pisang yang tidak bergejala layu fusarium di sekeliling tanaman pisang yang bergejala layu fusarium di kebun pisang PT NTF Way Jepara, Lampung Timur. Pengambilan sampel tanah dilakukan pada tiga tanaman pisang, masing-masing diambil 1 kg tanah yaitu pada empat titik yang berjarak 20 cm dari bonggol tanaman pisang sebanyak 250 g tanah, lalu
dimasukkan ke dalam plastik dan diaduk. Di laboratorium, Trichoderma spp. diisolasi dengan teknik pengenceran (dilution plate technique) menurut Johnson & Curl (1972).
b. Identifikasi Trichoderma spp.
Hasil isolasi jamur yang berupa biakan murni diidentifikasi berdasarkan morfologi mikroskopisnya. Identifikasi sampai ke tingkat spesies dilakukan menurut Rifai (1969) dalam Domsch et al. (1993). Identifikasi dilakukan dengan memperhatikan bentuk miselium, konidiospor, filiad dan konidia dari
Trichoderma spp. di bawah mikroskop.
c. Penyiapan Biakan F. oxysporum f.sp. cubense (Foc)
F. oxysporum diisolasi dari potongan bonggol dan batang tanaman pisang yang menunjukkan gejala layu fusarium di perkebunan PT NTF Way Jepara, Lampung Timur. Isolasi dilakukan dengan cara memotong jaringan tanaman di antara yang sakit dan sehat dengan ukuran kira-kira 0,5 x 0,5 cm atau lebih kecil, lalu
potongan tersebut dicelupkan dalam larutan NaOCl 0,525 % selama 1-2 menit dan dibilas dengan aquades steril. Dengan menggunakan pinset yang sudah disterilkan, potongan-potongan tersebut ditiriskan dengan cara meletakkannya di atas kertas tissu steril. Potongan-potongan jaringan tanaman diletakkan ke dalam satu cawan petri yang telah berisi media PDA-L. Pengamatan dilakukan 3-5 hari setelah infestasi. Isolat Foc yang ditemukan kemudian ditransfer ke media PDA-L dan dimurnikan dengan teknik ujung hifa (hyphal tips) (Agrios, 2005).
Setelah muncul gejala layu fusarium, patogen direisolasi dari jaringan tanaman sakit (Agrios, 2005).
d. Seleksi Trichoderma spp. melalui Uji Antagonisme
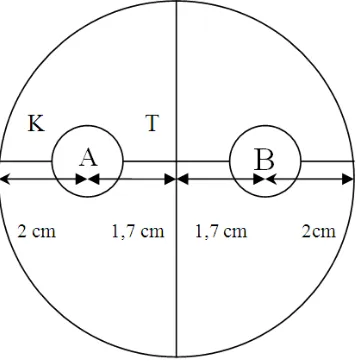
[image:35.595.207.387.482.663.2]Biakan Trichoderma spp.yang diperoleh kemudian diseleksi berdasarkan uji daya antagonismenya terhadap Foc. Uji antagonisme dilakukan dengan metode kultur ganda yaitu pada satu cawan petri ditumbuhkan dua jamur secara berlawanan. Cawan petri dibalik dan pada bagian belakangnya dibuat garis yang saling berpotongan pada tengah cawan petri dengan menggunakan spidol permanen. Kemudian pada garis tersebut ditentukan dua titik yang berjarak 2 cm dari tepi cawan secara berlawanan. Titik-titik tersebut digunakan sebagai tempat infestasi cuplikan jamur yang berdiameter 0,8 cm (Gambar 1). Trichoderma spp. dan Foc yang masing-masing berumur 3 hari diinfestasikan pada titik-titik tersebut kemudian diletakkan pada nampan dan diinkubasi dalam suhu ruang.
Gambar 1. Tata letak jamur Trichoderma spp. dan Foc pada uji antagonisme dalam cawan petri
e. Pengamatan
Pengamatan dilakukan setiap hari sampai koloni jamur memenuhi cawan petri. Peubah yang diamati dalam percobaan ini adalah persentase penghambatan pertumbuhan Foc oleh Trichoderma dengan cara mengukur jari-jari koloni Foc. Nilai penghambatan pertumbuhan dihitung dengan rumus :
P = K−T
K x 100%
Keterangan :
P = Persentase penghambatan Foc(%)
K = Jari-jari koloni Foc kontrol (arah berlawanan dengan koloni Trichoderma spp.)
T = Jari-jari koloni Foc hasil perlakuan (ke arah koloni Trichoderma spp.) (Agrios, 2005).
2. Uji Efikasi Trichoderma viride terhadap Penekanan Perkembangan Penyakit Layu Fusarium
a. Penyiapan Starter Trichoderma viride
dalam plastik tahan panas lalu disterilkan dalam otoklaf selama 1 jam pada tekanan 1,5 atm dengan suhu 121 0C. Miselium T. viride yang berumur 4 hari dimasukkan ke dalam masing-masing media tersebut dengan menggunakan bor gabus dengan lima lubang, kemudian seluruh media diinkubasi selama 14 hari disertai dengan penghomogenan setelah tampak pertumbuhan jamur (Ivayani, 2010).
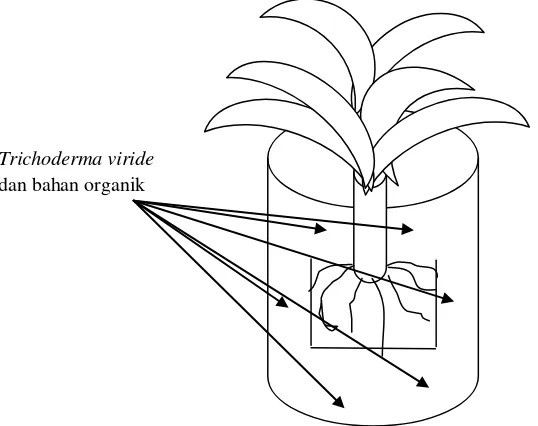
b. Perbanyakan dan Infestasi Campuran Trichoderma viride dengan Bahan Organik
Gambar 2. Aplikasi Trichodermaviride di pembibitan. Sebanyak 10 g preparasi T. viride diaplikasikan di rizosfer tanaman pisang yang berumur 2 minggu.
Gambar 3. Aplikasi bahan organik di media tanah. Sebanyak 100 g bahan organik diaplikasikan di rizosfer tanaman pisang yang berumur 2 bulan (bibit pisang berumur 2 bulan)
bahan organik dalam media tanah
Trichoderma viride dan bahan organik
[image:38.595.142.411.521.734.2]c. Perbanyakan dan Infestasi Fusarium oxysporum f.sp. cubense (Foc)
Isolat berasal dari kultur murni pada media agar miring potato dextrose agar (PDA) dalam tabung reaksi, kemudian dilakukan peremajaan pada media PDA dalam cawan petri. Foc diperbanyak dalam medium beras sebagai bahan
inokulum untuk diinokulasikan pada bibit pisang. Inokulasi Foc dilakukan setelah tanaman yang berumur dua bulan dipindahkan ke media tanah yaitu dengan membuat empat lubang disekeliling tanaman sedalam 5 cm, dengan jarak 2 cm dari pangkal tanaman. Setelah itu, biakan Foc dalam media beras diinokulasikan ke dalam lubang tersebut sebanyak 10 g/tanaman, masing-masing 2,5 g/lubang dan ditimbun kembali dengan tanah (Nurbailis & Martinus, 2011).
d. Persiapan Tanaman dan Media Tanam
Percobaan kedua ini dikondisikan semilapang. Tanaman pisang ditanam di dalam polybag berukuran 10 kg dengan media tanam 10 kg tanah dan diberikan pupuk sesuai dengan teknik budidaya di PT NTF. Bibit pisang yang dipakai ialah bibit pisang Cavendish klon CJ30 yang berumur dua minggu dan dua bulan hasil kultur jaringan di PT NTF (NTF, 2012).
e. Pengamatan
(1) Intensitas Penyakit
(a) Keterjadian Penyakit Layu Fusarium Pada Tanaman Pisang
Pengamatan keterjadian penyakit dilakukan berdasarkan masa inkubasinya yaitu munculnya gejala pertama setelah inokulasi Foc sampai tanaman berumur 16 minggu. Keterjadian penyakit (Disease incidence) pada daun dan bonggol dihitung menggunakan rumus:
KtP = n
Nx 100%
Keterangan:
KtP = Keterjadian penyakit
n = Jumlah tanaman yang sakit/ bergejala sakit N = Jumlah tanaman yang diamati
(b) Keparahan Penyakit Layu Fusarium Pada Tanaman Pisang
Tabel 1. Skor penyakit pada daun tanaman pisang
Skor Keterangan (gejala)
1 Tidak ada infeksi (tanaman sehat)
2 Daun sedikit menguning (<50% jumlah daun)
3 Sebagian besar daun menguning (>50% jumlah daun) 4 Semua daun menguning
5 Tanaman mati
Tabel 2. Skor penyakit pada bonggol tanaman pisang
Skor Keterangan (gejala)
1 Tidak ada bintik hitam pada jaringan bonggol 2 Ada beberapa bintik hitam pada bonggol
3 Ada bintik hitam menutupi <1/3 dari jaringan bonggol 4 Ada bintik hitam menutupi 1/3 – 2/3 dari jaringan bonggol 5 Ada bintik hitam menutupi >2/3 dari jaringan bonggol 6 Terdapat bintik hitam pada seluruh jaringan bonggol
Keparahan penyakit (Disease severity) pada daun dan bonggol dihitung menggunakan rumus:
KpP = ∑(nilai kategori x jumlah tanaman tiap kategori serangan)
(jumlah tanaman yang diamati x skor tertinggi) x 100%
(2) Kepadatan Propagul Trichoderma viride dan Foc
Penghitungan kepadatan propaguladilakukan dengan metode pengenceran bertingkat. Media yang digunakan ialah media potato dextrose agar rosebengal streptomycin (PDA-RSC). Media PDA-RSC ini diperoleh dengan cara
[image:41.595.109.489.290.431.2]suhu media turun menjadi ±480C lalu 60 mg streptomycin dan 60 mg chloramfenicol dimasukan ke dalam media tersebut.
Pengamatan terhadap kepadatan propagul Trichoderma viride. dan Foc dilakukan pada 6 dan 12 minggu setelah inokulasi (msi). Pengamatan dilakukan pada seluruh 2 ulangan dan masing-masing ulangan terdiri dari dua unit percobaan. Tanah di sekitar rizosfer tanaman diambil sebanyak 100 g yaitu pada empat titik yang berjarak 10 cm dari bonggol tanaman pisang sebanyak 25 g tanah, lalu dimasukkan ke dalam plastik dan diaduk. Masing-masing sampel tanah diambil sebanyak 10 g tanah dan dimasukkan ke dalam labu erlenmeyer, diaduk dengan 90 ml akuades steril selama 30 menit. Dengan menggunakan mikropipet,
sebanyak 1 ml suspensi tanah tersebut dimasukkan ke dalam labu lain yang berisi 99 ml akuades steril untuk mendapatkan pengenceran 10-3. Dengan cara serupa dibuat suspensi sampai pengenceran 10-5. Sebanyak 0,5 ml suspensi hasil pengenceran disebar-ratakan pada cawan petri yang mengandung PDA-R kemudian diinkubasikan selama 3-5 hari. Penghitungan propagula dilakukan dengan menghitung koloni yang muncul dihitung dengan menggunakan hand counter (Agrios, 2005).
(3) Pertumbuhan dan Perkembangan Tanaman Pisang
E. Analisis Data
V. SIMPULAN DAN SARAN
A. Simpulan
Berdasarkan hasil pengamatan maka dapat disimpulkan, bahwa:
1. Terdapat lima isolat Trichoderma spp. hasil isolasi dari tanah, dan yang memiliki daya antagonis tertinggi pada uji in vitro yaitu isolat
Trichoderma viride.
2. Keterjadian penyakit layu fusarium tertinggi terdapat pada perlakuan FT0O0 (tanpa pengendalian) sebesar 100% dan aplikasi dengan bahan
organik saja sebesar 78.33% . Aplikasi T. viride (FT1O0) mampu menekan
keterjadian penyakit sebesar 65%, dan keparahan penyakit sebesar 34,16% pada 16 msi.
3. Aplikasi T. viride di pembibitan menghasilkan keterjadian penyakit layu fusarium yang lebih rendah dibandingkan dengan aplikasi T. viride di media tanah.
4. Aplikasi T. viride saja di media pembibitan menghasilkan keterjadian penyakit yang lebih rendah dibandingkan dengan kombinasi aplikasi T. viride bersamaan dengan bahan organik.
5. Jenis bahan organik tidak berpengaruh nyata terhadap keterjadian dan keparahan penyakit layu fusarium.
T. viride pada media di pembibitan, sedangkan pada 12 msi kepadatan propagul perlakuan FT1O0 tidak berbeda nyata dengan perlakuan
kombinasi T. viride dan bahan organik.
7. Pertumbuhan tanaman pisang pada perlakuan T. viride saja atau kombinasi T. viride dan bahan organik lebih baik dibandingkan dengan perlakuan bahan organik saja, yang ditunjukkan oleh variabel tinggi tanaman, jumlah daun, dan lingkar batang tanaman pisang.
B. Saran
Berdasarkan hasil penelitian dapat disarankan agar mengulang penelitian ini dengan penggunaan bahan organik jenis lainnya dan variasi jumlah bahan organik yang digunakan, penambahan waktu pengamatan yaitu sampai panen,
penambahan waktu aplikasi Trichoderma spp. yaitu pada media pembibitan dan media tanah, penelitian dilakukan di habitat alaminya, yaitu di area pertanaman bukan di polybag, sebelum aplikasi bahan organik harus terlebih dahulu dianalisis C/N rationya dan metode aplikasi bahan organik dan Trichoderma spp. yang tepat sehingga bahan organik dan Trichoderma spp dapat berperan sebagaimana
DAFTAR PUSTAKA
Agrios, G.N. 2005. Plant Pathology. 5th edition. Elseivier Academic Press. USA. Ahmed, A. S., Sanchez, C. P. & Candela, M. E.. 2000. Evaluation of induction of systemic resistance in pepper plants (Capsicum annuum) to Phytopthora capsici using Trichoderma harzianum and its relation with capsidiol accumulation. Eur. J. Plant Pathol 106 (9): 817–824.
Alexopoulus, C. J., & Mims, C. W. 1979. Intoductory Mycology 3rd edition. Jhon Wiley and Sons, New York. Pp. 567.
Atmojo, S.W. 2003. Peranan Bahan organik Terhadap Kesuburan Tanah Dan Pengelolaannya. Pidato Pengukuhan Guru Besar Ilmu Kesuburan Tanah Fakultas Pertanian Universitas Sebelas Maret.Sebelas University Press. Surakarta.
Avivi, S.S., Ikrawati, 2004. Mikropropagasi pisang melalui teknik kultur jaringan tanaman. Ilmu Pertanian 11: 27-34.
Barakat, R.M., & Al-Masri, . 2009. Trichoderma harzianum in combination with sheep manure amendment enhances soil suppressiveness of Fusarium wilt of tomato. Phytopathol 48: 385–395.
Badan Pusat Statistik. 2011. Production of Fruit in Indonesia. www.BPS.go.id. Christopher, D.J., Suthin. R.U., & Udhayakumar, R. 2010. Role of defense
enzymes activity in tomato as induced by Trichoderma virens against Fusarium wilt caused by Fusarium oxysporum f sp. lycopersici.
Journal of Biopesticides 3(1): 158 – 162.
Daly, A., Walduck, G., Darwin. 2006. Fusarium Wilt of Bananas (Panama Disease) (Fusarium oxysporum f. sp. cubense). Northern Territory Government. Australia.
Dennis, C. & Webster, J. 1971. Antagonistic Properties Of Spesies Groups Of Trichoderma III. Hypal Interaction. Trans Br. Mycol. Soc. 57(3): 363-369.
Dinas Pertanian Lampung. 2006. Tanaman Perkebunan. www.distanph. lampung.go.id. Diakses pada tanggal 15 Juni 2012.
Djatmiko, H.A. & Rohadi, S.S. 1997. Efektivitas Trichoderma harzianum hasil perbanyakan dalam sekam padi dan bekatul terhadap patogenesitas Plasmodiophora brassicae pada tanah latosol dan andosol. Majalah Ilmiah UNSOED 23(2): 10-22.
Djatnika, I., & Nuryani, W. 1992. Pengendalian penyakit layu pada pisang dengan cara biologi. Pros. Sem. Pisang Sebagai Komoditas Andalan. Segunung, 5 November 1992: 29-32.
Djonovic, S., Vargas, W.A., Kolomiets, M.V., Horndeski, M.,. Wiest, A., & Kenerley, C.M.,. 2007. A proteinaceous elicitor sm1 from the beneficial fungus Fusarium oxysporum f. sp. adzuki and Pythium arrhenomanes and as a promoter of soybean. Crop Protection 29: 1452-1459.
Domsch, K.H., Gams, W., Anderson, T.H. 1993. Compendium of Soil Fungi. Volume 1. IHW-Verlag. Regensburg. Jerman
Gandjar, I., Robert, S. A., Iman, A., & Vermeulen, T. K. V. 1999. Pengenalan Kapang Tropik. Obor Indonesia. Jakarta.
Ginting, C., Maryono T. 2011. Efikasi Trichoderma harzianum dengan berbagai bahan organik dalam pengendalian penyakit busuk pangkal batang pada lada. J. HPT Tropika 11(2): 12-21.
Ginting, C., Maryono T. 2012. Penurunan keparahan penyakit busuk pangkal batang pada lada akibat aplikasi bahan organik dan Trichoderma harzianum. J. HPT Tropika 12(2): 32-41.
Harman, G.E., Petzoldt, R., Comis, A., & Chen, J. 2004. Interactions between Trichoderma harzianum strain T22 and Maize inbred line Mo17 and effects of these interactions on diseases caused by Pythium ultimum and Colletotrichum graminicola. Phytopathology 94(2):147-53.
Harman, G.E., Howell, C.R., Chet, I. & Lorito, M. 2004a. Trichoderma spesies- opportunistic, avirulent plant symbionts. Microbiology 2: 43-56.
Herlina, L. 2009. Potensi Trichoderma harzianum sebagai Biofungisida pada Tanaman Tomat. BIOSAINTIFIKA 1(1): 62-69.
Howell, C. R., Hanson, L. E., Stipanovic, R. D., & Puckhaber, L. S. 1999.
solani by seed treatment with Trichoderma virens. Phytopathology 90: 248–252.
Horiuchi S., Hori, M., Takahashi, S. & Shimizu, K. 1982. Factors responsible for development of clubroot suppressing effect in soil solarization. Agrric. 20: 25-48.
Hutahaean, A. & Junita. 2009. Uji efektifitas beberapa spesies Trichoderma spp. untuk mengendalikan penyakit jamur akar putih (Rigidoporus microporus [Swartz : fr.] van Ov) pada tanaman karet (Hevea brasiliensis Muell. Arg) di pembibitan. University of Sumatera Utara Institutional Repository. Hwang, S. C., & Ko, W. H. 1989. Improvement of fruit quality of Cavendish
banana mutants resistant to race 4 of Fusarium oxysporum f. sp. cubense. Plant Prot. Bul. 31:131-138.
Ismujiyanto, S. B., Aeny, T.N. & Ginting, C. 1996. Pengaruh cendawan antagonis Trichoderma viride dan kompos terhadap intensitas serangan Fusarium oxysporum schl. f. sp. Vanillae (tucker) gordon penyebab penyakit busuk batang pada tanaman panili (Vanilla plafolia Andrews). JPP 8(8): 85-90.
Isroi, M. 2008, Kompos. Balai Penelitian Bioteknologi Perkebunan. Indonesia Bogor.
Ivayani, 2010. Uji Beberapa Jenis Bahan Organik Starter dalam Perbanyakan Trichoderma harzianum sebagai Agensia Pengendalian Phytopthora capsici. Skripsi. Universitas Lampung. Bandar lampung.
John, R.P., Tyagi, R.D., Prévost, D. D., Brar, S.K., Pouleur, S., & Surampalli, R.Y.2010. Mycoparasitic Trichoderma viride as a biocontrol agent against Trichoderma virens is required for induced systemic resistance in maize. Plant Physiology 145: 875–889.
Johnson, L.F. & Curl, E.R. 1972. Methods For Research On The Ecology of Soilborne Plant Pathogens. Burgess Publ. Co. USA.
Nurbailis & Martinus. 2011. Pemanfaatan bahan organik sebagai pembawa untuk peningkatan kepadatan populasi Trichoderma viridae pada rizosfer pisang dan pengaruhnya terhadap penyakit layu Fusarium. J. HPT Tropika 11(2): 177-184.
Ploetz, R.C. 1990. Vascular wilt disease: Panama disease of bananas. In Fusarium Wilt Banana. APS Press, St. Paul.
Rismunandar. 1990. Bertanam Pisang. C.V. Sinar Baru. Bandung.
Robinson, J.H.& Sauco, V.G. 2010. Banana and Plantains. 2nd Editition. CABI North America Office. USA.
Scholes, M.C., Swift, O.W., Heal, P.A., Sanchez, J.S.I. & Dudal, R. 1994. Soil Fertility Research in Response to Demand for Sustainability. in the Biological Managemant of Tropical Soil Fertility (Eds Woomer, Pl. and Swift, MJ.) John Wiley & Sons. New York.
Semangun. H. 2007. Penyakit-Penyakit Tanaman Hortikultura di Indonesia. Edisi Kedua. Gadjah Mada University Press. Yogyakarta.
Seta, A.K. 1987. Konservasi Sumberdaya Tanah. Kalam Mulia. Jakarta.
Setyorini, Saraswati, R., & Anwar, E.K. 2006. Kompos. BPTP. Yogyakarta. Setyowati, Bustamam, H., & Derita, M. 2003. Penurunan penyakit busuk akar dan
pertumbuhan gulma pada tanaman selada yang dipupuk mikroba. Jurnal Ilmu-Ilmu Pertanian Indonesia 5(2): 48-57.
Sinaga, M.S. 1989. Potensi Gliocladium spp. sebagai agen pengendalian hayati beberapa cendawan patogenik tumbuhan yang bersifat soil borne. Laporan penelitian SPP/DPP FAPERTA IPB 1987/1988. Jurusan Hama dan Penyakit Tumbuhan . Fakultas Pertaian Institut Pertanian Bogor. Soesanto, L. & Rahayuniati, R.F. 2009. Pengimbasan ketahanan bibit pisang
ambon kuning terhadap penyakit layu fusarium dengan beberapa jamur antagonis. J. HPT Tropika 9(2): 130-140.
Stevenson, F.T. .1982. Humus Chemistry. John Wiley and Sons, New York. Stanley, F., Dror, M., Inna, K., Olga, Z., Aida & Marcel, M. 2004. Trichoderma
biocontrol of Colletotrichum acutatum and Botrytis cinerea and survival in strawberry. European Journal of Plant Pathology 110(4): 361-370.
Stover, R.H. 1990. Fusarium Wilt of Banana: Some History and Current Status of the Disease. APS Press, St. Paul. USA.
Suhardiman, P. 1997. Budi Daya Pisang Cavendish. Kanisius. Yogyakarta. Sutherland, R., Viljoen, A., Myburg, A.A. & Berg, N.V.D. 2012. Pathogenicity
associated genes in Fusarium oxysporum f. sp. cubense race 4. South African Journal of Science 109: 1-10.
Tian, G., L. Brussard, B.T., Kang, & Swift, M.J. 1997. Soil fauna- decomposition of plant residues under contreined environmental and residue quality condition. In Driven by Nature Plant Litter Quality and
Decomposition. (Eds. Cadisch, G. & Giller, K.E.). Wey College, University of London, UK.
Ting, A.S.Y., Mah, S.W., & Tee, C.S. 2010. Identification of volatile
metabolites from fungal endophytes with biocontrol potential towards Fusarium oxysporum f. sp. cubense Race 4. American Journal of
Agricultural and Biological Sciences 5(2): 177-182.
Tjitrosoepomo, G. 1988. Taksonomi Tumbuhan (Spermathopyta). Universitas Gadjah Mada. Yogyakarta.
Vey, A., Hoagland, R.E & Butt T.M. 2001.Toxic metabolites of fungal biocontrol agents. Fungi as Biocontrol Agents: Progress, Problems and Potential. Butt T.M, Jackson C and N, eds. CAB International, Bristol. USA.
Wardhana, R.A., Nugroho, H., & Loekito, S. 2004. Uji ketahanan beberapa
tanaman pisang klon Cavendish dan fluktuasi intensitas serangan Fusarium oxysporum f.sp. cubense (FOC) terhadap tanaman pisang Cavendish klon GCTCV 119. Simp. Nas. I tentang Fusarium. Purwokerto, Agustus 2004. Weller, D.M., Raaijmakers, J.M., Gardener, B.B.M., & Thomashow, L.S. 2002.
Microbial populations responsible for spesific soil suppressivenes to plant pathogens. Phytopathol 40: 309-348.