ABSTRACT
SYNTHESIS AND CHARACTERIZATION OF ZrO2-CuO COMPOSITES USING SOL GEL AS A FUNCTION OF TIME
By
NEVI YANTI LUBIS
In this study, composites ZrO2-CuO were synthesized from ZrCl4 and Cu(NO3)2 using sol-gel technique with the focus on the effect of stiring time on microstruktur of the sample. Characterization of the sampel were carried out using the techniques of XRD and SEM after the samples subjected to sintering temperature of 700℃. The results obtained clearly indicated the significant effect of processing time on the characteristic of the samples.
ABSTRAK
SINTESIS DAN KARAKTERISASI KOMPOSIT ZrO2-CuO DENGAN
METODE SOL GEL SEBAGAI FUNGSI WAKTU
Oleh Nevi Yanti Lubis
Telah dilakukan sintesis dan karakterisasi ZrO2-CuO dengan metode sol-gel antara campuran zirkonium klorida (ZrCl4) dan Cu(NO3)2. Desain mikrostruktur dilakukan dengan variasi waktu stirrer proses sol-gel yaitu 7, 8, 9, 10, 11 dan 12
jam. Karakterisasi dilakukan dengan difraksi sinar-X (XRD), scanning electron
microscopy (SEM). Struktur komposit ZrO2-CuO yang diperoleh adalah
zirkonium baddeleyit dan tenorit (CuO) yang masih didominasi fasa amorf yang dikalsinasi pada temperatur 700℃. Perubahan mikrostruktur jelas terlihat pada sampel sebagai fungsi waktu. Waktu proses 12 jam pada sampel dapat membuat mikrostruktur yang semakin kecil sekalipun masih ada aglomerasi yang berukuran besar.
SINTESIS DAN KARAKTERISASI KOMPOSIT ZrO2-CuO DENGAN
METODE SOL GEL SEBAGAI FUNGSI WAKTU
Oleh
NEVI YANTI LUBIS
Skripsi
Sebagai Salah Satu Syarat untuk Memperoleh Gelar SARJANA SAINS
Pada
Jurusan Fisika
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
SINTESIS DAN KARAKTERISASI KOMPOSIT ZrO2-CuO DENGAN
METODE SOL GEL SEBAGAI FUNGSI WAKTU
(SKRIPSI)
Oleh
NEVI YANTI LUBIS
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
40
DAFTAR PUSTAKA
Amista, P., Cesari, M., Montenero, A., Gnappi, G., and Lan. 1995. Crystallisation Behavior in the System MgO-Al2O3-SiO2. Journal Non Crystalline Solid. Vol. 192. Page 529-533.
Anonim A. 2012. http://en.wikipedia.org/wiki/Zirconium_dioxide. Diakses tanggal 14 Febuari 2012.
Anonim B. 2012. http://id.wikipedia.org/wiki/Zirkonia_kubik. Diakses pada tanggal 14 Febuari 2012.
Anonim C. 2012. http://id.wikipedia.org/wiki/komposit. Diakses pada tanggal 14 Desember 2012.
Anonim D. 2012. http://id.wikipedia.org/wiki/zirkonium klorida. Diakses pada tanggal 14 Desember 2012.
Anonim E. 2012. http://id.wikipedia.org/wiki/komposit. Diakses pada tanggal 14 Desember 2012.
Chang, J. P., You. L., and Karen. C. 2001. Rapid Thermal Chemical Vapor Deposition of Zirconium Oxide for Metal-Oxide-Semiconductor Field Effect Transistor Application. Journal of Vacuum Science & Technology.
Vol. 19. Hal. 1782–1787.
Cullity, B. D, and Stock, S. R. 1978. Elements of X-Ray Diffraction.
Addison-Wesley Publishing Company, Inc. New Jersey. USA. Hal. 10, 72.
Evans, A. G dan Cannon, R. M. 1986. Toughening of Brittle Solids by Martensitic Transformations. Acta Mettalurgica. Vol. 34. Hal. 761.
Elinso and Petrov. 1960. Introduction to X-Ray Diffraction, for EPS400-001.
Spring Company. Inc. p:3-86.
Fatimah, Is. 2009. Peningkatan Aktivitas Katalitiktik TiO2 dan ZrO2 Melalui
Pengembanan Pada Matriks Al2O3 Montmorillonit. Universitas Gadjah
Mada. Yogyakarta.
41
Fernandes. 2011. Makalah Sintesis Nanopartikel. Padang. Program Studi Kimia
Pascasarjana Universitas. Andalas
Forsyth, J. B and Hull, S. 1991. The Effect of Hydrostatic Pressure on the Ambient Temperature Structure of CuO. J Phys Condens. Vol. 3. Hal.
5257-5261.
Gradzielski .M. 2005. Microstructural Modificatiuntions of Copper Zinc Oxide Catalyst as a Function of Precipitate Ageing. Berlin. Vol 23. Hal 83-85.
Hassan, P and Chan, R. W. 1992. Materials Science and Technology, Characterization of Materials. Part I. Vol. 2A. Germany. Hal 233-236.
Ismunandar. 2006. Padatan Oksida Logam Struktur, Sintesis dan Sifat-Sifatnya.
Penerbit ITB. Bandung. Hal 126, 144.
Koffyberg, F. P and Benko, F. A. 1982. A Photoelectrochemical Determination of The Position of The Conduction and Valence Band Edges of p-type CuO.
J. Appl. Phys. Vol. 53. Hal. 1173.
Lutterotti, L and Scardi, P. 1990. Simultaneous Structure and Size-Strain Refinement by The Rietveld Method. J Appl Crystallography. Vol. 23 Hal
246-252.
Mastalir, A., Frank, B., Szizybalski A., Soerijanto, H., Deshpande, A., Niederberger, M., Schomacker, R., Schlogl, R., and Ressler, T. Steam Reforming of Methanol over CuO/ZrO2/CeO2 Catalysts A Kinetic Study.
J.Catal. Vol. 230. Hal. 464-470.
Ozawa and Kang. 2004. Balls and Stick : Easy-to-Use Structure Visualisasi and Animation Creating Program. J Appl. Cryst. 37. Page. 679.
Rahaman, M. N. 1995. Ceramics Processing and Sintering. Vol. 210. Hal
214-219.
Reed, S. J. B. 1993. Electron Microprobe Analysis and Scanning Electron Microscopy in Geology. Combridge University Press. Florida. Hal 23-24.
Ricci A, C. M. N and Maretti, L. 2003. TiO2-Promotedmineralization of Organic Sunscreens in Water Suspension and Sodium Dodecyl Sulfate Micelles Photochem. Photobiol Science. Vol. 2. Hal.487–492.
Smith, D. K and Newkrik, H. K. 1965. Crystal Structure of Baddeleyite (monoclinic ZrO2) and Its Relation to The Polymorphism of ZrO2. Acta crystallography. Vol. 18.Hal. 982.
Smith, W. F. 1990. Material Science and Engirneering. University of Central
42
Simbolon, Masduki, dan Aryadi. 2000. Penentuan Unsur-Unsur Tak Murnian di dalam Zirkonia Oksida dengan Metode Spektrografi Emisi. Prosiding Presentasi Ilmiah Daur Bahan Bakar Nuklir V P2TBDU dan P2BGDN-BATAN. Jakrta. Page. 639-646.
Soedojo, P. 2004. Fisika Dasar. Penerbit Andi. Yogyakarta. Hal 285, 286.
Tunell, G., Ponsjak dan Ksanda. Identification of The Copper Ore Minerals by Means of X-Rays Powder Diffraction Patterns. Zeit Krist. Vol. 90. Hal.
138-139.
Veda, R., Mahesh, B., Srinivas, D., and Ramaswamy, A. V. 2004. Structural and Spectral Features of Nano-crystalline Copper-stabilized Zirconia.
Catalysis Today. Vol. 97. Hal. 63-70.
Vahidshad, Y. Abdizadeh, H. Baharvandi, H. R. and Akbaribaseri, M. 2008. Calcinations Temperature and Structure of CuO-ZrO2 Nano Particle .
International Journal of Modern Physics. Vol. 22. Hal 18-19 and
3201-3209.
Widodo, S. 2010. Teknologi Sol-Gel pada Pembuatan Nano kristalin Metal Oksida untuk Aplikasi Sensor Gas. Seminar Rekayasa Kimia dan Proses. ISSN: 1411-4216. P. 1-8.
Zulfikar, M. A. Mohammad, A. W. Khadum., A. A. and Hilal. N. 2006. Synthesis and Characterizationof Novel Porous PMMA/SiO2.J.
Judul skripsi : SINTESIS DAN KARAKTERISASI KOMPOSIT
ZrO2-CuO DENGAN METODE SOL GEL SEBAGAI
FUNGSI WAKTU
Nama Mahasiswa : NEVI YANTI LUBIS
NPM : 0717041050
Jurusan : Fisika
Fakultas : Matematika dan Ilmu Pengetahuan Alam
MENYETUJUI 1. Dosen Pembimbing
Posman Manurung, Ph.D. Wasinton Simanjuntak, Ph.D.
NIP. 19590308 199103 1 001 NIP. 19590706 198811 1 001
2. Ketua Jurusan Fisika
KATA PENGANTAR
Assalammu’alaikkum Wr.Wb.
Puji syukur penulis panjatkan kehadirat Allah SWT karena atas karunianyalah yang tak pernah terbatas sehingga penulis dapat menyelesaikan skripsi dengan
judul “Sintesis dan Karakterisasi Komposit ZrO2-CuO dengan Metode Sol
Gel sebagai Fungsi Waktu”.Adapun tujuan penelitian ini adalah sebagai salah
satu persyaratan untuk mendapatkan gelar S1 pada Jurusan Fisika FMIPA
Universitas Lampung.
Penulis menyadari masih banyak kelemahan dan ketidak sempurnaan laporan ini,
oleh karena itu penulis mengharapkan kritik dan saran yang membangun terhadap kelanjutan dan hasil yang telah dicapai. Semoga laporan ini dapat bermanfaat bagi kita semua.
Wassalamu’alaikkum Wr.Wb.
Bandar Lampung, Januari 2013 Penulis
37
V. KESIMPULAN DAN SARAN
A. Kesimpulan
Berdasarkan dari tujuan penelitian dan hasil analisis struktur dan mikrostruktur pada masing-masing sampel yang dinalisis dan diuji maka didapatkan kesimpulan
sebagai berikut:
1. Komposit ZrO2-CuO dapat diperoleh dari bahan awal ZrCl4 dan Cu(NO3)2
melalui metode sol gel dengan fasa zirkonium baddeleyit dan tenorit (CuO)
pada suhu 700℃ .
2. Butiran komposit ZrO2-CuO semakin homogeny dan memprlihatkan struktur
yang berbentuk kecil sekalipun masih ada yang lebih besar.
3. Pembentukan komposit ZrO2-CuO pada sampel A, B, C, dan D dengan waktu proses stirrer sol gel dari 7, 8, 9, 10, 11 dan 12 jam pembentukan butiran
struktur yang lebih kecil terlihat pada sampel D dengan lama proses waktu stirrer 12 jam. Dengan semakin lamanya waktu stirrer sol gel maka tingkat
kehomogenan dan semakin kecil ukuran butir yang terlihat pada morfologi komposit ZrO2-CuO .
B. Saran
Dari penelitian yang telah dilakukan adalah melihat mikrostruktur sampel pada waktu proses sol-gel 12 jam semakin kecil maka diharapkan waktu proses sol-gel
MENGESAHKAN
1. Tim Penguji
Ketua : Posman Manurung, Ph.D ………..
Sekretaris : Wasinton Simanjuntak, Ph.D. ………
Penguji : Simon Sembiring, Ph.D. ………
2. Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Prof. Suharso, Ph.D.
NIP 19690530 199512 1 001
Motto
”Anak
paling bahagia ialah anak yang
membahagiakan orang tuanya….(Penulis)
“
Sesungguhnya orang-orang yang sabar akan
dicukupkan pahalanya tanpa batas
“
(Q.S 39;10)
“
Jadikan cobaan itu anugerah yang bisa merubah
ruang yang gelap menjadi indah...
”
(Penulis)
“Berusaha….Berdo’a…selanjutnya pasrah pada
PERNYATAAN
Dengan ini saya menyatakan bahwa dalam skripsi ini telah dibuat sendiri dengan isi karyanya berasal dari hasil bimbingan dari kelompok penelitian. Sepanjang pengetahuan saya skripsi ini tidak pernah menyalin suatu pernyataan yang sama
dari berbagai sumber karya tulis, kecuali pernyataan tersebut digunakan sebagai bahan kutipan bacaan yang kemudian disebutkan dalam daftar pustaka, selain itu
saya menyatakan pula bahwa skripsi ini belum pernah dipublikasikan dengan orang lain.
Apabila pernyataan saya tidak benar maka saya bersedia dikenai sanksi sesuai dengan hukum yang berlaku.
Bandar Lampung, Januari 2013
Nevi Yanti Lubis
Dengan segenap ketelusan hati ku persembahkan
skripsi ini untuk
…..
Ayah dan Mamak
Terimakasih atas do’anya yang tulus dan ik
hlas, karena berkat
kalianlah
aku bisa menjadi seperti sekarang ini…
Adiku tercinta Reni Sari Lubis
Terimaksih a
tas do’a,
semangat dan motivasinya
yang luar biasa
…
Almamater tercinta FISIKA FMIPA
RIWAYAT HIDUP
Penulis dilahirkan di Desa Way Tuba kecamatan Way Tuba
kabupaten Way Kanan Lampung Way Kanan pada tanggal 07
Desember 1988. Merupakan anak pertama dari dua
bersaudara, dari pasangan Bapak Oneng Lubis dan Ibu Juliani.
Penulis menyelesaikan pedidikan Sekolah Dasar Negeri I Way
Tuba selesai pada tahun 2001, Sekolah Menengah Pertama Pembangunan Way Tuba
selesai pada tahun 2004, dan Sekolah Menengah Atas Negeri I Way Tuba selesai
pada tahun 2007.
Penulis terdaftar sebagai mahasiswi jurusan Fisika Fakultas Matematika dan Ilmu
Pengetahuan Alam Universitas Lampung pada tahun 2007 melalui jalur SPMB.
Selama menjadi mahasiswi penulis pernah menjadi asisten praktikum Fisika Dasar I,
Praktikum Eksperimen Fisika dan koordinator Praktikum Fisika Inti. Penulis juga
pernah menjadi anggota Himpunan Mahasiswa Fisika (HIMAFI) pada tahun
2009/2010. Penulis pernah mengikuti Unit Kegiatan Mahasiswa(UKM) bela diri
Taekondo. Penulis melaksanakan Praktik Kerja Lapangan (PKL) di PT. SWEET
SANWANCANA
Kata ucapan terimakasih penulis sampaikan kepada semua pihak yang telah membantu dalam proses penyelesaian tugas akhir Jurusan Fisika Fakultas
Matematika dan Ilmu Pengetahuan Alam Universitas Lampung dengan judul
skripsi ” Sintesis dan Karakterisasi Komposit ZrO2 -CuO dengan Metode
Sol Gel Sebagai Fungsi Waktu”, yang mana penyelesaian ini berguna untuk memeperoleh gelar sarjana Sains di Universitas Lampung. Dengan demikian
kesempatan ini penulis mengucapkan banyak terimakasih kepada:
1. Bapak Posman Manurung, Ph.D selaku pembimbing pertama, yang telah membimbing, memberikan pengarahan, saran dan nasehat kepada penulis
selama melaksanakan penelitian dan penyusunan skripsi hingga selesai.
2. Bapak Wasinton Simanjuntak, Ph.D selaku pembimbing kedua, yang
selalu membantu dan meberi pengarahan kepada penulis.
3. Bapak Simon Sembiring, Ph.D selaku penguji yang selalu memberi
masukan serta kritik dan saran kepada penulis..
4. Kedua orang tua (Mamak dan Ayah), beserta adikku Reni yang selalu
memberikan dukungan, semangat, kesabaran dan doa yang tak pernah
berhenti kepada penulis.
5. Keluarga besar Akas Makmun (Alm) terimakasih atas semangat, do’a dan
6. Temen penelitian dalam suka dan duka Whindini terimakasih atas support
dan semangatnya.
7. Buat teman-teman Lia, Fitri, Yuyun, Desi, Echa, Arum, Een, Mifta, Mardi,
Ade terimakasih atas bantuan, semangat dan do’anya yang luar biasa. 8. Terimakasih buat temen-temen angkatan 2007 yang tidak bisa saya
sebutkan satu persatu terimakasih atas kekompakannya, solidaritasnya,
semangatnya dan do’anya.
9. Semua pihak yang terlibat secara langsung maupun tidak langsung.
Semoga skripsi ini mendapatkan ridho dan berkah dari ALLAH SWT
1
I. PENDAHULUAN
A. Latar Belakang
Dewasa ini salah satu jenis material aplikasi yang terus dikembangkan adalah
komposit. Jenis material ini menjadi fokus perhatian karena pemaduan dua bahan
atau lebih mampu memberikan keuntungan utama yakni mengatasi kelemahan
bahan tunggal dan menghasilkan sifa-sifat baru yang lebih unggul dari komponen
penyusunnya. Disamping itu komposisi komposit juga dapat diatur untuk
mengendalikan karakteristiknya sehingga memenuhi sifat-sifat yang diinginkan
untuk berbagai pembentukan komposit. Pengendalian sifat-sifat inilah yang
menjadi dasar pemanfaatan komposit yang begitu luas, misalnya sebagai katalis
(Vahids et al, 2008) dan keramik. Kelebihan material komposit dibandingkan
dengan logam adalah ketahanan terhadap korosi, pengaruh lingkungan dan untuk
jenis komposit tertentu memiliki kekuatan dan kekakuan yang lebih baik.
Secara garis besar berdasarkan komponen pembentukannya komposit dibedakan
menjadi beberapa kelompok yakni komposit organik dan komposit anorganik
(Anonim A, 2012). Komposit anorganik yang paling umum dikenal dan terus
dikembangkan adalah komposit oksida logam karena pemanfaatannya yang luas
khususnya sebagai katalis heterogen (Vahids et al, 2008) dan keramik (Anonim B,
2
ZrO2 adalah logam putih keabuan yang jarang dijumpai di alam bebas, Para
peneliti banyak memilih ZrO2 untuk dilihat unjuk kerjanya. ZrO2 banyak digunakan sebagai bahan katalis terutama untuk katalis penghasil oksigen tetapi
bahan ini mempunyai keterbatasan sangat mudah berekasi dengan oksigen. Kelebihan bahan Zirkonia (ZrO2) yaitu memiliki temperatur tinggi, kuat, tahan abrasi, tahan korosi, tidak menghantarkan listrik, konduktifitas rendah, kekuatan
termal yang baik, dalam penelitian ini ZrO2 akan digabungkan dengan CuO kami mengapa memilih CuO karena dengan menambahkan CuO untuk ZrO2 melihat
unjuk katalis khususnya sebagai bahan katalis(Anonim C, 2012). Selain itu tembaga oksida atau tenorit (CuO) adalah oksida tembaga yang lebih tinggi nomor pengoksidaannya. Ia merupakan butiran-butiran hitam dengan struktur ionik yang
melebur pada suhu melebihi 1200°C sambil kehilangan beberapa oksigennya. Ia dapat dihasilkan dengan memanaskan tembaga dalam udara, Sedangkan CuO/tembaga oksida atau tenorit CuO mempunyai keunggulan melebur melebihi
suhu 1200ºC dan jika dalam suhu 300ºC akan bereaksi dengan oksigen dan membentuk CuO yang memiliki warna hitam. Dan jika berada dalam suhu 1000ºC
akan terbentuk Cu2O yang berwarna merah, tembaga oksida mempunyai sifat sangat tinggi konduksian elektrik dan hambatannya. Bahan CuO dalam kehidupan sehari-hari dapat digunakan sebagai baterai, elektroda, penarik sulfur atau
belerang dan kelemahannya adalah mudah bereaksi dengan oksigen. Tembaga oksida digunakan sebagai katalis karena memiliki aktivitas dan selektivitas yang
3
Untuk membuat bahan komposit ZrO2-CuO banyak metode yang telah
dikembangkan salah satunya dengan metode sol-gel pemilihan metode ini dilakukan karena memiliki beberapa kelebihan seperti dilakukan pada temperatur
rendah, fase pemisahan yang cepat, kemurnian yang lebih baik, hemat energi, homogenitas yang lebih baik dan lebih murah dibanding dengan metode yang lain seperti metode padatan dan peleburan (Widodo, 2010). Selain itu pula
penggabungan ZrO2-CuO sebgai katalis penghasil mengharapkan besar butiran yang lebih kecil sebagian diharapkan nanopartikel maka pemilihan dilakukan
karakterisasi waktu pembentukan gel. Dalam penelitian ini pembentukan sol ZrO2 dapat diperoleh dari bahan awal berupa zirkonium isopropoxide, zirkonium butoxide dan zirkonium klorida atau ZrCl4 .Pada penelitian ini bahan yang dipilih
adalah ZrCl4 dimana bahan ini relatif lebih murah dibandingkan yang lainnya (Anonim D, 2012).
Metode sintesis cara sol-gel komposit ZrO2-CuO dapat dipengaruhi oleh beberapa faktor seperti perbandingan mol, temperatur sintering dan waktu proses stirrer.
Pada penelitian sebelumnya dilakukan pengaruh temperatur pada pembentukan komposit silika zirkonia melelui proses sol gel (Novesar et al, 2001). Pada
penelitian yang lain pula dilakukan pengaruh temperatur pada struktur ZrO2-CuO
nanopertikel (Vahidshad, 2008). Pada penelitian ini menggunakan proses waktu stirrer karena dengan adanya proses waktu stirrer yang semakin lama akan
4
zirkonia-tenorit dilakukan dikarakterisasi dengan Scanning Elektron Microscopy
(SEM) dan Difraksi Sinar-X.
B. Rumusan Masalah
Berdasarkan latar belakang yang telah dikemukakan, maka didapatkan beberapa
rumusan masalah dari penelitian ini seperti:
1. Bgaimana terbentuknya ZrO2-CuO dengn metode sol gel dengan perbandingan mol 1:1?
2. Bagaimana pengaruh waktu stirrer terhadap struktur ZrO2-CuO pada proses
sol-gel?
3. Bagaimana bentuk morfologi dan ukuran butiran ZrO2-CuO setelah dikalsinasi pada suhu 700ºC?
C. Batasan Masalah
Dalam penelitian ini masalah dibatasi pada sebagai berikut:
1. Perbandingan antara ZrCl4 dan Cu(NO3)2 sol pada penelitian ini adalah 1:1. 2. Suhu kalsinasi yang digunakan pada penelitian ini adalah 700ºC.
5
C. Tujuan Penelitian
Adapun tujuan penelitian ini adalah:
1. Untuk mengetahui pembentukan struktur Kristal, morfologi ZrO2-CuO dengan menggunakan XRD dan SEM.
2. Untuk mengetahui hubungan waktu stirrer pada proses sol-gel.
3. Untuk mengetahui hubungan antara morfologi ZrO2-CuO terhadap waktu proses sol gel.
D. Manfaat Penelitian
Manfaat penelitian ini adalah:
1. Memberikan informasi mengenai pembentukan ZrO2-CuO dengan menggunakan mentode sol-gel.
2. Memberikan informasi mengenai uji karakterisasi XRD, SEM terhadap
sampel ZrO2-CuO.
22
III. METODE PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Juli 2012 sampai bulan November 2012 di Laboratorium Fisika Inti, Laboratorium Kimia Fisik, Laboratorium Kimia Instrumentasi FMIPA Universitas Lampung. Karakterisasi sampel dilakukan di
Laboratorium Pusat Penelitian dan Pengembangan Geologi Kelautan (P3GL) Pasteur Bandung dan Laboratorium Biomas Kimia Universitas Lampung.
B. Alat dan Bahan Penelitian
1. Alat
Dalam penelitian ini alat yang digunakan adalah neraca, gelas ukur, labu ukur,
beaker glass, kompor listrik, spatula, magnetic strirer, pipet tetes, lesung (mortal)
dan alu (pastel), cawan tahan panas, pengayak, penekan hidrolik, tungku
23
2. Bahan
Bahan yang digunakan dalam penelitian ini adalah ZrCl4 dengan kemurnian 98% dari Merck, Cu(NO3)2.3HNO3 dengan kemurnian 99,5%, Merck, asam sitrat atau
C6H8O7, etilen glikol atau HOCH2CH2OH, KOH dan aquabides.
C. Prosedur Kerja
Adapun langkah-langkah yang dilakukan adalah preparasi serbuk ZrO2, preparasi serbuk CuO, sintesis komposit tenorit-zirkonia.
1. Preparasi ZrO2-CuO Sol
Pembuatan serbuk ZrO2-CuO diawali dengan pencampuran bahan zirconium klorida dengan kemurnian 98%, aquabides. Pencampuranya dengan cara
melarutkan 12 gr ZrCl4 kedalam 25 ml aquabides sambil dilakukan pengadukan menggunakan stirer. Setelah itu dimasukkan Cu(NO3)2 kedalam larutan ZrO2 sambil dilakukan stirrer. Dalam penelitian ini dibuat sampel 6 buah dengan variasi
24
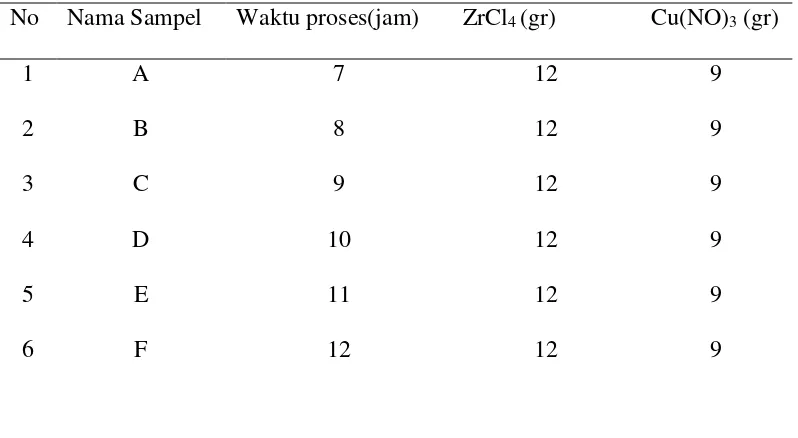
Tabel 3.1. Komposisi ZrO2 dan Cu(NO3)2 dengan perbandingan 1:1 dan waktu proses stirrer yang bervariasi
No Nama Sampel Waktu proses(jam) ZrCl4 (gr) Cu(NO)3 (gr)
1 A 7 12 9
2 B 8 12 9
3 C 9 12 9
4 D 10 12 9
5 E 11 12 9
6 F 12 12 9
2. Sintesis Komposit ZrO2-CuO
Sintesis komposit ZrO2-CuO dilakukan dengan metode sol gel dimana ZrO2-CuO
dicampur dengan pebandingan 1:1 sebanyak satu sampel. Zirkonia sol dihasilkan dari pencampuran bahan zirkonium klorida dengan aquabides 25 ml.
Pencampurannya dilakukan dengan perbandingan molar 1:1. ZrO2 sol yang dihasilkan kemudian ditambahkan Cu(NO3)2 sambil distirrer dengan waktu yang berbeda-beda yaitu 7, 8, 9, 10, 11 dan 12 jam. Selama perlakuaan stirrer dilakukan
pencampuran asam sitrat dan etilen agar pembentukan gel lebih bagus. Setelah distirr selama waktu yang ditentukan kemdian perlahan ditetesi KOH sampai
berbentuk gel. Gel yang terbentuk kemudian didiamkan selama 24 jam agar mengalami penuan (aging) dan dipanaskan pada suhu 110 oC selama 12 jam. Setelah dilakukan pengeringan bahan yang didapat kemudian ditumbuk sampai
25
kalsinasi berfungsi untuk menghilangkan zat-zat lain yang terdapat pada serbuk
ZrO-CuO. Sintering dilakukan menggunakan tungku pembakaran selama 9 jam pada suhu 700 oC.
3. Pressing
Sampel uji yang masih berupa bubuk kemudian dijadikan bentuk pellet, yaitu
dengan melakukan pemadatan sampel yang telah melewati proses preparasi menggunakan dengan alat tekan hidrolik, dengan tuuan untuk merubah bentuk
sampel dari bubuk menjadi padatan. Tekanan yang digunakan dalam proses penekan terhadap sampel sebesar 200 MPa prosesnya adalah menimbang dengan berat masing-masing sampel sebanyak 1,3 gr. Alat yang digunakan dalam proses
pressing adalah penekanan (hidrolik) yang dapat diatur besar tekanannya.
Langkah-langkah yang dilakukan dalam proses penekanan adalah sebagai berikut:
1. Menyiapkan sampel dan alat tekan.
2. Memasukkan sampel ke dalam cetakan (die) yang berbentuk silinder.
3. Mengunci alat tekan dengan memutar skrup.
4. Memompa tuas untuk menentukan berat beban.
5. Memutar skrup untuk membuka alat cetak.
6. Memompa tuas untuk mengeluarkan pellet.
26
4. Kalsinasi
Proses kalsinasi dilakukan dengan menggunakan tungku pembakaran atau furnance. Alat ini telah disediakan penyesuaian temperatur yang terkendali secara
otomatis dengan sistem digital. Dalam penelitian ini, kalsinasi dilakukan pada temperatur 700°C dengan waktu penahanan selama 4 jam. Untuk melaksanakan proses kalsinasi tersebut, terdapat suatu prosedur yang dapat dijelaskan berikut:
1. Menyiapkan sampel yang akan dikalsinasi, lalu memasukkan sampel bubuk kedalam cawan tahan panas.
2. Setelah memasukkan ke dalam furnace dan menghidupkannya dengan saklar diputar dengan posisi (ON).
3. Mengatur suhu yang diinginkan dengan memulai dari suhu kamar 27ºC
dengan kenaikkan suhu 300ºC selama 1 jam, selama suhu 300ºC dilakukan penahanan 2 jam. Selanjutnya suhu dinaikkan menjadi 700°C dilakukan penahan 1 jam dan pada puncaknya ditahan selama 4 jam.
4. Memutar saklar pada posisi OFF setelah proses kalsinasi selesai.
5. Mengeluarkan sampel dari furnace dan menyimpan sampel yang telah
27
2. Diagram Alir
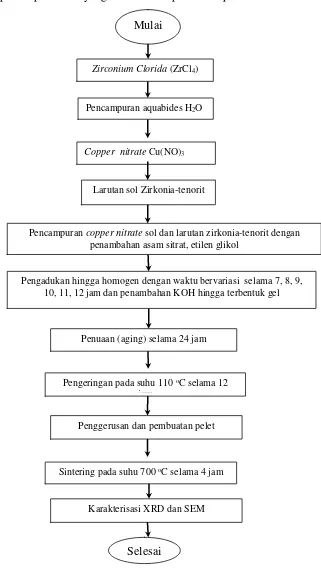
Adapun proses penelitian yang dilakukan dapat dilihat pada Gambar 3.1.
Gambar 3.1. Proses penelitian. Copper nitrate Cu(NO)3
Larutan sol Zirkonia-tenorit
Penuaan (aging) selama 24 jam
Pengadukan hingga homogen dengan waktu bervariasi selama 7, 8, 9, 10, 11, 12 jam dan penambahan KOH hingga terbentuk gel Pencampuran copper nitrate sol dan larutan zirkonia-tenorit dengan
penambahan asam sitrat, etilen glikol
Penggerusan dan pembuatan pelet Pengeringan pada suhu 110 oC selama 12
jam
Sintering pada suhu 700 oC selama 4 jam
Karakterisasi XRD dan SEM
Selesai Mulai
6
II. TINJAUAN PUSTAKA
A.Komposit
Komposit adalah material hasil kombinasi makroskopik dari dua atau lebih
komponen yang berbeda, komposit memiliki sifat fisik dan mekanis yang lebih baik daripada sifat masing-masing komponen penyusunnya (Sahari et al.,2009).
Dibanding dengan material konvensional keunggulan komposit antara lain yaitu
memiliki kekuatan yang dapat diatur (tailorability), tahanan lelah
(fatigue resistance) yang baik, tahan korosi dan memiliki kekutan jenis
(rasio kekuatan terhadap berat jenis) yang tinggi.
Manfaat utama dari penggunaan komposit adalah mendapatkan kombinasi sifat
kekuatan serta kekakuan tinggi dengan berat jenis ringan (Hendra, 2002). Komposit didefinisikan sebagai gabungan serat-serat dan resin. Penggabungannya sangat beragam, fiber atau serat ada yang diatur memanjang (unidirectional
composites), ada yang dipotong-potong kemudian dicampur secara acak (random fibers), ada yang dianyam silang lalu dicelupkan dalam resin (cross-ply laminae),
7
Menurut bentuk material penyusunnya, komposit dapat dibedakan menjadi lima
jenis, (Anonim E, 2012) yaitu, komposit serat (fibrous composite), Komposit laminat (laminate composite), Komposit sketal (filled), Komposit serpih (flake),
Komposit partikel (particulate composite).
Berdasarkan fungsinya komponen komposit dibedakan menajadi:
1. Penguat (reinforcement), yang mempunyai sifat kurang ductile tetapi lebih
rigid serta lebih kuat, dalam penelitian kali ini penguat komposit yang
digunakan yaitu dari serat glass.
2. Matriks, umumnya lebih detail, tetapi mempunyai kekuatan dan rigiditas
yang lebih rendah.
B.ZrO2 (Zirkonia)
ZrO2(Zirkonia) merupakan oksida logam berwarna putih dari unsur zirkonium.
Zirkonia memiliki densitas 5,68 g/cm3 dengan titik leleh sebesar 2715 ºC dan titik didih sebesar 4300 ºC. ZrO2 merupakan logam oksida yang memiliki polimorfi
yaitu tiga macam struktur kristal antara lain yaitu monoklinik, tetragonal dan kubik.
1. Struktur Kristal Monoklinik
Zirkonia murni pada suhu kamar sampai suhu 950ºC akan terbentuk struktur
8
1990). Pada suhu kamar zirkonia murni memiliki struktur kristal monoklinik.
Struktur ditunjukkan pada Gambar 2.1.
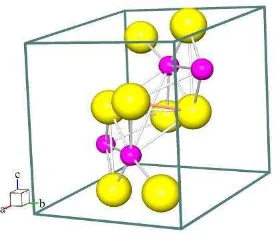
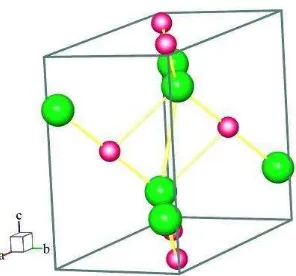
Gambar 2.1. Kristal ZrO2 monoklinik. Model kristal yang dipakai adalah (Smith dan
Newkirk, 1965). ZrO2 dengan ion Zr4+ ditunjukkan dengan bulatan kecil
berwarna pink dan ion O2- bulatan besar berwarna kuning di mana atom Zr
dikelilingi oleh lima atom oksigen. Perangkat lunak yang digunakan untuk membuat pemodelan adalah program Balls & Stick (Ozawa dan Kang, 2004).
Pada Gambar 2.1 Kristal ZrO2 monoklinik yang digunakan untuk pemodelan
sistem monoklinik dengan nomor grup ruang 14, parameter sel: a = 5,1450 Å, b = 5,2070 Å, c = 5,γ110Å, dan sudut α = 90°, = 99,β°, = 90°.
2. Struktur Kristal Tetragonal
ZrO2 ika dilakukan pemanasan sampai suhu 1000-1100ºC akan berubah struktur kristalnya tetragonal, jika didinginkan kembali pada suhu ruang akan berubah kembali menjadi monoklinik. Jadi monoklinik dan tetragonal tergolong memiliki
9
Gambar 2.2.Kristal ZrO2 tetragonal. Model kristal yang dipakai adalah Balls & Stick
(Lutterotti dan Scardi, 1990). Dapat kita lihat pada gambar di atas dimana ZrO2 dengan ion Zr4+ ditunjukkan dengan bulatan besar berwarna pink dan
ion O2- ditunjukkan dengan bulatan kecil berwarna biru di mana atom Zr
dikelilingi oleh lima atom oksigen. Perangkat lunak yang digunakan untuk membuat pemodelan adalah program Balls & Stick (Ozawa dan Kang, 2004).
Untuk kristal ZrO2 tetragonal pemodelan sistem monoklinik dengan nomor grup ruang 137, parameter sel: a = 3,5960 Å, b = 3,5960 Å, c = 5,1770 Å, dan sudut α = 90°, = 90°, = 90°.
3. Struktur Kristal Kubik
Zirkonia yang paling stabil adalah dengan struktur kristal kubik, fasa kubik dapat terbentuk pada suhu yang sangat tinggi yaitu sekitar 2680ºC. Kelemahan ZrO2
hanya dimiliki pada struktur kristal monoklinik dan tetragonal saja bila terkena pemanasan samapi 1100ºC karena terjadi transformasi fasa. Oleh karena itu ZrO2 untuk struktur Kristal monoklinik dan tetragonal hanya diaplikasikan untuk suhu
rendah dan suhu ruang, akan tetapi struktur Kristal monoklinik dan tetragonal memiliki kekuatan mekanik lebih tinggi dibandingkan dengan struktur kristal
10
perubahan suhu (Awan, 2008). Fase kubik zirkonia mempunyai daya hantar
listrik dan ionik yang lebih baik daripada fase zirkonia yang lain.
Dalam sifat elektrokramik, zirkonia dapat digunakan sebagai bahan fotoanoda untuk reaksi redoks (Veda dkk, 2004). Zirkonia juga digunakan untuk memproduksi berbagai macam garam, logam alkosida termasuk larutan logam
alkosida zirkonium yang mudah didapatkan dengan reaksi hidrolisis dengan air. Reaksi tersebut diperlukan pelarut alkohol dan asam yang berguna untuk
menghilangkan kadar air yang ada pada zirkonia. Adapun persamaan reaksi hidrolisis ZrCl4adalah:
ZrCl4(s)+½O2 (g) ZrCl3 (s) + O2 (g) (2.1)
Dengan melihat hasil reaksi hidrolisis ZrCl4, dapat kita lihat ZrCl4 diuapkan dengan menggunakan udara untuk menghilangkan Cl2 (Abbott, 1980), karena
ZrCl4 sangat mudah menguap di udara bebas. Zirkonia dapat terbentuk melalui bubuk ZrCl4melalui metode sol-gel. Dengan reaksi seperti:
Zr(OH)4(aq) + O2(g) ZrO2(s) +2OH-(g) (2.2)
Pada reaksi diatas dapat kita lihat bahwa zirkonia sol tidak dapat ikut menguap sebab dapat kita ketahui bahwa zirkonia memiliki titik didih yang sangat tinggi
yakni 4300 oC. Pada kenyataannya sifat alam zirkonia sol memiliki kandungan H2O yang terdapat di dalamnya.
Dengan kenyataan sifat zirkonia sol ini memiliki makna yakni, kandungan air 2H2O terjebak di dalamnya sehingga dibutuhkan temperatur kalsinasi untuk
11
C. Karakteristik ZrO2 (Zirkonia)
Zirkonia atau zirkonium adalah logam yang berwarna putih abu-abu, dengan bentuk struktur kristal yang tidak teratur, lunak, dan bila bahannya murni dapat
tahan terhadap udara bahkan api. Logam yang ditemukan oleh M.H. Kalaproth pada tahun 1788 dalam bentuk mineral zircon ini tidak ditemukan di alam dalam
bentuk bebas tetapi sebagi oksida atau silikat dalam kerak bumi dan bebatuan dalam kadar kecil. Logam ini memiliki lambang Zr dengan nomor massa 91,224.
Unsur zirkonium termasuk didalam golongan IVB pada sistem periodik. Unsur
dalam golongan ini disebut juga unsur transisi yaitu unsur blok d yang konfigurasi elektronnya diakhiri oleh sub kulit d. Selain zirkonium, unsur titanium, hafnium,
serta rutherfordium juga tergolong dalam golongan IV B. Sifat- sifat unsur pada golongan ini memiliki konfigurasi elektron terluar adalah (n-1). Bilangan oksidasi yang sering dijumpai adalah +2, +3 dan +4, namun khusus untuk unsur Zr
bilangan oksidasinya yaitu +1. Bilangan oksidasi +4 dikatakan lebih stabil dari yang lainnya. Hal ini dikarenakan bilangan oksidasi yang lebih rendah mengalami
reaksi redoks.
Zirkonium melimpah keberadaanya di alam seperti zircon (hyacianth) dan zirkonia (baddeleyit). Baddeleyit merupakan oksida zirkonium yang tahan
terhadap suhu yang sangat tinggi sehingga dapat digunakan untuk pelapis tanur tinggi. Zirkonium terjadi secara alami, terdapat 4 isotop yang stabil dan dari 1
12
Namun zirkonium dapat bereaksi dengan udara sehingga dapat menghasilkan
ZrO2.
Adapun reaksi zirkonium dengan udara yaitu sebagai berikut:
Zr(s) + O2 (g) ZrO2 (g) (2.3)
Zirkonia oksida merupakan senyawa bentukan dari zirkonium dengan udara. Dewasa ini penggunaan zirkonium oksida dalam pemenuhan kebutuhan
sehari-hari adalah sebagai pengeluaran emisi gas dari kendaraan bermotor. Adapun penggunaan zirkonium oksida yaitu mencapai suhu sampai 2400oC, dengan kepadatan tinggi, konduktivitas termalnya rendah, kimia inertness, logam, ionik konduksi listrik, ketahanan aus, ketangguhan perpatahan tinggi dan kekerasan tinggi.
D. Sifat-sifat ZrO2 (Zirkonia)
Adapun sifat-sifat zirkonia adalah daya tahan kimia yang kuat, tahan abrasi, tahan korosi, tidak menghantarkan listrik, konduktifitas termal rendah, kekuatan termal lebih baik dari pada alumnia dan sebagai dental material zirkonia memiliki sifat
fisik, mekanis, kimia, dan biologis yang sangat baik (Anonim B, 2012).
E. CuO (Tembaga Oksida) atau Tenorit
Tembaga oksida (CuO) adalah oksida tembaga yang lebih tinggi nombor pengoksidaannya. Ia merupakan satu pepejal hitam dengan struktur ionik yang
13
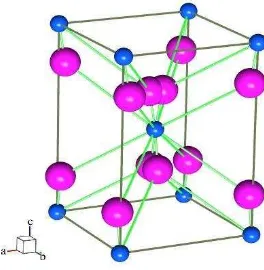
yang mempunyai densitas 6,09 g/cm3 dan memiliki struktur kristal monoklinik. Struktur kristal CuO ditunjukkan pada Gambar 2.3.
Gambar 2.3. Kristal CuO dengan ion Cu2+. Model yang dipakai adalah perangkat lunak
Balls & Stick (Tunell et. al, 1935). Ditunjukkan dengan bulatan kecil
berwarna merah dan ion O2- bulatan besar berwarna hijau di mana atom
Cu dikelilingi oleh empat atom oksigen. Perangkat lunak yang digunakan untuk membuat pemodelan adalah program yang Balls & Stick (Ozawa dan Kang, 2004).
Pemodelan sistem tetragonal dengan nomor grup ruang 15, parameter sel:
a = 4,653 Å, b = 3,4106 Å, c = 5,108 Å, dan sudut α = 90°, = 99,48°, = 90°. Tembaga oksida juga digunakan untuk memproduksi berbagai macam tembaga
diantaranya tembaga nitrat yang mudah didapatkan dengan reaksi oksida basa dengan asam, yang mana basa berupa tembaga oksida dan asam berupa asam nitrat. Reaksi tersebut dapat bersifat bolak-balik yang artinya garam tembaga
nitrat dapat kembali lagi menjadi tembaga oksida melalui reaksi hidrolisis. Adapun persamaan reaksi hidrolisis Cu(NO3)2.3H2O dituliskan pada persamaan
berikut.
Cu(NO3)2.3H2O (s) + HNO3(aq) Cu(OH)2(aq) + 3HNO3(aq) + H2O(l)
14
Dengan melihat hasil reaksi hidrolisis Cu(NO3)2.3H2O dengan asam nitrat HNO3 merupakan larutan yang mudah hilang ketika dipanaskan dan larutan Cu(OH)2
yang akan bereaksi menjadi tembaga oksida (CuO) dan terdapat air di dalamnya. Adapun reaksi tersebut dapat dituliskan pada persamaan 2.5.
Cu(OH)2(aq) CuO(s) + H2O(l) (2.5)
Terlihat jelas bahwa, air terikat pada tembaga oksida sehingga diperlukan temperatur kalsinasi agar kadar air yang terjebak dalam tembaga oksida
menghilang tetapi untuk CuO sendiri tidak ikut menguap sebab CuO memiliki titik didih 2000oC (Forsyth dan Hull, 1991).
F. Sistem Pembuatan ZrO2-CuO
Pada penelitian Simbolon dkk (2000), pembuatan ZrO2 dari ZrOCl2 yang direaksikan dengan ammonium hidroksida atau asam oksalat dan dikalsinasi pada suhu 900 ºC selama 4 jam, maka terbentuklah zirkonium dioksida. Perubahan
berat endapan Zr(OH)2 dan Zr(C2O4) setelah pemanasan akhirnya menjadi senyawa zirkonium dioksida. Adapun pengaruh aditif CaO dan suhu sintering
terhadap mikrostruktur keramik (partially stabilized zirconia) PSZ dari hasil XRD
menunjukkan bahan keramik tanpa menggunakan aditif hanya fase monoklinik. Zirkonium dioksida berbahan dasar ZrOCl2.8H2O dan CaO yang menggunakan
15
dengan serbuk ZrO2. Jadi pembuatan keramik Ca-PSZ pada suhu sintering 1500
ºC menimbulkan fase kubik dan fasa monoklinik.
G. Proses Sol-Gel
Metode sol-gel dikenal sebagai salah satu metode sintesis yang cukup sederhana dan mudah. Metode ini merupakan salah satu motode basah karena pada
prosesnya melibatkan larutan sebagai medianya. Pada metode sol-gel, sesuai dengan namanya larutan mengalami perubahan fase menjadi sol (koloid yang mempunyai padatan tersuspensi dalam larutannya) dan kemudian menjadi gel
(koloid tetapi mempunyai fraksi padatan yang lebih besar daripada sol (Rahaman, 1995).
Proses sol-gel memiliki kemurnian dan kekuatan yang tinggi serta temperatur yang rendah sehingga sangat mudah dilakukan jika dibandingkan dengan proses dan metode yang lainnya yaitu seperti metode pengabuan dan pelelehan yang
harus memakai temperatur yang sangat tinggi sehingga membutuhkan biaya yang mahal (Petrovic, 2001). Kemurnian sol-gel yang diperoleh sangat tinggi karena pada proses ini membutuhkan logam alkosida yang mudah bereaksi dengan air
atau alkohol yang dapat menguapkan molekul-molekul lain ketika proses sol terjadi. Adapun logam alkosida ini mempunyai rumus umum M(OR)z, di mana M
adalah logam seperti Zn, Be, B, Al, Si, Zr, Ti, Nb, Nd, Y, dan Yb dengan z adalah
valensi dan R adalah suatu grup alkosida. Dengan melihat molekul tersebut,
ternyata terdapat suatu rantai karbon (R) yang dapat mudah diputuskan. Selain itu,
16
dan alkohol atau air yang terjebak dalam mineral alkohol. Hasil dari reaksi dari
air dan alkohol tersebut disebut sol. Reaksi yang menggunakan air sebagai pelarutnya disebut hidrolisis dan yang menggunakan alkohol disebut dengan
alkoholisis. Sol tersebut diperlukan proses penuaan (aging) agar sol menjadi
homogen (Indayaningsih dkk., 1999).
Dengan melihat sol yang telah diperoleh, ternyata air yang berada dalam mineral tersebut dapat menjadi larutan katalis dan dapat berupa asam agar dapat
mengeluarkan kadar air tersebut dan diberi pengaruh temperatur kalsinasi. Ketika
pemberian asam tersebut ke fasa cair sol, wujud sol akan membentuk suatu jaringan yang kontiniu, sehingga terbentuk gel. Reaksi pemberian asam tersebut
kepada fasa zat cair disebut sebagai proses gelasi. Adapun gel tersebut masih
mengandung air sehingga diperlukan proses penuaan dan pengeringan dengan titik didih air. Setelah mendapatkan gel yang kering, gel tersebut kemudian diproses
menjadi padatan untuk membentuk pelet. Dengan demikian, proses sol-gel bisa dibagi menjadi beberapa tahap yakni, pembentukan larutan (sol), penuaan,
pembentukan gel, penuaan pengeringan dan pemadatan. Pada proses sol-gel, dapat dilakukan pengukuran porositas. Demikian pula pada proses tersebut, membran tersebut dapat memiliki porositas seragam akibat proses sol-gel nanofiltrasi.
Adapun aplikasi fisika yang digunakan dalam proses sol-gel, sebagai contohnya adalah pengukuran porositas suatu membran hibrid (gel basah dan gel kering) (Zulfikar dkk, 2006). Membran hibrid biasa didapatkan bahan prekusor dari tetra
17
H. Karakterisasi komposit ZrO2-CuO
1. Difraksi Sinar-X
Prinsip terjadinya difraksi sinar-X (XRD) sangat berbeda dengan difraksi yang dikenal pada umumnya (difraksi cahaya). Perbedaan tersebut dapat dilihat pada
teori dan kegunaanya. Pada teori dan kegunaannya, XRD menggunakan foton dengan rentang panjang gelombang (λ) dalam rentang 0,5-2,5 Å dan digunakan
untuk mengkarakterisasi struktur kristal logam, keramik, polimer dan komposit (Hassan dan Chan, 1992). Sedangkan pada difraksi digunakan cahaya tampak (monokromatik dan polikromatik) dengan kegunaannya sebagai bidang keoptikan.
Sebelumnya, XRD telah dihipotesiskan oleh Von Loe yang mengatakan bahwa, kristal tersusun atas atom-atom dalam ruang teratur sehingga kristal dapat
berperan sebagai pusat-pusat penghamburan sinar-X. Kristal-kristal yang tersusun tersebut diketahui memiliki celah yang sebanding dengan panjang gelombang sinar-X sehingga dapat menimbulkan difraksi. Inilah yang disebut dengan syarat
difraksi. Hamburan sinar-X itulah yang akan ditangkap oleh detektor berupa intensitas pada arah difraksinya.
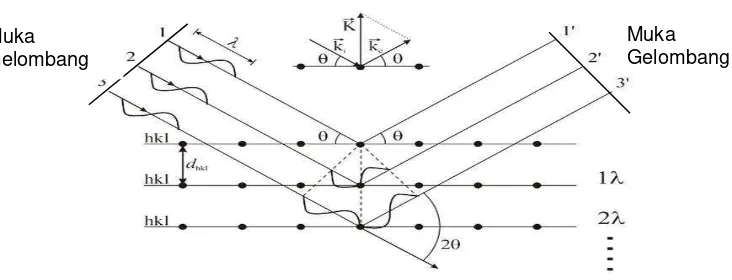
Sistem kerja difraktometer sinar-X didasarkan pada hukum Bragg yang menjelaskan tentang pola, intensitas dan sudut difraksi (βθ) yang berbeda-beda
pada tiap bahan. Jika seberkas sinar-X dengan panjang gelombang λ diarahkan pada permukaan kristal dengan sudut θ, maka sinar tersebut akan dihamburkan oleh bidang atom kristal dan akan menghasilkan puncak difraksi. Besar sudut
18
penghamburan (d). Skema difraksi sinar-X oleh atom-atom kristal dapat dilihat
seperti pada Gambar 2.5.
Gambar 2.4. Skema difraksi sinar-X oleh atom-atom kristal.
Kemudian diturunkan melalui hukum Bragg untuk difraksi, yang secara matematis dapat dituliskan dengan:
2dsin (2.6)dengan λ = panjang gelombang sinar-X (Å), d adalah jarak antara bidang, dan θ
adalah sudut difraksi (Cullity, 1978).
2. Scanning Electron Microscopy
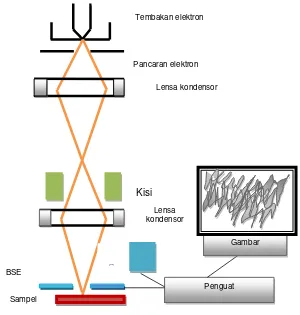
Scanning Electron Microscopy (SEM) pertama sekali dikembangkan pada tahun
1942 dengan instrumen terdiri dari penembak elektron (electron gun), tiga lensa
elektrostatik dan kumparan pengulas elektromagnetik yang terletak antara lensa kedua dan ketiga, serta tabung foto multiplier untuk mendeteksi cahaya pada layar
phospor. Berkas elektron dihasilkan dengan memanaskan filamen, lalu diberikan tegangan tinggi antara anoda dan katoda. Tujuannya untuk mempercepat elektron
Muka Gelombang Muka
19
hingga mencapai kecepatan yang kira-kira 1/3 kali kecepatan cahaya. Kemudian
berkas elektron dikumpulkan oleh lensa kondenser elektromagnetik, dan difokuskan oleh lensa objektif. Berkas elektron menumbuk sampel menghasilkan
elektron sekunder yang dipantulkan dari sampel kemudian dideteksi dan dikuatkan oleh tabung multiplier.
SEM adalah suatu jenis mikroskop elektron yang dapat menggambarkan permukaan sampel dengan ukuran butiran dalam sekala mikrometer dan
nanometer. Mikroskop ini bekerja dengan mengandalkan tembakan elektron yang dihasilkan dari filamen. Selanjutnya elektron primer difokuskan berinteraksi dengan atom pada sampel seperti pada Gambar 2.5.
20
Pada Gambar 2.5 terlihat bahwa elektron yang keluar dari pancaran elektron-elektron primer dengan energi yang sangat besar secara langsung tepat menumbuk
ataom sampel yang telah ditargetkan akibat pengaruh lensaa kondensor dan kisi.Pada saat terjadinya interaksi antara elektron primer dan elektron terluar dari sampel, misalnya kulit K, pada saat itu juga terjadi sebuah hamburan elektron
yang mengakibatkan elektron di kulit K terpental (tereksitasi) keluar karena energinya lebih kecil daripada energi elektron primer.
Dengan kenyataan tersebut, atom yang bereaksi mengakibatkan elektron yang baru datang tersebut dapat memberikan sisa energinya pada elektron-elektron
dikulit K, L, M, N dan seterusnya dengan cara menjatuhkan diri hingga menuju kulit yang terdekat dengan inti dan elektron-elektron kulit-kulit di atasnya akan kelebihan energi dari sebelumnya sehingga secara beraturan elektron-elektron
tersebut masing-masing akan naik menuju ke kulit terluar. Pada saat elektron kelebihan energi dan pindah ke kulit atasnya itulah akan timbul sinar-X. Dengan
melihat kejadian-kejadian tersebut, mikroskop elektron tidak menggunakan sinar-X tetapi menggunakan elektron yang tereksistasi. Elektron yang tereksistasi tersebut pada umumnya akan memiliki dua sebutan akibat energinya yang
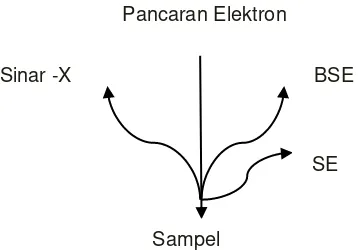
terdeteksi pada posisi tertentu oleh detektor-detektor yang didekatnya. Dua sebutan itu dapat ditunjukkan pada Gambar 2.6.
21
Gambar 2.6. Sinyal hasil interaksi berkas elektron dengan sampel (Reed, 1993).
Data atau tampilan gambar dari topologi permukaan atau lapisan yang tebalnya
sekitar 20 µm yang berupa tonjolan dapat diperoleh dari penangkapan elektron (hamburan inelastis) yang keluar dari kulit atom yang terluar dengan secondary
electron detector (SE). Kemudian diolah dalam bentuk tegangan-tegangan
menjadi digital dan ditampilkan pada layar CRT (TV). Hal yang berbeda pada eleketron terhambur balik backscattered electron (BE) yang mana akan
menghasilkan suatu gambar berupa komposisi (gambar yang termaksimumkan)
akibat penangkapan energi elektron yang keluar dari kulit atom yang terluar (hamburan elastis) (Smith, 1990).
Pancaran Elektron
Sampel