UIN SYARIF HIDAYATULLAH JAKARTA
FORMULASI DAN UJI AKTIVITAS ANTIOKSIDAN
KRIM
RICE BRAN OIL
SKRIPSI
DESTI ISWINDARI
1110102000016
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
ii UIN Syarif Hidayatullah Jakarta
UIN SYARIF HIDAYATULLAH JAKARTA
FORMULASI DAN UJI AKTIVITAS ANTIOKSIDAN
KRIM
RICE BRAN OIL
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi
DESTI ISWINDARI
1110102000016
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
vi ABSTRAK
Nama : Desti Iswindari Program Studi : Farmasi
Judul : Formulasi dan Uji Aktivitas Antioksidan Krim Rice Bran Oil
Minyak dedak padi atau yang lebih dikenal sebagai rice bran oil memiliki aktivitas antioksidan karena mengandung vitamin E, tokotrienol, dan gamma-oryzanol. Senyawa tersebut mampu menangkal radikal bebas yang dapat menyebabkan penuaan dini dan kerusakan kulit. Penelitian ini bertujuan untuk memformulasikan
rice bran oil menjadi sediaan krim antioksidan dengan menggunakan variasi konsentrasi asam stearat dan trietanolamin yaitu krim F1 (8% : 1%), krim F2 (12% : 2%), dan krim F3 (16% : 3%). Evaluasi fisik sediaan krim dilakukan terhadap beberapa parameter uji antara lain pengamatan organoleptik, pengujian homogenitas, pengukuran pH, pengukuran viskositas, dan pengujian stabilitas dengan metode sentrifugasi yang dilakukan selama 21 hari. Penentuan aktivitas antioksidan dilakukan dengan menggunakan metode DPPH. Hasil penelitian menunjukkan bahwa krim F3 memiliki stabilitas fisik yang lebih baik dibandingkan krim F1 dan F2. Krim rice bran oil mengalami penurunan aktivitas antioksidan dimana persen inhibisi krim pada konsentrasi 7000 g/mL kurang dari 50%.
vii ABSTRACT
Name : Desti Iswindari Program Study : Pharmacy
Title : Formulation and Antioxidant Activity Assay of Rice Bran Oil Creams
Rice bran oil has an antioxidant activity due to the content of vitamin E, tocotrienols, and gamma-oryzanol. This compounds is able to preventing of free radicals which cause premature aging and skin damage. This research aimed to formulate rice bran oil into antioxidant cream with the different concentration of stearic acid and triethanolamin. That concentration were F1 (8% : 1%), F2 (12% : 2%), and F3 (16% : 3%). The evaluation on physical characteristics was done based on organoleptic, homogenity, pH, viscosity, and stability test using centrifugation method for 21 days. Determination of antioxidant activity by using DPPH method. This research showed that F3 has a better physical stability than F1 and F2. Antioxidant activity of rice bran oil creams has decreased with the inhibition percent at 7000 g/mL less than 50%.
viii
KATA PENGANTAR
Alhamdulillah, puji syukur kehadirat Allah Ta’ala karena atas ridho-Nyalah penulis dapat menyelesaikan penyusunan skripsi dengan judul “Formulasi dan Uji
Aktivitas Antioksidan Krim Rice Bran Oil”. Skripsi ini disusun sebagai salah
satu syarat untuk memperoleh gelar Sarjana Farmasi, Fakultas Kedokteran dan Ilmu
Kesehatan, UIN Syarif Hidayatullah Jakarta.
Penulis menyadari bahwa dalam penyusunan skripsi ini tidak akan terwujud
tanpa adanya bantuan dan dukungan dari berbagai pihak. Oleh karena itu dalam
kesempatan ini penulis ingin menyampaikan ucapan terima kasih kepada:
1. Ibu Ofa Suzanti Betha, M.Si., Apt dan Ibu Sabrina, M.Farm., Apt selaku dosen
pembimbing yang telah meluangkan waktu, tenaga, pikiran serta memberikan
masukan saran kepada penulis.
2. Drs. Umar Mansyur, M. Sc selaku Ketua Program Studi Farmasi Fakultas
Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta.
3. Bapak dan Ibu dosen yang tanpa lelah memberikan pengajaran kepada penulis,
semoga menjadi amalan di akhirat kelak. Amin.
4. Kedua orang tua, Ayah Ade Yasin dan Ibu Siti Aisyah, yang telah memberikan
limpahan kasih sayang, semangat, dukungan dan doa yang tiada henti
dipanjatkan serta yang selalu mewujudkan mimpi-mimpi penulis, I Love You
Mom Dad.
5. Adik tersayang, Putri Rahmanda dan Maudy Rahma Deanti, serta seluruh
keluarga besar yang telah mendoakan dan memberikan dukungan disetiap
langkah penulis.
6. Laboran Farmasi UIN Syarif Hidayatullah Jakarta yang telah membantu penulis
selama proses penelitian.
7. Teman-teman, Desi, Cekgu, Niswah, Zakiya, Liana, Salsa, Mira, Ifah, Amel,
Hani, Deisy, Diah atas bantuan, doa, dan motivasinya.
8. Teman-teman Farmasi Angkatan 2010 yang selama perkuliahan berbagi suka
duka bersama, terimakasih atas kebersamaan dan persaudaraannya. Semoga tali
ix
9. Kak Aisyah, Kak Maulida, Anis, Eva, Ikmah, Iit, Anum, Novi, Rahmat, Riyan
yang senantiasa mendengarkan segala keluh kesah, memberikan semangat,
dukungan, dan doanya kepada penulis.
10.Semua pihak yang tidak dapat dituliskan satu persatu yang turut membantu
penulis dalam menyelesaikan skripsi ini.
Penulis menyadari bahwa penyusunan skripsi ini masih belum sempurna.
Oleh karena itu, penulis dengan senang hati menerima kritik dan saran yang
membangun. Penulis juga mengharapkan agar penelitian ini dapat bermanfaat
khususnya dalam pengembangan ilmu pengetahuan. Amin Ya Robbal’alamin.
Jakarta, September 2014
xi DAFTAR ISI
Halaman
HALAMAN JUDUL ... ii
HALAMAN PERNYATAAN ORISINALITAS ... iii
HALAMAN PERSETUJUAN PEMBIMBING ... iv
HALAMAN PENGESAHAN ... v
ABSTRAK ... vi
ABSTRACT ... vii
KATA PENGANTAR ... viii
HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... x
DAFTAR ISI ... xi
1.3Tujuan Penelitian ... 2
1.4Manfaat Penelitian ... 2
BAB 2 TINJAUAN PUSTAKA ... 3
2.1Kulit ... 3
2.1.1 Anatomi dan Fisiologi Kulit ... 3
2.1.2 Permeabilitas dan Penetrasi Kulit... 4
2.2 Rice Bran Oil ... 5
2.2.1 Komponen Kimia Rice Bran Oil ... 5
2.2.2 Manfaat Rice Bran Oil ... 5
2.3 Krim ... 5
2.3.1 Definisi Krim ... 5
2.3.2 Tipe Krim ... 6
2.3.3 Komponen Krim ... 6
2.3.4 Stabilitas Krim ... 7
2.4 Radikal bebas ... 8
2.4.1 Definisi Radikal Bebas ... 8
2.4.2 Sumber Radikal Bebas ... 9
2.4.3 Pembentukan Radikal bebas ... 9
2.4.4 Bahaya Radikal bebas ... 9
2.5 Antioksidan ... 10
2.5.1 Definisi Antioksidan ... 10
2.5.2 Pengelompokkan Antioksidan ... 10
2.6 Uji Aktivitas Antioksidan dengan Metode DPPH ... 11
xii
BAB 3 METODE PENELITIAN ... 13
3.1Tempat dan Waktu Penelitian ... 13
3.2Alat dan Bahan Penelitian ... 13
3.2.1 Alat Penelitian ... 13
3.2.2 Bahan Penelitian ... 13
3.3 Prosedur Kerja ... 13
3.3.1 Karakterisasi Sampel RBO ... 13
3.3.2 Rancangan Formula krim RBO ... 14
3.3.3 Proses Pembuatan Krim RBO ... 14
3.3.4 Evaluasi Fisik Krim RBO ... 14
3.3.5 Pengujian Aktivitas Antioksidan RBO dan Krim RBO ... 15
3.3.6 Alur Penelitian ... 17
BAB 4 HASIL DAN PEMBAHASAN ... 18
4.1Hasil Formulasi Krim RBO ... 18
4.2Hasil Evaluasi Fisik Krim RBO ... 18
4.2.1 Hasil Pengamatan Organoleptis Krim RBO ... 18
4.2.2 Hasil Pengujian Homogenitas Krim RBO ... 19
4.2.3 Hasil Pengukuran pH Krim RBO ... 19
4.2.4 Hasil Pengukuran Viskositas Krim RBO... 20
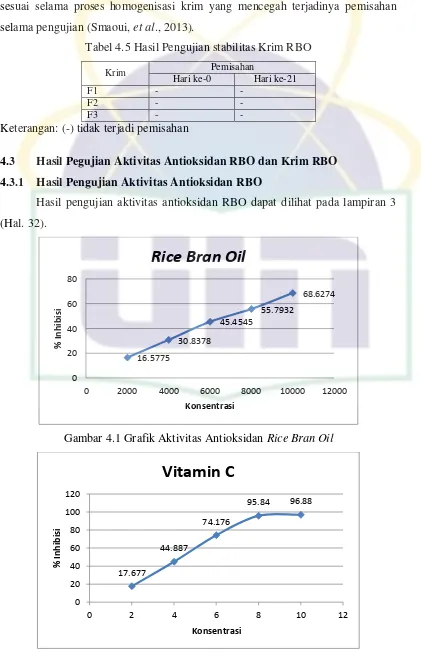
4.2.5 Hasil Pengujian Stabilitas Krim RBO ... 20
4.3 Hasil Pengujian Aktivitas Antioksidan RBO dan Krim RBO ... 21
4.3.1 Hasil Pengujian Aktivitas Antioksidan RBO ... 21
4.3.2 Hasil Pengujian Aktivitas Antioksidan Krim RBO Konsentrasi 7000 g/mL ... 23
BAB 5 KESIMPULAN DAN SARAN ... 24
5.1Kesimpulan ... 24
5.2Saran ... 24
xiii
DAFTAR TABEL
Halaman
Tabel 2.1 Komponen Utama Krim ... 6
Tabel 3.1 Karakterisasi Sampel RBO ... 14
Tabel 3.2 Rancangan Formula Krim RBO ... 14
Tabel 4.1 Hasil Hasil Pengamatan Organoleptis Krim RBO ... 19
Tabel 4.2 Hasil Pengujian Homogenitas Krim RBO ... 19
Tabel 4.3 Hasil Pengukuran pH Krim RBO ... 20
Tabel 4.4 Hasil Pengukuran Viskositas Krim RBO ... 20
xiv
DAFTAR GAMBAR
Halaman
Gambar 2.1 Penampang Kulit ...3
Gambar 2.2 Ilustrasi Skematik Beberapa Tipe Ketidakstabilan Emulsi ...8
Gambar 2.3 Reduksi DPPH dari Senyawa Peredam Radikal Bebas ... 11
Gambar 4.1 Grafik Aktivitas Antioksidan Rice Bran Oil ... 21
Gambar 4.2 Grafik Aktivitas Antioksidan Vitamin C ... 21
xv
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Prosedur Pengujian Aktivitas Antioksidan RBO dan Krim
RBO ... 29
Lampiran 2. Skema Pengujian Aktivitas Antioksidan RBO dan krim RBO ... 31
Lampiran 3. Hasil Pengujian Aktivitas Antioksidan RBO, Vitamin C, dan Krim RBO... 32
Lampiran 4. Sertifikat Analisis RBO ... 34
Lampiran 5. Sertifikat Analisis Asam Stearat... 35
Lampiran 6. Sertifikat Analisis Trietanolamin ... 36
Lampiran 7. Sertifikat Analisis DPPH ... 37
Lampiran 8. Sertifikat Analisis DPPH ... 38
1 UIN Syarif Hidayatullah Jakarta
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Minyak dedak padi atau yang lebih dikenal sebagai rice bran oil (RBO) merupakan minyak yang diekstraksi dari lapisan luar butiran padi dengan
sejumlah lembaga biji. Rice bran oil mengandung beberapa jenis lemak yaitu lemak monounsaturated, polyunsaturated, dan saturated serta asam lemak yaitu asam oleat, linoleat, linolenat, palmitat, dan stearat. Minyak ini juga kaya akan
antioksidan alami seperti vitamin E, tokotrienol, dan gamma-oryzanol yang dapat menangkal radikal bebas (Nasir, et al., 2009; Vorarat, et al., 2010).
Vitamin E diketahui berfungsi sebagai pemecah rantai antioksidan yang
mencegah propagasi dari reaksi radikal bebas. Tokotrienol telah dilaporkan
terlibat dalam aktivitas antikanker. Sedangkan gamma-oryzanol berperan dalam menurunkan kadar kolesterol dalam darah. Selain itu, gamma-oryzanol juga dapat melindungi kulit dari radiasi ultraviolet dan meningkatkan kelembaban kulit
(Vorarat, et al., 2010; Arab, et al., 2011; Choudhary, et al., 2013). Dengan adanya kandungan antioksidan inilah maka rice bran oil berpotensi untuk dibuat menjadi sediaan kosmetik perawatan kulit, salah satunya krim. Krim yang mengandung
antioksidan menyediakan perlindungan yang lebih besar terhadap pengaruh
lingkungan (matahari, polusi, angin, dan temperatur) pada kulit, sehingga
menghambat penuaan dan kerusakan kulit (Mishra, et al., 2010).
Sediaan krim dipilih karena memiliki beberapa keuntungan diantaranya
lebih mudah diaplikasikan, lebih nyaman digunakan pada wajah, tidak lengket,
dan mudah dicuci dengan air dibandingkan dengan sediaan salep, gel maupun
pasta (Sharon, et al., 2013). Pemanfaatan rice bran oil sebagai komponen dalam sediaan krim lebih baik daripada minyak mineral karena lebih mudah bercampur
dengan lemak kulit, lebih mampu menembus sel-sel stratum korneum, dan
memiliki daya adhesi yang lebih kuat (Tranggono dan Latifah, 2007).
Krim dengan sistem emulsi minyak dalam air (m/a) lebih banyak disukai
daripada krim dengan sistem emulsi air dalam minyak (a/m) karena tidak terasa
berlemak dan memerlukan biaya produksi yang lebih rendah terkait besarnya
2
UIN Syarif Hidayatullah Jakarta tidak terlalu dipilih karena memiliki karakteristik berlemak dan terasa berminyak
saat diaplikasikan ke kulit (Eipstein, 2009).
Berdasarkan pemaparan diatas, dibuatlah sediaan krim tipe minyak dalam
air (m/a) yang berbahan dasar rice bran oil. Formula krim rice bran oil
menggunakan variasi konsentrasi emulgator asam stearat dan trietanolamin.
Variasi emulgator diharapkan dapat membentuk sediaan krim yang baik dan
memenuhi persyaratan kestabilan fisik.
1.2 Rumusan Masalah
1. Apakah rice bran oil dapat diformulasikan menjadi sediaan krim tipe m/a yang baik dan stabil?
2. Berapa konsentrasi emulgator yang dapat menghasilkan sediaan krim rice bran oil yang baik dan stabil?
3. Apakah terdapat perbedaan aktivitas antioksidan rice bran oil sebelum dan setelah diformulasikan menjadi sediaan krim?
1.3 Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. Memformulasikan rice bran oil menjadi sediaan krim tipe m/a yang baik dan stabil selama jangka waktu penyimpanan tertentu.
2. Mencari konsentrasi emulgator yang dapat menghasilkan sediaan krim rice bran oil yang baik dan stabil selama jangka waktu penyimpanan tertentu. 3. Mengukur aktivitas antioksidan krim rice bran oil.
1.4 Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai
pemanfaatan rice bran oil sebagai bahan dasar dalam sediaan krim dengan menggunakan variasi konsentrasi emulgator asam stearat dan
trietanolamin serta dapat memberikan informasi mengenai aktivitas
3
UIN Syarif Hidayatullah Jakarta
BAB 2
TINJAUAN PUSTAKA
2.1 Kulit
2.1.1 Anatomi dan Fisiologi Kulit
Kulit merupakan “selimut” yang menutupi permukaan tubuh dan memiliki
fungsi utama sebagai pelindung dari berbagai macam gangguan dan rangsangan
luar. Fungsi perlindungan ini terjadi melalui sejumlah mekanisme biologis, seperti
pembentukan lapisan tanduk secara terus menerus (keratinisasi dan pelepasan
sel-sel yang sudah mati), respirasi dan pengaturan suhu tubuh, produksi sebum dan
keringat, dan pembentukan pigmen melanin untuk melindungi kulit dari bahaya
sinar ultraviolet matahari, sebagai peraba dan perasa, serta pertahanan terhadap
tekanan dan infeksi dari luar (Tranggono dan Latifah, 2007).
Gambar 2.1 Penampang Kulit (Graaf, et al., 2001)
Kulit manusia terbagi atas dua lapisan utama, yaitu (Tranggono dan Latifah,
2007):
1. Epidermis (kulit ari), sebagai lapisan yang paling luar.
Epidermis tersusun atas beberapa lapisan sel dengan ketebalan 0.1-0.3 mm
(Mitsui, 1997). Lapisan epidermis dari bagian terluar hingga ke dalam terbagi
menjadi 5 lapisan, yakni (Tranggono dan Latifah, 2007):
Lapisan Tanduk (stratum corneum), sebagai lapisan yang paling atas terdiri atas beberapa lapis sel yang pipih, mati, tidak memiliki inti, tidak mengalami
proses metabolisme, tidak berwarna, dan sangat sedikit mengandung air.
4
UIN Syarif Hidayatullah Jakarta
Lapisan Jernih (stratum lucidum), disebut juga “lapisan barrier” merupakan
lapisan yang tipis, jernih, mengandung eleidin, sangat tampak jelas pada
telapak tangan dan kaki.
Lapisan Berbutir-butir (stratum granulosum) tersusun oleh sel-sel keratinosit yang berbentuk poligonal, berbutir kasar, berinti mengkerut.
Lapisan Malphigi (stratum spinosum) memiliki sel yang berbentuk kubus dan seperti berduri.
Lapisan Basal (stratum germinativum) yang hanya tersusun oleh satu lapis sel-sel basal.
2. Dermis (korium, kutis, kulit jangat).
Dermis terutama terdiri dari bahan dasar serabut kolagen dan elastin, yang
berada di dalam substansi dasar yang bersifat koloid dan terbuat dari gelatin
mukopolisakarida. Di dalam dermis terdapat adneksa-adneksa kulit seperti folikel
rambut, papilla rambut, kelenjar keringat, saluran keringat, kelenjar sebasea, otot
penegak rambut, ujung pembuluh darah dan ujung saraf, juga sebagian serabut
lemak yang terdapat pada lapisan lemak bawah kulit (subkutis/hipodermis)
(Tranggono dan Latifah, 2007).
2.1.2 Permeabilitas dan Penetrasi Kulit
Menurut Tranggono dan Latifah (2007) terdapat beberapa cara penetrasi
yang mungkin ke dalam kulit, yaitu:
1. Lewat antara sel-sel stratum corneum
2. Melalui dinding saluran folikel rambut
3. Melalui kelenjar keringat
4. Melalui kelenjar sebasea
5. Menembus sel-sel stratum corneum
Cara 1 dan 5 disebut transepidermal. Cara 3 dan 4 disebut penetrasi. Cara
2 disebut transfolikular.
Faktor-faktor yang mempengaruhi penetrasi kulit sangat bergantung dari
sifat fisika kimia obat dan juga bergantung pada zat pembawa, pH, dan
konsentrasi. Perbedaan fisiologis melibatkan kondisi kulit yaitu apakah kulit
dalam keadaan baik atau terluka, umur kulit, perbedaan spesies, dan kelembaban
5
UIN Syarif Hidayatullah Jakarta
2.2 Rice Bran Oil (RBO)
Dedak merupakan hasil samping proses penggilingan padi, terdiri atas
lapisan luar butiran padi dengan sejumlah lembaga biji. Sementara bekatul
(polish) adalah lapisan dalam butiran padi, termasuk sebagian kecil endosperm berpati (Nasir, et al., 2009).
Minyak dedak padi atau dikenal sebagai rice bran oil (RBO) merupakan minyak alami yang kaya akan antioksidan yang diperoleh dari ekstraksi dedak
padi. Rice bran oil terbentuk sebagai cairan jernih berwarna kuning pucat, tidak berbau, dan rasanya sedikit manis (Cicero & Derosa, 2005).
2.2.1 Komponen Kimia Rice Bran Oil
Rice bran oil mengandung beberapa jenis asam lemak dan senyawa antioksidan. Asam lemak yang terkandung dalam rice bran oil antara lain asam
oleat (γ8.4%), asam linoleat (γ4.4%), dan asam α-linolenat (2.2%) sebagai asam
lemak tidak jenuh serta asam palmitat (21.5%), dan asam stearat (2.9%) sebagai
asam lemak jenuh (Sayre et al., 1990). Sedangkan senyawaantioksidannya terdiri
dari vitamin E (0.1-0.14%), dan gamma-oryzanol (0.9-2.9%). Vitamin E terdiri
atas empat kelompok tokoferol (α, , and δ) dan empat kelompok tokotrienol (α,
, and δ) (Arab, et al., 2011).
2.2.2 Manfaat Rice Bran Oil
Rice bran oil diketahui dapat menangkal radikal bebas karena mengandung senyawa antioksidan. Gamma-oryzanol melindungi kulit dari radiasi sinar ultraviolet dan meningkatkan kelembaban kulit. Gamma-oryzanol juga diketahui memiliki aktivitas farmakologis karena dapat menurunkan kadar
kolesterol dalam darah. Vitamin E berfungsi sebagai pemecah rantai antioksidan
yang mencegah propagasi dari reaksi radikal bebas. Sedangkan tokotrienol juga
telah dilaporkan terlibat dalam aktivitas antikanker dan anti aging (Arab, et al., 2011; Choudhary, et al., 2013).
2.3 Krim
2.3.1 Definisi Krim
Krim adalah tipe emulsi dimana dua cairan yang tidak saling bercampur,
6
UIN Syarif Hidayatullah Jakarta fase terdispersi melalui fase lain yang bertindak sebagai medium pendispersi
(Mitsui, 1997). Dispersi ini bersifat tidak stabil sehingga dibutuhkan suatu
emulgator agar dihasilkan suatu emulsi yang stabil. Semua emulgator bekerja
dengan membentuk lapisan (film) disekeliling butir-butir tetesan terdispersi dan
film ini berfungsi agar mencegah terjadinya koalesen dan terpisahnya cairan
dispers sebagai fase terpisah (Anief, 2008).
2.3.2 Tipe Krim
Seperti halnya emulsi, krim terdiri dari dua fase cair dimana salah satu fase
bersifat polar (contoh: air) dan fase lainnya bersifat relatif non-polar (contoh:
minyak). Krim dengan sistem emulsi minyak dalam air (m/a) dimana fase minyak
didispersikan sebagai butiran-butiran ke dalam fase air yang bertindak sebagai
fase kontinyu. Krim dengan sistem emulsi air dalam minyak (a/m) dimana fase
minyak bertindak sebagai fase kontinyu (Martin, et al., 1993).
2.3.3 Komponen Krim
Menurut Mitsui (1997) komponen krim secara umum mengandung fase
minyak, fase air, emulgator, dan bahan-bahan lainnya.
Tabel 2.1 Komponen Utama Krim (Mitsui, 1997)
Komponen Jenis Bahan
Fase minyak Hidrokarbon: skualen, paraffin, petrolatum, ceresin
Lemak dan minyak: minyak zaitun, minyak almond, lemak coklat Wax ester: bees wax, lanolin, carnauba wax
Asam lemak: asam stearat, asam oleat, asam palmitat, asam miristat Lemak alkohol: stearil alkohol, heksadesil alkohol
Ester sintetik: IPM, gliserin triester, kolesteril ester Lainnya: minyak silikon (dimetikon, siklometikon) Fase air Humektan: gliserin, propilenglikol, mannitol
Agen pengental: pektin, turunan sellulosa, xanthan gum, karagenan Alkohol: etanol, isopropil alkohol
Air murni: aqua DM
Surfaktan Non-ionik: gliserin monostearat, ester asam lemak sorbitan Anionik: sabun asam lemak, natrium alkil sulfat
Bahan lainnya Alkalis, parfum, pewarna, agen pengkhelat, pengawet, antioksidan, buffer, dan bahan aktif farmasi
Penggunaan minyak tumbuhan dalam komponen fase minyak sediaan
krim, lebih baik daripada minyak mineral karena lebih mudah bercampur dengan
lemak kulit, lebih mampu menembus sel-sel stratum korneum, dan memiliki daya
7
UIN Syarif Hidayatullah Jakarta Fase lemak lain yang digunakan adalah asam stearat dan setil alkohol.
Asam stearat berbentuk padatan kristal, berwarna putih atau sedikit kuning,
mengkilat, praktis tidak larut dalam air, berfungsi sebagai emulsifying agent
(Rowe, et al., 2009).
Setil alkohol terbentuk sebagai lilin, berupa butiran atau serpihan,
berwarna putih, praktis tidak larut dalam air, berfungsi sebagai stiffening agent. Setil alkohol juga dapat berfungsi sebagai emolien, water-absorptive dan
emulsifying agent (Rowe, et al., 2009).
Trietanolamin banyak digunakan dalam formulasi sediaan topikal,
terutama dalam pembentukan emulsi. Trietanolamin terbentuk sebagai cairan
kental yang jernih, tidak berwarna hingga kuning pucat, dan berbau sedikit
amoniak (Rowe, et al., 2009).
Aplikasi gliserin pada produk perawatan kulit berfungsi sebagai humektan
dan pelindung kulit (Loden, 2009). Gliserin juga digunakan sebagai solven dan
kosolven dalam sediaan krim dan emulsi (Rowe, et al., 2009).
Golongan paraben telah secara luas digunakan sebagai pengawet dalam
kosmetik karena efektif pada kisaran pH yang luas dan memiliki aktivitas
antimikroba spektrum luas, meskipun paling efektif terhadap ragi dan jamur.
Aktivitas antimikrobanya meningkat dengan meningkatnya panjang gugus alkil,
namun kelarutan dalam larutan berair menurun sehingga campuran paraben sering
digunakan agar fungsi pengawetnya efektif. Kombinasi metil paraben dan propil
paraben memberikan efek sinergis yang dapat meningkatkan aktivitas
antimikrobanya (Rowe, et al., 2009).
2.3.4 Stabilitas Krim
Terdapat empat fenomena utama yang berhubungan dengan
ketidakstabilan suatu emulsi yaitu flokulasi, creaming, koalesen, dan pemisahan
sempurna (breaking) (Im-Emsap & Siepmann, 2002). Hal tersebut juga bisa
8
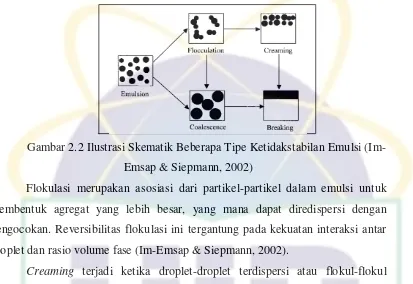
UIN Syarif Hidayatullah Jakarta Gambar 2.2 Ilustrasi Skematik Beberapa Tipe Ketidakstabilan Emulsi
(Im-Emsap & Siepmann, 2002)
Flokulasi merupakan asosiasi dari partikel-partikel dalam emulsi untuk
membentuk agregat yang lebih besar, yang mana dapat diredispersi dengan
pengocokan. Reversibilitas flokulasi ini tergantung pada kekuatan interaksi antar
droplet dan rasio volume fase (Im-Emsap & Siepmann, 2002).
Creaming terjadi ketika droplet-droplet terdispersi atau flokul-flokul terpisah dari medium pendispersi di bawah pengaruh gaya gravitasional
(Im-Emsap & Siepmann, 2002). Creaming dapat diminimalisasi dengan memperkecil ukuran droplet, menyamakan berat jenis dari kedua fase, dan menambah
viskositas dari fase kontinyu (Martin, et al., 1993).
Koalesen terjadi ketika penghalang (barrier) mekanik atau listrik tidak
cukup untuk mencegah pembentukan droplet yang lebih besar yang dapat memicu
pemisahan sempurna (breaking). Koalesen dapat dihindari dengan pembentukan
lapisan antarmuka yang mengandung makromolekul atau partikulat-partikulat
padat (Im-Emsap & Siepmann, 2002).
2.4 Radikal Bebas
2.4.1 Definisi Radikal Bebas
Radikal bebas (free radical) adalah suatu senyawa atau molekul yang mengandung satu atau lebih elektron tidak berpasangan pada orbital luarnya.
Adanya elektron yang tidak berpasangan menyebabkan senyawa tersebut relatif
tidak stabil dan sangat reaktif mencari pasangan, dengan cara menyerang dan
mengikat elektron molekul yang berada di sekitarnya sehingga disebut juga
9
UIN Syarif Hidayatullah Jakarta
2.4.2 Sumber Radikal Bebas
Radikal bebas terbentuk selain secara alamiah melalui sistem biologis
tubuh (sumber internal), juga berasal dari lingkungan (sumber eksternal). Reaksi
inflamasi maupun pada setiap respirasi di mitokondria, akan menghasilkan
oksidan. Kelebihan gizi juga merupakan faktor pemicu internal. Hal ini karena
saat dimetabolisme, disamping energi juga akan dihasilkan radikal bebas.
Sedangkan sebagai faktor eksternal, antara lain sinar ultra violet matahari antara
pukul 10.00-15.00, polusi asap rokok dan pabrik, emisi kendaraan bermotor
maupun konsumsi alkohol (Pinnell, 2003; Ames, et al., 1993; Baumann, 2002; Prahl, et al., 2008).
2.4.3 Pembentukan Radikal Bebas
Secara umum, tahapan reaksi pembentukan radikal bebas mirip dengan
rancidity oxidative (ketengikan oksidatif), yaitu melalui tiga tahapan reaksi berikut (Winarsi, 2011):
a. Tahap inisiasi, yaitu awal pembentukan radikal bebas. Misalnya:
Fe2+ + H2O2 → Fe3+ + OH- + ·OH R1-H + ·OH → R1· + H2O
b. Tahap propagasi, yaitu pemanjangan rantai radikal.
R2-H + R1· → R2· + R1-H
R3-H + R2· → R3· + R2-H
c. Tahap terminasi, yaitu bereaksinya senyawa radikal dengan radikal lain atau
dengan penangkap radikal, sehingga potensi propagasinya rendah.
R1· + R1· → R1- R1
R2· + R1· → R2- R1
R2· + R2· → R2- R2, dst.
2.4.4 Bahaya Radikal Bebas (Winarsi, 2011)
Target utama radikal bebas adalah protein, asam lemak tak jenuh dan
lipoprotein, serta unsur DNA termasuk karbohidrat. Dari ketiga molekul tersebut,
yang paling rentan terhadap serangan radikal bebas adalah asam lemak tak jenuh.
Berbagai kemungkinan dapat terjadi sebagai akibat kerja radikal bebas.
10
UIN Syarif Hidayatullah Jakarta tidak dapat dikenali oleh sistem imun, dan bahkan mutasi. Semua bentuk
gangguan tersebut dapat memicu munculnya berbagai penyakit.
Sadikin (2001) berpendapat bahwa serangan radikal bebas terhadap
molekul sekelilingnya akan menyebabkan terjadinya reaksi berantai, yang
kemudian menghasilkan senyawa radikal baru. Dampak reaktivitas senyawa
radikal bebas bermacam-macam, mulai dari kerusakan sel atau jaringan, penyakit
autoimun, penyakit degeneratif, hingga kanker.
2.5 Antioksidan
2.5.1 Definisi Antioksidan
Antioksidan adalah senyawa yang dapat menunda, menghambat atau
mencegah oksidasi lipid atau molekul lain dengan menghambat inisiasi atau
propagasi dari reaksi rantai oksidatif (Javanmardi, et al., 2003). Antioksidan merupakan senyawa pemberi elektron (electron donor) atau reduktan. Senyawa ini memiliki berat molekul kecil, tetapi mampu menginaktivasi berkembangnya
reaksi oksidasi, dengan cara mencegah terbentuknya radikal. Antioksidan juga
merupakan senyawa yang dapat menghambat reaksi oksidasi dengan mengikat
radikal bebas dan molekul yang sangat reaktif. Akibatnya, kerusakan sel akan
dihambat (Winarsi, 2011).
2.5.2 Pengelompokan Antioksidan
Secara umum, antioksidan dikelompokkan menjadi 2, yaitu antioksidan
enzimatis dan antioksidan non-enimatis. Antioksidan enzimatis misalnya enzim
superoksida dismutase (SOD), katalase, dan glutation peroksidase. Antioksidan
non-enzimatis dibagi dalam dua kelompok yaitu antioksidan larut lemak dan
antioksidan larut air. Antioksidan larut lemak seperti tokoferol, karotenoid,
flavonoid, quinon, dan bilirubin. Sedangkan antioksidan larut air seperti asam
askorbat, asam urat, protein pengikat logam, dan protein pengikat heme.
Antioksidan enzimatis dan non-enimatis tersebut bekerja sama memerangi
aktivitas senyawa oksidan dalam tubuh (Winarsi, 2011).
Lebih lanjut, Tandon (2005) menyatakan bahwa antioksidan digolongkan
menjadi tiga kelompok berdasarkan mekanisme pertahanannya, yaitu antioksidan
11
UIN Syarif Hidayatullah Jakarta
2.6 Uji Aktivitas Antioksidan dengan Metode DPPH
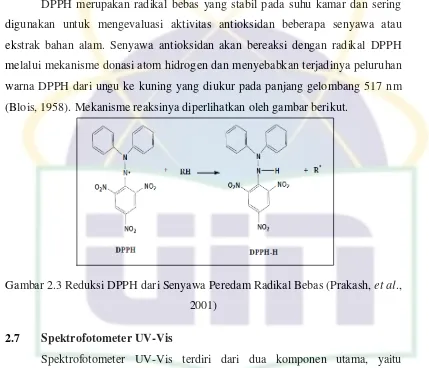
DPPH merupakan radikal bebas yang stabil pada suhu kamar dan sering
digunakan untuk mengevaluasi aktivitas antioksidan beberapa senyawa atau
ekstrak bahan alam. Senyawa antioksidan akan bereaksi dengan radikal DPPH
melalui mekanisme donasi atom hidrogen dan menyebabkan terjadinya peluruhan
warna DPPH dari ungu ke kuning yang diukur pada panjang gelombang 517 nm
(Blois, 1958). Mekanisme reaksinya diperlihatkan oleh gambar berikut.
Gambar 2.3 Reduksi DPPH dari Senyawa Peredam Radikal Bebas (Prakash, et al., 2001)
2.7 Spektrofotometer UV-Vis
Spektrofotometer UV-Vis terdiri dari dua komponen utama, yaitu
spektrometer dan fotometer. Spektrometer menghasilkan spektra panjang
gelombang tertentu, Sedangkan fotometer merupakan alat pengukur intensitas
cahaya yang ditransmisikan atau diabsorbsi. Spektrofotometer UV-Vis digunakan
untuk mengukur energi secara relatif bila energi tersebut ditransmisikan,
direfleksikan, atau diemisikan sebagai fungsi dari panjang gelombang. Sedangkan
spektrofotometri adalah suatu metode yang didasarkan pada pengukuran energi
cahaya tampak (visibel) atau cahaya ultraviolet (UV) oleh suatu senyawa sebagai
fungsi panjang gelombang (Day & Underwood, 2002).
Prinsip penentuan spektrofotometer UV-Vis adalah aplikasi hukum
“Lambert-Beer” yang menyatakan bahwa intensitas yang diteruskan oleh larutan
zat penyerap berbanding lurus dengan tebal dan konsentrasi larutan (Sudjadi,
12
UIN Syarif Hidayatullah Jakarta Keterangan: A = absorbansi sampel
a = absorptivitas b = tebal kuvet
c = konsentrasi sampel
Dimana terdapat beberapa pembatasan, antara lain:
Sinar yang digunakan dianggap monokromatis
Penyerapan terjadi dalam suatu volume yang mempunyai penampang luas
yang sama
Senyawa yang menyerap dalam larutan tersebut tidak tergantung terhadap
yang lain dalam larutan tersebut
Tidak terjadi peristiwa fluoresensi atau fosforesensi
Indeks bias tidak tergantung pada konsentrasi larutan
13
UIN Syarif Hidayatullah Jakarta
BAB 3
METODE PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium penelitian 1 dan Laboratorium
penelitian 2 Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan
Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta dari bulan April
hingga Agustus 2014.
3.2 Alat dan Bahan Penelitian 3.2.1 Alat Penelitian
Peralatan yang digunakan pada penelitian ini yaitu peralatan gelas,
hotplate, homogenizer (NISSEI), timbangan analitik (AND GH-202), viskometer (HAAKE viscoTester 6R), pH meter digital (HORBA), Sentrifugator (HETTICH
ZENTRIFUGEN D-78532), vortex (WIGGEN HAUSER), mikropipet
(BIORAD), dan spektrofotometer UV-Vis (HITACHI U-2910).
3.2.2 Bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian ini yaitu rice bran oil (CV. Cipta Anugerah, Jawa Timur), gliserin (CV. Cipta Anugerah, Jawa Timur),
trietanolamin (CV. Cipta Anugerah, Jawa Timur), asam stearat (PT Brataco,
Jakarta), setil alkohol (PT Brataco, Jakarta), metil paraben (PT Brataco, Jakarta),
propil paraben (PT Brataco, Jakarta), vitamin C (PT. Indofarma, Jawa Barat), etil
asetat, DPPH (2,2-diphenyl-1-picrylhydrazyl) (Sigma Aldrich), dan akuades.
3.3 Prosedur Kerja
3.3.1 Karakterisasi Sampel RBO
Karakterisasi sampel rice bran oil (RBO) berdasarkan certificate of analysis dapat dilihat pada tabel 3.1.
Organoleptik : Cairan berminyak berwarna kuning pucat, rasa sedikit spesifik.
14
UIN Syarif Hidayatullah Jakarta Tabel 3.1 Karakterisasi Sampel RBO
Unit Hasil
Nilai keasaman mg KOH/g 0,049
Nilai saponifikasi mg KOH/g 188,0
Nilai iodin g 2/100g 103,7
Zat tidak tersaponifikasi % 2,53
Kemurnian (1) Logam berat ppm Tidak terdeteksi
Kemurnian (2) Arsenik ppm Tidak terdeteksi
3.3.2 Rancangan Formula Krim RBO
Tabel 3.2 Formula Krim RBO (Sharon, et al., 2013 dengan modifikasi)
Bahan Konsentrasi (%)
3.3.3 Proses Pembuatan Krim RBO
Proses diawali dengan penimbangan bahan-bahan yang akan digunakan.
Bahan-bahan yang larut dalam air seperti trietanolamin, gliserin, metil paraben
dicampur ke dalam akuades dan dipanaskan hingga 70-80°C. Pada bagian lain,
bahan-bahan yang tergolong fase minyak seperti rice bran oil, asam stearat, setil alkohol, dan propil paraben dicampur dan dipanaskan pada temperatur yang sama.
Fase air kemudian ditambahkan sedikit demi sedikit ke dalam fase minyak dan
dilakukan proses pengadukan dengan menggunakan homogenizer agar diperoleh
sediaan krim yang homogen dengan kecepatan 2000 rpm selama 25 menit. Krim
yang terbentuk kemudian dipindahkan dalam wadah dan dilakukan pendinginan
pada suhu kamar hingga diperoleh sediaan krim yang mengental (Smaoui, et al., 2012 dengan modifikasi).
3.3.4 Evaluasi Fisik Krim RBO
Evaluasi fisik sediaan krim yang dilakukan selama 21 hari meliputi
pengamatan organoleptik krim, pengujian homogenitas, pengukuran pH,
pengukuran viskositas, dan pengujian stabilitas dengan metode sentrifugasi
15
UIN Syarif Hidayatullah Jakarta
3.3.4.1Pengamatan Organoleptis
Pengamatan sediaan krim dilakukan dengan mengamati dari segi warna,
bau, dan tekstur krim (Sharon, et al., 2013).
3.3.4.2Pengujian Homogenitas
Pemeriksaan homogenitas dilakukan dengan menggunakan gelas objek.
Sejumlah tertentu krim dioleskan pada kaca objek dan diamati adanya butiran
kasar (Ditjen POM, 1979).
3.3.4.3Pengukuran pH
Pengukuran pH dilakukan dengan menggunakan pH meter. pH meter
sebelumnya dikalibrasi dengan menggunakan larutan buffer standar. Ditimbang
sebanyak 0.5 gram krim dan dilarutkan dalam 50 mL akuades kemudian pH-nya
diukur (Aswal, et al., 2013).
3.3.4.4Pengukuran Viskositas
Pengukuran viskositas krim dilakukan dengan menggunakan viskometer
HAAKE ViscoTester 6R. Sediaan disimpan dalam beacker glass 100 mL. Power
alat ditekan dan alat akan mengkalibrasi terlebih dahulu kemudian dipilih spindel
yang cocok dengan kecepatan 2 rpm (Elya, et al., 2013). Krim F1 menggunakan spindel nomer 5, krim F2 menggunakan spindel nomer 6, dan krim F3
menggunakan spindel nomer 7.
3.3.4.5Pengujian Stabilitas dengan Metode Sentrifugasi
Pengujian stabilitas dilakukan dengan menempatkan 10 gr sampel krim ke
dalam tube sentrifugasi kemudian disentrifugasi dengan kecepatan 5000 rpm selama 10 menit (Smaoui, et al., 2012).
3.3.5 Pengujian Aktivitas Antioksidan RBO dan Krim RBO 3.3.5.1 Pengujian Aktivitas Antioksidan RBO
Sebanyak 500 mg sampel RBO dilarutkan dalam etil asetat hingga 25 mL
(diperoleh konsentrasi larutan induk 20000 g/mL). Dilakukan pengenceran dari
larutan induk tersebut menjadi beberapa konsentrasi yaitu 2000, 4000, 6000,
16
UIN Syarif Hidayatullah Jakarta mL larutan DPPH dalam etil asetat (0.04%) (Deepam, et al., 2011 dengan modifikasi). Campuran tersebut kemudian dihomogenkan dan didiamkan selama
30 menit dalam ruangan gelap (Mishra, et al., 2010). Penurunan absorbansi diukur pada panjang gelombang 515.5 nm. Sebagai kontrol positif digunakan vitamin C.
Perhitungan aktivitas anti-radikal DPPH dihitung sebagai persentase reduksi
DPPH (Q), mengacu pada Molyneux (2004), sebagai berikut:
Q
Ao = Absorbansi awal (larutan DPPH/2,2-diphenyl-1-picrylhidrazyl)
Ac = Absorbansi setelah penambahan sampel dengan konsentrasi tertentu
Persen aktivitas anti-radikal DPPH (persen inhibisi) kemudian diplot
terhadap konsentrasi sehingga didapat nilai IC50.
3.3.5.2 Pengujian Aktivitas Antioksidan Krim RBO Konsentrasi 7000 g/mL
Sebanyak 5 gr krim RBO dilarutkan dalam etil asetat hingga 25 mL.
Diambil sebanyak 3,5 mL dari larutan tersebut dan dicukupkan volumenya dengan
etil asetat hingga 10 mL. Larutan sampel (2 mL) dicampur dengan 2 mL larutan
DPPH dalam etil asetat (0.04%) (Deepam, et al., 2011 dengan modifikasi). Campuran tersebut kemudian dihomogenkan dan didiamkan selama 30 menit
dalam ruangan gelap (Mishra, et al., 2010). Penurunan absorbansi diukur pada panjang gelombang 515.5 nm. Perhitungan aktivitas anti-radikal DPPH dihitung
sebagai persentase reduksi DPPH (Q), mengacu pada Molyneux (2004), sebagai
berikut:
Q
Ao = Absorbansi awal (larutan DPPH/2,2-diphenyl-1-picrylhidrazyl)
17
UIN Syarif Hidayatullah Jakarta
3.3.6 Alur Penelitian
BAB 2
TINJAUAN PUSTAKA Rice bran oil
Formulasi krim rice bran oil
dalam berbagai perbandingan asam stearat dan trietanolamin
Pembuatan krim
Analisis sampel uji menggunakan spektrofotometer UV-Vis Evaluasi fisik krim meliputi
pengamatan organoleptik, uji homogenitas, uji pH, uji viskositas, dan uji sentrifugasi
Uji aktivitas antioksidan dengan metode DPPH
18 yang telah dikembangkan dan disesuaikan dengan ketersediaan bahan yang mudah
diperoleh dan yang umum digunakan dalam sediaan krim, seperti emulgator,
stiffening agent, humektan, pengawet, dan akuades. Zat pengemulsi atau emulgator berperan penting untuk menciptakan krim yang stabil. Emulgator
bekerja dengan membentuk lapisan (film) disekeliling tetesan terdispers sehingga
mencegah terjadinya koalesen dan terpisahnya cairan dispers (Anief, 2008).
Krim RBO menggunakan kombinasi emulgator asam stearat dan
trietanolamin. Asam stearat akan meningkatkan konsistensi krim dan membuat
krim tampak lebih kaku sementara trietanolamin akan menurunkan konsistensi
krim sehingga krim lebih encer dan mudah dituang (Rowe, et al., 2009). Kombinasi asam stearat dan trietanolamin diharapkan mampu menghasilkan krim
dengan konsistensi yang baik. Perbandingan asam stearat dan trietanolamin yang
digunakan dalam formula krim yaitu krim F1 (8% : 1%), krim F2 (12% : 2%), dan
krim F3 (16% : 3%).
4.2 HasilEvaluasi Fisik Krim RBO
4.2.1 Hasil Pengamatan Organoleptis Krim RBO
Hasil pengamatan organoleptis krim F1, F2, dan F3 pada hari ke-0
menunjukkan bahwa krim berwarna putih, tidak berbau, memiliki tekstur yang
lembut, dan tidak terasa lengket ketika diaplikasikan ke kulit (Tabel 4.1). Ketiga
formula krim tidak mengalami perubahan baik dari segi warna, bau maupun
tekstur setelah dilakukan penyimpanan selama 21 hari.
19
UIN Syarif Hidayatullah Jakarta Tabel 4.1 Hasil Pengamatan Organoleptis Krim RBO
Hari ke-0
Krim Warna Bau Tekstur
F1 Putih Tidak berbau Lembut, tidak terasa lengket
F2 Putih Tidak berbau Lembut, tidak terasa lengket
F3 Putih Tidak berbau Lembut, tidak terasa lengket
Hari ke-21
Krim Warna Bau Tekstur
F1 Putih Tidak berbau Lembut, tidak terasa lengket
F2 Putih Tidak berbau Lembut, tidak terasa lengket
F3 Putih Tidak berbau Lembut, tidak terasa lengket
4.2.2 Hasil Pengujian Homogenitas Krim RBO
Hasil pengujian homogenitas krim pada hari ke-0 menunjukkan bahwa
krim F1, F2, dan F3 homogen (Tabel 4.2). Krim F2 menjadi tidak homogen
setelah penyimpanan selama 21 hari karena ditemukan adanya butiran-butiran
kasar. Lachman, et al., (1994) menyatakan bahwa homogenitas sistem emulsi dipengaruhi oleh teknik atau cara pencampuran yang dilakukan serta alat yang
digunakan pada proses pembuatan emulsi tersebut.
Tabel 4.2 Hasil Pengujian Homogenitas Krim RBO
Krim Homogenitas
Hari ke-0 Hari ke-21
F1 - -
F2 - +
F3 - -
Keterangan: (-) tidak terjadi perubahan, (+) terjadi perubahan
4.2.3 HasilPengukuran pH Krim RBO
Nilai pH krim F1, F2 dan F3 pada hari ke-0 berturut-turut yaitu 7,195,
7,892, dan 7,244. Ketiga formula mengalami perubahan pH setelah penyimpanan
dimana pH krim F1 menjadi 7,601, pH krim F2 7,656, dan pH krim F3 7,765
(Tabel 4.3). Hasil pengukuran pH pada ketiga formula tidak sesuai dengan pH
kulit karena berada diatas 6,5. Tranggono dan Latifah (2007) menyatakan bahwa
pH krim harus diusahakan mendekati pH fisiologis kulit, yaitu 4,5-6,5. Nilai pH
yang kurang dari 4,5 dapat mengiritasi kulit sementara nilai pH yang melebihi 6,5
20
UIN Syarif Hidayatullah Jakarta Tabel 4.3 Hasil Pengukuran pH Krim RBO
Krim pH
Hari ke-0 Hari ke-21
F1 7,195 7,601
F2 7,892 7,656
F3 7,244 7,765
4.2.4 HasilPengukuran Viskositas Krim RBO
Nilai viskositas krim F1, F2 dan F3 pada hari ke-0 berturut-turut yaitu
83080 cPs, 396900 cPs, dan 637000 cPs. Pada penyimpanan hari ke-21, viskositas
krim F3 mengalami peningkatan menjadi 740500 cPs. Viskositas emulsi akan
meningkat seiring dengan umur emulsi tersebut kemudian relatif stabil (Lachman,
et al., 1994). Sementara viskositas krim F1 dan F2 mengalami penurunan karena adanya penggumpalan. Viskositas krim F1 turun menjadi 38810 cPs sedangkan
viskositas krim F2 turun menjadi 267000 cPs. Secara keseluruhan krim F1
memiliki viskositas yang paling rendah, sedangkan krim F3 memiliki viskositas
yang paling tinggi. Hal ini menunjukkan bahwa kombinasi asam stearat dan
trietanolamin mempengaruhi viskositas krim RBO. Semakin besar konsentrasi
asam stearat dan trietanolamin yang digunakan maka semakin tinggi viskositas
krim RBO yang dihasilkan.
Tabel 4.4 Hasil Pengukuran Viskositas Krim RBO
Krim Viskositas (cPs)
Hari ke-0 Hari ke-21
F1 83080 38810
F2 396900 267000
F3 637000 740500
4.2.5 Hasil Pengujian Stabilitas Krim RBO
Pengujian stabilitas krim dengan metode sentrifugasi bertujuan untuk
memisahkan dua atau lebih zat yang memiliki kepadatan yang berbeda seperti dua
cairan yang berbeda atau cairan dan padatan karena adanya pengaruh gaya
sentrifugal dan merupakan suatu alat yang berguna untuk menilai dan
memprediksi shelf-life suatu emulsi (Khan, et al., 2010). Hasil pengujian stabilitas ketiga formula krim menunjukkan tidak adanya pemisahan fase hingga hari ke-21
21
UIN Syarif Hidayatullah Jakarta sesuai selama proses homogenisasi krim yang mencegah terjadinya pemisahan
selama pengujian (Smaoui, et al., 2013).
Tabel 4.5 Hasil Pengujian stabilitas Krim RBO
Krim Pemisahan
Hari ke-0 Hari ke-21
F1 - -
F2 - -
F3 - -
Keterangan: (-) tidak terjadi pemisahan
4.3 Hasil Pegujian Aktivitas Antioksidan RBO dan Krim RBO 4.3.1 Hasil Pengujian Aktivitas Antioksidan RBO
Hasil pengujian aktivitas antioksidan RBO dapat dilihat pada lampiran 3
(Hal. 32).
Gambar 4.1Grafik Aktivitas Antioksidan Rice Bran Oil
22
UIN Syarif Hidayatullah Jakarta Pengujian aktivitas antioksidan RBO dilakukan dengan menggunakan metode free radical scavenging assay (DPPH). Metode DPPH (2,2-difenil-1-pikrilhidrazil) dipilih karena sederhana, mudah, cepat, dan peka serta hanya memerlukan sedikit
sampel (Hanani, et al., 2005). Sebagai kontrol positif digunakan asam askorbat (vitamin C) sedangkan sebagai kontrol negatif yaitu pelarut etil asetat.
Sampel yang mengandung antioksidan secara kualitatif dapat dilihat
dengan adanya penurunan intensitas warna DPPH. Senyawa antioksidan akan
bereaksi dengan radikal DPPH membentuk DPPH tereduksi yang bersifat
non-radikal melalui mekanisme donasi atom hidrogen dan menyebabkan terjadinya
peluruhan warna dpph dari ungu ke kuning (Blois, 1958). Penurunan absorbansi
kemudian diukur dengan spektrofotometer UV-Vis pada panjang gelombang
515.5 nm.
Dengan semakin meningkatnya konsentrasi sampel, maka semakin kecil
nilai absorbansi yang didapat namun persen inhibisinya semakin besar. Persen
inhibisi menunjukkan kemampuan suatu sampel untuk menghambat aktivitas
radikal bebas yang berhubungan dengan konsentrasi suatu sampel. Persen inhibisi
didapat dari perbedaan serapan antara absorbansi DPPH dengan absorbansi
sampel yang diukur dengan spektofotometer UV-Vis (Molyneux, 2004).
Seri konsentrasi dan persen inhibisi diplotkan sebagai fungsi x dan y ke
dalam persamaan regresi linier sehingga didapatkan nilai IC50. Nilai IC50
merupakan konsentrasi sampel yang dapat menangkal 50% radikal bebas.
Semakin kecil nilai IC50 maka semakin tinggi aktivitas antioksidannya (Zuhra, et al., 2008). Berdasarkan perhitungan, didapatkan nilai IC50 sampel rice bran oil
sebesar 7013,8 g/mL. Hasil tersebut lebih tinggi dibandingkan dengan nilai IC50
kontrol vitamin C sebesar 4,481 g/mL.
Suatu sampel dikatakan memiliki aktivitas antioksidan sangat kuat apabila
nilai IC50 kurang dari 50 g/mL, kuat apabila nilai IC50 antara 50-100 g/mL,
sedang apabila nilai IC50 antara 100-150 g/mL, dan lemah apabila nilai IC50
23
UIN Syarif Hidayatullah Jakarta
4.3.2 Hasil Pengujian Aktivitas Antioksidan Krim RBO Konsentrasi 7000
g/mL
Hasil pengukuran aktivitas antioksidan krim RBO dapat dilihat pada
lampiran 3 (Hal. 33).
Gambar 4.3Grafik Aktivitas Antioksidan Krim RBO Konsentrasi 7000 g/mL
Pengukuran aktivitas antioksidan krim dilakukan dengan menggunakan metode
free radical scavenging assay (DPPH) pada konsentrasi 7000 g/mL (konsentrasi dihitung berdasarkan bobot rice bran oil dalam sediaan krim). Pemilihan konsentrasi didasarkan pada nilai IC50 sampel rice bran oil. Nilai persen inhibisi krim F1, F2, dan F3 pada hari ke-1 berturut-turut yaitu 15,163%, 22,265%, dan
30,518%. Ketiga formula krim mengalami perubahan nilai persen inhibisi pada
pengukuran hari ke-22 dimana persen inhibisi Krim F1, F2, dan F3 berturut-turut
yaitu 18.871%, 19.753%, dan 30.511%. Pengukuran aktivitas antioksidan secara
keseluruhan menunjukkan bahwa persen inhibisi ketiga formula pada konsentrasi
7000 g/mL kurang dari 50%. Namun pada penelitian ini tidak dilakukan
pengujian lebih lanjut untuk mengetahui penyebab penurunan aktivitas
24
UIN Syarif Hidayatullah Jakarta
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil penelitian dapat disimpulkan bahwa:
1. RBO dapat diformulasikan menjadi sediaan krim tipe o/w yang memenuhi
syarat kestabilan fisik berdasarkan parameter uji organoleptik, homogenitas,
pH, viskositas, dan sentrifugasi.
2. Krim RBO dengan variasi konsentrasi emulgator asam stearat dan
trietanolamin 16% : 3% (F3) memiliki stabilitas fisik yang lebih baik
dibandingkan krim F1 (8% : 1%) dan F2 (12% : 2%).
3. RBO mengandung aktivitas antioksidan dengan nilai IC50 sebesar 7013,8
g/mL.
4. Aktivitas antioksidan krim RBO pada konsentrasi 7000 g/mL kurang dari
50%.
5.2 Saran
Saran yang dapat diberikan untuk penelitian selanjutnya adalah:
1. Perlu dilakukan optimasi pH krim agar diperoleh pH krim yang mendekati pH
fisiologis kulit.
2. Perlu dilakukan analisa stabilitas komponen kimia dalam sampel rice bran oil
dengan menggunakan HPLC.
3. Perlu dilakukan pengujian lebih lanjut secara in-vivo untuk mengetahui
efektivitas antioksidan krim rice bran oil.
25
UIN Syarif Hidayatullah Jakarta
DAFTAR PUSTAKA
Ames, B. N., Shigenaga, M. K., Hagen, T. M. 1993. Oxidants, Antioxidants, and
The generative Disease of aging. Proc. Natl. Acad. Sci. USA Vol 90, pp.
7915-7922.
Anief, Moh. 2008. Ilmu Meracik Obat. Cetakan ke-14. Yogyakarta: Gadjah Mada
University Press.
Arab, F. Alemzadeh, I., Maghsoudi, V. 2011. Determination of Antioxidant
Component and Activity of Rice Bran Extract. Scentia Iranica C, 18(6):
1402-1406.
Aswal, A., Kalra, M., Rout, A. 2013. Preparation and Evaluation of Polyherbal
Cosmetic Cream. Der Pharmacia Lettre, 5(1): 83-88.
Blois, M. S. 1958. Antioxidant Determinations by The Use of a Stable Free
Radical. Journal Nature, 181: 1199-1200.
Baumann, L. 2002. Cosmetic Dermatology: principles and Practice. New York:
McGraw-Hill Companies, Inc.
Cicero, A. F. G., Derosa, G. 2005. Rice Bran and Its Main Component: Potential
Role in The Management of Coronary Risk Factors. Current Topics in
Nutraceutical Research Vol. 3, No. 1, pp. 29-46.
Choudhary, M., Grover, K., Kaur, G. 2013. Fatty Acid Composition, Oxidative
Stability, and Radical Scavenging Activity of Rice Bran Oil Blends.
International Journal of Food and Nutritional Sciences, Vol.2: 33-43.
Ditjen POM. 1979. Farmakope Indonesia. Edisi ke-3. Jakarta: Departemen
Kesehatan RI.
Deepam, L. S. A., Sundaresan, A., Arumughan, C. 2011. Stability of Rice Bran
Oil in Terms of Oryzanol, Tocopherols, Tocotrienols and Sterols. J Am
Oil Chem Soc, 88: 1001-1009.
Eipstein, H. 2009. Skin Care Produccts. Didalam Barel, A. O., Paye, M., Maibach,
H. I. Handbook of Cosmetic Science and Technology. 3rd edition. New
York: Informa Health Care USA, Inc.
Elya, B., Dewi, R., Budiman, M. H. 2013. Antioxidant Cream of Solanum
lycopersicum L. International Journal of Pharmtech Vol.5, No.1, pp.
233-238.
26
UIN Syarif Hidayatullah Jakarta
Graaff, Kent M Van De., R Ward Rhees. β001. Scchaum’s Easy Outlines Human
Anatomy and Physiology. New York: McGraw-Hill.
Hanani, E., Mun’im A., Sekarini, R. 2005. Identifikasi Senyawa Antioksidan dalam Spons Callyspongia SP dari Kepulauan Seribu. Majalah Ilmu
Kefarmasian, Vol. II, No.3, 127-133.
Im-Emsap, W., Siepmann, J. 2002. Disperse Systems. Didalam Banker, G. S.,
Rhodes, C. T. Modern Pharmaceutics. 4th edition, Revised and Expanded.
New York: Marcel Dekker, Inc.
Javanmardi, J., Stushnoff, C., Locke, E., Vivanco, J. M. 2003. Antioxidant
Activity and Total Phenolic Content of Iranian Ocimum Accessions.
Journal Food Chem. 83(4): 547-550.
Khan, B.A., Akhtar, N., Mahmood, T., Qayum, M., Zaman, S.U. 2010.
Formulation and Pharmaceutical Evaluation of a W/O Emulsion of
Hippophae Ramnoides Fruit Extract. J. Pharm. Res. 3: 1342-1344.
Lachman, L., Lieberman, H. A., Kanig, J. L. 1994. Teori dan Praktek Farmasi
Industri II. Cetakan ke-1. Jakarta: UI-PRESS.
Loden, M. 2009. Hydrating Substances. Didalam Barel, A. O., Paye, M.,
Maibach, H. I. Handbook of Cosmetic Science and Technology. 3rd
edition. New York: Informa Health Care USA, Inc.
Martin, A., Swarbrick, J., Cammarata, A. 1993. Farmasi Fisik: Dasar-dasar Kimia
Fisik dalam Ilmu Farmasetik. Edisi ke-3. Jakarta: UI-PRESS.
Masaki, H. 2002. Role of Antioxidants in The Skin: Anti-aging Effects. J
Dermatol Sci; 58(2):85-90.
Mishra, A. K., Mishra, A., Chattopadhyay, P. 2010. Formulation and In-Vitro
Evaluation of Antioxidant Activity of O/W Sunscreen Cream Containing
Herbal Oil as Dispersed Phase. International Journal of Biomedical
Research; 5: 201-208.
Moini, H., Packer, L., Saris, N. E. L. 2002. Antioxidant and Prooxidant Activities
of α Lipoic Acid and Dihydrolipoic acid. Toxicology and Applied
27
UIN Syarif Hidayatullah Jakarta Molyneux, P. 2004. The Use of The Stable Free Radical
Diphenylpicrylhydrazzzyl (DPPH) for Estimating Antioxidant Activity.
Songklanakarin J. Sci. Technol. Vol. 26. No. 2.
Nasir, S., Fitriyanti, Kamila, H. 2009. Ekstraksi Dedak Padi Menjadi Minyak
Mentah Dedak Padi (Crude Rice Bran Oil) dengan Pelarut N-Hexane dan
Ethanol. Jurnal Teknik Kimia, No.2, Vol. 16.
Pinnel, S. R. 2003. Cutaneous Photodamage, Oxidative Stress, and Topical
Antioxidant Protection. J Am Acad Dermatol; 48: 1-19.
Prahl, S. Kueper, T., Biernoth, T., et al. 2008. Aging Skin is Functionally
Anaerobic: Importance of Coenzyme Q10 for Anti-aging Skin Care.
Biofactors. 32(1-4): 245-55.
Prakash, A., Rigelhof, F., Miller, E. 2001. Antioxidant Activity. Medalliaon
Laboratories Analitycal Progress, Vol. 10, No.2.
Rowe, R. C., Sheskey, P. J., Quinn, M. E. 2009. Handbook of Pharmaceutical
Exipients. 6th edition. London: Pharmaceutical Press.
Sharon, N., Anam, S., Yuliet. 2013. Formulasi Krim Ekstrak Etanol Bawang
Hutan (Eleutherine palmifolia L. Merr). Online Jurnal of Natural Science,
Vol 2(3): 111-122.
Smaoui, S., Hlima, H. B., Jarraya, R., Kamoun, N. G., Ellouze, R., Damak, M.
2012. Cosmetic Emulsion of Virgin Coconut Oil: Formulation and
Bio-physical Evaluation. African Journal of Biotechnology Vol. 11(40), pp.
9664-9671.
Sudjadi. 2007. Kimia Farmasi Analisis. Cetakan ke-2. Yogyakarta: Pustaka
Pelajar.
Tandon, R. 2005. Antioxidants: Past and Present. Dapat diakses melalui
http://www.pharmainfo.net/reviews/antioxidants-past-and-present. Vol. 3(4).
Tranggono, R. I., Latifah, F. 2007. Buku Pegangan Ilmu Pengetahuan Kosmetik.
Jakarta: PT. Gramedia Pustaka Utama.
Underwood, A. L., Day, R. A. 2001. Analisis Kimia Kualitatif. Edisi ke-6.
28
UIN Syarif Hidayatullah Jakarta Vorarat, S. Managit, C., Iamthanakul, L., Soparat, W., Kamkaen, N. 2010.
Examination of Antioxidant activity and Development of Rice Bran Oil
and Gamma-Oryzanol Microemulsion. J Health Rest, 24(2): 67-72.
Winarsi, H. 2011. Antioksidan Alami dan Radikal Bebas. Yogyakarta: Kanisius.
Zuhra, C.F., Tarigan, J. B., Sihotang, H. 2008. Aktivitas Antioksidan Senyawa
Flavonoid dari Daun Katuk. Jurnal Biologi Sumatera, Vol. 3, No. 1, hlm. 7 –
29
UIN Syarif Hidayatullah Jakarta
Lampiran 1. Prosedur Pengujian Aktivitas Antioksidan RBO dan Krim RBO
Pengujian Aktivitas Antioksidan RBO
1. Pembuatan larutan uji
Sebanyak 500 mg rice bran oil dilarutkan dengan etil asetat dan dicukupkan volumenya hingga 25 mL dalam labu ukur sehingga diperoleh
konsentrasi 20000 ppm (larutan induk). Kemudian dilakukan pengenceran dari
larutan induk menjadi beberapa konsentrasi 2000, 4000, 6000, 8000, dan 10000
g/mL.
2. Pembuatan larutan vitamin C (kontrol positif)
Sebanyak 5 mg vitamin C dilarutkan dengan sedikit metanol dan
dicukupkan volumenya dengan penambahan etil asetat hingga 25 mL dalam labu
ukur (konsentrasi 200 ppm). Kemudian dilakukan pengenceran dari larutan induk
menjadi beberapa konsentrasi 2, 4, 6, 8, dan 10 g/mL.
3. Pembuatan larutan blanko DPPH 0,04%
Ditimbang 2,0 mg DPPH (BM 394,32) lalu dilarutkan dengan etil asetat
dan dicukupkan volumenya hingga 50 mL.
4. Pengujian aktivitas antioksidan
Dari setiap seri konsentrasi larutan uji dipipet sebanyak 2 mL ke dalam
tabung reaksi dan ditambahkan 2 mL larutan DPPH 0,04%. Mulut tabung
kemudian ditutup dengan alumunium foil dan larutan dihomogenkan. Larutan uji
selanjutnya di inkubasi selama 30 menit. Pengukuran serapan dilakukan pada
panjang gelombang 515.5 nm menggunakan spektrofotometer UV-Vis. Perlakuan
ini dilakukan sebanyak tiga kali pengulangan (triplo). Aktivitas antioksidan
dihitung dengan menggunakan persamaan berikut.
% inhibisi
Dimana A0 merupakan absorbansi DPPH dan A1 merupakan absorbansi larutan
uji.
5. Perhitungan IC50
IC50 adalah konsentrasi yang dibutuhkan untuk mereduksi DPPH sebesar
50%. IC50 dihitung dengan menggunakan persamaan regresi linier dimana
30
UIN Syarif Hidayatullah Jakarta Dari persamaan y = a + bx dapat dihitung nilai IC50 dengan menggunakan
rumus:
y = a + bx
50 = a + bx
x =
Pengujian Aktivitas Antioksidan Krim RBO Konsentrasi 7000 g/mL
1. Pembuatan larutan uji
Sebanyak 5 gram krim dilarutkan dengan etil asetat dan dicukupkan
volumenya hingga 25 mL dalam labu ukur. Diambil 3.5 mL dari larutan induk
tersebut dan ditambahkan etil asetat hingga 10 mL.
2. Pembuatan larutan DPPH 0,04%
Ditimbang 2 mg DPPH (BM 394,32) lalu dilarutkan dengan etil asetat dan
dicukupkan volumenya hingga 50 mL.
3. Pengujian aktivitas antioksidan
Sebanyak 2 mL larutan uji dipipet ke dalam tabung reaksi dan
ditambahkan 2 mL larutan DPPH (0,04%). Mulut tabung kemudian ditutup
dengan alumunium foil dan larutan dihomogenkan. Larutan uji selanjutnya di
inkubasi selama 30 menit. Pengukuran serapan dilakukan pada panjang
gelombang 515.5 nm menggunakan spektrofotometer UV-Vis. Perlakuan ini
dilakukan sebanyak tiga kali pengulangan (triplo). Aktivitas antioksidan dihitung
dengan menggunakan persamaan berikut.
% inhibisi
Dimana A0 merupakan absorbansi DPPH dan A1 merupakan absorbansi larutan
31
UIN Syarif Hidayatullah Jakarta
Lampiran 2. Skema Pengujian Aktivitas Antioksidan RBO dan krim RBO
32
UIN Syarif Hidayatullah Jakarta
Lampiran 3. Hasil Pengujian Aktivitas Antioksidan RBO, Vitamin C, dan Krim
RBO
1. Hasil Pengujian Aktivitas Antioksidan RBO
Konsentrasi (g/mL) Rerata absorbansi Persen inhibisi Persamaan regresi linier IC50 (g/mL)
2000 0.468 16.5775 y = a + bx
Keterangan: Rerata absorbansi DPPH = 0.561
Perhitungan Persen Inhibisi dan IC50 Sampel RBO
2000 ppm
2. Hasil Pengujian Aktivitas Antioksidan Kontrol Vitamin C
Konsentrasi (g/mL) Rerata absorbansi Persen inhibisi Persamaan regresi linier IC50 (g/mL)
2 0.475 17.6776 y = a + bx
Keterangan: Rerata absorbansi DPPH = 0.577
Perhitungan Persen Inhibisi dan IC50 Sampel RBO
33
UIN Syarif Hidayatullah Jakarta
y = a + bx
51 = 3.08486 + 10.46794x
x (IC50) = 4.481 g/mL
3. Hasil Pengujian Aktivitas Antioksidan Krim RBO Konsentrasi 7000 g/mL
Formula Hari ke-1 Hari ke-22
Rerata absorbansi % Inhibisi Rerata absorbansi % Inhibisi
F1 0.442 15.163% 0.460 18.871%
F2 0.405 22.265% 0.455 19.753%
F3 0.362 30.518% 0.394 30.511%
Keterangan: Rerata absorbansi DPPH hari ke-1 = 0.522
Rerata absorbansi DPPH hari ke-22 = 0.567
Perhitungan Persen Inhibisi Krim RBO pada Konsentrasi 7000 g/mL
34
UIN Syarif Hidayatullah Jakarta
35
UIN Syarif Hidayatullah Jakarta
36
UIN Syarif Hidayatullah Jakarta
37
UIN Syarif Hidayatullah Jakarta
38
UIN Syarif Hidayatullah Jakarta
39
40
UIN Syarif Hidayatullah Jakarta