KERAGAMAN CENDAWAN ENDOFIT YANG DIISOLASI
DARI BERBAGAI SPESIES TANAMAN OBAT POTENSIAL
ROHANI CINTA BADIA BR GINTING
SEKOLAH PASCASARJANA PROGRAM STUDI MIKROBIOLOGI
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi berjudul “Keragaman
Cendawan Endofit yang Diisolasi dari Berbagai Spesies Tanaman Obat Potensial” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan, maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Agustus 2013
Rohani Cinta Badia Br Ginting
RINGKASAN
ROHANI CINTA BADIA BR GINTING. Keragaman Cendawan Endofit yang Diisolasi dari Berbagai Spesies Tanaman Obat Potensial. Dibimbing oleh NAMPIAH SUKARNO, UTUT WIDYASTUTI, LATIFAH KOSIM DARUSMAN, dan SHIGEHIKO KANAYA.
Indonesia memiliki keragaman tanaman obat yang tinggi namun cendawan endofit yang bersimbiosis dengan tanaman obat asal Indonesia belum banyak dipelajari terutama pada tanaman obat potensial seperti jahe merah (Zingiber officinale Roscoe), jati belanda (Guazuma ulmifolia Lamk), pegagan lokal (Centella asiatica L), pegagan malaysia, dan temulawak (Curcuma xanthorrhiza
Roxb). Beberapa cendawan endofit asal tanaman obat dilaporkan berpotensi menghasilkan berbagai senyawa metabolit termasuk antimikrob. Peranan cendawan endofit dalam produksi metabolit pada tanaman obat dilaporkan sangat signifikan namun keragaman cendawan tersebut pada kelima tanaman obat potensial tersebut di atas belum diketahui.
Penelitian ini bertujuan untuk: 1). Mendapatkan isolat cendawan endofit dari organ fungsional tanaman obat potensial yaitu jati belanda, pegagan lokal, pegagan malaysia, temulawak dan mengidentifikasi cendawan endofit yang diperoleh dengan karakter morfologi, sekuen DNA pada daerah ITS rDNA, dan filogenetik, dan kemampuan antagonistik terhadap F. oxysporum, 2). Mendapatkan isolat cendawan endofit dari tanaman obat jahe merah sebagai model yaitu dari organ fungsional dan non-fungsional dan mengidentifikasi cendawan endofit yang diperoleh dengan karakter morfologi, sekuen DNA pada daerah ITS rDNA, filogenetik, dan kemampuan antagonistik terhadap F. oxysporum, dan spesi kimia menggunakan FTIR, 3). Penapisan terhadap kemampuan cendawan endofit sebagai antagonistik terhadap cendawan patogen tanaman F. oxysporium secara in vitro.
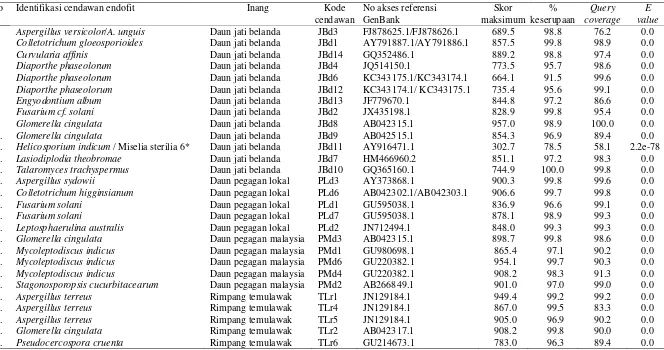
Tanaman obat yang digunakan dibagi dalam dua kelompok. Kelompok pertama ialah tanaman yang diambil organ fungsionalnya yaitu daun jati belanda, daun pegagan lokal, daun pegagan malaysia, dan rimpang temulawak. Kelompok kedua ialah jahe merah yaitu tanaman yang seluruh organnya baik fungsional yaitu rimpang maupun non-fungsional yaitu akar, batang, dan daun digunakan sebagai sumber isolat. Pada tanaman kelompok pertama, setiap organ fungsional masing-masing tanaman obat yang diteliti diperoleh bahwa keempat tanaman tersebut bersimbiosis dengan cendawan endofit. Pada organ daun jati belanda diperoleh 13 isolat cendawan endofit dan masing-masing lima isolat dari organ daun pegagan lokal, pegagan malaysia, dan rimpang temulawak. Hasil diidentifikasi dari cendawan endofit pada organ fungsional menggunakan kombinasi karakter morfologi, molekuler, dan filogenetik diperoleh cendawan endofit Aspergillus versicolor, Aspergillus sydowii, Aspergillus terreus,
Colletotrichum gloeosporioides dan fase teleomorfnya Glomerella cingulata,
Colletotrichum higginsianum, Curvularia affinis, Diaporthe phaseolorum,
Engyodontium album, Fusarium solani, Lasiodiplodia theobromae,
Leptosphaerulina australis, Mycoleptodiscus indicus, Pseudocercospora cruenta,
banyak diperoleh dan ditemukan pada tiga dari empat tanaman yang diteliti yaitu jati belanda, pegagan malaysia, dan temulawak, sementara C. higginsianum
ditemukan hanya pada pegagan lokal. Cendawan endofit yang mempunyai kemampuan aktivitas penghambatan yang tinggi terhadap pertumbuhan F. oxysporum ialah T. trachyspermus JBd10 dan F. solani JMd14, sementara cendawan yang mempunyai kemampuan penghambatan yang rendah ialah D. phaseolorum JBd6, M. indicus PMd1, dan E. album JBd13.
Pada tanaman jahe merah diperoleh 30 isolat cendawan endofit yaitu enam isolat berasal dari organ fungsional rimpang dan dua puluh empat isolat diperoleh dari organ fungsional yaitu akar, batang, dan daun. Setiap organ non-fungsional jahe merah masing-masing diperoleh sebanyak delapan isolat cendawan endofit. Hasil identifikasi menggunakan kombinasi karakter morfologi, molekuler, dan filogenetik diperoleh cendawan endofit A. macroclavatum, Beltrania sp., Cochliobolus geniculatus dan anamorfnya C. affinis, F. solani, G. cingulata dan anamorfnya C. gloeosporoides, Lecanicillium kalimantanense,
Myrothecium verrucaria, Neonectria punicea, Periconia macrospinosa, Rhizopycnis vagum, T. assiutensis, dan satu miselia sterilia JMd9.
C. gloeosporoides dan fase teleomorfnya G. cingulata merupakan cendawan endofit paling banyak ditemukan. Cendawan endofit R. vagum dan P. macrospinosa merupakan cendawan yang spesifik pada akar sementara L. kalimantanese dan M. verrucaria hanya diperoleh dari batang; dan Beltraniella
sp. hanya di rimpang tanaman jahe merah. C. affinis dan fase teleomorfnya C. geniculatus ditemukan hidup di tajuk yaitu daun dan batang tanaman, sementara
A. macroclavatum dan N. punicea pada sistem perakaran yaitu akar dan rimpang. Cendawan endofit asal organ jahe merah mempunyai kemampuan aktivitas penghambatan terhadap cendawan patogen F. oxysporum dengan persentase penghambatan berkisar 1.4-68.8%. Cendawan C. affinis JMbt7 dan F. solani
JMd14 mempunyai aktivitas penghambatan yang tinggi sementara R. vagum JMa4 dan C. geniculatus JMbt9 mempunyai aktivitas penghambatan yang rendah. Organ tanaman dimana cendawan endofit berasal tidak mempengaruhi kemampuan aktivitas cendawan endofit terhadap cendawan patogen F. oxysporum
secara in vitro.
Kombinasi identifikasi molekuler, spesi kimia menggunakan FTIR, dan kemampuan penghambatan terhadap cendawan patogen dapat membantu identifikasi cendawan ke tingkat spesies dan bahkan ada yang ke tingkat strain. Contoh spesies yang sama tetapi berbeda strain adalah spesies F. solani JMa5 dan
F. solani JMd14; spesies G. cingulata JMr2, G. cingulata JMd4, G. cingulata berbagai cendawan dengan spesies yang sama tetapi berbeda strain dan cendawan dengan spesies dan strain yang sama dapat tersebar di berbagai organ tanaman jahe merah.
SUMMARY
ROHANI CINTA BADIA BR GINTING. Diversity of Endophytic Fungi Derived from Some Potential Medicinal Plants. Supervised by NAMPIAH SUKARNO, UTUT WIDYASTUTI, LATIFAH KOSIM DARUSMAN, and SHIGEHIKO KANAYA.
Indonesia has high medicinal plant diversity, however, there was limited study on endophytic fungi associated with them, particularly on potential medicinal plant jahe merah (Zingiber officinale Roscoe), jati belanda (Guazuma ulmifolia Lamk), local pegagan (Centella asiatica L), malaysian pegagan, and temulawak (Curcuma xanthorrhiza Roxb). As traditional medicines, the society use certain medicinal plant organ such as leaf, stem, rhizome and root as functional organ in traditional remedy because it contains high bioactive compounds. Some endophytic fungi had been reported to produce bioactive compound including anti-microbe substances. Role of endophytic fungi in production of bioactive compound of medicinal plant as their host is significant, however, diversity and distribution of the fungi in the host plant are not sufficiently studied particularly for the five potential medicinal plant mention above.
The aims of the research were: 1). To obtained the endophytic fungi isolates from the functional organ of jati belanda, local pegagan and malaysian pegagan type, and jahe merah, and from whole of jahe merahplant organs, 2). To study the diversity of endophytic fungi by using a combination of morphological characteristic, molecular analysis of sequence DNA generated from ITS rDNA region, and chemistry characteristic by FTIR, 3). To study the potency of endophytic fungi which have activity as biological control against F. oxysporum.
The medicinal plants used were divided into two groups. The first group was medicinal plants that used only their functional organ that is leaf of jatibelanda, leaf of local pegagan and malaysian pegagan, and rhizome of temulawak. The second group was jahemerah plant. In this group all plant organs both functional and non-functional such as leaf, stem, rhizome and root were used as source of fungal isolation.
In the first group, all functional organ of plants studied harbored endophytic fungi. There were 13 isolates of the endophytic fungi obtained from leaf of jati belanda and each of leaves of pegagan local and malaysian cultivars, and rhizome of jahe merah was occupied by five isolates. The fungi were identified as
Aspergillus versicolor, Aspergillus sydowii, Aspergillus terreus, Colletotrichum gloeosporioides and its teleomorphic stage Glomerella cingulata, Colletotrichum higginsianum, Curvularia affinis, Diaporthe phaseolorum, Engyodontium album,
Fusarium solani, Lasiodiplodia theobromae, Leptosphaerulina australis,
Mycoleptodiscus indicus, Pseudocercospora cruenta, Stagonosporopsis cucurbitacearum, Talaromyces assiutensis. Colletotrichum gloeosporioides and its teleomorphic stage Glomerella cingulata were dominant endophyte fungi and were found in all plants study.
trachyspermus JBd10, Glomerella cingulata JMr2, and Fusarium solani JMd14 statistically had the highest inhibitation value, while Mycoleptodiscus indicus
PMd1 and Engyodontium album JBd13 had the lowest inhibitation value.
Thirty isolates of endophytic fungi having different colony characteristics were obtained from Zingiber officinale, six isolates were derived from functional organ of Zingiber officinale and twenty four isolates were derived from nonfunctional organ of Zingiber officinale, i.e. leaf, rhizome, root, and stem. Each of root, stem, and leaf was occupied by eight isolates. Fungal identification by using a combination of morphological characteristic, molecular analysis of sequence DNA generated from ITS rDNA region, and phylogenetic analysis resulted Acremonium macroclavatum, Beltraniella sp., Cochliobolus geniculatus
and its anamorphic stage Curvularia affinis, Fusarium solani, Glomerella cingulata and its anamorphic stage Colletotrichum gloeosporoides, Lecanicillium kalimantanense, Myrothecium verrucaria, Neonectria punicea, Periconia macrospinosa, Rhizopycnis vagum, Talaromyces assiutensis, and one mycelia sterilia JMd9.
C. gloeosporoides and its teleomorphic stage G. cingulata were dominant endophyte fungi in jahe merah.R. vagum was found specifically on root whereas
L. kalimantanense and M. verrucaria were found on stem of red ginger plant. A. macroclavatum was found specifically in bellow ground organ, whereas
Curvularia was determined from shoot or above ground organ of red ginger plant. Based on moleculer analysis, chemistry characteristic by FTIR, and antagonistic assay, the isolates JMa5 and JMd14 were belong to the same species, namely F. solani but they were differ in strain. Similarly JMr2, JMd4, JMd5, and JMd12 were belong to the same species G. cingulata but they were differ in strain. Other while, C. geniculatus JMbt9 and JMd13, G. cingulata JMd12 and JMr2. Otherwhile, G. cingulata JMbt13 and G. cingulata JMd4 were belong to the same species and also the same strain that spreaded in leaf and stem of jahe merah. Similarly A. macroclavatum JMa6 and A. macroclavatum JMr7. The endophytic fungi lived in the different organs of host plant may be belong to the same species and the same strain but also belong to the same species but in the different strain.
All jahe merah plant organs harbor diverse endophytic fungi and their inhibition effects on growth of F. oxysporum were varied with the inhibition value range from 1.4 to 68.8%. C. affinis (JMbt7) and F. solani (JMd14) had significantly highest antagonistic activity with the value above 65%; and R. vagum (JMa4) and C. geniculatus (JMbt9) had significantly lowest antagonistic activity with the value up to 10%. This finding showed that not only rhizome of red ginger inhabited by endophytic fungi with high antifungal activities, but also other organs.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor
pada
Program Studi Mikrobiologi
KERAGAMAN CENDAWAN ENDOFIT YANG DIISOLASI
DARI BERBAGAI SPESIES TANAMAN OBAT POTENSIAL
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2013
Penguji pada Ujian Tertutup: Dr Dyah Manohara
Peneliti Utama
Balai Penelitian Tanaman Rempah dan Obat Bogor Dr Iman Rusmana
Departemen Biologi FMIPA
IPB Bogor
Penguji pada Ujian Terbuka: Dr Bonny Poernomo Wahyu Soekarno Departemen Proteksi Tanaman
IPB Bogor Dr Ir Subowo Peneliti Utama
Judul Disertasi : Keragaman Cendawan Endofit yang Diisolasi dari Berbagai Spesies Tanaman Obat Potensial
Nama : Rohani Cinta Badia Br Ginting
NIM : G361080031
Disetujui oleh Komisi Pembimbing
Dr Ir Nampiah Sukarno Ketua
Dr Ir Utut Widyastuti, MSi Anggota
Prof Dr Latifah K Darusman, MS Anggota
Prof Dr Shigehiko Kanaya Anggota
Diketahui oleh
Ketua Program Studi Mikrobiologi
Prof Dr Anja Meryandini
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MAgr
PRAKATA
Puji syukur penulis panjatkan kepada Allah yang Maha Pemurah atas segala karuniaNya sehingga karya ilmiah ini berhasil diselesaikan. Tema penelitian yang dilaksanakan sejak bulan Oktober 2009 sampai dengan Desember 2012 ini ialah identifikasi dan skrining cendawan endofit dari tanaman obat Indonesia dengan judul Keragaman Cendawan Endofit yang Diisolasi dari Berbagai Spesies Tanaman Obat Potensial. Penelitian ini dilakukan di Laboratorium Mikrobologi dan Kesehatan Tanah Balai Penelitian Tanah Bogor, Lab. Biorin Pusat Penelitian Sumberdaya Hayati (PPSHB) dan Bioteknologi IPB, Lab. Terpadu dan Lab. Bagian Mikologi Departemen Biologi FMIPA, Lab. Kimia Analitik Departemen Kimia FMIPA IPB, Lab. Pusat Studi Biofarmaka LPPB-IPB, Bogor.
Penulis telah mendapatkan bimbingan dan bantuan dari berbagai pihak dalam melakukan penelitian ini. Penulis mengucapkan terima kasih kepada Dr Ir Nampiah Sukarno sebagai Ketua Komisi Pembimbing, Dr Ir Utut Widyastuti, Prof Dr Ir Latifah K Darusman MS, dan Prof Dr Shigehiko Kanaya sebagai Anggota Komisi Pembimbing, atas segala bimbingan dan bantuan kepada penulis selama penelitian dan penyelesaian disertasi ini.
Penulis mengucapkan terimakasih kepada Badan Litbang Pertanian dan Kepala Balai Penelitian Tanah, Bogor yang telah memberikan kesempatan kepada penulis untuk melanjutkan studi di Sekolah Pascasarjana IPB Bogor dan menyediakan biaya pendidikan serta biaya penelitian melalui Program KKP3T Tahun 2011 dan 2012 dengan surat perjanjian No:1998.9/LB.620/I.1/5/2011 dan No:1142/LB.620/I.1/3/2012 serta PPSHB - Nara Institute Science and Technology dalam rangka kerjasama Young Researcher. Penghargaan dan terima kasih penulis ucapkan kepada Rektor, Dekan Sekolah Pascasarjana, Dekan FMIPA, Ketua Departemen Biologi, Ketua Program Studi Mikrobiologi, SPs IPB Bogor atas kesempatan yang diberikan untuk mengikuti pendidikan di SPs IPB Bogor. Penulis juga mengucapkan terima kasih kepada seluruh staf pengajar dan administrasi SPs IPB, staf PPSHB IPB, Tim kemometrik Pusat Studi Biofarmaka LPPB-IPB, dan Departemen Biologi atas ilmu dan bantuan administrasi yang diberikan.
Penulis mengucapkan terima kasih kepada rekan-rekan di Lab. BIORIN PPSHB, Lab. Terpadu dan Lab. Bagian Mikologi Dept. Biologi FMIPA, Lab. Kimia Analitik Dept. Kimia FMIPA, IPB Bogor atas segala bantuan, dukungan semangat dan doa, serta persahabatan selama penulis melakukan penelitian. Masih banyak pihak yang telah membantu kelancaran penelitian ini, namun tidak dapat penulis sebutkan satu persatu, untuk itu penulis juga mengucapkan terima kasih.
Ucapan terima kasih juga disampaikan kepada suami tercinta Biston Situngkir dan anak-anakku Cindy Anastasia dan Della Claudya, serta seluruh keluarga Besar N. Ginting (Alm) dan Situngkir (Alm) atas segala doa, semangat, dan dukungannya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juli 2013
DAFTAR ISI
DAFTAR TABEL DAFTAR GAMBAR PENDAHULUAN
Latar Belakang 1
Tujuan Penelitian 4
Manfaat Penelitian 4
Alur Penelitian 5
TINJAUAN PUSTAKA 6
METODE
Waktu dan Tempat Penelitian 16
Bahan Penelitian 16
Prosedur Penelitian 19
HASIL
Keragaman Cendawan Endofit pada Organ Fungsional Beberapa Tanaman Obat
Keragaman cendawan endofit berdasarkan karakteri morfologi 23 Keragaman cendawan endofit berdasarkan identifikasi molekuler
menggunakan primer ITS 30
Keragaman cendawan endofit berdasarkan kemampuan
penghambatan terhadap cendawan patogen F. oxysporum 38 Keragaman Cendawan Endofit pada Tanaman Model: Jahe Merah
Keragaman cendawan endofit berdasarkan karakter morfologi 39 Keragaman cendawan endofit berdasarkan identifikasi molekuler 49 Keragaman cendawan endofit berdasarkan kemampuan
penghambatan terhadap F.oxysporum 56
Keragaman cendawan endofit berdasarkan spesi kimia
menggunakan FTIR 58
PEMBAHASAN
Keragaman Cendawan Endofit pada Organ Fungsional Beberapa
Tanaman Obat 63
Keragaman Cendawan Endofit pada Tanaman Model: Jahe Merah 68 SIMPULAN DAN SARAN
Simpulan 76
Saran 77
DAFTAR PUSTAKA 78
DAFTAR TABEL
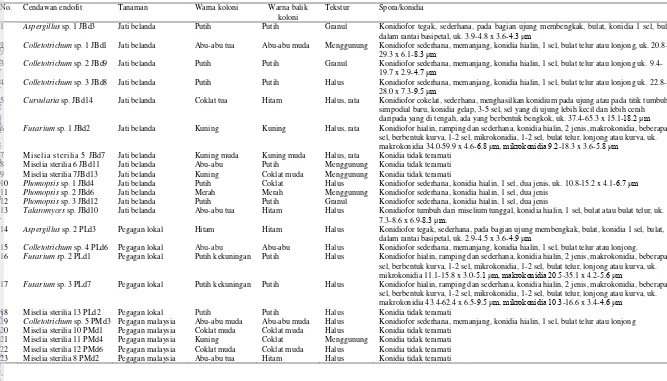
1. Keragaman dan penyebaran cendawan endofit asal organ fungsional jati belanda, pegagan lokal, pegagan malaysia,
dan temulawak berdasarkan karakter morfologi 23 2. Karakter morfologi cendawan endofit yang berasosiasi dengan
daun jati belanda, pegagan lokal, pegagan malaysia, dan
rimpang temulawak 24
3. Identifikasi molekuler cendawan endofit asal organ fungsional jati belanda, pegagan lokal, pegagan malaysia, dan temulawak berdasarkan ITS1-5.8S-ITS2 rDNA menggunakan primer
ITS1/ITS4, ITS5/ITS2, atau ITS3/NL4 32
4. Keragaman dan penyebaran cendawan endofit asal organ fungsional jati belanda, pegagan lokal, pegagan malaysia,
dan temulawak berdasarkan identifikasi molekular menggunakan
primer ITS1/ITS4, ITS5/ITS3, atau ITS3/NL4 33
5. Uji hipersensivitas cendawan endofit asal organ fungsional tanaman jati belanda, pegagan lokal, pegagan malaysia, dan
temulawak pada daun tembakau 38
6. Aktivitas penghambatan cendawan endofit asal organ fungsional jati belanda, pegagan lokal, pegagan malaysia, dan temulawak
terhadap cendawan patogen F. oxysporum secara in vitro 39 7. Keragaman dan penyebaran cendawan endofit berdasarkan
karakter morfologi pada setiap organ tanaman jahe merah 40 8. Karakter morfologi cendawan endofit yang berasosiasi dengan
organ tanaman jahe merah 47
9. Identifikasi molekuler cendawan endofit asal organ tanaman jahe merah berdasarkan ITS1-5.8S-ITS2 rDNA menggunakan
primer ITS1/ITS4, ITS5/ITS3, atau ITS3/NL4 51
10.Keragaman dan penyebaran cendawan endofit pada organ tanaman jahe merah berdasarkan identifikasi molekuler ITS1-5.8S-ITS2 rDNA menggunakan primer ITS1/ITS4,
ITS5/ITS3, atau ITS3/NL 53
11.Uji hipersensivitas cendawan endofit asal tanaman jahe merah pada
daun tembakau 56
12.Aktivitas penghambatan cendawan endofit asal tanaman jahe merah
terhadap F. oxysporum secara invitro 57
13.Hasil analisis komponen utama spektrum cendawan endofit asal
DAFTAR GAMBAR
1. Jati belanda 7
2. Pegagan 8
3. Temulawak 9
4. Jahe merah 10
5. Peta ITS1-5.8S-ITS2 rDNA 13
6. Ilustrasi koreksi garis dasar spektrum emisi Raman 14 7. Ilustrasi pendekatan menggunakan derivatisasi pada spektrum infra
merah campuran air-metanol 15
8. Hasil proses smoothing kuadratik savitzky-golay 16
9. Alur pelaksanaan kerja 17
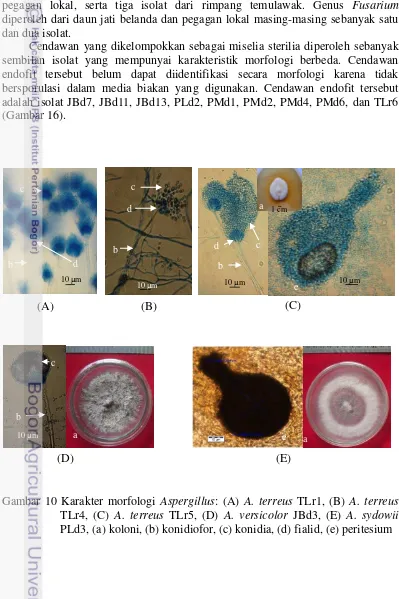
10.Karakter morfologi Aspergillus 26
11.Karakter morfologi Curvularia 27
12.Karakter morfologi Fusarium 27
13.Karakter morfologi Talaromyces 28
14.Karakter morfologi Colletotrichum dan Glomerella 28
15.Karakter morfologi Phomopsis 29
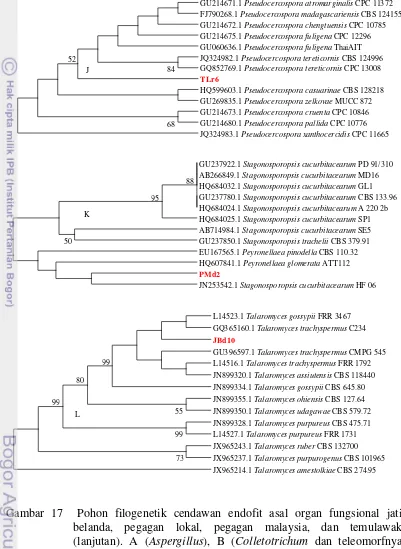
16.Karakter morfologicendawan endofit miselia sterilia 29 17.Pohon filogenetik cendawan endofit asal organ fungsional jahe merah,
jati belanda, pegagan lokal, pegagan malaysia, dan temulawak 34
18.Karakter morfologi Acremonium 41
19.Karakter morfologi Beltraniella 41
20.Karakter morfologi Curvularia affinis 42
21.Karakter morfologi Cylindrocarpon 43
22.Karakter morfologi Fusarium solani 43
23.Karakter morfologi Colletotrichum dan Glomerella 44
24.Karakter morfologi Talaromyces assiutensis 45
25.Karakter morfologi Periconia 45
26.Karakter morfologi Lecanilicilium kalimantanese 45 27.Karakter morfologi cendawan endofit miselia sterilia 46 28.Pohon filogenetik hasil identifikasi cendawan endofit asal organ
tanaman jahe merah 54
29.Spektrum inframerah data asli dan data yang telah mengalami proses
pendahuluan dari 17 cendawan endofit asal tanaman jahe merah 59 30.Hasil analisis komponen utama data FTIR 17 isolat cendawan
endofit asal tanaman jahe merah menggunakan PCA 60 31.Hasil analisis komponen utama data FTIR 17 isolat cendawan
PENDAHULUAN
Latar Belakang
Cendawan endofit ialah cendawan yang seluruh siklus hidupnya berada dalam jaringan suatu organ tanaman seperti akar, batang, daun, dan buah dan hidup bersimbiosis mutualisme atau netral dengan tanaman inangnya (Wilson 1995). Dalam simbiosisnya, cendawan endofit menghasilkan senyawa metabolit baik untuk tanaman inang maupun untuk cendawan itu sendiri sedangkan tanaman inang memberikan nutrisi dan senyawa aktif yang diperlukan oleh cendawan endofit. Senyawa bioaktif cendawan endofit berfungsi antara lain sebagai fungisida (You et al. 2009), zat pengatur tumbuh tumbuhan, antimikrob (Rukachaisirikul et al. 2008), antivirus, insektisida, dan mediasi berbagai ketahanan tanaman terhadap cekaman biotik dan abiotik. Bailey et al. (2008) melaporkan bahwa tanaman yang diinokulasi cendawan endofit menunjukkan ketahanan yang lebih tinggi terhadap serangan patogen dan tahan terhadap cekaman kekeringan, logam berat, pH rendah, dan salinitas tinggi. Mekanisme resistensi tersebut diikuti dengan proses fisiologi tanaman atau peningkatan penyerapan hara mineral. Sejumlah senyawa metabolit sekunder yang dihasilkan oleh cendawan endofit memiliki aktivitas biologi (Strobel dan Daisy 2003) dan beberapa dari senyawa bioaktif tersebut merupakan senyawa bioaktif yang baru (Schulz et al. 2002).
Berdasarkan sifat tumbuhnya, sebagian cendawan endofit memiliki sifat spesifik sehingga dapat diisolasi dari tanaman inangnya dan ditumbuhkan pada media yang sesuai dan ada yang bersifat obligat yaitu tidak dapat ditumbuhkan pada media buatan kecuali bersama-sama dengan tanaman inangnya. Cendawan endofit yang potensial biasanya diperoleh dari tumbuhan inang yang khas seperti 1). tumbuhan yang hidup di lingkungan yang unik, 2). tanaman yang mempunyai sejarah etnobotani yaitu tanaman yang sering digunakan oleh masyarakat sebagai bahan obat, 3). tumbuhan endemik, 4). tumbuhan yang hidup di areal atau lingkungan yang mempunyai keragaman yang tinggi, dan 5). tumbuhan yang hidup di sekitar tumbuhan yang terserang penyakit (Strobel dan Daisy 2003).
penyakit kulit, anti stress, anti radang, anti kanker, dan sebagai bahan kosmetik (Bermawie et al. 2005). Industri jamu memerlukan sekitar 100 ton simplisia pegagan setiap tahunnya. Dari sepuluh jenis jamu yang beredar di pasaran, pegagan merupakan bahan baku yang dipergunakan dengan kadar simplisia yang dicantumkan dalam kemasannya antara 15-25 % (Januwati dan Yusron 2004). Kebutuhan bahan baku tanaman tersebut sebagai bahan obat terus meningkat. Dengan mengisolasi cendawan endofit dari tanaman obat tersebut, maka diharapkan akan diperoleh cendawan endofit potensial dan juga dapat menghasilkan senyawa aktif yang potensial yang dapat digunakan untuk pengembangan pertanian berkelanjutan.
Cendawan endofit dapat menghasilkan senyawa bioaktif yang dapat digunakan untuk berbagai bidang seperti industri pertanian (Schulz et al. 2002). Dalam bidang pertanian, cendawan endofit telah banyak digunakan antara lain sebagai pengendali hayati cendawan patogen pada berbagai tanaman budi daya (Campanile, Ruscelli, dan Luisi 2007; You et al. 2009). Cendawan endofit
Trichoderma, Pestalotiopsis, Curvularia, Tolypocladium dan Fusarium dari tanaman coklat mempunyai kemampuan menghambat pertumbuhan cendawan patogen Phytophtora palmivora. Selain itu, Colletotrichum trunctatum yang diisolasi dari tanaman jarak (Jatropha curcas) mampu mengendalikan pertumbuhan cendawan patogen tanaman Fusarium oxysporum dan Scleorotinia sclerotiorum (Kumar dan Kaushik 2013; Hanada et al. 2010). Antifungi yang termasuk dalam kelompok sitokalasin, kaetoglobosin A dan kaetoglobosin C yang dihasilkan oleh cendawan endofit Chaetomium globosum mampu menekan pertumbuhan cendawan patogen Setosphaeria turcica pada tanaman jagung (Zhang et al. 2013). Larkin, Hopkins, dan Martin (1996) menggunakan cendawan
F. oxysporum bukan patogen untuk mengendalikan penyakit layu fusarium pada tanaman semangka.
Sumber senyawa bioaktif cendawan dapat merupakan hasil metabolisme cendawan itu sendiri atau merupakan prekursor dari tanaman inang yang akan digunakan untuk menghasilkan senyawa bioaktif oleh cendawan. Dalam media pertumbuhan, di luar tanaman inang, cendawan endofit dilaporkan dapat menghasilkan bahan bioaktif yang sejenis atau yang berbeda dengan yang terkandung pada tanaman inangnya dengan bantuan aktivitas suatu enzim yang diduga sebagai akibat koevolusi antara tanaman inang dengan cendawan endofit (Tan dan Zou 2001).
Kecenderungan masyarakat saat ini untuk kembali ke alam dengan slogan
”back to nature” semakin meningkat. Masyarakat berusaha menggunakan pangan
dan produk kesehatan yang aman dan mengurangi penggunaan obat-obat kimiawi sehingga permintaan bahan baku tanaman obat semakin meningkat. Senyawa bioaktif tanaman yang merupakan bahan baku obat-obatan merupakan hasil metabolit sekunder dari tanaman seperti senyawa terpen, fenol, alkaloid, dan glukosida. Poduksi metabolit sekunder pada tanaman dipengaruhi oleh faktor internal dan eksternal dimana mikroba endofit dan lingkungan merupakan salah satu faktor eksternal (Faeth dan Fagan 2002).
secara langsung dari tanaman dibutuhkan sangat banyak biomassa atau bagian dari tanaman tersebut sehingga terjadi ekspolaitasi tanaman obat di alam yang menyebabkan kelangkaan tanaman obat. Untuk mendapatkan biomassa yang banyak, berarti diperlukan lahan yang cukup luas untuk menumbuhkan tanaman obat dan memerlukan jangka waktu yang cukup lama untuk dapat dipanen. Dengan menggunakan cendawan endofit sebagai produsen senyawa bioaktif berarti mengurangi masalah kelangkaan tanaman obat.
Pada penggunaan tanamanan obat, biasanya digunakan bagian tanaman tertentu yang mengandung senyawa bioaktif dengan konsentrasi yang tinggi seperti temulawak dan jahe merah diambil dari bagian rimpang sementara jati belanda dan pegagan diambil dari bagian daun. Informasi keragaman cendawan endofit yang menempati organ fungsional tanaman obat jati belanda, pegagan, dan temulawak masih terbatas. Selain itu, informasi mengenai keragaman cendawan endofit tersebut pada organ fungsional dibandingkan dengan organ non-fungsional terutama untuk tanaman jahe merah belum tersedia. Metode untuk identifikasi cendawan endofit tersebut dapat dilakukan antara lain dengan karakterisasi sifat-sifat morfologi, analisis molekular sekuen DNA antara lain menggunakan ruas ITS rDNA, filogenetik, dan analisis spesi kimia menggunakan Fourier Transform Infra Red (FTIR). Identifikasi cendawan menggunakan kombinasi berbagai metode tersebut diharapkan akan memberikan hasil yang lebih akurat.
Salah satu faktor pembatas dalam peningkatan produktivitas tanaman obat seperti jahe merah, temulawak, dan pegagan adalah adanya serangan patogen penyebab penyakit, di antaranya adalah penyakit yang disebabkan oleh patogen F. oxysporum. Semangun (1989) melaporkan bahwa cendawan tersebut menyebabkan penyakit busuk akar rimpang pada tanaman jahe merah dan
temulawak. Tanaman yang terserang cendawan patogen F. oxysporum umumnya
menunjukkan gejala antara lain daun menguning, layu, klorosis, nekrosis, daun muda berguguran, sistem vaskular menjadi warna cokelat, kerdil, dan pucuk mongering, dan tanaman mati. Akar berkeriput dan berwarna kehitam-hitaman,
dan pada bagian tengah rimpang membusuk. Layu fusarium menyebabkan
kerusakan tanaman pertanian yang menyebabkan menurunnya produksi baik kualitas maupun kuantitas. Pengendalian hama maupun penyakit pada tanaman obat tidak boleh menggunakan bahan kimia karena residu yang tertinggal pada bagian tanaman dapat mempengaruhi kandungan bahan aktif yang dikandungnya yang mempengaruhi kualitas dari tanaman obat tersebut. Untuk pengendalian hama dan penyakit sebaiknya digunakan agens pengendali hayati antara lain cendawan endofit yang mempunyai aktivitas yang tinggi.
Tujuan Penelitian
Penelitian ini bertujuan:
1. Mendapatkan isolat cendawan endofit dari organ fungsional tanaman obat jati belanda, pegagan lokal, pegagan malaysia, dan temulawak serta mengidentifikasi cendawan endofit yang diperoleh dengan karakter morfologi, sekuen DNA pada daerah ITS rDNA, analisis filogenetik, dan kemampuan antagonistik terhadap F. oxysporium.
2. Mendapatkan isolat cendawan endofit dari seluruh organ tanaman jahe merah yang digunakan sebagai tanaman model dalam analisis cendawan yaitu dari organ fungsional dan non-fungsional serta mengidentifikasi cendawan endofit yang diperoleh dengan karakter morfologi, sekuen DNA pada daerah ITS rDNA, filogenetik, kemampuan antagonistik terhadap F. oxysporium, dan spesi kimia menggunakan FTIR.
3. Penapisan cendawan endofit potensial asal kelima tanaman obat sebagai pengendali hayati cendawan patogen tanaman F. oxysporium secara in vitro.
Hipotesis
1. Tanaman obat merupakan habitat berbagai cendawan endofit.
2. Cendawan endofit yang mengkolonisasi tanaman obat mempunyai keragaman yang tinggi dari karakter morfologi, molekuler, filogenetik, spesi kimia, dan kemampuan antagonis terhadap cendawan patogen tanaman F. oxysporum. 3. Cendawan endofit yang bersimbiosis dengan tanaman obat ada yang berpotensi
sebagai pengendali hayati cendawan patogen.
Manfaat
1. Diperoleh koleksi cendawan endofit asal organ fungsional tanaman obat jati belanda, pegagan lokal, pegagan malaysia, temulawak, dan seluruh organ tanaman jahe merah yang telah teridentifikasi dan terkarakterisasi dengan baik sebagai sumber plasma nutfah untuk pengembangan industri pertanian dan obat-obatan.
2. Diperoleh informasi biologi berupa keragaman dan penyebaran cendawan endofit pada tanaman obat potensial untuk pengembangan dan produksi tanaman obat yang berkualitas.
Isolat potensial sebagai penghasil antifungi Isolat potensial sebagai
penghasil antifungi
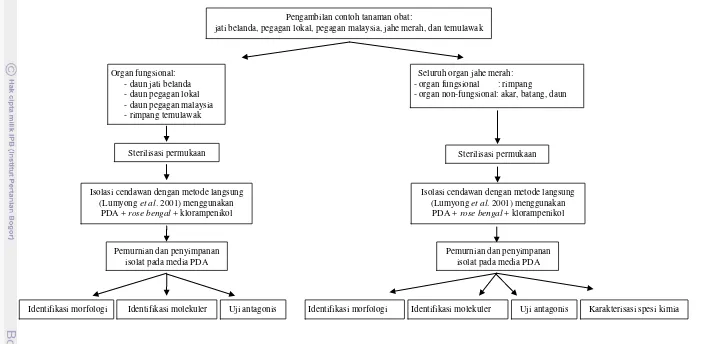
Alur Penelitian
Pengambilan contoh tanaman obat:
jati belanda, pegagan lokal, pegagan malaysia, jahe merah, dan temulawak
Isolasi, pemurnian, dan penyimpanan isolat cendawan endofit
Identifikasi: - morfologi - molekuler
-analisis filogenetik Organ fungsional: - daun jati belanda - daun pegagan lokal - daun pegagan malaysia - rimpang temulawak
Seluruh organ tanaman jahe merah: - organ fungsional : rimpang
- organ non-fungsional : akar, batang, daun
Isolasi, pemurnian, dan penyimpanan isolat
cendawan endofit
Identifikasi: - morfologi - molekuler
-analisis filogenetik
Uji antagonistik in vitro
terhadap F. oxysporum
Uji antagonistik in vitro
terhadap F. oxysporum
TINJAUAN PUSTAKA
Tanaman Obat
Indonesia merupakan salah satu negara yang memiliki keragaman tumbuhan obat yang tinggi. Wilayah hutan tropika Indonesia memiliki keanekaragaman hayati tertinggi ke dua di dunia setelah Brazilia. Dari 40.000 spesies flora yang ada di dunia, sebanyak 30.000 spesies dijumpai di Indonesia dan 940 spesies di antaranya diketahui berkhasiat sebagai obat-obatan yang telah dipergunakan dalam pengobatan tradisional. Jumlah tumbuhan obat tersebut meliputi sekitar 90% dari jumlah tumbuhan obat yang terdapat di kawasan Asia (Puslitbangtri 1992). Menurut Ditjen BPOM (1991) terdapat 283 spesies tumbuhan obat yang sudah terdaftar digunakan oleh industri obat tradisional antara lain jahe merah, jati belanda, pegagan, dan temulawak. Badan Litbang Deptan (2007) menetapkan tanaman potensial unggulan untuk dikembangkan berdasarkan khasiat, jumlah serapan oleh industri obat tradisional, jumlah petani dan tenaga yang terlibat, prospek pengembangan dan kecenderungan pengembangan ke depan dan ke-empat tanaman obat tersebut termasuk ke dalam tanaman obat potensial unggulan. Sebagai bahan obat-obatan, masyarakat biasanya menggunakan bagian tertentu dari tanaman obat tersebut karena diyakini mengandung bahan aktif yang diinginkan dalam konsentrasi yang tinggi dibanding organ lainnya. Organ yang biasa digunakan sebagai bahan utama obat-obatan disebut sebagai organ fungsional dan organ tanaman lainnya yang tidak atau jarang digunakan sebagai bahan obat-obatan disebut bagian non-fungsional.
Jati Belanda
Gambar 1 Jati belanda: (A) pohon jati belanda, (B) daun jati belanda
Kulit jati belanda mengandung lemak, glukosa, dan lendir. Daunnya mengandung alkaloid, flavaonoid, saponin, steroid, terpena, triterpenoid, tanin, fenol hidrokuinon, asam fenolat, karotenoid, glukosa, resin, asam lemak, zat pahit, dan karbohidrat. Secara tradisonal, daun jati belanda berkhasiat sebagai obat pelangsing tubuh dan menurunkan kadar lemak tubuh sehingga simplisia daun ini banyak digunakan dalam ramuan galian singset. Daun jati belanda menghambat peningkatan kadar lipid peroksida pada kelinci. Bijinya dapat digunakan sebagai obat sakit perut dan kembung serta buahnya dapat digunakan sebagai obat batuk. Selain itu, dekok kulit batang dapat digunakan sebagai obat malaria, diare dan sipilis. Jati belanda juga dapat digunakan untuk mengobati influenza, pilek, disentri, luka, dan patah tulang. Ekstrak daun tanaman ini dapat menekan pertumbuhan bakteri Staphylococcus aureus, Shigella dysenteria, dan Bacillus subtilis secara in vitro.
Pegagan
Pegagan (Centella asiatica L) berasal dari Asia dan jenis pegagan yang banyak dijumpai adalah pegagan merah dan pegagan hijau. Pegagan merah dikenal juga dengan antanan kebun atau antanan batu karena banyak ditemukan di daerah bebatuan, kering dan terbuka. Pegagan merah tumbuh merambat dengan stolon (geragih) dan tidak mempunyai batang, tetapi mempunyai rhizoma (rimpang pendek). Pegagan hijau sering dijumpai di daerah persawahan dan di sela-sela rumput. Tempat yang disukai oleh pegagan hijau yaitu tempat agak lembab dan terbuka atau agak ternaungi. Pegagan hijau tersebut merupakan pegagan hijau lokal. Ada juga pegagan hijau yang berdaun tebal dengan postur tubuh yang lebih tinggi yang dikenal dengan pegagan malaysia (Gambar 2).
Pegagan merupakan tanaman herba tahunan yang tumbuh menjalar, berbunga sepanjang tahun, dan berbatang pendek sehingga dianggap tidak
mempunyai batang. Dari batang tumbuh stolon yang menjalar horizontal di atas permukaan tanah dan berbuku-buku. Dari buku-buku yang menyentuh tanah, akan keluar akar tunas yang akan tumbuh menjadi tanaman baru. Daun pegagan tersusun secara basalis (roset) dengan 2-10 daun tunggal per tanaman, berwarna hijau, berbentuk seperti kipas, ginjal, atau buah pinggang, berukuran 2-5 cm x 3-7 cm. Tangkai daun tegak dan sangat panjang berukuran 9-17 cm dengan bagian dalam berlubang serta bagian pangkal melekuk ke dalam dan melebar seperti pelepah. Tepi daun agak melengkung ke atas, bergerigi, dan kadang-kadang berambut, Tulangnya berpusat di pangkal, tersebar ke ujung, berdiameter 1-7 cm (Winarto dan Surbakti 2003). Bunga pegagan berbentuk seperti payung tunggal dan biasanya tersusun dari 3 bunga. Bunga bersifat aktinomorf dan biseksual dengan kelopak berwarna hijau berjumlah lima. Buah pegagan berukuran kecil berbentuk lonjong atau pipih, menggantung, baunya wangi, rasanya pahit, dan berwarna kuning. Buah berukuran kecil berwarna kuning cokelat.
Gambar 2 Pegagan: (A) pegagan lokal dan (B) pegagan malaysia
Pegagan mengandung beberapa komponen fitokimia seperti triterpenoid, saponin, alkaloid, flavaonoid, tanin, steroid, dan glikosida, valerin, dan minyak atsiri. Pegagan berasa manis, bersifat mendinginkan, memiliki fungsi membersihkan darah, melancarkan peredaran darah, peluruh kencing (diuretika), penurun panas (antipiretika), menghentikan pendarahan (haemostatika), meningkatkan syaraf memori, antibakteri, tonik, antiinflamasi, hipotensif, insektisida, antialergi dan stimulan. Saponin yang ada menghambat produksi jaringan bekas luka yang berlebihan (menghambat terjadinya keloid). Selain itu, tanaman ini dapat meningkatkan sirkulasi darah pada lengan dan kaki; mencegah varises dan salah urat; meningkatkan daya ingat, mental dan stamina tubuh; serta menurunkan gejala stres dan depresi. Kebanyakan pegagan dikonsumsi segar untuk lalapan, tetapi ada yang dikeringkan untuk dijadikan teh, diambil ekstraknya untuk dibuat kapsul atau diolah menjadi krem, salep, obat jerawat, maupun pelembab kulit.
Temulawak
Temulawak (Curcuma xanthorrhiza Roxb) adalah tanaman herbal asal Indonesia dan sudah dimanfaatkan sebagai bahan baku obat, bahan pangan, pewarna, bahan baku industri kosmetika, maupun dibuat makanan dan minuman segar. Temulawak mempunyai ciri morfologi antara lain berbatang semu dengan tinggi mencapai 2 m dan berwarna hijau atau coklat gelap. Daun temulawak termasuk daun sempurna, berbentuk lebar dan pada setiap helaian dihubungkan dengan pelepah dan tangkai daun yang agak panjang. Bunga temulawak pendek dan lebar serta berbentuk unik (bergerombol), berwarna putih kuning atau kuning muda bercampur merah di puncaknya. Rimpang temulawak terdiri atas rimpang induk dan rimpang anakan, berwarna jingga tua atau kecokelatan, berbentuk bulat, beraroma tajam yang menyengat, dan rasanya pahit (Gambar 3).
Gambar 3 Temulawak: (A) daun dan (B) bunga
Bahan aktif yang berkhasiat dalam rimpang temulawak antara lain kurkuminoid dan minyak atsiri. Temulawak digunakan sebagai penyembuh berbagai penyakit degeneratif, penurunan imunitas, dan penurunan vitalitas seperti sariawan, demam, kembung, asma, ambein, sembelit, rematik, asam urat, hepatitis, antikolesterol (Afifah dan Tim Lentera 2003), obat jerawat, meningkatkan nafsu makan, antiinflamasi, anemia, antioksidan, pencegah kanker, dan antimikrob. Senyawa kurkuminoid mempunyai aktifitas farmakologi seperti antioksidan, antiinflamasi (anti-radang), antilipidemia, antikanker, antimikrob, antifungi dan antikarsinogenik. Minyak atsiri pada temulawak berkhasiat sebagai
cholagum, yaitu bahan yang dapat merangsang pengeluaran cairan empedu yang berfungsi sebagai penambah nafsu makan dan antispasmodikum yaitu menenangkan dan mengembalikan kekejangan otot.
Jahe Merah
Di Indonesia, rimpang jahe (Zingiber officinale Roscoe) digunakan terutama sebagai bumbu masak, pemberi aroma dan rasa masakan dan minuman serta digunakan dalam industri farmasi, parfum, dan kosmetika. Berdasarkan aroma, warna, bentuk, dan ukuran rimpang, terdapat tiga varietas jahe yang biasa diperdagangkan yaitu jahe putih besar (Zingiber officinale Rosc var. officinale), jahe putih kecil (Zingiber officinale Rosc var. rubrum) dan jahe merah (Zingiber officinale Rosc var. amarum). Jahe putih besar yang disebut juga jahe gajah atau jahe badak dipergunakan untuk bumbu dan merupakan jahe yang paling disukai di pasaran internasional. Bentuknya besar gemuk dan rasanya tidak terlalu pedas. Daging rimpang berwarna kuning hingga putih. Jahe putih kecil yang disebut juga sebagai jahe kuning merupakan jahe yang banyak dipakai sebagai bumbu masakan, terutama untuk konsumsi lokal. Rasa dan aromanya cukup tajam. Ukuran rimpang sedang dengan warna kuning. Jahe merah merupakan jahe yang memiliki kandungan minyak atsiri tinggi dan rasa paling pedas sehingga cocok untuk bahan dasar farmasi dan jamu. Ukuran rimpangnya paling kecil dengan warna merah dengan serat lebih besar dibandingkan dengan jahe lainnya. Jahe kuning dan jahe merah banyak digunakan untuk industri obat tradional dan jamu (Gambar 4).
Gambar 4 Jahe merah: (A) tanaman jahe merah, (B) rimpang jahe merah, (C) rimpang jahe merah
Tanaman jahe terdiri atas struktur rimpang, batang, daun, bunga, dan buah. Jahe merah memiliki ciri morfologi antara lain berbatang semu yang tumbuh tegak tidak bercabang, berbentuk bulat, tersusun dari lembaran-lembaran pelepah daun, dan tinggi mencapai 1,25 m. Setiap batang umumnya terdiri atas 8-12 helai daun. Daun menyirip dengan panjang 15-23 cm dan panjang 8-15 cm. Tangkai daun berbulu halus. Bunga jahe majemuk, tersusun berupa mayang, membentuk
malai yang kompak atau terbuka, bunga berkelamin dua (hermaphrodite), berbenang sari satu, dan berputik tiga. Buahnya berbentuk kotak dengan tiga ruangan yang kadang-kadang tidak pecah. Akarnya berbentuk rimpang dengan daging akar berwarna kuning hingga kemerahan dengan bau menyengat. Pada jahe merah, akar keluar hampir di sekeliling sisik, nampak lebih kokoh, berserat, besar, panjang dan kuat mencengkeram tanah.
Bagian jahe yang banyak digunakan adalah rimpangnya. Rimpang jahe pada umumnya mengandung minyak atsiri yang menjadi pembawa aroma khas pada jahe dan oleoresin. Minyak atsiri terdiri atas beberapa komponen penting seperti zingiberene, curcumene, philandren, limonene, farnesol. Limonene berfungsi sebagai antifungi Candida albicans, sebagai antikolinesterase, dan sebagai obat flu. Selain itu terdapat 1.8-kineole berfungsi untuk mengatasi ejakulasi prematur, anestetik, antikolinesterase, dan perangsang aktivitas syaraf pusat, sementara farnesol dapat merangsang regenerasi sel (Herlina et al. 2002). Oleoresin jahe mengandung senyawa pemberi rasa pedas seperti gingerol, shogaol, dan gingeron. Shogaol dan gingerol merupakan senyawa yang dapat mengatasi masalah mabuk laut, rematik, mual dan muntah.
Cendawan Endofit
Cendawan endofit merupakan salah satu mikrob yang hidup dalam jaringan tanaman. Setiap tumbuhan bersimbiosis dengan beberapa mikrob endofit yang mampu menghasilkan metabolit. Ditinjau dari taksonomi, cendawan ini merupakan organisme yang sangat beragam. Petrini et al. (1992) menggolongkan cendawan ke dalam Ascomycotina, Basidiomycotina, dan Deutromycotina dengan anggota terbesar dari Ascomycotina dari kelas Loculoascomycetes, Discomycetes, dan Pyrenomycetes. Strobell et al. (1996) menambahkan bahwa cendawan endofit meliputi genus Pestalotia, Pestalotipsis, Monochaethia, dan lain-lain. Clay (1988) menggolongkan cendawan endofit dalam famili Balansiae yang terdiri atas 5 genus yaitu Atkinsonella, Balansiae, Balansiopsis, Epichloe, dan
Myriogenosporae.
Cendawan endofit dapat diisolasi dari jaringan tanaman dan ditumbuhkan pada medium tertentu. Cendawan endofit dilaporkan juga dapat menghasilkan senyawa bioaktif dalam media biakan. Cendawan umumnya menghasilkan metabolit sekunder pada saat organisme tersebut berada pada fase kritis yaitu fase stasioner. Cendawan endofit dapat juga menghasilkan senyawa bioaktif yang sejenis dengan yang dihasilkan inangnya, sebagai contoh, cendawan endofit T. andreanae menghasilkan senyawa bioaktif yang sejenis dengan inangnya yaitu paclitaxel (Shrestha et al. 2001). Dibandingkan dengan tanaman inangnya, pemanfaatan cendawan endofit untuk menghasilkan senyawa metabolit sekunder mempunyai beberapa kelebihan antara lain 1). lebih cepat menghasilkan produk dengan mutu seragam, 2). dapat diproduksi dalam skala besar, dan 3). kemungkinan diperoleh komponen bioaktif baru dengan memberikan kondisi yang berbeda (Stierle et al. 1995). Hal ini karena cendawan tersebut mempunyai siklus hidup yang lebih pendek dibandingkan dengan tanaman. Pertumbuhan cendawan endofit lebih mudah dimanipulasi terutama memanipulasi media dan kondisi pertumbuhannya.
Untuk mendapatkan cendawan endofit potensial perlu diperhatikan sumber cendawan endofit tersebut dan teknik sterilisasi permukaan untuk mengeliminasi tumbuhnya cendawan epifit dan kontaminan. Sumber cendawan endofit potensial menurut Strobel dan Daisy 2003 adalah 1). Tanaman yang hidup di niche dan lingkungan unik, seperti tanaman yang hidup di tanah yang sangat masam, sangat kering, dan lain sebagainya, 2). Tanaman yang mempunyai sejarah etnobotanikal dan digunakan oleh masyarakat setempat, 3). Tanaman endemik, 4). Tanaman yang hidup di areal yang mempunyai keragaman yang tinggi, 5). Tanaman yang hidup di sekitar tanaman yang terserang penyakit, dan 6). Jaringan tanaman muda lebih baik dijadikan sebagai sumber cendawan endofit daripada jaringan yang tua Dengan mengisolasi cendawan endofit dari sumber demikian diharapkan akan diperoleh cendawan endofit potensial bahkan cendawan endofit yang baru yang menghasilkan senyawa bioaktif yang potensial juga. Sebagai contoh cendawan endofit Collletotrichum sp. yang berasal dari tanaman obat Artemisia annua
menghasilkan senyawa bioaktif yang dapat mengendalikan bakteri dan cendawan parasit pada manusia dan juga sebagai fungistatik bagi cendawan patogen tanaman (Lu et al. 2000). Oleh karena kemampuan cendawan endofit dalam menghasilkan sejumlah senyawa bioaktif potensial, penelitian mengenai cendawan endofit menjadi berkembang yang antara lain mengenai keragaman cendawan endofit tersebut, kandungan metabolit sekundernya, serta hubungan cendawan tersebut dengan inangnya.
Identifikasi Cendawan Endofit
dan aseksual (Hyde dan Soytong 2007). Berbagai cara dilakukan untuk merangsang cendawan endofit bersporulasi dalam media pertumbuhan sehingga dapat diidentifikasi antara lain dengan menggunakan berbagai media dan kondisi inkubasi. Guo, Hyde, dan Liew (2000) menggunakan beberapa media seperti
potato dextrose agar (PDA), malt extract agar (MEA), corn meal agar (CMA),
potato carrot agar (PCA), dan water agar (WA), atau dengan menambahkan potongan atau ekstrak jaringan tanaman inang pada kultur biakan. Meskipun sudah diinduksi untuk merangsang terjadinya sporulasi, sejumlah cendawan tidak juga bersporulasi dalam media pertumbuhan yang disebut miselia sterilia (Lacap, Hyde, dan Liew 2003).
Berbeda dengan karakterisasi morfologi, identifikasi molekuler merupakan metode yang tidak bergantung pada media pertumbuhan. Identifikasi molekuler yang saat ini berkembang antara lain dengan denaturing gradient gel electrophoresis (DGGE), terminal restriction fragment length polymorphism (T-RFLP), dan sekuensing rDNA ITS (internal transcribed spacer). Dalam analisis sekuensing ITS, gen 5.8S merupakan gen yang sangat conserve sehingga digunakan untuk filogenetik pada tingkat taksonomi yang lebih tinggi sedangkan daerah ITS (ITS1 dan ITS2) merupakan daerah dengan keragaman yang tinggi sehingga digunakan untuk menganalisis filogenetik pada tingkat yang lebih rendah (Gambar 5). Chen, Zhang, dan Lu (2008) menambahkan bahwa analisis sekuen daerah ITS efektif terutama dalam mengidentifikasi cendawan yang tidak bersporulasi dan juga untuk mengurangi pengaruh subjektifitas dalam pengamatan morfologi. Lin et al. (2007) menggunakan metode tersebut dan dapat mengidentifikasi sebanyak 48.9% cendawan endofit yang tidak bersporulasi (miselia sterilia) yang diperoleh dari tanaman Camptotheca aacuminata. Untuk mengamplifikasi ruas ITS1-28S rDNA dapat menggunakan berbagai primer, yaitu NS7, ITS5, ITS3, dan NL1 sebagai primer forward dan NS6, NS8, ITS2, ITS4, dan NL4 sebagai primer reverse dengan ukuran hasil amplifikasi sekitar 550 pasang basa.
Keberadaan cendawan endofit dalam tanaman inang tertentu ada yang berlimpah dan ada juga sebagai spesifik inang (Cohen 2004). Schulz et al. (1993, 1995, 1998) memperoleh lebih dari 6500 isolat cendawan endofit yang berasal dari kira-kira 500 tanaman. Cendawan yang ditemukan berlimpah misalnya
Acremonium, Alternaria, Cladosporium, Coniothyrium, Epicoccum, Fusarium,
Geniculosporium, Phoma, Pleospora. Ditambahkan oleh Cannon dan Simmons (2002); dan Suryanarayanan, Venkatesan, dan Murali (2003) bahwa genus cendawan endofit yang umum hidup di daerah tropik dan temperate adalah
Fusarium, Phomopsis, Phoma, sementara anggota Xylariaceae, Colletotrichum,
Guignardia, Phyllosticta dan Pestalotiopsis merupakan cendawan yang predominan di daerah tropik.
Spektroskopi infra merah digunakan secara luas untuk analisis secara kualitatif dan kuantitatif. Spektroskopi ini banyak digunakan untuk mengidentifikasi senyawa organik karena spektrumnya sangat kompleks yang terdiri dari banyak puncak-puncak serapan. Spektrum infra merah dari senyawa organik mempunyai sifat-sifat fisik yang karakteristik. Setiap senyawa mempunyai spektrum spesifik dan kemungkinan dua senyawa mempunyai spektrum yang sama adalah sangat kecil kecuali senyawa isomer optik. Spektrum infra merah terletak pada daerah dengan penjang gelombang 780 - 1.000.000 nm (0.78 - 1000 mm), atau bilangan gelombang 1200 - 10 cm-1. Dilihat dari panjang gelombang dan dari segi aplikasinya, spektrum infra merah dibagi dalam tiga daerah yaitu infra merah dekat, pertengahan, dan infra merah jauh. Daerah infra merah yangdigunakan untuk keperluan analisis kimia adalah pada daerah sekitar 4000 sampai dengan 670 cm-1 atau 2.5 -15 mm.
Spektroskopi FTIR telah banyak digunakan untuk mengidentifikasi berbagai organisme antara lain cendawan (Erukhimovitch et al. 2007; Naumann et al. 2005). Metode ini dapat mengidentifikasi cendawan tidak hanya pada tingkat genus tetapi juga pada tingkat spesies dan bahkan strain (Beattie et al. 1998). Spektroskopi FTIR merupakan metode identifikasi dengan beberapa kelebihan yaitu lebih sensitif, cepat, murah dan dengan tingkat ketelitian yang tinggi (Kummerle, Scher, dan Seiler 1998). Spektrum infra merah yang dihasilkan merupakan total komposisi kimia seperti protein, membran, dinding sel, dan asam nukleat dari sel dan setiap spesies mempunyai kuantitas spektrum yang khas.
Dalam proses analisis, beberapa koreksi perlu dilakukan untuk mendapatkan hasil yang lebih baik dan akurat. Proses tersebut antara lain koreksi garis dasar, normalisasi, derivatisasi, dan smoothing. Pada proses koreksi garis dasar, spektrum dikoreksi karena ada wilayah yang tidak mempunyai sinyal (Gambar 6). Normalisasi dimaksudkan untuk menormalisai serangkaian sinyal spektrum utama. Derivatisasi merupakan fungsi kontinu dan digunakan untuk menghilangkan serangkaian garis dasar yang tidak terdeteksi (Gambar 7).
Smoothing merupakan manipulasi matematika untuk menyederhanakan data spektrum (Gambar 8).
Gambar 6 Ilustrasi koreksi garis dasar spektrum emisi Raman: (A) spektrum asli (B) spektrum yang telah dikoreksi dengan garis dasar (Gemperline 2006).
Gambar 7 Ilustrasi pendekatan menggunakan derivatisasi pada spektrum infra merah campuran air-metanol (a) spektrum asli (b) spektrum hasil derivatisasi (Gemperline 2006).
A B
Gambar 8 Hasil proses smoothing kuadratik Savitzky-Golay terhadap spektrum menggunakan 5-poin span, 9-poin span, 13-poin span, dan 17-poin span (Gemperline 2006).
METODE
Waktu dan Tempat
Penelitian ini dilaksanakan di Laboratorium Biologi Balai Penelitian Tanah Bogor, Lab. Biorin Pusat Penelitian Sumberdaya Hayati dan Bioteknologi IPB, Lab. Terpadu dan Lab. Bagian Mikologi Dept. Biologi FMIPA IPB, Lab. Kimia Analitik Dept. Kimia FMIPA IPB, dan Lab. Pusat Studi Biofarmaka LPPB IPB Bogor. Penelitian dilaksanakan dari Oktober 2009 sampai Desember 2012.
Bahan Penelitian
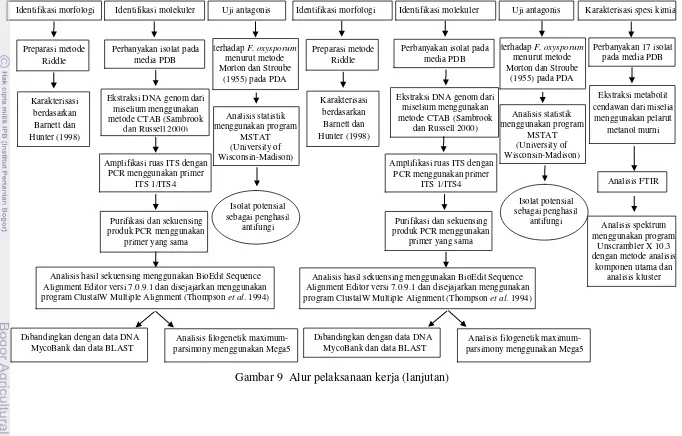
Gambar 9 Alur pelaksanaan kerja
Pengambilan contoh tanaman obat:
jati belanda, pegagan lokal, pegagan malaysia, jahe merah, dan temulawak
Isolasi cendawan dengan metode langsung (Lumyong et al. 2001) menggunakan
PDA + rose bengal + klorampenikol Organ fungsional:
- daun jati belanda - daun pegagan lokal - daun pegagan malaysia - rimpang temulawak
Seluruh organ jahe merah: - organ fungsional : rimpang
- organ non-fungsional: akar, batang, daun
Sterilisasi permukaan Sterilisasi permukaan
Pemurnian dan penyimpanan isolat pada media PDA
Identifikasi morfologi
Isolasi cendawan dengan metode langsung (Lumyong et al. 2001) menggunakan
PDA + rose bengal + klorampenikol
Pemurnian dan penyimpanan isolat pada media PDA
Isolat potensial
Gambar 9 Alur pelaksanaan kerja (lanjutan)
Ekstraksi DNA genom dari
Analisis hasil sekuensing menggunakan BioEdit Sequence Alignment Editor versi 7.0.9.1 dan disejajarkan menggunakan program ClustalW Multiple Alignment (Thompson et al. 1994)
Identifikasi morfologi Identifikasi molekuler Uji antagonis Identifikasi morfologi Identifikasi molekuler Uji antagonis Karakterisasi spesi kimia
terhadap F. oxysporum
Analisis hasil sekuensing menggunakan BioEdit Sequence Alignment Editor versi 7.0.9.1 dan disejajarkan menggunakan program ClustalW Multiple Alignment (Thompson et al. 1994)
Prosedur Penelitian
Penelitian ini terdiri dari serangkaian kegiatan meliputi isolasi cendawan endofit dari tanaman yang dipelajari, identifikasi keragaman berdasarkan karakterisasi morfologi, molekuler, filogenetik, kemampuan antagonistik terhadap cendawan patogen F. oxysporum, dan spesi kimia menggunakan FTIR. Alur kerja penelitian disajikan dalam Gambar 9. Tanaman obat yang digunakan dibagi dalam dua kelompok. Kelompok pertama ialah tanaman yang diambil organ fungsionalnya yaitu daun jati belanda, daun pegagan lokal, daun pegagan malaysia, dan rimpang temulawak. Kelompok kedua ialah jahe merah yang merupakan tanaman model yaitu tanaman yang seluruh organnya baik fungsional yaitu rimpang maupun non-fungsional yaitu akar, batang, dan daun digunakan sebagai sumber isolat.
Isolasi Cendawan Endofit
Cendawan endofit diisolasi dari organ fungsional tanaman jati belanda, pegagan lokal, pegagan malaysia, temulawak, dan dari seluruh organ tanaman jahe merah yaitu dari akar, batang, daun dan rimpang. Masing-masing organ tanaman dipotong menjadi potongan-potongan dengan ukuran 2x2 cm2 untuk daun, 1 cm untuk batang, dan 2x2x2 cm3 untuk rimpang. Sebanyak 50 potongan dari masing-masing organ disetrilisasi permukaan dengan cara merendam sampel dalam etanol selama 1 menit, dibilas tiga kali dengan air steril, kemudian direndam kembali dalam larutan hipoklorit (NaOCl) 0.5% selama 5 menit dan dibilas menggunakan air steril sebanyak 6 kali. Sampel dikeringkan di atas kertas saring steril selama 12 jam. Semua persiapan sterilisasi dan isolasi dilakukan secara aseptik. Isolasi cendawan endofit dilakukan dengan metode langsung (Lumyong et al. 2001) menggunakan PDA yang diberi suplemen fungistatik rose bengal (30 mgl-1) dan antibiotik klorampenikol (0.5 gl-1). Setelah cendawan endofit tumbuh dari organ tanaman, cendawan dimurnikan dengan cara memindahkan sekelumit cendawan pada PDA tanpa penambahan rose bengal
maupun antibiotik dan setiap isolat disimpan di IPB Culture Collection. Pada organ yang sama untuk tanaman jahe merah dan tanaman yang sama untuk tanaman jati belanda, pegagan lokal, pegagan malaysia, dan temulawak, diseleksi hanya koloni yang mempunyai karakteristik yang berbeda.
Identifikasi Cendawan Endofit
Identifikasi molekuler cendawan endofit. Identifikasi molekuler cendawan endofit dilakukan berdasarkan ITS1-5.8S-ITS2 rDNA dan menggunakan pasangan primer universal ITS1 (forward) (5’-TCCGTAGGTG AACCTGCGG-3’) dan ITS4 (reverse) (5′-TCCTCCGCTTATTGATATGC-3′) (White et al. 1990). Jika pada saat sekuensing, DNA tidak tersekuen dengan baik menggunakan pasangan primer ITS1 dan ITS4, maka digunakan pasangan primer ITS5 (5′-GGAAGTAAAAGTCGTAACAAGG-3′) dan ITS2 (5′-GCTGCGTTCT TCATCGATGC-3′) untuk sekuen yang tidak dapat mensekuen DNA dengan primer ITS1, atau ITS3 (5′-GCATCGATGAAGAACGCAGC-3′) dan NL4 (5’ -GGTCCGTGTTTCAAGACGG-3’) untuk DNA yang tidak tersekuen dengan baik menggunakan primer ITS4 sesuai dengan peta ribosomal DNA (Gambar 5).
Isolat-isolat cendawan endofit dari PDA dipindahkan ke PDB untuk diagitasi menggunakan inkubator bergoyang dengan kecepatan 120 rpm selama 7 hari pada suhu ruang. Miselia dipanen menggunakan penyaringan vacuum di atas kertas saring steril dan segera didinginkan dalam nitrogen cair, dihaluskan menggunakan mortar steril. DNA genom cendawan endofit diekstraksi dari miselium menggunakan metode CTAB (Sambrook dan Russell 2000) yang telah dimodifikasi. Sebanyak 0.5 g bubuk biomassa dipindahkan ke 1.5-ml tabung eppendorf yang berisi buffer ekstraksi (600 μl PVP dan 1.2 μl CTAB) yang telah diinkubasi dalam penangas air pada suhu 65 oC selama 30 menit. Tabung eppendorf dibolak balik dan diinkubasi pada suhu 65 oC selama 30 menit, dan diinkubasi dalam es selama 5 menit. Selanjutnya sampel ditambahkan 600 μl CI (24:1), dibolak balik, dan disentrifugasi selama 10 menit pada suhu 10 oC, 25,000×g. Fase cair dipindahkan ke tabung eppendorf yang baru dan diekstraksi dengan satu kali volume fenol:kloroform:isoamil alkohol (25:24:1), selanjutnya tabung dibolak balik, disentrifugasi pada suhu 4 oC, 25,000×g selama 5 menit. Supernatan dipindahkan ke tabung yang baru dan ditambah dengan volume yang sama 2M NaOAc pH 5.2 dan 2x volume EtOH dingin dan diinkubasi selama 30 menit pada suhu 20 oC. Pelet DNA dikumpulkan dengan cara sentrifugasi dengan kecepatan 25,000×g, 4 oC selama 30 menit. Pelet DNA dicuci dengan 500 μl 70% etanol dingin, disentrifugasi pada suhu 4 oC dengan kecepatan 25,000×g selama 5 menit. Pelet DNA kemudian dikeringkan dalam vacuum, lalu diresuspensi dalam 20 µl air double-distilled steril dan 0.2x volume RNAse, lalu diinkubasi pada suhu 37 oC selama 10 min. Inaktifasi RNAse dilakukan dengan cara inkubasi larutan pada suhu 70 oC selama 10 menit. Kualitas molekul DNA hasil isolasi diperiksa dengan elektroforesis gel agarosa 1% yang dijalankan pada tegangan 100 V selama 30 menit dalam larutan penyangga TAE 1×. DNA cendawan endofit disimpan dalam freezer sampai digunakan. Gel agarosa direndam dalam larutan EtBr selama 15 menit dan dibilas dengan akuades, dan diamati menggunakan UV transluminator. Sampel yang menampilkan pita tunggal pada gel agarosa 1% dapat digunakan untuk amplifikasi ruas ITS (Internal Transcribed Spacers) menggunakan mesin PCR.
ruas DNA (ekstensi) selama 1 menit pada suhu 72 °C, dan di akhir proses dilakukan ekstensi kembali selama 5 menit pada suhu 72 °C, dan disimpan selama 10 menit pada suhu 25 °C menggunakan Gene Amp 9700 thermal cycler (Applied Biosystems, USA). Kualitas amplikon diperiksa dengan cara sebanyak 5 ml produk PCR dipisahkan dengan elektroforesis menggunakan 1% gel agarosa dalam buffer 1x TAE selama 30 menit (Sambrook dan Russell 2000), diwarnai dengan 0.5 mg/ml etidium bromida dan diamati di bawah sinar UV. Bila primer ITS1 dan ITS4 tidak menempel pada template, maka digunakan pasangan primer ITS5 dengan ITS2 atau ITS3 dengan NL4 (White et al. 1990) dengan volume dan reaksi yang sama kecuali annealing dilakukan pada suhu 58 °C.
Purifikasi dan sekuensing produk PCR dilakukan oleh PT. Genetic Science Indonesia menggunakan primer yang sama. Untuk menentukan spesies atau genus, sekuen nukleotida setiap sampel dianalisis menggunakan BioEdit Sequence Alignment Editor versi 7.0.9.1. Sequen ruas ITS disejajarkan menggunakan program ClustalW Multiple Alignment (Thompson et al. 1994) dan dibandingkan dengan data DNA MycoBank (http://www.mycobank.org) dan data BLAST (http://www.blast.ncbi.nlm.nih.gov/blast). Data yang telah disejajarkan kemudian direkonstruksi menggunakan analisis maximum-parsimony untuk memperoleh pohon filogenetik menggunakan program Mega5 dengan nilai bootstrap yang dihitung dari 1000 ulangan (Tamura et al. 2007).
Penapisan cendawan endofit potensial sebagai pengendali hayati antifungi. Sebelum dilakukan penapisan cendawan endofit potensial sebagai antifungi terlebih dahulu dilakukan uji pendahuluan yaitu uji hipersensivitas cendawan endofit pada daun tembakau. Uji pendahuluan ini dimaksudkan untuk mengetahui cendawan endofit yang diperoleh merupakan cendawan patogen atau cendawan endofit. Uji hipersensivitas cendawan endofit pada daun tembakau dilakukan dengan cara menumbuhkan tembakau dari biji pada polibag. Setelah tembakau berumur tiga minggu, daun tembakau diinokulasi dengan cendawan endofit yang diremajakan pada PDA. Isolat cendawan endofit dipotong ukuran 1 cm2 lalu ditempelkan pada daun tembakau yang terlebih dahulu dilukai, ditutup dengan kapas steril dan dibasahi dengan air steril. Setiap hari isolat cendawan endofit yang ditutup dengan kapas steril dibasahi agar cendawan endofit tidak kekeringan. Sebagai perlakuan kontrol, potongan PDA dengan ukuran 1 cm2 ditempelkan pada daun tembakau yang telah dilukai. Pengamatan dilakukan pada 7 dan 14 hari setelah inokulasi. Setiap perlakuan dilakukan ulangan 3 kali.
penghambatan, R1 adalah jari-jari pertumbuhan cendawan patogen F. oxysporum
dalam perlakuan kontrol, dan R2 adalah jari-jari pertumbuhan cendawan F. oxysporum ke arah cendawan endofit dalam kultur ganda dengan cendawan endofit. Percobaan diatur dalam rancangan acak lengkap, semua isolat cendawan endofit sebagai perlakuan yang diulang lima kali. Analisis statistik dilakukan menggunakan program MSTAT (University of Wisconsin-Madison) dan nilai rata-rata dianalisis dengan menggunakan DMRT (p<0.05).
Ekstraksi metabolit cendawan endofit. Masing-masing isolat cendawan endofit murni terlebih dahulu diremajakan dalam media padat PDA dan diinkubasi pada suhu 28 oC selama 7 hari. Selanjutnya isolat tersebut diinokulasi kembali ke dalam tabung erlenmeyer (250 ml) yang berisi 100 ml PDB yang telah disterilisasi dalam autoklaf pada suhu 125 oC selama 15 menit. Kultur cair kemudian diinkubasi menggunakan inkubator goyang tidak kontinu dengan kecepatan 120 rpm selama 14 hari pada suhu ruang.
Untuk mendapatkan ekstrak kasar, miselia cendawan (biomassa) dipisahkan dari media dengan cara filtrasi menggunakan kertas saring steril. Biomassa kemudian dibekukan dengan menambah nitrogen cair, lalu dihaluskan sampai berbentuk tepung menggunakan mortar steril. Selanjutnya dilakukan ekstraksi dengan cara maserasi dengan merendam biomassa dalam pelarut metanol murni dengan perbandingan metanol:biomassa 2:1 pada suhu ruang selama 3x24 jam dan ditutup dengan aluminium foil. Setiap 24 jam, maserat dipisahkan dari residu dengan cara filtrasi menggunakan kertas saring. Ke dalam residu ditambahkan kembali pelarut dan tahapan ekstraksi diulang sampai tiga kali. Maserat dari setiap ulangan ekstraksi digabung dan dipekatkan dengan rotary vacuum evaporator. Ekstrak kasar dipindahkan ke dalam 2.5 ml botol dan dikeringkan dengan udara steril untuk menghilangkan metanol. Residu yang diperoleh disimpan untuk penggunaan selanjutnya.
Analisis spesi kimia cendawan endofit menggunakan FTIR. Dua mg ekstrak biomassa cendawan endofit dicampur dengan 200 mg KBr untuk dijadikan pelet. Pelet dibuat dengan menggunakan hand press Shimadzu dengan tekanan kerja sebesar 8 ton selama 2 menit. Pengukuran spektrum FTIR dilakukan dengan menggunakan Spektrosmeter FTIR Tensor 37 (Bruker Spectrospin) yang dilengkapi dengan detektor DTGS. Personal computer yang dilengkapi dengan Software OPUS versi 4.2 digunakan untuk mengontrol kerja spektrometer dalam menghasilkan spektrum pada kisaran panjang gelombang 4000–600 cm-1.