(Andrographis paniculata)
SEBAGAI ANTIDIABETES
ARIS WIBUDI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi Mekanisme Kerja Sambiloto
(Andrographis paniculata) Sebagai Antidiabetes adalah karya saya sendiri dan
belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber
informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak
diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam
Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Februari 2006
Aris Wibudi
sebagai Antidiabetes. Dibimbing oleh BAMBANG KIRANADI, WASMEN MANALU, ADI WINARTO dan SLAMET SUYONO.
Dalam penelitian terdahulu telah dibuktikan bahwa Andrographis paniculata (AP) bersifat menurunkan kadar glukosa darah pada tikus diabetes-STZ dan kelinci diabetes-aloksan, dan semua penelitian tersebut mengarahkan dugaan bahwa AP bekerja pada organ ekstra-pankreas. Sampai saat ini belum ada penelitian yang mempelajari pengaruh AP pada sel β pankreas. Tujuan penelitian ini adalah mempelajari pengaruh AP pada sel β pankreas.
BRIN-BD11 yang diinkubasi selama satu jam dalam media yang mengandung glukosa 16.7 mM + 0.625-2.5 mg/mL AP, menunjukkan respon sekresi insulin 1.7-3.73 kali lebih tinggi (p = 0.003 – p < 0.001) dibanding dengan glukosa 16.7 mM saja. Respon sekresi insulin meningkat 1.5 kali (p = 0.034) dan 2.3 kali (p = 0.001) dalam media 1.25 dan 2.5 mg/mL AP, dibanding dengan 100 μM glibenklamid. Pada konsentrasi 5 dan 10 mg/mL AP, terjadi penurunan respon insulinotropik BRIN-BD11 hingga 50.7 – 79.5% (p = 0.001) dibanding dengan 2.5 mg/mL AP. BRIN-BD11 yang diinkubasi selama 20 menit dalam media glukosa 16.7 mM + 0.625 – 5 mg/mL AP, menunjukkan respon sekresi insulin 1.4 – 4.7 kali lebih tinggi ( p = 0.002 – p < 0.001) dibanding dengan glukosa 16.7 mM saja. BRIN-BD11 yang diinkubasi selama 20 menit dalam media yang mengandung glukosa 1.11 mM + 0.625 – 10 mg/mL AP, menunjukkan respon sekresi insulin 1.3 – 2.7 kali lebih tinggi (p = 0.019 – p < 0.001) dibanding dengan glukosa 16.7 mM saja.
Pemberian 0.5 mM diazoxide dan 0.1 mM verapamil, dapat menghambat respon insulinotropik 2.5 mg/mL AP pada BRIN-BD11 sebesar 32% (p < 0.001) dan 31% ( p = 0.008). Di samping itu 0.1 mM verapamil menghambat sekresi insulin BRIN-BD11 akibat 25 meq KCL sebesar 64% ( p < 0.001). Dalam kondisi terdepolarisasi oleh 25 meq KCL, 0.625 dan 1.25 mg/mL AP masih dapat meningkatkan sekresi insulin BRIN-BD11 sebesar 14% ( p = 0.017) dan 34% ( p < 0.001).
AP bersifat insulinotropik atau insulin sekretagog yang kuat, yang meningkat seiring dengan peningkatan konsentrasi, dan bisa bekerja tanpa bergantung pada keberadaan glukosa, serta bekerja pada mekanisme sekresi insulin alur triggering pathway, baik K+ATP-dependent maupun - independent
Antidiabetic. Under the direction of BAMBANG KIRANADI, WASMEN MANALU, ADI WINARTO, and SLAMET SUYONO.
Studies of Andrographis paniculata (AP) had shown hypoglycaemic effect in Streptozotozin Diabetic Rats and Alloxan Diabetic Rabbits, and all of the studies suggested that AP affected extrapancreatic organs. There was no study the effect of AP to pancreatic β cells. The aim of this study is to learn the effect of AP to pancreatic β cells by measuring the insulin release from clonal glucose-responsive insulin secreting cells BRIN-BD11 during acute 20 and 60 minute-incubation (n=3-4).
One hour of incubation with 0.625-2.5 mg/mL AP, BRIN-BD11 evoked 1.7-3.73 fold (p = 0.003 – p <0.001) insulin secretory responses at 16.7 mM glucose. Interestingly the insulin response was elevated by 1.5 fold (p = 0.034) dan 2.3 fold (p = 0.001) at 1.25 mg/ mL and 2.5 mg/mL AP respectively, compared to that folowing administration of 100 μM glibenclamide. The insulinotropic response of BRIN-BD11 were abolished by 50.7%-79.5% (p = 0,001) at 5 and 10 mg/mL AP respectively, compared to 2.5 mg/mL AP. Twenty minutes incubation with 0.625-5 mg/mL AP, BRIN-BD11 also evoked 1.4 - 4.7 fold (p = 0.002 – p < 0.001) insulin secretory responses at 16.7mM glucose. These results showed that the insulinotropic effects of AP exhibited dose- and glucose-dependent pattern, and may suggest that high dose AP possesses a calcium channel blocking activity exerted primarily in a depolarizing condition. Twenty minutes incubation with 1.25 -10 mg/mL AP evoked 1.6 - 2.6 fold (p = 0.03 – p = 0.001) insulin secretory response at 1.11 mM glucosa. These results showed that the insulinotropic effects of AP exhibited dose-dependent and glucose-independent pattern.
Insulin secretory respons at 2.5 mg/mL AP was abolished by 32% (p < 0.001) and 31% (p = 0.008) when 0.5 mM Diazoxide and 0.1 mM Verapamil was administered, respectively. On the other side, 0.1 mM verapamil abolished insulin secretory response by 64% (p < 0,001) in 20 minute-incubation of BRIN-BD11 exerted primarily in a depolarizing conditon (25 meq KCl). In a depolarizing condition by KCl 25 meq, 0.625 and 1.25 mg/mL AP showed an increase of insulin respons by 14% (p = 0.017) and 34% (p < 0.01) respectively.
© Hak cipta milik Aris Wibudi, tahun 2006
Hak cipta dilindungi
Dilarang mengutip dan memperbanyak tanpa izin tertulis dari
Institut Pertanian Bogor, sebagian atau seluruhnya dalam
(
Andrographis paniculata
)
SEBAGAI ANTIDIABETES
ARIS WIBUDI
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar
Doktor pada
Departemen Biologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
NIM : G426010121
Disetujui
Komisi Pembimbing
Bambang Kiranadi M.Sc.Ph.D Prof.Dr.Ir. Wasmen Manalu Ketua Anggota
drh. Adi Winarto Ph.D Prof.dr.Slamet Suyono Sp.PD,KEMD Anggota Anggota
Diketahui
Ketua Program Studi Biologi Dekan Sekolah Pascasarjana
Dr.Ir. Dedi Duryadi Solihin, DEA Prof.Dr.Ir.Syafrida Manuwoto, M.Sc
segala karunia Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang
dipilih dalam penelitian yang dilaksanakan sejak bulan April 2005 ini ialah herbal
antidiabetik, dengan judul Mekanisme Kerja Sambiloto (Andrographis
paniculata) sebagai Antidiabetes.
Terima kasih penulis ucapkan kepada Bapak Bambang Kiranadi Ph.D,
Prof.Dr.Ir. Wasmen Manalu, drh. Adi Winarto Ph.D, dan Prof.dr. Slamet Suyono
Sp.PD-KEMD selaku pembimbing, serta Bapak Prof.Dr.dr.Andrè Herchuelz yang
telah memberikan sel lestari penghasil insulin BRIN-BD11, sebagai organ uji dan
pelatihan serta arahan dalam teknik penelitian, sdri Silmi Mariya SSi dan seluruh
staf laboratorium virologi yang tanpa lelah memberikan pelatihan khusus kultur
sel, dan Kepala Laboratorium Virologi, LPPM, PSSP, IPB Bogor yang
memberikan fasilitas laboratorium untuk pelaksanaan penelitian ini. Di samping
itu, terima kasih juga penulis sampaikan kepada Direktur Kesehatan TNI-AD dan
Kepala RSPAD Gatot Soebroto yang telah memberikan kesempatan yang sangat
berharga ini. Terima kasih juga penulis sampaikan kepada PT. Aventis Farma
Indonesia yang memberikan bahan aktif glibenklamid, dan PT. Dexa Medika yang
memberikan DMSO dan verapamil. Ungkapan terima kasih juga disampaikan
kepada ayah, ibu serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2006
sebagai anak sulung dari pasangan Asih Windrojo dan Ishwandari. Pendidikan
sarjana ditempuh di Fakultas Kedokteran Universitas Indonesia, lulus pada tahun
1980. Pada tahun 1986, penulis diterima di Program Studi Spesialis 1, pada
Program Pascasarjana UI bidang Ilmu Penyakit Dalam dan menamatkannya pada
tahun 1991. Kesempatan untuk melanjutkan ke program doktor pada program
studi Biologi, Institut Pertanian Bogor diperoleh pada tahun 2001, dengan biaya
sendiri.
Pada tahun 1981, penulis mengawali tugasnya sebagai dokter Batalyon
741 di Singaraja, Bali dan selanjutnya pada tahun 1983 dipindahtugaskan sebagai
dokter Batalyon 745 di Baucau, Timor Timur. Pada tahun 1985, penulis
dipindahtugaskan menjadi Wakil Komandan Detasemen Kesehatan 164 di Dili,
Timor Timur. Setelah menyelesaikan pendidikan spesialis, penulis ditugaskan
sebagai dokter spesialis penyakit dalam di RS.Ridwan Meuraksa, Jakarta sampai
tahun1998. Pada tahun 1998 penulis kembali dipindahtugaskan ke RSPAD Gatot
Soebroto. Sejak bulan Oktober tahun 2004 penulis ditugaskan sebagai dokter
pribadi Presiden RI. Di samping tugas pokok tersebut di atas, penulis sempat
ditugaskan sebagai Kepala Seksi Operasi Batalyon Kesehatan, Kontingen Garuda
XIV, Pasukan Penjaga Perdamaian PBB di Bosnia Herzegovina pada tahun 1995
DAFTAR TABEL... ii
DAFTAR GAMBAR... iii
DAFTAR LAMPIRAN... v
PENDAHULUAN Latar Belakang... 1
Tujuan dan Kegunaan... 7
TINJAUAN PUSTAKA ATP-Dependent Potassium Channel (K+ATP)………. 9
Kanal ion kalsium (Ca2+ channels)……… 13
Ultrastruktur granul insulin... 16
Fisiologi sekresi insulin... 18
BRIN-BD11... 27
Sambiloto (Andrographis paniculata)... 30
Enzyme-Linked Immunosorbent Assay (ELISA)... 35
BAHAN DAN METODE Tempat dan Waktu... 38
Bahan Penelitian... 38
Penyiapan Ekstraksi Sambiloto... 38
Penyiapan Berbagai Media... 39
Penyiapan BRIN-BD11... 45
Metode Penelitian... 49
HASIL DAN PEMBAHASAN Efek insulinotropik sambiloto pada BRIN-BD11... 54
Pengaruh sambiloto pada sekresi insulin fase cepat……..….. 58
Mekanisme kerja sambiloto sebagai insulin sekretagog…….. 63
SIMPULAN ... 78
DAFTAR PUSTAKA... 79
DAFTAR TABEL
Halaman
1 Sekresi insulin sebagai respons insulinotropik sambiloto pada BRIN-BD11 dalam media KRB-3 yang mengandung
glukosa 16.7 mM dan diinkubasi selama 60 dan 20 menit... 54
2 Sekresi insulin sebagai respons insulinotropik glibenklamid dan KCL 25 meq pada BRIN-BD11 dalam media KRB-3 yang mengandung glukosa 16.7 mM dan diinkubasi selama
60 dan 20menit... 55
3 Sekresi insulin sebagai respons insulinotropik sambiloto pada BRIN-BD11 dalam media KRB yang mengan
dung glukosa 1.11 mM dan diinkubasi selama 20 menit... 60
4 Inhibisi efek insulinotropik 2.5 mg/mL sambiloto pada BRIN-BD11 oleh diazoxide dan verapamil dalam media dengan kandungan glukosa 1.11 mM yang diinkubasi
selama 20 menit... 69
5 Inhibisi diazoxide dan verapamil pada sekresi insulin
BRIN-BD11 pada media yang mengandung glukosa 1.11 mM
dan KCL 25 meq... 70
6 Efek insulinotropik sambiloto pada BRIN-BD11 dalam
DAFTAR GAMBAR
Halaman
1 Ilustrasi pola sekresi insulin pada pulau Langerhans
pankreas yang diinkubasi dalam larutan glukosa 11.1 mM... 8
2 Ilustrasi ATP-dependent K+ channel... 10
3 Ilustrasi kompleks ATP-dependent K+ channel……….. 11
4 Aktivitas elektrik sel β pankreas………. 12
5 Aktivitas elektrik sel β pankreas pada pemberian gliburid dan diazoxide... 13
6 Ilustrasi kanal kalsium VDCC... 14
7 Ultrastruktur sel β pankreas tikus... 16
8 Ilustrasi pola sekresi insulin dan pool granul... 17
9 Ilustrasi protein SNARE, granul insulin dan VDCC... 18
10 Ilustrasi berbagai faktor yang dapat mempengaruhi sekresi insulin... 20
11 Skema tiga sumber pembentukan ATP... 21
12 Ilustrasi tahapan proses fisiologik sekresi insulin ……… 22
13 Skema fisiologi sekresi insulin………. 24
14 Peran Potassium-dependent channel (KV2.1) dalam mekanisme Glucose competence concept oleh GLP-1……… 26
15 BRIN-BD11 pada hari ke 0……… 29
16 BRIN-BD11 pada hari ke-3... 29
17 BRIN-BD11 pada hari ke-7... 30
18 Foto tanaman sambiloto... 31
19 Rumus bangun andrografolid... 32
Halaman
20 Ilustrasi tahapan proses yang terjadi pada metode direct
Sandwich ELISA………..… 36
21 Sekresi insulin sebagai respons insulinotropik berbagai
kondisi pada BRIN-BD11 dalam media KRB-3…………... 56
22 Sekresi insulin sebagai respons insulinotropik sambiloto pada BRIN-BD11 dalam media glukosa 16.7 mM dan
diinkubasi 20 menit... 59
23 Efek insulinotropik sambiloto pada BRIN-BD11 dalam
media glukosa 1.11 mM dan diinkubasi selama 20 menit……….. 61
24 Efek insulinotropik sambiloto pada BRIN-BD11dalam media glukosa 16.7 mM dan 1.11 mM dan diinkubasi selama
20 menit... 62
25 Grafik sekresi insulin BRIN-BD 11 selama inkubasi 20 menit
dalam media KRB-1 dengan pemberian sambiloto... 64
26 Grafik double reciprocal plot dari respons insulinotropik
sambiloto pada BRIN-BD11 selama inkubasi 20 menit……..…. 65
27 Inhibisi respons insulinotropik sambiloto pada BRIN-BD11 oleh diazoxide dan verapamil dalam media glukosa 1.11 mM
dan inkubasi 20 menit... 69
28 Sekresi insulin BRIN-BD11 pada berbagai kondisi dalam
media glukosa 1.11 mM... 71
29 Efek insulinotropik sambiloto pada BRIN-BD11 pada
kondisi terdepolarisasi oleh KCl 25 meq dalam media KRB-1
DAFTAR LAMPIRAN
Halaman
Latar Belakang
Satu dari empat pilar penatalaksanaan diabetes melitus (DM), khususnya
DM tipe-2 adalah terapi medikamentosa, termasuk terapi herbal. Obat antidiabetes
oral (OAD) termasuk herbal, sebaiknya tidak hanya diketahui manfaat dalam
kendali glikemiknya saja, tetapi sangat penting diketahui target organ serta
mekanisme kerja obat tersebut. Anjuran ini didasarkan pada kenyataan bahwa
tidak semua OAD bersifat hipoglikemik, hanya golongan insulin sekretagog saja
yang dikenal sebagai bahan yang bersifat hipoglikemik. Suatu bahan yang
bermanfaat sebagai antidiabetes haruslah bersifat paling tidak salah satu dari
mekanisme atau termasuk dalam salah satu kategori di bawah ini:
1. Insulin sekretagog, yaitu bersifat insulinotropik atau dapat memicu sekresi
insulin terutama fase cepat, seperti yang dimiliki oleh semua jenis
sulfonilurea dan glinid. Obat golongan ini terutama memperbaiki
hiperglikemia prandial, dan sesuai dengan sifatnya yang memperbaiki
sekresi insulin, maka golongan ini, terutama yang termasuk dalam masa
kerja menengah, potensial mencetuskan kejadian hipoglikemia.
2. Menekan produksi glukosa oleh hati (Hepatic Glucose Production) seperti
yang dimiliki oleh biguanid. Golongan ini tidak memperbaiki sekresi insulin,
tetapi lebih bersifat menghambat produksi glukosa hati, sehingga manfaat
yang terlihat adalah perbaikan profil glukosa darah puasa, dan tidak
potensial mencetuskan hipoglikemia. Dengan perbaikan glukosa darah puasa
tentunya akan diikuti perbaikan glukosa prandial, dengan asumsi bahwa
defek sekresi insulin fase cepat masih mampu mengatasi lonjakan beban
glukosa.
3. Menghambat enzim glukosidase α. Aktivitas obat golongan ini menghambat enzim yang memecah polisakarida menjadi di- dan mono-sakarida dalam
lumen usus, sehingga dapat memperlambat absorbsi glukosa dari saluran
cerna. Dengan demikian dapat mengurangi lonjakan kadar glukosa darah
prandial. Sudah tentu obat golongan ini tidak akan bermanfaat sama sekali
disakarida seperti glukosa, fruktosa ataupun sukrosa. Sampai saat ini baru
ada satu jenis OAD dalam golongan ini yaitu akarbose. Sebetulnya secara
alamiah, kandungan yang tinggi dari serat tidak larut dalam air di dalam
makanan juga mempunyai sifat yang sama dalam menghambat absorbsi
glukosa, tetapi tidak berhubungan dengan mekanisme kerja enzim
glukosidase α.
4. Insulin sensitizer. Golongan ini merupakan golongan OAD terbaru yang
dapat memperbaiki resistensi insulin, terutama di jaringan otot, lemak dan
juga di hati seperti yang dimiliki golongan tiazolidindion. Golongan ini tidak
secara langsung menurunkan gukosa darah seperti yang dimiliki oleh
sulfonilurea, tetapi melalui beberapa alur antara lain:
a. Menurunkan asam lemak bebas (Free Fatty Acid=FFA) dalam
sirkulasi darah, sehingga memperbaiki kinerja insulin pada organ
target.
b. Menurunkan berbagai sitokin inflamasi sekunder, terutama TNFα, akibat penurunan FFA dalam sirkulasi, yang juga berdampak pada
perbaikan kinerja insulin pada organ target, khususnya pada proses
autofosforilasi reseptor insulin. Dengan demikian terjadilah perbaikan
proses translokasi transporter glukosa isoform 4 (GLUT-4) yang
terganggu pada DM tipe-2.
c. Agonis PPAR γ yang dapat memperbaiki transkripsi GLUT-4 di
jaringan otot dan lemak, sehingga dapat memperbaiki gangguan
transport glukosa ke dalam sel yang terjadi pada DM tipe-2.
Semua hal tersebut di atas bersifat memperbaiki kerja insulin, baik di
jaringan lemak, otot dan hati serta pada sel β pankreas itu sendiri. Dengan demikian obat golongan ini bekerja tanpa meningkatkan sekresi insulin,
tetapi memperbaiki kinerja insulin pada organ target seperti otot, lemak dan
hati. Obat golongan ini tidak potensial mencetuskan hipoglikemia, tetapi
karena mekanisme kerjanya secara tidak langsung, maka efek terapetik
penurunan glukosa darah biasanya baru terlihat setelah sekitar 14 hari. Di
tiasolidindion dapat memperbaiki kapasitas kandungan granul insulin dalam
sel β pankreas, dan efek ini tidak terjadi pada pemberian sulfonilurea maupun metformin.
Sampai saat ini, golongan OAD terbanyak yang beredar di seluruh dunia
adalah golongan insulin sekretagog yang sangat bermanfaat dalam memperbaiki
defek sekresi insulin fase cepat pada DM tipe-2, seperti sulfonilurea turunan dari
sulfonamid. Sifat hipoglikemik dari senyawa ini ditemukan secara tidak sengaja
oleh Janbon dan kawan-kawan di Sekolah Kedokteran Montpelier, Perancis.
Pemberian sulafonamid pada pengobatan demam tifoid secara oral menimbulkan
kematian dan setelah diteliti lebih jauh kematian tersebut diakibatkan oleh
penurunan gula darah yang sangat cepat. Dari situ lahirlah generasi pertama obat
oral antidiabetes turunan sulfanilamid yakni tolbutamid, disusul oleh glibenklamid
dan sampai sekarang masih turunan sulfonilurea akan tetapi lebih canggih dalam
mekanisme penanganan penurunan gula darah seperti glimeperid. Sulfonilurea
bertahan sampai sekarang sejak diketemukannya pada tahun 1942 (Bryan &
Aguilar-Bryan, 2000). Sebelum diketemukannya antidiabetes turunan sulfonilurea,
pengobatan menggunakan herbal juga telah banyak dilakukan. Pengobatan herbal
banyak yang berkhasiat akan tetapi banyak juga yang hanya berupa mitologi, oleh
karena itu penelitian mekanisme kerja antidiabetes herbal perlu dilakukan.
Memahami mekanisme kerja antidiabetes memerlukan pengetahuan tentang
penggolongan OAD, tetapi sangat disayangkan pengetahuan penggolongan OAD
tersebut tidak banyak diketahui oleh tenaga medis, khususnya yang tidak
mendalami diabetes. Ketidaktahuan tentang golongan OAD atau herbal tersebut,
potensial menyebabkan kekurangtepatan dalam perencanaan terapi kombinasi.
Penggunaan kombinasi OAD dan/atau herbal yang mempunyai organ target yang
sama, khususnya golongan insulin sekretagog sudah tentu akan lebih cepat
menurunkan kadar glukosa darah, tetapi juga potensial terjadi hipoglikemia yang
berkepanjangan. Di samping itu, penggunaan golongan insulin sekretagog secara
bersamaan dalam penggunaan kombinasi OAD, tanpa disadari akan meningkatkan
glukosa darah yang optimal, tanpa harus terjadi peningkatan sekresi insulin secara
berlebihan, sehingga beban sel β pankreas dapat dikurangi. Agar terhindar dari pemberian dua atau lebih OAD dan/atau herbal yang memiliki mekanisme kerja
serta target organ yang sama, perlu diketahui betul mekanisme kerja dan organ
target dari berbagai OAD dan herbal tersebut.
Berbagai tanaman yang berkhasiat obat, khususnya sebagai antidiabetes
telah banyak dipergunakan orang dan diteliti efek hipoglikemiknya (Grover et al,
2002, Yaniv et al, 1987). Pada umumnya penelitian yang dilakukan bersifat
penelitian klinis dengan mengamati pengaruh berbagai bahan tradisional terhadap
penurunan kadar glukosa darah, baik pada tikus DM yang diberi Streptozotosin
(Gray & Flatt, 1998c, Gray & Flatt, 1998a, Babu & Stanely Mainzen Prince, 2004,
Bhattacharya et al, 1997), aloksan (Kar et al, 2003, Noor & Ashcroft, 1989, Noor
et al, 1989), tikus Wistar normal ataupun tikus diabetes Goto-Kakizaki (Hoa et al,
2004), kelinci DM yang diberi aloksan (Andayani YWR, 2002, Hasan, 1993)
ataupun langsung pada penderita DM tipe-2 (Shekhar et al, 2002). Ada pula
penelitian yang menilai pengaruh protektif biji klabet, terhadap kerusakan sel β pankreas akibat pemberian aloksan (Widowati et al, 2005). Minimnya informasi
mekanisme kerja herbal antidiabetes terlihat pada banyaknya kombinasi herbal
antidiabetes yang beredar di pasaran yang hanya mengemukakan kekuatan
kombinasi herbal tersebut sebagai agen hipoglikemik tanpa berpikir pengaruh
jangka panjangnya, seperti potensial hipoglikemia, ataupun beban sel β pankreas yang diperkirakan dapat menimbulkan gagal sekunder yang lebih dini.
Bratawali (Tinospora crispa) telah terbukti bersifat insulinotropik (Noor &
Ashcroft, 1989, Noor & Ashcroft, 1998, Noor et al, 1989, Kiranadi, 1990).
Kiranadi (1990) mendapatkan bahwa bratawali tidak menimbulkan aktivitas
elektrik pada sel β pankreas, sehingga diambil kesimpulan bahwa bratawali tidak bekerja pada kanal K+ATP, tetapi melalui alur yang lain (Kiranadi, 1990). Noor
(1998) pada penelitiannya secara in vitro dengan menggunakan sel lestari
penghasil insulin HIT-T15, memang mendapatkan bahwa selama inkubasi 60
menit, bratawali bersifat insulin sekretagog, tetapi tidak terlihat adanya aktivitas
kanal K+ATP, yang ditunjukkan oleh tidak adanya efluks 86Rb. Pada penelitian
bratawali. Dengan demikian sangat mungkin bratawali memang bersifat
meningkatkan efisiensi ion kalsium intraselular dalam proses sekresi insulin.
Penelitian klinis di Thailand juga menunjukkan kegagalan terapi bratawali pada
penderita DM tipe-2 yang sudah tidak respons terhadap obat antidiabetes oral
yang menolak suntik insulin, bahkan efek samping perburukan fungsi hati dalam
kurun waktu 6 bulan (Sangsuwan et al, 2004). Ini tidak serta merta menunjukkan
bahwa bratawali tidak bermanfaat sebagai antidiabetes, tetapi lebih tepat
dikatakan bahwa bratawali tidak bermanfaat bagi DM dalam fase gagal sekunder,
mengingat pemilihan sampel adalah kelompok gagal sekunder, yang tentunya
tidak akan terlihat respon perbaikan glukosa darah, bila herbal tersebut bekerja
sebagai insulin sekretagog, jadi tergantung pada ketepatan pemilihan sampelnya
(Darmansyah, 2002). Kegagalan serupa juga beberapa kali terjadi dalam
penelitian klinis herbal antidiabetes di Indonesia, seperti penggunaan serbuk
sambiloto dan pare (unpublished).
Penelitian di Departemen Nutrisi Manusia, Institut Pertanian, Peshawar,
Pakistan (Departmen of Human Nutrition, NWFP Agricultural University)
menunjukkan penurunan glukosa puasa, trigliserida, kolesterol total dan kolesterol
LDL pada penderita DM tipe-2 bila diberi 1, 3 dan 6 gr serbuk kayu manis
(Cinnamomum casia) selama 20 sampai 40 hari (Khan et al, 2003).
Jamur Agaricus campestris (Gray & Flatt, 1998c), dan Viscum album
(mistletoe) (Gray & Flatt, 1999) juga terbukti bersifat insulinotropik pada sel
lestari penghasil insulin BRIN-BD11, yang serupa dengan mekanisme kerja
sulfonilurea sehingga kedua herbal tersebut bisa digolongkan ke dalam insulin
sekretagog, karena mampu meningkatkan sekresi insulin dalam waktu 20 menit.
Pada penelitian ini sangat mungkin kedua jenis herbal tersebut bekerja pada kanal
K+ATP, karena efek insulinotropik yang terjadi terhambat oleh pemberian 0,5 mM
diazoxide sebagai antagonis kanal K+ATP.
Buncis juga sudah terbukti mempunyai pengaruh menurunkan glukosa darah
pada kelinci DM aloksan, tetapi belum diketahui secara pasti mekanisme kerjanya
(Andayani YWR, 2002). Perlu diperhatikan penggunaan aloksan sebagai zat
diabetogenik, karena ada laporan yang mengatakan bahwa aloksan bersifat
Sambiloto (Andrographis paniculata) sudah terbukti dapat menurunkan
glukosa darah, baik pada tikus DM yang diberi streptozotosin (Mafauzy et al,
2002, Niki et al, 2003, Nunemaker et al, 2004, Zhang & Tan, 2000) maupun pada
kelinci DM yang diberi Streptozotosin (Borhanuddin et al, 1994), akan tetapi pada
penelitian tersebut belum dipelajari lebih lanjut bagaimana mekanisme kerja dari
sambiloto tersebut dalam menurunkan glukosa darah.
Dari penelitian tersebut di atas, ada beberapa dugaan mekanisme kerja
sambiloto sebagai antidiabetes, antara lain:
1. Hambatan absorbsi glukosa dari usus. Kesimpulan ini didapat dari penelitian
yang mengamati pencegahan hiperglikemia pada kelinci nondiabetik yang
diberi beban glukosa 2 mg/kgBB secara oral dan diberi minum ekstrak air
sambiloto dengan dosis 10 mg/kgBB, tetapi pencegahan hiperglikemia tidak
terjadi pada kelinci yang diberi adrenalin (Borhanuddin et al, 1994).
2. Perbaikan metabolisme glukosa. Kesimpulan ini diambil dari penelitian
yang mendapatkan penurunan glukosa darah pada tikus diabetes yang diberi
STZ dengan pemberian ekstrak alkohol sambiloto 0,1 sampai 0,4 g/kgBB.
Penurunan glukosa darah puasa terlihat setelah hari ke 14 dan hal ini serupa
dengan pemberian metformin sebagai pembanding positif. Efek penurunan
glukosa darah tidak terlihat pada tikus normal. Pada penelitian ini juga tidak
menunjukkan perbedaan kadar insulin di antara tikus normal dan DM STZ
yang diberi sambiloto maupun metformin. Di samping itu terlihat penurunan
kadar trigliserida puasa sebesar 49,8% pada tikus yang diberi sambiloto,
dibanding 27,7% pada tikus yang diberi metformin (Zhang & Tan, 2000)
3. Perbaikan resistensi insulin. Kesimpulan ini didapat dari penelitian yang
mengamati penurunan glukosa darah pada tikus diabetik STZ dengan
pemberian sambiloto secara oral. Berbeda dengan penelitian Zhang (2000),
penelitian ini menunjukkan hambatan peningkatan glukosa darah pada test
toleransi glukosa intravena pada tikus normal yang diberi 1,5 mg/kgBB
sambiloto. Di samping itu terlihat peningkatan ambilan glukosa pada otot
dan peningkatan mRNA transporter glukosa isoform-4 (GLUT-4) (Niki et al,
2003).
Sampai saat ini belum ada penelitian pengaruh sambiloto pada sel β pankreas sebagai herbal antidiabetes. Dengan mengetahui lebih jauh pengaruh
sambiloto pada sel β pankreas, maka penggolongan sambiloto sebagai antidiabetes akan lebih jelas dan memudahkan para dokter apabila merencanakan terapi
kombinasi multifarmasi, termasuk kombinasi dengan herbal, tanpa menambah
beban sel β pankreas, sehingga dapat meminimalisasi kejadian hipoglikemia dan diharapkan dapat menunda terjadinya gagal sekunder yang terjadi secara dini.
Tujuan dan Kegunaan
Penelitian ini bertujuan untuk mempelajari:
1. Pengaruh insulinotropik sambiloto pada sel β pankreas, dan bila terbukti, penelitian dilanjutkan dengan
2. Mempelajari pengaruh sambiloto pada sekresi insulin fase akut, dan
bila terbukti, penelitian dilanjutkan dengan
3. Mekanisme kerja sambiloto sebagai insulin sekretagog.
Hasil penelitian ini diharapkan dapat memberi sumbangan informasi
pengetahuan kepada kalangan medis dan awam tentang cara penggunaan
sambiloto yang tepat dan aman sebagai herbal antidiabetes yang murah, mudah
didapat dan terjangkau oleh masyarakat luas, untuk mencapai kendali glukosa
TINJAUAN PUSTAKA
Diabetes melitus tipe-2, merupakan sindroma yang disebabkan oleh
resistensi insulin atau terganggunya sensitivitas insulin pada jaringan otot, lemak
dan hati, serta defek sekresi insulin, terutama defek sekresi insulin fase cepat oleh
sel β pankreas. Dari gangguan tersebut di atas, defek sekresi insulin merupakan penyebab terjadinya hiperglikemia yang berkepanjangan. Gangguan sensitivitas
insulin, atau yang dikenal sebagai resistensi insulin sudah terjadi 1 – 2 dekade
sebelum terjadinya hiperglikemia (DeFronzo et al, 1992, Gerich, 2003). Defek
sekresi insulin sel β pankreas yang dicetuskan oleh asupan glukosa ke dalam sel β pankreas, diduga kuat disebabkan oleh terganggunya fungsi mitokondria sebagai
sumber produksi ATP (Lowell & Shulman, 2005, Maassen et al, 2004)
Sekresi insulin fase lambat Sekresi insulin fase cepat
Waktu (jam)
Insulin
(n
g
/mL/
is
let
)
11.1 mM glukosa
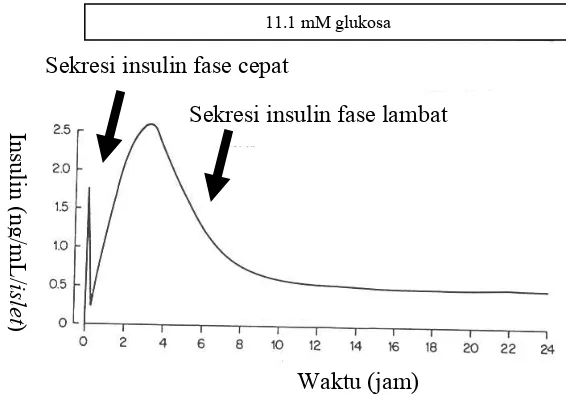
Gambar 1 Ilustrasi pola sekresi insulin pada pulau Langerhans pankreas yang
diinkubasi dalam larutan glukosa 11 mM (Grodsky 2000).
Pada penelitian in vitro, sel β pankreas normal yang diinkubasi dalam media yang mengandung glukosa dengan konsentrasi 11 mM selama 24 jam secara terus
menerus, menunjukkan pola sekresi insulin bifasik (gambar 1), yaitu diawali
dengan sekresi fase cepat yang terjadi pada 5-10 menit pertama setelah terpapar
glukosa dengan konsentrasi 11 mM, yang selanjutnya diikuti oleh sekresi fase
penurunan sekresi insulin hingga mencapai sekresi minimal, yang dikenal sebagai
sekresi basal (Grodsky, 1989, Rorsman et al., 2000, Grodsky, 2000).
Fenomena ini sangat erat hubungannya dengan interaksi yang sangat kompleks
dari beberapa komponen sel, antara lain:
1. Kompleks ATP-dependent potassium channel (K+ATP), yang berperan dalam
proses depolarisasi membran sel β pankreas secara fisiologis (Aguilar-Bryan & Bryan, 1999).
2. Kanal ion kalsium (Ca2+channel), khususnya VDCC (Voltage Dependent
Calcium Channels) tipe-L, yang berperan dalam proses influks ion kalsium
ke dalam sel β pankreas, sebagai pencetus sekresi insulin, (Nunemaker et al, 2004, Schulla et al, 2003, Garcia-Barrado et al, 1996).
3. Ultra-struktur granul insulin yang menggambarkan distribusi granul insulin
di dalam sitosol, yang berperan dalam terjadinya sekresi insulin dengan pola
bifasik (Daniel et al, 1999, Rorsman & Renstrom, 2003).
ATP-Dependent Potassium Channel (K+ATP)
ATP-Dependent Potassium Channel (K+ATP), merupakan alat yang sangat
penting dalam proses sekresi insulin, karena merupakan penghubung utama antara
proses metabolik dan sekresi insulin, melalui aktivitas elektrik membran, atau
terjadinya depolarisasi membran sel β pankreas (Bryan & Aguilar-Bryan, 1997). Peran K+ATP ini sangat penting dalam proses sekresi insulin, dan bisa dianggap
sebagai inisiator fisiologis dalam rangkaian proses sekresi atau eksositosis granul
insulin, karena proses fisiologis sekresi insulin yang dicetuskan oleh glukosa
selalu diawali inhibisi kanal K+ATP ini. Besarnya peran K+ATP ini juga terlihat dari
begitu besarnya jumlah kanal K+ATP pada sel β pankreas, yaitu sekitar 103 sampai
104 dalam satu sel. Untuk dapat menjalankan fungsi tersebut di atas, K+ATPterletak
pada daerah granul insulin (Geng et al, 2003), bahkan K+ATP sebagai sensor ATP
terletak dalam satu tempat dengan kanal ion kalsium (VDCC), sensor cAMP dan
Membran plasma
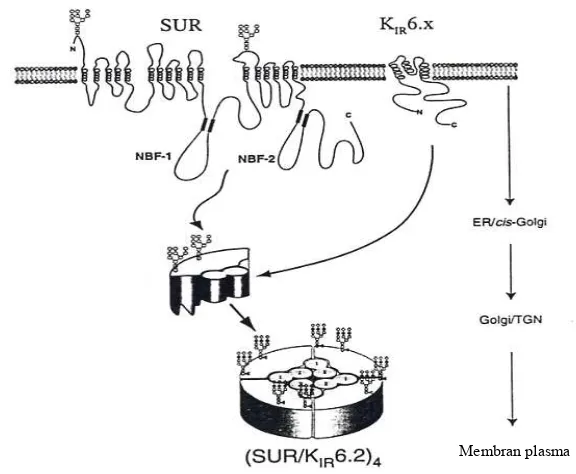
Gambar 2 Ilustrasi ATP-dependent K+ channel (K+ATP)(Bryan & Aguilar-Bryan, 2000).
K+ATP adalah sebuah kompleks protein berbentuk tetramer dari 4 unit, di
mana masing masing unit terdiri atas 2 subunit, yaitu reseptor sulfonilurea
(SUR-X), sebuah protein yang termasuk dalam superfamili ATP-binding cassette (ABC)
dan kanal ion kalium KIR6.x (Potassium inward rectifier) (Aguilar-Bryan et al,
1995, Aguilar-Bryan & Bryan, 1999, Aguilar-Bryan et al, 2001, Aguilar-Bryan et
al, 1998) (gambar 2). Subunit SUR-X mempunyai isoform SUR1 dan SUR2 yang
dibedakan dari afinitasnya terhadap sulfonilurea, sedangkan SUR2A dan SUR2B
dibedakan dari afinitasnya terhadap diazoxide (Aguilar-Bryan & Bryan, 1999,
Babenko et al, 1998, Inagaki et al, 1995, Bryan & Aguilar-Bryan, 2000). K+ATP
ini tidak hanya terdapat pada sel β pankreas saja, tetapi juga tersebar di berbagai jenis sel, dengan perbedaan komponen SUR, termasuk di sel α pankreas dan berfungsi sebagai regulator sekresi glukagon (Gromada et al, 2004).
K+ATP dengan komponen SUR1 dan KIR6.2, mempunyai afinitas tinggi
terhadap sulfonilurea, terutama diketemukan pada sel β pankreas. K+ATP dengan
SUR2A dan KIR6.2, mempunyai afinitas lebih rendah terhadap sulfonilurea,
SUR2B dan KIR6.1 atau KIR6.2 banyak diketemukan di jaringan otot polos
(Babenko et al, 1998, Aguilar-Bryan et al, 2001, Bryan & Aguilar-Bryan, 2000).
Reseptor ATP terletak pada subunit KIR6.2,sedangkan reseptor sulfonilurea
dan diazoxide terletak pada subunit SUR-1 (gambar 3). Dalam kondisi istirahat,
kanal K+ATP pada sel β pankreas selalu dalam keadaan terbuka, yang
memungkinkan ion kalium keluar menuju ekstraselular untuk mempertahankan
konsentrasi kalium intraselular sekitar 130 mM dan konsentrasi ekstraselular 4 – 5
mM. Berbeda dengan sel otot, khususnya otot jantung, K+ATP dengan komponen
SUR2A dan KIR6.2 selalu dalam keadaan tertutup, dan terbuka bila dalam kondisi
iskemia.
Gambar 3 Ilustrasi kompleks ATP-dependent potassium channel (K+ATP)
(MacDonald & Wheeler, 2003)).
glibenklamid glibenklamid
Dalam keadaan istirahat, atau tanpa adanya peningkatan glukosa, pergeseran
ion kalium menuju kompartemen ekstraselular akan menimbulkan potensial
membran (resting membrane potential) sekitar -70 sampai -60 mV. Bila kadar
glukosa dalam media inkubasi ditingkatkan sampai sekitar 7 mM, maka sudah
akan terlihat peningkatan tegangan listrik membran atau sudah mulai terjadi
depolarisasi, tetapi belum mencapai ambang untuk mencetuskan aktivitas elektrik
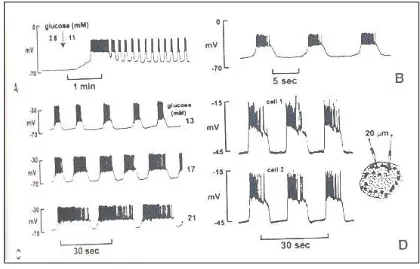
membran. Aktivitas elektrik sel β pankreas baru terlihat bila glukosa ditingkatkan lebih tinggi sampai konsentrasi 11 mM, di mana terjadi depolarisasi yang lebih
yaitu sekitar –50 mV. Depolarisasi membran ini terjadi karena terhentinya
pergeseran ion kalium dari intra-selular menuju ektra-selular, akibat tertutupnya
kanal K+ATP (Mears & Atwater, 2000).
Gambar 4 Aktivitas elektrik sel β pakreas. (Mears & Atwater, 2000)
Peningkatan rasio ATP/ADP akibat metabolisme glukosa akan
menyebabkan terjadinya ikatan antara ATP dengan reseptornya pada subunit
KIR6.2 dan terjadilah inhibisi atau penutupan kanal K+ATP. Inhibisi K+ATP ini
menyebabkan depolarisasi atau terjadinya perubahan potensial membran menjadi
sekitar -30 mV sampai -40 mV yang berdampak pada terbukanya kanal ion
kalsium VDCC (gambar 4). Proses yang sama juga bisa terjadi bila berbagai
golongan sulfonilurea berikatan dengan reseptornya pada subunit SUR-1.
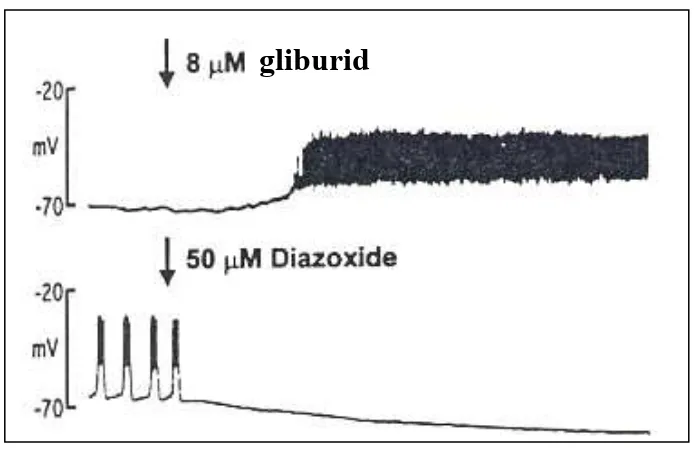
Sebaliknya akan terjadi aktivasi kanal K+ATP bila diazoxide berikatan dengan
reseptornya pada subunit SUR-1 yang mengakibatkan kanal K+ATP tetap terbuka,
sehingga tidak terjadi depolarisasi membran, yang selanjutnya tidak terjadi
aktivitas elektrik membran, dengan demikian tidak terjadi proses sekresi insulin,
gliburid
Gambar 5 Aktivitas elektrik sel β pankreas pada pemberian sulfonilurea (gliburid) dan diazoxide (Mears & Atwater, 2000)
Kanal ion kalsium (Ca2+ channels)
Ion kalsium sebagai intracellular (2nd) messenger, sangat vital dalam
berbagai fungsi sel, termasuk sekresi insulin oleh sel β pankreas. Untuk menjamin kestabilan konsentrasi ion kalsium intraselular, diperlukan kanal ion kalsium
untuk masuk ke dalam sel, dan transporter ataupun penukar ion kalsium untuk
membawa ion kalsium keluar dari sitosol ke kompartemen ekstraselular
(Belkacemi et al, 2005). Ion kalsium masuk ke dalam sel melalui 3 pintu, yaitu:
1. VDCC, Voltage-Dependent Calcium Channel.
2. Transient Receptor Potential (TRP)-related Ca2+ channel, dan
3. SOC, Store-operated Ca2+ channel.
Sedangkan untuk membawa ion kalsium keluar dari sitosol diperlukan bantuan:
1. PMCA (Plasma membrane Ca2+-ATPase), Kalsium-ATPase membran
plasma
VDCC (Voltage dependent calcium channels).
VDCC merupakan kanal influks kalsium yang paling banyak dipelajari, dan
mempunyai peran sangat penting dari berbagai sel dengan berbagai fungsi,
termasuk fungsi sekresi insulin sel β pankreas (Nunemaker et al, 2004).
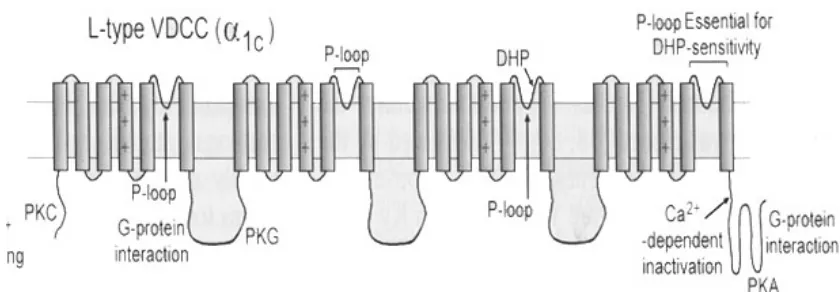
Gambar 6 Ilustrasi kanal kalsium yang bergantung tegangan lsitrik membran
tipe-L (VDCC=voltage-dependent calcium channel; DHP=letak reseptor
dihidropiridin; +++ = voltage-sensor) (MacDonald & Wheeler, 2003))
Sampai saat ini, berdasarkan kekuatan arus listrik yang diperlukan untuk
aktivasi kanal kalsium tersebut, dikenal 3 subfamili (Catterall et al, 2003), yaitu
antara lain:
1. L-type high voltage-activated (HVA) Ca2+ channel, atau VDCC tipe-L, yang
untuk aktivasinya diperlukan depolarisasi kuat, dan aktivasinya cukup lama,
serta dapat dihambat oleh antagonis Tipe-L seperti dihidropiridin,
fenilalkilamin dan benzothiazepine. Tipe-L ini terdiri atas CaV1.1, 1.2, 1.3
dan 1.4, banyak terdapat di jaringan otot dalam fungsi kontraksi dan sel
endokrin dalam fungsi sekresi hormon. Tipe-L, khususnya CaV1.2 inilah
yang sangat berperan pada proses sekresi insulin fase cepat (Schulla et al,
2003). Kanal kalsium tipe ini akan terbuka atau teraktivasi bila ada
peningkatan tegangan listrik membran (depolarisasi), hal ini dimungkinkan
karena VDCC tipe-L mempunyai sensor tegangan listrik (voltage-sensor)
ini tidak hanya terjadi akibat penutupan kanal K+ATP semata, tetapi bisa juga
dicetuskan oleh kondisi lain, seperti asam amino L-arginina atau kondisi
artifisial dengan menambahkan 25 meq kalium ke dalam media inkubasi.
Asam amino L-arginina yang bermuatan positif dapat menembus membran
sel, sekaligus menyebabkan terjadinya depolarisasi yang cukup kuat untuk
membuka VDCC tipe-L ini. Penambahan 25 meq KCl ke dalam media
inkubasi dapat mengaktivasi VDCC tipe-L karena perubahan konsentrasi ion
kalium ekstraselular akan menyebabkan terjadinya depolarisasi membran
sampai mencapai tegangan listrik sekitar sampai -30 mV, yang mampu
membuka hampir semua VDCC tipe-L. Perhitungan ini didapat dari
persamaan Nernst: E= -58 log [K]o/[K]i. (E=perbedaan tegangan) (Hille,
1984)
2. Non-L-type HVA channel, terdiri atas 3 subfamili, CaV2.1 (tipe-P/Q), CaV2.2
(tipe-N), dan CaV2.3 (Tipe-R), yang untuk aktivasinya juga diperlukan
depolarisasi yang kuat, tetapi tidak terhambat oleh antagonis tipe-L,
terutama terdapat pada jaringan syaraf atau neuron dalam proses
neurotransmisi. CaV2.3 sangat berperan pada proses sekresi insulin fase
lambat, khususnya pada penambahan granul insulin pada posisi RRP (Jing et
al, 2005).
3. Low voltage-activated (LVA) T-type Ca2+ channel (Tipe T), terdiri atas
CaV3.1, 3.2 dan 3.3 yang untuk aktivasinya diperlukan depolarisasi lemah,
dan aktivasinya hanya sesaat saja, serta tidak terhambat oleh antagonis
tipe-L dan Tipe-N, P/Q serta R. Walaupun belum jelas perannya dalam sekresi
insulin, Tipe-T inipun juga terdapat pada sel β pankreas (Zhuang et al, 2000)
Sesuai dengan fungsinya sebagai komponen yang berperan dalam sekresi insulin,
VDCC tipe-L ini berkedudukan sangat berdekatan atau berdampingan dengan
granul insulin yang sudah dalam posisi docked (Eliasson et al, 1996). Jumlah
insulin, khususnya sekresi fase cepat (Schulla et al, 2003), sedangkan fase ke dua
atau fase lambat dipengaruhi oleh keberadaan CaV2.3 (Jing et al, 2005).
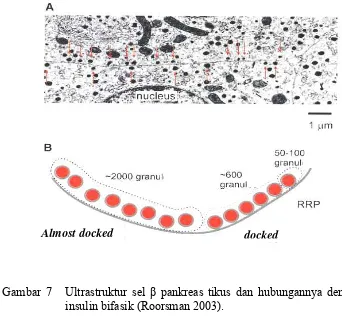
Ultrastruktur granul insulin.
Di dalam sitosol sel β pankreas mencit, tersebar sekitar 9.000 – 10.000 granul insulin. Ditinjau dari jarak antara granul dengan membran sel, posisi granul
insulin yang sudah dekat dengan membran sel, dapat dikelompokkan ke dalam 2
posisi, yaitu granul cadangan dan granul yang siap untuk disekresikan (gambar 7).
Granul insulin cadangan berada dalam posisi hampir menempel pada membran sel
(almost docked), berjumlah sekitar 2000 granul, terletak pada jarak kurang dari
0,2 μm dari membran sel, sedangkan granul yang siap disekresikan berada dalam posisi sudah menempel pada membran sel (docked) berjumlah sekitar 650 granul.
[image:30.595.111.453.408.734.2]Almost docked docked
Granul insulin dalam posisi sudah menempel pada membran sel (docked) ini
dikelompokkan lagi ke dalam 2 bagian (Bratanova-Tochkova et al, 2002,
Olofsson et al, 2002, Rorsman & Renstrom, 2003), yaitu:
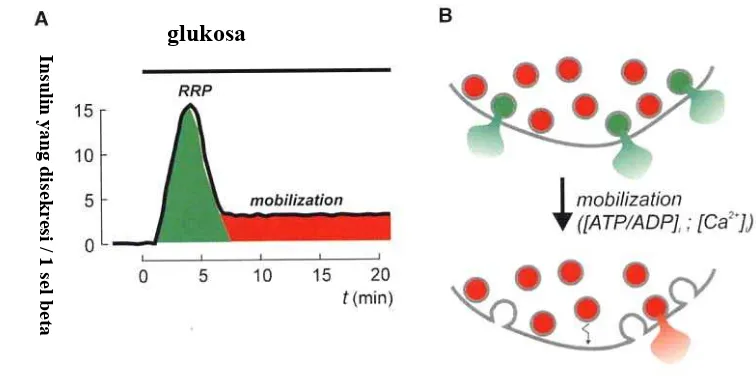
1. Readily Release Pool (RRP), berjumlah sekitar 50 granul, adalah posisi
granul insulin yang sudah menempel atau lebih tepat dikatakan terkait pada
membran sel, yang betul-betul siap untuk disekresikan dan kelompok RRP
inilah yang bertanggung jawab terjadinya sekresi insulin fase cepat (Barg et
al, 2002) (gambar 8).
Insulin
y
a
ng disekresi / 1
sel
beta
[image:31.595.127.505.268.458.2]glukosa
Gambar 8 Ilustrasi pola sekresi insulin dan pool granul (Rorsman 2003).
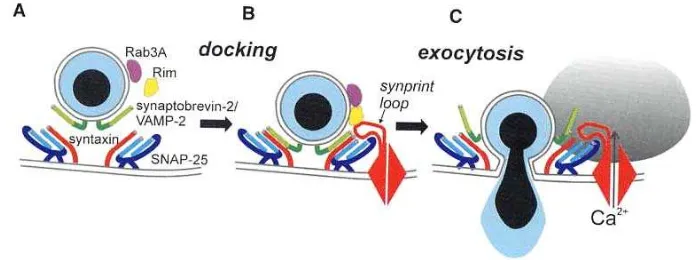
Granul insulin dalam posisi RRP ini terkait pada membran sel akibat
bergabungnya 4 protein SNARE (gambar 9), yang membentuk sebuah
kompleks protein, yaitu:
a. Synaptobrevin-2/VAMP-2 (berada pada dinding granul), dengan
b. Syntaxin, SNAP-25 dan Synaptotagmin (berada pada membran sel)
Kompleks SNARE ini sangat berperan, baik dalam proses penggabungan
granul insulin dengan membran sel maupun terjaminnya influks ion kalsium
(Ca2+) ke dalam suatu area yang sangat dekat dengan granul insulin yang
siap disekresikan. Fungsi ini bisa terlaksana karena Syntaxin, SNAP-25 dan
kalsium VDCC tipe-L yang berfungsi sebagai pintu gerbang masuknya Ca2+
ke dalam sitosol (gambar 9) (Daniel et al, 1999). Dari berbagai penelitian,
ditunjukkan bahwa gangguan sekresi insulin fase cepat inilah yang
merupakan defek awal pada DM tipe-2 (Fukushima et al, 2004a, Fukushima
[image:32.595.152.500.223.353.2]et al, 2004b, Hosker et al, 1989, Nesher et al, 1987).
Gambar 9 Ilustrasi protein SNARE, granul insulin dan VDCC tipe-L dalam
posisi docked, dan proses eksositosis insulin (Daniel et al, 1999)
2. Sekitar 600 granul akan bertanggung jawab terhadap terjadinya sekresi
insulin fase lambat selama sekitar 2 jam, dengan kecepatan sekresi sekitar 5
granul tiap menit (Bratanova-Tochkova et al, 2002).
Fisiologi Sekresi Insulin
Untuk mempelajari mekanisme kerja obat atau herbal yang bersifat
insulinotropik atau insulin sekretagog, diperlukan pengenalan fisiologi sekresi
insulin secara lebih mendalam. Regulasi sekresi insulin dipengaruhi oleh berbagai
faktor yang dapat dikelompokkan ke dalam tiga kategori (Masharani et al, 2004,
1. Stimulan sekresi insulin secara langsung (direct stimulant insulin release),
seperti glukosa, manosa, asam amino leusin, arginina, stimulasi vagal, dan
obat obat golongan sekretagog insulin sulfonilurea dan glinid, yang dapat
mencetuskan rangkaian proses sehingga terjadi sekresi insulin secara
langsung karena dapat mencetuskan terjadinya depolarisasi membran secara
langsung, baik dengan atau tanpa melibatkan K+ATP (Doyle & Egan, 2003).
2. Penguat sekresi insulin (amplifiers of glucose-induced insulin release),
adalah berbagai zat yang dapat meningkatkan sekresi insulin yang telah
diawali oleh glukosa, jadi tanpa glukosa bahan dalam golongan ini tidak bisa
mencetuskan sekresi insulin. Adapun bahan-bahan yang tergolong dalam
kelompok ini adalah sebagai berikut:
a. Hormon enterik seperti Glucagon-like peptide-1 (GLP-1), Gastric
Inhibitory Peptide (GIP), Cholesistokinin, Sekretin dan Gastrin
b. Neural amplifier : stimulasi adrenergik β dan kolinergik c. Asam amino arginina.
3. Penghambat sekresi insulin (inhibitors of insulin release) (Sieg et al, 2004)
a. neural : pengaruh adrenergik α dari katekolamin b. humoral : somatostatin
c. obat-obat: diazoxide, phenytoin, vinblastin, colchicine.
Sampai sebelum tahun 2004, mekanisme sekresi insulin oleh glukosa secara
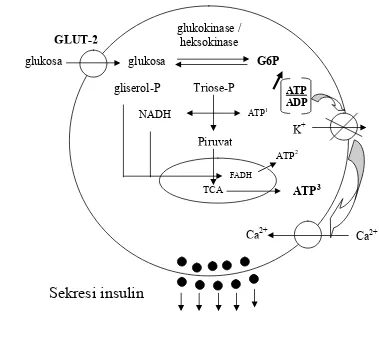
fisiologis dapat digambarkan sebagai berikut. Setelah glukosa masuk ke dalam sel β pankreas melalui transporter glukosa isoform-2 (GLUT-2), oleh enzim glukokinase / heksokinase, akan diubah menjadi glukosa-6 fosfat (G6P) dan
selanjutnya terjadilah proses pembentukan ATP. Alam memberikan kemampuan
sel β pankreas dengan sistem transport glukosa yang sangat baik. Sistem transport ini diperankan oleh transporter glukosa isoform-2 (GLUT–2) yang tidak
bergantung pada keberadaan insulin, dan selalu siap dipermukaan membran sel.
Transporter ini aktif dengan Km 5.5 mM/L, dan glukokinase juga mempunyai Km
dipergunakan untuk menangani peningkatan glukosa dalam sirkulasi dalam
konsentrasi yang tinggi dan perubahan yang cepat seperti yang terjadi pada
keadaan sehabis makan, atau kondisi prandial. Di samping glukokinase, sel juga
mempunyai kelengkapan enzim Heksokinase dengan nilai Km sebesar 0.01 mM/L.
Kenyataan ini menunjukkan bahwa fungsi heksokinase lebih ke arah pemeliharaan
sel dalam menjaga energi β sel (gambar 11)
SUR
AC
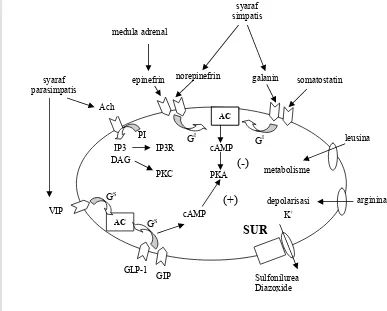
epinefrin norepinefrin syaraf
parasimpatis
AC
galanin somatostatin
GLP-1
leusina
VIP
Ach
PI
IP3 IP3R
DAG
PKC
cAMP
cAMP PKA
GS GS
GI GI
(-)
(+)
Sulfonilurea Diazoxide
K+
GIP
arginina metabolisme
depolarisasi medula adrenal
[image:34.595.100.487.248.559.2]syaraf simpatis
Gambar 10 Ilustrasi berbagai faktor yang dapat mempengaruhi sekresi insulin,
baik stimulator maupun inhibitor (Weir et al, 2000).
Rangkaian reaksi proses sekresi insulin oleh glukosa ini dapat dikelompokkan
dalam beberapa tahap (Newgard & Johnson, 2000):
1. Tahap 1: tahap peningkatan rasio ATP/ADP, yang dapat terjadi melalui 3
a. Produksi dari glikolisis dari triose-fosfat menjadi piruvat (sumber ATP
dari alur ini tidak cukup untuk terjadinya inhibisi kanal K+ATP)
b. Proses perubahan reduced nicotinamide dinucleotide phosphate
(NADH) dalam mitokondria, ini merupakan sumber ATP terbesar
dalam rangkaian proses sekresi insulin. Hal ini diperkuat dengan
penelitian yang mendapatkan adanya inhibisi sekresi insulin pada
penggunaan asam bongkrek sebagai inhibitorATP/ADP translokase di
dalam mitokondria (Kiranadi et al, 1991)
[image:35.595.107.486.304.642.2]c. Oksidasi piruvat dalam mitokondria.
Gambar 11 Skema tiga sumber pembentukan ATP yang berasal dari alur
metabolisme glukosa dalam rangkaian regulasi sekresi insulin yang
difasilitasi oleh glukosa pada sel β pankreas (Newgard & Johnson, 2000)
glukosa
GLUT-2
glukosa
glukokinase / heksokinase
G6P
Triose-P gliserol-P
Piruvat
TCA
NADH
ATP ADP
ATP1
ATP2
ATP3
FADH
Ca2+ Ca2+
K+
2. Tahap 2: Inhibisi K+ATP. Peningkatan rasio ATP/ADP akan diikuti terikatnya
ATP dengan reseptornya pada subunit KIR6.2 yang mengakibatkan inhibisi
atau penutupan kanal K+ATP.
3. Tahap 3: Penutupan kanal K+ATP akan meningkatkan terhentinya pergeseran
ion kalium dari intra menuju ekstraselular. Kondisi ini menyebabkan
terjadinya depolarisasi membran dan tegangan listrik membran sel akan
meningkat dari sekitar -70 mV menjadi sekitar -40 mV, sehingga melampaui
ambang aktivitas elektrik membran yaitu sekitar – 50 mV.
ATP/ADP
K
+ATP(-)
SU (-)
glukosa
(+)
VDCC
sekresi
insulin
Depolarisasimembran
repolarisasi
Ca2+
(+)
(+) (+)
(-)
[image:36.595.99.462.287.663.2]K
VGambar 12 Ilustrasi tahapan proses fisiologik sekresi insulin oleh sel β pankreas. Terlihat terjadinya aktivasi VDCC dan KV akibat depolarisasi secara
bersamaan. Aktivasi KV terjadi sedikit lebih lambat dibanding
4. Tahap 4: Aktivasi VDCC tipe-L. Depolarisasi membran sel yang
meningkatkan potensial membran sekitar -40 mV akan diikuti dengan
aktivasi atau terbukanya kanal kalsium VDCC tipe-L yang memungkinkan
masuknya ion kalsium (Ca2+) ke dalam sitosol. Bersamaan dengan aktivasi
VDCC tipe-L, depolarisasi juga mengakibatkan aktivasi atau terbukanya
voltage dependent potassium channels (KV), tetapi proses ini terjadi sedikit
lebih lambat dibanding dengan aktivasi VDCC. Aktivasi KV ini akan
memungkinkan masuknya kembali ion kalium ke dalam sitosol, sehingga
terjadi repolarisasi kembali tegangan listrik membran sel (gambar 12).
5. Perubahan konsentrasi ion kalsium intraselular [Ca2+]i selanjutnya
mencetuskan proses eksositosis atau sekresi insulin dari sekitar 50 granul
insulin yang sudah dalam posisi RRP dalam waktu yang bersamaan dan
terjadilah sekresi insulin fase cepat.
6. Posisi RRP yang sudah mengalami eksositosis akan digantikan oleh granul
cadangan, dengan kecepatan eksositosis sekitar 5 granul tiap menit. Proses
pergeseran granul insulin ini mutlak memerlukan energi yang berasal dari
metabolisme glukosa, tanpa metabolisme glukosa tidak terjadi pengisian
posisi RRP yang sudah kosong tersebut yang berdampak pada tidak
terjadinya sekresi insulin fase lambat.
Henquin (2004) menyempurnakan teori tersebut di atas dan ada beberapa
perubahan yang mendasar tentang sekresi insulin. Sekresi insulin terjadi karena
adanya suatu kompleks alur yang dapat dikelompokkan ke dalam dua alur pokok,
yaitu triggering dan amplifying pathway (gambar13). Triggering pathway ditandai
dengan terbukanya kanal kalsium VDCC setelah membran sel mengalami
depolarisasi, dan secara fisiologis, sekresi insulin baru bisa terjadi bila diperkuat
oleh amplifying pathway. Triggering pathway yang didahului penutupan kanal
K+ATP, disebut sebagai K+ATP-dependent triggering pathway. Dalam berbagai
penelitian terbukti bahwa sekresi insulin juga dapat dicetuskan oleh berbagai
faktor eksternal, seperti asam amino tertentu, berbagai zat yang bekerja sebagai
insulin sekretagog, serta aktivitas yang menyebabkan depolarisasi membran sel,
langsung (Herchuelz et al, 1984, Weinhaus et al, 1997). Karena zat tersebut dapat
menyebabkan depolarisasi membran tanpa melalui inhibisi kanal K+ATP, maka alur
tersebut dikenal sebagai K+ATP-independent triggering pathway (Henquin, 2004,
Bratanova-Tochkova et al, 2002).
SUR 1 Kir 6.2 SUR 1 Kir 6.2 glukosa metabolisme 1
nutrien
K
+
ATP ADP messenger lain Triggering pathwayCa
2+Ca
2+ 3-+
amplifying pathway amplifying pathwaysekresi insulin
2 4 4arginin
6?
?
?
α2-adr GLP-1+
+
-5
+
-Henquin, Diabetes (53) Suppl 3; 2004
[image:38.595.109.516.200.502.2]VGCC
Gambar 13 Skema fisiologi sekresi insulin serta lokasi potensial tempat bekerjanya berbagai obat insulin sekretagog pada sel β pankreas (Henquin, 2004).
Glukosa sebagai stimulan langsung sekresi insulin, tidak hanya berpengaruh
baik pada triggering pathway saja, karena secara fisiologis triggering pathway
saja, tidak akan cukup untuk mencetuskan sekresi insulin, tetapi juga bekerja pada
amplifying pathway melalui alur metabolisme yang menghasilkan penambahan
peningkatan rasio ATP/ADP, dan pengaktifan second (2nd) messenger.
Henquin (2004) menjelaskan sangat rinci tentang adanya 6 lokasi potensial
tempat bekerjanya berbagai obat golongan insulin sekretagog (gambar 13).
golongan insulin sekretagog akan menjadi sangat jelas, dan dapat dipakai untuk
mengidentifikasi salah satu dari 6 lokasi tempat bekerja obat tersebut.
Lokasi-1 adalah lokasi yang dapat menstimulasi metabolisme sel β pankreas melalui aktivasi glukokinase, inhibisi glukosa-6-fosfatase, sumber energi alternatif
dan inhibisi Na+/Ca2+ exchanger di mitokondria. Lokasi-2 adalah lokasi yang
dapat meningkatkan kalsium sitosol [Ca2+]i dengan cara inhibisi kanal K+ATP, baik
melalui interaksi dengan subunit SUR-1 ataupun KIR6.2. Lokasi-3 adalah lokasi
yang juga dapat meningkatkan kalsium sitosol [Ca2+]I, tetapi tidak melalui kanal
K+ATP melainkan dengan inhibisi kanal kalium lainnya, aktivasi kanal kalsium,
bekerja pada kanal ion lain dan inhibisi proses yang menurunkan ion kalsium
sitosol [Ca2+]i. Lokasi-4 merupakan lokasi terjadinya amplifikasi amplifying
pathway melalui aktivasi dari proses amplifikasi yang dimediasi oleh nutrien
selain glukosa, inhibisi AMP-kinase, inhibisi 11β-hidroksisteroid dehidrogenase tipe-1, sensitisasi ion kalsium, inhibisi degradasi cAMP dan aktivasi PKC
pathway. Lokasi-5 merupakan lokasi yang berhubungan dengan reseptor membran
sel, seperti antagonis reseptor inhibitorik ataupun agonis reseptor stimulatorik.
Lokasi-6 merupakan lokasi yang berhubungan dengan reseptor pada inti sel.
Henquin (2004) juga sangat jelas memperlihatkan mekanisme kerja
Glucagon like peptide-1 (GLP-1) yang bersifat penguat sekresi insulin yang
difasilitasi oleh glukosa. GLP-1 bersifat glucose dependent, karena tanpa glukosa
tidak akan terjadi inisiasi triggering pathway. Terlihat jelas GLP-1 dapat
meningkatkan efisiensi [Ca2+]i yang dicetuskan oleh triggering pathway pada
lokasi 3 dan meningkatkan efisiensi amplifying pathway pada lokasi 4. Hal ini
memperkuat teori sebelumnya yang mengemukakan bahwa GLP-1 bekerja dengan
prinsip mekanisme cross talk pada proses sekresi insulin yaitu dengan
memperkuat inhibisi kanal K+ATP dan aktivasi VDCC oleh protein kinase A (PKA)
yang terbentuk setelah GLP-1 berikatan dengan reseptornya di membran sel β pankreas. Inhibisi kanal K+ATP dan aktivasi VDCC oleh PKA tidak secara
langsung, tetapi memperkuat alur yang difasilitasi oleh glukosa sehingga disebut
pula sebagai glucose competenceconcept. Teori ini mengemukakan bahwa GLP-1
pathway (Habener, 2000). Henquin (2004) memperbaiki teori tersebut di atas,
[image:40.595.132.440.172.474.2]dengan memperjelas mekanisme kerja GLP-1, seperti dalam gambar 13.
Gambar 14 Peran Potassium dependent channel (Kv2.1) dalam mekanisme
glucose compentence concept oleh GLP-1 (MacDonald & Wheeler,
2003).
Pada penjelasan di atas, belum diketahui secara pasti bagaimana PKA dapat
memperkuat aktivasi VDCC. McDonald (2003) memperjelas mekanisme ini.
Setelah GLP-1 berikatan dengan reseptornya pada membrane sel β, akan terjadi aktivasi protein G oleh GLP-1, selanjutnya akan diikuti aktivasi adenilsiklase
(AC) sebagai enzim yang mengaktifkan cAMP. Terbentuknya cAMP akan diikuti
oleh aktivasi protein kinase A (PKA) yang bersifat inhibitor kanal Kv2.1 (Voltage
dependent potassium channels). Inhibisi ini juga terjadi pada alur metabolisme
meningkatkan rasio NADPH/NADP+. Inhibisi KV2.1 ini, akan memperkuat
depolarisasi yang terjadi akibat inhibisi K+ATP oleh metabolisme glukosa, jadi
GLP-1 tidak langsung bekerja pada VDCC. Proses inilah yang dimaksud sebagai
kerja GLP-1 dalam memperkuat alur amplifying pathway (gambar 14). Dari
penelitian terdahulu, diketemukan adanya penurunan efektifitas, penurunan
sekresi GLP-1 pada DM tipe-2 (Nauck et al, 1986). Dengan penjelasan tersebut
dapat dimengerti bahwa salah satu sebab terganggunya sekresi insulin fase cepat
adalah kurangnya dukungan yang memperkuat alur triggering dan amplifying
pathway oleh GLP-1.
BRIN-BD11
BRIN-BD11 adalah salah satu jenis sel lestari penghasil insulin (clonal
glucose-responsive insulin-secreting cell) yang cukup stabil, dan mempunyai sifat
yang mendekati fisiologi sel β pankreas. BRIN-BD11 dapat dipergunakan untuk berbagai penelitian yang berhubungan dengan sekresi insulin, dan dapat
mengatasi beberapa keterbatasan pada penggunaan islet cell yang diisolasi dari
pankreas tikus atau mencit seperti kesulitan teknis isolasi islet Langerhans,
heterogenisitas selular dan hormonal dari islet, dan penurunan produksi insulin
secara cepat dalam kondisi kultur jaringan.
BRIN-BD11 dibentuk dari proses fusi-elektrik (electrofusion) dari RINm5F
dan pancreatic islet cells tikus New England Deaconess Hospital (NEDH). Dari
proses ini dihasilkan tiga jenis sel lestari penghasil insulin, yaitu BRIN-BG5,
BRIN-BG7 dan BRIN-BD11. Di antara ketiga jenis sel tersebut, BRIN-BD11
mempunyai tingkat respons yang paling baik terhadap perbedaan konsentrasi
glukosa, karena mempunyai kandungan GLUT-2 dan glukokinase yang terbanyak
(McClenaghan & Flatt, 2000, McClenaghan et al, 1996).
Secara morfologi, BRIN-BD11 tumbuh sebagai sel monolayer pada kultur
sel dengan sifat epiteloid, yang cukup stabil walaupun sudah mengalami lebih dari
50 passage (McClenaghan et al, 1996).
BRIN-BD11 pernah dicoba untuk ditransplantasikan ke tikus diabetes yang
diberi streptosotozin, ternyata memberikan perbaikan glukosa darah hingga
yang diambil kembali dari tempat transplan dan dilakukan kultur ulang,
menunjukkan perbaikan respons sekresi insulin dari BRIN-BD11 tersebut (Davies
et al, 2001).
Dibanding dengan sel lestari penghasil insulin lain seperti RIN5mF,
HIT-T15, dan INS, BRIN-BD 11 mempunyai sifat yang paling mendekati sel β pankreas walaupun INS mempunyai kandungan granul insulin paling banyak.
BRIN-BD11 mempunyai sensitivitas terhadap glukosa dengan menunjukkan
perbedaan respons sekresi insulin pada berbagai konsentrasi glukosa, sedangkan
yang lainnya tidak (Akbarsha et al, 1990). Profil metabolisme BRIN-BD11 juga
lebih baik dibanding dengan sel induknya RIN5mF (Rasschaert et al, 1996).
Mekanisme glucose sensing dimiliki oleh BRIN-BD11, karena mempunyai
kelengkapan GLUT-2 dan rasio glukokinase/heksokinase yang tinggi, serta
kandungan insulin sekitar 77 ng/106 sel, jauh lebih tinggi dibanding dengan sel
induknya RINm5F yang hanya mempunyai kandungan insulin sekitar 0,6 ng/106
sel. Secara dinamika, BRIN-BD11 mampu menunjukkan pola sekresi insulin fase
cepat dengan puncak sekresi pada menit ke 2 setelah kadar glukosa media
ditingkatkan dari 1,1 mM menjadi 16,7 mM. Sekresi insulin akut oleh
BRIN-BD11 pada media dengan kadar glukosa 16,7 mM selama 20 menit menunjukkan
peningkatan sebesar 1,4 kali dibanding inkubasi pada media dengan kadar glukosa
1,11 mM. Sekresi insulin ini dapat dihambat oleh 0,5 mM diazoxide dan
sebaliknya terjadi peningkatan tajam, sekitar 9 kali pada pemberian 25 mM KCl
(McClenaghan et al, 1996).
Media terbaik yang dapat dipakai untuk pemeliharaan adalah RPMI 1640,
dengan kadar glukosa 11,1 mM, dan sekresi insulin terbaik setelah 10 hari
inkubasi (Akbarsha et al, 1990). Jumlah sel berkembang biak menjadi 2 kali lipat
dalam kurun waktu 20 jam.
BRIN-BD11 juga telah dipakai di berbagai pusat penelitian, yang
berhubungan dengan efek insulinotropik berbagai herbal seperti jamur Agaricus
campestris (Gray & Flatt, 1998c), Eucalyptus globulus (Gray & Flatt, 1998c),
Medicago sativa (Gray & Flatt, 1997), Agrimony eupatria (Gray & Flatt, 1998a).
BRIN-BD11 juga dapat dipakai untuk mempelajari pengaruh berbagai obat pada
Kamagate et al, 2002) bahkan dapat pula mempelajari berbagai metabolisme dan
fisiologi sel β pankreas (Welters et al, 2004, Rasschaert et al, 1996, McClenaghan et al, 1996)
[image:43.595.147.474.155.397.2]
Gambar 15 BRIN-BD11 pada hari ke 0, sesaat setelah dipindahkan ke botol pada proses subkultur (Pemotretan gambar 16 – 18 dilakukan tanpa skala, dengan inverted microscope).
[image:43.595.148.474.472.720.2]
Gambar 17 BRIN-BD11 pada hari ke-7 dalam proses kultur
Sambiloto (Andrographis paniculata)
Sambiloto adalah nama di daerah Jawa Tengah, Sunda: Ki oray, Melayu :
Sambilata, Maluku: pepaitan dan Malaysia: Hempedu Bumi. Sambiloto dalam
klasifikasi sistem Engler termasuk dalam divisi : Embryophyta siphonogama,
Subdivisi: Angiospermae, Kelas Dicotyledonae, Bangsa Tubiflorae, Suku
Acanthaceae serta Marga: Andrographis. Menurut klasifikasi modern (Integrated
Sistem of Classification) termasuk divisi Magnoliophyta, kelas Magnoliopsida,
anak kelas Asteridae, bangsa Scrophulariales dan suku Acanthaceae. Sambiloto
termasuk tanaman Herba, semusim, tinggi + 35 - 90 cm. Batang berkayu, pangkal
bulat, masih muda berbentuk segi empat setelah tua bulat, percabangan
monopodial, hijau. Daun tunggal bulat telur, bersilang berhadapan pangkal dan
ujung runcing, tepi rata, panjang + 5 cm, lebar + 1,5 cm., pertulangan menyirip,
Gambar 18 Foto tanaman sambiloto (Andrographis paniculata) umur tanam 30
hari (kiri), 60 hari (tengah) dan 90 hari (kanan) setelah dipindahkan
dari tempat persemaian. Foto diambil di rumah kaca BALITRO
Daun sambiloto mengandung saponin, flavonoid dan tanin (Hanan, 1996).
Kandungan aktif dari sambiloto adalah antara lain andrografolid (AP1) (gambar
19), 14-deoksi-11,12 didehidroandrografolid (AP3) dan neo-andrografolid (AP4)
yang rasanya sangat pahit (Pholphana et al, 2004). Kandungan andrografolid
mencapai 2,5 – 4,6% dari bobot kering. Andrografolid sangat mudah diabsorbsi
melalui saluran cerna, dan hampir seluruhnya diabsorbsi pada pemberian oral
pada tikus. Sebagian besar andrografolid (55%) terikat pada albumin dalam
sirkulasi, dan sedikit dalam keadaan bebas, sehingga hanya sedikit yang bisa
masuk ke dalam sel. Konsentrasi maksimum yang dapat dicapai dalam sirkulasi
darah setelah pemberian 20 mg andrografolid peroral pada manusia 393 ng/mL
atau sekitar 1,12 μM andrografolid. Konsentrasi tertinggi tercapai dalam 90 sampai 120 menit setelah pemberian andrografolid peroral. Waktu paruh
andrografolid sekitar 6,6 jam (Panossian et al, 2000).
Ditinjau dari aspek toksikologi, berdasarkan kriteria Gleason, sambiloto
termasuk ke dalam golongan yang Practically Non Toxic, mengingat dosis toksik
akut (LD50 ) sebesar 71,27 mg/10 gBB. Efek toksisitas yang terlihat adalah
Gambar 19 Rumus bangun andrografolid;
3,14,19-trihidroksi-8(17),12-labdadien-16,15-0lide; C20H30O5 (BM:350.454)
Manfaat klinis sambiloto
Sambiloto berkhasiat sebagai obat berbagai jenis penyakit antara lain
demam, penyakit kulit, kencing manis, diuretika, antialergi, antitukak lambung
radang telinga dan obat masuk angin.
Berbagai pengaruh sambiloto yang telah dibuktikan antara lain, pemberian
20 mg serbuk kering daun sambiloto ke pada tikus albino selama 60 hari dapat
menyebabkan depresi spermatogenesis sebagai dampak dari sifat sambiloto
sebagai antiandrogen (Akbarsha et al, 1990).
Pada penelitian yang membandingkan ekstrak sambiloto (A. paniculata
nees) dengan minyak ikan, terihat bahwa ekstrak sambiloto tersebut bersifat
anti-arteriosklerosis dan mencegah restenosis pasca angioplasti, sedangkan minyak
ikan tidak mempunyai sifat tersebut (Inagaki et al, 1996).
Sifat inhibisi kanal kalsium juga terlihat pada penelitian yang menggunakan
ekstrak kering daun sambiloto. Pada konsentrasi 0.4 mg/mL dalam media inkubasi
vasa deferens tikus, terlihat inhibisi influks ion kalsium secara total (Burgos et al,
kering sambiloto dengan konsentrasi 0.4 mg/mL pada media inkubasi uterus tikus
(Burgos et al, 2001).
Fraksi etanol dari serbuk kering daun sambiloto ternyata juga bersifat
antihistamin, sehingga dapat dipertimbangkan sebagai herbal antialergi (Aldi et al,
1996).
Sambiloto juga mempunyai sifat antimikrobial, termasuk antimalaria.
Serbuk daun sambiloto dapat menghilangkan gejala subyektif infeksi saluran
nafas bagian atas sederhana (Coon & Ernst, 2004). Empat jenis Xanthones yang
dihasilkan dari ekstraksi akar sambiloto, ternyata terbukti dapat menurunkan
derajat parasitemia Plasmodium berghei pada mencit Swiss Albino sampai
sebesar 62% pada pemberian oral dengan konsentrasi 30 mg/kgBB (Dua et al,
2004), sedangkan ekstrak daun sambiloto yang dibuat infus, tidak mempunyai
pengaruh sebagai antimalaria (Dzulkarnaen et al, 1996). Dari fakta tersebut di atas,
dapat disimpulkan bahwa daun dan akar sambiloto mempunyai perbedaan
komponen kandungan bahan aktif sehingga mempunyai manfaat klinis yang
berbeda pula.
Manfaat sambiloto dalam dunia diabetes.
Di samping begitu banyak manfaat klinis sambiloto, baik daun maupun
akarnya, ternyata daun sambiloto juga mempunyai peranan dalam dunia diabetes.
Sudah cukup banyak penelitian-penelitian hewan yang membuktikan bahwa daun
sambiloto bermanfaat dalam perbaikan profil glukosa darah.
Pada tahun 1994, Borhanudin mendapatkan bahwa pemberian ekstrak air
daun sambiloto dengan konsentrasi 10 mg/kgBB pada kelinci diabetes, dapat
mencegah peningkatan glukosa darah pada pemberian 2 mg/kgBB glukosa peroral,
tetapi tidak bisa mencegah kenaikan glukosa darah yang diakibatkan oleh
adrenalin. Di samping itu pada pemberian jangka panjang sekitar 6 minggu,
sambiloto juga tidak menunjukkan pengaruh dalam penurunan glukosa darah
puasa. Penelitian ini menyimpulkan bahwa ektrak air daun sambiloto berperan
Pemberian peroral ekstrak etanol daun sambiloto dengan konsentrasi 0.1 –
0.4 g/kgBB dapat memperbaiki profil glukosa darah tikus diabetes-STZ sebanding
dengan pemberian 0.5 g/kgBB metformin, tetapi tidak terlihat adanya perbedaan
kadar insulin darah, baik pada kelompok kontrol, metformin maupun sambiloto.
Dari penelitian tersebut diambil simpulan bahwa perbaikan profil glukosa darah
disebabkan oleh perbaikan metabolisme glukosa. Pada penelitian ini, juga terlihat
keunggulan sambiloto dalam memperbaiki kadar trigliserida darah, di mana pada
pemberian sambiloto terjadi penurunan trigliserida sebesar 49.8%, sedangkan
metformin hanya menurunkan trigliserida darah sebesar 27.7% (Zhang & Tan,
2000).
Penelitian lanjutan menunjukkan bahwa di samping memperbaiki profil
glukosa darah pada tikus diabetes-STZ, ekstrak etanol daun sambiloto juga
bersifat antioksidan. Dibanding dengan metformin, perbaikan oksidatif stres
bukanlah disebabkan oleh perbaikan glukosa darah semata, tetapi oleh sambiloto,
karena perbaikan glukosa darah oleh metformin pada penelitian yang sama tidak
menunjukkan perbaikan oksidatif stres tersebut (Nunemaker et al, 2004).
Mafauzy (2002) melanjutkan penelitian tentang manfaat sambiloto pada
tikus diabetes-STZ. Secara keseluruhan terlihat adanya penurunan glukosa darah
dan penurunan angka kematian tikus diabetes-STZ pada pemberian sambiloto
peroral, baik dalam bentuk serbuk kering dengan konsentrasi 1 g/kgBB, maupun
ekstrak etanol dengan konsentrasi 2 mg/kgBB (Mafauzy et al, 2002), hasil yang
sama juga ditunjukkan penelitian yang serupa, hanya perbedaan konsentrasi
serbuk sambiloto sebesar 0.5 mg/kgBB dan konsentrasi ekstrak yang dilakukan
dengan metode freez-dried sebesar 6.25 mg/kg BB (Husen et al, 2004). Kedua
penelitian ini tidak menjelaskan lebih rinci tentang kesetaraan antara ekstra