CHANDRA RISDIAN. Hubungan Kandungan Protein dari Gen
ESR1
dengan
Organogenesis 16 Varietas Lokal Tembakau (
Nicotiana tabacum
L.). Dibimbing
oleh HASIM dan ARIEF BUDI WITARTO.
Studi tentang potensi organogenesis tembakau (
Nicotiana tabacum
L.) dan
hubungannya dengan kandungan protein dari gen
ESR1
(
Enhancer of Shoot
CHANDRA RISDIAN. The Relation Between Content of Protein from
ESR1
Gene and Organogenesis 16 Varieties of Local Tobacco (
Nicotiana tabacum
L.).
Under the direction of HASIM and ARIEF BUDI WITARTO.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Judul Skripsi : Hubungan Kandungan Protein dari Gen
ESR1
dengan
Organogenesis 16 Varietas Lokal Tembakau
(
Nicotiana tabacum
L.)
Nama
: Chandra Risdian
NIM
: G44102011
Disetujui
Komisi Pembimbing
Dr. drh. Hasim, DEA
Dr. Arief BudiWitarto, M.Eng
Ketua
Anggota
Diketahui
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Prof. Dr. Ir. Yonny Koesmaryono, M.S.
NIP 131473999
Puji syukur penulis alamatkan kepada Allah SWT yang senantiasa
melimpahkan karunia kepada hambaBhambaBNya dan shalawat serta salam tak
lupa kepada Rasulullah Muhammad SAW. Penulis sangat bersyukur sekali dapat
menyelasaikan karya ilmiah ini, yang berjudul Hubungan Kandungan Protein dari
Gen
ESR1
dengan Organogenesis 16 Varietas Lokal Tembakau (
Nicotiana
tabacum
L.).
Tidak lupa penulis mengucapkan banyak terima kasih kepada Kelompok
Penelitian Rekayasa ProteinBLIPI, Cibinong, yang telah mengeluarkan dana untuk
penelitian ini, Dr. drh. Hasim, DEA. dan Dr.Arief Budi Witarto, M.Eng. sebagai
pembimbing, Desriani S.Si, M.Si yang telah banyak membantu penulis selama
mengejakan penelitian kultur jaringan tanaman serta karya tulis ini, Suwarti S.TP
yang telah membantu penulis dalam hal teknis pekerjaan analisis protein, ayah
dan ibu yang selalu memberikan semangat serta do’anya, Yulfan, Febri,
Bambang, Aris, Nanda, Firdaus, Anang, dan Aqwin yang telah membantu penulis
dalam menyelesaikan penelitian, analisis data serta menyelesaikan karya tulis ini.
Akhir kata,
penulis sangat berharap bahwa penelitian ini dapat
memberikan kontribusi pengembangan ilmu pengetahuan bagi pembacanya. Tak
ada gading yang tak retak, penulis yakin di dalam karya tulis ini masih terdapat
kekurangannya, untuk itu saran dan kritik yang bersifat membangun sangat
diharapkan.
Bogor, Januari 2007
Penulis dilahirkan di Jakarta pada tanggal 4 Nopember 1984 dari ayah
Yudiswan dan ibu Sumarni. Penulis merupakan putra pertama dari empat
bersaudara.
Tahun 2002 penulis lulus dari SMU Negeri 2 Bekasi dan pada tahun yang
sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB. Penulis
memilih Program Studi Biokimia, Jurusan Kimia, Fakultas Matematika dan Ilmu
Pengetahuan Alam.
! " #
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ...
ix
PENDAHULUAN ...
1
TINJAUAN PUSTAKA
Molecular farming
...
1
Tanaman Tembakau ...
2
Kultur Jaringan Tanaman ...
3
Induksi Tunas ...
3
Potensi Organogenesis Tembakau ...
5
BAHAN DAN METODE
Bahan dan Alat ...
6
Metode ...
...
6
HASIL DAN PEMBAHASAN
JumlahTunas, Persentase Cakram Daun Yang Tumbuh Tunas dan
Persentase Area Permukaan Cakram Daun Tumbuh Tunas ...
8
Analisis Protein Cakram Daun ... 11
SIMPULAN DAN SARAN ... 14
DAFTAR PUSTAKA ... 14
! " #
1 ProteinBprotein rekombinan bernilai tinggi yang dihasilkan tembakau dalam
usaha
molecular farming
... 2
2 Tembakau koleksi Laboratorium Rekayasa ProteinBLIPI ... 6
3 Jumlah tunas dan persentase cakram daun yang tumbuh tunas dari 16
varietas lokal tembakau setelah 7 minggu ... 9
4 Data persentase luas area cakram daun tumbuh tunas dari 16 varietas lokal
setelah 7 minggu waktu inkubasi ... 11
5 Kelompok Duncan berdasarkan rataan jumlah tunas tiap cakram daun
yang terbentuk ... 12
! " #
1 Mekanisme sinyal hormonal pada tanaman ... 4
2 MacamBmacam sitokinin ... 4
3 MacamBmacam auksin ... 4
4 Reseptor sitokinin
CRE1
... 4
5 Reseptor auksin
ABP1
... 5
6 Grafik hubungan eksponensial antara jumlah tunas tiap eksplan daun
dengan persentase eksplan daun yang tumbuh tunas ... 5
7 Grafik hubungan eksponensial antara jumlah tunas yang tumbuh
dengan persentase luas area eksplan daun yang tumbuh tunas ... 5
8 Grafik hubungan antara jumlah tunas dengan persentase cakram daun
yang tumbuh tunas (%) ... 10
9 Perbandingan tunas yang terbentuk antara varietas Gewol Setiyeng dengan
varietas Deli ... 10
10 Grafik hubungan antara jumlah tunas yang tumbuh dengan persentase luas
area eksplan daun yang tumbuh tunas ... 10
11 Perkembangan cakram daun tembakau ... 12
12 Elektroforegram total protein pada cakram daun ... 13
13 Elektroforegram total protein cakram daun setelah sampel minggu I
diencerkan ... 13
! " #
1 Komposisi larutan stok Media MS ... 17
2 TahapBtahap kerja penelitian ... 18
3 TahapBtahap ekstraksi dan analisis protein ... 19
4 Larutan stok SDSBPAGE ... 20
5 Komposisi gel akrilamid 10% ... 21
6 Data hasil uji RAL ANOVA ... 22
7 Data hasil uji Duncan ... 23
8 Kurva protein standar SDS PAGE ulangan I ... 24
9 Kurva protein standar SDS PAGE ulangan II ... 25
CHANDRA RISDIAN. Hubungan Kandungan Protein dari Gen
ESR1
dengan
Organogenesis 16 Varietas Lokal Tembakau (
Nicotiana tabacum
L.). Dibimbing
oleh HASIM dan ARIEF BUDI WITARTO.
Studi tentang potensi organogenesis tembakau (
Nicotiana tabacum
L.) dan
hubungannya dengan kandungan protein dari gen
ESR1
(
Enhancer of Shoot
CHANDRA RISDIAN. The Relation Between Content of Protein from
ESR1
Gene and Organogenesis 16 Varieties of Local Tobacco (
Nicotiana tabacum
L.).
Under the direction of HASIM and ARIEF BUDI WITARTO.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Judul Skripsi : Hubungan Kandungan Protein dari Gen
ESR1
dengan
Organogenesis 16 Varietas Lokal Tembakau
(
Nicotiana tabacum
L.)
Nama
: Chandra Risdian
NIM
: G44102011
Disetujui
Komisi Pembimbing
Dr. drh. Hasim, DEA
Dr. Arief BudiWitarto, M.Eng
Ketua
Anggota
Diketahui
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Prof. Dr. Ir. Yonny Koesmaryono, M.S.
NIP 131473999
Puji syukur penulis alamatkan kepada Allah SWT yang senantiasa
melimpahkan karunia kepada hambaBhambaBNya dan shalawat serta salam tak
lupa kepada Rasulullah Muhammad SAW. Penulis sangat bersyukur sekali dapat
menyelasaikan karya ilmiah ini, yang berjudul Hubungan Kandungan Protein dari
Gen
ESR1
dengan Organogenesis 16 Varietas Lokal Tembakau (
Nicotiana
tabacum
L.).
Tidak lupa penulis mengucapkan banyak terima kasih kepada Kelompok
Penelitian Rekayasa ProteinBLIPI, Cibinong, yang telah mengeluarkan dana untuk
penelitian ini, Dr. drh. Hasim, DEA. dan Dr.Arief Budi Witarto, M.Eng. sebagai
pembimbing, Desriani S.Si, M.Si yang telah banyak membantu penulis selama
mengejakan penelitian kultur jaringan tanaman serta karya tulis ini, Suwarti S.TP
yang telah membantu penulis dalam hal teknis pekerjaan analisis protein, ayah
dan ibu yang selalu memberikan semangat serta do’anya, Yulfan, Febri,
Bambang, Aris, Nanda, Firdaus, Anang, dan Aqwin yang telah membantu penulis
dalam menyelesaikan penelitian, analisis data serta menyelesaikan karya tulis ini.
Akhir kata,
penulis sangat berharap bahwa penelitian ini dapat
memberikan kontribusi pengembangan ilmu pengetahuan bagi pembacanya. Tak
ada gading yang tak retak, penulis yakin di dalam karya tulis ini masih terdapat
kekurangannya, untuk itu saran dan kritik yang bersifat membangun sangat
diharapkan.
Bogor, Januari 2007
Penulis dilahirkan di Jakarta pada tanggal 4 Nopember 1984 dari ayah
Yudiswan dan ibu Sumarni. Penulis merupakan putra pertama dari empat
bersaudara.
Tahun 2002 penulis lulus dari SMU Negeri 2 Bekasi dan pada tahun yang
sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB. Penulis
memilih Program Studi Biokimia, Jurusan Kimia, Fakultas Matematika dan Ilmu
Pengetahuan Alam.
! " #
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ...
ix
PENDAHULUAN ...
1
TINJAUAN PUSTAKA
Molecular farming
...
1
Tanaman Tembakau ...
2
Kultur Jaringan Tanaman ...
3
Induksi Tunas ...
3
Potensi Organogenesis Tembakau ...
5
BAHAN DAN METODE
Bahan dan Alat ...
6
Metode ...
...
6
HASIL DAN PEMBAHASAN
JumlahTunas, Persentase Cakram Daun Yang Tumbuh Tunas dan
Persentase Area Permukaan Cakram Daun Tumbuh Tunas ...
8
Analisis Protein Cakram Daun ... 11
SIMPULAN DAN SARAN ... 14
DAFTAR PUSTAKA ... 14
! " #
1 ProteinBprotein rekombinan bernilai tinggi yang dihasilkan tembakau dalam
usaha
molecular farming
... 2
2 Tembakau koleksi Laboratorium Rekayasa ProteinBLIPI ... 6
3 Jumlah tunas dan persentase cakram daun yang tumbuh tunas dari 16
varietas lokal tembakau setelah 7 minggu ... 9
4 Data persentase luas area cakram daun tumbuh tunas dari 16 varietas lokal
setelah 7 minggu waktu inkubasi ... 11
5 Kelompok Duncan berdasarkan rataan jumlah tunas tiap cakram daun
yang terbentuk ... 12
! " #
1 Mekanisme sinyal hormonal pada tanaman ... 4
2 MacamBmacam sitokinin ... 4
3 MacamBmacam auksin ... 4
4 Reseptor sitokinin
CRE1
... 4
5 Reseptor auksin
ABP1
... 5
6 Grafik hubungan eksponensial antara jumlah tunas tiap eksplan daun
dengan persentase eksplan daun yang tumbuh tunas ... 5
7 Grafik hubungan eksponensial antara jumlah tunas yang tumbuh
dengan persentase luas area eksplan daun yang tumbuh tunas ... 5
8 Grafik hubungan antara jumlah tunas dengan persentase cakram daun
yang tumbuh tunas (%) ... 10
9 Perbandingan tunas yang terbentuk antara varietas Gewol Setiyeng dengan
varietas Deli ... 10
10 Grafik hubungan antara jumlah tunas yang tumbuh dengan persentase luas
area eksplan daun yang tumbuh tunas ... 10
11 Perkembangan cakram daun tembakau ... 12
12 Elektroforegram total protein pada cakram daun ... 13
13 Elektroforegram total protein cakram daun setelah sampel minggu I
diencerkan ... 13
! " #
1 Komposisi larutan stok Media MS ... 17
2 TahapBtahap kerja penelitian ... 18
3 TahapBtahap ekstraksi dan analisis protein ... 19
4 Larutan stok SDSBPAGE ... 20
5 Komposisi gel akrilamid 10% ... 21
6 Data hasil uji RAL ANOVA ... 22
7 Data hasil uji Duncan ... 23
8 Kurva protein standar SDS PAGE ulangan I ... 24
9 Kurva protein standar SDS PAGE ulangan II ... 25
Tembakau merupakan salah satu tanaman komoditi di Indonesia. Tanaman ini digunakan sebagai bahan baku pembuatan rokok. Jenis tembakau di Indonesia antara lain adalah tembakau deli, dan tembakau
temanggung. Perkembangan ilmu
pengetahuan menyebabkan tembakau bisa dijadikan sarana untuk usaha molecular farmingdi Indonesia.
Molecular farming adalah usaha produksi protein rekombinan bernilai tinggi pada tanaman. Kegiatan ini meliputi penyisipan gen asing ke genom tanaman (seperti gen penyandi serum albumin manusia). Hasilnya kemudian dinamakan tanaman transgenik (Niesing 2001). Dengan molecular farmingini, tanaman tembakau bisa direkayasa menjadi tanaman yang bernilai tinggi karena mampu memproduksi proteinB protein bagi manusia.
Tembakau memiliki beberapa kelebihan sehingga bisa dijadikan objek dalam usaha molecular farming, yakni meliputi sistem ekspresi tingkat tinggi untuk protein asing, produksi biomassanya tinggi dan merupakan tanaman nonpangan (Giddings et al.2000, Daniellet al. 2001, Maliga 2003).
Organogenesis tunas tembakau dari eksplan daun adalah sistem regenerasi yang sangat efektif yang digunakan untuk transformasi tanaman (Horsch et al. 1985, Svab & Maliga 1993).
Pembuatan tembakau transgenik lokal memerlukan beberapa tahap, salah satunya adalah mencari varietas bermutu baik untuk ditransformasi. Parameter yang dilihat diantaranya adalah respon menumbuhkan tunas organogenesis meliputi persentase bahan atau eksplan daun yang dapat menumbuhkan tunas organogenesis, persentase luas area permukaan yang dapat menumbuhkan tunas tiap eksplan, serta kemampuan untuk menumbuhkan tunas yang banyak apabila diberi perlakuan oleh zat
penginduksi pertumbuhan tunas
organogenesis. Belum adanya informasi penelitian yang melihat potensi organogenesis dari tembakau varietas lokal menyebabkan dilakukannya penelitan ini.
Tujuan dari penelitian adalah untuk mengetahui potensi organogenesis tembakau lokal berdasarkan kemampuan membentuk tunas, serta membandingkan hasil analisis kandungan protein dari gen ESR1 yang merupakan gen pengatur jumlah tunas.
Hipotesis dari penelitian ini adalah perbedaan genetik dan habitat asal dalam suatu varietas tembakau akan mempengaruhi potensi organogenesisnya, hipotesis yang kedua adalah kandungan protein dari gen ESR1akan lebih banyak pada tembakau yang lebih banyak tunasnya.
Penelitian ini dilakukan dari April sampai September 2006 di Laboratorium Kelompok Penelitian Rekayasa Protein B Pusat Penelitian Bioteknologi LIPI (Lembaga Ilmu Pengetahuan Indonesia), Cibinong. Penelitian ini dibiayai oleh Kelompok Penelitian Rekayasa Protein yang merupakan bagian dari penelitianmolecular farmingpada tembakau.
$
Molecular farming adalah usaha produksi protein rekombinan bernilai tinggi pada tanaman. Kegiatan ini meliputi penyisipan gen asing ke genom tanaman (seperti gen penyandi serum albumin manusia). Hasilnya kemudian dinamakan tanaman transgenik. Adanya gen asing yang tersisipkan pada genomnya menyebabkan tanaman tersebut dapat memproduksi protein dari gen asing tersebut, yang disebut dengan protein rekombinan. Molecular farming merupakan cara yang efektif untuk memproduksi produkBproduk farmasi dan protein berguna lainnya dalam skala yang besar (Niesing 2001).
Usaha molecular farming saat ini sedang berkembang di Indonesia. Pada tahun 2004 telah dilakukan tranformasi gen penyandi protein human erythropoietin (hEPO) untuk penyakit anemia dan sialidase, yakni pendiagnosis adanya sel kanker, ke tembakau varietas Petit Havana SR1. Penelitan tersebut kemudian diteruskan untuk tembakau varietas lokal (Witarto 2005).
Kusnadi et al. (1997) menyatakan bahwa biaya produksi protein rekombinan dari tanaman bisa mencapai 10B50 kali lebih rendah daripada memproduksi protein yang sama dalam Escherichia coli. Selain dari keuntungan ekonomis, ada beberapa keuntungan lainnya yang dimiliki oleh tanaman dalam memproduksi protein rekombinan, atau yang lebih spesifik lagi adalah protein yang berhubungan dengan farmasi.
sarana molecular farming antara lain adalah (1) lebih ekonomis daripada menggunakan sistem fermentasi atau bioreaktor yang digunakan dalam industri, (2) telah tersedianya teknologi untuk pemrosesan hasil tanaman dalam skala yang besar, (3) protein yang diproduksi pada tanaman lebih stabil karena disimpan dalam ruangan intraseluler, (4) jumlah produk rekombinan yang bisa dihasilkan mendekati produksi skala industri, dan (5) resiko terkontaminasi patogen dan toksin manusia sangat kecil.
Sistem ekspresi pada sel hewan dapat menghasilkan protein yang tepat, tetapi mahal dan sensitif dengan perubahan lingkungan, terutama saat dikultur untuk skala industri (Fischer & Emans 2000, Fischeret al. 2000). Pengendalian kondisi kultur yang ketat diperlukan untuk menghasilkan produk yang benarBbenar murni (Giddingset al. 2000).
Kultur mikroba dan fungi lebih cepat memproduksi protein, namun protein yang diproduksinya nanti bisa tidak tepat, disebabkan karena perbedaan penggunaan kodon dan modifikasi pascatranslasi (Fischer & Emans 2000, Fischeret al. 2000). Sintesis protein, sekresi dan modifikasi pascatranslasi untuk sel tanaman dan hewan hampir serupa, hanya saja sedikit berbeda dalam glikosilasi protein (Fischer et al. 2000). Sebagai tambahan, produk dari tanaman transgenik cenderung tidak terkontaminasi oleh patogen hewan, toksin mikroba ataupun sekuens onkogenik (Fischer & Emans 2000, Fischeret al. 2000).
Beberapa tanaman yang telah menghasilkan berbagai produk protein rekombinan bernilai tinggi di antaranya adalah tembakau (Human Protein C, Human interferon! β, Human somatotropin, Human serum albumin, Human erythropoietin), tomat (Angiotensin!converting enzyme),Arabidopsis (Human enkephalin), padi (Human α
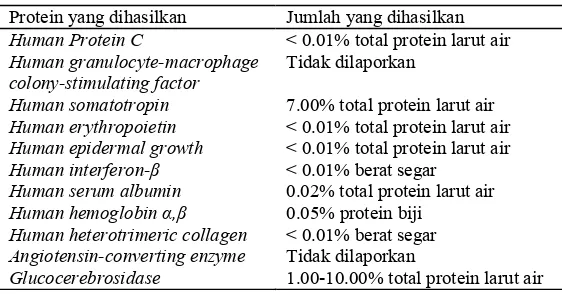
antitripsin), jagung (Human aprotinin), dan kentang (Human lactoferrin) (Daniell et al. 2001). Penggunaan tanaman tembakau untuk molecular farming sudah sangat banyak digunakan sehingga sudah banyak protein yang bernilai tinggi yang sudah dihasilkan melalui usahamolecular farming ini. Jumlah protein yang telah dihasilkan tiap tanaman tersebut dapat dilihat pada Tabel 1.
# " # %"& ' (
Genus Nicotiana adalah salah satu divisi terbesar pada famili Solanaceae. Goodspeed (1954) mengelompokkan 3 subgenera yakni (1) subgenus rustica, (2) subgenustabacum, (3) subgenuspetunioides. Selain dibagi menjadi 3 subgenera, genus Nicotiana juga dibagi lagi menjadi 14 seksi dan 66 spesies. Sejumlah 45 spesies berasal dari Amerika Utara dan Amerika Selatan, 20 spesies merupakan berasal dari Australia dan 1 spesies sisanya berasal dari Afrika (Margaretet al. 1991). Subgenus yang paling banyak mengandung alkaloid nikotin adalah subgenustabacum(Durbin 1979).
Tembakau adalah genus tanaman yang berdaun lebar, berasal dari daerah Amerika Utara dan Amerika Selatan. Daun dari tanaman ini sering digunakan sebagai bahan baku rokok, baik dengan menggunakan pipa maupun digulung dalam bentuk rokok atau cerutu. Daun tembakau dapat pula dikunyah atau dikulum, dan ada pula yang menghisap tembakau melalui hidung. Tembakau mengandung zat alkaloid nikotin, sejenis neurotoksin yang sangat ampuh jika digunakan pada serangga. Zat ini sering digunakan sebagai bahan utama insektisida.
Tanaman tembakau pertama kali masuk ke Indonesia kiraBkira tahun 1630, kemudian berkembang ke berbagai daerah di
Tabel 1 ProteinBprotein rekombinan bernilai tinggi yang dihasilkan tembakau dalam usaha molecular farming(Daniellet al. 2001)
Protein yang dihasilkan Jumlah yang dihasilkan Human Protein C < 0.01% total protein larut air Human granulocyte!macrophage
colony!stimulating factor
Tidak dilaporkan
Human somatotropin 7.00% total protein larut air Human erythropoietin < 0.01% total protein larut air Human epidermal growth < 0.01% total protein larut air Human interferon!β < 0.01% berat segar
Human serum albumin 0.02% total protein larut air Human hemoglobin α,β 0.05% protein biji
Human heterotrimeric collagen < 0.01% berat segar Angiotensin!converting enzyme Tidak dilaporkan
Indonesia (Rochman & Suwarso 2000). Tjitrosoepomo (1994 di dalam Basuki,
Rochman & Yulaikah 2000)
mengelompokkan tanaman tembakau ke dalam tumbuhan obatBobatan, dengan sistematika sebagai berikut : divisi Spermatophyta; kelas Dicotyledoneae; famili Solanaceae; genus Nicotiana; spesies tabacum.
Tembakau memiliki beberapa kelebihan sehingga bisa dijadikan objek dalam usaha molecular farming, yakni meliputi sistem ekspresi tingkat tinggi untuk protein asing, produksi biomassanya tinggi dan merupakan tanaman nonpangan (Giddings et al.2000, Daniellet al. 2001, Maliga 2003).
(!)(* $ *+#, # # " #
Kultur jaringan tanaman merupakan teknik menumbuhkembangkan bagian tanaman, baik berupa sel, jaringan, atau organ dalam kondisi aseptik secarain vitro(Yusnita 2003). Istilah in vitro digunakan untuk menggambarkan lingkungan kultur yang steril dan artifisial (Tisserat 1985). Tanaman yang tumbuh dalam teknik kultur jaringan dengan akar dan tunas yang sudah dapat dibedakan disebut dengan planlet (Tisserat 1985). Dengan teknik kultur jaringan ini, regenerasi tanaman dari bagian tanaman lainnya dapat dilakukan.
Regenerasi tanaman dengan kultur jaringan tanaman dapat dilakukan dengan tiga metode, yakni kultur embrio, embriogenesis somatik, dan organogenesis. Kultur embrio merupakan kultur yang menggunakan embrio zigotik, salah satunya berasal dari biji. Embriogenesis somatik merupakan teknik yang memproduksi struktur mirip embrio (misal: kalus) yang berasal dari sel somatik (misal: daun, akar atau batang). Kalus merupakan kumpulan selBsel yang belum terdeferensiasi. Organogenesis terjadi apabila dari kalus tumbuh menjadi tunas atau tumbuh tunas samping dari ujungBujung bahan yang dikulturkan, yang kemudian akan membentuk akar juga (Tisserat 1985).
Bahan tanaman yang dikulturkan secarain vitrolazim disebut dengan eksplan. Umumnya bagian tanaman yang digunakan sebagai eksplan adalah jaringan atau organ meristematik (sedang tumbuh aktif). Jaringan atau organ meristematik ini masih mampu untuk memperbanyak selnya, sifat totipotensinya masih tinggi, daya tahannya masih baik dan sedikit mengandung kontaminan (Tisserat 1985, Yusnita 2003).
Beberapa contoh bagian tanaman yang digunakan sebagai eksplan adalah biji atau bagianBbagian biji seperti aksis embrio atau kotiledon, tunas pucuk, potongan batang atau buku, potongan akar, potongan daun, potongan umbi batang, umbi akar, empulur batang, umbi lapis dengan sebagian batang dan bagian bunga (Tisserat 1985, Yusnita 2003).
Selain memperhitungkan darimana eksplan itu diambil, proses sterilisasi eksplan harus diperhatikan juga. Sterilisasi eksplan dapat menggunakan bahanBbahan seperti etanol, NaOCl, Ca(OCl)2, Cl2, Br2, I2, HgBr2, HgI2 HgCl2, dan Tween 20 (Dixon 1985, Tisserat 1985).
Etanol merupakan pendenaturasi protein dan perusak membran sel. Halogen serta senyawanya merupakan oksidator kuat yang dapat merusak komponen seluler. Logam berat seperti Hg dapat mendenaturasi protein. Tween 20 merupakan deterjen yang dapat melarutkan membran sel (Pelczar & Chan 1988). BahanBbahan tersebut digunakan dalam konsentrasi yang sedikit agar tidak menyebabkan kematian eksplan juga.
Dibandingkan dengan perbanyakan tanaman secara konvensional, perbanyakan tanaman secara kultur jaringan mempunyai beberapa kelebihan yaitu (1) memberikan peluang besar untuk menghasilkan jumlah bibit tanaman yang banyak dalam waktu relatif singkat sehingga lebih ekonomis; (2) tidak memerlukan tempat yang luas; (3) dapat dilakukan sepanjang tahun tanpa bergantung pada musim; (4) bibit yang dihasilkan lebih sehat; dan (5) memungkinkan dilakukannya manipulasi genetik (Yusnita 2003).
Selain kelebihannya, teknik kultur jaringan mempunyai beberapa kelemahan yaitu (1) dibutuhkannya biaya awal yang relatif tinggi untuk laboratorium dan bahan kimia; (2) dibutuhkan keahlian khusus untuk melaksanakannya; (3) tanaman yang dihasilkan berukuran kecil, aseptik dan terbiasa hidup di tempat yang berkelembaban tinggi sehingga memerlukan aklimatisasi ke lingkungan eksternal (Yusnita 2003).
#-('.+ (# .
bahwa nisbah sitokinin dan auksin yang tinggi mendorong pembentukan tunas, sedangkan nisbah sitokinin dan auksin yang rendah mendorong pembentukan akar. Jika diberikan dalam jumlah yang seimbang, sitokinin dan auksin akan mendorong pembentukan kalus.
Mekanisme kerja ZPT sama dengan sistem transduksi hormon (Gambar 1). ZPT dapat dikenali sel karena adanya reseptor (penerima) pada membran sel. Pesan yang dibawa ZPT akan diteruskan ke dalam sel dengan bantuan caraka kedua, yakni IP3 (inositol 1,4,5Btrifosfat) dan ion Ca2+. Caraka kedua kemudian akan menimbulkan respon sel, salah satunya melalui pengaktifkan protein kinase c (Salisbury FB & Ross CW 1995).
Zat pengatur tumbuh yang sering digunakan berasal dari jenis sitokinin dan auksin. Kerja sitokinin adalah merangsang pertumbuhan tunas, sementara itu kerja auksin adalah merangsang pembentukan akar. Jenis sitokinin antara lain adalah kinetin, isopentenil adenin (IPA), benziladenin purin (BAP) dan thidiazuron (TDZ) (Gambar 2). Jenis auksin antara lain adalah asam indolbutarat (IBA), asam indolasetat (IAA) dan asam LBnaftalen asetat (NAA) (Gambar 3) (Dixon 1985, Salisbury FB & Ross CW 1995).
Gambar 1 Mekanisme sinyal hormonal pada tanaman (Salisbury FB & Ross CW 1995).
Inoue et al. pada tahun 2001 menemukan reseptor sitokinin yang dinamakan CRE1 (Cytokinin Response 1). CRE1 terdiri dari domain CHASE (Cyclases/Histidine kinases Associated Sensory Extracellular) yang dihubungkan dengan histidin kinase (Napier 2004). Sedangkan reseptor auksin menurut Napier (2004) dinamakan ABP1 (Auxin!Binding Protein 1). Reseptor sitokinin dan auksin tersebut ditampilkan dalam Gambar 4 dan 5.
Gambar 2 MacamBmacam sitokinin.
Gambar 3 MacamBmacam auksin.
Gambar 5 Reseptor auksinABP1(Napier 2004).
Pada penelitian Li, Huang, Bass (2003) terhadap tanaman genus Nicotiana, terdapat hubungan eksponensial antara jumlah tunas tiap eksplan daun dengan persentase eksplan daun yang tumbuh tunas. Hubungan ini memiliki persamaan: jumlah tunas = 14.7825×(persentase)0.05×exp[–0.2455×(100– persentase)–2(R 2=0.6415, P<0.0001. Kurva dari persamaan ini dapat dilihat pada Gambar 6. Li, Huang, Bass (2003) membuat 4 kriteria
untuk menentukan potensi daya
organogenesis. Kriteria pertama adalah 80B 100% (beregenerasi tinggi), kedua adalah 50B 79% (beregenerasi moderat), ketiga adalah 1B 49% (beregenerasi rendah), dan keempat 0% (tidak beregenerasi).
Witarto dan Desriani (2005) telah meneliti 9 varietas tembakau lokal (Nicotiana tabacum L.) dengan parameter jumlah tunas yang tumbuh serta persentase luas area permukaan eksplan daun yang tumbuh tunas untuk dapat membedakan potensi organogenesis dari 9 varietas tembakau lokal.
Jumlah tunas
Persentase (%)
Gambar 6 Grafik hubungan eksponensial antara jumlah tunas tiap eksplan daun dengan persentase eksplan daun yang tumbuh tunas (Li, Huang, Bass 2003).
Dari kedua parameter tersebut didapat hubungan eksponensial dengan persamaan: jumlah tunas = 1.1814e0.0305 x persentase (R2 = 0.828). Grafik dari persamaan tersebut dapat dilihat pada Gambar 7.
Walaupun mekanisme yang
mempengaruhi organogenesis tunas tidak banyak diketahui, namun telah diidentifikasi dan dikarakterisasi 2 tipe gen yang mengatur organogenesis tunas. Tipe gen yang pertama mengendalikan pembentukan tunas dari selB sel yang belum terdiferensiasi, sebagai contoh adalah gen reseptor sitokinin CRE1. Gen tersebut menyandikan protein histidin kinase sehingga dapat memproduksi tunas ( Inoueet al. 2001, Ueguchiet al. 2001). Tipe gen kedua adalah yang mengendalikan jumlah tunas yang tumbuh, contohnya adalah gen ESR1 (Enhancer of Shoot Regeneration 1). ESR1 menyandikan faktor transkripsi terduga (36.2 kDa) dan jika ekspresinya berlebih maka dapat menginduksi tunas empat kali lebih banyak dari kultur akar dibandingkan dengan kontrolnya (Bannoet al. 2001). Ekspresi gen ESR1 diinduksi oleh sitokinin namun proses sinyal yang secara pasti dari awal adanya sitokinin hingga bisa mengaktifkan genESR1 belum diketahui (Bannoet al. 2001).
Lebih lanjut menurut Witarto dan Desriani (2005), tembakau varietas Gewol Setiyeng (Jawa) memiliki potensi organogenesis tertinggi kemudian varietas Deli (Sumatera) memiliki potensi organogenesis terendah. Perbedaan respon atau potensi organogenesis ini kemungkinan juga karena perbedaan habitat asalnya.
/ # - # ! )
BahanBbahan yang digunakan adalah biji dan planlet tembakau varietas lokal (Tabel 2), media MS (MurashigeBSkoog, yaitu sukrosa, unsur hara makro, unsur hara mikro, NaFeEDTA, vitamin dan asam amino, mioinositol), fitagel, ZPT seperti BAP dan NAA, aluminium foil, plastik tahan panas, koran atau kertas bekas, kertas saring, etanol 70 %, plastik parafilm, akuades, TrisBHCl, EDTA, merkaptoetanol, akrilamida, N’N’! bismethylene!acrilamide, SDS, bromphenol blue, APS, Temed, asam asetat, etanol, dan glisin.
AlatBalat yang digunakan adalah autoklaf, sentrifus, microwave, alatBalat elektroforesis, tabung mikro, magnetic stirer, pengaduk magnet, freezer, autopipet, neraca analitik, skalpel, pinset, kertas saring, sarung tangan tahan panas, laminar air!flow, dan seperangkat alat gelas.
Tabel 2 Tembakau koleksi Laboratorium Rekayasa ProteinBLIPI Nama Varietas Tembakau Asal Gobir Andong Gewol Setiyeng Gewol Kerincing Gobir Kemloko Gobir Koplo Gobir Mustang SR 1 Deli Jawa Andeh Gadang Andong Kuning Genjah Kenongo Cetok Koplo Srintil
Ngablak + Koplo Kerlaeng + Loncang Kemloko Kecil Kemloko PutihBBesar Kemloko Wonosobo Besar Andong Jawa Jawa Jawa Jawa Jawa Jawa Varietas Internasional Sumatera Jawa Sumatera Jawa Jawa Jawa Jawa Jawa Jawa Jawa Jawa Jawa Jawa Jawa %)0-%
Jumlah varietas tembakau lokal yang digunakan adalah sebanyak 16 varietas. Daun ketiga atau keempat dari pucuk dijadikan
eksplan dalam bentuk cakram, yakni daun yang dipotong dengan ukuran 0.5 cm x 0.5 cm. Sebanyak 5 buah cakram daun tiap varietas ditanam di media induksi tunas (MS + 1 ppm BAP + 0.1 ppm NAA) selama 3 minggu kemudian dipindahkan ke media baru yang sama selama 4 minggu, sehingga total waktu yang digunakan adalah 7 minggu.
Tunas yang tumbuh tiap cakram daun dihitung, persentase cakram daun yang dapat menumbuhkan tunas dihitung berdasarkan perbandingan jumlah cakram daun yang tumbuh tunas dengan cakram daun total yang diinkubasi, sedangkan persentase luas area permukaan cakram daun yang tumbuh tunas dihitung berdasarkan perbandingan luas area permukaan yang tumbuh tunas terhadap total luas area permukaan cakram daun.
Data jumlah tunas yang tumbuh dianalisis secara statistik dengan menggunakan metode rancangan acak lengkap (RAL) ANOVA dengan α=0.05 Perbedaan pengaruh perlakuan diuji dengan uji lanjutan Duncan. Data diolah dengan menggunakan program SAS. Model umum rancangan tersebut (Mattjik & Sumertajaya. 2000) adalah:
ij i ij
Y
=
+
λ
+
ε
keterangan:
Yij = Pengamatan pada perlakuan keBi dan ulangan keBj,
Q = Pengaruh rataan umum, L = Pengaruh perlakuan keBi,
ξ = Pengaruh galat perlakuan keBi dan ulangan keBj.
Analisis kandungan protein yang mengatur jumlah tunas (protein dari gen ESR1) dilakukan dengan metode SDSBPAGE sebanyak 2 ulangan dengan menggunakan cakram daun dari varietas dengan jumlah tunas tertinggi dan jumlah tunas terendah. Cakram daun yang dianalisis adalah cakram daun yang telah diinkubasi selama 1, 2, dan 3 minggu dalam media induksi tunas. Untuk mendukung metode ini maka semua alat, bahan dan pengerjaannya harus steril.
)%*+!+. .+ ! )
Kertas saring dipotong dengan ukuran kurang lebih 6 x 6 cm dan dimasukkan ke dalam petri ukuran besar untuk bersamaBsama disterilisasi. Spatula dan pinset dibungkus dengan aluminium foil. Akuades dimasukkan ke dalam botol ukuran 1 liter lalu ditutup dan dari tutup hingga leher botol dilapisi dengan aluminium foil. Mulut alatBalat gelas seperti gelas ukur dan erlenmeyer ditutup dengan aluminium foil.
%"&( ) # - # )%*+!+. .+ %-+ (* ./+,%1 '00, ) #2 3
Media yang digunakan adalah media MS0 (MurashigeBSkoog tanpa ZPT). Media dibuat sebanyak 1 liter, terdiri dari stok hara makro 50 ml, stok hara mikro 2 ml, stok NaFeEDTA 5 ml, stok vitamin dan asam amino 5 ml, kemudian ditambahkan sukrosa 20 gram, mioinositol 0.1 gram, dan akuades hingga volume campurannya 800 ml. Campuran diatur pHBnya agar menjadi 5.8 dengan ditambahkannya beberapa tetes NaOH 1 N. Setelah itu ditera hingga 1000 ml dengan akuades, dan ditambahkan fitagel sebanyak 3 gram.
Untuk membuat campuran agar homogen, maka campuran yang telah dibuat dididihkan dengan microwave. Dalam keadaan panas, dengan menggunakan sarung tangan tahan panas, campuran dituangkan 40B 50 ml ke dalam botol jar, ditutup lalu disterilisasi dengan autoklaf 121oC selama 15 menit. Media yang sudah steril lalu disegel dengan plastik parafilm untuk mencegah kontaminan masuk ke dalam botol.
%"&( ) # - # )%*+!+. .+ %-+ #-('.+ (# .
Media induksi tunas yang digunakan adalah media MS (MurashigeBSkoog) ditambah 0.1 ppm NAA dan 1 ppm BAP. Campuran diatur pHBnya agar menjadi 5.8 dengan ditambahkannya beberapa tetes NaOH 1 N. Setelah itu ditera hingga 1000 ml dengan akuades dan ditambahkan fitagel sebanyak 3 gram.
Campuran kemudian dituangkan ke dalam erlenmeyer kemudian ditutup dengan aluminium foil lalu disterilisasi. Setelah steril maka dituangkan secara aseptik sebanyak 20B 25 ml ke dalam petri yang steril di dalam laminar air!flow.
)%*+!+. .+ %*"(' # +4+ %"& ' (
Sterilisasi permukaan biji tembakau temanggung dilakukan secara aspetik di dalam laminar air flow. Tangan pelaku disemprot alkohol 70% terlebih dahulu. Biji tembakau dituangkan ke dalam petri yang steril lalu ditambahkan akuades steril secukupnya dan digoyangkan selama 3 X 5 menit. Pemutih pakaian 70 % kemudian ditambahkan ke dalamnya, biji direndam dan digoyangkan selama 30 menit setelah itu dibilas dengan akuades steril 2 X 5 menit.
Biji yang sudah dibilas lalu dikeringanginkan di atas kertas saring yang steril kurang lebih selama 3B5 menit. Dengan spatula yang steril lalu biji tersebut dimasukkan ke dalam media yang telah dibuat. Botol dan tutupnya disegel juga dengan plastik parafilm. Biji yang sudah ditanam di media lalu dikondisikan dalam keadaan gelap dengan botol yang dibungkus aluminium foil.
#-('.+ (# . - *+ '.2! # '* " (#
Induksi tunas dari eksplan cakram daun dilakukan dengan membuat potongan daun kurang lebih berukuran 0.5 cm x 0.5 cm. Daun diambil dari posisi kedua atau ketiga dari pucuk plantlet lalu diinkubasi pada media MS + 0.1 ppm NAA + 1 ppm BAP yang dilakukan secara aseptik. Setelah berumur 3 minggu, eksplan dipindahkan ke media baru yang sama komposisinya hingga 4 minggu. Jadi, total waktu inkubasi adalah 7 minggu.
%*/+)(#, # $("! / (# .5 %*.%#) .% '* " (# 6 #, ("&(/ (# .5 - # %*.%#) .% ( . *% %*"(' # '* "
(# 6 #, ("&(/ (# .
%, maka tingkat regenarasinya tinggi, 50B79 % memiliki tingkat regenerasi moderat, 1B49 % memiliki tingkat regenerasi rendah dan 0 % tidak beregenerasi (Li, Huang & Bass 2003, Witarto & Desraini 2005).
'.)* '.+ *0)%+# *+ '* " (#
Sebagian eksplan cakram daun yang berumur 1 minggu, 2 minggu, dan 3 minggu diambil dan digerus dengan menggunakan pestle di dalam tabung mikro bersamaan dengan ditambahkan larutan bufer ekstraksi (100mM TrisBHCl pH 7.6 yang mengandung 20% gliserol, 5 % βBmerkaptoetanol, dan 4 % sodium dodesilsulfat) untuk dihomogenkan lalu disentrifus pada 15000 rpm dengan suhu 4 oC selama 20 menit. Supernatan yang diperoleh diambil dan dipindahkan ke dalam tabung mikro, kemudian disimpan dalam freezer (B20oC).
# !+.+. *0)%+# -%#, # !%')*070*%.+. 1
Pembuatan gel dilakukan dengan lebih dahulu menyiapkan cetakan gel berupa dua lembar kaca yang dipisahkan dengan spacer. Konsentrasi akrilamid yang digunakan adalah 10 %. Larutan untuk Resolving gel dimasukkan ke dalam cetakan gel sampai batas tertentu, kemudian ditambahkan etanol agar permukaan gel rata. Gel dibiarkan mengeras, lalu etanol 70 % yang berada di atas separating gel dibuang. Larutan untuk Stacking gelyang telah dibuat dimasukkan ke dalam cetakan yang telah dipasangi sisir pelubang dan dibiarkan mengeras. Sisir kemudian dilepaskan dengan gerakan vertikal ke atas. Gel telah siap digunakan dan dipasang pada alat elekroforesis.
Sampel hasil ekstraksi protein dipipet ke dalam tabung mikro dan ditambahkan loading buffer dengan perbandingan 4:1. Campuran tersebut kemudian dipanaskan dalam air mendidih selama 3B5 menit.
MasingBmasing sampel serta protein standar sebanyak 5 Ul dimasukkan ke dalam sumurBsumur yang terdapat pada gel. Alat elektroforesis dihubungkan ke power supply pada tegangan 110 V. Elektroforesis kemudian dilanjutkan selama kurang lebih 120 menit hingga pewarna mencapai ujung gel . Deteksi protein pada gel dilakukan dengan pewarnaan gel menggunakan larutan staining selama semalam. Kemudian gel dicuci sebanyak 1 kali dengan larutan destaning selama 30 menit. Gel kemudian dipanaskan dalam air (95 oC) hingga pita
protein terlihat dengan intensitas memadai. Penyimpanan gel dilakukan dengan melapisinya dengan plastik.
Identifikasi dan analisis pola SDSB PAGE dilakukan dengan pengamatan pemisahan pita proteinnya. Protein target ditentukan RfBnya, kemudian bobot molekul dari protein tersebut ditentukan berdasarkan kurva standar log BM terhadap Rf dari protein standar.
Dalam penelitian ini ada beberapa varietas tembakau lokal yang belum ada plantletnya sehingga harus ditumbuhkan terlebih dahulu dari bijinya di dalam media MS0 sehingga butuh waktu kurang lebih 6 minggu hingga plantletnya tersebut siap untuk dijadikan eksplan cakram daun.
Pada awal penelitian, banyak sekali cakram daun yang terkontaminasi bakteri dan cendawan sehingga penelitian harus diulangi lagi dengan hatiBhati. Untuk menghindari terjadinya kontaminasi maka alat dan bahan yang digunakan harus dipastikan steril, pengerjaannya juga harus steril misalnya saja dengan menggunakan sarung tangan yang sebelumnya diberikan alkohol atau dengan menggunakan masker. Selain itu, wadah inkubasi cakram daun sebaiknya jangan terlalu banyak disentuh atau dipindahkan karena plastik parafilm yang menyegelnya mudah terbuka.
Jumlah cakram daun tiap varietas yang digunakan adalah 5, karena jumlah ini sudah cukup untuk memperkecil deviasi standar walaupun pada penelitian Li, Huang, Bass (2003) digunakan 10 cakram daun. Inkubasi selama 7 minggu adalah waktu optimal untuk organogenesis tunas dari cakram daun berdasarkan hasil penelitian Li, Huang, Bass (2003) dengan pemindahan ke media baru yang sama setelah 3 minggu. Media induksi tunas yang digunakan adalah MS + 1 ppm BAP + 0.1 ppm NAA, media ini dapat menginduksi tunas secara optimal dari cakram daun varietas lokal yang telah dilakukan oleh Witarto & Desriani (2005).
$("! / (# .5 %*.%#) .% '* " (# 6 #, ("&(/ (# . - # %*.%#) .% ( . *% %*"(' # '* " (# 6 #,
("&(/ (# .
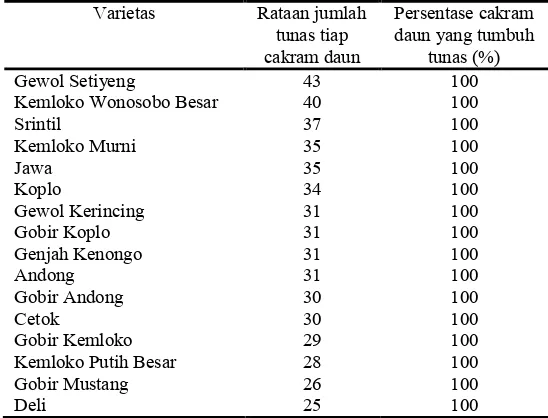
induksi tunas (MS + BAP 1 ppm + NAA 0.1 ppm) selama 7 minggu menunjukkan bahwa tiap cakram daun dari 16 varietas tersebut semuanya dapat tumbuh tunas (100%) dengan jumlah tunas rataan yang berbeda pada tiap varietas (Tabel 3).
Rataan jumlah tunas tiap cakram daun memiliki respon yang beragam dari tiap varietas. Rataan jumlah tunas di atas 40 terjadi pada 2 varietas, rataan jumlah tunas 30B40 terjadi pada 8 varietas, dan rataan jumlah tunas 20B30 terjadi pada 6 varietas. Dari keB16 varietas lokal tersebut varietas Gewol Setiyeng adalah varietas yang paling banyak memiliki rataan jumlah tunas tiap cakram daun berespon tunas, sedangkan varietas Deli adalah varietas yang paling sedikit membentuk tunas tiap cakram daun yang berespon tunas. Varietas Gewol Setiyeng berasal dari Jawa sedangkan varietas Deli berasal dari Sumatera, dengan demikian perbedaan habitat asal berpengaruh terhadap pembentukan tunas secara organogenesis.
Varietas lokal menurut Tjitrosoepomo (1994) merupakan spesies tabacum, pada penelitian Li, Huang, Bass di tahun 2003, spesies tabacum yang berasal dari Amerika Selatan dengan nomor aksesi PI 552432 dan PI 119208 memiliki potensi organogenesis yang tinggi karena memiliki persentase cakram daun yang tumbuh tunas sebesar 100%.
Hasil penelitian ini sesuai dengan persamaan yang dihasilkan dalam penelitian
yang dilakukan oleh Li, Huang, Bass (2003). Persamaan tersebut yaitu: jumlah tunas = 14.7825×(persentase)0.05×exp[–0.2455×(100– persentase)–2. Grafik yang dihasilkan oleh Li, Huang & Bass (2003) menunjukkan garis yang vertikal jika jumlah tunas yang dihasilkan lebih dari 20 tunas, dengan persentase sebesar 100%. Jika data dari penelitian ini dibuat grafik, maka grafik tersebut akan vertikal karena jumlah tunas yang dihasilkan di atas 20 tunas dan persentase cakram daun yang tumbuh tunas menujukkan nilai 100% semuanya (Gambar 8).
Perbedaan pada tembakau varietas lokal tersebut hanya terbatas pada jumlah tunas saja, namun di dalam pengamatan ternyata terdapat perbedaan antar varietas yang lain, yakni luas area permukaan yang tumbuh tunas pada tiap cakram daun berbeda (Gambar 9). Oleh karena itu, untuk melakukan studi potensi organogenesis dari sesama spesies Nicotiana tabacum, L digunakan parameter persentase luas area permukaan cakram daun yang tumbuh tunas dan jumlah tunas.
Witarto dan Desriani (2005) menggunakan kedua parameter ini untuk melihat potensi organogenesis 9 varietas tembakau lokal, didapat persamaan eksponensial dengan persamaan: jumlah tunas = 1.1814e0.0305 x persentase(R2= 0,828). Nilai R yang tinggi yaitu 0,828 menunujukkan bahwa kedua parameter tersebut dapat digunakan
Tabel 3 Jumlah tunas dan persentase cakram daun yang tumbuh tunas dari 16 varietas lokal tembakau setelah 7 minggu
Varietas Rataan jumlah
tunas tiap cakram daun
Persentase cakram daun yang tumbuh
tunas (%)
Gewol Setiyeng 43 100
Kemloko Wonosobo Besar 40 100
Srintil 37 100
Kemloko Murni 35 100
Jawa 35 100
Koplo 34 100
Gewol Kerincing 31 100
Gobir Koplo 31 100
Genjah Kenongo 31 100
Andong 31 100
Gobir Andong 30 100
Cetok 30 100
Gobir Kemloko 29 100
Kemloko Putih Besar 28 100
Gobir Mustang 26 100
untuk melakukan studi potensi organogenesis pada spesies Nicotiana tabacum dengan varietas yang berbedaBbeda.
Penelitian dilakukan dengan membandingkan luas area permukaan yang tumbuh tunas terhadap total luas area permukaan cakram daun, dan hasilnya dibuat dengan satuan persentase. Witarto dan Desriani (2005) juga mengelompokkan potensi organogenesis ke dalam 4 golongan berdasarkan persentase luas area ini, yaitu : beregenerasi tinggi (80B100 %), beregenerasi moderat (51B79 %), beregenerasi rendah (1B50 %) dan tidak beregenerasi (0 %).
Pada penelitian selama 7 minggu inkubasi didapatkan 7 varietas lokal yang tergolong tinggi potensi organogenesisnya (80B100%) dan 9 varietas lokal yang tergolong moderat (50B79%). Varietas Gewol Setiyeng memiliki persentase rataan yang paling tinggi (92%) di antara varietas lainnya sedangkan varietas Cetok memiliki persentase rataan yang paling rendah (56%), data selengkapnya ditampilkan pada Tabel 4.
Gambar 8 Grafik hubungan antara rataan jumlah tunas dengan persentase cakram daun yang tumbuh tunas (%).
Gambar 9 Perbandingan tunas yang terbentuk antara varietas Gewol Setiyeng dangan varietas Deli; tunas ditunjukkan dengan tanda panah, area cakram daun tidak tumbuh tunas ditandai dengan lingkaran.
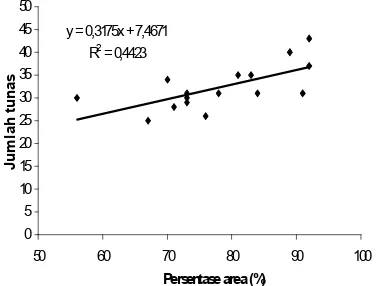
Persamaan grafik hubungan antara jumlah tunas dan persentase luas area permukaan cakram daun tumbuh tunas menunjukkan nilai R2 yang kecil sekali (0.4423), grafik ini tidak seperti apa yang telah didapatkan oleh Witarto dan Desriani (1995). Jika grafik ini dibuat eksponensial maka nilai R2 yang diperoleh lebih rendah yakni 0.4344. Untuk itu grafik hubungan antara keduanya dibuat dengan hubungan linear walaupun nilai R2yang diperoleh kecil sekali (Gambar 10).
Dari grafik tersebut titik yang paling atas dan yang paling kanan menunjukkan persentase dan jumlah tunas yang paling tinggi (varietas Gewol Setiyeng), titik yang paling bawah menunjukkan jumlah tunas yang paling rendah (varietas Deli), dan titik yang paling kiri menunjukkan persentase yang paling rendah (varietas Cetok).
Grafik yang memiliki nilai R2 kecil ini disebabkan karena faktor ukuran tunas yang berbeda selama inkubasi 7 minggu. Sebagai contoh adalah perbandingan varietas Deli (jumlah tunas terendah) dan varietas Cetok (persentase terendah). Walaupun jumlah tunas varietas Deli sangat sedikit namun varietas Deli memiliki ukuran tunas kecil dan sedang sehingga area tumbuh tunasnya agak sedikit besar dibandingkan varietas Cetok yang memiliki jumlah tunas selisih 5 tunas lebih banyak dari varietas Deli memiliki ukuran tunas yang sangat kecil dan sedikit sehingga terdapat area tumbuh tunas yang sempit.
[image:30.612.134.302.341.631.2] [image:30.612.339.527.464.607.2]# !+.+. *0)%+# '* " (#
Untuk analisis protein, perlu dibandingkan varietas dengan jumlah tunas yang berbeda nyata. Faktor jumlah tunas dipilih karena telah diketahui protein yang disandikan lebih banyak apabila jumlah tunasnya juga banyak. Protein tersebut adalah produk dari gen ESR1 (Enhancer of Shoot Regeneration 1) yang ekspresinya diinduksi oleh adanya sitokinin (Bannoet al. 2001).
Faktor yang lainnya yaitu persentase cakram daun yang tumbuh tunas tidak bisa digunakan untuk membedakannya mengingat semua varietas memiliki persentase 100%, sedangkan faktor persentase luas area permukaan yang tumbuh tunas belum dapat diketahui protein apa yang berhubungan dengannya.
Hasil analisis statistik rataan jumlah tunas tiap cakram daun dengan ANOVA tingkat kepercayaan 95% menunjukkan bahwa nilai F hitung sebesar 6,87 dengan peluang nyata sebesar 0,0001 (α=0.01). Dengan hasil tersebut maka dapat disimpulkan bahwa rataan jumlah tunas tiap cakram daun
dengan varietas yang berbeda adalah berbeda secara signifikan.
Uji Duncan sebagai uji lanjut untuk mengelompokkan varietas dengan rataan jumlah tunas tiap cakram daun menunjukkan bahwa terdapat 5 kelompok Duncan, varietas yang berada pada kelompok yang sama menunjukkan rataan jumlah tunas tiap cakram daun yang tidak berbeda secara signifikan (Tabel 5).
Varietas yang memiliki potensi organogenesis tinggi namun jumlah tunasnya menurut uji Duncan seperti pada varietas Genjah Kenongo yang memiliki persentase luas area tumbuh tunas 92% namun dalam kelompok Duncan tergolong kelompok C,D,E dapat dijelaskan karena varietas tersebut memiliki tunas yang kecil dengan ukuran cakram daun yang kecil juga.
Dari kelompokBkelompok tersebut diperoleh bahwa varietas Gewol Setiyeng dan varietas Deli memiliki perbedaan yang sangat signifikan, sehingga untuk analisis protein, digunakan 2 varietas ini, namun cakram daun yang dipilih adalah yang berumur 1 sampai 3 minggu, hal ini karena secara kasat mata dalam tempo 3 minggu sudah ada perbedaan yang signifikan terhadap respon
Tabel 4 Data persentase luas area cakram daun tumbuh tunas dari 16 varietas lokal setelah 7 minggu waktu inkubasi
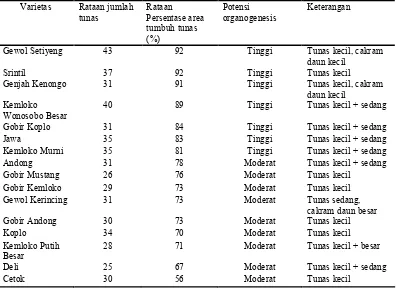
Varietas Rataan jumlah tunas Rataan Persentase area tumbuh tunas (%) Potensi organogenesis Keterangan
Gewol Setiyeng 43 92 Tinggi Tunas kecil, cakram
daun kecil
Srintil 37 92 Tinggi Tunas kecil
Genjah Kenongo 31 91 Tinggi Tunas kecil, cakram
daun kecil Kemloko
Wonosobo Besar
40 89 Tinggi Tunas kecil + sedang
Gobir Koplo 31 84 Tinggi Tunas kecil + sedang
Jawa 35 83 Tinggi Tunas kecil + sedang
Kemloko Murni 35 81 Tinggi Tunas kecil + sedang
Andong 31 78 Moderat Tunas kecil + sedang
Gobir Mustang 26 76 Moderat Tunas kecil
Gobir Kemloko 29 73 Moderat Tunas kecil
Gewol Kerincing 31 73 Moderat Tunas sedang,
cakram daun besar
Gobir Andong 30 73 Moderat Tunas kecil
Koplo 34 70 Moderat Tunas kecil
Kemloko Putih Besar
28 71 Moderat Tunas kecil + besar
Deli 25 67 Moderat Tunas kecil + sedang
[image:31.612.108.505.105.394.2]Tabel 5 Kelompok Duncan berdasarkan rataan jumlah tunas tiap cakram daun yang terbentuk
Varietas Rataan
jumlah tunas
Gewol Setiyeng 43.0a
Kemloko Wonosobo Besar 40.0a,b
Srintil 36.6b,c
Jawa 35.4b,c,d
Kemloko Murni 35.4b,c,d
Koplo 34.6b,c,d
Genjah Kenongo 31.2c,d,e
Gobir Koplo 31.2c,d,e
Andong 30.8c,d,e
Gewol Kerincing 30.7c,d,e
Cetok 30.4c,d,e
Gobir Andong 30.0d,e
Gobir Kemloko 29.0d,e
Kemloko Putih Besar 27.8e
Gobir Mustang 25.8e
Deli 24.8e
keterangan : huruf yang berbeda menyatakan perbedaan yang nyata.
organogenesis di antara varietas tersebut. Kemungkinan di tingkat molekuler juga terdapat perbedaan yang signifikan sehingga dijadikan landasan untuk pemilihan lama inkubasi untuk kepentingan analisis protein cakram daun sebagai respon terhadap lingkungan tumbuhnya.
Tunas sudah muncul dari cakram daun setelah 3 minggu. Dari minggu keB1 hingga minggu keB2 terlihat bahwa ukuran cakram daun membesar yang kemudian pada minggu keB3 muncul tunas dari sisiBsisi cakram daun tembakau (Gambar 11). Pembesaran dan pembentukan tunas ini merupakan respon cakram daun ketika diberi tambahan ZPT NAA dan BAP. NAA (Naphtalene Acetic Acid) merupakan auksin sintetik yang cara kerjanya sama dengan auksin alami. ZPT lainnya yakni BAP (Benziladenin Purine) merupakan sitokinin sintetik.
Auksin mempunyai efek membesarkan sel, hal tersebut berawal dari meningkatnya isi sel tetapi tidak diimbangi dengan peningkatkan dinding sel sehingga terjadi tekanan turgor dan hal ini akan mendorong kerja enzim selulase memotongBmotong selulosa pada dinding primer hingga dinding elastis dan sel membesar (Santoso & Nursandi 2003, Wattimena 1988).
Gambar 11 Perkembangan cakram daun. Tembakau varietas Gewol Setiyeng (atas) (a) minggu I, (b) minggu II, dan (c) minggu III dan Deli (bawah) (d) minggu keB1, (e) minggu keB2, dan (f) minggu keB3. Tunas ditunjukkan dengan lingkaran.
Selain membuat sel membesar, auksin juga mempengaruhi jenis protein yang terbentuk dan bekerja dengan sangat cepat. Seperti auksin, sitokinin juga dapat membesarkan sel dengan jalan mengganggu enzim tertentu di dalam dinding sel (Salisbury & Ross 1992). Namun, utamanya sitokinin berperan memacu pertumbuhan tunas dengan jalan pemacuan sitokinesis (pembelahan sel). Sitokinin mendorong pembelahan sel dalam biakan jaringan dengan cara meningkatkan peralihan dari G2 ke mitosis (Salisbury & Ross 1992).
Fase G2 merupakan fase pertumbuhan sel sesudah replikasi DNA, pada fase ini sel bersiap untuk membelah. Selain dengan meningkatkan peralihan dari G2 ke mitosis, sitokinin juga bekerja dengan cara meningkatkan kestabilan mRNA, dan karena itu mempercepat translasi pesan genetik mereka menjadi protein (Salisbury & Ross 1992).
Salah satu syarat terpenting yang harus
dimiliki suatu tanaman untuk
dikembangankan dalam usaha molecular farming adalah daya regenerasi dengan metode kultur jaringan, karena pada molecular farming digunakan metode kultur jaringan untuk percepatan mendapatkan bibit dengan jumlah besar dalam waktu sesingkatB singkatnya. Organogenesis tunas dari eksplan daun adalah yang umum digunakan baik dalam regenerasi maupun transformasi tembakau. Dari hasil ini, diketahui potensi organogenesis dari 16 varietas lokal yang ada di Indonesia, yang dapat dijadikan sebagai landasan untukmolecular farming.
[image:32.612.341.495.78.174.2] [image:32.612.137.307.122.363.2]namun telah diidentifikasi dan dikarakterisasi 2 tipe gen yang mengatur organogenesis tunas pada Arabidopsis. Tipe gen yang pertama mengendalikan pembentukan tunas dari selB sel yang belum terdiferensiasi, sebagai contoh adalah gen reseptor sitokinin CRE1. Gen tersebut menyandikan protein histidin kinase sehingga dapat memproduksi tunas (Inoueet al.2001, Ueguchiet al. 2001). Tipe gen kedua adalah yang mengendalikan jumlah tunas yang tumbuh, contohnya adalah gen
menyandikan faktor transkripsi terduga (36.2 kDa) dan jika ekspresinya berlebih maka dapat menginduksi tunas empat kali lebih banyak dari kultur akar dibandingkan dengan kontrolnya (Bannoet al. 2001).
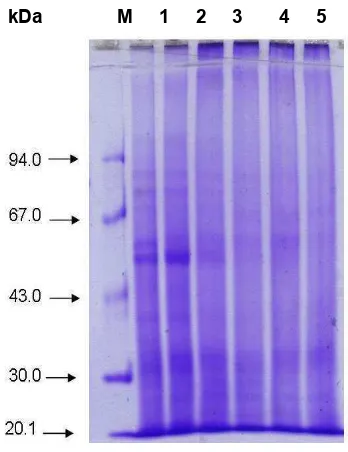
Hasil analisis total protein dengan SDSBPAGE menunjukkan pada minggu kedua dan ketiga, konsentrasi protein berkurang, karena selama inkubasi cakram daun menyerap air, sehingga mempengaruhi berat sampel saat akan dianalisis.
Urutan Sampel : M = Protein standar
1 = Total protein daun tembakau varietas Gewol Setiyeng minggu I
2 = Total protein daun tembakau varietas Gewol Setiyeng minggu II
3 = Total protein daun tembakau varietas Gewol Setiyeng minggu III
4 = Total protein daun tembakau varietas Deli minggu I 5 = Total protein daun tembakau varietas Deli minggu II 6 = Total protein daun tembakau varietas Deli minggu III
Gambar 12 Elektroforegram total protein pada cakram daun.
Analisis diulang kembali dengan mengencerkan sampel minggu I dari 0.6 % (v/v) menjadi 0.2 % (v/v). Hasilnya menunjukkan konsentrasi sampel minggu I hampir sama dengan sampel minggu II dan minggu III (Gambar 13).
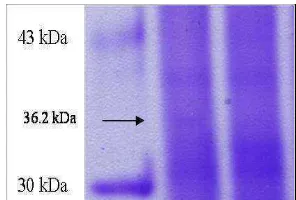
Hasil analisis protein ESR1 dengan SDSBPAGE ditunjukkan pada Gambar 14. Sampel pada minggu I antara varietas Gewol Setiyeng yang tumbuh tunas paling banyak dengan varietas Deli yang tumbuh tunas paling sedikit menunjukkan ketebalan pita daerah protein ESR1 (ditunjukkan dengan tanda panah) yang dimiliki varietas Gewol Setiyeng agak sedikit lebih tebal dibanding varietas Deli. Hasil ini lebih mendukung penyebab mengapa varietas Gewol Setiyeng dapat menumbuhkan tunas lebih banyak dibandingkan dengan varietas Deli.
Urutan Sampel : M = Protein standar
1= Total protein daun tembakau varietas Gewol Setiyeng minggu I
2= Total protein daun tembakau varietas Deli minggu I 3= Total protein daun tembakau varietas Gewol Setiyeng
minggu II
4= Total protein daun tembakau varietas Deli minggu II 5= Total protein daun tembakau varietas Gewol Setiyeng
minggu III
6= Total protein daun tembakau varietas Deli minggu III
[image:33.612.330.504.292.518.2]Gambar 14 Perbandingan pita protein terduga dari gen ESR1 pada varietas Gewol Setiyeng dengan varietas Deli. Urutan sampel dari kiri ke kanan adalah protein standar, varietas Gewol Setiyeng, varietas Deli, pita protein terduga dari gen ESR1 ditunjukkan dengan tanda panah.
Dari 16 varietas tembakau lokal, varietas Gewol Setiyeng menghasilkan persentase luas area permukaan yang tumbuh tunas paling tinggi yaitu 92 %, sedangkan varietas Cetok menghasilkan persentase luas area permukaan yang tumbuh tunas paling rendah yaitu 56 %. Varietas Gewol Setiyeng tergolong dengan jumlah tunas tertinggi (43 tunas) dan varietas Deli terendah (25 tunas).
Hubungan antara persentase luas area permukaan yang tumbuh tunas dengan jumlah tunas tiap cakram daun memiliki nilai R2=0.4423. Pada analisis protein, daerah yang menunjukkan pita protein terduga dari gen ESR1sedikit lebih tebal pada varietas Gewol Setiyeng. Saran untuk penelitian selanjutnya adalah perlu dilakukan penelitian potensi organogenesis terhadap varietas lokal lainnya yang belum diteliti.
Banno H, Ikeda Y, Niu QW, Chua NH. 2001. Over expression of Arabidopsis ESR1 induces initiation of shoot regeneration. Plant Cell13: 1609B1618.
Basuki S, Rochman F, Yulaikah S. 2000. Biologi tembakau temanggung. Di dalam: [Balittas] Balai Penelitian Tembakau dan Tanaman Serat. Tembakau Temanggung. Malang: Balittas.
Daniell H, Streatfield SJ, Wycoff K. 2001. Medical molecular farming: production of antibodies, biopharmaceuticals and edible vaccine in plants. Trends Plant Sci5:219B226.
Dixon RA. 1985. Isolation and maintenance of callus and cell suspension cultures. Di dalam: Dixon RA, editor.Plant Cell Culture A Practical Approach. Oxford: IRL Pr. hlm 1B4.
Durbin RD (ed). 1979.Nicotiana: procedures for experimental use.USDA Tech Bull 1586.
Fischer R, Emans N. 2000. Molecular farming of pharmaceutical proteins [Abstrak]. Transgenic Res9:279B299.
Fischer R, Hoffmann K, Schillberg S, Emans N. 2000. Antibody production by molecular farming in plants [Abstrak]. J Biol Regul Homeost Agents14:83B92.
Giddings G, Allison G, Brooks D, Carter A. 2000. Transgenic plants as factories for biopharmaceuticals. Nat Biotechnol 18:1151B1155.
Goodspeed TH. 1954. The Genus Nicotiana. Waltham, Mass: Chronica Botanica
Horsch RB. 1985. A simple and general method for transferring genes into plants [Abstrak]. Science 227:1229B 1231.
[image:34.612.145.293.78.178.2]Inoueet al. 2001. Identification ofCRE1as a cytokinin receptor from Arabidopsis [Abstrak].Nature409:1060B1063.
Kusnadi A, Nikolov ZL, Howard JA. 1997. Production of recombinant proteins in transgenic plants: practical considerations. Biotechnol Bioeng 56:473B484.
Li B, Huang W, Bass T. 2003. Shoot production per responsive leaf explant increases exponentially with explant organogenic potential in Nicotiana species.Plant Cell Rep22:231B238.
Maliga P. 2003. Progress towards commercialization of plastid transformation technology. Trends Biotechnol21:20B28.
Mattjik AA, Sumertajaya M. 2000. Perancangan Percobaan. Bogor: IPB Pr.
Napier R. 2004. Plant hormone binding site. Annals of Botany93:227B233.
Niesing B. 2001. Therapeutic drugs from tobacco. [terhubung berkala]. http://www.fraunhofer.de/fhg/archiv/m agazin/pflege.zv.fhg.de/english/publica tions/df/df2001/magazine2_2001_22.p df. [16 Maret 2006].
Pelczar MJ dan Chan ECS. 1986. Dasar! Dasar Mikrobiologi. Volume keB1. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL, penerjemah; Jakarta: UI Pr. Terjemahan dari: Elements of Microbiology.
Rochman F, Suwarso. 2000. Kultivar lokal temanggung dan usaha perbaikannya. Di dalam : [Balittas] Balai Penelitian Tembakau dan Tanaman Serat. Tembakau Temanggung. Malang : Balittas.
Salisbury FB, Ross CW. 1995. Fisiologi Tumbuhan. Volume keB3. Lukman DR, penerjemah; Bandung: ITB. Terjemahan dari:Plant Physiology.
Santoso U, Nursandi F. 2003.Kultur Jaringan Tanaman. Malang: UMM Pr.
Svab Z, Maliga P. 1993. High frequency plastid transformation in tobacco by selection for a chimeric aadA gene. Proc Natl Acad Sci USA90: 913B917.
Tisserat B. 1985. Embryogenesis, organogenesis and plant regenration. Di dalam: Dixon RA, editor. Plant Cell Culture A Practical Approach. Oxford: IRL Pr. hlm 79B105.
Tjitrosoepomo G. 1994. Taksonomi Tumbuhan Obat!Obatan. Yogyakarta: Gajah Mada University Pr.
Ueguchi C, Sato S, Kato T, Tabata S. 2001. The AHK4 gene involved in the cytokinin signaling pathway as a direct receptor molecule in Arabidopsis thaliana. Plant Physiol 42: 751B755. [Abstrak].
Wattimena GA. 1988. Zat Pengatur Tumbuh Tanaman. Bogor: PAU Bioteknologi IPB.
Witarto AB. 2005. Molecular farming pada tembakau, protein bernilai tinggi untuk terapetik dan diagnostik, human erythropoietindan sialidase. [terhubung berkala]. http://www.biodiversityB lipi.org/programmes/biotech/biotech_ar ief.html B 4k B. [30 Maret 2006].
Witarto AB, Desriani. 2005. Potensi organogenesis 9 tembakau varietas lokal. Di dalam: Laporan Kerja Tahunan Puslit Bioteknologi LIPI. Bogor: Puslit Bioteknologi LIPI
17
Lampiran 1 Komposisi larutan stok Media MS
1 Stok Hara Makro
Nama bahan
Konsentrasi akhir
(g/L)
Stok 20X dalam
1000 ml (g)
Pemakaian
NH
4NO
31.650
33.0
KNO
31.900
38.0
50 ml stok/liter media
MgSO
40.370
7.4
KH
2PO
40.170
3.4
CaCl
20.440
8.8
2 Stok Hara Mikro
Nama bahan
Konsentrasi akhir
(mg/L)
Stok 500X dalam 200
ml (mg)
Pemakaian
KI
0.830
83.0
H
3BO
36.200
620.0
MnSO
4.4H
2O
22.300
2230.0
2 ml stok/liter
media
ZnSO
4.7H
2O
8.600
860.0
Na
2MoO
4.2H
2O
0.250
25.0
CuSO
4.5H
2O
0.025
2.5
CoCl
2.6H
2O
0.025
2.5
3 Stok NaFeEDTA
Nama bahan
Konsentrasi akhir
(mg/L)
Stok 200X dalam
100 ml (mg)
Pemakaian
NaFeEDTA
36,700
734 mg
5 ml/liter
4 Stok Vitamin dan Asam Amino
Nama bahan
Kosentrasi akhir
(mg/L)
Stok 200X dalam
100 ml (mg)
Pemakaian
Asam nikotinat
0.5
10
5 ml stok/liter
media
Piridoksin HCl
0.5
10
Tiamin HCl
0.3
2
18
Lampiran 2 TahapBtahap kerja penelitian
diambil daun kedua atau ketiga dari pucuk
dipotong berukuran 0.5 cm x 0.5 cm
ditanam di media induksi tunas
2! #!%) )%"& ' (
- (# )%"& ' (
8 '* " - (#
2%"&%#)(' # )(# .
# !+.+. .) )+.)+'
%'.)* '.+ - # # !+.+.
19
Lampiran 3 TahapBtahap ekstraksi dan analisis protein
cakram daun (0.3 g) + bufer ekstraksi protein 0.6 ml
digerus
disentrifus 15000 rpm, 20 menit, 4
oC
Pelet (debris sel dan sel belum hancur)
Supernatan (protein larut air dan fraksi membran dengan protein membran)
Ekstrak protein 64 UL + loading bufer 16 UL
Dididihkan 5 menit
Sampel dipindahkan ke gel
Hubungkan ke alat elektroforesis dengan power supply 110 volt, diatur 30 mA,
selama 120 menit
Gel + pewarna (larutan staining)
Didiamkan 1 malam
Larutan staining diganti dengan larutan destaining
Didiamkan 30 menit
Larutan destaining dibuang, dan gel dipanaskan selama 60 menit untuk
menghilangkan warna yang tidak terikat protein.
20
Lampiran 4 Larutan stok SDSBPAGE
1.
30 % Akrilamid
29.2 g akrilamid + 0.8 g N’N’BbisBmetilenBakrilamid
Volume diatur hingga 100 ml, disimpan di tempat gelap, suhu 4
oC.
2.
1.5 M TrisBHCl (pH 8.8)
18.15 g basa Tris, pH diatur 8.8 dengan tambahan HCl.
Volume diatur hingga 100 ml, disimpan pada suhu 4
oC.
3.
0.5 M TrisBHCl (pH 6.8)
6.05 g basa Tris, pH diatur hingga 6.8 dengan tambahan HCl.
Volume diatur hingga 100 ml, disimpan pada suhu 4
oC.
4.
10 % SDS
10 g SDS dilarutkan dalam akuades hingga volumeya 100 ml.
5.
0.9 % APS (Ammonium Peroksida Sulfat)
0.09 g APS dilarutkan dalam 10 ml akuades, disimpan dalam 2 ml aliquot,
disimpan di freezer, dibiarkan mencair sebelum digunakan.
6.
TEMED
7.
Buffer elektroforesis stok 5x
15 g TrisBHCl + 72 g glisin + 5 g SDS.
Volume diatur hingga 1000 ml.
8.
Loading buffer stok 3x
3 ml TrisBHCl 0,5 M (pH 6.8)
+ 0.3 ml EDTA 0,2 M
+ 3 ml 10 % SDS
+ 0.3 ml βBmerkaptoetanol
+ 2.4 ml glisin
+ 3 ml akuades
9.
Larutan resolving buffer
10 ml TrisBHCl 1.5 M (pH 8.8)
+ 0.4 ml SDS dan akuades 12. 4 ml.
10. Larutan stacking buffer
8 ml TrisBHCl 0,5 M (pH 6.8)
21
Lampiran 5 Komposisi gel akrilamid 10 %
1.
Resolving gel
a. Resolving buffer
5.00 ml
b. Akrilamid 30%
4.00 ml
c. APS 0.9%
1.00 ml
d. TEMED
0.01 ml
Total
10.01 ml
2.
Stacking gel
a. Resolving buffer
1.456 ml
b. Akrilamid 30%
1.174 ml
c. APS 0.9%
0.300 ml
d. TEMED
0.004 ml
22
Lampiran 6 Data hasil uji RAL ANOVA
! " # $ % & ' (
) % % * +
, - % . /0) 1 2 & - (
1 ,3 1 14 14 3
5 3
" +$ 6 $ #7+ $6++$! " 7 6#+ 76777
8 7 7!"6! + +6! !!!!!!
/ +" #! 6 "+#$!+!
14 6 6 18 /0) 1
76 "+ 6##" !6 +! "$+" 6 $!+ #!
1 ,3 /9- 11 14 3 5 3
" +$ 6 $ #7+ $6++$! " 7 6#+ 76777
1 ,3 /9- 11 14 3 5 3
23
Lampiran 7 Data hasil uji Duncan
, : - / % . /0) 1
);/8. /& & 9- - < =
& >- <
-& * 767" * 7 18* +6! !!!
? ) ) . @ 4 6
@ * !6 " #"
) % ! " + # $
"6!$ "6+# "6$+ 6 7# 6 6 $# 6 + 6!
) % 7 ! "
6!+" 6" # 6"" 6"## 6 + 6 ! 6
< & & 9 6
, - )
! 6777 "
A !76777 " (
A
A 6 77 "
A
A , "6!77 " &
A ,
A , "6!77 " $
A ,
A , !6 77 "
,
8 , 6 77 " %
8 ,
8 , 6 77 " "
8 ,
8 , 76#77 "
8 ,
8 , 76 +
8 ,
8 , 76!77 "
8 ,
8 , 76777
8 ,
8 , $6777 " !
8
8 +6#77 " '
8
8 "6#77 "
8
24
Lampiran 8 Kurva protein standar SDS PAGE ulangan I
!"
# $% !" &
' ' ' '
' ' ' '
' ' ' '
' ' ' '
' ' ' '
( '
'
'
'
'
'
25
Lampiran 9 Kurva protein standar SDS PAGE ulangan II
!"
# $% !" &
' ' '
' ' '
' ' ' '
' ' ' '
' ' ' '
( ' '
'
' ' '
26
Lampiran 10 Data jumlah tunas dari 16 varietas lokal tembakau
Varietas
Minggu I
Minggu III
Minggu VII
Keterangan
ulangan
jumlah tunas
ulangan
jumlah tunas
ulangan jumlah
tunas
Gobir
Andong
0,0,0,0,0
3,3,2
30,34,26
2 cakram daun
terkontaminasi
Gewol
Setiyeng
0,0,0,0,0
4,4,2,4,3
47,40,45,40,43
Gewol
Kerincing
0,0,0,0,0
6,5,1
32,34,26
2 cakram daun
terkontaminasi
Gobir
Kemloko
0,0,0,0,0
2,3,2,3,4
20,34,30,26,35
Gobir
Koplo
0,0,0,0,0
3,2,1,3,3
29,39,26,27,35
Gobir
Mustang
0,0,0,0,0
3,0,1,1,1
19,27,24,27,32
Deli
0,0,0,0,0
1,3,2,0,0
28,27,22,23,24
Jawa
0,0,0,0,0
2,1,5,5,4
34,39,35,37,32
Genjah
Kenongo
0,0,0,0,0
2,3,3,7,6
34,30,31,30,31
Cetok
0,0,0,0,0
3,4,2,4,2
33,29,36,34,20
Koplo
0,0,0,0,0
3,4,2,2,4
39,36,30,35,33
Srintil
0,0,0,0,0
2,5,4,3,2
33,38,42,35,35
Kemloko
Murni
0,0,0,0,0
5,4,5,5,7
38,35,34,34,36
Kemloko
Putih Besar
0,0,0,0,0
2,4,3,1,2
16,32,28,31,32
Kemloko
Wonosobo
Besar
0,0,0,0,0
3,2,5,6,6
40,38,42,41,39