KARAKTERISASI DAN UJI AKTIVITAS SELULOTIK
KAPANG ENDOFIT MAKROALGA (
Sargassum
sp,
Gracilaria
sp,
Caulerpa
sp dan
Gelidium
sp) DI HABITAT LAMUN
PULAU PARI, KEPULAUAN SERIBU
AMI SHAUMI
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PERLIMPAHAN HAK CIPTA
Saya menyatakan bahwa skripsi berjudul Karakterisasi dan Uji Aktivitas Selulotik Kapang Endofit Makroalga (Sargassum Sp, Gracilaria Sp, Caulerpa Sp dan Gelidium Sp) di Habitat Lamun Pulau Pari, Kepulauan Seribu adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2014
ABSTRAK
AMI SHAUMI. Karakterisasi dan Uji Aktivitas Kapang Endofit Makroalga (Sargassum sp, Gracilaria sp, Caulerpa sp dan Gelidium sp) di Habitat Lamun Pulau Pari, Kepulauan Seribu. Dibimbing oleh MUJIZAT KAWAROE dan ADRIANI SUNUDDIN.
Makroalga merupakan salah satu sumber bahan baku energi untuk bioetanol yang memiliki potensi untuk dikembangkan sebagai energi alternatif yang bersifat terbarukan. Bioetanol merupakan produk fermentasi karbohidrat yang memerlukan kapang untuk menghasilkan enzim perombak selulosa kompleks menjadi bentuk yang lebih sederhana. Tujuan penelitian ini adalah mengetahui keanekaragaman kapang endofit yang berasosiasi dengan makroalga yang hidup di habitat lamun Pulau Pari, Kepulauan Seribu, serta mengukur aktivitas selulotik kapang endofit tersebut. Sebanyak 21 isolat kapang telah diisolasi dari empat jenis makroalga, diantaranya Sargassum sp, Caulerpa sp,
Gracilaria sp dan Gelidium sp. Kapang tersebut diisolasi pada media CMC (Carboxy Methyl Cellulose), pewarnaan congo red, dan untuk perhitungan aktivitas enzim menggunakan metode Milles. Nilai indeks selulotik tertinggi diperoleh dari Aspergillus westerdijkial isolat dari Caulerpa sp (PCLAR 6). Aktivitas selulase untuk Aspergillus versicolor dan Aspergilus sydowii optimum pada hari ke-2 sedangkan Penicillium citrinum dan Aspergillus westerdijkial
optimum pada hari ke-1. Aspergillus versicolor dan Aspergillus sydowii
ABSTRACT
AMI SHAUMI.Characterization and Test Cellulolytic Activity of Endophyte Molds Associted with Macroalgae (Sargassum sp, Gracilaria sp, Caulerpa sp dan
Gelidium sp) in Seagrass Habitats of Pari Island, Kepulauan Seribu. Under direction of by MUJIZAT KAWAROE and ADRIANI SUNUDDIN.
Macroalgae is one source of raw materials for bioethanol which has good potency to be developed as renewable energy. Bioethanol is a fermented product of carbohydrates that requires molds to produce enzym in breaking down complex cellulose into more simple form. The aims of this research were (1) to explore diversity endophytic molds associated with macroalgae living in seagrass habitats of Pari Island, Kepulauan Seribu ; (2) to measure cellulolytic activity of endophytic molds. A total of 21 isolates molds were isolated from four species of macroalgae, namely Sargassum sp, Gracilaria sp, Caulerpa sp, and Gelidium sp. Molds were isolated using CMC (Carboxy Methyl Cellulose) media, stained using red congo, and enzymatic activities were measured according to Milles method. The highest value of cellulolytic index was observed for Aspergillus westerdijkial
isolated from Caulerpa sp (PCLAR 6). Cellulolytic activity of Aspergillus versicolor and Aspergillus sydowii showed optimum performance on day-2,
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Ilmu Kelautan
pada
Departemen Ilmu dan Teknologi Kelautan
KARAKTERISASI DAN UJI AKTIVITAS SELULOTIK
KAPANG ENDOFIT MAKROALGA(
Sargassum
sp,
Gracilaria
sp,
Caulerpa
sp dan
Gelidium
sp) DI HABITAT LAMUN
PULAU PARI, KEPULAUAN SERIBU
AMI SHAUMI
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Karakterisasi dan Uji Aktivitas Selulotik Kapang Endofit Makroalga (Sargassum sp, Gracilaria sp, Caulerpa sp dan
Gelidium sp) di Habitat Lamun Pulau Pari, Kepulauan Seribu Nama : Ami Shaumi
NIM : C54090051
Disetujui oleh
Dr. Ir. Mujizat Kawaroe, M.Si Pembimbing I
Adriani Sunuddin, S.Pi, M.Si Pembimbing II
Diketahui oleh
Dr. Ir. I Wayan Nurjaya, M.Sc Ketua Departemen
PRAKATA
Puji syukur kehadirat Allah SWT yang telah memberikan rahmat serta hidayah-Nya sehingga penyusunan skripsi yang berjudul berjudul Karakterisasi dan Uji Aktivitas Selulotik Kapang Endofit Makroalga (Sargassum Sp, Gracilaria
Sp, Caulerpa Sp dan Gelidium Sp) di Habitat Lamun Pulau Pari, Kepulauan Seribu dapat diselesaikan. Skripsi disusun dalam rangka memenuhi salah satu syarat untuk menyelesaikan studi di Departemen Ilmu dan Teknologi Kelautan, Institut Pertanian Bogor.
Pada kesempatan ini, penulis mengucapkan terima kasih kepada semua pihak yang telah membantu dalam penulisan dan penyusunan skripsi ini, terutama kepada :
1. Ibu Dr Ir Mujizat Kawaroe, M.Si dan Ibu Adriani Sunuddin, S.Pi, M.Si, selaku pembimbing
2. Ibu, Ayah, Mia serta seluruh keluarga atas segala doa dan kasih sayangnya, 3. Mba Indah dari Labolatorium Surfactant and Bioenergy Reseacrh Center
4. Kak Afny, Bertoka dan Krisye atas bantuannya selama proses penelitian 5. Crazier ITK 46 dan penghuni Asrama Putri Darmaga atas semangat dan
dukungannya dalam menyelesaikan penelitian ini
7. Semua pihak yang tidak dapat penulis sebutkan satu persatu
Kritik dan saran yang membangun sangat diharapkan untuk perbaikan di masa depan. Semoga karya ilmiah ini bermanfaat.
Bogor, Juni 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
METODE 2
Waktu dan Lokasi Penelitian 2
Bahan 2
Alat 2
Prosedur Penelitian 2
HASIL DAN PEMBAHASAN 5
Spesies Kapang Endofit rumput Laut 5
Aktivitas Selulase Kualitatif Isolat Kapang 6
Waktu Optimum Produksi Enzim Selulase 7
Karakteristik Enzim Selulase 10
SIMPULAN DAN SARAN 11
DAFTAR PUSTAKA 12
DAFTAR TABEL
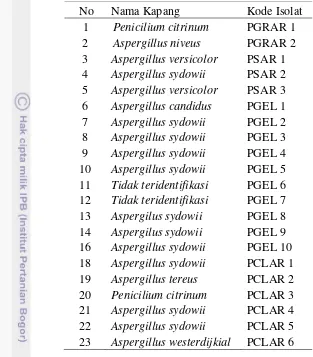
1 Jenis kapang endofit makroalga 6
DAFTAR GAMBAR
1 Kurva standar glukosa 4
2 Nilai indeks selulotik kapang 7
3 Pertumbuhan isolat kapang 8
4 Kurva aktivitas enzim selulase 9
5 Pengaruh pH terhadap aktivitas enzim selulase 11
6 Pengaruh suhu terhadap aktivitas selulase 11
DAFTAR LAMPIRAN
1 Nilai indeks selulotik kapang 14
2 Aktivitas selulase kapang 15
3 Kurva standar glukosa 17
4 Komposisi media CMC 1 % dalam 1 liter air laut 17
5 Komposisi reagen DNS 18
6 Nilai laju pertumbuhan kapang 18
7 Nilai aktivitas enzim selulase 18
8 Nilai aktivitas enzim pH optimum 19
PENDAHULUAN
Latar Belakang
Lamun merupakan suatu habitat yang memiliki keanekaragaman hayati yang cukup tinggi. Hal ini dapat dilihat dari banyaknya organisme laut yang berasosiasi di habitat lamun. Habitat lamun memberikan tempat hidup dan tempat berlindung untuk sejumlah organisme laut tersebut. Salah satu organisme laut yang hidup di habitat lamun adalah makroalga (rumput laut). Makroalga termasuk salah satu sumberdaya hayati laut yang banyak terdapat diperairan Indonesia. Makroalga memiliki potensi besar untuk dikembangkan, karena memiliki peranan penting baik dari segi ekologis maupun ekonomis. Saat ini makroalga dapat digunakan sebagai sumber bahan baku energi atau bahan baku bioetanol. Bioetanol merupakan salah satu pengembangan energi alternatif yang bersifat terbarukan. Bioetanol memiliki efisiensi energi yang lebih tinggi dibandingkan dengan minyak bumi. Selain itu bioetanol juga bersifat lebih ramah lingkungan. Bioetanol merupakan produk fermentasi yang dapat dibuat dari substrat yang mengandung karbohidrat (gula, pati, atau selulosa). Selulosa merupakan polisakarida melimpah di bumi yang dapat diubah menjadi glukosa dengan cara hidrolisis (Xin et al. 2010). Selulosa adalah komponen utama penyusun dinding sel tumbuhan dan merupakan biopolimer yang jumlahnya paling melimpah di alam (Perez et al. 2002). Selulosa di alam biasa didegradasi oleh serangga, cacing tanah, cendawan dan bakteri. Kapang merupakan dekomposer selulosa yang umum ditemukan. Kapang yang mampu menguraikan selulosa berasal dari kelompok Ascomycota, Basidiomycota, Zigomycota, dan Deuteromycota (Moore-Landecker 1996). Kapang mendegradasi selulosa menjadi monomernya dengan memproduksi enzim ekstraselular yaitu selulase (Saczi et al. 1986; Ling Lin et al.
2002; Perez et al. 2002).
Enzim selulase mampu menghidrolis selulosa menjadi gula sederhana atau glukosa serta dapat digunakan pada proses pembuatan bioetanol. Produksi bioetanol memerlukan glukosa sebagai substrat fermentasi. Sumber glukosa yang paling murah adalah dari pemecahan selulosa. Selulosa yang tersedia berlimpah di alam sangat potensial dipakai sebagai bahan baku untuk produksi etanol. Selulosa di hidrolisis menjadi monosakrida, disakarida dan oligosakarida dengan menggunakan cara kiawi dan hayati. Hidrolisis dengan cara kimiawi dengan menggunakan asam kuat sedangkan dengan cara hayati dapat menggunkan enzim murni atau mikroorganisme penghasil enzim selulase (Hardjo et al. 1989). Selama ini proses hidrolisis yang dilakukan untuk merubah bahan baku bioethanol menjadi gula sederhana dilakukan secara asam, namun hidrolisis dengan menggunakan asam memiliki beberapa kekurangan diantaranya biaya yang dikeluarkan relatif mahal, monosakarida yang dihasilkan rendah, proses yang dilakukan cukup panjang, dan penangan limbah asam yang tidak mudah (Hardjo
2
Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk :
1.Mengetahui beberapa jenis kapang yang ada dari beberapa makroalga
2.Mengetahui kemampuan aktivitas selulotik dari kapang-kapang tersebut secara kualitatif dan kuantitatif.
3.Mengetahui karakteristik enzim yang optimal untuk menghidrolisis selulase
METODE
Waktu dan Lokasi Penelitian
Penelitian ini dilaksanakan pada bulan Maret 2013 hingga Januari 2014, bertempat di Pulau Pari, Kepulauan Seribu, Laboratorium Surfactant and Bioenergy Reseacrh Center (SBRC) Lembaga Penelitian dan Pengabdian Masyarakat (LPPM) Institut Pertanian Bogor dan Laboratory Marine Bioprospecting, Departemen ITK, FPIK-IPB.
Bahan
Bahan yang digunakan pada penelitian ini adalah air laut steril, makroalga, media Potato Dextrose Agar (PDA), Media CMC 1 %, Alkohol, Congo red 0.1 %, isolat kapang, reagen DNS (Dinistrosalisilat).
Alat
Alat yang digunakan pada penelitian ini adalah cutter/pisau, tabung erlemeyer, pinset streril, cawan petri, jarum ose, autoklaf, inkubator, penanggas goyang, sentifuge, spektrofotometer, shaker, water bath, laminar airflow, vortexs dan peralatan umum di laboratorium SBRC.
Prosedur Penelitian
Isolasi Kapang
Pengisolasian kapang yang terdapat pada makroalga dilakukan dengan tahapan kerja sebagai berikut: Sampel makroalga dicuci dengan menggunakan air laut steril, kemudian dipotong-potong berukuran 1 cm X 1 cm. Selanjutnya sampel diletakkan di atas cawan petri yang berisi media Potato Dextrose Agar (PDA) Chloramphenicol. Kapang selanjutnya diinkubasi pada suhu ruang selama 3-7 hari.
Pemurnian dan Identifikasi Kapang
3 baik selanjutnya dipilih dan ditanam kembali dalam cawan petri baru sebanyak dua kali ulangan. Isolat kapang yang telah murni kemudian diamati untuk proses identifikasi. Identifikasi dilakukan di Laboratory SEAMEO BIOTROP.
Aktivitas Selulase Secara Kualitatif
Uji aktivitas selulotik dilakukan secara kualitatif . Uji kualitatif dilakukan dengan metode pewarnaan merah kongo 0.1%. Isolat kapang ditotolkan pada media agar-agar CMC 1% (Lampiran 1). Kapang diinkubasi selama 5 hari pada suhu ruang, kemudian dilakukan uji aktivitas selulotik dengan menambahkan merah kongo sebanyak 15 ml dan didiamkan selama 30-60 menit. Diameter zona bening dan diameter koloni yang terbentuk diukur. Pengukuran diameter zona bening dan diameter koloni dilakukan 3 kali ulangan dengan. Uji aktivitas selulase dilihat dari indeks selulase yang terbentuk. Indeks selulase merupakan nisbah antara diameter zona bening dengan diameter koloni. Semakin besar indeks selulotik yang dihasilkan maka semakin besar enzim yang dihasilkan oleh isolat kapang tersebut. Indeks selulotik atau aktivitas selulase (IAS) diperoleh dengan menggunakan rumus sebagai berikut (Kader dan Oman 1998) :
IS
Dimana :Penentuan Waktu Optimum Produksi Enzim Selulase
Penentuan waktu optimum produksi enzim selulase diawali dengan penentuan waktu penuangan inokulum. Hal ini dilakukan agar dapat diketahui waktu pertumbuhan eksponensial kapang pada inokulum yang akan digunakan. Penentuan waktu inokulum dilakukan dengan mengkultur 4 lup isolat yang terpilih pada aktivitas selulase secara kualitatif didalam 50 mL PDL (Potato Dextrose Liquid ). Kultur diinkubasi pada suhu ruang di dalam penanggas goyang dengan kecepatan agitasi 150 rpm. Pengambilan sampel dilakukan setiap hari selama 5 hari dengan rentang waktu sampling 24 jam untuk diukur kepadatan spora. Setelah itu dibuat kurva pertumbuhan kapang untuk menentukan waktu yang terbaik pada penuangan inokulum media produksi. Setelah waktu penuangan inokulum dalam media produksi diketahui, dilanjutkan dengan penentuan waktu optimum aktivitas enzim selulase. Sebanyak 10 mL kaldu nutrien yang telah mengandung biakan sel diinokulasikan pada media PDL. Inokulum tersebut di tuang kedalam media cair CMC 1% sebanyak 90 mL. Sampel disimpan di dalam
water bath pada suhu 50 0C. Kemudian sebanyak 3 mL filtrat diambil setiap hari untuk diambil ekstrak kasar enzimnya. Ekstrak kasar enzim diperoleh, dengan mensentrifugasi filtrat hasil kultur pada kecepatan 4000 g selama 15 menit dalam suhu ruang. Kemudian diambil larutan supernatan sebanyak 1 mL Aktivitas selulase harian ditetapkan berdasarkan metode Miller 1959 dengan cara mencampurkan 1 mL ekstrak kasar enzim dalam 1 ml CMC cair. Kemudian ke dalam campuran tersebut ditambahkan 3 ml DNS, dikocok kuat dengan vortex, selanjutnya diinkubasi pada suhu 100 0C selama 25 menit. Setelah larutan dingin
IS = Indeks Selulotik
4
absorbansi diukur pada panjang gelombang 550 nm. Produksi optimum enzim ditetapkan berdasarkan aktivitas selulase tertinggi pada periode inkubasi.
Aktivitas selulase dinyatakan dalam satuan internasional yaitu U/mL. Satu unit merupakan jumlah enzim yang dibutuhkan untuk memecah I µmol selulosa menjadi gula pereduksi per menit pada kondisi pengujian. Kadar glukosa yang dihasilkan dari hidrolisis selulosa dengan enzim selulase berdasarkan absorbansi pada panjang gelombang 575 nm.
Abs = (As-Ab) Dimana :
Nilai absorbansi yang diperoleh kemudian dimasukan kedalam persamaan yang diperoleh dari kurva standar glukosa. Hasil dari persamaan tersebut adalah nilai kadar glukosa yang diperoleh. Gambar 1 adalah kurva standar glukosa dan persamaan kadar glukosa.
Gambar 1. Kurva Standar Glukosa Persamaan kadar glukosa adalah y= 0.002x – 0,166 Dimana y = Absorbansi sampel
x = Kadar glukosa
Nilai kadar glukosa yang diperoleh dapat dimasukan kedalam rumus aktivitas enzim selulase. Aktivitas selulase dihitung berdasarkan rumus sebagai berikut (Irawan et al. 2008) yang dimodifikasi.
5 Dimana :
ProduksiEnzim Kasar
Produksi enzim selulase dilakukan berdasarkan prosedur dan waktu inkubasi yang telah diketahui aktivitas selulase tertinggi dan waktu inkubasi yang telah diketahui aktivitas selulase tertinggi pada kurva aktivitas selulase yang dihasilkan. Media pertumbuhan produksi di inkubasi pada suhu 50 0C di dalam penanggas goyang dengan kecepatan agitasi 150 rpm, kemudian enzim selulase di panen selama waktu produksi tertinggi yang telah didapatkan sebelumnya. Kultur sel pada media produksi yang mengandung enzim selulase ekstrakseluler di sentifugasi pada kecepatan 10.000 x g selama 15 menit untuk memisahkan larutan enzim. Supernatan hasil sentrifugasi kemudian disimpan pada suhu 10 0C sebagai ekstrak enzim kasar.
Karakterisasi Enzim Selulase
pH optimum. Pengaruh pH terhadap aktivitas enzim diuji dengan menambahkan 0.2 mL enzim yang direaksikan dengan 1,8 mL substrat. Substrat dibuat dengan mencampurkan CMC kedalam buffer dengan berbagai tingkatan pH 3,4,5,6,7,8 dan 9. Masing-masing enzim diinkubasi pada suhu 30 0C selama 30 menit. Aktivitas enzim selulase diukur sesuai dengan prosedur pengujian sebelumnya.
Suhu Optimum. Pengaruh suhu terhadap aktivitas enzim dilakukan dengan mereaksikan 0.2 mL enzim dengan 1,8 mL substrat dimana substrat dibuat dengan mencampurkan 1,8 g CMC dalam buffer pH optimum. Enzim yang telah dicampurkan dengan substrat kemudian diinkubasi pada tingkatan suhu antara 30-90 0C dengan selang 10 0C selama 30 menit waktu inkubasi. Aktivitas enzim selulase diukur sesuai dengan prosedur pengujian sebelumnya.
HASIL DAN PEMBAHASAN
Spesies Kapang Endofit Makroalga
Hasil isolasi dan identifikasi kapang dari beberapa endofit rumput laut diantaranya Gracilaria sp, Sargassum sp, Gelidium sp dan Caulerpa sp memiliki 21 isolat. Jenis kapang yang dihasilkan sebagian besar terdapat dari genus
Aspergillus serta terdapat satu isolat dari genus Penicillium.
Kapang endofit makroalga merupakan kapang yang berasal dari dalam jaringan makroalga. Hasil identifikasi menunjukan bahwa genus dari Aspergillus
banyak terdapat dalam endofit makroalga. Selain itu didapatkan satu genus
Penicilium sp dari isolat Gracilaria sp. Terdapat tiga isolat yang tidak teridentifikasi jenis kapangnya karena morfologi tidak diketahui dengan jelas. Semua isolat yang ditumbuhkan pada media agar CMC 1% membentuk zona bening setelah diberi pewarna merah congo red (Lampiran 1).
v = volume enzim (1 mL) t = waktu inkubasi (30 menit)
6
Tabel 1. Jenis kapang yang dihasilkan dari beberapa makroalga No Nama Kapang Kode Isolat Aktivitas selulase kualitatif beberapa isolat
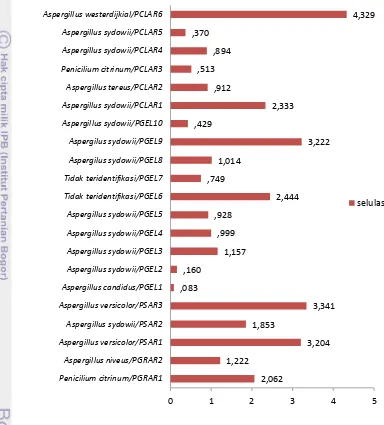
7 terhambatnya proses degradasi selulosa (Hankin dan Anagostakis 1997). Zverlova
et al. (2003) menyatakan bahwa diameter zona bening umumnya berukuran lebih besar dibandingkan diameter koloni, karena enzim selulase disekresikan ke lingkungan atau media di sekeliling koloni kapang untuk mendegradasi selulosa (Lampiran 1).
Gambar 2. Nilai Indeks Selulotik Kapang Waktu Optimum Produksi Enzim Selulase
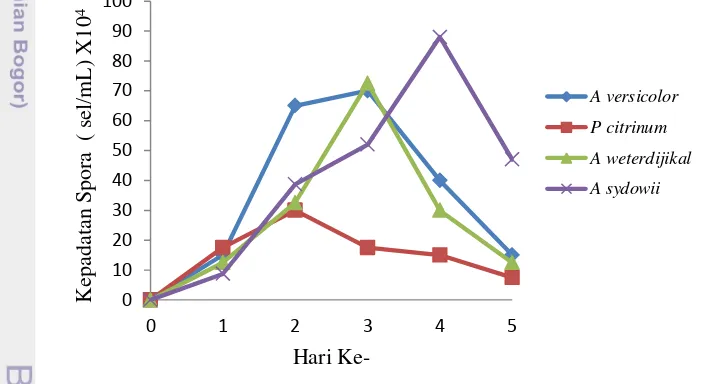
Pertumbuhan kapang dilihat dari nilai kepadatan sel spora yang diukur setiap hari selama 5 hari dengan (Gambar 2). Isolat kapang Sargassum sp (PSAR3/Aspergillus versicolor) mengalami peningkatan kepadatan kapang atau mengalami fase eksponensial, pada hari ke-2 dan ke-3 dengan jumlah sebesar 70 x 104 sel/mL. Pada hari ke-4 dan 5 pertumbuhan kapang A. versicolor mengalami fase penurunan. Isolat kapang dari Gracilaria sp (PGRAR1/Penicillium citrinum) mulai mengalami peningkatan pertumbuhan pada hari ke-2 (30 x 104 sel/mL), kemudian pada hari ke-3 dan 5 mengalami penurunan. Isolat kapang Caulerpa sp
8
(PCLAR6/Aspergillus westerdjikal) mengalami peningkatan pertumbuhan kapang (fase eksponensial) pada hari ke-2 sampai hari ke-3 dengan jumlah sel tertingi sebesar 72,5 x 104 sel/mL. Isolat kapang dari Gelidum sp (PGEL9/Apergillus sydowii) mulai mengalami peningkatan pertumbuhan, pada hari ke-2 sampai hari ke-4 dengan jumlah sel tertingi sebesar 88 x 104 sel/mL. Kapang Aspergillus sydowii (PGEL9) yang diisolasikan dari makroalga Gelidium sp memiliki kepadatan sel spora tertinggi dibandingkan jenis lainnya yaitu 88 x 104 sel/mL (Gambar 2).
Menurut Fardiaz (1992) kapang yang diinokulasikan ke dalam suatu media, mula-mula akan mengalami fase adaptasi untuk menyesuaikan diri dengan media dan kondisi lingkungan sekitarnya. Pada fase ini belum terjadi pembelahan sel karena beberapa enzim belum disintesa. Fase selanjutnya adalah pertumbuhan awal, sel mulai membelah dengan kecepatan yang masih rendah karena baru selesai tahap penyesuaian diri. Pertumbuhan eksponensial terjadi ketika inokulum mengalami pertumbuhan dan perkembangbiakan yang cepat sampai dicapai pertumbuhan lambat. Pertumbuhan lambat disebabkan berkurangnya zat nutrisi di dalam media dan adanya hasil metabolisme yang dapat menghambat pertumbuhan. Fase berikutnya adalah pertumbuhan statis, Jumlah sel pada fase ini tetap. Bila inkubasi dilanjutkan pada fase ini tidak akan menambah jumlah sel, melainkan jumlah sel hidup akan berkurang serta adanya lisis atau pecahnya sel karena kerja suatu antibodi, yang menyebabkan massa sel menurun sampai terjadi kematian.
Gambar 3. Kurva Pertumbuhan Isolat Kapang
Pertumbuhan kapang pada fase optimum dari setiap kapang digunakan sebagai penentuan waktu terbaik untuk penuangan media inokulum ke media produksi. Hal ini dilakukan agar isolat kapang memiliki jumlah spora optimum, sehingga pada saat di panen pada media produksi enzim selulase dapat menghasilkan jumlah enzim kasar yang lebih banyak. Isolat kapang dari
Sargassum sp/Aspergillus versicolor yaitu optimum pada hari ke-2, Gracilaria
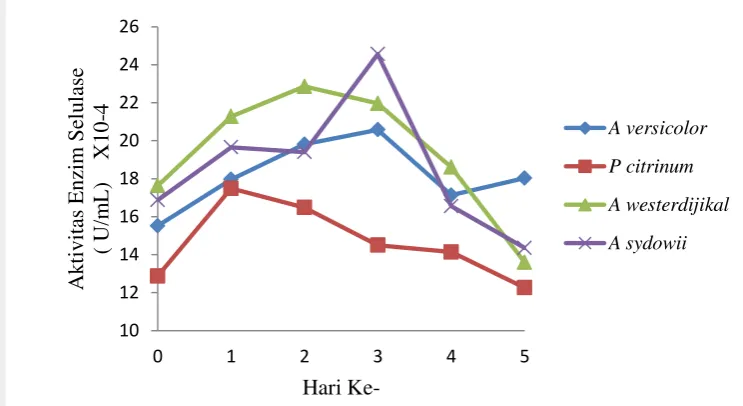
9 Aktivitas Enzim Selulase
Aktivitas enzim selulase (CMC-ase) dari empat isolat kapang terpilih memiliki nilai bervariasi (Gambar 3). Caulerpa sp (PCLAR6) dengan jenis kapang Aspergillus westerdjikal memiliki aktivitas enzim tertinggi yaitu pada hari ke-2 dengan nilai aktivitas enzim selulase sebesar22,860X10-4 U/mL, isolat dari
Gracillaria sp (PGRAR1) dengan jenis kapang Penicillium citrinum memiliki nilai aktivitas enzim tertinggi pada hari ke-1 dengan nilai aktivitas enzim selulase sebesar 17,489X10-4 U/mL, isolat dari Gelidium sp (PGEL9) dengan jenis kapang
Aspergillus sydowii memiliki nilai aktivitas enzim tertinggi pada hari ke-3 dengan nilai aktivitas enzim selulase sebesar 24,554X10-4 U/mL dan isolat dari
Sargassum sp (PSAR3) dengan jenis kapang Aspergillus versicolor memiliki nilai aktivitas enzim tertinggi pada hari ke-3 dengan nilai aktivitas enzim selulase sebesar 20,575X10-4 U/mL.
Gambar 4. Kurva Aktivitas Enzim Selulase
Penentuan waktu optimum produksi enzim selulase dilakukan dengan menentukan besarnya aktivitas enzim selulase dengan selang 1 hari selama 5 hari. Waktu optimum dari masing-masing kapang digunakan untuk memanen spora kapang tersebut karena dalam keadaan ini merupakan keadaan yang efektif, dilihat dari segi waktu dan jumlah spora. Isolat kapang dari Sargassum sp/Aspergillus versicolor yaitu optimum pada hari ke-2, Gracilaria sp/Penicillium citrinum
yaitu pada hari ke-1, Caulerpa sp/Aspergillus westerdijikal yaitu pada hari ke-1 dan Gelidium sp/Aspergillus sydowii pada hari ke-2. Fardiaz (1992) menjelaskan bahwa produksi enzim dalam suatu bioproses memerlukan beberapa faktor, antara lain jenis mikroba, kurva pertumbuhan dan kondisi optimum untuk meningkatkan aktivitas enzim. Nilai aktivitas enzim selulase mengindikasikan besarnya laju degradasi CMC menjadi glukosa. Kultur inokulum yang diinokulasikan ke media CMC berasal dari kurva pertumbuhan sebelumnya. Setelah mencapai hari maksimum pada masing-masing isolat kemudian semua isolat mengalami penurunan produksi aktivitas enzim selulase. Hal ini mungkin disebabkan oleh keberadaan glukosa dalam jumlah waktu tertentu sebagai produk akhir pemecahan selulosa yang dapat menjadi inhibitor alosterik bagi enzim. Selain itu, ketersedian
10
substrat yang semakin berkurang mempengaruhi menurunkan produksi enzim selulase.
Karakterisasi Enzim Selulase pH optimum
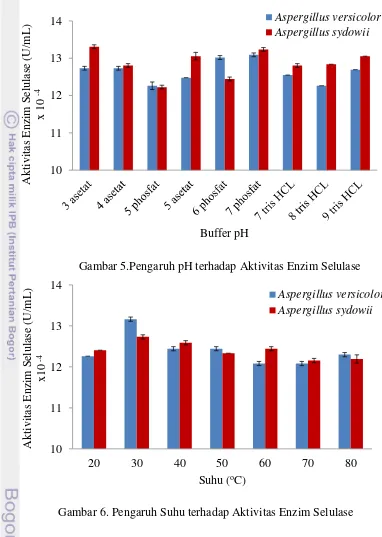
Aktivitas selulase enzim dari isolat kapang Sargassum sp (PSAR3/
Aspergillus versicolor) pada pH optimum tertinggi didapatkan pada buffer fosfat pH 7 dengan nilai aktivitas selulase sebesar 13,092x10-4 U/mL (Gambar 4) sedangkan isolat kapang Gelidium sp(PGEL9/Aspergillus sydowii), pH optimum tertinggi didapatkan pada buffer pH 7 dengan nilai aktivitas selulase sebesar 13,236x10-4 U/mL (Gambar 4) .
Karakteristik enzim yang diukur dalam penelitian ini adalah pengaruh pH terhadap aktivitas selulotik enzim selulase dengan selang pH 3-9. pH merupakan salah satu parameter yang berpengaruh terhadap aktivitas enzim (Li Jung et al. 2010). Perubahan pH berpengaruh terhadap aktivitas enzim jika kondisi pH rendah atau pH tinggi dapat pula menyebabkan terjadinya denaturasi dan akan mengakibatkan aktivitas enzim menjadi turun. Aktivitas enzim yang menurun akibat perubahan pH dipengaruhi oleh keberadaan yang digunakan ion enzim substrat media. Energi cadangan yang mulai habis dan nutrient yang berkurang dapat menyebabkan aktivitas enzim menurun. Grafik (Gambar 4) tidak menunjukan demikian, karena diduga adanya multienzim, yang merupakan terdapatnya beberapa jenis enzim yang berbeda dalam suatu media produksi (Ahlgren et al. 1967). Kedua isolat menunjukan hasil maksimum pada pH 7 fosfat hal ini menunjukan bahwa pada pH ini merupakan pH optimum untuk memproduksi enzim selulase pada media CMC cair. Menurut Bailey dan Ollis (1986) pada enzim selulase konsumsi glukosa pada pH 7 lebih banyak pada pH yang lain.
Suhu Optimum
Setiap enzim umumnya memiliki aktivitas maksimum pada suhu tertentu, semakin meningkatnya suhu maka aktivitas enzim akan meningkat, namun setelah suhu optimum tercapai akan terjadi denaturasi protein yang menyebabkan aktivitas enzim akan menurun (Baehaki et al. 2004). Aktivitas enzim selulase tertinggi yang dihasilkan oleh kedua isolat Sargassum sp (PSAR3/ Aspergillus versicolor) dan Gelidium sp (PGEL9/Aspergillus sydowii) didapatkan pada suhu 40 0C dengan nilai aktivitas enzim masing-masing sebesar 12,528x10-4 U/mL dan 12,367x10-4 U/mL (Gambar 5). Suhu merupakan salah satu faktor lingkungan yang mempengaruhi perkembangan dari aktivitas enzim selulase. Aktivitas enzim selulase semakin rendah seiring kenaikan suhu setelah 30 0C dan mencapai suhu optimum pada suhu 40 0C. Pengaruh suhu yang semakin tinggi dapat menghambat aktivitas enzim selulase melalui proses denaturasi protein enzim. Dari hasil didapatkan bahwa suhu optimum yang sesuai untuk proses produksi enzim adalah pada suhu 40 0C. Kenaikan suhu akan meningkatkan kecepatan reaksi aktivitas enzim selulase hanya pada kisaran tertentu (Murray et al. 2003).
11
Gambar 5.Pengaruh pH terhadap Aktivitas Enzim Selulase
Gambar 6. Pengaruh Suhu terhadap Aktivitas Enzim Selulase
KESIMPULAN DAN SARAN
Simpulan
21 kapang endofit yang diisolasikan dari makroalga Gracilaria sp,
Sargassum sp, Gelidium sp dan Caulerpa sp dari Pulau Pari, Kepulauan Seribu, memiliki spesies diantaranya Aspergillus sydowii, Aspergillus niveus, Aspergillus versicolor, Aspergillus candidus, Aspergillus tereus, dan Penicilium citrinum.
12
Empat isolat tertinggi dari uji kualitatif selulotik yaitu Aspergillus versicolor
isolat Sargassum sp (PSAR3), Aspergillus sydowii isolat Gelidium sp (PGEL9), A. westerdijikal isolate Caulerpa sp (PCLAR6) dan Penicilium citrinum isolat
Gracilaria sp (PGRAR1) memiliki nilai indeks selulotik sebesar 3,34 , 3,22 , 4,33 dan 2,06. Pada uji kuantitatif, isolat kapang Aspergillus versicolor (PSAR3) dan
Aspergillus sydowii (PGEL9) yaitu optimum pada hari ke-2, Aspergillus westerdijikal (PCLAR6) dan Penicillium citrinum (PGRAR1) optimum pada hari ke-1, yaitu pada hari ke-1 dan Gelidium sp/Aspergillus sydowii pada hari ke-2. Isolat kapang Aspergillus versicolor dan Aspergillus sydowii optimum pada pH phosfat 7 dan suhu 40 0C
Saran
Saran dari penelitian ini adalah agar dilakukan uji aktivitas selulase untuk semua isolat kapang makroalga yang dihasilkan sehingga dapat diketahui potensi aktivitas enzim selulase dari masing-masing kapang, dilakukan pemurnian enzim, serta perlunya dilakukan pengujian lebih lanjut agar dapat diketahui kemampuan kapang tersebut dalam menghasilkan bioethanol.
DAFTAR PUSTAKA
Ahlgren E, Eriksson K, Vesterberg O. 1967. Characterization of cellulases and related enzymes by isoelectric focusing, gel filtration and zone electrophoresis. Acta Chem Scand. 21(4): 937-944.
Bailey and Olis M. 1986. Biochemistry Engineering Fundamentals. New York: Mc Graw-Hill.
Darwis A dan Sukara E. 1989. Penuntun Praktikum Isolasi, Purifikasi dan Karakterisasi Enzim. Pusat Antar Universitas. Institut Pertanian Bogor, Bogor.
Fardiaz S. 1992. Mikrobiologi Pangan 1. Pusat Antar Universitas Pangan dan Gizi. Hankin L and Anagnotakis SL. 1997. Solid Media Containing Carboxymethyl
cellulose to Detect Cx cellulose Activity of Microorganism. J Gen Microbiol 98 : 109-115.
Hardjo S, Indrasti NS, Bantacut T. 1989. Biokonversi Pemanfaatan LimbahPertanian. Bogor: PAU Pangan dan Gizi, Institut Pertanian Bogor, Bogor.
Irawan B, Sutihat, Sumardi. 2008. Uji Aktivitas Selulase dan Lipase pada Mikrofungi selama Proses Dekomposisi Limbah Cair Kelapa Sawit dengan Pengujian Kultur Murni. Prosiding Seminar Hasil Penelitian dan Pengabdian kepada Masyarakat. Lampung : Universitas Lampung hlm 284-291.
Kader AJ and Omar O. 1998. Isolation of Cellulotik Fungi from Sayap-Kinabalu Park, Sabah, Serawak. J Biodiversity Bio-Century (ARBEC): 1-6.
13 Ling L, Xianzhao K, Hao Y, Danni W. 2012. Characterization of Extracellular Cellulose Degrading Enzymes from Bacillus thuringiensis Strains. Electronic Journal of Biotechnology.15(3).
Miller GL. 1959. Use of Dinitrosalicyclyc Acid Reagent for Determination of Reducing Sugar. Anal. Chem. 31: 426-428.
Murray RK, Granner DK, Mayers PA. Rodwel VW. 2003. Biokimia Harper. Jakarta : EGC. Terjemahan dari : Harpers Biochemistry
Moore and Landecker E. 1996. Fundamentals of Fungi. Ed.Ke-4. New Jersey : Prentice-Hall.
Palmer T. 1981. Understanding Enzymes. England: Ellis Horwood.
Perez J, Munoz-Dorado J, Rubia T, Martinez J. 2002. Biodegradation and Biological Treatments of Cellulose, Hemicellulose, And Lignin. J. Int.
Microbiol. 5:53-63.
Qin Y, He H, Li N, Ling M, Liang Z. 2010. Isolation and characterization of a thermostabl cellulase-producing Fusarium chlamydosporum. World Journal of Microbiology and Biotechnology. 26(11):1991-1997.
Saczi A, Radford A, Erenler K. 1986. Detection of Cellulolytic Fungi by Using Congo Red As An Indicator: A Comparative Study With the Dinitrosalicyclic Acid. Appl. Bacteriol. 61:559-562
Teather RM, Wood PJ. 1982. Use of Congo Red-Polysaccharide Interactions in Enumeration and Characterization of Celluloiytic Bacteria From The Bovine Rumen. Appl. Environ. Microbiol.43: 777-780.
14
Lampiran 1. Nilai Indeks Selulotik Kapang
NO
NO
ISOLAT ENDOFIT SPESIES
NISBAH ZONA BENING
citrinum 2.26 1.92 2.00 2.06
2 PGRAR 2 Gracilaria sp
Aspergillus
niveus 2.00 0.67 1.00 1.22
3 PSAR 1 Sargassum sp
Aspergillus
versicolor 3.33 3.66 2.62 3.20
4 PSAR 2 Sargassum sp
Aspergillus
sydowii 1.89 2.04 1.64 1.85
5 PSAR 3 Sargassum sp
Aspergillus
versicolor 3.39 3.52 3.11 3.34
6 PGEL 1 Gelidium sp
Aspergillus
candidus 0.00 0.00 0.25 0.08
7 PGEL 2 Gelidium sp
Aspergillus
sydowii 0.13 0.11 0.24 0.16
8 PGEL 3 Gelidium sp
Aspergillus
sydowii 0.90 1.61 0.97 1.16
9 PGEL 4 Gelidium sp
Aspergillus
sydowii 1.15 1.53 0.32 1.00
10 PGEL 5 Gelidium sp
Aspergillus
sydowii 1.20 0.87 0.71 0.93
11 PGEL 6 Gelidium sp Tidak
teridentifikasi 2.33 3.00 2.00 2.44
12 PGEL 7 Gelidium sp
Tidak
teridentifikasi 0.19 1.49 0.57 0.75
13 PGEL 8 Gelidium sp
Aspergilus
sydowii 1.04 1.02 0.98 1.01
14 PGEL 9 Gelidium sp
Aspergilus
sydowii 4.00 4.00 1.67 3.22
15 PGEL 10 Gelidium sp
Aspergillus
sydowii 0.65 0.21 0.43 0.43
16 PCLAR 1 Caulerpa sp
Aspergillus
sydowii 1.67 3.33 2.00 2.33
17 PCLAR 2 Caulerpa sp
Aspergillus
tereus 0.64 0.58 1.52 0.91
18 PCLAR 3 Caulerpa sp
Penicilium
citrinum 0.57 0.39 0.57 0.51
19 PCLAR 4 Caulerpa sp
Aspergillus
sydowii 1.03 0.46 1.19 0.89
20 PCLAR 5 Caulerpa sp
Aspergillus
sydowii 0.49 0.38 0.24 0.37
21 PCLAR 6 Caulerpa sp Aspergillus
15 Lampiran 2. Aktivitas Selulase Kapang
PSAR3
16
PGRAR1
17 Lampiran 3. Kurva Standar Glukosa
Kadar Glukosa Nilai Absorbansi
50 0.008
100 0.101
150 0.228
200 0.401
250 0.519
300 0.7
Lampiran 4. Komposisi Media CMC 1% dalam 1 Liter Air Laut Steril
No Bahan Komposisi (Gram)
1 CMC 10
2 MgSO47H2O 0.2
3 KNO3 0.75
4 K2HPO4 0.5
5 FeSO47H2O 0.02
6 CaCl22H2O 0.04
7 Agar-agar 15
8 Glukosa 1
9 Antibiotik 0.025
y = 0,0028x - 0,1661 R² = 0,9901
-0,100 0,000 0,100 0,200 0,300 0,400 0,500 0,600 0,700 0,800
0 100 200 300 400
A
bsorbansi
18
Lampiran 5. Komposisi Reagen DNS (Dinistrosalisilat)
No Bahan
1 Asam 3,5 dinitrosalisilat
2 NaOH
3 K-Na Tartarat
4 Fenol
5 Na-Metabisulfit
6 HCL 0,1
Lampiran 6. Nilai laju pertumbuhan kapang
Hari Kepadatan Sel (Sel/mL)
A.versicolor P. citrinum A. westerdijikial A. sydowii
0 0 0 0 0
Lampiran 7. Hasil uji aktivitas selulase kapang
hari
A.versicolor P. citrinum A. westerdijikial A. sydowii
19
Lampiran 8. Nilai uji pH optimum
Suhu Aktivitas Enzim (U/mL)
A.versicolor A. sydowii
3 asetat 0.001273 0.001331
4 asetat 0.001273 0.001280
5 phosfat 0.001226 0.001223
5 asetat 0.001248 0.001306
6 phosfat 0.001302 0.001244
7 phosfat 0.001309 0.001324
7 tris HCL 0.001255 0.001280
8 tris HCL 0.001226 0.001284
9 tris HCL 0.001270 0.001306
Lampiran 9. Nilai uji suhu optimum
Suhu Aktivitas Enzim (U/mL)
A.versicolor A. sydowii
20 0.001226 0.001241
30 0.001316 0.001273
40 0.001244 0.001259
50 0.001244 0.001233
60 0.001208 0.001244
70 0.001208 0.001215
20
RIWAYAT HIDUP
Penulis dilahirkan di Garut, 31 Maret 1991 dari pasangan Bapak Ato Hermayanto dan Ibu Mimin. Penulis merupakan anak pertama dari dua bersaudara. Pada tahun 2009 penulis menyelesaikan pendidikan di SMAN 2 Tarogong. Penulis diterima di IPB di Fakultas Perikanan dan Ilmu Kelautan, melalui jalur Undangan Seleksi Masuk IPB (USMI). Selama kuliah di IPB, penulis aktif sebagai pengurus Himpunan Mahasiswa Ilmu dan Teknologi Kelautan (HIMITEKA) Divisi Hidrobiologi Laut periode 2010-2011 dan Divisi Keilmuan periode 2011-2012. Penulis juga pernah menjadi asisten mata kuliah Biologi Laut pada tahun 2012, Ekologi Laut Tropis pada tahun 2013, dan koordinator asisten Biologi tumbuhan Laut pada tahun 2013. Pada kesempatan lan, penulis pernah mempresentasikan makalah dalam acara Annual Internasional Scholar Conference in Taiwan (AISC-T) pada tahun 2013.
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Ilmu Kelautan di Departemen ITK-IPB, penulis menyelesaikan skripsi dengan judul “Karakterisasi dan Uji Aktivitas Selulotik Beberapa Kapang Endofit Rumput Laut (Sargassum sp,