IDENTIFIKASI SUBTIPE, PATOGENITAS,
DAN FILOGENETIK VIRUS AVIAN INFLUENZA
ISOLAT 2012
–
2013
SUSSI WIDI KURNIASIH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Identifikasi Subtipe, Patogenitas, dan Filogenetik Virus Avian Influenza Isolat 2012–2013 adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, November 2015
Sussi Widi Kurniasih
RINGKASAN
SUSSI WIDI KURNIASIH. Identifikasi Subtipe, Patogenitas, dan Filogenetik Virus Avian Influenza Isolat 2012–2013. Dibimbing oleh RETNO DAMAJANTI SOEJOEDONO dan NI LUH PUTU IKA MAYASARI.
Penyakit Avian Influenza (AI) merupakan penyakit infeksius yang sangat penting pada unggas yang disebabkan oleh virus Avian Influenza. Penyakit ini pertama kali masuk ke Indonesia pada tahun 2003 dan telah menyebar secara luas menyebabkan kerugian ekonomi yang besar dan kematian yang tinggi pada peternakan-peternakan unggas. Dewasa ini wabah penyakit AI masih sering terjadi secara sporadis meskipun pada peternakan yang telah rutin divaksin AI.
Tujuan dari penelitian ini adalah untuk menentukan subtipe dan patogenitas virus AI serta melakukan analisis filogenetik dan jarak kekerabatan gen hemaglutinin dari virus-virus AI yang diisolasi pada tahun 2012–2013 di daerah Jawa Barat, Jawa Tengah, dan Medan. Sampel diperoleh dari peternakan unggas yang mengalami wabah penyakit AI dan diinokulasikan serta dipropagasi dalam Telur Ayam Berembrio (TAB) specific pathogen free (SPF) berumur 10 hari.Cairan alantois yang dipanen 5 hari setelah inokulasi diuji hemaglutinasi (HA). Cairan alantois dengan HA positif diuji lebih lanjut untuk menentukan subtipe hemaglutinin dan neuraminidase menggunakan real-time reverse transcription polymerase chain reaction (RRT-PCR) dan dipersiapkan untuk proses pengurutan oligonukleotida menggunakan reverse transcription polymerase chain reaction (RT-PCR). Hasil proses pengurutan oligonukleotida dari gen hemaglutinin digunakan dalam analisis pola asam amino daerah pemotongan gen hemaglutinin dan hubungan kekerabatan antar virus-virus yang diisolasi.
Hasil penelitian menunjukkan bahwa semua isolat tergolong ke dalam HPAI H5N1 dengan pola asam amino daerah pemotongan PQRESRRKKR/GLF dan PQRERRRKR/GLF. Isolat-isolat tersebut terbagi ke dalam klaster 2.1 dan klaster 2.3 dan masih memiliki hubungan kekerabatan yang dekat dengan jarak genetik kurang dari 0.3 antara virus yang satu dengan yang lainnya dan juga terhadap beberapa isolat virus AI yang menyebabkan wabah-wabah sebelumnya di Indonesia.
Di masa mendatang isolat-isolat yang digunakan dalam penelitian ini dapat dimanfaatkan sebagai alternatif strain virus untuk produksi vaksin AI yang diharapkan dapat melindungi peternakan-peternakan unggas terhadap ancaman wabah AI.
SUMMARY
SUSSI WIDI KURNIASIH. Identification of Subtype, Pathogenicity, and Phylogenetic of Avian Influenza Viruses Isolated in 2012–2013. Supervised by RETNO DAMAJANTI SOEJOEDONO and NI LUH PUTU IKA MAYASARI.
Avian Influenza (AI) is an important infectious disease in poultry caused by Avian Influenza virus. This disease is first isolated in Indonesia in 2003 and has been widely spreaded in regions and provincies causing major economic losses and deaths in poultry farms. Recently, AI outbreaks still raised sporadically although in poultry farms that have been practiced routine vaccination.
The aim of this research is to determine the subtype and pathogenicity and to analyze the phylogenetic and genetic distances of hemagglutinin gene of isolated AI viruses in Indonesia in 2012–2013 particularly from West Java, Central Java, and Medan. Samples were obtained from poultry farms that suffered AI outbreaks and were inoculated and propagated in ten days old specific pathogen free (SPF) embryonated chicken eggs. Harvested allantoic fluids 5 days post-inoculation were tested for hemagglutination activity. Positive allantoic fluids were further tested to determine the hemagglutinin and neuraminidase subtype using real-time reverse transcription polymerase chain reaction (RRT-PCR) and to be prepared for sequencing using reverse transcription polymerase chain reaction (RT-PCR).The sequence of hemagglutinin genes were analyzed for the amino acid pattern of the cleavage site region and the genetic distances and relationships of the viruses.
The results indicate that all of the isolates are classified as HPAI H5N1 with the pattern of cleavage site regions are PQRESRRKKR/GLF and PQRERRRKR/GLF. All of the isolates are devided into cluster 2.1 and cluster 2.3 and have close genetic relationship with the genetic distances less than 0.3 between one and another and also with several AI viruses that caused previous outbreaks in Indonesia.
In future, the isolates used in this research might give benefit as seed vaccine strain choices of AI virus that could be useful to make vaccine products as a protection of poultry farms against the upcoming outbreaks of AI.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Bioteknologi
IDENTIFIKASI SUBTIPE, PATOGENITAS,
DAN FILOGENETIK VIRUS AVIAN INFLUENZA
ISOLAT 2012
–
2013
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Identifikasi Subtipe, Patogenitas, dan Filogentik Virus Avian Influenza Isolat 2012
–
2013Nama : Sussi Widi Kurniasih NIM : P051120161
Disetujui oleh Komisi Pembimbing
Prof Dr drh Retno D. Soejoedono, MS Ketua
Dr drh Ni Luh Putu Ika Mayasari Anggota
Diketahui oleh
Ketua Program Studi Bioteknologi
Prof Dr Ir Suharsono, DEA
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Kuasa atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian adalah penyakit Avian Influenza dengan judul Identifikasi Subtipe, Patogenitas, dan Filogenetik Virus Avian Influenza Isolat 2012
–
2013.Penulis mengucapkan terima kasih kepada Prof Dr drh Retno D. Soejoedono, MS selaku Ketua Komisi Pembimbing, Dr drh Ni Luh Putu Ika Mayasari selaku Anggota Komisi Pembimbing, Prof Dr Ir Suharsono, DEA selaku Ketua Program Studi Bioteknologi, serta Dr dr Sri Budiarti selaku Penguji Luar Komisi. Ucapan terima kasih juga penulis sampaikan kepada manajemen PT. Sierad Produce Tbk. atas dukungan dana dan fasilitas yang telah diberikan sehingga penelitian ini dapat dilaksanakan dengan baik, juga kepada rekan-rekan sejawat dan seluruh karyawan Prolab Diagnostic Laboratory atas dukungan moral dan kerjasamanya selama ini, serta rekan-rekan Bioteknologi angkatan 2012. Tidak lupa penulis menyampaikan ungkapan terima kasih kepada suami tercinta, Prayogo Oetomo Eklas, orang tua serta seluruh keluarga atas dukungan doa, semangat, dan cinta kasihnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, November 2015
DAFTAR ISI
Reverse-transcriptase Polymerase Chain Reaction (RT-PCR) 10
Pengurutan Oligonukleotida 11
Hubungan Kekerabatan 12
Mutasi Virus AI 12
Penyakit AI pada Unggas Air 13
Vaksinasi 13
3 METODE
Waktu dan Tempat 14
Isolasi Virus 14
Uji Hemaglutinasi (HA) 15
Identifikasi H5 dan N1 dengan Real-time Reverse-transcription
Polymerase Chain Reaction (RRT-PCR) 16
Identifikasi Neuraminidase N1 dengan Reverse-transcriptionPolymerase
Chain Reaction (RT-PCR) 17
Reverse-transcription Polymerase Chain Reaction (RT-PCR)
untuk Pengurutan Oligonukleotida 17
Pengurutan Oligonukleotida 18
Analisis Filogenetik dan Jarak Kekerabatan 18
4 HASIL DAN PEMBAHASAN
Kematian Embrio setelah Inokulasi Virus AI 19
Korelasi antara Jumlah Virus dengan Aktivitas Hemaglutinasi
dan Virulensi Virus 20
Pengurutan Oligonukleotida Gen Hemaglutinin 24 Pengurutan Oligonukleotida Daerah Pemotongan Gen
Hemaglutinin 27
Analisis Filogenetik dan Hubungan Kekerabatan 30 5 SIMPULAN DAN SARAN
Simpulan 33
Saran 33
DAFTAR PUSTAKA 33
LAMPIRAN 39
DAFTAR TABEL
1 Isolat virus Avian Influenza yang digunakan dalam penelitian 14 2 Hasil pengamatan embrio setelah inokulasi virus AI 19
3 Kematian embrio setelah inokulasi virus AI 20
4 Hasil pengukuran titer HA 22
5 NilaiCt dan jumlah kopi RNA hasil uji RRT-PCR H5 dan N1 23 6 Hasil pegukuran konsentrasi produk PCR setelah amplifikasidengan
primer H548F-H1215R 26
7 Pola asam amino daerah pemotongan gen hemaglutinin 27
DAFTAR GAMBAR
1 Gambaran struktur virus AI 5
2 Gambaran siklus hidup virus AI 9
3 Alur penelitian 14
4 Gambaran hasil uji hemaglutinasi cepat 15
5 Gambaran hasil uji hemaglutinasi dengan mikrotitrasi 16 6 Posisi primer yang digunakan dalam proses pengurutan oligonukleotida
pada gen hemaglutinin 18
7 Hasil uji hemaglutinasi cepat cairan alantois setelah inokulasi virus AI 21 8 Produk PCR hasil amplifikasi dengan primer N1-1 N1-2 23 9 Produk PCR hasil amplifikasi dengan primer HA01-HA645 25 10 Produk PCR hasil amplifikasi dengan primer H548F-H1215R 25 11 Produk PCR hasil amplifikasi dengan primer H5-1–H5-3 25 12 Pohon filogenetik hasil analisis nukleotida gen hemaglutininvirusAI
yang digunakan dalam penelitian (nomor 1–9)dipadankandengan virus
AI dari wabah-wabah sebelumnya 32
DAFTAR LAMPIRAN
1 Tabel nilai HA dengan mikrotitrasi 39
2 Urutan oligonukleotida isolat-isolat virus yang digunakandalam
konstruksi pohon filogenetik 40
3 Urutan oligonukleotida daerah pemotongan gen hemaglutinin 44 4 Asam amino hasil translasi oligonukleotida daerah pemotongan gen
hemaglutinin 46
1
PENDAHULUAN
Latar Belakang
Penyakit Avian Influenza (AI) merupakan penyakit yang berpotensi sangat merugikan bagi dunia perunggasan di Indonesia dan di seluruh dunia. Penyakit AI paling banyak terjadi pada ayam, tetapi kejadian penyakit ini juga dilaporkan pada itik dan unggas lainnya (Susanti et al. 2009; Dharmayanti et al. 2012). Penyakit AI ditemukan tahun 1878 di Italia, tetapi baru berhasil diisolasi pertama kali pada tahun 1959 yaitu subtipe H5N1 A/chicken/Scotland/59. Setelah itu wabah AI yang disebabkan oleh subtipe H5N1 terjadi di Hongkong pada tahun 1997 (Shortridge et al. 1998).
Indonesia pertama kali melaporkan kasus AI yang disebabkan oleh subtipe H5N1 pada bulan Januari 2004 meskipun wabah sebenarnya terjadi pada Agustus 2003 di daerah Tangerang dan Pekalongan (Dharmayanti et al. 2011). Penyakit ini sekarang telah bersifat endemik di berbagai daerah di Jawa, Bali, Sumatra, dan Sulawesi Selatan. Hingga Desember 2008 hanya 2 propinsi di Indonesia yang tidak melaporkan kejadian penyakit AI, dan hingga April 2012 penyakit AI sudah endemik di 32 propinsi di Indonesia dan hanya 1 propinsi yang masih dinyatakan bebas AI yaitu Maluku Utara (Andesfha et al. 2013).
Virus AI penyebab wabah di Indonesia digolongkan ke dalam klaster 2.1, termasuk ke dalamnya adalah klaster 2.1.1, 2.1.2 dan 2.1.3 (Eagles et al. 2009; Takano et al. 2009). Semua virus AI klaster Indonesia dikarakterisasi berdasarkan perbedaan geografis dan spesies inangnya. Klaster 2.1.1 dominan di Jawa sejak tahun 2003, diisolasi dari unggas yang terinfeksi AI selama periode wabah 2004– 2007. Klaster 2.1.2 diisolasi di Sumatra pada tahun 2004–2007, dan klaster 2.1.3 merupakan klaster dominan bersirkulasi secara luas di Indonesia sejak tahun 2004, menyebar dan menjadi endemik di banyak daerah di Indonesia. Hasil evolusi dari klaster inilah yang membentuk beberapa subklaster baru. (Takano et al. 2009), seperti pernyataan Dharmayanti et al. (2011) bahwa karakteristik molekuler virus AI Indonesia telah mengalami perubahan secara dinamis sejak pertama kali diisolasi tahun 2003. Introduksi virus AI dari klaster 2.3 juga telah dilaporkan (Eagles et al.2009). Wabah virusAI H5N1 klaster 2.3.2 di Indonesia terjadi pada bulan September 2012 yang mengakibatkan kematian masal itik pada peternakan-peternakan itik di Kabupaten Brebes, Jawa Tengah. Varian virus yang menyerang itik tersebut sangat ganas. Sembilan propinsi dilaporkan telah terjangkit dalam waktu 6 bulan sejak kasus pertama dilaporkan yaitu Jawa Tengah, Jawa Timur, Jawa Barat, DIY, Banten, Lampung, Riau, Sulawesi Selatan, dan Sulawesi Barat. Hingga Desember 2012 tercatat 150000 ekor itik mati dan seluruh kasus kematian terjadi pada peternakan itik rakyat (WHO 2011). Pada saat terjadi kematian masal pada itik juga dilaporkan terjadi kematian pada ayam buras yang disebabkan oleh AI H5N1 klaster 2.1.3 sehingga dapat diduga bahwa klaster lama Indonesia 2.1.3 tetap ada dan masih patogen pada ayam (Andesfha et al. 2013).
2
kebijakan pelaksanaan program vaksinasi dengan menggunakan isolat lokal dan isolat dengan subtipe yang sama (Eagles et al. 2009). Karakter genetik dari virus H5N1 terus berkembang dan dapat mengalami mutasi sehingga kemungkinan pergeseran genetik sudah terjadi di lapangan oleh karena tekanan imunologis dari program vaksinasi. Strain vaksin yang efektif sebaiknya memiliki kesamaan genetik minimal 80 % dengan virus AI lapangan (Dharmayanti et al. 2011; Swayne et al. 1999). Adanya 2 klaster yang bersirkulasi bersama menuntut penyesuaian strategi vaksinasi untuk memaksimalkan pengendalian terhadap penyakit AI. Perbedaan klaster tersebut juga berimplikasi dalam seleksi kandidat virus yang akan digunakan sebagai vaksin (Dharmayantiet al. 2014). Perbedaan klaster ataupun subklaster dapat menyebabkan perbedaan struktur antigenik antara virus yang satu dengan yang lainnya, sehingga vaksin yang digunakan untuk mencegah wabah penyakit AI juga berbeda antara satu wilayah dengan wilayah lainnya (Smith et al. 2006). Vaksin yang digunakan harus memiliki kesesuaian antigenik dengan virus yang bersirkulasi di lapangan (Dharmayantiet al. 2014). Analisis filogenetik sangat diperlukan untuk mengetahui tingkat penyebaran virus dan menentukan kedekatan hubungan kekerabatan antara virus yang satu dengan yang lainnya, sehingga dapat ditentukan strategi pengendalian dan jenis vaksin yang tepat untuk mencegah wabah AI selanjutnya (Susanti 2008).
Virus AI memiliki 8 macam protein. Dua jenis protein yang berperan penting dalam patogenitas virus AI adalah hemaglutinin (HA) dan neuraminidase (NA) (Asmara et al. 2005). Hemaglutinin berfungsi melakukan penempelan virus dan fusi dengan membran endosom pada sel inang, sedangkan neuraminidase berperan dalam pelepasan progeni virion ke dalam sel inang (Dharmayanti et al. 2007; Susanti 2008). Hemaglutinin dan neuraminidase menentukan subtipe dari virus AI. Perbedaan susunan oligonukleotida dalam gen HA ataupun NA menentukan perbedaan antara subtipe virus AI yang satu dengan yang lainnya. Virus AI subtipe H5N1 dinyatakan sebagai subtipe virus AI patogen atau highly pathogenic avian influenza (HPAI) dan dinyatakan sebagai penyebab dari wabah-wabah AI yang terjadi di Indonesia dan di seluruh dunia (OFFLU 2014; OIE 2014).
Di dalam hemaglutinin terdapat daerah pemotongan dan komponen-komponen lain seperti daerah antigenik, residu pengikat reseptor, kantong pengikat reseptor, dan tempat glikosilasi (Perdue 2008; Susanti 2008). Daerah pemotongan merupakan urutan asam amino pada hemaglutinin sebagai tempat pembelahan prekursor HA menjadi HA1 dan HA2 oleh protease sel inang sehingga menjadi perantara fusi antara amplop virus dengan membran endosomal sel inang (Perdue 2008; Swayne dan Pantin-Jackwood 2008). Aktivitas proteolitik molekul HA sangat penting dalam infektivitas dan virulensi dari virus AI. Spesifisitas dari molekul HA inilah yang dapat menjadi faktor utama yang membedakan patogenitas virus AI (Dharmayanti et al. 2012). Perbedaan antara molekul-molekul HA dapat ditentukan berdasarkan urutan asam amino pada daerah pemotongan (Susanti2008; Susanti et al. 2008).
3 kekerabatan virus-virus AI yang masih menimbulkan wabah di beberapa jenis unggas di berbagai daerah di Indonesia.
Penelitian ini menggunakan isolat-isolat yang berasal dari beberapa jenis unggas yaitu ayam kampung, ayam petelur, ayam pedaging, dan itik yang diisolasi dari berbagai daerah yaitu Bogor, Cianjur, Tangerang, Medan, dan Brebes. Pemilihan isolat tahun 2012–2013 didasarkan pada kejadian-kejadian wabah AI yang dipandang penting dan memberikan perubahan pada peta genetik penyakit AI di Indonesia, antara lain wabah AI pada itik yang memunculkan klaster baru di Indonesia yaitu klaster 2.3.
Tujuan Penelitian
Penelitian ini bertujuan untuk menentukan subtipe dan patogenitas virus AI yang diisolasi tahun 2012–2013 di beberapa daerah di Indonesia serta melakukan analisis filogenetik dan jarak kekerabatan baik antar isolat-isolat virus tersebut maupun dengan isolat virus AI Indonesia dari wabah-wabah sebelumnya.
Hipotesis Penelitian
Virus AI yang diisolasi dan menyebabkan wabah di peternakan unggas di berbagai daerah di Indonesia tergolong ke dalam HPAI. Virus-virus AI tersebut memiliki kedekatan genetik antara satu dengan yang lain dan dengan virus AI penyebab wabah-wabah sebelumnya.
Manfaat Penelitian
4
2 TINJAUAN PUSTAKA
Etiologi dan Epidemiologi
Avian Influenza (AI) merupakan penyakit infeksius yang menyerang unggas, disebabkan oleh virus dari golongan Orthomyxoviridae. Penyakit ini telah menyebar luas di seluruh dunia.Kasus-kasus AI telah dilaporkan dari Afrika, Asia, Australia, Eropa, dan Amerika Utara maupun Amerika Selatan (Swayne dan Halvorson 2003). Virus AI telah berhasil diisolasi dari unggas domestik terutama ayam, kalkun, itik dan unggas air lainnya, dan burung-burung liar maupun burung peliharaan. Pada berbagai populasi peternakan kurangnya biosekuriti dan penanganan yang baik mengakibatkan virus AI menjadi bersifat endemik dan menjadi ancaman besar bagi tercetusnya wabah penyakit tersebut (Lubroth et al.
2008). Penyakit AI yang disebabkan oleh virus AI subtipe H5N1 di Indonesia telah diidentifikasi pada unggas sejak tahun 2003 (Damayanti et al. 2004; Wiyono
et al. 2004), kemudian secara berturutan terjadi wabah-wabah AI hingga Agustus 2006, dan kini penyakit tersebut bersifat endemis di banyak wilayah di Indonesia seperti Jawa, Sumatera, dan Sulawesi (Gutierrez et al. 2009). Virus AI yang diisolasi dari unggas di Indonesia termasuk dalam klaster 2.1 (Takano et al. 2009; Nidom et al. 2012). Virus AI subtipe H5N1 dari berbagai negara secara filogenetik terpisah menjadi 2 klaster.Klaster 1 adalah virus AI yang diisolasi di Kamboja, Thailand, Vietnam, Laos, Korea Selatan, dan Jepang pada tahun 2003– 2004. Klaster 2 terbagi menjadi 3 subklaster yaitu subklaster 1 adalah isolat Indonesia tahun 2004–2006 dan Hongkong tahun 2003, subklaster 2 adalah isolat virus AI dari Rusia, Turki, dan Timur Tengah tahun 2005–2006, sedangkan subklaster 3 adalah dari Laos, Thailand, Kamboja, dan Vietnam tahun 2005–2006 (Hulse-Post et al. 2005; WHO 2005; Webster dan Govorkova 2006). Virus-virus dalam klaster terpisah mempunyai perbedaan struktur antigenik sehingga setiap klaster memerlukan vaksin yang berbeda (Smith et al. 2006).
Genom Virus AI
5
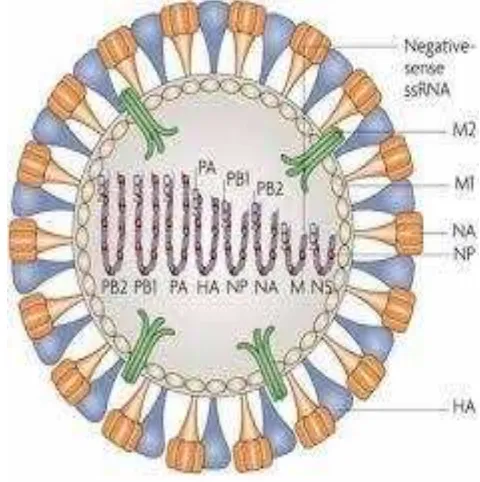
Gambar 1 Gambaran struktur virus AI (Garmaroudi 2007)
Klasifikasi Virus AI
Berdasarkan karakter protein M yang dimilikinya, virus influenza A digolongkan menjadi 3 tipe yang sangat berbeda secara antigenik yaitu virus influenza tipe A, B, dan C. Tipe A utamanya menyerang unggas meskipun dapat juga ditemukan pada manusia, babi, kuda, dan spesies mamalia lainnya, sedangkan tipe B dan C hanya ditemukan pada manusia dan bersifat ringan (Swayne et al. 1998; Swayne dan Halvorson 2003; Capua dan Marangon 2006). Berdasarkan gen hemaglutinin dan neuraminidase pada amplop pembungkus luar virus maka virus AI dapat diklasifikasikan menjadi beberapa subtipe sehingga penamaan virus ini didasarkan pada HA dan NA yaitu HxNx. Sampai saat ini telah diketahui terdapat 18 subtipe HA (H1–H18) dan 11 subtipe NA (N1–N11) (Mehle 2014). Masing-masing virus AI mempunyai 1 protein HA dan 1 protein NA yang berpotensi membentuk beberapa kombinasi(SADC 2010; OIE 2014).
Hemaglutinin
6
dari HA2 yang selanjutnya akan menjadi perantara fusi antara amplop viral dan membran endosomal, sehingga aktivitas proteolitik molekul HA sangat penting dalam infektivitas virus AI (Perdue 2008).
Protein HA juga berperan dalam fusi membran virus dengan membran sel induk semang sehingga dapat memfasilitasi pelepasan informasi genetik untuk menginisiasi pembentukan virus baru. Proses tersebut diperantarai oleh daerah peptida fusi dari gen hemaglutinin yang berlokasi di daerah HA2. Setelah partikel virus mengalami endositosis dalam vesikula endositosik dan pH mengalami penurunan, HA2 mengalami perubahan konformasi yang membawa peptida fusi berdekatan dengan membran vesikula sehingga terjadi fusi dan penekanan material isinya ke dalam sitoplasma sel. Oleh karena itu pembelahan dari gen HA sangat penting bagi pembentukan dan pelepasan peptida fusi dan bagi inisiasi infeksi virus AI (Suzuki dan Nei 2002).
Daerah Pemotongan Gen Hemaglutinin
Daerah pemotongan merupakan urutan asam amino yang berperan dalam pembelahan prekursor HA (HA0) menjadi HA1 dan HA2 secara enzimatis oleh protease sel inang sehingga fusi dengan membran endosom dapat terjadi untuk memfasilitiasi infeksi virus AI ke dalam sel inang (Klenk et al. 1975). Daerah pemotongan HA0 tergantung dari adanya asam amino arginin (R) atau lisin (K). Daerah tersebut bersifat spesifik dan spesifisitas tertentu dari protease membatasi distribusi jaringan yang terinfeksi oleh virus AI. Pada umumnya virus AI nonvirulen atau dengan patogenitas rendah memiliki 1 asam amino basa di daerah pemotongan sedangkan strain dengan patogenitas tinggi memiliki lebih dari 1 asam amino basa (Munch et al. 2001; Perdue 2008; Gutierrez et al. 2009).
Daerah pemotongan HA dengan asam amino arginin tunggal pada virus AI avirulen (misalnya HA1-PSIQVR-GL-HA2) yang hanya dapat dipecah oleh triptase yang dihasilkan oleh epitel saluran pernafasan dan pencernaan, hanya memungkinkan terjadinya infeksi lokal pada saluran pernafasan atau pencernaan atau keduanya, menghasilkan infeksi ringan atau asimtomatis. Sebaliknya daerah pemotongan HA dengan asam amino arginin atau lisin berulang pada virus AI virulen (misalnya HA1-KKREKR-GL-HA2) memungkinkan HA dapat dipecah oleh protease seperti furin dan proprotein konvertase 6 (PC6) yang dapat ditemukan pada aparatus Golgi dari semua sel sehingga menyebabkan infeksi sistemik di berbagai organ yang dapat mengakibatkan kematian (Bosch et al.
1979; Chen et al. 2004; Gutierrez et al. 2009; Horimoto et al. 1994). Virus AI dengan pola daerah pemotongan asam amino basa ganda memiliki distribusi tak terbatas sehingga virus tersebut dapat diisolasi dari darah, cairan serebrospinal, dan feses (Chen et al. 2004; WHO 2005).
Penularan
7 dengan unggas penderita, peralatan terkontaminasi, atau dari material organik yang mengandung virus AI (Capua dan Marangon 2006). Penularan melalui material eksudat saluran pernafasan merupakan cara penularan yang paling banyak terjadi karena konsentrasi virus dalam saluran pernafasan tinggi. Konsentrasi virus yang lebih rendah tetapi dalam volume yang lebih banyak yang terdapat dalam feces unggas terinfeksi juga menjadi sarana penularan yang utama. Masa inkubasi penyakit yang disebabkan oleh virus ini bervariasi dari beberapa jam pada unggas percobaan yang diinfeksi secara intravena, hingga 3 hari pada unggas yang terinfeksi secara alami, sampai 14 hari pada suatu flok yang terinfeksi. Masa inkubasi tergantung dari jumlah virus yang masuk, cara penularan, dan spesies unggas yang terinfeksi (Tabbu 2000).
Morbiditas dan Mortalitas
Morbiditas dan mortalitas penyakit AI bervariasi tergantung dari gejala klinis,patogenitas virus, dan faktor-faktor induk semang. Pada kasus yang disebabkan oleh HPAI morbiditas berkisar antara 50–89 % dan mortalitas dapat mencapai 100 %, sedangkan pada kasus LPAI morbiditasnya cukup tinggi tetapi mortalitasnya rendah (kurang dari 5 %) kecuali jika terjadi infeksi penyakit lain yang bersamaan atau unggas yang terserang berumur muda (Capua et al. 2000).
Siklus Hidup dan Patogenesis
Virus AI dapat dikasifikasikan ke dalam 2 patotipe yang berbeda yaitu low pathogenic avian influenza (LPAI) dan high pathogenic avian influenza (HPAI) berdasarkan kemampuannya dalam menyebabkan sakit dan kematian pada unggas yang diserang (Tabbu 2000). Identifikasi patotipe virus AI sangat penting bagi penggolongan suatu strain atau isolat ke dalam LPAI atau HPAI. Virus LPAI menyebabkan gangguan respirasi dan penurunan produksi telur pada semua spesies unggas, sedangkan HPAI menyebabkan gangguan sistemik dengan kematian yang tinggi pada ayam dan beberapa spesies unggas lainnya hingga mencapai 100% (Capua dan Marangon 2006).
Virus AI diklasifikasikan sebagai patogen (HPAI) apabila memiliki
intravenous pathogenicity index (IVPI) terhadap ayam umur 6 minggu sebesar lebih dari 1.2, atau menyebabkan kematian 75 % dalam waktu 10 hari pada ayam umur 4–8 minggu yang diinfeksi dengan 0.2 ml virus AI secara intravenosa. Virus AI yang termasuk ke dalam subtipe H5 dan H7 tetapi tidak memiliki IVPI lebih dari 1.2 atau menyebabkan kematian 75 % pada uji tantang secara intravenosa harus dilakukan proses pengurutan oligonukleotida untuk menentukan adanya pola asam amino basa berulang pada daerah pemotongan gen hemaglutinin, sehingga dapat digolongkan ke dalam AI patogen/HPAI. Virus AI yang diklasifikasikan sebagai LPAI adalah semua virus AI subtipe H5 dan H7 yang tidak memenuhi kriteria untuk digolongkan sebagai HPAI (WHO 2006; OIE 2014).
8
tereksplotasi setelah pemecahan daerah pemotongan protein HA menjadi subunit HA1 dan HA2 (Skehel et al. 2001). Pada virus LPAI pemecahan daerah pemotongan terjadi karena aktivitas enzim menyerupai tripsin yang terdapat pada sel-sel epitel saluran pernafasan, sedangkan pada virus HPAI pemecahan dapat dilakukan oleh enzim menyerupai tripsin ataupun protease-protease ubikuitus seperti furin yang terdapat pada hampir semua sel di seluruh tubuh (Swayne 2007; Swayne dan Halvorson 2008).
Setelah terjadi perlekatan, virus akan mengalami endositosis. Kondisi pH yang rendah (5.5) menjadi pemicu terjadinya perubahan konformasi HA2 dan berlanjut dengan fusi antara domain HA yang aktif dengan membran sel inang sehingga RNA virus dapat dilepaskan ke dalam sitoplasma sel inang (Webster et al. 1992).Proses tersebut diperantarai oleh protein M2 yang merupakan protein membran integral yang memungkinkan ion H+ masuk ke dalam virion dan menyebabkan perubahan konformasi protein HA sehingga protein tersebut menjadi aktif (Pinto dan Lamb 2007).
Tahap berikutnya adalah RNA yang berorientasi negatif dikopi menjadi RNA positif oleh kompleks polimerase virus yang melibatkan 3 jenis protein polimerase (PB1, PB2, dan PA) serta protein NP di dalam inti sel. Virus menggunakan perangkat dari sel inang yaitu RNA polimerase II untuk menginisiasi sintesis mRNA virus. Ribonucleic acid (RNA) positif kemudian bermigrasi dari inti sel menuju sitoplasma untuk mengalami proses translasi, dan selanjutnya RNA positif berperan sebagai cetakan untuk membentuk RNA negatif yang akan dirakit menjadi virion baru (Krug 1981).
Dua protein virus yaitu M1 dan NS2 berperan dalam lalu lintas protein-protein virus ke dalam dan dari inti sel inang. Protein M1 juga memiliki peran dalam perakitan struktur virion baru. Proses perakitan virus juga terjadi terhadap 3 protein membran yaitu HA, NA, dan M2 yang masuk ke dalam retikulum endoplasmik dan mengalami pelipatan dan glikosilasi sebelum akhirnya berpindah ke bagian apikal dari membran plasma. Setelah virion baru terbentuk, terjadi reaksi enzimatis dari protein NA untuk memotong asam sialat dari glikoprotein HA (Matrosovich et al. 2004).
Replikasi virus AI dimulai di epitel rongga hidung dan saluran pernafasan. Pada kasus LPAI virus akan dilepaskan ke sel-sel lain di saluran pernafasan dan pencernaan. Berbeda dengan LPAI, virus HPAI akan bereplikasi dalam sel-sel endotelial dan menyebar melalui sistem vaskular atau limfatik untuk menginfeksi dan bereplikasi dalam berbagai jenis sel dalam organ-organ viseral, otak, dan kulit. Gejala klinis dan kematian disebabkan oleh kaskade edema, perdarahan, dan kegagalan fungsi multiorgan. Kerusakan yang disebabkan oleh virus HPAI merupakan hasil dari proses replikasi virus secara langsung pada sel, jaringan, dan organ ataupun merupakan efek tidak langsung dari produksi mediator-mediator seluler seperti sitokin, serta iskemia karena trombosis vaskular (Swayne dan Halvorson 2003). Pada tingkat seluler perubahan-perubahan yang terjadi karena infeksi HPAI adalah nekrosis dan apoptosis. Nekrosis berhubungan dengan tingginya tingkat replikasi virus, paling banyak dilaporkan terjadi pada neuron otak, sel-sel tubuli ginjal, epitel asinar pankreas, miosit jantung, sel-sel kortikal adrenal, dan sel-sel epitelial paru-paru dari unggas yang terinfeksi (Suarez et al.
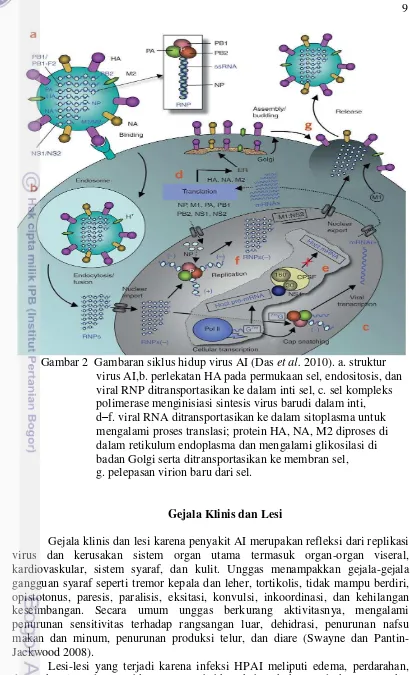
9
Gambar 2 Gambaran siklus hidup virus AI (Das et al. 2010). a. struktur virus AI,b. perlekatan HA pada permukaan sel, endositosis, dan viral RNP ditransportasikan ke dalam inti sel, c. sel kompleks polimerase menginisiasi sintesis virus barudi dalam inti, d–f. viral RNA ditransportasikan ke dalam sitoplasma untuk mengalami proses translasi; protein HA, NA, M2 diproses di dalam retikulum endoplasma dan mengalami glikosilasi di badan Golgi serta ditransportasikan ke membran sel, g. pelepasan virion baru dari sel.
Gejala Klinis dan Lesi
Gejala klinis dan lesi karena penyakit AI merupakan refleksi dari replikasi virus dan kerusakan sistem organ utama termasuk organ-organ viseral, kardiovaskular, sistem syaraf, dan kulit. Unggas menampakkan gejala-gejala gangguan syaraf seperti tremor kepala dan leher, tortikolis, tidak mampu berdiri, opistotonus, paresis, paralisis, eksitasi, konvulsi, inkoordinasi, dan kehilangan keseimbangan. Secara umum unggas berkurang aktivitasnya, mengalami penurunan sensitivitas terhadap rangsangan luar, dehidrasi, penurunan nafsu makan dan minum, penurunan produksi telur, dan diare (Swayne dan Pantin-Jackwood 2008).
10
leher bagian atas, periorbital, intermandibular, tungkai, dan kaki. Hiperemia terjadi pada kelopak mata, konjungtiva, dan trakea. Perdarahan ptekial hingga ekimosa dan sianosis terjadi pada pial dan jengger. Lesi pada organ-organ internal meliputi perdarahan pada permukaan serosa atau mukosa seperti lemak jantung dan epikardium, proventrikulus dan ventrikulus, otot pektoral, permukaan dalam sternum, seka tonsil, dan divertikulum Meckel. Nekrosis dapat terjadi pada pankreas, sedangkan nekrosis dan perdarahan terjadi pada lempeng Peyer dan paru-paru. Selain itu paru-paru juga dapat mengalami pneumonia interstitialis disertai dengan edema. Pada otak dapat terjadi nekrosis dan hemoragi yang disertai edema. Lesi pada ginjal ditandai dengan adanya deposit urat. Pada unggas muda, bursa Fabrisius dan timus mengalami atropi dengan atau tanpa perdarahan. Limpa normal atau membesar disertai foki nekrotik (Swayne dan Pantin-Jackwood 2008).
Diagnosis
Diagnosis definitif dari penyakit AI ditetapkan berdasarkan deteksi langsung terhadap protein virus AI yang terdapat di dalam spesimen seperti jaringan, preparat usap, kultur sel dan Telur Ayam Berembrio (TAB), atau melalui isolasi dan identifikasi virus AI (Swayne dan Halvorson 2003; Spackman et al.
2008).
Isolasi virus
Isolasi virus merupakan referensi standar dalam diagnosa penyakit AI. Metode ini penting untuk mengkonfirmasi ada tidaknya virus pada suatu kasus penyakit dan untuk dapat melakukan analisis lebih lanjut. Sampel yang diperlukan untuk isolasi virus dapat berupa suspensi organ dan preparat usap kloaka, trakea, atau orofaring, serta sampel-sampel dari lingkungan. Metode ini dapat digunakan untuk mendeteksi keberadaan virus AI pada semua stadium infeksi (Spackman et al. 2008).
Reverse-trancription Polymerase Chain Reaction (RT-PCR)
Aplikasi metode molekuler untuk mengetahui ada tidaknya asam nukleat virus telah menjadi metode yang penting dalam mendeteksi virus AI dan mengidentifikasi subtipe dari virus tersebut (Spackman et al. 2008). Metode molekuler yang paling banyak digunakan adalah Reverse-trancription Polymerase Chain Reaction (RT-PCR), baik Real-time RT-PCR (RRT-PCR) ataupun RT-PCR konvensional. Metode ini memiliki banyak kelebihan antara lain sensitivitas dan spesifisitasnya yang tinggi, mampu mengakomodasi ukuran sampel yang kecil dan dapat mengurangi kontak dengan material yang infeksius. Kelebihan lain dari metode ini adalah hanya memerlukan jumlah sampel yang sangat sedikit. Real-time RT-PCR memiliki kelebihan dibandingkan RT-PCR konvensional yaitu hasil yang diterima lebih cepat (kurang dari 3 jam), lebih spesifik daripada RT-PCR konvensional oleh karena menggunakan probe, dan mengurangi potensi kontaminasi oleh karena sampel tidak dimanipulasi setelah amplifikasi (Trani et al.
11 informasi awal yang dapat digunakan sebagai dasar dalam menentukan tindakan yang cepat, sedangkan metode RT-PCR konvensional biasanya akan dilanjutkan dengan proses pengurutan oligonukleotida untuk melihat lebih jauh karakter virus AI seperti hubungan kekerabatan, adanya mutasi, atau untuk menentukan patogenitas virus AI (Hewajuli dan Dharmayanti 2008).
Virus AI merupakan virus RNA untai tunggal sehingga pada reaksi PCR diperlukan suatu tahap transkripsi balik oleh enzim reverse transcriptase untuk mendapatkan urutan DNA yang merupakan komplementer dari urutan RNA virus (complementary DNA atau cDNA). Prinsip reaksi RT-PCR adalah ekstraksi RNA virus yang kemudian disintesis menjadi cDNA menggunakan enzim reverse transcriptase.Pada tahap berikutnya cDNA dijadikan cetakan dalam reaksi PCR untuk menghasilkan DNA untai ganda melalui siklus denaturation, annealing, dan extension menggunakan primer spesifik.Enzim reverse transcriptase yang umum digunakan adalah Taq DNA polymerase yang merupakan enzim yang tahan panas dan dapat bekerja pada suhu tinggi, serta memiliki kecepatan polimerase dan kemampuan menggabungkan nukleotida dengan suatu primer secara terus-menerus tanpa terdisosiasi dari kompleks primer-DNA cetakan (Yuwono 2006). Pada PCR konvensional hasil diagnosis ditentukan berdasarkan ada tidaknya amplikon yang terlihat sebagai pita pada gel elektroforesis. Elektroforesis adalah proses migrasi fragmen DNA di dalam gel yang direndam dalam larutan penyangga. Proses migrasi tersebut berjalan mengikuti arus listrik dari kutub negatif menuju ke kutub positif. Keseluruhan proses diagnosis menggunakan RT-PCR konvensional memerlukan waktu kurang lebih 4–5 jam. Metode Real-time
RT-PCR dikembangkan untuk dapat melakukan uji lebih cepat. Di dalam metode tersebut tahapan elektroforesis dihilangkan sehingga waktu yang diperlukan lebih singkat (Trani et al. 2005; Hewajuli dan Dharmayanti 2008).
Prinsip kerja Real-time RT-PCR hampir sama dengan RT-PCR konvensional yaitu melalui denaturation, annealing, dan extension pada 1 siklus. Perjalanan proses reaksi-reaksi tersebut setiap siklus dapat dilihat per satu satuan waktu. Di dalam Real-time RT-PCR digunakan suatu penanda yang disebut probe yang menempel pada suatu urutan DNA. Probe tersebut dilengkapi dengan pembawa sinyal (reporter) dan penahan sinyal (quencher). Pada saat primer melakukan perpanjangan rangkaian DNA yang diperantarai oleh enzim polimerase, proses perpanjangan akan menabrak probe yang menyebabkan terlepasnya ikatan reporter dan quencher. Terlepasnya ikatan tersebut mengakibatkan terbacanya emisi sinyal reporter oleh perangkat dalam mesin PCR yang akan dimunculkan dalam bentuk suatu grafik penambahan kopi DNA per satuan siklus PCR (Hewajuli dan Dharmayanti 2008; Sakurai dan Shibasaki 2012).
Pengurutan Oligonukleotida
12
dalam analisis epidemiologi untuk identifikasi geografi dan asal-usul dari suatu spesies virus AI, mengetahui ada tidaknya mutasi, dan untuk menentukan hubungan genetik virus tersebut dengan virus-virus AI sebelumnya yang telah diketahui karakter genetiknya (Dharmayanti et al. 2004; WHO 2006;OIE 2014).
Hubungan Kekerabatan
Menurut World Health Organization (2012) konstruksi filogenetik dilakukan atas dasar pendekatan terhadap variasi urutan oligonukleotida gen hemaglutinin H5 yang telah dipublikasikan, yang merupakan perkembangan dari virus AI H5N1 A/goose/Guangdong/1996. Virus-virus AI H5N1 yang bersirkulasi dikelompokkan menjadi klaster menurut karakteristik filogenetik dan homologi urutan oligonukleotida dari gen HA. Berdasarkan kriteria yang digunakan dalam membedakan kelompok-kelompok yang bervariasi dari gen HA H5, sistem ini mengidentifikasi 20 klaster virus AI yang berbeda. Klaster-klaster tersebut didefinisikan berdasarkan kriteria : 1) digolongkan sebuah klaster baru apabila memiliki rata-rata persentase jarak pasangan nukleotida antar spesies (average pairwise distance) lebih dari 1.5 % dari klaster yang telah ada dan terdefinisi sebelumnya, 2) hasil analisis filogenetik dan keragaman sekuen HA menunjukkan
sharing common ancestral node dengan nilai bootstrap >60 % pada nodus filogenetik yang menunjukkan klaster setelah 1000 neighbor-joining bootstrap replicates. Sejalan dengan evolusi virus AI, terdapat potensi terbentuknya klaster-klaster baru secara periodik. Apabila terdapat klaster-klaster baru yang memenuhi kriteria tersebut, maka akan didefinisikan sebagai klaster yang terpisah.
Mutasi Virus AI
Virus AI memiliki 2 mekanisme untuk mempertahankan diri di dalam lingkungan, yaitu dengan cara mutasi dan kemampuan untuk melakukan reasorsi genetik. Material virus AI yang berupa RNA untai tunggal bersegmen ini memberi peluang terjadinya pertukaran informasi genomik di antara virus influenza A. Antigen permukaan yang dimiliki virus AI dapat berubah secara periodik, dikenal dengan istilah antigenic drift dan antigenic shift. Antigenic drift
merupakan perubahan minor antigenik yang terjadi pada satu titik dari gen HA atau NA yang dapat menyebabkan perubahan struktur permukaan virus sehingga antibodi yang telah terbentuk oleh tubuh sel induk semang akibat proses vaksinasi tidak mampu mengenali keberadaan virus tersebut, sedangkan antigenic shif tmerupakan perubahan genetik virus yang lebih besar, meliputi minimal 1 segmen dari 8 segmen genom virus yang memungkinkan munculnya strain atau varian virus baru(Munch et al. 2001).
13 baru virus AI juga dapat melakukan adaptasi dan evolusi untuk menghasilkan strain baru yang berbeda dengan virus-virus AI sebelumnya dan lebih virulen.Mutasi pada materi genetik dapat menimbulkan perubahan polipeptida virus, yaitu sekitar 2–3 kali substitusi asam amino per tahun (Capua et al. 2000).
Penyakit AI pada Unggas Air
Unggas air diketahui sebagai inang dari semua subtipe virus AI sehingga memberikan resiko kesehatan yang sangat serius terhadap spesies hewan lain secara luas dan memungkinkan terjadinya pencampuran genetik (genetic mixing). Meskipun beberapa subtipe virus AI yang terdapat dalam tubuh inang alami bersifat tidak patogen atau tidak virulen tetapi keberadaannya menyebabkan inang alami tersebut menjadi reservoir virus AI (Susanti et al. 2009; Hewajuli dan Dharmayanti 2012).
Adaptasi virus AI pada unggas air berjalan bertahun-tahun oleh karena unggas air yang berperan sebagai reservoir juga dapat menyebabkan virus HPAI H5N1 dalam unggas air menjadi avirulen (Webster et al. 1992; Horimoto dan Kawaoka 2001). Tingkat patogenitas virus HPAI H5N1 yang rendah dalam unggas air berhubungan dengan jumlah dan kemampuan yang terbatas dari protease sel unggas air untuk memecah daerah pemotongan HA0 (Susanti et al. 2008). Sebagai inang alami virus AI, unggas air juga berperan dalam adaptasi induk semang terhadap virus AI (Hulse-Post et al. 2005; Susanti et al. 2008). Karakteristik nonpatogenik HPAI H5N1 dalam unggas air menunjukkan bahwa evolusi virus telah mencapai titik keseimbangan pada inang alami ini. Sebagian besar virus mungkin telah dieliminasi oleh respon kekebalan dari unggas air tetapi sebagian kecil populasinya akan tetap bereplikasi dan dikeluarkan lewat feses (Hulse-Post et al. 2005).
Vaksinasi
14
2
METODE
Waktu dan Tempat
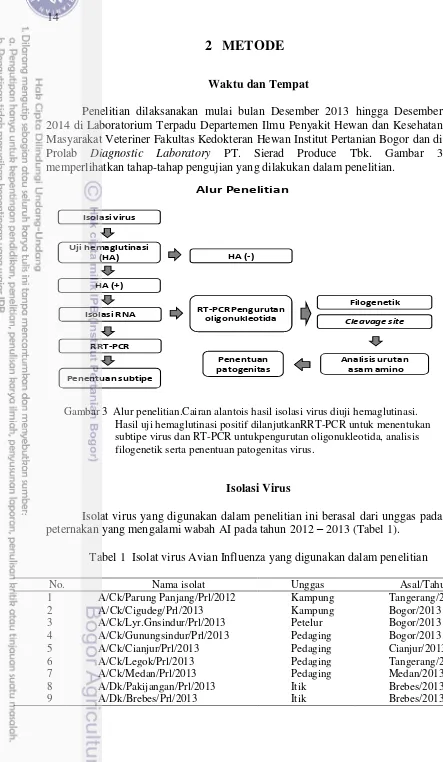
Penelitian dilaksanakan mulai bulan Desember 2013 hingga Desember 2014 di Laboratorium Terpadu Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner Fakultas Kedokteran Hewan Institut Pertanian Bogor dan di Prolab Diagnostic Laboratory PT. Sierad Produce Tbk. Gambar 3 memperlihatkan tahap-tahap pengujian yang dilakukan dalam penelitian.
Alur Penelitian
Gambar 3 Alur penelitian.Cairan alantois hasil isolasi virus diuji hemaglutinasi. Hasil uji hemaglutinasi positif dilanjutkanRRT-PCR untuk menentukan subtipe virus dan RT-PCR untukpengurutan oligonukleotida, analisis filogenetik serta penentuan patogenitas virus.
Isolasi Virus
Isolat virus yang digunakan dalam penelitian ini berasal dari unggas pada peternakan yang mengalami wabah AI pada tahun 2012 – 2013 (Tabel 1).
Tabel 1 Isolat virus Avian Influenza yang digunakan dalam penelitian
No. Nama isolat Unggas Asal/Tahun
1 A/Ck/Parung Panjang/Prl/2012 Kampung Tangerang/2012
15
Isolasi virus dilakukan menurut Swayne et al. (1998) dan OIE (2014). Sampel yang digunakan dapat berupa preparat usap ataupun organ yang diambil dari saluran pernafasan (trakea, paru-paru, kantong udara, dan eksudat sinus) atau saluran pencernaan (preparat usap kloaka). Selain itu virus juga dapat diisolasi dari hati, limpa, darah, jantung, ataupun otak. Pada penelitian ini sampel diambil dari trakea, paru-paru, dan otak. Prosedur isolasi dimulai dengan pembuatan suspensi organ 20 % dalam phosphate-buffered saline (PBS) yang telah mengandung antibiotik Penicillin10000 IU/ml, Streptomycin 2000 µg/ml, Kanamycin sulfate 650 µg/ml, dan Amphotericin B 20 µg/ml. Suspensi organ disentrifus 1500×g selama 15 menit. Supernatan hasil sentrifugasi diinokulasikan ke dalam Telur Ayam Berembrio (TAB) Specific Pathogen Free
(SPF) umur 10 hari sebanyak 0.2 ml/TAB, masing-masing 5 TAB untuk tiap isolat. Kontrol TAB tidak diinokulasi. Telur Ayam Berembrio (TAB) yang telah diinokulasi, diinkubasikan pada suhu 38–39 °C dengan kelembaban udara 60– 65 % dan dilakukan pengamatan setiap hari terhadap ada tidaknya embrio yang mati. Semua TAB dengan embrio yang mati disimpan pada suhu 4 °C selama semalam, selanjutnya dilakukan panen cairan alantois dan uji hemaglutinasi.
Uji Hemaglutinasi (HA)
Uji hemaglutinasi dilakukan dengan metode hmaglutinasi cepat dan hemaglutinasi dengan mikrotitrasi menurut Office International des Epizooties (OIE) (2014). Uji HA cepat dilakukan dengan cara mencampukan 1 bagian yang sama antara cairan alantois dengan Sel Darah Merah (SDM) ayam dan diamati terhadap terjadinya aglutinasi. Contoh hasil uji hemaglutinasi cepat dapat dilihat pada Gambar 4.
A B C
Gambar 4 Gambaran hasil uji hemaglutinasi cepat. A dan B hasil positifendapan SDM berbentuk butiran-butiran atau gumpalan, C hasil negatifendapan berbentuk bulatan dengan tepiberbatas jelas.
Uji hemaglutinasi dengan mikrotitrasi dilakukan dengan terlebih dahulu meletakkan 0.025 ml PBS pada semua lubang V-bottomed microtitre plate.
16
0.025 ml PBS ditambahkan ke semua lubang. Selanjutnya ditambahkan 0.025 ml SDM 1 % ke semua lubang, dilakukan pencampuran, dan ditunggu 40 menit pada suhu ruang. Titer HA ditentukan dengan cara memiringkan microtitre plate dan mengamati ada tidaknya aliran ke bawah dari SDM. Titer HA merupakan pengenceran tertinggi pada lubang yang menunjukkan terjadinya hemaglutinasi (tidak terjadi aliran ke bawah dari SDM). Contoh hasil uji hemaglutinasi lambat dapat dilihat pada Gambar 5. Nilai HA dengan pengenceran 1/2, 1/3, 1/5, 1/7, dan 1/9 dapat dilihat pada Lampiran 1.
Gambar 5Gambaran hasil uji hemaglutinasidengan mikrotitrasi. Titer HA=(32+48+40+56+36)/5=42 HAU
Identifikasi H5 dan N1 dengan Real-timeReverse-transcription Polymerase Chain Reaction (RRT-PCR)
Uji PCR dengan Real-time RT-PCR digunakan untuk menentukan subtipe H5 dan N1.Ekstraksi RNA virus dilakukan menurut protokol QIAamp Viral RNA Mini Kit (Qiagen 2010). Untuk identifikasi H5 dilakukan RRT-PCR dengan primer forward H5f-53 5ʹ-ACATGCCCAAGACATACTGGAA-3ʹ, primer
reverse H5r-182 5ʹ-GAATTCGTCACACATTGGGTTTC-3ʹ, dan probe H5 Probe-79 FAM-CACACAACGGGAAGCTCT-GCGATCT-TAMRA (Chen et al. 2007). Komposisi larutan PCR yang digunakan adalah 12.5 µl 2× Quantifast Probe RT-PCR Master Mix, 1 µl primer H5f 0.8 µM, 1 µl primer H5r 0.8 µM, 1 µl probe 0.2 µM, 0.25 µl Quantifast RT Mix, 2 µl template RNA 100 ng, dan 7.25 µl RNase free-water sehingga volume total larutan PCR menjadi 25 µl. Proses PCR dilakukan di dalam Qiagen Rotor-Gene Q 2plex HRM System dengan pengaturan suhu untuk reverse transcription adalah 50 °C selama 10 menit, inisiasi/aktivasi 95 °C selama 5 menit, denaturasi 95°C selama 15 detik, dan kombinasi annealing-extension 52 °C selama 60 detik. Siklus PCR diatur sebanyak 40 kali.
17 yang tidak berhasil diidentifikasi dengan menggunakan Real-time RT PCR untuk N1, selanjutnya diuji dengan RT PCR konvensional N1.
Identifikasi Neuraminidase N1 dengan Reverse-transcription Polymerase Chain Reaction (RT-PCR)
Identifikasi neuraminidase N1 selanjutnya dilakukan menggunakan primer
forward N1-1 5ʹ-TTGCTTGGTCGGCAAGTGC-3ʹ dan primer reverse N1-2 5ʹ -CCAGTCCACCCATTTGGATCC-3ʹ (WHO 2007) dengan produk PCR sebesar 616 bp. Komposisi larutan PCR terdiri dari 5 µl 5× Qiagen OneStep RT-PCR Bufer, 1 µl dNTP Mix 10 mM, 1µl primer forward 10 µM, 1µl primer reverse 10 µM, 1 µl Qiagen OneStep RT-PCR Enzyme Mix, 1 µl RNA 1–2 µg, dan 15 µl RNase-free water sehingga volume total larutan PCR menjadi 25 µl. Larutan PCR ditempatkan pada mesin PCR dengan pengaturan suhu untuk reverse transcription
adalah 45 °C selama 60 menit, pre-denaturasi 95 °C selama 5 menit, denaturasi 95 °C selama 30 detik, annealing 58 °C selama 30 detik, extension 72 °C selama 40 detik dengan siklus PCR sebanyak 35 kali, dan final extension 72 °C selama 10 menit, selanjutnya dilakukan elektroforesis terhadap hasil amplifikasi PCR.Elektroforesis dilakukan pada gel agarose 1 % dalam larutan 1× TAE bufer dengan menggunakan pewarna Sybr safe DNA gel stain.
Reverse-transcription Polymerase Chain Reaction (RT-PCR) untuk Pengurutan Oligonukleotida
Proses pengurutan oligonukleotida dilakukan dengan primer HA01– HA645, H548F–H1215R, dan H5-1 – H5-3. Posisi masing-masing primer yang digunakan untuk proses tersebut dapat dilihat pada Gambar 6. Komposisi larutan untuk menghasilkan produk PCR yang akan digunakan dalam pengurutan oligonukleotida terdiri dari 10 µl 5× Qiagen OneStep RT-PCR Buffer, 2 µl dNTP Mix 10 mM, 1.5 µl primer forward 0.6 µM, 1.5 µl primer reverse 0.6 µM, 2 µl Qiagen OneStep RT-PCR Enzyme Mix, 10 µl Q solution, 2 µl RNA 1–2 µg, dan 21 µl RNase-free water sehingga volume total larutan PCR menjadi 50 µl. Larutan PCR ditempatkan pada mesin PCR dengan pengaturan suhu untuk reverse transcription adalah 50 °C selama 30 menit, pre-denaturasi 95 °C selama 15 menit, denaturasi 94 °C selama 30 detik, annealing 53 °C selama 60 detik, extension
72 °C selama 60 detik dengan siklus PCR sebanyak 40 kali, dan final extension 72 °C selama 10 menit. Proses PCR dilakukan terhadap 3 pasang primer yaitu primer forward HA01 5ʹ-TGGAGAAAATAGTGCTTCTTCTTGC-3ʹ dan reverse HA645 5ʹ-GGAAATATAGGTGGTTGGGTTTTG-3ʹ (Susanti 2008), primer
forward HA548F 5ʹ-CCAACCAGAGAAGGATCTTTTGG-3ʹ dan reverse
18
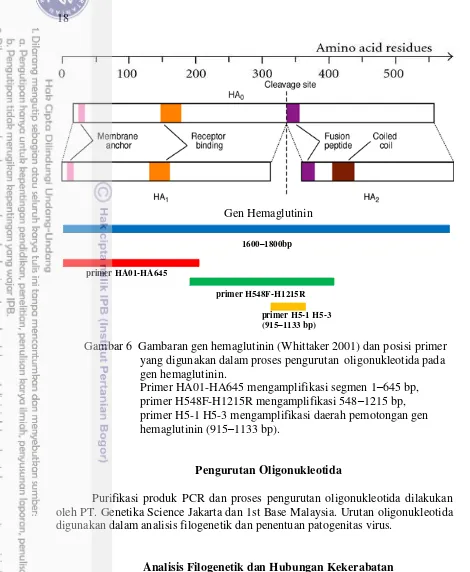
Gen Hemaglutinin
1600–1800bp
primer HA01-HA645
primer H548F-H1215R
primer H5-1 H5-3 (915–1133 bp)
Gambar 6 Gambaran gen hemaglutinin (Whittaker 2001) dan posisi primer yang digunakan dalam proses pengurutan oligonukleotida pada gen hemaglutinin.
Primer HA01-HA645 mengamplifikasi segmen 1–645 bp, primer H548F-H1215R mengamplifikasi 548–1215 bp, primer H5-1 H5-3 mengamplifikasi daerah pemotongan gen
hemaglutinin (915–1133 bp).
Pengurutan Oligonukleotida
Purifikasi produk PCR dan proses pengurutan oligonukleotida dilakukan oleh PT. Genetika Science Jakarta dan 1st Base Malaysia. Urutan oligonukleotida digunakan dalam analisis filogenetik dan penentuan patogenitas virus.
Analisis Filogenetik dan Hubungan Kekerabatan
Analisis hubungan kekerabatan antar isolat virus dilakukan dengan
19
3
HASIL DAN PEMBAHASAN
Kematian Embrio setelah Inokulasi Virus AI
Isolat 1, 2, 4, 6, 7, dan 8 menyebabkan kematian embrio 24–48 jam setelah inokulasi pada TAB, sedangkan inokulasi dengan isolat 3, 5, dan 9 menyebabkan embrio mati setelah 48 jam (Tabel 2 dan Tabel 3). Kematian embrio berkorelasi dengan virulensi dan patogenitas virus. Swayne et al. (1998) menyebutkan bahwa virus HPAI dapat menimbulkan kematian embrio dalam 24– 48 jam setelah inokulasi sebanyak 0.2 ml virus ke dalam ruang alantois TAB, sedangkan hasil penelitian Nuradji et al. (2008) menyebutkan bahwa virus HPAI membunuh embrio dalam waktu 20–24 jam setelah inokulasi atau maksimum 24– 36 jam. Kematian embrio yang terjadi antara 24–48 jam setelah inokulasi pada penelitian ini mengindikasikan bahwa isolat 1, 2, 4, 6, 7, dan 8 merupakan virus AI yang patogen.
Tabel 2 Hasil pengamatan embrio setelah inokulasi virus AI
No. <24 j 24–48 j 48–72 j 72–96 j >96 j
1 3 h 3 m - - -
2 3 h 3 m - - -
3 3 h 3 h 2m,1h 1 m -
4 3 h 3 m - - -
5 3 h 3 h 2 m, 1 h 1 m -
6 3 h 3 m - - -
7 3 h 3 m - - -
8 3 h 3 m - - -
9 3 h 3 h 3 m - -
K 3 h 3 h 3 h 3 h 3 h
j=jam;h=hidup; m=mati; K=kontrol
20
Tabel 3 Kematian embrio setelah inokulasi virus AI
Nomor Nama isolat Kematian embrio
1 A/Ck/Parung Panjang/Prl/2012 <48 jam
2 A/Ck/Cigudeg/Prl/2013 <48 jam
4 A/Ck/Gunungsindur/Prl/2013 <48 jam
6 A/Ck/Legok/Prl/2013 <48 jam
7 A/Ck/Medan/Prl/2013 <48 jam
8 A/Dk/Pakijangan/Prl/2013 <48 jam
3 A/Ck/Lyr.Gunungsindur/Prl/2013 >48 jam
5 A/Ck/Cianjur/Prl/2013 >48 jam
9 A/Dk/Brebes/Prl/2013 >48 jam
Korelasi antara Jumlah Virus dengan Aktivitas Hemaglutinasi dan Virulensi Virus
Uji hemaglutinasi digunakan untuk mengetahui jumlah virus yang dapat mengaglutinasi sel darah merah (SDM) dan merupakan suatu cara yang digunakan untuk mengetahui ada tidaknya agen penyebab hemaglutinasi seperti virus Influenza A dalam cairan alantois (Killian 2014). Progeni virus AI yang dilepaskan dari sel-sel terinfeksi dapat dideteksi dengan uji hemaglutinasi. Aglutinasi SDM oleh virus AI diperantarai oleh reaksi antara tempat pengikatan reseptor yang terdapat dalam molekul hemaglutinin dengan reseptor sialat (Louisirirotchanakul et al. 2007).
Hemaglutinin merupakan bagian dari virus yang dapat mengaglutinasi SDM. Menurut Swayne et al. (1998) protein H dari virus AI akan melekat pada reseptor SDM ayam. Aktifitas inilah yang menjadi dasar dalam uji hemaglutinasi untuk mendeteksi ada tidaknya virus yang diduga AI dalam cairan alantois. Waktu yang dibutuhkan untuk terjadinya aglutinasi cairan alantois yang diinokulasi virus AI adalah 15–30 detik (Hirst 1941). Hemaglutinasi terjadi karena virus dalam jumlah tertentu yang melekat pada SDM melalui hemaglutinin. Perlekatan tersebut akan membentuk jembatan protoplasma yang pada akhirnya akan membentuk massa yang dapat mengendap di dasar cawan mikro (Natih et al. 2010). Gambaran reaksi aglutininasi cepat terhadap virus AI dalam penelitian ini dapat dilihat pada Gambar 7.
21
Gambar 7 Hasil uji hemaglutinasi cepat cairan alantois setelah inokulasi virus AI. 1. A/Ck/ParungPanjang/Prl/2012,
2. A/Ck/Cigudeg/Prl/2013, 3. A/Ck/Lyr.Gunungsindur/Prl/2013 4. A/Ck/Gunungsindur/Prl/2013, 5. A/Ck/Cianjur/Prl/2013,
6. A/Ck/Legok/Prl/2013, 7. A/Ck/Medan/Prl/2013, 8. A/Dk/Pakijangan/Prl/2013,9. A/Dk/Brebes/Prl/2013.
Sejalan dengan pernyataan Hirst (1941) tersebut semua isolat dalam penelitian ini merupakan virus yang dapat mengaglutinasi SDM. Adanya perbedaan pola butiran-butiran endapan SDM diduga berkaitan dengan tinggi rendahnya titer HA dari virus-virus tersebut.Isolat 3, 5, dan 9 yang memperlihatkan hasil uji HA cepat dengan butiran-butiran endapan SDM yang halus ternyata memiliki titer HA yang lebih rendah dibandingkan dengan isolat-isolat lainnya. Titer HA berhubungan dengan tingginya jumlah virus dalam cairan alantois hasil inokulasi virus. Titer HA menunjukkan hasil negatif apabila jumlah virus kurang dari 105–106 embryo infectious dose (EID50)/ml (Swayne et al. 1998).
Uji ini bersifat kuantitatif, nilai 1 HAU adalah setara dengan 107 partikel virus (Angi 2008; Killian 2014).Menurut Beato et al. (2007) reaksi positif hemaglutinasi terjadi apabila titer HA berkisar antara 22–210 (4–1024 HAU).
Hasil pengukuran titer HA dari isolat-isolat dalam penelitian ini (Tabel 4) berkisar 18–1382 HAU dengan level tertinggi adalah isolat 8 (1382 HAU) dan paling rendah adalah isolat 3 (18 HAU). Menurut Wanasawaeng et al. (2008) embrio ayam yang diinokulasi dengan virus AI virulen biasanya akan mati dalam
1
6 7 8
4 2
9 5
22
waktu 32 jam dengan titer infektifitas antara 7.3–9.0 log2 titer HA atau 128–512 HAU. Sejalan dengan pernyataan tersebut dapat diasumsikan bahwa isolat virus 1, 2, 4, 6, 7, dan 8 dalam penelitian ini merupakan virus yang bersifat virulen dengan kisaran titer HA antara 343–1382 HAU.
Tabel 4 Hasil pengukuran titer HA
No. Nama isolat Titer HA (HAU)
1 A/Ck/Parung Panjang/Prl/2012 512
2 A/Ck/Cigudeg/Prl/2013 589 HAU diduga merupakan virus-virus AI yang kemungkinan telah mengalami mutasi atau reasorsi sehingga di dalam tubuh induk semang tidak mampu bereplikasi untuk mencapai titer hemaglutinasi yang seharusnya sehingga aktifitas hemaglutinasi yang dihasilkan kecil atau hampir tidak ada sama sekali (Scholtissek et al. 1988). Rott et al. (1980) menjelaskan bahwa setelah inokulasi cairan alantois dengan strain AI yang patogen, maka cairan tersebut akan mengandung titer virus yang tinggi. Inokulasi dengan strain non-patogenik juga akan menghasilkan titer virus yang tinggi dalam cairan alantois tetapi replikasi virus tersebut hanya terbatas pada epitel alantois dan tidak terjadi pada lapisan-lapisan lainnya. Perbedaan dalam tipe penyebaran virus ini didasarkan pada aktivasi yang berbeda dari daerah pemotongan proteolitik hemaglutinin. Hemaglutinin strain patogen dipecah pada setiap lapisan di dalam TAB sedangkan pada strain non-patogenik hanya dipecah pada epitel alantois.
Subtipe Virus Avian InfluenzaIsolat 2012–2013
Hasil RRT-PCR berupa nilai threshold cycle (Ct) yang merupakan jumlah siklus PCR pada saat terjadinya peningkatan fluoresensi yang dapat dideteksi secara signifikan pada tahap awal dari sampel yang positif. Nilai Ct mewakili perubahan jumlah siklus pada saat reaksi amplifikasi positif tersebut dapat diukur (Payungporn et al. 2006). Hasil RRT-PCR positif apabila nilai Ct < 33, sedangkan hasil disebut negatif apabila nilai Ct > 35 (SADC 2010).
23 Gambaran elektroforesis menunjukkan hasil positif N1 untuk ketiga isolat tersebut, seperti ditampilkan pada Gambar 8.
Tabel 5 Nilai Ct dan jumlah kopi RNA hasil uji RRT-PCR H5 dan N1
No. Ct Jumlah kopi RNA/µl
H5 N1 H5 N1
1 20.02 13.90 1381543 283112136
2 17.22 15.16 63815531 125437247
4 16.54 23.75 92686366 481532
6 15.94 16.12 128404046 67493217
7 16.18 15.14 112597534 126602979
8 17.06 17.81 6975631 22448560
3 16.89 tba 76147115 tba
5 17.85 tba 45025043 tba
9 20.54 tba 10331331 tba
a
Hasil tidak terbaca oleh mesin PCR
Aplikasi RT-PCR baik real-time maupun konvensional telah digunakan secara luas dalam deteksi virus influenza secara langsung dari material terinfeksi. Prosedur RT-PCR dapat digunakan untuk mengidentifikasi dan menentukan subtipe dari virus AI (Lee et al. 2001). Menurut Trani et al. (2006) dan Li et al.
(2008) RRT-PCR merupakan metode yang lebih spesifik, 10–100 kali lebih sensitif, lebih mampu mengurangi resiko kontaminasi, dan lebih cepat dibandingkan RT-PCR. Akan tetapi dalam penelitian ini uji RRT-PCR untuk menentukan subtipe neuraminidase terhadap isolat 3, 5, dan 9 menunjukkan hasil negatif N1, sedangkan dengan metode RT-PCR konvensional menunjukkan hasil positif. Lee et al. (2001) menyatakan bahwa keberhasilan proses amplifikasi dalam PCR ditentukan oleh kesesuaian antara desain primer dengan urutan oligonukleotida dari virus yang dideteksi. Dalam identifikasi subtipe diperlukan primer yang bersifat spesifik yang didesain berdasarkan urutan nukleotida yang bersifat conserveddalam subtipe tersebut. Semakin banyak urutan nukleotida dengan homologi yang tinggi dari suatu subtipe digunakan dalam penyusunan primer, akan diperoleh susunan nukleotida primer yang conserved terhadap subtipe tersebut. Dalam penelitian ini primer N1 (Payungporn et al. 2006) yang
Gambar 8 Produk PCR hasil amplifikasi dengan primer N1-1 N1-2
24
digunakan pada uji RRT-PCR diduga kurang memiliki kesesuaian dengan urutan oligonukleotida neuraminidase isolat 3, 5, dan 9 dibandingkan dengan primer RT-PCR N1 dari WHO(WHO 2007). Spesifitas RT-RT-PCR ditentukan oleh perbedaan urutan oligonukleotida dari strain yang dideteksi. Virus AI dengan subtipe yang berbeda memiliki urutan oligonukleotida yang berbeda dengan kisaran 20–74 % (Lee et al. 2001). Dugaan lainnya adalah karena virus AI terus berevolusi sehingga terjadi diversifikasi genetik dari strain-strain H5N1 yang telah ada sebelumnya, sehingga primer N1 menurut Payungporn et al. (2006) tidak lagi sesuai. Hal ini diperkuat oleh WHO (2007) yang telah merekomendasikan penggunaan serangkaian primer untuk mengantisipasi kemungkinan adanya pergeseran genetik virus-virus AI yang telah bersirkulasi di seluruh dunia. Urutan nukleotida yang bervariasi dari genetik virus-virus AI yang digunakan dalam penyusunan primer dapat meningkatkan sensitivitas uji RT-PCR dalam mendeteksi virus AI.
Hasil identifikasi subtipe virus AI dalam penelitian ini mengindikasikan adanya 2 kelompok virus AI H5N1 yang memiliki perbedaan karakter di antara keduanya. Isolat 3, 5, dan 9 yang juga termasuk ke dalam subtipe H5N1 memiliki fenotipe yang berbeda dengan 6 isolat lainnya.Diduga adanya perbedaan urutan oligonukleotida pada segmen neuraminidase di antara kedua kelompok virus H5N1 tersebut ikut berperan dalam menyebabkan terjadinya perbedaan fenotipe di antara keduanya, selain itu juga terdapat dugaan bahwa isolat 3, 5, dan 9 berasal dari strain virus yang telah berevolusi sehingga mengalami pergeseran genetik pada segmen neuraminidase apabila dibandingkan dengan virus-virus AI lainnya yang bersirkulasi di Indonesia.
Hasil RRT-PCR dalam penelitian ini (Tabel 5) menunjukkan kisaran jumlah kopi RNA 106–108 untuk isolat-isolat yang menunjukkan hasil positif H5 dan 105–108 untuk isolat-isolat positif N1. Produk RRT-PCR dideteksi menggunakan urutan probe yang spesifik sehingga hanya target yang tepat yang diamplifikasi.Probe HA yang spesifik dapat digunakan untuk kuantifikasi virus dengan subtipe yang berbeda dalam satu campuran virus (Spackman et al. 2002; Lee dan Suarez 2004). Pada uji RRT-PCR terhadap H5 besarnya nilai Ct dan jumlah kopi RNA tidak menunjukkan korelasi dengan hasil isolasi virus dan uji hemaglutinasi. Isolat-isolat yang pada uji RRT-PCR positif H5 menunjukkan hasil negatif N1 ternyata memiliki besaran nilai Ct dan jumlah kopi RNA yang hampir sama atau sebanding dengan isolat-isolat positif N1. Hal ini dimungkinkan karena dalam RRT-PCR kuantitas RNA yang sangat kecil dapat dideteksi dan diamplifikasi, sesuai dengan pernyataan Lee et al. (2001) dan Munch et al. (2001) bahwa uji RRT-PCR merupakan uji yang memiliki sensitivitas dan spesifisitas yang tinggi.
Pengurutan Oligonukleotia Gen Hemaglutinin
25 genetiknya, dan untuk menentukan patotipe virus AI (Dharmayanti et al. 2004; Afonso 2007; OIE 2014).
Gambar 9 Produk PCR hasil amplifikasi dengan primer HA01-HA645. M. Marker 1kb, 1. A/Ck/Parung Panjang/Prl/2012,
2. A/Ck/Cigudeg/Prl/2013,3. Ck/Lyr.Gunungsindur/Prl/2013, 4. A/Ck/Gunungsindur/Prl/2013, 5. A/Ck/Cianjur/Prl/2013, 6. A/Ck/Legok/Prl/2013, 7. A/Ck/Medan/Prl/2013,
8. A/Dk/Pakijangan/Prl/2013, 9. A/Dk/Brebes/Prl/2013, K(-). Kontrol negatif, K(+). Kontrol positif.
Gambar 10 Produk PCR hasil amplifikasi dengan primer H548F-HA1215R. M. Marker 1kb, 1. A/Ck/Parung Panjang/Prl/2012,
2. A/Ck/Cigudeg/Prl/2013,3. Ck/Lyr.Gunungsindur/Prl/2013, 4. A/Ck/Gunungsindur/Prl/2013, 5. A/Ck/Cianjur/Prl/2013, 6. A/Ck/Legok/Prl/2013, 7. A/Ck/Medan/Prl/2013,
8. A/Dk/Pakijangan/Prl/2013, 9. A/Dk/Brebes/Prl/2013, K(-). Kontrol negatif, K(+). Kontrol positif.
Gambar 11 Produk PCR hasil amplifikasi dengan primer H5-1 H5-3. M. Marker 1kb, 1. A/Ck/Parung Panjang/Prl/2012,
2. A/Ck/Cigudeg/Prl/2013,3. Ck/Lyr.Gunungsindur/Prl/2013, 4. A/Ck/Gunungsindur/Prl/2013, 5. A/Ck/Cianjur/Prl/2013, 6. A/Ck/Legok/Prl/2013, 7. A/Ck/Medan/Prl/2013,
26
Dalam penelitian ini hasil pengurutan oligonukleotida digunakan untuk menentukan patogenitas virus dan untuk mengetahui hubungan kekerabatan antara virus-virus yang diisolasi. Sebelum dilakukan proses tersebut terlebih dahulu dilakukan PCR terhadap RNA hasil ekstraksi virus dengan menggunakan primer HA01-HA645, H548F-H1215R, dan primer H5-1 H5-3 yang khusus mengamplifikasi daerah pemotongan gen hemaglutinin.Hasil elektroforesis produk PCR yang akan dilanjutkan proses pengurutan oligonukleotida ditampilkan pada Gambar 9, Gambar 10, dan Gambar 11. Urutan oligonukleotida isolat-isolat virus yang digunakan dalam penelitian ini dapat dilihat pada Lampiran 2 dan Lampiran 3.
Produk PCR diukur konsentrasinya untuk mengetahui korelasi antara gambaran elektroforesis dengan tinggi rendahnya konsentrasi produk PCR. Pada penelitian ini hanya dilakukan pengukuran konsentrasi produk PCR setelah amplifikasi cDNA virus dengan primer H548F-H1215R. Hasil pengukuran tidak menunjukkan korelasi antara konsentrasi produk PCR hasil amplifikasi (Tabel 6) dengan gambaran elektroforesis (Gambar 10).
Tabel 6 Hasil pengukuran konsentrasi produk PCR setelah amplifikasi dengan primer H548F-H1215R
No. Nama isolat Konsentrasi
produk PCR (ng/µl)
1 A/Ck/Parung Panjang/Prl/2012 559.3
2 A/Ck/Cigudeg/Prl/2013 636.85
4 A/Ck/Gunungsindur/Prl/2013 622.45
6 A/Ck/Legok/Prl/2013 602.95
7 A/Ck/Medan/Prl/2013 590.95
8 A/Dk/Pakijangan/Prl/2013 634.85
3 A/Ck/Lyr.Gunungsindur/Prl/2013 628.4
5 A/Ck/Cianjur/Prl/2013 585.65
9 A/Dk/Brebes/Prl/2013 626.5
27 produk PCR yang tinggi tetapi ekspresi gen dari 3 isolat yaitu 3, 5, dan 9 memperlihatkan hasil yang berbeda dibandingkan dengan isolat-isolat lainnya. Hasil dari proses RT-PCR tersebut selain juga dapat digunakan untuk menentukan subtipe virus juga dapat dilanjutkan dengan analisis perbandingan urutan oligonukleotida dan filogenetik. Hasil-hasil analisis tersebut dapat memberikan dan melengkapi informasi-informasi yang berhubungan dengan karakter virus AI yang diisolasi (Lee et al. 2001).
Pengurutan Oligonukleotida Daerah Pemotongan Gen Hemaglutinin
Produk PCR hasil amplifikasi dengan primer yang khusus mengamplifikasi daerah pemotongan gen hemaglutinin memperlihatkan urutan asam amino arginin (R) atau lisin (K) yang berulang, seperti ditampilkan pada Tabel 7 dan Lampiran 4. Virus AI dengan urutan asam amino arginin atau lisin berulang merupakan virus AI yang bersifat patogen (Dharmayanti et al. 2005; Susanti et al. 2008; Wibawa et al. 2012). Karakteristik virulensi AI yang membedakan antara LPAI dan HPAI adalah kemampuan dari virus HPAI untuk mengalami proses pembelahan oleh protease yang dapat ditemukan di hampir semua jenis dari induk semang. Gen hemaglutinin (HA) yang dihasilkan sebagai polipeptida tunggal dipotong menjadi subunit HA1 dan HA2 sebelum virus menjadi infeksius. Proses pembelahan ini penting bagi domain fusi untuk menjadi aktif selama proses replikasi virus.
Tabel 7 Pola asam amino daerah pemotongangen hemaglutinin
Nomor Nama isolat Pola asam amino
1 A/Ck/Parung Panjang/Prl/2012 PQRESRRKKR/GLF
2 A/Ck/Cigudeg/Prl/2013 PQRESRRKKR/GLF