SELEKSI BAKTERI PENAMBAT NITROGEN DAN PENGHASIL
HORMON IAA (Indole Acetic Acid)
DAN UJI POTENSINYA
TERHADAP PERTUMBUHAN DAN PRODUKSI TANAMAN
KEDELAI (Glycine max L.)
SKRIPSI
RATNA SARI TARIGAN
080805028
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
SELEKSI BAKTERI PENAMBAT NITROGEN DAN PENGHASIL HORMON IAA (Indole Acetic Acid)DAN UJI POTENSINYA TERHADAP
PERTUMBUHAN DAN PRODUKSI TANAMAN KEDELAI (Glycine max L.)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
RATNA SARI TARIGAN 080805028
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : SELEKSI BAKTERI PENAMBAT NITROGEN
DAN PENGHASIL HORMON IAA (Indole Acetic Acid) DAN UJI POTENSINYA TERHADAP PERTUMBUHAN DAN PRODUKSI TANAMAN KEDELAI (Glycine max L.)
Kategori : SKRIPSI
Nama : RATNA SARI TARIGAN
Nomor Induk Mahasiswa : 080805028
Program Studi : SARJANA (S-1) BIOLOGI Departemen : BIOLOGI
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Komisi Pembimbing Pembimbing 2
:
Diluluskan di
Medan, Pebruari 2013
Pembimbing 1
Dra. Elimasni. M.Si Dr. It. Jamilah, M.Sc
NIP. 19650524 199103 2 001 NIP. 19631012 199103 2 003
Diketahui/Disetujui oleh
Departemen Biologi FMIPA USU Ketua,
PERNYATAAN
SELEKSI BAKTERI PENAMBAT NITROGEN DAN PENGHASIL HORMON IAA (Indole Acetic Acid) DAN UJI POTENSINYA TERHADAP PERTUMBUHAN DAN
PRODUKSI TANAMAN KEDELAI (Glycine max L.)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Februari 2013
080805028
PENGHARGAAN
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas berkat dan rahmat-Nya, sehingga penulis dapat menyelesaikan skripsi yang berjudul “Seleksi Bakteri Penambat Nitrogen dan Penghasil Hormon IAA (Indole Acetic Acid)dan Uji Potensinya Terhadap Pertumbuhan dan Produksi Tanaman Kedelai (Glycine max L.)” sebagai salah satu syarat untuk mendapatkan gelar Sarjana Sains (S.Si) pada Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam di Universitas Sumatera Utara.
Ucapan terima kasih penulis sampaikan kedapa Ibu Dr. It. Jamilah, M.Sc selaku dosen Pembimbing I dan Ibu Dra. Elimasni. M.Si selaku dosen Pembimbing II atas bimbingan, arahan, dan dukungannya dalam pembuatan skripsi ini. Penulis juga mengucapkan terima kasih kepada Ibu Dra. Nunuk Priyani, M.Sc dan Bapak Drs. M. Zaidun Sofyan, M.Si selaku dosen Penguji yang telah memberi banyak saran dan kritik membangun dalam penyempurnaan skripsi ini.
Pada kesempatan ini ungkapan terima kasih penulis sampaikan kepada ayahanda tercinta Alm. Warimalem Tarigan dan ibunda tercinta Setianna br Sinulingga karena selalu memberikan doa, dukungan, dan kasih sayang yang tak ternilai harganya sehingga penulis dapat menyelesaikan skripsi ini. Ucapan terima kasih penulis sampaikan juga kepada pendamping ibu dan ayah penulis, Bapak Firman Pinem dan Ibu Kristina Tarigan yang telah bersedia memberikan perhatian kepada penulis. Ucapan terima kasih penulis sampaikan juga kepada keluarga besar yang telah memberikan doa dan semangat kepada penulis.
Jika ada saran dan kritik yang membangun, penulis akan menerima dengan hati terbuka, karena penulis menyadari sebagai manusia tidaklah sempurna. Akhir kata penulis mengharapkan semoga tulisan ini bermanfaat bagi kita semua.
Medan, Februari 2013
SELEKSI BAKTERI PENAMBAT NITROGEN DAN PENGHASIL HORMON IAA (Indole Acetic Acid)DAN UJI POTENSINYA TERHADAP
PERTUMBUHAN DAN PRODUKSI TANAMAN KEDELAI (Glycine max L.)
ABSTRAK
Bakteri rizosfer yang menambat nitrogen dan menghasilkan IAA (Indol Acetic Acid) dapat dimanfaatkan sebagai salah satu upaya peningkatan pertumbuhan dan produksi tanaman kedelai. Penelitian ini telah dilakukan di laboratorium Mikrobiologi dan pengujian secara in-vivo di rumah kasa, Departemen Biologi, FMIPA, Universitas Sumatera Utara dari bulan Februari hingga September tahun 2012. Penelitian ini bertujuan untuk menyeleksi bakteri penambat nitrogen dan penghasil IAA paling potensial dan melihat pengaruhnya terhadap pertumbuhan dan produksi tanaman kedelai yang ditanam di tanah kuning yang diduga mengandung sedikit unsur hara. Penambahan bakteri dilakukan pada tanah penanaman kedelai yang berumur 1 minggu dengan cara menyiramkannya pada daerah rizosfer. Hasil penelitian menunjukkan bahwa konsentrasi IAA tertinggi dihasilkan oleh isolat I3 sebanyak 33.3 ppm,
sedangkan konsentrasi nitrogen yang tertinggi dihasilkan oleh N3 dengan konsentrasi
29.93 ppm. Perlakuan penambahan gabungan isolat N3 dan I3 (N3I3) menunjukkan
pengaruh terbaik terhadap pertumbuhan dan produksi tanaman, seperti berat buah, volume akar, tinggi tanaman, jumlah buah, berat basah dan berat kering tanaman kedelai. Pemakaian bakteri penambat nitrogen dan penghasil IAA secara bersamaan dapat meningkatkan pertumbuhan tanaman dan produksi kedelai secara signifikan (P < 0.05).
SELECTION OF NITROGEN FIXING AND IAA (Indol Acetic Acid) PRODUCING BACTERIA AND ITS POTANTIAL IN INFLUENCE GROWTH
AND PRODUCTION OF SOYBEAN (Glycine max L.)
ABSTRACT
Rizosphere bacteria which is fix nitrogen and produce IAA (Indol Acetic Acid) is used as an effort to increase both growth and production of soybean plants. The research had been done in the Microbiology laboratory and in the home screen, Department of Biology, Faculty of Mathematics and Natural Sciences, University of North Sumatera from February until September 2012. The aim of this study is to select the most potential nitrogen fixing and IAA producing bacteria then examine their effect on growth of soybean plants which had been grown in soil containing less nutrients. The in vivo test has been done on seven days old of soybean plants. Bacteria were introduced by pouring them on the rhizosphere of plants. The results showed that the highest IAA concentration was produced by I3 isolate which was 33.3 ppm and the
highest concentration of nitrogen was produced by N3 isolate which was 29.93 ppm.
Combination between N3 and I3 isolates (N3I3) showed the best results in affecting the
growth and production of plants, among which the weight of fruit, root volume, plant height, number of fruits, fresh and dry weights of soybean plants. The use of nitrogen fixing and producing IAA bacteria simultaneously can significantly increase the growth of soybean plants (P < 0.05).
DAFTAR ISI
1.5Manfaat Penelitian 3
BAB 2 TINJAUAN PUSTAKA
2.1Kedelai 4
2.2Mikroorganisme pada Tanah 5
2.3Mikroorganisme Penambat Nitrogen 6
2.4 Peran Nitrogen bagi Tanaman 7
2.5Mekanisme Penambat Nitrogen 7
2.6Mikroorganisme Penghasil IAA 8
2.7Peran IAA bagi Tanaman 9
BAB 3 BAHAN DAN METODE
3.1Waktu dan Tempat 10
3.2Alat dan Bahan 10
3.3Metode Penelitian 11
3.3.1 Pengambilan Sampel 11
3.3.2 Isolasi dan Pemurnian Bakteri Penambat Nitrogen 11 3.3.3 Uji Kemampuan Bakteri dalam Menambat Nitrogen 12
3.3.4 Penentuan Kurva Standar IAA 13 3.3.5 Isolasi dan Pemurnian Bakteri Penghasil IAA 13
3.3.6 Uji Kemampuan Bakteri dalam Menghasilkan IAA
Selama Masa Pertumbuhan secara In-vitro 13
3.3.7 Uji Sinergisme 14
3.3.8 Uji Pengaruh Bakteri IAA dan Penambat Nitrogen
Terhadap Pertumbuhan Kedelai 15
BAB 4 HASIL DAN PEMBAHASAN
4.2 Kemampuan Bakteri dalam Menghasilkan IAA Selama Masa
Pertumbuhan Secara In-vitro 17 4.3 Isolasi dan Karakterisasi Bakteri Penambat Nitrogen 20 4.4 Uji Kemampuan Bakteri dalam Menambat Nitrogen 22 4.5 Uji Sinergis Bakteri IAA dengan Bakteri Penambat Nitrogen 24 4.6 Pengaruh Bakteri IAA dan Penambat Nitrogen dalam Mendukung
Pertumbuhan dan Produksi Tanaman Kedelai (Glyzine max L.) 25
BAB 5 KESIMPULAN DAN SARAN
5.1 Kesimpulan 30
5.2 Saran 30
DAFTAR PUSTAKA 31
DAFTAR LAMPIRAN
Halaman Lampiran 1 Pembuatan Media Selektif dan Reagen Salkowski 34
Lampiran 2 Penentuan Kurva Standart IAA (Indole Acetic Acid) 35
Lampiran 3 Data Pengamatan Nilai Absorban Setiap Isolat 37
Lampiran 4 Data Pengamatan Terhadap Pertumbuhan Tanaman Kedelai (Glycine max L.)
38
Lampiran 5 Data Uji Statistik Rancangan Acak Lengkap Terhadap Parameter Pertumbuhan Tanaman Kedelai (Glyzine max L.)
41
DAFTAR TABEL
Halaman Tabel 1 Karakterisasi Morfologi Bakteri Penghasil IAA 16
Tabel 2 Uji Biokimia Bakteri Penghasil IAA 17
Tabel 3 Pertumbuhan Jumlah Koloni Bakteri Penghasil IAA 19
Tabel 4 Karakterisasi Morfologi Bakteri Penambat Nitrogen 20
Tabel 5 Karakterisasi Biokimia Bakteri Penambat Nitrogen 21
Tabel 6 Pelikel yang Terbentuk oleh Bakteri Penambat Nitrogen 23
Tabel 7 Rata-rata Pengukuran Pertumbuhan dan Produksi Tanaman Kedelai
25
Tabel 8 Nilai Persamaan Garis Regresi Kurva Standart IAA 35
Tabel 9 Nilai Rata-rata Konsentrasi IAA secara In-vitro 36
Tabel 10 Pengukuran Nilai Absorban Setiap Isolat 37
Tabel 11 Hasil Pengukuran Tinggi Tanaman dan Jumlah Daun 38
Tabel 12 Hasil Perhitungan Jumlah Bunga Dan Buah Tanaman Kedelai
(Glycine max L.) 39
Tabel 13 Hasil Perhitungan Berat Basah, Berat kering Tanaman,
Volume Akar, Berat Buah dan Jumlah Polong 40
Tabel 14 Daftar Sidik Ragam Parameter Tinggi Tanaman 41
Tabel 15 Daftar Sidik Ragam Parameter Jumlah Daun 41
Tabel 16 Daftar Sidik Ragam Parameter Jumlah Bunga 41
Tabel 17 Daftar Sidik Ragam Parameter Jumlah Buah 41
Tabel 18 Daftar Sidik Ragam Parameter Berat Basah 41
Tabel 19 Daftar Sidik Ragam Parameter Berat Kering 41
Tabel 20 Daftar Sidik Ragam Parameter Volume Akar 42
Tabel 21 Daftar Sidik Ragam Parameter Jumlah Polong 42
DAFTAR GAMBAR
Halaman Gambar 1 Konsentrasi IAA yang Dihasilkan oleh Beberapa Bakteri 18
Gambar 2 Pembentukan Pelikel Bakteri Penambat Nitrogen pada Media JNFB Semisolid Setelah Diinkubasi Selama 10
Hari pada Suhu 36 oC 22
Gambar 3 Uji Asai Reduksi Asetilen Bakteri dalam Menambat
Nitrogen 23
Gambar 4 Uji Sinergisme Isolat N3 dan
I3 yang Diinkubasi Selama 24 jam 24
Gambar 5 (a) Morfologi Tanaman Kedelai, (b) Perlakuan N3I3,
Perlakuan I3, (c) Perlakuan N3 26
Gambar 6 Parameter Pertumbuhan Tanaman yang Memberikan Efek Berbeda Nyata Dengan Parameter (a) Tinggi Tanaman, (b) Berat Kering, (c) Berat Basah, (d) Volume Akar, (e)
Jumlah Buah, dan (f) Berat Buah 27
Gambar 7 Nilai Persamaan Garis Kurva Standard IAA 35
Gambar 8 (a) Biakan Murni I3 pada Media LB + L-Triptofan, (b)
Biakan Murni N3 pada Media JNFB 43
Gambar 9 (a) Isolat Awal Bakteri Rizosfer dari Perkebunan Tanjung Selamat,
(b) Uji Sinergisme Bakteri IAA dan Bakteri Penambat Nitrogen
43
Gambar 10 (a) Uji Standart Plate Count Bakteri IAA pada Media PCA 43
Gambar 11 (a) IAA Murni, (b) Supernatan Bakteri IAA yang Diberi Reagen Salkowsky, Terlihat Isolat I3 Memiliki Warna yang
Lebih Pekat 44
Gambar 12 (a) Uji Biokimia TSIA, Perubahan Warna pada Slant dan
Butt Menunjukkan Kemampuan Bakteri
Memfermentasikan Gula (b) Uji SSA, Perubahan Warna Media dari Hijau ke Biru Menunjukkan Bakteri Mampu
Menggunakan Na-Sitrat dan NH4 44
Gambar 13 (a) Uji Biokimia Katalase, (b) Pembentukan Pelikel pada Medium JNFB Semipadat oleh Bakteri Penambat Nitrogen
SELEKSI BAKTERI PENAMBAT NITROGEN DAN PENGHASIL HORMON IAA (Indole Acetic Acid)DAN UJI POTENSINYA TERHADAP
PERTUMBUHAN DAN PRODUKSI TANAMAN KEDELAI (Glycine max L.)
ABSTRAK
Bakteri rizosfer yang menambat nitrogen dan menghasilkan IAA (Indol Acetic Acid) dapat dimanfaatkan sebagai salah satu upaya peningkatan pertumbuhan dan produksi tanaman kedelai. Penelitian ini telah dilakukan di laboratorium Mikrobiologi dan pengujian secara in-vivo di rumah kasa, Departemen Biologi, FMIPA, Universitas Sumatera Utara dari bulan Februari hingga September tahun 2012. Penelitian ini bertujuan untuk menyeleksi bakteri penambat nitrogen dan penghasil IAA paling potensial dan melihat pengaruhnya terhadap pertumbuhan dan produksi tanaman kedelai yang ditanam di tanah kuning yang diduga mengandung sedikit unsur hara. Penambahan bakteri dilakukan pada tanah penanaman kedelai yang berumur 1 minggu dengan cara menyiramkannya pada daerah rizosfer. Hasil penelitian menunjukkan bahwa konsentrasi IAA tertinggi dihasilkan oleh isolat I3 sebanyak 33.3 ppm,
sedangkan konsentrasi nitrogen yang tertinggi dihasilkan oleh N3 dengan konsentrasi
29.93 ppm. Perlakuan penambahan gabungan isolat N3 dan I3 (N3I3) menunjukkan
pengaruh terbaik terhadap pertumbuhan dan produksi tanaman, seperti berat buah, volume akar, tinggi tanaman, jumlah buah, berat basah dan berat kering tanaman kedelai. Pemakaian bakteri penambat nitrogen dan penghasil IAA secara bersamaan dapat meningkatkan pertumbuhan tanaman dan produksi kedelai secara signifikan (P < 0.05).
SELECTION OF NITROGEN FIXING AND IAA (Indol Acetic Acid) PRODUCING BACTERIA AND ITS POTANTIAL IN INFLUENCE GROWTH
AND PRODUCTION OF SOYBEAN (Glycine max L.)
ABSTRACT
Rizosphere bacteria which is fix nitrogen and produce IAA (Indol Acetic Acid) is used as an effort to increase both growth and production of soybean plants. The research had been done in the Microbiology laboratory and in the home screen, Department of Biology, Faculty of Mathematics and Natural Sciences, University of North Sumatera from February until September 2012. The aim of this study is to select the most potential nitrogen fixing and IAA producing bacteria then examine their effect on growth of soybean plants which had been grown in soil containing less nutrients. The in vivo test has been done on seven days old of soybean plants. Bacteria were introduced by pouring them on the rhizosphere of plants. The results showed that the highest IAA concentration was produced by I3 isolate which was 33.3 ppm and the
highest concentration of nitrogen was produced by N3 isolate which was 29.93 ppm.
Combination between N3 and I3 isolates (N3I3) showed the best results in affecting the
growth and production of plants, among which the weight of fruit, root volume, plant height, number of fruits, fresh and dry weights of soybean plants. The use of nitrogen fixing and producing IAA bacteria simultaneously can significantly increase the growth of soybean plants (P < 0.05).
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Kebutuhan kedelai di Indonesia setiap tahun selalu meningkat seiring dengan pertambahan penduduk dan perbaikan pendapatan per kapita. Menurut Data Sosial Ekonomi 2011 produksi kedelai tahun 2010 diperkirakan sebesar 905,02 ribu ton biji kering. Hasil ini turun menjadi 69,50 ribu ton (7,13 persen) dibandingkan produksi tahun 2009, oleh karena itu diperlukan suplai kedelai tambahan yang harus diimpor. Di samping itu lahan budidaya kedelai pun diperluas dan produktivitasnya ditingkatkan (Adisarwanto, 2005).
Kacang kedelai(Glycine max) mempunyai potensi yang sangat besar sebagai sumber protein utama bagi masyarakat Indonesia karena harga yang tidak mahal dan dapat diolah menjadi bahan pangan yang disukai. Kedelai telah lama dikenal dan dipakai dalam beragam produk makanan seperti tahu, tempe, tauco, dan kecap. Walaupun Indonesia adalah salah satu negara penghasil kedelai tetapi produksi kedelai belum mencukupi kebutuhan penduduk. Oleh sebab itu masih perlu usaha-usaha peningkatan budidaya kacang kedelai yang modern penting dilakukan tanpa harus merusak lingkungan. Salah satu cara budi daya yang baik bagi tumbuhan ialah dengan menggunakan mikroba yang mampu menghasilkan metabolit sekunder sebagai faktor pendukung pertumbuhan.
Mikroba tanah menghasilkan metabolit yang mempunyai peran sebagai zat pengatur tumbuh yang dapat menambat nitrogen (Nasahi, 2010). Azotobacter yang diisolasi dari tanah masam Jawa Barat mempunyai kemampuan dalam penambatan nitrogen yang unggul (>400 mg/g berat kering sel) (Isminarni, 2007). Selain itu isolat Azotobacter juga mampu menghasilkan zat pengatur tumbuh, seperti Indol Acetic Acid (IAA) (Wedhastri, 2002). Bakteri aerob obligat termasuk dalam genus-genus Beijerinckia, Derxia, Archromobacter, Mycobacterium, Arthrobacter dan Bacillus diketahui mampu memfiksasi nitrogen (Rao, 1994). Beberapa hasil penelitian yang lain telah membuktikan bahwa sebagian mikroba dapat menghasilkan fitohormon seperti Pseudomonas fluorescens dan dilaporkan menghasilkan IAA yang juga dapat merangsang pertumbuhan akar jagung pada kondisi hidroponik (Benizri et al., 1998).
Pemanfaatan kelompok PGPR yang dapat menambat nitrogen dan penghasil IAA diharapkan mampu mempengaruhi pertumbuhan kedelai. Langkah awal dalam pemanfaatan kelompok mikroba ini ialah dengan mengisolasinya dari tanah kemudian dilanjutkan dengan uji kemampuan mikroba dalam menambat nitrogen dan menghasilkan hormon IAA bagi tanaman. Berdasarkan latar belakang di atas, maka penelitian isolasi dan seleksi bakteri penambat nitrogen dan penghasil hormon IAA layak dilakukan.
1.2 Perumusan Masalah
1.3. Tujuan Penelitian
Penelitian ini bertujuan untuk menyeleksi bakteri penambat nitrogen dan bakteri penghasil IAA (Indol Acetic Acid) yang potensial serta melihat pengaruhnya terhadap pertumbuhan dan produksi tanaman kedelai (Glycine max L.).
1.4. Hipotesis
Bakteri penambat nitrogen dan penghasil IAA (Indol Acetic Acid) mampu meningkatkan pertumbuhan dan produksi tanaman kedelai (Glycine max L.).
1.5. Manfaat
BAB 2
TINJAUAN PUSTAKA
2.1 Kedelai
Kedelai merupakan tanaman asli Daratan Cina dan telah dibudidayakan oleh manusia sejak 2500 SM. Sejalan dengan makin berkembangnya perdagangan antar negara yang terjadi pada awal abad ke-19, menyebabkan tanaman kedelai juga ikut tersebar ke berbagai negara tujuan perdagangan tersebut. Kedelai mulai dikenal di Indonesia sejak abad ke-16. Awal mula penyebaran dan pembudidayaan kedelai yaitu di Pulau Jawa, kemudian berkembang ke Bali, Nusa Tenggara, dan pulau-pulau lainnya. Pada awalnya, kedelai dikenal dengan beberapa nama botani, yaitu Glycine soja dan Soja max. Namun pada tahun 1948 telah disepakati bahwa nama botani yang dapat diterima dalam istilah ilmiah, yaitu Glycinemax (L.) Merill (Adisarwanto, 2005).
2.2 Mikroorganisme Tanah
Peran mikroba tanah dalam siklus berbagai unsur hara di dalam tanah sangat penting, sehingga bila salah satu jenis mikroba tersebut tidak berfungsi maka akan terjadi ketimpangan dalam daur unsur hara di dalam tanah. Ketersediaan unsur hara sangat berkaitan dengan aktivitas mikroba yang terlibat di dalamnya.
Tanah merupakan hasil gabungan proses fisik, kimia, dan biologi, jika dianalisis merupakan campuran yang terdiri dari bahan organik, anorganik, air, dan udara yang keseluruhannya tercampur menjadi satu secara sempurna, sehingga sukar untuk dipisahkan antara yang satu dengan yang lainnya. Senyawa organik merupakan kumpulan sisa-sisa makanan, yang sebagian telah diuraikan dan bahan ini merupakan bagian yang mudah dihancurkan oleh organisme tanah seperti bakteri, fungi, dan protozoa. Dengan demikian mikroba merupakan bagian dari tanah yang memegang peranan penting dalam menentukan sifat dan tekstur tanah. Keadaan nutrisi dalam tanah, merupakan faktor penting lain yang mempengaruhi aktivitas mikroba tanah. Aktivitas terbesar terdapat dalam lapisan permukaan yang kaya bahan organik, khususnya pada daerah yang dekat dengan akar tumbuhan (rizosfer). Jumlah dan aktivitas mikroba tanah bergantung pada besarnya tingkat keseimbangan jumlah nutrisi. Hal ini akan berpengaruh terhadap tingkat kesuburan tanah (Ristiati et al., 2008).
Rizosfer merupakan daerah yang ideal bagi tumbuh dan berkembangnya mikroorganisme tanah. Keadaan ini didukung oleh fungsinya, yaitu sebagai penyedia nutrisi dan juga sebagai tempat tumbuh dan berkembangnya mikroorganisme. Beberapa macam nutrisi disekresikan di dalam rizosfer, yang sangat dipengaruhi oleh berbagai faktor lingkungan di dalam tanah. Beberapa bakteri penyedia hara yang terdapat pada rizosfer akar disebut sebagai rhizobakteri pemacu tanaman atau dikenal sebagai PGPR (Basan & Holguin, 1998).
2.3 Mikroorganisme Penambat Nitrogen
Cano (1986) dalam jurnal Ristiati (2008) menyatakan bahwa nitrogen memasuki tanah dalam bentuk amonia dan nitrat bersama air hujan, dalam bentuk hasil penambatan nitrogen bebas atau dalam bentuk penambahan pupuk sintesis. Tetapi kenaikan kandungan nitrogen tanah yang cukup tinggi, lebih banyak disebabkan oleh adanya kemampuan beberapa mikroba untuk memfiksasi. Bakteri mampu melakukan penambatan nitrogen udara. Secara umum, fiksasi nitrogen biologis sebagai bagian dari input nitrogen untuk mendukung pertumbuhan tanaman telah menurun akibat intensifikasi pemupukananorganik (Hindersah & Simarmata, 2004).
Beberapa kelompok bakteri yang dapat dimanfaatkan untuk meningkatkan produksi tanaman ialah Rhizobium (bakteri penambat N2 yang bersimbiosis dengan
kacang-kacangan), Azotobacter dan Azospirillum (bakteri penambat N2 yang tidak
2.4 Peran Nitrogen bagi Tanaman
Nitrogen merupakan unsur hara yang utama bagi pertumbuhan tanaman, yang pada umumnya sangat diperlukan untuk pembentukan atau pertumbuhan bagian-bagian vegetatif tanaman, seperti daun, batang dan akar. Fungsi nitrogen yang selengkapnya bagi tanaman adalah untuk meningkatkan pertumbuhan tanaman, dapat menyehatkan pertumbuhan daun, daun tanaman lebar dengan warna yang lebih hijau, meningkatkan kadar protein dalam tubuh tanaman, meningkatkan kualitas tanaman penghasil daun (Sutedjo, 1987). Nitrogen merupakan nutrisi penting bagi tumbuhan dan diperlukan dalam jumlah besar. Kandungan nitrogen dalam jaringan tumbuhan tinggi per berat kering jaringan ialah sebanyak 1,5%. Nitrogen menjadi salah satu komponen dalam molekul protein, purin, pirimidin dan porfirin. Purin dan pirimidin merupakan basa nitrogen yang penting dalam pembentukan molekul asam nukleat (RNA dan DNA). Sedangkan porfirin penting dalam pembentukan klorofil Arief (1989) dalam skripsi Nurhayati (2006).
Nitrogen dikatakan penting bagi tumbuhan oleh karena dinilai mampu memenuhi tiga kriteria yang harus dipenuhi oleh setiap unsur. Ketiga kriteria tersebut meliputi dimana unsur N penting bagi pertumbuhan dan reproduksi, unsur tersebut tidak dapat diganti dengan unsur lain dan kebutuhan akan unsur tersebut bersifat langsung dan bukan hasil efek tidak langsung Sasmitamiharja (1990) dalam jurnal Nurhayati (2006).
2.5 Mekanisme Penambatan Nitrogen
Sumber utama N berasal dari gas N2 dari atmosfir, kadar gas nitrogen di atmosfir
Komponen utama nitrogen di atas bumi adalah N2, yang dapat digunakan
sebagai sumber nitrogen oleh bakteri pengfiksasi nitrogen. Amonia yang dihasilkan oleh fiksasi nitrogen atau oleh ammonifikasi dari nitrogen campuran bahan organik dapat berasimilasi ke bahan organik atau dapat dioksidasi ke nitrat oleh bakteri nitrifikasi. Nitrogen yang hilang dari biosfer terjadi sebagai hasil denitrifikasi, di mana nitrat dikompersikan kembali ke N2. Amoniak diproduksi selama dekomposisi dari
bahan nitrogen organik (ammonifikasi) dan terjadi pada pH netral sebagai ion ammonium (NH4). Di dalam tanah, sebagian besar amoniak yang dilepaskan oleh
dekomposisi aerobik dengan cepat didaur ulang dan dikonversi ke asam amino didalam tumbuhan. Sebab amoniak mudah menguap, beberapa kehilangan dapat terjadi dari tanah (terutama tanah sangat bersifat alkali) (Nasahi, 2010).
2.6 Mikroorganisme Penghasil IAA
Kelompok bakteri yang bermanfaat bagi pertumbuhan tanaman secara langsung adalah kelompok penghasil zat pengatur tumbuh. Kelompok bakteri ini berperan penting pada pertanian di wilayah tropis (Lestari, 2007).
Banyak bakteri tanah telah digunakan sebagai PGPR, dan salah satunya adalah Bacillus sp., bakteri yang dapat meningkatkan pertumbuhan tanaman dan menghambat perkembangan patogen akar (Bahri et al., 2009). Beberapa mikroorganisme tanah yang menghasilkan IAA seperti Azospirillum sp., Enterobacter sp., Azotobacter sp., Klebsiella sp., Alcaligenes faecalis, Azoarcus sp., Serratia sp., Cyanobacteria dan bakteri sulfur dapat mendorong pertumbuhan tanaman (Rubio et al, 2000). Azotobacter chroococcum, A. vinelandii dan A. paspali mampu menghasilkan auksin (Azcon & Barea, 1975).
2.7 Peran IAA Bagi Tanaman
Sumber hormon IAA yang alami tidak hanya dihasilkan oleh tumbuhan saja tetapi juga dihasilkan oleh rhizobakteri. Pemakaian supernatan dari kultur rhizobakteri yang mengandung IAA mampu memberikan efek fisiologis pada suatu tanaman. Hormon tumbuh yang dihasilkan oleh mikroorganisme rhizosfer mampu meningkatkan perkecambahan biji, pembentukan rambut akar serta meningkatkan transpor ion sehingga pengangkutan air oleh akar meningkat (Pamungkas et al., 2009).
Menurut Siregar (2009), auksin merupakan salah satu hormon tanaman yang dapat meregulasi banyak proses fisiologi, seperti pertumbuhan, pembelahan dan diferensiasi sel serta sintesa protein (Darnell et al, 1986). Fungsi auksin menurut Wilkins (1989), adalah menyebabkan terjadinya pembelahan sel pada lapisan kambium. Pada konsentrasi auksin optimum, sel-sel penyusun kambium aktif membelah dan terbentuk lapisan xilem yang cukup tinggi.
BAB 3
BAHAN DAN METODA
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Februari-September 2012 di Laboratorium Mikrobiologi dan Laboratorium Sentral, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara, Medan.
3.2 Alat & Bahan
Alat yang digunakan dalam penelitian ini ialah timbangan, cawan petri, tabung reaksi, beaker glass, gelas ukur, erlenmeyer, spatula, hot plate, pipet serologi, bunsen, indikator pH, inkubator, autoklaf, polibag, shaker, pipet mikro, sentrifuse, dan spektrofotometer, gas kromatografi (GC).
3.3 Metode Penelitian
Penelitian ini dirancang dengan menggunakan metode Rancangan Acak Lengkap (RAL). Perlakuan yang dibuat sesuai dengan jenis inokulan yang berhasil diisolasi dan telah diuji kemampuan menambat nitrogen dan menghasilkan IAA dari laboratorium. Data yang diperoleh kemudian dianalisis dengan uji ANOVA.
Perlakuan terdiri atas:
1. perlakuan tanpa penambahan bakteri dengan tanah kuning (KT), 2. perlakuan tanpa penambahan bakteri dengan tanah hitam (KH), 3. penambahan bakteri penambat nitrogen dengan tanah kuning (N), 4. penambahan bakteri penghasil IAA dengan tanah kuning (I),
5. penambahan bakteri penambat nitrogen + bakteri penghasil IAA dengan tanah kuning (NI).
Setiap perlakuan dibuat ulangan sebanyak 5 kali dengan total keseluruhan adalah 25 percobaan.
3.3.1 Pengambilan Sampel
Sampel tanah diambil dari daerah rizosfer dan dimasukkan ke dalam kantong-kantong plastik yang diberi label yang menyatakan nomor kode lokasi pengambilannya.
3.3.2 Isolasi dan Pemurnian Bakteri Penambat Nitrogen
Isolasi bakteri penambat nitrogen dengan menggunakan medium pertumbuhan JNFB (James Nitrogen Free Malat Bromthymol Blue). Sebelumnya dilakukan pengenceran tanah secara serial dan ditumbuhkan dengan metode cawan sebar pada medium pertumbuhan JNFB dengan komposisi media yaitu 5,0 g asam malat, 0,6 g K2HPO4, 1,8 g KH2PO4, 0,2 g MgSO4.7H2O, 0,1 g NaCl, 0,2 g CaCl2.2H2O, 0,066 g
5,8. Bakteri diinkubasi selama 48 jam, dan diamati koloni yang tumbuh. Biakan murni diperoleh dengan menginokulasikan setiap koloni yang berdeba ke dalam petri yang berisi media JNFB. Isolat tersebut dikarakterisasi yang meliputi morfologi koloni, bentuk sel, morfologi sel, pewarnaan Gram dan uji biokimia yang terdiri atas uji sitrat, gelatin, katalase, motilitas, hidrolisa pati, dan sulfida.
3.3.3 Uji Kemampuan Bakteri dalam Menambat Nitrogen
Isolat yang telah dimurnikan dan telah diuji biokimia diinokulasikan pada media JNFB semi padat di dalam tabung-tabung reaksi. Inkubasi dilakukan pada suhu ruang selama 10 hari. Jika pada medium semi padat tersebut telah terbentuk pelikel berwarna putih di bawah permukaan media maka selanjutnya dipindahkan ke dalam cawan petri berisi medium JNFB padat. Isolat yang pelikelnya paling banyak dihasilkan, maka diuji lanjutan dengan metode Asai Reduksi Asetilen (ARA) (Susilowati et al, 2007).
3.3.4 Penentuan Kurva Standar IAA
IAA murni ditimbang sebanyak 0,001 g dan dilarutkan di dalam 100 ml akuades. IAA murni masing-masing dibagi kedalam tabung yang berbeda dengan konsentrasi 0 ppm, 2 ppm, 4 ppm, 6 ppm, 8 ppm, dan 10 ppm. Dari setiap tabung reaksi diambil 3 ml kemudian ditambahkan 1 ml reagen Salkowski dan dihomogenkan. Absorbansinya diukur dengan spektrofotometer UV-Visible dengan panjang gelombang 535 nm (Aryantha et al., 2004).
3.3.5 Isolasi dan Pemurnian Bakteri Penghasil IAA
Sampel tanah sebanyak 1 g dimasukkan ke dalam 9 ml akuades steril secara aseptis, kemudian dibuat seri pengenceran 10-4. Setelah itu diambil 0,1 ml suspensi dan diinokulasi pada media Luria Bertani (LB) + L-triptofan dengan komposisi: ekstrak ragi 5 g, BactoTryptone 10 g, Bacto agar 20 g, NaCl 5 g, L-tryptophan 5 mM, pH 7,5 (Bric et al., 1991) dan dilakukan pengulangan sebanyak 3 kali dan diamati koloni yang muncul. Diinkubasi pada suhu 280C selama 2 hari dan diamati koloni yang muncul. Biakan murni diperoleh dengan menginokulasikan setiap koloni yang berdeba ke dalam petri yang berisi media LB+L-triptofan. Isolat tersebut dikarakterisasi yang meliput i morfologi koloni, bentuk sel, morfologi sel, pewarnaan Gram dan uji biokimia yang terdiri atas uji sitrat, gelatin, katalase, motilitas, hidrolisa pati, dan sulfida.
3.3.6 Uji Kemampuan Bakteri dalam Menghasilkan IAA Selama Masa Pertumbuhan Secara In-vitro
Setiap 2 hari sekali cairan kultur yang telah di shaker diambil sebanyak 0,1 ml untuk menghitung jumlah koloni dengan metode SPC (Standart Plate Count). Diambil 3 ml untuk menghitung kadar IAA yang dihasilkan oleh bakteri dan cairan kultur tersebut disentrifugasi dengan kecepatan 5500 rpm selama 10 menit. Supernatan yang diperoleh kemudian dipindahkan ke dalam tabung reaksi steril dan diuji kemampuannya dalam menghasilkan IAA dengan metode kolorimetri yang menambahkan reagen Salkowski (150 ml H2SO4 pekat, 250 ml akuades, 7,5 ml
FeCl3.6H2O 0,5 M) (Patten dan Glick, 2002), dengan perbandingan 4:1 (supernatan :
Salkowski) (Zahir et al., 1997). Campuran tersebut diinkubasi selama 20 menit dan absorbannya diukur dengan spektrofotometer dengan panjang gelombang 535 nm.
Konsentrasi IAA dari setiap isolat dapat diketahui dengan cara memasukkan nilai absorban supernatan ke persamaan garis kurva standart IAA yang telah diperoleh. Persamaan garis regresi kurva standar IAA ditentukan dengan metode Least Square (Glover & Mitchell, 2002 dalam Warsito, 2009) dengan rumus:
Y= a + bX a = Y – bX
�
=
�(∑��)−(∑�)(∑�)�(∑�2)−(∑�)2
Dimana: a = intersep
b = slope (koefisien regresi) Y = absorbansi
X = Konsentrasi
3.3.7 Uji Sinergisme
bersinergisme dengan bakteri penambat nitrogen ditunjukkan dengan tidak terbentuk zona hambat pada pertumbuhan bakteri penambat nitrogen begitu juga sebaliknya (Rahayu, 2006).
3.3.8 Uji Pengaruh Bakteri IAA dan Penambat Nitrogen Terhadap Pertumbuhan Kacang Kedelai
Bakteri yang positif menghasilkan hormon IAA dan menambat nitrogen yang paling potensial dan telah dilakukan uji sinergismenya diinokulasikan sebanyak 10 ml dengan kepadatan sel 108 CFU/ml ke permukaan tanah steril yang telah ditanami kecambah kacang kedelai berumur 1 minggu. Dibuat lima perlakuan yaitu: tanah kuning tanpa penambahan bakteri (TK), tanah hitam tanpa penambahan tanah bakteri (TH), tanah kuning dengan penambahan bakteri penambat nitrogen (N3), tanah kuning
dengan penambahan bakteri penghasil IAA (I3) dan tanah kuning dengan penambahan
bakteri penambat nitrogen + bakteri penghasil IAA (N3I3). Percobaan dilakukan
BAB 4
HASIL DAN PEMBAHASAN
4.1 Isolasi dan Karakterisasi Bakteri Penghasil IAA
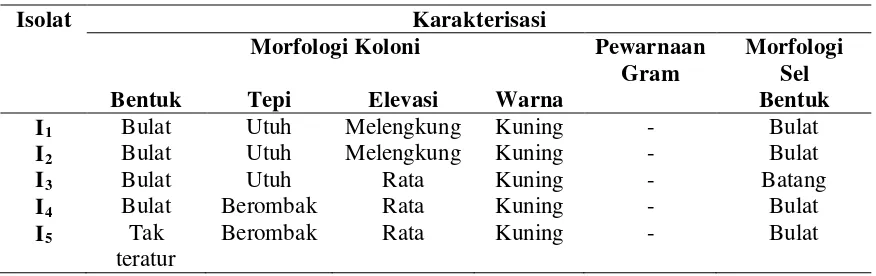
Isolasi bakteri tanah yang dilakukan di perkebunan kedelai di Tanjung Selamat, telah diperoleh 5 isolat bakteri penghasil IAA dengan karakter morfologi koloni, bentuk sel, dan pewarnaan Gram yang berbeda. Bentuk koloni dari isolat penghasil IAA bulat dan tak teratur. Tepi isolat berbentuk utuh dan berombak sedangkan elevasi isolat yang diperoleh rata dan melengkung. Bakteri penghasil IAA ini didominasi dengan warna kuning dan Gram negatif. Sel yang berbentuk bulat lebih dominan dibanding yang berbentuk batang (Tabel 1).
Tabel 1. Karakterisasi Morfologi Bakteri Penghasil IAA
Isolat Karakterisasi
Morfologi Koloni Pewarnaan
Gram
Morfologi Sel
Bentuk Tepi Elevasi Warna Bentuk
I1 Bulat Utuh Melengkung Kuning - Bulat
I2 Bulat Utuh Melengkung Kuning - Bulat
I3 Bulat Utuh Rata Kuning - Batang
I4 Bulat Berombak Rata Kuning - Bulat
I5 Tak
teratur
Berombak Rata Kuning - Bulat
Uji biokimia menunjukkan perbedaan antara kelima bakteri penghasil IAA. Semua isolat yang diperoleh bersifat motil, uji katalase bersifat positif, dan tidak satu pun bakteri yang diperoleh dapat menghidrolisis gelatin. Hanya satu bakteri yang dapat menggunakan sitrat sebagai sumber karbonnya yaitu I1 dan sebagian lainnya
dapat menghidrolisis pati, serta memfermentasikan gula.
Tabel 2. Uji Biokimia Bakteri Penghasil IAA
Isol
at
Respon terhadap Uji Biokimia
S
Hasil pengamatan pada uji biokimia menunjukkan bahwa semua isolat penghasil IAA bersifat positif setelah diuji katalase hal ini berbanding terbalik dengan penelitian yang dilakukan oleh Siregar (2009), yang mendapatkan bahwa semua bakteri penghasil IAA yang diisolasi dari akar padi bersifat negatif seletah diuji katalase. Perbedaan ini kemungkinan disebabkan oleh asal isolasi bakteri yang tidak sama. Pengamatan aktivitas mikroorganisme dapat diketahui dari kemampuannya menggunakan dan menguraikan molekul yang kompleks seperti pati, lemak, protein, asam nukleat, asam amino dan sakarida. Hasil dari pengujian ini digunakan untuk spesifikasi mikroorganisme tersebut dan untuk membuktikan bahwa isolat-isolat tersebut berbeda (Lay, 1994).
4.2 Kemampuan Bakteri dalam Menghasilkan IAA Selama Masa Pertumbuhan Secara In-vitro
masing-masing isolat. Pada hari ke-2, isolat I3 menghasilkan IAA tertinggi sebanyak 24.10
ppm dan isolat I4 menghasilkan IAA terendah sebanyak 10.50 ppm. Pada hari ke-4,
isolat I3 masih menghasilkan IAA tertinggi sebanyak 32.80 ppm dan isolat I5
menghasilkan IAA terendah sebanyak 18.15 ppm. Pada hari ke-6, isolat I3 masih
menunjukkan dominansinya dalam menghasilkan IAA tertinggi sebanyak 33.3 ppm dan isolat I5 masih tetap menghasilkan IAA terendah sebanyak 18.00 ppm. Hasil
pengamatan tersebut menunjukkan bahwa isolat I3 mampu menghasilkan konsentrasi
IAA paling tinggi dan terus meningkat hingga hari keenam (Gambar 1).
Gambar 1. Konsentrasi IAA yang dihasilkan oleh beberapa bakteri
Hasil pengamatan pertumbuhan koloni bakteri pada hari ke-2, ke-4 dan hari ke-6 menunjukkan bahwa pertumbuhan kelima bakteri penghasil IAA terus meningkat. Isolat I3 secara konsisten menunjukkan peningkatan jumlah koloni dari
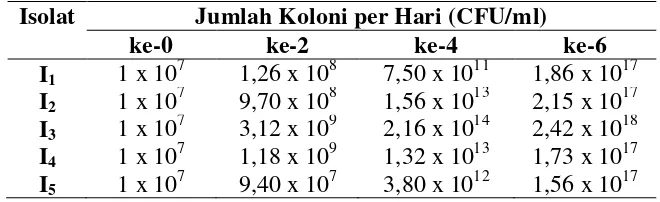
hari ke-2 sampai hari ke-6 dengan nilai 3.12 x 109 CFU/ml pada hari ke-2, 2.16 x 1014 CFU/ml pada hari ke-4, dan 2.42 x 1018 CFU/ml pada hari ke-6. Sedangkan isolat I5
menunjukkan jumlah koloni terendah pada hari ke-2 sebesar 9.4 x 107 CFU/ml, dan isolat I1 menunjukkan jumlah koloni terendah pada hari ke-4 sebesar 3.8 1012 CFU/ml
dan pada hari ke-6 sebesar 1.56 x 1017 CFU/ml (Tabel 3). Pertumbuhan koloni isolat I3
ini juga berbanding lurus dengan produk IAA yang dihasilkan. Sehingga isolat I3 ialah
isolat yang dianggap paling potensial dibandingkan keempat isolat lainnya dan yang akan diintroduksikan ke kecambah kedelai yang berumur 1 minggu serta dilihat pengaruhnya terhadap pertumbuhan tanaman kedelai.
Tabel 3. Pertumbuhan Jumlah Koloni Bakteri Penghasil IAA
Isolat Jumlah Koloni per Hari (CFU/ml)
ke-0 ke-2 ke-4 ke-6
Variasi konsentrasi hormon IAA yang dihasilkan oleh masing-masing isolat diduga karena perbedaan kemampuan kecepatan bakteri dalam mensintesis triptofan menjadi IAA. Biosintesis IAA oleh mikroba dapat ditingkatkan dengan penambahan triptofan sebagai prekursor. Menurut Bric (1991), bakteri yang menghasilkan IAA dapat ditumbuhkan di dalam media pertumbuhan yang mengandung triptofan yang penting dalam pembentukan IAA. IAA disintesis sebagai metabolit sekunder yang dihasilkan dalam kondisi pertumbuhan bakteri suboptimal atau saat tersedia prekursor asam amino triptofan (Lucyanie, 2009).
Bakteri I2, I4 dan I5 menghasilkan IAA yang terus menurun dari hari ke-2, ke-4
4.3 Isolasi dan Karakterisasi Bakteri Penambat Nitrogen
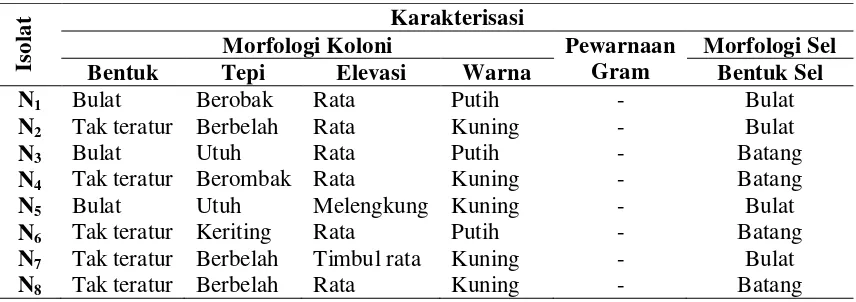
Isolasi mikroba tanah yang dilakukan di perkebunan kedelai di Tanjung Selamat, telah diperoleh delapan isolat bakteri penambat nitrogen dengan karakter morfologi koloni, bentuk sel, dan pewarnaan Gram yang berbeda. Bentuk koloni dari isolat yang diperoleh bulat dan tak teratur, tepi koloni bervariasi seperti berombak, berbelah, utuh dan keriting. Elevasi koloni yang paling dominan pada isolat bakteri berbentuk rata sedangkan yang lainnya melengkung dan timbul rata. Warna bakteri putih dan kuning, sedangkan bentuk selnya bulat dan batang (Tabel 4).
Tabel 4. Karakterisasi Morfologi Bakteri Penambat Nitrogen
Is
ol
at Karakterisasi
Morfologi Koloni Pewarnaan
Gram
Hasil pengelompokan sifat Gram yang dimiliki oleh kedelapan isolat setelah diuji menunjukkan bahwa semua isolat penambat nitrogen yang diperoleh bersifat Gram negatif. Firrani (2011), melaporkan bahwa dari 20 isolat penambat nitrogen yang diisolasi dari dari akar sawit menunjukkan ada 19 isolat bakteri yang bersifat Gram negatif.
Dari hasil uji biokimia yang telah dilakukan dapat diketahui bahwa semua isolat bakteri penambat nitrogen bersifat katalase positif, dua isolat yang bersifat motil yaitu N5 dan N7, dan hanya N4 yang dapat menghidrolisis gelatin. Sebagian besar
Tabel 5. Karakterisasi Biokimia Bakteri Penambat Nitrogen
Isol
at
Respon terhadap Uji Biokimia
S
Hasil uji biokimia yang dilakukan pada bakteri penambat nitrogen menunjukkan 7 isolat bakteri bersifat negatif terhadap uji gelatin, hanya 1 isolat yang bersifat positif yaitu N4. Penelitian yang dilakuan oleh Firrani (2011), menunjukkan
bahwa semua isolat penambat nitrogen yang diisolasi dari akar sawit bersifat negatif setelah diuji gelatin.
4.4 Uji Kemampuan Bakteri dalam Menambat Nitrogen
Seleksi kemampuan bakteri dalam menambat nitrogen terlebih dulu dilakukan secara kualitatif yang dilihat dari pelikel yang terbentuk di bawah permukaan media JNFB semi padat. Dari delapan bakteri penambat nitrogen terdapat tiga bakteri yang menghasilkan pelikel paling tebal di bawah permukaan mediumnya yaitu isolat N6
dengan 0.60 cm, isolat N3 dengan 0.55 cm dan N4 dengan 0.60 cm (Tabel 6).
Tabel 6. Pelikel yang Terbentuk oleh Bakteri Penambat Nitrogen
Isolat bakteri Tebal Pelikel (cm) N1 0.45 N2 0.45 N3 0.60 N4 0.55 N5 0.45 N6 0.50 N7 0.40 N8 0.45
Terbentuknya pelikel pada permukaan media JNFB semipadat ini menunjukkan kondisi yang baik untuk aktivitas nitrogenase (Gambar 2). Menurut Susilowati (2007) pelikel yang dihasilkan oleh bakteri pada media JNFB disebabkan di dalam medium tidak ada kelebihan oksigen, laju difusi oksigen yang sama dengan laju respirasi organisme merupakan kondisi yang baik untuk aktivitas enzim nitrogenase yang mambantu mereduksi asetilen menjadi etilen. Ketiga bakteri yaitu isolat N3, N4 dan N6 diuji lanjut secara kuantitatif dengan menggunakan metode ARA
untuk mengetahui kemampuan menambat nitrogen oleh masing-masing mikroba.
Gambar 2. Pembentukan pelikel bakteri penambat nitrogen pada media JNFB semisolid setelah diinkubasi selama 10 hari pada suhu 36 oC
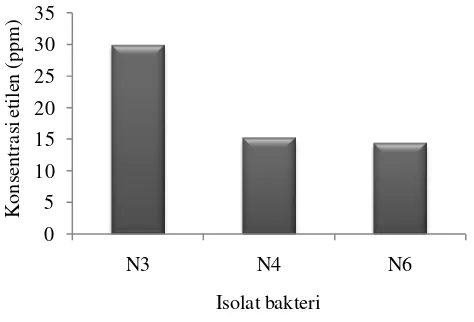
Uji kemampuan bakteri dalam menambat nitrogen secara kuantitatif dengan menggunakan metode ARA menunjukkan bahwa isolat N3 memiliki kemampuan
paling tinggi dalam menambat nitrogen di udara yaitu sebesar 29.93 ppm, diikuti oleh isolat N4 sebesar 15.24 ppm dan isolat N6 sebesar14.42 ppm (Gambar 3). Firrani
(2011), melaporkan bahwa kemampuan isolat bakteri tertinggi dalam menambat nitrogen hanya menghasilkan 3.13 ppm saja, dimana bakteri diisolasi dari akar tanaman sawit dan Susilowati et al (2007), menyatakan pada tanaman kedelai nilai kemampuan menambat nitrogen udara yang dinyatakan dalam kisaran nilai ARA sebesar 0,0039-0,087 µmol jam-1 kultur-1. Hal tersebut menunjukkan bahwa isolat penambat nitrogen yang diiolasi dari rizosfer kedelai pada penelitian inimemiliki kemampuan penambat nitrogen yang lebih baik.
Gambar 3. Uji asai reduksi asetilen bakteri dalam menambat nitrogen
Hasil pengujian secara kuantitatif yang dilakukan dengan metode ARA ini berbanding lurus dengan pengujian kemampuan bakteri penambat nitrogen secara kualtitaf yang ditandai dengan terbentuknya pelikel pada permukaan media JNFB semipadat. Kemampuan bakteri dalam menambat N2 diukur berdasarkan kemampuan
enzim nitrogenase dalam mereduksi asetilen (C2H2) menjadi etilen (C2H4). Hal ini
menunjukkan bahwa isolat N3 memiliki kemampuan yang paling potensial (29.93)
ppm, sehingga bakteri ini diaplikasikan ke tanaman kedelai dan dilihat pengaruhnya.
4.5 Uji Sinergis Bakteri IAA dengan Bakteri Penambat Nitrogen
Uji sinergisme yang dilakukan secara kualitatif antara kedua isolat penambat nitrogen (N3) dan penghasil IAA (I3), maka tidak ada terbentuk zona hambat pada pertumbuhan
bakteri penambat nitrogen maupun sebaliknya. Hal ini menunjukkan bahwa isolat N3
dan isolat I3 tidak bersifat antagonis satu sama lain, sehingga kedua bakteri ini dapat
diintroduksi ke tanaman kedelai dan dilihat pengaruhnya terhadap pertumbuhan tanaman kedelai (Gambar 4). Bakteri yang antagonis ditunjukkan dengan terbentuknya zona hambat atau zona bening ketika kedua bakteri yang berbeda ditumbuhkan dalam media pertumbuhan yang sama.
Gambar 4. Uji sinergisme isolat N3 dan I3 yang diinkubasi selama 24 jam
Isolasi 2 bakteri dari lingkungan tanah yang sama, kemungkinan tidak akan berantagonis, karena faktor-faktor fisik pendukung pertumbuhan mikroorganisme seperti suhu, pH, kelembaban tanah relatif hampir sama. Setiap bakteri memiliki temperatur optimal dan konsentrasi pH lingkungan dimana mereka dapat tumbuh dengan cepat dan memiliki rentang temperatur dimana mereka dapat tumbuh begitu juga rentang pH untuk mendukung pertumbuhan dan melakukan metabolismenya.
N3
4.6 Pengaruh Bakteri IAA dan Penambat Nitrogen dalam Mendukung Pertumbuhan dan Produksi Tanaman Kedelai (Glycine max L.)
Penambahan bakteri IAA dan penambat nitrogen mempengaruhi pertumbuhan dan produksi kedelai baik untuk tanah kuning atau tanah hitam. Hasil pengukuran faktor pertumbuhan tanaman kedelai ditampilkan pada Tabel 7.
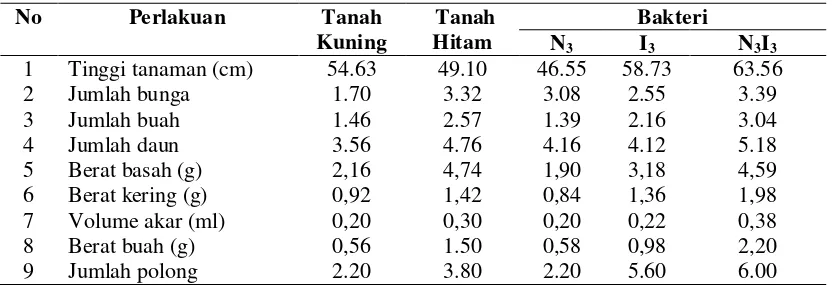
Tabel 7. Pengukuran Rata-rata Pertumbuhan dan Produksi Tanaman Kedelai
No Perlakuan Tanah
Pada Tabel 7 diketahui bahwa perlakuan N3I3 berpengaruh dalam mendukung
pertumbuhan tanaman kedelai. Perlakuan N3I3 menunjukkan berpengaruh terhadap
tinggi tanaman dengan rata-rata 63.56 cm, sedangkan perlakuan N3 menunjukkan
pengaruh yang paling rendah terhadap tinggi tanaman dengan rata-rata 46.55 cm. Pada pengamatan jumlah bunga, perlakuan N3I3 menghasilkan pengaruh tertinggi dengan
rata-rata 3.4 helai daun sedangkan perlakuan TK menunjukan hasil terendah dengan rata-rata 1.7 helai daun. Pada pengamatan jumlah buah, perlakuan N3I3 menghasilkan
buah paling banyak dengan rata-rata 3.0 sedangkan perlakuan N3 menghasilkan
jumlah buah paling sedikit dengan rata-rata 1.4. Pada pengamatan berat basah tanaman, perlakuan N3I3 menunjukkan hasil tertinggi dengan rata-rata 4.59 g
sedangkan perlakuan N3 menunjukkan hasil terendah dengan rata-rata 1.9 g. Pada
pengamatan berat kering tanaman, perlakuan N3I3 juga menunjukkan hasil tertinggi
dengan rata-rata 1.98 g sedangkan perlakuan N3 menunjukkan hasil terendah dengan
rata-rata 0.7 g. Pada pengamatan volume akar, perlakuan N3I3 menghasilkan rata-rata
berat voleme akar tertinggi dengan 0.38 ml sedangkan perlakuan N3 dan TK
menunjukkan pengaruh paling tinggi dibandingkan dengan perlakuan yang lainnya pada berat buah dengan rata-rata 2.2 g, sedangkan perlakuan N3 menunjukkan
pengaruh terendah dengan rata-rata 0.58 g.
Dari semua perlakuan terlihat bahwa perlakuan N3 yang memberikan efek
kurang terhadap parameter pertumbuhan tanaman kedelai seperti tinggi tanaman, jumlah buah, berat basah, berat kering, volume akar, berat buah dan jumlah polong tanaman kedelai kecuali jumlah bunga dan jumlah daun (Gambar 5).
Gambar 5. Morfologi tanaman kedelai (a) perlakuan N3I3, (b) perlakuan I3,
(c) perlakuan N3
Bakteri penambat nitrogen yang diintroduksikan ke tanaman kedelai tidak cukup untuk mendukung pertumbuhan tanaman tersebut karena dibutuhkan beberapa faktor pendukung bakteri lainnya sebagai biofertilizer bagi tanaman. Sehingga ketika bakteri penambat nitrogen yang potensial setelah diuji secara laboratorium belum tentu menunjukkan efek yang bagus setelah diaplikasikan secara in-vivo. Menurut Ozawa et al. (2000) dalam Susilowati et al. (2007), inokulasi isolat bakteri diazotrof terkadang memberikan respon tanaman dengan aktivitas penambatan N2 dan kadar N
lebih tinggi daripada tanaman kontrol, namun secara statistik tidak berbeda nyata.
Selain itu faktor lingkungan seperti tanah, suhu, intensitas cahaya dan distribusi curah hujan merupakan komponen lingkungan tumbuh yang berpengaruh pada pertumbuhan tanaman kedelai. Menurut Adisarwanto (2005), untuk mencapai pertumbuhan tanaman kedelai yang optimal diperlukan kondisi lingkungan tumbuh yang optimal pula. Untuk mencapai pertumbuhan yang optimal, kedelai harus ditanam
pada jenis tanah berstruktur lempung berpasir dan suhu lingkungan berkisar 25-28 oC. Kedelai membutuhkan intensitas cahaya yang cukup selama pertumbuhan. Hal terpenting pada aspek distribusi curah hujan yaitu jumlahnya merata sehingga kebutuhan air pada tanaman kedelai dapat terpenuhi. Pada umumnya kebutuhan air pada tanaman kedelai berkisar 350-450 mm selama masa pertumbuhan.
Hasil uji statistik terhadap kesembilan parameter pertumbuhan tanaman kedelai memberikan efek berbeda nyata terhadap 6 paramater pertumbuhan yaitu tinggi tanaman, berat kering, berat basah, volume akar, jumlah buah dan berat buah. Sedangkan 3 parameter lainnya seperti jumlah buah, jumlah bunga dan jumlah polong memberikan efek yang tidak berbeda nyata (Lampiran 5 hlm. 40). Rata-rata hasil pengamatan parameter pertumbuhan tanaman kedelai yang memberikan efek berbeda nyata ditampilkan pada Gambar 6.
Gambar 6. Parameter pertumbuhan tanaman yang memberikan efek berbeda nyata pada (a) tinggi tanaman, (b) berat kering, (c) berat basah, (d) volume akar, (e) jumlah buah, dan (f) berat buah.
Dari Gambar 6 dapat dilihat bahwa pada parameter tinggi tanaman kedelai menunjukkan perlakuan N3I3 berbeda nyata dengan perlakuan N3. Perlakuan N3I3
mampu meningkatkan pertumbuhan tanaman kedelai dibandingkan perlakuan N3.
Pada parameter berat kering, berat basah, volume akar, jumlah buah dan berat buah tanaman kedelai menunjukkan bahwa perlakuan N3I3 berbeda nyata dengan perlakuan
N3 dan TK, dimana perlakuan N3I3 berperan dalam meningkatkan pertumbhan dan
produksi tanaman kedelai dibandingkan perlakuan N3 dan TK. Hal ini menunjukkan
perlakuan penggunaan bakteri penambat nitrogen dengan penghasil hormon IAA secara bersamaan pada perlakuan N3I3 mampu mempengaruhi pertumbuhan tanaman
kedelai. Hasil pengamatan juga menunjukkan perkembangan organ vegetatif yang dipengaruhi oleh pemberian bakteri penambat nitrogen dan penghasil IAA yang potensial secara tak langsung akan mendukung perkembangan organ generatif tanaman kedelai. Diasumsikan pula bahwa bakteri penambat nitrogen dan penghasil IAA yang diintroduksikan ke daerah perakaran tanaman kedelai kemungkinan dapat membantu melarutkan fosfat, sehingga tidak hanya mendukung pertumbuhan dan perkembangan organ vegetatif tanaman tetapi juga mendukung perkembangan organ generatif tanaman kedelai. Selain itu tanah yang digunakan pada penelitian ini kemungkinan mengandung unsur hara yang dapat mendukung perkembangan organ gerneratif tanaman seperti halnya kalium dan fosfor.
Bakteri yang mampu meningkatkan pertumbuhan tanaman dikelompokkan dalam PGPR (plant growth promoting rhizobacteria). Efek peningkatan pertumbuhan oleh PGPR ini dapat dihasilkan oleh suatu mekanisme penghasil fitohormon seperti IAA dan peningkatan ketersediaan hara oleh bakteri pemfiksasi nitrogen yang ada di sekitar rizosfer tanaman. Sumber hormon IAA yang alami tidak hanya dihasilkan oleh tumbuhan saja tetapi juga dihasilkan oleh rizobakteri. Pemakaian supernatan dari kultur rizobakteri yang mengandung IAA mampu memberikan efek fisiologis pada suatu tanaman. Hormon IAA merupakan hormon kunci bagi berbagai aspek pertumbuhan dan perkembangan tanaman sehingga sintesisnya oleh bakteri tanah tertentu dapat meningkatkan pertumbuhan tanaman (Aryantha et al., 2004).
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Diperoleh 5 isolat penghasil IAA dan 8 isolat penambat nitrogen yang diisolasi dari daerah rizosfer tanaman kedelai di perkebunan Tanjung Selamat, Medan. Isolat I3
merupakan yang paling potensial dalam menghasilkan IAA secara in-vitro dengan konsentrasi sebanyak 33.3 ppm sedangkan isolat N3 memilki kemampuan menambat
nitrogen yang paling potensial setelah diuji secara kualitatif dan kuantitatif sebesar 29.93 ppm. Setelah diaplikasikan ke tanaman kedelai, pemakaian bakteri penambat nitrogen dan penghasil IAA secara bersamaan mampu meningkatkan pertumbuhan dan produksi seperti jumlah bunga, jumlah buah dan jumlah polong tanaman kedelai.
5.2 Saran
DAFTAR PUSTAKA
Adisarwanto, T. 2005. Budidaya dengan Pemupukan Efektif dan Kedelai Pengoptimalan Peran Bintil Akar. Jakarta: Penebar Swadaya. hlm 5-6.
Aryantha, I.NY.P., P.L Dian. & P.D.P Nurmi. 2004. Potensi Isolat Bakteri Penghasil IAA dalam Peningkatan Pertumbuhan Kecambah Kacang Hijau Pada Kondisi Hidroponik. Mikrobiol Indones. 9: 43-46.
Azcon, R. & J.M. Barea. 1975. Synthesis of Auxins, Gibberellins and Cytokinins by Azotobacter vinelandii and Azotobacter beijerinckii Related to Effects Produced on Tomato Plants. Plant Soil. 43: 609-619.
Bahri, S., Wahyudi, A.T. & Mubarik, N.S. 2009. Genetic Diversity of Plant Growth Promoting Rhizobacteria of Bacillus sp. Based on 16S rRNA Sequence and Amplified rDNA Restriction Analysis. Microbiol Indones. 3: 12-16.
Benizri, E., Courtade, C., & Guckert, A. 1998. Role of Maize Root Exudates In the Production of Auxin by Pseudomonas fluorescens M3.1. Soil Biol Biochem. 30. 1481-1482.
Bric, J.M., Richard, M.B. & Sara, E.S. 1991. Rapid In Situ Assay for Indoleacetic Acid Production by Bacteria Immobilized on a Nitrocellulose Membrane. Appli Environ Microbiol. 57: 535-538.
Darnell, J. & H. Lodish. 1986. Molecular Cell Biology. New York: Scientific American Books, Inc
Dewi, I.R. 2007. Fiksasi N Biologi pada Ekosistem Tropis. Tesis. Bandung: Universitas Padjajaran.
Dobereiner, J. & J.M. Day. 1976. Chatacterization of Microorganism and Dinitrogen-fixing Sites. Proccedings of the 1st Internatioanal Symposium on N2 Fixation. Pullman: Washington State University Press. hlm: 518-538.
Ekowahyuni, L. P. 2002. Fenomena Vivipary Labu (Sechium edule jacg Swartz) Varietas Lokal Desa Barukupa Bawah Cipanas. Makalah Falsafah Sains Bogor. Institit Pertanian Bogor.
Fauziah, N. 2012. Potensi Bakteri Endorizosfer Ageratum Conyzoides L. Sebagai Antagonis Patogen Manusia. Bandung: Universitas Pendidikan Indonesia. Firrani, M. 2011. Isolasi dan Uji Kemampuan Bakteri Endofit Diazotrof yang
Hindersah, R., & T. Simarmata. 2004. Potensi Rhizobacteri Azotobacter Dalam Meningkatkan Kesehatan Tanah. J Natura Indones. 5:127-133.
Hoflich, G., Wiche, W., & Hecht, B.T. 1995. Rhizosphere Colonization of Different Crops with Growth Promoting Pseudomonas and Rhizobium Bacteria. Microbiol Res. 150: 139-147.
Isminarni, F., Wedhastri, S., Widada, J. & Bembo, H. P. 2007. Penambatan Nitrogen dan Fungsi Penghasil Indol Asam Asetat oleh Isolat-Isolat Azotobacter pada pH Rendah dan Aluminium Tinggi. J Ilmu Tanah Ling. 7: 23-30.
Lay, B.W. 1994. Analisa Mikroba di Laboratorium. Edisi pertama. Cetakan pertama. Jakarta: PT Raja Grafindo Persada. hlm 59-72.
Lay, B.W. & Hastowo. 1992. Mikrobiologi. Edisi Pertama. Cetakan I. Jakarta: Rajawali. hlm 98-102.
Lestari, P., N.S Dwi. & I.R. Eny. 2007. Pengaruh Hormon Asam Indol Asetat yang Dihasilkan Azospirillum sp. Terhadap Perkembangan Akar Padi. J Agro Biogen. 3: 66-72.
Lucyanie, D. 2009. Pengaruh Penambahan Bahan Organik yang Mengandung Triptofan (TRP) terhadap Produksi Asam Indol Asetat (AIA) oleh Azospirillum spp. Strain Lokal. Skripsi. Bandung: ITB.
Nasahi, H. C. 2010. Peran Mikroba dalam Pertanian Organik. Tesis. Bandung: Universitas Padjajaran.
Nurhayati, H. 2006. Isolasi Bakteri Penambat Nitrogen Non Siombiotik dari Lahan Kering Masam. Skripsi. Malang: Universitas Islam Negeri Malang.
Pamungkas, F. T., Sri, D1 & Raharjo, B. 2009. Pengaruh Konsentrasi dan Lama Perendaman dalam Supernatan Kultur Bacillus sp.2ducc-br-kl.3 Terhadap Pertumbuhan Stek Horisontal Batang Jarak Pagar (Jatropha curcas L.). Artikel Penelitian. Universitas Diponegoro.
Rahayu, T. 2006. Potensi Antibiotik Isolat Bakteri Rhizosfer Terhadap Bakteri Escherichia coli Multiresisten. J Penelit Sains Teknol. 7: 81-91.
Raihana, N. 2011. Profil Kultur Dan Uji Sensitivitas Bakteri Aerob Dari Infeksi Luka Operasi Laparatomi di Bangsal Bedah Rsup Dr. M. Djamil Padang. Makalah Sains. Padang. Universitas Andalas.
Rao, N.S. 1994. Mikroorganisme Tanah dan Pertumbuhan Tanaman. Edisi Kedua. Jakarta: UI-Press. hlm 100.
Rubio, M.G.T., A.V.P Sandra., B.C. Jaime. & M.N. Patricia. 2000. Isolation of Enterobacteria, Azotobacter sp. And Pseudomonas sp., Producers of Indole-3-Acetic Acid and Siderophores from Colombian Rice Rhizosphere. Revista Latinoamericana de Microbiol. 42: 171-176.
Rusmana, I & Hadijaya, D. D. 1994. Aktivitas Nitrogenase Azospirillum sp. dan Efektivitas Simbiotiknya dengan Jagung. Hayati. 1: 51-54.
Patten, C. L. & B.R. Glick. 2002. Role of Pseudomonas putida Indole Acetic Acid in Development of The Host Plant Root System. Appli Environ Microbiol. 68: 3795-3801.
Siregar, M. W. 2009. Isolasai dan Uji Kemampuan Bakteri Endofit Penghasil Hormon IAA (Indol Acetic Acid) dari Akar Tanaman Padi (Oryza sativa L). Skripsi. Departemen Biologi: FMIPA USU.
Suprapto, H. 2001. Bertanam Kedelai. Jakarta: Penebar Swadaya. hlm 2-5.
Susilowati, D. N, R. Saraswati, R.D. Hastuti, & Yuniarti, E. 2007. Peningkatan Serapan N pada Kedelai yang Diinokulasi Bakteri Diazotrof Endofit di Medium Vermiculit. J Tanah Iklim. Bogor. 26: 41-46.
Sutedjo, M. M. 1987. Pupuk Dan Cara Pemupukan. Penerbit Rhineka Cipta. Jakarta.hlm 41,111.
Toumi, T., Lakso, S., & Rosenquist, H. 1994. Indol 3 Acetic Acid (IAA) Production by abiofungicide Streptomyces griseoviridis A Strain. Ann Boot Fennici. 31: 59-63.
Vasanthakumar A, McManus PS. 2004. Indole-3-Acetic Acid Producing Bacteria are Associated with Cranberry Stem Gall. Phytopathol.94: 1164-1171.
Warsito, K. 2009. Isolasi dan Potensi Bakteri Penghasil Biosurfaktan dari Laut Sibolga dan Tanjung Balai Sumatera Utara dalam Mendegradasi Naftalen. Skripsi. Medan: Universitas Sumatera Utara.
Wedhastri, S. 2002. Isolasi dan seleksi Azotobacter spp. Penghasil Faktor Tumbuh dan Penambat Nitrogen dari Tanah Masam. J Ilmu Tanah Ling. 3: 45-51. Wilkins, M.B. 1989. Fisiologi Tumbuhan. Cetakan Kedua. Jakarta: Bina Aksara. hlm
19-30.
LAMPIRAN
LAMPIRAN 1. PEMBUATAN MEDIA SELEKTIF DAN REAGEN SALKOWSKI
a) Media Luria Bertani Cair (Bric et al, 1991)
Yeast extract 5 g, agar 20 g, Trypton 10 g, NaCl 0,5 g, 5 mM L-Tryptopan dilarutkan dalam 1 liter aquades dan diukur pH sampai 7,5, jika belum mencapai ditambahkan NAOH.
b) Media JNFB (James Nitrogen Free Malat Bromthymol Blue)
5,0 g asam malat, 0,6 g K2HPO4, 1,8 g KH2PO4, 0,2 g MgSO4.7H2O, 0,1 g NaCl,
0,2 g CaCl2.2H2O, 0,066 g FeEDTA, 0,02 g ekstrak khamir, 4,5 g KOH, 2 ml
BTB, 2 ml mikronutrien, pH 5,8)
c) Pembuatan Reagen Salkowski (Patten & Glick, 2002)
LAMPIRAN 2. PENENTUAN KURVA STANDART IAA (Indole Acetic Acid)
Gambar 7: Persamaan garis kurva standart IAA
Tabel 8. Nilai Persamaan Garis Regresi Kurva Standart IAA
x y x2 y2 xy
Untuk mencari persamaan garis regresi kurva maka nilai absorban (y) dari setiap konsentrasi IAA (x) dimasukkan ke dalam rumus:
�= ∑�� − KURVA STANDAR IAA
�= 0.02005� −0.0101
�2= 0.999
= 4108−3306
�(220−180)(0.076823−0.0607202)
= 0.802
Sehingga diperoleh persamaan garis kurva standart adalah �= 0.02005� −0.0101
Untuk mencari konsentrasi sampel, substitusikan nilai absorban dari setiap sampel ke persamaan garis kurva standart diatas.
Tabel 9. Nilai Rata-rata Konsentrasi IAA Secara In-vitro Isolat Konsentrasi IAA (ppm)
LAMPIRAN 3. DATA PENGAMATAN NILAI ABSORBAN SETIAP ISOLAT
Tabel 10. Pengukuran Nilai Absorban Setiap Isolat
Isolat Absorbansi hari ke-2 Absorbansi hari ke-4 Absorbansi hari ke-6
U1 U2 Rata-rata U1 U2 Rata-rata U1 U2 Rata-rata
I1 0,3204 0,2731 0,297 0,3973 0,3684 0,383 0,4833 0,3156 0,399
I2 0,2185 0,2849 0,252 0,3657 0,3461 0,356 0,2581 0,3312 0,295
I3 0,4799 0,4644 0,472 0,6136 0,6783 0,646 0,6613 0,6511 0,656
I4 0,2017 0,1975 0,200 0,4105 0,3607 0,386 0,3734 0.3086 0,341
LAMPIRAN 4. DATA PENGAMATAN TERHADAP PERTUMBUHAN TANAMAN KEDELAI (Glycine max
L.)
Tabel 11. Hasil Pengukuran Tinggi Tanaman dan Jumlah Daun
Perlakuan Ulangan tinggi tanaman minggui ke- Jumlah Jumlah daun minggu ke- Jumlah
Tabel 12. Hasil Perhitungan Jumlah Bunga dan Buah Tanaman Kedelai (Glycine max L.)
Perlakuan Ulangan JUMLAH BUNGA
Rata-Tabel 13. Hasil Perhitungan Berat Basah, Berat kering Tanaman,
Rata-rata 2.16 0.92 0.2 2.2 0.56
Tanah
Rata-rata 4.74 1.42 0.3 3.8 1.5
I3
Rata-rata 3.18 1.36 0.22 5.6 0.98
N3
Rata-rata 1.9 0.7 0.2 2.2 0.58
N3I3
LAMPIRAN 5. DATA UJI STATISTIK RANCANGAN ACAK LENGKAP TERHADAP PARAMETER PERTUMBUHAN TANAMAN KEDELAI (Glyzine max L.)
Tabel 14. Daftar Sidik Ragam Parameter Tinggi Tanaman Sumber
Perlakuan 961,5593 4 240,3898 3,394833161* 2,87 4,43 Galat 1416,21 20 70,8105
Total 2377,769 24
Tabel 15. Daftar Sidik Ragam Parameter Jumlah Daun Sumber
Perlakuan 1218,188 4 304,5469 2,399197996 2,87 4,43 Galat 2538,739 20 126,937
Total 3756,927 24
Tabel 16. Daftar Sidik Ragam Parameter Jumlah Bunga Sumber
Perlakuan 9,859304 4 2,464826 1,891178583 2,87 4,43 Galat 26,06656 20 1,303328
Total 35,92586 24
Tabel 17. Daftar Sidik Ragam Parameter Jumlah Buah Sumber
Perlakuan 10,12262 4 2,530654 2,933248179* 2,87 4,43 Galat 17,25496 20 0,862748
Total 27,37758 24
Tabel 18. Daftar Sidik Ragam Parameter Berat Basah Sumber
Tabel 20. Daftar Sidik Ragam Parameter Volume Akar
Tabel 21. Daftar Sidik Ragam Parameter Jumlah Polong Sumber
LAMPIRAN 6. DOKUMENTASI PENELITIAN
a b
Gambar 8: (a) biakan murni I3 pada media LB + L-Triptofan, (b) Biakan murni
N3 pada media JNFB
a b
Gambar 9: (a) Isolat awal bakteri rizosfer dari perkebunan Tanjung Selamat, (b) Uji sinergisme bakteri IAA dan bakteri penambat nitrogen
a
Gambar 10: (a) Uji Standart Plate Count bakteri IAA pada media PCA
I3
a b
Gambar 11: (a) IAA murni, (b) Supernatan bakteri IAA yang diberi reagen Salkowsky, terlihat isolat I3 memiliki warna yang lebih pekat
a b
Gambar 12: (a) Uji biokimia TSIA, perubahan warna pada slant dan butt menunjukkan kemampuan bakteri memfermentasikan gula (b) Uji SSA, perubahan warna media dari hijau ke biru menunjukkan bakteri mampu menggunakan Na-sitrat dan NH4
a b
Gambar 13: (a) Uji biokimia Katalase, (b) Pembentukan pelikel pada medium JNFB semipadat oleh bakteri penambat nitrogen yang diinkubasi selama 10 hari pada suhu 35-36 oC
I1
slant
I2
I3 I4 I5
pelikel