SELEKSI BAKTERI PENGHASIL
INDOLE-3-ACETIC ACID
(IAA) DAN PENGUJIAN PADA BIBIT KELAPA SAWIT
(
Elaeis guineensis
Jacq.)
MELI ASTRIANI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Seleksi Bakteri Penghasil
Indole-3-Acetic Acid (IAA) dan Pengujian pada Bibit Kelapa Sawit (Elaeis guineensis Jacq.) adalah benar karya saya dengan arahan dari komisi
pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2015
Meli Astriani
RINGKASAN
MELI ASTRIANI. Seleksi Bakteri Penghasil Indole-3-Acetic Acid (IAA) dan Pengujian pada Bibit Kelapa Sawit (Elaeis guineensis Jacq.). Dibimbing oleh NISA RACHMANIA MUBARIK dan ARIS TJAHJOLEKSONO.
Kelapa sawit (Elaeis guineensis Jacq.) merupakan komoditi perkebunan yang memiliki nilai ekonomi tinggi sebagai penghasil minyak nabati di Indonesia. Salah satu faktor yang mempengaruhi produktivitas tanaman yaitu kualitas bibit yang unggul dan penyiapan pembibitan sawit yang merupakan langkah dasar yang menentukan penanaman di lapangan. Penyiapan pemeliharaan tanaman mempunyai kendala yaitu biaya yang tinggi untuk pengeluaran pupuk. Pemakaian pupuk kimia dan pestisida jangka panjang dalam perkebunan kelapa sawit dapat menyebabkan masalah lingkungan yang akan meninggalkan residu senyawa sintetik di tanah. Salah satu solusinya yaitu dengan menghasilkan suatu senyawa alami atau agen biologi yang dapat meningkatkan pertumbuhan tanaman. Salah satu fitohormon yang banyak terdapat di alam dan paling aktif adalah Indole-3-acetic acid (IAA). Auksin eksogen yang berasal dari bakteri rhizosfer merupakan fokus dari penelitian ini. Tujuan dari penelitian ini untuk mendapatkan bakteri penghasil IAA dari Taman Nasional Bukit Dua Belas (TNBD) Jambi dan diaplikasikan pada bibit kelapa sawit.
Metode penelitian ini meliputi peremajaan bakteri, uji hipersensitivitas, penapisan isolat penghasil IAA, pengujian bakteri pelarut P dan K, penentuan kurva pertumbuhan dan produksi IAA, pengukuran IAA dengan metode High Performance Liquid Chromatography (HPLC), identifikasi molekuler gen 16S rRNA, dan aplikasi bakteri pada bibit kelapa sawit. Hasil seleksi bakteri penghasil IAA terdiri atas 9 bakteri kitinolitik dan 16 selulolitik. Uji hipersensitivitas pada daun tembakau diperoleh 4 dari 9 isolat bakteri kitinolitik dan 9 dari 16 isolat bakteri selulolitik tidak menyebabkan nekrotik (negatif hipersensitivitas) pada daun tembakau. Sebanyak 13 Isolat yang tidak menyebabkan gejala nekrotik pada daun selanjutnya diseleksi berdasarkan kemampuannya dalam menghasilkan IAA pada media yang ditambah dengan triptofan dan tanpa triptofan. Hasil penapisan menggunakan metode kolorimetri menunjukkan isolat SAHA 12.08 dan KAHN 15.12 menghasilkan IAA sebesar 3.99 dan 3.75 ppm. Pengukuran secara kuantitatif menggunakan (HPLC) untuk kedua isolat menghasilkan IAA pada puncak kromatogram yang sama dengan IAA standar pada waktu retensi 21 sampai 22 menit. KAHN 15.12 memiliki tingkat kemiripan 99% dengan Serratia marcescens setelah diidentifikasi gen penyandi 16S rRNA. Aplikasi pada bibit kelapa sawit dengan pemberian kultur S. marcescens KAHN 15.12 dan Bacillus thuringiensis SAHA 12.08 berpengaruh secara nyata pada jumlah akar lateral yaitu sebesar 60.7-65% dibandingkan kontrol negatif untuk 90 (HST) hari setelah tanam. Isolat SAHA 12.08 dan KAHN 15.12 dengan setengah dosis pupuk Rock Phosphate berpengaruh lebih baik pada jumlah akar lateral, diameter batang, dan jumlah daun pada bibit sawit.
SUMMARY
MELI ASTRIANI. Selection of IAA-Producing Bacteria and its Apllication on Oil Palm Seedlings (Elaeis guineensis Jacq.). Supervised by NISA RACHMANIA MUBARIK and ARIS TJAHJOLEKSONO.
Oil Palm (Elaeis guineensis Jacq.) is a crop that has a high economic value in the production of vegetable oil in Indonesia. The eminent seed quality and seedlings preparation of oil palm are some factors that effect plant productivity and a basic step which determinates the planting process in field. The high cost for fertilizer expenses was a basic matter for plant maintenance preparation. The use of chemical fertilizers and pesticides for long term in oil palm plantation can cause environmental problems due to the residue of this synthetic compound on the soil. One of the solutions for this problem is the use of a natural compound or biological agent that can promote plant growth. Indole-3-acetic acid (IAA) is the most active phytohormone which widely available in nature. Exogenous auxin derived from rhizosphere bacteria is the focus of this study. The objectives of this study was to obtain bacteria producing IAA from Taman Nasional Bukit Dua Belas (TNBDB) Jambi and to apply the selected bacteria in oil palm seedlings.
Methods of this research were cultivation of isolates, hypersensitivity test, screening of isolates which produced IAA, phosphate and potassium solubilizing assay, bacterial growth and IAA production, measurement of IAA using High Performance Liquid Chromatography (HPLC) method, molecular identification using 16S rRNA gene, and application of bacteria on oil palm seedlings. The result of IAA which produced by bacteria which selected in this research consists of 9 chitinolytic and 16 cellulolytic bacteria. Hypersensitivity test on tobacco leaf showed that 4 of 9 chitinolytic isolates and 9 of 16 cellulolytic isolates did not cause necrotic (negative hypersensitivity) in tobacco leaves. A total of 13 isolates that did not caused necrotic symptoms on leaves then selected based on their ability to produce IAA on supplemented media with and without tryptophan. Screening results based on colorimetric method showed isolates SAHA 12.08 and KAHN 15.12 produced IAA up to 3.99 and 3.75 ppm. Quantitative measurement of IAA producing using (HPLC) for both isolates had the peaks with the same as IAA standards at a retention time in 21 to 22 minutes. KAHN 15.12 gene 99% sequences similarity with Serratia marcescens which identified based on 16S rRNA gene. The application of S. marcescens KAHN 15.12 and Bacillus thuringiensis SAHA 12.08 on oil palm seedlings showed better effect the number of lateral roots up to 60.7-65% compared to negative control for 90 DAP (days after planting). Isolate SAHA 12.08 and KAHN 15.12 with a half dose of Rock Phosphate fertilizer showed a better effect on oil palm seedlings such as number of lateral roots, stem diameter, number of leaves.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
SELEKSI BAKTERI PENGHASIL
INDOLE-3-ACETIC ACID
(IAA) DAN PENGUJIAN PADA BIBIT KELAPA SAWIT
(
Elaeis guineensis
Jacq.)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juni 2014 sampai Mei 2015 ini ialah Seleksi Bakteri Penghasil Indole-3-Acetic Acid (IAA) dan Pengujian pada Bibit Kelapa Sawit (Elaeis guineensis Jacq.).
Terima kasih penulis ucapkan kepada Dr Nisa Rachmania Mubarik, MSi sebagai ketua komisi pembimbing dan Bapak Dr Aris Tjahjoleksono, DEA sebagai anggota komisi pembimbing, yang telah membimbing dan mengarahkan penulis dengan penuh kesabaran, ikhlas telah meluangkan waktu, ilmu, nasehat, saran, motivasi yang membangun, serta solusi dari permasalahan yang dihadapi penulis selama melaksanakan penelitian dan penyusunan karya ilmiah ini. Selain itu penulis ucapkan terima kasih kepada penguji luar komisi Dr Happy Widiastuti, MSi atas saran dan diskusi yang diberikan dan Prof Dr Anja Meryandini, MS selaku Ketua Program Studi Mikrobiologi IPB, yang telah memberikan motivasi selama studi dan masukan pada ujian sidang tesis. Terima kasih kepada Bapak Mashuri Waite, Ph.D untuk memeriksa penulisan artikel dalam bahasa Inggris yang dikirim ke Malaysian Journal of Microbiology. Kepada DIKTI Kementerian Riset dan Pendidikan Tinggi Republik Indonesia melalui Beasiswa BPPDN 2013/2014 terima kasih atas kepercayaannya untuk memberikan beasiswa kuliah selama menempuh pendidikan pascasarjana di IPB dan terima kasih atas dukungan dana dari Penelitian Unggulan IPB tahun 2015 a.n. Dr Nisa Rachmania Mubarik, MSi sehingga penelitian yang penulis lakukan dapat terlaksana dengan baik.
Ucapan terima kasih juga ditujukan kepada kedua orang tua tercinta ayahanda Iskandar, ibu Elia, dan saudari-saudariku (Weni Iskafitri, Wika Perwasi, Pepi Indah Sari, Amd, Helin Maharani, dan Siska Oktalia) serta seluruh keluarga untuk dukungannya, kasih sayang dan doa yang senantiasa mengiringi setiap langkahku. Penulis juga mengucapkan terima kasih kepada Ibu Heni dan Bapak Jaka selaku teknisi Laboratorium Mikrobiologi, teman-teman seperjuangan di laboratorium penelitian Mikrobiologi IPB angkatan 2013 serta seluruh pihak yang telah memberikan doa dan dukungannya, penulis ucapkan terima kasih.
Semoga karya ilmiah ini bermanfaat.
Bogor, September 2015
DAFTAR ISI
IAA pada Tanaman dan Bakteri 4
Rhizobakteria Penghasil IAA 4
Biosintesis IAA 5
Peran Rhizobakteria pada Bibit Kelapa Sawit 6
Aplikasi Pupuk Kimia dan Pupuk Hayati pada Bibit Kelapa Sawit 7
3 METODE 8
Penapisan Isolat Penghasil IAA 9
Uji Bakteri Pelarut P dan K 9
Penentuan Kurva Pertumbuhan dan Produksi IAA 10
Pengukuran IAA dengan HPLC 10
Identifikasi Molekuler Gen 16S rRNA 10
Aplikasi Bakteri pada Bibit Kelapa Sawit 11
4 HASIL DAN PEMBAHASAN 13
Uji Hipersensitivitas 13
Penapisan Isolat Penghasil IAA 13
Pengujian Kemampuan Bakteri dalam Melarutkan P dan K 14
Pengukuran IAA dengan HPLC 14
Kurva Pertumbuhan Bakteri dan Produksi IAA 15
Identifikasi Molekuler 15
Aplikasi Bakteri pada Bibit Kelapa Sawit 16
DAFTAR TABEL
1 Konsentrasi IAA pada media yang ditambah triptofan dan tanpa
triptofan 13
2 Hasil pengukuran IAA menggunakan HPLC 15
3 Pengaruh perlakuan bakteri pada bagian atas bibit sawit umur 90 HST 17 4 Pengaruh perlakuan bakteri pada perakaran bibit sawit umur 90 HST 17 5 Pengaruh perlakuan bakteri pada bobot kering bibit sawit umur 90 HST 18
DAFTAR GAMBAR
1 Diagram alur penelitian 8
2 Hasil uji hipersensitivitas pada daun tembakau 13 3 Koloni isolat KAHN 15.12 pada medium Pikovskaya dan medium
Aleksandrov 14
4 Kromatogram IAA standar, kromatogram isolat KAHN 15.12,
kromatogram isolat SAHA 12.08 14
5 Kurva pertumbuhan bakteri dan produksi IAA 15
6 Visualisasi hasil amplifikasi gen 16S rRNA dengan elektroforesis gel
agarosa 1%. 16
7 Pohon filogenetik isolat KAHN 15.12 16
8 Akar bibit sawit umur 90 HST 18
9 Jumlah sel bakteri pada media tanam bibit kelapa sawit umur 45 HST
dan 90 HST 19
DAFTAR LAMPIRAN
1 Kurva standar IAA 28
2 Kurva standar isolat SAHA 12.08 dan KAHN 15.12 28
3 Kalibrasi standar IAA dengan HPLC 29
4 Homologi sekuen gen 16S rRNA isolat KAHN 15.12 menggunakan
program BLAST-N 29
5 Sekuens Isolat KAHN 15.12 30
6 Hasil analisis BLAST-N sekuen isolat KAHN 15.12 pada sekuen NCBI 31
7 Karakteristik kimia tanah Darmaga IPB 32
8 Model Rancangan Acak Lengkap (RAL) 32
1
PENDAHULUAN
Latar Belakang
Kelapa Sawit (Elaeis guineensis Jacq.) merupakan salah satu komoditi perkebunan yang memiliki nilai ekonomi tinggi sebagai penghasil minyak nabati. Menurut Badan Pusat Statistik (2013), produksi olahan minyak kelapa sawit
Crude Palm Oil (CPO) mengalami peningkatan mulai tahun 2008 produksi sebesar 19.40 juta ton meningkat menjadi 26.02 juta ton pada tahun 2012. Pada tahun 2013 produksi minyak sawit menjadi sebesar 26.90 juta ton dan di tahun 2014 meningkat 4.19 persen menjadi 28.02 juta ton. Perkembangan produksi minyak kelapa sawit (CPO) meningkat sejalan dengan luas areal. Total areal perkebunan kelapa sawit di Indonesia cenderung menunjukkan peningkatan, sekitar 2.49 sampai 11.33% per tahun. Pada tahun 2008 lahan perkebunan kelapa sawit Indonesia tercatat seluas 7.33 juta ha meningkat menjadi 10.13 juta ha pada tahun 2012. Pada tahun 2013 luas areal perkebunan kelapa sawit menjadi 10.59 juta ha dan tahun 2014 meningkat menjadi 10.85 juta ha. Provinsi Riau dan Sumatera Utara merupakan sentral produksi terbesar yang berkontribusi masing-masing sebesar 28.52% dan 17.77% kemudian disusul oleh Provinsi di pulau Sumatera, Kalimantan, Jawa Barat, Banten, Sulawesi Tengah, dan Papua.
Kelapa sawit sebagai sumber penghasil minyak nabati memegang peranan penting bagi perekonomian negara. Perkembangan industri kelapa sawit di negara beriklim tropis telah didorong oleh potensi produktivitas yang sangat tinggi. Produktivitas dan mutu minyak sawit sangat ditentukan oleh kualitas bibit yang unggul dan penyiapan pembibitan kelapa sawit. Penyiapan pembibitan merupakan langkah dasar yang sangat menentukan penanaman di lapangan. Sekitar 60% biaya pemeliharaan tanaman dikeluarkan untuk biaya pemupukan. Pupuk kimia dan pestisida dapat terakumulasi di dalam tanah yang dapat menurunkan kualitas tanah. Aryantha et al. (2004) melaporkan salah satu alternatif dalam mengatasi masalah penggunaan pupuk kimia dan pestisida, yaitu menggunakan senyawa alami yang dapat meningkatkan pertumbuhan tanaman (fitohormon).
IAA merupakan salah satu fitohormon auksin yang banyak terdapat di alam dan paling aktif (Tsavkelova et al. 2005). IAA eksogen yang diproduksi oleh bakteri dapat mempercepat pertumbuhan tanaman dengan memacu proses differensiasi pada akar dalam membentuk rambut akar. Konsentrasi IAA rendah dapat menstimulasi pemanjangan akar utama, sedangkan konsentrasi tinggi dapat menstimulasi pembentukan akar lateral dan akar adventif. Pertumbuhan akar lateral dan akar adventif berperan pada tanaman yang masih muda dalam hal menyerap unsur hara (Patten dan Glick 2002).
2
Bakteri panambat nitrogen yang diisolasi dari tanah perkebunan kelapa sawit mampu menghasilkan IAA setelah diinduksi triptofan 1 mM. Bakteri tersebut antara lain Beijerinckia fluminensis, Ensifer adhaerens, Microbacterium, Caulobacter segnis, dan Rhizobium grahamii (Harca et al. 2014). Rhizobakteria
Herbaspirillum sorepedicae galur Z78 dan Microbacterium sp galur E7 yang berasal dari jaringan akar kelapa sawit memberikan pengaruh positif pada pertumbuhan kelapa sawit (Ai’shah et al. 2013). Azosprillum dan Bacillus spp. merupakan rhizobacteria yang dilaporkan meningkatkan pertumbuhan dan fiksasi N2 beberapa tanaman nonleguminosae dan bibit kelapa sawit (Amir et al. 2005). Hutan Taman Nasional Bukit Dua Belas (TNBDB) Jambi merupakan daerah deforestasi yang mengalami pembukaan hutan menjadi lahan perkebunan kelapa sawit dan karet. Haryanto (2013) dan Purnamasari (2013) telah berhasil mengisolasi bakteri selulolitik dan kitinolitik dari tanah TNBDB Jambi. Salah satu isolatnya ialah Bacillus thuringiensis SAHA 12.08 yang memiliki kemampuan menghasilkan kitinase dan memiliki aktivitas antagonis terhadap Culvularia affinis dan Colletotrichum gleosporoides (Asril et al. 2014). Namun demikian, belum ada laporan bakteri selulolitik dan kitinolitik ini sebagai bakteri penghasil IAA, serta mengenai aplikasi bakteri penghasil IAA yang dapat digunakan sebagai pemacu pertumbuhan kelapa sawit masih sedikit. Oleh karena itu, penelitian ini perlu dilakukan untuk mencari bakteri penghasil IAA yang dapat dimanfaatkan sebagai pupuk hayati dalam pembibitan kelapa sawit.
Perumusan Masalah
Pembibitan sawit merupakan salah satu faktor yang mempengaruhi produktivitas tanaman dan langkah dasar yang menentukan penanaman di lapangan. Penyiapan, penanaman, pemeliharaan tanaman di lapangan membutuhkan biaya yang tinggi terutama untuk pupuk kimia. Pemakaian pupuk kimia juga meninggalkan residu di tanah, tercuci dan mengubah kondisi tanah. Pupuk hayati yang berasal dari agen biologi sangat dibutuhkan karena bersifat ramah lingkungan dan diharapkan dapat diformulasi dan diaplikasikan untuk mereduksi penggunaan pupuk kimia dalam pembibitan sampai dengan pemeliharaan tanaman di lapangan.
Tujuan Penelitian
Penelitian ini bertujuan untuk mendapatkan bakteri penghasil IAA yang dapat digunakan sebagai pemacu pertumbuhan bibit kelapa sawit.
Manfaat Penelitian
3
sehingga dapat menghasilkan bibit yang baik dan mereduksi penggunaan pupuk kimia.
Ruang Lingkup Penelitian
4
2
TINJAUAN PUSTAKA
IAA pada Tanaman dan Bakteri
Hormon auksin (IAA) dibedakan menjadi dua kelompok, yaitu IAA endogen dan eksogen. IAA endogen berasal dari tanaman yang merupakan salah satu hormon tanaman paling penting yang mengatur banyak aspek di antaranya pertumbuhan dan perkembangan tanaman sepanjang siklus sel tumbuhan, pembelahan sel, pemanjangan sel, dan diferensiasi untuk inisiasi akar, dominasi apikal, tropisme, dan pembungaan (Baca dan Elmerich 2003). IAA mengendalikan banyak proses fisiologis termasuk pembesaran sel, diferensiasi jaringan, serta respon tanaman terhadap cahaya (Spaepen et al. 2007).
IAA eksogen merupakan salah satu fitohormon paling aktif secara fisologi, dihasilkan oleh beberapa mikrob yang mempunyai jalur metabolisme antara lain melalui sintesis L-triptofan. Bakteri rizosfer dapat mensintesis auksin sebagai metabolit sekunder karena persediaan substrat yang berasal dari eksudat akar lebih banyak dibandingkan dengan tanah nonrhizosfer (Patil 2011).
Rhizobakteria Penghasil IAA
Rhizosfer adalah tanah di sekitar akar tanaman yang secara langsung dipengaruhi oleh mikrob tanah dan eksudasi perakaran tanaman. Penyediaan nutrisi pada tanaman sangat dipengaruhi oleh komposisi mikrob di daerah rhizosfer (Sukmadi 2013). Tanaman menarik mikrob menguntungkan di daerah rhizosfer dengan cara mengeluarkan eksudat akar yang berperan sebagai sumber nutrisi bagi mikrob, sedangkan mikrob akan mengeluarkan metabolit berupa zat pemacu pertumbuhan tanaman yang digunakan untuk pertumbuhan dan perkembangannya. Adanya eksudat akar tersebut menyebabkan populasi mikrob di daerah rhizosfer jauh lebih tinggi dari pada di bagian tanah yang lain (Akbari et al. 2007). Mikrob yang menghuni rhizosfer mampu memproduksi dan menghasilkan auksin sebagai hasil metabolit sekunder karena ketersediaan substrat pada daerah ini dibandingkan dengan area nonrhizosfer (Ahmad et al.
2005). Sekitar 80% bakteri rhizosfer dapat menghasilkan hormon IAA (Zakharova
et al. 1999).
Peningkatan pertumbuhan akar menjadi suatu penanda utama yang memberikan efek menguntungkan bagi pertumbuhan tanaman dan bakteri. Pembentukan akar yang baik dengan adanya pemanjangan akar primer atau proliferasi akar lateral dan akar adventif menguntungkan bagi bibit tanaman muda dalam meningkatkan kemampuan menyerap air dan hara. Kebanyakan bakteri rhizosfer mensintesis IAA sebagai hormon eksogen tanaman yang akan memacu akar primer dan munculnya akar lateral. Akar lateral dan akar adventif diinduksi oleh IAA sebagai hormon eksogen dalam konsentrasi tinggi dan pertumbuhan akar primer dirangsang oleh konsentrasi IAA yang rendah (Patten dan Glick 2002).
5
pertumbuhan akar dari benih jagung sebesar 185.3 mm (Khamna et al. 2010).
Pseudomonas syringae dapat memperpanjang akar tanaman gula dengan memproduksi IAA (Loper dan Schroth 1986). Lwin et al. (2012) berhasil mengisolasi bakteri dari berbagai tanah di antaranya rhizobacteria, Bacillus spp. dan Serratia spp. Rhizobacteria galur R1 mempunyai kemampuan dalam menghasilkan IAA tertinggi sebesar 121.1 ppm pada hari ke-6 dengan meningkatkan jumlah akar adventif pada Zea mays L. sebesar 14.4±1.476.
Bacillus spp. memproduksi IAA mulai dari 53.1 ppm sampai optimal 71.1 ppm dan Serratia spp. menghasilkan IAA terendah mulai dari 3.14 ppm dan optimum pada hari ke-8 sebesar 20.05 ppm.
Produksi IAA oleh bakteri yang berasal dari rhizosfer diinduksi oleh berbagai konsentrasi triptofan. Ahmad et al. (2005) melaporkan bahwa beberapa bakteri yang memproduksi IAA dengan penambahan triptofan antara lain ialah
Azotobacter memproduksi IAA sebesar 1.47-11.88 mg/ml, 5.99-24.8 mg/ml dan 7.3-32.8 mg/ml setelah penambahan triptofan 1, 2, dan 5 mg/ml. Pseudomonas fluorescence dengan konsentrasi triptofan 1 sampai 5 mg/ml menghasilkan IAA sebesar 41.0-53.2 mg/ml, sedangkan 6 isolat lainnya dihasilkan IAA 23.4-36.2 mg/ml. Pseudomonas putida galur GR12-2 dengan penambahan triptofan 0.5 mM menghasilkan IAA sebesar 68.3 ± 2.2 µM (Patten dan Glick 2002)
Konsentrasi IAA pada kultur bakteri yang ditumbuhkan pada media dengan penambahan triptofan umumnya lebih tinggi dibandingkan dengan kultur yang ditumbuhkan pada media tanpa triptofan. Bacilus sp. galur TG-1 menghasilkan IAA tertinggi yaitu 67.2 ppm yang diberi triptofan 0.5 mM, sedangkan tanpa triptofan hanya menghasilkan IAA sebesar 38.9 ppm. Isolat HI-2 menghasilkan IAA sebesar 67.2 ppm sedangkan tanpa penambahan triptofan hanya 47.6 ppm (Widayanti 2007).
Biosintesis IAA
Spaepen et al. (2007) melaporkan bahwa triptofan telah diidentifikasi sebagai prekursor utama bagi jalur biosintesis IAA pada bakteri. Identifikasi intermediet menyebabkan terdapat jalur yang berbeda cara menggunakan triptofan sebagai prekursor untuk biosintesis IAA. Jalur biosintesis IAA di antaranya ialah
Indole-3-asetamida (IAM) yang merupakan jalur khusus pada bakteri. Triptofan diubah menjadi IAM oleh enzim triptofan monooxygenase (IaaM). Pada langkah kedua IAM akan dikonversi menjadi IAA oleh enzim IAM hidrolase (IaaH). Lintasan IAM ini terjadi pada Agrobacterium tumefaciens, Pseudomonas syringae, Pantoea agglomerans, Rhizobium, dan Bradyrhizobium. Jalur Indole-3-piruvat
(IPyA) dianggap sebagai jalur utama untuk biosintesis IAA pada tanaman. Enzim yang terlibat dalam biosintesis IAA pada tanaman belum teridentifikasi secara jelas berbeda dengan bakteri. Bakteri mensintesis IAA melalui jalur IPyA dengan enzim aminotransferase pada proses transaminasi seperti Bradyrhizobium, Azospirillum, Rhizobium, Enterobacter cloacae, dan Cyanobacteria. IPyA didekarboksilasi menjadi indole-3-asetaldehida (IAAld) oleh enzim
6
Lintasan triptamin (TAM) telah diidentifikasi pada bakteri Bacillus cereus. Pada tumbuhan, triptamin diidentifikasi sebagai senyawa endogen untuk dekarboksilasi triptofan. Sebagian besar lintasan TAM pada bakteri berbeda dengan tanaman, karena lintasan TAM dapat langsung dikonversi ke IAAld oleh amina oksidase (Hartmann et al. 1983).
Biosintesis IAA melalui indole-3-asetonitril (IAN), IAN dikonversi menjadi IAA oleh nitrilase diidentifikasi oleh (Bartling et al. 1992). IAN terbentuk melalui glucosinolates indolic (glucobrassicin) dan indole-3 acetaldoxime. Alcaligenes faecalis merupakan bakteri yang menggunakan lintasan ini. Nitrilase telah dideteksi spesifik untuk IAN. Beberapa bakteri seperti
Agrobacterium tumefaciens dan Rhizobium spp. mengkonversi IAN menjadi IAA melalui IAM (Kobayashi et al. 1995).
Peran Rhizobakteria pada Bibit Kelapa Sawit
Kelapa sawit merupakan tanaman perkebunan yang bernilai ekonomi tinggi. Perkembangan perkebunan kelapa sawit yang cukup pesat di Indonesia telah membuat alih fungsi lahan dari hutan menjadi perkebunan pada ekosistem rawa gambut (Nurbaiti et al. 2012). Semakin cepat pembukaan lahan maka permintaan bibit kelapa sawit semakin tinggi. Produktivitas tanaman sangat ditentukan oleh kualitas pemupukan yang baik dari aspek dosis, waktu, metode aplikasi dan jenis pupuk. Penggunaan pupuk kimia yang semakin meningkat akan berdampak negatif terhadap lingkungan. Alternatif ramah lingkungan dengan menghasilkan zat yang dapat meningkatkan pertumbuhan kelapa sawit. Rhizobakteria menghasilkan senyawa alami yang dapat memacu pertumbuhan kelapa sawit. Bakteri diazotrof penghasil IAA akan memacu pertumbuhan tunas kelapa sawit secara in vitro dengan cara mengkolonisasi dan menginduksi sekitar akar. Bakteri diazotrof Microbacterium sp. galur E7 dan E14 dilaporkan mampu menginisiasi akar sekunder, kadar protein, dan peningkatan berat basah tertinggi ternyata dapat meningkatkan pertumbuhan dan perkembangan in vitro tunas kelapa sawit dan dapat dikembangkan lebih lanjut menjadi biofertilizer yang potensial (Ai’shah et al. 2013).
Azosprillum dan Bacillus spp. merupakan rizobacteria yang mampu meningkatkan pertumbuhan dan fiksasi N2 beberapa tanaman nonleguminosae dan dapat diaplikasikan pada bibit kelapa sawit untuk mengurangi penggunaan pupuk nitrogen (Amir et al. 2005). Tanaman yang diinokulasikan dengan
Acetobacter diazotrophicus (R12) dan Azospirillum brasilense (Sp7) memberikan pengaruh lebih baik dibandingkan kontrol, namun Pemberian A. diazotrophicus
7
Aplikasi Pupuk Kimia dan Pupuk Hayati pada Bibit Kelapa Sawit
Pupuk kimia yang sering digunakan untuk pemupukan bibit kelapa sawit pada tahap main-Nursery seperti pupuk majemuk NPKMg, pupuk kieserite (PPKS 2005), pupuk tunggal yang banyak beredar di pasaran berisi hara utama nitrogen (N) seperti urea, ZA, K, ZN, KCl (Lingga 1998). Pupuk anorganik yang digunakan antara lain rock phosphate, MOP, TSP dan SP36, sedangkan pupuk organik memberikan hara bagi tanaman, memperbaiki struktur tanah dan sangat bermanfaat bagi tanaman karena secara komparatif memberikan unsur hara yang murah tanpa adanya resiko keracunan bagi tanaman serta mempengaruhi pertumbuhan dan mutu produk yang dihasilkan. Perkebunan kelapa sawit menggunakan pupuk organik yang berasal dari limbah perkebunan proses pengolahan kelapa sawit, inokulan tanah meliputi bakteri legume pengikat N, bakteri nonlegum pengikat N dan cendawan pelarut P (Pahan 2006). Pupuk hayati yang digunakan bibit kelapa sawit seperti pupuk Greenfeed yang ramah lingkungan (Pardamean 2011). Endopalma ialah salah satu produk pupuk hayati yang berasal dari berbagai bakteri endofit yang mampu menekan serangan
Ganoderma boninense di lapangan serta meningkatkan kesuburan tanah dan produktivitas tanaman kelapa sawit (PPKS 2012).
Biaya yang dikeluarkan untuk pupuk anorganik sangat mahal yaitu 25-30% dari total biaya produksi. Kebijakan perkebunan mensubstitusikan
8
3
METODE
Bahan
Bahan yang digunakan ialah 16 bakteri selulolitik dan 9 bakteri kitinolitik asal tanah perkebunan kelapa sawit dan karet dari sekitar Taman Nasional Bukit Dua Belas (TNBDB) Jambi dikoleksi di IPBCC. Kecambah kelapa sawit yang digunakan yaitu varietas hasil persilangan Dura x Pisifera dari Pusat Penelitian Kelapa Sawit (PPKS) Medan. Tanaman tembakau (Nicotiana tabaccum L.) dari diperoleh Balai Besar Litbang Bioteknologi dan Sumber daya Genetik Pertanian.
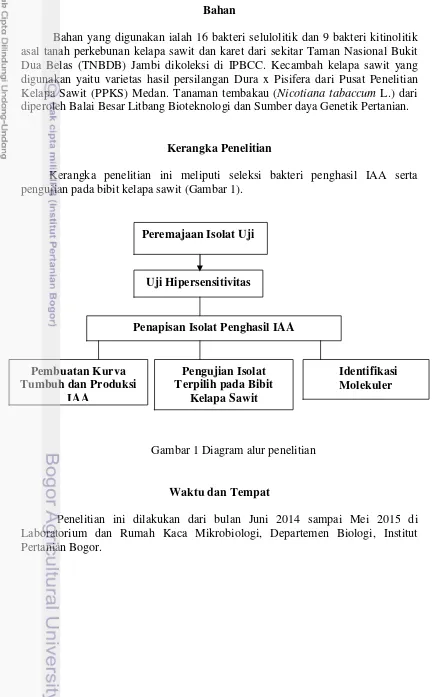
Kerangka Penelitian
Kerangka penelitian ini meliputi seleksi bakteri penghasil IAA serta pengujian pada bibit kelapa sawit (Gambar 1).
Gambar 1 Diagram alur penelitian
Waktu dan Tempat
Penelitian ini dilakukan dari bulan Juni 2014 sampai Mei 2015 di Laboratorium dan Rumah Kaca Mikrobiologi, Departemen Biologi, Institut Pertanian Bogor.
Peremajaan Isolat Uji
Uji Hipersensitivitas
Penapisan Isolat Penghasil IAA
Identifikasi Molekuler Pengujian Isolat
Terpilih pada Bibit Kelapa Sawit Pembuatan Kurva
9
Peremajaan Isolat
Peremajaan isolat bakteri dengan menumbuhkan sebanyak 25 isolat antara lain 16 isolat bakteri selulolitik dan 9 bakteri kitinolitik pada media agar-agar miring Nutrient Agar (NA) sebagai biakan kerja.
Uji Hipersensitivitas
Seluruh isolat bakteri diuji reaksi hipersensitivitas (HR) pada daun tembakau (Nicotiana tabacum L.) yang berumur 2 sampai 3 bulan. Masing-masing suspensi bakteri dengan kerapatan 108 CFU/ml diinokulasikan (disuntikkan) menggunakan syringe 1 ml pada bagian mesofil antara tulang daun tembakau pada permukaan bawah daun. Kontrol negatif digunakan akuades steril sedangkan pada kontrol positif digunakan Pseudomonas syringae sebagai inokulan. Pengamatan HR dilakukan 24 dan 48 jam setelah inokulasi. Reaksi positif ditunjukkan dengan timbulnya gejala nekrotik pada daun tembakau (Klement dan Godman 1967). Isolat bakteri yang tidak menyebabkan gejala nekrotik (reaksi negatif) pada daun tembakau kemudian digunakan pada uji selanjutnya.
Penapisan Isolat Penghasil IAA
Pengukuran kandungan IAA dilakukan dengan metode kolorimetri menggunakan reagen Salkowski dengan komposisi 150 ml H2SO4 pekat, 7.5 ml
FeCl3.6H2O 0.5 M, dan 250 ml aquades steril (Gordon dan Weber 1951).
Pengujian aktivitas IAA dilakukan dengan mengambil 1 ml kultur bakteri kemudian disentrifugasi dengan kecepatan 4600 g selama 15 menit. Sebanyak 1 ml supernatan kemudian direaksikan dengan reagen Salkowski sebanyak 4 ml. Uji ini dilakukan duplo. Suspensi kemudian diinkubasi selama 15 menit, tanpa paparan cahaya kemudian dilakukan pengukuran absorbansi dengan menggunakan spektrofotometer Genesys pada panjang gelombang 520 nm. Warna merah muda yang terbentuk menunjukkan dihasilkan IAA (Patil 2011). Konsentrasi IAA yang dihasilkan oleh setiap isolat diketahui melalui persamaan pada kurva standar IAA (Lampiran 1). Dua isolat terbaik menghasilkan konsentrasi IAA tertinggi digunakan untuk analisis selanjutnya.
Uji Bakteri Pelarut P dan K
10
diameternya (Ø), kemudian indeks pelarutan (IP) fosfat dan kalium dihitung dengan rumus IP= (Ø zona bening – Ø koloni) ÷ Ø koloni.
Penentuan Kurva Pertumbuhan dan Produksi IAA
Kurva standar dibuat untuk mengetahui jumlah sel berdasarkan absorbansinya (Lampiran 2). Satu lup isolat bakteri terpilih yang berumur 24 jam diinokulasikan ke dalam 50 ml medium NB ditambahkan 1.0 mM L-triptofan dan diinkubasi pada inkubator goyang hingga kepadatan sel mencapai 108 sel/ml. Kultur bakteri diambil sebanyak 1 ml dan ditumbuhkan dalam media NB 100 ml, lalu diinkubasi dengan inkubator goyang kecepatan agitasi 100 rpm. Pengukuran densitas sel pada panjang gelombang 620 nm dan pengukuran IAA dilakukan dengan mengambil 1 ml supernatan ditambahkan dengan 4 ml reagen Salkowski dan diinkubasi pada ruangan gelap selama 15 menit. Pengukuran produksi IAA dilakukan menggunakan spektrofotometer pada panjang gelombang 520 nm. Data masing-masing bakteri pada setiap waktu pengamatan selanjutnya digunakan untuk membuat grafik sehingga diketahui fase pertumbuhannya dan produksi IAA.
Pengukuran IAA dengan HPLC
Analisis IAA secara kuantitatif dilakukan menggunakan HPLC Shimadzu LC 20 A tipe Prominance kolom C18, metode analisis fase terbalik (reversed phase). Tahap yang pertama adalah melakukan pemekatan supernatan bakteri dengan melarutkan 100 ml supernatan masing-masing isolat menggunakan etil asetat sebanyak 3 kali dengan perbandingan volume 1:1. Ekstraksi hasil pemekatan dievaporasi (dikeringkan) menggunakan rotary evaporator agar didapatkan ekstrak kasar sampel yang diperlukan untuk HPLC. Hasil ekstraksi berupa ekstrak kasar kemudian diresuspensikan ke dalam 1 ml metanol. Sampel dianalisis dengan HPLC dan fase gerak ialah methanol: asam asetat: akuabides (30: 1: 70 v/v/v), kecepatan alir 1.2 ml/menit, menggunakan detektor UV-VIS pada panjang gelombang 254 nm. Konsentrasi IAA dari sampel ditentukan berdasarkan konsentrasi larutan IAA murni yang diukur pada keadaaan dan kondisi yang sama (Mehnaz dan Lazarovits 2006).
Identifikasi Molekuler Gen 16S rRNA
Ekstraksi DNA
11
Amplifikasi Gen 16S rRNA
DNA hasil ekstraksi digunakan dalam PCR (Polymerase Chain Reaction) untuk mengamplifikasi gen 16S rRNA. Reaksi mix PCR dibuat sebanyak 50 µl menit dan divisualisasi di bawah sinar UV.
Sekuensing DNA dan Analisis Filogenetik
Produk hasil PCR (gen 16S rRNA) yang diperoleh selanjutnya disekuen dan dikirim ke perusahan jasa sekuensing. Sekuen gen 16S rRNA dari isolat KAHN 15.12 (Lampiran 5) kemudian disejajarkan dengan data sekuen yang terdapat pada GenBank menggunakan program BLASTN (Lampiran 6). Konstruksi pohon filogenetik dilakukan menggunakan program MEGA 6.0 dengan metode Neighbour Joining dan nilai bootstrap 1000x.
Aplikasi Bakteri pada Bibit Kelapa Sawit
Pembuatan Media Tanam
Komposisi media tanam terdiri atas tanah, kompos, dan sekam. Tanah diperoleh dari kebun Darmaga IPB dengan pH 4.9 (Lampiran 7). Masing-masing komponen media tanam disterilisasi dengan autoklaf pada suhu 121 oC tekanan 1 atm. Media tanam dengan komposisi yaitu tanah: kompos: sekam (1:1) dihomogenkan dan dimasukkan ke dalam polibag berukuran 30 cm x 30 cm. Persiapan Tanaman
Kecambah kelapa sawit diseleksi terlebih dahulu dengan memisahkan kecambah normal dan abnormal. Kecambah yang normal selanjutnya diberi perlakuan fungisida Dithane M-45 selama 2 menit lalu dibilas dengan akuades steril. Kecambah ditanam pada kedalaman 2 cm di dalam polibag dan diaklimatisasi selama 2 minggu.
Rancangan Percobaan
12
setelah tanam. Pada setiap inokulasi, 10 ml kultur bakteri diteteskan di sekitar perakaran tanaman.
Pengamatan
Tanaman kelapa sawit berusia 90 HST dipindahkan dari polibag untuk dibersihkan akarnya dari media tanam dan diamati (Lampiran 9). Parameter yang diamati pada penelitian ini meliputi:
1. Tinggi tanaman: diukur dari permukaan tanah hingga ujung daun tertinggi dengan meluruskan daun
2. Panjang batang: diukur dari permukaan tanah sampai pelepah pertama muncul
3. Diameter batang: diukur pada posisi 1 cm di atas permukaan media tanam dengan menggunakan jangka sorong
4. Jumlah akar lateral: jumlah akar cabang yang muncul dari akar utama 5. Diameter akar: diukur pada posisi 5 cm di bawah pangkal akar utama
menggunakan jangka sorong
6. Panjang akar primer: diukur dari pangkal akar sampai ujung akar tunggangnya
7. Jumlah daun: jumlah daun yang sudah terbuka sempurna
8. Bobot kering: tajuk dan akar bibit sawit dikeringkan menggunakan oven pada suhu 60 oC selama 2 hari kemudian ditimbang dengan menggunakan timbangan analitik
Perhitungan Jumlah Bakteri
Perhitungan jumlah bakteri dilakukan pada semua perlakuan. Sampel tanah diambil di dekat perakaran tanaman pada lapisan permukaan antara 0-5 cm. Jumlah sel bakteri dihitung dengan metode total plate count (TPC) yaitu dengan menimbang tanah sebanyak 1 g kemudian dilarutkan dalam 9 ml aquades steril diperoleh larutan dengan pengenceran 10-1 lalu dilakukan pengenceran sampai 10-6. Dari pengenceran 10-4, 10-5 dan 10-6 diambil 100 μl kemudian diinokulasikan secara cawan sebar pada medium NA. Jumlah sel bakteri dihitung dengan cara mengalikan jumlah koloni yang terhitung dengan faktor pengenceran terhadap semua perlakuan, dengan rumus:
Jumlah sel/gram= Jumlah koloni X
Analisis Data
Data yang diperoleh dianalisis dengan ANOVA menggunakan software
SPSS v.21 dan uji lanjutan Duncan Multiple Range Test (DMRT) pada taraf α=5% (Lampiran 10).
1
13
4
HASIL DAN PEMBAHASAN
Uji Hipersensitivitas
Dari 25 isolat yang digunakan dalam uji hipersensitivitas diperoleh 13 isolat yang terdiri atas empat dari 9 isolat bakteri kitinolitik dan 9 dari 16 isolat bakteri selulolitik tidak menginduksi reaksi positif hipersensitif pada daun tembakau (Nicotiana tabacum L.) dengan ditandai tidak terjadi perubahan warna daun pada tempat injeksi kultur. Reaksi positif ditunjukkan oleh gejala daun nekrosis berupa bercak kecoklatan di sekitar daerah yang disuntik dengan suspensi bakteri setelah 48 jam pengujian (Gambar 2).
(a) (b) (c) (d)
Gambar 2 Hasil uji hipersensitivitas pada daun tembakau. Gejala positif nekrosis (a), dan gejala negatif (b), kontrol positif Pseudomonas syringae (c), kontrol negatif (d).
Penapisan Isolat Penghasil IAA
IAA yang dihasilkan oleh 13 isolat nonekrotik diukur dari kultur yang berumur 24 jam. Seluruh isolat nonnekrotik (13 isolat) mampu menghasilkan IAA dengan penambahan triptofan 1 mM dan tanpa penambahan triptofan (Tabel 1). Penambahan triptofan menunjukkan konsentrasi IAA yang dihasilkan lebih tinggi dibandingkan tanpa pemberian triptofan. Dari 13 isolat yang diuji hanya dipilih 2 isolat yang memproduksi IAA tertinggi ialah SAHA 12.08 dan KAHN 15.12 untuk diuji lebih lanjut.
Tabel 1 Konsentrasi IAA pada media yang ditambah triptofan dan tanpa triptofan Kode Isolat Konsentrasi IAA
14
Pengujian Kemampuan Bakteri Terpilih dalam melarutkan P dan K
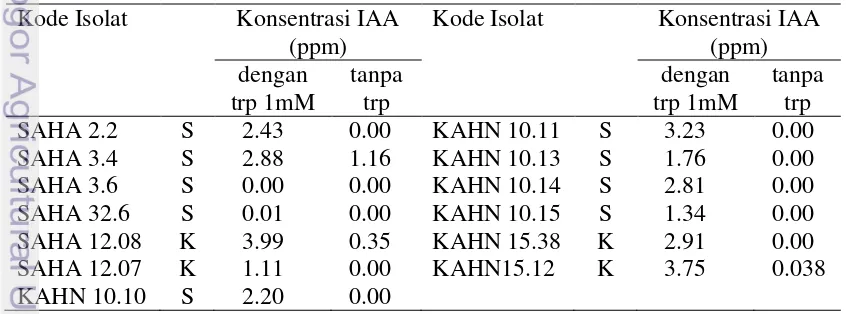
Bakteri pelarut fosfat atau kalium membentuk zona bening di sekeliling koloni (Gambar 3). Kemampuan bakteri dalam melarutkan fosfat (P) atau kalium (K) dinyatakan dalam bentuk indeks pelarutan (IP). Isolat KAHN 15.12 mampu melarutkan P dan K dengan indeks pelarutan P sebesar 0.35 dan indeks pelarutan K sebesar 1, sedangkan SAHA 12.08 tidak dapat melarutkan P dan K. Hal ini ditunjukkan dengan tidak terbentuknya zona bening di sekitar koloni SAHA 12.08.
Gambar 3 Koloni isolat KAHN 15.12 pada medium Pikovskaya (a) dan medium Aleksandrov (b)
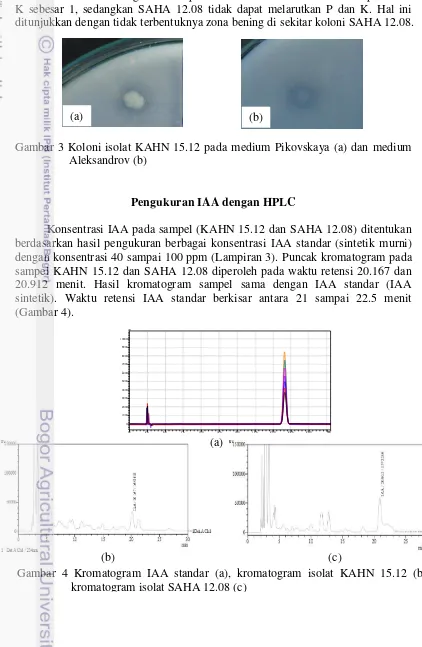
Pengukuran IAA dengan HPLC
Konsentrasi IAA pada sampel (KAHN 15.12 dan SAHA 12.08) ditentukan berdasarkan hasil pengukuran berbagai konsentrasi IAA standar (sintetik murni) dengan konsentrasi 40 sampai 100 ppm (Lampiran 3). Puncak kromatogram pada sampel KAHN 15.12 dan SAHA 12.08 diperoleh pada waktu retensi 20.167 dan 20.912 menit. Hasil kromatogram sampel sama dengan IAA standar (IAA sintetik). Waktu retensi IAA standar berkisar antara 21 sampai 22.5 menit (Gambar 4).
0.0 2.5 5.0 7.5 10.0 12.5 15.0 17.5 20.0 22.5 25.0 min 0
1000 2000 3000 4000 5000 6000 7000 8000 9000 10000 uV
(a)
(b) (c)
(a) (b)
15
Konsentrasi IAA yang dihasilkan oleh isolat terpilih SAHA 12.08 dan KAHN 15.12 diukur secara kuantitatif menggunakan HPLC. Hasil pengukuran konsentrasi IAA dari sampel KAHN 15.12 dan SAHA 12.08 masing-masing sebesar 94.05 ppm dan 91.00 ppm (Tabel 2).
Tabel 2 Hasil pengukuran IAA menggunakan HPLC
Isolat Sampel Waktu
Kurva Pertumbuhan Bakteri dan Produksi IAA
Berdasarkan hasil uji hipersensitifitas dan seleksi bakteri penghasil IAA dipilih isolat SAHA 12.08 dan KAHN 15.12 untuk dilakukan pembuatan kurva pertumbuhan dan kurva produksi IAA pada medium NB yang ditambah dengan triptofan 1 mM (Gambar 5). Isolat SAHA 12.08 optimum mensintesis IAA pada jam ke-30 sebesar 2.34 ppm (Gambar 5a). Isolat KAHN 15.12 tertinggi mensintesis IAA sebesar 22.37 ppm pada saat memasuki fase stasioner pada jam ke-18 (Gambar 5b).
Gambar 5 Kurva pertumbuhan bakteri dan produksi IAA. Isolat SAHA 12.08 (a), KAHN 15.12 (b). ◊ log sel, ■ : konsentrasi IAA (ppm).
Identifikasi Molekuler
Amplifikasi gen 16S rRNA menghasilkan pita DNA berukuran sekitar 1300 pb pada gel agarosa 1% (Gambar 6). Hasil analisis sekuen gen penyandi 16S rRNA pada GenBank menggunakan program BLASTN menunjukkan bahwa isolat KAHN 15.12 memiliki tingkat kemiripan 99% dengan Serratia marcescens
(Lampiran 4). Konstruksi pohon filogenetik menunjukkan bahwa isolat KAHN 15.12 memiliki hubungan yang sangat dekat dengan Serratia marcescens
(Gambar 7). Isolat SAHA 12.08 telah diidentifikasi sebelumnya oleh (Asril et al.
16
Gambar 6 Visualisasi hasil amplifikasi gen 16S rRNA dengan elektroforesis gel agarosa 1%. (M) marker 1 kb,(1) KAHN 15.12.
Gambar 7 Pohon filogenetik isolat KAHN 15.12
Aplikasi Bakteri pada Bibit Kelapa Sawit
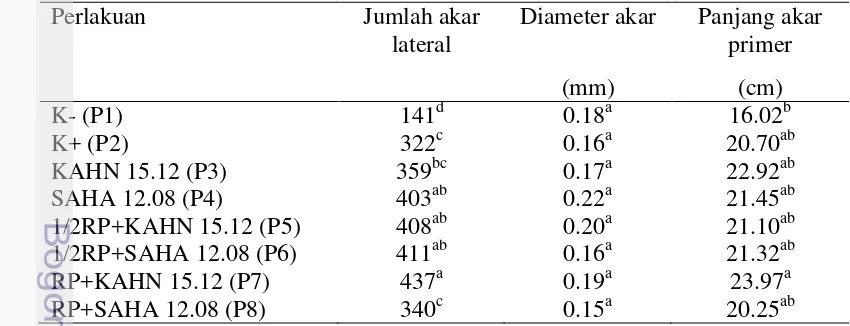
Kemampuan isolat SAHA 12.08 dan KAHN 15.12 sebagai agen pemacu pertumbuhan bibit sawit diamati pada umur 90 hari setelah tanam (HST). Perlakuan P6 dan P7 berbeda nyata pada tinggi tanaman jika dibandingkan dengan kontrol negatif, namun tidak berbeda nyata dengan perlakuan lain. Pemberian isolat tanpa pupuk RP (P3 dan P4) atau dikombinasikan dengan pupuk RP dosis setengah (P5 dan P6) berbeda nyata dalam hal panjang batang bila dibandingkan dengan kontrol negatif. Hanya 2 perlakuan yaitu KAHN 15.12 yang dikombinasikan dengan pupuk RP dosis setengah (P5) dan pupuk RP dosis penuh (P7) yang berbeda nyata dalam hal diameter batang bila dibandingkan dengan kontrol negatif. Jumlah daun dipengaruhi secara nyata oleh pupuk RP dosis setengah atau RP dosis penuh yang dikombinasikan dengan kultur bakteri. Perlakuan kultur bakteri tanpa pupuk RP tidak berbeda nyata terhadap jumlah daun. Dibandingkan dengan perlakuan lainnya, isolat SAHA 12.08 tidak menghasilkan perbedaan yang nyata terhadap tinggi tanaman, panjang batang, dan diameter batang bila dikombinasikan dengan 100% dosis pupuk RP (Tabel 3).
~ 1300 pb
M 1
17
Tabel 3 Pengaruh perlakuan bakteri pada bagian atas bibit sawit umur 90 HST
Perlakuan Tinggi
Keterangan: Angka yang diikuti huruf yang berbeda pada kolom menunjukkan hasil yang berbeda nyata berdasarkan uji Duncan pada α=0.05. (K-) tanpa inokulasi bakteri sebagai kontrol negatif, (K+) pupuk Rock Phosphate (RP) sebagai kontrol positif.
Pemberian kultur bakteri dapat meningkatkan jumlah akar lateral sebesar 25-27%. Kombinasi isolat dengan 1/2 dosis pupuk RP memberikan pengaruh makin baik dalam hal peningkatan jumlah akar lateral sebesar 60-65% (Tabel 4). Semakin tinggi dosis pupuk RP dikombinasikan dengan perlakuan bakteri KAHN 15.12, semakin banyak jumlah akar lateral yang terbentuk. Sebaliknya, jumlah akar lateral menjadi lebih sedikit bila isolat SAHA 12.08 dikombinasikan dengan pupuk RP dosis penuh.
Tabel 4 Pengaruh perlakuan bakteri pada perakaran bibit sawit umur 90 HST
Perlakuan Jumlah akar
Keterangan: Angka yang diikuti huruf yang berbeda pada kolom menunjukkan hasil yang berbeda nyata berdasarkan uji Duncan pada α=0.05. (K-) tanpa inokulasi bakteri sebagai kontrol negatif, (K+) pupuk Rock Phosphate (RP) sebagai kontrol positif.
18
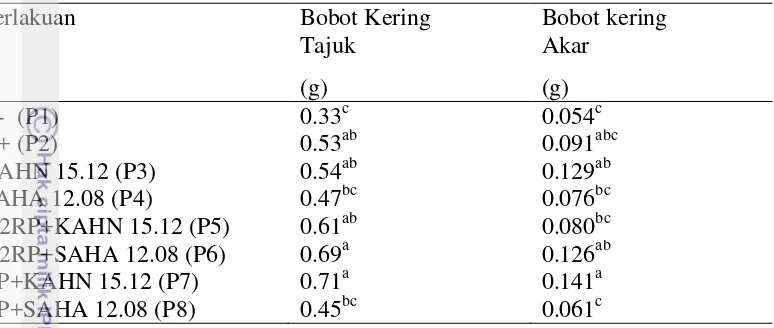
dengan pupuk RP dosis penuh yang menghasilkan bobot kering yang lebih rendah dibandingkan dengan kontrol positif (pupuk dosis penuh) (Tabel 5).
Tabel 5 Pengaruh perlakuan bakteri pada bobot kering bibit sawit umur 90 HST
Perlakuan Bobot Kering
Tajuk
Bobot kering Akar
(g) (g)
K- (P1) 0.33c 0.054c
K+ (P2) 0.53ab 0.091abc
KAHN 15.12 (P3) 0.54ab 0.129ab
SAHA 12.08 (P4) 0.47bc 0.076bc
1/2RP+KAHN 15.12 (P5) 0.61ab 0.080bc
1/2RP+SAHA 12.08 (P6) 0.69a 0.126ab
RP+KAHN 15.12 (P7) 0.71a 0.141a
RP+SAHA 12.08 (P8) 0.45bc 0.061c
Keterangan: Angka yang diikuti huruf yang berbeda pada kolom menunjukkan hasil yang berbeda nyata berdasarkan uji Duncan pada α=0.05. (K-) tanpa inokulasi bakteri sebagai kontrol negatif, (K+) pupuk Rock Phosphate (RP) sebagai kontrol positif.
Pemberian isolat KAHN 15.12 dan SAHA 12.08 memberikan pengaruh yang nyata pada peningkatan jumlah akar lateral dibandingkan dengan perlakuan kontrol negatif (tanpa pemberian kultur bakteri dan pupuk) dan tidak berbeda nyata dengan perlakuan pupuk dosis penuh (Gambar 8).
19
Perhitungan jumlah sel bakteri (TPC) dari media tanam sawit menunjukkan bahwa pemberian kultur ke media tanam menghasilkan jumlah sel bakteri lebih banyak dari pada kontrol (tanpa pemberian isolat). Pada umur 90 HST terjadi penurunan jumlah sel bakteri pada perlakuan pemberian kultur isolat SAHA 12.08 (Gambar 9).
Gambar 9 Jumlah sel bakteri pada media tanam bibit kelapa sawit umur 45 HST ( ) dan 90 HST ( )
Pembahasan
Beberapa mikroorganisme memproduksi auksin karena kehadiran prekursor IAA yaitu L-triptofan (Mohite 2013). Penambahan triptofan pada medium pertumbuhan merupakan faktor penting bagi isolat untuk biosintesis IAA.
Beijerinckia fluminensis galur UQM 1685 mampu menghasilkan IAA pada media pertumbuhan yang mengandung triptofan 1 mM (Harca et al. 2014). Kisaran IAA pada galur Azotobacter yang diinduksi triptofan 1 mg/mL berkisar 1.47-11.88 ppm (Ahmad et al. 2005). Dua isolat terpilih dari penapisan bakteri dengan metode kolorimetri, yaitu SAHA 12.08 dan KAHN 15.12 menghasilkan IAA sebesar 3.99 dan 3.75 ppm setelah diinduksi triptofan sebesar 1 mM. Waktu optimum bakteri dalam mensintesis IAA dapat dilihat pada kurva pertumbuhan dan produksi IAA. Isolat SAHA 12.08 dan KAHN 15.12 mempunyai laju pertumbuhan yang berbeda, namun kedua isolat mensintesis IAA tertinggi pada fase stasioner. IAA dihasilkan pada saat fase stasioner (Wahyudi et al. 2011). Konsentrasi IAA masih rendah pada fase logaritmik dan mengalami kenaikan pada awal fase stasioner (Omay et al. 1993).
IAA yang diproduksi oleh bakteri diukur konsentrasinya menggunakan HPLC dengan membandingkan puncak kromatogram sampel isolat KAHN 15.12 maupun SAHA 12.08 dengan standar IAA (IAA sintetik). Sampel isolat yang diukur menunjukkan bahwa waktu retensi sampel sama dengan IAA standar yaitu pada 20.167 dan 20.912 menit. Mujahid et al. (2011) melaporkan bahwa terdapat
beberapa waktu retensi untuk senyawa-senyawa yang dihasilkan melalui jalur-jalur biosintesis IAA pada Rubrivivax benzoatilyticus JA2, di antaranya
20
dengan waktu retensi 17.5 menit untuk indole 3-aldehyde, 18.55 menit untuk
IAA, 18.9 menit untuk indole-3-carboxylic acid, 23.1 menit untuk
indole-3-acetonitrile, dan 24.6 menit untuk indol.
Pengukuran konsentrasi IAA menggunakan metode kolorimetri memberikan hasil yang berbeda dengan metode HPLC. Metode kolorimetri menggunakan supernatan dari kultur isolat, sedangkan HPLC menggunakan ekstrak sampel. Pengujian dengan metode kolorimetri sebagai pendugaan awal bakteri menghasilkan IAA menggunakan reagen Salkowski yang direaksikan dengan supernatan dan diukur menggunakan spektrofotometer (Pattern dan Glick 2002). Metode HPLC menganalisis dan mengetahui keberadaan IAA dengan pemisahan senyawa berdasarkan tingkat kepolaran. Penentuan peak senyawa IAA dari pemisahan ekstrak dilakukan dengan HPLC (Sweetser dan Swartzfager 1978). HPLC mempunyai daya pisah atau resolusi pemisahan yang tinggi dan selektivitas sangat baik serta banyaknya solut yang dapat dipisahkan dengan metode ini merupakan kelebihan dari HPLC (Skoog et al. 2010). Metode kolorimetri digunakan untuk deteksi senyawa indol dengan teknik mereaksikan reagen Salkowski. Metode ini telah banyak digunakan karena mudah, cepat, dan memungkinkan untuk analisis supernatan bakteri dalam jumlah banyak (Sarwar et al. 1992).
Pengujian bakteri bersifat patogen atau tidak pada tanaman dilakukan sebelum aplikasi. Kedua isolat terpilih, yaitu KAHN 15.12 dan SAHA 12.08 tidak menginduksi gejala nekrosis pada daun tembakau. Hal ini mengindikasikan bahwa kedua isolat tersebut tidak bersifat patogen dan aman untuk diaplikasikan pada tanaman. Setiap kali patogen menyerang inang, jaringan tanaman bereaksi dengan pembentukan nekrosis untuk mencegah penyebaran patogen lebih lanjut (Klement dan Godman1967).
Aplikasi bakteri terpilih pada bibit kelapa sawit dan pemberian pupuk RP secara terpisah maupun bersamaan (kombinasi) mampu meningkatkan jumlah akar lateral secara nyata bila dibandingkan dengan kontrol negatif. Hal ini karena isolat SAHA 12.08 dan KAHN 15.12 mampu menghasilkan IAA yang tinggi sekitar 1.33x10-6 M dan 1.27x10-5 M. Bakteri yang memproduksi IAA tinggi dapat memacu terbentuknya akar lateral (Patten dan Glick 2002). Pemanjangan akar primer dapat dirangsang oleh konsentrasi IAA yang rendah sebesar 5.10-9 M, sedangkan pada konsentrasi yang lebih tinggi 10-4 sampai 10-8 M menghambat pamanjangan akar primer dan merangsang terbentuk akar lateral (Pilet dan Saugy 1987). IAA yang disintesis oleh mikrob umumnya mempengaruhi sistem perakaran, meningkatkan ukuran dan jumlah akar adventif (Ribeiro dan Cardoso 2012). Peningkatan jumlah akar lateral akan mempengaruhi peningkatan densitas dan panjang rambut akar. Perluasan daerah akar memudahkan untuk penyerapan nutrisi hara mineral, sehingga membantu perkembangan tanaman bagian atas (Tien et al. 1979).
21
dalam endospermanya dan mulai efektif melakukan fotosintesis serta menyerap hara dari lingkungan tumbuhnya setelah cadangan nutrisi di dalam endosperma tersebut mulai berkurang. Setelah beberapa waktu, perbedaan asupan nutrisi pada bibit kelapa sawit mulai menunjukkan perbedaan respon pertumbuhan tinggi tanaman. Pertumbuhan tinggi bibit kelapa sawit terlihat pada waktu 18 minggu setelah tanam atau memasuki bulan ke-5 (Panjaitan 2014).
Perlakuan isolat SAHA 12.08 dan KAHN 15.12 tanpa pupuk (P3 dan P4) meningkatkan jumlah akar lateral walaupun tidak nyata terhadap pemberian pupuk (P2). Serratia marcescens KAHN 15.12 dan Bacillus thuringiensis SAHA 12.08 merupakan bakteri pemacu pertumbuhan tanaman. Genus Serratia spp.
merupakan salah satu bakteri yang memproduksi IAA (Lwin et al. 2012).
S. marcescens yang berhasil diisolasi dari rhizosfer kelapa mampu memacu pertumbuhan tanaman, memiliki aktivitas kitinase sebagai agen biokontrol, memproduksi siderophore dan dapat memfiksasi nitrogen (George et al. 2013; Tilak et al. 2005). Bacillus thuringiensis galur KR1 merupakan bakteri potensial sebagai pemacu pertumbuhan tanaman (Mishrah et al. 2009).
Kombinasi dosis pupuk RP dan bakteri KAHN 15.12 memberikan pengaruh yang lebih baik terhadap akar lateral, diameter batang, dan jumlah daun bila dibandingkan dengan pemberian bakteri saja tanpa pupuk P. Bakteri KAHN 15.12 bekerja secara sinergis dalam menghasilkan IAA dan dalam penyediaan hara P karena mampu melarutkan P yang terdapat pada pupuk RP. Pupuk P yang ditambahkan ke dalam tanah, tidak semuanya langsung diserap oleh tanaman. Sebanyak 75-90% unsur P di dalam tanah berada dalam bentuk terikat. Unsur P yang ditambahkan melalui pupuk ke dalam tanah dapat berikatan dengan senyawa Fe, Al, dan Ca (Gyaneshwar et al. 2002). Bakteri KAHN 15.12 mempunyai kemampuan melarutkan P sehingga dapat mengoptimalkan pemberian pupuk RP. Isolat KAHN 15.12 yang diidentifikasi secara molekuler menunjukkan tingkat kemiripan 99% dengan Serratia marcescens. Chakraborty et al. (2010) melaporkan bahwa S. marcescens mampu melarutkan fosfat. Berbeda dengan SAHA 12.08 yang tidak memiliki kemampuan dalam melarutkan P.
Bakteri SAHA 12.08 pada perlakuan dosis pupuk 100% RP dan bakteri SAHA 12.08 (P8) tidak bekerja sinergis dalam melarutkan P. Pupuk P yang terikat membuat konsentrasi pupuk menjadi jenuh dalam tanah yang akan berpengaruh terhadap pertumbuhan tanaman. Pemberian pupuk dapat menyebabkan larutan tanah menjadi pekat sehingga air dan garam-garam mineral tidak dapat diserap oleh akar dan terjadi penimbunan garam atau ion-ion dipermukaan akar yang akan menghambat penyerapan hara dan sekaligus menimbulkan keracunan bagi tanaman (Haryanto et al. 2000). Hal ini sejalan dengan hasil perhitungan jumlah sel bakteri. Jumlah sel bakteri pada P8 tidak sebanyak pada P6 karena dosis pupuk yang tinggi membuat eksudat yang dikeluarkan tanaman menurun sehingga berpengaruh pada pertumbuhan populasi bakteri SAHA 12.08 pada media tanam. Faktor tumbuh mikrob meliputi vitamin, asam amino, purin, dan pirimidin. Kondisi pertumbuhan yang optimum dipengaruhi ketersedian nutrien, kondisi suhu, pH, kelembaban, dan perubahan musim (Madigan et al. 2006).
22
pada tanah dapat menambah jumlah mikrob yang ada dalam tanah tersebut. Pada 90 HST, jumlah bakteri pada beberapa perlakuan mengalami penurunan. Hal ini diduga karena terjadi persaingan antar mikrob, sedangkan substrat yang tersedia semakin berkurang. Mikrob di lingkungan saling berinteraksi, jumlah sel dan kelompok sel dipengaruhi oleh sumberdaya alam dan kondisi lingkungan. Penurunan jumlah substrat bakteri diikuti dengan penurunan metabolisme menyebabkan sel lambat laun akan mati (Madigan et al. 2006).
23
5
SIMPULAN DAN SARAN
Simpulan
Dua isolat penghasil Indole Acetic Acid (IAA) tertinggi berhasil diseleksi dari 13 isolat penghasil IAA dengan metode kolorimetri. Kedua isolat, yaitu SAHA 12.08 dan KAHN 15.12 menghasilkan IAA sebesar 3.99 dan 3.75 ppm. Dengan menggunakan metode High Performance Liquid Chromatography
(HPLC), IAA yang dihasilkan oleh kedua isolat masing-masing 91.568 ppm dan 94.015 ppm. Aplikasi isolat bakteri pada bibit sawit memberikan pengaruh berbeda dari perlakuan kontrol tanpa penambahan bakteri dan pupuk RP (Rock Phosphate). Pemberian kultur isolat KAHN 15.12 dan SAHA 12.08 memberikan pengaruh yang nyata dalam meningkatkan jumlah akar lateral. Bakteri KAHN 15.12 memberikan pengaruh terbaik bila ditambahkan dengan pupuk RP dosis setengah atau dosis penuh, sedangkan isolat SAHA 12.08 memberikan pengaruh terbaik bila dikombinasikan dengan pupuk RP dosis setengah. Isolat KAHN 15.12 yang diidentifikasi secara molekuler menunjukkan tingkat kemiripan 99% dengan dengan Serratia marcescens.
Saran
24
DAFTAR PUSTAKA
Ahmad F, Ahmad I, Khan MS. 2005. Indole acetic acid production by the indigenous isolates of Azotobacter and fluorescent Pseudomonas in the presence and absence of tryptophan. J Biol. 29:29-34.
Ai’shah NO, Tharek M, Keyeo F, Keng CL, Zamzuri I, Ramli AMY, Amir HG. 2013. Influence of indole-3-acetic acid (IAA) produced by diatrophic bacteria on root development and growth of in vitro oil palm shots (Elaeis guineensis Jacq.). J Oil Palm Res. 25(1):100-107.
Akbari GA, Arab SM, Alikhani HA, Allahdadi I, Arzanesh MH. 2007. Isolation and selection of indigenous Azospirillum spp. and the IAA of superior strains effects on wheat roots. J Agric Sci. 3(4):523-529.
Alexander M. 1977. Introduction to Soil Microbiology. Edisi ke-2. New York (US): Academic Pr.
Amir GH, Shamsuddin ZH, Halimi MS, Marziah M, Ramlan MF. 2005. Enhancement in nutrient accumulation and growth of oil palm seedlings caused by PGPR under field nursery conditions. Soil Sci Plant Analys. 36: 2059–2066.doi: 10.1080/00103620500194270.
Aryantha IN, Lestari DP, Pangesti NPD. 2004. Potensi isolat bakteri penghasil IAA dalam peningkatan pertumbuhan kecambah kacang hijau pada kondisi hidroponik. J Mikrobiol Indones. 9(2):43-46.
Asril M, Mubarik NR, Wahyudi AT. 2014. Partial purification of bacterial chitinase as biocontrol of leaf blight disease on oil palm. J Microbiol Res. 9(6):265-277.
Baca BE, Elmerich C. 2003. Microbial Production of Plant Hormones. Amsterdam (NL): Kluwer Academic Publishers.
Bartling D, Seedorf M, Mithofer A, Weiler EW. 1992. Cloning and expression of an Arabidopsis nitrilase which can convert indole-3-acetonitrile to the plant hormone, indole-3-acetic acid. Eur J Biochem. 205:417–424.
Bioplanmate. 2011. Pentingnya unsure hara fosfor untuk tanaman kelapa sawit. [diunduh 2015 Juni 18]. Produk Pupuk: Bioplanmate Indonesia PT. tersedia pada: http//bioplanmate.com/pupuk-organik/pupuk-organik-planmate.
[BPS] Badan Pusat Statistik. 2013. Statistik Kelapa Sawit Indonesia. Hardjo SH, Setiawati R, Hariyanto, Sulistina, Suwarti, editor. Jakarta (ID): BPS. Chakraborty U, Chakraborty BN, Chakraborty AP. 2010. Influence of Serratia
marcescens TRS-1 on growth promotion and induction of resistance in
Camellia sinensis against Fomes lamaoensis. J Plant Interact. 5(4):261-272.doi: 10.1080/17429140903551738.
George P, Gupta A, Gopal M, Thomas L, Thomas GV. 2013. Multifarious beneficial traits and plant growth promoting potential of Serratia marcescens KiSII and Enterobacter sp. RNF 267 isolated from the rhizosphere of coconut palms (Cocos nucifera L.). J Microbiol Biotechnol. 29:109–117.doi: 10.1007/s11274-012-1163-6.
25
Gyaneshwar P, Kumar GN, Parekh LJ, Poole. 2002. Role of soil microorganisms in improving P nutrition of plant. J Plant Soil. 245:83-93.doi:
10.1007/s00253-010-2951-2.
Harca NN, Mubarik NR, Wahyudi AT. 2014. Isolation and identification of nitrogen fixing and indole acetic acid producing bacteria from oil plantation in Jambi Indonesia. J Environ Appl Sci. 9(4):546-553.
Hartmann A, Singh M, Klingmuller W. 1983. Isolation and characterization of
Azospirillum mutants excreting high amounts of indole acetic acid.
J Microbiol. 29:916–923.
Haryanto A. 2013. Isolation of chitinolytic bacteria used as biological control of suspected pathogenic fungi on oil palm seedlings [skripsi]. Bogor (ID): rhizosfere soils. J Biol Sci. 4:23-32.
Klement Z, Goodman RN. 1967. The hypersensitive reaction to infection by bacterial plant pathogens. J Phyto Pathol. 5:17-44.
Kobayashi M, Suzuki T, Fujita T, Masuda M, Shimizu S. 1995. Occurrence of enzymes involved in biosynthesis of acetic acid from indole-3-acetonitrile in plant-associated bacteria, Agrobacterium and Rhizobium.
Proc Natl Acad Sci USA. 92:714–718.
Kresnawaty I, Andanawarih S, Suharyanto, Panji T. 2008. Optimisasi dan pemurnian IAA yang dihasilkan Rhizobium sp. dalam medium serum lateks dengan suplementasi triptofan dari pupuk kandang. J Menara Perkeb. 76(2):74-82.
Lingga P. 1998. Petunjuk Penggunaan Pupuk. Bogor (ID): Penebar Swadaya. Lwin KM, Moe MM, Tar T, Aung ZM. 2012. Isolation of plant hormone
indole-3-acetic acid producing rhizobacteria and study on their effects on maize seedling. Eng J. 16:138-144.doi: 10.4186/ej.2012.16.5.137.
Loper JE, Schroth MN. 1986. Influence of bacterial sources of indole-3-acid on root elongation of sugar beeat. J Phyto Pathol. 76(4):386-389.
Madigan MT, Martinko JM. 2006. Brock Biology of Microorganisms. Bergen (US): Pearson Prantice Hall.
Marchesi JR, Sato T, Weightman AJ, Martin TA, Fry JC, Hiom SJ, Wade WG. 1998. Bacterium specific PCR primers that amplify genes coding for bacterial 16 SRNA. J Appl Environ Microbiol. 64(2):795-799.
Mehnaz S, Lazarovits G. 2006. Inoculation effects of Pseudomonas putida,
Gluconacetobacter azotocaptans, and Azospirillum lipoferum on corn plant growth under greenhouse conditions. J Microbial Ecol. 51:326-335.doi: 10.1007/s00248-006-9039-7.
26
Mohite, B. 2013. Isolation and characterization of indole acetic acid (IAA) producing bacteria from rhizospheric soil and its effect on plant growth.
J Soil Sci Plant Nutr. 13(3):638-649.
Mujahid MD, Sasikala CH, Ramana CHV. 2011. Production of indole-3-acetic acid and related indole derivatives from L-tryptophan by Rubrivivax benzoatilyticus JA2. Appl Microbiol Biotechnol. 89:1001–1008.
Nurbaiti, Yulia AE, Sitorus J. 2012. Respon pertumbuhan bibit kelapa sawit (Elaeis guineensis Jacq.) pada medium gambut dengan berbagai periode penggenangan. J Agrotek Trop. 1(1):14-17.
Om AC, Ghazali AHA, Keng CL, Ishak Z. 2009. Microbial inoculation improves growth of oil palm plants (Elaeis guineensis Jacq.). Tropic Life Sci Res. 20(2):71–77.
Omay SH, Schmidt WA, Martin P. 1993. Indole acetic acid production by the rhizosphere bacterium Azospirillum brasilense Cd under in vitro
conditions. J Microbiol. 39:187-192.
Pahan I. 2006. Panduan Lengkap Kelapa Sawit Manajemen Agribisnis dari Hulu Hingga Hilir. Depok (ID): Penebar Swadaya.
Panjaitan A. 2014. Kemampuan bakteri diazotrof endofit untuk meningkatkan pertumbuhan bibit kelapa sawit (Elaeis guineensis Jaqc.) [tesis]. Bogor (ID): Institut Pertanian Bogor.
Pardamean M. 2011. Sukses Membuka Kebun dan Pabrik Kelapa Sawit. Depok (ID): Penebar Swadaya.
Parmar P, Sindhu SS. 2013. Potassium solubilization by rhizosphere bacteria: influence of nutritional and environmental conditions. J Microbiol Res. 3(1):25-31.
Patil V. 2011. Production of indole acetic acid by Azotobacter sp. Rec Res Sci Technol. 3 (12):14-16.
Patten CL, Glick BR. 2002. Role of Pseudomonas putida indole acetic acid in development of the host plant root system. Appl Environ Microbiol. 68(8): 3795-3801.doi: 10.1128/AEM.68.8.3795–3801.2002.
Paul NB, Rao SWVB. 1971. Phosphate dissolving bacteria in the rhizosphere of some cultivated legumes. J Plant Soil . 35:127-132.
Pilet PE, Saugy M. 1987. Effect on root growth of endogenous and applied IAA and ABA. Plant Physiol. 83:33-38.
[PPKS] Pusat Penelitian Kelapa Sawit Indonesia. 2005. Pemeliharaan kesehatan tanaman kelapa sawit melalui pengendalian terkini hama, penyakit dan gulma serta aplikasi pemupukan. Di dalam: Susanto A, Erningpraja L, Sutarta E, Utomo C, Harahap IY, Prasetyo AE, Dongaran AP, Lubis AF, editor. Pertemuan Teknis Kelapa Sawit (2005 Sep 13-14); Yogyakarta , Indonesia. Medan (ID): IOPRI.
[PPKS] Pusat Penelitian Kelapa Sawit Indonesia. 2012. Endopalma pupuk hayati untuk kelapa sawit. [Produk pupuk dan sarana produk]. [diunduh 2015 Juni 11]; Medan: IOPRI. [terhubung berkala].
http://www.iopri.org/pupuk.html.
27
Ribeiro CM, Cardoso EJBN. 2012. Isolation, selection and characterization of root-associated growth promoting bacteria in Brazil pine (Araucaria angustifolia). J Microbiol. 167:60-78.
Sarwar M, Arshad M, Martens DA, Frankenberger WT. 1992. Tryptophan dependent biosynthesis of auxins in soil. Plant Soil. 147:207-215.
Skoog DA, West DM, Holler FJ. (2010). Fundamentals of analytical chemistry. New York (US): Saunders College.
Spaepen S, Vanderleyden J, Remans. 2007. Indole-3-acetic acid in microbial and microorganism plant signaling. J FEMS Microbiol Rev. 31(4):1-24.doi: 10.1111/j.1574-6976.2007.00072.x.
Sukmadi RB. 2013. Aktivitas fitohormon indole-3-acetic acid (IAA) dari beberapa isolat bakteri rizosfer dan endofit. J Sains Teknol Indones. 14(3):221-227. Sweetser PB, Swartzfager DG. 1978. Indole-3-acetic acid levels of plant tissue as
determined by a new high performance liquid chromatographic method.
Plant Physiol. 61:254-258.
Tien TM, Gaskins MH, Hubbell DH. 1979. Plant growth substances produced by
Azospirillum brasilense and their effect on the growth of pearl millet (Pennisetum americanum L.). Appl Environ Microbiol. 37(5):1016-1024. Tilak KVBR, Ranganayaki N, Pal KK, Saxena AK, Nautiyal CS, Mittals S,
Tripathi AK, Johri BN. 2005. Diversity of plant growth and soil health supporting bacteria. Curr Sci. 89(1):136-150.
Tsavkelova EA, Cherdyntseva TA, Netrusov AI. 2005. Auxin production by bacteria associated with orchid roots. J Microbiol. 74(1):55-62.
Wahyudi AT, Astuti RP, Widyawati A, Meryandini A, Nawangsih AA. 2011. Characterization of Bacillus sp. strains isolated from rhizosfere of soybean plants for their use as potential plant growth for promoting rhizobacteria.
J Microbiol Antimicrob. 3(2):34-40.
Widayanti T. 2007. Isolasi dan karakterisasi Bacillus sp. indigenus penghasil asam indol asetat asal tanah rizosfer [skripsi]. Bogor (ID): Institut Pertanian Bogor.
28
LAMPIRAN
Lampiran 1 Kurva standar IAA
29
Lampiran 3 Kalibrasi standar IAA dengan HPLC standar Konsentrasi (ppm) Area
1 40 705486
2 50 884707
3 60 1051773
4 70 1222666
5 80 1399846
6 90 1580924
7 100 1760305
Lampiran 4 Homologi sekuen gen 16S rRNA isolat KAHN 15.12 menggunakan program BLAST-N
Spesies Pembanding %
Identitas
E-Value No
Akses
Serratia marcescens galur JASM1 99 0.0 NR 113236.1
Serratia marcescens galur NBRC 102204 99 0.0 NR 114043.1
Serratia marcescens galur JCM 1239 99 0.0 NR 113236.1
Serratia marcescens galur WW4 99 0.0 NR 102509.1
30
Lampiran 5 Sekuens isolat KAHN 15.12
31
Lampiran 6 Hasil analisis Blast-N sekuen isolat KAHN 15.12 pada software
32
Lampiran 7 Karakteristik kimia tanah Darmaga IPB
Sifat Kadar Kriteria
pH H2O 4.90 Masam
C (%) 2.00 Rendah
N (%) 0.18 Rendah
Ca (me/100 g) 4.56 Rendah
P Bray 1 (ppm) 6.10 Rendah
P HCl 25% (ppm) 400.00 Tinggi
Mg (me/100 g) 1.01 Rendah
K (me/100 g) 0.46 Sedang
Na (me/100 g) 0.33 Sedang
KTK (me/100 g) 11.88 Rendah
KB (%) 53.54 Sedang
Fe (me/100 g) 3.61 Rendah
Cu (me/100 g) 1.93 Tinggi
Zn (me/100 g) 7.19 Tinggi
Debu (%) 28.09 -
Liat (%) 60.23 -
Tekstur:pasir (%) 11.68 -
Keterangan: KTK: kapasitas tukar kation; KB: kejenuhan basa, analisis dilakukan di Laboratorium Tanah Departemen Ilmu Tanah dan Sumberdaya Lahan Fakultas Pertanian IPB.
Lampiran 8 Model Rancangan Acak Lengkap (RAL)
12.08 (4) K+ (3) 15.12 (3) 12.08 (3) RP3+15.12 RP4+ 12.08 K – (1) ½RP3+12.08
½RP2+15.12 RP2+15.12 RP2+12.08 K – (3) 12.08 (1) ½RP4+15.12 15.12 (1) ½RP1+12.08
K + (1) 15.12 (4) K - (4) RP4+15.12 12.08 (2) ½RP1+15.12 K+ (2) RP1+12.08
33
Lampiran 9 Penampilan vegetatif bibit kelapa sawit umur 90 HST. (P1): tanpa inokulasi bakteri sebagai kontrol negatif, (P2): pupuk Rock phospat
(RP) sebagai kontrol positif, (P3): kultur isolat KAHN 15.12, (P4): kultur isolat SAHA 12.08, (P5): ½ RP + kultur isolat KAHN 15.12, (P6): ½ RP + kultur isolat SAHA 12.08, (P7): RP + kultur isolat KAHN 15.12, (P8): RP + kultur isolat SAHA 12.08.
P1 P2 P3
P4 P5 P6